ABSTRAK
PRAVITHA WIDYASTANA HARTIANTO. Adsorpsi Biru Metilena pada
Metakaolin dan Nanokomposit Metakaolin-TiO
2serta Uji Fotokatalisis.
Dibimbing oleh SRI SUGIARTI dan ZAENAL ABIDIN.
Salah satu metode yang digunakan untuk menghilangkan zat warna pada
perairan adalah adsorpsi-fotodegradasi. Metode ini berdasar pada proses adsorpsi
senyawa organik oleh permukaan padatan yang sekaligus dapat mendegradasi
senyawa organik. Adsorben yang digunakan umumnya berbahan dasar lempung,
seperti kaolin. Pemanasan suhu tinggi pada kaolin membuat struktur dari kaolin
itu sendiri rusak dan membentuk metakaolin yang bersifat amorf. Penggunaan
metakaolin sebagai adsorben kurang diminati karena memiliki daya jerap yang
rendah. Oleh karena itu, dilakukan modifikasi metakaolin menjadi nanokomposit
dengan menambahkan serbuk TiO
2anatase secara fisik. Pada penelitian ini,
metakaolin dibentuk dengan mengkalsinasi kaolin Bangka Belitung pada suhu
550 dan 700 ˚C selama 3 dan 6 jam. Hasil pengamatan menunjukkan kapasitas
adsorpsi turun dengan bertambahnya suhu kalsinasi pada kaolin. Nanokomposit
metakaolin-TiO
2dibuat dari metakaolin hasil kalsinasi pada suhu 550 ˚C selama 3
jam dengan bantuan bahan pengikat TB3. Komposisi dalam pembuatan
nanokomposit ini adalah metakaolin:bahan pengikat:TiO
2(6:3:1). Kapasitas
adsorpsi metakaolin lebih tinggi dibanding nanokomposit, yaitu 14,76 dan 13,26
mg/g. Akan tetapi, nanokomposit ini mempunyai kelebihan yaitu mampu
mendegradasi biru metilena menjadi senyawa lain.
ABSTRACT
PRAVITHA WIDYASTANA HARTIANTO. Methylene Blue adsorption on
Metakaolin and Metakaolin-TiO
2Nanocomposite and Their Catalysis Test.
Supervised by SRI SUGIARTI and ZAENAL ABIDIN.
PENDAHULUAN
Kaolin atau ”kaolinite” dengan rumus
molekul Al2O3.2SiO2.2H2O merupakan salah satu jenis mineral lempung yang banyak terdapat di Indonesia. Kaolin lazim disebut
sebagai “lempung cina” karena pertama kali
ditemukan di daerah Kao-Lin, Cina (Zheng 2005). Bagian permukaan kristal kaolinit mempunyai muatan negatif yang tetap dan tidak bergantung pada pH (permanent charge). Muatan negatif tersebut berasal dari substitusi atom dalam struktur kristal yang tidak memengaruhi struktur kristal tersebut, misalnya dengan adanya atom Al yang bermuatan +3 menggantikan atom Si yang bermuatan +4, kerangka kaolinit kekurangan muatan positif atau kelebihan muatan negatif (Tan 1982).
Mineral lempung kaolin dalam bentuk dehidroksilasi disebut metakaolin. Terhidroksilasi kaolin menjadi metakaolin merupakan proses endotermik yang membutuhkan sejumlah energi yang besar untuk menghilangkan gugus hidroksil yang terikat secara kimia. Pemanasan suhu tinggi pada kaolin membuat struktur kaolin rusak dan membentuk metakaolin yang bersifat amorf berdasarkan analisis sinar-X (Mitra dan Bhattacherjee 1969). Metakaolin ini dapat dimanfaatkan untuk mengatasi pencemaran lingkungan pada perairan khususnya.
Dewasa ini masalah pencemaran lingkungan yang disebabkan oleh zat warna telah cukup memprihatinkan sehingga perlu ditangani dengan serius. Salah satu contoh zat warna yang sering digunakan pada industri tekstil adalah biru metilena. Salah satu metode yang digunakan untuk menghilangkan zat warna adalah teknik adsorpsi dengan menggunakan berbagai jenis adsorben. Teknik adsorpsi dilakukan karena metodenya sederhana dan ekonomis. Mekanisme adsorpsi dapat dibedakan menjadi dua, yaitu adsorpsi secara fisika (fisisorpsi) dan secara kimia (kimisorpsi). Pada proses fisisorpsi, gaya yang mengikat adsorbat oleh adsorben adalah gaya-gaya van der Waals, sedangkan pada proses kimisorpsi terjadi interaksi adsorbat dengan adsorben melalui pembentukan ikatan kimia.
Adsorben yang paling umum digunakan adalah zeolit, montmorilonit, dan karbon aktif. Upaya konvensional tersebut telah banyak dilakukan. Kelemahan cara ini adalah menimbulkan masalah baru dalam mendaur zat warna yang telah teradsorpsi pada adsorben.
Nanokomposit merupakan suatu bahan yang dibuat dari penggabungan antara dua komponen berbeda yang salah satu atau keduanya berskala nanometer (10-9) atau setara dengan ukuran atom dan molekul (Netcomposites 2007). Pada penelitian ini, dibuat nanokomposit dengan menggunakan prinsip metode adsorpsi-fotodegradasi untuk mengatasi masalah dalam mendaur ulang zat warna yang telah teradsorpsi pada adsorben.
Metode adsorpsi-fotodegradasi didasarkan pada proses adsorpsi senyawa organik oleh permukaan padatan yang sekaligus dapat mendegradasi senyawa organik. Metode ini sedang dikembangkan. Dari berbagai hasil penelitian, diketahui bahwa senyawa-senyawa zat warna dapat didegradasi melalui serangkaian proses fotokimia dengan menggunakan sinar UV.
Fotokatalis yang digunakan pada penelitian ini adalah oksida logam TiO2. Serbuk TiO2 memiliki aktivitas fotokatalitik yang tinggi, stabil, dan tidak beracun. Titanium oksida merupakan bahan semikonduktor oksida logam yang sering digunakan sebagai katalis dalam berbagai penanganan limbah polutan organik dan zat pewarna (Wijaya et al. 2005). TiO2 mampu mendegradasi senyawa organik, namun kurang efektif dalam mengolah limbah yang konsentrasinya tinggi. Kemampuan fotokatalisis oksida logam transisi ini dapat mengalami peningkatan apabila memiliki ukuran partikel dalam kisaran nanometer. Penurunan dimensi partikel oksida logam transisi sampai ke daerah nanometer dapat membantu aktivitas dalam proses degradasi dari zat warna.
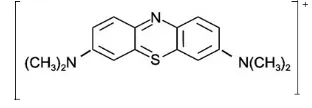
Zat warna yang digunakan pada penelitian ini adalah biru metilena. Biru metilena merupakan senyawa kimia aromatik heterosiklik. Senyawa ini memiliki rumus molekul C16H18ClN3S dengan bobot molekul 319,86 g/mol. Struktur kation biru metilena ditunjukkan pada Gambar 1. Biru metilena merupakan salah satu zat warna pencemar yang murah, mudah didapat, dan cukup berbahaya.
Gambar 1 Struktur kation biru metilena.
bermuatan positif. Kation yang dihasilkan akan berinteraksi dengan adsorben sehingga terjadi penurunan intensitas warna.
Penelitian ini bertujuan mensintesis metakaolin dari kaolin, mensintesis nanokomposit metakaolin-TiO2 untuk proses adsorpsi-fotodegradasi, menentukan kapasitas adsorpsi, isoterm adsorpsi, dan uji fotokatalisis.
METODE
Bahan dan Alat
Bahan-bahan yang digunakan dalam penelitian ini adalah kaolin yang berasal dari Bangka Belitung, TiO2 Degussa P25, zat warna biru metilena, TB1, TB2, TB3, dan air destilata.
Alat-alat yang digunakan adalah alat-alat gelas, neraca analitik, oven, tanur, cawan porselen, sentrifuga Kokusan H-107, lampu UV, XRD, dan spektrofotometer UV-Vis Shimadzu 1700.
Lingkup Kerja
Penelitian ini terbagi menjadi empat tahapan (Lampiran 1). Tahap pertama adalah pembentukan metakaolin. Tahap kedua sintesis nanokomposit metakaolin-TiO2. Tahap ketiga adalah penentuan kapasitas adsorpsi dan penentuan tipe isoterm adsorpsi. Tahap keempat adalah uji fotokatalisis.
Pembentukan Metakaolin
Kaolin dikalsinasi pada suhu 250, 550, dan
700 ˚C selama 3 dan 6 jam. Setelah itu,
dianalisis menggunakan difraktometer sinar-X (XRD).
Pembuatan larutan stok Biru Metilena
Larutan stok biru metilena 1000 mg/L dibuat dengan cara 1000 mg serbuk zat warna dilarutkan dengan air distilata hingga 1 Liter, kemudian dibuat larutan standar dari larutan biru metilena tersebut dengan konsentrasi 0,5; 1; 1,5; 2; 2,5; dan 3 mg/L.
Penentuan panjang gelombang maksimum
Panjang gelombang maksimum ditentukan dengan mengukur serapan larutan biru metilena 5 mg/L pada panjang gelombang 600-700 nm.
Penentuan kapasitas adsorpsi dan isoterm adsorpsi zat warna
Sebanyak 500 mg metakaolin hasil
kalsinasi 250, 550, dan 700 ˚C selama 3 dan 6
jam dimasukkan ke dalam vial kemudian ditambahkan larutan biru metilena dengan konsentrasi 25, 50, 75, 100, 150, 200, dan 300 mg/L sebanyak 15 mL. Larutan tersebut kemudian digojok selama 2 jam, lalu disentrifugasi selama 10 menit dan konsentrasi supernatan ditentukan dengan spektrofotometer UV-Vis pada panjang gelombang maksimum. Metode yang sama dilakukan juga untuk TiO2, bahan pengikat, dan nanokomposit.
Kapasitas adsorpsi dapat dihitung dengan menggunakan rumus
Keterangan:
Q = kapasitas adsorpsi (mg/g) V = volume larutan (L) Co = konsentrasi awal (mg/L) C = konsentrasi akhir (mg/L) m = massa (g)
Pola isoterm adsorpsi diperoleh dengan membuat persamaan regresi linier menggunakan persamaan Langmuir dan Freundlich untuk menentukan tipe isoterm yang sesuai.
Sintesis Nanokomposit Metakaolin-TiO2 Nanokomposit metakaolin-TiO2 dibuat dengan mencampurkan metakaolin-bahan pengikat-TiO2 dengan metakaolin sebagai komposisi terbesar dan TiO2 sebagai komposisi terkecil. Sebelum nanokomposit dibuat, dilakukan uji coba 3 jenis bahan pengikat, yaitu TB1, TB2, dan TB3 dengan perbandingan metakaolin-bahan pengikat 9:1, 8:2, dan 7:3. Kemudian campuran metakaolin-bahan pengikat-TiO2 dibuat pasta dengan cara menambahkan air distilata. Pasta diaduk hingga homogen kemudian dikeringkan pada
suhu 100 ˚C dan dibiarkan pada suhu kamar
selama 24 jam. Hasil nanokomposit yang diperoleh dan serbuk TiO2 dianalisis menggunakan XRD.
Uji Fotokatalisis
selama 6 jam. Larutan diambil dan diukur serapannya dengan spektrofotometer UV-Vis pada panjang gelombang 700 sampai dengan 200 nm. Sebagai pembanding juga dilakukan untuk 15 ml biru metilena, larutan biru metilena dan TiO2, larutan biru metilena dan bahan pengikat, serta larutan biru metilena dan metakaolin. Sebagai kontrol dilakukan juga perlakuan tersebut dan disimpan dalam ruang gelap (tanpa sinar UV).
HASIL
Pembentukan Metakaolin
Serbuk kaolin yang berasal dari Bangka Belitung (BB) dikalsinasi dengan beberapa variasi suhu dan waktu, yaitu 250, 550, dan
700 ˚C selama 3 dan 6 jam. Kemudian dilakukan pencirian menggunakan XRD untuk melihat puncak-puncak khas yang muncul
pada 2θ. Gambar 2, 3, dan 4 memperlihatkan
pola difraksi sampel kaolin yang dikalsinasi
dengan suhu 250, 550, 700 ˚C selama 3 dan 6 jam.
Kaolin yang dikalsinasi 250 ˚C selama 3
dan 6 jam masih menunjukkan puncak khas
kaolin pada 2θ = 12,36 dan 24,88, sedangkan kaolin yang dikalsinasi pada 550 dan 700 ˚C
selama 3 dan 6 jam sudah berbentuk amorf. Perubahan ini ditandai dengan hilangnya puncak-puncak khas kaolin. Hal ini menunjukkan metakaolin hasil kalsinasi 550
dan 700 ˚C selama 3 dan 6 jam sudah
terbentuk.
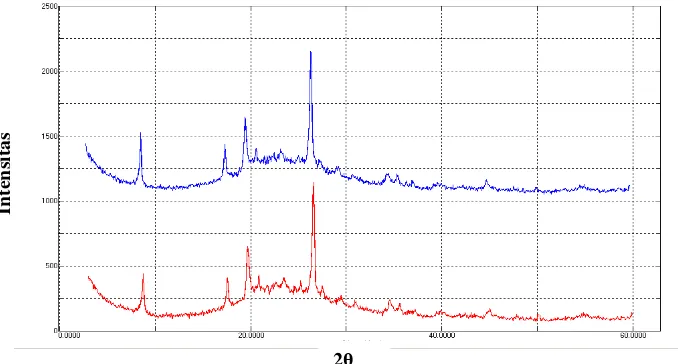
Gambar 2 Pola XRD dari metakaolin BB hasil kalsinasi suhu 700 ˚C selama 3( ) dan 6 ( ) jam.
Gambar 3 Pola XRD dari metakaolin BB hasil kalsinasi suhu 550 ˚C selama 3 ( ) dan 6 ( ) jam.
Inte
ns
it
a
s
Inte
ns
it
a
s
2 θ
Gambar 4 Pola XRD dari metakaolin BB hasil kalsinasi suhu 250 ˚C selama 3( ) dan 6 ( ) jam.
Penentuan Kapasitas Adsorpsi Metakaolin
Panjang gelombang maksimum biru metilena adalah 664 nm (Lampiran 2). Penentuan kapasitas adsorpsi larutan biru metilena yang terjerap pada metakaolin dilakukan menggunakan tujuh konsentrasi yang berbeda. Semakin tinggi konsentrasi, kapasitas adsorpsinya semakin tinggi (Lampiran 3-8). Nilai kapasitas adsorpsi metakaolin hasil kalsinasi 250, 550, dan 700
˚C selama 3 dan 6 jam ditunjukkan pada Tabel 1. Kurva yang menunjukkan kapasitas adsorpsi metakaolin, TiO2, dan bahan pengikat TB3 terdapat pada Gambar 5. Nilai kapasitas adsorpsi bahan pengikat TB3 dan TiO2 pada Lampiran 9 dan 10.
Tabel 1 Kapasitas adsorpsi biru metilena pada metakaolin hasil kalsinasi berbagai suhu dan lama kalsinasi
Sampel Kapasitas adsorpsi (mg/g)
250˚C 3 jam 15,1949
250˚C 6 jam 14,9446
550˚C 3 jam 14,7637
550˚C 6 jam 12,2890
700˚C 3 jam 12,1521
700˚C 6 jam 9,1411
Gambar 5 Kurva kapasitas adsorpsi metakaolin hasil kalsinasi 250 ˚C 3 jam ( ), 250 ˚C 6 jam ( ), 550 ˚C 3 jam ( ), 550 ˚C 6 jam ( ), 700 ˚C 3 jam ( ), 700 ˚C 6 jam ( ), TiO2 ( ), dan bahan pengikat TB3 ( ) terhadap larutan biru metilena.
Pemodelan Isoterm Adsorpsi Metakaolin
Hasil pengukuran kapasitas adsorpsi digunakan untuk menentukan tipe isoterm adsorpsi dari metakaolin. Berdasarkan nilai linieritas, tipe isoterm adsorpsi metakaolin
Tabel 2 Nilai linieritas isoterm adsorpsi
Sampel Langmuir Freundlich
250 ˚C 3 jam 0,9942 0,9855
250 ˚C 6 jam 0,9977 0,9716
550 ˚C 3 jam 0,9972 0,9439
550 ˚C 6 jam 0,9955 0,9640
700 ˚C 3 jam 0,9992 0,8511
700 ˚C 6 jam 0,9888 0,8764
Tabel 3 Nilai konstanta isoterm Langmuir pada metakaolin
Sampel Xm (mg/g) k (g/L)
250 ˚C 3 jam 15, 1515 0,1466
250 ˚C 6 jam 15,1057 0,1679
550 ˚C 3 jam 15,6006 0,0811
550 ˚C 6 jam 12,9366 0,0571
700 ˚C 3 jam 12,5945 0,0973
700 ˚C 6 jam 9,8912 0,0477
Sintesis Nanokomposit Metakaolin-TiO2
dan Karakterisasi XRD
Nanokomposit metakaolin-TiO2 dibuat dengan mencampurkan metakaolin dan TiO2 secara fisik, tetapi pencampuran secara fisik tersebut tidak membuat nanokomposit terbentuk sehingga ditambahkan bahan pengikat agar kedua komponen tersebut saling mengikat. Bahan pengikat yang diujicobakan ada tiga jenis, yaitu TB1, TB2, dan TB3. Hasil penelitian menunjukkan bahan pengikat yang dapat mengikat metakaolin dengan TiO2 adalah TB3. Metakaolin yang dapat dibentuk nanokomposit dengan baik adalah metakaolin
hasil kalsinasi 550 ˚C selama 3 jam. Data hasil uji coba bahan pengikat ditunjukkan pada Tabel 4 dan Lampiran 17.
Tabel 4 Hasil uji coba beberapa jenis perbandingan metakaolin dan bahan pengikat
Jenis bahan pengikat
Perbandingan metakaolin dan bahan pengikat
Hasil
TB 1 9:1 Hancur
8:2 Hancur
7:3 Hancur
TB 2 9:1 Hancur
8:2 Hancur
7:3 Hancur
TB 3 9:1 Hancur
8:2 Sedikit Hancur 7:3 Tidak hancur
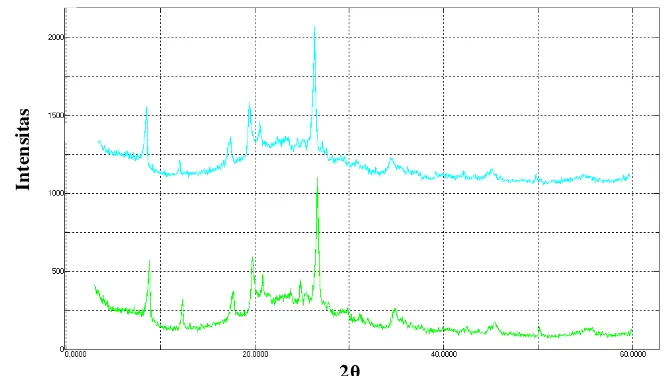
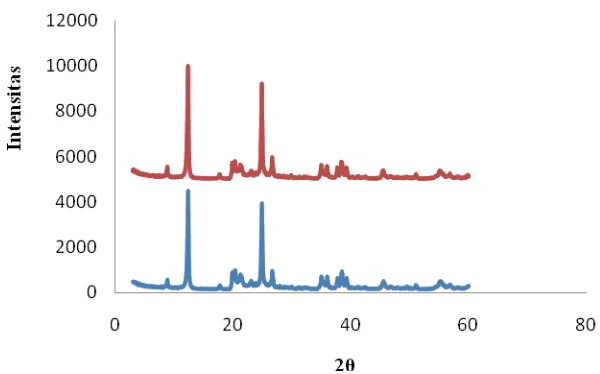
Pola difraksi nanokomposit metakaolin-TiO2 dan TiO2 ditunjukkan pada Gambar 6.
Gambar 6 Pola XRD nanokomposit metakaolin-TiO2 ( ) dan TiO2 ( ).
Kapasitas Adsorpsi Nanokomposit Metakaolin-TiO2
Kapasitas adsorpsi nanokomposit lebih rendah daripada metakaolin, yaitu 13,2631 mg/g (Lampiran 18).
Gambar 7 Kurva kapasitas adsorpsi nanokomposit terhadap larutan biru metilena.
Pemodelan Isoterm Adsorpsi
Nanokomposit Metakaolin-TiO2
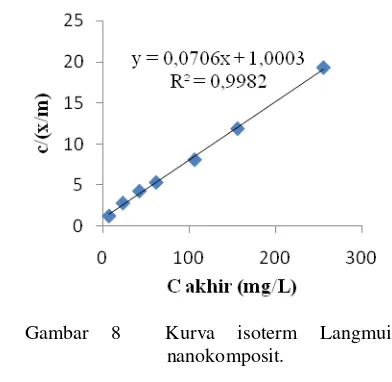
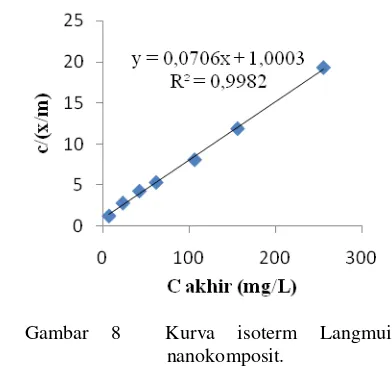
Isoterm nanokomposit mengikuti tipe isoterm Langmuir (Gambar 8). Nilai R2
isoterm Langmuir lebih besar dari isoterm Freundlich. Nilai R2 dari isoterm Langmuir dan Freundlich berturut-turut 0,9982 dan 0,9353. Perhitungan isoterm Langmuir nanokomposit ditunjukkan pada Lampiran 19. Nilai Xm dan k untuk nanokomposit, yaitu 13,1643 mg/g dan 0,0706 g/L.
Gambar 8 Kurva isoterm Langmuir nanokomposit.
Uji Fotokatalis
Hasil reaksi fotokatalisis tanpa radiasi sinar UV secara visual dapat dilihat pada Gambar 9.
Gambar 9 Perubahan warna larutan biru metilena tanpa sinar UV setelah 6 jam. (a) biru metilena; (b) biru metilena dan TiO2; (c) biru metilena dan metakaolin; (d) biru metilena dan nanokomposit (e) biru metilena dan bahan pengikat TB3.
Hasil reaksi fotokatalisis dengan radiasi sinar UV selama 6 jam secara visual dapat dilihat pada Gambar 10.
Gambar 10 Perubahan warna larutan biru metilena dengan sinar UV setelah 6 jam. (a) biru metilena; (b) biru metilena dan TiO2; (c) biru metilena dan metakaolin; (d) biru metilena dan nanokomposit (e) biru metilena dan bahan pengikat TB3.
Larutan biru metilena dengan metakaolin dan biru metilena dengan nanokomposit tidak memperlihatkan perubahan warna yang jelas antara tanpa dan dengan sinar UV. Selain itu, hasil pemayaran menggunakan spektrofotometer UV-Vis pada Lampiran 20 terlihat hilangnya puncak biru metilena. Bukti biru metilena terdegradasi dapat dilihat dari endapan (Lampiran 21). Warna endapan yang masih biru pada perlakuan tanpa sinar UV menunjukkan bahwa nanokomposit tersebut hanya memiliki kemampuan menjerap saja dan fotokatalis TiO2 tidak bekerja. Sedangkan
A
B
C
D
A
B
C
D
E
pada perlakuan dengan sinar UV, endapan nanokomposit berubah menjadi biru pudar/putih. Hal ini menunjukkan terjadi proses fotokatalisis.
PEMBAHASAN
Pembentukan Metakaolin
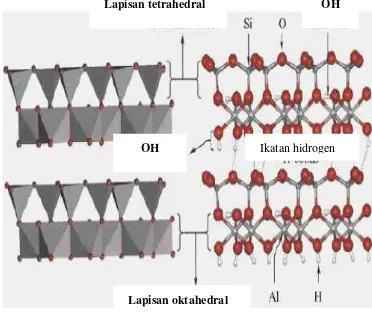
Bahan baku pembuatan metakaolin adalah kaolin. Kaolin yang digunakan pada penelitian ini berasal dari Bangka Belitung yang berwarna putih. Kaolin dapat berwarna putih, merah muda, atau abu-abu bergantung pada komposisinya (Bougeard et al. 2000). Kaolinit merupakan lapisan aluminosilikat dengan lapisan struktur dioktahedral tak bermuatan 1:1 (Gambar 11). Pengertian lapisan 1:1 adalah untuk setiap satuan mineral terdiri atas satu lapisan oksida-Si (lapisan silikat) dan satu lapisan hidroksioksida-Al (lapisan aluminat). Satuan-satuan ini berikatan kuat sesamanya dengan ikatan hidrogen dan van der Waals (Muhdarina & Linggawati 2003). Metakaolin dibuat dengan mengkalsinasi kaolin menggunakan suhu tinggi sehingga ikatan hidrogen yang ada pada antar lapisan kaolin tersebut putus dan membentuk metakaolin yang amorf.
Gambar 11 Struktur Kaolinit
Metakaolin merupakan bentuk dehidroksilasi dari kaolin. Pola XRD pada Gambar 4 menunjukkan puncak-puncak khas dari kaolin masih terlihat. Pada kalsinasi
dengan suhu 250 ˚C selama 3 dan 6 jam hanya
menghilangkan air yang terjerap pada pori dan permukaan kaolin (Ilić et al. 2010). Setelah
dikalsinasi dengan suhu 550 dan 700 ˚C
selama 3 dan 6 jam, puncak khas kaolin hilang karena kalsinasi suhu tinggi menghilangkan gugus hidroksil yang terikat secara kimia. Hal ini sesuai dengan penelitian Mitra dan
Bhattacherjee (1969), bahwa pemanasan suhu tinggi pada kaolin membuat struktur dari kaolin itu sendiri rusak dan membentuk metakaolin yang bersifat amorf. Adapun masih ada puncak yang terlihat (Gambar 2 dan 3) pada metakaolin hasil kalsinasi 550 dan
700 ˚C adalah puncak-puncak dari mineral lain karena kaolin Indonesia tidak murni.
Penentuan Kapasitas Adsorpsi dan Isoterm Adsorpsi Metakaolin
Konsentrasi awal adsorbat merupakan salah satu faktor yang menentukan besarnya kapasitas adsorpsi dari metakaolin. Nilai kapasitas adsorpsi yang besar menunjukkan bahwa adsorben tersebut optimal dalam mengikat adsorbat. Berdasarkan hasil penelitian, meningkatnya suhu dan lama kalsinasi membuat kapasitas adsorpsi menurun. Penurunan ini disebabkan oleh rusaknya struktur sehingga permukaan dari metakaolin tidak dapat menjerap zat warna secara maksimal. Sesuai dengan penelitian Ghosh dan Bhattacharyya (2002), kapasitas adsorpsi metakaolin lebih kecil daripada kaolin.
Isoterm adsorpsi menunjukkan hubungan kesetimbangan antara konsentrasi adsorbat dalam fluida dan pada permukaan adsorben, pada suhu tetap. Tipe isoterm adsorpsi dapat digunakan untuk mengetahui mekanisme penjerapan biru metilena dengan adsorben metakaolin. Isoterm adsorpsi Langmuir dilakukan dengan cara membuat kurva hubungan c/(x/m) terhadap c, sedangkan isoterm adsorpsi Freundlich dilakukan dengan membuat kurva hubungan log x/m terhadap log c (Atkins 1999). Hasil penelitian menunjukkan tipe isoterm pada metakaolin BB mengikuti tipe isoterm Langmuir karena linieritas isoterm Langmuir lebih besar daripada isoterm Freundlich. Mekanisme adsorpsi biru metilena berlangsung secara kimisorpsi pada adsorben tersebut. Adsorpsi terjadi akibat adanya interaksi kimia antara padatan adsorben dengan material yang terjerap.
Bentuk dari persamaan Langmuir adalah sebagai berikut.
c
Xm
k
Xm
m
x
c
1
.
1
/
Nilai Xm menggambarkan jumlah yang dijerap atau kapasitas adsorpsi untuk membentuk lapisan sempurna pada
Lapisan tetrahedral
Ikatan hidrogen
Lapisan oktahedral
OH
permukaan adsorben. Nilai k merupakan konstanta yang bertambah dengan kenaikan ukuran molekuler yang menunjukkan kekuatan ikatan molekul adsorbat pada permukaan adsorben. Hasil penelitian menunjukkan dengan kalsinasi suhu tinggi akan menurunkan nilai Xm dan k. Hal ini disebabkan oleh struktur metakaolin yang amorf. Selain itu, ada penyimpangan pada
metakaolin hasil kalsinasi 250 ˚C selama 3
dan 6 jam yaitu terjadi kenaikan nilai k. Hal ini dikarenakan pada kalsinasi suhu tersebut merupakan bentuk transisi dari kaolin menjadi metakaolin, jadi energi pengikatan antara adsorbat dan adsorben masih kuat dibandingkan metakaolin yang sudah amorf.
Sintesis Nanokomposit Metakaolin-TiO2 Nanokomposit metakaolin-TiO2 dibuat dengan mencampurkan metakaolin, bahan pengikat TB3, dan TiO2 dengan perbandingan (6:3:1). Metakaolin yang digunakan adalah
hasil kalsinasi 550 ˚C selama 3 jam karena
pada uji coba bahan pengikat, metakaolin tersebut yang dapat mengikat dengan TiO2. Hal ini disebabkan oleh struktur dari metakaolin yang belum rusak seluruhnya dibanding dengan metakaolin hasil kalsinasi
700 ˚C. TiO2 yang dicampurkan dalam jumlah kecil, karena TiO2 ini bertindak sebagai katalis yang dalam jumlah kecil sudah dapat bekerja. Selain itu, TiO2 juga memiliki kapasitas adsorpsi yang kecil yaitu 3,2838 mg/g. Sama halnya dengan bahan pengikat TB3, bahan pengikat ini mempunyai kapasitas adsorpsi yang kecil yaitu 9,7135 mg/g.
Campuran ketiga komponen pembentuk nanokomposit dibuat pasta kemudian
dipanaskan dengan suhu 100 ˚C untuk
menghilangkan molekul air dan didiamkan dalam suhu kamar selama 24 jam. Setelah itu, nanokomposit yang telah dibuat diuji dengan cara melarutkan nanokomposit tersebut ke dalam air. Berdasarkan hasil penelitian, nanokomposit yang telah dibuat tidak hancur ketika dilarutkan dalam air. Hal ini menunjukkan bahwa bahan pengikat TB3 sebanyak 30% cukup efektif mengikat TiO2 sehingga TiO2 tidak saling lepas dari metakaolin.
Berdasarkan pola difraksi nanokomposit metakaolin-TiO2 terlihat puncak khas
2θ=25,28. Puncak ini adalah puncak TiO2 sehingga pada nanokomposit tersebut TiO2 terikat.
Penentuan Kapasitas Adsorpsi dan Isoterm Adsorpsi Metakaolin-TiO2
Kapasitas adsorpsi nanokomposit diukur untuk melihat perubahan kapasitas adsorpsi ketika dibentuk nanokomposit. Hasil penelitian menunjukkan kapasitas adsorpsi nanokomposit lebih kecil dibanding metakaolinnya. Kapasitas adsorpsi metakaolin sebesar 14,7637 mg/g, sedangkan kapasitas adsorpsi nanokomposit adalah 13,2631 mg/g. Penurunan ini dikarenakan faktor penambahan bahan pengikat dan TiO2 yang memiliki kemampuan menjerap lebih kecil dibanding metakaolin. Penambahan bahan-bahan tersebut mengurangi jumlah metakaolin sehingga sisi aktif dari tiap gram metakaolin berkurang.
Tipe isoterm adsorpsi nanokomposit adalah isoterm Langmuir sama seperti metakaolin. Pengubahan bentuk menjadi nanokomposit tidak mengubah isoterm adsorpsi. Tipe adsorpsinya secara kimia. Nilai konstanta Xm dan k nanokomposit ditunjukkan pada Tabel 5. Nilai Xm dan k nanokomposit lebih kecil dibanding nilai metakaolin. Hal ini menunjukkan kapasitas adsorpsi dan kekuatan ikatan biru metilena dengan permukaan adsorben yang rendah.
Uji Fotokatalis
Pengujian fotodegradasi nanokomposit metakaolin-TiO2 dilakukan untuk melihat kemampuan nanokomposit dalam menjerap sekaligus mendegradasi zat warna dengan bantuan radiasi sinar UV. Nanokomposit metakaolin-TiO2 hasil sintesis digunakan untuk uji fotodegradasi zat warna biru metilena. Reaksi yang terjadi pada degradasi biru metilena adalah reaksi redoks dimana terjadi pelepasan dan penangkapan elektron yang diakibatkan oleh energi foton hv (Sumerta et al. 2002). Proses fotodegradasi menggunakan sinar UV. Sinar UV berperan sebagai sumber foton. Berikut adalah proses fotodegradasi zat warna :
TiO2+ hv →TiO2 (e- + h+)
TiO2 (h+) +H2O → TiO2 + HO* + H+ TiO2 (e-) + O2→ TiO2 + O2
-Zat warna + hv → -Zat warna*
Zat warna* + O2-→ produk degradasi
metakaolin-TiO2 ditambahkan biru metilena yang disimpan dalam ruangan gelap selama 6 jam. Berdasarkan hasil penelitian, biru metilena yang dberi penyinaran UV mengalami pengurangan yang cukup besar dibandingkan dengan yang diberi perlakuan gelap. Reaksi fotodegradasi biru metilena dapat dituliskan sebagai berikut (Nogueira & Jardim 1993).
C16H18N3SCl(teradsorp+terlarut) +5½ O2 → HCl + H2SO4 + 3HNO3 + 16CO2 + 6H2O
Berdasarkan hasil penelitian (Gambar 9 dan 10) terlihat bahwa TiO2 bekerja sebagai fotokatalis ketika disinari sinar UV, ditandai hilangnya warna biru metilena. Hasil pemayaran menggunakan spektrofotometer UV-Vis menunjukkan puncak biru metilena hilang pada sampel nanokomposit dengan biru metilena yang diberi sinar UV. Hal ini menunjukkan biru metilena teradsorpsi dan terdegradasi (Lampiran 20). Berdasarkan warna endapan terlihat bahwa endapan TiO2 yang dicampur bahan pengikat TB3 berwarna putih ketika disinari sinar UV. Hal ini menunjukkan bahwa TiO2 bekerja sebagai fotokatalis jika diberi sinar UV. Fenomena adsorpsi terlihat dari warna endapan yang berwarna biru tua. Sedangkan pada nanokomposit metakaolin-TiO2 dengan sinar UV endapannya berwarna biru sangat pudar dibanding perlakuan tanpa sinar UV. Hal ini menunjukkan pada nanokomposit terjadi fenomena adsorpsi-fotodegradasi. Akan tetapi, hasil degradasinya kurang maksimal karena pencampuran fisik dan kemampuan sinergi metakaolin, bahan pengikat, dan TiO2 yang kurang baik.
SIMPULAN DAN SARAN
Simpulan
Struktur amorf metakaolin terlihat pada
hasil kalsinasi 550 dan 700 ˚C selama 3 dan 6
jam. Kapasitas adsorpsi menurun dengan bertambahnya suhu kalsinasi pada kaolin. Metakaolin hasil kalsinasi 550 ˚C selama 3 jam yang digunakan untuk membuat nanokomposit metakaolin-TiO2. Komposisi dalam pembuatan nanokomposit ini adalah metakaolin:bahan pengikat:TiO2 (6:3:1). Kapasitas adsorpsi metakaolin lebih tinggi dibanding nanokomposit yaitu, 14,76 dan 13,26 mg/g. Nanokomposit metakaolin-TiO2 memiliki kemampuan fotokatalis pada reaksi
penguraian biru metilena di bawah radiasi sinar ultraviolet.
Saran
Tahapan selanjutnya perlu dilakukan analisis senyawa hasil degradasi. Selain itu, perlu dilakukan juga karakterisasi IR untuk melihat pola ikatan yang ada pada nanokomposit metakaolin-TiO2.
DAFTAR PUSTAKA
Atkins PW. 1999. Kimia Fisik Jilid 1. Irma I Kartohadiprojo, penerjemah; Rohhadyan T, Hadiyana K, editor. Jakarta: Erlangga. Terjemahan dari: Physical chemistry.
Bougeard D, Geidel E, Smirnov KS. 2000. Vibrational spectra and structure of kaolinite: A computer simulation study.J Phys Chem B 104: 9210-9217.
Ghosh D, Bhattacharyya KG. 2002. Adsorption of methylene blue on kaolinite. Appl Clay Sci 20:295-300.
Ilić BR, Mitrović AA, Miličić LR. 2010. Thermal Treatment of Kaolin Clay to Obtain Metakaolin. Belgrade:Institute for Testing of Materials.
Mitra GB, Bhattacherjee. 1969. X-Ray Difraction studies on the transformation of kaolinite into metakaolin: I. Variability of interlayer spacings. Am Mineralogist 54.
Muhdarina, Linggawati A. 2003. Pilarisasi Kaolinit Alam untuk Meningkatkan Kapasitas Tukar Kation. J Natur Indones
6:20-23.
Netcomposites. 2007. [terhubung berkala]. http://www.netcomposites.com/image/mo ntmorillonite.html [13 Des 2009].
Nogueira RFP, Jardim WF. 1993. Photodegradation of methylene blue using solar light and semiconductor (TiO2). J Chem 10:861-862.
metakaolin-TiO2 ditambahkan biru metilena yang disimpan dalam ruangan gelap selama 6 jam. Berdasarkan hasil penelitian, biru metilena yang dberi penyinaran UV mengalami pengurangan yang cukup besar dibandingkan dengan yang diberi perlakuan gelap. Reaksi fotodegradasi biru metilena dapat dituliskan sebagai berikut (Nogueira & Jardim 1993).
C16H18N3SCl(teradsorp+terlarut) +5½ O2 → HCl + H2SO4 + 3HNO3 + 16CO2 + 6H2O
Berdasarkan hasil penelitian (Gambar 9 dan 10) terlihat bahwa TiO2 bekerja sebagai fotokatalis ketika disinari sinar UV, ditandai hilangnya warna biru metilena. Hasil pemayaran menggunakan spektrofotometer UV-Vis menunjukkan puncak biru metilena hilang pada sampel nanokomposit dengan biru metilena yang diberi sinar UV. Hal ini menunjukkan biru metilena teradsorpsi dan terdegradasi (Lampiran 20). Berdasarkan warna endapan terlihat bahwa endapan TiO2 yang dicampur bahan pengikat TB3 berwarna putih ketika disinari sinar UV. Hal ini menunjukkan bahwa TiO2 bekerja sebagai fotokatalis jika diberi sinar UV. Fenomena adsorpsi terlihat dari warna endapan yang berwarna biru tua. Sedangkan pada nanokomposit metakaolin-TiO2 dengan sinar UV endapannya berwarna biru sangat pudar dibanding perlakuan tanpa sinar UV. Hal ini menunjukkan pada nanokomposit terjadi fenomena adsorpsi-fotodegradasi. Akan tetapi, hasil degradasinya kurang maksimal karena pencampuran fisik dan kemampuan sinergi metakaolin, bahan pengikat, dan TiO2 yang kurang baik.
SIMPULAN DAN SARAN
Simpulan
Struktur amorf metakaolin terlihat pada
hasil kalsinasi 550 dan 700 ˚C selama 3 dan 6
jam. Kapasitas adsorpsi menurun dengan bertambahnya suhu kalsinasi pada kaolin. Metakaolin hasil kalsinasi 550 ˚C selama 3 jam yang digunakan untuk membuat nanokomposit metakaolin-TiO2. Komposisi dalam pembuatan nanokomposit ini adalah metakaolin:bahan pengikat:TiO2 (6:3:1). Kapasitas adsorpsi metakaolin lebih tinggi dibanding nanokomposit yaitu, 14,76 dan 13,26 mg/g. Nanokomposit metakaolin-TiO2 memiliki kemampuan fotokatalis pada reaksi
penguraian biru metilena di bawah radiasi sinar ultraviolet.
Saran
Tahapan selanjutnya perlu dilakukan analisis senyawa hasil degradasi. Selain itu, perlu dilakukan juga karakterisasi IR untuk melihat pola ikatan yang ada pada nanokomposit metakaolin-TiO2.
DAFTAR PUSTAKA
Atkins PW. 1999. Kimia Fisik Jilid 1. Irma I Kartohadiprojo, penerjemah; Rohhadyan T, Hadiyana K, editor. Jakarta: Erlangga. Terjemahan dari: Physical chemistry.
Bougeard D, Geidel E, Smirnov KS. 2000. Vibrational spectra and structure of kaolinite: A computer simulation study.J Phys Chem B 104: 9210-9217.
Ghosh D, Bhattacharyya KG. 2002. Adsorption of methylene blue on kaolinite. Appl Clay Sci 20:295-300.
Ilić BR, Mitrović AA, Miličić LR. 2010. Thermal Treatment of Kaolin Clay to Obtain Metakaolin. Belgrade:Institute for Testing of Materials.
Mitra GB, Bhattacherjee. 1969. X-Ray Difraction studies on the transformation of kaolinite into metakaolin: I. Variability of interlayer spacings. Am Mineralogist 54.
Muhdarina, Linggawati A. 2003. Pilarisasi Kaolinit Alam untuk Meningkatkan Kapasitas Tukar Kation. J Natur Indones
6:20-23.
Netcomposites. 2007. [terhubung berkala]. http://www.netcomposites.com/image/mo ntmorillonite.html [13 Des 2009].
Nogueira RFP, Jardim WF. 1993. Photodegradation of methylene blue using solar light and semiconductor (TiO2). J Chem 10:861-862.
ADSORPSI BIRU METILENA PADA METAKAOLIN
DAN NANOKOMPOSIT METAKAOLIN-TiO
2SERTA
UJI FOTOKATALISIS
PRAVITHA WIDYASTANA HARTIANTO
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
metakaolin-TiO2 ditambahkan biru metilena yang disimpan dalam ruangan gelap selama 6 jam. Berdasarkan hasil penelitian, biru metilena yang dberi penyinaran UV mengalami pengurangan yang cukup besar dibandingkan dengan yang diberi perlakuan gelap. Reaksi fotodegradasi biru metilena dapat dituliskan sebagai berikut (Nogueira & Jardim 1993).
C16H18N3SCl(teradsorp+terlarut) +5½ O2 → HCl + H2SO4 + 3HNO3 + 16CO2 + 6H2O
Berdasarkan hasil penelitian (Gambar 9 dan 10) terlihat bahwa TiO2 bekerja sebagai fotokatalis ketika disinari sinar UV, ditandai hilangnya warna biru metilena. Hasil pemayaran menggunakan spektrofotometer UV-Vis menunjukkan puncak biru metilena hilang pada sampel nanokomposit dengan biru metilena yang diberi sinar UV. Hal ini menunjukkan biru metilena teradsorpsi dan terdegradasi (Lampiran 20). Berdasarkan warna endapan terlihat bahwa endapan TiO2 yang dicampur bahan pengikat TB3 berwarna putih ketika disinari sinar UV. Hal ini menunjukkan bahwa TiO2 bekerja sebagai fotokatalis jika diberi sinar UV. Fenomena adsorpsi terlihat dari warna endapan yang berwarna biru tua. Sedangkan pada nanokomposit metakaolin-TiO2 dengan sinar UV endapannya berwarna biru sangat pudar dibanding perlakuan tanpa sinar UV. Hal ini menunjukkan pada nanokomposit terjadi fenomena adsorpsi-fotodegradasi. Akan tetapi, hasil degradasinya kurang maksimal karena pencampuran fisik dan kemampuan sinergi metakaolin, bahan pengikat, dan TiO2 yang kurang baik.
SIMPULAN DAN SARAN
Simpulan
Struktur amorf metakaolin terlihat pada
hasil kalsinasi 550 dan 700 ˚C selama 3 dan 6
jam. Kapasitas adsorpsi menurun dengan bertambahnya suhu kalsinasi pada kaolin. Metakaolin hasil kalsinasi 550 ˚C selama 3 jam yang digunakan untuk membuat nanokomposit metakaolin-TiO2. Komposisi dalam pembuatan nanokomposit ini adalah metakaolin:bahan pengikat:TiO2 (6:3:1). Kapasitas adsorpsi metakaolin lebih tinggi dibanding nanokomposit yaitu, 14,76 dan 13,26 mg/g. Nanokomposit metakaolin-TiO2 memiliki kemampuan fotokatalis pada reaksi
penguraian biru metilena di bawah radiasi sinar ultraviolet.
Saran
Tahapan selanjutnya perlu dilakukan analisis senyawa hasil degradasi. Selain itu, perlu dilakukan juga karakterisasi IR untuk melihat pola ikatan yang ada pada nanokomposit metakaolin-TiO2.
DAFTAR PUSTAKA
Atkins PW. 1999. Kimia Fisik Jilid 1. Irma I Kartohadiprojo, penerjemah; Rohhadyan T, Hadiyana K, editor. Jakarta: Erlangga. Terjemahan dari: Physical chemistry.
Bougeard D, Geidel E, Smirnov KS. 2000. Vibrational spectra and structure of kaolinite: A computer simulation study.J Phys Chem B 104: 9210-9217.
Ghosh D, Bhattacharyya KG. 2002. Adsorption of methylene blue on kaolinite. Appl Clay Sci 20:295-300.
Ilić BR, Mitrović AA, Miličić LR. 2010. Thermal Treatment of Kaolin Clay to Obtain Metakaolin. Belgrade:Institute for Testing of Materials.
Mitra GB, Bhattacherjee. 1969. X-Ray Difraction studies on the transformation of kaolinite into metakaolin: I. Variability of interlayer spacings. Am Mineralogist 54.
Muhdarina, Linggawati A. 2003. Pilarisasi Kaolinit Alam untuk Meningkatkan Kapasitas Tukar Kation. J Natur Indones
6:20-23.
Netcomposites. 2007. [terhubung berkala]. http://www.netcomposites.com/image/mo ntmorillonite.html [13 Des 2009].
Nogueira RFP, Jardim WF. 1993. Photodegradation of methylene blue using solar light and semiconductor (TiO2). J Chem 10:861-862.
Yogyakarta: Universitas Negeri Yogyakarta.
Tan KH. 1982. Dasar Kimia Tanah. Ed. ke-2. Yogyakarta: Universitas Gadjah Mada.
Wijaya K, Iqmal T, Nanik H. 2005. Sintesis Fe2O3-montmorilonit dan aplikasinya sebagai fotokatalis untuk degradasi zat pewarna congo red. Indones J Chem 5: 41-47.
ADSORPSI BIRU METILENA PADA METAKAOLIN
DAN NANOKOMPOSIT METAKAOLIN-TiO
2SERTA
UJI FOTOKATALISIS
PRAVITHA WIDYASTANA HARTIANTO
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
ABSTRAK
PRAVITHA WIDYASTANA HARTIANTO. Adsorpsi Biru Metilena pada
Metakaolin dan Nanokomposit Metakaolin-TiO
2serta Uji Fotokatalisis.
Dibimbing oleh SRI SUGIARTI dan ZAENAL ABIDIN.
Salah satu metode yang digunakan untuk menghilangkan zat warna pada
perairan adalah adsorpsi-fotodegradasi. Metode ini berdasar pada proses adsorpsi
senyawa organik oleh permukaan padatan yang sekaligus dapat mendegradasi
senyawa organik. Adsorben yang digunakan umumnya berbahan dasar lempung,
seperti kaolin. Pemanasan suhu tinggi pada kaolin membuat struktur dari kaolin
itu sendiri rusak dan membentuk metakaolin yang bersifat amorf. Penggunaan
metakaolin sebagai adsorben kurang diminati karena memiliki daya jerap yang
rendah. Oleh karena itu, dilakukan modifikasi metakaolin menjadi nanokomposit
dengan menambahkan serbuk TiO
2anatase secara fisik. Pada penelitian ini,
metakaolin dibentuk dengan mengkalsinasi kaolin Bangka Belitung pada suhu
550 dan 700 ˚C selama 3 dan 6 jam. Hasil pengamatan menunjukkan kapasitas
adsorpsi turun dengan bertambahnya suhu kalsinasi pada kaolin. Nanokomposit
metakaolin-TiO
2dibuat dari metakaolin hasil kalsinasi pada suhu 550 ˚C selama 3
jam dengan bantuan bahan pengikat TB3. Komposisi dalam pembuatan
nanokomposit ini adalah metakaolin:bahan pengikat:TiO
2(6:3:1). Kapasitas
adsorpsi metakaolin lebih tinggi dibanding nanokomposit, yaitu 14,76 dan 13,26
mg/g. Akan tetapi, nanokomposit ini mempunyai kelebihan yaitu mampu
mendegradasi biru metilena menjadi senyawa lain.
ABSTRACT
PRAVITHA WIDYASTANA HARTIANTO. Methylene Blue adsorption on
Metakaolin and Metakaolin-TiO
2Nanocomposite and Their Catalysis Test.
Supervised by SRI SUGIARTI and ZAENAL ABIDIN.
ADSORPSI BIRU METILENA PADA METAKAOLIN
DAN NANOKOMPOSIT METAKAOLIN-TiO
2SERTA
UJI FOTOKATALISIS
PRAVITHA WIDYASTANA HARTIANTO
Skripsi
Sebagai salah satu syarat untuk memperoleh gelar
Sarjana Sains pada
Departemen Kimia
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
Judul : Adsorpsi Biru Metilena pada Metakaolin dan Nanokomposit
Metakaolin-TiO
2serta Uji Fotokatalisis
Nama : Pravitha Widyastana Hartianto
NIM
: G44060082
Disetujui
Pembimbing I
Pembimbing II
Dr. Sri Sugiarti
Dr. Zaenal Abidin
NIP 19701225 199512 2 001
NIP 19710614 199512 1 001
Diketahui
Ketua Departemen Kimia
Prof. Dr. Ir. Tun Tedja Irawadi, M.S.
NIP 19501227 197603 2 002
PRAKATA
Puji syukur penulis panjatkan kepada Allah SWT atas berkat limpahan rahmat
dan hidayah-Nya penulis dapat menyelesaikan karya ilmiah dengan judul Adsorpsi Biru
Metilena pada Metakaolin dan Nanokomposit Metakaolin-TiO
2serta Uji Fotokatalisis.
Salawat serta salam semoga selalu tercurahkan kepada Nabi Muhammad SAW,
keluarganya, dan semoga kita semua menjadi pengikutnya hingga akhir zaman.
Penulis mengucapkan terima kasih kepada Ibu Dr. Sri Sugiarti selaku
pembimbing pertama dan Bapak Dr. Zaenal Abidin selaku pembimbing kedua yang telah
memberikan arahan, saran, dan dorongan selama pelaksanaan penelitian dan penulisan
karya ilmiah ini. Ungkapan terima kasih penulis berikan kepada keluarga tercinta, Bapak,
Ibu, adik-adikku (Irfan dan Shafwa), dan Raidinal yang selalu memberikan semangat,
doa, dan kasih sayang. Terima kasih juga kepada Bapak Syawal, Bapak Caca, Bapak
Mul, Nurul, Mas Eko, Bapak Eman atas fasilitas dan bantuan yang diberikan selama
penelitian. Ucapan terima kasih juga disampaikan kepada Evi, Nova, Nisa, Rania, Nurul,
Mia, Charisna, Susi, Rifa, Rina, dan adik-adikku di Vision yang turut membantu,
memberikan semangat dan dukungannya dalam penyusunan karya ilmiah.
Penulis berharap karya ilmiah ini dapat bermanfaat bagi perkembangan ilmu
pengetahuan.
Bogor, Februari 2011
RIWAYAT HIDUP
Penulis dilahirkan di Blitar pada tanggal 26 Desember 1988 sebagai anak pertama
dari tiga bersaudara dari pasangan Sudarwanto dan Sugiharti. Tahun 2006, penulis lulus
dari SMU Negeri 5 Bogor dan pada tahun yang sama lulus seleksi masuk Institut
Pertanian Bogor (IPB) melalui jalur Undangan Seleksi Masuk IPB (USMI) pada
Departemen Kimia, Fakultas Matematika dan Ilmu Pengetahuan Alam, IPB. Tahun 2008,
penulis mengikuti kegiatan Praktik Lapangan di LIPI Cibinong.
DAFTAR ISI
Halaman
DAFTAR TABEL ... vii
DAFTAR GAMBAR ... vii
DAFTAR LAMPIRAN ... viii
PENDAHULUAN ...
1
METODE
Bahan dan Alat ...
2
Lingkup Kerja ...
2
HASIL
Pembentukan Metakaolin ...
3
Penentuan Kapasitas Adsorpsi Metakaolin ...
4
Pemodelan Isoterm Adsorpsi Metakaolin ...
4
Sintesis Nanokomposit Metakaolin-TiO
2dan Karakterisasi XRD ...
5
Penentuan Kapasitas Adsorpsi Nanokomposit Metakaolin-TiO
2...
5
Pemodelan Isoterm Adsorpsi Nanokomposit Metakaolin-TiO
2...
6
Uji Fotokatalis ...
6
PEMBAHASAN
Pembentukan Metakaolin ...
7
Penentuan Kapasitas Adsorpsi dan Isoterm Adsorpsi Metakaolin ...
7
Sintesis Nanokomposit Metakaolin-TiO
2...
8
Penentuan Kapasitas Adsorpsi dan Isoterm Adsorpsi Metakaolin-TiO
2...
8
Uji Fotokatalis ...
8
SIMPULAN DAN SARAN
Simpulan ...
9
Saran ...
9
DAFTAR PUSTAKA ...
9
DAFTAR TABEL
Halaman
1 Kapasitas adsorpsi biru metilena pada metakaolin hasil kalsinasi berbagai
suhu dan lama kalsinasi ...
4
2 Nilai linieritas isoterm adsorpsi ...
5
3 Nilai konstanta isoterm Langmuir pada metakaolin ...
5
4 Hasil uji coba beberapa jenis perbandingan metakaolin dan bahan pengikat
5
DAFTAR GAMBAR
Halaman
1 Struktur biru metilena ...
1
2 Pola XRD dari metakaolin BB hasil kalsinasi
suhu 700 ˚C selama 3(
) dan
6 ( ) jam ...
3
3
Pola XRD dari metakaolin BB hasil kalsinasi suhu 550 ˚C selama 3
(
)
dan 6 ( ) jam ...
3
4
Pola XRD dari metakaolin BB hasil kalsinasi suhu 250 ˚C selama 3
(
) dan
6 ( ) jam ...
4
5 Kurva kapasitas
adsorpsi metakaolin hasil kalsinasi 250 ˚C 3 jam ( ),
250 ˚C 6 jam (
), 550 ˚C 3 jam (
), 550 ˚C 6 jam (
), 700 ˚C 3
jam (
), 700 ˚C 6 jam (
), TiO
2(
), dan bahan pengikat TB3 (
)
terhadap larutan biru metilena ...
4
6 Pola XRD nanokomposit metakaolin-TiO
2(
) dan TiO
2(
) ...
5
7 Kurva kapasitas adsorpsi nanokomposit terhadap larutanbiru metilena ...
6
8 Kurva isoterm Langmuir nanokomposit. ...
6
9 Perubahan warna larutan biru metilena tanpa sinar UV setelah 6 jam.
(a) biru metilena; (b) biru metilena dan TiO
2; (c) biru metilena dan
metakaolin; (d) biru metilena dan nanokomposit (e) biru metilena
dan bahan pengikat TB3. ...
6
10 Perubahan warna larutan biru metilena dengan sinar UV setelah 6 jam.
(a) biru metilena; (b) biru metilena dan TiO
2; (c) biru metilena dan
metakaolin; (d) biru metilena dan nanokomposit (e) biru metilena dan
DAFTAR LAMPIRAN
Halaman
1 Diagram alir penelitian ... 12
2 Penentuan panjang gelombang maksimum larutan biru metilena ... 13
3 Penentuan kapasitas adsorpsi biru metilena oleh metakaolin hasil kalsinasi
250 ˚C selama 3 jam
... 14
4 Penentuan kapasitas adsorpsi biru metilena oleh metakaolin hasil kalsinasi
250 ˚C selama 6 jam
... 15
5 Penentuan kapasitas adsorpsi biru metilena oleh metakaolin hasil kalsinasi
550 ˚C selama 3 jam
... 15
6 Penentuan kapasitas adsorpsi biru metilena oleh metakaolin hasil kalsinasi
550 ˚C selama 6 jam
... 16
7 Penentuan kapasitas adsorpsi biru metilena oleh metakaolin hasil kalsinasi
700
˚C selama 3 jam
... 16
8 Penentuan kapasitas adsorpsi biru metilena oleh metakaolin hasil kalsinasi
700 ˚C selama 6 jam
... 17
9 Penentuan kapasitas adsorpsi bahan pengikat TB3 ... 17
10 Penentuan kapasitas adsorpsi TiO
2... 18
11 Penentuan isotherm Langmuir dan Freundlich untuk adsorpsi biru
metilena oleh metakaolin hasil kalsinasi 250 ˚C selama 3 jam
... 19
12 Penentuan isotherm Langmuir dan Freundlich untuk adsorpsi biru
metilena oleh metakaolin hasil kalsinasi 250 ˚C selama 6 jam
... 20
13 Penentuan isotherm Langmuir dan Freundlich untuk adsorpsi biru
metilena oleh metakaolin hasil kalsinasi 550 ˚C selama 3 jam
... 21
14 Penentuan isotherm Langmuir dan Freundlich untuk adsorpsi biru
metilena oleh metakaolin hasil kalsinasi 550 ˚C sel
ama 6 jam ... 22
15 Penentuan isotherm Langmuir dan Freundlich untuk adsorpsi biru
metilena oleh metakaolin hasil kalsinasi 700 ˚C selama 3 jam
... 23
16 Penentuan isotherm Langmuir dan Freundlich untuk adsorpsi biru
metilena oleh metakaolin hasil kalsinasi
700 ˚C selama 6 jam
... 24
17 Gambar hasil uji coba bahan pengikat ... 25
18 Penentuan kapasitas adsorpsi biru metilena oleh nanokomposit ... 26
19 Penentuan isotherm Langmuir dan Freundlich untuk adsorpsi biru
PENDAHULUAN
Kaolin atau ”kaolinite” dengan rumus
molekul Al2O3.2SiO2.2H2O merupakan salah satu jenis mineral lempung yang banyak terdapat di Indonesia. Kaolin lazim disebut
sebagai “lempung cina” karena pertama kali
ditemukan di daerah Kao-Lin, Cina (Zheng 2005). Bagian permukaan kristal kaolinit mempunyai muatan negatif yang tetap dan tidak bergantung pada pH (permanent charge). Muatan negatif tersebut berasal dari substitusi atom dalam struktur kristal yang tidak memengaruhi struktur kristal tersebut, misalnya dengan adanya atom Al yang bermuatan +3 menggantikan atom Si yang bermuatan +4, kerangka kaolinit kekurangan muatan positif atau kelebihan muatan negatif (Tan 1982).
Mineral lempung kaolin dalam bentuk dehidroksilasi disebut metakaolin. Terhidroksilasi kaolin menjadi metakaolin merupakan proses endotermik yang membutuhkan sejumlah energi yang besar untuk menghilangkan gugus hidroksil yang terikat secara kimia. Pemanasan suhu tinggi pada kaolin membuat struktur kaolin rusak dan membentuk metakaolin yang bersifat amorf berdasarkan analisis sinar-X (Mitra dan Bhattacherjee 1969). Metakaolin ini dapat dimanfaatkan untuk mengatasi pencemaran lingkungan pada perairan khususnya.
Dewasa ini masalah pencemaran lingkungan yang disebabkan oleh zat warna telah cukup memprihatinkan sehingga perlu ditangani dengan serius. Salah satu contoh zat warna yang sering digunakan pada industri tekstil adalah biru metilena. Salah satu metode yang digunakan untuk menghilangkan zat warna adalah teknik adsorpsi dengan menggunakan berbagai jenis adsorben. Teknik adsorpsi dilakukan karena metodenya sederhana dan ekonomis. Mekanisme adsorpsi dapat dibedakan menjadi dua, yaitu adsorpsi secara fisika (fisisorpsi) dan secara kimia (kimisorpsi). Pada proses fisisorpsi, gaya yang mengikat adsorbat oleh adsorben adalah gaya-gaya van der Waals, sedangkan pada proses kimisorpsi terjadi interaksi adsorbat dengan adsorben melalui pembentukan ikatan kimia.
Adsorben yang paling umum digunakan adalah zeolit, montmorilonit, dan karbon aktif. Upaya konvensional tersebut telah banyak dilakukan. Kelemahan cara ini adalah menimbulkan masalah baru dalam mendaur zat warna yang telah teradsorpsi pada adsorben.
Nanokomposit merupakan suatu bahan yang dibuat dari penggabungan antara dua komponen berbeda yang salah satu atau keduanya berskala nanometer (10-9) atau setara dengan ukuran atom dan molekul (Netcomposites 2007). Pada penelitian ini, dibuat nanokomposit dengan menggunakan prinsip metode adsorpsi-fotodegradasi untuk mengatasi masalah dalam mendaur ulang zat warna yang telah teradsorpsi pada adsorben.
Metode adsorpsi-fotodegradasi didasarkan pada proses adsorpsi senyawa organik oleh permukaan padatan yang sekaligus dapat mendegradasi senyawa organik. Metode ini sedang dikembangkan. Dari berbagai hasil penelitian, diketahui bahwa senyawa-senyawa zat warna dapat didegradasi melalui serangkaian proses fotokimia dengan menggunakan sinar UV.
Fotokatalis yang digunakan pada penelitian ini adalah oksida logam TiO2. Serbuk TiO2 memiliki aktivitas fotokatalitik yang tinggi, stabil, dan tidak beracun. Titanium oksida merupakan bahan semikonduktor oksida logam yang sering digunakan sebagai katalis dalam berbagai penanganan limbah polutan organik dan zat pewarna (Wijaya et al. 2005). TiO2 mampu mendegradasi senyawa organik, namun kurang efektif dalam mengolah limbah yang konsentrasinya tinggi. Kemampuan fotokatalisis oksida logam transisi ini dapat mengalami peningkatan apabila memiliki ukuran partikel dalam kisaran nanometer. Penurunan dimensi partikel oksida logam transisi sampai ke daerah nanometer dapat membantu aktivitas dalam proses degradasi dari zat warna.
Zat warna yang digunakan pada penelitian ini adalah biru metilena. Biru metilena merupakan senyawa kimia aromatik heterosiklik. Senyawa ini memiliki rumus molekul C16H18ClN3S dengan bobot molekul 319,86 g/mol. Struktur kation biru metilena ditunjukkan pada Gambar 1. Biru metilena merupakan salah satu zat warna pencemar yang murah, mudah didapat, dan cukup berbahaya.
Gambar 1 Struktur kation biru metilena.
bermuatan positif. Kation yang dihasilkan akan berinteraksi dengan adsorben sehingga terjadi penurunan intensitas warna.
Penelitian ini bertujuan mensintesis metakaolin dari kaolin, mensintesis nanokomposit metakaolin-TiO2 untuk proses adsorpsi-fotodegradasi, menentukan kapasitas adsorpsi, isoterm adsorpsi, dan uji fotokatalisis.
METODE
Bahan dan Alat
Bahan-bahan yang digunakan dalam penelitian ini adalah kaolin yang berasal dari Bangka Belitung, TiO2 Degussa P25, zat warna biru metilena, TB1, TB2, TB3, dan air destilata.
Alat-alat yang digunakan adalah alat-alat gelas, neraca analitik, oven, tanur, cawan porselen, sentrifuga Kokusan H-107, lampu UV, XRD, dan spektrofotometer UV-Vis Shimadzu 1700.
Lingkup Kerja
Penelitian ini terbagi menjadi empat tahapan (Lampiran 1). Tahap pertama adalah pembentukan metakaolin. Tahap kedua sintesis nanokomposit metakaolin-TiO2. Tahap ketiga adalah penentuan kapasitas adsorpsi dan penentuan tipe isoterm adsorpsi. Tahap keempat adalah uji fotokatalisis.
Pembentukan Metakaolin
Kaolin dikalsinasi pada suhu 250, 550, dan
700 ˚C selama 3 dan 6 jam. Setelah itu,
dianalisis menggunakan difraktometer sinar-X (XRD).
Pembuatan larutan stok Biru Metilena
Larutan stok biru metilena 1000 mg/L dibuat dengan cara 1000 mg serbuk zat warna dilarutkan dengan air distilata hingga 1 Liter, kemudian dibuat larutan standar dari larutan biru metilena tersebut dengan konsentrasi 0,5; 1; 1,5; 2; 2,5; dan 3 mg/L.
Penentuan panjang gelombang maksimum
Panjang gelombang maksimum ditentukan dengan mengukur serapan larutan biru metilena 5 mg/L pada panjang gelombang 600-700 nm.
Penentuan kapasitas adsorpsi dan isoterm adsorpsi zat warna
Sebanyak 500 mg metakaolin hasil
kalsinasi 250, 550, dan 700 ˚C selama 3 dan 6
jam dimasukkan ke dalam vial kemudian ditambahkan larutan biru metilena dengan konsentrasi 25, 50, 75, 100, 150, 200, dan 300 mg/L sebanyak 15 mL. Larutan tersebut kemudian digojok selama 2 jam, lalu disentrifugasi selama 10 menit dan konsentrasi supernatan ditentukan dengan spektrofotometer UV-Vis pada panjang gelombang maksimum. Metode yang sama dilakukan juga untuk TiO2, bahan pengikat, dan nanokomposit.
Kapasitas adsorpsi dapat dihitung dengan menggunakan rumus
Keterangan:
Q = kapasitas adsorpsi (mg/g) V = volume larutan (L) Co = konsentrasi awal (mg/L) C = konsentrasi akhir (mg/L) m = massa (g)
Pola isoterm adsorpsi diperoleh dengan membuat persamaan regresi linier menggunakan persamaan Langmuir dan Freundlich untuk menentukan tipe isoterm yang sesuai.
Sintesis Nanokomposit Metakaolin-TiO2 Nanokomposit metakaolin-TiO2 dibuat dengan mencampurkan metakaolin-bahan pengikat-TiO2 dengan metakaolin sebagai komposisi terbesar dan TiO2 sebagai komposisi terkecil. Sebelum nanokomposit dibuat, dilakukan uji coba 3 jenis bahan pengikat, yaitu TB1, TB2, dan TB3 dengan perbandingan metakaolin-bahan pengikat 9:1, 8:2, dan 7:3. Kemudian campuran metakaolin-bahan pengikat-TiO2 dibuat pasta dengan cara menambahkan air distilata. Pasta diaduk hingga homogen kemudian dikeringkan pada
suhu 100 ˚C dan dibiarkan pada suhu kamar
selama 24 jam. Hasil nanokomposit yang diperoleh dan serbuk TiO2 dianalisis menggunakan XRD.
Uji Fotokatalisis
selama 6 jam. Larutan diambil dan diukur serapannya dengan spektrofotometer UV-Vis pada panjang gelombang 700 sampai dengan 200 nm. Sebagai pembanding juga dilakukan untuk 15 ml biru metilena, larutan biru metilena dan TiO2, larutan biru metilena dan bahan pengikat, serta larutan biru metilena dan metakaolin. Sebagai kontrol dilakukan juga perlakuan tersebut dan disimpan dalam ruang gelap (tanpa sinar UV).
HASIL
Pembentukan Metakaolin
Serbuk kaolin yang berasal dari Bangka Belitung (BB) dikalsinasi dengan beberapa variasi suhu dan waktu, yaitu 250, 550, dan
700 ˚C selama 3 dan 6 jam. Kemudian dilakukan pencirian menggunakan XRD untuk melihat puncak-puncak khas yang muncul
pada 2θ. Gambar 2, 3, dan 4 memperlihatkan
pola difraksi sampel kaolin yang dikalsinasi
dengan suhu 250, 550, 700 ˚C selama 3 dan 6 jam.
Kaolin yang dikalsinasi 250 ˚C selama 3
dan 6 jam masih menunjukkan puncak khas
kaolin pada 2θ = 12,36 dan 24,88, sedangkan kaolin yang dikalsinasi pada 550 dan 700 ˚C
selama 3 dan 6 jam sudah berbentuk amorf. Perubahan ini ditandai dengan hilangnya puncak-puncak khas kaolin. Hal ini menunjukkan metakaolin hasil kalsinasi 550
dan 700 ˚C selama 3 dan 6 jam sudah
terbentuk.
Gambar 2 Pola XRD dari metakaolin BB hasil kalsinasi suhu 700 ˚C selama 3( ) dan 6 ( ) jam.
Gambar 3 Pola XRD dari metakaolin BB hasil kalsinasi suhu 550 ˚C selama 3 ( ) dan 6 ( ) jam.
Inte
ns
it
a
s
Inte
ns
it
a
s
2 θ
Gambar 4 Pola XRD dari metakaolin BB hasil kalsinasi suhu 250 ˚C selama 3( ) dan 6 ( ) jam.
Penentuan Kapasitas Adsorpsi Metakaolin
Panjang gelombang maksimum biru metilena adalah 664 nm (Lampiran 2). Penentuan kapasitas adsorpsi larutan biru metilena yang terjerap pada metakaolin dilakukan menggunakan tujuh konsentrasi yang berbeda. Semakin tinggi konsentrasi, kapasitas adsorpsinya semakin tinggi (Lampiran 3-8). Nilai kapasitas adsorpsi metakaolin hasil kalsinasi 250, 550, dan 700
˚C selama 3 dan 6 jam ditunjukkan pada Tabel 1. Kurva yang menunjukkan kapasitas adsorpsi metakaolin, TiO2, dan bahan pengikat TB3 terdapat pada Gambar 5. Nilai kapasitas adsorpsi bahan pengikat TB3 dan TiO2 pada Lampiran 9 dan 10.
Tabel 1 Kapasitas adsorpsi biru metilena pada metakaolin hasil kalsinasi berbagai suhu dan lama kalsinasi
Sampel Kapasitas adsorpsi (mg/g)
250˚C 3 jam 15,1949
250˚C 6 jam 14,9446
550˚C 3 jam 14,7637
550˚C 6 jam 12,2890
700˚C 3 jam 12,1521
700˚C 6 jam 9,1411
Gambar 5 Kurva kapasitas adsorpsi metakaolin hasil kalsinasi 250 ˚C 3 jam ( ), 250 ˚C 6 jam ( ), 550 ˚C 3 jam ( ), 550 ˚C 6 jam ( ), 700 ˚C 3 jam ( ), 700 ˚C 6 jam ( ), TiO2 ( ), dan bahan pengikat TB3 ( ) terhadap larutan biru metilena.
Pemodelan Isoterm Adsorpsi Metakaolin
Hasil pengukuran kapasitas adsorpsi digunakan untuk menentukan tipe isoterm adsorpsi dari metakaolin. Berdasarkan nilai linieritas, tipe isoterm adsorpsi metakaolin
Tabel 2 Nilai linieritas isoterm adsorpsi
Sampel Langmuir Freundlich
250 ˚C 3 jam 0,9942 0,9855
250 ˚C 6 jam 0,9977 0,9716
550 ˚C 3 jam 0,9972 0,9439
550 ˚C 6 jam 0,9955 0,9640
700 ˚C 3 jam 0,9992 0,8511
700 ˚C 6 jam 0,9888 0,8764
Tabel 3 Nilai konstanta isoterm Langmuir pada metakaolin
Sampel Xm (mg/g) k (g/L)
250 ˚C 3 jam 15, 1515 0,1466
250 ˚C 6 jam 15,1057 0,1679
550 ˚C 3 jam 15,6006 0,0811
550 ˚C 6 jam 12,9366 0,0571
700 ˚C 3 jam 12,5945 0,0973
700 ˚C 6 jam 9,8912 0,0477
Sintesis Nanokomposit Metakaolin-TiO2
dan Karakterisasi XRD
Nanokomposit metakaolin-TiO2 dibuat dengan mencampurkan metakaolin dan TiO2 secara fisik, tetapi pencampuran secara fisik tersebut tidak membuat nanokomposit terbentuk sehingga ditambahkan bahan pengikat agar kedua komponen tersebut saling mengikat. Bahan pengikat yang diujicobakan ada tiga jenis, yaitu TB1, TB2, dan TB3. Hasil penelitian menunjukkan bahan pengikat yang dapat mengikat metakaolin dengan TiO2 adalah TB3. Metakaolin yang dapat dibentuk nanokomposit dengan baik adalah metakaolin
hasil kalsinasi 550 ˚C selama 3 jam. Data hasil uji coba bahan pengikat ditunjukkan pada Tabel 4 dan Lampiran 17.
Tabel 4 Hasil uji coba beberapa jenis perbandingan metakaolin dan bahan pengikat
Jenis bahan pengikat
Perbandingan metakaolin dan bahan pengikat
Hasil
TB 1 9:1 Hancur
8:2 Hancur
7:3 Hancur
TB 2 9:1 Hancur
8:2 Hancur
7:3 Hancur
TB 3 9:1 Hancur
8:2 Sedikit Hancur 7:3 Tidak hancur
Pola difraksi nanokomposit metakaolin-TiO2 dan TiO2 ditunjukkan pada Gambar 6.
Gambar 6 Pola XRD nanokomposit metakaolin-TiO2 ( ) dan TiO2 ( ).
Kapasitas Adsorpsi Nanokomposit Metakaolin-TiO2
Kapasitas adsorpsi nanokomposit lebih rendah daripada metakaolin, yaitu 13,2631 mg/g (Lampiran 18).
Gambar 7 Kurva kapasitas adsorpsi nanokomposit terhadap larutan biru metilena.
Pemodelan Isoterm Adsorpsi
Nanokomposit Metakaolin-TiO2
Isoterm nanokomposit mengikuti tipe isoterm Langmuir (Gambar 8). Nilai R2
isoterm Langmuir lebih besar dari isoterm Freundlich. Nilai R2 dari isoterm Langmuir dan Freundlich berturut-turut 0,9982 dan 0,9353. Perhitungan isoterm Langmuir nanokomposit ditunjukkan pada Lampiran 19. Nilai Xm dan k untuk nanokomposit, yaitu 13,1643 mg/g dan 0,0706 g/L.
Gambar 8 Kurva isoterm Langmuir nanokomposit.
Uji Fotokatalis
Hasil reaksi fotokatalisis tanpa radiasi sinar UV secara visual dapat dilihat pada Gambar 9.
Gambar 9 Perubahan warna larutan biru metilena tanpa sinar UV setelah 6 jam. (a) biru metilena; (b) biru metilena dan TiO2; (c) biru metilena dan metakaolin; (d) biru metilena dan nanokomposit (e) biru metilena dan bahan pengikat TB3.
Hasil reaksi fotokatalisis dengan radiasi sinar UV selama 6 jam secara visual dapat dilihat pada Gambar 10.
Gambar 10 Perubahan warna larutan biru metilena dengan sinar UV setelah 6 jam. (a) biru metilena; (b) biru metilena dan TiO2; (c) biru metilena dan metakaolin; (d) biru metilena dan nanokomposit (e) biru metilena dan bahan pengikat TB3.
Larutan biru metilena dengan metakaolin dan biru metilena dengan nanokomposit tidak memperlihatkan perubahan warna yang jelas antara tanpa dan dengan sinar UV. Selain itu, hasil pemayaran menggunakan spektrofotometer UV-Vis pada Lampiran 20 terlihat hilangnya puncak biru metilena. Bukti biru metilena terdegradasi dapat dilihat dari endapan (Lampiran 21). Warna endapan yang masih biru pada perlakuan tanpa sinar UV menunjukkan bahwa nanokomposit tersebut hanya memiliki kemampuan menjerap saja dan fotokatalis TiO2 tidak bekerja. Sedangkan
A
B
C
D
A
B
C
D
E
pada perlakuan dengan sinar UV, endapan nanokomposit berubah menjadi biru pudar/putih. Hal ini menunjukkan terjadi proses fotokatalisis.
PEMBAHASAN
Pembentukan Metakaolin
[image:30.595.113.299.421.577.2]Bahan baku pembuatan metakaolin adalah kaolin. Kaolin yang digunakan pada penelitian ini berasal dari Bangka Belitung yang berwarna putih. Kaolin dapat berwarna putih, merah muda, atau abu-abu bergantung pada komposisinya (Bougeard et al. 2000). Kaolinit merupakan lapisan aluminosilikat dengan lapisan struktur dioktahedral tak bermuatan 1:1 (Gambar 11). Pengertian lapisan 1:1 adalah untuk setiap satuan mineral terdiri atas satu lapisan oksida-Si (lapisan silikat) dan satu lapisan hidroksioksida-Al (lapisan aluminat). Satuan-satuan ini berikatan kuat sesamanya dengan ikatan hidrogen dan van der Waals (Muhdarina & Linggawati 2003). Metakaolin dibuat dengan mengkalsinasi kaolin menggunakan suhu tinggi sehingga ikatan hidrogen yang ada pada antar lapisan kaolin tersebut putus dan membentuk metakaolin yang amorf.
Gambar 11 Struktur Kaolinit
Metakaolin merupakan bentuk dehidroksilasi dari kaolin. Pola XRD pada Gambar 4 menunjukkan puncak-puncak khas dari kaolin masih terlihat. Pada kalsinasi
dengan suhu 250 ˚C selama 3 dan 6 jam hanya
menghilangkan air yang terjerap pada pori dan permukaan kaolin (Ilić et al. 2010). Setelah
dikalsinasi dengan suhu 550 dan 700 ˚C
selama 3 dan 6 jam, puncak khas kaolin hilang karena kalsinasi suhu tinggi menghilangkan gugus hidroksil yang terikat secara kimia. Hal ini sesuai dengan penelitian Mitra dan
Bhattacherjee (1969), bahwa pemanasan suhu tinggi pada kaolin membuat struktur dari kaolin itu sendiri rusak dan membentuk metakaolin yang bersifat amorf. Adapun masih ada puncak yang terlihat (Gambar 2 dan 3) pada metakaolin hasil kalsinasi 550 dan
700 ˚C adalah puncak-puncak dari mineral lain karena kaolin Indonesia tidak murni.
Penentuan Kapasitas Adsorpsi dan Isoterm Adsorpsi Metakaolin
Konsentrasi awal adsorbat merupakan salah satu faktor yang menentukan besarnya kapasitas adsorpsi dari metakaolin. Nilai kapasitas adsorpsi yang besar menunjukkan bahwa adsorben tersebut optimal dalam mengikat adsorbat. Berdasarkan hasil penelitian, meningkatnya suhu dan lama kalsinasi membuat kapasitas adsorpsi menurun. Penurunan ini disebabkan oleh rusaknya struktur sehingga permukaan dari metakaolin tidak dapat menjerap zat warna secara maksimal. Sesuai dengan penelitian Ghosh dan Bhattacharyya (2002), kapasitas adsorpsi metakaolin lebih kecil daripada kaolin.
Isoterm adsorpsi menunjukkan hubungan kesetimbangan antara konsentrasi adsorbat dalam fluida dan pada permukaan adsorben, pada suhu tetap. Tipe isoterm adsorpsi dapat digunakan untuk mengetahui mekanisme penjerapan biru metilena dengan adsorben metakaolin. Isoterm adsorpsi Langmuir dilakukan dengan cara membuat kurva hubungan c/(x/m) terhadap c, sedangkan isoterm adsorpsi Freundlich dilakukan dengan membuat kurva hubungan log x/m terhadap log c (Atkins 1999). Hasil penelitian menunjukkan tipe isoterm pada metakaolin BB mengikuti tipe isoterm Langmuir karena linieritas isoterm Langmuir lebih besar daripada isoterm Freundlich. Mekanisme adsorpsi biru metilena berlangsung secara kimisorpsi pada adsorben tersebut. Adsorpsi terjadi akibat adanya interaksi kimia antara padatan adsorben dengan material yang terjerap.
Bentuk dari persamaan Langmuir adalah sebagai berikut.
c
Xm
k
Xm
m
x
c
1
.
1
/
Nilai Xm menggambarkan jumlah yang dijerap atau kapasitas adsorpsi untuk membentuk lapisan sempurna pada
Lapisan tetrahedral
Ikatan hidrogen
Lapisan oktahedral
OH
[image:30.595.375.473.676.710.2]permukaan adsorben. Nilai k merupakan konstanta yang bertambah dengan kenaikan ukuran molekuler yang menunjukkan kekuatan ikatan molekul adsorbat pada permukaan adsorben. Hasil penelitian menunjukkan dengan kalsinasi suhu tinggi akan menurunkan nilai Xm dan k. Hal ini disebabkan oleh struktur metakaolin yang amorf. Selain itu, ada penyimpangan pada
metakaolin hasil kalsinasi 250 ˚C selama 3
dan 6 jam yaitu terjadi kenaikan nilai k. Hal ini dikarenakan pada kalsinasi suhu tersebut merupakan bentuk transisi dari kaolin menjadi metakaolin, jadi energi pengikatan antara adsorbat dan adsorben masih kuat dibandingkan metakaolin yang sudah amorf.
Sintesis Nanokomposit Metakaolin-TiO2 Nanokomposit metakaolin-TiO2 dibuat dengan mencampurkan metakaolin, bahan pengikat TB3, dan TiO2 dengan perbandingan (6:3:1). Metakaolin yang digunakan adalah
hasil kalsinasi 550 ˚C selama 3 jam karena
pada uji coba bahan pengikat, metakaolin tersebut yang dapat mengikat dengan TiO2. Hal ini disebabkan oleh struktur dari metakaolin yang belum rusak seluruhnya dibanding dengan metakaolin hasil kalsinasi
700 ˚C. TiO2 yang dicampurkan dalam jumlah kecil, karena TiO2 ini bertindak sebagai katalis yang dalam jumlah kecil sudah dapat bekerja. Selain itu, TiO2 juga memiliki kapasitas adsorpsi yang kecil yaitu 3,2838 mg/g. Sama halnya dengan bahan pengikat TB3, bahan pengikat ini mempunyai kapasitas adsorpsi yang kecil yaitu 9,7135 mg/g.
Campuran ketiga komponen pembentuk nanokomposit dibuat pasta kemudian
dipanaskan dengan suhu 100 ˚C untuk
menghilangkan molekul air dan didiamkan dalam suhu kamar selama 24 jam. Setelah itu, nanokomposit yang telah dibuat diuji dengan cara melarutkan nanokomposit tersebut ke dalam air. Berdasarkan hasil penelitian, nanokomposit yang telah dibuat tidak hancur ketika dilarutkan dalam air. Hal ini menunjukkan bahwa bahan pengikat TB3 sebanyak 30% cukup efektif mengikat TiO2 sehingga TiO2 tidak saling lepas dari metakaolin.
Berdasarkan pola difraksi nanokomposit metakaolin-TiO2 terlihat puncak khas
2θ=25,28. Puncak ini adalah puncak TiO2 sehingga pada nanokomposit tersebut TiO2 terikat.
Penentuan Kapasitas Adsorpsi dan Isoterm Adsorpsi Metakaolin-TiO2
Kapasitas adsorpsi nanokomposit diukur untuk melihat perubahan kapasitas adsorpsi ketika dibentuk nanokomposit. Hasil penelitian menunjukkan kapasitas adsorpsi nanokomposit lebih kecil dibanding metakaolinnya. Kapasitas adsorpsi metakaolin sebesar 14,7637 mg/g, sedangkan kapasitas adsorpsi nanokomposit adalah 13,2631 mg/g. Penurunan ini dikarenakan faktor penambahan bahan pengikat dan TiO2 yang memiliki kemampuan menjerap lebih kecil dibanding metakaolin. Penambahan bahan-bahan tersebut mengurangi jumlah metakaolin sehingga sisi aktif dari tiap gram metakaolin berkurang.
Tipe isoterm adsorpsi nanokomposit adalah isoterm Langmuir sama seperti metakaolin. Pengubahan bentuk menjadi nanokomposit tidak mengubah isoterm adsorpsi. Tipe adsorpsinya secara kimia. Nilai konstanta Xm dan k nanokomposit ditunjukkan pada Tabel 5. Nilai Xm dan k nanokomposit lebih kecil dibanding nilai metakaolin. Hal ini menunjukkan kapasitas adsorpsi dan kekuatan ikatan biru metilena dengan permukaan adsorben yang rendah.
Uji Fotokatalis
Pengujian fotodegradasi nanokomposit metakaolin-TiO2 dilakukan untuk melihat kemampuan nanokomposit dalam menjerap sekaligus mendegradasi zat warna dengan bantuan radiasi sinar UV. Nanokomposit metakaolin-TiO2 hasil sintesis digunakan untuk uji fotodegradasi zat warna biru metilena. Reaksi yang terjadi pada degradasi biru metilena adalah reaksi redoks dimana terjadi pelepasan dan penangkapan elektron yang diakibatkan oleh energi foton hv (Sumerta et al. 2002). Proses fotodegradasi menggunakan sinar UV. Sinar UV berperan sebagai sumber foton. Berikut adalah proses fotodegradasi zat warna :
TiO2+ hv →TiO2 (e- + h+)
TiO2 (h+) +H2O → TiO2 + HO* + H+ TiO2 (e-) + O2→ TiO2 + O2
-Zat warna + hv → -Zat warna*
Zat warna* + O2-→ produk degradasi