PENAPISAN BAKTERI FILOSFER PENGHASIL SENYAWA BIOAKTIF
ANTI XANTHOMONAS ORYZAE PV. ORYZAE PENYEBAB PENYAKIT
HAWAR DAUN BAKTERI PADA PADI
RINA NURFITRIANI
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa skripsi berjudul Penapisan Bakteri Filosfer Penghasil Senyawa Bioaktif Anti Xanthomonas oryzae pv. oryzae Penyebab Penyakit Hawar Daun Bakteri pada Padi adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, September 2014
ABSTRAK
RINA NURFITRIANI. Penapisan Bakteri Filosfer Penghasil Senyawa Bioaktif Anti Xanthomonas oryzae pv. oryzae Penyebab Penyakit Hawar Daun Bakteri pada Padi. Dibimbing oleh ARIS TRI WAHYUDI dan ALINA AKHDIYA.
Penyakit hawar daun bakteri (HDB) yang disebabkan oleh Xanthomonas oryzae pv. oryzae (Xoo) merupakan salah satu penyakit penting dalam pertanaman padi. Penyakit ini sulit dikendalikan karena menyerang tanaman padi pada berbagai stadia pertumbuhan mulai fase anakan, berbunga dan pemasakan. Salah satu alternatif yang dapat digunakan untuk mengendalikan penyebaran penyakit HDB yaitu menggunakan agen biokontrol yang diantaranya dapat diperoleh dari filosfer. Penelitian ini bertujuan mengisolasi, menapis dan mengkarakterisasi bakteri filosfer padi penghasil senyawa bioaktif anti Xoo penyebab penyakit HDB pada padi. Hasil isolasi bakteri filosfer dari daun padi varietas Ciherang umur 2,5 bulan yang sehat menggunakan 4 media yang berbeda diperoleh 285 isolat bakteri, yaitu 65 isolat dari media King’s B agar, 86 isolat dari media nutrient agar, 81 isolat dari media Luria-Bertani agar, dan 53 isolat dari media trypticase soy agar. Uji antagonis menggunakan metode double layer menunjukkan 58 isolat bakteri filosfer mempunyai potensi sebagai agen biokontrol penghasil senyawa bioaktif anti Xoo. Uji patogenisitas terhadap padi menghasilkan 18 isolat yang tidak berpotensi patogenik terhadap tanaman padi. Diantara 18 isolat non-fitopatogenik tersebut, 14 isolat termasuk bakteri Gram positif, 4 isolat bakteri Gram negatif, dan 5 isolat diduga Bacillus. Tiga dari 18 isolat tersebut (BFSGb 8, BFSGb 55, dan BFSGb 99) memiliki nilai Indeks Penghambatan in-vitro terbesar terhadap Xoo yaitu 1.33, 1.67, dan 1.33 berturut-turut untuk isolat BFSGb 8, BFSGb 55, dan BFSGb 99.
ABSTRACT
RINA NURFITRIANI. Screening of Bioactive Compounds Producing by Phyllosphere Bacteria Against Xanthomonas oryzae pv. oryzae Causes Bacterial Leaf Blight in Rice. Supervised by ARIS TRI WAHYUDI and ALINA AKHIYA.
Bacterial leaf blight (BLB) caused by Xanthomonas oryzae pv. oryzae (Xoo) is one of the important diseases in rice crops. The disease is difficult to control because it attacks the rice plant at different growth stages ranging tillering, flowering and ripening. One alternative that can be used to control the spread of BLB is using the biocontrol agent which can be obtained from phyllosphere. This study aims to isolate, characterize and screen the rice phyllosphere bacteria producing bioactive compounds anti Xoo causes BLB in rice. Phyllosphere bacteria isolated from rice leaves Ciherang healthy age of 2.5 months using 4 different media obtained 285 bacterial isolates, the 65 isolates of King’s B agar, 86 isolates of nutrient agar, 81 isolates of Luria-Bertani agar, and 53 isolates of trypticase soy agar. Antagonist test using double layer method showed 58 isolates phyllosphere bacteria potential as a biocontrol agent producing bioactive compounds Xoo. Pathogenicity test showed 18 isolates not potentially pathogenic to rice plants. Among the 18 non-phytopathogenic isolates, 14 isolates including Gram-positive bacteria, 4 isolates Gram-negative bacteria, and 5 isolates of Bacillus suspected. Three of the 18 isolates (BFSGb 8, BFSGb 55, and BFSGb 99) has the largest index value inhibition of in-vitro against Xoo is 1.33, 1.67, and 1.33 respectively to isolate BFSGb 8, BFSGb 55, and BFSGb 99.
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains pada
Departemen Biologi
PENAPISAN BAKTERI FILOSFER PENGHASIL SENYAWA BIOAKTIF
ANTI XANTHOMONAS ORYZAE PV. ORYZAE PENYEBAB PENYAKIT
HAWAR DAUN BAKTERI PADA PADI
RINA NURFITRIANI
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga skripsi ini berhasil diselesaikan. Judul yang dipilih dalam penelitian yang dilaksanakan sejak bulan Januari 2014 sampai bulan Juli 2014 ini ialah Penapisan Bakteri Filosfer Penghasil Senyawa Bioaktif Anti Xanthomonas oryzae pv. oryzae Penyebab Penyakit Hawar Daun Bakteri pada Padi.
Terima kasih penulis ucapkan kepada Prof Dr Aris Tri Wahyudi, MSi dan Dr Alina Akhdiya, Msi selaku pembimbing. Terima kasih penulis sampaikan kepada Prof Dr Alex Hartana selaku penguji atas saran, koreksi, dan masukan yang diberikan. Sebagian penelitian ini didanai oleh proyek penelitian Hibah Kompetensi DIKTI 2014, atas nama Prof Dr Aris Tri Wahyudi, Msi dengan nomor kontrak MAK: 2013. 109. 521. 213, untuk itu penulis mengucapkan terima kasih. Selain itu, ucapan terima kasih juga disampaikan kepada semua pihak yang telah banyak membantu dalam penelitian ini (Pak Saan, Mbak Gege, Kak Cessa, Kak Ica, Kak Wulan, Bu Heni, dan Pak Jaka). Ungkapan terima kasih juga disampaikan kepada ayah, ibu, dan seluruh keluarga, atas segala doa dan kasih sayangnya, serta teman-teman atas dukungan dan bantuannya.
Semoga karya ilmiah ini bermanfaat.
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR GAMBAR vi
DAFTAR LAMPIRAN vi
PENDAHULUAN 1
Latar Belakang 1
Tujuan Penelitian 2
METODE 2
Waktu dan Tempat Penelitian 2
Metode Penelitian 2
Pengambilan sampel daun padi 2
Isolasi bakteri filosfer 2
Uji antagonis bakteri filosfer terhadap Xanthomonas oryzae pv. oryzae 2
Uji hipersensitivitas pada tanaman tembakau 3
Uji patogenisitas pada tanaman padi 3
Pewarnaan Gram dan pewarnaan endospora 3
HASIL 3
Isolasi bakteri filosfer 3
Uji antagonis bakteri filosfer terhadap Xanthomonas oryzae pv. oryzae 4
Uji hipersensitivitas pada tanaman tembakau 7
Uji patogenisitas pada tanaman padi 9
Pewarnaan Gram dan pewarnaan endospora 11
PEMBAHASAN 13
SIMPULAN 16
DAFTAR PUSTAKA 16
LAMPIRAN 19
DAFTAR TABEL
1. Hasil perhitungan cawan total koloni bakteri filosfer padi yang tumbuh pada media isolasi 2. Daftar isolat bakteri filosfer padi yang mampu menghambat
pertumbuhan Xoo dan nilai indeks penghambatannya 3. Hasil uji hipersensitif respon yang ditimbulkan oleh 58 isolat terpilih
pada tanaman tembakau 4. Hasil uji patogenisitas pada tanaman padi 10 5. Reaksi Gram dan keberadaan endospora pada 18 isolat bakteri filosfer
terpilih penghasil senyawa bioaktif anti Xoo yang non-patogenik pada
tanaman padi
DAFTAR GAMBAR
1. Persentase jumlah bakteri yang berhasil diisolasi dari filosfer padi
menggunakan media agar NA, LA, KBA, TSA 2. Koloni – koloni bakteri filosfer padi yang tumbuh pada media KBA (A),
NA (B), LA (C), dan TSA (D)
3. Perbandingan jumlah isolat bakteri filosfer yang diperoleh dengan jumlah isolat bakteri filosfer yang menghasilkan senyawa bioaktif anti Xoo
4. Zona hambat isolat bakteri BFSGb 8 (A), BFSGb 55 (B), dan BFSGb 99 (C) terhadap Xoo
5. Hasil uji hipersensitif respon pada daun tembakau dengan akuades steril (A), E. coli DH5α (B), Xoo STG 21 (C), bakteri hasil isolasi BFSGb 22
7. Hasil pewarnaan Gram isolat BFSGb 8 (A), BFSGb 55 (B), dan BFSGb 99 (C) pada perbesaran 1000x 8. Foto mikograf hasil pewarnaan spora isolat BFSGb 8 (A), dan BFSGb
238 (B). Anak panah berwarna putih menunjukkan sel vegetatif dan
anak panah berwarna hitam menunjukkan endospora 9. Morfologi koloni isolat bakteri filosfer BFSG 8 (A), BFSGb 55 (B), dan
BFSGb 99 (C) umur 48 jam pada media LA
DAFTAR LAMPIRAN
1. Komposisi media yang digunakan untuk isolasi bakteri filosfer 2. Karakteristik morfologi koloni bakteri hasil isolasi yang berpotensi
PENDAHULUAN
Latar Belakang
Padi merupakan salah satu tanaman pangan utama di dunia yang menjadi makanan pokok bagi sekitar 50% populasi di dunia (Zeigler dan Barclay 2008). Padi juga merupakan komoditas pangan yang sangat penting di Indonesia karena lebih dari 50% populasi penduduk Indonesia mengkonsumsi padi sebagai makanan pokok. Sebagaimana umumnya negara berkembang, Indonesia menghadapi masalah pertumbuhan jumlah penduduk yang tinggi dan penyediaan bahan pangan pokok.
Upaya peningkatan produksi padi nasional telah dilakukan pemerintah melalui program intensifikasi dan ekstensifikasi, namun berbagai kendala seperti masalah penyakit hawar daun bakteri (HDB) menjadi menghambat upaya tersebut (Hanarida et al. 2007). HDB merupakan penyakit padi paling serius yang disebabkan oleh bakteri Xanthomonas oryzae pv. oryzae (Xoo). Di daerah tropis, penyakit HDB menyerang tanaman padi di berbagai wilayah penghasil padi (Ou 1985) pada musim hujan maupun kemarau (Dinh 2008). Serangan HDB di wilayah tropis seperti Indonesia menimbulkan kerusakan yang lebih besar dibandingkan wilayah sub tropis. Tingkat kehilangan hasil akibat serangan HDB di Indonesia mencapai 21-36% pada musim hujan dan 18-28% pada musim kemarau (Suparyono dan Sudir 1992).
Xoo menginfeksi jaringan daun padi melalui hidatoda pada bagian atas dan pinggir daun (Ou 1985). Infeksi bakteri patogen ini menyebabkan timbulnya garis basah pada tepian daun yang dekat dengan ujung daun. Garis tersebut akan meluas dan berubah menjadi kekuning-kuningan kemudian dengan cepat menjadi putih keabu-abuan. Gejala HDB umum dijumpai pada stadium anakan, berbunga, dan pemasakan. Penyakit ini akan menurunkan kemampuan tanaman untuk melakukan proses fotosintesis karena daun mengalami kerusakan klorofil. Bila serangan HDB terjadi pada awal pertanaman, tanaman menjadi layu dan mati, gejala ini disebut kresek. Bila serangan terjadi pada saat berbunga, proses pengisian gabah menjadi terganggu sehingga menyebabkan gabah tidak terisi penuh atau bahkan hampa sehingga dapat menyebabkan kehilangan hasil mencapai 70% (Mew et al. 1982). HDB sulit dikendalikan karena bakteri penyebabnya memiliki banyak patotipe dan dapat menyerang tanaman padi pada berbagai stadia tumbuh (Suparyono et al. 2004).
Bakterisida kimia secara rutin umumnya digunakan untuk mengendalikan penyakit ini di Indonesia. Namun, ketergantungan yang berlebihan pada bakterisida kimia sering menyebabkan pencemaran lingkungan dan meningkatkan resistensi. Selain itu, residu bakterisida pada bulir padi dapat menyebabkan masalah kesehatan pada konsumen. Oleh karena itu, penggunaan agen biokontrol berbasis mikroba dapat digunakan sebagai alternatif pengganti atau suplemen untuk bakterisida kimia (Hastuti 2012).
penghasilnya menjadi agen biokontrol untuk penggunaan komersial (Dowling dan O'Gara 1994). Salah satu sumber agen biokontrol penghasil senyawa bioaktif yang dapat menghambat aktivitas Xoo adalah area filosfer (permukaan daun).
Tujuan Penelitian
Penelitian ini bertujuan mengisolasi, menapis dan mengkarakterisasi bakteri filosfer padi penghasil senyawa bioaktif anti Xanthomonas oryzae pv. oryzae penyebab penyakit hawar daun bakteri pada padi.
METODE
Waktu dan Tempat Penelitian
Penelitian dilakukan pada bulan Januari 2014 sampai bulan Juli 2014 di Laboratorium Penelitian Mikrobiologi dan rumah kaca Departemen Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Metode Penelitian
Pengambilan sampel daun padi
Pengambilan sampel daun padi dilakukan dengan metode survei. Pengambilan sampel dilakukan di daerah persawahan Situgede, Kecamatan Bogor Barat, Kota Bogor. Sampel padi yang diambil merupakan rumpun padi sehat (tidak terkena penyakit HDB) varietas Ciherang berumur 2.5 bulan, yang berasal dari petak padi yang terkena penyakit HDB.
Isolasi bakteri filosfer
Sampel daun padi dipotong sepanjang satu sentimeter dan direndam dalam larutan fisiologis 0,85% selama ± 30 menit. Kemudian daun di-vorteks sehingga didapatkan suspensi. Suspensi bakteri diencerkan hingga 10-6 sel/mL dan disebar pada media padat. Sebanyak 100 µl suspensi bakteri disebar dengan mengunakan metode cawan sebar pada media King’s B agar (KBA), nutrient agar (NA), Luria-Bertani agar (LA), dan trypticase soy agar (TSA) (Lampiran 1), kemudian diinkubasi pada suhu ruang selama 24 jam. Koloni-koloni yang tampak berbeda dipilih untuk dimurnikan dengan metode gores kuadran pada medium yang sama. Isolat yang telah murni diremajakan pada media agar miring dan disimpan dalam lemari pendingin.
Uji antagonisme bakteri filosfer terhadap Xanthomonas oryzae pv. oryzae
(diameter 0,6 cm), kemudian dikering anginkan dan diletakkan di permukaan cawan agar yang telah disebari inokulum Xoo tersebut.Biakan diinkubasi selama 24 jam kemudian diamati zona hambat di sekeliling cakram. Indeks Penghambatan (IP) dihitung dengan menggunaan persamaan sebagai berikut:
IP = diameter zona bening (cm) – diameter koloni bakteri/diameter cakram (cm) diameter koloni bakteri/diameter cakram (cm)
Uji hipersensitivitas pada tanaman tembakau
Uji hipersensitivitas isolat bakteri terhadap tanaman tembakau dilakukan menurut Zou et al. (2006). Kultur cair isolat bakteri filosfer dengan kerapatan ±107 sel/mL dalam kultur cair disuntikkan ke daun tanaman tembakau menggunakan syringe 1 mL (tanpa jarum). Sebagai kontrol positif digunakan Xoo STG 21, sedangkan untuk kontrol negatif digunakan Escherichia coli DH5α dan akuades steril. Pengamatan gejala penyakit dilakukan hingga 48 jam setelah penyuntikan.
Uji patogenisitas pada tanaman padi
Benih padi IR64 yang telah disterilisasi permukaannya dengan Natrium-hipoklorit 2% ditumbuhkan dalam keadaan steril di dalam growth chamber hingga berusia dua minggu. Ujung daun padi selanjutnya dgunting dan dicelupkan ke dalam suspensi bakteri (kerapatan ±107 sel/mL) selama ±10 detik. Pengamatan gejala penyakit dilakukan pada 3 dan 14 hari setelah inokulasi. Uji patogenisitas dinyatakan positif jika bakteri yang diinokulasikan menyebabkan penyakit pada daun padi dan dinyatakan negatif jika bakteri yang diinokulasikan tidak menyebabkan penyakit pada daun padi. Sebagai kontrol positif digunakan kultur Xoo STG 21, sedangkan untuk kontrol negatif digunakan kultur Escherichia coli
DH5α dan akuades steril.
Pewarnaan Gram dan pewarnaan endospora.
Karakterisasi terbatas isolat-isolat bakteri dilakukan pada 18 isolat bakteri yang tidak patogenik terhadap padi yang dilakukan dengan teknik pewarnaan Gram (Gram 1884). Isolat yang termasuk bakteri gram positif dan berbentuk batang selanjutnya diamati keberadaan struktur endosporanya menggunakan metode pewarnaan spora (Lay 1994).
HASIL
Isolasi bakteri filosfer
Isolasi yang dilakukan pada empat media yang berbeda menunjukkan jumlah koloni yang relatif tinggi berdasarkan metode hitungan cawan total (total plate count) pada masing-masing media (Tabel 1).
Tabel 1 Hasil perhitungan cawan total koloni bakteri filosfer padi yang tumbuh pada media isolasi
Media isolasi Jumlah koloni bakteri
KBA 205 X 104
NA 140 X 107
LA 245 X 107
TSA 279 X 106
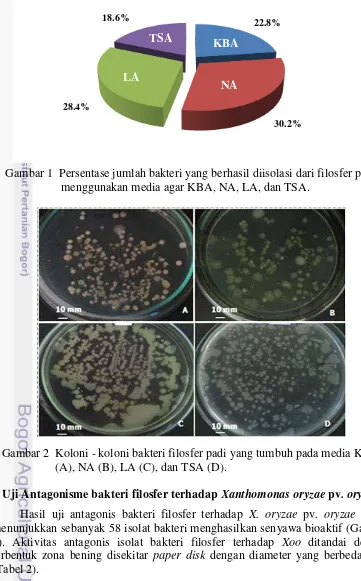
Sebanyak 285 isolat bakteri filosfer berhasil diisolasi dari rumpun tanaman padi varietas Ciherang berumur 2.5 bulan yang sehat asal Situgede, Bogor. Enam puluh lima isolat (22.8%) diisolasi menggunakan media KBA, 86 isolat (30.2%) dari media NA, 81 isolat (28.4%) dari media LA, dan 53 isolat (18.6%) dari media TSA (Gambar 1; Gambar 2). Isolat-isolat yang diperoleh tersebut selanjutnya diberi kode BFSGb.
Gambar 1 Persentase jumlah bakteri yang berhasil diisolasi dari filosfer padi menggunakan media agar KBA, NA, LA, dan TSA.
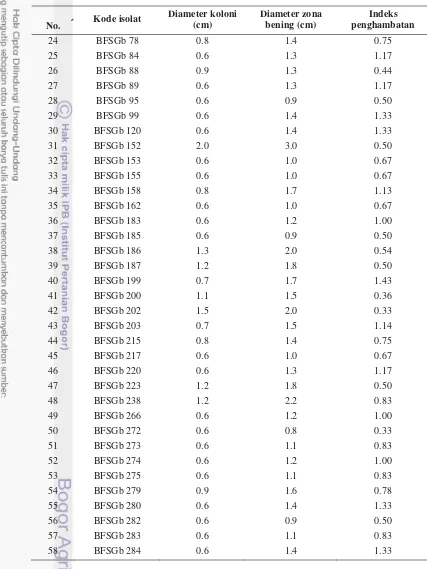
Gambar 2 Koloni - koloni bakteri filosfer padi yang tumbuh pada media KBA (A), NA (B), LA (C), dan TSA (D).
Uji Antagonisme bakteri filosfer terhadap Xanthomonas oryzae pv. oryzae
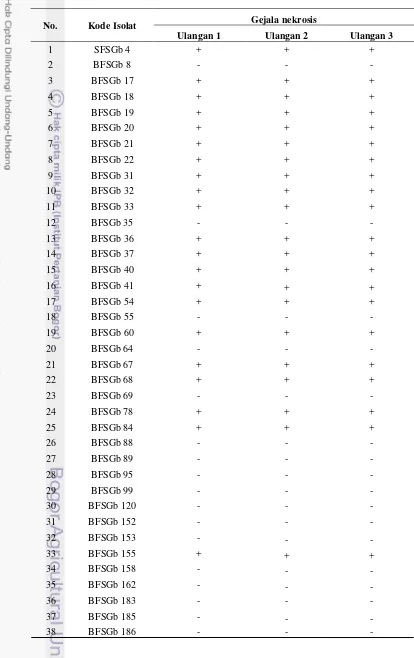
Hasil uji antagonis bakteri filosfer terhadap X. oryzae pv. oryzae (Xoo) menunjukkan sebanyak 58 isolat bakteri menghasilkan senyawa bioaktif (Gambar 3). Aktivitas antagonis isolat bakteri filosfer terhadap Xoo ditandai dengan terbentuk zona bening disekitar paper disk dengan diameter yang berbeda-beda (Tabel 2).
22.81 %
30.18 % 28.42 %
18.60 %
LA TSA
NA KBA 18.6%
28.4%
22.8%
Gambar 3 Perbandingan jumlah isolat bakteri filosfer yang diperoleh dengan jumlah isolat bakteri filosfer yang menghasilkan senyawa bioaktif anti Xoo.
Tabel 2 (Lanjutan)
Gambar 4 Zona hambat isolat bakteri BFSGb 8 (A), BFSGb 55 (B), dan BFSGb 99 (C) terhadap Xoo.
Uji hipersensitivitas pada tanaman tembakau
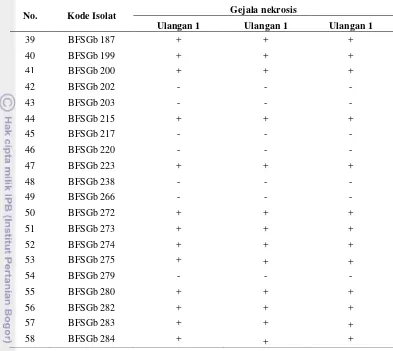
Sebanyak 58 isolat yang bersifat antagonis terhadap Xoo diuji reaksi hipersensitivitas respon (HR) yang ditimbulkannya pada tanaman tembakau. Reaksi HR yang ditimbulkan isolat-isolat bakteri filosfer yang patogenik teramati dengan jelas 48 jam setelah dilakukan infeksi. Reaksi yang sama juga ditunjukkan oleh daun tembakau yang diinokulasi dengan Xoo STG 21. Sebaliknya pada daun yang diinfeksi dengan E. coli DH5α dan akuades steril (kontrol negatif) tidak menunjukkan reaksi hipersensitif. Hasil uji menunjukkan 34 isolat menimbulkan reaksi hipersensitif pada daun padi, dan 24 isolat tidak mengakibatkan reaksi hipersensitif (Gambar 5; Tabel 3).
Gambar 5 Hasil uji hipersensitif respon pada daun tembakau dengan akuades steril (A), E. coli DH5α (B), Xoo STG 21 (C), isolat BFSGb 22 (D), dan isolat BFSGb 8 (E). Gambar yang dilingkari menunjukkan bagian daun yang diinokulasi bakteri filosfer.
7
BFSGb 8
cm
BFSGb 55
BFSGb 99
cm cm
A B C
B
E D
C A
cm
cm cm
Tabel 3 Hasil uji hipersensitif respon pada tanaman tembakau yang ditimbulkan oleh 58 isolat terpilih
No. Kode Isolat Gejala nekrosis
Tabel 3 (Lanjutan)
No. Kode Isolat Gejala nekrosis
Ulangan 1 Ulangan 1 Ulangan 1
39 BFSGb 187 + + +
40 BFSGb 199 + + +
41 BFSGb 200 + + +
42 BFSGb 202 - - -
43 BFSGb 203 - - -
44 BFSGb 215 + + +
45 BFSGb 217 - - -
46 BFSGb 220 - - -
47 BFSGb 223 + + +
48 BFSGb 238 - - -
49 BFSGb 266 - - -
50 BFSGb 272 + + +
51 BFSGb 273 + + +
52 BFSGb 274 + + +
53 BFSGb 275 + + +
54 BFSGb 279 - - -
55 BFSGb 280 + + +
56 BFSGb 282 + + +
57 BFSGb 283 + + +
58 BFSGb 284 + + +
Keterangan: (+) muncul gejala nekrosis. (-) tidak muncul gejala nekrosis.
Uji patogenisitas pada tanaman padi
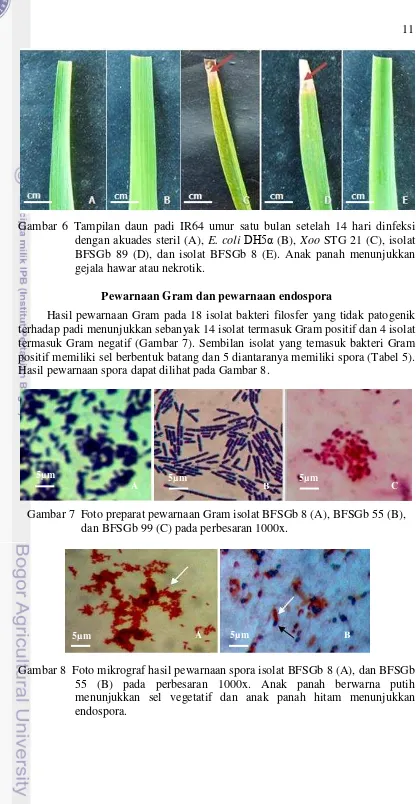
Tanaman padi IR64 berusia satu bulan diinokulasi dengan isolat bakteri terpilih yang tidak mengakibatkan gejala hipersensitif pada tanaman tembakau. Pengamatan yang dilakukan pada 3 hari dan 14 hari setelah inokulasi (hsi) menunjukkan 18 isolat diantaranya menyebabkan gejala nekrotik pada ujung daun padi yang digunting dan diinokulasi. Gejala nekrotik tersebut dimulai dengan dengan perubahan warna daun menjadi hijau kusam dan selanjutnya muncul garis-garis kecoklatan disepanjang berkas pembuluh. Sisanya sebanyak 6 isolat tidak mengakibatkan gejala nekrotik tersebut pada bagian daun yang digunting dan diinokulasi (Tabel 4; Gambar 6).
Gambar 6 Tampilan daun padi IR64 umur satu bulan setelah 14 hari dinfeksi dengan akuades steril (A), E. coli DH5α (B), Xoo STG 21 (C), isolat BFSGb 89 (D), dan isolat BFSGb 8 (E). Anak panah menunjukkan gejala hawar atau nekrotik.
Pewarnaan Gram dan pewarnaan endospora
Hasil pewarnaan Gram pada 18 isolat bakteri filosfer yang tidak patogenik terhadap padi menunjukkan sebanyak 14 isolat termasuk Gram positif dan 4 isolat termasuk Gram negatif (Gambar 7). Sembilan isolat yang temasuk bakteri Gram positif memiliki sel berbentuk batang dan 5 diantaranya memiliki spora (Tabel 5). Hasil pewarnaan spora dapat dilihat pada Gambar 8.
Gambar 7 Foto preparat pewarnaan Gram isolat BFSGb 8 (A), BFSGb 55 (B), dan BFSGb 99 (C) pada perbesaran 1000x.
Gambar 8 Foto mikrograf hasil pewarnaan spora isolat BFSGb 8 (A), dan BFSGb 55 (B) pada perbesaran 1000x. Anak panah berwarna putih menunjukkan sel vegetatif dan anak panah hitam menunjukkan endospora.
11
C B
A
5µm 5µm 5µm
Tabel 5 Reaksi Gram dan keberadaan endospora pada 18 isolat bakteri filosfer terpilih penghasil senyawa bioaktif anti Xoo yang bersifat non-patogenik pada tanaman padi
No. Kode isolat Jenis Gram Bentuk sel Penataan sel Struktur endospora
Isolat bakteri filosfer BFSGb 8, BFSGb 55, dan BFSGb 99 merupakan tiga isolat terpilih yang memiliki nilai Indeks Penghambatan terbesar terhadap Xoo diantara 18 isolat yang tidak berpotensi patogenik terhadap padi. Morfologi koloni BFSGb 8 pada umur 48 jam pada media LA memiliki koloni berwarna putih pekat, bentuk bundar dengan tepian timbul, tepian licin, dan elevasi seperti tombol. Morfologi koloni BFSGb 55 pada umur 48 jam pada media LA memiliki koloni berwarna putih transparan, bentuk tidak beraturan, tepian tidak beraturan, dan elevasi datar. Sedangkan Morfologi koloni BFSGb 99 pada umur 48 jam pada media LA memiliki koloni berwarna putih susu, bentuk keriput, tepian tidak beraturan , dan elevasi berbukit-bukit (Gambar 9).
Gambar 9 Morfologi koloni isolat bakteri filosfer BFSGb 8 (A), BFSGb 55 (B), dan BFSGb 99 (C) umur 48 jam pada media LA.
B
5µm 5µm 5µm
PEMBAHASAN
Isolasi dilakukan dengan menggunakan empat media yang berbeda, dengan tujuan untuk meningkatkan perolehan jumlah bakteri dan keragaman bakteri yang didapat. Dibandingkan dengan tiga media isolasi lainnya, jumlah koloni bakteri yang tumbuh pada media NA (86 isolat) relatif lebih banyak dibandingkan dengan dengan jumlah koloni yang tumbuh pada media isolasi lainnya. NA adalah media non-selektif yang umum digunakan untuk menumbuhan bakteri. Tingginya jumlah koloni yang tumbuh pada media NA diduga disebabkan oleh komposisinya yang mampu mendukung pertumbuhan kebanyakan bakteri. Media ini dapat digunakan untuk bakteri yang tidak membutuhkan kondisi khusus (Downes 2001). Jumlah koloni bakteri yang tumbuh pada media LA (81 koloni) tidak jauh berbeda dengan jumlah koloni yang tumbuh pada media NA. Hal ini dapat disebabkan karena LA termasuk media yang bersifat non-selektif dan relatif kaya nutrisi yang umum digunakan untuk pertumbuhan bakteri (Bertani 1951).
Dibandingkan dengan media NA dan LA, jumlah koloni bakteri pada media TSA (53 koloni) yang tumbuh dan jumlah koloni bakteri pada media KBA (65 koloni) jauh lebih rendah. Hal ini diduga karena komposisi nutrisi TSA yang relatif lebih rendah dibandingkan dengan NA dan LA. Media KBA merupakan media isolasi yang relatif paling rendah komposisi nutrisinya dan umum digunakan untuk isolasi bakteri filosfer. Penggunaan media yang tidak terlalu kaya nutrisi untuk isolasi bakteri filosfer ditujukan untuk menjaring kelompok-kelompok bakteri yang tumbuh relatif lambat, sesuai dengan kondisi daerah filosfer yang relatif lebih terbatas ketersedian nutrisinya (Lindow dan Brandl 2003). Diharapkan dengan kombinasi penggunaan media isolasi yang relatif kaya nutrisi (NA, LA, TSA) dan rendah nutrisi (KBA) dapat diperoleh isolat-isolat yang lebih beragam.
Selain pengaruh komposisi media, keragaman perolehan isolat bakteri filosfer dipengaruhi oleh kondisi lingkungan tempat pengambilan sampel dan jenis sampel tanaman yang diambil. Permukaan tanaman mengalami perubahan suhu yang cepat dan kelembaban dalam menanggapi adanya embun dan hujan. Selain itu, ketersediaan nutrisi pada permukaan tanaman juga mempengaruhi keragaman bakteri filosfer. Permukaan tanaman membatasi nutrisi untuk koloni bakteri. Umumnya bakteri filosfer dapat menahan stres lingkungan seperti ini (Lindow dan Brandl 2003). Secara alami, bakteri filosfer mampu menahan paparan radiasi ultraviolet yang tinggi di permukaan daun. Ketahanan bakteri filosfer terhadap radiasi ultraviolet disebabkan antara lain produksi pigmen merah muda atau oranye atau polisakarida ekstraselular (EPS) yang melindunginya dari radiasi tersebut. EPS dapat juga melindungi bakteri dari keterbatasan air, membantu sel untuk menyesuaikan dengan permukaan daun, dan melindungi dari aktivitas senyawa antibiotik atau antimikroba (Whipps et al. 2008). Selain itu, senyawa antimikroba yang diproduksi oleh beberapa bakteri filosfer dapat juga mempengaruhi keragaman bakteri filosfer (Lindow dan Brandl 2003).
mempunyai kelimpahan dan variasi yang paling, rata-rata berkisar 102 sampai 1012 sel/g daun (Thompson et al. 1993; Inacio et al. 2002).
Senyawa antimikroba yang dihasilkan oleh suatu bakteri dapat menyebabkan interaksi yang bersifat antagonis antara bakteri penghasil senyawa tersebut dengan mikroba lain di sekitarnya. Sebanyak 58 isolat dari 285 isolat yang diperoleh menunjukkan kemampuannya dalam menghambat Xoo secara in-vitro. Uji antagonisme in-vitro ini dilakukan pada media LA double layer (Lisboa et al. 2006) karena media ini memungkinkan isolat bakteri yang diuji dan bakteri patogen uji dapat tumbuh secara bersamaan dan senyawa antimikroba yang dihasilkan dapat berdifusi dengan baik dalam media semi padat.
Aktivitas penghambatan tersebut terlihat dari adanya zona bening di sekitar isolat bakteri filosfer yang diuji. Zona bening tersebut terbentuk karena pada area tersebut mengandung senyawa antimikroba yang berdifusi sehingga Xoo tidak dapat tumbuh di bagian tersebut dan permukaan media tetap jernih. Berdasarkan nilai Indeks Penghambatannya (IP), isolat BFSGb 17 merupakan isolat yang memiliki IP paling tinggi dengan nilai 2.67, sedangkan nilai IP paling rendah yaitu 0.33 diperoleh dari hasil uji isolat terhadap isolat BFSGb 32, BFSGb 68, BFSGb 202, dan BFSGb 272.
Diantara 58 isolat tersebut, 34% merupakan isolat yang diisolasi menggunakan media KBA (30.7% dari total isolat KBA), 17% menggunakan media NA (11.6% dari total isolat NA), 29% menggunakan media LA (21% dari total isolat LA), dan 19% menggunakan media TSA (20.8% dari total isolat TSA). Hasil ini menunjukkan bahwa media KBA lebih sesuai untuk media isolasi bakteri filosfer yang bersifat antagonis terhadap Xoo dibandingkan dengan ketiga media isolasi lainnya (NA, LA, dan TSA). Media KBA merupakan media non selektif yang umum digunakan untuk mengisolasi bakteri kandidat agen hayati untuk penyakit tanaman (King 1954).
Tiga puluh empat dari 58 isolat yang bersifat antagonis terhadap Xoo
mengakibatkan timbulnya hipersensitif respon (HR) pada tanaman tembakau. Reaksi HR didefinisikan sebagai program kematian sel yang cepat dan terlokalisasi. Reaksi ini muncul pada tanaman yang terinfeksi saat pengenalan patogen dan merupakan usaha tanaman untuk menghambat pertumbuhan patogen (Zhu et al. 2000). Uji hipersensitivitas pada tanaman tembakau merupakan tahap awal yang umum digunakan untuk mengetahui potensi patogenisitas suatu mikroba terhadap tumbuhan. Penggunaan tembakau pada uji ini karena tembakau merupakan tanaman indikator yang akan menunjukkan reaksi hipersensitif dengan cepat karena memiliki struktur daun yang lunak. Berdasarkan hasil uji HR ini, diduga 34 isolat tersebut memiliki potensi sebagai patogen tumbuhan sehingga tidak digunakan sebagai bahan percobaan berikutnya.
tanaman padi. Melalui luka tersebut, bakteri kemudian bergerak sambil memperbanyak diri menuju xilem. Bakteri juga dapat masuk pada tanaman padi melalui lubang alami seperti hidatoda, seperti cara Xoo menginfeksi daun padi (Ou 1985). Namun, infeksi bakteri lebih mudah terjadi melalui bagian daun yang terluka (Gnanamanickam et al. 1999). Pertimbangan penggunaan teknik pelukaan ini berdasar pada entry point yang efektif untuk proses infeksi Xoo. Diharapkan dengan cara ini selain diperoleh isolat bakteri filosfer yang memiliki kemampuan untuk menghambat perkembangan Xoo pada relung ekologi yang sama melalui mekanisme kompetisi (ruang dan nutrisi) dan atau antagonisme, diharapkan isolat tersebut juga mampu melindungi tanaman padi dari infeksi Xoo pada entry point-nya tanpa adapoint-nya kekhawatiran isolat itu sendiri akan menyebabkan pepoint-nyakit pada tanaman padi.
Pewarnaan Gram dilakukan untuk identifikasi awal 18 isolat bakteri filosfer terpilih menunjukkan preparat 14 isolat bakteri berwarna ungu atau termasuk kelompok Gram positif setelah diwarnai dengan pereaksi Gram, sedangkan 4 sisanya berwarna merah yang menunjukkan kelompok Gram negatif. Warna ungu pada hasil pewarnaan Gram tersebut tersebut disebabkan karena adanya lapisan peptidoglikan tebal yang dapat menahan kompleks warna ungu kristal dan iodium pada bakteri kelompok Gram positif disebabkan oleh adanya lapisan peptidoglikan yang tebal pada sel bakteri, lapisan peptidoglikan tersebut mampu menahan kompleks warna ungu kristal dan iodium sehingga sel tampak berwarna ungu ketika diamati dibawah mikroskop. Sebaliknya kelompok bakteri gram negatif memiliki lapisan peptidoglikan tipis yang berada ditengah membran luar dan membran dalam sehingga hanya dapat menahan kompleks warna safranin. Hasil tersebut sesuai dengan hasil penelitian Zhang et al. (2010) dan Mwajita et al. (2013) yang menunjukkan bahwa komonitas mikroba filosfer mempunyai potensi fisiologis dan jumlah bakteri Gram positif yang tinggi dibandingkan bakteri Gram negatif.
Sembilan dari 14 isolat yang bersifat Gram positif memiliki sel berbentuk batang dan 5 isolat (BFSGb 55, 64, 220, 238, dan 266) diantaranya memiliki endospora. Preparat pewarnaan endospora tersebut dibuat dari kultur yang diinkubasi secara aerobik. Keberadaan struktur endospora dan sifat aerobik dari ketiga isolat tersebut mengindikasikan bahwa ketiganya termasuk ke dalam kelompok Bacillus. Keberadaan Bacillus pada filosfer dalam persentase yang cukup besar juga telah dilaporkan dari filosfer tanaman padi (Mwajita et al. 2013), tanaman oleander (Lavermicocca et al. 1987), tanaman cabai (Zhang et al. 2008), dan tanaman Tillandsia (Brighigna et al. 2000).
Pengamatan morfologi koloni dilakukan terhadap 3 isolat dengan IP terbesar terhadap Xoo yaitu BFSGb 8, BFSGb 55, dan BFSGb 99. Ketiga isolat tersebut memiliki koloni bakteri berwarna putih. BFSGb 8 memiliki koloni bakteri dengan warna lebih pekat dibandingkan koloni bakteri BFSGb 55. Sedangkan isolat BFSGb 99 memiliki koloni berwarna putih susu dengan bentuk keriput (Lampiran 2). Isolat BFSGb 8 bersifat Gram positif dan tidak mempunyai spora, dan BFSGb 55 bersifat Gram positif dan mempunyai spora, sedangkan isolat BFSGb 99 termasuk bakteri Gram negatif.
SIMPULAN
Sebanyak 285 isolat bakteri filosfer berhasil diisolasi dari tanaman varietas Ciherang umur 2.5 bulan yang sehat yang berasal dari persawahan Situgede, Dramaga, Bogor. Isolat-isolat tersebut diisolasi menggunakan media NA (86 isolat), LA (81 isolat), KBA (65 isolat), dan TSA (53 isolat). Lima puluh delapan isolat menghasilkan senyawa bioaktif anti Xoo. Uji patogenisitas pada tanaman padi IR64 berumur satu bulan menunjukkan 18 isolat tidak berpotensi patogenik pada tanaman padi. Pewarnaan Gram pada 18 isolat non patogen pada padi menunjukkan 14 isolat termasuk bakteri Gram positif, 4 bakteri Gram negatif, dan 5 diantaranya diduga Bacillus. Tiga isolat dari 18 isolat bakteri filosfer tersebut (isolat BFSGb 8, BFSGb 55, dan BFSGb 99) memiki nilai Indeks Penghambatan terbesar yaitu 1.33, 1.67, dan 1.33 berturut-turut untuk isolat BFSGb 8, BFSGb 55, dan BFSGb 99. Aktivitas penghambatan terhadap Xoo tersebut mengindikasikan adanya potensi kemampuan isolat-isolat tersebut sebagai agen pengendali hayati untuk Xoo yang merupakan penyebab penyakit hawar daun padi. Oleh karena itu, perlu dilakukan penelitian lebih lanjut untuk menguji potensi ketiga isolat terpilih tersebut dalam mengendalikan penyakit hawar daun bakteri secara in-planta.
DAFTAR PUSTAKA
Brighignal L, Gori A, Gonnelli S, Favilli F. 2000. The influence of air pollution on the phyllosphere microflora composition of Tillandsia leaves (Bromeliaceae). Rev Bio Trop. 48(2):511-517.
Bertani G. 1951. Studies on lysogenesis. I. The mode of phage liberation by lysogenic Escherichia coli. J Bacteriol. 62: 293-300.
Dinh DH, Ky ON, Duc TN, Van DP, Cam LL. 2008. Pathotype profile of Xanthomonas oryzae pv. oryzae isolates from the rice ecosystem in cuulong rever Delta. Omonrice. 16: 34-40.
Dowling DN, O’Gara F. 1994. Metabolites of Pseudomonas involved in the biocontrol of plant desease. Tibtech. 12:133-141.
Downes FP, Ito K. 2001. Compendium of Methods for the Microbiological Examination of Foods. 4th Ed. Washington D.C (US): American Public Health Association.
Gnanamanickam SS, Priyadarisini VB, Narayanan NN, Vasudevan P, Kavitha S. 1999. An overview of bacterial blight disease of rice and strategies for its management. Curr Sci. 77:1435-1443.
Gram CH. 1884. The differential staining of Schizomycetes in tissue sections and in dried preparation. Fortschitte der Medicin. 2: 185-189.
Hanarida I, Utami DW, Kadir TS, Koerniati S. 2007. Galur padi baru tahan hawar daun bakteri. Warta Penelitian dan Pengembangan Pertanian. 20 (1): 5-6. Hastuti DH, Lestari Y, Suwanto A, Saraswati R. 2012. Endophytic Streptomyces
Inacio J, Pereira P, de Carvalho M, Fonseca A, Amaral-Collaco MT, Martins IS. 2002. Estimation and diversity of phylloplane mycobiota on selected plants in a mediterranean-type ecosystem in Portugal. Microb Ecol. 44:344-353.
King EO, Ward MK, Raney DE. 1954. Two simple media for the demonstration of pyocyanin and fluorescein. J Lab Clin Med. 44: 301.
Lavermicocca P, Surico G, Varvaro L, Babelegoto NM. 1987. Plant hormone, cryogenic and antimicrobial activities of epiphytic bacteria of live and oleander. Phytopathol Mediterr. 26:65-72. Characterization of bakteriosin-like substance produced by Bacillus amyloliquefaciens isolated from the Brazilian atlantic forest. Int Microbial. 9:111-118.
Mew TW, Cruz V, Rayes RC. 1982. Interaction of Xanthomonas campestris oryzae and resistance of rice cultivar. Phytopathology. 72 (7): 786-789. Morris CE, Kinkel LL. 2002. Fifty years of phyllosphere microbiology:
significant contributions to research in related fields. In: Phyllosphere Microbiology. (eds.) Lindow, S.E., E.I. Hecht-Poinar and V.J. Elliott. St Paul (US): APS Press.
Mwajita MR, Murage H, Tani A, Kahangi EM. 2013. Evaluation of rhizosphere, rhizoplane and phyllosphere bacteria and fungi isolated from rice in Kenya for plant growth promoters. SpringerPlus. 2: 606.
Ou SH. 1985. Rice Disease. 2nd. England (GB): Kiew, Surrey.
Suparyono, Sudir, Suprihanto. 2004. Pathotype profil of Xanthomonas oryzae pv. oryzae isolates from the rice ecosystem in Java. Indones J Agric Sci. 5: 63-69.
Suparyono, Sudir. 1992. Perkembangan penyakit bakteri hawar daun pada stadia tumbuh yang berbeda dan pengaruhnya terhadap hasil padi. Media Penelitian Sukamandi. 12 : 6-9.
Thompson IP, Bailey MJ, FenlonFermor TR, Lilley AK, Lynch JM, McCormack PJ, McQuilken MP. 1993. Quantitative and qualitative seasonal changes in the microbial community from the phyllosphere of sugar beet (Beta vulgaris). Plant Soil. 150:177-191.
Whipps JM, Hand P, Pink P, Bending GD. 2008. Phyllosphere microbiology with special reference to diversity and plant genotype. J Appl Microbiol. 105: 1744.
Zeigler R, Barclay A. 2008. The relevance of rice. Rice. 1:3-10.
Zhang B, Bai Z, Hoefel D, Tang L, Yang Z, Zhuang, Yang J, Zhang H. 2008. Assessing the impact of the biological control agent Bacillus thuringiensis on the indigenous microbial community within the pepper plant phyllosphere. FEMS Microbiol Lett. 284:102–108
Zhang B, Bai Z, Hoefel D, Wang X, Zhang L, Li Z. 2010. Microbial diversity within the phyllosphere of different vegetable species. Formatex. 1067-1077.
Zhu W, Magbanva MM, White FF. 2000. Identification of two novel hrp-associated genes in the hrp gene cluster of Xanthomonas oryzae pv. oryzae. J Bacteriol. 182(7): 1844-1853.
LAMPIRAN
Lampiran 2 Karakteristik morfologi koloni bakteri hasil isolasi yang berpotensi menghasilkan senyawa bioaktif anti Xoo
No. Kode isolat
Ciri morfologi koloni bakteri
Warna Bentuk Tepian Elevasi
1 BFSGb 4 putih tidak beraturan tidak beraturan timbul
2 BFSGb 8 putih krem bundar dengan tepian timbul licin seperti tombol
3 BFSGb 17 putih susu tidak beraturan tidak beraturan timbul
4 BFSGb 18 putih krem tidak beraturan tidak beraturan datar
5 BFSGb 19 putih tidak beraturan tidak beraturan timbul
6 BFSGb 20 putih berbenang-benang seperti benang datar
7 BFSGb 21 putih susu bundar licin seperti tetesan
8 BFSGb 22 kuning Bundar licin cembung
9 BFSGb 31 putih tidak beraturan tidak beraturan timbul
10 BFSGb 32 putih tidak beraturan tidak beraturan timbul
11 BFSGb 33 putih tidak beraturan tidak beraturan timbul
12 BFSGb 35 kuning kecoklatan bundar dengan tepian timbul tidak beraturan timbul
13 BFSGb 36 putih tidak beraturan tidak beraturan timbul
14 BFSGb 37 putih tidak beraturan tidak beraturan timbul
15 BFSGb 40 putih tidak beraturan berombak timbul
16 BFSGb 41 putih tidak beraturan tidak beraturan timbul
17 BFSGb 54 putih tidak beraturan berombak timbul
18 BFSGb 55 putih bening tidak beraturan tidak beraturan Datar
19 BFSGb 60 putih tidak beraturan tidak beraturan timbul
20 BFSGb 64 putih tidak beraturan tidak beraturan timbul
21 BFSGb 67 putih susu keriput tidak beraturan berbukit-bukit
22 BFSGb 68 putih usu keriput tidak beraturan berbukit-bukit
23 BFSGb 69 putih susu keriput tidak beraturan berbukit-bukit
24 BFSGb 78 kuning pucat tidak beraturan tidak beraturan datar
25 BFSGb 84 putih krem tidak beraturan tidak beraturan berbukit-bukit
26 BFSGb 88 kuning kecoklatan bundar licin seperti tetesan
27 BFSGb 89 putih bening tidak beraturan tidak beraturan datar
28 BFSGb 95 kuning bundar licin cembung
29 BFSGb 99 putih susu keriput tidak beraturan berbukit-bukit
30 BFSGb 120 putih bening keriput tidak beraturan berbukit-bukit
31 BFSGb 152 kuning kecoklatan tidak beraturan licin cembung
32 BFSGb 153 putih bening bundar dengan tepian timbul tidak beraturan datar
33 BFSGb 155 putih pucat tidak beraturan berombak cembung
34 BFSGb 158 kuning kecoklatan bundar licin cembung
35 BFSGb 162 putih susu keriput tidak beraturan berbukit-bukit
36 BFSGb 183 kuning kecoklatan bundar licin seperti tetesan
37 BFSGb 185 kuning kecoklatan bundar licin cembung
38 BFSGb 186 putih tidak beraturan tidak beraturan timbul
Lampiran 2 (Lanjutan)
No. Kode
isolat
Ciri morfologi koloni bakteri
Warna Bentuk Tepian Elevasi
39 BFSGb 187 kuning kecoklatan bundar dengan tepian timbul licin cembung
40 BFSGb 199 putih krem tidak beraturan licin cembung
41 BFSGb 200 kuning tidak beraturan licin cembung
42 BFSGb 202 putih krem tidak beraturan tidak beraturan datar
43 BFSGb 203 putih krem bundar licin timbul
44 BFSGb 215 putih tidak beraturan tidak beraturan timbul
45 BFSGb 217 kuning tidak beraturan tidak beraturan cembung
46 BFSGb 220 putih tidak beraturan tidak beraturan timbul
47 BFSGb 223 putih tidak beraturan tidak beraturan datar
48 BFSGb 238 kuning kecoklatan tidak beraturan tidak beraturan datar
49 BFSGb 266 kuning pucat bundar dengan tepian timbul licin seperti tombol
50 BFSGb 272 putih pucat tidak beraturan tidak beraturan datar
51 BFSGb 273 putih susu keriput tidak beraturan berbukit-bukit
52 BFSGb 274 merah bundar licin cembung
53 BFSGb 275 putih bundar licin datar
54 BFSGb 279 kuning kecoklatan bundar licin seperti tetesan
55 BFSGb 280 kuning pucat bundar dengan tepian timbul licin seperti tombol
56 BFSGb 282 kuning kecoklatan tidak beraturan licin timbul
57 BFSGb 283 kuning kecoklatan bundar licin cembung
RIWAYAT HIDUP
Penulis bernama Rina Nurfitriani, dilahirkan pada 27 Februari 1992 di Bogor, Jawa Barat. Penulis merupakan anak pertama dari tiga bersaudara pasangan Bapak Karman Sugiono dan Ibu Dede Yulia. Penulis tinggal di Subang, Jawa Barat. Penulis menyelesaikan pendidikan menengah atas di SMA Negeri 1 Subang pada tahun 2010, kemudian melanjutkan studi di Institut Pertanian Bogor melalui jalur Undangan Seleksi Masuk (USMI) pada tahun 2010 dan diterima di Departemen Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam.
Selama kuliah penulis mengikuti organisasi keilmiahan FORCES (forum for scientific study). Penulis menjadi asisten praktikum Mikrobiologi dasar, dan asisten praktikum Biologi Cendawan pada tahun 2014. Penulis juga berpartisipasi dalam kepanitiaan beberapa acara, diantaranya: Gebyar Inovasi Pemuda Indonesia (GIPI), Bayer Young Enviromental Envoy (BYEE), Pesta Sains Nasional (PSN), Pelatihan Pembuatan Proposal PKM (P4). Selain itu pada tahun 2013 penulis mendapat dana hibah PKM-Pengembangan Masyarakat.
Tahun 2012 penulis melaksanakan Studi Lapangan di Taman Nasional Gunung Gede Pangrango dengan tema Identifikasi Makrofungi yang Tumbuh pada Kayu di Taman Nasional Gunung Gede-Pangrango, Cipanas-Jawa Barat di bawah bimbingan Dr Ir Lisdar I Sudirman, sedangkan pada tahun 2013 penulis melaksanakan Praktik Lapangan di Balai Besar Penelitian Tanaman Padi (BB Padi) Sukamandi, Subang dengan tema Pengendalian Penyakit Hawar Daun Bakteri di Balai Besar Penelitian Tanaman Padi Sukamandi di bawah bimbingan Dr Triadiati dan Ir Sudir.