DEPARTEMEN TEKNOLOGI HASIL PERAIRAN FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR BOGOR
2014
EKSTRAKSI DAN KARAKTERISASI GELATIN DARI TULANG
IKAN COBIA (
Rachycentron canadum
)
▸ Baca selengkapnya: tulang ikan dan tulang dari hewan daging dapat diolah menjadi
(2)(3)PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa skripsi dengan judul “Ekstraksi dan Karakterisasi Gelatin dari Tulang Ikan Cobia (Rachycentron canadum)” adalah karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan penulis lain telah disebutkan dalam teks dan dicantumkan dalam daftar pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Agustus 2014
ABSTRAK
SILVANA GODELIFA M. FOFID . Ekstraksi dan Karakterisasi Gelatin dari Tulang Ikan Cobia (Rachycentron canadum). Dibimbing oleh TATI NURHAYATI dan PIPIH SUPTIJAH.
Pemanfaatan tulang ikan cobia (Rachycentron canadum) belum dilakukan secara optimal. Konversi tulang menjadi gelatin dapat meningkatkan nilai tambah produk. Isolasi gelatin dari tulang ikan cobia dilakukan melalui empat tahap, yaitu degreasing, deproteinisasi dengan NaOH 0,05M dengan rasio sampel/larutan, yaitu 1:10 (b/v) selama 5 hari, demineralisasi menggunakan HCl 5% dengan rasio sampel/larutan adalah 1:6 (b/v) selama 4 hari, dan ekstraksi menggunakan akuades selama 3 jam pada suhu 70oC dengan rasio sampel/larutan 1:2 (b/v). Rendemen yang diperoleh berdasarkan perhitungan basis basah adalah 5,76%. Gelatin yang dihasilkan memiliki kandungan protein yang tinggi yaitu 86,65%, kadar air (10,35%), abu (0,75%), dan lemak(1,25%) yang rendah. Nilai pH yang diperoleh yaitu 6,56. Analisis asam amino menunjukkan bahwa gelatin memiliki komposisi glisin dan prolina yang tinggi. Analisis FTIR menunjukkan wilayah penyerapan amida A, B, I, II, III pada 3335, 2923, 1657, 1543, dan 1235 cm-1.
Kata kunci: cobia (Rachycentron canadum), degreasing, deproteinisasi, demineralisasi, ekstraksi, gelatin.
ABSTRACT
SILVANA GODELIFA M. FOFID. Extraction and characterization of gelatin from the bone of cobia fish (Rachycentron canadum). Supervised by TATI NURHAYATI and PIPIH SUPTIJAH.
The Utilization of cobia (Rachycentron canadum) bone was not optimum. The convertion of fish bone to be the gelatin can increase the value of this rare product. There were four main steps to isolate the gelatin from the bone, such as degreasing, deproteinitation in NaOH 0,05 M with the sample/solution ratio 1:10 (b/v) for five days, demineralitation in HCl 5% with the sample/solution ration 1:6 (b/v), for four days, and the extraction on 70oC aquades for three hours with the sample/ solution ratio 1:2 (b/v). The yield of this process was 5,76% based on wet weight of bione. The gelatin had high proteins content (86,65%) and less of water (10,35%), ash (0,75%), and fat (1,26%) content. The pH of gelatin was 6,56. The amino acid analysis showed the gelatin was high glysin and prolina content. Fourier transform infrared (FTIR) spectroscopic analyze showed absorption bands of amide A, B, I, II, dan III at 3335, 2923, 1657, 1543, and 1235 cm-1.
© Hak Cipta Milik IPB, Tahun 2014
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
EKSTRAKSI DAN KARAKTERISASI GELATIN DARI TULANG
IKAN COBIA (
Rachycentron canadum
)
SILVANA GODELIFA M. FOFID
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Perikanan pada
Departemen Teknologi Hasil Perairan
DEPARTEMEN TEKNOLOGI HASIL PERAIRAN FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR BOGOR
Judul Skripsi : Ekstraksi dan Karakterisasi Gelatin dari Tulang Ikan Cobia (Rachycentron canadum)
Nama : Silvana Godelifa M. Fofid NIM : C34090003
Program Studi : Teknologi Hasil Perairan
Disetujui oleh
Dr Tati Nurhayati, SPi, MSi Pembimbing I
Dr Dra Pipih Suptijah, MBA Pembimbing II
Diketahui oleh
Prof Dr Ir Joko Santoso, MSi Ketua Departemen
KATA PENGANTAR
Puji dan syukur penulis pajatkan kepada Tuhan Yang Maha Esa karena skripsi yang berjudul “Ekstraksi dan karakterisasi gelatin dari tulang ikan cobia (Rachycentron canadum)” dapat diselesaikan dengan baik. Skripsi ini merupakan salah satu syarat untuk memperoleh gelar sarjana di Departemen Teknologi Hasil Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor.
Pada kesempatan ini, penulis ingin mengucapkan terima kasih kepada semua pihak yang telah memberikan bantuan dan dorongan hingga penulis dapat menyelesaikan skripsi ini, yaitu:
1 Dr Tati Nurhayati, SPi, MSi dan Dr Dra Pipih Suptijah, MBA selaku dosen pembimbing yang telah memberikan pengarahan dalam penyusunan skripsi ini,
2 Dr Ir Ruddy Suwandi, MS, MPhil selaku dosen penguji yang telah memberikan saran dan kritik untuk perbaikan skripsi ini,
3 Prof Dr Ir Joko Santoso, MSi selaku ketua Departemen Teknologi Hasil Perairan,
4 Dosen dan staf administrasi Departemen Teknologi Hasil Perairan,
5 Ibu Ema Masruroh, SSi; Dini Indriani, AMd; Saeful Bahri, AMd; Ibu Ari; dan Ibu Butet yang telah membantu penulis selama penelitian di Laboratorium,
6 Paulinus Fofid, Lambertina Fenanlampir, Mario Ronaldo Christian Fofid, Anton Oktavio Rian Fofid serta seluruh keluarga yang telah memberikan dukungan dan motivasi kepada penulis,
7 Christy Ariesta teman seperjuangan dalam penelitian ini,
8 Margaretha Winem, Annisa Saskia, Tommy Gantohe, Olivia Scarinta, Dewi Octavia, Rizqi Monoarfa Putri, Theresia Farneubun, Donatila Faranso, serta teman-teman seperjuangan THP 46 Alto yang senantiasa memberikan semangat dan dukungan kepada penulis.
Penulis menyadari bahwa penulisan skripsi ini masih jauh dari sempurna. Oleh karena itu, kritik dan saran yang membangun dari semua pihak sangat diharapkan. Semoga skripsi ini dapat memberikan manfaat bagi semua pihak yang memerlukannya.
Bogor, Agustus 2014
DAFTAR ISI
Optimasi ekstraksi gelatin (modifikasi Amiruldin 2007) ... 4
Hidrolisis ossein ... 4
Prosedur Analisis ... 4
Uji Bradford (Bradford 1976) ... 4
Analisis pH (AOAC 2005) ... 4
Analisis asam amino (AOAC 1995) ... 6
Analisis gugus fungsi dengan FTIR ... 7
Analisis data ... 7
HASIL DAN PEMBAHASAN... 8
Karakteristik Bahan Baku ... 8
Optimasi Proses Degreasing, Deproteinisasi, Demineralisasi Tulang Ikan Cobia ... 8
Karakteristik Gelatin ... 10
Komposisi Asam Amino Gelatin ... 11
Analisis Gugus Fungsi dengan Fourier Transform Infra Red (FTIR) ... 12
DAFTAR TABEL
Komposisi proksimat tulang ikan cobia dan ikan tuna ... 8 Efektivitas penurunan lemak pada larutan NaOH ... 9 Karakteristik proksimat, pH, dan rendemen gelatin tulang cobia ... 10 Komposisi asam amino gelatin tulang ikan cobia, BSG, PSG, ikan silver carp, channel catfish, dan standar GMIA ... 12
DAFTAR GAMBAR
Diagram alir pembuatan gelatin ... 6 Konsentrasi protein terlarut dalam larutan NaOH 0,05 M, sisa perendaman tulang berdasarkan waktu perendaman ... 9 Spektra inframerah gelatin ... 14
DAFTAR LAMPIRAN
PENDAHULUAN
Latar Belakang
Ikan cobia merupakan ikan pelagis dan dapat ditemukan di daerah tropis dan subtropis. Sebayang (2012) menyatakan bahwa ikan cobia memiliki ciri khas yaitu memiliki tubuh yang panjang dengan kepala agak pipih, pita gelap pada sisi lateral memanjang dari mata sampai pangkal ekor, sirip dorsal pertama berupa duri berjumlah 7 sampai 9 yang tidak dihubungkan oleh membran. Ikan cobia sering dijumpai di Samudera Pasifik, Atlantik dan sebelah baratdaya Meksiko. Ikan cobia dewasa tidak terdapat di laut antara bulan Maret dan Oktober serta dipercaya bermigrasi dari daerah perairan tropis ke daerah yang lebih dingin. Ikan cobia bertelur di perairan tropis Teluk Meksiko yang jauh dari pantai atau tepi laut antara Bulan April dan Oktober, telur dan larvanya dikumpulkan dari ekosistem perairan estuari di Florida. Penyebaran ikan cobia di wilayah Indonesia adalah di perairan Bali dan Lampung. Budidaya ikan cobia juga telah dilakukan di perairan Lampung. Ikan cobia belum dimanfaatkan secara optimal karena belum dikenal secara luas.
Gelatin merupakan suatu jenis protein yang diekstraksi dari jaringan kolagen
hewan. Kolagen terdapat pada tulang, tulang rawan, kulit, dan jaringan ikat pada
hewan. Gelatin diperoleh dengan cara denaturasi panas dari kolagen. Perbedaan gelatin dan kolagen adalah kolagen memiliki struktur triple helix, sedangkan gelatin single helix. Kolagen juga tidak bersifat reversible, yaitu sifat di mana membentuk sol jika dipanaskan dan kembali menjadi gel jika didiginkan, sedangkan gelatin bersifat reversible. Gelatin lebih tahan panas jika dibandingkan dengan kolagen. Permintaan gelatin telah meningkat selama bertahun-tahun. Produksi gelatin dunia mendekati angka 326.000 ton per tahun. Sebanyak 46% gelatin yang bersumber dari kulit babi, dari kulit sapi sebesar 29,4%, dari tulang sapi sebesar 23,1%, dan dari sumber lain sebesar 1,5% (Karim dan Bhat 2009). Gelatin dibedakan menjadi 2 tipe berdasarkan proses pembuatannya. Gelatin tipe A dibuat melalui proses asam, sedangkan gelatin tipe B dibuat melalui proses basa.
Gelatin dapat dimanfaatkan dalam industri fotografi, farmasi, dan pangan sebagai emulsifier, foaming agent, stabilizer, water binding, dan edible film. Gelatin memiliki sifat yang dapat berubah secara reversible dari bentuk sol ke gel, mengembang dalam air dingin, dapat membentuk film. Gelatin juga dapat mempengaruhi viskositas suatu bahan, dan dapat melindungi sistem koloid. Sifat yang dimiliki gelatin tersebut menyebabkan gelatin lebih banyak disukai dibandingkan dengan bahan lain, contohnya gum xantan, karegenan, dan pektin,
sehingga gelatin cocok untuk diterapkan dalam industri pangan (Guillen et al. 2011).
Gelatin pada umumnya berasal dari hewan mamalia yaitu babi dan sapi
Produksi gelatin yang bersumber dari babi dan sapi dapat menjadi kendala karena babi haram bagi umat Islam dan Yahudi, serta sapi haram bagi umat Hindu. Hal tersebut dapat diatasi dengan menggunakan tulang atau kulit ikan sebagai bahan baku pembuatan gelatin. Penelitian terkait gelatin yang bersumber dari tulang ikan sebelumnya telah dilakukan pada beberapa jenis ikan, contohnya tulang ikan tuna
2
Limbah hasil samping dari produksi fillet ikan cobia berupa tulang, kulit, jeroan, dan kepala. Limbah tulang hasil samping tersebut dapat dimanfaatkan sebagai bahan baku pembuatan gelatin. Sebayang (2012) mengemukakan bahwa persentase tulang ikan cobia sebesar 16,42% dari total berat tubuh, kulit 6,87%, kepala 28,67%, jeroan 11,21%, dan daging 36,83%. Pemanfaatan limbah ikan cobia masih terbatas pada pemanfaatan kulit (Amiza dan Aishah 2011), sehingga pembuatan gelatin yang bersumber dari tulang ikan cobia perlu untuk dilakukan. Hal ini juga bermanfaat sebagai peningkatan nilai komersil hasil samping produk perikanan dan sebagai alternatif untuk menggantikan gelatin yang bersumber dari babi dan sapi.
Perumusan Masalah
Limbah tulang ikan cobia belum dimanfaatkan secara optimal. Salah satu alternatif meningkatkan nilai komersil limbah tulang cobia adalah dengan pembuatan gelatin. Gelatin dapat dimanfaatkan dalam industri, contoh: industri pangan dan farmasi. Permasalahan dalam pemanfaatan gelatin adalah kelompok agama tertentu tidak menghalalkan gelatin yang terbuat dari babi atau sapi. Tulang ikan cobia juga belum dimanfaatkan sebagai bahan baku pembuatan gelatin. Kualitas gelatin dapat dilihat melalui hasil karakterisasi yang dibandingkan dengan standar mutu gelatin.
Tujuan Penelitian
Tujuan penelitian ini adalah menentukan waktu perendaman tulang ikan cobia dengan larutan alkali untuk menghilangkan protein non-kolagen, lemak, dan abu; mengekstraksi dan mengarakterisasi gelatin, serta membandingkannya dengan standar mutu.
Manfaat Penelitian
Ekstraksi gelatin dari tulang ikan cobia (Rachycentron canadum) dapat menjadi upaya pemanfaatan hasil samping produk perikanan dan menghasilkan gelatin yang memiliki mutu baik.
Ruang Lingkup Penelitian
3
METODE
Penelitian ini dilaksanakan pada bulan April 2013 sampai April 2014. Preparasi dan ekstraksi sampel dilakukan di Laboratorium Pengetahuan Bahan Baku Industri Hasil Perairan, Laboratorium Biokimia Hasil Perairan, Laboratorium Pengetahuan Bahan Baku Industri Hasil Perairan, Departemen Teknologi Hasil Perairan, Fakultas Perikanan dan Ilmu Kelautan. Analisis gugus fungsi dilakukan di Laboratorium Analisis Bahan, Departemen Fisika, Fakultas MIPA, Institut Pertanian Bogor. Analisis asam amino dan proksimat di Laboratorium Saraswanti Indo Genetech.
Bahan
Bahan utama gelatin yang digunakan dalam penelitian ini adalah tulang ikan cobia (Rachycentron canadum) yang diperoleh dari Pelabuhan Perikanan Nusantara Muara Angke (Jakarta). Bahan untuk penentuan analisis protein kualitatif yaitu larutan Bradford. Bahan yang digunakan pada pembuatan gelatin adalah akuades, NaOH, HCl, dan bahan untuk analisis karakteristik gelatin.
Alat
Alat yang digunakan dalam preparasi ikan cobia adalah pisau. Alat yang digunakan dalam uji Bradford adalah labu ukur, kertas saring, dan tabung reaksi. Alat yang digunakan dalam pembuatan gelatin adalah termometer, beaker glass, batang pengaduk, dan kompor listrik. Alat yang digunakan dalam analisis proksimat adalah, oven, sudip, desikator (analisis kadar air); tabung kjeldahl, destilator, biuret (analisis kadar protein); tabung sokhlet, (analisis kadar lemak); tanur dan desikator (analisis kadar abu). Alat yang digunakan dalam pengujian gusus fungsi gelatin adalah Fourier Transform Infra Red (FTIR) merk Abbmb3000. Pengujian asam amino menggunakan alat High Performance Liquid Chromatography (HPLC) merek Waters Corporation USA.
Prosedur Penelitian
Pembuatan gelatin dari tulang ikan cobia dilakukan melalui empat tahap, yaitu karakterisasi bahan baku tulang ikan cobia, penentuan perlakuan terbaik pada pembuatan gelatin, ekstraksi gelatin, dan karakterisasi gelatin.
Preparasi bahan baku
4
Optimasi ekstraksi gelatin (modifikasi Amiruldin 2007)
Pembuatan gelatin diawali dengan melakukan deproteinisasi untuk menghilangkan protein non kolagen dan komponen lain menggunakan larutan alkali. Larutan alkali digunakan adalah larutan NaOH konsentrasi 0,05 M dengan perbandingan 1:10 (b/v) pada suhu ruang. Larutan alkali bertujuan untuk menghilangkan protein non kolagen yang masih terkandung di dalam tulang, mengikat lemak yang membentuk sabun. Larutan NaOH diganti setiap 24 jam sekali selama 6 hari. Uji Bradford dilakukan untuk untuk menentukan lama waktu perendaman terbaik. Efektivitas penurunan lemak diukur secara kualitatif. Proses selanjutnya adalah demineralisasi dengan menggunakan HCl 5% dengan perbandingan 1:6 (b/v) selama 4 hari. Asam mampu mengubah serat kolagen triple helix menjadi rantai tunggal. Sampel tulang yang telah lunak atau ossein dinetralisasi menggunakan larutan akuades hingga netral.
Hidrolisis ossein
Hidrolisis gelatin dilakukan terhadap tulang yang telah menjadi ossein hasil perendaman. Ekstraksi dilakukan dengan akuades selama tiga jam pada suhu 70oC. Perbandingan antara akuades dan sampel yaitu 1:2 (b/v). Hasil ekstraksi yang diperoleh merupakan gelatin larut air. Proses selanjutnya adalah pengeringan menggunakan oven pada suhu 40oC selama 2 hari sehingga diperoleh lembaran-lembaran gelatin. Diagram alir pembuatan gelatin disajikan pada Gambar 1.
Prosedur Analisis
Analisis yang dilakukan dalam mengarakterisasi gelatin dari tulang ikan cobia meliputi uji Bradford, analisis komposisi proksimat, analisis pH, analisis FTIR, analisis, asam amino, dan analisis data.
Uji Bradford (Bradford 1976)
Penentuan konsentrasi protein terlarut pada sampel dilakukan dengan menggunakan uji Bradford. Standar protein yang digunakan pada pengujian ini adalah Bovine Serum Albumin (BSA). Pembuatan larutan Bradford dilakukan dengan mencampurkan 10 mg Coomasive Briliat Blue (CBB) dengan 5 mL etanol 95%, lalu ditambahkan 10 mL larutan asam fosfat 85% dan akuades sehingga volumenya mencapai 500 mL. Larutan Bradford lalu disaring menggunakan kertas saring.
Konsentrasi protein terlarut diukur dengan menggunakan spektrofotometer. Sebanyak 0,01 mL sampel ditambahkan dengan 1,99 mL akuades, kemudian divortex. Sampel yang telah divortex kemudian ditambahkan dengan 5 mL larutan Bradford. Absorbansi sampel ditentukan dengan spektrofotometer pada panjang gelombang 595 nm.
Analisis proksimat (AOAC 2005)
Analisis proksimat dilakukan untuk mengetahui komposisi kimia suatu bahan yang meliputi, analisis kadar air, kadar lemak, kadar protein, dan kadar abu dari suatu bahan atau sampel.
Analisis pH (AOAC 2005)
5 dihidupkan dan dibiarkan hingga stabil. Elektroda dicelupkan ke dalam sampel selama beberapa saat sampai diperoleh angka yang stabil pada monitor pH meter.
Uji konsentrasi protein terlarut pada larutan sisa perendaman NaOH setiap 24
jam selama 6 hari
Kandungan protein terendah Ikan cobia
(Rachycentron canadum)
Perendaman dalam larutan NaOH 0,05 M (1:10) (b/v) dengan perlakuan waktu perendaman 1-6
hari Preparasi sampel
Analisis proksimat
Tulang perendaman NaOH dengan perlakuan terbaik
Perendaman dalam larutan HCl 5% (1:6) (b/v) selama 4 hari
Ekstraksi dengan akuades (70°C, 3 jam) dengan rasio 2:1 (b/v) Netralisasi
Gelatin
Pengeringan dengan oven pada suhu 40oC selama 2 hari Serbuk gelatin
Netralisasi
6
Gambar 1 Diagram alir pembuatan gelatin Analisis asam amino (AOAC 1995)
Sebanyak 0,2 gram sampel disiapkan dalam tabung reaksi tertutup dan ditambahkan 5mL HCl 6N. Sampel dimasukan dalam oven dengan suhu 100 oC selama 24 jam, selanjutnya sampel disaring dalam kertas saring Whatman 40. Hasil hidrolisis dipipet sebanyak 20 μl larutan pengering (aseton). Lalu dikeringkan dengan pompa vakum bertekanan 50 torr. Sampel yang telah dikeringkan ditambahkan larutan derivat (methanol, phenyl iso tiocyanat dan TEA) sebanyak 30 μl dan dibiarkan selama kurang lebih 20 menit. Sampel selanjutnya diencerkan dengan 200 μl larutan pengencer natrium asetat 1 M. Sampel siap dianalisis dengan menggunakan HPLC Water Asiociates. Kondisi HPLC pada saat dilakukan analisis:
Temperatur kolom : 38 oC
7 Batas tekanan : 3000 psi
Program : Gradien
Fase gerak : Asetonitril 60% Buffer Natrium Asetat 1 M, pH 5,75
Detektor : UV, panjang gelombang 254 nm Konsentrasi asam amino dapat ditentukan dengan rumus:
Keterangan :
AC : Luas area sampel AS : Luas area standar BC : Berat sampel (µ g) BS : Berat standar (µ g)
BM : Berat molekul masing-masing asam amino Fp : Faktor pengenceran
Analisis gugus fungsi dengan FTIR
Analisis FTIR dilakukan untuk mengetahui gugus fungsi khas dari gelatin yang dihasilkan. Sebanyak 0,2 gram gelatin dibentuk pellet dengan KBr dalam mortar hingga homogen, kemudian dimasukkan ke dalam cetakan pellet dan dipadatkan. Sampel lalu divakum dalam mesin pencetak pellet. Pellet yang telah divakum dimasukkan ke dalam sel kemudian dimasukkan pada media penempatan sel dengan ditembakkan sinar dari spektofotometer inframerah IR-408 yang sudah dinyalakan terlebih dahulu dengan kondisi yang stabil. Selanjutnya, dilakukan pendeteksian menggunakan tombol detektor dan akan dihasilkan rekorder histogram FTIR pada monitor yang akan menampilkan puncak-puncak dari gugus fungsi yang terdapat pada sampel. Histogram yang diperoleh dianalisis untuk memperoleh data kualitatif maupun kuantitatif.
Analisis data
Data yang diperoleh dari hasil uji Bradford dianalisis dengan menggunakan softwear SPSS 17. Rancangan yang digunakan adalah Rancangan Acak Lengkap (RAL). Perlakuan yang digunakan adalah lama perendaman. Ulangan yang dilakukan pada setiap perlakuan yaitu 2 kali. Model rancangannya adalah:
Yij = μ + τi + εij
Keterangan:
Yij = Nilai pengamatan dari perlakuan ke-i (waktu) dan ulangan ke-j μ = Nilai rataan umum populasi
τi = Pengaruh perlakuan ke-i (waktu)
εij = Galat pengamatan pada perlakuan ke-i dengan ulangan ke-j.
Apabila hasil analisis menunjukkan berpengaruh nyata, maka dilanjutkan dengan uji Duncan’s Multiple Range Test (DMRT) dengan taraf kepercayaan 95%. Hipotesis Pengaruh kosentrasi NaOH:
8
H1 = Lamanya perendaman berpengaruh nyata terhadap total protein non-kolagen terlarut.
HASIL DAN PEMBAHASAN
Karakteristik Bahan Baku
Tulang ikan cobia yang digunakan terlebih dahulu dikarakterisasi dengan melakukan analisis komposisi proksimat. Hal ini bertujuan untuk mengetahui kandungan gizi yang terkandung di dalamnya. Analisis komposisi proksimat yang dilakukan meliputi kadar air, protein, lemak, dan abu. Komposisi proksimat tulang ikan cobia dan perbandingannya dengan tulang ikan tuna disajikan pada Tabel 1.
Tabel 1 Komposisi proksimat tulang ikan cobia dan ikan tuna Sumber Kadar air Tulang ikan cobia 26,41±0,48 23,12±0,24 19,65±0,31 27,68±0,13
Tulang ikan tuna1 28,57 23,64 15,49 28,97
Keterangan : 1(Amiruldin 2007)
Kadar air tulang ikan cobia yang digunakan adalah sebesar 26,41±0,48%. Nilai ini lebih rendah dari nilai yang diperoleh Amiruldin (2007). Kadar protein sebesar 23,12±0,24% relatif sama dengan yang diperoleh oleh Amiruldin (2007). Kadar lemak yang terkandung pada tulang ikan cobia sebesar 19,65±0,31%. Perbedaan komposisi antara tulang ikan cobia dan tuna dipengaruhi spesies, habitat, serta makanan. Winarno (2002) menyatakan kadar protein pada kisaran > 20% berada pada taraf tinggi. Kadar lemak dikatakan rendah bila nilainya < 5%. Perendaman dengan larutan alkali dapat menurunkan jumlah protein non kolagen, abu dan lemak.
Optimasi Proses
9
Gambar 2 Konsentrasi protein terlarut dalam larutan NaOH 0,05 M, sisa perendaman tulang berdasarkan waktu perendaman
Hasil analisis statistik menggunakan Rancangan Acak Lengkap menunjukkan bahwa lamanya perendaman berpengaruh terhadap total protein non-kolagen terlarut dan setiap perlakuan menunjukkan hasil yang berbeda nyata. Gambar 3 menunjukkan bahwa perlakuan terbaik yang ditandai dengan konsentrasi protein terkecil adalah pada hari kelima. Yang et al. (2007) menyatakan bahwa larutan alkali NaOH dapat menghilangkan protein non kolagen. Pernyataan ini sejalan dengan Zhou dan Regenstein (2005) yang menyatakan bahwa perendaman dalam alkali dapat menghilangkan keberadaan lemak dan protein pada bahan, yaitu protein non-kolagen, serta menghasilkan gelatin dengan kandungan protein yang tinggi. Larutan Alkali juga dapat menurunkan abu pada bahan baku. Konsentrasi protein yang meningkat pada hari keenam disebabkan oleh protein-protein kolagen yang telah larut ke dalam larutan NaOH.
Tabel 2 Efektivitas penurunan lemak pada larutan NaOH
Hari Tingkat kekeruhan Busa
1 ++++ ++++ terkandung pada tulang ikan cobia. Hal ditunjukkan dengan tingkat kekeruhan larutan yang semakin berkurang. Nagai dan Suzuki (1999) mengemukakan bahwa perendaman NaOH juga dapat menghilangkan lemak dan abu yang masih terkandung di dalam tulang. Busa menjadi salah satu indikator penurunan lemak
10
karena adanya proses saponifikasi antara lemak dan alkali. Semakin sedikit busa yang dihasilkan menunjukkan bahwa kandungan lemak pada larutan semakin berkurang. Handayani et al. (2012) menyatakan bahwa busa tercipta karena reaksi antara lemak dan alkali (NaOH) akan menghasilkan sabun dan air. Proses berikutnya adalah demineralisasi. Jamilah dan Harvinder (2002) menyatakan bahwa perendaman dalam larutan asam bertujuan untuk menghilangkan garam dan kalsium tulang sehingga dihasilkan tulang lunak yang disebut ossein.
Karakteristik Gelatin
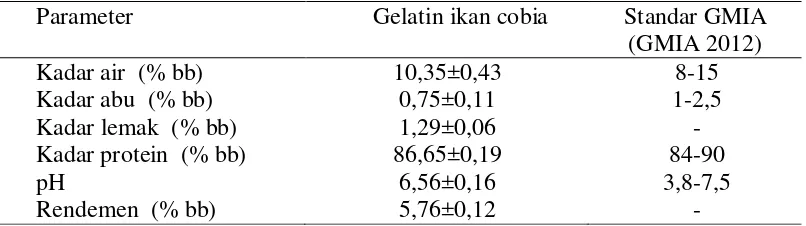
Kualitas gelatin dari tulang ikan cobia ditunjukkan hasil karakterisasi. Efektivitas proses degreasing, deproteinisasi, dan demineralisasi yang bertujuan untuk menghilangkan protein non kolagen dan komponen lainnya juga dapat dilihat melalui komposisi proksimat, pH dan rendemen. Karakteristik gelatin dari tulang ikan cobia dan beberapa ikan disajikan pada Tabel 3.
Tabel 3 Karakteristik proksimat, pH, dan rendemen gelatin tulang cobia
Parameter Gelatin ikan cobia Standar GMIA
(GMIA 2012)
Nilai kadar air gelatin dari tulang cobia yaitu 10,35±0,43% lebih tinggi dari dari kadar air pada ikan kakap merah (Sari et al. 2012), ikan patin (Nurilmala 2006), dan channel catfish (Liu et al. 2009). Kadar abu dari gelatin cobia yaitu 0,75±0,11%. Nilai kadar air dan abu gelatin dari tulang cobia masih memenuhi standar dan GMIA (2012). Kadar lemak yang terkandung di dalam gelatin cobia sebesar 1,29±0,06%. Penurunan kadar lemak dan abu dari bahan baku menunjukkan bahwa proses degreasing, deproteinisasi, dan demineralisasi mampu mengurangi komponen non kolagen pada tulang ikan cobia. Kadar protein gelatin cobia lebih tinggi dari ikan patin (Nurilmala et al 2006), channel catfish (Liu et al. 2009), dan lebih rendah dari ikan kakap merah (Sari et al. 2012). Kadar protein gelatin tulang ikan cobia juga memenuhi standar protein gelatin GMIA. Karim dan Bhat (2009) menyatakan bahwa perbedaan protein disebabkan oleh perbedaan metode ekstraksi dan jenis ikan yang digunakan.
11 asam dan basa pada proses ekstraksi cenderung menghasilkan pH akhir yang netral. Jenis asam yang digunakan pada perendaman juga mempengaruhi nilai pH pada gelatin. Proses penetralan berpengaruh pada pH akhir gelatin karena penetralan berfungsi mengurangi sisa-sisa larutan asam maupun basa akibat perendaman.
Perhitungan rendemen dilakukan untuk mengetahui persentase gelatin yang dihasilkan. Rendemen juga berguna untuk melihat keefektifan proses ekstraksi. Rendemen gelatin tulang ikan cobia lebih kecil dari rendemen yang dimiliki oleh
gelatin patin (Peranginangin et al. 2005), yaitu 15,38%; channel catfish (Liu et al. 2009), dan lizardfish (Wangtueai dan Noonhorm 2009) yang memiliki
rendemen sebesar 9,1%. Rendemen dipengaruhi oleh pH, struktur tulang, dan kandungan kolagen dalam tulang. Nilai pH juga mempengaruhi kemurnian gelatin.
Poppe (1992) dalam Peranginangin et al. (2005) menyatakan bahwa pemecahan triple helix akan semakin besar jika laju hidrolisis semakin cepat. Rendemen gelatin semakin meningkat seiring dengan penurunan pH. Rendemen gelatin dari tulang cobia lebih kecil karena NaOH yang masih terikat pada tulang yang menyebabkan jalannya hidrolisis menjadi terhambat. Liu et al. (2009) menyatakan bahwa perbedaan rendemen gelatin dapat disebabkan oleh perbedaan konsentrasi larutan yang digunakan, perbedaan metode ekstraksi, dan jenis bahan. Faktor pencucian dapat menjadi penyebab berkurangnya rendemen gelatin. Bahan yang hilang pada saat pencucian dan penirisan yang kurang sempurna mengakibatkan bobot terhitung saat penimbangan bukan bobot murni tulang.
Komposisi Asam Amino Gelatin
Asam amino merupakan molekul yang membentuk protein. Analisis asam amino bertujuan untuk mengetahui jenis dan komposisi asam amino yang menyusun gelatin hasil ekstraksi. Komposisi asam amino juga merupakan salah satu
faktor mempengaruhi sifat fisik gelatin. Komposisi asam amino yang menyusun
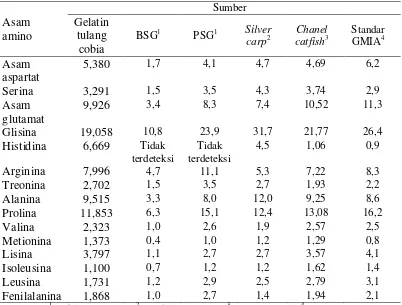
gelatin dari tulang cobia disajikan pada Tabel 4.
Asam amino yang terdapat didalam gelatin merupakan asam amino tidak lengkap, karena tidak adanya asam amino triptofan. Asam amino yang memiliki nilai paling tinggi adalah glisina dan prolina yaitu 19,058% dan 11,853%. Kandungan asam amino terendah adalah isoleusina dan leusina, masing-masing sebesar 1,100% dan 1,731%. Kandungan glisina dan prolina pada gelatin tulang cobia lebih tinggi dari kandungan glisina pada Bovine Skin Gelatine (BSG) (Hafidz et al. 2011), dan lebih rendah dari kandungan Porcine Skin Gelatine (PSG) (Hafidz et al. 2011), gelatin silver carp (Tavakolipour 2011), gelatin channel catfish (Liu et al. 2009), dan standar GMIA (GMIA 2012).
12
diekstraksi, gelatin yang bersumber dari kulit babi memiliki kandungan asam amino yang lebih tinggi dari tulang ikan.
Tabel 4. Komposisi asam amino gelatin tulang ikan cobia, BSG, PSG, ikan silver carp, channel catfish, dan standar GMIA
Asam
hidroksiprolina merupakan asama amino utama penyusun gelatin. Glisina mengisi 2
/3 bagian dari komposisi asam amino, sisanya diisi oleh prolina, hidroksiprolina dan asam amino lainnya. Hidroksiprolina merupakan salah satu asam amino pembatas dalam berbagai protein. Semakin besar nilai glisina, prolina, hidroksiprolina akan berpengaruh pada kualitas mutu gelatin.
Kandungan prolina dan hidroksiprolina akan sangat berpengaruh terhadap besar kecilnya nilai viskositas dan kekuatan gel pada gelatin. Rendahnya titik leleh disebabkan rendahnya kandungan asam amino prolina dan hidroksiprolina didalam gelatin. Asam amino prolina dan hidroksiprolina membantu pembentukan rantai polipeptida dan memperkuat struktur gelatin. Tingginya kandungan glisina pada gelatin menyebabkan gelatin mudah larut dalam air dan mampu membentuk emulsi, karena asam amino glisina merupakan asam amino yang bersifat hidrofilik Gimenez et al. (2005). Amiza dan Aishah (2011) menyatakan bahwa komposisi asam amino histidina dipengaruhi oleh kandungan histidina pada bahan dan kesegaran bahan baku.
13
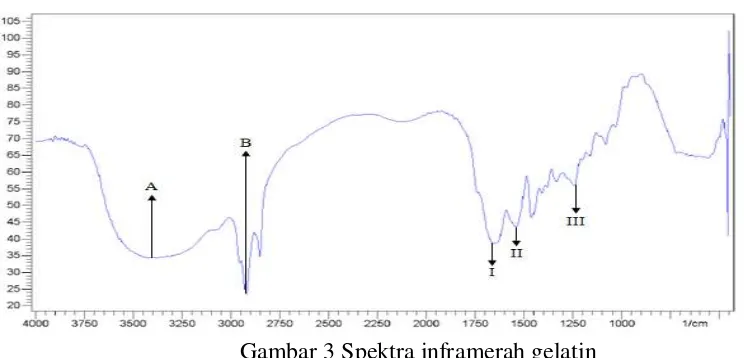
Analisis FTIR dilakukan untuk memastikan senyawa yang dihasilkan adalah gelatin. Hasil spektra inframerah menunjukkan struktur sekunder pada protein. Gugus fungsi yang khas pada gelatin adalah amida A, B, I, II, dan III. (Al-Saidi et al. 2012). Kong dan Yu (2007) menyatakan bahwa komponen α-helix ditunjukkan pada wilayah serapan yang berkisar antara 1658-1653 cm-1, sehingga puncak serapan amida I gelatin tulang cobia menunjukan adanya komponen α-helix.
Gugus amida II terdeteksi pada wilayah serapan 1575-1480 cm-1. Amida II menunjukkan adanya NH bending dan CN streching (Kong dan Yu 2007). Gugus amida II pada gelatin tulang cobia terdeteksi pada bilangan gelombang 2923 cm-1. Nilai yang serupa juga ditunjukkan oleh gelatin dari ikan nila hasil penelitian Muyonga et al. (2007). Gugus amida III telah terdeteksi pada bilangan gelombang 1235 cm-1. Nilai ini lebih rendah dari gugus amida III pada gelatin ikan nila
(Muyonga et al. 2004) dan ikan shaari (Al-Saidi et al. 2012). Muyonga et al. (2004) juga menyatakan bahwa intensitas amida III berkaitan
dengan struktur triple helix.
Tabel 5 Karakteristik gugus fungsi gelatin tulang ikan cobia dan ikan nila
14
Gambar 3 Spektra inframerah gelatin
Kolagen pada ossein tulang cobia yang telah diekstraksi pada suhu 70oC telah terdegradasi menjadi gelatin karena struktur triple helix terurai menjadi rantai tunggal α-helix. Hal ini ditandai dengan bilangan gelombang pada amida I (1657 cm-1) dan III (1235 cm-1) yang menunjukkan adanya struktur α-helix.
KESIMPULAN DAN SARAN
Kesimpulan
Proses deproteinisasi terbaik untuk perendaman tulang ikan cobia adalah menggunakan NaOH 0,05 M dan perendaman selama 5 hari. Tulang ikan cobia menghasilkan gelatin dengan rendemen sebesar 5,76% (bb) dengan pH 6,56. Karakteristik gelatin yang diperoleh adalah kadar air 11,35%, abu 0,75%, lemak 1,29%, dan protein sebesar 86,65%. Asam amino dengan komposisi terbesar yang menyusun gelatin tulang ikan cobia adalah glisina dan prolina. Analisis FTIR menunjukkan struktur α-helix pada bilangan gelombang amida I (1657 cm-1) dan III (1235 cm-1). Karakteristik proksimat dan pH gelatin tulang ikan cobia telah memenuhi standar GMIA.
Saran
15
DAFTAR PUSTAKA
Amiruldin M. 2007. Pembuatan dan Analisis Karakteristik Gelatin dari Tulang Ikan Tuna (Thunnus albacares). [Skripsi]. Bogor (ID): Program Studi Teknologi Industri Pertanian, Fakultas Teknologi Pertanian, Institut Pertanian Bogor.
Amiza MA & Aishah SD. 2011. Efeect of drying and freezing of cobia (Rachycentron canadum) skin its gelatine properties. International Food Research Journal 18: 159-166.
[AOAC] Association of Official Analytical Chemyst. 1995. Official Method of Analysis of The Association of Official Analytical of Chemist. Arlington, Virginia, USA : Published by The Association of Official Analytical Chemist, Inc.
Association of Official Analytical Chemyst. 2005. Official Method of Analysis of The Association of Official Analytical of Chemist. Arlington, Virginia, USA: Published by The Association of Official Analytical Chemist, Inc.
Bradford MM. 1976. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Analytical Biochemistry 72: 248-254.
Da Silva RSG, Bandeira SF, Petry FC, Pinto LAA. 2011. Effect of bone particle size of carp (Cyprinus carpio) heads in gelatine extraction. Vetor. Rio Grande 21(2): 34-43.
Gimenez B, Turnay J, Lizarbe MA, Montero P, Gomezz-Guillen. 2005. Use of lactic acid for extraxtion of fish skin gelatin. Food Hydrocollois 19(2005): 941-950.
[GMIA] Gelatine Manufacture’s Institute of America. 2012. Gelatine Handbook. New York, USA: Published by Gelatine Manufacture’s Institute of America, Inc.
Guillen MCG, Gimenez B, Caballero MEL, Montero MP. 2011. Functional and bioactive properties of collagen and gelatin from alternative sources. Food Hydrocolloids 25: 1813-1827.
Hafidz MR, Yaakob CM, Amin I, Noorfaizan A. 2011. Chemical and fuctional properties of bovine and porcine skin gelatin. International Food Research Journal 18(2011): 813-817.
Handayani S, Novianingsih I, Barkah A, Hudiyono S. 2012. Enzymatic synthesis of sucrose polyester as food emulsifier compound. Makara Journal of Science 16(3): 141-148.
Jamilah B, Harvinder KG. 2002. Properties of gelatin from skons black tilapia (Oreochromis mossambicus) and red tilapia (Oreochromis nilotica). Journal Food Chemistry 12(2002): 35-41.
Karim AA, Bhat R. 2009. Fish gelatin: properties, challenges, and prospects as an alternative to mamalian gelatins. Food Hydrocolloids 23(2009): 563-576. Kong J & Yu S. 2007. Fourier transform infrared spectroscopic analysis of protein
16
Liu HY, Han J, Guo SD. 2009. Characterics of the gelatin extracted from channel catfish (Ictalurus punctatus) head bones. Food Science Technology 42(2009). 540-544.
Muyonga JH, Cole CGB, Duodu KG. 2004. Fourier transform infrared (FTIR) spectroscopic study of acid soluble collagen and gelatin from skins and bones of young and adult Nile perch (Lates niloticus). Elsevier Food Chemistry 86(2004): 325-332.
Nagai T, Suzuki N. 1999. Emulsifying capacity of collagenous material-skin, bone and fins. Elsevier Food Chemistry 68(1999): 277-281.
Nurilmala M, Wahyuni M, Wiratmaja H. 2006. Perbaikan nilai tambah limbah tulang ikan tuna (Thunnus sp) menjadi gelatin serta analisis fisika kimia. Buletin Teknologi Hasil Perairan 9(2): 22-33.
Peranginangin R, Mulyasari, Sari A, Tazwir. 2005. Karakterisasi mutu gelatin yang diproduksi dari tulang ikan patin (Pangasius hypopthalmus) secara ekstraksi asam. Jurnal Penelitian Perikanan Indonesia 11(4): 34-49.
Puspitasari DAP, Bintoro VP, Setiani BE. 2013. The soaking effect on different hydrocloride acid level and soaking time on pH, swelling percentage and collagen yield of chicken shank bone. J. Indonesian Trop. Anim. Agric 38(2): 98-102.
Sanaei AV, Mahmoodani F, See SF, Yusop SM, Babji AS. 2013. Optimization of gelatin extraction and physico-chemical properties of catfish (Clarias gariepinus) bone gelatin. International Foof Research Journal 20(1): 423-430.
Sari IV, Wignyanto, Sunyoto NMS. 2012. Efisiensi penggandaan skala kapasitas bench pada produksi gelatin tulang ikan kakap merah (Lutjanus sp.). Jurnal Industria 2(2): 67-73.
Sebayang L. 2012. Perubahan kandungan asam lemak dan kolesterol ikan cobia (Rachycentron canadum) akibat pengukusan. [Skripsi]. Bogor (ID): Program Studi Teknologi Hasil Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor.
Tavakolipour H. 2011. Extraction and evaluation of gelatin from silver carp waste. World Journal of Fish and Marine Science 3(1): 10-15.
Wangtueai S, Noomhornm A. 2009. Processing optimization and characterization of gelatin from lizadfish (Saurida spp.) scales. Food Sci. Technol-LEB 42: 825-834.
Winarno FG. 2002. Kimia Pangan dan Gizi. Jakarta (ID): PT Gramedia Pustaka Utama.
Yang H, Wang Y, Jiang M, Jun-Hyun O, Herring J, Zhou P. 2007. 2-Step optimization of the extraction an subsequent physical properties of channer catfish (Ictalurus punctatus) skin gelatin. Journal Food Science 72(2007): 188-195.
18
20
Lampiran 1 Kurva regresi linier standar BSA
Lampiran 2 Hasil uji anova nilai konsentrasi protein larutan NaOh sisa perendaman tulang
Source Jumlah
kuadrat
Db Kuadrat tengah
F Nilai-p
Waktu perendaman 1,321 5 0,264 4178,697 0,000
Intercept 13,137 1 13,137 207851,193 0,000
Galat 0,000 6 6,320
Total 14,458 12
Lampiran 3 Hasil uji DMRT pengaruh lamanya perendaman terhadap konsentrasi protein larutan sisa perendaman tulang
Lamanya perendaman N Rata-rata konsentrasi protein terlarut
(mg/mL)
Notasi
T5 2 0,5317 A
T6 2 0,7778 B
T4 2 1,0000 C
T3 2 1,1032 D
T2 2 1,3333 E
21