POTENSI BUDIDAYA RUMPUT LAUT
Kappaphycus alvarezii DAN Gracilaria gigas
DALAM PENYERAPAN KARBON
ERLANIA
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI DISERTASI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa tesis berjudul Potensi Budidaya Rumput Laut Kappaphycus alvarezii dan Gracilaria gigas dalam Penyerapan Karbon adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
RINGKASAN
ERLANIA. Potensi Budidaya Rumput Laut Kappaphycus alvarezii dan Gracilaria gigas dalam Penyerapan Karbon. Dibimbing oleh KUKUH NIRMALA dan DINAR TRI SOELISTYOWATI.
Pengikatan karbon oleh algae yang merupakan organisme fotoautotrofik, berpotensi untuk mengurangi pelepasan CO2 ke atmosfer dan dapat membantu mengurangi kecenderungan terjadinya pemanasan global. Penelitian ini bertujuan untuk menganalisis tingkat penyerapan karbon pada budidaya rumput laut Kappaphycus alvarezii dan Gracilaria gigas berdasarkan aktivitas fotosintesis serta variabel-variabel yang mempengaruhinya, serta menganalisis potensi penyerapan karbon oleh kawasan budidaya rumput laut. Budidaya rumput laut dilakukan dengan metode long-line di perairan Teluk Gerupuk, Lombok Tengah, Nusa Tenggara Barat pada satu unit long-line dengan luas area budidaya 2.500 m2. Selama penelitian, dilakukan pengujian terhadap sampel rumput laut dan sampel air laut dari lokasi budidaya yang diambil pada hari ke-0, 10, 20, 30 dan 45. Parameter uji yang diamati pada rumput laut yaitu laju pertumbuhan, laju penyerapan karbon, produksi karbohidrat, kandungan pigmen fotosintesis, produktivitas budidaya, dan indeks percabangan. Parameter kualitas air yang diukur adalah suhu, salinitas, oksigen terlarut, pH, total padatan terlarut, CO2 total, NO3-N, NO2-N, NH3-N, PO4-P, kecerahan dan kecepatan arus.
Laju penyerapan karbon total berdasarkan biomassa panen pada G. gigas (20,67 ton C/ha/tahun) mencapai 335,79% lebih tinggi dibandingkan K.alvarezii (90,09 ton C/ha/tahun). Selain itu, laju pertumbuhan dan produksi karbohidrat pada G. gigas juga lebih tinggi, yang mengindikasikan laju fotosintesis yang lebih tinggi, dan didukung oleh indeks percabangan yang juga lebih tinggi. Laju penyerapan karbon oleh rumput laut memiliki korelasi positif tertinggi dengan faktor internal rumput laut yaitu kandungan pigmen, dan faktor eksternal yaitu kecerahan perairan. Potensi penyerapan karbon oleh kawasan budidaya rumput laut di perairan Teluk Gerupuk mencapai 6.656,51 ton C/tahun untuk budidaya K. alvarezii atau 0,36 ton C/ton biomassa panen; dan 29.008,53 ton C/tahun atau 0,58 ton C/ton biomassa panen untuk budidaya G. gigas. Besarnya potensi penyerapan karbon oleh budidaya rumput laut, dapat dijadikan sebagai salah satu alternatif dalam pengelolaan budidaya rumput laut yang berkelanjutan. Strategi budidaya rumput laut disesuaikan berdasarkan segmen umur dengan laju penyerapan karbon tertinggi, yaitu pada umur pemeliharaan 0 – 20 hari dengan cara melakukan peremajaan, sehingga lebih efektif dalam penyerapan karbon dan peningkatan produktivitas budidaya rumput laut.
SUMMARY
ERLANIA. Potency of Seaweeds Aquaculture Kappaphycus alvarezii and Gracilaria gigas in Carbon Sequestration. Supervised by KUKUH NIRMALA and DINAR TRI SOELISTYOWATI.
Carbon sequestration by algae as photoautotrophic organism is potential to reduce CO2 released to the atmosphere, and support to reduce the inclination of global warming. The aim of this study was to analyzed the level of carbon sequestration by seaweed aquaculture of Kappaphycus alvarezii and Gracilaria gigas based on photosynthesis activity included influential variabels, and also analyzed potency of carbon sequestration by seaweed aquaculture area. Seaweed cultivation was conducted at Gerupuk Bay, Central Lombok, West Nusa Tenggara on long-line system with culture area of 2.500 m2. The seaweeds and sea water parameters were analysed on days-0, 10, 20, 30 and 45. Seaweeds parameters was observed included daily growth rate, carbon absorption rate, carbohydrate production, photosynthesis pigment content, aquaculture productivity, and branching index. Water quality parameters was analyzed included temperature, salinity, dissolved oxygen, pH, total dissolved solid, total CO2, NO3-N, NO2-N, NH3-N, PO4-P, transparency and current velocity.
Total rate of carbon sequestration based on biomass seaweeds harvesting at the end of cultivation that showed G. gigas (20,67 ton C/ha/year) was almost 335,79% higher than K. alvarezii (90,09 ton C/ha/year), and also higher daily growth rate, carbohydrates production, and photosynthesis rate that supported by higher branching index. The rate of carbon absorption by seaweeds had the highest positive correlation with pigment content as internal factor of seaweeds, as well as water transparency as external factor. Potency of carbon sequestration by seaweeds aquaculture area in Gerupuk Bay reached 6.656,51 tons C/year or 0,36 ton C/ton biomass for K. alvarezii; and 29.008,53 tons C/year or 0,58 ton C/ton biomass for G. gigas cultivation. High potency of carbon sequestration of seaweeds aquaculture could be an alternative of sustainable seaweed aquaculture management. Strategy of seaweeds cultivation might applied based on the highest carbon absorption rate on days 0 – 20 by getting rejuvenation, so that more effective in carbon sequestration as well as increasing of seaweed aquaculture productivity.
© Hak Cipta Milik IPB, Tahun 2013
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Ilmu Akuakultur
POTENSI BUDIDAYA RUMPUT LAUT
Kappaphycus alvarezii DAN Gracilaria gigas
DALAM PENYERAPAN KARBON
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
Judul Tesis : Potensi Budidaya Rumput Laut Kappaphycus alvarezii dan Gacilaria gigas dalam Penyerapan Karbon
Nama : Erlania
NIM : C151110051
Disetujui oleh Komisi Pembimbing
Dr Ir Kukuh Nirmala, MSc Ketua
Dr Ir Dinar Tri Soelistyowati, DEA Anggota
Diketahui oleh
Ketua Program Studi Ilmu Akuakultur
Prof Dr Ir Enang Harris, MS
Dekan Sekolah Pascasarjana
Dr Ir Dahrul Syah, MSc Agr
PRAKATA
Puji dan syukur kepada Allah SWT atas segala rahmat-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan pada bulan Juli - Agustus 2012 ini ialah penyerapan karbon oleh rumput laut, dengan judul Potensi Budidaya Rumput Laut Kappaphycus alvarezii dan Gracilaria gigas dalam Penyerapan Karbon.
Ungkapan terima kasih disampaikan kepada:
1. Komisi pembimbing Bapak Dr Ir Kukuh Nirmala, MSc dan Ibu Dr Ir Dinar Tri Soelistyowati, DEA atas bimbingan, kebijaksanaan dan motivasi yang telah diberikan kepada penulis
2. Bapak Prof Dr Ir Enang Harris, MS sebagai dosen penguji luar komisi dan Bapak Dr Dedi Jusadi sebagai dosen penguji dari Program Studi Ilmu Akuakultur atas saran dan masukan yang diberikan untuk tesis ini
3. Kementerian Kelautan dan Perikanan yang telah memberikan beasiswa Program Pascasarjana
4. Bapak Dr Ir I Nyoman Radiarta, MSc dan Bapak Dr Anang H. Kristanto atas masukan, saran dan dukungan dalam pelaksaanaan penelitian
5. Bapak Ir. Ujang Komarudin A.K., MSc sebagai Kepala Balai dan Bapak Rusman H., SPi MSi sebagai Koordinator Kegiatan Rumput Laut pada Balai Budidaya Laut Lombok, serta Bapak Ir Buntaran, MSi beserta staf National Seaweed Center Gerupuk, Lombok Tengah yang telah membantu selama pelaksanaan penelitian dan pengumpulan data.
6. Kedua orang tua tercinta Ayahanda Drs Idrial Idris dan Ibunda Susiyanti, serta seluruh keluarga, atas segala doa dan kasih sayangnya
7. Suamiku Kurniawan, SPi dan anakku tersayang Athaya Hazel Elwana atas kesetiaan dan kesabaran selama penulis melaksanakan studi
8. Teman-teman AKU 2011 dan TEK 2012 atas bantuan dan dukungan yang diberikan.
Tesis ini diharapkan memberikan informasi baru bagi perkembangan ilmu pengetahuan. Semoga karya ilmiah ini bermanfaat.
DAFTAR ISI
DAFTAR TABEL x
DAFTAR GAMBAR x
DAFTAR LAMPIRAN xi
1 PENDAHULUAN 1
Latar Belakang 1
Perumusan Masalah 3
Tujuan Penelitian 3
Manfaat Penelitian 3
2 TINJAUAN PUSTAKA 4
Rumput Laut Kappaphycus alvarezii dan Gracilaria gigas 4
Keragaan BudidayaRumput Laut 5
Fotosintesis padaRumput Laut 6
Karbondioksida (CO2) dan Perubahan Iklim 10
Blue carbon dan Peranan Ekosistem Laut dalam Penyerapan Karbon 11
3 METODE 13
Waktu dan Lokasi Penelitian 13
Materi Uji 13
Rancangan Penelitian 14
Prosedur Penelitian 14
Budidaya rumput laut 14
Teknik pengambilan sampel rumput laut 15
Pengukuran parameter kualitas air 16
Pengumpulan data sekunder 16
Parameter Uji 17
Analisis Data 19
4 HASIL DAN PEMBAHASAN 20
Hasil Penelitian 20
Pertumbuhan dan produktivitas budidaya rumput laut 20
Karbohidrat pada rumput laut 21
Penyerapan karbon oleh rumput laut 22
Kandungan pigmen pada rumput laut 24
Indeks percabangan 25
Rasio C:N:P rumput laut 25
Hubungan laju penyerapan karbon dengan lingkungan budidaya
rumput laut 26
Kondisi klimatologi lokasi penelitian 29
Pembahasan 31
Penyerapan karbon berdasarkan aktivitas fotosintesis pada
rumput laut K. alvarezii dan G. gigas 32
Hubungan parameter lingkungan perairan dengan tingkat
penyerapan karbon pada budidaya rumput laut 36 Potensi penyerapan karbon pada kawasan budidaya rumput laut di
perairan Teluk Gerupuk, Lombok 38
Strategi budidaya rumput laut berkelanjutan dalam konteks
mitigasi perubahan iklim 40
5 SIMPULAN DAN SARAN 43
Simpulan 43
Saran 43
DAFTAR PUSTAKA 44
LAMPIRAN 49
RIWAYAT HIDUP 66
DAFTAR TABEL
1 Metode analisa parameter uji rumput dan kualitas air 16 2 Parameter budidaya rumput laut K.alvarezii dan G. gigas yang diamati
pada akhir masa pemeliharaan 21
3 Laju penyerapan karbon dan jumlah serapan karbon total oleh rumput laut K.alvarezii dan G. gigas pada akhir masa pemeliharaan 24 4 Indeks percabangan rumput laut yang diamati pada akhir masa
pemeliharaan 25
5 Rasio C:N:P, C:N, C:P dan N:P pada rumput laut K. alvarezii dan G.
gigas pada setiap umur pemeliharaan 25
DAFTAR GAMBAR
1 Struktur molekul pigmen fotosintesis klorofil-a dan fikoeritrin
(fikoeritrobilin) 9
2 Lokasi penelitian di Teluk Gerupuk, Lombok Tengah, Provinsi Nusa
Tenggara Barat 13
3 Sistem budidaya rumput laut dengan metode long-line, (a) tampak atas,
(b) tampak samping 15
4 Pertambahan biomassa dan laju pertumbuhan harian K. alvarezii dan
G.gigas pada setiap umur pemeliharaan 20
5 Kandungan karbohidrat dan produksi karbohidrat per m2 area budidaya rumput laut K. alvarezii dan G. gigas pada setiap umur pemeliharaan 21 6 Laju penyerapan karbon pada rumput laut K. alvarezii dan G. gigas pada
7 Jumlah serapan karbon oleh rumput laut K. alvarezii dan G. gigas berdasarkan biomassa produksi budidaya pada setiap segmen umur
pemeliharaan 23
8 Kandungan pigmen klorofil-a dan fikoeritrin rumput laut K. alvarezii
dan G. gigas pada setiap umur pemeliharaan 24
9 Dendogram hubungan inter-variabel penyerapan karbon oleh rumput
laut dengan variabel yang mempengaruhinya 26
10 Scree plot hasil analisis komponen utama dari variabel-variabel laju
penyerapan karbon oleh rumput laut 27
11 Loading plot dari dua komponen utama pertama yang menjelaskan 73.81% keragaman total dari seluruh variabel yang diamati 28 12 Nilai korelasi antara laju penyerapan karbon oleh rumput laut dengan
variabel-variabel yang mempengaruhinya 29
13 Kondisi klimatologi (suhu udara, kecepatan angin dan curah hujan) lokasi penelitian pada tahun 2012. Garis merah merupakan kisaran
waktu pelaksanaan penelitian 30
14 Laju penyerapan karbon oleh berbagai komoditas pada ekosistem alami 41
DAFTAR LAMPIRAN
1 Pertambahan bobot per titik tanam dan laju pertumbuhan harian rumput
laut pada setiap waktu pengamatan 49
2 Persentase kandungan karbohidrat dan produksi karbohidrat per m2 area
budidaya rumput laut 50
3 Persentase kandungan karbon dan laju penyerapan karbon oleh rumput
laut K. alvarezii dan G. gigas 51
4 Nilai absorbansi pada analisa kandungan pigmen klorofil-a dan fikoeritrin rumput laut K. alvarezii dan G. gigas 53 5 Kandungan total nitrogen dan total fosfat rumput laut K. alvarezii dan
G. gigas 54
6 Kisaran nilai parameter kualitas perairan selama pelaksanaan penelitian 54 7 Analisis ragam pertambahan bobot rumput laut berdasarkan perbedaan
spesies 55
8 Analisis ragam pertambahan bobot rumput laut berdasarkan perbedaan
umur pemeliharaan 55
9 Analisis ragam laju pertumbuhan harian rumput laut berdasarkan
perbedaan spesies 56
10 Analisis ragam laju pertumbuhan harian rumput laut berdasarkan
perbedaan umur pemeliharaan 56
11 Analisis ragam produksi karbohidrat rumput laut berdasarkan
perbedaan spesies 57
12 Analisis ragam produksi karbohidrat rumput laut berdasarkan
perbedaan umur pemeliharaan 57
13 Analisis ragam kandungan karbohidrat rumput laut berdasarkan
perbedaan spesies 58
14 Analisis ragam kandungan karbohidrat rumput laut berdasarkan
15 Analisis ragam laju penyerapan karbon oleh rumput laut berdasarkan
perbedaan spesies 59
16 Analisis ragam laju penyerapan karbon oleh rumput laut berdasarkan
perbedaan umur pemeliharaan 59
17 Analisis ragam jumlah serapan karbon berdasarkan perbedaan spesies 60 18 Analisis ragam jumlah serapan karbon berdasarkan perbedaan umur
pemeliharaan 60
19 Analisis ragam kandungan pigmen pada rumput laut berdasarkan
perbedaan spesies 61
20 Analisis ragam kandungan pigmen pada rumput laut berdasarkan
perbedaan umur pemeliharaan 61
21 Analisis cluster laju penyerapan karbon oleh rumput laut dan
variabel-variabel yang mempengaruhinya 62
22 Analisis komponen utama laju penyerapan karbon oleh rumput laut dan
1 PENDAHULUAN
Latar Belakang
Karbondioksida (CO2) merupakan salah satu gas rumah kaca (green house gas/GHG) terpenting yang dihasilkan dari aktivitas manusia, yaitu 77% dari total emisi GHG antropogenik pada tahun 2004. Laju peningkatan tahunan dari konsentrasi CO2 di atmosfir secara global semakin besar dalam kurun waktu 10 tahun terakhir (1995 – 2005) yaitu rata-rata 1,9 ppm/tahun (IPCC 2007). Terjadinya peningkatan emisi gas CO2 dan GHG lainnya ke atmosfir secara terus-menerus telah berkontribusi pada terjadinya perubahan iklim (Nellemann et al. 2009).
IPCC (2007) mendefinisikan perubahan iklim (climate change) sebagai suatu perubahan kondisi iklim yang dapat teridentifikasi, melalui perubahan rata-rata atau perubahan sifatnya dalam jangka waktu yang panjang, misalnya satu dekade atau lebih. Faktor yang menjadi pemicu terjadinya perubahan iklim dapat berupa faktor alamiah maupun aktivitas manusia (antropogenik) yang menyebabkan peningkatan emisi GHG ke atmosfir yang berdampak pada terjadinya kenaikan suhu permukaan bumi. Faktor alamiah diantaranya yaitu kebakaran hutan dan aktivitas gunung berapi, sedangkan aktivitas manusia yang utama berupa kegiatan transportasi dan industri. Sub sektor akuakultur saat ini juga diposisikan sebagai salah satu aktivitas manusia yang ikut menyumbang emisi GHG CO2 antropogenik ke atmosfir, walaupun besarannya belum diketahui secara kuantitatif. Sementara itu, rumput laut sebagai salah satu komoditas akuakultur berpotensi untuk menyerap karbon, yang dimanfaatkan dalam proses fotosintesis untuk pertumbuhan dan produksi biomassanya. Hal ini dibuktikan oleh hasil penelitian Muraoka (2004) yang menunjukkan bahwa berbagai spesies rumput laut yang hidup secara alami pada perairan pantai di Jepang mampu menyerap karbon sebesar 2.669 ton C/tahun dengan luas area 2.012 km2, dengan rata-rata laju penyerapan sebesar 13,27 ton C/ha/tahun, yang setara dengan 48,66 ton CO2/ha/tahun.
Berbagai upaya mitigasi terhadap perubahan iklim telah dilakukan oleh berbagai sektor, termasuk sektor Kelautan dan Perikanan. Salah satu langkah yang telah diambil oleh Kementerian Kelautan dan Perikanan terkait upaya mitigasi tersebut adalah penanaman vegetasi pantai yang dapat mengurangi konsentrasi CO2 di atmosfer (Aldrian et al. 2011). Sejauh ini upaya mitigasi yang umumnya dilakukan lebih cenderung berbasis ekosistem (ecosystem based).
terutama adalah Kappaphycus alvarezii yang merupakan jenis utama dari komoditas ekspor rumput laut Indonesia sebagai penghasil karaginan.
Pengikatan karbon oleh algae yang merupakan organisme fotoautotrofik berpotensi untuk mengurangi pelepasan CO2 ke atmosfer dan dapat membantu mengurangi kecenderungan terjadinya pemanasan global (Kaladharan 2009).
Rumput laut atau makroalgae termasuk salah satu vegetasi pantai yang merupakan penyerap karbon (carbon sink) yang sangat baik jika dibandingkan dengan tumbuhan terestrial. Untuk pertumbuhan dan perkembangannya, rumput laut melakukan proses fotosintesis dengan memanfaatkan CO2 dan energi cahaya yang dikonversi menjadi karbohidrat. Meskipun faktor-faktor yang dibutuhkan untuk pertumbuhan rumput laut tergolong sederhana (nutrien, trace mineral, air CO2 dan cahaya matahari) dan relatif sama dengan tumbuhan terestrial, namun kelompok algae ini dapat memanfaatkannya dengan sangat efisien sehingga menghasilkan produktivitas yang tinggi (Packer 2009). Menurut Dawes (1981) terdapat empat faktor fisik yang paling berpengaruh terhadap laju fotosintesis pada rumput laut yaitu intensitas cahaya, temperatur, salinitas dan kondisi kekeringan akibat mekanisme pasang-surut. Selain itu, produktivitas algae juga dipengaruhi oleh kompleksitas morfologi; algae dengan morfologi yang kompleks memiliki produktivitas yang lebih rendah dibandingkan yang berbentuk lembaran.
Hasil penelitian Kaladharan (2009) memperlihatkan bahwa Gracilaria corticata (alga merah) dan Sargassum polycystum (alga coklat) mampu memanfaatkan 100% CO2 terlarut untuk fotosintesis dengan peningkatan konsentrasi CO2 5 mg/L lebih tinggi dibandingkan kondisi di lingkungan asalnya. Sedangkan Ulva lactuca (alga hijau) memanfaatkan 100% CO2 terlarut hingga konsentrasi 15 mg/L melebihi kondisi lingkungan asalnya. Selain itu, hasil uji terhadap beberapa spesies mikroalgae memperlihatkan kemampuan memanfaatkan CO2 terlarut hanya pada perlakuan konsentrasi 15 mg/L, yaitu sebesar 27,7%; sedangkan pada konsentrasi lebih tinggi atau lebih rendah tidak menunjukkan adanya pengaruh terhadap fiksasi carbon.
Perumusan Masalah
Rumput laut merupakan tumbuhan fotoautotrofik yang melakukan aktivitas fotosintesis untuk menghasilkan bahan organik dari bahan anorganik. Proses fotosintesis memanfaatkan karbondioksida dan air, dengan bantuan energi dari cahaya matahari serta molekul klorofil, untuk menghasilkan senyawa karbohidrat dan oksigen. Besarnya jumlah karbondioksida yang diserap dalam proses fotosintesis mengindikasikan tingginya aktivitas atau laju fotosintesis. Parameter yang dapat mengindikasikan laju fotosintesis antara lain adalah kandungan pigmen fotosintesis, pertambahan biomassa, dan kandungan karbohidrat yang dihasilkan sebagai produk akhir dari proses fotosintesis. Namun demikian, laju fotosintesis juga dipengaruhi oleh berbagai faktor, baik faktor eksternal maupun faktor internal dari rumput laut sendiri.
Kemampuan rumput laut dalam menyerap karbondioksida melalui proses fotosinntesis dapat menjadi manfaat tambahan dari kegiatan budidaya rumput laut yang utamanya berorientasi pada keuntungan (profit oriented). Terjadinya peningkatan konsentrasi karbondioksida pada lingkungan, seyogyanya menyebabkan peningkatan aktivitas fotosintesis, sehingga meningkatnya laju pertumbuhan dan produksi dari budidaya rumput laut. Semakin besar produksi budidaya rumput laut, berarti semakin besar pula jumlah karbon yang diserap dan disimpan (sequestered) dalam biomassa panen rumput laut, sehingga secara tidak langsung budidaya rumput laut berperan dalam penyerapan karbon terkait mitigasi terhadap perubahan iklim.
Tujuan Penelitian
Penelitian ini bertujuan untuk :
1. Menganalisis tingkat penyerapan karbon oleh rumput melalui aktivitas fotosintesis berdasarkan pigmen dan produk fotosintesis yang dihasilkan 2. Mengidentifikasi dan menganalisis faktor lingkungan yang mempengaruhi
tingkat penyerapan karbon pada budidaya rumput laut
3. Menganalisis tingkat penyerapan karbon pada kawasan budidaya rumput laut
Manfaat Penelitian
2 TINJAUAN PUSTAKA
Rumput Laut Kappaphycus alvarezii dan Gracilaria gigas
Kappaphycus alvarezii dan Gracilaria gigas termasuk dalam kelompok algae merah (Rhodophyta), yang memiliki pigmen asesori utama fikoeritrin yang memberikan warna merah, bahkan seringkali menutupi klorofil-a secara menyeluruh (Bold & Wynne 1985). Pemanfaatan utama dari kelompok alga merah ini adalah sebagai makanan dan sumber dari dua senyawa hidrokoloid, yaitu agar dan karaginan.
K. alvarezii hidup pada habitat pasang surut, rataan terumbu karang dan menempel pada substrat yang keras. Talus lunak seperti tulang rawan, warna merah-coklat, berbentuk silindris, percabangan tidak teratur, dikhotomous, mempunyai duri yang pendek (Soekendarsi et al. 2004). Sebelum berganti nama menjadi K. alvarezii, secara taksonomi jenis alga ini lebih dikenal dengan nama spesies Eucheuma cottonii. Klasifikasi taksonomi dari spesies ini adalah sebagai berikut (Dawes 1981, Bold & Wynne 1985, Lüning 1990, Soekendarsi et al.
Spesies : Kappaphycus alvarezii (Doty)
Budidaya rumput laut jenis Kappaphycus pertama kali diperkenalkan di Filipina sekitar tahun 1970-an, yang pada saat itu memberikan manfaat besar berupa peningkatan suplai bahan baku bagi industri karaginan. Keuntungan lebih lanjut menunjukkan bahwa salah satu spesies dari genus ini mengandung tipe karaginan tertentu, yaitu kappa-karginan yang kandungannya bersifat hampir eksklusif pada jenis rumput laut tersebut (McHugh 2003). K. alvarezii bernilai ekonomis karena kandungan karaginannya yang tinggi (Bold & Wynne 1985) yang banyak digunakan pada industri kosmetik, makanan dan obat-obatan. Spesies ini merupakan salah satu jenis rumput laut yang saat ini banyak dibudidayakan di perairan Indonesia.
Gracilaria hidup pada substrat kulit kerang, pecahan koral dan batu karang pada perairan dengan dasar berpasir di bawah area pasang surut (Terada & Ohno 2000, Hirotoshi 1978). Genus Gracilaria pada umumnya memiliki struktur percabangan talus dengan satu poros (uniaxial), dan biasanya talus memiliki cabang yang sangat banyak (Bold & Wynne 1985). Namun Terada & Ohno (2000) menyebutkan bahwa G. gigas memiliki struktur percabangan talus yang bersifat multiaxial. Talusnya bersifat kaku, diameter 0,5 – 1,0 mm, berwarna merah gelap hingga kecoklatan (FAO/NACA 1996). Menurut Dawes (1981), Bold & Wynne (1985), Lüning (1990) dan Terada & Ohno (2000), secara taksonomi Gracilaria gigas diklasifikasikan sebagai berikut:
Subkelas : Florideophycidae Ordo : Gigartinales Famili : Gracilariaceae Genus : Gracilaria
Spesies : Gracilaria gigas (Harvey)
Gracilaria gigas termasuk salah satu spesies yang yang umumnya dibudidayakan di tambak karena kandungan agarnya, sehingga spesies ini digolongkan pada kelompok agarofit. Pada awalnya perkembangan industri agar, Gracilaria hanya dikumpulkan dari alam dengan tujuan untuk menutupi keterbatasan suplai dari jenis rumput yang dinggap sebagai penghasil utama agar, yaitu Gelidium. Namun karena kebutuhan akan spesies ini semakin meningkat, maka di Chili dikembangkan teknik budidayanya baik di tambak maupun di perairan laut khususnya pada lokasi teluk tertutup. Teknik budidaya tersebut yang kemudian menyebar ke berbagai negara seperti Cina, Korea, Indonesia, Namibia, Filipina dan Vietnam yang diaplikasikan untuk spesies asli Gracilaria dari masing-masing negara tersebut (McHugh 2003). Berbagai studi telah dilakukan terhadap Gracilaria terkait budidaya dan produksi agar yang dihasilkan; namun aspek yang paling menarik dari Gracilaria adalah laju pertumbuhan yang tinggi, toleransi yang luas terhadap lingkungan, kemamuan dalam menyerap nutrien N dan P yang tinggi, serta keanekaragaman spesiesnya yang tersebar di perairan berperan sebagai penyerap karbon yang sangat baik. Budidaya rumput laut sangat potensial untuk dikembangkan, karena terdapat beberapa kelebihan dibandingkan dengan budidaya komoditas perikanan lainnya. Teknologi yang digunakan dalam budidaya rumput tergolong sederhana, tidak membutuhkan biaya produksi yang tinggi (seperti biaya pakan pada budidaya ikan), waktu pemeliharaan yang relatif singkat serta kegiatan budidayanya bersifat ramah lingkungan.
diprediksi, kurangnya kandungan nutrien di perairan, serta serangan hama, penyakit ice-ice dan ikan-ikan pemakan rumput laut (Neis 2003).
Merebaknya penyakit udang pada awal tahun 1980 di Sulawesi Selatan menyebabkan banyaknya lahan tambak yang tidak operasional. Hal ini merupakan awal dimulainya budidaya Gracilaria di lahan tambak yang dilakukan pada skala komersil di Indonesia (Hussain 1989). Hingga saat ini usaha budidaya Gracilaria lebih banyak dilakukan di lahan tambak; selain memudahkan pengontrolan juga untuk dibudidayakan secara terpadu dengan udang (polikultur). Penerapan aktivitas budidaya Gracilaria di tambak udang juga diharapkan dapat meningkatkan efisiensi penggunaan lahan untuk memanfaatkan relung (niche) yang tersedia di tambak (Widyorini 2010).
Produksi rumput laut Indonesia hingga saat ini masih terus mengalami peningkatan. Pada tahun 1999 volume produksi rumput laut sebesar 133.720 ton, dan terus meningkat hingga mencapai 1.485.654 ton pada tahun 2007 (MMAF-JICA 2009). Pengembangan program industrialisasi kelautan dan perikanan, khususnya untuk komoditas rumput laut saat ini didukung oleh ketersediaan potensi wilayah yang cukup besar yang tersebar pada 15 provinsi di seluruh Indonesia, dengan total luas area mencapai 1.381.332 hektar (MMAF-JICA 2010). Menurut Lucas & Southgate (2003), total produksi rumput laut dunia mencapai 9,5 juta ton pada tahun 1999, yang merupakan 22% dari total produksi akuakultur dunia.
...)
Fotosintesis pada Rumput Laut
Fotosintesis merupakan proses metabolisme yang menggunakan energi cahaya tampak (visible light energy) untuk mengkonversi karbon anorganik (dalam bentuk CO2) dan air menjadi karbon organik (dalam bentuk karbohidrat) dan molekul oksigen (O2) (Diaz-Pulido & McCook 2008) dengan reaksi sebagai berikut :
n CO2+2n H2O+ energi matahari
klorofil CH2O n+n O2+n H2O
Berdasarkan reaksi tersebut, peningkatan konsentrasi CO2 seharusnya dapat meningkatkan produktivitas biologis dengan harapan terjadinya peningkatan penyimpanan karbon fotosintetik dan juga laju pertumbuhan yang lebih tinggi pada berbagai jenis tanaman.
Fotosintesis melibatkan ratusan reaksi kimia, dimana produk dari satu reaksi kimia akan menjadi reagen untuk reaksi berikutnya, dan laju fotosintesis secara keseluruhan dapat dibatasi oleh salah satu reaksi yang terjadi (Byrne, 1998). Proses fotosintesis secara keseluruhan terdiri dari dua fase yang berbeda, yaitu fase terang (light dependent stages/LDS) dan fase gelap (light independent stages/LIS) (Pace 2005, Byrne 1998).
Menurut Pace (2005), pada fase terang, energi cahaya diserap oleh antena dari molekul klorofil yang berada di dalam membran sel khusus (thylakoids) dan ditransfer ke pusat reaksi klorofil. Disini reaksi elektrokimia dimulai, yang menghasilkan dua senyawa biologis vital yang kaya energi, yaitu ATP (adenosine triphosphate) dan NADPH (nikotinamid adenin dinukleotida fosfat). Oksigen dihasilkan sebagai produk sampingan dari proses tersebut dan dilepaskan ke atmosfir. Pada fase gelap, produk yang dihasilkan pada fase terang yaitu ATP dan NADPH digunakan di dalam sel untuk pembentukan karbohidrat atau zat gula dari karbondioksida melalui serangkaian reaksi biokimia lanjutan. Byrne (1998) menyatakan bahwa intensitas cahaya dibutuhkan untuk proses fotolisis dan eksitasi elektron, dimana kedua proses tersebut terjadi pada fase terang di dalam tilakoid. Jika intensitas cahaya meningkat, maka demikian juga dengan laju fotofosforilasi, baik yang bersifat siklik maupun non-siklik, sehingga produksi NADPH dan ATP juga meningkat. Selanjutnya kedua produk tersebut akan keluar dari tilakoid menuju stroma dan digunakan pada fase gelap.
Sejumlah karakter lingkungan perairan dapat mempengaruhi laju fotosintesis pada rumput laut. Beberapa faktor utama yang paling berpengaruh nyata terhadap laju fotosintesis rumput laut, yaitu intensitas cahaya, temperatur dan salinitas (Dawes 1981, Raikar et al. 2001) serta dessication atau kekeringan akibat perubahan kondisi pasang-surut (Dawes 1981). Menurut Byrne (1998) dan Dawes (1981), temperatur berpengaruh terhadap laju aktivitas enzim. Secara umum, selama temperatur tidak menyebabkan terjadinya denaturasi enzim, maka peningkatan temperatur akan menyebabkan terjadinya peningkatan aktivitas enzim, sehingga diharapkan juga akan meningkatkan laju fotosintesis. Dalam hal ini peningkatan temperatur memberikan pengaruh yang lebih besar dalam mempercepat reaksi pada fase gelap dari pada pengaruhnya dalam mempercepat reaksi fase terang. Oleh karena itu produk yang dihasilkan pada fase terang tidak akan mampu memenuhi kebutuhan dari fase gelap. Dengan kata lain laju fotosintesis secara keseluruhan akan dibatasi oleh suplai NADPH ataupun ATP.
karbohidrat, sedangkan spektrum cahaya biru memicu peningkatan sintesis protein, respirasi dan aktivasi enzim.
Rumput laut, sebagaimana tumbuhan darat dan fitoplankton memiliki kemampuan adaptasi terhadap perubahan intensitas cahaya dengan penyesuaian kandungan pigmen dan aktivitas fotosintesis, yang dikenal dengan photoacclimation (Lüning 1990). Pada kondisi intensitas cahaya rendah, kandungan pigmen yang lebih tinggi dibutuhkan untuk meningkatkan peluang terserapnya foton oleh antena molekul dari fotosistem; pada kondisi intensitas cahaya tinggi, kandungan pigmen harus lebih rendah untuk menghindari terjadinya photodamage (kerusakan akibat paparan sinar matahari) dan photoinhibition (penurunan laju fotosintesis karena penghambatan oleh intensitas cahaya tinggi yang dapat menyebabkan kerusakan pigmen fotosintesis) (Alves et al. 2002, Lüning 1990). Konsekuensi dari terjadinya photoinhibition diantaranya adalah penurunan efisiensi dari kuantum maksimum penyerapan CO2 dan pelepasan O2, penurunan aktivitas fotokimia dari fotosistem II, serta penurunan laju fotosintesis (Alves 2002).
Perubahan kondisi lingkungan akibat terjadinya mekanisme pasang surut juga mempengaruhi proses fisiologis pada rumput laut. Beberapa penelitian menunjukkan bahwa spesies algae intertidal secara fotosintetik lebih aktif pada kondisi surut, karena terekspos oleh intesitas cahaya yang lebih tinggi (Dawes 1981). Akan tetapi jenis algae tertentu mengalami penurunan laju fotosintesis pada saat kekeringan, dan akan normal lagi ketika sudah terendam air kembali (reimmersion). Namun, jika fotosintesis tidak mencapai laju optimum setelah reimmersion, maka kondisi tersebut tidak akan pulih kembali dan tanaman akan segera mati (Lüning 1990).
Menurut Dawes (1981) terdapat berbagai mekanisme toleransi struktur dan fisiologi pada algae terhadap perubahan salinitas. Proses osmoregulasi dapat terjadi dengan berbagai cara, melalui penggunaan asam amino maupun karbohidrat. Asam amino yang umumnya berhubungan dengan proses osmoregulasi adalah asam amino yang terkait dengan proses glikolisis dan enzim pada siklus krebs. Jika algae diberi perlakuan salinitas yang lebih rendah, maka asam amino bebas akan keluar dari sel, sehingga menyebabkan osmolaritas sel menjadi lebih rendah. Menurut Lüning (1990) organisme laut terekspos pada tekanan osmotik 2 MPa (20 bar) terkait kondisi lingkungan dengan salinitas 30‰. Untuk menjaga tekanan turgor selnya, algae harus mengembangkan mekanisme adaptasinya untuk menjaga agar tekanan osmotik di dalam selnya sedikit lebih tinggi dari pada lingkungannya. Peningkatan atau penurunan salinitas secara tiba-tiba mengakibatkan terjadinya aliran air mengikuti gradien osmotik, serta menyebabkan tekanan turgor berubah-ubah yang dapat membahayakan algae; karena stabilitas, bentuk dan pertumbuhan algae tergantung pada tekanan turgor yang konstan. Untuk itu, algae mengembalikan kondisi tekanan turgornya melalui pengaturan osmotik atau dikenal dengan osmoacclimation.
-adalah 2 mM, sedangkan CO2 hanya 10 µM; dan hasil penelitian menunjukkan makroalga Chondrus crispus cenderung menyerap CO2 daripada HCO3. Proses difusi CO2 pada proses fotosintesis terjadi berdasarkan gradien konsentrasi, yang masuk melalui epidermis menuju kloropas (Rychter & Rao 2005).
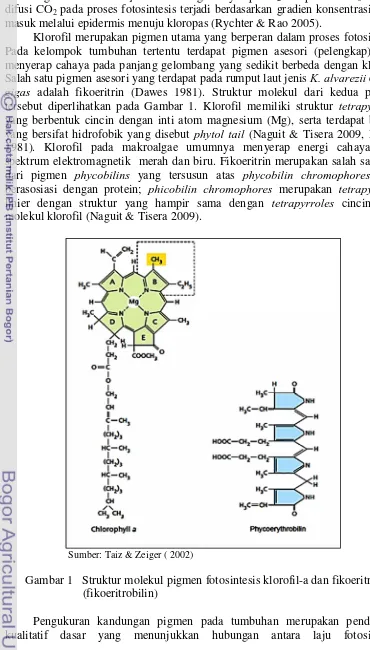
Klorofil merupakan pigmen utama yang berperan dalam proses fotosintesis. Pada kelompok tumbuhan tertentu terdapat pigmen asesori (pelengkap) yang menyerap cahaya pada panjang gelombang yang sedikit berbeda dengan klorofil. Salah satu pigmen asesori yang terdapat pada rumput laut jenis K. alvarezii dan G. gigas adalah fikoeritrin (Dawes 1981). Struktur molekul dari kedua pigmen tersebut diperlihatkan pada Gambar 1. Klorofil memiliki struktur tetrapyrroles yang berbentuk cincin dengan inti atom magnesium (Mg), serta terdapat bagian yang bersifat hidrofobik yang disebut phytol tail (Naguit & Tisera 2009, Dawes 1981). Klorofil pada makroalgae umumnya menyerap energi cahaya pada spektrum elektromagnetik merah dan biru. Fikoeritrin merupakan salah satu tipe dari pigmen phycobilins yang tersusun atas phycobilin chromophores yang berasosiasi dengan protein; phicobilin chromophores merupakan tetrapyrroles linier dengan struktur yang hampir sama dengan tetrapyrroles cincin pada molekul klorofil (Naguit & Tisera 2009).
Sumber: Taiz & Zeiger ( 2002)
Gambar 1 Struktur molekul pigmen fotosintesis klorofil-a dan fikoeritrin (fikoeritrobilin)
pertumbuhan, dan jumlah dari material tumbuhan tersebut (Geider & Osborne 1992). Dawes (1981) juga menyatakan bahwa level kandungan klorofil dapat digunakan untuk menyatakan laju fotosintesis pada suatu spesies alga; ekspresi aktivitas relatif fotosintesis terhadap jumlah klorofil-a direkomendasikan untuk membandingkan berbagai spesies algae.
Ketersediaan nutrien pada air laut memberikan pengaruh yang sangat besar terhadap keberadaan tumbuhan akuatik, termasuk rumput laut. Empat elemen utama yang dibutuhkan oleh tumbuhan akuatik untuk pertumbuhannya adalah oksigen, karbon, nitrogen dan fosfor, dengan rasio O:C:N:P pada air laut adalah 212:106:15:1 (Davis 1977 in Dawes 1981). Senyawa nitrogen yang umumnya ditemukan pada air laut adalah NO3, NO2, dan NH3 yang konsentrasinya semakin menurun denganbertambahnya kedalaman perairan; pada algae merah makroskopik menunjukkan terdapatnya hubungan antara laju pertumbuhan dengan bentuk dan konsentrasi senyawa nitrogen (Dawes 1981).
Pada air laut, senyawa fosfor anorganik berada dalam bentuk H2PO4- dan HPO42- (Dawes 1981). Tumbuhan akuatik umumnya memanfaatkan ortofosfat sebagai sumber fosfor (Effendi 2003, Dawes 1981). Effendi (2003) menyatakan bahwa pada saat perairan mengandung fosfor dalam jumlah cukup, algae akan mengakumulasi fosfor di dalam sel melebihi kebutuhannya (luxury consumption), dan kelebihan tersebut akan dimanfaatkan pada saat perairan mengalami defisiensi fosfor sehingga algae masih dapat tumbuh selama beberapa waktu. Selain itu algae juga dapat memanfaatkan fosfor organik dengan bantuan enzim alkalin fosfat yang berfungsi memecah senyawa organofosfor; dengan demikian keberadaan enzim tersebut akan meningkat jika terjadi kekurangan fosfor di perairan.
Karbondioksida (CO2) dan Perubahan Iklim
Karbondioksida (CO2) adalah gas tanpa warna, tanpa bau dan sedikit asam yang terdiri dari satu atom karbon (C) yang berikatan dengan dua atom oksigen (O) pada kedua sisinya dengan ikatan ganda. CO2 merupakan gas yang bersifat sangat stabil, non-reaktif dan tidak mudah terbakar (Aldrian et al. 2011, Dawson & Spannagle 2009). CO2 merupakan GHG antropogenik yang paling penting, dimana emisi tahunan dari gas tersebut mengalami peningkatan sebesar 80% dalam kurun waktu antara tahun 1970 – 2004, dari 21 menjadi 38 Gt (gigaton), dan pada tahun 2004 CO2 merupakan 77% dari total emisi GHG yang berasal dari aktivitas manusia (IPCC 2007).
Secara alami, GHG merupakan bagian dari atmosfir bumi, berupa molekul gas yang memiliki lebih dari dua atom dengan ikatan antar atom yang tidak terlalu kuat sehingga dapat mengalami getaran (vibrasi) saat terjadinya proses penyerapan panas. Selanjutnya molekul yang bergetar tersebut akan melepaskan radiasi yang kemungkinan besar diserap lagi oleh molekul GHG lainnya, sehingga siklus “penyerapan–pelepasan–penyerapan” tersebut mempertahankan panas di dekat permukaan bumi dan secara efektif mengisolasi permukaan bumi dari ruang angkasa yang dingin (Aldrian et al. 2011).
(antropogenik). Berdasarkan protokol Kyoto tahun 1997, GHG antropogenik terdiri dari enam jenis, yaitu CO2 (karbondioksida), CH4 (methane), N2O (nitrous oxide), HFCs (hydrofluorocarbons), PFCs (perfluorocarbons) dan SF6 (sulphur hexafluoride) (Aldrian et a. 2011). Konsensus saintifik secara umum menyatakan bahwa tingginya laju peningkatan emisi GHG antropogenik lebih dari dua abad yang lalu, terutama sejak tahun 1950, telah memberikan dampak utama perubahan iklim (Dawson & Spannagle 2009).
Menurut Aldrian et al. (2011), perubahan iklim adalah berubahnya pola intensitas unsur iklim pada periode waktu yang dapat dibandingkan (biasanya terhadap rata-rata 30 tahun), yang dapat berupa suatu perubahan dalam kondisi cuaca rata-rata atau perubahan dalam distribusi kejadian cuaca terhadap kondisi rata-ratanya. Rata-rata temperatur global telah mengalami peningkatan sebesar 0,76 oC sejak tahun 1900, dan telah menyebabkan terjadinya perubahan pada sistem geofisik dan biofisik bumi (Dawson & Spannagle 2009). Secara umum, mitigasi perubahan iklim bertujuan untuk menurunkan atau mengurangi faktor yang menjadi penyebab perubahan iklim, khususnya emisi gas-gas yang menyebabkan terjadinya pemanasan global (Houghton 2004).
Karbondioksida yang terlarut pada air laut berada dalam tiga bentuk utama sebagai senyawa anorganik, yaitu karbondioksida cair bebas (CO2(aq)), bikarbonat (HCO3-), dan ion karbonat (CO32-), sedangkan bentuk lainnya berupa asam karbonat (H2CO3) yang konsentrasinya sangat kecil, yaitu kurang dari 0,3% konsentrasi CO2 (aq) (Zeebe & Wolf-Gladrow 2001). CO2 yang terlarut dalam air membentuk beberapa reaksi kesetimbangan sebagai berikut (Zeebe & Wolf-Gladrow 2001):
Blue carbon dan Peranan Ekosistem Laut dalam Penyerapan Karbon
Wilayah perairan pantai (coastal waters) merupakan 7% dari luas total area lautan (ocean) (Nellemann et al. 2009). Perairan pantai memiliki peranan yang cukup besar dalam siklus karbon. Gas CO2 di atmosfer masuk ke laut karena adanya perbedaan antara tekanan parsial CO2 di laut dan atmosfer serta kemampuan laut untuk melarutkan gas CO2 tersebut (KLH 2007). Pada wilayah pantai terdapat berbagai vegetasi seperti mangrove, ketapang, waru dan cemara laut. Vegetasi tersebut memiliki dua fungsi sekaligus, yaitu terkait dengan upaya adaptasi dan mitigasi perubahan iklim. Disebut adaptasi, karena vegetasi pantai tersebut dapat melindungi kawasan pesisir dari dampak perubahan iklim seperti banjir, rob dan erosi, sedangkan di sisi lain vegetasi tersebut dapat menyerap emisi karbon sehingga tergolong dalam mitigasi perubahan iklim (Aldrian et al. 2011).
dan pelepasan karbon. Total karbon yang disimpan di laut sekitar 50 kali lebih besar daripada yang ada di atmosfer. Nilai pertukaran karbon di laut, yaitu sekitar 90 milyar ton/tahun yang dilepaskan ke atmosfer dan 92 milyar ton/tahun yang miliar ton karbon yang diserap(KLH 2007). Keseluruhan hasil tangkapan karbon biologis (biological carbon/green carbon) tahunan di dunia berasal dari aktivitas fotosintesis, dan lebih dari setengahnya (55%) dilakukan oleh organisme laut (Simon et al. 2009, Arrigo 2005, Falkowski et al. 2004), sehingga disebut sebagai blue carbon (Nellemann et al. 2009).
Blue carbon didefinisikan sebagai karbon yang disimpan, diasingkan dan dilepaskan dari ekosistem pantai termasuk rawa pasang surut, hutan bakau, padang lamun (seagrass) (Herr et al. 2011) dan rumput laut (seaweed), yang mengambil karbon dari atmosfir dan laut, kemudian menyimpannya di dalam tanaman dan didepositkan dalam sedimen di bawahnya melalui proses natural. Penangkapan dan penyimpanan karbon oleh ekosistem pantai berlangsung sangat efisien, dimana laju penyerapan karbon dari atmosfir dan lautan untuk setiap km2 luasan ekosistem pantai lebih tinggi dibandingkan dengan hutan tropis untuk luasan yang sama.
Carbon sequestration merupakan proses yang berlangsung secara alami maupun buatan untuk menghilangkan karbon dari atmosfir dan disimpan dalam suatu sistem penyerap karbon (carbon sinks) seperti laut, hutan atau tanah melalui proses fisik atau biologis, seperti fotosintesis (Sundquist 2008). Carbon sink adalah reservoir karbon yang cenderung lebih banyak menyerap dari pada menghasilkan emisi karbon (Dawson & Spannagle 2009). Laut merupakan salah satu reservoir karbon yang berfungsi menyerap dan menyimpan karbon. Setiap tumbuhan dan biota laut memiliki kemampuan menyerap karbon yang berbeda-beda. Untuk wilayah laut Indonesia, perkiraan jumlah karbon yang dapat diserap adalah sebesar 66,9 juta ton C/tahun, yang setara dengan 245,6 juta ton CO2/tahun (CO2 equivalent), dimana nilai tersebut merupakan hasil kontribusi dari ekosistem terumbu karang, mangrove, padang lamun dan laut terbuka dengan nilai berturut-turut 20,0 juta; 20,6 juta; 15,3 juta; dan 11,0 juta ton C/tahun untuk luas area masing-masing adalah 61.000, 93.000, 30.000 dan 5.800.000 km2 (KLH 2007). Keempat ekosistem perairan laut yang berperan dalam penyerapan karbon tersebut umumnya terdiri atas ekosistem vegetasi alami, dimana kontribusi penyerapan karbon oleh ekosistem rumput laut dan fitoplankton diperkirakan termasuk ke dalam kalkulasi untuk ekosistem laut terbuka.
3 METODE
Waktu dan Lokasi Penelitian
Penelitiaan telah dilaksanakan di perairan Teluk Gerupuk, Kabupaten Lombok Tengah, Provinsi Nusa Tenggara Barat (Gambar 2). Jangka waktu pelaksanaan penelitian terdiri atas satu siklus budidaya rumput laut (satu siklus 45 hari), yang akan dilaksanakan pada bulan Juli - Agustus 2012. Analisa sampel dilakukan di Service Laboratory SEAMEO BIOTROP, Laboratorium Terpadu Institut Pertanian Bogor, dan Laboratorium Penguji Balai Budidaya Laut Lombok.
Gambar 2 Lokasi penelitian di Teluk Gerupuk, Lombok Tengah, Provinsi Nusa Tenggara Barat
Materi Uji
Kabupaten Lombok Tengah; dan Gracilaria gigas yang berasal dari tambak budidaya rumput laut milik pembudidaya di Sekotong, Kabupaten Lombok Barat. Selama penelitian akan dilakukan pengujian terhadap sampel rumput laut dan sampel air laut dari lokasi budidaya.
Rancangan Penelitian
Rancangan percobaan yang diterapkan pada penelitian ini adalah Rancangan Acak Lengkap (RAL) satu faktor. Faktor perlakuan terdiri dari dua taraf yaitu dua spesies rumput laut yang berbeda (K. alvarezii dan G gigas).Pengambilan sampel uji rumput laut dilakukan sebanyak 5 ulangan. Ulangan yang dilakukan berupa ulangan sampling, yaitu dengan pengambilan 5 titik tanam. Model linier yang digunakan dalam RAL adalah sebagai berikut :
Yij = µ + i + εij ;
i = 1,2 (perlakuan jenis rumput laut) j = 1,2,3,4,5 (ulangan/replication) dimana :
Yij = nilai pengamatan pada jenis rumput laut ke-i dan ulangan ke-j µ = rataan umum percobaan
i = respon terhadap perlakuan jenis rumput laut ke-i
εij = galat percobaan pada jenis rumput laut ke-i dan ulangan ke-j
Prosedur Penelitian
Budidaya rumput laut
Sumber: SNI 7579.2:2010
Gambar 3 Sistem budidaya rumput laut dengan metode long-line, (a) tampak atas, (b) tampak samping
Teknik pengambilan sampel rumput laut
Pengambilan sampel rumput laut dilakukan secara acak sebanyak lima titik tanam, yang dilakukan dengan metode sampling-panen. Pertumbuhan diamati dengan melakukan penimbangan bobot basah tanaman dari setiap titik tanam yang
Ket: (1) tali jangkar, (2) tali utama, (3) tali pembantu, (4) tali ris bentang, (5) tali jangkar utama, (6) jangkar pembantu, (7) pelampung pembantu
terambil sebagai sampel, selanjutnya dimasukkan ke dalam plastik sampel untuk dilakukan analisa laboratorium. Parameter uji yang diamati dari sampel rumput laut yaitu seperti pada Tabel 1. Untuk mendapatkan data rendemen, dilakukan pengambilan sampel rumput laut sebanyak 1 kg (bobot basah) kemudian dijemur hingga kering dan ditimbang kembali sehingga diperoleh data bobot kering. Sampling rumput laut dilakukan pada hari ke-0, 10, 20, 30 dan 45.
Pengukuran parameter kualitas air
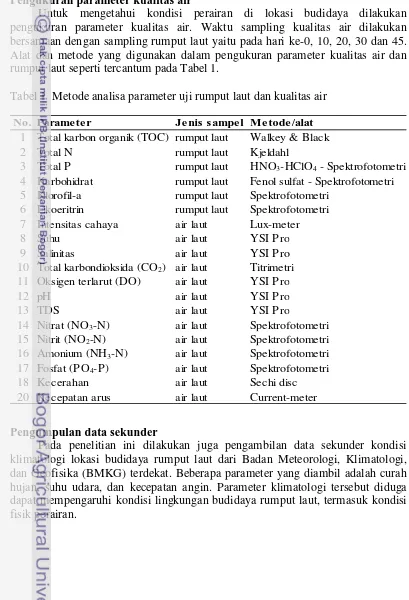
Untuk mengetahui kondisi perairan di lokasi budidaya dilakukan pengukuran parameter kualitas air. Waktu sampling kualitas air dilakukan bersamaan dengan sampling rumput laut yaitu pada hari ke-0, 10, 20, 30 dan 45. Alat dan metode yang digunakan dalam pengukuran parameter kualitas air dan rumput laut seperti tercantum pada Tabel 1.
Tabel 1 Metode analisa parameter uji rumput laut dan kualitas air
No. Parame te r Je nis sampe l Me tode /alat 1 Total karbon organik (TOC) rumput laut Walkey & Black 2 Total N rumput laut Kjeldahl
3 Total P rumput laut HNO3-HClO4 - Spektrofotometri
4 Karbohidrat rumput laut Fenol sulfat - Spektrofotometri 5 Klorofil-a rumput laut Spektrofotometri
6 Fikoeritrin rumput laut Spektrofotometri 7 Intensitas cahaya air laut Lux-meter 8 Suhu air laut YSI Pro 9 Salinitas air laut YSI Pro 10 Total karbondioksida (CO2) air laut Titrimetri
11 Oksigen terlarut (DO) air laut YSI Pro 12 pH air laut YSI Pro 13 TDS air laut YSI Pro
14 Nitrat (NO3-N) air laut Spektrofotometri
15 Nitrit (NO2-N) air laut Spektrofotometri
16 Amonium (NH3-N) air laut Spektrofotometri
17 Fosfat (PO4-P) air laut Spektrofotometri
18 Kecerahan air laut Sechi disc 20 Kecepatan arus air laut Current-meter
Pengumpulan data sekunder
Parameter Uji
Parameter uji yang diamati selama penelitian terdiri atas : 1. Laju pertumbuhan harian rumput laut
Laju pertumbuhan harian (daily growth rate/DGR) dihitung dengan formula sebagai berikut (Lüning 1990) :
DGR % =100 ln W2⁄W1 2. Produksi karbohidrat oleh rumput laut
Kandungan karbohidrat diukur sebagai data pembanding untuk melihat konsistensi tingkat penyerapan CO2 oleh rumput laut yang dikonversi menjadi karbohidrat dalam proses fotosintesis. Nilai dari kandungan karbohidrat dianalisis secara deskriptif untuk melihat pola peningkatan atau penurunan parameter tersebut mulai dari awal hingga akhir pemeliharaan. Produksi karbohidrat (g/m2) merupakan jumlah karbohidrat yang dapat dihasilkan oleh rumput laut per luas area budidaya yang dapat dikalkulasikan berdasarkan biomassa rumput laut, kadar karbohidrat dan rendemen rumput laut kering sebagai berikut :
Produksi karbohidrat (g/m2) = biomassa (g/m2) x kandungan karbohidrat (%) x rendemen (%)
3. Laju penyerapan karbon oleh rumput laut
Kandungan total kabon organik (selanjutnya disebut sebagai kandungan karbon) dari sampel rumput laut diukur untuk mengetahui laju penyerapan karbon oleh rumput laut. Nilai produksi yang diukur pada akhir masa budidaya digunakan untuk menghitung penyerapan karbon oleh rumput laut per satuan luas area budidaya per waktu. Untuk mengestimasi laju penyerapan karbon per tahun oleh rumput laut dapat dihitung berdasarkan formula sebagai berikut (Muraoka 2004) : P-B rasio = rasio produksi-biomassa
CC = kandungan karbon rumput laut (%)
Jumlah serapan karbon pada kawasan budidaya rumput laut dapat diestimasi melalui pendekatan total biomassa panen dari budidaya rumput laut pada kawasan tesebut. Estimasi serapan karbon tersebut dapat diketahu dengan mengkalkulasikan laju penyerapan karbon dengan produktivitas budidaya sebagai berikut :
4. Kandungan pigmen fotosintesis pada rumput laut
Salah satu metode yang dapat digunakan untuk mengetahui aktivitas fotosintesis adalah melalui pengukuran kandungan pigmen fotosintesis yang terdiri dari klorofil-a dan fikoeritrin. Metode yang digunakan dalam analisa kandungan pigmen mengacu pada Naguit & Tisera (2009). Konsentrasi klorofil-a dan fikoeritrin dihitung berdasarkan formula sebagai berikut :
Chlorophyll a (mg/L) = 11,93 (A664) – 1,93 (A647)
Phycoerythrin (mg/L) = [(A564 – A592) – (A455 – A592) 0,20] * 0,12
Untuk menentukan kandungan pigmen per gram rumput laut (mg/g) dihitung dengan formula sebagai berikut :
Kandungan pigmen ( mg g)⁄ = konsentrasi mg L⁄ ) × volume pelarut (mL) bobot sampel rumput laut (g)
5. Produktivitas budidaya rumput laut
Produktivitas dari budidaya rumput laut dapat dikalkulasikan berdasarkan pertambahan biomassa yang diproduksi dari luasan area budidaya dan lamanya waktu pemeliharaan dengan persamaan sebagai berikut:
Y = [(Wt – W0) / T] / SA, dimana :
Y = produktivitas (g/m2/hari) W1 = biomassa akhir (g) W0 = biomassa awal (g)
T = waktu pemeliharaan (hari). SA = luas area (m2)
6. Indeks percabangan
Indeks percabangan (branching index) dari rumput laut menunjukkan jumlah cabang per gram sampel rumput laut. Indeks percabangan dapat dikalkulasikan dengan formula Pickering et al. (1995) sebagai berikut :
BI = AGP ws dimana :
BI = indeks percabangan
AGP = jumlah titik percabangan (apical growing point) ws = bobot sampel (gram)
7. Rasio C : N : P pada rumput laut
Berdasarkan data kandungan total karbon, total N dan total P, maka dapat dihitung rasio rata-rata kandungan karbon : nitrogen : fosfor dari rumput laut. Rasio C:N:P ini diukur untuk melihat kondisi pertumbuhan dari rumput laut, kondisi availabilitas nutrien di lingkungan serta untuk melihat gambaran dari struktur kimia dan unsur yang dominan pada rumput laut.
8. Kualitas perairan
berperan dalam proses fotosintesis sebagai indikator penyerapan karbon dari perairan.
9. Klimatologi
Data-data klimatologi yang terdiri dari curah hujan, kecepatan angin dan suhu udara, dianalisis secara deskriptif untuk melihat fluktuasi kondisi klimatologi wilayah penelitian yang dapat mempengaruhi kondisi lingkungan perairan yang menjadi lokasi budidaya rumput laut selama penelitian dilakukan.
Analisis Data
4 HASIL DAN PEMBAHASAN
Hasil Penelitian
Pertumbuhan dan produktivitas budidaya rumput laut
Rata-rata pertambahan bobot K. alvarezii dari rata-rata bibit yang ditanam sekitar 500 g/m2 meningkat pada akhir masa pemeliharaan (hari ke-45) menjadi 5.250 g/m2. Sedangkan pada G. gigas, dengan bobot awal yang sama, rata-rata peningkatan bobotnya lebih tinggi dari pada K. alvarezii, dengan rata-rata bobot pada akhir masa pemeliharaan (hari ke-30) mencapai 11.050 g/m2 (Gambar 4). Rata-rata pertambahan bobot G. gigas pada setiap selang waktu pemeliharaan jauh lebih tinggi dibandingkan dengan K. alvarezii. Pertambahan bobot yang dicapai oleh G. gigas mulai hari ke-10 hingga hari ke-30 mencapai 87,29 – 331,22% lebih besar dibandingkan K. alvarezii pada selang waktu yang sama, yaitu pada hari ke-0 hingga hari ke-30.
Gambar 4 Pertambahan biomassa dan laju pertumbuhan harian K. alvarezii dan G. gigas pada setiap umur pemeliharaan (hasil analisis ragam pada Lampiran 7 – Lampiran 10)
Rata-rata laju pertumbuhan harian dari K. alvarezii tinggi pada hari ke 0-10 yaitu 6,74 – 7,31%; dan menurun hingga akhir masa pemeliharaan (hari ke-45) menjadi 5,16%. Sedangkan pada G. gigas rata-rata laju pertumbuhan harian awalnya lebih tinggi yaitu 13,03%; kemudian menurun menjadi 10,28% pada akhir masa pemeliharaan (hari ke-30) (Gambar 4).
Tabel 2 Parameter budidaya rumput laut K. alvarezii dan G. gigas yang diamati pada akhir masa pemeliharaan
Parameter Satuan K. alvarezii G.gigas
Laju pertumbuhan harian % 2,40 5,63 Biomassa panen/unit long-line/siklus kg 885 1.625 Produktivitas ton/ha/tahun 37,96 128,97
Pertambahan biomassa harian G. gigas (46,89 g/hari) dua kali lipat lebih tinggi dibandingkan K. alvarezii (21,11 g/hari). Hal ini terlihat pada total produksi G. gigas yang juga dua kali lipat lebih tinggi dibandingkan K. alvarezii (Tabel 2). Demikian pula laju pertumbuhan harian yang dikalkulasikan pada akhir masa pemeliharaan berdasarkan biomassa panen, menunjukkan laju pertumbuhan harian G. gigas (5,63%) dua kali lipat lebih tinggi dibandingan dengan laju pertumbuhan harian K alvarezii (2,40%). Produktivitas budidaya G. gigas dengan metode long-line yaitu 128,97 ton/ha/tahun, lebih tinggi dari pada K. alvarezii yaitu 37,96 ton/ha/tahun (Tabel 2). Produktivitas budidaya rumput laut untuk komoditas G. gigas mencapai 339,74% lebih tinggi dibandingkan K. alvarezii.
Karbohidrat pada rumput laut
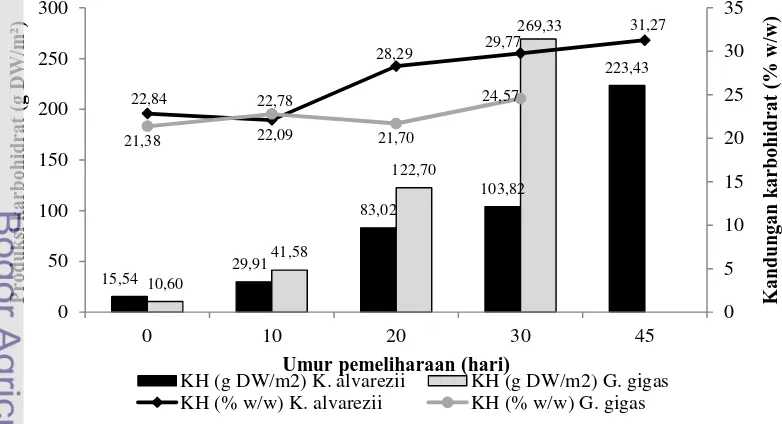
Persentase kandungan karbohidrat dari kedua jenis rumput laut yang diamati selama masa pemeliharaan dengan budidaya metode long-line berkisar antara 22,09 – 31,27 % (K.alvarezii) dan 21,38 – 24,57 % (G. gigas) dalam berat kering (Gambar 5). Kisaran kandungan karbohidrat kedua K. alvarezii lebih tinggi dibandingkan G. gigas. Kandungan karbohidrat pada kedua spesies rumput laut tersebut meningkat dengan bertambahnya umur pemeliharaan.
Gambar 5 Kandungan karbohidrat dan produksi karbohidrat per m2 area
KH (g DW/m2) K. alvarezii KH (g DW/m2) G. gigas
Berdasarkan kandungan karbohidrat dan rata-rata bobot rumput laut yang diukur pada setiap selang waktu sampling, maka diketahui karbohidrat yang dapat dihasilkan dari biomassa rumput laut per m2 luas area budidaya (Gambar 5). Produksi karbohidrat yang dihasilkan dari biomassa K. alvarezii dan G. gigas pada awal pemeliharaan berturut-turut adalah 14,99 g/m2 dan 10,60 g/m2 (berat kering); sedangkan pada akhir pemeliharaan meningkat hingga 215,55 g/m2 dan 269,33 g/m2 (berat kering). Karbohidrat yang dihasilkan dari biomassa rumput laut per luasan area meningkat dengan bertambahnya umur pemeliharaan, seiring dengan meningkatnya biomassa rumput laut yang dihasilkan per luasan area tersebut.
Penyerapan karbon oleh rumput laut
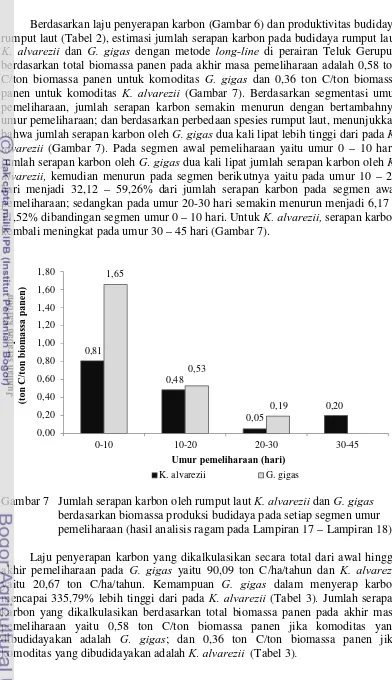
Berdasarkan hasil analisis kandungan karbon, biomassa panen dan luas area budidaya dari dua spesies rumput laut K. alvarezii dan G. gigas yang dibudidaya dengan metode long-line menunjukkan laju penyerapan karbon pada G. gigas 335,79% lebih tinggi dibandingkan dengan K. alvarezii, yaitu sebesar 20,67 ton C/ha/tahun (K. alvarezii) dan 90,09 ton C/ha/tahun (G. gigas). Kemampuan kedua spesies rumput laut dalam menyerap karbon dari lingkungan perairan semakin menurun dengan semakin bertambahnya umur pemeliharaan (Gambar 6). Kemampuan G. gigas dalam menyerap kabon mencapai hampir empat kali lipat lebih tinggi dari pada K. alvarezii pada segmen awal pemeliharaan, yaitu pada umur 0 – 10 hari. Kemudian terjadi penurunan pada umur 10 – 20 hari dengan laju penyerapan karbon menjadi sekitar 32,00 – 62,46% dibandingan segmen awal, dan seterusnya menurun hingga umur 20 – 30 hari. Pada umur 30 – 45 hari, laju penyerapan karbon pada K.alvarezii kembali meningkat hingga 5 kali lipat dibandingkan umur 20 – 30 hari (Gambar 6).
Berdasarkan laju penyerapan karbon (Gambar 6) dan produktivitas budidaya rumput laut (Tabel 2), estimasi jumlah serapan karbon pada budidaya rumput laut K. alvarezii dan G. gigas dengan metode long-line di perairan Teluk Gerupuk berdasarkan total biomassa panen pada akhir masa pemeliharaan adalah 0,58 ton C/ton biomassa panen untuk komoditas G. gigas dan 0,36 ton C/ton biomassa panen untuk komoditas K. alvarezii (Gambar 7). Berdasarkan segmentasi umur pemeliharaan, jumlah serapan karbon semakin menurun dengan bertambahnya umur pemeliharaan; dan berdasarkan perbedaan spesies rumput laut, menunjukkan bahwa jumlah serapan karbon oleh G. gigas dua kali lipat lebih tinggi dari pada K. alvarezii (Gambar 7). Pada segmen awal pemeliharaan yaitu umur 0 – 10 hari, jumlah serapan karbon oleh G. gigas dua kali lipat jumlah serapan karbon oleh K. alvarezii, kemudian menurun pada segmen berikutnya yaitu pada umur 10 – 20 hari menjadi 32,12 – 59,26% dari jumlah serapan karbon pada segmen awal pemeliharaan; sedangkan pada umur 20-30 hari semakin menurun menjadi 6,17 – 11,52% dibandingan segmen umur 0 – 10 hari. Untuk K. alvarezii, serapan karbon kembali meningkat pada umur 30 – 45 hari (Gambar 7).
Gambar 7 Jumlah serapan karbon oleh rumput laut K. alvarezii dan G. gigas berdasarkan biomassa produksi budidaya pada setiap segmen umur pemeliharaan (hasil analisis ragam pada Lampiran 17 – Lampiran 18) Laju penyerapan karbon yang dikalkulasikan secara total dari awal hingga akhir pemeliharaan pada G. gigas yaitu 90,09 ton C/ha/tahun dan K. alvarezii yaitu 20,67 ton C/ha/tahun. Kemampuan G. gigas dalam menyerap karbon mencapai 335,79% lebih tinggi dari pada K. alvarezii (Tabel 3). Jumlah serapan karbon yang dikalkulasikan berdasarkan total biomassa panen pada akhir masa pemeliharaan yaitu 0,58 ton C/ton biomassa panen jika komoditas yang dibudidayakan adalah G. gigas; dan 0,36 ton C/ton biomassa panen jika komoditas yang dibudidayakan adalah K. alvarezii (Tabel 3).
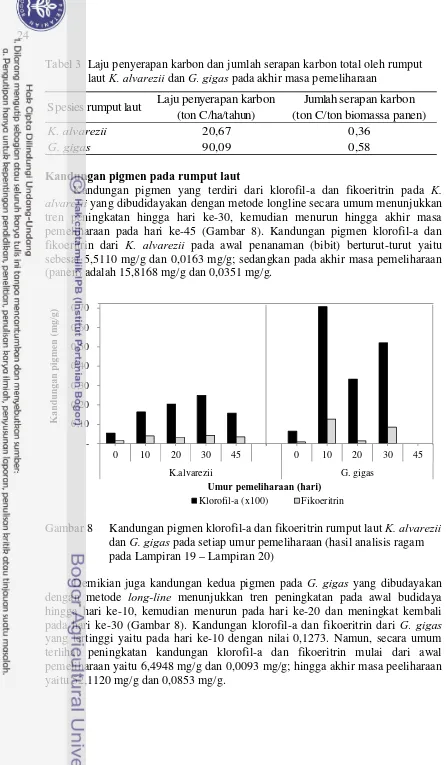
Tabel 3 Laju penyerapan karbon dan jumlah serapan karbon total oleh rumput laut K. alvarezii dan G. gigas pada akhir masa pemeliharaan
Spesies rumput laut Laju penyerapan karbon (ton C/ha/tahun) alvarezii yang dibudidayakan dengan metode longline secara umum menunjukkan tren peningkatan hingga hari ke-30, kemudian menurun hingga akhir masa pemeliharaan pada hari ke-45 (Gambar 8). Kandungan pigmen klorofil-a dan fikoeritrin dari K. alvarezii pada awal penanaman (bibit) berturut-turut yaitu sebesar 5,5110 mg/g dan 0,0163 mg/g; sedangkan pada akhir masa pemeliharaan (panen) adalah 15,8168 mg/g dan 0,0351 mg/g.
Gambar 8 Kandungan pigmen klorofil-a dan fikoeritrin rumput laut K. alvarezii dan G. gigas pada setiap umur pemeliharaan (hasil analisis ragam pada Lampiran 19 – Lampiran 20)
Demikian juga kandungan kedua pigmen pada G. gigas yang dibudayakan dengan metode long-line menunjukkan tren peningkatan pada awal budidaya hingga hari ke-10, kemudian menurun pada hari ke-20 dan meningkat kembali pada hari ke-30 (Gambar 8). Kandungan klorofil-a dan fikoeritrin dari G. gigas yang tertinggi yaitu pada hari ke-10 dengan nilai 0,1273. Namun, secara umum terlihat peningkatan kandungan klorofil-a dan fikoeritrin mulai dari awal pemeliharaan yaitu 6,4948 mg/g dan 0,0093 mg/g; hingga akhir masa peeliharaan yaitu 52,1120 mg/g dan 0,0853 mg/g.
-Indeks percabangan
Indeks percabangan dari kedua jenis rumput laut yang diukur pada akhir masa pemeliharaan dapat dilihat pada Tabel 4. Rata-rata indeks percabangan pada G. gigas (24,07) jauh lebih tinggi dibandingkan dengan K. alvarezii (1,86). Walaupun indeks percabangan pada K. alvarezii relatif kecil, tapi spesies ini memiliki 6 (enam) tingkat percabangan, sedangkan pada G. gigas hanya terdapat 3 tingkat percabangan. Namun demikian, G. gigas memiliki jumlah titik percabangan (appical growing point) yang jauh lebih banyak pada setiap tingkat percabangannya. Hal ini menyebabkan tingginya keragaman indeks percabangan dari G. gigas yang diukur pada akhir masa pemeliharaan. Besarnya nilai dari indeks percabangan menunjukkan jumlah cabang/gram rumput laut (Pickering et al. 1995), sehingga semakin besar indeks percabangan berarti semakin banyak dan semakin kompleks sistem percabangan dari rumput laut tersebut.
Tabel 4 Indeks percabangan rumput laut yang diamati pada akhir masa pemeliharaan karbon:nitrogen:fosfor (C:N:P) dari organisme laut dikenal dengan Redfield Ratio, yaitu 116:16:1 (Atkinson & Smith 1983). Rata-rata C:N:P rasio K. alvarezii (99:5:1) lebih tinggi dibandingkan G. gigas (88:6:1). Rasio C:N:P kedua spesies rumput laut tersebut menunjukkan nilai yang lebih rendah dibandingkan nilai redfield ratio. Rata-rata C:N rasio dan C:P rasio pada K. alvarezii lebih besar dibandingkan G. gigas, sedangkan rata-rata N:P rasio pada K. alvarezii lebih rendah dibangingkan G. gigas (Tabel 5).
Tabel 5 Rasio C:N:P; C:N, C:P dan N:P pada rumput laut K. alvarezii dan G. gigas pada setiap umur pemeliharaan
Hubungan laju penyerapan karbon dengan lingkungan budidaya rumput laut
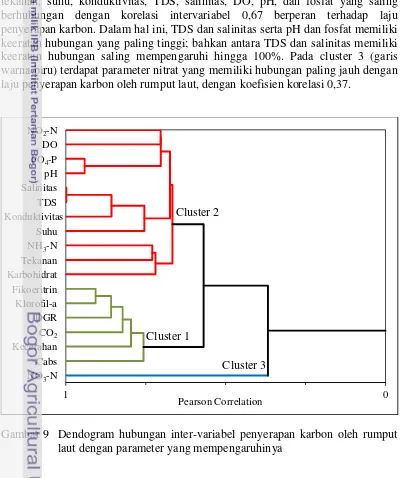
Analisis cluster dari variabel-variabel laju penyerapan karbon, kandungan klorofil-a, fikoeritrin, karbohidrat dan laju pertumbuhan harian rumput laut yang dibudidayakan dengan motode long-line serta variabel lingkungan budidaya yang mempengaruhinya, berdasarkan tingkat korelasinya menghasilkan 3 cluster (Gambar 9). Berdasarkan hasil tersebut ditunjukkan bahwa laju penyerapan karbon oleh rumput laut berhubungan secala langsung dengan kandungan klorofil-a, fikoeritrin dan laju pertumbuhan harian rumput laut, serta kecerahan dan konsentrasi CO2 perairan dengan korelasi inter-variabel sebesar 0,76 (cluster 1, garis warna hijau).
Cluster 2 (garis warna merah) mewakili parameter yang terdiri dari kadar karbohidrat rumput laut serta parameter kualitas air yang terdiri dari amonia, tekanan, suhu, konduktivitas, TDS, salinitas, DO, pH, dan fosfat yang saling berhubungan dengan korelasi intervariabel 0,67 berperan terhadap laju penyerapan karbon. Dalam hal ini, TDS dan salinitas serta pH dan fosfat memiliki keeratan hubungan yang paling tinggi; bahkan antara TDS dan salinitas memiliki keeratan hubungan saling mempengaruhi hingga 100%. Pada cluster 3 (garis warna biru) terdapat parameter nitrat yang memiliki hubungan paling jauh dengan laju penyerapan karbon oleh rumput laut, dengan koefisien korelasi 0,37.
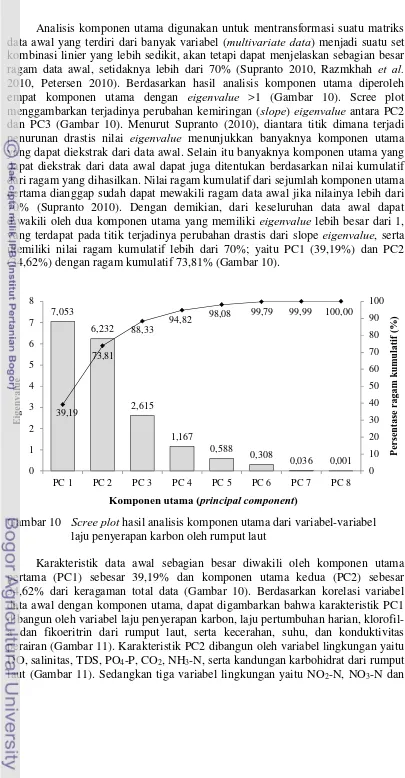
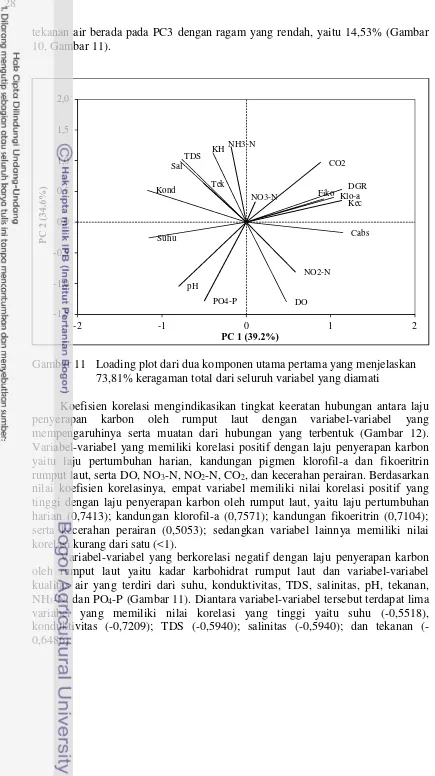
Analisis komponen utama digunakan untuk mentransformasi suatu matriks data awal yang terdiri dari banyak variabel (multivariate data) menjadi suatu set kombinasi linier yang lebih sedikit, akan tetapi dapat menjelaskan sebagian besar ragam data awal, setidaknya lebih dari 70% (Supranto 2010, Razmkhah et al. 2010, Petersen 2010). Berdasarkan hasil analisis komponen utama diperoleh empat komponen utama dengan eigenvalue >1 (Gambar 10). Scree plot menggambarkan terjadinya perubahan kemiringan (slope) eigenvalue antara PC2 dan PC3 (Gambar 10). Menurut Supranto (2010), diantara titik dimana terjadi penurunan drastis nilai eigenvalue menunjukkan banyaknya komponen utama yang dapat diekstrak dari data awal. Selain itu banyaknya komponen utama yang dapat diekstrak dari data awal dapat juga ditentukan berdasarkan nilai kumulatif dari ragam yang dihasilkan. Nilai ragam kumulatif dari sejumlah komponen utama pertama dianggap sudah dapat mewakili ragam data awal jika nilainya lebih dari 70% (Supranto 2010). Dengan demikian, dari keseluruhan data awal dapat diwakili oleh dua komponen utama yang memiliki eigenvalue lebih besar dari 1, yang terdapat pada titik terjadinya perubahan drastis dari slope eigenvalue, serta memiliki nilai ragam kumulatif lebih dari 70%; yaitu PC1 (39,19%) dan PC2 (34,62%) dengan ragam kumulatif 73,81% (Gambar 10).
Gambar 10 Scree plot hasil analisis komponen utama dari variabel-variabel laju penyerapan karbon oleh rumput laut
tekanan air berada pada PC3 dengan ragam yang rendah, yaitu 14,53% (Gambar 10, Gambar 11).
Gambar 11 Loading plot dari dua komponen utama pertama yang menjelaskan 73,81% keragaman total dari seluruh variabel yang diamati
Koefisien korelasi mengindikasikan tingkat keeratan hubungan antara laju penyerapan karbon oleh rumput laut dengan variabel-variabel yang mempengaruhinya serta muatan dari hubungan yang terbentuk (Gambar 12). Variabel-variabel yang memiliki korelasi positif dengan laju penyerapan karbon yaitu laju pertumbuhan harian, kandungan pigmen klorofil-a dan fikoeritrin rumput laut, serta DO, NO3-N, NO2-N, CO2, dan kecerahan perairan. Berdasarkan nilai koefisien korelasinya, empat variabel memiliki nilai korelasi positif yang tinggi dengan laju penyerapan karbon oleh rumput laut, yaitu laju pertumbuhan harian (0,7413); kandungan klorofil-a (0,7571); kandungan fikoeritrin (0,7104); serta kecerahan perairan (0,5053); sedangkan variabel lainnya memiliki nilai korelasi kurang dari satu (<1).
Gambar 12 Nilai korelasi antara laju penyerapan karbon oleh rumput laut dengan variabel-variabel yang mempengaruhinya
Kondisi klimatologi lokasi penelitian
Parameter klimatologi yang diperoleh terdiri atas suhu udara, kecepatan angin dan curah hujan dari bulan Januari – September 2012 (Gambar 13). Parameter-parameter klimatologi secara langsung dapat mempengaruhi kualitas perairan, serta secara tidak langsung dapat mempengaruhi pertumbuhan rumput laut sebagai komoditas yang dibudidayakan di lokasi perairan tersebut.
Pada periode Juli – Agustus terlihat bahwa suhu udara relatif lebih rendah dibandingkan dengan periode Januari – April. Kisaran suhu udara harian pada selang waktu tersebut yaitu 22,8 – 29,6 oC atau rata-rata yaitu 26,4 oC. Penurunan kisaran suhu udara mulai terlihat pada awal bulan Mei, dan diperkirakan berdampak pada terjadinya penurunan suhu air laut pada selang waktu tersebut.
Gambar 13 Kondisi klimatologi (suhu udara, kecepatan angin dan curah hujan) lokasi penelitian pada tahun 2012. Garis merah merupakan
kisaran waktu pelaksaan penelitian