PENGARUH KOMPOSISI MEDIA TERHADAP
PERTUMBUHAN TUNAS BULBIL BAWANG PUTIH
(
Allium sativum
L.) CV. TAWANGMANGU BARU DALAM
KULTUR
IN VITRO
RANDI
DEPARTEMEN AGRONOMI DAN HORTIKULTURA
FAKULTAS PERTANIAN
INSTITUT PERTANIAN BOGOR
PERNYATAAAN MENGENAI SKRIPSI DAN SUMBER
INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa skripsi berjudul Pengaruh Komposisi Media terhadap Pertumbuhan Tunas Bulbil Bawang Putih (Allium sativum L.) cv. Tawangmangu Baru dalam Kultur In Vitro adalah benar karya saya dengan arahan dari pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta karya tulis saya kepada Insitut Pertanian Bogor.
Bogor, April 2015
Randi
ABSTRAK
RANDI. Pengaruh Komposisi Media terhadap Pertumbuhan Tunas Bulbil Bawang Putih (Allium sativum L.) cv. Tawangmangu Baru dalam Kultur In Vitro. Dibimbing oleh DINY DINARTI.
Perbanyakan bawang putih secara in vitro umumnya menggunakan eksplan tunas adventif dari siung umbi bibit. Persentase kontaminasi yang tinggi merupakan masalah apabila menggunakan bahan tanam yang berasal dari lapangan. Bulbil merupakan salah satu alternatif bahan tanam dalam perbanyakan mikro bawang putih. Tujuan dari penelitian ini adalah untuk mempelajari pengaruh komposisi media terhadap pertumbuhan tunas mikro bawang putih cv. Tawangmangu Baru yang berasal dari bulbil. Rancangan percobaan yang digunakan adalah rancangan acak lengkap (RAL) dengan satu faktor yakni komposisi media. Terdapat empat taraf komposisi media yaitu MSI percobaan terdiri dari 3 botol kultur yang masing-masing ditanam 1 tunas mikro yang berasal dari bulbil. Data diuji lanjut dengan uji BNT (Beda Nyata Terkecil)
pada taraf α = 5%. Hasil penelitian menunjukkan bahwa tunas bulbil dapat tumbuh dan berkembang pada semua media perlakuan. Komposisi media nyata meningkatkan rata-rata jumlah daun pada 8 MSP. Komposisi media MS + vitamin MS + 2.0 ppm 2ip + 0.5 ppm NAA menghasilkan jumlah daun tertinggi sebanyak 1.63 helai dan membentuk bulblet mikro sebanyak 33%. Komposisi media tidak menunjukkan hasil yang nyata terhadap peubah jumlah tunas dan akar.
Kata kunci: 2ip, BAP, Bulbil, Bulblet, Media B5
ABSTRACT
RANDI. The Effect of Media Composition to growth of Bulbil Shoot of Garlic (Allium sativum L) Cv. Tawangmangu Baru in In Vitro Culture. Supervised by DINY DINARTI
nutrient) + B5 vitamin + 2.0 ppm 2iP + 0.5 ppm NAA), MBB (MS media (Macro nutrient + micro nutrient) + vitamin B5 + 2.25 ppm BAP + 0.5 ppm NAA). Each media were repeated five times so there were 20 experimental unit. One experimental unit consisted of three shoot bulbil explant. Data obtained were analyzed by F-test, followed by LSD (Least Significant Different) at 5% significant level. The result showed that bulbil shoot could grow and developed in all treatment. Media composition significantly different to increase total average leaf in 8 week after treatment. MS Media + vitamin MS + 2.0 ppm 2iP + 0.5 ppm NAA delivered the higest total average leaf namely 1.63 after 8 and formed bulblet 33 %. Media composition did not give significant affect in total average shoot and root.
PENGARUH KOMPOSISI MEDIA TERHADAP
PERTUMBUHAN TUNAS BULBIL BAWANG PUTIH
(
Allium sativum
L.) CV. TAWANGMANGU BARU dalam
KULTUR
IN VITRO
RANDI
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Pertanian
pada
Departemen Agronomi dan Hortikultura
DEPARTEMEN AGRONOMI DAN HORTIKULTURA FAKULTAS PERTANIAN
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah SWT atas segala karunia-Nya sehingga skripsi ini berhasil diselesaikan. Judul penelitian ini adalah Pengaruh Komposisi Media terhadap Pertumbuhan Tunas Bulbil Bawang Putih (Allium sativum L.) cv. Tawangmangu Baru dalam Kultur In Vitro. Penelitian ini merupakan salah satu syarat untuk memperoleh gelar Sarjana Pertanian pada Departeman Agronomi dan Hortikultura Fakultas Pertanian IPB.
Ungkapan terima kasih disampaikan kepada ma’e, pa’e serta seluruh keluarga, atas segala doa dan kasih sayangnya selama penulis menempuh pendidikan dan menyelesaikan studi. Terimakasih penulis ucapkan kepada Dr Ir Diny Dinarti, MSi sebagai pembimbing atas segala pengarahan, bimbingan, dalam perencanaan, pelaksanaan, penulisan skripsi hingga pendanaan penelitian. Disamping itu, penulis juga menyampaikan terimakasih kepada Ibu Siti Kholifah dari Laboratorium Kultur Jaringan 3 dan juga rekan-rekan mahasiswa S1 dan S2 yang sedang melaksanakan penelitian di laboratorium tersebut yang telah banyak membantu dan memberikan informasi selama pelaksanaan penelitian ini.
Terimaksih juga penulis sampaikan kepada teman-teman di Departeman Agronomi dan Hortikultura 47 (Edelweiss 47), sahabat lorong asrama C3 TPB kamar 253, Keluarga PPSDMS Bogor angkatan 6, sahabat PSDM BEM Faperta Kabinet Unity, Super tim Isra, Adi, Grace, Fika, Paijo, Dirga, Gisha, Wiwi, dan Risma.
Semoga hasil penelitian ini dapat menjadi tambahan informasi dalam pengembangan bawang putih selanjutnya.
Bogor, April 2015
DAFTAR ISI
DAFTAR ISI i
DAFTAR TABEL ii
DAFTAR GAMBAR ii
DAFTAR LAMPIRAN ii
PENDAHULUAN 1
Latar Belakang 1
Tujuan Penelitian 2
Hipotesis 2
TINJAUAN PUSTAKA 2
Bawang Putih (Allium sativum L.) 2 Morfologi dan Ekologi Bawang Putih 3
Kultur Jaringan Tanaman 5
Eksplan 5
Media Kultur Jaringan 5
Zat Pengatur Tumbuh 6
Kultur In Vitro Bawang Putih 7
METODE 8
Tempat dan Waktu Pelaksanaan 8
Bahan dan Alat 8
Pelaksanaan 9
HASIL DAN PEMBAHASAN 10
Keadaan umum 10
Jumlah Tunas 11
Jumlah daun 13
Jumlah akar 15
Umbi Mikro 16
KESIMPULAN DAN SARAN 17
Simpulan 17
Saran 17
DAFTAR PUSTAKA 17
LAMPIRAN 22
DAFTAR TABEL
1. Komposisi media perlakuan 8 2. Rekapitulasi respon peubah yang diamati 11 3. Presentase kultur tunas bulbil bawang putih yang mengalami multiplikasi tunas pada empat komposisi media selama 8 MSP 12 4. Rata-rata jumlah tunas mikro bawang putih pada empat taraf komposisi media
selama 8 MSP 12
5. Rata-rata jumlah daun hijau dari kultur tunas bulbil bawang putih selama 8 MSP pada empat komposisi media 13 6. Presentase kultur berakar pada kultur tunas bulbil bawang putih selama asdfaj
jds8 MSP 15
7. Rata-rata jumlah akar eksplan pada berbagai komposisi media perlakuan 16 8. Persentase tunas membentuk umbi pada media perlakuan selam 8 MSP 16
DAFTAR GAMBAR
1. Morfologi umbi bawang putih. Irisan melintang umbi bawang putih (a), irisan membujur siung (b), tunas adventif (c) batang semu (1) pelepah yang
mengering (2) daun pelindung siung (3) Siung (4) Lubang berisi tunas vegetatif (5) tunas vegetatif (6) eksplan tunas adventif ± 0.5 cm (7) (Sengin 1992) 3 2. Bunga bawang putih. (a) Bunga terinduksi di wilayah subtropis (b)Bulbil
terdapat pada bunga di wilayah subtropis (Simon et al. 2003) (c) (d) bulbil di dalam batang di wilayah tropis 4 3. Ukuran bulbil yang digunakan 9 4. Tunas Bulbil. (a) Tunas Bulbil setelah diisolasi (b) Kultur tunas bulbil setelah
2 MSP 10
5. Rataan jumlah daun senesens pada kultur tunas bulbil bawang putih bawang
putih selama 8 MSP 14
6. Tunas Bulbil yang mengalami senesens 14 7. Bulblet in vitro (a) penampang melintang dari eksplan berasal dari bawang
putih tunggal (b) penampang melintang dari eksplan berasal dari bulbil (1)Tunas adventif (2) Siung 16
DAFTAR LAMPIRAN
1
PENDAHULUAN
Latar BelakangBawang putih (Allium sativum L.) merupakan salah satu sayuran penting dunia dan termasuk dalam genus Allium, famili Liliaceae. Produktivitas bawang putih di Indonesia hanya 6.3 ton/ha. Produksi bawang putih pada tahun 2013 mencapai 15 766 ton dengan luas panen 2 479 Ha (BPS 2013). Nilai tersebut tergolong rendah jika dibandingkan dengan China yang mampu menghasilkan 18.56 juta ton bawang putih (FAO 2010). Produksi bawang putih Indonesia saat ini masih belum mencukupi kebutuhan per kapita dalam negeri yang mencapai 1.351 kg, sehingga pemerintah harus melakukan impor.
Manfaat utama bawang putih adalah sebagai bumbu penyedap masakan yang membuat masakan menjadi beraroma dan mengandung selera. Uji coba secara eksperimental diketahui bahwa bawang putih dapat menurunkan kolesterol (Steveinson et al. 2000), mencegah penggumpalan darah (Block 1985), mencegah kanker usus besar, antimikroba (Tattelman 2005), dan anti hipertensi (Ried et al.
2010).
Terdapat beberapa faktor penyebab rendahnya produksi bawang putih di Indonesia. Pertama, rendahnya luas lahan produksi bawang putih hanya 2 479 hektar (BPS 2013). Kedua, 7 % sampai 11 % umbi hasil produksi digunakan kembali sebagai bibit. Bawang putih umumnya diperbanyak secara vegetatif karena sebagian besar kultivar bawang putih tidak mampu menghasilkan biji (Metwally et al. 2012). Kebutuhan umbi bawang putih setiap hektar berkisar 500 sampai 700 kg. Perbanyakan secara vegetatif ini memungkinkan terjadinya transfer virus dan patogen ke generasi selanjutnya yang akan berpengaruh terhadap penurunan produksi (Bhojwani et al. 1982; Conci dan Nome 1991). Ketiga, masa dormansi bawang putih yang memakan waktu 6 bulan sejak dipanen. Dormansi pada umbi bawang putih akan menghambat kelancaran proses produksi serta budidaya yang hanya dapat dilakukan satu kali dalam 1 tahun.
Berdasarkan permasalahan penyediaan bibit, dibutuhkan solusi dalam menyediakan bibit sehat dalam waktu yang cepat. Salah satu solusinya yaitu dengan teknik kultur jaringan. Teknik ini sudah dikenal luas dalam kemampuannya menyediakan sejumlah besar bibit tanaman dalam waktu relatif cepat, bebas dari patogen atau virus, klonal dan tersedia tanpa dipengaruhi musim (Zulkarnain 2009).
Eksplan untuk kultur in vitro bawang putih yang digunakan oleh beberapa peneliti yaitu ujung akar (Shuto et al. 1993), bagian basal (Masuda et al. 1994),
scale tip (Ma et al. 1994; Xue et al. 1991), ujung tunas (Abo El Nil 1977; Bhojwani et al. 1982; Verbeek et al. 1995), daun umbi (Abo El Nil 1977). Suh dan Park (1993) mencoba perbanyakan bawang putih menggunakan eksplan tunas bulbil. Penggunaan eksplan bulbil dalam penelitian tersebut memberikan hasil lain yaitu menurunnya konsentrasi virus dari tunas mikro yang dihasilkan. Penggunaan bulbil sebagai eksplan diduga akan memudahkan proses sterilisasi disebabkan bahan tanaman tersebut berada di bagian tajuk tanaman dan tidak terjadi kontak dengan tanah sebagai salah satu sumber kontaminan.
2
menghindari fase kalus dengan alasan bahwa selama proses regenerasi kalus dapat terjadi variasi somaklonal.
Wiendi et al. (1996) menggunakan kombinasi ZPT 2.4-D dan kinetin sebagai media terbaik untuk induksi tunas adventif bawang putih secara langsung. Barandariaran et al. (1999) dan Haque et al. (1997) mendapatkan media terbaik untuk induksi tunas mikro bawang putih dengan penambahan NAA dan BAP. Suh dan Park (1993) mendapatkan tunas bawang putih kultivar Eusiong dan Nando asal bulbil tertinggi pada media MS dengan tambahan 2.0 ppm BAP dan 2.0 ppm NAA. Roksana et al. (2002) mendapatkan media terbaik induksi tunas bawang putih dengan kombinasi ZPT 0.5 ppm 2iP + 0.25 ppm NAA.
Tujuan Penelitian
Penelitian ini bertujuan untuk mempelajari respon tunas bulbil bawang putih cv. Tawangmangu Baru pada media dengan kombinasi jenis vitamin dan sitokinin secara in vitro.
Hipotesis
Terdapat satu komposisi media yang sesuai untuk induksi dan pertumbuhan tunas adventif asal bulbil bawang putih cv. Tawangmangu Baru.
TINJAUAN PUSTAKA
Bawang Putih (Allium sativum L.)
Tanaman bawang putih (Allium sativum L.) termasuk famili Liliaceae dan merupakan tanaman monokotil (Becker dan van den Brink 1963). Kultivar bawang putih pada umumnya diploid dengan jumlah kromoson 2n=2x=16. Tanaman ini merupakan herba perenial yang membentuk umbi lapis (Van Wyk et al. 1997).
Bawang putih telah digunakan dan dibudidayakan sejak 600 tahun sebelum masehi di India dan Mesir (Rubatzki dan Yamaguchi 1997). Pusat keragaman bawang putih berada di Asia Tengah dan menyebar ke seluruh Asia, China, India dan akhirnya ke seluruh dunia (Kamenetsky 2003). Bawang putih masuk ke Indonesia dibawa oleh para pedagang Cina dan Arab, kemudian dibudidayakan.
Perannya sebagai bumbu penyedap masakan sampai sekarang belum tergantikan oleh penyedap masakan sintesis yang dikemas sedemikian menariknya (Syamsiah dan Tajudin 2003). Bawang putih mempunyai aroma yang kuat, karena itu sebagai bumbu masak penggunaannya relatif sedikit, tetapi masakan tanpa bawang putih akan terasa kurang sedap. Aroma ini disebabkan karena senyawa
3
Alisin pada bawang putih berperan sebagai antibakteri dan cendawan sehingga bayak digunakan sebagai obat dan pestisida. Bawang putih juga digunakan sebagai obat untuk menurunkan tekanan darah tinggi, kembung, infeksi, gatal-gatal pada permukaan kulit, serta sebagai penawar racun serangga berbisa (Jones dan Mann 1983)
Morfologi dan Ekologi Bawang Putih
Bawang putih adalah herba perenial berumpun yang memiliki tinggi 30-75 cm. Batang yang tampak di atas permukaan tanah adalah batang semu yang terdiri dari pelepah-pelepah daun. Daunnya berbentuk pita (pipih memanjang), tepi rata, ujungnya runcing, beralur, panjangnya 60 cm dan lebar 1.5 cm. Batang yang sebenarnya berada dalam tanah. Akar tumbuh dari pangkal batang berbentuk serabut kecil yang banyak dengan panjang kurang dari 10 cm. Akar yang tumbuh pada batang pokok bersifat rudimenter, berfungsi sebagai alat absorbsi unsur hara (Santoso 2000).
Bawang putih membentuk umbi lapis berwarna putih. Satu umbi terdiri dari 8-20 siung (anak bawang). Antara siung satu dengan yang lainnya dipisahkan oleh kulit tipis dan liat serta membentuk satu kesatuan yang kuat dan rapat. Dalam siung terdapat tunas adventif yang dapat tumbuh menerobos pucuk siung mejadi tunas baru, serta daging pembungkus tunas adventif yang berfungsi sebagai pelindung sekaligus gudang persediaan makanan. Bagian dasar umbi pada hakikatnya adalah batang pokok yang mengalami rudimentasi (Santoso 2000).
Gambar 1. Morfologi umbi bawang putih. Irisan melintang umbi bawang putih (a), irisan membujur siung (b), tunas adventif (c) batang semu (1) pelepah yang mengering (2) daun pelindung siung (3) Siung (4) Lubang berisi tunas vegetatif (5) tunas vegetatif (6) eksplan tunas adventif ± 0.5 cm (7) (Sengin 1992)
4
Gambar 2. Bunga bawang putih. (a) Bunga terinduksi di wilayah subtropis (b)Bulbil terdapat pada bunga di wilayah subtropis (Simon et al.
2003) (c) (d) bulbil di dalam batang di wilayah tropis
Bawang putih diperbanyak secara vegetatif karena bunga bawang putih steril (Metwally et al. 2012). Bunga yang steril membuat perbaikan karakter bawang putih melalui teknik pemuliaan konvensional tidak memungkinkan (Nagasawa dan Finer 1988; Barandiaran et al. 1999). Perbayakan secara vegetatif menyebabkan penyakit degeneratif yang akan berpengaruh terhadap kualitas dan kuantitas umbi yang dihasilkan (Bhojwani et al. 1982). Banyak kultivar bawang putih yang membawa berbagai penyakit yang disebabkan oleh virus, nematoda, bakteri dan cendawan (Davies 1994, Verbeek et al. 1995). Penelitian Perez (2014) mendeteksi presentase infeksi virus pada bawang putih yakni 50.9 %
garlic common latent virus (GCLV). Rendahnya tingkat perbanyakan dan akumulasi virus yang dibawa menyebabkan dikembangkannya beberapa protokol dalam perbanyakan bawang putih secara in vitro untuk menjadi solusi meningkatkan perbanyakan dan memproduksi benih bawang putih yang bebas dari virus (Haque et al. 1997; Myers dan Simon 1998; Kim et al. 2003; Luciani et al. 2006).
Bawang putih umumnya tumbuh di dataran tinggi seperti kultivar Lumbu Hijau, Tawangmangu, Lumbu Kuning, Gombloh dan Tes. Beberapa kultivar bawang putih di Indonesia seperti Lumbu putih, Jati Barang, Bagor, Sanur, Sumbawa, Layur dan Obleg mampu tumbuh di dataran rendah. Khusus untuk lahan di dataran rendah, kultivar Lumbu Putih paling banyak disukai oleh petani karena adaptif terhadap iklim (Palungkun dan Asiani 2001). Produksi bawang putih per satuan luas di dataran tinggi lebih besar dari pada di dataran rendah.
Bawang Putih akan tumbuh dan menghasilkan umbi pada kondisi iklim dengan suhu 15-26 oC (Hilman et al. 1997) dan kelembaban relatif 60-80% (Rukmana 2009) Waktu yang paling tepat untuk penanaman bawang putih adalah bulan Mei sampai Juli. Tanaman bawang putih kurang baik ditanam pada musim penghujan karena kondisi tanah yang terlalu basah, akan mempersulit pembentukan siung (Palungkun dan Asiani 2001).
Tanaman bawang putih dapat tumbuh pada berbagai tipe tanah. Pada tanah yang ringan, gembur (bertekstur pasir atau lempung) dan porous dapat
5
menghasilkan umbi bawang putih yang lebih baik dari pada tanah yang berat seperti liat atau lempung. Kondisi tanah yang porous menstimulir perkembangan akar sehingga serapan unsur hara akan berjalan baik. Derajat kemasaman tanah (pH) yang paling disukai adalah 6.5-7.5, sedangkan apabila pH>6.5 maka tanah harus dikapur. Hasil percobaan pada tanah Latosol merah kuning Subang (tergolong lahan marginal dengan pH= 4.8), kebutuhan kapur untuk mencapai pH=9.6 ton/ha dapat meningkatkan hasil umbi bawang putih (Suwandi 1990).
Kultur Jaringan Tanaman
Eksplan
Eksplan adalah bagian dari tanaman yang dipergunakan sebagai bahan untuk inisiasi suatu kultur. Pada prinsipnya semua bagian tanaman dapat digunakan sebagai sumber eksplan, tetapi sebaiknya dipilih bagian-bagian yang belum mengalami perubahan bentuk dan diferensiasi fungsi (Santoso dan Nursandi 2001). Menurut Hussey (1978) penggunaan eksplan dari jaringan muda akan memiliki tingkat keberhasilkan yang lebih baik dibandingkan jaringan yang tua.
Eksplan berukuran besar akan membelah dan tumbuh lebih cepat daripada eksplan yang kecil, tetapi kemungkinan mengandung virus akan lebih besar (Murashige 1973), sebaliknya eksplan yang berukuran kecil tingkat pertumbuhannya lebih rendah. Menurut Murashige (1974) hal-hal yang perlu dipertimbangkan dalam menentukan eksplan yang cocok adalah sumber eksplan, fase perkembangan eksplan, umur eksplan dan perlakuan terhadap eksplan sebelum dikulturkan.
Eksplan memegang peranan penting dalam perbanyakan bawang putih dengan teknik kultur jaringan. Eksplan dari bagian basal siung (cakram) memiliki tingkat kerberhasilan yang tertinggi.Tunas yang langsung terbentuk dari bagian basal ini tidak mengalami perubahan ploidi maupun genetik (Dunstan & Short membutuhkan unsur-unsur mikro seperti Fe, Mn, Zn, B, Mo, dan Co (Dodds dan Roberts 1985).
6
media dasar dan zat pengatur tumbuh dapat mengoptimalkan aktivitas pembelahan sel untuk multiplikasi tunas (Lestari 2008).
Vitamin memiliki fungsi katalis dalam sistem enzim tanaman dan diperlukan dalam jumlah yang kecil. Vitamin yang terdapat pada media MS terdiri atas glisin (2.0 mg L-1), niasin (0.5 mg L-1), piridoksin-HCl (0.5 mg L-1), dan
Tiamin-HCl (0.1 mg L-1) (Murashige dan Skoog 1962). Vitamin yang terdapat pada media B5 terdiri atas niasin (1.0 g L-1), piridoksin-HCl (1.0 mg L-1), dan tiamin-HCl (10.0 g L-1) (Gamborg et al. 1968). Secara komposisi vitamin B5 dan
MS memiliki kesamaan, yang membedakannya adalah konsentrasi vitamin B5 lebih tinggi dibandingkan dengan vitamin MS.
Pemberian niasin (asam nikotinant) dan piridoksin (vitamin B6) dapat meningkatkan pertumbuhan kultur (Gamborg et al.1976). Tiamin diberikan pada medium kultur dalam bentuk tiamin-HCl dengan takaran berkisar 0.1-30.0 mg L-1. Perlunya kehadiran tiamin pada kultur in vitro terutama pada kondisi kandungan sitokinin yang rendah dalam medium. Eriksson (1965), menemukan bahwa niasin dan priridoksin diperlukan pada kultur jaringan Haplopappus gracilis. Asam amino glisin yang terdapat pada media MS berfungsi sebagai sumber nitrogen.
Penelitian Dinarti (2012) menggunakan kombinasi media dasar MS + vitamin B5 + 90 g L-1 sukrosa sebagai media terbaik terbaik inisiasi umbi lapis mikro bawang merah. Pada kultur bawang merah yang dilakukan Karjadi dan Buchory (2007) menghasilkan persentase daun normal pada kultur bawang merah terbesar terdapat pada media B5 tanpa pikloram dan BAP, media MS + BAP tanpa pikloram. Pertumbuhan akar plantlet lebih baik yang dikulturkan pada media MS tanpa BAP atau dengan penambahan BAP dengan konsentrasi rendah. Media B5 menurut Fereol et al. (2002) cocok untuk penumbuhan kalus dari eksplan Allium sp. Kombinasi yang tepat antara auksin, sitokinin, dan media B5 akan menghasilkan kalus yang banyak dan besar.
Zat Pengatur Tumbuh
Zat pengatur tumbuh tanaman didefinisikan sebagai senyawa organik bukan nutrisi yang aktif dalam jumlah kecil (10-6-10-5 mM) yang disintesa pada bagian
tertentu tanaman dan pada umumnya diangkut ke bagian lain tanaman dimana zat tersebut menimbulkan tanggapan secara biokimiawi, fisiologis dan morfologis (Wattimena 1988). Zat pengatur tumbuh yang penting dan banyak digunakan dalam kultur jaringan adalah auksin dan sitokinin. Kedua jenis zat pengatur tumbuh tersebut mempengaruhi pertumbuhan dan morfogenesis dalam kultur sel, jaringan, dan atau kultur organ. Perimbangan konsentrasi dan interaksi antara ZPT yang diberikan dalam media dan yang diproduksi oleh sel secara endogen akan menentukan arah perkembangan suatu kultur (George dan Sherrington 1984; Lestari 2008).
Auksin berperan dalam merangsang pembelahan, pembesaran, pemanjangan dan pertumbuhan sel. Auksin yang terdapat pada pucuk tanaman dapat menyebabkan pertumbuhan pucuk-pucuk baru. Auksin juga menyebabkan terjadinya pertumbuhan kalus. Auksin terbagi dalam dua kategori yaitu auksin endogen dan auksin eksogen (sintetik). IAA merupakan auksin yang disintesis secara alami di dalam tubuh tanaman, namun senyawa ini mudah mengalami degradasi akibat pengaruh cahaya dan oksidasi enzimatik. IAA biasa diberikan pada konsentrasi yang relatif tinggi 1-30 mg L-1. NAA yang merupakan auksin
7
dapat diberika pada medium kultur pada konsentrasi yang lebih rendah, berkisar 0.1-0.2 mg/L. NAA memiliki berat 186.21 dengan rumus molekul C12H10O2
(Santoso dan Nursandi 2001). Pemberian 2,4 D pada konsentrasi 10-7-10-5 M tanpa sitokinin sangat efektif untuk induksi proliferasi kalus pada kebanyakan kultur (Dodds dan Roberts 1985). Menurut Gamborg et al. (1976) senyawa tersebut dapat menekan organogenesis dan sebaiknya tidak digunakan pada kultur yang melibatkan inisiasi pucuk dan akar. Sementara itu, Pierik (1997) menganjurkan untuk membatasi penggunaan 2,4-D pada kultur in vitro karena 2,4-D dapat meningkatkan peluang terjadinya mutasi genetik.
Zat pengatur tumbuh lainnya yang penting dalam kultur jaringan adalah sitokinin yang merupakan turunan adenin. Menurut Murashige (1974) jenis sitokinin yang umum digunakan untuk menginduksi tunas dan kultur jaringan adalah BAP, Kinetin, Zeatin, dan 2 ip. Sitokinin yang paling efektif diantara keempat jenis tersebut adalah zeatin, namun zeatin adalah jenis sitokin yang termahal harganya. Jenis sitokinin yang lainnya yang memiliki efektifitas yang tinggi adalah 2iP. BAP dan Kinetin memiliki efektifitas yang hampir sama. BAP memiliki resistensi terhadap oksidasi yang lebih baik dibandingkan 2iP maupun Kinetin. BAP adalah jenis sitokinin yang relatif tahan degradasi (Wattimena 1988). BAP memiliki berat molekul sebesar 225.26 g/mol dengan rumus C12H11N5 sedangkan 2iP memiliki berat molekul 203.25g/mol (Santoso dan
Nursandi 2001).
Kultur In Vitro Bawang Putih
Teknik perbanyakan in vitro pada bawang dapat diaplikasikan untuk berbagai tujuan, antara lain untuk perbanyakan tanaman secara mikro, mendapatkan tanaman bebas virus, dan perbaikan klon melalui metode mutasi maupun transformsi genetik (Conci & Nome 1991, Sawahel 2002, Walkey et al.
1987). Eksplan bawang putih yang digunakan berupa tunas adventif (Wiendi et al.
1996,Haque et al. 1997), ujung akar (Haque et al. 1997, Myers & Simon 1999, Fereol et al. 2002), cakram batang, organ bunga, basal plate (Luciani et al. 2006) daun muda (Nagasawa & finer 1988) dan kultur maristem (Haque et al. 2003). serta Tunas bulbil (Suh dan Park 1993).
Pembentukan tunas secara langsung tergantung dari eksplan digunakan. Laju perkembangan tunas adventif dapat didorong dengan mengatur kondisi kultur. Wiendi et al. (1996) menggunakan media BDS (Dunstan dan Short 1977) dan kombinasi ZPT 0.4 ppm 2,4-D dan 2 ppm kinetin serta air kelapa dengan konsentrasi 10% yang terbaik untuk induksi tunas adventif secara langsung dan tidak langsung. Barandariaran et al. (1999) menggunakan media B5 (Gamborg et al. 1968) dan Haque et al. (1997) menggunakan media MS sebagai media terbaik untuk induksi tunas dengan kombinasi NAA dan BAP. Suh dan Park (1993) mencoba menggunakan bulbil yang di kulturkan di media MS dengan tambahan ZPT NAA dan BAP. Inisiasi tunas tertinggi dihasilkan pada media dengan tambahan 2.0 ppm BAP dan 2.0 ppm NAA.
8
dilakukan dengan peningkatan konsentrasi sukrosa dengan dikombinasikan dengan etephon dan BA (Keller 1993).
METODE
Tempat dan Waktu Pelaksanaan
Penelitian dilaksanakan di Laboratorium Kultur Jaringan 3, Departemen Agronomi dan Hortikultura, Fakultas Pertanian, Institut Pertanian Bogor. Penelitian dilaksanakan dari bulan Agustus sampai Desember 2014.
Bahan dan Alat
Bahan yang digunakan adalah bulbil bawang putih cv. Tawangmangu Baru, hara makro dan mikro media MS, vitamin MS dan B5, sukrosa, BAP, 2ip, NAA, agar-agar, aquadestilata, desinfektan, alkohol 96%, agrimisin dan, mancozeb 80. Alat yang digunakan terdiri dari peralatan gelas (botol kultur, gelas ukur, gelas piala, cawan petri, corong gelas, botol ukur), kompor, autoklaf, laminar air flow cabinet, peralatan diseksi (pinset, gunting, dan scalpel), kertas pH, lampu spirtus, botol sprayer, rak kultur, dan plastik wrap.
Rancangan percobaan yang digunakan adalah Rancangan Acak Lengkap (RAL) satu faktor yaitu komposisi media (Tabel 1). Setiap perlakuan diulang lima kali sehingga terdapat 20 satuan percobaan. Setiap satuan percobaan terdiri dari tiga botol yang ditanam satu tunas bulbil per botol. Seluruhnya terdapat 60 botol satuan amatan.
Tabel 1.Komposisi media perlakuan Media
perlakuan Media dasar Jenis Vitamin Jenis Sitokinin Auksin MSI Media MS Vitamin MS 2.00 ppm 2iP 0.5 ppm NAA MSB Media MS Vitamin B5 2.25 ppm BAP 0.5 ppm NAA MBI Media MS Vitamin MS 2.00 ppm 2iP 0.5 ppm NAA MBB Media MS Vitamin B5 2.25 ppm BAP 0.5 ppm NAA
Model rancangan yang digunakan dalam penelitian adalah :
Yi = µ +αi + εi
Keterangan :
Yijk = Respon pengamatan pada perlakuan komposisi media ke-i µ = Rataan umum
αi = Pengaruh perlakuan kombinasi media ke-i
εi = Pengaruh galat perlakuan kombinasi media ke-i
Data pengamatan yang diperoleh, selanjutnya dianalisa dengan uji F pada taraf kepercayaan 95% (α=5%). Jika terdapat pengaruh nyata, maka dilakukan uji lanjut dengan BNT (Beda Nyata Terkecil). Pengolahan data dilakukan dengan program Statistical Analysis System (SAS).
9
dilakukan tanpa mengeluarkan eksplan dari botol. Pengamatan dilakukan terhadap beberapa peubah yaitu persentase kontaminasi, jumlah tunas, jumlah daun, jumlah akar, dan persentase kultur berumbi.
Pelaksanaan
Media MS dan B5 dibuat dari larutan stok yang telah tersedia, kemudian ditambahkan aquades hingga mencapai 1 Liter. Setiap jenis media ditambahkan zat pengatur tumbuh sesuai perlakuan yaitu 2.0 ppm 2ip + 0.5 ppm NAA dan 2.25 ppm BAP + 0.5 ppm NAA. Media diatur derajat kemasamannya hingga mencapai derajat kemasaman (pH) 5.7. Kemasaman larurtan (pH) media diatur dengan menambahkan KOH 1 N atau HCl 1 N sehingga mencapai pH 5.8. Media yang telah diatur pH-nya ditambahkan agar-agar sebanyak 7 g L-1 dimasak hingga larut. Media dituangkan ke dalam botol-botol kultur steril yang telah dipersiapkan masing-masing 10 ml untuk setiap botolnya. Botol segera ditutup rapat dengan menggunakan plastik dan diikat dengan karet gelang lalu disterilkan dengan
autoclave pada suhu 121oC dengan tekanan 17.5 Psi selama 20 menit. Botol-botol media yang telah disterilkan kemudian disimpan dalam ruang kultur media.
Eksplan bulbil yang diambil dari lapang dimasukkan ke dalam lemari pendingin selama dua bulan untuk memecah dormansi dari bulbil. Ukuran bulbil yang digunakan beragam dengan panjang antara 3-15 mm dan diameter antara diameter 2-10 mm. (Gambar 3)
Gambar 3. Ukuran bulbil yang digunakan
Metode sterilisasi diawali dengan mengupas dan membuang lapisan terluar bulbil. Bahan tanam selanjutnya dicuci bersih dengan sabun dan air mengalir, kemudian direndam dalam larutan sterilan yang mengandung mancozeb 80 dan streptomycin 17 berturut-turut 1.6 g L-1 dan 0.3 g L-1 selama 24 jam. Bulbil
kemudian dibilas dengan aquadestilata. Pengerjaan selanjutnya dilakukan di
Laminar Air Flow Cabinet. Bulbil direndam dengan NaOCl 1.05% selama 30 menit kemudian dibilas dengan aquadestilata.
10
Tunas adventif disubkultur ke media perlakuan pada 3 MST. Kriteria eksplan yang disubkultur memiliki minimal satu daun yang telah membuka penuh, tidak mengalami vitrivikasi dan browning/pencoklatan.
HASIL DAN PEMBAHASAN
Keadaan umum
Sterilisasi merupakan tahap terpenting dalam menghasilkan eksplan yang steril. Sterilisasi dilakukan untuk mengurangi terjadinya kontaminasi. Menurut Moeso (1977) gagal tidaknya kultur jaringan terutama terletak pada kemampuan menjaga eksplan tetap steril. Metode sterilisasi yang dilakukan telah sesuai yang ditunjukkan dengan persentase kontaminasi yang sangat rendah. Eksplan yang ditanam pada media MS 0 100% steril (Gambar 4 a dan b).
Gambar 4. Tunas Bulbil. (a) Tunas Bulbil setelah diisolasi (b) Kultur tunas bulbil setelah 2 MSP
Metode yang sama dilakukan dalam sterilisasi bawang putih tunggal, didapatkan hasil eksplan steril sebesar 20 %. Berdasarkan hal tersebut eksplan yang berasal dari dalam tanah memiliki potensi kontaminasi yang lebih tinggi dibandingkan dengan eksplan yang terletak jauh dari tanah. George dan Sherrington (1984) menyatakan bahwa semakin kecil ukuran eksplan, akan semakin kecil pula kemungkinan terjadinya kontaminasi, baik secara internal maupun eksternal, namun laju proliferasi akan rendah.
Hasil penelitian pendahuluan ini menunjukkan ukuran bulbil yang cukup kecil berpotensi untuk dijadikan bahan perbanyakan bawang putih dalam kultur
in vitro. Menurut Gunawan (1987) bahwa setiap bagian tanaman dapat digunakan sebagai sumber eksplan, tetapi sebaiknya dipilih bagian yang belum banyak mengalami perubahan bentuk dan diferensiasi fungsi. Menurut Hussey (1978) penggunaan eksplan dari jaringan muda akan memiliki tingkat keberhasilan yang lebih baik dibandingkan jaringan tua. Eksplan yang ukurannya lebih besar akan membelah dan membesar lebih cepat daripada eksplan yang kecil, tetapi kemungkinan mengandung virus yang lebih besar (Murashige 1973), sedangkan Hussey (1978) menyatakan bahwa ukuran potongan tunas yang dibutuhkan kultur cukup kecil saja dan berguna untuk mendapatkan eksplan yang tidak terkontaminasi.
Eksplan tunas adventif yang steril disubkultur ke media perlakuan. Tingkat kontaminasi eksplan setelah subkultur termasuk tinggi pada 1 MSP (Minggu
11
Setelah Perlakuan) mencapai 40%. Kontaminasi yang disebabkan oleh cendawan mula-mula terlihat dipermukaan dan atau di tepi media yang kontak langsung dengan dinding botol. Kontaminasi yang disebabkan oleh bakteri terjadi langsung pada eksplan, ditandai dengan munculnya lendir berwarna putih keruh disekeliling bagian pangkal tunas eksplan. Nisa dan Rodinah (2005) menyatakan bahwa eksplan yang terinfeksi bakteri, virus, atau cendawan akan menyebabkan kontaminasi pada tahap pertumbuhan meskipun pada awal penanaman tidak terlihat. Kontaminasi juga sangat ditentukan oleh sterilitas ruangan dan kemungkinan munculnya mikroorganisme yang bersifat sistemik. Faktor lain kontaminasi juga berasal dari keahlian dan kehati-hatian peneliti saat melakukan kultur di dalam laminar air flow.
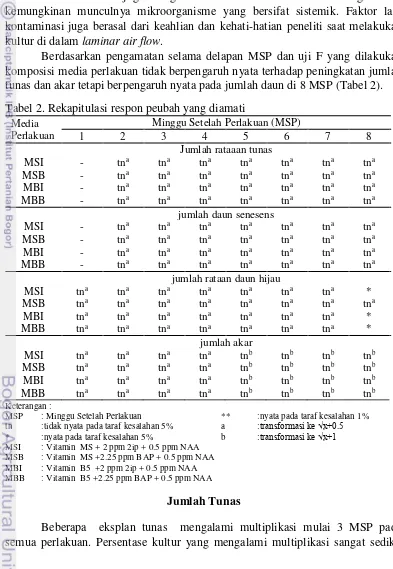
Berdasarkan pengamatan selama delapan MSP dan uji F yang dilakukan komposisi media perlakuan tidak berpengaruh nyata terhadap peningkatan jumlah tunas dan akar tetapi berpengaruh nyata pada jumlah daun di 8 MSP (Tabel 2). Tabel 2. Rekapitulasi respon peubah yang diamati
12
(Tabel 3). Persentase kultur yang mengalami multiplikasi terjadi pada media dengan penambahan vitamin B5 cenderung lebih baik dibandingkan pada media dengan vitamin MS. Hal itu diduga disebabkan konsentrasi vitamin dari vitamin B5 lebih tinggi daripada vitamin MS yang berpengaruh terhadap pembelahan sel dan pertumbuhan tunas.
Tabel 3. Presentase kultur tunas bulbil bawang putih yang mengalami multiplikasi tunas pada empat komposisi media selama 8 MSP
Media
keterangan: hasil tidak berbeda nyata berdasarkan BNT pada taraf α=5%. MSI : Vitamin MS + 2 ppm 2ip + 0.5 ppm NAA
MSB : Vitamin MS +2.25 ppm BAP + 0.5 ppm NAA MBI : Vitamin B5 +2 ppm 2ip + 0.5 ppm NAA MBB : Vitamin B5 +2.25 ppm BAP + 0.5 ppm NAA
Komposisi media tidak nyata meningkatkan rata-rata jumlah tunas yang terbentuk (Tabel 4). Tunas baru terbentuk mulai 3 MSP. Rata-rata jumlah tunas pada media yang vitaminnya dimodifikasi dengan vitamin B5 baik dengan penambahan 2ip dan BAP memiliki rata-rata jumlah tunas lebih banyak dibandingkan perlakuan lainnya.
Tabel 4. Rata-rata jumlah tunas mikro bawang putih pada empat taraf komposisi media selama 8 MSP
Keterangan: Hasil tidak berbeda nyata berdasarkan BNT pada taraf α=5%. MSI : Vitamin MS + 2 ppm 2ip + 0.5 ppm NAA
MSB : Vitamin MS +2.25 ppm BAP + 0.5 ppm NAA MBI : Vitamin B5 +2 ppm 2ip + 0.5 ppm NAA MBB : Vitamin B5 +2.25 ppm BAP + 0.5 ppm NAA
Rata-rata jumlah tunas pada penelitian ini termasuk rendah. Salah satu kemungkinan penyebabya adalah sitokinin gagal menginduksi pembentukan tunas, menurut Street (1973) dalam Doods dan Roberts (1985), karena konsentrasi hormon terlalu kecil, sehingga perlu ditambah untuk menginduksi tunas lebih banyak. Pendapat tersebut diperkuat George dan Sherington (1984) yang menyatakan konsentrasi 2iP untuk dapat menginduksi tunas adventif secara langsung adalah 4,9-49,3 µM atau setara dengan 1.0-10.0 mg L-1 dengan
13
oksidasi yang lebih baik. Wattimena (1988) menambahkan bahwa BAP adalah jenis sitokinin yang relatif tahan degradasi dan harganya murah. Rendahnya jumlah tunas adventif bawang putih yang terbentuk diduga juga karena kandungan hormon sitokinin dan auksin yang sangat rendah pada tunas yang berasal bulbil sehingga penambahan secara eksogen belum mampu meningkatkan keseimbangan hormon endogen walaupun sudah ditambahkan BAP atau 2ip sebanyak 10 µM. BAP dan 2ip pada percobaan ini mempunyai efektifitas yang sama terhadap pembentukan tunas bawang putih dengan eksplan tunas bulbil
Jumlah daun
Daun mengalami pertumbuhan mengikuti siklus pertumbuhan jenis allium yang tumbuh secara in vivo. Eksplan mengalami pertumbuhan daun sampai tahap tertentu, kemudian daun akan senesens dan berganti ke proses pengisian umbi (Rismunandar 1986).
Daun yang diamati adalah daun yang telah membuka penuh. Perlakuan komposisi media tidak nyata meningkatkan jumlah daun hijau dari 1 MSP hingga 7 MSP akan tetapi pada 8 MSP memberikan hasil berbeda nyata (Tabel 5). Daun baru, muncul pada 1 MSP dan terus bertambah setiap minggunya sampai 4 MSP dan mulai 5 MSP tidak terbentuk lagi daun baru. Rata-rata jumlah daun pada keempat perlakuan terjadi pada 4 MSP antara 1-3 helai dengan rata-rata jumlah daun terbanyak diperoleh pada perlakuan media dasar MS dengan penambahan 2 ppm 2iP + 0.5 ppm NAA (MSI) dan berbeda nyata dengan media perlakuan MS dengan penambahan 2.25 ppm BAP + 0.5 ppm NAA (MSB) pada 8 MSP.
14
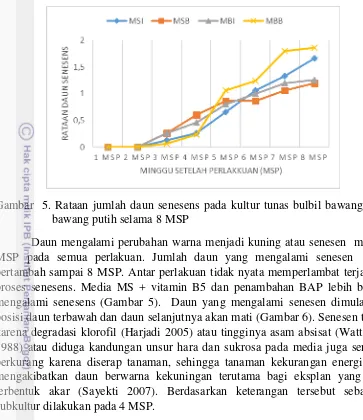
Gambar 5. Rataan jumlah daun senesens pada kultur tunas bulbil bawang putih bawang putih selama 8 MSP
Daun mengalami perubahan warna menjadi kuning atau senesen mulai 3 MSP pada semua perlakuan. Jumlah daun yang mengalami senesen terus bertambah sampai 8 MSP. Antar perlakuan tidak nyata memperlambat terjadinya proses senesens. Media MS + vitamin B5 dan penambahan BAP lebih banyak mengalami senesens (Gambar 5). Daun yang mengalami senesen dimulai dari posisi daun terbawah dan daun selanjutnya akan mati (Gambar 6). Senesen terjadi karena degradasi klorofil (Harjadi 2005) atau tingginya asam absisat (Wattimena 1988) atau diduga kandungan unsur hara dan sukrosa pada media juga semakin berkurang karena diserap tanaman, sehingga tanaman kekurangan energi yang mengakibatkan daun berwarna kekuningan terutama bagi eksplan yang tidak terbentuk akar (Sayekti 2007). Berdasarkan keterangan tersebut sebaiknya subkultur dilakukan pada 4 MSP.
Gambar 6. Tunas Bulbil yang mengalami senesens
15
vitrifikasi adalah tingginya kadar etilen dalam kultur. Menurut Leopold dan Kriedmann (1975) produksi etilen dipacu oleh tingginya kandungan auksin dan stress lingkungan. Eksplan yang mengalami vitrifikasi ditandai dengan pertumbuhan dan perkembangan yang tidak normal, kandungan air dalam jaringan tinggi (Yusnita 2003).
Jumlah akar
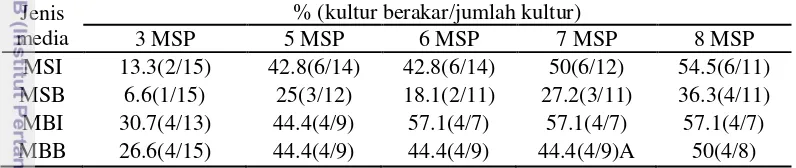
Pembentukan akar terjadi sejak 2 MSP. Akar yang terbentuk umumnya tumbuh baik dan terlihat semakin menebal dari 1 MSP hingga 8 MSP. Presentase kultur yang berakar di semua perlakuan juga tergolong rendah (Tabel 6). Media dengan penambahan 2 ppm 2ip memiliki persentase kultur berakar lebih tinggi dibandingkan dengan perlakuan lain.
Tabel 6. Presentase kultur berakar pada kultur tunas bulbil bawang putih selam 8 MSP
Keterangan: hasil tidak berbeda nyata berdasarkan BNT pada taraf α=5%. MSI : Vitamin MS + 2 ppm 2ip + 0.5 ppm NAA
MSB : Vitamin MS +2.25 ppm BAP + 0.5 ppm NAA MBI : Vitamin B5 +2 ppm 2ip + 0.5 ppm NAA MBB : Vitamin B5 +2.25 ppm BAP + 0.5 ppm NAA
16
Tabel 7. Rata-rata jumlah akar eksplan pada berbagai komposisi media perlakuan Jenis
media
Jumlah akar per eksplan
2 MSP 3 MSP 5 MSP 6 MSP 7 MSP 8 MSP
MSI 0.12 0.26 1.1 1.1 1.76 1.4
MSB 0.06 0.06 0.26 0.3 0.36 0.43
MBI 0.3 0.4 0.86 0.86 1 1.06
MBB 0 0.36 0.52 0.72 1 1.2
keterangan: hasil tidak berbeda nyata berdasarkan BNT pada taraf α=5%. MSI : Vitamin MS + 2 ppm 2ip + 0.5 ppm NAA
MSB : Vitamin MS +2.25 ppm BAP + 0.5 ppm NAA MBI : Vitamin B5 +2 ppm 2ip + 0.5 ppm NAA MBB : Vitamin B5 +2.25 ppm BAP + 0.5 ppm NAA
Umbi Mikro
Beberapa eksplan pada penelitian ini membentuk umbi mikro (bulblet) dengan persentase pembentukan umbi rendah. Umbi mikro dari eksplan tunas bulbil bawang putih dapat terbentuk meskipun dikulturkan pada media inisiasi tunas (Tabel 8). Perlakuan media MS dengan penambahan 2ip merupakan perlakuan yang menghasilkan kultur yang membentuk umbi terbanyak.
Tabel 8. Persentase tunas membentuk umbi pada media perlakuan selam 8 MSP
Keterangan:
MSI : Vitamin MS + 2 ppm 2ip + 0.5 ppm NAA MSB : Vitamin MS +2.25 ppm BAP + 0.5 ppm NAA MBI : Vitamin B5 +2 ppm 2ip + 0.5 ppm NAA MBB : Vitamin B5 +2.25 ppm BAP + 0.5 ppm NAA
Gambar 7. Bulblet in vitro (a) penampang melintang dari eksplan berasal dari bawang putih tunggal (b) penampang melintang dari eksplan berasal dari bulbil (1)Tunas adventif (2) Siung
Berdasarkan Gambar 7 dapat dilihat bahwa penampang melintang bulblet bawang putih in vitro yang berasal darieksplan bawang putih tunggal dan tunas jenis media % (eksplan membentuk umbi/ jumlah eksplan) MSI 33.33(5/15)
MSB 13.33(2/15) MBI 13.33(2/15) MBB 6.66(1/15)
17
bulbil memiliki kesamaan anatomi yakni tidak terbentuk siung-siung atau partisi. Bulblet bawang putih in vitro mempunyai tunas adventif, organ penyimpanan yang tebal dan lapisan kulit terluar yang tipis seperti pada bulblet bawang putih tunggal. Terbentuknya bulblet secara in vitro dari eksplan tunas bulbil sangat memungkinkan untuk menerapkan penanaman bulbil dilapangan untuk menghasilkan umbi bawang putih tunggal.
KESIMPULAN DAN SARAN
Simpulan
Tunas bulbil tumbuh dan berkembang pada semua media perlakuan tetapi multiplikasi tunas belum optimal. Komposisi media nyata meningkatkan jumlah daun hijau pada 8 MSP dan tidak berpengaruh pada peubah jumlah tunas dan akar. Jumlah daun hijau dan bulblet mikro terbanyak diperoleh pada perlakuan media MS dengan penambahan 2 ppm 2ip.
Saran
Bulbil dapat dipergunakan sebagai eksplan untuk perbanyakan mikro bawang putih. Perlu dilakukan penelitian lanjutan untuk mendapatkan konsentrasi ZPT yang optimal untuk perbanyakan tunas bulbil.
DAFTAR PUSTAKA
Abo ENM. 1977. Organogenesis and embryogenesis in callus culture of garlic.
Plant Sci. Lett. 9:259-264.
[BPS] Badan Pusat Statistik. 2013. Statistik Produksi, luas panen dan produktivitas hortikultura di Indonesia. Jakarta(ID).
Barandariaran X, Martin N, Rodriguez M, Di Pietro A, Martin J. 1999. Genetic performance of micropropagation plants. Sci.Hort. 18: 39-43.
Bhojwani SS, Razdan MK. 1983. Plant Tissue Tulture : Therory and Practice. Amsterdam (NL): Elsevier.
Block. 1985. The chemistry of onions and garlic. Scientific american. 252:94-99. Conci V, Nome S. 1991. Virus free garlic (Allium sativum L.) plants obtained by
thermotherapy and maristem tip culture. J. Phytopath. 132:186-192.
Dantu PK, Bhojwani SS. 1987. In vitro propagation and corm formation in gladiolus. Gartenbauwissenschaft. 52:90-93
18
Digby JF, Skoog. 1966. Cytokinin activation of thiamine biosyntesis in tobacco callus cultures. Plant Physiol.41(4):647-52.
Dinarti D. 2012. Perbanyaan dan Induksi Umbi Lapis Mikro Bawang Merah secara In Vitro [disertasi]. Bogor (ID): Institut Pertanian Bogor.
Dravnicks DE, Skoog F, Burris RH. 1969. Cytokinin activation of de novo thiamine biosynthesis in tobacco calus cultures. Plant Physiol. 44(6):866– 870.
Dunstan, DI, KC Short. 1977. Improved growth of tissue culture of onion Allium cepa. Physiol Plant. 41:70-72. doi : 10.1111/j.
Dodds JH, Roberts LW.1985. Experiments in Plant Tissue Culture. New York [USA] : Cambridge University Press.
Eriksson T. 1965. Studies on the growth requirements and growth measurements of Haplopappus gracilis. HortScience. 18(4):976-993
FAO. 2010. Food and Agriculture Organization. [internet]. [diunduh 2014 Des 1] tersedia pada www.fao.org
Fereol L, Chovelon V, Causse S, Michaux FN, Kahane R. 2002. Evidence of a somatic embryogenesis process for plant regeneration in garlic (Allium sativum L.). Plant Cell Rep. 21:197-203
Gamborg OL. 1991. Kalus dan Kultur Sel. dalam : Metode Kultur Jaringan Tanaman. Bandung (ID): ITB Press.
Gamborg OL, Shyluk JP, Shahin EA. 1981. Isolation, Fusion, and Culture of Plant Protoplast. New York (US): Academic Press.
Gamborg OL, Miller RA, Ojima K. 1968. Nutrient requirements of suspension cultures of soybean root cells. Exp Cell Res. 50(1):151-8.
Gamborg OL. 1976. Plant Tissue Culture Media. In vitro. 12(7):473-8.
George EF, Sherrington PD. 1984. Plant Propagation by Tissue Culture. London(UK): Exegatus Ltd.
Gunawan LW. 1987. Teknik Kultur Jaringan: Lab Kultur Jaringan Tanaman. Bogor(ID): Pusat Antar Universitas Bioteknologi, Institut Pertanian Bogor. Harjadi MM. 2005. Pengatar Agronomi. Jakarta (ID): Gramedia.
Haque MS, Wada T, Hattori K. 2003. Shoot regeneration and bulblets formation from shoot and root maristem of garlic CV Bangladesh Local. Asian J.
Jones HA, Mann LK. 1983. Onions and Their allief. London (UK):Leonard Hill Ltd.
Karjadi AK, Buchory A. 2008. Pengaruh komposisi media dasar, Penambahan BAP dan Pikloram terhadap induksi tunas bawang merah. J. Hort. 18(1):1-9 Keller ERJ. 1993. Sucrose, cytokinin and ethylene influence formation of in vitro bulblets in onion and leek. Genetic Resources and Crop Evolution 40:113-120.
Kamenetsky R, Rabinowitch HD. 2001. Floral Development in Bolting Garlic.
19
Kamenetsky R, London SI, Baizerman M, Khassanov F, Kik C, Rabinowitch HD. 2003. Garlic (Allium sativum) and its wild relatives from Central Asia: evaluation for fertility potential. Proceeding of the XXVIth Internatioanal Horticulture Congress. august 2002, Toronto, nama negara, Canada [CA] Acta Hort in Press. 637:83-91.
Leopold AC, Kriedmann. 1975. Plant Growth and Development. Washington (US): Mc Graw-Hill Inc.
Lestari EG. 2008. Kultur Jaringan : Menjawab Persoalan Pemenuhan Kebutuhan Akan Peningkatan Kualitas Bibit Unggul dan Perbanyakan Secara Besar-besaran. Bogor (ID): Penerbit Akademia.
Linsmaier BSM, Skoog F. 1967. Thiamine requirement in relationship to
cytokinin in “normal”and “mutant” strains of tobacco callus.Physiol plant. 18:100-127.
Luciani GF, Mary AK, Pellegrini C, Curvetto NR.2006. Effects of explants and growth regulators in garlic callus formation and plant regeneration. Plant Cell Tissue Organ Cult 87:139-142.
Ma YH, Wang L, Zhang J, Kang YQ. 1994. High rate of virus free plantlet regeneration via garlic scape tip culture. Plant Cell Rpt. 14:65-68.
Masuda K, Hatakeyama A, Ito ST, Inoue M. 1994. Micropropagation of garlic (Allium sativum L). Bul Akita Pref. 20:43-48.
Metwally EI, El Denary ME, Omar AMK, Naidoo Y, Dewir YH. 2012. Bulb and vegetative characteristics of garlic (Allium sativum L.) from in vitro culture through acclimatization and field production. Afr. j. Agric. res. 7(43):5792-5795.
Moeso S. 1977. Mari Bertanam Anggrek. Yogyakarta(ID): Yayasan Kanisius. Murashige T. 1974. Plant Propagation through Tissue Culture. Ann. Rev. Plant
Physiol 25:135-166.
Murashige T. 1977. Plant Tissue Cultre and Its Bio-technological Apllication. New York (US) : Springer Verlag.
Myers JM, Simon PW. 1999. Regeneration of garlic callus as affected by clonal variation, plant growth regulators and culture conditions over time. Plant Cell Reports 19:32-36.
Nagasawa A, Finer J. 1988. Development of morphogenic suspension culture of garlic (Allium sativum L.). Plant Cell Tissue Organ Cult 15:183-187.
Nisa R, Rodinah. 2005. Kultur jaringan beberapa kultivar buah pisang (Musa paradisiaca L.) dengan pemberian campuran NAA dan kinetin.
Bioscienticae. 2(2):23-26.
Perez Morena L, Sabinanez JLI, Mendoza CB, Ramirez MR, Nunez PHG. 2014. Effect of natural virus infection on quality and yield garlic elite lines.
Journal of Experimental Biology and Agricultural Sciences. 2(2):2320-8694 Pierek, RLM. 1987. In Vitro Culture of Higher Plants. Boston (US): Martinus
Nihjoff Publ.
Palungkun R, Budiarti A. 2001. Bawang Putih Dataran Rendah. Jakarta (ID): Penebar Swadaya
20
Reynolds JF, Murashige T. 1979. Asexual Embriogenesis in Callus Cultures of Palms. In vitro. 15(5):383-387.
Rismunandar. 1986. Membudidayakan Lima Jenis Bawang. Bandung(ID):CV. Sinar Baru.
Roksana R, Alam MF, Islam R, Hossain MM. 2002. In vitro bulblet formation from shoot apex in garlic (Allium sativum L.). Plant Tissue Cult. 12(1):11-17.
Rukmana R. 2009. Budidaya Bawang Putih. Yogyakarta (ID) Kanisius.
Santoso HB.2000. Bawang Putih. Edisi ke-12. Yogyakarta(ID): Penerbit Kanisius.
Santoso U, Nursandi F. 2001. Kultur Jaringan Tanaman. Malang (ID): UMM Press.
Sayekti U. 2007. Pengaruh Media Terhadap Pertumbuhan dan Perkembangan Kecambah Kantong Semar (Nephentes mirabilis) secara In Vitro. [Skripsi]. Bogor (ID): Institut Pertanian Bogor.
Sengin, Enny L. 1992. Perbanyakan mikro pada tanaman bawang putih (Allium sativum L.) [disertasi]. Bogor (ID): Institut Pertanian Bogor.
Shuto, Abe HT, Sasahara T. 1993. In vitro propagation of plants from root apex-derived calli in chinese chieve (Allium tuberosum Rottler) and garlic (Allium sativum L.). Jpn. J. Breed. 43:349-354.
Simon PW, Jenderek MM. 2003.Flowering, seed production and the genesis of garlic breeding. Plant Breeding review. 23:211
Shu SK, Park HG. 1993. Rapid multiplication through immature bulbil culture of garlic (in Korean). J. Korean Soc. Hort. Sci. 34:173-178.
Suwandi. 1990. Pengaruh Pengapuran dan Pemberian Pupuk Kandang Terhadap Pertumbuhan dan Hasil Bawang Putih pada Tanah Latosol Merah Kuning. Lembang (ID) : Balai Penelitian Hortikultura.
Steveinson C, Pittler MH, Ernst E. 2000. Garlic for treating hypercholesterolemia. A metaanalysis of randomized clinical trials. Ann Intern Med.
133(6):420-Taji AM, Dodd WA, Williams RR. 1995. Plant Tissue Culture Practice. Armidale (AU): University of New England.
Tattelman E. 2005. Health effect of garlic. Am Fam Physician. 72(1):103.
Van Wyk BE, Van Oudsthoorn B, Gericke N. 1997. Medicinal plants of South Africa. Pretoria (ZA): Briza Publication.
Verbeek M, van dijk P, van Well PM. 1995. Efficiency of eradication of four viruses from garlic (Allium sativum L.) by maristem tip culture. European Journal of Plant Pathology.101:231-239
Wareing PF, Philips IDJ. 1981. Growth and Differentiation in Plants.New York(US): Pergamon Press.
Wattimena GA. 1988. Zat Pengatur Tumbuh Tanaman. IPB. Bogor (ID): PAU. Wiendi NMA, Wattimena GA, Prasetyanti E. 1996. Perbanyakan in vitro tanaman
21
Xue HE, Araki H, Shi L,Yakuwa L, 1991. Somatic embryogenesis and plant regeneration in basal plate and receptacle derived callus culture of garlic (Allium sativum L.). J. Japan Soc Hort. Sci. 60 : 627-634.
Yoo KS, Pike LM, Cobb BG. 1990. Promotion of In Vitro. New Jersey (US): Avery Publ. Group Inc.
Yusnita. 2003. Kultur Jaringan Cara Memperbanyak Tanaman Secara Efisien. Jakarta(ID) :Agromedia Pustaka.
Ziv M. 1991. Vitrification: Morphological and Physiological Disorder of In Vitro Plants. Boston (US): Kluwer Academic Publisher.
22
LAMPIRAN
Lampiran 1. Komposisi Medium Murashige dan Skoog (MS) (1962) dan Medium B5 Gamborg OL, Millers RA dan Ojima K (1968)
Senyawa Konsentrasi dalam media MS (mg/L)
Konsentrasi dalam media B5 (g/L)
(NH4)2SO3 1.650 -
(NH4)2SO4 - 134
KNO3 1.900 2.500
NaH2PO4. 2 H2O - 130.5
H3BO3 6.2 3.0
KI 0.83 0.75
Na2MoO4. 2 H2O 0.25 0.25
CoCl2. 6 H2O 0.025 0.025
CaCl2. 2H2O 440 150
MgSO4. 7H20 370 250
KH2PO4 170 -
MnSO4.4H2O 22.3 -
MnSO4.H2O - 10
ZnSO4. 4H2O 8.6 2.0
CuSO4.5H2O 0.025 0.025
Na2EDTA 37.26 37.3
FeSO4. 7H2O 27.8 27.8
Myo-inositol 100 100
Niasin 0.5 1.0
glisin 2.0
Piridoksin-HCl 0.5 1.0
Tiamin 0.1 10.0
23
RIWAYAT HIDUP
Penulis dilahirkan di Sukoharjo pada 15 April 1992. Penulis adalah anak ke empat dari empat bersaudara keluarga Bapak Suradi dan Ibu Warsih. Penulis mulai bersekolah di SDN Mattoanging 3 Kota Makassar pada tahun 1999-2004. Tahun 2007, penulis lulus dari SMPN 1 Kota Makassar dan melanjutkan ke SMAN 11 Kota Makassar. Tahun 2010 melanjutkan studi pada Departemen Agronomi dan Hortikultura Fakultas Pertanian IPB melalui jalur USMI.
Selama menjadi mahasiswa, penulis tergabung dalam beberapa organisasi mahasiswa antara lain: IAAS Indonesia (International Association of Student in Agriculture and Related Sciences) sebagai Vice Director of Partnership, BEM Faperta Kepala Departemen PSDM, BEM KM IPB sebagai Menteri PSDM.