KARAKTERISASI BAKTERI ENDOFIT PENGHASIL
VOLATILE ORGANIC COMPOUNDS
(VOCs) UNTUK
MENINGKATKAN KETAHANAN TANAMAN
KENTANG TERHADAP PENYAKIT LAYU BAKTERI
ALINA AKHDIYA
SEKOLAH PASCA SARJANA
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI DISERTASI
DAN SUMBER INFORMASI
Dengan ini saya menyatakan bahwa disertasi ”Karaterisasi Bakteri Endofit Penghasil Volatile Organic Compounds (VOCs) untuk Meningkatkan Ketahanan Tanaman Kentang terhadap Penyakit Layu Bakteri” adalah karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir disertasi ini.
Bogor, 17 Juli 2014
ALINA AKHDIYA. Karaterisasi Bakteri Endofit Penghasil Volatile Organic Compounds (VOCs) untuk Meningkatkan Ketahanan Tanaman Kentang terhadap Penyakit Layu Bakteri. Dibawah bimbingan ARIS TRIWAHYUDI, ABDUL MUNIF, dan LATIFAH K DARUSMAN.
Kebutuhan kentang nasional terus meningkat seiring dengan peningkatan populasi dan pendapatan penduduk serta industri pengolahan makanan. Namun upaya peningkatan produksi kentang di Indonesia menghadapi berbagai kendala diantaranya serangan hama penyakit serta kualitas bibit kentang yang rendah.
Ralstonia solanacearum adalah patogen penyebab penyakit layu bakteri pada tanaman kentang. Pada varietas-varietas yang rentan, tingkat kehilangan hasil yang ditimbulkan oleh penyakit ini dapat mencapai 100%.
Produksi bibit kentang yang berkualitas tinggi dalam skala besar dapat dilakukan dengan teknologi perbanyakan in vitro (kultur jaringan). Perbanyakan secara in vitro dilakukan pada kondisi yang steril dan terkontrol. Sebagai konsekuensinya, bibit tanaman yang dihasilkan banyak kehilangan mikroorganisme berguna yang turut berperan dalam ketahanan tanaman terhadap patogen. Inokulasi dini bakteri endofit merupakan saah satu alternatif yang baik untuk melindungi dan meningkatkan ketahanan bibit tanaman hasil kultur invitro terhadap penyakit layu bakteri. Penelitian ini bertujuan untuk : (1) mengisolasi dan menapis bakteri endofit yang mampu meningkatkan ketahanan bibit kentang terhadap penyakit layu bakteri yang disebabkan oleh Ralstonia solanacearum, (2) mengkarakterisasi isolat bakteri endofit terpilih, dan (3) menelaah kemampuan kolonisasi isolat bakteri endofit terpilih pada planlet kentang.
Bakteri endofit kentang diisolasi dari dua varietas tanaman kentang (Granola dan Atlantic) yang diambil dari Pasir Wangi, Garut dan Kebun Percobaan Balai Penelitian Tanaman Sayuran di Lembang. Penapisan isolat dilakukan berdasarkan pengujian-pengujian berikut : uji aktivitas hemolitik, uji hipersensitif respon (HR) pada daun tembakau, uji patogenisitas terhadap planlet kentang, serta uji peningkatan ketahanan tanaman kentang yang ditanam pada kondisi tidak steril dan steril.
Sebanyak 214 bakteri endofit berhasil diisolasi dari kedua varietas tanaman kentang tersebut. Diantara isolat-isolat tersebut, 168 bersifat non-hemolitik dan tidak menimbulkan reaksi HR pada daun tembakau. Dari 168 isolat, 119 diantaranya non-patogenik terhadap planlet kentang. Empat isolat yaitu G053, G062, G0196, dan L-12 mampu menurunkan DI layu bakteri dan meningkatkan pertumbuhan tanaman kentang pada uji ketahanan yang dilakukan pada kondisi tidak steril. Penapisan berikutnya menunjukkan hanya 2 isolat bakteri endofit yaitu G053 dan G062 yang secara nyata mampu meningkatkan ketahanan dan pertumbuhan tanaman kentang. Kedua isolat tersebut diisolasi dari batang tanaman kentang varietas Atlantic yang diambil dari Garut.
menghasilkan senyawa serupa fitohormon dan siderofor, serta menambat nitrogen. Kemampuan fiksasi nitrogen kedua bakteri endofit tersebut dapat meningkatkan ketersediaan nitrogen tanaman inang, sehingga tanaman inang tumbuh lebih baik dari pada tanaman kontrol yang tidak diperkaya dengan bakteri endofit tersebut. M. endophyticus G053 juga mengemisikan berbagai senyawa organik volatil (VOCs) dan mengekskresikan kitinase, sedangkan P. halophylus
G062 juga mampu menghasilkan enzim pelarut fosfat.
Untuk menelaah perubahan fisiologis tumbuhan inang terkait respon induksi resistensi oleh kedua bakteri endofit terpilih terhadap infeksi R. solanacearum, dilakukan pengukuran kadar protein daun dan aktivitas enzim (peroksidase, polifenol oksidase atau PPO, dan askorbat peroksidase atau APX) terhadap tanaman yang diperkaya dengan bakteri endofit tersebut . Duapuluh empat jam setelah inokulasi R. solanacearum, kadar protein, aktivitas polifenol oksidase (PPO), askorbat peroksidase (APX), dan peroksidase tanaman G053 meningkat lebih tinggi dibandingkan dengan tanaman kontrol dan G062. Peningkatan kadar protein total, aktivitas PPO, APX, dan peroksidase tanaman yang diperkaya isolat G053 berturut-turut mencapai 4.6%, 2075%, 111%, dan 42%, sedangkan pada tanaman G062 hanya meningkat aktivitas enzim peroksidase (126%) dan kadar protein totalnya (0.09%). Telaah lebih lanjut menunjukkan bahwa setelah infeksi
R. solanacearum, emisi etilen oleh tanaman G053 lebih tinggi dibandingkan dengan tanaman kontrol. Kandungan lignin tanaman G053 yang diinfeksi R. solanacearum juga meningkat 23.5%, sebaliknya lignin tanaman kontrol turun 26.7%.
VOCs yang diemisikan M. endophyticus G053 merupakan campuran dari sedikitnya 16 senyawa volatil. Metil eugenol (ME) merupakan komponen utama VOCs M. endophyticus G053. Kompleks VOCs tersebut juga mengandung heksadekan dalam konsentrasi yang lebih rendah. Paparan VOCs M. endophyticus
G053 terhadap planlet yang diinfeksi R. solanacearum mampu mereduksi nilai DI layu bakteri sebesar 46.7%. Hal ini diduga disebabkan oleh komponen heksadekan dalam VOCs tersebut. Heksadekan merupakan kandidat senyawa sinyal baru untuk menginduksi ekspresi protein PR1 yang berperan dalam mekanisme ketahanan tumbuhan melalui lintasan Systemic Acquired Resistance
(SAR). Paparan kompleks VOCs dan ME juga terbukti dapat menekan produksi EPS bakteri patogen ini. Perbedaan EPS yang diproduksi oleh kultur R. solanacearum A dan B yang dipapar dan tidak dipapar VOCs berturut-turut mencapai 34% dan 155%. Selisih kadar EPS tersebut hanya mencapai 4.7% dan 75% berturut-turut untuk R. solanacearum galur A dan B ketika kultur patogen ini dipapar dengan ME. Pengamatan kemampuan kolonisasi M. endophyticus G053 dan Paracoccus halophylus G062 yang dilakukan dengan teknik reisolasi dan pengamatan mikroskopis menggunakan scanning electron microscope
menunjukkan bahwa kedua bakteri endofit tersebut memiliki kemampuan kolonisasi dan persistensi yang tinggi pada planlet dan tanaman kentang.
dan perlindungan yang kuat pada tanaman kentang terhadap penyakit. Sedangkan
P. halophylus G062 meningkatkan ketahanan tanaman kentang melalui aktivasi ISR. Kedua bakteri endofit tersebut sangat potensial untuk dikembangkan menjadi agen hayati yang unggul untuk ketahanan tanaman kentang terhadap penyakit layu bakteri dan meningkatkan pertumbuhannya.
Organic Compounds (VOCs) to Enhance Potato Plant Resisantance Against Bacterial Wilt Disease. Under supervision of ARIS TRIWAHYUDI, ABDUL MUNIF, dan LATIFAH K DARUSMAN.
National potato demand is increasing due to growth of population, increasing of public income and food processing industries. However in the efforts to increase potato production in Indonesia, it faces many obstacles including pests, diseases and low quality of the potato seedling. Ralstonia solanacearum is important pathogens for potato plant. Yield loss caused by the disease could reach up to 100% on the susceptible cultivars.
Production of high-quality potatoes seedling on a large scale could done by in vitro propagation (tissue culture). In vitro propagation was carried out in sterile and controlled conditions. As a consequence, the seedlings are lost many useful microorganisms that play an important role in plant growth and resistance against pathogens. Early inoculation of bacterial endophytes is one of good alternative way to protect and increase resistance of seedling produced by tissue culture against bacterial wilt.
This research was conducted to (1) isolate and screen the endophytic bacteria that can increase the resisitance of potato plant (G0) against Ralstonia Solanacearum, (2) identify the bacterial compounds indicating had an important role in increasing of plant resistance mechanism, and (3) observe the colonization ability of selected endophytic bacteria in potato plantlets. The endophytic bacteria were isolated from 2 cultivars (Granola and Atlantic) from Pasir Wangi, Garut and the research station of the Research Center of Horticultural Crop (BALITSA) Lembang, Bandung. Screening of the isolates was based on haemolytic test, hypersensitive response (HR) on tobacco leaves, pathogenecity against potato plantlets test, and ability of the isolates to induce potato plant resistant on unsterile and sterile conditions.
As many as 214 endophytic bacterial isolates were successfully isolated. Among the isolates, 168 isolates were non-haemolytic and did not cause HR reaction on tobacco leaves. A hundred and nineteen isolates of them were non-pathogenic against potato plantlets. Four isolates i.e. G062, G0196, dan L-12 isolates showed their ability to decrease bacterial wilt DI and to promote potato plant growth on the plant resistance test conducting on unsterile condition. Further screening showed that only 2 endophytic isolates i.e G053 and G062 could enhance the plants resistance against bacterial wilt and promote plant growth significantly. Both isolates were isolated from the stem of potato plants cv. Atlantic which were taken from Garut.
G053 emitted volatile organic compounds (VOCs) and excreted chitinase, while
P. halophylus G062 produced phosphate solubilizing enzyme.
To study physiological change of the host plants due to resistant induction response by the both of selected endophytic bacteria against R. Solanacearum
infection, analysis of protein content and enzyme activity (peroxydase, polyphenol oxydase and ascorbate oxydase) were conducted to the endophytic bacteria enriched and control plants. Twenty four hours after R. solanacearum
infection, the leaf protein content, polyphenol oxidase (PPO) activity, ascorbic peroxidase (APX), and peroxidase activity of the G053 enriched plants were increased higher than that of the control and G062 enriched plants. Increasing of the total protein content, and activity of PPO, APX, and peroxidase of G053 plants were 4.6%, 2075%, 111%, and 42% respectively. On the othe hand, the G062 enriched plants were olny increased for the protein content (0.09%) and peroxidase activity (126%). Further studies showed that the G053 plants emitted higher level of ethylene than that of the control plants after infected with the pathogen. In addition, lignin content of G053 treated plants was increase by 23.5%, but it was decrease by 26.7% on the control plants.
VOCs emitted by M. endophyticus G053 were mixed of at least 16 volatile compounds. Methyl eugenol (ME) was primary VOCs of M. endophyticus G053. The VOCs also contained hexadecane in lower concentration. VOCs exposured to the plantlet infected by R. solanacearum could reduce DI of bacterial wilt by 46.7%. It was presumably caused by hexadecan component in the VOCs. Hexadecan was a new signaling compound candidate to induce gene expression of PR1 protein that involved in Systemic Acquired Resistance (SAR) pathway. Additionally, VOCs and ME exposure could reduce EPS production by the pathogen. The difference between EPS production by R. solanacearum strains A and B that were exposed and unexposed to the VOCs were 34% and 155% subsequently. While there were only 4.7% dan 75% for the strain A dan B subsequently when the pathogen cultures exposed to ME. Observation of M. endophyticus G053 colonization ability conducted by reisolation technique and
scanning electron microscope showed that M. endophyticus G053 and P. halophylus G062 were endophytic bacteria having high colonization ability and persistency in potato plantlets and plants.
Based on the characters and plant resistance test results, it was concluded that bacterial endophyte M. endophyticus G053 could activate SAR and ISR of the potato plant pararely. Accumulation effect of both resistance pathways and its high colonization and persistance ability resulted the strong enhancement and protection against the disease. While resistance enhancement activated by P. halophylus G062 was through the ISR pathways. Both of the endophytic bacteria had a great potent to be developed as a great biological agent to enhance potato plant resistance against bacterial wilt disease and to promote the plant growth.
© Hak cipta milik IPB, tahun 2014
VOLATILE ORGANIC COMPOUNDS
(VOCs) UNTUK
MENINGKATKAN KETAHANAN TANAMAN
KENTANG TERHADAP PENYAKIT LAYU BAKTERI
ALINA AKHDIYA
Disertasi sebagai salah satu syarat
untuk memperoleh gelar Doktor
pada Program Studi Mikrobiologi
SEKOLAH PASCA SARJANA
INSTITUT PERTANIAN BOGOR
Penguji pada ujian tertutup :
1. Dr Giyanto, MSi. (Departemen Proteksi Tanaman, Fakultas Pertanian, IPB).
2. Dr Rakhmat Sutarya, MS. (Balai Penelitian Tanaman Sayuran, Badan Litbang Pertanian, Lembang).
Penguji pada ujian terbuka :
1. Dr Yulin Lestari MS. (Departemen Biologi, FMIPA, IPB).
kekuatan, serta kesabaran yang telah dilimpahkan Allah SWT sehingga penulis berhasil menyelesaikan disertasi yang berjudul “Karakterisasi Bakteri endofit yang Efektif untuk Meningkatkan Ketahanan Tanaman Kentang terhadap Penyakit Layu Bakteri” ini. Kentang merupakan komoditas pertanian introduksi yang telah diterima dengan baik oleh masyarakat Indonesia sebagai salah satu bahan pangan komplemen serta memiliki nilai ekonomi yang relatif tinggi. Budidaya kentang yang sangat rentan terhadap serangan berbagai penyakit mendorong petani untuk mengaplikasikan pestisida sintetik secara tidak rasional untuk menyelamatkan tanamannya. Kecenderungan praktek budidaya kentang yang tidak ramah lingkungan tersebut menjadi salah satu pertimbangan penulis dalam untuk memilih topik penelitian ini.
Penelitian dan disertasi ini terwujud atas dukungan dan bantuan berbagai pihak. Oleh karena itu penulis menyampaikan terima kasih kepada pihak-pihak tersebut :
1. Prof Dr Aris Tri Wahyudi, MSi., Dr Abdul Munif, MSc. Agr. dan Prof Dr Latifah K Darusman selaku pembimbing atas bimbingan dan arahan yang diberikan selama penelitian dan penulisan disertasi.
2. SEAMEO BIOTROP sebagai pengelola program PhD Research Grant atas dana penelitian yang diberikan untuk pelaksanaan sebagian penelitian ini. 3. Bpk. Rahmat dan Ajat (Gapoktan Multi Tani Jayagiri Desa Cipendawa,
Pasir Cina Cianjur) atas segala bantuan penggunaan fasilitas screen house dan perawatan tanaman.
4. Tira Nur Afiah SSi., Ari Fina Bintarti, MSi., Andri Ferbianto, SSi., Herni Widiatuti SSi. (Laboratorium BrMC SEAMEO BIOTROP) dan rekan peneliti serta teknisi di kelti Biak Sel dan Jaringan dan Biokimia BB-BIOGEN atas bantuannya selama pelaksanaan penelitian.
5. Pegawai Laboratorium Mikrobiologi, Departemen Biologi, FMIPA IPB, atas segala bantuan, fasilitas dan penggunaan alat.
6. Prof Dr Akira Yokota atas bimbingannya dalam melakukan analisa FAME dan GC-content.
7. Prof Dr Ika Mariska S atas masukan dan diskusinya tentang aspek fisiologi tumbuhan dan Prof Dr Supriadi atas kesediaanya mengoreksi manuskrip publikasi.
8. Dr Giyanto, MSi. (Departemen Proteksi Tanaman, Fakultas Pertanian, IPB) dan Dr Rakhmat Sutarya (Balai Penelitian Tanaman Sayuran) atas kesediannya sebagai penguji dan saran perbaikan yang diberikan pada ujian tertutup.
9. Dr Yulin Lestari dan Prof Dr Supriadi atas kesediannya sebagai penguji dan saran perbaikan yang diberikan pada ujian terbuka.
ilmiah yang berguna dalam bidang mikrobiologi dan pengelolaan hama dan penyakit tanaman di Indonesia serta dapat dikembangkan menjadi teknologi alternatif yang baik untuk meningkatkan produksi kentang melalui teknik budidaya pertanian yang berkelanjutan dan ramah lingkungan.
Bogor, Juli 2014
HALAMAN PERNYATAAN ... i
RINGKASAN ... iii
SUMMARY ... vi
HALAMAN HAK CIPTA ... viii
HALAMAN JUDUL ... x
HALAMAN PENGESAHAN ... xi
PRAKATA ... xiii
DAFTAR ISI ... xv
DAFTAR TABEL ... xviii
DAFTAR GAMBAR ... xix
DAFTAR LAMPIRAN ... xxiii
PENDAHULUAN ... 1
Latar Belakang ... 1
Tujuan ... 2
Manfaat Penelitian ... 2
Kerangka Pemikiran ... 2
Novelty ... 3
Hipotesis ... 3
Kerangka Penelitian ... 3
TINJAUAN PUSTAKA ... 5
Ralstonia solanacearum Penyebab Penyakit Layu Bakteri ... 5
Bakteri Endofit ... 5
Peran Bakteri Endofit dalam Meningkatkan Ketahanan Tanaman. 6 VOCs Sebagai Penginduksi Ketahanan Tanaman ... 10
Aplikasi Bakteri Endofit untuk Meningkatkan Resistensi, Pertumbuhan, dan Produktivitas Tanaman ... 11
BAHAN DAN METODE ... 13
. Prosedur Sterilisasi Permukaan dan Isolasi Bakteri Endofit ... 13
Contoh tanaman ... 13
Optimasi sterilisasi permukaan akar ... 13
Sterilisasi permukaan batang dan daun ... 15
Isolasi bakteri endofit dari jaringan tanaman kentang ... 15
. Penapisan Isolat Bakteri Endofit Kentang Tahap I ... 16
Bioesei Respon Hipersentif (HR) ... 17
Uji hemolitik ... 18
Uji patogenisitas isolat terhadap plantlet kentang ... 18
Uji ketahanan tanaman Generasi 0 (G0) yang diperkaya isolat bakteri endofit terhadap layu bakteri ... 18
bakteri endofit pada media steril ... 19
Evaluasi DI tanaman Generasi 1 (G1) pada media tidak steril 20 Analisis Respon Fisiologis Tumbuhan Terkait Ketahanan ... 20
a Penentuan kandungan protein total...... 20
b Pengukuran aktivitas enzim peroksidase ... 20
c Pengukuran aktivitas enzim polifenol oksidase ... 21
d Pengukuran aktivitas enzim askorbat peroksidase ... 21
e Pengukuran emisi etilen ... 21
f Penetapan kandungan lignin like compounds ... 21
Pengamatan Pertumbuhan Tanaman dan Produktivitas Umbi ... 22
Uji Kolonisasi ... 22
Pengamatan tampilan morfologi akar planlet yang diperkaya dengan bakteri endofit ... 22
Pengamatan secara mikroskopis ... 22
Reisolasi M. endophyticus G053 dari tanaman dan planlet ... 22
Karakterisasi Isolat Bakteri Endofit Terpilih ... 23
Identifikasi dan karakterisasi molekuler ... 24
Karakterisasi fisiologis dan biokimia ... 25
a Uji fisiologis dan biokimia umum ... 25
b Uji aktivitas fiksasi nitrogen ... 25
c Uji kemampuan produksi plant growth hormone like compounds ... 26
d Uji kemampuan produksi siderofor ... 26
e Analisa Fatty Acid Methyl Ester (FAME) ... 27
f Bioesei produksi VOCs dan aktivitas penghambatannya terhadap kultur R. solanacearum ... 27
Pengamatan motilitas dan morfologi ... 28
Identifikasi Komponen VOCs dan Pengaruhnya terhadap R. solanacearum dan Planlet Kentang ... 28
Trapping dan identifikasi komponen VOCs G053 ... 28
Uji pengaruh VOCs terhadap produksi EPS oleh R.solanacearum ... 28
Uji pengaruh VOCs terhadap munculnya gejala layu bakteri pada planlet ... 29
Penyimpanan isolat ... 29
HASIL DAN PEMBAHASAN ... 30
Optimasi Prosedur Sterilisasi Permukaan Akar ... 30
Isolasi bakteri Endofit ... 31
Isolat bakteri endofit terseleksi I ... 35
Isolat bakteri endofit terseleksi II ... 38
Tanaman Kentang ... 48
Identitas dan Karakter Isolat Bakteri Endofit G053 dan G062 ... 53
Identitas dan Karakter molekuler ... 53
Deskripsi karakter fisiologis dan biokimia ... 55
Deskripsi karakter morfologi ... 62
Identitas Komponen Senyawa VOCs M. endophyticus G053 ... 64
Pengaruh VOCs Isolat G053 dalam Menekan Gejala Layu Bakteri pada Planlet dan Produksi EPS ... 65
Peran M. endophyticusG053 dan P. halophilus G062 dalam Induksi Resistensi Tanaman Kentang ... 69
SIMPULAN ... 73
DAFTAR PUSTAKA ... 75
LAMPIRAN ... 85
RIWAYAT HIDUP ... 91
No Halaman
n
1. Beberapa senyawa dan determinan bakteri penginduksi
ketahanan pada beberapa tumbuhan (Chodhary dan Johri 2009) 9
2. Komposisi campuran reaksi PCR untuk amplifikasi 16S rDNA
G053 dan G062 24
3. Kondisi reaksi PCR amplifikasi 16S rDNA G053 dan G062 24
4. Peningkatan emisi etilen dan kadar lignin tanaman G053dan
kontrol setelah infeksi R. solanacearum 42
5. Densitas isolat G053 pada planlet dan tanaman kentang 50
6. Karakter fisiologis dan biokimia M. endophyticus G053 56
7. Aktivitas fiksasi nitrogen dan produksi senyawa mirip fitohormon (IAA, Giberellin, zeatin, dan ABA like) oleh
M. endophyticus G053 dan aracoccus halophilus G062 57
8. Komposisi asam lemak sel M. endophyticus G053 YIM 56238,
K. rosea DSMZ 20447 dan K. erythromyxa ATCC 187 58
9. Karakter fisiologis dan biokimia P..halophilus G052 60
10 Karakter P. halophilus G062, strain pembanding, serta beberapa
spesies terdekat 61
11. Komposisi VOCs M. endophyticus G053 yang tertangkap
dengan hexan 64
12. Nilai DI layu bakteri pada kelompok plantlet yang tidak dipapar
dan dipapar dengan VOCs dari M. endophyticus G053 65
13. Perbedaan kadar EPS kultur R. solanacearum yang dipapar VOCs isolat G053 dan metil eugenol dengan yang tidak dipapar
1. Diagram alir kegiatan penelitian yang dilakukan 4
2. Lintasan induksi resistensi tanaman oleh bakteri patogen
dan rhizobacteria (Vallad dan Goodman 2004) 7
3. Model induksi ISR dan SAR secara paralel (Saskia et al.
2000) 8
4. Diagram alir prosedur sterilisasi permukaan akar 14
5. Diagram alir isolasi bakteri endofit dari tanaman kentang 16
6. Diagram alir penapisan isolat bakteri endofit dan kajian
perubahan fisiologis inang 17
7. Diagram alir kegiatan karakterisasi isolat bakteri endofit
terpilih yang dilakukan dalam penelitian ini 23
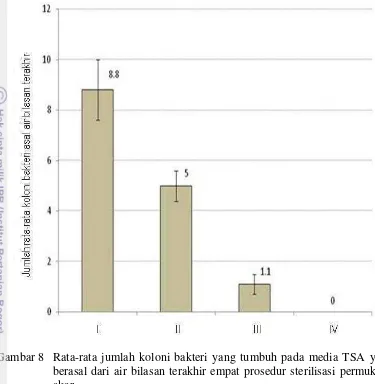
8. Rata-rata jumlah koloni bakteri yang tumbuh pada media TSA yang berasal dari air bilasan terakhir empat prosedur sterilisasi
permukaan akar 31
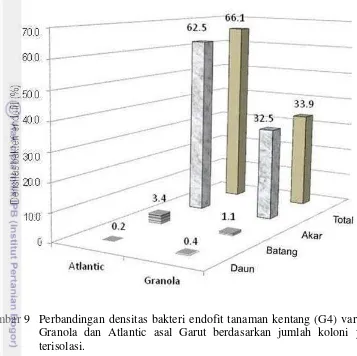
9. Perbandingan densitas bakteri endofit tanaman kentang (G4) varietas Granola dan Atlantic asal Garut berdasarkan jumlah koloni yang terisolasi
32
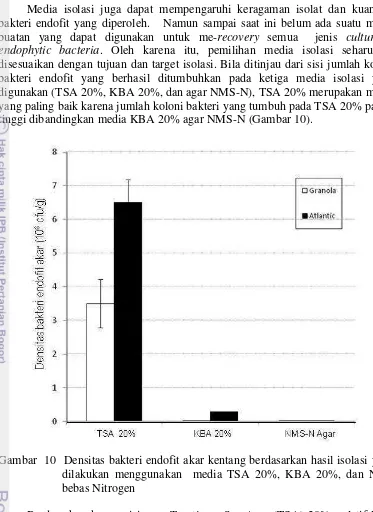
10. Densitas bakteri endofit akar kentang berdasarkan hasil isolasi yang dilakukan menggunakan media TSA 20%, KBA 20%,
dan NMS bebas Nitrogen 33
11. Densitas bakteri endofit batang kentang berdasarkan hasil isolasi yang dilakukan menggunakan media TSA 20%, KBA
20%, dan NMS bebas Nitrogen 34
12. Densitas bakteri endofit daun kentang berdasarkan hasil isolasi yang dilakukan menggunakan media TSA 20%, KBA
20%, dan NMS bebas Nitrogen 34
13. Tampilan koloni isolat bakteri endofit yang bersifat hemolitik
dan nonhemolitik pada medium agar darah 36
14. Reaksi jaringan daun tembakau pada 24 jam (A) dan 96 jam (B) setelah diinfiltrasi dengan suspensi R. solanacearum
endofit 37
16. Parameter pertumbuhan tanaman G0 yang diinokulasi dengan
empat isolat terpilih yang ditanam pada media tidak steril 38
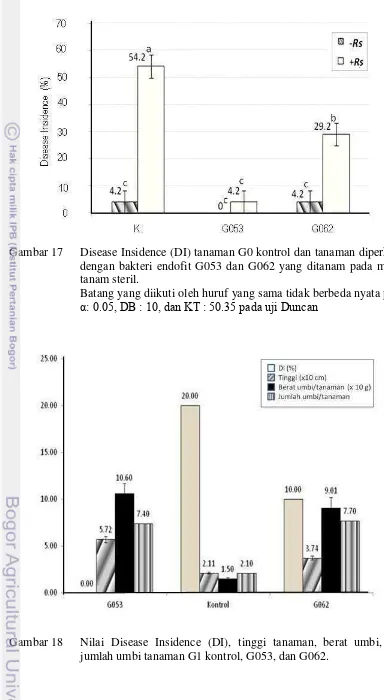
17. Disease Insidence (DI) tanaman G0 kontrol dan yang diperkaya dengan bakteri endofit G053 dan G062 yang
ditanam pada media tanam steril 39
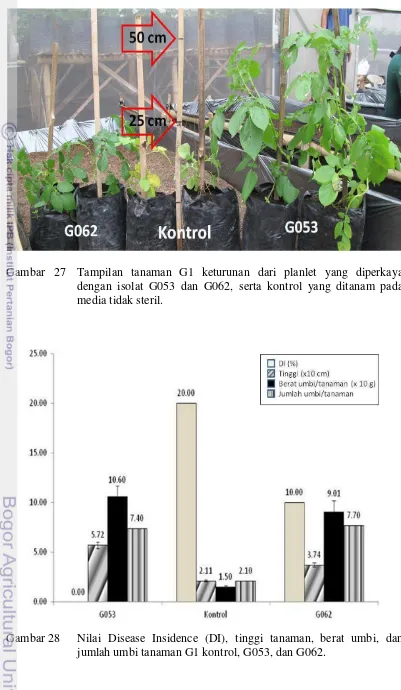
18. Nilai Disease Insidence (DI), tinggi tanaman, berat umbi, dan
jumlah umbi tanaman G1 kontrol, G053, dan G062 39
19. Peningkatan kadar protein tanaman G0 pada 24 jam dan 48
jam setelah infeksi (jsi) R. solanacearum 40
20. Peningkatan aktivitas enzim APX peroksidase, peroksidase, dan polifenol oksidase tanaman kentang (G0) 24 jam setelah
infeksi Ralstonia solanacearum 41
21. Lintasan biosintesis dan regulasi etilen pada tanaman 43
22. Pengaruh pengayaan bakteri endofit terhadap berat kering tajuk tanaman kentang G0 yang tidak diinfeksi dan diinfeksi
dengan R. solanacearum 44
23. Pengaruh pengayaan bakteri endofit terhadap berat kering akar tanaman kentang G0 yang tidak diinfeksi dan diinfeksi
dengan R. solanacearum 45
24. Pengaruh pengayaan bakteri endofit terhadap jumlah umbi kentang pada tanaman G0 yang tidak diinfeksi dan diinfeksi
dengan R. solanacearum 45
25. Pengaruh pengayaan bakteri endofit terhadap berat umbi kentang dari tanaman G0 yang tidak diinfeksi dan diinfeksi
dengan R. solanacearum 46
26. Tampilan tanaman G0 yang diperkaya dengan isolat G053 dan G062, serta kontrol yang ditanam pada media tanam yang
telah disteril 46
27. Tampilan tanaman G1 kontrol dan tanamana yang diperkaya dengan isolat G053 dan G062, serta kontrol yang ditanam
pada media tidak steril 47
29. Tampilan akar planlet setelah diinokulasi dengan bakteri
endofit 49
30. Mikrograf elektron payar jaringan batang plantlet kontrol
pada perbesaran 1000X 50
31. Mikrograf elektron payar jaringan batang plantlet yang diinokulasi isolat bakteri endofit G053 pada perbesaran
1000X 51
32. Mikrograf elektron payar jaringan xilem planlet yang
dikolonisasi oleh isolat G053 pada perbesaran 7500X 51
33. Mikrograf elektron payar kolonisasi isolat G062 disekitar jaringan bunga karang pada batang planlet kentang pada
perbesaran 750X 52
34. Mikrograf elektron payar koloni isolat G062 disekitar jaringan bunga karang dalam batang planlet kentang pada perbesaran
10000X 52
35. Pohon filogenetik M. endophyticus G053 dan beberapa bakteri
yang berkerabat dekat 53
36. Pohon filogenetik Paracoccus halophilus G062 dan beberapa
bakteri yang berkerabat dekat 54
37. Produk PCR gen senyawa antifungi dari Paracoccus
halophilus G062 55
38. Aktivitas kitinolitik M. endophyticus G053 (A) dan pelarutan
fosfat isolat oleh P. halophilus G062 (B) 56
39. Produksi VOCs oleh M. endophyticus G053 yang berpengaruh
terhadap R.solanacearum 57
40. Hasil pewarnaan Gram dan morfologi koloni M. endophyticus
G053 dan P. halophilus G062 yang tumbuh pada media TSA 62
41. Foto mikrograf elektron payar M. endophyticus G053 (A) dan
P. halophilus G062 (B) pada perbesaran 10000X 63
42. Pengaruh paparan VOCs isolat bakteri endofit G053 terhadap
44. Model hipotetik induksi resistensi sistemik hibrid tanaman
kentang oleh M. endophyticus G053 70
45. Produksi etilen dan kaitannya dengan ISR (Pieterse et al.
PENDAHULUAN
Latar Belakang
Kentang (Solanum tuberosum Linn.) merupakan bahan makanan pokok di dunia setelah beras, gandum, dan jagung. Kentang juga merupakan salah satu komoditas hortikultura yang memiliki harga yang cukup tinggi dalam perdagangan domestik maupun internasional. Kebutuhan kentang nasional terus meningkat seiring dengan peningkatan populasi dan pendapatan penduduk serta industri pengolahan makanan. Dalam rangka memenuhi kebutuhan kentang nasional, pemerintah menjadikan kentang sebagai salah satu prioritas pengembangan komoditas hortikultura nasional. Upaya peningkatan produksi kentang di Indonesia menghadapi berbagai kendala diantaranya serangan hama penyakit serta kualitas bibit kentang yang rendah. Layu bakteri merupakan penyakit penting pada budidaya kentang. Penyakit ini disebabkan oleh bakteri patogen Ralstonia solanacearum. Bakteri ini merupakan bakteri fitopatogen paling merusak di seluruh dunia karena keragamannya yang sangat tinggi terkait dengan asal geografis dan inangnya (Genin 2010). Survey yang dilakukan terhadap 458 anggota komunitas internasional bacterial pathologist bekerjasama dengan Jurnal Molecular Plant Pathology menempatkan R. solanacearum pada peringkat kedua setelah P. syringae untuk kategori bakteri fitopatogen yang penting secara ilmiah dan ekonomi (Mansfield et al. 2012).
Kehilangan hasil yang disebabkan oleh penyakit layu bakteri di wilayah Sumatera, Jawa, Bali, Lombok, dan Sulawesi berkisar 15%-95% (Machmud 2005). Survei dan inventarisasi patogen tular-tanah di lahan pertanaman kentang di Kabupaten purbalingga yang dilakukan pada tahun 2008-2009 menunjukkan persentase populasi R. solanacearum mencapai 71.6% dan menempati peringkat pertama dari 7 spesies mikroba fitopatogen tular-tanah (R. solanacearum, Fusarium oxysporum, F. solani, Curvularia sp. Phytophtora infestans, Helminthosporium purpureum, Pseudomonas berpendar) yang ditemukan (Soesanto et al. 2011). Pada umumnya petani kentang mengaplikasikan pestisida sintetik untuk melindungi tanamannya dari serangan penyakit. Namun aplikasi pestisida sintetik secara tidak rasional dan berlebihan dalam jangka panjang menimbulkan masalah serius bagi lingkungan dan meningkatkan residu dalam umbi kentang.
Berbagai hasil penelitian di luar negeri yang berkaitan dengan eksplorasi dan eksperimen aplikasi bakteri endofit sebagai agensia biokontrol fitopatogen pada bibit dan tanaman telah banyak dilaporkan (Andreotte et al. 2010; Hoon et al. 2007). Namun demikian, studi tentang aplikasi bakteri endofit pada planlet dan pengaruhnya terhadap ketahanan bibit kentang terhadap penyakit belum pernah dilaporkan di Indonesia. Oleh karena itu, eksplorasi karakterisasi, dan percobaan aplikasi bakteri endofit dari Indonesia sangat penting untuk dilakukan, karena sebagai negara tropis Indonesia memiliki kondisi dan iklim yang berbeda.
Tujuan
Secara umum penelitian ini dilakukan dengan tujuan untuk mendapatkan bakteri endofit yang efektif untuk meningkatkan ketahanan tanaman kentang terhadap penyakit layu bakteri. Tujuan umum tersebut dicapai melalui beberapa tahap penelitian dengan tujuan khusus untuk :
1. Mengisolasi dan menapis bakteri endofit yang efektif untuk meningkatkan ketahanan tanaman kentang terhadap penyakit layu bakteri yang disebabkan oleh Ralstonia solanacearum.
2. Mengamati kemampuan kolonisasi isolat bakteri endofit terpilih pada planlet dan tanaman kentang.
3. Menguji kemampuan bakteri endofit terpilih dalam menghasilkan Volatile Organic Compounds (VOCs) yang berperan dalam meningkatkan ketahanan tanaman kentang terhadap penyakit layu bakteri
4. Mengkarakterisasi isolat bakteri endofit yang terpilih.
Manfaat Penelitian
1. Memberikan kontribusi informasi ilmiah bagi penelitian dan pengembangan agen hayati untuk penyakit layu bakteri yang baik dan unggul di Indonesia 2. Tersedianya kandidat agen hayati yang terkarakterisasi dengan baik serta
memiliki kemampuan tinggi dalam meningkatkan pertumbuhan serta resistensi dan atau melindungi tanaman kentang dari penyakit layu bakteri. 3. Meeningkatan kualitas dan produktivitas bibit kentang.
Kerangka Pemikiran
R. solanacearum merupakan bakteri fitopatogen yang memiliki kisaran inang yang sangat luas dan menjadi masalah di negara-negara subtropis maupun tropis. Karakter R. solanacearum yang menjadikan jaringan xilem sebagai sasaran aktivitas patogeniknya serta persistensinya yang tinggi ketika berada di tanah menjadikannya sulit dikendalikan. Pemanfaatan bakteri endofit sebagai agen hayati untuk meningkatkan ketahanan tanaman sekaligus mengendalikan fitopatogen ini merupakan alternatif strategi yang baik dan tepat karena kedua jenis bakteri ini memiliki relung ekologi yang sama tetapi memiliki karakter yang berbeda.
dilakukan. Isolasi bakteri endofit, penapisan, interaksi isolat terpilih dengan
tanaman inang dan Ralstonia solanacearum, kemampuan kolonisasi, serta
karakter-karakter isolat terpilih perlu dikaji secara seksama untuk mendapatkan kandidat agen hayati yang efektif, unggul, dan aman untuk meningkatkan ketahanan tanaman terhadap penyakit ini.
Novelty
Hasil penelusuran yang telah dilakukan menunjukkan bahwa sampai saat ini belum ada laporan dari dalam atau luar negeri tentang kajian pemanfaatan bakteri
endofit yang menghasilkan Volatile Organic Compounds (VOCs) untuk
meningkatkan ketahanan tanaman kentang terhadap penyakit layu bakteri yang disebabkan oleh R. solanacearum. Pemanfaatan bakteri penghasil VOCs sebagai agen penginduksi ketahanan tanaman merupakan salah satu topik riset dalam bidang mikrobiologi dan fitopatologi yang baru dalam kurun waktu 10 tahun terakhir. Oleh karena itu penemuan jenis-jenis bakteri baru, mode of action baru, atau dengan potensi menghasilkan senyawa-senyawa volatil dengan jenis atau komposisi baru, berpotensi besar untuk dimanfaatkan dan dikembangkan sebagai agen untuk meningkatkan ketahanan tanaman terhadap penyakit.
Hipotesis
1. Terdapat sejumlah bakteri endofit kentang yang efektif dalam meningkatkan ketahanan dan melindungi bibit kentang terhadap penyakit layu bakteri yang disebabkan oleh R. solanacearum.
2. Efektivitas bakteri endofit dalm meningkatkan ketahanan tanaman kentang terhadap R. solanacearum melibatkan berbagai senyawa bioaktif antara lain
Volatile Organic Compounds (VOCs).
3. Isolat bakteri endofit yang diperoleh mampu mengkolonisasi jaringan bibit tanaman kentang untuk melindunginya dari serangan penyakit layu bakteri.
Kerangka Penelitian
Berdasarkan tujuan dan hipotesis penelitian yang telah dipaparkan sebelumnya, dirancang suatu penelitian dengan tahapan-tahapan sebagai berikut (Gambar 1) :
1. Isolasi bakteri endofit dari tanaman kentang
2. Penapisan isolat bakteri endofit yang mampu meningkatkan ketahanan
tanaman kentang terhadap penyakit layu bakteri
TINJAUAN PUSTAKA
Ralstonia solanacearum Penyebab Penyakit Layu Bakteri
R. solanacearum adalah bakteri Gram negatif yang semula dikenal sebagai
Pseudomonas solanacearum. Bakteri ini termasuk dalam kelompok beta Proteobacteria (Sequira,1992). Ralstonia solanacearum merupakan patogen penting pada tanaman kentang. Bakteri ini menyerang akar tanaman melalui luka yang diantaranya disebabkan oleh munculnya akar lateral. Di dalam tanaman inang yang rentan, bakteri ini berkembang biak dengan cepat di jaringan korteks untuk selanjutnya menyerang bagian xylem. Dalam beberapa jam, terjadi kolonisasi R. solacearum secara agresif di tabung xylem, lalu melalui sistem jaringan pembuluh menyebar ke bagian tajuk dan batang mengikuti aliran transpirasi dan akhirnya menyebabkan kelayuan yang mematikan. Gejala penyakit layu bakteri meliputi kekuningan dan layu, diikuti dengan nekrosis dan kematian tanaman (Vasse et al. 1995; Tan-Kersten et al. 2001).
R. solacearum adalah salah satu patogen tanaman yang sulit dikendalikan karena bakteri ini memiliki kisaran inang yang luas. Lebih dari 200 famili tumbuhan telah diketahui sebagai inang R. solacearum (Hayward, 1990). Di daerah penanaman kentang di Pangalengan Jawa Barat telah diketahui lebih dari 70 gulma yang menjadi inang R. solacearum (Gunawan, 2006). Selain itu, bakteri ini memiliki persistensi yang tinggi di dalam tanah walaupun tanpa tanaman inang (Jackson dan Gonzales, 1979).
Genom R. solanacearum strain tropis GMI1000 terdiri dari 1 kromosom sirkuler berukuran 3.7 Mb dan 1 megaplasmid berukuran 2.1 Mb. Megaplasmid mengandung gen-gen yang berperan penting untuk kebugaran dan kemampuan adaptasi bakteri ini pada berbagai kondisi serta semua gen hrp yang diperlukan dalam proses kolonisasi relung ekologi spesifik serta patogenesis. Analisis sekuen genom menunjukkan keberadaan struktur mozaik yang membuktikan adanya gen-gen yang diperoleh dari transfer gen-gen secara horizontal. Ada 10 gen-gen yang diduga terlibat dalam detoksifikasi ROS, 6 gen haemolysin-like, beberapa gen peptide
atau polyketide synthase, gen toxin syringomycin synthase, gen pengkode protein pelekat AttM dan AttZ, serta puluhan gen yang terkait dengan biogenesis dan struktur berbagai pili. Tingginya jumlah dan variasi gen pengkode pili serta faktor pelekat lainnya sangat mendukung kemampuan adaptasi yang tinggi dari bakteri ini (Salanoubat et al. 2002). Berdasarkan analisis genom, diperkirakan patogen ini mengekresikan ratusan protein yang berperan sebagai efektor dalam proses patogenisitasnya terhadap ina
Bakteri Endofit
disterilisasi permukaannya serta tidak membahayakan tanaman (Hallmann et al. 1997).
Dewasa ini, perkembangan bidang mikrobiologi dan bioteknologi telah membuktikan bahwa keberadaan bakteri endofit berperan penting bagi pertumbuhan dan ketahanan tumbuhan terhadap cekaman biotik dan abiotik. Beberapa bakteri endofit diketahui dapat berperan sebagai penambat nitrogen, penghasil fitohormon, biokontrol patogen, serta penginduksi ketahanan tumbuhan terhadap cekaman biotik dan abiotik (Andreotte et al. 2010, Mano dan Morisaki 2008). Penemuan bakteri endofit yang mampu menambat nitrogen pada tanaman gramineae pada tahun 1980 telah memicu berbagai penelitian tentang aplikasi bakteri endofit yang mampu menambat nitrogen pada tanaman-tanaman tidak berbintil dari golongan serealia diantaranya padi.
Bakteri endofit juga terbukti berperan dalam meningkatkan pasokan Fe bagi tanaman inang. Percobaan inplanta menggunakan bakteri endofit Streptomyces sp. GMKU 3100 dan mutan gen desD-like (penyandi enzim kunci pada akhir lintasan biosintesis siderofor) membuktikan bahwa tanaman padi dan kacang hijau yang diinokulasi Streptomyces sp. GMKU 3100 tipe liar memiliki biomasa tanaman yang lebih tinggi dibandingkan dengan dengan tanaman yang diinokulasi dengan Streptomyces sp. GMKU 3100 mutan (Siriwan et al. 2012). Sebelumnya, Dimkpa et al. (2009) juga telah mempublikasikan hasil penelitiannya yang membuktikan bahwa pemberian supernatan bebas sel
Streptomyces sp. tipe liar pada tanaman kacang tunggak (cowpea) dapat meningkatkan penyerapan Fe, kadar klorofil, dan menghindari efek peroksidasi lemak pada daun walaupun ditanam pada media tanam yang mengandung Al, Cu, Mn, Ni dan U dalam konsentrasi cukup tinggi. Pemberian siderophore tersebut juga menurunkan pembentukan radikal bebas sehingga melindungi auksin yang diproduksi mikroba dari degradasi dan pada akhirnya dapat meningkatkan pertumbuhan tanaman. Uji penyerapan kompleks Fe-pyoverdin menggunakan tanaman kacang hijau juga membuktikan bahwa tanaman mampu menyerap
komplek tersebut (Vansuyt et al. 2007). Percobaan menggunakan tanaman
tembakau transgenik over ekspresi ferritin menunjukkan bahwa kadar Fe pada tanaman transgenik lebih tinggi dibandingkan tanaman non-transgeniknya (Robin
et al. 2006). Hasil-hasil penelitian tersebut secara tidak langsung membuktikan bahwa selain meningkatkan penyerapan Fe, ekspresi siderofor di dalam jaringan tanaman juga tidak berbahaya bagi tanaman.
Kemampuan bakteri endofit dalam melarutkan fosfat diduga juga berperan dalam meningkatkan pertumbuhan tanaman. Selain meningkatkan ketersedian nutrisi seperti Nitrogen Fe, dan Fosfat untuk tumbuhan, berbagai senyawa bioaktif seperti fitohormon dan vitamin yang diproduksi oleh beberapa bakteri endofit juga berguna dapat meningkatkan pertumbuhan tanaman inangnya (Ryan et al. 2008; Tsavkevlova et al. 2006; Rosenblueth dan Romero 2006).
Peran Bakteri Endofit dalam Meningkatkan Ketahanan Tanaman
tumbuhan yang akan melindunginya dari berbagai mikroorganisme (broad spectrum) untuk jangka panjang. Ketahanan tumbuhan yang timbul akibat infeksi patogen ini dikenal sebagai Systemic Acquired Resistance (SAR) (Francis et al.
2010). Lintasan SAR bersifat salicylic acid (SA) dependent (Choudhary dan Johri 2009; Kloepper dan Ryu 2006) (Gambar 5). Sebagai respon terhadap patogen, tumbuhan akan memproduksi reactive oxygen species (ROS), protein-protein terkait patogenesis (PR- proteins), penebalan dinding-dinding sel, serta produksi fitoaleksin. Fitoaleksin adalah metabolit sekunder berberat molekul rendah yang memiliki aktivitas antimikroba. Kelompok senyawa ini merupakan salah satu marka untuk ketahanan tumbuhan terhadap penyakit. Berbagai fitoaleksin telah berhasil diisolasi dan didentifikasi dari berbagai tumbuhan, namun sampai saat ini mekanisme dan lintasan biosintesisnya belum diketahui dengan pasti. Capsidiol dan scopoletin adalah senyawa fitoaleksin utama yang dihasilkan oleh tumbuhan Solanaceae. (Ahuja et al. 2011).
Berbeda dengan SAR yang diaktifkan oleh patogen, ISR dapat diaktifkan diantaranya oleh kolonisasi bakteri kelompok Plant Growth Promoting (PGP) (Francis et al. 2010). Sebagian besar laporan penelitian menunjukkan bahwa ISR diinduksi oleh strain-strain bakteri akar yang hidup bebas. Tetapi akhir-akhir ini berbagai hasil penelitian menunjukkan bahwa bakteri endofit juga dapat merangsang Induced Systemic Resistance (ISR) sebagaimana kelompok bakteri PGP (Jimtha et al. 2014; Choudhary dan Johri 2009; Ryan et al. 2008; Compant et al. 2005). Berbeda dengan SAR yang bersifat salicylic acid (SA) dependent, lintasan ISR bersifat salicylic acid (SA) independent dan etilen (ET) dependent
(Choudhary dan Johri 2009; Kloepper dan Ryu 2006; Vallad dan Goodman 2004; Pieterse et al. 1998) (Gambar 2).
Analisa transkriptomik pada tanaman A. thaliana yang diinokulasi secara ganda menggunakan bakteri akar non-fitopatogenik P. fluorescens WCS417r dan
P. syringae pv. tomato DC3000 membuktikan bahwa aktivasi lintasan SAR dan ISR dapat terjadi secara paralel. Berdasarkan hasil analisa transkriptomik tersebut dibuat suatu model hipotetik lintasan aktivasi paralel SAR dan ISR (Gambar 3) (Saskia et al. 2000). Hasil-hasil penelitian menggunakan metode transkriptomik, genetika molekuler, dan proteomik yang dilakukan oleh peneliti-peneliti berikutnya (Chi et al. 2013; Ma dan Berkowitz 2011; Thomma et al. 2011) memperkuat bukti yang mendukung model hipotetik yang disusun oleh Saskia et al. (2006). Model hipotetik tersebut menghilangkan dikotomi yang kaku antara lintasan ISR dan SAR. Selain itu, walaupun sederhana model ini juga mengakomodir kemungkinan peran ganda dari senyawa-senyawa dan atau protein pada kedua lintasan resistensi tersebut serta kompleksitas hubungan berbagai senyawa dan atau protein yang terlibat di dalamnya.
Gambar 3 Model induksi ISR dan SAR secara paralel (Saskia et al. 2000)
oleh bakteri endofit mirip dengan mekanisme biokontrol oleh populasi bakteri rizosfer dan epifit yaitu melalui kompetisi kolonisasi relung ekologi dan atau nutrisi yang sama dengan pathogen serta produksi senyawa-senyawa allelokimia diantaranya siderofor, antibiotik, biocidal volatiles, enzim-enzim pendegradasi, dan atau senyawa pendetoksifikasi (Chernin et al. 2011; Compant et al. 2005; Francis et al. 2010).
Tabel 1. Beberapa senyawa dan determinan bakteri penginduksi ketahanan pada beberapa tumbuhan (Chodhary dan Johri 2009)
Strain Bakteri Spesies
Tumbuhan
Senyawa atau Determinan
B. amyloliquefaciens IN937a Arabidopsis 2,3-butenadiol
B. subtilis GB03 Arabidopsis 2,3-butenadiol Kacang polong SA
Tembakau SA
Tomat Pyocelin & pyocyanin
P. fluorescens CHA0 Arabidopsis 2,4 DAPG Tembakau Siderofor Tomat 2,4 DAPG P. fluorescens Q2-87 Arabidopsis 2,4 DAPG
P. fluorescens WCS 374 Lobak LPS
Siderofor & Fe regulated compouns P. fluorescens WCS 417 Arabidopsis LPS
Carnation LPS
Lobak LPS
Fe regulated compouns P. fluorescens WCS 358 Arabidopsis LPS, siderofor, flagela
Kacang polong LPS, siderofor
Tomat LPS, siderofor P. fluorescens GRP3 Padi Siderofor Rhizobium etli G12 Kentang LPS
S. marcescens 90-166 Tembakau Fe regulated compouns
bakteri PGP. Antibiotik tersebut diantaranya adalah amphisin, 2,4-diacetylphloroglucinol (DAPG), higrogen sianida, oomycin A, phenazine, pyoluterin, pyrronitrin, tensin, tropolone, ecomycin (lipopeptida siklik), oligomycin A, kanosamin, zwittermicin A, dan xanthobaccin. Beberapa antibiotik yang dihasilkan oleh bakteri PGP tersebut juga telah digunakan pada berbagai percobaan farmasi (Compant et al. 2005; Ryan et al. 2008).
Beberapa jenis bakteri PGP juga menunjukkan aktivitas hiperparasit terhadap fungi fitopatogenik dengan cara memproduksi enzim-enzim pelisis dinding sel fungi, misalnya kitinase. Kitinase yang dihasilkan oleh Serratia plymuthica dapat menghambat pemanjangan tabung kecambah B. cinerea. Produksi kitinase oleh S marcescens menyebabkan bakteri ini bersifat antagonis terhadap S. rolfsii, sedangkan pada Paenibacillus sp. strain 300 dan Streptomyces
sp. strain 385 kitinase bersama β-1-3 glukanase menimbulkan sifat antagonis terhadap F. oxysporum f. sp. cucumerinum. Pada S plymutica IC14, enzim protease terlibat dalam aktivitas antagonisme terhadap S. rolfsii dan B. cinerea. Degradasi senyawa autoinduser (AHL) oleh enzim laktonase dan asiklase yang dihasilkan oleh bakteri PGP juga mampu memblok ekspresi faktor-faktor virulensi bakteri fitopatogen sehingga menurunkan atau menghilangkan patogenisitasnya (Compant et al. 2005).
Pengendalian fitopatogen oleh bakteri PGP juga dapat terjadi melalui mekanisme detoksifikasi atau degradasi faktor-faktor virulensi. Bakteri Klebsiella oxytoca dan Alcaliges denitrificans memproduksi protein yang dapat mengikat toksin albicidin yang dihasilkan oleh X. albilineans. Albicidin juga dapat didegradasi oleh enzim esterase yang dihasilkan oleh Pantoea dispersa (Compant
et al. 2005).
Ekspresi faktor-faktor virulensi bakteri patogen dapat dihambat melalui mekanisme quorum quenching (penghambatan proses Quorum Sensing). Chernin et al. (2011) melaporkan bahwa produksi senyawa-senyawa organik volatile oleh
P fluorescens B-4117 dan S plymuthica IC1270 mampu menghambat produksi senyawa signal autoinduser QS (AHL) pada Agrobacterium, Chromobacterium, Pectobacterium, dan Pseudomonas. Beberapa enzim mikroba telah diketahui berperan dalam proses quorum quenching bakteri fitopatogen melalui inaktivasi senyawa signal autoinduser QS. B. cereus, B. mycoides, B. thuringiensis (Dong
et al. 2000; Dong et al. 2001), P. aeruginosa PAI-A, Arthrobacter sp., K. pnemoniae, A. tumefaciens, dan Rhodococcus sp.( Uroz et al. 2003, Carlier et al. 2003; Park et al. 2003; Huang et al. 2003) menghasilkan enzim yang dapat membuka cincin lakton pada molekul AHL. Enzim β-hidroksipalmitat metil ester hidrolase juga dilaporkan dapat menghambat ekspresi faktor-faktor virulensi pada
R. solanacearum. Enzim ini menghidrolisis senyawa signal QS (3 hidroksipalmitat metil ester) yang dihasilkan oleh R. solanacearum (Shinohara et al. 2007).
VOCs Sebagai Penginduksi Ketahanan Tanaman
propionat, dsb.), alkohol, ester, merkaptan, pentilfuran dan sebagainya yang merupakan produk metabolisme mikroba. Namun bukti ilmiah tentang aktivitas VOCs sebagai penginduksi pertumbuhan dan resistensi tanaman baru mulai dipublikasikan pada tahun 2003 (Ryu et al. 2003a; Ryu et al. 2004). Sejak itu, peran kelompok senyawa VOCs dalam induksi ketahanan tumbuhan mulai mendapat banyak perhatian dan menarik minat peneliti-peneliti lainnya untuk mengeksporasi dan mengkaji potensi pengembangan serta aplikasinya.
Percobaan menggunakan tanaman A. thaliana mutan dan transgenik
membuktikan bahwa ketahanan tanaman tersebut dapat diinduksi oleh senyawa volatil acetoin dan 2,3-butenadiol yang diemisikan oleh Bacillus GB-03. Induksi sistem ketahanan A. thaliana tersebut terjadi melalui aktivasi lintasan Induce Systemic Resistance (ISR) dan berhubungan dengan lintasan etilen (Ryu et al. 2004). Bukti peran kedua senyawa tersebut dalam meningkatkan ketahanan tanaman diperkuat oleh hasil penelitian berikutnya yang dilakukan dengan menggunakan galur Bacillus GB-03 mutan (BSIP1173 dan BSIP1174) yang tidak mampu mensintesis kedua senyawa volatil tersebut. Berbeda dengan A. thaliana
yang diinokulasi dengan Bacillus GB-03, tanaman A. thaliana yang diinokulasi dengan kedua BSIP1173 atau BSIP1174 tidak mampu meningkatkan kapasitas ISR-nya setelah diinfeksi dengan bakteri patogen Erwinia carotovora (Ryu et al. 2005).
Selain kemampuannya dalam menginduksi ketahanan tanaman, VOCs yang diemisikan oleh bakteri seperti seperti benzothiazole, cyclohexanol, n-decanal, dimetil trisulfit, 2-etil-1-hexanol dan nonanal juga memiliki aktivitas antimikroba. Sifat antimikroba dari senyawa-senyawa tersebut dapat dimanfaatkan untuk mengendalikan fitopatogen (Fernando et al. 2005). Menurut (Song dan Ryu 2013), selain dapat menginduksi ketahanan tumbuhan, VOCs merupakan kandidat yang potensial dan menjanjikan untuk dimanfaatkan sebagai agen pengendalian dalam pengelolaan hama dan penyakit karena efektivitasnya tinggi, tidak mahal, dan hanya memerlukan konsentrasi yang relatif rendah dibandingkan senyawa agrokimia lainnya.
Percobaan lapangan yang dilakukan menggunakan senyawa organik volatil 3-pentanol dan 2-butanon pada konsentrasi 0.1 mM dan 0.1 nM berturut-turut untuk kedua senyawa tersebut menunjukkan kedua senyawa tersebut secara nyata
mampu menginduksi ketahanan tanaman mentimun terhadap Pseudomonas
syringae pv. lachrymans. Penurunan nilai Disease severity yang dihasilkan oleh aplikasi kedua senyawa volatil tersebut sama dengan penurunan nilai Disease severity yang disebabkan oleh aplikasi 1 mM senyawa agrokimia benzotiadizol (Actigard®, Syngenta). Selain itu menginduksi ketahanan terhadap P. syringae
pv. lachrymans kedua senyawa tersebut juga terbukti mampu melindungi tanaman mentimun terhadap serangan hama aphid pengisap Myzus persicae (Song dan Ryu 2013).
Aplikasi Bakteri Endofit untuk Meningkatkan Resistensi, Pertumbuhan dan Produktivitas Tanaman
2010) serta meningkatkan resistensi dan pertumbuhannya (Choudhary dan Johri 2009; Ryan et al. 2008; Hoon et al. 2007; Tsavkelova et al. 2006; Compant et al. 2005) Kemampuan bakteri endofit dalam menghasilkan fitohormon dan meningkatkan ketersediaan nutrisi bagi inang secara langsung dapat meningkatkan pertumbuhan tanaman inang. Kemampuannya untuk beradaptasi dan berkembang di dalam jaringan tumbuhan inang tanpa menimbulkan efek negatif merupakan kelebihan bakteri endofit. Oleh karena itu, aplikasi bakteri endofit secara dini dapat melindungi tanaman inangnya dari infeksi dan kolonisasi patogen. Secara tidak langsung, kondisi tanaman yang sehat dan terlindung dari fitopatogen akan meningkatkan pertumbuhan dan produktivitasnya.
Percobaan menujukkan bahwa plantlet kentang yang ditumbuhkan bersama-sama dengan bakteri endofit mengalami peningkatan pertumbuhan yang dramatis dibandingkan dengan plantlet yang ditumbuhkan tanpa bakteri endofit. Peningkatan pertumbuhan tersebut diturunkan pada plantlet hasil perbanyakan pada generasi berikutnya (Frommel, 1991). Efek peningkatan pertumbuhan juga teramati pada planlet anggur yang diinokulasi dengan bakteri endofit (Compant et al. 2005).
Hasil penelitian Krechel et al.(2002) dan Sessitsch et al. (2004)
menunjukkan bahwa isolat bakteri endofit yang diisolasi dari tanaman kentang memiliki aktivitas antagonis terhadap berbagai patogen asal tanah diantaranya
Erwinia carotovora, Phytophtora cactorum, R. solani, V. dahlia, Sclerotium sclerotium, and M. incognita. Percobaan inokulasi Pseudomonas fluorescens B1 dan Serratia plymuthica B4 secara bersama-sama pada plantlet kentang terbukti dapat menurunkan hilangnya berat kering dan nilai keparahan penyakit (Disease Severity) yang disebabkan oleh R. solani. Efektivitas tertinggi bakteri endofit dalam menekan penyakit kentang dilapangan dilaporkan oleh Faitlin dkk. Inokulasi P. florescens B1 dapat menekan timbulnya penyakit yang disebabkan oleh R. solani Kuhn di lapangan sampai 37% dan meningkatkan produksi umbi kentang sampai 12%. Sedangkan inokulasi Serratia plymuthica B4 meningkatkan produksi umbi kentang sampai 17% (Faitlin et al. 2004).
BAHAN DAN METODE
Prosedur Sterilisasi Permukaan dan Isolasi Bakteri Endofit
Contoh tanaman
Tanaman kentang diambil bersama-sama dengan tanah bagian rizosfernya dari lokasi (1) kebun Gapoktan Multi Tani Jaya Giri Desa Cipendawa, Cipanas, Cianjur (2) kebun percobaan Balai Penelitian Tanaman Sayuran Lembang, (3) screen house di Cisurupan Garut, dan (4) lahan pertanaman kentang di Desa Mulyasari Pasirwangi Garut (Lampiran 1). Wilayah-wilayah tersebut dipilih sebagai tempat pengambilan sampel tanaman kentang karena merupakan daerah penghasil kentang di wilayah Jawa Barat. Jarak antara lokasi pengambilan sampel dan laboratorium tempat isolasi yang dapat ditempuh kurang dari 24 jam juga menjadi salah satu pertimbangan pemilihan lokasi-lokasi tersebut, sehingga kondisi sampel yang diambil tetap segar ketika diisolasi bakterinya. Diantara ketiga daerah tersebut, luas area pertanaman dan produksi kentang di dataran tinggi Garut adalah paling tinggi, sehingga wilayah ini menjadi salah satu pusat penghasil bibit kentang dan umbi kentang di Indonesia.
Tanaman kentang yang diambil berumur 6 sampai 8 minggu, dan dipilih tanaman sehat yang tumbuh di dekat tanaman yang menunjukkan gejala layu bakteri. Tanaman bersama tanah tempat tumbuhnya dimasukkan ke dalam amplop coklat besar dalam posisi berdiri, selanjutnya bagian bawah amplop dimasukkan ke dalam kantong plastik. Sampel tanaman diatur dan diletakkan dalam posisi berdiri dalam bak plastik. Kesegaran tanaman dijaga dengan cara memercikkan air mineral kemasan ke bagian tajuk dan tanahnya selama proses transportasi dari lapangan sampai ke laboratorium di Balai Besar Penelitian dan Pengembangan Bioteknologi dan Sumberdaya Genetik Pertanian (BB BIOGEN) Bogor untuk diisolasi bakteri endofitnya. Sampel tanaman yang sampai di Laboratorium pada malam hari selanjutnya segera diisolasi pada hari berikutnya. Selisih waktu pengambilan sampel di lapangan dengan waktu pelaksanaan isolasi bakteri endofit tidak lebih dari 24 jam.
Optimasi sterilisasi permukaan akar
Sterilisasi sampel bagian pertama dilakukan dengan urutan sebagai berikut : direndam selama 1 menit dalam 1.5% larutan bleaching komersial (BAYCLIN, Johnson Home Hygiene Product, Indonesia; mengandung 5.25% NaOCl) dibilas dengan akuades steril, direndam selama 5 menit dalam ethanol 75%, dan terakhir dibilas 2 kali dengan akuades steril. Sampel kedua disterilisasi dengan urutan berikut: direndam selama 1 menit dalam 2.5% larutan bleaching komersial, dibilas dengan akuades steril, direndam selama 5 menit dalam ethanol 75%, dan terakhir dibilas 2 kali dengan akuades steril (Gambar 4).
Sampel bagian ketiga dan keempat masing masing dimasukkan secara terpisah ke dalam mangkuk ultrasonic cleaner (ULTRA 7000, James Product Ltd. Sturminster Newton, Dorset, UK) berisi akuades steril dingin dan dilanjutkan dengan sonikasi bertahap (5 kali). Setiap tahap sonikasi dilakukan selama 2 menit dalam akuades steril dingin yang baru. Selanjutnya untuk sampel bagian ketiga dilanjutkan dengan tahapan sterilisasi seperti yang dilakukan terhadap sampel bagian pertama. Sedangkan sterilisasi sampel keempat dilanjutkan dengan tahapan sterilisasi seperti yang dilakukan terhadap sampel kedua (Gambar 4). Masing-masing bagian sampel ditiriskan diatas kertas tissue steril yang terletak di dalam cawan petri besar steril. Keberhasilan sterilisasi permukaan dicek dengan cara menginokulasikan 100 µL air bilasan terakhir dari masing-masing prosedur sterilisasi ke permukaan media Trypticase Soy Agar (TSA : TSB 30 g/L, agar-agar BIOTEK 20 g/L). Selain itu, pengecekan juga dilakukan dengan cara mengusapkan permukaan akar yang telah disterilisasi permukaannya ke media TSA. Inokulasi air bilasan dan pengusapan akar ke media TSA masing-masing dilakukan dalam tiga ulangan.
Cawan-cawan TSA tersebut tersebut di-seal menggunakan plastict wrap
selanjutnya diinkubasi pada suhu ruang (29ºC-30ºC) selama 3 hari. Pengamatan dilakukan terhadap terhadap jumlah koloni yang tumbuh dari masing-masing prosedur sterilisasi permukaan akar yang telah dilakukan. Prosedur sterilisasi yang tidak menghasilkan pertumbuhan koloni mikroba dari air bilasan terakhirnya (mikroba phyloplant atau rhizosphere) pada media TSA kontrol dipilih sebagai prosedur sterilisasi sampel akar yang akan diisolasi bakteri endofitnya.
Sterilisasi permukaan batang dan daun
Tanaman dibersihkan dari tanah yang menempel, dicuci dibawah air mengalir, lalu ditiriskan diatas kertas tissue. Bagian batang dipisahkan dari bagian akar dan daunnya menggunakan gunting steril kemudian dipotong-potong dengan ukuran ± 4 cm sebelum disterilisasi. Sterilisasi dilakukan dengan cara direndam selama 1
menit dalam 2.5% larutan bleaching komersial (BAYCLIN, Johnson Home
Hygiene Product, Indonesia) yang mengandung 5.25% NaOCl, dibilas dengan akuades steril, direndam selama 5 menit dalam ethanol 75%, dan terakhir dibilas 2 kali dengan akuades steril. Daun-daun (beserta tangkainya) disterilisasi dengan cara yang sama dengan cara sterilisasi bagian batang.
Konfirmasi keberhasilan proses sterilisasi dilakukan dengan cara menempelkan sesaat permukaan sampel batang atau daun (masing-masing 3 buah) ke media TSA, serta menginokulasikan air bilasan terakhir ke media TSA seperti diuraikan diatas. Jika dalam waktu 24 atau 48 jam setelah inkubasi, terdapat koloni mikroba yang tumbuh pada media TSA tersebut, maka proses sterilisasi dianggap gagal dan proses isolasi yang dilakukan dengan sampel tersebut harus diulang mulai dari awal.
Isolasi bakteri endofit dari jaringan tanaman kentang
(proteosa pepton 4 g/L, K2HPO4. 3H2O 0.3 g/L, MgSO4.7H2O 0.3 g/L, gliserol 4
ml/L dan Agar-agar 20 g/L), dan agar Nitrate Mineral Salt (NMS) bebas N (MgSO4.7H2O 1.0 g/L, CaCl2.6H2O 0.2 g/L, KH2PO4 0.272 g/L, Na2HPO4 4.0
g/L, Na2EDTA 0.5 g/L, FeSO4.7H2O 0.2 g/L, H3BO4 0.03 g/L, CoCl2.6H2O 0.02
g/L, ZnSO4.7H2O 0.01 g/L, MnCl2.4H2O 3.0 mg/L, Na2MoO4.2H2O 3.0 mg/L,
NiCl2.6H2O 2.0 mg/L dan CaCl2.2H2O 1.0 mg/L, methanol 100 mL/L , dan Bacto
Agar 15 g/L). Inkubasi dilakukan pada suhu ruang dan kondisi gelap selama 2 hari sampai 6 minggu. Koloni yang tumbuh pada media isolasi dan menunjukkan morfologi koloni yang berbeda dipilih dan dimurnikan dengan teknik penggoresan kuadran pada media yang sama. Tahapan proses isolasi bakteri endofit secara garis besar ditampilkan pada Gambar 5.
Gambar 5 Diagram alir isolasi bakteri endofit dari tanaman kentang
Penapisan Isolat Bakteri Endofit Kentang Tahap I
Gambar 6 Diagram alir penapisan isolat bakteri endofit dan kajian perubahan fisiologis inang
Bioesei Hypersentive Response (HR)
Isolat bakteri endofit ditumbuhkan pada media TSA seama 2-7 hari, E. coli
ditumbuhkan pada media Luria Berthani Agar (LBA : yeast extract 5 g/L, trypton 10 g/L, NaCl 10 g/L, dan agar-agar BIOTEK 20 g/L) selama 2 hari, dan Ralstonia solanacearum ditumbuhkan pada media Sucrose Peptone Agar (SPA : sukrosa 20 g/L, Pepton 5 g/L, MgSO4 7H2O 0.5 g/L, KH2PO4 0.25 g/L, dan agar-agar
Uji hemolitik
Uji aktivitas hemolitik dilakukan dengan cara menginokulasikan isolat bakteri ke permukaan media agar darah yang komposisinya terdiri dari : Blood Agar Base (BBL) 40 g/L, dan darah domba steril yang telah di-defibrinasi sebanyak 50 ml/L (Snavely dan Brahier 1960). Setelah diinkubasi selama 1-5 hari pada suhu ruang (29°C-30°C), dilakukan pengamatan ada tidaknya aktivitas hemolitik di sekitar koloni bakteri. Isolat-isolat yang tidak menunjukkan aktivitas hemolitik merupakan isolat terpilih yang digunakan sebagai bahan pada percobaan berikutnya. E. coli K1.1 koleksi IPB Culture Collection (IPBCC) digunakan sebagai kontrol posif pada uji ini. Uji hemolitik untuk setiap isolat dilakukan dalam 3 ulangan.
Uji patogenisitas isolat terhadap planlet kentang
Inokulum bakteri endofit terpilih ditumbuhkan pada medium TSA selama 5-7 hari. Koloni yang telah tumbuh diambil degan ose selanjutnya disuspensikan dalam akuades steril. Sebanyak 100 µL suspensi bakteri (± 1.0 x107 sel/ mL) diteteskan ke media disekitar akar planlet kentang (Granola) berumur 2 minggu. Sebagai kontrol, akuades steril digunakan untuk menggantikan suspensi bakteri endofit yang diinokulasikan. Planlet yang telah diinokulasi diinkubasi kembali dan gejala penyakit yang ditimbulkan oleh bakteri yang diinokulasikan diamati selama 10 hari. Penumbuhan planlet dilakukan pada kondisi berikut : media Murashige-Skoog, suhu 23ºC, 8 jam gelap dan 16 jam terang (intensitas cahaya 2500 lux). Planlet yang sehat diinkubasi lebih lanjut sampai berumur 4 minggu untuk digunakan sebagai bahan percobaan berikutnya. Uji ini dilakukan masing-masing dalam 3 ulangan (satu planlet dalam satu botol kultur setiap ulangan) untuk setiap isolat.
Uji ketahanan tanaman Generasi 0 (G0) yang diperkaya isolat bakteri endofit terhadap layu bakteri
Plantlet-plantlet yang telah diinokulasi dengan bakteri endofit dan tidak menunjukkan gejala penyakit (sehat) dan telah berumur 4 minggu ditanam dalam
polybag berisi 3 kg media tanam tidak steril yang terdiri atas campuran kompos kotoran ayam, tanah, dan sekam bakar dengan perbandingan 1:1:1. Polybag yang telah ditanami bibit kentang tersebut dipelihara dalam sungkup plastik di Kebun Percobaan BB-BIOGEN Pacet Cianjur, Jawa Barat. Penyiraman dilakukan menggunakan air embung yang terdapat di kebun tersebut. Jumlah planlet yang ditanam masing-masing sebanyak 5 plantlet untuk setiap perlakuan. Pada percobaan ini tidak ada pupuk kimia atau pestisida yang diaplikasikan.
melindungi semua tanaman dalam setiap perlakuan (5 tanaman) dari penyakit layu bakteri diamati parameter pertumbuhannya (biomasa tajuk, biomasa akar, jumlah dan berat umbi).
Pengukuran densitas sel bakteri
Densitas sel bakteri dalam suspensi inokulum ditentukan dengan menggunakan kombinasi teknik spektrofotometri dan plate count (Hadioetomo, 1993). Bakteri yang akan diukur densitasnya ditumbuhkan pada media yang sesuai (TSA untuk bakteri endofit, SPA untuk R. solanacearum). Biomasa sel yang diperoleh dari kultur padat disuspensikan dalam akuades steril atau larutan garam fisiologis kemudian diencerkan secara serial (1:1, 1:2, 1:4, 1:8, dst.). Sebagian suspensi sel dari masing-masing tingkat pengenceran diukur nilai
Optical Density-nya (OD) pada panjang gelombang 600 nm. Sisa suspensi sel dari masing-masing tingkat pengenceran diencerkan lebih lanjut secara serial (10-1, 10
-2
, 10-3 , 10-4 , 10-5 , dst.) kemudian sebanyak 100 µL hasil pengenceran tersebut disebarkan pada cawan agar yang sesuai. Semua agar cawan yang telah diinokulasi diinkubasi pada suhu ruang selama 4-7. Pengukuran densitas sel bakteri pada kultur cair dilakukan dengan cara yang sama tetapi pengenceran dilakukan menggunakan media cair yang sesuai. Jumlah koloni yang tumbuh pada setiap agar cawan dihitung. Nilai jumlah koloni yang tumbuh dari masing-masing tingkat pengenceran dan nilai OD-nya digunakan untuk mendapatkan persamaan kurva konversi nilai OD menjadi densitas sel permililiter.
Penapisan Isolat Bakteri Endofit Kentang Tahap II
Evaluasi ketahanan tanaman G0 yang diperkaya isolat bakteri endofit pada media steril
Seleksi lanjut dilakukan dengan menanam kembali planlet yang sebelumnya telah diinokulasi dengan 2 isolat bakteri endofit terpilih pada 3 kg media tanam seperti yang dilakukan pada tahap seleksi awal namun media tanam dan air yang digunakan untuk menyiram tanaman telah disterilkan terlebih dahulu. Selanjutnya setelah tanaman berumur 1.5 bulan diinfeksi dengan R. solanacearum. Percobaan dilakukan menggunakan Rancangan Acak Kelompok (RAK) yang terdiri dari 6 perlakuan yaitu tanaman kontrol yang tidak diperkaya endofit dan tidak diinfeksi
R. solanacearum (K), tanaman kontrol yang diinokulasi R. solanacearum (K+Rs), tanaman diperkaya isolat G053, tanaman diperkaya isolat G062, tanaman diperkaya isolat G053 dan diinokulasi R. solanacearum (G053+Rs), dan tanaman
diperkaya isolat G062 dan diinokulasi R. solanacearum (G062+Rs). Setiap
perlakuan terdiri dari 3 ulangan dan setiap ulangan terdiri dari 8 tanaman. Pengamatan dilakukan terhadap Nilai Disease Incidence (DI) layu bakteri yang dihitung menggunakan persamaan berikut (Kelman 1954):
Pengolahan data dilakukan menggunakan program SAS versi 6.12. Nilai DI yang diperoleh dianalisa ragamnya dan apabila ada perbedaan yang nyata dilanjutkan dengan uji jarak berganda Duncan pada taraf 0.05.
Evaluasi DI tanaman Generasi 1 (G1) pada media tidak steril.
Evaluasi DI tanaman G1 dilakukan terhadap 3 perlakuan tanaman yaitu tanaman G1Kontrol, G1G053, dan G1G062. Masing-masing perlakuan terdiri dari 15
ulangan, dan setiap ulangan terdiri dari 1 tanaman G1. Umbi yang dihasilkan oleh tanaman G0 kontrol, tanaman diperkaya isolat G053, dan tanaman diperkaya G062 pada percobaan sebelumnya (evaluasi ketahanan tanaman G0 pada kondisi steril) disimpan di dalam lemari pendingin. Umbi yang telah disimpan selama ±3 bulan dan telah bertunas ditanam pada media tanam (komposisi seperti media tanam pada uji ketahanan tanaman pada penapisan awal) yang tidak steril di
screen house di Desa Cipendawa, Cipanas, Cianjur. Tanaman G1 tersebut disiram dengan air yang langsung diambil dari aliran air gunung di kebun. Tanaman G1 tidak diinokulasi secara artifisial, oleh karena itu nilai DI dihitung berdasarkan infeksi yang terjadi secara alami.
Analisis respon fisiologis tumbuhan terkait ketahanan
a. Penentuan kandungan protein total. Masing-masing sebanyak 8
polybag tanaman kontrol (1 tanaman per-polybag), tanaman G053, dan tanaman G062 yang berumur 1.5 bulan dipindahkan dari kebun percobaan BB-BIOGEN di Pacet ke dalam low temperature incubator (23⁰C, 14 jam terang dan 10 jam gelap) di Laboratorium Mikrobiologi, Kelti Biokimia BB-BIOGEN. Setelah tanaman dibiarkan beradaptasi selama 3 hari, dari masing-masing tanaman diambil 200 mg daun muda yang telah berkembang sempurna (daun ketiga dari pucuk). Daun-daun tersebut digerus menggunakan mortar yang telah didinginkan di dalam freezer. Hasil gerusan dihomogenisasi dengan 10 ml buffer fosfat pH 6.8 lalu disentrifugasi pada kecepatan 12000 rpm selama 15 menit pada suhu 4ºC. Supernatan yang merupakan ekstrak daun diambil dan dipindahkan ke dalam botol pyrex bertutup ulir yang telah didinginkan terlebih dahulu. Sebanyak 4
tanaman dari masing-masing perlakuan diinfeksi dengan suspensi R.
solanacearum, sedangkan sisanya diperlakukan dengan cara yang sama tetapi dengan akuades (kontrol negatif yang tidak diinfeksi R. solanacearum). Infeksi R. solanacearum dilakukan dengan cara seperti diuraikan di bagian sebelumnya. Dua puluh empat jam dan 48 jam kemudian dilakukan kembali pengambilan sampel daun dari semua tanaman (yang diinfeksi R. solanacearum dan tanaman yang tidak diinfeksi R. solanacearum) untuk diekstraksi seperti diuraikan diatas. Ekstrak daun yang diperoleh ditentukan kandungan protein totalnya menggunakan teknik microassay sebagaimana yang dipublikasikan oleh Bradford (1976). Satu mililiter reagen protein ditambahkan ke dalam tabung berisi 100 µL supernatan atau larutan Bovine Serum Albumin (BSA) yang dipergunakan sebagai standar protein. Campuran reaksi divortex, dibiarkan selama 2 menit, dan akhirnya diukur absorban-nya pada panjang gelombang 565nm. Pengukuran protein dilakukan dalam 4 ulangan.