a
KONSTRUKSI PUSTAKA cDNA SENGON
(Parmerianthes falcataria
L.
Nielsen) YANG
TERINDUKSI
OLEH
SERANGAN
HAMA
BOKTOR
(Xystrosera festiva)
OLEH
N.
SRI HARTATI
PROGRAM PASCASARJANA
INSTITUT PERTANIAN BOGOR
N. SRI HARTATI. Konstruksi Pwtaka cDNA Sengon (Parczserimthes
faleafaria L. Niefsen) Yang Terinduksi Oleh Semngan Hamrt B Q ~ X (Xystrmra festiva)). Dibrrwah bimbingan SUHARSONO sebagai ketua dm ENNY
SUDARMONOWATI sebagai anggota.
Penelitian ini bertujuan untuk mengklon gen-gen sengon yang terinduksi oleh swangim hama boktor melalui konstnrksi pustaka GDNA Vektor yang digunakan gdalah pSPORTl yang membawa gen penanda resistensi terhadap ampisilin (A& dan lacOPZ' penyandi P-galaktosidase. RNA total diisolasi dari kambium batang mngon yang terideksi dan yang tidak terideksi oleh hama boktor secara terpsah. Isolasi mRNA dari RNA total dilakukan Bengan metda fiaksinasi pada kolom oligo-dT seblosa. DNA komplementer @DNA) yang disintesis &%an menggunakan
mRNA
sebagai cetkan disisipkan pada situsNotl- EcoRl yang terletak pada daerah 1acOPZ'. Plasmid rekombinan diintroduks'lkan ke daiaxn sel ~ c h e r i c h i a coli DH5a. Frelcuensi rekombinan yang diperdeh
adalah
31,91% dan 67,58% masing-masinguntuk
E wli yangditransformasi dengan plasmid rekombinan yang mengandung cDNA sengon yang terinfeksi dengan hama boktor dan yang tidak terinfeksi. A d i s i s pustaka cDNA dilakukan dengan mengamplifikasi sisipan cDNA pada mesin
PCR
menggunakan primer M13 (reverse dan forward) serta restriksi dengan Not1 danSURAT PERNYATAAN
Dengan ini saya menyatakan bahwa t i i s yang bejudul
KONSTRUKSI PUSTAKA eDNA SENGON ( P ~ v ~ a n t h c ~ falcataria
L.
NSdscn)YANG
TERIlWW#SI O m H SERANGAN HAMA BOK~@R (Xystmsetrz fdm)Adalah
be=
merupakan hasil karya sendiri dan belum pentah dipubiikaikan. Semua sumbe?. data dan infonnasi yang digunakan telah dinyatakm jelas dan dapat diperiksa kebenarannya.N.
Sri HartatiJudul Tesis : Konstiuksi Pustaka cDNA Sengon (Paraserianthes falmtaria L. Nielsen ) Yang Terinduksi Oleh
Serangan Hama Boktor (Xystrosera festiva)
Nama : N. Sri Hartati
Nomor Pokok : 99637
Program Studi : Bioteknologi
Menyetujui
Ketua
2. Ketua Program Studi
u.
Muhammad JusufC Dr. Ir. Ennv Sudarmonowati
Anggota
Mengetahui
ur Program Pasca
~ i ~Manuw d a
. Sarjana
,oto. MSc.
KONSTRUKSI PUSTAKA cDNA
SENGON
( P a r d a n t h a
falcataria L.
Nielsen)
YANG
TERINDUKSI
OLEH
SERANGAN
HAMA BOKTOR
(Xystrwera
f&a)
N.
SRI
HARTATI
Tesis
Sebagai salah satu syarat untuk rnernperoleh gelar Magister Sains pada
Program Studi Bioteknologi
PROGRAM
PASCASARJANARIWAYAT EUDUP
Penulis dilahirkan di Tasikmalaya, Jawa Barat pada fanggal 26 Desember
1969 sebagai anak pertma dari pasangan Bapak Maryoto
(ah)
dan Ibu AtiSusilawati. Penulis rnenyelesaikan jenjang pendidikan formal di SD Negeri
Arjasari 1 pada tahun 1981, SMP Negeri 1 Singaparna pada tahun 1984 dm
SMA Negeri 1 Tasikmalaya pada tahun 1987. Pada tahun yang sama penulis
rnelanjutkan pendidikan di Institut Teknologi Sepuluh Nopember, Surabaya dan
memperoleh gelar Sarjana Kimia pada bufan Februari 1992.
Pada tahun 1999 penu1is diterima di Program studi Bioteknologi,
Program Pasmsarjana Institut Pertanian Bogor. Penulis bekeja sebagai staf
peneliti pada Pusat Penelitian Bioteknologi-Lembaga Ilmu Pengetahuan
PRAKATA
Puji syukur penulis p 8 t l . h ke hadirat Allah swt atas selesainya karya tulis i h i a h ini. Top& yang dipiff aeSalah Konstruksi Pustaka cDNA Sengon (Panwaianthes falcafmk
L.
Nielson ) Yang Tcriiaduksi0 1 ~ B
Serangan Hama Boktor (xystrosm f k s t h ).T g r i m m diucapkan
lrepada
Dr. Ir. Suharsono dm Dr. Ir: Emy Sudarmonmtiselaku
pembimbing, atas gagasan dan dorongan yang sangat berguna dalam memyelesaikan penelitian serta penulisan tesis; Ketua ProgramStudi
be-staf
atas kqemayaandan
kasediaannya mendidik penulis khususnyaddam
bidang biologi nroleh1er;Df
ektur
Program Pasea sajana IPBbeserta staf atas jdsymm
sel.83a
p d s menempuh pendidikan; Kepala Pusat Pmlitian Bideknologi UP1 begesta staf yang telah memberikan ijin belajar serta fasiritas penelitign; Dr. Made Sri Pram dm Dr. TitikK.
Pransl,
atas segala dukmgmnya; Vivi Ang%raini, Elfawati dim Budi Saksono, atas semua saran yang berkaitan dengan teknis pditian; Pak Yitno, untuk dokumentasi hasil penelitian, Pak Nanang, atsrs bambmya dalam koleksi bahan penelitian; rekan- rekan di Labomtmium Biologi Wekuler 3 yaitu Retno, Santi, Tati, Upi, Soni, Bodhi, Tia, atas semua bantuan dan kebersamaan selama pemtlis melakukan penelitian; kepada orang tuadan
adik-adik, keluarga (Anwar dan Harits), atas semua kasih sayang yang selalu menyertai perjalanan penulis; kepada semua teman Program Studi B i o t c h o ~ angkatan 99, Aryanti, Atmitri, Ragapadmi,F
-
Lizawatidan
b s u s kepada Enung Sri Mulyaningsih, atas kebemamaan yang sangat M.Kegiatan penelitian
ini
didukung oleh proyek penelitian "RekayisaGenet& Sengon", kerjasama antam k t Penelitian Bioteknologi-LIP1 dengan Perum Perhutani, dibawah koordinator Dr. Ir. Emy Sudarmonowati. Dengan denikian, has3 penelitian yang diperoleh sepenuhnya milik kedua instansi tersebut. Kepda kedua fihak, pa&s mengucapkan terimakasih atas kesempatan yang dib- untuk d a k h&ah satu topik penelitian yang berkaitan
dengan kerjamma teastbut. Sdwgian studi penulis dibiayai oleh PPKT, Lembaga Ilmu Pen@ahn Indonesia, terinrakasih atas kesempatan yang dibePikan.
Akhir
kata, semoga
intbrm6 yang dfsajikan Mam karya tulis ini berguna bagi k e m a j w ilmu pengehhuan.DAFTAR TABEL DATAR GAMBAR
TINJAUAN
PUSTAKA
Hama b o b (Xyslrwra fe 3 W ) Inter* h~ma-tammm
Konstruksi pustaka cDNA Isolasi RNA
Isolasi mRNA Sintesis cDNA
Perkifam jumlah Idon cDNA ymg ideal
BAHAN DAN METODE Bahan tawnan
Persiapon alat dan bahan untuk igolasi RNA Tahapan penelhian
Isolasi RNA total Isolasi mRNA Sintesis cDNA
Konstruksi plasmid rekomb'm
Introddcsi plasmid rekombinaa
kt
dalam baktei Analisis pustaka GDMAHASIL DAN
PEMBAHASAN
Serangan X jestbm t e r U p sagon Isolasi RNA total
Isolasi mRNA Sintesis cDNA
Konstnrksi pustaka cDNA Analisis pustaka cDNA
KESIMPULAN SARAN
Tabel 1 Jurnlah koloni hail transformasi plasmid rekombinan dan fiekuensi rekombinan
Halaman
[image:80.555.73.478.0.783.2]-bar 1 Mekanisme pertahanan yang terinduksi oleh serangan hama. 7
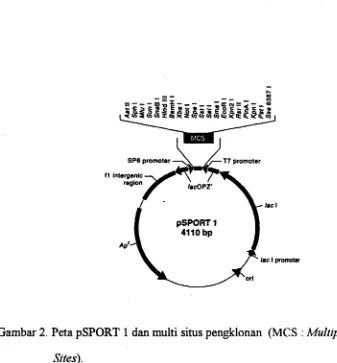
GIMbar 2 Peta pSPORTl dan multi situs pengklonan (MCS: Mulriple
Cloning Sites) 28
Cirnbar 3 Penampalcan sengon yang terserang hama boktor 3 1 G a m h 4 Hasil dektroforesis RNA total yang diperoleh dengan
[image:81.555.75.493.133.780.2]metoda 1-3 33
Gambar 5 Hasil elektroforesis RNA total yang diperoleh dengan
metoda 4 34
Gambar 6 Isolasi mRNA melalui kolom oligo-dT selulosa 35
Gambar 7 Hasil elektroforesis mRNA 36
Gambar 8 Hasil elektroforesis cDNA 37
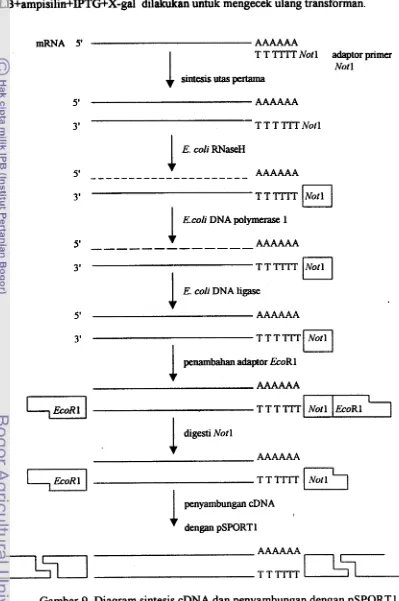
Gambar 9 Diagram sintesis cDNA dan penyambungan dengan
pSPORTl 39
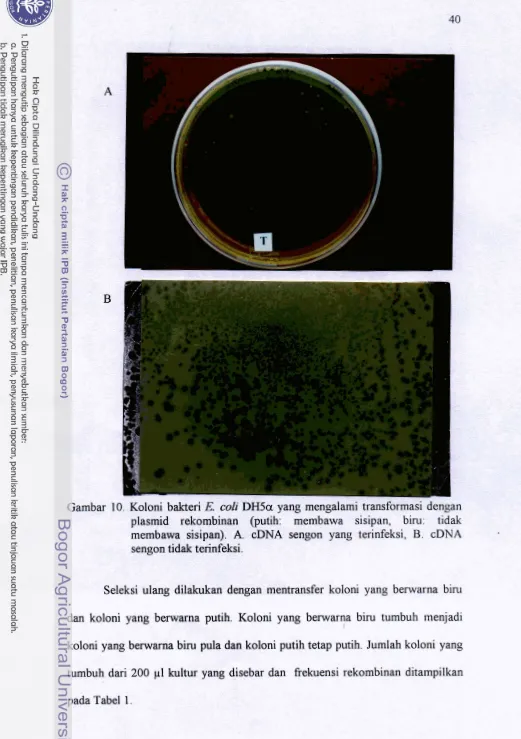
Gambar 10 Koloni bakteri E colz DH5 yang mengalami transformasi
dengan plasmid rekominan 40
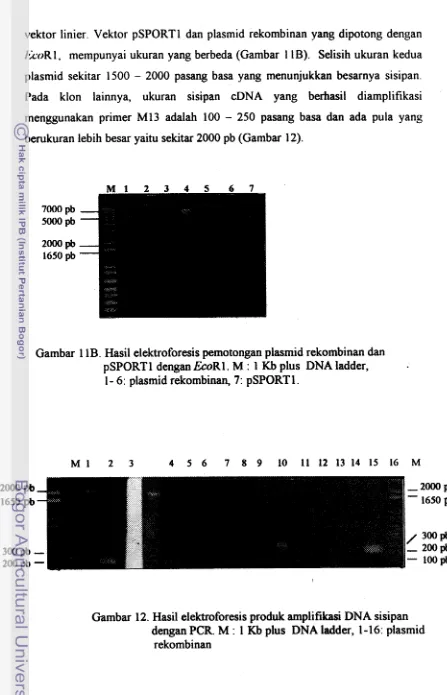
Gambar
1 1A Hasil elektroforesis pernotongan plasmid rekombinandan pSPORTl dengan EcoRl dan Not 1 42 Gambar 11B Hasil elektroforsis pernotongan plasmid rekombinan
dan pSPORT1 dengan b R l 43'
Gambar 12 Hasil elektroforesis produk amplifikasi DNA sisipan
Latar Belakang
Sengon (Paraseriunthes f a l c c ~ t ~ a L. Nielsen) merupakan &ah satu
jenis pohon yang dilrembangkan dalam program Hutan Tanaman Industri.
Tanaman ini mempunyai sifat-sifat unggul yaitu dapat tumbuh cepat pada tanah
miskin hara dan drainase yang kurang baik, batang lurus, dan muki guna sebagai
kayu pertukangan maupun bahan
baku
industri pulp. Sifatnya yang turnbuh cepatsangat sesuai digunakan dalam reboisasi dan penghijauan lahan-lahan kritis
sebagai penyubur tanah.
Masalah penting dalam tegakan sengon yang hampir selalu mengancam
program pembangunan hutan sengon adalah masalah hama dengan dampak
kerusakan yang cukup besar. Xystrosera festiw yang lebih dikenal sebagai
kumbang penggerek batang (uter, wowolan, boktor) merupakan hama utama
pohon sengon. Harna ini secara ekonomis sangat merugikan walaupun masih ada
hama-harna lain yang mengganggu tetapi merupakan hama sekunder (Suratmo,
Serangan X festiva dapat mengakibatkan turunnya kuditas kayu dan
kadang-kadang mematikan pohon inang. Pada serangan yang berat kulit pohon
akan mengering dan pecah-pecah, bahkan sebagian daunnya akan mengering dan
gugur (Nandika dan Wiseno, 1993). Penggerekan bathg mengakibatkan
msaknya bagian dalam kulit kayu sehingga kulit akan mati dan terkelupas. Bila
tidak terjadi serangan berulang-ulang, pertumbuhan pohon yang cepat akan
menyembuhkan luka-luka dengan cara pembentukan kalus. Akan tetapi
sthingga banyak pohon yang mati atau patah. Kerusakan tersebut
akan
m n u n k a n volume dan kualitas kayu pertukangan yang dihasilkan (Husaeni
dan Nandika, 1991).
Cara pengendalian yang benar-benar efektif hingga saat ini. belum
ditemukan. Berklcan ha1 tersebut peflu dilalnrkan usaha untuk mengatasi
m a d a h hama yang melibatlcan pendekatan biologi molekuler. DaIam rangka
mengatasi hama boktor yang lebih komprehensif dengan pendekatan biologi
molehler, dipandan8 perh untuk melakukan karakterisasi gen-gen yang
terinduksi oleh serangan hama boktor.
Respon yang dilakukan oleh tanaman saat terjadi interaksi dengan hama,
adalah melakukan sintesis berbagai molekul toksik baik molekul protein rnaupun
non pratein yang m g s i untuk perliiungan terhadap hama.
Perubahan
yangterjadi pada tanaman sebagai akibat adanya kerusakan atau cekaman dise6ut
sebagai respon dari suatu induksi. Warn beberapa kasus, respon terjadi sebagai
sistem ketahanan suatu tanaman terhadap pelukaan oleh herbivora atau patogen.
Pelukaan jaringan tanaman dapat menginduksi sintesis senyawa fitokimia
tertentu sebagai bent& respon tamman. Respon ini bervariasi sesuai dengan
genotip tanaman, ontogmi, fenologi serta interaksi antara tanaman dengan
lingkungan abiotik dan biotik. Panda dan Kush (1995) mengemukakan bahwa
d a l m beberapa penelitian, respon tamman t d a p hama ditunjukkan oleh
adanya perubahan dalam kandungan tanin dan fen01 yang merupakan produk
jalur asam sikimat. Disamping itu aktifitas relatif fenil alanin ammonia liase
a k t i h PAL dapat menjadi indikator adanya tingkat ketahanan tanaman
twhadap suatu cekaman.
Pada
jenis tanaman tertentu seperti kentang, telah dike&& adanyaproddcsi senyawa fitoaleksin yang berbobot molekul rendah dan terakumulasi
wbagai respon tanaman terhadap m g g a (hama). Akumulasi fitoaleksin
sew respon tehadap kerusftkan oleh hama, mikroba atau pelukaan secara
mekanik telah diketahui terjadi pada beberapa famili tanaman meliputi
Legummoseae, &Ahnaceae, dan Compositae. Perkembangan lebih lanjut,
beberapa peneliti berhasil mengungkapkan adanya respon k e t a b n tanaman
terhadap hama yang melibatkan sekelompok inhibitor proteinase seperti pada
Salix viminalis (Saarikoski et al., 1996), kentang (Gruden et al., 1997), ubi jalar
(Yeh el
al.,
1997) dan buncis (Gin et al., 1998).Penapisan gen-gen yang terlibat dalam sintesis senyawa-senyawa yan'g
berhubungan denga. pertahanan terhadap hama dapat dilakukan terhadap
pustaka cDNA yang disintesis dari mRNA. Penapisan suatu gen yang terinduksi
atau yang didEspresh pada jwingan tertentu dari pustaka cDNA, dapat
dilakukan melahi penapisan d i f m i a l atau plus minus screening maupun
hibridisasi asam nukIeat &ngan pelacak berupa gen tertentu. Penapisan
diferensial dilakulcan dengan melacak pustaka cDNA dengan dua jenis pelacak
berbeda baupa cDNA yang b r a d dari jaringan yang mengekspresikan gen
I
terinduksi dan yang tidak terinduksi atau jaringan cDNA dari dua jenis jaringan
yang berbeda.
Ukuran -men c ~ ~ ~ - u r n u m n ~ a lebih kecil dibandingkan dengan gen
sebagai vektor untuk mengklon cDNk Melalui konstmbi pustaka cDNA
sengoa mbngguItakan plasrnid pSPORTI diharaph dgpat diperoleh cDNA ymg
khubungan dengan g~n-gen ketahanan yang twinWsi oleh m g a n hama
Tujuan Penelitian
Penelitian ini M j u a n untuk mengkonstntksi pustaka cDNA tanaman
sengon Yang terinduksi oleh arangan hama bolctor, sehingga dapat digunahn
sebagai bahan penapisan untuk gen-gen yang berkaitm dengan ketahanan
terhadap serangan k a a dalarn m g k a perbailcan sifat tanaman sengon di masa
yang akan datang.
Waktu dan Tempat Penelitian
Penelitian ini dilaksanakan di Laboratorium Biologi Molelculer 3,
Pu&
Penelitian Bioteknologi LPI. Penelitian dilaksanakan sejak bulan Februari 2001
TINJAUAN PUSTAKA
Hama sengon yang secant ekommis sangat merugikan adalah penggerek
batang boktor (Xystrmera fern). Hama ini mempunyai nama daerah uter-uter,
boktor, wowolan, kumbang serendeng, dan engkes-engkes, yang tennasuk ke
dalam famili Cerambicidae clan ordo Coleoptera. Hama ini menyerang beberapa
spesies dari famili Leguminoceae sepwti Albizia falcatma
(P.
falcataria), A.sumparm, A. strfilda, A. lebbeck, dan Pithecellobiurn lobdurn (Suratmo, 1982;
Nandika dan Wiseno, 1993).
Hama ini biasanya menyerang saat sengon berumur 3 tahun dan bila
serangan dibiarkan selama 2-5 tahun s e l w h tanaman &an rusak . Serangan
ditandai dengan warna merah kecokhtan pada batang. Serangan yang terjadi
pada kayu kadang sampai sekeliling batang dan bila demikian maka tajuk akan
menguning sehingga daun berguguran dan akhirnya pohon &an mati.
Derajat serangan hama pohon sengon dipengaruhi oleh umur pohon,
ketinggian, diameter batang serta p l a taaam. Derajat serangan kumbang
penggerek pada sengon cenderung semakin besar menghti pertumbuhan pohon
dan serangan terbesar terjadi pa& ketinggian batang 6,s
-
9 m (Hasan et al.,1990). Hama boktor pada umumya menyerang batang-batang pohon yang besar
sehingga dapat diambil kesimpulan bahwa semakin tuai umur pohon maka
serangan hama ini pada sengon akan semakin besar. Berdaszukan pengamatan
dilapangan, besar kerusakan yang diakibatkan oleh serangan X festiva mencapai
Bebentpa peaelitian mengenai penggunaan insektisida tetah dilakukan
untuk mengatasi m&ah hama seperti insektisida kontak Sumithion SO EC dan
Sumialpha 25
EC
serta insek-tisida sistemik Suscon Blue yang disemprotkanlangsung. Insektisida ini dapat rnematikan imago maupun larva X' f e s t h .
Berbagai usaha yang dilakukan untuk mengatasi masalah hama baik dengan cars
men- pola tanam maupun penggunaan insektisida belum efektif untuk
mengendalikan serangan hama.
Interaksi hama-tanaman
Mekanisme perlindungan tanaman terhadap hama dan patogen terdiri dari
mekanisme konstitutif dan mekanisme terinduksi. Mekanisme konstitutif berupa
ciri-ciri yang dibentuk pada perhunbuhan vegetatif dan perkembangan tanaman,
seperti trikoma yang merupakan perlindungan daerah aerial pada berbagai
spesies tanaman. Pada mekanisme tefinduksi, hama atau patogen memicu
tanaman membentuk suatu sistem pertahanan. Mekanisme ini mungkin
melibatkan produk
gen
in situ yang telah siap, seperti induksi alrtivitas callmesynthase,
gluiranase,
kithast atclu inhibitor pfdeinase (Ayres, 1992). Infeksihama yang dilakukan pada daun melon ternyata meningkatkan aktivitas inhibitor
proteinase, sehingga diduga protein tersebut berperan dalam sistem pertahanan
tanaman melon terhadap hama (Hammersmidt dan Kuc', 1995). Mekanisme yang
lain adalah yang mengarah kepada pengaktifan gen-gen pertahanan.
Gen-gen yang terlibat didalam pertahanan mungkin menyandi sejumlah
produk yang b e h n g s i secara langsung seperti deterrents, anti feedtmts ataupun
ketahanan sejxrti fitodeksin (Ayres, 1992). Kecepatan serta i~ltmsitas biosintesis
senyawa yang terlibat ddam respon ketahatlan tanaman terhadap serangga
tergmtung pada jarak dari titik pelukaan, besarnya kerusakan, dan jenis elisitor
yang terlibat.
Fragmen tanaman dm dinding sel cendawan mengandung oligosakarida
dalam s t d c h r polisakaridanya. Oligosakarida yang dibebaskan ketika sel
mengalami kerusakan oleh hama atau mikroorganisme dapat befingsi sebagai
sinyd yang mengaktifkan gen-gen penyandi enzim untuk menghasilkan
senyawa-senyawa yang berkaitan dengan kelahanan tanaman (Gambar 1).
Fragmen poli dan oligosakarida yang dilepaskan akibat serangan hama dapat
distimulasi secara in viiro, yaitu meldui kontak antara dinding sel dengan
endopoligalalcturonase (ERhe) yang mempakan suatu enzim yang dilepaskan
oleh bagian tertentu di dalam sel akibat serangan hama.
avon no id Diterpen
Gambztr 1. Mekanisme pertahanan yang terinduksi oleh serangan hama (Panda
Penelitian-pelitim yang berkaitan dengan pengaktifan sistem
pertahanan tamman telah banyak dil-. Pemggeaek polong (Helicoverpa
armigera) yang diinfeks'lkan pada polong buncis 12 sampai 60 hari setelah
pemtwngaan, meng* inhibitor proteinase dengan aktivitas penghdmbatan
yang berbeda terhadap tripsin, kimotripsin, proteinase pencemaan ulat dan
proteinase bakteri (Giri et
d.,
1998). Aktivitas inhibitor tripsin pada kedelai yangterinduksi oleh hama lebih tinggi d i b a n d i i a n dengan tanpa induksi (Zhao et
al., 1996). Pelukaan
secara
mekanik juga diketahui dapat menginduksi genpenyandi inhibitor tripsin. Gen swin 1.1 penyandi inhibitor protease serin
d i t e m u h pada Salk viminalis yang dilukai secara mekanik, yang ditapis dari
pustaka genom dengan menggunakan pelacak win 3 dari populus (Saarikoski et
al., 1 996).
Penelitian lain menunjukkan adanya perbedaan respon
secara
rnolekulQantara pelukaan yang disebabkan oleh harna dan pelukaan secara rnekanik. Pada
kentang (So- tuberam), akumulasi transkrip mRNA untuk proteinase
inhibitor I1 @in 11)
dan
3-hydK,xy-3-methylalutsryI-coeayme akibat kerusakanoleh harna lebih besar dibandihg dengan pernotongan daun (Korth
ctan
Dixon,1 997).
Konstruksi Pustaka cDNA
Pengklonan gen melalui cara pemotongan DNA genom dengan suatu
enzim restriksi yang kemudian disisipkan dalam suatu vektor dan dipelihara
dalam suatu inang disebut dengan shot gun cloning. Setiap vektor yang
SekumpUtan klon DNA goaom mempakan pustaka genom. Fragmen DNA genom
yang dihorsilltan 58npt banyrrk, clan k e n a pemotmgm teajadi seam acak maka
hanya sedikit fiagmen saja yang mengandung gen. Cara lain untuk memperoleh
klon DNA ymg berupa gen dapat dilalrukan dengan memilih sekuen penyandi
saja. Enzim trankriptase balik dapat d i m a n f w untuk ntensintesis DNA
komplementer (cDNA) dengan menggunakan RNA sebagai cetakan (tRNA,
rIUUA, mRNA).
Gen-gen eukariot urnumnya terdiri dari sekuen-sekuen DNA yang
dipisahkm oleh sekuen bukan penyandi (intron). Intron ini
akan
dibuang padaproses pasca transkripsi mRNA yang disebut dengan splicing. Klon cDNA
eukariot
yang diperolehdari
mRNq tidak mengandung intron-clan bergunauntuk
mempelajari ekspresinya di dalam sel bakteri misalnya Escheriichia coli. Pada
umumnya prokariot tidak &pat memproses intron (Old dan Primrose, 1985).
Bakteri yang digunakan untuk membuat klon cDNA umumnya adalah E. coli.
Secara umum pembuatan pustaka cDNA dilakulcan melalui tahap-tahap
sebagai befilnrt ( Huang et al., 1982):
I . Isolasi RNA total
bahaa
untuk
isolasi mRNA2. Sintesis utas pertama dan utas kedua cDNA
3. Konstruksi vektor rekombinan. Jika vektor ystng digunakan berupa plasmid,
selanjutnya plasmid rekombinan diintmduksikan ke dalam sel inang.
4. Seleksi vektor r e k o m b i i berdasarkan gen penanda yang terdapat pada
vektor.
Plasmid merupakan salah satu vektor yang &pat digunakan untuk
untuk klon cDNA Br&m napus (Kim et al., 1998), pGEX-2T untuk klon
cDNA ubi jalar (Yeh et al., 1997) dan pSPORTl untuk mengkIon gen-gen
kedelai yang terinduksi oleh alumunium (Miftahudin et al., 1995; Yuniati, 1999;
ARWar, 2000). Pembuatan pustaka cDNA dapat pula dilakukan dengan
menggunakan vektor lain seperti cosmid dan vektor h. Vektor h banyak
digunakan untuk mengkonstruksi cDNA seperti ZAPXR untuk konstruksi cDNA
Cicer arietinum (Munoz et al, 1998), h gtl 1 untuk kentang (Gruden et al.,
1997),
A
Zap 1 1 untuk Brassim campestris L. ssp. pekinensis dan Arabidopsis(Lim et al., 1996 ; Park et al., 1 998).
Masing-masing klon dari suatu pustaka cDNA dapat dimanfaatkan untuk
berbagai tujuan seperti peningkatan produksi protein yang disandikan oleh klon
cDNA tertentu dalam sel inang, karakterisasi gen maupun transfer cDNA kepada
sel lain. Gen mustard tripsin PI2 (mti-2) yang diperoleh dari klon cDNA telah
dimasukkan ke dalam Nicotiana tabacum L. cv Xanthi dan Arabidopsis L.
(Heynh.)
dan
digunakm untuk mempelajari pengaruh tingkat ekspresi inhibitorproteinase terhadap larva S ' t e r a lifforalis (Leo et al., 1998).
Klon cDNA juga dapat d i d - dalarn upaya mengurutkan DNA
genom. Pada eukariot tingkat tinggi urutan DNA keseluruhan genom masih sulit
dilakukan karena ukurannya besar dan kompleks, sehingga analisis genom
dimulai dengan mengenali wutan DNA yang diekspresikan saja atau yang
dikenal dengan analisis EST (Expremed Sequence Tags). Dalam analisis EST,
cDNA diklon ke dalarn suatu vektor dan selanjutnya dilakukan pengurutan DNA
pasang basa cukup untuk mengidentifikasi gen dengan cara membandingkannsa
dengan database publik.
Menurut data per September 2000 sudah lebih dari 26000 sekuen EST
l,o/ri.s japot~ictrs yang telah tercatat dalam database publik. Sekuen vang
ditemukan tersebut dibagi menjadi beberapa grup dengan berbagai fungsi seperti
respon terhadap lingkungan, sintesis protein, proses seluler, respon terhadap
patogen dan metabolit sekunder (Asamizu el al., 2000). Beberapz- famili gen
pinus seperti chaperonin 60, thiolase, elongnizon.fact)r i a, acid phoshatase, actin
Jeplymerizing factor, heat shock polypeptide HSP 90 dan alcohol
dehidrogenase telah diidentifikasi dengan cara mensekuen cDNA (Kinlaw dan
Neale, 1997). Gen penyandi Notch dari Drosophila juga telah diteliti urutan
basanya dari cDNA (Caballero, 1992).
Isolasi
RNA
RNA merupakan polimer linier yang terdiri dari monomer ribonukleosida
monofosfat yang dihubungkan oleh ikatan fosfodiester (Farrell, 1993). RNA
terdiri dari dua jenis yaitu RNA yang berhubungan dengan ekspresi gen serta
yang tidak berhubungan dengan ekspresi gen, yaitu RNA primer dalam repiikasi
DNA dan RNA dalam struktur kromosom bakteri.
Terdapat tiga jenis RNA yang berhubungan dengan ekspresi gen yaitu
rRNA (ribosomal RNA), tRNA (trmfer RNA) dan m w A (messenger RNA).
rRNA merupakan komponen utama penyusun ribosom yang berperan dalam
sintesis rantai protein, yaitu sebagai tempat pertemuan antara mRNA dengan
paling banyak y a h 80-85% dari RNA total. Pada eukariot terdapat 4 jenis rRNA
yaitu rRNA 18s (17s pada khamir), 28s (25s pada khamir), 5,8S, dan 5s
(Sambrook et al., 1989).
Jumlah tRNA lebih sedikit dibanding rIWA yaitu 15-20%. RNA transfer
b b n g s i mentejemahkan kodon yang terdapat pada mRNA menjadi satu jenis
asam amino pada proses translasi. mRNA merupakan model cetakan dalam
proses penyusunan asam-asam amino pada rantai polipeptida dan disandi oleh
mas khas. Proporsi mRNA adalah yang paling sedikit yaitu 1-2% dari RNA total
dan hanya ada sehtna protein yang disandikan masih diproduksi. Kebanyakan
rnRNA prokariot sangat tidak stabil clan mempunyai waktu paruh sekitar 3 menit
sedangkan mRNA eukariot lebih stabil dengan waktu paruh >10 jam
(P-
globin)dan ada pula yang hanya 30 menit atau h a n g (Albert et al., 1989).
Populasi mRNA dalam sel mamalia terbagi menjadi tiga jenis yaitu tipe
mRNA beriimpah (12000 kopi per sel), tipe intermediet (300 kopi per sel) dan
tipe jarang (15 kopi per sel) (Farrel, 1993). Sambrook et al. (1989) membagi
mRNA menjadi dua jenis yaitu abuncht mRNA dan low abumhce mRNA
( 4 4 kopi per sel). Fro@ low abtnsdance mRNA adalah. 30% dari jumlah
mRNA.
Secara kimiawi maupun biologi, RNA lebih labil dibanding DNA
terutama pada suhu tinggi (%S°C) dan terhadap alkali. RNA juga sangat mudah
terdegradasi oleh RNase, yang merupakan enzim yang sangat stabil. Pada saat
mengisolasi
RNA,
aktivitas RNase h a s dihambat, yang dapat dilakukan denganmenambahkan inhibitor RNase misalnya 8-hydroxyquinolin, memanaskan
Air yang digunakan untuk melarutkan bahan untuk isolasi RNA juga harus bebas
RNase.
Sifat RNA yang tidalc stabil memerlukan cara-cara yang tepat u~ltuk
mengisolasinya. Beberapa ha1 yang perlu diperhatikan dalam isolasi RNA dari
jaringan tanaman yaitu:
1. Penghancuran dinding sel tamman
Se1 tanaman dilcelilingi oleh dinding sei yang terdiri dari selulosa, pektin dan
xyloglucan. Pada prinsipnya isolasi RNA dilakukan dengan rrierusak dinding
sel untuk mengeluarkan sitoplasma dan RNA. Penggunaan nitrogen cair ketika
penggerusan jaringan tanaman sangat penting untuk menjaga jaringan tanaman
tetap beku karena suhu sangat rendah (- 196°C) sehingga ribonuklease tidak
aktif (Wilkins dan Smart, 1996).
2. Pdisakarida dan metabolit sekunder
Kandungan polisakarida dan metabolit sekunder pada sel tanaman sering
menyulitkan dalam isolasi RNA. Banyak jaringan tanaman yang mengandung
polisakarida
cukup
tinggi yang sifirtnya mirip denganasam
nuWestt sehinggadapat mengendap bersama RNA Polisakarida dapat menghalangi atau
menghambat pengendapan
RNA,
mengganggu kuantifikasi RNA yangberdasarkan absorbansi, menghsmbat aktivitas enzirnatik pada percobaan
selanjutnya seperti terhadap enzim restriksi, ligase dan polimerase,
menghambat seleksi poly(~)'-RNA (mRNA) dan mengg- migrasi RNA
saat elektroforesis (Wilkins clan Smart, 1996). Karena sifatnya yang mirip
dengan asam nukleat, pemisahan polisakarida dari RNA sangat sulit.
tanaman seperti Geranium, poinsetia, pinus putih dan k h o dapat
menghasilkan RNA yang ba& (Schultz et al., 1994 dan Santoso, 1996).
Senyawa fenolik dm metabolit sehnder lain seperti antosianin, lateks dan
asam anacardic dapat mempengaruhi proses isolasi RNA dan percobaan
selanjutnyo yang menggunakan
RNA.
Terdapat beberapa cara untuk mengatasiha1 ini antam lain penggunam polivinilpirolidon (PVP) yang bekerja melalui
ikatm
hidrogen
dm
mengendapkan senyawa fenolik serta metabolit sekunder.Senyawa pereduksi seperti $-mercaptoethanol dan dithithreitol
(Dm)
&patme@ oksidasi senyawa fenolik sehingga menghambat aktifitas radial
bebas yang dihasilkan oleh oksidasi fen01 terhadap asam nukleat. Bufer alkalin
dapat menghambat reduksi senyawa fenolik oleh difenol oksidase. Penggunaan
proteinase
K
dapat mendegradasi enzim pengoksidasi senyawa fenolik danmetabolit sekunder.
3. Aktivitas nuklease
Dalam kondisi senescens, pelukaaq serangan patogen atau kekwangan fosfat,
produksi r i b o d e a s e endogen bisa meningkat. Hal ini dapat diiasi dengan
penambahan peredulrsi kuat seperti $-merkaptoe&mol atau
DTT,
proteinase K,guanidin isotiosianat, beberrrpa jenis inhibitor nuWease seperti
VDR
(vanadylribonuclease complexes), RNasin
dan
RNAguard. Beberapa bahan lain yangdapat menghambat aktivitas nuklease adalah guanidine hydrochloride, SDS,
sarcosyl, phenol : chloroform : isoamylalcohol, 8-hydroxyquinoline, cesium
chloride d m cesium tri fluoroacetate (Farrell, 1993; Wilkins dan Smart, 1996)
Larutan untuk isolasi RNA yang siap pakai telah tersedia , seperti T R I z o L ~ ~
varia) dm sel HeLa dengan kualitas RNA yang dihasilkan baik (Kapros
dm
Weterborg, 1995; Braccete et al., 1 999)
Isolasi
mRNA
Pada sel eukafiot mRNA matang dibentuk dari prekursor hnRNA
(heterogenw nuclear RNA) meldui proses pasca transkripsi
RNA.
Sekitar 1-4% RNA total yang terdapat ddam sitoplasma merupakan mRNA matang. Pasca
transkripsi RNA terdiri dari pemasangan tudung ( 5 ' q ) yang krupa
pemunbahan nukleotida 7-methyl guanosine (m7G) pada ujung 5', met3asi pada
posisi
N-7
dari nukleotida panin, pembuangan intron (intron splicing) danpenambahan ekor (3'-end processing) yaitu penambahan 50-300 nukleotida
adenin pada ujung 3 ' (Farrel, 1993).
Ketmadaan poly-A+ yang baperan menjaga kestabilan stmktuf mRNA
dapat dimanfbtkan untuk memisahkan mRNA dari rRNA dan tRNA. Isolasi
mRNA dapat dilakukan dengan melalui beberapa cara yaitu hksinasi mRNA
daIam kolom digo-dT penggunaan partikel magnetik, biotinilasi secara
kimia maupun enzimatik atrurpvn metoda kombinasi seperti fraksinasi oligo dT
berlapis &el magnet
dan
strep avidin berlapis partikel magnet (Jones et al.,1994). Seluruh metoda isolasi RNA berdwrkan pada perpasangan basa antara
* residu adenilat dari mRNA dengsn residu timidilat (oligo-dT) 'Mau residu urasilat
Sintesis eDNA
Prinsip sintesis cDNA addab membentuk DNA kornplementer meialui
proses enzimatik dengan RNA sebagai cetakan. Sintesis cDNA dari mRNA
terdiri dari dua tahap yaitu sintesis utas perkma yang memanfhtkan ekor plyA+
pada ujung 3' yang @at berpasangan dengan primer oligo dT untuk memulai
sintesis utas pertama
dm
sintesis utas kedua dengan cetakan utas pertama daricDNA yang terbentuk. Pada sintesis utas pertama diperlukan molekul mRNA
sebagai mtakan, suatu primer sebagai umpan untuk memulai sintesis, cmpat
macam nukleotida yaitu d A Z , dCTP, dGTP dan dTTP, enzim transkriptase
terbalik dan larutan penyangga reaksi.
Sintesis utas kedua cDNA dapat dilakukan dengan metode seypriming
yang memanfatkan 'simpul jepit rambut' yang terbentuk pada ujung 3' sebagai
primer. Sintesis utas kedua diitalisis oleh fiagmen Klenow dari DNA
polimerase I E cob dan selanjutnya simpul ini dipotong dengan S1 nuklease.
Metoda ini mempunyai kelemahan, yaitu penggunaan S1 nuklease untuk
memotong simpul jepit nunbut mmpakan reaksi yang sulit dikontrol.
Cara lain untuk rhensintesisutas
kedua
cIlNA addah metoda replacementsynthesis yang dikembangkan oleh Okayama dan Berg (1982) dan dimojifikasi
oleh Gubler dan
Hoffman
(1983). Metoda ini menggunakanmRNA
yangberpasangan dengan utas pertama cDNA sebagai bahan r@csi nick translasi
RNaseH. Hasil pernotongan RNaseW pada rnRNA digunakan sebagai primer
* Perkiraan jumlah klon cDNA yang ideal
Pengklonan cDNA untuk memperoleh jenis kopi mRNA berlimpah
seperti penyandi globin, imunoglobulin dan ovalbumin yang proporsinya
mencapai 50-90% dari M A sitoplasma, tidak memerlukan tahap purifikasi
lebih lanjut sebelum disintesis menjadi cDNA utas ganda.
Konstruksi pustaka cDNA yang lengkap, yaitu yang mengandung seluruh
jenis mRNA yang berbeda Mam sel membutuhkan jumlah klon cDNA yang
tinggi. Menurut Kamalay dan Goldberg (1980) yang disitir oleh Slightom dan
Quemada (1988), diperkirakan dalam sel tembakau terdapat 25.000 jenis
mRNA
dan sekitar 6000 diantaranya unik
untuk
setiap organ seperti daun, akar, cabang,petal, anter atau ovari.
Jumlah klon cDNA yang diperlukan agar jenis mRNA jenis low.
abundance tercakup dalam pustaka, dapat diperkirakan dengan rumus sebagai
berikut (Sambrook et al., 1989):
N = ln (1 - P) 1 l(1
-
lln)N : jumiah Mon yang d h t d b q P : probabilitas ,bhany-a: 0,99, n: fraksi populasi
mRNA total yang dinpesewasilcan oleh satu jenis low abundcmce mRNk
Sebagai contoh, dalam sel fibroblast manusia yang mengandung 30% RNA jenis
low abundance dengan 1 1.000 jenis sekuen yang berbeda, dibutuhkan 170.000
klon cDNA untuk menyusun pustaka cDNA yang lengkap.
Penapisan klon cDNA untuk mengidentifikasi sekuen yang diinginkan
dari sejumlah klon cDNA yang sangat banyak merupakan pekerjaan yang sulit
dan membutuhkan biaya yang ti@. Untuk memudahkan penapisan, jumlah
klon cDNA bisa dibatasi dengan cara melakukan fraksinasi mRNA atau
Fraksinasi mRNA kdasarkan ukuran merupakan cara paling sederhana
untuk mendapatkan populasi mRNA yang mengandung h n yang diinginkan.
Fraksinasi mRNA dapat cEilakukan dengan cara sentrifugsi dalam gradien
sukrosa yang mengandung bahan yang dapat mendenaturasi struktur sekunder
RNA. Fraksinasi cDNA lebih menguntungkan dibandingkan fiaksinasi mRNA
karena DNA lebih tahan terhadap degradasi oleh rmklease, dapat dilakukan
fiaksinasi secara lebih akurat melalui elektrof~esis pada gel agarose, dan karena
fidcsinasi cDNA dilakukan pada tahap yang lebih lanjut maka kemungkinan
BAHAN
DAN
METODEBahan tanaman
Bahan tanaman yang digunakan dalam penelitian ini berupa kambium
batang sengon yang terinfeksi hama boktor dan tidak terinfeksi yang diperoleh
dari kebun koleksi plasma nu- Puslit Bioteknologi LIPI.
Persiapan alat dan bahan untuk isolasi RNA
Semua tahapan ekstraksi
RNA
dilakukan pada kondisi dingin denganmenggunakan peralatan dan air yang bebas RNase. Peralatan dibebaskan dari
RNase dengan merendamnya dalam 0,l % DEPC (dietil pirokarbonat) dan
diautoklaf. Air yang digunakan ditambah dengan 0,l % DEPC, diaduk beberapa
jam dan diautoklaf.
Tahapan penelitian
Penelitian ini dilakukan melalui beberapa tahap yang dirangkum pada
Lampiran 1.
Proses
pengendapan dengan sentrifbgasi pada seluruh percobaandilakukan dengan menggunakan dua jenis sentrifbs. Sentrihgasi yang
menggunakan tabung sentrihs 50 ml dilakukan dengan Bioftse 28RSLHeraeus
(No. rotor: 3746), sedangkan sentrifbgasi yang menggunakan tabung mikro 1,5
ml dilakukan dengan Biofbse fresco.
Isolasi
RNA
total.I d a s i RNA total dilakukan segera setelah bahan tanaman dikoleksi.
metoda isolasi RNA yang paling sesuai. Analisis kualitatif RNA total dilalcukan
dengan cara elektroforesis pda 1% gel agarose menggunakan bufer 0,5X
TBE
(0,05M Tris-HCl, pH 8,3; 0,0415 M asam borat; 0,SmM EDTA).
Met& 1
Sebanyak 0,s g kambium sengon digenrs bersama nitrogen cair dan 0,3 g
polivinilpirolidon
(PW)
hingga halus. Selanjutnya dimaddcan pada tabungwntrifus 50 ml yang berisi 5 ml bufer pengekstrak CTAB (100mM Tris-HC1 pH
8,O; 1,4
M
NaCI; 20rnM EDTA, 0,02% B-merkaptoetmol; 2% CTAB), kemudiandicampur perlahan-lahan dan diinkubasi pada 65°C selama 1 jam. Setelah
inkubasi campuran didinginkan pada
suhu
ruang selama 6 menit dan kemudianditambahkan 6 ml k l o r o f o d l - oktanol (24:l). Selanjutnya disentrifbgasi pada
10.000 rpm, 4OC selama 20 menit. Cairan bagian atas diambil dan diekstraksi
dengan klorofodl-oktanol (24: 1) yang dilakukan sebanyak 3 kali. Supernatan
yang diperdeh pada tahap ekstraksi ditambahkan dengan 112 volume 5M NaCl,
dicampur pertahan dan ditambah dengan 2 volume 95% etanol clan disimpan
pada -20°C se1ama beberap8 jam. Selanjutnya disentrifugasigasi pada 10.000 rpm,
4°C selama 20 menit. Endapan dicuci dengan lamtan etanol 70% dingin dan .
dikeringkan pada suhu ruang. Endapan yang telah dikeringkan ditambah dengan
1 ml air bebas nuklease dan 114 volume 10M LiCl dan disimpan selama 1
malam pada suhu ruang. Selanjutnya disentrihgasi pada 10.000 rpm selama 20
menit. Endapan dilarutkan dalam air bebas nuklease, ditambah dengan 1/10
volume 3M sodium asetat pH 5,2 dan 2,5 volume 95% etano1 dan dibiarkan
selama 20 menit. Endapan yang dihasilkan dicuci dengan 70?4 etml,
dikeringha pada suhu m g
dan
dilamtkan dengan 40 pl air.Tahapan isolasi RNA pada metoda 2, hingga tahapgn presipitasi asam
nukleat setelah ekstraksi dmgan Morofodl-oktanol(24: 1) sama dengan met&
I. Enciapan yang dihasilkan selanjutnya dilmtkan dalam bufer resuspensi (25
m M
baric acid; 50 mM Tris-HCl pH 7,6; 1,25mM
EDTA (pH 8,O); 0,l M NaCI)serta 0,4 vohune 2-Butil Eter (2-BE). Campuran dihomogenkan menggunakan
vorteks
dan
diinkubasi di es selama 30 menit. Selanjutnya disentrifbgasi pada10.000 rpm, 4OC selama 20 menit. Selanjutnya supernatan ditambah dengan 1
volume 2-BE untuk mengendapkan asam nukleat. Campuran dihomogenkan
menggunakan vorteks selama 2 menit, diinkubasi di es selama 30 menit dan '
dilanjutkan dengm sentrifugasi pa& 10.000 rpm, 4°C selama 20 menit. Endapan
dicuci dengan 70% etanol untuk xnenghdangkan 2-BE dan selanjutnya
dilarutkan dalam lml air bebas rmklease. Pengendapan RNA dilakukan dengan
8M LiCl (Irowntrasi
aWrir
WII) dan disimpan pada 4°C selama 1 malam.Endapan yang diperoleh melalui sentrifbgasi pacia 10.000 rpm, 4°C selama 20
menit dicuci dengan 70% etanol dim dikeringkan pa& suhu ruang.
Met& 3
Sebanyak 0,s g jaringan digerus bersarna 0,3 g
PVP
dan nitrogen cairhingga halus dan segera dipindahkirn ke dalam tabung sentrifbs 50 mi yang
100 mM LiCl, 5mM
EDTA,
100 m M NaCl dan 1% SDS (Wilkins dan Smart,1996). Setanjutnya ditapnbah dengan 5 ml fenol yang dipanaskan pa& 60°C dan
dihomogedcan dengan vorteks selarna 2 menit. Ke ddam campuran ditambahkan
5 ml klorofbnn/isoamilalkohol(24: 1) dan dihomogenkan dengan vorteks selama
2 menit, kemudian dilanjutkan dengan sentrifbgasi pada 3500 rpm, 4°C selama
10 menit. Bagian atas larutan dipindahkan dan ditambah dengan 10 ml fenol-
klorofonn-isoamilalkohol
(25:24:1), dihomogenkan dengan vorteks selama 2menit dan disentrifbgasi pada 3500 rpm, 4°C selarna 10 menit. Tahapan ini
dilaktdm sebanyak 2 kali. Selanjutnya pada bagian atas larutan ditambahkan
kloroform/isoamilalkohol
(24:l) dengan volume yang sama dan disentrifugasipada 3500 rpm, 4°C selama 10 menit. Bagian atas larutan ditambah dengan 113
volume 8M LiCl dan disimpan pada 4°C selama semalam. Endapan yang
diperoleh meldui sentrifbgasi pada 10.000 rpm, 4OC selama 20 menit, dicuci
dengm 2M LiCl dingin sebanyak 2 ml. Selanjutnya disentrifbgasi pada 10.000
rpm, 4°C selama 20 menit. E n m a n dikeringkan pada suhu ruang, dilarutkan
dalam 250 pl air bebas mklease
dm
ditambah dengan 1/10 volume 3 M sodiumasetat dan 2,s volume etano1 absolut wrta disimpan pada -20°C selama semalam.
Selanjutnya disentrihgasi pada 13.000 rpm , 4°C selama 20 menit. Endapan
dicuci dmgan 70% etanol, dikeringkan pada suhu ruang dan dilarutkan dalam 40
pl air bebas nukIease.
Metode 4.
Jaringan tanaman sebanyak 1,O gram digerus bersama dengan 0,4 gram
sentrifbs 50 ml yang berisi 10 ml bufer
HB,
dicampur perlahan-lahan dandihomogenkm den- slbakier pada kecepatan rendah (100 rpm) s e b a 10 menit.
Selanjutnya 10
d
fenol ditambahkan ke dalam larutan tersebut dmdihomogenkan dengan vorteks selama 2 menit. Ke dalam campuran ditambahkan
.
5 ml klorofonn-isoamildkohol (24:l) dan dicampur perlahan. Selanjutnya
disentrihgasi pada 7000 rpm, 4°C selama 10 menit. Bagian atas diambil dan
dilakukan kembali ekstraksi dengan 10 ml fen01 dan 5 ml klorofoxm-
isoamilzlkohol (24:l) serta disentrihgasi dengan kecepatan 7000 rpm, 4°C
selama 10 menit. Selanjutnya pada fase atas ditambahkan 5 ml kloroforml
isoamilalkohoI(24: 1) dan disentrifiigasi pada 7000 rpm selama 10 menit. Tahap
ini dilakukan sebanyak 2 Mi. Setelah dilakukan ekstraksi dengan kloroform-
olctanol dan disentrifbgasi, pada fase atas ditambahkan 113 volume 8M LiCl dan
dibiarkan pada 4°C selarna semalam (pekerjaan dilakukan dalam tabung 1,5 mi).
.
Endapan
yang diperoleh setelah dilakukan sentrifbgasi pada dengan kecepatan12.000 rpm, 4°C selama 20 menit, dicuci dengan 200 pl larutan 2M LiCl dingin.
Selanjutnya larutan d i i h g a s i pada 12.000 rpm, 4°C selama 20 menit.
Endapan dikeringhm pa& whu ntaag
dan
kemudian dilarutkan dalam 300 pl airbebas rmklease dan ditambahkan 1/10 volume 3M sodium asetat dan 2 volume
etanol absolut serta disimpan pada -20°C selama semalam. Selanjutnya lamtan
disentrifbgasi pada 13.000
rpm,
4°C selama 20 menit. Endapan dicuci denganI
70% etanol, dieringkan pada suhu ruang dan dilarutkan dalam 40 p1 air bebas
IsoIrsi
d m A
I& mRWA dilakukan dengan metoda fhtksinasi pttda kolom oligo-dT
selulosst. Tibp-tabap isolasi mRNA terdii dari preparasi RNA total, isolasi
mRNA ~eleksi pertama dan isolasi mRNA seleksi kedua yang dilalrukan menurut
pro& yang t&pat pada panduan kit ME;SSAGEMK&X mRNA isolation
system (OBCO
BRL).
Sinttsia cDNA
Tahapan sintesis cDNA terdiri dari (1) sintesis utas pertama dan (2) sintesis
utas kedua.
1. S i e s i s utas pertama. Sintesis utas pertama dilakukan dengan memhat
campuran lop1 mRNA (1,375 pg untuk sengon terinfeksi dan 2,s pg untuk
sengon tidak terinfeksi), 2 pl (0,s pglpl) primer adaptor Not1 (5'-
dAAATTWGGCCGC C(T)15 3') dan 3 pl air bebas nuklease. Campuran
diinkubasi pada 6S°C selama 5 rnenit. Selanjutnya pada campuran tersebut
ditambilhkan 10 pl 5X
bufk
reaksi utas pertama (50 ,nM Tris-HC1 pH 8,3;75
m M
KCI; 3mEul MgCh), 5 p l DTT (0,1M), 2,s pldNlT
(10 mM), 15 p1air bebas nuklease. Campuran ini diinlnrbasi pada 42°C selama 5 menit.
Sehjutnya ditambahkan 2,s pl M-MLV Reverse Transkriptuse (20U/@)
dan diinkubasi pada 37°C selama 1 jam, kemudian di simpan di es selama
30 menit. Realcsi dihentikan dengan menambahkan 0,25M EDTA sebanyak
2. Reaksi utas kedua. Utas kdua cDNA dibuat dengan mencampurkan 50 pl
reaksi utas pertama, 7,s pl dNTP (I-, 40 pl 1OX bufer utas kedua (25
m M
Tfis-fK:l pH 8,3; 100 mM KCl; lOmM 0$304; 5mM MgCI2, 0,15mM $-NAD), 10 pl DNA polimerase I (lOUlj~l), 1,25 pI E coli DNA
ligase (lOUIpl), 1,75 pl
RN&
(2U/fl), 289,s pl air bebas nuklease.Campuran diinkubasi pada 15°C selama semalam. Selanjutnya reaksi
dihentikan dengan menambalkan 0,25 M EDTA pH 7,5 sebanyak 4 pl.
3. Ekstraksi clan presipitasi. Hasil pada reaksi utas kedua diekstraksi dengan
fen01 shnyak l x
,
kemudian disentrifbgasi pada 4"C, 12.000 rpm selama20 menit. Kemudian diekstraksi dengan kloroform I isoamilalkohol (24:l)
sebanyak Ix dan disentrifbgasi dengm kecepatan 5000 rpm, 4OC selama 5
menit. Fase bagian atas dipresipitasi dengan 2 volume etano1 absolut dan 0,l
volume 3M sodium asetat pH 5,2 kemudian diinkubasi pada -20°C selama
semalam. Untuk memperoleh endapan cDNA, larutan disentrifbgasi pada
12.000 rpm, 4°C selama 30 menit. Selanjutnya endapan dibilas dengan etanol
70% dan akhirnya diresuspensi dengan 30 pl air bebas nuklease. Analisis
kualitatif cDNA dilakukan melalui elektroforesis pada 1,596 agarose
menggunakan bufer Ix TAE (0,04M Tris-HCI, pH 8,3; 0,0198M asam asetat
Konstruksi plasmid rekambinan
Plasmid yang digunakan sebagai vektor untuk mengMon cDNA adalah
pSPORTl yang membawa gen penanda resistensi terhadap ampisitin (Ap3 dan
JacOPZ' penyandi $-galaktosidase. Konstruksi plasmid rekombinan terdiri dari,
(1) penyambungan cDNA dengan adaptor EcoR1, (2) pemotongan fbsi cDNA-
adaptor dengan enzim restriksi Notl, dan (3) penyisipan cDNA yang berujung
EcoRl dan Notl
ke
dalam pSPORTl yang telah dipotong dengan EcoRl danNot 1
.
1. Penyambungun cDNA dengan adaptor EcoRlt
Reaksi dilakukan dengan mencampurkan 5 pl cDNA (5Ong/pl),6 pl
5X
buferligasi, 1 pl BSA (10 mglml), 1 pl adaptor EcoRI, 2,s U T4 DNA ligase dan.
Air bebas nuklease pada volume akhir reaksi 30 p1. Campuran diinkubasi
pada 15°C selama 4 jam. Inaktivasi enzim dilakukan pada 70°C selama 10
menit dan selsnjutnya disimpan di es.
2 . Pemotongan cDNA
-
a&ptot denganNoJl
Fusi cDNA dan adaptor dipotong dengan Notl yaitu dilakukan dengan cara
mengirhbasi campuran yang terdiri dari 30 pl reaksi ligasi, 4 p1 10X bufer
restriksi NotI, 45 U NotI dan air bebas nuklease pada volume akhir reaksi 40
p1, pada 37°C selama semalarn. Inaktivasi enzim dilakukan pada 65°C
selama 10 menit dan diencerkan d e n p
dH20
sebanyak 500 p1. Tahapisoamilalkohol (25:24:1) dan disentrifigasi pada suhu ruang dengan
kecepatan 5000 rpm selama 3 menit. Presipitasi dilakukan dengan
mensunbahkan 0,1 vdume 3M sodium asetat pH 5,2 dan 2 volume etanol
absolut serta diinkubasi pada -20
"C
selama semalam. Selanjutnya campurandisentrifbgasi dengan kecepatan 12.000 rpm selama 30 menit. Endapan
dicuci dengan 70% etanol absolut, dikeringudarakan dan diresuspensi
dengan I 0 pl air bebas nuklease.
3. Pemotongun vektor pSPORTI (GIBCO, BRL) dengar, enzim Not1 dan
EcoRI
Pemotongan pSPORTl dengan enzim EcoRl dan Nor1 dilakukan bersamaan
karena kedua enzim restriksi yang digunakan membutuhkan suhu inkubasi
d m komposisi bufer restriksi yang sama. Setiap pg vektor dipotong dengan
6 unit enzim restriksi. Peta pSPORTl dan multi situs pengklonan disajikan
pada Garnbar 2.
4. Penyisipun cDNA Re &lam vektor
Reaksi ligasi yang terdii dari 2 p1 vektor ( 0,5 pglpl), 3 p1 cDNA (1 0 ng/pl),
1 pl 10X bufer T4 DNA ligase, 3U T4 DNA ligase dan air bebas nuklease
SP6 promoter
,\
A /-
T7 promoter11 lntergenlc region
[image:109.564.93.430.52.415.2]IacOPZ'
Gambar 2. Peta pSPORT 1 dan multi situs pengklonan (MCS : Multiple Cloning
Sites).
Introduksi plasmid rekombinan ke dalam bakteri
Pembuatan sel bakteri kompeten
Sebelum plasmid rekombinan diintroduksi ke dalam sel E. coli DHSa,
bakteri hams dalam keadaan kompeten. Pembuatan sel kompeten dilakukan
dengan menggunakan kalsium klorida (Tomley, 1996). Stok kultur E. coli DHSa
sebanyak 0,l ml dikultur dalam media LB (10 g/l tripton, 5 g/i yeast extract, 4,8
I
g/l NaC1, pH 7,O) selama semalam dalam inkubator shaker pada 37 "C dengan
kecepatan 150 rpm. Selanjutnya 0,5 ml kultur ini dimasukkan dalam 10 ml LB
Sebany* 1 ml kultur ditransfer ke dalam tabung mikro steril dan disentrifugasi
pada 5000 rpm, 4 OCselama 2 rnenit.
Endapan yang diperoleh ditambah dengan lml larutan 0,lM CaClz dingin
dan disuspemikan. Suspensi kemudian disentrifugasi dengan kondisi yang sama
dan se:lanjutnya endapan disuspensikan kembali dalam 250 pl larutan 0,lM
CaC12 dingin. Selanjutnya diinkubasi di e.s selama 10 menit. Bakteri siap untuk
ditransfmnasi
.
Transf-i baRieri
Plasmid rekombinan hasil ligasi pSPORTl dengan cDNA sebanyak 10
dimasukkan dalam tabung mikro yang berisi 250 pl set E. coli DHSa kompeten.
Selanjutnya campran tersebut diinkubasi pada 42°C selama 45 detik ( heat
shock), kemudian disimpan di es selama 1 jam dan setiap 30 menit digoyang.
Heat shock dilakukan kembali 1 kali, selanjutnya dimasukkan ke dalam 2 ml
media LB. Suspensi bakteri dikultur pada inkubator shaker dengan kecepatan
150 rpm pada 37°C selama 1 jam. Selanjutnya disebar pada media seleksi.
Media seieksi yang digunakan adalah media LB padat yang mengandung 1,5%
bakto agar, 100 pglrnl ampisilin, 2 mg
IPTG
per cawan dan 1 mg X-gal percawan.
Anatisis putaka eDNA
Analisis terhadap pustaka cDNA yang diperoleh dilakukan terhadap
beberapa koloni yang berwarna putih yang diarnbil secara acak. Sisipan cDNA
dan pemotongan plasmid rekombinan dengan kombinasi enzim restriksi EcoRl
d m
Not1
serta k o R 1 saja. PCR dilakukan s e b y a k 30 siklus den* kondisisebagai berikut: 95OC, 9 menit (pra- PCR); 95OC, 1 menit (denaturasi); 60°C, 1
menit (pelelcatan); 72OC, 3 menit (pemanjangan); 72OC, 5 menit (pasca PCR).
Selain dengan
PCR,
pada beberapa kdoni yang lain, sisipan yang ada didalamvektor dianalisis dengan pemotongan menggunakan enzim restriksi yang sesuai.
Plasmid dipotong dengan enzim restriksi pada perbandingan 1 pg plasmid dan 6
HASIL DAN PEMBAHASAPJ
k q a s X fath terhttdap sagan
EWmg S ~ ~ O P I yang temmmg X fed'w k a d m g - u dop;rt h a t i
dqgm mmperhatikan kulit ksyu yang atma tetapi
8da
@aymg h2i.t
kayunya
tidak
maam yrtag jetas -f 3A).Kambium
mngon y a q tidak terinfiksj hama War tamp& sle@lar d e wk a b g a f t
air
ymg tin& serta w m a q a putih. Berbda dagan kambiurny u q -hat, k d i u m sengcm y q terserang hma b o b bienvgna
coklrtt dm seratnya ada yang Icehitaman serta kandungan airnya sadikit atau
[image:112.555.13.543.16.765.2]mengering ( G m k 3B).
Gambar 3. Penam* sengon yang terserang hama bktw: A. Kvlit kayu
terserarrg hama tetapi ti& mermmpdckm Ismsakan yang jefas, Qyu = w n ylng *..'@&L*<g?5$y!n~=ang. . .
I - . i . I .
Kambium yang digunakan untuk isolasi RNA total sebagai bahan untuk
membuat pustaka cDNA sengon yang terinduksi oleh sermgan harna boktor
berasal dari pohon yang masih terserang ulat, dengan tujuan untuk mendapatkan
mRNA yang ditfmskripsikan dari gen-gen yang terinduksi. Isolasi RNA total
dilakukan segera setelah kayu sengon dikoleksi untuk mencegah degradasi RNA.
lsolasi RNA total
RNA total diisolasi dari kambium batang sengon yang terinfeksi hama
boktor d m yang tidak terinfeksi. Kualitas RNA total tanaman yang baik
ditunjukkan dengan integritas RNA ribosom yaitu rRNA 28s dan rRNA 18s
serta tebal kedua pita tersebut yang seimbang. Intensitas pita rRNA 28s yang
lemah m e n u n j u b terjadinya degradasi RNA yang berukuran besar. Degradasi
RNA total ditandai dengan ketidak-tampakan kedua pita tersebut dan munculnya
pita tebal dibagian bawah lajur migrasi RNA yang merupakan pdongan-
potongan RNA total yang berukuran kecil akibat terdegradasi oleh nuklease (Lin
et al., 1996).
RNA yang diperoleh dengan menggunakan metoda 1-3 tidak
menghgsilkan RNA total yang baik (Gambar 4A-C). Pada gambar tersebut tidak
tampak Pita rRNA 28s dan rRNA 18s yang utuh. Penggunaan metoda I
disamping menghasilkan RNA total yang tidak utuh, juga larutan RNA totalnya
kental. Larutan RNA total yang kental mungkin disebabkan oleh kandungan
polisakarida yang tinggi. Pengendapan diferensial untuk memisahkan
total yang tidak kental tetapi mengalami degradasi. RNA total yang diperoleh
dengan metoda 3 juga masih mengalami degradasi.
[image:114.555.65.472.48.783.2]A B C
Gambar 4. Hasil elektroforesis RNA total pada gel agarose 1% menggunakan bufer 0,5X
TBE
yang diperoleh dengan metoda 1 (A), 2 (3) dan 3(C).
Hasil pengujian secara kualitat if terhadap RN A total yang dii solasi
dengan menggunakan metoda 4 (Gambar 5) menghasilkan RNA total yang
mengandung rRNA 28s dan rRNA 18s utuh. Dengan demikian metoda 4 sesuai
untuk mengisolasi RNA total sengon dan dapat digunakan sebagai bahan untuk
mengisolasi rnRNA. Bufer pengekstrak yang digunakan pada metoda 4
komposisinya sama dengan bufer pengekstrak pada metoda 3 yaitu bufer
HB,
demikian juga tahapan isolasinya secara umum harnpir sarna dengan metoda 3.
Tahap yang berbeda adalah homogenisasi ekstrak pada shaker dengan kondisi
dingin serta fen01 yang digunakan tidak dipanaskan terlebih dahulu.
Homogenisasi ekstrak dengan shaker pada isolasi RNA telah dilakukan pada
isolasi RNA dari daun Arabidopsis thaliana dengan hasil, yang sangat baik
(Eggkrmont et al., 1996). Berdasarkan pengukuran jumlah RNA dengan
menggunakan "Gene Quant", RNA total yang dihasilkan adalah 0,895 mg-1,438
Garnbar 5. Hasil elektroforesis RNA total pada gel agarose 1% menggunakan bufer 0,5X TBE. 1-4 : sengon terinfeksi; 5-7: sengon tidak terinfeksi. .
Isolasi
mRNA
Sebagian besar RNA dalam sel terdiri dari transkrip yang tidak menyandi
protein. Sekitar 80-85% merupakan RNA ribosom (rRNA), sebagian lainnya
adalah t W A (15-20%) dan RNA struktural. RNA yang telah mengalami
poliadenilasi (mRNA) hanya sebagian kecil dari RNA total sel yaitu 1-5%.
Isolasi rnRNA yang utuh merupakan tahapan yang penting untuk sintesis
cDNA. Metode isolasi mRNA yang digunakan adalah metoda fraksinasi pada
kolom oligo dT selulosa. Metoda ini berdasarkan adanya afinitas oligonukleotida
dT terhadap poli A pada ujung 3' mRNA. mRNA aka11 ditahan di dalam kolom
oligo dT selulosa, sedangkan komponen lain seperti rRNA dan tRNA tidak diikat
oleh kolom (Gambar 6). Selanjutnya mRNA yang terikat dibebaskan pada tahap
elusi. Oligo-dT selulosa mempunyai kemampuan mengikat sangat tinggi
terhadap poli A yang dapat digunakan secara efektif dalam kolom dan volume
yang sama dapat digunakan kembali untuk seleksi poli-A atau sampel RNA total
[image:116.559.72.478.32.797.2]yang lain (Cleaver et al., 19%).
Gambar 6. Isolasi mRNA melalui kolom oligo-dT selulosa (Wilkins dan Smart, 1 996).
Pengujian mRNA secara kualitatif dengan elektroforesis (Gambar 7)
menunjukkan bahwa mRNA berukuran antara 0,24 kb - 7,6 kb. Hasil isolasi
mRNA yang baik tampak berupa usapan panjang yang berukuran antara 500
nukleotida (bas) dan 8000 nukleotida (Sambrook el al., 1989). Berdasarkan
hasil elektroforesis, rnR