1,2-DIMETIL-1,1,2,2-TETRAFENILDISILANA SULFONAT
MENGKATALISIS REAKSI ESTERIFIKASI ASAM
STEARAT DENGAN METANOL
DAN 2-PROPANOL
SKRIPSI
PAULUS OSARA BALI
080802045
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
UNIVERSITAS SUMATERA UTARA
1,2-DIMETIL-1,1,2,2-TETRAFENILDISILANA SULFONAT
MENGKATALISIS REAKSI ESTERIFIKASI ASAM
STEARAT DENGAN METANOL
DAN 2-PROPANOL
SKRIPSI
Diajukan untuk melengkapi tugas dan memenuhi syarat mencapai gelar Sarjana Sains
PAULUS OSARA BALI
080802045
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
UNIVERSITAS SUMATERA UTARA
PERSETUJUAN
Judul : 1,2-dimetil-1,1,2,2-tetrafenildisilana Sulfonat Mengkatalisis Reaksi Esterifikasi Asam Stearat dengan Metanol dan 2-propanol
Kategori : Skripsi
Nama : Paulus Osara Bali
Nomor Induk Mahasiswa : 080802045
Program Studi : Sarjana (S1) Kimia Departemen : Kimia
Fakultas : Matematika dan Ilmu Pengetahuan Alam Universitas Sumatera Utara
Disetujui di
Medan, Agustus 2014
Komisi Pembimbing :
Pembimbing 2 Pembimbing 1
Prof. Dr. Seri Bima Sembiring, M.Sc Dr. Nimpan Bangun, M.Sc NIP. 194907181976031001 NIP. 195012221980031002
Disetujui oleh
Departemen Kimia FMIPA USU Ketua
PERNYATAAN
1,2-DIMETIL-1,1,2,2-TETRAFENILDISILANA SULFONAT
MENGKATALISIS REAKSI ESTERIFIKASI ASAM
STEARAT DENGAN METANOL
DAN 2-PROPANOL
SKRIPSI
S
aya mengakui bahwa skripsi ini adalah hasil kerja saya sendiri. Kecuali beberapa kutipan dan ringkasan yang masing-masing disebutkan sumbernya.Medan, Agustus 2014
PENGHARGAAN
Puji dan syukur penulis haturkan kepada Tuhan Yesus Kristus sebab atas berkat dan rahmatNya sehingga penulis dapat menyelesaikan penelitian dan penyusunan skripsi ini dengan baik.
Dengan rasa hormat penulis mengucapkan banyak terima kasih kepada Bapak Dr. Nimpan Bangun, M.Sc selaku dosen pembimbing I dan kepada Bapak Prof. Dr. Seri Bima Sembiring, M.Sc selaku dosen pembimbing II yang yang telah banyak memberikan motivasi, wawasan ilmu kimia, mengajarkan keterampilan kerja maupun penulisan laporan hasil penelitian, serta dukungan dana selama penulis melakukan penelitian penelitian. Terima kasih kepada Ibu Dr. Rumondang Bulan, MS dan Bapak Dr. Albert Pasaribu, M.Sc selaku Ketua dan Sekretaris Departemen Kimia yang telah memberikan dukungan selama penyelesaian skripsi ini, kepada Bapak Dr. Lamek Marpaung, M.Phil, Ph.D selaku dosen pembimbing akademik, staf dosen Lab. Kimia Anorganik serta seluruh dosen dan staf pegawai yang telah banyak memberikan bimbingan selama penulis menjalani perkuliahan.
Penulis juga mengucapkan rasa terima kasih yang sebesar-besarnya kepada ayah dan ibu tercinta U. Bali dan F. Dachi yang telah banyak berkorban selama ini hingga penulis dapat menyelesaikan masa studi serta kedua adikku Lukas dan Angelika yang selalu mendoakan penulis.
Akhirnya dengan segala kerendahan hati penulis juga sangat berterima kasih kepada orang-orang yang telah banyak membantu terutama kepada Pak Justaman, Bg Naek, K’ Dewi, sahabat-sahabat asisten Lab. Kimia Anorganik Bg Julianto, Bg Gullit, K’ Elisa, Bg Sahat, Bg Hamdan, K’ Adel, K’ Karlina, K’ Lina, Rizal, Christiana, Lois, Fantoso, Mars, Nabila, Rahel, Tio, Wiyanti, Daniel, dan Anita. Sahabat-sahabatku stambuk 2008 terutama teman seperjuangan Okta, Samuel, Ivo, Christou, Rizal, Jhon, dan Noaksen. Juga kepada teman-teman KMK St. Aloysius Gonzaga dan teman-teman Bung dan Sarinah di GmnI, Frans, Petrus, Beni, Alex serta teman-teman lainnya yang tidak bisa penulis sebutkan satu persatu. Kiranya Tuhan yang akan membalas semua kebaikan yang telah dilakukan untuk penulis.
Penulis menyadari karena keterbatasan penulis sehingga skripsi ini masih jauh dari kesempurnaan. Semoga skripsi ini dapat bermanfaat bagi siapa saja yang membacanya demi kemajuan ilmu pengetahuan.
ABSTRAK
1,2-DIMETHYL-1,1,2,2-TETRAPHENYLDISILANE
SULFONATE CATALYZING ESTERIFICATION
REACTION OF STEARIC ACID WITH
METHANOL AND 2-PROPANOL
ABSTRACT
DAFTAR ISI
Halaman
Persetujuan ii
Pernyataan iii
Penghargaan iv
Abstrak v
Abstract vi
Daftar Isi vii
Daftar Gambar ix
Daftar Singkatan x
Daftar Lampiran xi
Bab 1. Pendahuluan 1.1. Latar Belakang 1
1.2. Perumusan Masalah 3
1.3. Tujuan Penelitian 3
1.4. Manfaat Penelitian 4
1.5. Lokasi Penelitian 4
1.6. Metodologi Penelitian 4
Bab 2. Tinjauan Pustaka 2.1. Industri Oleokimia 5
2.2. Kimia Hijau 6
2.3. Minyak dan Lemak 7
2.4. Asam Stearat 8
2.5. Esterifikasi 9
2.6. Katalis 10
2.7.1. Katalis Homogen 11
2.7.2. Katalis Heterogen 12
2.7.3. Katalis Padat Tersulfonasi 13
2.8. Metil Stearat 16
2.9. Isopropil Stearat 17
Bab 3. Metode Penelitian 3.1. Alat 18
3.2. Bahan 19
3.3. Prosedur Penelitian 19
3.3.1. Esterifikasi Asam Stearat dengan Metanol 19
3.3.2. Esterifikasi Asam Stearat dengan 2-propanol 19
3.4. Bagan Penelitian 21
3.4.1. Esterifikasi Asam Stearat dengan Metanol 21
Bab 4. Hasil dan Pembahasan
4.1. Esterifikasi Asam Stearat dengan Metanol 23
4.2. Esterifikasi Asam Stearat dengan 2-propanol 25
Bab 5. Kesimpulan dan Saran 5.1. Kesimpulan 31
5.2. Saran 31
Daftar Pustaka 32
DAFTAR GAMBAR
Nomor Judul Halaman
Gambar
1. Struktur katalis 1,2-dimetil-1,1,2,2-tetrafenildisilana
Sulfonat 2
2.1. Reaksi antara gliserol dengan asam stearat 7
2.2. Reaksi umum pembentukan ester 9
2.3. Mekanisme reaksi esterifikasi dengan katalis asam 11 2.4. Sintesis asam naftalensulfonat dengan proses sulfonasi
naftalen 14
2.5. Reaksi sulfonasi kitosan dengan menggunakan asam
sulfosuksinat 15
3.4.1. Bagan esterifikasi asam stearat dengan metanol 21 3.4.2. Bagan esterifikasi asam stearat dengan 2-propanol 22 4.1. Reaksi esterifikasi asam stearat dengan metanol 23 4.2. Spektrum kromatografi gas metil stearat 24
4.3. Spektrum FT-IR metil stearat 25
4.4. Reaksi esterifikasi asam stearat dengan 2-propanol 26 4.5. Data kromatografi gas Isopropil Stearat 26
4.6. Spektrum FT-IR Isopropil Stearat 27
4.7. Spektrum 1H-NMR Isopropil Stearat 28 4.8. Spektrum ekspansi 1H-NMR pergeseran kimia δ 0,8 - 1,6
ppm 29
4.9. Spektrum ekspansi 1H-NMR pergeseran kimia δ 2 – 2,4
ppm 29
4.10. Spektrum ekspansi 1H-NMR pergeseran kimia δ 5 – 5,4
DAFTAR SINGKATAN
FT-IR = Fourier Transform – Infra Red GC = Gas Chromatography
1
DAFTAR LAMPIRAN
Nomor Judul Halaman
Lamp
ABSTRAK
1,2-DIMETHYL-1,1,2,2-TETRAPHENYLDISILANE
SULFONATE CATALYZING ESTERIFICATION
REACTION OF STEARIC ACID WITH
METHANOL AND 2-PROPANOL
ABSTRACT
BAB 1
PENDAHULUAN
1.1. Latar Belakang
Reaksi esterifikasi antara asam karboksilat dengan alkohol bersifat reversible, sehingga untuk membuat kesetimbangan reaksi berjalan ke arah pembentukan
ester dapat dilakukan dengan memakai jumlah alkohol yang berlebih. Kecepatan
reaksi antara asam karboksilat dengan alkohol bergantung pada jenis alkoholnya
dengan urutan sebagai berikut : alkohol primer > alkohol sekunder > alkohol
tersier (Hoydonckx, dkk, 2004). Reaktivitas alkohol sekunder dan alkohol tersier
lebih kecil akibat adanya efek halangan ruang pada gugus alkoholnya. Efek
halangan sterik tersebut telah dibuktikan melalui data energi aktivasi Arrhenius
(Eact) dimana energi aktivasi dengan menggunakan alkohol sekunder dan tersier
lebih besar dibandingkan alkohol primer (Moya-Leon, dkk, 2006). Pada reaksi
esterifikasi umumnya digunakan katalis asam sulfat, namun katalis ini dapat
menimbulkan korosi pada reaktor, pencemaran lingkungan, dan tidak dapat
digunakan kembali sehingga harga produk (cost of production) menjadi lebih mahal (Basumatary, 2013).
Oleh karena itu, penggunaan katalis padat dengan gugus fungsi asam
sulfonat telah banyak dikembangkan untuk mengatasi kelemahan yang dimiliki
asam sulfat, dimana telah diketahui bahwa gugus sulfonat memiliki aktivitas
katalitik yang tinggi (Voort, dkk, 2013), misalnya polistirena sulfonat yang
disintesis dari reaksi polistirena dengan asetilsulfat yang kemudian digunakan
pada reaksi transesterifikasi minyak jarak pagar dengan yield sebesar 93,35%
Si Si CH3
CH3
SO3H
SO3H
HO3S
SO3H
jelantah menghasilkan biodiesel. Katalis padat lainnya telah disintesis dari reaksi
silika gel dengan asam klorosulfonat yang kemudian digunakan pada reaksi
esterifikasi asam asetat, asam benzoat, asam sinamat, asam monokloroasetat, dan
asam salisilat dengan etanol menghasilkan ester dengan yield 97-99% (Rajendran
& Karthikeyan, 2011).
Katalis berbasis silikon-karbon telah diketahui bersifat stabil digunakan
pada suhu tinggi dan dapat digunakan kembali (reusable) (Peng, dkk, 2013). Morales (2010) telah mensintesis katalis polistirena yang dimodifikasi dengan
organosilika mesopori dari reaksi ko-kondensasi prekursor stiril-organosilan yang
kemudian disulfonasi dengan menggunakan asetilsulfat. Katalis ini telah
digunakan pada reaksi esterifikasi asam oleat dengan 1-butanol menghasilkan
yield 92%.
Belum lama ini Manullang (2014) juga telah membuat katalis berfase
padat turunan dari silan yang tersubstitusi dengan gugus sulfonat. Katalis ini
disintesis dengan mensulfonasi senyawa 1,2-dimetil-1,1,2,2-tetrafenildisilana
dengan struktur seperti berikut :
Gambar 1. Struktur katalis 1,2-dimetil-1,1,2,2-tetrafenildisilana sulfonat
Katalis 1,2-dimetil-1,1,2,2-tetrafenildisilana sulfonat ini telah digunakan
dalam reaksi transesterifikasi minyak CPO yang mengandung asam lemak bebas
sebesar 8% pada suhu 140oC dan didapatkan yield 96%. Dari penelitian yang
yang sangat baik sehingga dapat digunakan pada suhu tinggi dan bersifat reusable (Manullang, 2014).
Dari uraian diatas, diketahui bahwa reaksi esterifikasi yang dilakukan
hanya menggunakan alkohol primer. Reaksi esterifikasi antara asam karboksilat
dengan alkohol sekunder masih belum banyak dilakukan. Beberapa penelitian
sebelumnya yang melakukan reaksi esterifikasi menggunakan alkohol sekunder
misalnya esterifikasi campuran asam lemak dari minyak kelapa sawit dengan
isopropanol pada suhu 77oC dan 2-butoksietanol pada suhu 95oC menggunakan
katalis asam metanasulfonat (Moya-Leon, dkk, 2006), esterifikasi asam asetat
dengan 2-butanol menggunakan katalis resin asam sulfonat (Xin, dkk, 2013) pada
suhu 120oC, dan esterifikasi asam butirat dengan 2-heksanol menggunakan enzim
Novozym 435 yang diimobilisasi pada resin akrilik makropori (Romero, dkk,
2011). Dari beberapa penelitian diatas, katalis yang digunakan tidak mengandung
Si sehingga katalis tersebut tidak tahan digunakan pada suhu yang tinggi.
Oleh karena itu, dalam penelitian ini akan dibuat metil stearat dan
isopropil stearat melalui reaksi esterifikasi asam stearat dengan metanol dan
2-propanol menggunakan katalis 1,2-dimetil-1,1,2,2-tetrafenildisilana sulfonat.
1.2. Permasalahan
1. Apakah katalis 1,2-dimetil-1,1,2,2-tetrafenildisilana sulfonat dapat
digunakan dalam reaksi esterifikasi asam stearat untuk menghasilkan metil
stearat dan isopropil stearat.
2. Apakah katalis 1,2-dimetil-1,1,2,2-tetrafenildisilana sulfonat dapat
1.3. Tujuan Penelitian
Untuk memperoleh metil stearat dan isopropil stearat melalui reaksi esterifikasi
asam stearat dengan metanol dan 2-propanol menggunakan katalis
1,2-dimetil-1,1,2,2-tetrafenildisilana sulfonat dan memisahkan katalis dari campuran hasil
reaksi.
1.4. Manfaat Penelitian
Hasil penelitian ini diharapkan dapat memberikan informasi ilmiah terhadap
penggunaan katalis asam heterogen berbasis silikon-karbon pada reaksi
esterifikasi asam lemak berantai panjang dengan alkohol sekunder yang bersifat
ramah lingkungan dan reusable.
I.5. Lokasi Penelitian
Penelitian ini dilakukan di Laboratorium Kimia Anorganik FMIPA USU. Analisis
Kromatografi Gas dilakukan di PPKS Medan. Karakterisasi produk dengan
spektroskopi FT-IR dilakukan di Laboratorium Kimia FMIPA UGM Yogyakarta
dan Laboratorium Terpadu USU. Karakterisasi dengan spektroskopi 1H-NMR
dilakukan di Laboratorium LIPI, Serpong.
1.6. Metodologi Penelitian
autoclave. Reaksi esterifikasi dilakukan pada suhu 100oC selama 10 jam sambil diaduk. Setelah reaksi selesai, autoclave dibuka dan campuran hasil reaksi diekstraksi dengan n-heksan kemudian disaring. Fraksi yang larut dalam n-heksan
ditambahkan Na2SO4 anhidrous, lalu didestilasi pelarutnya dan kemudian
divakum. Fraksi yang tidak larut dalam n-heksan dicuci kembali dengan n-heksan,
lalu dikeringkan dan divakum. Hasil esterifikasi yang diperoleh dianalisa dengan
BAB 2
TINJAUAN PUSTAKA
2.1. Industri Oleokimia
Oleokimia saat ini mewakili satu dari kemungkinan-kemungkinan utama terhadap
tantangan besar ilmu kimia pada produk-produk yang terperbarukan. Semua
teknologi yang diperlukan untuk pemurnian minyak, transformasi dan fraksionasi
bahan kimia telah tersedia dan diketahui. Berbicara secara umum mengenai sistem
industri, maka terdapat empat unit proses (penghancuran, pemurnian, fraksionasi,
dan transformasi bahan kimia) yang dilakukan dengan berbagai aktor tumbuhan
yang berbeda (Bondioli, 2003).
Industri oleokimia yang salah satu contohnya yaitu pengolahan kelapa
sawit merupakan industri yang berkembang pesat di Indonesia. Kelapa sawit
merupakan sumber material terperbaharui yang sangat potensial untuk
dikembangkan. Kandungan asam lemak jenuh seperti miristat, palmitat, dan
stearat serta asam lemak tidak jenuh yaitu asam oleat dan linoleat menjadi bahan
baku yang diproses menjadi senyawa baru seperti metil ester asam lemak dan
alkohol asam lemak (Roesyadi, dkk, 2012). Secara sederhana, kegunaan non
makanan dari minyak kelapa sawit dan minyak inti kelapa sawit serta produknya
dibagi menjadi dua kategori, yaitu produk yang dibuat secara langsung dari bahan
minyak dan produk yang diperoleh melalui rute oleokimia, yaitu
senyawa-senyawa kimia yang diturunkan dari minyak atau lemak (Fereidoon, 2004).
meningkat pada tahun-tahun mendatang, karena asam lemak ini banyak dipakai
pada berbagai industri seperti industri ban, kosmetik, plastik, cat, farmasi,
detergen dan sabun, serta alternatif bahan bakar biodiesel (Tambun, 2002).
2.2. Kimia Hijau
Secara luas telah diakui bahwa terdapat peningkatan kebutuhan akan
proses-proses yang lebih ramah lingkungan dalam industri kimia. Tren ini selanjutnya
dikenal sebagai ‘Kimia Hijau’ atau ‘Teknologi Berkelanjutan’ yang
mengharuskan terjadinya pergeseran pandangan dari konsep tradisional mengenai
efisiensi proses ke nilai ekonomi untuk menghilangkan limbah dan menghindari
pemakaian zat-zat beracun dan/atau berbahaya (Sheldon, dkk, 2007).
Dalam prakteknya, kimia hijau melingkupi persoalan-persoalan yang lebih
luas dari definisi yang diberikan. Meski begitu, dengan ditingkatkannya perhatian
terhadap proteksi lingkungan, pencegahan polusi, dan teknologi produksi yang
bersih dan ramah lingkungan, maka akan terdapat ketertarikan tinggi dan
tantangan yang besar bagi ahli kimia untuk mengembangkan produk baru serta
prosesnya (Sharma & Mudhoo, 2011).
Bahan-bahan kimia organik yang banyak digunakan saat ini diturunkan
dari minyak bumi dan gas alam yang tidak terperbarukan, dan juga beberapa
bahkan masih dibuat dari batu bara. Setelah digunakan, sisa-sisa bahan tersebut
berakhir sebagai karbon dioksida yang merupakan gas rumah kaca penyebab
pemanasan global. Untuk masa depan yang lebih baik, penelitian mesti didasarkan
pada sumber-sumber terperbarukan yang berasal dari pertanian dan hasil hutan
2.3. Minyak dan Lemak
Minyak dan lemak merupakan senyawa yang sangat melimpah di alam dalam
bentuk lipida. Minyak dan lemak berbentuk triester dari reaksi kondensasi antara
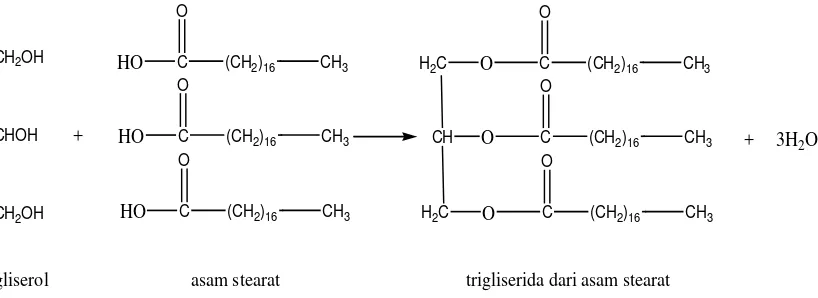
tiga molekul asam lemak dengan sebuah molekul gliserol. Triester tersebut
umumnya dikenal dengan trigliserida. Reaksi antara gliserol dan tiga molekul
asam stearat menghasilkan suatu trigliserida dengan struktur sebagai berikut :
Gambar 2.1. Reaksi antara gliserol dengan asam stearat
Perlu diingat bahwa setiap terbentuk ikatan ester, maka sebuah molekul air
juga dihasilkan. Produk triester dari gliserol dengan asam stearat merupakan
contoh sebuah trigliserida yang sederhana (Stoker, 1991).
Lemak dan minyak yang dijumpai di alam terdiri dari trigliserida
campuran yang merupakan ester dari asam lemak rantai panjang. Trigliserida
dapat berwujud padat atau cair. Pada umumnya minyak berwujud cair pada suhu
kamar karena mengandung sejumlah besar asam lemak tak jenuh seperti oleat,
linoleat, dan linolenat. Sedangkan lemak umumnya berwujud padat pada suhu
kamar karena mengandung sejumlah besar asam lemak jenuh seperti stearat,
palmitat, dan laurat. Minyak dapat diperoleh dari tumbuh-tumbuhan dan lemak
dapat diperoleh dari hewan. Ada beberapa reaksi penting pada minyak dan lemak CH2OH
CHOH
CH2OH
HO C O
(CH2)16 CH3
HO C O
(CH2)16 CH3
HO C O
(CH2)16 CH3
O C
O
(CH2)16 CH3
O C
O
(CH2)16 CH3
O C
O
(CH2)16 CH3 H2C
CH
H2C
+ 3H2O
yaitu hidrolisa, oksidasi, hidrogenasi, dan esterifikasi / transesterifikasi (Ketaren,
1986).
Minyak dan lemak yang diperdagangkan merupakan campuran-campuran
dari lipid, mayoritas tersusun atas triasilgliserol (umumnya >95%) bersama
dengan diasilgliserol, monoasilgliserol dan asam lemak bebas. Namun, minyak
dan lemak juga mengandung fosfolipida, sterol bebas dan ester-ester sterol, tokols
(tokoferol dan tokotrienol), triterpen alkohol, hidrokarbon dan vitamin-vitamin
yang terlarut dalam minyak.
Kebanyakan minyak dan lemak biasanya dinamai berdasarkan sumber
biologisnya (seperti minyak kedelai) tetapi masing-masing minyak dan lemak
memiliki rentang parameter fisika, kimia, dan komposisinya sehingga dapat
dikenali (Gunstone, 2004).
2.4. Asam Stearat
Asam lemak terdiri atas unsur-unsur seperti karbon, hidrogen dan oksigen yang
tersusun sebagai rangka rantai karbon linier dengan beragam panjang rantai dan
mempunyai sebuah gugus karboksil pada salah satu ujung rantainya. Asam-asam
lemak dapat berupa saturated (tidak memiliki ikatan rangkap), monounsaturated (memiliki sebuah ikatan rangkap), atau polyunsaturated (memiliki dua atau lebih ikatan rangkap) (Chow, 2007).
Asam stearat( nama sistematis, asam oktadekanoat, CH3(CH2)16COOH)
merupakan asam lemak berantai panjang dengan 18 atom karbon tanpa adanya
ikatan rangkap. Meskipun asam stearat diklasifikasikan sebagai asam lemak
jenuh, baik dari segi biokimia maupun kegunaan nutrisi serta rekomendasi diet,
data yang telah dikumpulkan selama 50 tahun terakhir menunjukkan bahwa asam
stearat sangat unik diantara asam-asam lemak jenuh dalam makanan. Tidak seperti
mana dapat meningkatkan level kolesterol dalam darah, namun asam stearat
menunjukkan efek netral pada total darah serta mempunyai level kolesterol LDL
yang rendah (Beef Facts, 2007).
2.5. Esterifikasi
Esterifikasi dapat diartikan sebagai transformasi asam karboksilat atau turunannya
menjadi ester. Reaksi langsung antara alkohol dan asam karboksilat secara umum
dibantu dengan katalis asam. Reaksi ini dapat berlangsung dengan baik jika
dilakukan pada suhu tinggi (Otera, 2003).
Suatu ester asam karboksilat ialah suatu senyawa yang mengandung gugus
–CO2R dengan R dapat berbentuk alkil ataupun aril. Laju reaksi esterifikasi suatu
asam karboksilat bergantung terutama pada halangan sterik dalam alkohol dan
asam karboksilatnya (Fessenden, 1986).
Gambar 2.2. Reaksi umum pembentukan ester
Reaksi antara asam lemak dengan alkohol merupakan reaksi reversible sehingga alkohol harus ditambahkan dalam jumlah berlebih. Penggunaan alkohol
berlebih bertujuan untuk menggeser reaksi ke arah kanan dan memastikan reaksi
berjalan sempurna (Fangrui & Hanna, 1999).
Romero (2011) telah menginvestigasi pengaruh posisi gugus –OH dari
RCOH
O+
R'OH
kalor
RCOR'
O
+
H
2O
suatu asam karboksilat
suatu alkohol
suatu ester
diperoleh, diketahui bahwa 1-heksanol memberikan yield lebih tinggi
dibandingkan dengan 2-heksanol diikuti oleh 3-heksanol. Hal ini disebabkan oleh
efek halangan ruang dari alkohol tersebut. Alkohol primer memiliki halangan
sterik yang lebih kecil dibandingkan alkohol sekunder dan alkohol tersier.
2.6. Katalis
Katalis merupakan suatu senyawa yang dapat meningkatkan laju reaksi tetapi
tidak ikut terkonsumsi oleh reaksi. Katalis digunakan secara luas baik di alam,
laboratorium dan industri (Shriver & Atkins, 1999 ).
Suatu katalis biasanya bekerja dengan membentuk ikatan kimia ke satu
atau lebih pereaksi yang kemudian dapat memfasilitasi konversi dari pereaksi
menjadi produk. Katalis tidak mempengaruhi kesetimbangan reaksi. Penjelasan
kimia dari proses katalisis secara kualitatif mengambil bentuk berupa mekanisme
reaksi (Gates, 1991).
Katalis ada yang homogen dan heterogen. Contoh dari katalis asam,
dimana intermediet terprotonasi berperan, dimungkinkan dengan adanya pengaruh
katalis asam berproton seperti pada dekomposisi asam formiat. Pada contoh
diatas, katalisnya homogen. Asam kuat ditambahkan pada larutan asam formiat
dan keseluruhan proses berlangsung dalam satu fase cairan. Di lain pihak,
khususnya dalam reaksi-reaksi industri yang penting, katalisnya berupa padatan,
dan pereaksi baik sebagai gas maupun dalam larutan, mengalir pada permukaan
padatan.
Hidrogenasi olefin merupakan contoh dimana kedua katalis homogen dan
heterogen dapat dipergunakan secara efektif. Reaksi sederhana tanpa katalis
berjalan lambat kecuali dengan suhu yang sangat tinggi, yang menyebabkan
timbulnya kesulitan lain, seperti kesulitan mengatur suhu yang tinggi dan
R C OH O H+ R C O
OH2+
R'OH R C O O H R' -H+ R C OR' O +
(1) (2) (3)
2.6.1. Katalis Homogen
Katalis konvensional untuk reaksi esterifikasi adalah katalis asam
homogen (seperti H2SO4). Katalis asam homogen sangat sulit untuk diperoleh
kembali dari reaksi dan harus dioperasikan pada suhu yang tinggi, serta dapat
meningkatkan masalah lingkungan yang serius. (Basumatary, 2013)
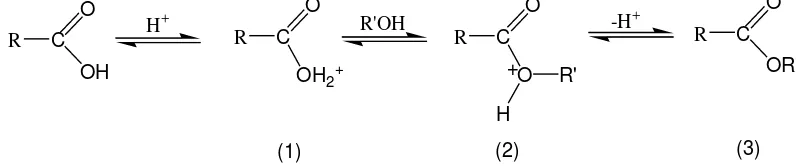
Gambar 2.3. Mekanisme reaksi esterifikasi dengan katalis asam
Langkah mula-mula dari proses diatas yaitu protonasi asam karboksilat
untuk menghasilkan ion oksonium (1), yang mana mengalami reaksi pertukaran
dengan suatu alkohol menghasilkan intermediet (2), dan selanjutnya akan
melepaskan proton untuk membentuk ester (3). Masing-masing langkah dalam
proses tersebut bersifat reversible tetapi dengan berlebihnya jumlah alkohol yang dipakai maka akan membuat kesetimbangan reaksi berjalan kearah produk.
Namun, jika terdapat air yang merupakan donor elektron yang lebih kuat dari
alkohol alifatik akan membuat pembentukan intermediet (2) menjadi tidak disukai
sehingga proses esterifikasi tidak berjalan sempurna (Christie, 1993).
Rachmaniah (1999) telah meneliti studi kinetika transesterifikasi minyak
mentah dedak dengan katalis HCl menghasilkan yield 25-50%. Guan juga telah
melakukan transesterifikasi minyak jarak dengan katalis H2SO4, asam benzen
sulfonat, dan asam p-toluene sulfonat dimana diperoleh kesimpulan bahwa katalis
p-toluene sulfonat memberikan yield yang lebih tinggi (Guan, dkk, 2009)
Penggunaan katalis asam homogen seperti asam sulfat dan asam sulfonat
pengembangan kearah kimia hijau telah membawa kemajuan terhadap
perkembangan katalis asam fase padat, dimana material ini dapat menggantikan
cairan asam yang bersifat korosif yang banyak digunakan dalam industri.
2.6.2. Katalis Heterogen
Katalis asam berfase padat memberikan manfaat yang lebih signifikan dibanding
katalis asam homogen. Penggunaan katalis tersebut dapat menyelesaikan
permasalahan lingkungan, korosi, toksisitas, serta mudah dipisahkan dari
campuran produk. Pengembangan katalis padat memberikan peluang inovasi
kimia hijau di masa depan (Clark, 2002). Katalis asam berfase padat telah menjadi
katalis heterogen yang umum digunakan pada industri petrokimia terutama untuk
reaksi-reaksi organik seperti reaksi Friedel-Crafts. Katalis asam berfase padat
dideskripsikan berdasarkan keasaman Bronsted atau Lewis, kekuatan dan jumlah
situsnya, serta morfologi penyangga. Aktivitas dan selektivitas katalis akan
bergantung dari sifat-sifat yang telah disebutkan sebelumnya.
Zeolit merupakan katalis yang sangat luas digunakan dalam industri
karena harganya tidak mahal, prosesnya ramah lingkungan dan memiliki luas
permukaan yang besar. Zeolit terdiri dari tetrahedral AlO4-5 dan SiO4-4 yang
berikatan melalui atom oksigen. Namun diketahui kebanyakan zeolit asam
menunjukkan laju reaksi yang lambat sehingga memerlukan waktu reaksi yang
cukup lama pada proses esterifikasi (Kiros, dkk, 2001).
2.6.3. Katalis Padat Tersulfonasi
Penggunaan katalis padat yang memiliki gugus fungsi sulfonat telah banyak
dikembangkan saat ini. Kiss, dkk (2006) telah meneliti penggunaan resin penukar
ion sebagai katalis reaksi esterifikasi. Katalis yang digunakan yaitu Amberlyst-15
meskipun memiliki banyak gugus sulfonat, namun kedua resin tersebut
menunjukkan ketidakstabilan selama proses reaksi.
Kedua katalis ini menunjukkan aktivitas awal yang cukup tinggi, tapi
katalis Amberlyst-15 setelah 2 jam reaksi menjadi tidak aktif, sedangkan katalis
Nafion-NR50 setelah 4,5 jam reaksi. Hal ini membuat kedua katalis resin tersebut
tidak dapat digunakan secara terus-menerus dalam proses industri. Disamping itu,
harga kedua katalis tersebut sangat mahal.
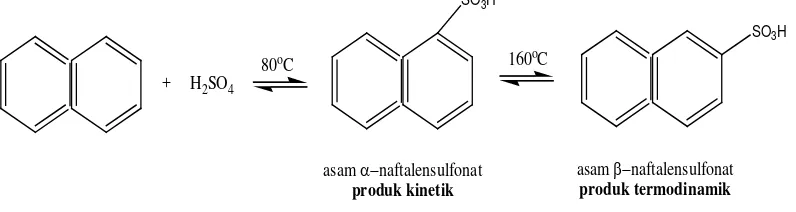
Katalis sulfonat berbasis karbon baru-baru ini juga telah dibuat.
Pembuatan katalis berbasis karbon seperti naftalen yang diikuti dengan proses
sulfonasi dilakukan dengan menggunakan asam sulfat berasap yang menghasilkan
padatan hitam. Asam sulfat berlebih dapat dihilangkan dengan destilasi vakum.
Senyawa aromatik tersulfonasi yang sederhana seperti pada Gambar 2.4 memiliki
aktivitas katalitik yang bagus namun tidak bersifat stabil sebagai katalis (Emrani
& Shahbazi, 2012).
Gambar 2.4. Sintesis asam naftalensulfonat dengan proses sulfonasi naftalen
Wang (2012) telah membuat katalis polimer yaitu polietersulfon. Katalis
ini dibuat melalui jalur sintesis langsung dengan polimerisasi monomer
sulfonatnya. Dengan begitu, derajat gugus sulfonat dapat dikontrol. Katalis
polietersulfon diketahui memiliki aktivitas katalitik yang baik dan stabil dalam
reaksi. Disamping itu katalis ini dapat digunakan kembali lebih dari empat kali
dan tidak menunjukkan penurunan aktivitas yang berarti meskipun katalis ini
memiliki konsentrasi asam yang relatif sedikit. + H2SO4 80
oC
SO3H
160oC
SO3H
asam α−naftalensulfonat
produk kinetik
asam β−naftalensulfonat
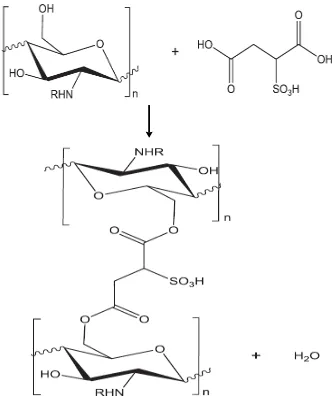
Castanheiro, dkk (2013) telah membuat katalis sulfonat berbasis
biopolimer kitosan dengan mensulfonasi kitosan dengan asam sulfosuksinat.
Katalis kitosan sulfonat tersebut digunakan untuk mengesterifikasi asam palmitat,
asam stearat dan asam oleat dengan metanol pada suhu 60oC.
Aktivitas katalitik dari katalis tersebut meningkat seiring bertambahnya
jumlah gugus sulfonat yang terikat hingga batas tertentu. Diketahui bahwa jika
terlalu banyak gugus sulfonat yang terikat, membuat aktivitas katalitik menjadi
menurun. Hal ini diakibatkan oleh terhambatnya proses difusi asam lemak
kedalam matriks kitosan.
Baru-baru ini Manullang (2014) juga telah mengembangkan katalis padat
yang disulfonasi berbasis silikon. Katalis berbasis silikon ini telah diketahui
memiliki kestabilan termal yang sangat baik dalam reaksi transesterifikasi
maupun esterifikasi, dimana katalis ini dapat digunakan pada suhu yang tinggi
serta mudah untuk diperoleh kembali dari campuran produk reaksi. Katalis
tersebut juga dapat digunakan kembali tanpa mengalami leaching.
Katalis padat disilan sulfonat diketahui efektif sebagai katalis pada
acid-transesterifikasi minyak sawit low-grade. Konversi optimum yang dicapai untuk CPO dengan ALB 7,83% adalah 95,75% pada kondisi konsentrasi katalis 10%(wt,
derajat sulfonasi 36,7%), suhu reaksi 120oC, rasio mol metanol:CPO (22:1) dan
waktu reaksi 8 jam.Konversi optimum yang dicapai untuk PFAD dengan ALB
8,72% adalah 97,49% pada kondisi konsentrasi katalis 10%(wt, derajat sulfonasi
36,7%), suhu reaksi 80oC, rasio mol metanol:CPO (6:1) dan waktu reaksi 8 jam.
Katalis padat disilan sulfonat ini relatif toleran terhadap kandungan air.
2.8. Metil Stearat
Metil ester merupakan salah satu senyawa turunan lemak/minyak yang dihasilkan
dari reaksi transesterifikasi / esterifikasi. Metil ester merupakan bahan baku yang
dibutuhkan dalam industri oleokimia. Metil stearat dibuat dengan mengesterifikasi
asam stearat menggunakan metanol. Pembuatan metil stearat telah banyak
dikembangkan dengan menggunakan katalis seperti titanat (Blandy, dkk, 1991)
dan kitosan sulfonat (Castanheiro, dkk, 2013).
Penggunaan metil stearat cukup banyak. Ester stearat telah diteliti
penggunaannya sebagai campuran polyvinylchloride (PVC), dimana campuran metil stearat-PVC memiliki tingkat kelarutan yang lebih baik (Pizzoli, dkk, 1982).
/ PCM) untuk penyimpanan energi panas pada bangunan. Penggunaan campuran
ini didasarkan pada karakteristik sifat termal dari ester rantai pendek stearat dan
palmitat stabil dan tidak bersifat korosif jika dibandingkan dalam bentuk asam
lemaknya. Disamping itu, penggunaan campuran stearat dan palmitat dipakai
karena produksi senyawa ini sangat besar di industri kimia serta harganya yang
cukup murah.
Eliasson, dkk (2001) juga telah menguji asam stearat serta metil stearat
dalam pembuatan film monolayer. Baik asam stearat maupun metil stearat terjerap
secara kimia pada permukaan oksida dari aluminium melalui ikatan koordinasi
asimetrik dari gugus karboksilat yang dibuktikan dari data spektroskopi FT-IR.
2.9. Isopropil Stearat
Isopropil stearat dibuat melalui reaksi esterifikasi asam stearat dengan isopropil
alkohol. Isopropil stearat termasuk salah satu dari ester stearat yang memiliki
karakteristik yang unik dengan viskositas yang rendah dan sifatnya berminyak
yang menghasilkan film hidrofobik sehingga umum digunakan terutama sebagai
bahan kosmetik. Dari data yang diperoleh menunjukkan bahwa ester-ester stearat
termasuk isopropil stearat mempunyai toksisitas yang sangat rendah dan tidak
bersifat iritasi pada kulit.
Pada kosmetik, ester ini sering digunakan sebagai formula makeup mata,
kulit, lipstik, dan produk-produk perawatan kulit. Ester ini bertindak sebagai
pelumas pada permukaan kulit, yang membuat kulit menjadi terlihat lembut dan
halus. Isopropil stearat saat mengering akan membentuk lapisan tipis pada
BAB 3
METODE PENELITIAN
3.1. Alat
- Gelas Beaker 250 ml Pyrex
- Gelas Ukur 25 ml Pyrex
- Labu Leher Dua 250 ml Pyrex
- Corong Pisah 250 ml Pyrex
- Kondensor
- Corong
- Termometer 360oC Boeco
- Autoclave
- Tanur Model 182
- Neraca Analitis Mettler PM 400
- Hotplate stirer Cimarec
- Magnetic Bar
- Spektrofotometer FT-IR Shimadzu
- Kromatografi Gas Shimadzu
- Spektrofotometer 1H-NMR JEOL
3.2. Bahan
- Asam Stearat 93 % PT Sochi Mas
- Isopropil alkohol Bratachem
- 1,2-dimetil-1,1,2,2-tetrafenildisilana sulfonat PPKS
- Na2SO4 anhidrat p.a Merck
3.3. Prosedur Penelitian
3.3.1. Reaksi Esterifikasi Asam Stearat dengan Metanol
Reaksi esterifikasi dilakukan dalam autoclave stainless steel dengan mencampurkan 10 gram asam stearat (0,0327 mol), 6,28 gram metanol (0,1962
mol), 0,4 gram katalis 1,2-dimetil-1,1,2,2-tetrafenildisilana sulfonat dan
dimasukkan pengaduk magnet. Reaksi esterifikasi dilakukan pada suhu 100oC
sambil diaduk selama 10 jam. Setelah 10 jam reaksi, autoclave dibuka dan
campuran hasil reaksi lalu disaring. Residu diekstraksi dengan n-heksan. Fraksi
yang larut dalam n-heksan ditambahkan dengan Na2SO4 anhidrat, kemudian
disaring, didestilasi pelarutnya lalu divakum. Fraksi yang tidak larut dalam
n-heksan dicuci kembali dengan n-n-heksan, kemudian dikeringkan dan divakum.
3.3.2. Esterifikasi Asam Stearat dengan 2-propanol
Reaksi esterifikasi dilakukan dalam autoclave stainless steel dengan mencampurkan 10 gram asam stearat (0,0327 mol), 11,77 gram 2-propanol
(0,1962 mol), 0,4 gram katalis 1,2-dimetil-1,1,2,2-tetrafenildisilana sulfonat dan
dimasukkan pengaduk magnet. Reaksi esterifikasi dilakukan pada suhu 100oC
sambil diaduk selama 10 jam. Setelah 10 jam reaksi, autoclave dibuka dan campuran hasil reaksi disaring, kemudian residu diekstraksi dengan n-heksan.
Fraksi yang larut dalam n-heksan ditambahkan dengan Na2SO4 anhidrat,
10 g asam stearat (0.0327 mol)
dimasukkan kedalam autoclave
dimasukkan 6,28 g metanol (0,169 mol) dan 0,4 g katalis 1,2-dimetil-1,1,2,2-tetrafenil disilana sulfonat
dimasukkan magnetik stir dipanaskan sambil diaduk pada suhu 100oC selama 10 jam campuran hasil reaksi
disaring
filtrat residu
diuapkan pelarutnya divakum
ditimbang
diekstraksi dengan n-heksan fase yang larut
dalam n-heksan
fase yang tidak larut dalam n-heksan
ditambahkan Na2SO4 anhidrous dicuci dengan n-heksan divakum
divakum dilarutkan dalam nheksan hingga jenuh, lalu didinginkan pada suhu
-15oC selama 3 jam kemudian disaring. Filtrat yang diperoleh lalu diuapkan dan
divakum. Fraksi yang tidak larut dalam n-heksan dicuci kembali dengan n-heksan,
kemudian dikeringkan dan divakum.
3.4. Bagan Penelitian
10 gram asam stearat
dimasukkan kedalam autoclave ditambahkan 11,77 gram 2-propanol dan 0,4 gram katalis 1,2-dimetil-1,1,2,2-tetrafenildisilana sulfonat
dimasukkan magnetik stir dipanaskan sambil diaduk pada suhu 100oC selama 10 jam
campuran hasil reaksi
diekstraksi dengan n-heksan
fase yang tidak larut dalam n-heksan fase yang larut
dalam n-heksan
ditambahkan Na2SO4 anhidrat
disaring
didestilasi pelarut
dianalisa dengan GC, FT-IR dan 1H-NMR divakum
dilarutkan dalam n-heksan hingga jenuh didinginkan pada suhu -15oC selama 30 menit
dicuci dengan n-heksan
dikeringkan dan divakum
katalis destilat residu diuapkan pelarutnya divakum ditimbang disaring
fase yang larut dalam n-heksan
fase yang tidak larut dalam n-heksan
hasil
C17H35-C
O
OH
CH3OH C17H35-C
O
OCH3
H2O
1,2-dimetil-1,1,2,2-tetrafenildisilana sulfonat
T= 100oC BAB 4
HASIL DAN PEMBAHASAN
Dalam penelitian ini, ada 2 ester yang dibuat yaitu metil stearat dari reaksi antara
asam stearat dengan metanol dan isopropil stearat dari reaksi antara asam stearat
dengan 2-propanol menggunakan katalis 1,2-dimetil-1,1,2,2-tetrafenildisilana
sulfonat.
4.1. Esterifikasi Asam Stearat dengan Metanol
Reaksi esterifikasi antara asam stearat dengan metanol menggunakan katalis
1,2-dimetil-1,1,2,2-tetrafenildisilana sulfonat menghasilkan metil stearat. Reaksi
esterifikasi berlangsung pada suhu 100oC dan metanol yang berlebih sekaligus
sebagai pelarut. Metil stearat yang diperoleh berupa padatan lunak yang berwarna
putih kekuningan dengan yield 86,1 % dan titik lebur 38oC. Katalis dapat
diperoleh kembali berupa padatan coklat.
Gambar 4.1. Reaksi Esterifikasi Asam Stearat dengan Metanol
produk esterifikasi jelas terlihat bahwa produk esterifikasi ini sudah cukup baik,
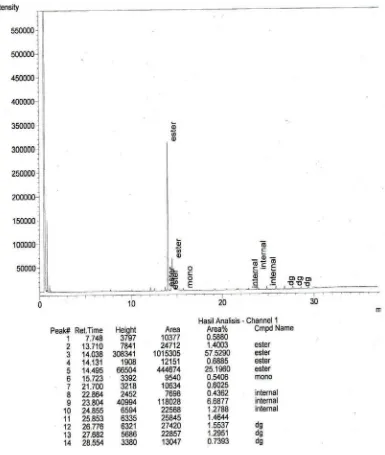
[image:37.595.122.507.139.594.2]namun ada sedikit pengotoran. Kandungan ester metil stearat hanya 84,81 %.
Gambar 4.2. Spektrum Kromatografi Gas Metil Stearat
Spektrum FT-IR (KBr pellet) dari metil stearat yang diperoleh ditunjukkan
pada Gambar 4.3. Pita serapan pada bilangan gelombang 2916 cm-1 dan 2855 cm-1
diberikan oleh
υ
C-H alifatik, dan pita serapan pada bilangan gelombang 1743,65cm-1 menunjukkan regangan
υ
C=O. Pita serapan ini bergeser sebesar 47 cm-1 daricm-1 yang merupakan karakteristik dari suatu ester (Silverstein, 1981). Data
[image:38.595.111.511.149.467.2]tersebut diatas jelas menunjukkan bahwa ester telah terbentuk.
Gambar 4.3. Spektrum FT-IR Metil Stearat
4.2. Esterifikasi Asam Stearat dengan 2-propanol
Reaksi esterifikasi antara asam stearat dengan 2-propanol menggunakan katalis
1,2-dimetil-1,1,2,2-tetrafenildisilana sulfonat menghasilkan isopropil stearat.
Reaksi esterifikasi dilakukan pada suhu 100oC dan pemakaian 2-propanol berlebih
sekaligus sebagai pelarut, diperoleh cairan kental berwarna kuning dengan yield
C17H35-C
O
OH
C17H35-C
O
OCH
H2O
1,2-dimetil-1,1,2,2-tetrafenildisilana sulfonat
T= 100oC
HC OH
CH3
CH3
CH3
[image:39.595.115.509.95.158.2]CH3
Gambar 4.4. Reaksi Esterifikasi Asam Stearat dengan 2-propanol
Asam stearat yang digunakan dalam reaksi ini juga memiliki kemurnian 93
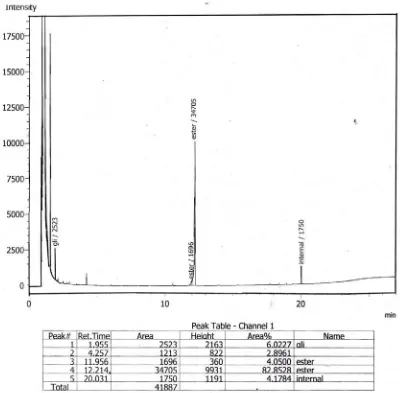
%. Dari kromatogram produk esterifikasi (Gambar 4.5) jelas terlihat bahwa
produk esterifikasi ini sudah cukup murni, namun ada sedikit pengotoran.
Kandungan ester isopropil stearat berdasarkan data kromatogram diatas hanya
86,9 %.
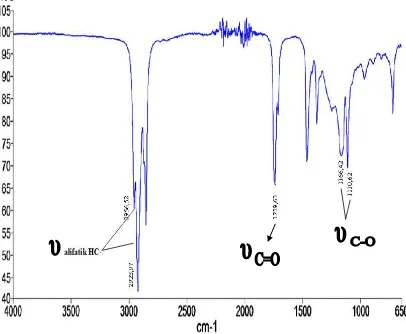
[image:39.595.112.512.322.715.2]Spektrum FT-IR dari isopropil stearat yang diperoleh ditunjukkan pada
Gambar 4.6. Pita serapan pada bilangan gelombang 2957 cm-1 dan 2924 cm-1
diberikan oleh regangan
υ
C-H alifatik, dan pita serapan pada bilangan gelombang1740 cm-1 menunjukkan
υ
C=O. Pita serapan ini bergeser sebesar 43 cm-1 dariυ
C=Opada asam stearat (Lampiran 1). Disamping itu tampak juga
υ
C-O pada bilangangelombang 1166 cm-1 yang merupakan karakteristik dari suatu ester (Silverstein,
1981). Dari data tersebut diatas jelas menunjukkan bahwa ester telah terbentuk.
Gambar 4.6. Spektrum FT-IR Isopropil Stearat
Spektrum 1H-NMR zat hasil esterifikasi asam stearat dengan 2-propanol
(500 MHz, CDCl3) (Gambar 4.7) menunjukkan beberapa pergeseran kimia yaitu δ
5,0 ppm (7H, m,-CH-), δ 2,24 ppm (2H, t, -CH2-), δ 1,6 ppm (2H, m, -CH2-), δ1,
C
A
G
B F E D
[image:41.595.116.514.99.412.2]* = pengotoran
Gambar 4.7. Spektrum 1H-NMR Isopropil Stearat
Pada spektrum ekspansi pergeseran kimia δ 0,8-1,6 ppm (Gambar 4.8),
terlihat adanya pergeseran kimia pada δ 0,87 ppm (t) yang menunjukkan integrasi
3 atom H menandakan proton CH3- (A). Pergeseran kimia pada δ 1,21 ppm (d)
menunjukkan integrasi 3 atom H yang menandakan proton –CH3 (G). Pergeseran
kimia pada δ 1,24 ppm (m) menunjukkan integrasi 26 atom H yang menandakan
proton –CH2- (C). Pergeseran kimia pada δ 1,27 ppm (m) menunjukkan integrasi
2 atom H yang menandakan proton –CH2- (B).Pergeseran kimia pada δ 1,6 ppm
(m) menunjukkan integrasi 2 atom H yang menandakan proton –CH2- (D). Pada
spektrum ekspansi pergeseran kimia δ 2,0 – 2,4 ppm (Gambar 4.9), terlihat
adanya pergeseran kimia pada δ 2,24 ppm (t) yang menunjukkan integrasi 2 atom H menandakan proton –CH2- (E). Pada spkctrum ekspansi pergeseran kimia δ 5,0
– 5,4 ppm (Gambar 4.10), terlihat adanya pergeseran kimia pada δ 5.0 ppm (m)
C
A
G
B
[image:42.595.115.512.87.373.2]D
Gambar 4.8. Spektrum Ekspansi 1H-NMR Pergeseran Kimia δ 0,8 – 1,6 ppm
*
E
*
[image:42.595.113.510.430.714.2]*
*
F
[image:43.595.115.513.99.409.2]* = pengotoran
Gambar 4.10. Spektrum Ekspansi 1H-NMR Pergeseran Kimia δ 5,0 – 5,4 ppm
Dari data spektrum 1H-NMR diatas dan juga didukung oleh data
pergeseran kimia 1H-NMR Isopropil stearat pada penelitian Satapimonphan
BAB 5
KESIMPULAN DAN SARAN
5.1. Kesimpulan
Reaksi esterifikasi antara asam stearat dengan metanol dan 2-propanol
menggunakan katalis 1,2-dimetil-1,1,2,2-tetrafenildisilana sulfonat menghasilkan
metil stearat dan isopropil stearat dengan yield masing-masing sebesar 86,1 % dan
67,5 %. Reaksi esterifikasi dilakukan pada suhu 100oC selama 10 jam dengan
rasio mol asam stearat : alkohol = 1 : 6 dan jumlah katalis 4 %. Katalis
1,2-dimetil-1,1,2,2-tetrafenildisilana sulfonat terbukti mampu mengkatalisis reaksi
esterifikasi dan dapat dipisahkan dari campuran hasil reaksi sehingga katalis
1,2-dimetil-1,1,2,2-tetrafenildisilana sulfonat sangat potensial untuk digunakan dalam
reaksi esterifikasi.
5.2. Saran
Reaksi esterifikasi dalam penelitian ini masih dilakukan pada sembarang kondisi,
sehingga hasil ester yang diperoleh masih belum optimal. Oleh karena itu
diharapkan kepada peneliti selanjutnya untuk melakukan studi lanjutan agar
diperoleh hasil ester yang optimum dengan menggunakan katalis
DAFTAR PUSTAKA
Basumatary, S. 2013. Transesterification with Heterogenous Catalyst in Production of Biodiesel : A Review. Journal of Chemical and Pharmaceutical Research. 5(1):1-7.
Beef facts. 2007. Stearic Acid : A Unique Saturated Fat. USA. National Cattlemen’s Beef Association.
Blandy, C., Gervais, D., Pellegatta, J.L., Gilot, B., Guiraud, R. 1991. Stearic Acid Esterification Catalysed by Titanates : Comparative Study of Homogeneous and Heterogeneous Systems. Journal of Molecular Catalysis. 64 (1991) L1-L6.
Bondioli, P. 2003. From Oilseeds to Industrial Products : Present and Near Future of Oleochemistry. Journal of Agronomy. 7,2, 129-135.
Castanheiro, J.E., Caetano, C.S., Caiado, M., Farinha, J., Fonseca, I.M., Ramos, A.M., Vital, J. 2013. Esterification of Free Fatty Acids Over Chitosan with Sulfonic Acid Groups. Chemical Engineering Journal. 230 (2013) 567-572.
Chow, C.K. 2008. Fatty Acids in Foods and Their Implications. 3rd Ed. Boca Raton. CRC Press.
Christie, W. 1993. Preparation of Ester Derivatives of Fatty Acids for Chromatographic Analysis. Advances in Lipid Methodology-Two. 69-111. Clark, J.H. 2002. Solid Acids for Green Chemistry. Accounts of Chemical
Research. 35, 791-797.
Cotton, F.A. 1976. Basic Inorganic Chemistry. New York. John Wiley & Sons.
Eliasson, B., Oberg, K., Persson, P., Shchukarev, A. 2001. Comparison of Monolayer Films of Stearic Acid and Methyl Stearate on An Al2O3
Surface. Thin Solid Films. 397 (2001) 102-108.
Emrani, J. and Shahbazi, A. 2012. A Single Bio-based Catalyst for Bio-fuel and Bio-diesel. Journal of Biotechnology Biomaterial. Volume 2, Issue 1, 1000124.
Feldman, D., Banu, D., Hawes, D. 1993. Low Chain Esters of Stearic Acid As Phase Change Materials for Thermal Energy Storage in Buildings. Solar Energy Materials and Solar Cells. 36 (1995) 311-322.
Fereidoon, S. 2004. Bailey’s Industrial Oil And Fat Products. USA. John Wiley & Sons, Inc.
Fessenden, J. 1986. Kimia Organik. Edisi 3. Jilid 2. Jakarta. Erlangga.
Gates, B. 1991. Catalytic Chemistry. USA. John Wiley & Sons.
Guan, G., K. Kusakabe, N. Sakurai, dan K. Moriyama. 2009. Transesterification of Vegetable Oil to Biodiesel Fuel Using Acid Catalyst in the Presence of Dimethyl Ether. Fuel. Volume 88, Issue 1, 81-86.
Gunstone, F.D. 2004. The Chemistry of Oils and Fats. Australia. Blackwell Publishing Company Ltd.
Hoydonckx, H.E., De Vos, D.E., Charan, S.A., Jacobs, P.A. 2004. Esterification & Transesterification of Renewable Chemicals. Topics in Catalyst. 27, 83-96.
International Journal of Toxicology. 1985. Vol. 4. No. 5, 107-146.
Ketaren, S. 1986. Pengantar Teknologi Minyak Dan Lemak Pangan. Jakarta. UI-Press.
Kirk, R.E. and D.F. Othmer. 1980. Encyclopedia of Chemical Technology. New York. Wiley & Sons, Inc. 9,291-298.
Kiros, Y., Endalew, A.K., Zanzi, R. 2001. Inorganic Heterogenous Catalyst for Biodiesel Production from Vegetable Oils. Stockholm. KTH-Royal Institute of Technology.
Kiss, A., Dimian, A., Rothenberg, G. 2006. Solid Acid Catalyst for Biodiesel Production-Towards Sustainable Energy. Weinheim. Wiley-VCH Verlag GmbH & Co. KGaA.
Manullang, W. F. 2014. 1,2-dimetil-1,1,2,2-tetrafenildisilana Sulfonat Sebagai Katalis Transesterifikasi CPO (Crude Palm Oil) Berkadar Asam Lemak Bebas Tinggi untuk Menghasilkan Biodiesel. [Skripsi]. Medan : Universitas Sumatera Utara.
Matlack, A.S. 2001. Introduction To Green Chemistry. USA: Marcel Dekker, Inc.
Morales, G., van Grieken, R., Martin, A., Martinez, F. 2010. Sulfonated Polystyrene-modified Mseoporous Organosilicas for Acid-Catalyzed Process. Chemical Engineering Journal. 161 (2010) 388-396.
Moya-Leon, A., Viales-Montero, C., Arias-Carrillo, M., Mata-Segreda, J. 2006. Kinetics of the Fischer Esterification of Palm Fatty Acids with Isopropanol and Butyl Cellosolve. Ciencia Y Tecnologia. 24 (2) : 175-181.
Okamura, M., Takagaki, A., Toda, M., Kondo, J.N., Domen, K., Tatsumi, T., Hara, M., Hayashi, S. 2006. Acid-Catalyzed Reactions on Flexible Polycyclic Aromatic Carbon in Amorphous Carbon. Chemistry of Materials. 19, 3039-3045.
Otera, J. 2003. Esterification : Methods, Reaction and Applications. Weinheim. Wiley-VCH Verlag GmbH & Co. KgaA.
Peng, W., Lu, C., Kun, Z., Lin, F. 2013. Carbon-coated Mesoporous Silica Functionalized with Sulfonic Acid Groups and Its Application to Acetalization. Chinese Journal of Catalysis. 34 (2013) 932-941.
Pizzoli, M., Pezzin, G., Ceccorulli, G., Scandola, M., Crose, G. 1982. Aliphatic Stearates of Increasing Chain Length : Characterization and Solubility in Polyvinylchloride. Solvent-Property Relationships in Polymers. 70-83. Rachmaniah, O. 1999. Studi Kinetika Transesterifikasi Dengan Katalis Asam
(HCl) Minyak Mentah Dedak Padi Menjadi Biodiesel. Surabaya. Institut Teknologi Sepuluh November.
Rajendran, A. dan Karthikeyan, C. 2011. Silica Sulfuric Acid Catalyzed Fischer Esterification Reaction under Solventless Condition : A Novel Green Chemical Reaction. American Chemical Science Journal. 1(1) : 28-36. Roesyadi, A., Hariprajitno, D., Nurjannah, N., Savitri, S.D. 2012. HZSM-5
Catalyst For Cracking Palm Oil To Gasoline: A Comparative Study With And Without Impregnation. Semarang. Bulletin of Chemical Reaction Engineering & Catalysis UNDIP.
Romero, M., Gomez, J., Diaz-Suelto, B., Garcia-Sanz, A. 2011. Study of the Influence of Alcohols in the Synthesis of Short Chain Esters. Chemical Engineering Transactions. Volume 24.
Satapimonphan, S. & Pengprecha, S. 2012. Improving Cold Flow Property of Biodiesel from White Sesame Seed Oil. International Conference on Chemical Processes and Environmental Issues (ICCEEI’2012).
Sheldon, R., Arends, I., Hanefeld, U. 2007. Green Chemistry And Catalysis. Germany. WILEY-VCH Verlag GmbH & Co. KgaA.
Shriver, D. & Atkins, P. 1999. Inorganic Chemistry. Third Edition. New York. Oxford University Press.
Sidabutar, A., 2011. Penggunaan Polistirena Sulfonat Sebagai Katalis Transesterifikasi Minyak Jarak Pagar (Jatropha curcas) Berkadar Asam Lemak Tinggi. [Skripsi]. Medan : Universitas Sumatera Utara.
Silverstein, R.M. , Bassler, G.C., Morrill, T.C. 1981. Spectrometric Identification of Organic Compound. 4th Edition. New York. John Wiley & Sons.
Stoker, H.S. 1991. Fundamentals of Chemistry : General, Organic, and Biological. USA. Allyn and Bacon.
Tambun, R. 2002. Proses Pembuatan Asam Lemak Secara Langsung Dari Buah Kelapa Sawit. Medan. USU Digital Library.
Voort, P., Muylaert, I., Verbeckmoes, A., Spileers, J., Demuynck, A., Peng, Li, Clippel, F., Sels, B. 2013. Synthesis of Sulfonated Mesoporous Phenolic Resins and Their Application in Esterification and Asymmetric Aldol Reactions. Material Chemistry and Physics. 138 (2013) 131-139.
Wang, Z., Wang, Z., Bai, Y., Fu, B., Liu, H., Song, A., Zhang, Z., Zhang, M. 2012. Sulfonated Polyethersulfone Directly Sinthesized Through Sulfonic Monomer As A New Stable Solid Acid Catalyst for Esterification. Catalyst Communications. 27 (2012) 164-168.