PECTINASE PRODUCTION BY
Aspergillus ustus
AT SOLID
STATE FERMENTATION MEDIUM USING AGRICULTURE
WASTE AS SUBSTRATE
Yufi Sara Anggraini1, Darwin Kadarisman1, and Nanik Rahmani2
1Department of Food Science and Technology, Faculty of Agricultural Technology, Bogor
Agricultural University, IPB Darmaga Campus, PO Box 220, Bogor,West Java, Indonesia
Phone: +62 856 91666832, e-mail: yufiseba@gmail.com
2
Biocatalyst and Fermentation Laboratory, Research Center for Biotechnology, Indonesian Institute of Sciences, Cibinong, West Java, Indonesia
ABSTRACT
Many types of enzyme are used in food manufacturing process, and pectinase is one of enzyme that is frequently used by many food industries. Pectinase can be fabricated by microorganism through fermentation process using pectin-containing-medium to boost metabolite production. The objective of this research is to determine the substrate from several agricultural wastes and to define the optimum condition of fermentation for pectinase production using Aspergillus ustus (involving substrate concentration, acidity of medium, and temperature of fermentation). There are four steps in this research including substrate preparation, analysis for substrate (pectin measurement and proximate analysis), pectinase production, and trial for optimum fermentating condition. The result shows that difference in fermentating condition will affect the activity of pectinase. The highest pectinase activity is 1.2751 U/mL and it originated from peel of Medanese tangerine. Optimum condition for pectinase production was using peel of Medanese tangerine as substrate in 10% concentration, pH 4, at temperature of 40oC.
Yufi Sara Anggraini. F24080031. Produksi Enzim Pektinase oleh Aspergillus ustus pada Media Fermentasi Semi Padat Menggunakan Limbah Pertanian Sebagai Substrat. Di bawah bimbingan Darwin Kadarisman dan Nanik Rahmani. 2012.
RINGKASAN
Enzim merupakan protein. Enzim biasa disebut sebagai biokatalisator karena dihasilkan dari jaringan hidup dan memiliki fungsi untuk meningkatkan laju reaksi yang terjadi di dalam jaringan. Enzim mampu mengatalisis reaksi-reaksi biologis penting sehingga reaksi menjadi lebih efisien karena berjalan jauh lebih cepat jika dibandingkan dengan reaksi tanpa enzim. Aplikasi enzim meliputi berbagai bidang, salah satunya industri pangan. Salah satu jenis enzim yang banyak digunakan di industri pangan adalah pektinase yang menyumbang total perdagangan enzim pangan dunia sebesar 25%. Sesuai dengan namanya, pektinase merupakan enzim yang bekerja khusus pada substrat pektin.
Penelitian ini dilakukan dengan tujuan untuk mengetahui substrat terbaik dan kondisi optimum fermentasi untuk produksi enzim pektinase oleh Aspergillus ustus menggunakan media fermentasi semi padat. Substrat yang digunakan untuk produksi enzim pektinase berupa tepung berukuran 500 mesh yang berasal dari kulit jeruk Siam, kulit jeruk Medan, kulit durian, dan daun teh tua yang dikeringkan. Pengujian kondisi optimum produksi enzim pektinase dilakukan terhadap tiga parameter, yaitu konsentrasi substrat, pH media, dan suhu fermentasi.
Analisis awal dilakukan terhadap substrat yaitu analisis kadar pektin dan kadar proksimat. Analisis kadar pektin dilakukan dengan menggunakan metode refluks. Analisis proksimat yang dilakukan meliputi pengukuran kadar air, kadar abu, kadar protein, kadar lemak, karbohidrat, dan kadar serat kasar.
Substrat kulit jeruk Medan memiliki kadar pektin tertinggi dibanding tiga substrat lainnya, yaitu sebesar 41.08%. Hasil produksi enzim pektinase menggunakan keempat substrat dari limbah pertanian menunjukkan bahwa kulit jeruk Medan merupakan substrat terbaik untuk produksi enzim pektinase dengan aktivitas enzim yang dihasilkan adalah sebesar 1.2751 U/mL. Hasil ini merupakan aktivitas enzim pektinase tertinggi dibandingkan dengan aktivitas enzim yang dihasilkan pada substrat kulit jeruk Siam, kulit durian, dan daun teh tua (masing-masing aktivitasnya sebesar 1.2223, 0.8906, dan 0.3065 U/mL).
Pengujian kondisi optimum produksi enzim pektinase bertujuan untuk mengetahui kondisi pada saat produksi enzim yang optimum untuk menghasilkan aktivitas enzim yang tinggi. Parameter uji untuk kondisi optimum yang dilakukan pada penelitian ini adalah konsentrasi substrat (5, 10, 15, 20, dan 25%), pH media (4, 5, 6, 7, 8), dan suhu fermentasi (30, 40, 50o C).
Pada penelitian ini, peningkatan konsentrasi substrat di atas 10% ternyata menghasilkan nilai aktivitas enzim pektinase yang lebih kecil dari aktivitas enzim yang dihasilkan pada konsentrasi substrat 10%.
I.
PENDAHULUAN
1.1 LATAR BELAKANG
Indonesia memiliki kekayaan alam yang berlimpah, mulai dari hasil-hasil pertanian, pertambangan, perairan, hingga pemandangan alamnya yang sangat indah. Kebutuhan pokok masyarakat Indonesia disokong oleh produk-produk pertaniannya, yaitu padi, sayur-sayuran, dan buah-buahan. Produk pertanian selain memberi manfaat untuk dikonsumsi juga menghasilkan limbah dalam jumlah yang cukup besar yang dapat menimbulkan masalah.
Penelitian mengenai pemanfaatan limbah dari produk pertanian sudah banyak dilakukan, salah satunya yaitu penggunaan limbah dari produk pertanian sebagai media pertumbuhan mikroorganisme. Hal ini dikarenakan ternyata pada limbah dari produk pertanian masih terdapat komponen atau zat-zat yang memungkinkan digunakan sebagai nutrisi bagi mikroorganisme. Manfaat yang didapat dari hal ini, diantaranya : (1) mengurangi dampak buruk limbah bagi kehidupan manusia, (2) meningkatkan nilai tambah limbah karena tidak hanya terbuang sia-sia begitu saja, dan (3) memungkinkan dihasilkannya produk lain yang dapat diaplikasikan lebih luas pada berbagai aspek kehidupan manusia. Salah satu contoh produk yang dapat dihasilkan dari limbah pertanian ini adalah enzim.
Enzim merupakan protein. Enzim biasa disebut sebagai biokatalisator karena dihasilkan dari jaringan hidup dan memiliki fungsi untuk meningkatkan laju reaksi yang terjadi di dalam jaringan (Montgomery et al. 1993). Enzim mampu mengatalisis reaksi-reaksi biologis penting sehingga reaksi menjadi lebih efisien karena berjalan jauh lebih cepat jika dibandingkan dengan reaksi tanpa enzim.
Seiring dengan perkembangan zaman dan ilmu pengetahuan, eksistensi enzim semakin mendapat perhatian, hal ini terbukti dari banyaknya kajian dan penelitian yang dilakukan berkaitan dengan enzim serta nilai ekonomis perdagangan enzim yang meningkat setiap tahunnya. Nilai ekonomis perdagangan enzim dunia pada tahun 2009 mencapai 3.1 miliar dollar AS, kemudian meningkat di tahun 2010 menjadi 3.6 miliar dollar AS, dan tahun 2011 sebesar 3.9 miliar dollar AS (BCC Research 2012). Peningkatan nilai ekonomis perdagangan enzim dunia diprediksi akan terus terjadi sehingga pada tahun 2015 diperkirakan nilai ekonomis perdagangan enzim dunia mencapai 7.6 – 8.0 miliar dollar AS (Freedonia Group Inc. 2011).
Enzim-enzim yang digunakan dalam industri pangan sangat banyak dan beragam jenisnya. Tujuan penggunaan enzim pada industri pangan adalah untuk mengefisiensikan proses produksi dan meningkatkan mutu atau kualitas produk akhir terutama dari segi organoleptik. Proses produksi yang efisien dapat secara signifikan mengurangi ongkos produksi dan kualitas produk pangan akhir menentukan apakah produk tersebut dapat diterima atau tidak oleh konsumen.
Salah satu jenis enzim yang banyak digunakan di industri pangan adalah pektinase yang menyumbang total perdagangan enzim pangan dunia sebesar 25% (Namasivayam et al. 2011). Sesuai dengan namanya, pektinase merupakan enzim yang bekerja khusus pada substrat pektin. Pada beberapa produk pangan, kecenderungan pektin menjadi gel sangat diharapkan misalnya pada produk jam dan jelly, namun pada produk jus dan konsentrat jus keberadaan komponen gel tersebut dapat menjadi masalah untuk menghasilkan produk jus yang jernih. Pektinase digunakan pada proses depektinasi sehingga produk akhir yang dihasilkan merupakan produk jus atau konsentrat jus yang jernih dan umumnya lebih disukai konsumen. Selain digunakan pada industri jus buah, pektinase juga digunakan pada industri wine untuk penjernihan; ekstraksi minyak, flavour, dan pigmen dari tanaman; pengolahan serat selulosa untuk pembuatan linen, goni (jute), dan tali rami (hemp); sebagai salah satu bahan pada produksi oligogalakturonida sebagai komponen pangan fungsional, dan membantu proses fermentasi teh dan kopi (Phutela et al. 2005).
Enzim pektinase dapat diproduksi dari mikroorganisme, terutama dari jenis kapang-kapangan seperti Aspergillus sp. Penelitian yang dilakukan untuk memproduksi enzim pektinase oleh Aspergillus sp. sudah banyak dilakukan, salah satunya produksi enzim pektinase oleh Aspergillus ustus pada media fermentasi cair (submerged fermentation) (Andriani et al. 2011). Selain menggunakan media fermentasi cair, terdapat metode fermentasi lainnya untuk produksi enzim, yaitu fermentasi pada media semi padat (solid-state fermentation). Metode ini diketahui memiliki kelebihan dibandingkan submerged fermentation, salah satunya yaitu menghasilkan rendemen (metabolit) dalam jumlah yang lebih banyak.
Limbah pertanian yang berjumlah sangat banyak dan belum dimanfaatkan dengan maksimal memiliki potensi digunakan sebagai media fermentasi semi padat untuk produksi enzim pektinase. Dengan demikian, penelitian ini diharapkan menjadi salah satu solusi untuk mengatasi permasalahan limbah pertanian yang belum teratasi dengan baik dan menghasilkan produk enzim yang dapat dimanfaatkan pada berbagai aspek kehidupan, terutama untuk industri pangan.
1.2 TUJUAN PENELITIAN
II.
TINJAUAN PUSAKA
2.1
ENZIM
Enzim merupakan protein. Enzim biasa disebut sebagai biokatalisator karena dihasilkan dari jaringan hidup dan memiliki fungsi untuk meningkatkan laju reaksi yang terjadi di dalam jaringan (Montgomery et al. 1993). Sebagai biokatalisator dalam meningkatkan laju reaksi, enzim dapat mempercepat laju reaksi kimiawi hingga 1010-1020 kali lebih cepat dibandingkan reaksi kimiawi tanpa menggunakan enzim (Muchtadi et al. 1990).
2.1.1 Sumber Produksi Enzim
Enzim dapat diproduksi melalui tiga sumber utama, yaitu hewan, tanaman, dan mikroorganisme. Sumber dan jenis enzim yang diproduksi dapat dilihat pada Tabel 1.
Tabel 1. Sumber utama produksi enzim era pra-1960
Sumber Enzim Mikroorganisme
Kamir :
Saccharomyses cerevisiae Invertase
Saccharomyces fragilis Lactase
Bakteri : Bacillus subtilis
Micrococcus lysodeikticus
Amilase, protease Katalase
Kapang :
Aspergillus flavus Amilase
Aspergillus niger Glukosidase, katalase, selulase, lipase, pektinase
Aspergillus oryzae Protease
Aspergillus notatum Glukosa oksidase
Tanaman
Jelai / gandum (Hordeum vulgare) Amilase (diastase)
Pepaya (Carica papaya) Protease (papain)
Pineapple (Ananas commosus) Protease (bromelin) Hewan
Pankreas sapi (Bos sp.) Trypsin, erepsin, amilase Ekstrak lambung babi dan sapi ternak (Sus
scrofa dan Bos sp.)
Pepsin, lipase
Mikroorganisme untuk produksi enzim dikembangkan lebih luas karena memiliki kelebihan dibandingkan sumber lainnya. Kelebihan mikroorganisme sebagai sumber produksi enzim diantaranya : (1) scaling up produksi enzimnya tidak membutuhkan ruang yang besar, (2) sel-sel mikroorganisme lebih mudah diternakkan dalam lingkungan yang telah terkontrol, (3) waktu pengembangbiakan sel mikroorganisme relatif lebih singkat sehingga produksi enzim lebih cepat (Suhartono 2000).
2.1.1.1
Aspergillus ustus
Salah satu jenis mikroorganisme yang dapat menghasilkan enzim adalah Aspergillus ustus. Aspergillus ustus merupakan spesies yang bervariasi (Houbraken et al., 2007) berupa kapang berfilamen yang sangat umum ditemukan pada makanan, tanah, dan udara (Samson et al., 2004). Aspergillus ustus memiliki penampakkan warna koloni yang bervariasi mulai dari cokelat lumpur hingga abu-abu. National Center for Biotechnology Information (NCBI) (2012) menggolongkan Aspergillus ustus sebagai berikut :
Domain : Eukarya
Kingdom : Fungi
Filum : Ascomycota Kelas : Eurotiomycetes Ordo : Eurotiales Famili : Trichocomaceae Genus : Aspergillus Species : Aspergillus ustus
Menurut Machida dan Gomi (2012), Aspergillus ustus termasuk ke dalam bagian Usti bersama enam spesies lainnya (A. puniceus, A. granolosus, A. keveii, A. pseudodeflectus, A. calidoustus, A. insuetus). Pada agar ekstrak malt, koloni Aspergillus ustus terlihat semi padat, seperti kapas (cottony), berwarna abu-abu kecokelatan, terdapat warna putih di pinggir koloni, dengan pigmen warna kuning yang menyebar (Paterson 2004). Gambar 1. memperlihatkan penampakkan koloni, konidiofor, dan konidia Aspergillus ustus.
Gambar 1. (a) koloni Aspergillus ustus; (b) konidiofor Aspergillus ustus; (c) konida Aspergillus ustus (Paterson 2004)
Paterson (2004) menambahkan, secara mikroskopis penampakkan Aspergillus ustus terlihat halus, berwarna cokelat, konidiofor berdinding tebal (panjang 250 µm dan lebar 50 µm), konidianya seperti globula (bulat) berdiameter 4-5 µm dengan dinding yang terlihat kasar berwarna cokelat.
Penelitian Andriani et al. (2011) menunjukkan bahwa Aspergillus ustus memiliki potensi menghasilkan enzim pektinase. Pada screening aktivitas pektinolitik, isolat Aspergillus ustus pada media yang mengandung pektin menunjukkan zona bening (clear zone). Hal ini berarti selama masa pertumbuhan Aspergillus ustus, terjadi degradasi komponen pektin pada media pertumbuhannya. Selain screening aktivitas pektinolitik, fermentasi pada media cair (submerged fermentation) juga membuktikan bahwa Aspergillus ustus mampu menghasilkan enzim pektinase dengan aktivitas sebesar 1.32 U/mL.
2.1.2 Metode Produksi Enzim oleh Mikroorganisme
Terdapat dua metode yang sering digunakan untuk memproduksi enzim yang bersumber dari mikroorganisme, yaitu metode fermentasi cair(submerged fermentation) dan fermentasi semi padat (solid-state fermentation). Fermentasi cair (submerged fermentation) adalah proses fermentasi yang substratnya larut atau tersuspensi dalam fase cair. Sebaliknya, fermentasi semi padat adalah proses fermentasi yang substratnya tidak larut, serta sedikit atau tidak mengandung air bebas (Sabu et al. 2006). Menurut Rashid et al. (2011), produksi enzim dengan fermentasi semi padat dilakukan untuk memanfaatkan biomassa yang jumlahnya banyak untuk menghasilkan produk terutama enzim dengan lebih efisien. Fermentasi semi padat (solid-state fermentation) merupakan suatu metode biakan alternatif yang telah banyak digunakan untuk memproduksi produk-produk industri seperti enzim, pigmen, antibiotik, dan lain-lain (Praveen dan Savitha 2012). Metode fermentasi semi padat memiliki beberapa kelebihan dibandingkan dengan metode fermentasi cair, diantaranya : (1) kontrol prosesnya lebih baik, (2) substrat yang dimanfaatkan lebih banyak, (3) kemungkinan terjadinya kontaminasi lebih rendah, (4) pengolahan hilirnya lebih mudah (Praveen dan Savitha 2012), (5) rendemen metabolit sekunder atau enzim lebih banyak (Gonzales 2012).
2.1.3 Aplikasi Enzim
2.2
PEKTIN
2.2.1 Pengertian dan Struktur Pektin
Pektin merupakan kompleks heteropolisakarida yang terkandung dalam dinding sel primer dan lamela tengah tanaman tingkat tinggi (Heerd et al. 2012). Komponen utama penyusun pektin adalah asam galakturonat yang merupakan turunan dari galaktosa (Willats et al. 2001). Secara strukural, pektin digambarkan melalui dua daerah, yaitu daerah “halus (smooth)” dan daerah “berambut (hairy)”. Daerah halus merupakan daerah yang dibentuk oleh homogalacturonans (HGs), sedangkan daerah berbulu merupakan daerah yang dibentuk oleh rhamnogalacturonans tipe I (RGs-I) (Koubala et al. 2012). Pektin tersusun atas asam D-galakturonat yang dihubungkan dengan ikatan α-(1,4)-glukosida. Gambar struktur kimia pektin dapat dilihat pada Gambar 2.
Gambar 2. Struktur Pektin (Chayati dan Andian 2009)
Secara umum, senyawa pektin dikelompokkan menjadi tiga senyawa, yaitu substansi pektat, asam pektinat, dan protopektin. Nussinovitch et al. (1997) menjelaskan definisi ketiga kelompok dari senyawa pektin tersebut seperti penjelasan di bawah ini:
2. Asam pektinat adalah istilah yang digunakan bagi asam poligalakturonat yang mengandung gugus metil ester dalam jumlah yang cukup banyak. Asam pektinat dalam keadaan yang sesuai mampu membentuk gel dengan ion-ion logam
3. Protopektin adalah zat pektat yang tidak larut dalam air dan jika dihidrolisis menghasilkan asam pektinat atau pektin.
2.2.2 Aplikasi Pektin
Pektin telah banyak digunakan, baik pada industri pangan, maupun non-pangan. Penggunaan pektin pada industri pangan diantaranya sebagai bahan pembentuk gel dan penstabil pada sari buah, jelly, jam, dan marmalade, selain itu pektin juga berperan sebagai penstabil pada minuman susu asam dan yoghurt (Willats et al. 2006). Pada bidang farmasi, pektin berguna sebagai obat diare, menurunkan tingkat kolestrol darah, anemia, dan juga digunakan sebagai bahan kapsul obat-obatan (Christensen dan Towle 1973).
2.2.3 Ekstraksi Pektin
Ekstraksi pektin bertujuan untuk mengeluarkan pektin dari jaringan dengan cara memanaskan bahan dalam larutan asam encer yang panas. Hal ini mengakibatkan terlarutnya substansi pektat dan asam pektinat (pektin) serta protopektin yang tidak larut akan terhidrolisis menjadi pektin yang larut (Widodo et al. 2012).
Terdapat tiga tahap utama dalam melakukan ekstraksi pektin, yaitu ekstraksi, pengendapan, dan pengeringan pektin. Secara umum, ekstraksi dilakukan dengan menggunakan asam sebagai pelarut, baik asam mineral, maupun asam organik.
Tahap ekstraksi dimulai dengan memanaskan bahan bersama dengan pelarutnya pada suhu dan waktu (lama ekstraksi) tertentu. Menurut Christensen dan Towle (1973), ekstraksi pektin dari sayur-sayuran sebaiknya dilakukan pada pH 1.5-3.0 dengan suhu pemanasan antara 60-100o C selama kurang dari satu jam, sedangkan ekstraksi pektin terbaik dari kulit Jeruk adalah pada suhu 95o C selama 45 menit dengan menggunakan pelarut asam klorida atau asam sulfat (Cruess 1958).
2.3
PEKTINASE
2.3.1 Pengertian dan Struktur Pektinase
Pektinase adalah nama umum dari kelompok enzim yang mengatalisis hidrolisis ikatan glikosidik pada polimer pektat (Rangarajan 2010) atau enzim yang berperan dalam degradasi substansi pektin (Heerd et al. 2012). Menurut Oyeleke (2012), pektinase merupakan enzim komersial yang dapat merusak pektin (substrat polisakarida) dengan cara memecah asam poligalakturonat menjadi asam monogalakturonat melalui pelepasan ikatan glikosidik. Pedrolli et al. (2009) menjelaskan selain mengatalisis degradasi zat pektat (pektin) melalui depolimerisasi (hidrolase dan liase), pektinase juga dapat merombak zat pektat (pektin) tersebut melalui reaksi diesterifikasi (esterase).
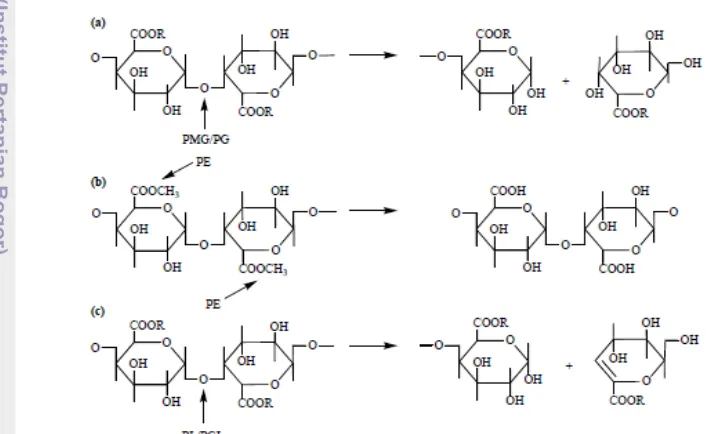
Berdasarkan titik pemotongannya, pektinase dibagi ke dalam tiga kelompok, yaitu pektin esterase, poligalakturonase, dan pektin liase (Gambar 3).
Gambar 3. Tipe pektinase berdasarkan titik pemotongannya (Pedrolli et al. 2009)
Keterangan : (a) R = H untuk Poligalakturonase (PG) dan CH3 untuk Polimetilgalakturonase
(PMG); (b) Pektinesterase (PE); (c) R = H untuk Pektat Liase (PGL) dan CH3 untuk Pektin Liase
(PL).
D-galakturonat. Pektin liase terbagi menjadi dua yaitu pektat liase dan pektin liase. Pektat liase memotong ikatan glikosidik dari asam poligalakturonat membentuk 4,5-D-galakturonat melalui reaksi transeliminasi, sedangkan pektin liase memotong ikatan glikosidik dari pektin terutama pektin teresterifikasi tinggi membentuk metil oligogalakturonat (Pedrolli et al. 2009).
2.3.2 Aplikasi Enzim Pektinase
Aplikasi enzim pektinase sangat luas, mencakup industri pangan dan non-pangan, pektinase dapat digunakan pada proses ekstraksi dan klarifikasi jus buah dan wine, ekstraksi minyak, flavour, dan pigmen dari tanaman, digunakan untuk pengolahan serat selulosa untuk pembuatan linen, goni (jute), dan tali rami (hemp), sebagai salah satu bahan yang dapat diterapkan dalam produksi oligogalakturonida sebagai komponen pangan fungsional, dan membantu proses fermentasi teh dan kopi (Phutela et al. 2005). Pektinase berguna terhadap pemecahan substansi pektin. Pemecahan substansi pektin oleh pektinase akan menurunkan viskositas sari buah yang kaya akan pektin kasar, memperpendek waktu penekanan (press-time), dan meningkatkan laju alir sari buah (juice flow) (Heerd et al. 2012), selain itu pektinase dapat juga digunakan untuk melunakkan dinding sel dan mampu meningkatkan rendemen ektrak jus dari buah sehingga enzim pektinase menjadi salah satu enzim yang penting pada industri pangan (Oyeleke 2012).
2.4 LIMBAH PERTANIAN
2.4.1 Penanganan dan Pemanfaatan Limbah Pertanian
Limbah pertanian di Indonesia sangat berlimpah. Hal ini tentu saja terjadi karena Indonesia merupakan negara tropis yang lahan pertaniannya subur, banyak ditanami berbagai jenis tanaman, dan menghasilkan produk pertanian yang jumlahnya melimpah. Contoh limbah pertanian yang jumlahnya sangat banyak dan pemanfaatannya masih minimal adalah kulit buah-buahan, kulit padi (gabah), daun teh tua, dan lain sebagainya.
Penanganan limbah pertanian bertujuan untuk mengubah bentuk limbah tersebut menjadi sesuatu yang berpotensi rendah menimbulkan bahaya, mengurangi jumlahnya, hingga pada tujuan untuk meningkatkan nilai tambah dari limbah tersebut jika dalam limbah tersebut memang memiliki potensi untuk dimanfaatkan atau digunakan. Penanganan limbah dengan konsep produksi bersih dilakukan dengan cara meminimalkan dampak negatif, memanfaatkan kembali limbah melalui praktik-praktik keterpaduan dan efisiensi pada penggunaan input bahan baku, energi, dan air, atau mendaur ulang limbah sedemikian rupa sehingga meningkatkan nilai tambah. (BPBPI 2012).
tertentu untuk menghasilkan enzim. Oleh karena itu, dengan bioteknologi diharapkan permasalahan limbah ini dapat diatasi dengan baik.
2.4.2 Jeruk Siam (
Citrus nobilis
) dan Jeruk Medan (
Citrus sinensis
L.)
Penamaan Siam pada jeruk Siam berasal dari daerah asal jeruk tersebut yaitu Siam (Muangthai, China). Penyebaran jeruk Siam di Indonesia tidak diketahui secara pasti kapan dan dimana dimulai, namun Kalimantan Barat merupakan salah satu daerah di Indonesia yang diketahui membudidayakan jeruk Siam sejak lama yaitu dimulai sekitar tahun 1940 (Tim Penulis PS 1999). Secara sistematis, Tim penulis PS (1999) dan Pracaya (1999) mengklasifikasi jeruk Siam sebagai berikut:
Filum : Spermatophyta (tanaman berbiji) Subfilum : Angiospermae (biji di dalam buah) Kelas : Dicotyledoneae
Ordo : Rutales Famili : Rutaceae Subfamili : Aurantioidae Tribe : Citriae Subtribe : Citrinae Genus : Citrus Subgenus : Eucitrus, Papeda Species : Citrus nobilis
Varietas : Citrus nobilis LOUR var. microcarpa Hassk
Jeruk Siam memiliki ciri khas yaitu kulit buahnya tipis (sekitar 2 mm), permukaannya halus, licin, mengkilap, dan menempel lekat pada daging buahnya (Gambar 4). Dasar buah jeruk Siam berleher pendek dengan puncak berlekuk, tangkai buahnya pendek dengan panjang sekitar 3 cm dan berdiameter 2.6 mm. Biji jeruk Siam berbentuk ovoid, warnanya putih kekuningan dengan ukuran sekitar 0.9 cm x 0.6 cm.
Pemanenan jeruk Siam biasanya dilakukan pada bulan Mei-Agustus dengan rata-rata satu pohon mampu menghasilkan 7.3 kg buah (Tim Penulis PS 1999). Permintaan pasar terhadap jeruk Siam cukup tinggi, terbukti dari penguasaan pasar jeruk sebesar 60% oleh jeruk Siam. Hal ini terjadi karena jeruk Siam memang memiliki kelebihan dibanding jeruk lain sehingga masyarakat lebih menyukai jeruk ini. Kelebihan jeruk Siam dibanding jeruk yang lain adalah memiliki daging buah yang lunak, rasa yang manis, dan aroma yang harum.
Jeruk Medan merupakan salah satu produk agroindustri yang berasal dari Sumatera Utara. Jeruk Medan mempunyai nama ilmiah Citrus sinesis L. Buah jeruk Medan berukuran sedang, berbentuk bulat, bulat lonjong, atau bulat rata (papak) dengan panjang garis tengah sebesar 4-12 cm. Kulit buah yang masak berwarna orange, kuning atau hijau kekuningan, berbau sedikit harum, agak halus, tidak berbulu, kusam, dan sedikit mengkilap. Tebal kulit buah jeruk Medan sebesar 0.3-0.5 cm, dari tepi berwarna kuning atau orange tua dan makin ke dalam berwarna putih kekuningan sampai putih, berdaging, dan kuat melekat pada dinding buah (Purba 2011). Gambar buah Jeruk Medan dapat dilihat pada Gambar 5.
Gambar 5. Jeruk Medan (BAPLUH-KP 2012)
Menurut data Departemen Pertanian (2012), luas panen dan produksi buah jeruk di Indonesia mengalami peningkatan yang cukup pesat yaitu masing-masing 17.9% dan 22.4% dalam kurun waktu tujuh tahun (1998- 2005). Pada tahun 2005, luas panen jeruk telah mencapai 67,883 ha dengan total produksi sebesar 2,214,019 ton, hal ini sekaligus menempatkan Indonesia sebagai negara penghasil utama jeruk dunia diperingkat ke-10. Produktivitas usaha tani jeruk cukup tinggi, yaitu berkisar 17-25 ton per ha dari potensi 25-40 ton per ha. Dari data tersebut jika diasumsikan limbah (kulit) jeruk adalah 20% dari setiap buah yang dihasilkan maka jumlah limbah (kulit) Jeruk yang dihasilkan cukup besar per tahunnya yaitu sekitar 5-8 ton per ha, hal ini tentu saja akan menimbulkan masalah jika limbah-limbah tersebut tidak ditangani.
2.4.3 Teh (
Camellia sinensis
L.)
2005). Ciri lain dari varietas sinensis adalah tumbuhnya lambat, jarak cabang dengan permukaan tanah sangat dekat, daunnya berwarna hijau muda, sedangkan verietas assamica tumbuh cepat, cabang agak jauh dari permukaan tanah, daunnya berwarna hijau mengilap, struktur batang yang lebih kokoh dan kuat (Andrianis 2012). Varietas tanaman teh yang banyak ditanam di Indonesia yaitu C. sinensis var. assamica (PPTK 2011).
Gambar 6. (a) Camellia sinensis var. sinensis (Anonim 2009); (b) Camellia sinensis var. assamica (Anonim 2011)
Perbanyakan tanaman teh adalah dengan biji, setek, sambungan atau cangkokan.Tanaman teh biasanya tumbuh berupa pohon kecil yang tampak seperti perdu akibat seringnya pemangkasan. Tanaman teh yang tidak dipangkas akan tumbuh kecil dan ramping setinggi 5 - 10 m dengan bentuk tajuk seperti kerucut.
Ciri umum tanaman teh adalah memiliki batang tegak, berkayu, bercabang-cabang, ujung ranting dan daun muda berambut halus. Ciri lainnya adalah memiliki daun tunggal, bertangkai pendek, letak berseling, helai daun kaku seperti kulit tipis, bentuknya elips memanjang, ujung dan pangkal runcing, tepi bergerigi halus, pertulangan menyirip, panjang 6 - 18 cm, lebar 2 - 6 cm, berwarna hijau, dan permukaannya mengilap. Bagian tanaman teh yang lain yaitu bunga, terletak di ketiak daun, tunggal atau beberapa bunga bergabung menjadi satu, berkelamin dua, garis tengah 3 - 4 cm, warnanya putih cerah dengan kepala sari berwarna kuning, dan berbau harum. Ciri terakhir adalah buah berbentuk kotak, berdinding tebal, buah muda berwarna hijau sedangkan buah tua berwarna cokelat kehitaman, memiliki biji yang keras sejumlah 1 - 3 biji (Anonim 2005). Tjitrosoepomo (1989) menggolongkan tanaman teh sebagai berikut :
Divisi : Spermatophyta
Familia : Camelliaceae (Theaceae) Genus : Camellia
Spesies : Camellia sinensis Varietas : assamica, sinensis
Tingkat produktivitas teh di Indonesia saat ini sebesar 1,516 kg per ha per tahun. Seperti yang diketahui, produk minuman teh hanya menggunakan pucuk tanaman teh atau daun muda untuk produksinya sehingga daun teh tua masih kurang pemanfaataannya. Dengan produktivitas tanaman teh di Indonesia yang cukup besar tersebut maka pemanfaatan daun teh tua juga perlu ditingkatkan.
2.4.4 Durian (
Durio zibethinus
Murr)
Tanaman durian berasal dari hutan Malaysia , Sumatera, dan Kalimantan yang berupa tanaman liar. Penyebaran durian ke arah Barat adalah ke Thailand, Birma, India, dan Pakistan. Buah durian sudah dikenal di Asia Tenggara sejak abad 7 M. Nama lain durian adalah Duren (Jawa, Gayo), Duriang (Manado), Dulian (Toraja), Rulen (Seram Timur) (Wijaya 2012). Plantamor (2012) menggolongkan durian sebagai berikut :
Kindom : Plantae
Subkingdom : Tracheobionta (tumbuhan berpembuluh) Super Divisi : Spermatophyta (menghasilkan biji) Divisi : Magnoliophyta (tumbuhan berbunga) Kelas : Magnoliopsida (berkeping dua/ dikotil) Sub Kelas : Dilleniidae
Ordo : Malvales Famili : Bombaceae Genus : Durio
Species : Durio zibethinus Murr
Durian merupakan tanaman pohon asli nusantara. Pusat keragaman durian yaitu di Pulau Kalimantan. Kata “Durian” mengacu pada kulit buahnya yang berduri sehingga diberi nama duri dengan akhiran-an. Di Indonesia (Gambar 7), durian pada awalnya merupakan tanaman hutan, namun karena rasanya yang disukai kemudian durian dikembangkan menjadi tanaman pekarangan, selanjutnya dikebunkan. Seiring dengan perkembangan teknologi dan budi daya pertanian, durian di Indonesia mulai dibudidayakan secara intensif sehingga kualitasnya meningkat. Hal ini menjadi penting karena Indonesia memiliki varietas durian yang sangat beragam (Sobir & Napitupulu 2012).
berwarna cokelat kemerahan. Bunga muncul di batang atau cabang yang sudah besar, bertangkai, kelopak berbentuk lonceng (campanulatus) - berwarna putih hingga cokelat keemasan, berbunga sekitar bulan Januari. Buah bulat atau lonjong, panjang 15 - 30 cm, kulit dipenuhi duri-duri tajam, warna coklat keemasan atau kuning, bentuk biji lonjong, 2 - 6 cm - berwarna cokelat, berbuah setelah berumur 5 - 12 tahun. Perbanyakannya secara generatif (biji) (Plantamor 2012).
Gambar 7. Durian (MNN 2012)
III. METODOLOGI PENELITIAN
2.4
BAHAN DAN ALAT
Bahan-bahan yang digunakan untuk preparasi media fermentasi semi padat adalah limbah pertanian berupa kulit durian, kulit jeruk Siam, kulit jeruk Medan, dan daun teh tua. Limbah pertanian yang digunakan untuk penelitian ini berasal dari beberapa sumber. Kulit durian didapat dari satu pedagang produk es durian di daerah Dramaga (Bogor), kulit jeruk Siam dan jeruk Medan didapat dari satu penjual buah di daerah Senen (Jakarta Pusat), sedangkan daun teh tua diperoleh dari satu perkebunan teh di daerah Puncak, Jawa Barat. Bahan-bahan yang digunakan untuk pembuatan media pertumbuhan dan peremajaan Aspergillus ustus adalah biakan Aspergillus ustus yang diperoleh dari koleksi Laboratorium Biokatalis dan Fermentasi, Bidang Bioproses, Pusat Penelitian Bioteknologi, LIPI Cibinong, purified agar, pektin komersial (Sigma), bahan-bahan mineral seperti (NH4)2HPO4, KH2PO4, K2HPO4, dan MGSO4.7H2O, HCl 10%, NaOH, air
destilata, dan alkohol 70%. Bahan-bahan yang digunakan untuk produksi enzim pektinase adalah substrat media fermentasi semi padat berupa tepung limbah pertanian berukuran 500 mesh, NaNO3, KCl, MGSO4.7H2O, FeSO4.7H2O, K2HPO4, yeast extract, sukrosa, buffer fosfat pH 6 (0.1
M), dan air destilata. Bahan-bahan yang digunakan untuk analisis produk adalah semua jenis substrat media fermentasi semi padat yang digunakan dalam penelitian ini, DNS (Sigma), enzim pektinase kasar (hasil produksi enzim pada penelitian ini), pektin komersial (Sigma), HCl 10% pH 2.5, NaOH 1 M, alkohol 96%, dan air destilata.
Alat-alat yang digunakan untuk preparasi media fermentasi semi padat adalah penggiling, oven, ayakan ukuran 500 mesh, dan wadah penampung dan penyimpan hasil gilingan. Alat-alat yang digunakan untuk pembuatan media pertumbuhan dan peremajaan Aspergillus ustus adalah cawan petri steril, tabung reaksi steril, rak tabung reaksi, ose steril, bunsen, laminar, dan plastik wrap. Alat-alat yang digunakan untuk produksi enzim pektinase adalah Erlenmeyer 100 mL, kapas, alumunium foil, magnetic stirrer, inkubator 30, 40, dan 50oC, dan pemanas (hot plate). Alat-alat yang digunakan untuk analisis produk adalah microtube eppendorf, pipet mikro, sentifuse, labu bulat, refluks, timer atau stopwatch, tabung reaksi, rak tabung reaksi, vortex, kuvet, spektrofotometer uv-vis (Hitachi U-3900H). Alat tambahan untuk proses sterilisasi adalah autoclave (Tomy High-Pressure steam Sterilizer ES-315).
2.5
METODE PENELITIAN
Gambar 8. Diagram alir penelitian
3.2.1 Preparasi Substrat untuk Produksi Enzim Pektinase
Preparasi substrat untuk media fermentasi meliputi dua tahap, yaitu pengumpulan limbah pertanian dan pembuatan tepung dari limbah pertanian. Limbah pertanian didapat dari beberapa sumber seperti yang sudah diinformasikan pada Bab III. Sub-bab bahan dan alat. Tahap pembuatan tepung limbah pertanian dimulai dengan mengeringkan limbah-limbah tersebut di bawah sinar matahari. Proses pengeringan dilakukan hingga limbah-limbah tersebut kering dan dapat digiling. Untuk mempercepat proses pengeringan dan memudahkan proses penggilingan, maka kulit durian, jeruk Siam, dan jeruk Medan dipotong-potong menjadi ukuran yang lebih kecil sebelum dikeringkan. Tepung hasil penggilingan sebelum digunakan untuk pembuatan media fermentasi semi padat terlebih dahulu diayak dengan penyaring berukuran 500 mesh sehingga tepung yang dihasilkan berukuran seragam.
Kondisi optimum untuk produksi
pektinase Substrat terbaik
Pengujian kondisi optimum produksi enzim pektinase : Konsentrasi substrat, pH media,
dan suhu fermentasi Pengumpulan limbah
pertanian
Pembuatan tepung limbah
Tepung limbah
Czapek’s nutrient medium + buffer fosfat 0.1 M
produksi enzim pektinase Analisis kadar
pektin dan
Proksimat Inokulasi Asperillus
3.2.2 Analisis Substrat
3.2.2.1 Pengukuran Kadar Pektin
Pengukuran kadar pektin dilakukan dengan metode refluks. Alat refluks digunakan untuk proses ekstraksi pektin dari tiap substrat. Proses ekstraksi dilakukan dengan cara mendidihkan 1 gram substrat dengan 50 mL HCl pH 2.5 kemudian direfluks selama 30 menit pada suhu 90-95oC. Hasil proses refluks tersebut disaring menggunakan kertas saring sehingga didapat filtrat kasar. Filtrat kasar kemudian dipanaskan hingga diperoleh filtrat pekat (volume filtrat pekat = ½ volume filtrat kasar). Filtrat pekat didinginkan pada suhu ruang selama kurang-lebih 15 menit setelah itu diendapkan dengan ditambahkan larutan pengendap dengan perbandingan 2:3 (fitrat : larutan pengendap). Dari proses pengendapan ini akan diperoleh endapan pektin yang akan dipisahkan dari komponen supernatannya (filtrat) menggunakan kertas saring yang telah diketahui bobotnya, endapan yang terpisah ini dinamakan pektin masam. Pektin masam selanjutnya akan dicuci sekaligus dikurangi tingkat keasamannya menggunakan alkohol 96% sebanyak 50 mL. Hasil pencucian kemudian dikeringkan menggunakan oven dengan suhu 50oC selama 24 jam. Dari proses pengeringan didapatkan pektin kering. Kadar pektin dihitung dari perbandingan bobot akhir substrat (pektin kering) dengan bobot awal substrat (tepung limbah yang diekstrak menggunakan refluks). Komposisi penyusun larutan pengendap adalah alkohol 96% dan HCl 10%, HCl 10% ditambahkan hingga alkohol memiliki pH sebesar 3-4.
3.2.2.2 Analisis Proksimat
3.2.2.2.1 Pengukuran Kadar Air (Metode Gravimetri : SNI 01-2891-1992, butir 5.1)
Cawan porselin kosong dicuci kemudian dipanaskan pada nyala bunsen hingga kering dan tidak berasap, setelah itu cawan dimasukkan ke dalam tanur listrik dan didinginkan di dalam desikator. Sampel yang akan diukur kadar airnya ditimbang sebanyak 1-2 gram (c), dimasukkan ke dalam cawan porselin kosong yang sudah didinginkan tadi dan ditimbang (a), kemudian cawan berisi sampel tersebut dikeringkan pada suhu 105o C selama 3 jam, setelah itu didinginkan di dalam desikator. Langkah-langkah tersebut dilakukan hingga bobot cawan berisi sampel yang sudah dikeringkan bernilai tetap atau tidak berubah lagi (b). Kadar air sampel dapat dihitung dengan persamaan (1.1) di bawah ini.
Kadar air % c a bc x %
(1.1)
Keterangan :
3.2.2.2.2 Pengukuran Kadar Abu (Metode Gravimetri : SNI 01-2891-1992, butir 6.1)
Cawan porselin dikeringkan dalam oven bersuhu 105oC selama 15 menit dan didinginkan dalam desikator kemudian ditimbang. Selanjutnya 2-3 gram sampel dimasukkan ke cawan porselin dan diarangkan diatas nyala pembakar. Selanjutnya dimasukkan ke dalam tanur bersuhu 550oC selama 3-4 jam atau pengabuan sempurna. Setelah pengabuan selesai, cawan didinginkan dalam desikator kemudian ditimbang. Penimbangan diulang hingga bobot sampel konstan. Kadar abu dapat dihitung menggunakan persamaan (1.2) di bawah ini.
Kadar abu % a bc %
(1.2)
Keterangan :
a : bobot cawan porselin dan sampel awal (g) b : bobot cawan porselin dan sampel akhir (g) c : bobot sampel awal (g)
3.2.2.2.3 Pengukuran Kadar Protein (Metode Semi Mikro Kjeldahl : SNI
01-2891-1992, butir 7.1)
Sampel sebanyak 0.1 gram dimasukkan dalam labu Kjeldahl dan ditambahkan 0.5 gram campuran selen (SeO2 : K2SO4 : CuSO4.5H2O = 1 : 40 : 8) kemudian dilakukan destruksi di atas
api pembakar sampai mendidih dan larutan menjadi jernih kehijau-hijauan (sekitar 2 jam), biarkan dingin. Selanjutnya pindahkan isi labu ke dalam labu takar 100 mL dan tepatkan sampai tanda tera dengan air destilata. Pipet 5 mL larutan dan masukkan ke dalam alat penyuling. Selanjutnya dilakukan penambahan 5 mL NaOH 30% dan beberapa tetes indikator PP. Kemudian dilakukan penyulingan selama ± 10 menit, sebagai penampung digunakan 10 ml larutan asam borat 2% yang telah dicampur indikator BCG-MR. Setelah itu dilakukan titrasi dengan HCl 0.01 N yang telah distandarisasi hingga berubah warna. Kadar protein dapat dihitung menggunakan persamaan (1.3).
Kadar protein %bb ml HCl sampel ml HCl blankoberat sampel x N HCl x . x x .
(1.3)
3.2.2.2.4 Pengukuran Kadar Lemak (Metode Soxhlet : SNI 01-2891-1992, butir 8.1)
Sampel sebanyak 1-2 gram dibungkus dengan kertas saring lalu dimasukkan ke labu soxhlet yang sudah ditimbang sebelumnya. Heksana dituang ke dalam labu soxhlet kemudian sampel diekstraksi selama ±6 jam. Labu soxhlet tersebut kemudian dimasukkan ke oven bersuhu 105 oC hingga seluruh sisa pelarut (heksana) menguap. Labu yang berisi lemak hasil ekstraksi didinginkan dalam desikator kemudian ditimbang. Kadar lemak dapat dihitung dengan persamaan (1.4).
Kadar lemak % a bc %
Keterangan:
a : berat labu dan sampel awal (g) b : berat labu dan sampel akhir (g) c : berat sampel awal (g)
3.2.2.2.5 Pengukuran Karbohidrat (By Different, SNI 01-2891-1992, butir 9.1)
Total karbohidrat (by difference) dapat dihitung dengan persamaan (1.5)
Kadar karbohidrat % % a b c d (1.5)
Keterangan:
a = kadar protein (%) b = kadar air (%) c = kadar abu (%) d = kadar lemak (%)
3.2.2.2.6 Pengukuran Serat Kasar (SNI 01-2891-1992, butir 11)
Sebanyak 2 gram sampel ditimbang dan diekstraksi lemaknya dengan Soxhlet. Bila bahan yang akan dianalisis mengandung lemak yang sangat kecil, maka pemisahan lemak dapat diabaikan. Sampel dipindahkan ke dalam labu ekstraksi 500 mL dengan pendingin tegak, ditambahkan 200 mL H2SO4 1.25% dan dididihkan selama 30 menit. Setelah itu, larutan disaring
dengan corong Büchner yang dihubungkan dengan vakum, dan dicuci dengan air panas. Sampel dimasukkan kembali ke dalam labu ekstraksi 500 mL dan dididihkan dengan 200 mL NaOH 1.25% selama 30 menit. Larutan disaring dengan kertas saring yang telah diketahui bobotnya (A). Endapan yang diperoleh dicuci dengan H2SO4 1.25%, air panas, dan alkohol 95%. Kertas saring
dan isinya dipindahkan ke cawan porselin yang telah diketahui bobotnya (B), dikeringkan dalam oven pada suhu 105 ºC, didinginkan, dan ditimbang sampai bobotnya tetap (C). Bila kadar serat kasar lebih besar dari 1%, maka kertas saring beserta isinya diabukan, didinginkan, dan ditimbang sampai bobotnya tetap (D) (Persamaan 1.6)
Serat kasar < 1%: Kadar serat kasar = 100%
Serat kasar > 1%: Kadar serat kasar = 100% (1.6)
3.2.3 Produksi Enzim Pektinase
3.2.3.1 Persiapan Media Fermentasi Semi Padat
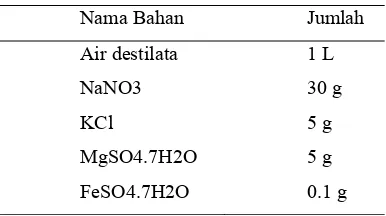
Tabel 2. Komposisi czapek’s nutrient medium
Nama Bahan Jumlah
Air destilata 1 L
NaNO3 30 g
KCl 5 g
MgSO4.7H2O 5 g
FeSO4.7H2O 0.1 g
3.2.3.2 Persiapan Isolat (Aspergillus ustus)
Persiapan isolat dilakukan dalam tiga tahap, yaitu penumbuhan, peremajaan isolat, dan pengenceran isolat. Penumbuhan isolat Aspergillus ustus bertujuan untuk mendapatkan stock isolat untuk produksi enzim pektinase, sedangkan peremajaan isolat bertujuan untuk memperoleh isolat yang segar untuk produksi enzim pektinase. Isolat Aspergillus ustus yang digunakan untuk produksi enzim pektinase adalah isolat yang berumur lima hari.
Media penumbuhan dan peremajaan Aspergillus ustus berupa media agar. Komposisi media agar terdiri dari air destilata, pektin komersial, bahan-bahan mineral ((NH4)2HPO4,
KH2PO4, K2HPO4, dan MGSO4.7H2O), dan purified agar. Pembuatan media penumbuhan dan
peremajaan isolat Aspergillus ustus dapat dilihat pada Lampiran 1.
Media agar steril yang telah dibuat kemudian diinokulasikam isolat Aspergillus ustus menggunakan ose steril dan dilakukan di dalam laminar (yang telah disinari UV (ultraviolet) selama 15 menit untuk menghindari kontaminasi). Media agar steril yang ditempatkan di dalam cawan petri digunakan untuk penumbuhan isolat Aspergillus ustus (untuk stock isolat), sedangkan yang ditempatkan di dalam tabung reaksi (agar miring) digunakan untuk peremajaan Aspergillus ustus.
Pengenceran isolat Aspergillus ustus bertujuan untuk memperoleh inokulum yang akan digunakan untuk produksi enzim pektinase. Isolat Aspergillus ustus yang diencerkan berasal dari hasil isolat Aspergillus ustus yang diremajakan dan berumur lima hari. Pengenceran isolat menggunakan air destilata steril sebanyak 5 mL yang dicampurkan ke dalam isolat Aspergillus ustus yang diremajakan.
3.2.3.3 Produksi Enzim Pektinase
GP x FP x 1000 t x BM
fermentasi terlepas atau keluar (Baladhandayutham dan Thangavelu 2011). Produksi enzim pektinase ini dilakukan sebanyak dua ulangan untuk masing-masing kultur.
Produksi enzim pektinase dilakukan pada suhu ruang selama 7 hari mulai dari hari ke-0 hingga hari ke-7 untuk masing-masing jenis substrat media fermentasi semi padat. Setiap 24 jam sekali (1 hari), kultur yang difermentasi dipindahkan dari ruang fermentasi ke lemari pendingin (chiller) untuk menghentikan aktivitas Aspergillus ustus.
Produksi enzim pektinase yang pertama dilakukan untuk mendapatkan substrat terbaik, yaitu jenis limbah pertanian mana yang dapat dijadikan media fermentasi sehingga menghasilkan aktivitas enzim pektinase tertinggi dan hasilnya akan digunakan untuk tahap selanjutnya. Produksi enzim pektinase selanjutnya adalah untuk tahap optimasi kondisi fermentasi, yaitu untuk mengetahui kondisi optimal pada saat fermentasi sehingga didapatkan aktivitas enzim pektinase tertinggi.
3.2.3.4 Pengukuran Aktivitas Enzim Pektinase
Analisis aktivitas enzim dilakukan dengan penambahkan air destilata sebanyak 15 mL ke dalam masing-masing kultur kemudian diaduk menggunakan magnetic stirrer (suhu selama pengadukan harus tetap dingin agar enzim tidak rusak) selama 15 menit. Hal ini bertujuan untuk mengekstraksi enzim pektinase ekstraseluler yang terbentuk. Enzim yang terekstrak kemudian dipipet dengan pipet mikro sebanyak 1500 µL dan dipindahkan ke dalam microtube eppendorf. Tahap selanjutnya yaitu sentrifugasi ekstrak enzim menggunakan sentrifuse dengan kecepatan 11.000 rpm selama 20 menit, dari proses ini akan terbentuk enzim pektinase kasar (crude enzyme) berupa supernatan atau filtrat serta biomassa dan sel (endapan).
Enzim pektinase kasar digunakan untuk analisis aktivitas enzim dengan cara melakukan pengenceran 102. Aktivitas enzim didapat dengan melakukan pengukuran nilai absorbansi crude enzim yang telah direaksikan dengan larutan substrat pektin komersial dan dihentikan reaksinya oleh DNS (dinitrosalisilat) setelah reaksi berlangsung selama 30 menit, kemudian dengan menggunakan spektrofotometer pada panjang gelombang 540 nm, absorbansi enzim tersebut diukur. Tahapan pengukuran aktivitas enzim dengan spektrofotometer secara skematis dapat dilihat pada Lampiran 3. Nilai absorbansi yang didapat dikonversi menjadi konsentrasi gula pereduksi (ppm) menggunakan persamaan yang didapat dari kurva standar asam galakturonat (Lampiran 4) kemudian dihitung nilai aktivitas enzim pektinase menggunakan rumus berikut (persamaan 1.7)
AE =
Keterangan :
AE : Aktivitas enzim pektinase kasar (U/mL)
[GP] : Konsentrasi gula pereduksi yang diperoleh dari kurva standar (mg/mL) 1000 : Faktor konversi
FP : Faktor pengenceran t : Waktu inkubasi (menit)
BM : Bobot molekul asam galakturonat 212 g/mol
Aktivitas enzim pektinase dinyatakan dalam U/mL. Satu unit merupakan jumlah enzim yang dibutuhkan untuk memecah 1 µmol pektin menjadi asam galakturonat per menit pada kondisi pengujian.
3.2.4 Pengujian Kondisi Optimum Produksi Enzim Pektinase
Setelah didapatkan informasi mengenai substrat terbaik pada tahap produksi enzim pektinase yang pertama maka dilakukan pengujian kondisi optimum fermentasi. Media fermentasi semi padat yang digunakan untuk tahap ini komposisinya terdiri dari tepung limbah pertanian yang menghasilkan aktivitas enzim pektinase tertinggi pada tahap produksi enzim pektinase yang pertama, buffer fosfat pH 6 (konsentrasi 0.1 M), dan czapek’s nutrient medium.
IV. HASIL DAN PEMBAHASAN
4.1 PREPARASI SUBSTRAT DAN ISOLAT UNTUK PRODUKSI ENZIM
PEKTINASE
Tahap pengumpulan, pengeringan, penggilingan, dan homogenisasi kulit jeruk Siam, kulit jeruk Medan, kulit durian, dan daun teh tua menghasilkan substrat untuk pembuatan media fermentasi semi padat berupa tepung limbah berukuran 500 mesh. Substrat yang tersedia kemudian disimpan untuk produksi enzim pektinase. Data rendemen tepung limbah untuk masing-masing substrat dapat dilihat pada Tabel 3. di bawah ini.
Tabel 3. Data rendemen limbah pertanian
Jenis Limbah Bobot Sampel (g) Rendemen (%)
Awal (W1) Akhir (W2)
Kulit Jeruk Siam 428 141 32.49
Kulit Jeruk Medan 1404 309 22.01
Kulit Durian 1464 300 20.49
Daun teh tua 273 132 48.35
Keterangan :
W1 : bobot limbah sebelum pengeringan dan penggilingan (g) W2 : bobot limbah setelah pengeringan dan penggilingan (g) Rendemen : ( [W2 – W1]/ W1) x 100%
Substrat dalam bentuk tepung limbah berukuran 500 mesh dapat dilihat pada Gambar 9.
Gambar 9. Substrat untuk media fermentasi semi padat, dari kiri ke kanan : daun teh tua, kulit jeruk Siam, kulit jeruk Medan, dan kulit durian
4.2 ANALISIS SUBSTRAT
4.2.1 Kadar Pektin Substrat
Analisis kadar pektin dilakukan terhadap keempat jenis substrat, hal ini bertujuan untuk mengetahui jumlah pektin yang tersedia untuk digunakan sebagai substrat bagi Aspergillus ustus sehingga dapat menghasilkan enzim pektinase. Persentase kadar pektin setiap jenis substrat dapat dilihat pada gambar 10. Kadar pektin untuk setiap jenis substrat terdapat pada Lampiran 5.
Gambar 10. Chart kadar pektin seluruh substrat Keterangan :
KJS : kulit jeruk Siam KJM : kulit jeruk Medan KDU : kulit durian DTT : daun teh tua
Berdasarkan hasil analisis kadar pektin pada keempat substrat, terlihat bahwa substrat kulit jeruk Medan memiliki kadar pektin tertinggi yaitu sebesar 41.08% kemudian diikuti oleh kulit jeruk Siam dengan nilai kadar pektin sebesar 7.80%, setelah itu kulit durian sebesar 3.51%, dan terakhir daun teh tua sebesar 2.31%.
Penelitian yang dilakukan oleh Khule et al. (2012) menggunakan kulit jeruk lokal India menunjukkan hasil kadar pektin tertinggi yaitu sebesar 17.63% dan terendah sebesar 5.29%. Kadar pektin tertinggi didapat pada pengukuran kadar pektin menggunakan asam sitrat pada pH 2, sedangkan kadar pektin terendah didapat pada pengukuran menggunakan asam sitrat pH 1.2. Hasil ini jika dibandingkan dengan kadar pektin kulit jeruk Medan dan Siam menunjukkan hasil yang lebih rendah.
7.805
41.08
3.51
2.32
0 5 10 15 20 25 30 35 40 45
Kadar
Pektin
(%)
Jenis Substrat
Perkiraan sementara dari hasil pengukuran kadar pektin keempat substrat adalah semakin banyak kandungan pektin yang tersedia pada substrat maka metabolisme dari Aspergillus ustus akan meningkat. Dengan demikian, enzim pektinase sebagai produk hasil metabolisme juga akan meningkat. Hasil ini akan dihubungkan dengan hasil dari analisis aktivitas enzim pektinase sehingga dapat diketahui bagaimana pengaruh ketersediaan pektin terhadap aktivitas enzim pektinase yang dihasilkan.
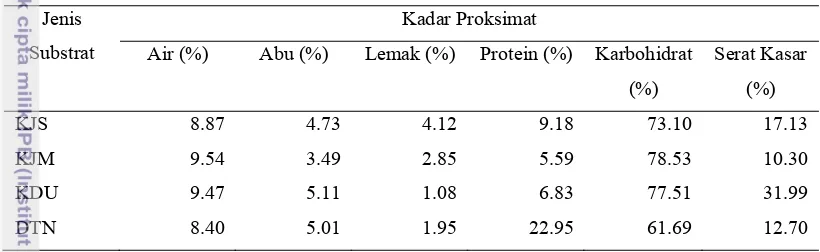
4.2.2 Kadar Proksimat Substrat
Tabel 4. Data Kadar Proksimat Seluruh Substrat Jenis
Substrat
Kadar Proksimat
Air (%) Abu (%) Lemak (%) Protein (%) Karbohidrat (%)
Serat Kasar (%)
KJS 8.87 4.73 4.12 9.18 73.10 17.13
KJM 9.54 3.49 2.85 5.59 78.53 10.30
KDU 9.47 5.11 1.08 6.83 77.51 31.99
DTN 8.40 5.01 1.95 22.95 61.69 12.70
Keterangan : KJS (kulit jeruk Siam); KJM (kulit jeruk Medan); KDU (kulit durian); DTN(Daun teh tua)
Substrat-substrat yang diuji pada penelitian ini mengandung pektin sebagai penyusun utama karbohidratnya. Berdasarkan data proksimat diatas, terlihat bahwa kadar karbohidrat tertinggi dimiliki oleh substrat kulit jeruk Medan yaitu sebesar 78.53%. Hal ini menunjukkan hubungan yang positif dengan kadar pektin substrat yang telah diuji, yaitu semakin tinggi kadar karbohidrat maka semakin tinggi pula kadar pektin substrat.
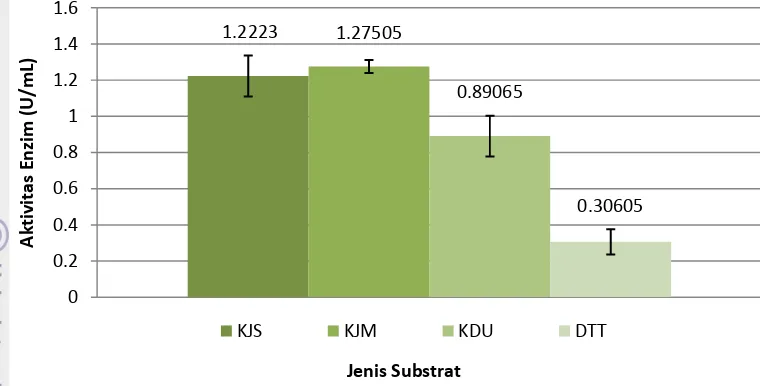
4.3 ANALISIS AKTIVITAS ENZIM PEKTINASE SELURUH SUBSTRAT
Analisis aktivitas enzim pektinase dari keempat substrat yang digunakan, dilakukan dengan menghitung nilai aktivitas enzim pektinase yang dihasilkan oleh Aspergillus ustus pada masing-masing media fermentasi semi padat.
Gambar 11. Chart pengaruh jenis substrat terhadap aktivitas enzim pektinase
Waktu fermentasi atau inkubasi optimum untuk menghasilkan enzim pektinase dengan aktivitas tertinggi pada masing-masing substrat adalah 2 hari, kecuali untuk substrat daun teh tua yaitu 1 hari. Waktu fermentasi atau inkubasi optimum ini menggambarkan waktu yang dibutuhkan Aspergillus ustus menggunakan substrat untuk menghasilkan enzim pektinase secara maksimal. Kurva produksi enzim pektinase oleh Aspergillus ustus oleh berbagai substrat selama fermentasi pada suhu ruang terdapat pada Gambar 12.
Gambar 12. Kurva aktivitas enzim pektinase oleh Aspergillus ustus pada berbagai substrat (suhu ruang)
Mikroorganisme mempunyai masa pertumbuhan yang bervariasi atau biasa disebut dengan fase pertumbuhan. Fase-fase pertumbuhan tersebut sangat berpengaruh terhadap enzim yang dihasilkan oleh mikroorganisme untuk membantu pencernaan makanannya. Pada awal
1.2223 1.27505
0.89065
0.30605
0 0.2 0.4 0.6 0.8 1 1.2 1.4 1.6
Aktivitas
En
zim
(U/mL)
Jenis Substrat
KJS KJM KDU DTT
0 0.2 0.4 0.6 0.8 1 1.2 1.4 1.6
0 1 2 3 4 5 6
Aktivitas
En
zim
(U/mL)
Lama Fermentasi (Hari)
KJS
KJM
KDU
pertumbuhan, fase yang dilalui adalah fase pertumbuhan kemudian aktivitas metabolisme akan menurun setelah mikroorganisme melewati fase puncak pertumbuhannya, fase penurunan ini disebut fase kematian (death phase). Hal ini dapat dilihat pada hasil produksi enzim pektinase oleh Aspergillus ustus pada penelitian ini, yaitu terjadinya fase pertumbuhan mulai dari hari ke-0 hingga mencapai fase puncak pertumbuhan yang menghasilkan aktivitas enzim tertinggi, kemudian mulai masuk ke fase kematian (death phase) yang ditandai dengan menurunnya aktivitas enzim pektinase.
Penelitian mengenai produksi pektinase mengunakan media dari kulit jeruk telah banyak dilakukan, sedangkan produksi pekinase menggunakan media dari kulit durian dan daun teh tua belum pernah dilakukan. Penelitian yang dilakukan oleh Rangarajan et al. ( 2010) menunjukkan bahwa sumber karbon non-glukosa (kulit jeruk) dengan tambahan sumber nitrogen organik (bungkil kedelai) dapat digunakan sebagai substrat untuk produksi enzim pektinase yang dihasilkan oleh Aspergillus niger. Karbon yang digunakan tidak bersumber dari glukosa atau fruktosa melainkan dari kulit jeruk dikarenakan glukosa atau fruktosa diindikasikan akan menyebabkan terjadinya represi katabolit, yaitu berlebihnya gula terlarut di dalam pertumbuhan sel yang dapat menekan produksi enzim.
Penelitian yang dilakukan oleh Adeleke et al. (2012) menggunakan kulit jeruk lokal Nigeria dengan metode fermentasi semi padat oleh Penicillium atrovenetum, Aspergillus flavus, and Aspergillus oryzae menghasilkan aktivitas pektinase masing-masing sebesar 11.58 U/mL, 12.12 U/mL, dan 10.17 U/mL. Hasil ini menunjukkan aktivitas pektinase oleh ketiga isolat tersebut lebih tinggi dibandingkan dengan aktivitas pektinase oleh Aspergillus ustus pada media kulit jeruk Medan dan jeruk Siam. Perbedaan ini mungkin disebabkan oleh kemampuan isolat yang digunakan berbeda-beda dalam mendegradasi pektin dan menghasilkan pektinase.
Berdasarkan hasil analisis produksi enzim pektinase pada keempat substrat, maka substrat yang akan digunakan untuk optimasi kondisi produksi enzim pektinase adalah kulit jeruk Medan yang menghasilkan enzim pektinase dengan aktivitas tertinggi dengan waktu inkubasi optimum 2 hari. Hasil ini juga menunjukkan hubungan positif antara kadar pektin dengan aktivitas enzim pektinase, yaitu semakin tinggi kadar pektin pada substrat maka aktivitas enzim pektinase yang dihasilkan juga semakin tinggi.
4.4 ANALISIS AKTIVITAS ENZIM PEKTINASE TAHAP OPTIMASI
4.4.1 Optimasi Konsentrasi Substrat
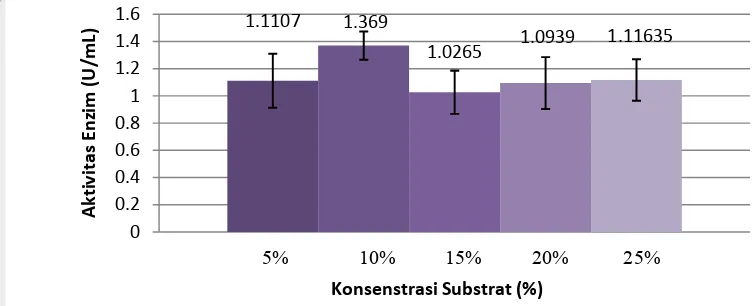
[image:31.595.123.500.218.371.2]Konsentrasi substrat yang dianalisis adalah 5, 10, 15, 20, dan 25% padatan. Persentase tersebut menggambarkan perbandingan padatan (dalam hal ini adalah substrat yaitu kulit jeruk Medan) dengan cairan (dalam hal ini adalah buffer fosfat dan czapek’s nutrient medium). Komposisi bahan pembuatan media fermentasi semi padat untuk tahap optimasi konsentrasi substrat dapat dilihat pada lampiran 2. Pengaruh konsentrasi substrat terhadap aktivitas enzim pektinase dapat dilihat pada Gambar 13.
Gambar 13. Chart pengaruh konsentrasi substrat terhadap aktivitas enzim pektinase
Berdasarkan analisis aktivitas enzim pektinase pada tahap optimasi konsentrasi substrat, diperoleh nilai aktivitas enzim pektinase tertinggi yaitu pada konsentrasi substrat 10% sebesar 1.3690 U/mL. Konsentrasi substrat 10% merupakan konsentrasi optimum yang dapat menghasilkan enzim pektinase dengan aktivitas yang maksimal. Pada kosentrasi substrat di atas 10%, aktivitas enzim pektinase yang dihasilkan menunjukkan penurunan nilai aktivitas. Meskipun terjadi peningkatan nilai aktivitas enzim pektinase pada konsentrasi 15, 20, dan 25%, namun nilainya tidak terlalu besar. Dengan demikian, peningkatan konsentrasi substrat di atas 10% justru mengurangi efisiensi produksi enzim pektinase karena membutuhkan substrat yang lebih banyak namun tidak menghasilkan aktivitas enzim pektinase yang lebih tinggi.
Konsentrasi substrat yang lebih kecil juga dapat menyebabkan produksi enzim menjadi tidak maksimal. Hal ini disebabkan karena substrat sebagai penyedia pektin dan penginaktif represor pada proses produksi enzim pektinase tidak cukup tersedia sehingga represor kembali aktif yang mengakibatkan produksi enzim menurun atau bahkan terhenti.
Hasil yang berbeda ditunjukkan pada penelitian yang dilakukan oleh Baladhanyutham dan Thangavelu (2011), aktivitas pektinase tertinggi dihasilkan pada konsentrasi substrat 20% yaitu sebesar 88.65 U/mL. Pektinase ini dihasilkan oleh isolat Aspergillus awamori menggunakan media fermentasi padat yang tersusun dari rice brand dan sugar cane bagasse. Perbedaan hasil ini kemungkinan disebabkan oleh perbedaan isolat penghasil pektinase dan jenis substrat penyusun media fermentasi.
1.1107 1.369
1.0265
1.0939 1.11635
0 0.2 0.4 0.6 0.8 1 1.2 1.4 1.6
Aktivitas
En
zim
(U/mL)
Konsenstrasi Substrat (%)
Berdasarkan hasil optimasi konsentrasi substrat, maka besar konsentrasi substrat yang digunakan pada tahap optimasi pH media dan optimasi suhu fermentasi adalah konsentrasi substrat 10%.
4.4.2 Optimasi pH Media Fermentasi Semi padat
Salah satu faktor yang memengaruhi aktivitas enzim adalah pH. Mayoritas enzim sangat sensitif terhadap pH dan memiliki kisaran aktivitas yang spesifik. Aktivitas enzim akan maksimal pada pH yang optimum.
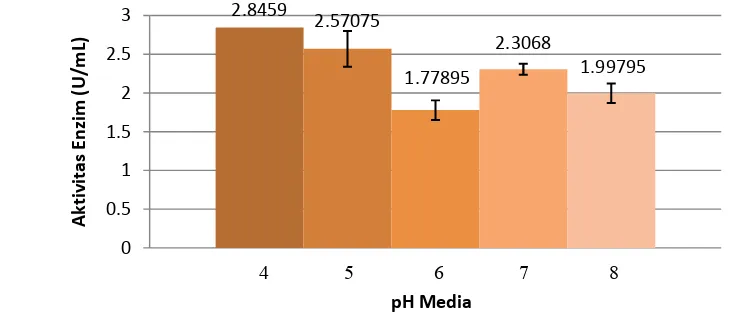
[image:32.595.133.499.310.466.2]Nilai pH media fermentasi semi padat yang dianalisis pada penelitian ini adalah pH 4, 5, 6, 7, dan 8. Kisaran pH ini diuji karena dianggap mewakili seluruh daerah pH, yaitu daerah asam, netral, dan basa. Hasil dari optimasi ini akan menunjukkan kondisi pH yang optimum, baik untuk pertumbuhan Aspergillus ustus, maupun metabolismenya.
Gambar 14. Chart pengaruh pH terhadap aktivitas enzim pektinase
Berdasarkan hasil analisis aktivitas enzim pektinase pada pH media fermentasi semi padat yang diuji maka diperoleh nilai aktivitas enzim pektinase tertinggi yaitu sebesar 2.8459 U/mL. Aktivitas enzim pektinase tertinggi ini diperoleh pada media fermentasi semi padat pH 4. Hasil ini menunjukkan bahwa pH optimum untuk pertumbuhan dan metabolisme berupa enzim pektinase oleh Aspergillus ustus adalah pH 4 atau dengan kata lain kondisi optimum untuk produksi enzim pektinase oleh Aspergillus ustus adalah pada daerah yang cukup asam.
Penelitian yang dilakukan oleh Baladhanyutham dan Thangavelu (2011) memberikan hasil yang serupa. Penelitian tersebut menggunakan Aspergillus awamori sebagai isolat dan menghasilkan aktivitas enzim pektinase yang meningkat pada kisaran pH 3-5, kemudian pada peningkatan pH media di atas pH 5, aktivitas enzim pektinase justru mengalami penurunan. Hasil yang sama juga ditunjukkan oleh aktivitas enzim pektinase yang diproduksi oleh Aspergillus niger (Baladhanyutham dan Thangavelu 2010). Aktivitas enzim pektinase meningkat pada pH 4-5 kemudian mengalami penurunan aktivitas pada pH media di atas pH 5.
2.8459
2.57075
1.77895
2.3068
1.99795
0 0.5 1 1.5 2 2.5 3
Aktivitas
En
zim
(U/mL)
pH Media
4.4.3 Optimasi Suhu fermentasi
Selain pH, faktor lain yang memengaruhi aktivitas enzim adalah suhu. Secara umum, peningkatan suhu akan meningkatkan laju reaksi, namun kenaikan suhu yang berlebih juga dapat menurunkan laju reaksi. Hal ini karena suhu tinggi dapat menyebabkan terjadinya denaturasi protein atau putusnya ikatan ion dan hidrogen, sedangkan suhu yang terlalu rendah dapat menyebabkan enzim menjadi tidak aktif.
[image:33.595.115.489.81.422.2]Besaran suhu yang diuji pada penelitian ini adalah 30, 40, dan 50oC. Pengaruh suhu terhadap aktivitas enzim pektinase dapat dilihat pada Gambar 15 di bawah ini.
Gambar 15. Chart pengaruh suhu fermentasi terhadap aktivitas enzim pektinase
Berdasarkan hasil pengujian terhadap aktivitas enzim pada beberapa suhu, terlihat bahwa suhu 40oC merupakan suhu yang menghasilkan aktivitas enzim pektinase tertinggi yaitu sebesar 1.9194 U/mL. Penurunan aktivitas enzim pektinase terjadi pada kenaikan suhu sebesar 10oC, hal ini mungkin terjadi akibat terputusnya ikatan sekunder enzim karena besarnya energi kinetika dari molekul enzim sehingga mengakibatkan hilangnya struktur sekunder dan tersier enzim yang disertai dengan hilangnya aktivitas enzim (Suhartono 1989).
1.48695
1.91935
1.8688
0 0.5 1 1.5 2 2.5
Aktivitas
En
zim
(U/mL)
Suhu Fermentasi (oC)
V. SIMPULAN DAN SARAN
5.1 SIMPULAN
Penelitian ini menunjukkan bahwa limbah pertanian yaitu kulit jeruk Siam, kulit jeruk Medan, kulit durian, dan daun teh tua memiliki kandungan pektin di dalamnya sehingga menjadikannya sebagai bahan yang berpotensi untuk digunakan sebagai substrat untuk produksi enzim pektinase. Dari keempat jenis limbah yang digunakan, kulit jeruk Medan menghasilkan aktivitas enzim pektinase dengan nilai tertinggi yaitu sebesar 1.2751 U/mL.
Optimasi kondisi fermentasi enzim pektinase menunjukkan bahwa aktivitas enzim pektinase yang diproduksi dipengaruhi oleh konsentrasi substrat yang tersedia pada media fermentasi, pH media, dan suhu fermentasi. Hasil optimasi menunjukkan bahwa konsentrasi substrat yang menghasilkan aktivitas enzim pektinase yang maksimal adalah konsentrasi substrat 10% dengan aktivitas enzim pektinase yang dihasilkan yaitu sebesar 1.3690 U/mL. pH media optimum adalah pH 4 dengan besar aktivitas enzim pektinase sebesar 2.8459 U/mL, sedangkan suhu media yang optimum adalah 40oC dengan aktvitas enzim pektinase yang dihasilkan yaitu sebesar 1.9194 U/mL. Kadar pektin dalam limbah memiliki hubungan yang sebanding dengan aktivitas enzim pektinase yang diproduksi. Kadar pektin yang tinggi pada substrat kulit jeruk Medan menjadikan aktivitas enzim pektinase yang dihasilkan pada substrat tersebut juga tinggi.
5.2 SARAN
Penelitian yang sudah dilaksanakan ini masih memiliki beberapa kekurangan terutama dari segi pelaksanaannya. Analisis aktivitas enzim pektinase sebaiknya dilakukan segera setelah pemanenan hasil produksi enzim. Hal ini dikarenakan enzim pektinase yang dihasilkan masih berupa enzim kasar dengan tingkat kestabilan yang masih rendah sehingga memungkinkan terjadinya ketidakakuratan hasil aktivitas enzim yang diukur jika telah terjadi kerusakan pada enzim yang tidak segera dianalisis tersebut.
PRODUKSI ENZIM PEKTINASE OLEH
Aspergillus ustus
PADA MEDIA FERMENTASI SEMI PADAT
MENGGUNAKAN LIMBAH PERTANIAN SEBAGAI
SUBSTRAT
SKRIPSI
YUFI SARA ANGGRAINI
F24080031
FAKULTAS TEKNOLOGI PERTANIAN
INSTITUT PERTANIAN BOGOR
DAFTAR PUSTAKA
Adeleke AJ, Odunfa SA, Olanbiwonninu A, Owoseni MC. 2012. Production of cellulase and pectinase from orange peels by fungi. J Nat and scie 10(5): 107-112.
Andriani A, Rahmani N, Yopi, Lisdiyanti P. 2011. Production and characterization of pectinase enzyme from Aspergillus ustus BL5 using submerged fermentation. Procceding of the 2nd International Seminar on Chemistry, 24-25 November 2011, Jatinangor.
Andrianis. 2012. Pengolahan teh hitam. www.rumahteh.com. [14 November 2012]
Anonim. 2005. Tanaman obat. http://www.iptek.net.id/ind/pd_tanobat/view.php?id=159. [11 Oktober 2012]
Anonim. 2009. luxurious.whatsoever.hk/2009/03/tea.html. [1 Oktober 2012]
Anonim. 2011. http://tealoveandcare.wordpress.com/2011/09/16/cloudwater-tea-picture-update/img_9685/). [2 Oktober 2012]
Anonim. 2012.Tanaman Jeruk. http://syifacitrus.blogspot.com. [23 Oktober 2012]
Baladhanyutham S dan Thangavelu V. 2010. Optimization and kinetics of pectinase enzyme using Aspergillus niger by solid-state fermentation. Indian J of scie and technol 3(8): 867-870. Baladhanyutham S dan Thangavelu V. 2011. Optimization and kinetics of solid-state fermentative
production of pectinase by Aspergillus awamori. J Intl j of chem technol research 3(4): 1758-1764.
BAPLUH-KP. 2012. http://bapluhoganilir.wordpress.com/2012/04/30/budidaya-tanaman-jeruk/. [12 Oktober 2012]
BCC Research. 2012. Global markets for enzymes in industrial applications - focus on Asia. http://www.marketresearch.com/BCC-Research-v374/Global-Enzymes-Industrial-Applications-Focus-6905142/. [20 September 2012]
[BPBPI] Badan Penelitian Bioteknologi Perkebunan Indonesia . 2012. http:// xa.yimg. com/kq / groups / 17803752/43794408/name/leaflet+limbah.pdf. [11 Oktober 2012]
[BSN] Badan Standarisasi Nasional. 1992. Pengukuran Kadar Abu (SNI 01-2891-1992, Butir 6.1). BSN, Jakarta.
[BSN] Badan Standarisasi Nasional. 1992. Pengukuran Kadar Air (SNI 01-2891-1992, Butir 5.1). BSN, Jakarta.
[BSN] Badan Standarisasi Nasional. 1992. Pengukuran Kadar Lemak (SNI 01-2891-1992, Butir 8.1). BSN, Jakarta.
[BSN] Badan Standarisasi Nasional. 1992. Pengukuran Kadar Protein (SNI 01-2891-1992, Butir 7.1). BSN, Jakarta.
[BSN] Badan Standarisasi Nasional. 1992. Pengukuran Karbohidrat (SNI 01-2891-1992, Butir 9.1). BSN, Jakarta.
[BSN] Badan Standarisasi Nasional. 1992. Pengukuran Serat Kasar (SNI 01-2891-1992, Butir 11). BSN, Jakarta.
Chayati I dan Andian AA. 2009. Diktat Ilmu Pangan Fakultas Teknik Universitas Negeri Yogyakarta. Fakultas Teknik Universitas Negeri Yogyakarta, Yogyakarta.
Christensen dan Towle. 1973. Pectin Industrial Gums, Polysaccharides and Derivatives (Whistler and Be Miller Ed). New York : Academic Press.
Cruess WV. 1958. Commercially Fruits and Vegetables Products. New York : McGraww Hill Book.
Departemen Pertanian. 2012. http://www.deptan.go.id . [14 Oktober 2012]
Direktorat Jenderal Perkebunan Kementerian Pertanian. 2012. http://www.deptan.go.id. [14 November 2012]
Dordick JS. 1991. Biocatalysts for Industry. New York : Plenum Press.
Freedonia Group Inc. 2011. World enzymes. http://www.marketresearch.com/Freedonia-Group-Inc-v1247/Enzymes-6842194/. [20 September 2012]
Gonzales JB. 2012. Solid-state fermentation: physiologi of solid medium, its molecular basis and application. http://www.sciencedirect.com / science / article / pii /
S1359511311004132. [1Oktober 2012]
Hutapea P. 2010. Pembuatan Tepung Biji Durian (Durio zibethinus murr) dengan Variasi Perendaman dalam Air Kapur dan Uji Mutunya. Sumatera Utara : USU.
Houbraken J, Due M, Varga J, Meijer M, Frisvad JC, Samson RA. 2007. Polyphasic taxonomy of Aspergillus section Usti. J Studies in Mycology 59: 107-128.
Koubala BB, Kansci G, Garnier C, Ralet MC, JF Thibault. 2012. Mango (Mangifera indica) and ambarella (Spondias cytherea) peel extracted pectins improve viscoelastic properties of derived jams. African Scholarly Scie Com Trust 12(3): 6200-6212.
Khule NR, Mahale NB, Shelar DS, Rokade MM, Chaudhari SR. 2012. Extraction of pectin from citrus fruit peel and use as natural binder in paracetamol tablet. J Der pharmacia lettre 4(2) : 558-564.
Machida M, Gomi K. 2012. Aspergillus Molecular Biology and Genomics. Norfolk : Center Academic Press.
[MNN] Mother Nature Network. 2012. http://www.mnn.com/food/healthy-eating/photos/15-fruits-youve-probably-never-heard-of/durian. [12Oktober 2012]
Montgomery et al. 1993. Biokimia : Suatu Pendekatan Berorientasi Kasus. Yogyakarta : UGM Press.
Muchtadi D, Astawan M, Palupi NS. 1990. Enzim dalam Industri Pangan. Bogor : PAU IPB. Namasivayam E, Ravindar J, K M, Jiji A, Kumar M, Jayaraj RL. 2011. Production of extracellular
pectinase by Bacillus cereus isolated from market solid waste. J Bioanal Biomed. Vol. 3(3): 070-075.
[NCBI] National Center for Biotechnology. 2012. http:// eol.org /pages /189961/ entries/ 38862034/ overview . [11Oktober 2012]
Nussinovitch. 1997. Hydrocolloid Applications Gum Technology in the Food and Other Industries. London : Blackie Academic and Professional.
Oyeleke SB, Oyewole OA, Egwim EC, Dauda BEN, Ibeh EN. 2012. Cellulase and pectinase production potentials of Aspergillus niger isolated from corn cob. J Bayero journal of pure and app scie 5(1): 078-083.
Paterson BL. 2004. New clinical presentations of invasive aspergillosis in non-conventional hosts. J clin microbiol infect 10(1): 024-030.
Pedrolli DB, Monteiro AC, Gomes E, Carmona EC. 2009. Pectin and pectinases: production, characterization, and industrial application of microbial pectinolytic enzymes. J the open biotech 3: 009-018.
Persley GJ. 1994. Agricultural Technology : Policy Issues of the International Community. Cambrige : CAB International.
Phutela U, Dhuna V, Sandhu S, Chadha. 2005. Pectinase and polygalacturonase production by a thermophilic Aspergillus fumigatus isolated from decomposing orange peel. J Brazilian J of Microbiol 36: 63-69.
Plantamor. 2012. http://www.plantamor.com/index.php?plant=509. [12 Oktober 2012] [PPTK] Pusat Penelitian Teh dan Kina. 2012. www.ritc.co.id. [12 Oktober 2012]
Pracaya. 1999. Jeruk Manis. Bogor : Penebar Swadaya.
Praveen VK, Savitha J. 2012. Solid state fermentation: an effective method for lovastatin production by fungi – a mini review. J the open tropical med 5: 001-005.
Purba. 2011. Pemanfaatan kulit jeruk Medan. http:// tinagers.wordpress.com/ 2011/ 09/ 30/ pemanfaatan-jeruk-medan/. [12 Oktober 2012]
Rangarajan V, Rajasekharan M, Ravichandran R, Sriganesh K, Vaitheeswaran V. 2010. Pectinase production from orange peel extract and dried orange peel solid as substrates using Aspergillus niger. J Internasional Journal of Biotech and Biochem 6(3): 445-453.
Rashid JIA, Samat N, Yusoff WMW. 2011. Optimization of temperature, moisture content and inoculum size in solid state fermentation to enhance mannanase production by Aspergillus terreus SUK-1 using RSM. J Pakistan journal of biologic scie 14(9): 533-539.
Sabu A, C Augur, C Swati, A Pandey. 2006. Tannase production by Lactobacillus sp. ASR-S1 under solid-state fermentation. J Process biochem 41: 575-580.
Samson RA, Hoekstra ES, Frisvad JC (eds). 2004. Introduction to Food and Airbone Fungi. Utrecht : Centraal Bureau voor Schimmelcultures.
Sobir, Napitupulu RM. 2012. Bertanam Durian Unggul. Jakarta : Penebar Swadaya. Suhartono MT. 1989. Enzim dan Bioteknologi. Bogor : IPB.
Tim Penulis PS. 1999. Peluang Usaha dan Pembudidayaan Jeruk Siam. Jakarta : Penebar Swadaya..
Tjitrosoepomo. 1989. Taksonomi Tumbuhan (Spermatophyta). Yogyakarta : UGM Press.
Widodo LU, Karaman N, K YC. 2012. Pektin dari Kulit Buah Pepaya. Surabaya : Universitas Pembangunan Nasional "Veteran" Jawa Timur.
Wijaya I. 2012. Bertanam Durian. Bekasi : Ganesa Exact.
Willats WGT, Knox JP, Mikkelsen JD. 2006. Pectin: new insights into an old polymer are starting to gel. J Trends in Food Scie and Technol 17: 097-104.
Willats WGT, McCartney L, Mackie W, Knox JP. 2001. Pectin: cell biology for functional analysis. Plant mol biol 47: 9-27.
PRODUKSI ENZIM PEKTINASE OLEH
Aspergillus ustus
PADA MEDIA FERMENTASI SEMI PADAT
MENGGUNAKAN LIMBAH PERTANIAN SEBAGAI
SUBSTRAT
SKRIPSI
YUFI SARA ANGGRAINI
F24080031
FAKULTAS TEKNOLOGI PERTANIAN
INSTITUT PERTANIAN BOGOR
PECTINASE PRODUCTION BY
Aspergillus ustus
AT SOLID
STATE FERMENTATION MEDIUM USING AGRICULTURE
WASTE AS SUBSTRATE
Yufi Sara Anggraini1, Darwin Kadarisman1, and Nanik Rahmani2
1Department of Food Science and Technology, Faculty of Agricultural Technology, Bogor
Agricultural University, IPB Darmaga Campus, PO Box