ITA PURNAMASARI. Perkembangan Mikrospora dalam Kultur Antera dan Viabilitas Polen Kelapa Sawit (Elaeis guineensis Jacq.). Dibimbing oleh ENCE DARMO JAYA SUPENA dan SUMARYONO.
Pengembangan teknologi haploid melalui induksi androgenesis secara in vitro merupakan alternatif yang banyak ditempuh untuk mendapatkan galur murni secara singkat. Penerapan teknologi ini pada kelapa sawit akan mempercepat pengembangan varietas hibrida untuk meningkatkan produktivitas. Namun sampai saat ini usaha tersebut belum dilaporkan berhasil. Hal ini erat kaitannya dengan fisiologi dan kemampuan sel mikrospora untuk berkembang dalam kondisi in vitro. Oleh karena itu, perkembangan gametofitik mikrospora dalam kultur antera dengan sistem media dua lapis serta viabilitas polen kelapa sawit perlu diamati sebagai langkah awal untuk mengembangkan teknik androgenesis. Ciri morfologi malai jantan diamati untuk menentukan stadia perkembangan mikrospora yang akan digunakan sebagai bahan untuk induksi androgenesis. Antera untuk induksi androgenesis kelapa sawit dengan populasi mikrospora stadium uninukleat akhir sampai binukleat awal lebih dari 50% dapat diisolasi dari bunga pada ujung spikelet yang terletak di tengah malai dengan spata ½ terbuka. Polen kelapa sawit memiliki viabilitas yang tinggi, yaitu sebesar 95% dengan waktu yang diperlukan untuk pengujian viabilitas melalui reduksi enzimatik trifenil tetrazolium klorida cukup 4 jam, sedangkan untuk perkecambahan dengan metode hanging drop perlu waktu 12-14 jam. Mikrospora uninukleat stadium akhir menunjukkan respon perkembangan gametogenesis yang lebih stabil daripada uninukleat awal-tengah pada kultur in vitro. Penggunaan sumber karbon maltosa 4% dalam media dapat mendukung perkembangan kedua kelompok mikrospora tersebut menjadi polen matang dalam kultur in vitro.
Kata kunci : kelapa sawit, polen, mikrospora, gametofitik, viabilitas, perkecambahan.
ABSTRACT
ITA PURNAMASARI. Microspore Development in Anther Culture and Pollen Viability of Oil Palm (Elaeis guineensis Jacq.). Supervised by ENCE DARMO JAYA SUPENA and SUMARYONO.
Development of haploid technology via induction of in vitro androgenesis is the most common approach to produce pure lines in a short period of time. Introduction of this technology on oil palm will speed up the development of hybrid variety to increase plant productivity. Unfortunately it has not been reported successful yet, in which could be influenced by the physiology and capability of microspores to develop at in vitro conditions. For these reason, gametophytic development of microspores of oil palm in a double layer medium along with the viability of pollen were observed as the first step to develop androgenesis technique. Morphology of male inflorescences was observed to determine the developmental phase of microspore used as the material for androgenesis induction. The anther for androgenesis induction with more than 50% microspore at late stage of uninucleat to early binucleat phase could be isolated from the upper part of spikelet located at the middle part of the male inflorescence with ½ part of spatha
was opened. Viability of oil palm pollen was up to 95%, in which the time needed for viability test with enzymatic reduction of triphenyl tetrazolium chloride was only 4 hours, and germination test with hanging drop method was 12-14 hours. The late uninucleat microspore showed better gametogenesis development response than the early-middle uninucleat microspore on in vitro culture. Maltose 4% as the carbon source in the medium can support the development of two groups of microspore to mature pollen on in vitro culture.
PENDAHULUA
N Latar belakangKelapa sawit (Elaeis guineensis Jacq.) merupakan komoditas perkebunan unggulan di Indonesia yang sangat berperan dalam pertumbuhan investasi dan devisa. Pada tahun 2007, produksi minyak kelapa sawit Indonesia mencapai 18.3 juta ton dan telah mengungguli Malaysia. Pada tahun 2010, produksi minyak kelapa sawit Indonesia meningkat hingga mencapai 22 juta ton (USDA 2011). Peningkatan ini dicapai melalui perluasan areal perkebunan di daerah utama penghasil kelapa sawit, yaitu Sumatera Utara, Riau, Kalimantan Barat, Sumatera Selatan, Jambi, dan Aceh. Namun, perluasan areal penanaman ini tidak ditopang dengan tersedianya bibit yang berkualitas dalam jumlah yang cukup. Kondisi tersebut menyebabkan rata-rata produksi minyak kelapa sawit Indonesia hanya 3 ton CPO/ha/tahun. Hasil ini masih lebih rendah dari produktivitas perkebunan kelapa sawit di Malaysia yang mencapai 4.2 ton CPO/ha/tahun (USDA 2011).
Bibit kelapa sawit yang digunakan umumnya merupakan varietas hibrida tipe
tenera hasil persilangan antara tetua tipe dura
dengan tipe pisifera. Terbatasnya varietas hibrida ini erat kaitannya dengan terbatasnya ketersediaan calon tetua berupa galur-galur murni (homozigot). Pembentukan galur murni dapat dilakukan secara konvensional melalui penyerbukan sendiri secara terkendali, namun cara ini membutuhkan 5-7 generasi. Sementara itu, waktu yang dibutuhkan untuk menyelesaikan satu generasi pada kelapa sawit adalah 3-4 tahun. Oleh karena itu, diperlukan pengembangan teknik yang dapat menghasilkan galur murni dalam waktu yang singkat (Dunwell et al. 2010).
Pengembangan teknologi haploid melalui induksi androgenesis secara in vitro
merupakan alternatif yang banyak ditempuh untuk mendapatkan galur murni secara singkat pada beberapa spesies tanaman seperti pada
Nicotiana tabacum L. (Reinert et al. 1975),
Triticum aestivum L. (Marsolais et al. 1984),
Brassica napus (Custers et al. 1994), dan
Capsicum annuum (Supena et al. 2006). Sementara itu, tanaman haploid dan haploid ganda pada kelapa sawit baru dapat diperoleh melalui seleksi terhadap bibit dalam skala besar. Teknik seleksi ini dilakukan melalui seleksi morfologi, penentuan homozigositas atau heterozigositas dengan markah molekuler, dan pengukuran tingkat ploidi (Dunwell et al. 2010). Namun, produksi
tanaman haploid dan haploid ganda melalui induksi androgenesis pada kelapa sawit belum dilaporkan berhasil. Kultur antera kelapa sawit pada media semi padat telah dilakukan, namun belum berhasil dan tidak dilengkapi dengan pengamatan terhadap stadia mikrospora (Tirtoboma 1997). Selain itu, upaya induksi pembelahan sporofitik dengan cekaman suhu tinggi dan sumber karbon yang berbeda pada kultur antera kelapa sawit dalam sistem media dua lapis juga belum berhasil (Septiani 2008). Oleh karena itu, perlu dilakukan penelitian terlebih dahulu terhadap perkembangan gametofitik mikrospora maupun pengujian tingkat viabilitas dan perkecambahan polen kelapa sawit dalam kutur in vitro.
Tujuan
Penelitian ini bertujuan mengamati hubungan morfologi malai jantan dengan stadia mikrospora, mengamati perkembangan gametofitik mikrospora mulai dari beberapa stadia awal mikrospora, serta menguji tingkat viabilitas dan perkecambahan polen kelapa sawit dalam kultur in vitro.
BAHAN DAN METODE
Sumber antera
Antera yang digunakan berasal dari bunga jantan kelapa sawit tipe tenera berumur 3-7 tahun yang diperoleh dari kebun koleksi Balai Penelitian Bioteknologi Perkebunan di Ciomas - Bogor.
Pengamatan morfologi malai jantan dan stadia mikrospora
Pengamatan morfologi malai dan stadia mikrospora dilakukan pada tiga kelompok malai jantan kelapa sawit, yaitu malai dengan spata (pelindung bunga majemuk) ¼ terbuka, ½ terbuka, dan sudah terbuka sepenuhnya. Antera yang diisolasi dari kuncup bunga
di-squash dalam setetes larutan manitol 5.5% (b/v) untuk diisolasi mikrosporanya. Selanjutnya mikrospora yang terlarut dalam larutan manitol dimasukkan ke tabung eppendorf yang berisi 0.1 mL larutan manitol dengan konsentrasi yang sama. Mikrospora atau polen yang terlarut di dalam larutan manitol diisolasi dengan cara diendapkan dengan sentrifuse pada 8000 rpm selama lima menit pada suhu 160C. Selanjutnya pellet
perkembangan mikrospora diamati menggunakan mikroskop fluoresens. Masing-masing pengamatan dilakukan dengan tiga kali pengulangan posisi spikelet pada malai dan posisi kuncup bunga pada spikelet. Pada setiap preparat yang mengandung ≥ 50 mikrospora diamati pada lima bidang pandang dengan perbesaran 200X. Hasil pengamatan stadia mikrospora dikorelasikan dengan hasil pengamatan morfologi malai.
Pembuatan media kultur untuk induksi gametofitik
Media kultur yang digunakan adalah modifikasi media yang mengandung nutrisi makro dan mikro Eeuwens (Y3), vitamin Kao dan Michayluk (vitamin KM) 1% (v/v), dan 40 gL-1 maltosa dengan sistem media dua lapis, yaitu media cair di atas media padat dengan komposisi yang sama dengan pH 5.8. Namun, pada media padat ditambahkan 10 gL-1 arang aktif dan 2 gL-1 agar pemadat gelrite (Teixeira et al. 1995; Septiani 2008). Pada penelitian ini digunakan cawan petri berdiameter 6 cm serta dibutuhkan media padat dan cair masing-masing 3 mL.
Pengamatan perkembangan gametofitik mikrospora
Kuncup bunga jantan kelapa sawit dari spikelet dan malai dengan kriteria morfologi yang mengandung mikrospora stadia uninukleat awal-tengah dan uninukleat akhir didesinfeksi dengan alkohol 70% selama satu menit. Setelah itu kuncup bunga jantan dibilas sebanyak dua kali dengan akuades steril. Selanjutnya, kuncup bunga didesinfeksi dalam 2% NaOCl dengan penambahan 0.05% (v/v) Tween-20 selama 10 menit, kemudian dibilas sebanyak tiga kali dengan akuades steril.
Kuncup bunga hasil desinfeksi dibuka dengan pinset dan antera dipisahkan dari filamen serta kelopak bunga. Antera diletakkan pada media dua lapis sehingga mengapung pada permukaan media cair. Pada media cair ditambahkan 0.1% (v/v) Plant Preservative Mixture (PPMTM) untuk mencegah kontaminasi pada kultur. Pada setiap cawan petri dikulturkan antera yang berasal dari 10 kuncup bunga dan diinkubasi pada suhu 260-290C selama 15 hari pada kondisi gelap. Antera diambil satu-persatu dari kultur secara berkala pada 0, 1, 3, 6, 10, dan 15 hari setelah kultur (HSK) untuk diisolasi mikrosporanya dan diwarnai dengan pewarna DAPI (Septiani 2008). Tahap perkembangan inti sel mikrospora diamati menggunakan mikroskop fluoresens.
Masing-masing pengamatan dilakukan dengan tiga kali pengulangan kultur (3 cawan), dan setiap
preparat yang mengandung ≥ 50 mikrospora diamati pada lima bidang pandang dengan perbesaran 200X.
Pengujian viabilitas polen
Polen yang akan diuji viabilitasnya dalam penelitian ini berasal dari malai dengan spata terbuka sepenuhnya. Viabilitas polen diamati dengan menggunakan dua cara. Cara pertama dilakukan dengan metode pewarnaan menggunakan larutan triphenyl tetrazolium chloride (TTC). Cara kedua dilakukan dengan mengamati tingkat perkecambahan polen.
Pengujian viabilitas polen dengan metode pewarnaan dilakukan melalui pengujian reduksi enzimatik TTC. Larutan TTC (0.5% TTC dalam 8% (b/v) larutan sukrosa) diteteskan di atas kaca objek, kemudian polen disuspensikan di atas permukaannya dan ditutup dengan gelas penutup secepat mungkin untuk mencegah oksidasi. Suspensi tersebut diinkubasi dalam kondisi gelap pada suhu 260-290C selama empat jam (Armendariz et al. 2006). Masing-masing pengamatan dilakukan dengan tiga kali pengulangan kultur (3 preparat), dan setiap preparat yang mengandung ≥ 50 polen diamati pada lima bidang pandang dengan perbesaran 100X.
Berdasarkan uji tersebut, polen kelapa sawit akan dibedakan menjadi tiga kelompok, yaitu polen viable, semi-viable, dan polen
unviable. Polen yang viable akan mampu mereduksi senyawa TTC dan berwarna merah cerah. Sedangkan polen semi-viable
menunjukkan warna merah muda dan polen
unviable tidak tidak menunjukkan perubahan warna (Asma 2008).
HASIL
Hubungan ciri morfologi malai jantan dan stadia mikrospora
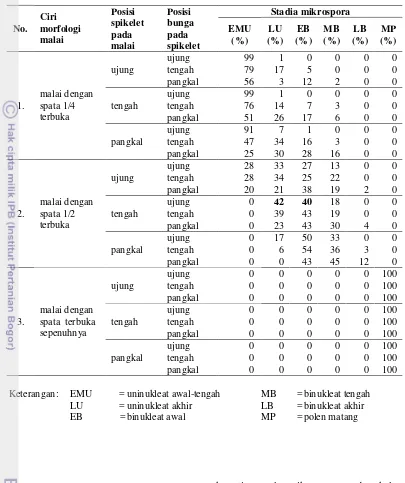
Morfologi malai jantan kelapa sawit dalam penelitian ini dibedakan berdasarkan ukuran pembukaan spata, posisi spikelet pada malai, dan posisi bunga pada spikelet (Gambar 1 & Tabel 1). Ciri morfologi yang diamati kemudian dihubungkan dengan stadia mikrospora. Malai jantan kelapa sawit dengan spata ¼ terbuka mengandung populasi mikrospora yang didominasi oleh stadia uninukleat awal-tengah. Sel mikrospora stadia uninukleat awal-tengah terutama dapat diisolasi dari bunga yang terletak di ujung spikelet yang terdapat pada bagian ujung malai. Mikrospora pada stadium ini dicirikan dengan sel yang berbentuk triangular dengan inti yang mengalami dekondensasi dan terletak di tengah sel (Gambar 2A). Selanjutnya inti sel tampak mengalami rekondensasi dan kedudukannya semakin ke arah tepi karena terdesak oleh vakuola (mendekati dinding sel) (Gambar 2B). Sel mikrospora dengan ciri seperti ini berada pada stadium uninukleat akhir. Mikrospora pada stadium uninukleat akhir dapat diisolasi dari bunga yang terletak di ujung spikelet yang terdapat pada bagian tengah malai dengan spata ½ terbuka.
Selanjutnya sel mikrospora memasuki stadium binukleat awal. Pada stadium ini, inti sel mengalami pembelahan mitosis sebanyak satu kali sehingga dihasilkan dua inti yang berukuran sama dalam satu sel (Gambar 2C). Sel mikrospora stadium ini banyak dijumpai pada bunga yang terletak di tengah spikelet yang terdapat pada bagian pangkal malai dengan spata ½ terbuka. Setelah inti sel membelah secara mitosis, kedua inti tersebut mulai bergerak menjauh dan mulai terjadi diferensiasi, yaitu menjadi inti vegetatif dan inti generatif. Sel mikrospora dengan ciri seperti ini menandakan bahwa sel berada pada stadium binukleat tengah (Gambar 2D). Mikrospora stadium binukleat tengah dapat dijumpai dengan populasi terbesar pada bunga yang terletak di pangkal spikelet yang terdapat pada bagian pangkal malai dengan spata ½ terbuka.
Pada perkembangan selanjutnya, sel mikrospora akan memasuki stadium binukleat akhir. Stadium binukleat akhir dicirikan oleh inti vegetatif dan inti generatif yang dapat dibedakan dengan jelas. Perbedaan ini terlihat pada inti generatif yang berukuran lebih kecil
karena lebih terkondensasi sehingga terlihat lebih terang daripada inti vegetatif (Gambar 2E). Setelah stadium binukleat akhir, mikrospora akan menjadi polen matang. Polen matang ditunjukkan oleh kedua inti (inti vegetatif & inti generatif) yang berukuran kecil dan inti generatif berbentuk lonjong sempit (Gambar 2F). Polen matang dapat diisolasi pada semua bagian malai jantan kelapa sawit dengan spata terbuka sepenuhnya.
Gambar 1 Morfologi malai jantan dan spikelet kelapa sawit, (A) malai jantan dengan spata ¼ terbuka, (B) malai jantan setelah spata dibuka, dan (C) spikelet. Malai dan spikelet dibagi menjadi tiga bagian, yaitu pangkal (P), tengah (T), dan ujung (U). Garis skala = 1 cm untuk B-C.
Gambar 2 Stadia mikrospora kelapa sawit, (A)
uninukleat awal-tengah, (B)uninukleat
akhir, (C)binukleat awal, (D) binukleat
tengah, (E) binukleat akhir, dan (F)
polen matang. Inti generatif (ig) dan
inti vegetatif (iv).Garis skala = 30 µm
[image:4.595.323.512.229.421.2] [image:4.595.324.511.542.675.2]Tabel 1 Hubungan ciri morfologi malai bunga jantan dan stadia mikrospora kelapa sawit No. Ciri morfologi malai Posisi spikelet pada malai Posisi bunga pada spikelet Stadia mikrospora EMU (%) LU (%) EB (%) MB (%) LB (%) MP (%) 1. malai dengan spata 1/4 terbuka ujung
ujung 99 1 0 0 0 0
tengah 79 17 5 0 0 0
pangkal 56 3 12 2 0 0
tengah
ujung 99 1 0 0 0 0
tengah 76 14 7 3 0 0
pangkal 51 26 17 6 0 0
pangkal
ujung 91 7 1 0 0 0
tengah 47 34 16 3 0 0
pangkal 25 30 28 16 0 0
2.
malai dengan spata 1/2 terbuka
ujung
ujung 28 33 27 13 0 0
tengah 28 34 25 22 0 0
pangkal 20 21 38 19 2 0
tengah
ujung 0 42 40 18 0 0
tengah 0 39 43 19 0 0
pangkal 0 23 43 30 4 0
pangkal
ujung 0 17 50 33 0 0
tengah 0 6 54 36 3 0
pangkal 0 0 43 45 12 0
3.
malai dengan spata terbuka sepenuhnya
ujung
ujung 0 0 0 0 0 100
tengah 0 0 0 0 0 100
pangkal 0 0 0 0 0 100
tengah
ujung 0 0 0 0 0 100
tengah 0 0 0 0 0 100
pangkal 0 0 0 0 0 100
pangkal
ujung 0 0 0 0 0 100
tengah 0 0 0 0 0 100
pangkal 0 0 0 0 0 100
Keterangan : EMU = uninukleat awal-tengah MB = binukleat tengah LU = uninukleat akhir LB = binukleat akhir EB = binukleat awal MP = polen matang
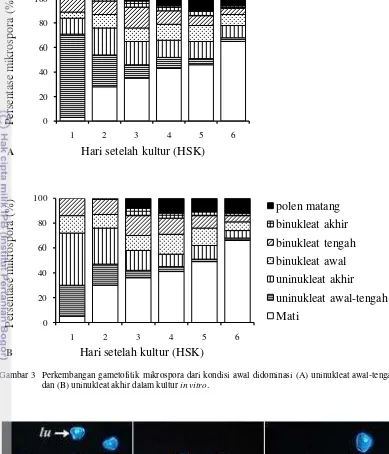
Perkembangan gametofitik mikrospora
Kultur mikrospora yang dimulai dari populasi mikrospora yang didominasi oleh fase uninukleat awal-tengah ataupun fase uninukleat akhir menunjukkan respon yang sama. Namun, terlihat bahwa kelompok kultur yang dimulai dengan mikrospora stadium uninukleat akhir mengalami perkembangan yang lebih stabil. Hal ini terlihat dari stabilitas pengurangan jumlah mikrospora stadium uninukleat akhir akibat kematian sel mikrospora pada kultur (Gambar 3B). Sedangkan pengurangan jumlah mikrospora stadium uninukleat awal-tengah akibat
kematian sel mikrospora pada kultur cenderung fluktuatif dan kematian sel sangat tinggi pada 1 HSK (Gambar 3A).
Gambar 3 Perkembangan gametofitik mikrospora dari kondisi awal didominasi (A) uninukleat awal-tengah
dan (B) uninukleat akhir dalam kultur in vitro.
Gambar 4 Perkembangan mikrospora dari kondisi awal didominasi uninukleat akhir dalam antera pada
kultur in vitro (A) 0 HSK, (B) 1 HSK, (C) 3 HSK, (D) 6 HSK, (E) 10 HSK, dan (F) 15 HSK.
Mikrospora stadium uninukleat akhir (lu), polen matang (mp), inti sel keluar (ik), dan sitoplasma
keluar (sk). Garis skala = 30 µm untuk A-F.
0 20 40 60 80 100
1 2 3 4 5 6
P
er
se
n
ta
se
m
ikr
o
spo
ra
(
%
)
Hari setelah kultur (HSK)
0 20 40 60 80 100
1 2 3 4 5 6
P
er
se
n
ta
se
m
ikr
o
spo
ra
(
%
)
Hari setelah kultur (HSK)
polen matang
binukleat akhir
binukleat tengah
binukleat awal
uninukleat akhir
uninukleat awal-tengah
Mati
[image:6.595.114.503.93.547.2] [image:6.595.105.513.511.711.2]Viabilitas dan tingkat perkecambahan polen
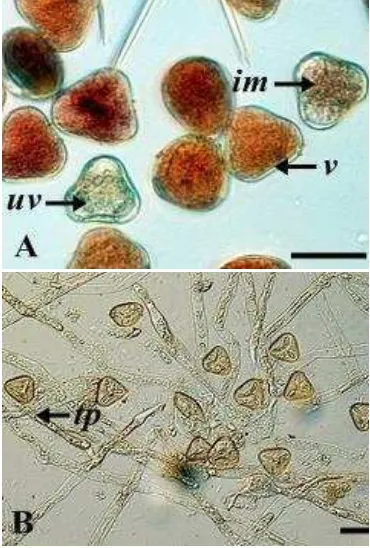
Hasil pengujian viabilitas polen kelapa sawit dengan menggunakan uji TTC yang mengindikasikan keberadaan enzim sitoplasmik diperoleh 95% polen viable, 1%
semi-viable, dan 4% polen unviable setelah empat jam pengujian (Gambar 7).
Polen yang berkecambah membentuk tabung polen dengan panjang rata-rata mencapai 190 µm setelah diinkubasi selama 24 jam (Gambar 5). Kapasitas germinasi polen kelapa sawit dapat mencapai 95% bila diinkubasi dalam waktu 12-14 jam (Gambar 6).
Gambar 5 Ukuran panjang tabung polen kelapa sawit dalam periode 24 jam inkubasi.
Gambar 6 Tingkat perkecambahan polen kelapa sawit dalam periode 24 jam inkubasi.
Gambar 7 Pengujian viabilitas dan tingkat
perkecambahan polen kelapa sawit. (A)
Uji viabilitas dengan TTC, polen viable
(v) berwarna merah, semi-viable (im)
berwarna merah muda, dan polen
unviable (uv) tidak berwarna; (B) Polen
yang dikecambahkan membentuk
tabung polen (tp).Garis skala = 30 µm.
PEMBAHASAN
Antera untuk induksi androgenesis kelapa sawit dengan populasi mikrospora stadium uninukleat akhir sampai binukleat awal lebih dari 50% dapat diisolasi dari bunga pada ujung spikelet yang terletak di tengah malai dengan spata ½ terbuka. Hal ini menunjukkan bahwa posisi bunga pada spikelet, posisi spikelet pada malai, dan ukuran membukanya spata malai jantan kelapa sawit dapat digunakan sebagai penanda stadia mikrospora. Ciri yang digunakan sebagai penanda stadia mikrospora berbeda-beda antar spesies tanaman, seperti warna ungu pada ujung antera tanaman cabai (Supena et al. 2006), ukuran kuncup bunga pada tanaman tembakau (Wahidah 2010), dan rasio panjang braktea terhadap panjang kuncup bunga pada tanaman kedelai (Budiana 2010).
r = 0.792 y = 9,479x
0 50 100 150 200 250
0 2 4 6 8 10 12 14 16 18 20 22 24
pa
nj
ang
t
abu
ng
po
le
n
(µ
m
)
waktu inkubasi (jam)
waktu inkubasi (jam)
0 2 4 6 8 10 12 14 16 18 20 22 24 0
20 40 60 80 100
r = 0.988
pe
rs
en
ta
se
pe
rke
ca
m
ba
ha
n
(
%
)
[image:7.595.324.509.86.360.2] [image:7.595.105.303.157.812.2]Penentuan stadia mikrospora dalam antera yang akan digunakan pada induksi androgenesis merupakan faktor penting. Berdasarkan penelitian yang dilakukan oleh Perera et al. (2008), stadium mikrospora yang paling responsif untuk induksi androgenesis pada Cocos nucifera adalah saat pembelahan mitosis pertama yaitu stadium uninukleat akhir sampai binukleat awal. Hal ini karena mikrospora pada stadium uninukleat akhir merupakan transisi antara fase G1 dan Sintesis (S). Fase G1 merupakan periode presintesis DNA, sedangkan fase S merupakan masa berlangsungnya sintesis DNA. Bila mikrospora diberi perlakuan stress ketika memasuki check point G1 yang berada di antara fase G1 dan S, maka akan menghasilkan proses seluler yang berbeda dari proses alaminya sehingga dapat dimanfaatkan untuk proses pembelokkan arah perkembangan gametofitik ke arah sporofitik untuk induksi androgenesis dalam upaya pengembangan teknologi haploid (Indrianto et al. 2001). Stadia mikrospora yang paling responsif untuk induksi androgenesis pada fase uninukleat akhir sampai binukleat awal juga dilaporkan untuk tanaman Hordeum vulgare (Maraschin et al. 2005), Brassica napus (Custers et al. 1994), dan Capsicum annuum (Supena et al. 2006; Supena & Custers 2011).
Perkembangan mikrospora dalam kultur antera dengan teknik media dua lapis dengan media Y3 yang mengandung maltosa 4% sebagai sumber karbon dapat mendukung perkembangan kelompok mikrospora uninukleat awal-tengah dan uninukleat akhir menjadi polen matang pada hari ketiga setelah kultur (3 HSK). Namun, tidak dapat dipastikan bahwa polen matang tersebut merupakan hasil perkembangan dari mikrospora stadium uninukleat awal-tengah ataupun uninukleat akhir. Adam et al. (2005) dalam penelitiannya menyebutkan bahwa waktu yang diperlukan oleh gamet jantan untuk berkembang dari fase tetrad menjadi polen matang in planta adalah 6 minggu. Berdasarkan hal ini, polen matang yang dijumpai pada 3 HSK tersebut kemungkinan dapat berasal dari perkembangan mikrospora stadia binukleat yang sudah ada pada 0 HSK. Septiani (2008) menyebutkan bahwa perkembangan mikrospora secara in vitro
dalam teknik kultur antera pada media dua lapis dengan media standar embriogenesis yang mengandung sukrosa 1.5% dan glukosa 0.5% hanya dapat mendukung perkembangan mikrospora dari tahap uninukleat akhir hingga
binukleat tengah. Hal ini karena banyaknya mikrospora yang mengalami plasmolisis pada 3 HSK.
Sel mikrospora mengalami kematian selama periode kultur. Bertambahnya tingkat kematian sel mulai dari 1 HSK sampai 15 HSK ditandai dengan keluarnya inti dan sitoplasma sel. Penggunaan maltosa dapat mempertahankan persentase sel hidup kurang lebih sebesar 40% pada 15 HSK. Sementara penggunaan sukrosa dan glukosa seperti yang telah disebutkan oleh Septiani (2008), hanya dapat mempertahankan persentase sel hidup kurang dari 35% pada 15 HSK. Kondisi tersebut menunjukkan bahwa penggunaan maltosa sebagai sumber karbon dalam media kultur lebih baik daripada sukrosa dan glukosa. Maltosa merupakan disakarida yang secara struktur lebih lambat dimetabolisme oleh sel. Sedangkan sukrosa secara struktur lebih mudah dihidrolisis dan glukosa merupakan monosakarida yang dapat langsung digunakan oleh sel untuk memperoleh ATP melalui respirasi, sehingga metabolismenya cepat yang menyebabkan terjadinya keracunan pada sel (Scott & Lyne 1994).
Pengujian viabilitas dengan metode pewarnaan menunjukkan hasil yang sama dengan metode pengujian tingkat perkecambahan, yaitu sebesar 95% polen
viable. Polen viable mampu mereduksi senyawa TTC yang mengindikasikan keberadaan enzim dehidrogenase yang dibutuhkan untuk respirasi sel. Polen viable
ini juga dikategorikan sebagai polen fertil karena mampu membentuk tabung kecambah. Sedangkan polen semi-viable dan unviable
dapat disebut sebagai polen steril karena kemampuan metabolisme yang rendah dan tidak mampu membentuk tabung kecambah (Asma 2008)
Pahan (2006) menyatakan bahwa pelepasan polen dari antera (antesis) kelapa sawit terjadi selama 2-3 hari setelah bunga mekar dan akan habis dalam lima hari, di mana viabilitas polen biasanya sudah sangat rendah. Menurut Myint (2010), viabilitas polen kelapa sawit dipengaruhi oleh berbagai faktor diantaranya kondisi nutrisi, genotipe, umur tanaman, dan faktor lingkungan.
Bunga kelapa sawit memiliki antera dengan stadia mikrospora yang beragam. Oleh karena itu, perlu dilakukan identifikasi mikrospora dengan parameter yang lebih tepat agar perkembangan gametofitik mikrospora dapat diamati secara lengkap dan lebih akurat. Parameter yang lebih spesifik seperti ciri morfologi kuncup bunga dan antera mungkin dapat digunakan untuk tujuan tersebut.
SIMPULAN
Ukuran membukanya spata pada malai jantan, kedudukan spikelet pada malai, dan posisi bunga pada spikelet kelapa sawit dapat digunakan sebagai penanda stadia mikrospora. Untuk mendapatkan populasi mikrospora yang didominasi fase uninukleat akhir untuk induksi androgenesis yaitu dari bunga pada ujung spikelet yang terletak di tengah malai dengan spata ½ terbuka. Polen kelapa sawit memiliki viabilitas sebesar 95% dengan waktu yang diperlukan untuk pengujian viabilitas dengan uji TTC cukup 4 jam, sedangkan untuk perkecambahan pada media yang mengandung 8% (b/v) larutan sukrosa dalam 15 ppm larutan asam borat perlu waktu 12-14 jam. Kultur mikrospora uninukleat akhir menunjukkan respon perkembangan gametogenesis yang lebih stabil daripada uninukleat awal-tengah. Penggunaan sumber karbon maltosa 4% dapat mendukung perkembangan kedua kelompok mikrospora tersebut menjadi polen matang dalam kultur in vitro.
DAFTAR PUSTAKA
[USDA] United States Department of Agriculture. 2011. World Agricultural Production. Washington D.C.: USDA. Adam H, Jouannic S, Escoute J, Duval Y,
Verdeil JL, Tregear JW. 2005. Reproductive developmental complexity in the african oil palm
(Elaeis guineensis, Arecaceae).
American J Bot 92: 1836-1852. Armendariz BHC, Oropeza C, Chan JL,
Maust B, Aguilar C de la CC, Sáenz L. 2006. Pollen fertility and female flower anatomy of micropropagated coconut palms. Rev Fitotec Mex 29: 373-378.
Asma BM. 2008. Determination of pollen viability, germination, ratios, and morphology of eight apricot genotypes.
African J Biotech 7: 4269-4273. Budiana. 2010. Induksi pembelahan sporofitik
mikrospora kedelai melalui kultur antera pada sistem media dua lapis [Tesis]. Bogor: Program Pascasarjana, Institut Pertanian Bogor.
Custers JBM, Cordewener JHG, Niillen Y, Dons HJM, Campagne MMVL. 1994. Temperature controls both gametophytic and sporophytic development in microspore cultures of
Brassica napus. Plant Cell Rep 13: 267-271.
Dunwell JM, Wilkinson MJ, Nelson S, Wening S, Sitorus AC, Mienanti D, Alfiko Y, Croxford AE, Ford CS, Foster BP, Caligari PDS. 2010. Production of haploids and doubled haploids in oil palm. BMC Plant Biol
10: 218-243.
Franchi GG, Nepi M, Dafni A, Pacini E. 2002. Partially hydrated pollen: taxonomic distribution, ecological, and evolutionary significance. Plant Systematics Evol 234: 211-227. Heslop-Harrison Y. 2000. Control gates and
micro-ecology: the pollen-stigma interaction in perspective. Ann Bot 85: 5-13.
Indrianto A, Barinova I, Touraev A, Bors EH. 2001. Tracking individual wheat microspores in vitro: identification of embryogenic microspores and body axis formation in embryo. Planta 212: 163-174.
Maraschin SF, Priester W, Spaink HP, Wang M. 2005. Androgenic switch: an example of plant embryogenesis from male gametophyte perspective. J Expt Bot 56: 1711-1726.
Marsolais AA, Swartz GS, Kasha KJ. 1984. The influence of anther cold pretreatments and donor plant genotypes on in vitro androgenesis in wheat (Triticum aestivum L.). Plant Cell Tissue Organ Culture 3: 69-79. Myint KA. 2010. Viability and Vigor of Dura,
ANTERA DAN VIABILITAS POLEN KELAPA SAWIT
(
Elaeis guineensis
Jacq.)
ITA PURNAMASARI
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
ITA PURNAMASARI. Perkembangan Mikrospora dalam Kultur Antera dan Viabilitas Polen Kelapa Sawit (Elaeis guineensis Jacq.). Dibimbing oleh ENCE DARMO JAYA SUPENA dan SUMARYONO.
Pengembangan teknologi haploid melalui induksi androgenesis secara in vitro merupakan alternatif yang banyak ditempuh untuk mendapatkan galur murni secara singkat. Penerapan teknologi ini pada kelapa sawit akan mempercepat pengembangan varietas hibrida untuk meningkatkan produktivitas. Namun sampai saat ini usaha tersebut belum dilaporkan berhasil. Hal ini erat kaitannya dengan fisiologi dan kemampuan sel mikrospora untuk berkembang dalam kondisi in vitro. Oleh karena itu, perkembangan gametofitik mikrospora dalam kultur antera dengan sistem media dua lapis serta viabilitas polen kelapa sawit perlu diamati sebagai langkah awal untuk mengembangkan teknik androgenesis. Ciri morfologi malai jantan diamati untuk menentukan stadia perkembangan mikrospora yang akan digunakan sebagai bahan untuk induksi androgenesis. Antera untuk induksi androgenesis kelapa sawit dengan populasi mikrospora stadium uninukleat akhir sampai binukleat awal lebih dari 50% dapat diisolasi dari bunga pada ujung spikelet yang terletak di tengah malai dengan spata ½ terbuka. Polen kelapa sawit memiliki viabilitas yang tinggi, yaitu sebesar 95% dengan waktu yang diperlukan untuk pengujian viabilitas melalui reduksi enzimatik trifenil tetrazolium klorida cukup 4 jam, sedangkan untuk perkecambahan dengan metode hanging drop perlu waktu 12-14 jam. Mikrospora uninukleat stadium akhir menunjukkan respon perkembangan gametogenesis yang lebih stabil daripada uninukleat awal-tengah pada kultur in vitro. Penggunaan sumber karbon maltosa 4% dalam media dapat mendukung perkembangan kedua kelompok mikrospora tersebut menjadi polen matang dalam kultur in vitro.
Kata kunci : kelapa sawit, polen, mikrospora, gametofitik, viabilitas, perkecambahan.
ABSTRACT
ITA PURNAMASARI. Microspore Development in Anther Culture and Pollen Viability of Oil Palm (Elaeis guineensis Jacq.). Supervised by ENCE DARMO JAYA SUPENA and SUMARYONO.
Development of haploid technology via induction of in vitro androgenesis is the most common approach to produce pure lines in a short period of time. Introduction of this technology on oil palm will speed up the development of hybrid variety to increase plant productivity. Unfortunately it has not been reported successful yet, in which could be influenced by the physiology and capability of microspores to develop at in vitro conditions. For these reason, gametophytic development of microspores of oil palm in a double layer medium along with the viability of pollen were observed as the first step to develop androgenesis technique. Morphology of male inflorescences was observed to determine the developmental phase of microspore used as the material for androgenesis induction. The anther for androgenesis induction with more than 50% microspore at late stage of uninucleat to early binucleat phase could be isolated from the upper part of spikelet located at the middle part of the male inflorescence with ½ part of spatha
was opened. Viability of oil palm pollen was up to 95%, in which the time needed for viability test with enzymatic reduction of triphenyl tetrazolium chloride was only 4 hours, and germination test with hanging drop method was 12-14 hours. The late uninucleat microspore showed better gametogenesis development response than the early-middle uninucleat microspore on in vitro culture. Maltose 4% as the carbon source in the medium can support the development of two groups of microspore to mature pollen on in vitro culture.
ANTERA DAN VIABILITAS POLEN KELAPA SAWIT
(
Elaeis guineensis
Jacq.)
ITA PURNAMASARI
Skripsi
sebagai salah satu syarat untuk memperoleh gelar
Sarjana Sains pada
Departemen Biologi
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
Kelapa Sawit (
Elaeis guineensis
Jacq.)
Nama : Ita Purnamasari
NIM : G34070042
Menyetujui,
Pembimbing I
Pembimbing II
Dr. Ir. Ence Darmo Jaya Supena, M.Si.
Ir. Sumaryono, M.Sc.
NIP. 19641002 198903 1 002
NIK. 110 700 258
Mengetahui,
Ketua Departemen Biologi
Fakultas Matematika dan Ilmu Pengetahuan Alam
Institut Pertanian Bogor
Dr. Ir. Ence Darmo Jaya Supena, M.Si.
NIP. 19641002 198903 1 002
Puji syukur penulis panjatkan kepada Allah SWT atas segala rahmat yang telah dilimpahkan-Nya sehingga saya dapat menyelesaikan penelitian yang berjudul “Perkembangan Mikrospora dalam Kultur Antera dan Viabilitas Polen Kelapa Sawit (Elaeis guineensis Jacq.)”.
Penelitian dilakukan mulai bulan Februari sampai dengan Juli 2011 di Laboratorium Kultur Jaringan Tanaman, Pusat Penelitian Sumberdaya Hayati dan Bioteknologi (PPSHB)-IPB serta Laboratorium Terpadu, Departemen Biologi, FMIPA-IPB.
Terimakasih saya ucapkan kepada berbagai pihak yang telah membantu dalam penelitian ini, diantaranya adalah:
1. Dr. Ir. Ence Darmo Jaya Supena, M.Si. selaku dosen pembimbing yang telah memberikan pendanaan pada penelitian ini, serta selalu memberikan saran dan motivasi dalam penyusunan karya ilmiah ini.
2. Ir. Sumaryono, M.Sc. yang telah membimbing dan menyediakan bahan bunga kelapa sawit dari kebun koleksi Balai Penelitian Bioteknologi Perkebunan Bogor.
3. Dr. Ir. Dorly, M.Si. selaku dosen penguji yang telah memberikan saran terkait penyusunan karya ilmiah ini.
4. Kedua orang tua saya untuk setiap tetes keringat, pengorbanan, dan dukungannya. 5. Ernih Eryanti dan Acih Yuningsih yang telah menjadi kakak yang penuh perhatian. 6. Ibu Rini dan rekan atas bantuannya dalam mengusahakan biaya masuk kuliah. 7. Eka Tjipta Foundation yang telah memberikan bantuan beasiswa.
8. Marinda Sari Sofiyana, Anggianing Tyas Rahayu, Maulida Mulya Rahmawati, dan Seztifa Miyasyiwi atas semangat dan motivasi yang diberikan.
9. Rekan-rekan Biologi angkatan 44.
10.Pak Imron, teh Nia Dahniar, teh Sarah, pak Asep, pak Mulya, pak Yanto, mba Pepi, pak Edi, pak Agus, Ibu Retno, Ibu Eti, dan semua pihak yang telah membantu.
Kritik dan saran yang membangun saya harapkan agar karya ilmiah ini dapat bermanfaat bagi masyarakat dan perkembangan ilmu pengetahuan.
Bogor, Januari 2012
Penulis dilahirkan di Kabupaten Bogor-Jawa Barat pada tanggal 2 Juli 1989 dari pasangan keluarga petani bernama Bapak Inin dan Ibu Iyah. Penulis merupakan anak ke empat dari empat bersaudara. Pada tahun 2007 penulis lulus dari SMAN 5 Bogor, dan diterima di Departemen Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor melalui jalur undangan PMDK, serta mendapatkan beasiswa S1 dengan pembiayaan penuh selama delapan semester dari Eka Tjipta Foundation.
Selama mengikuti perkuliahan, penulis pernah menjadi asisten praktikum Biologi Dasar TPB, Botani Umum D3, Biologi Alga dan Lumut S1, Genetika Dasar S1, dan staf pengajar mata pelajaran Biologi di Bimbingan Tes Alumni (BTA) group cabang Bogor. Selain itu penulis juga aktif dalam Lembaga Dakwah Kampus (LDK) DKM Al-Hurriyah sebagai staf divisi soskemas pada periode 2007/2008.
Prestasi yang diraih oleh penulis selama mengikuti perkuliahan diantaranya adalah: menjadi duta IPB dalam ON-MIPA 2011 bidang Biologi, Mewakili wilayah kopertis 3 (Jabodetabek-Banten) dalam MIPA 2011 bidang Biologi, meraih medali perunggu (Juara ke-3) dalam ON-MIPA tahun 2011 bidang Biologi di Bandung, mendapat penghargaan dari Kementerian Pendidikan Nasional-Institut Pertanian Bogor sebagai mahasiswa berprestasi di bidang ekstra kurikuler tahun 2011, lolos dalam seleksi pramentoring Intensive-Student Technopreneurship Program (ISTEP) 2010, menjadi finalis Lomba Karya Tulis Ilmiah (LKTI) tingkat Nasional di UIN Malang (2009), dan didanai oleh DIKTI dalam Program Kreativitas Mahasiswa Bidang
Penelitian (PKMP) dengan judul “Uji Aktivitas Ekstrak Buah Sirih (Piper bettle) Asal Nusa
guineensis Jacq.) Pollen [tesis]. Selangor: Fakultas Pertanian, Universiti Putra Malaysia.
Pahan I. 2006. Panduan Lengkap Kelapa Sawit : Manajemen Agribisnis dari Hulu hingga Hilir. Jakarta: Penebar Swadaya.
Perera PIP, Hocher V, Verdeil JL, Bandupriya, Yakandawala DMD, Weerakoon LK. 2008. Androgenic potential in coconut (Cocos nucifera
L.). Plant Cell Tiss Org Cult 92: 293-302.
Reinert J, Bajaj YPS, Heberle E. 1975. Induction of haploid tobacco plant from isolated pollen, Brief report.
Protoplasma 84: 191-196.
Scott P, Lyne LR. 1994. Initiation of embryogenesis from cultured barley microspore: a further investigation into the toxic effects of sucrose and glucose. Plant Cell Tiss Org Cult 37: 61-65.
Septiani P. 2008. Perkembangan mikrospora dan induksi pembelahan sporofitik pada kultur antera kelapa sawit (Elaeis guineensis Jacq.) [Skripsi]. Bogor: Fakultas Matematika dan Ilmu
Pengetahuan Alam, Institut Pertanian Bogor.
Supena EDJ, Suharsono S, Jacobsen E, Custers JBM. 2006. Successful development of shed-microspore culture protocol for doubled haploid production in Indonesian hot peppers (Capsicum annuum L.). Plant Cell Rep
25: 1-10.
Supena EDJ, Custers JBM. 2011. Refinement of shed-microspore culture protocol to increase normal embryos production in hot pepper (Capsicum annuum L.). Sci Hortic 130: 769-774.
Teixeira JB, Sondahl MR, Nakamura T, Kirby EG. 1995. Establishment of oil palm cell suspensions and plant regeneration. Plant Cell Tiss Org Cult
40: 105-111.
Tirtoboma. 1997. Culturability of oil palm microspore cells in relation to anther maturity pp.42-47. In: Proc BTIG Workshop on Oil Palm Improvement through Biotechnology. Biotec Res Unit for Estate Crops, Bogor.