ADSORPSI ION Cr(III) DAN Cr(VI) MENGGUNAKAN
BENTONIT TERMODIFIKASI OKSIDA BESI
NIATI PATRI
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
ABSTRAK
NIATI PATRI. Adsorpsi Ion Cr(III) dan Cr(VI) Menggunakan Bentonit Alam
Termodifikasi Oksida Besi. Dibimbing oleh ETI ROHAETI AZIS dan BETTY
MARITA SOEBRATA.
Spesiasi Cr(III) dan Cr(VI) penting dilakukan karena keduanya memiliki
sifat yang sangat berlainan. Kromium (VI) bersifat toksik sementara Cr(III)
merupakan bentuk yang diperlukan tubuh dalam metabolisme. Penelitian ini
bertujuan memodifikasi bentonit alam asal Cigudeg, Bogor menggunakan natrium
dan oksida besi guna meningkatkan kinerjanya sebagai adsorben bagi spesiasi
Cr(VI) dan Cr(III). Hasil penelitian menunjukkan kapasitas adsorpsi terhadap
Cr(III) dan Cr(VI) Na-bentonit dan bentonit termodifikasi meningkat
dibandingkan dengan bentonit alam. Kapasitas adsorpsi bentonit alam,
Na-bentonit, dan bentonit termodifikasi terhadap Cr(III) berturut-turut sebesar 4.49,
6.08, dan 8.17 mg/g adsorben, sedangkan terhadap Cr(VI) berturut-turut sebesar
4.14, 4.97, dan 5.85 mg/g adsorben. Adsorpsi Cr(III) dan Cr(VI) oleh ketiga
bentonit mengikuti pola isoterm Langmuir. Karakterisasi menggunakan
difraktometer sinar-X menunjukkan pergeseran, pelebaran, dan perubahan jumlah
puncak pada difraktogram Na-bentonit dan bentonit termodifikasi dibandingkan
bentonit alam. Spesiasi menggunakan kolom adsorpsi terkendala pada rendahnya
laju alir.
Kata kunci: adsorpsi, bentonit, kromium, oksida besi.
ABSTRACT
NIATI PATRI. Adsorption of Cr(III) and Cr(VI) Ion Using Modified Natural
Bentonite by Iron Oxide. Supervised by ETI ROHAETI AZIS and BETTY
MARITA SOEBRATA.
Speciation of trivalent and hexavalent chromiums is important to do because
both have very different characteristics.
Hexavalent chromium is toxic meanwhile
trivalent chromium is needed in metabolism. The aim of this study is
to modify
natural bentonite from Cigudeg, Bogor with sodium and iron oxide to increase its
performance as an adsorbent for speciation of Cr (VI) and Cr (III). The result
showed that the adsorption capacity of Cr(III) and Cr(VI) using Na-bentonite and
modified bentonite were higher than that of natural bentonite. Adsorption capacity
of Cr(III) for natural bentonite, Na-bentonite, and modified bentonite were 4.49,
6.08, and 8.17 mg/g adsorbent, meanwhile adsorption capacity of Cr(VI) for
natural bentonite, Na-bentonite, and modified bentonite were 4.14, 4.97, and 5.85
mg/g adsorbent, respectively. Adsorption of Cr(III) and Cr(VI) by the three types
of bentonite followed the Langmuir isotherm pattern. Characterization using
X-ray diffractometer showed shifting, broadening, and changing in the number of
peaks in the diffractogram of Na-bentonite and modified bentonite compared to
that of natural bentonite. Speciation using adsorption column is constrained by the
low flow rate.
ADSORPSI ION Cr(III) DAN Cr(VI) MENGGUNAKAN
BENTONIT TERMODIFIKASI OKSIDA BESI
NIATI PATRI
Skripsi
sebagai salah satu syarat untuk memperoleh gelar
Sarjana Sains pada
Departemen Kimia
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
Judul : Adsorpsi Ion Cr(III) dan Cr(VI) Menggunakan Bentonit Alam
Termodifikasi Oksida Besi
Nama : Niati Patri
NIM : G44070003
Disetujui
Pembimbing I, Pembimbing II,
Dr Dra Eti Rohaeti Azis, MS Betty Marita Soebrata, SSi, MSi
NIP. 19600807 198703 2 001
NIP. 19630621 198703 2 013
Diketahui
Ketua Departemen,
Prof Dr Ir Tun Tedja Irawadi, MS
NIP. 19501227 197603 2002
PRAKATA
Alhamdulillah, puji dan syukur penulis panjatkan ke hadirat Allah SWT
karena atas berkat dan hidayah-Nya penulis dapat menyelesaikan karya ilmiah ini.
Karya ilmiah ini berjudul
Adsorpsi Ion Cr(III) dan Cr(VI) Menggunakan
Bentonit Alam Termodifikasi Oksida Besi, yang dilaksanakan pada bulan Juli
2011 sampai dengan Februari 2012 bertempat di laboratorium Kimia Analitik,
Departemen Kimia, Institut Pertanian Bogor.
Penulis mengucapkan terima kasih kepada Ibu Dr. Eti Rohaeti Azis, MS
dan Ibu Betty Marita Soebrata SSi, MSi selaku pembimbing yang telah banyak
memberikan motivasi, dorongan, dan pengarahan kepada penulis. Ucapan terima
kasih juga disampaikan kepada kedua orang tua, adik, keluarga besar di Padang,
keluarga di Pekanbaru, dan keluarga di Cileungsi atas kasih sayang, doa, dan
dorongan baik secara moral maupun material. Penulis juga mengucapkan terima
kasih kepada pemerintah kabupaten Tanah Datar, Wali Nagari Salimpaung, dan
Pengurus Masjid Raya Salimpaung atas bantuan biaya pendidikan yang diberikan.
Ucapan terima kasih juga disampaikan penulis kepada Forum Eka Tjipta
Foundation yang telah memberikan beasiswa selama 4 tahun. Ucapan terima kasih
tak lupa disampaikan kepada Ibu Iis Subariyah dan suami beserta Pak Mulyadi
yang telah berkenan membantu menyediakan sampel bentonit. Tidak lupa penulis
ucapkan terima kasih pula kepada Ibu Nunung, Pak Eman, dan pegawai kimia
yang tidak disebutkan namanya satu per satu. Ucapan terima kasih juga
disampaikan kepada teman-teman satu bimbingan (Zurida, Mutiara, Ichsan, Pita)
yang selalu memberikan bantuan, dorongan, dan doa.
Semoga karya ilmiah ini bermanfaat bagi semua orang untuk dapat
memajukan ilmu pengetahuan.
Bogor, Oktober 2012
RIWAYAT HIDUP
Penulis dilahirkan di Salimpaung pada tanggal 20 Mei 1989 sebagai anak
pertama dari pasangan Bapak Budiar dan Ibu Nurhayati. Penulis memiliki seorang
adik yang bernama Suci Maharani. Tahun 2007 penulis lulus dari SMA Negeri 1
Salimpaung dan pada tahun yang sama masuk ke Departemen Kimia, Fakultas
Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor, melalui jalur
Undangan Seleksi Masuk IPB (USMI). Tahun 2010 penulis mengikuti kegiatan
praktik lapangan di Pusat Penelitian dan Pengembangan Hasil Hutan, dengan
judul Bioetanol dari Nira Nipah Sterilisasi.
DAFTAR ISI
Halaman
DAFTAR TABEL ... ii
DAFTAR GAMBAR ... ii
DAFTAR LAMPIRAN ... iii
PENDAHULUAN ... 1
TINJAUAN PUSTAKA
Bentonit ... 2
Oksida Besi ... 2
Adsorpsi ... 2
Kromium ... 3
Isoterm Adsorpsi... 4
Ekstraksi Fase Padat ... 4
BAHAN DAN METODE
Bahan dan Alat ... 5
Metode ... 5
HASIL DAN PEMBAHASAN
Kadar Air Bentonit ... 8
Kadar Besi Bentonit Termodifikasi Oksida Besi ... 8
Keasaman Bentonit ... 9
pH Optimum Adsorpsi Cr(VI) dan Cr(III) ... 10
Waktu Kontak Optimum Adsorpsi Cr(VI) dan Cr(III) ... 11
Kapasitas dan Pola Isoterm Adsorpsi Cr(VI) dan Cr(III) ... 12
Kolom Adsorpsi ... 14
Analisis
X-ray Diffractometer
... 14
SIMPULAN DAN SARAN ... 16
DAFTAR PUSTAKA ... 16
DAFTAR TABEL
Halaman
1 Nilai ambang batas Cr(VI) dalam air ... 3
2 Kapasitas tukar kation bentonit alam, Na-bentonit, dan bentonit
termodifikasi oksida besi ... 9
3 Nilai linearitas adsorpsi Cr(VI) dan Cr(III) ... 13
4 Nilai Ea adsorpsi Cr(III) dan Cr(VI) ... 13
5 Tiga puncak tertinggi difraktogram sinar-X bentonit alam, Na-bentonit,
dan bentonit termodifikasi oksida besi ... 15
DAFTAR GAMBAR
Halaman
1 Struktur monmorilonit. ... 2
2 Pilarisasi oksida besi pada bentonit. ... 2
3 Reaksi antara DPC dan kromium heksavalen ... 3
4 Pengaruh pH terhadap kapasitas adsorpsi Cr(III) dan Cr(VI) bentonit
alam (a), Na-bentonit (b), dan bentonit termodifikasi oksida besi (c). ... 11
5 Pengaruh waktu kontak terhadap kapasitas adsorpsi Cr(VI) dan Cr(III)
bentonit alam (a), Na-bentonit (b), dan bentonit termodifikasi oksida
besi (c) ... 12
6 Pengaruh konsentrasi awal larutan terhadap kapasitas adsorpsi Cr(VI)
dan Cr(III) bentonit alam (a), Na-bentonit (b), dan bentonit termodifikasi
oksidabesi (c). ... 13
7 Difraktogram sinar-X bentonit alam (biru), Na-bentonit (merah), bentonit
DAFTAR LAMPIRAN
Halaman
1 Diagram alir penelitian ... 20
2 Perhitungan pembuatan larutan stok Cr(III) dan Cr(VI) ... 21
3 Penentuan kadar air sampel sebelum dan setelah preparasi ... 22
4 Pengukuran kadar besi bentonit termodifikasi oksida besi ... 22
5 Keasaman bentonit alam, Na-bentonit, dan bentonit termodifikasi oksida
besi ... 24
6 Kurva standar larutan Cr(III) dan Cr(VI) ... 26
7 Penentuan pH optimum bentonit alam ... 27
8 Penentuan pH optimum Na-bentonit ... 27
9 Penentuan pH optimum bentonit termodifikasi oksida besi ... 28
10 Penentuan waktu kontak optimum ... 30
11 Isoterrm adsorpsi Cr(VI) ... 31
12 Isoterm adsorpsi Cr(III)... 33
13 Parameter isoterm adsorpsi Cr(VI) dan Cr(III) ... 35
14 Hasil analisis kualitatif difraksi sinar-X dan nilai kristalinitas bentonit
alam (a), Na-bentonit (b), dan bentonit termodifikasi oksida besi (c) ... 36
15 Data PCPDFWIN montmorilonit (a), kuarsa (b), dan hematit (c) ... 39
PENDAHULUAN
Kromium merupakan salah satu logam yang penting diawasi keberadaannya di lingkungan karena dapat membahayakan kesehatan. Kromium heksavalen merupakan bentuk kromium yang memiliki tingkat toksisitas yang tinggi. Paparan kromium rerata per hari dari udara, air, dan makanan
berturut-turut sebesar 0.01−0.03 µg, 2.0 µg/L, dan 60.0
µg. Akumulasi kromium dalam tubuh dapat menimbulkan berbagai penyakit di antaranya kerusakan hati, ginjal, saluran pernapasan, saluran pencernaan, dan kanker paru-paru. Sumber pencemar kromium dapat berasal dari limbah industri pelapisan logam, penghambat korosi besi, penyamakan kulit, cat, tekstil, dan bahan pengawet kayu (Gode & Moral 2008).
Kromium trivalen merupakan bentuk kromium yang dibutuhkan oleh tubuh, karena termasuk logam esensial dan bersama-sama dengan insulin menjaga kadar gula dalam darah. Selain itu, kromium trivalen juga berperan dalam metabolisme karbohidrat, protein, dan lemak (USEPA 1998). Namun, tidak demikian dengan kromium heksavalen, kromium bentuk ini memiliki tingkat toksisitas jauh lebih tinggi dibandingkan dengan kromium trivalen. Konsentrasi Cr(III) di atas 5 mg/L bersifat toksik bagi organisme air, sedangkan konsentrasi Cr(VI) di atas 0.05 mg/L bersifat toksik bagi mamalia dan organisme air (Goswani & Ghosh 2005). Mengingat hal ini, maka penting untuk membedakan dalam pengukurannya bentuk kromium heksavalen dari kromium trivalen.
Berbagai peraturan yang membatasi keberadaan kromium di lingkungan telah dikeluarkan oleh lembaga yang berwenang, seperti Peraturan Pemerintah Nomor 82 Tahun 2001 tentang pengelolaan kualitas air dan pengendalian pencemaran air, konsentrasi kromium heksavalen yang diperbolehkan untuk golongan I, II, dan III tidak boleh lebih dari 0.05 ppm. Menurut USEPA (1998), konsentrasi ambang kromium total untuk air minum adalah 50 µg/L.
Pengukuran kromium dalam kadar yang sangat kecil ini tentu saja memerlukan peralatan dengan limit deteksi rendah. Peralatan yang umumnya tersedia untuk pengukuran konsentrasi logam, termasuk kromium, seperti spektrofotometer serapan atom (SSA) memiliki limit deteksi lebih tinggi dari nilai ambang kromium yang diperbolehkan ada pada air minum. Kisaran konsentrasi pengukuran kromium
menggunakan SSA dengan nyala sebesar 2−8 ppm. Kisaran pengukuran kromium heksavalen menggunakan spektrofotometer sinar tampak sebagai kompleks
kromium-difenilkarbazida sebesar 0.1−1.5 ppm.
Metode ekstraksi merupakan solusi meningkatkan konsentrasi analit yang lebih rendah dari limit deteksi alat. Metode ekstraksi fase padat atau solid phase extraction (SPE) telah banyak dikembangkan untuk pemisahan, perolehan kembali, dan pemekatan senyawa target (Poole 2003). Metode ini lebih efisien dan dapat menanggulangi kelemahan ekstraksi pelarut karena membutuhkan pelarut organik yang lebih sedikit. Bahan yang digunakan sebagai pengekstrak fase padat (adsorben) harus bersifat selektif, yaitu memiliki kemampuan untuk memisahkan spesi-spesi sasaran melalui prinsip penukar ion (Trisunaryanti et al. 2005). Beberapa material padatan yang dapat digunakan sebagai adsorben di antaranya arang aktif, zeolit, dan bentonit.
Bentonit merupakan sumber daya mineral yang melimpah di Indonesia (380 juta ton) dan belum dimanfaatkan secara optimal (Syuhada et al. 2009). Aplikasi bentonit yang banyak dikaji pada saat ini adalah sebagai adsorben. Permukaan bentonit bermuatan negatif, sehingga mampu mengadsorpsi ion-ion logam yang bermuatan positif, tetapi kemampuannya dalam mengadsorpsi anion sangat rendah. Oleh karena itu, bentonit perlu dimodifikasi sebelum digunakan sebagai adsorben kromium. Kromium heksavalen terdapat sebagai bentuk anion, sementara kromium trivalen umumnya sebagai kation. Salah satu cara memodifikasi bentonit adalah dengan pilarisasi, yaitu menginterkalasikan suatu agen pemilar ke dalam antarlapis silikat pada bentonit, sehingga daya kerjanya meningkat karena mengembangnya ruang antarlapis dalam strukturnya sehingga mampu mengakomodasi kation-kation dalam jumlah besar (Wijaya et al. 2005).
Cr(VI) lebih lama dibandingkan dengan Cr(III), yaitu berturut-turut selama 48 dan 6 jam. Hal ini menunjukkan adanya laju adsorpsi yang berbeda antara kromium heksavalen dan kromium trivalen oleh monmorilonit termodifikasi oksida besi, sehingga memungkinkan untuk memisahkan (spesiasi) keduanya melalui pengaturan laju alirnya menggunakan kolom adsorpsi.
Penelitian ini bertujuan memodifikasi bentonit alam asal Cigudeg, Bogor menggunakan natrium dan oksida besi guna meningkatkan kinerjanya sebagai adsorben bagi spesiasi Cr(VI) dan Cr(III).
TINJAUAN PUSTAKA
Bentonit
Bentonit merupakan istilah yang digunakan di dalam dunia perdagangan untuk sejenis batu liat yang mengandung lebih dari 85% monmorilonit. Bentonit mempunyai rumus kimia Al2O3.4SiO2.xH2O, yaitu
senyawa silikat dan alumina yang mengandung air terikat secara kimia (Wijaya et al. 2004).Bentonit mempunyai warna dasar putih dengan sedikit kecokelatan, kemerahan, atau kehijauan bergantung pada jenis dan jumlah fragmen mineralnya. Bentonit bersifat lunak, ringan, mudah pecah, terasa seperti sabun, mudah menyerap air, dan dapat melakukan pertukaran ion. Bobot jenis bentonit berkisar antara 2.4 dan 2.8 g/mL. Ukuran partikel koloid bentonit sangat kecil dan mempunyai kapasitas tukar ion yang tinggi terutama ditempati oleh ion-ion Ca2+
dan Mg2+ (Sukandarrumidi 1999)
Bentonit dengan kandungan utamanya monmorilonit (Gambar 1), terdiri atas tiga lembar, yaitu satu lembar alumina (AlO6)
berbentuk oktahedral yang diapit oleh dua lembar silika (SiO4) yang berbentuk
tetrahedral. Di antara lapisan-lapisan silikat tersebut terdapat ruang antarlapisan yang berisi kation monovalen maupun bivalen, seperti Na+, Ca2+ , dan Mg2+ (Syuhada et al.
2009).
Gambar 1 Struktur monmorilonit.
Oksida Besi
Oksida besi termasuk salah satu mineral dalam tanah. Oksida besi memiliki bentuk kristal yang sedikit kompleks dan dapat digunakan sebagai agen pemilar dalam proses pilarisasi monmorilonit. Hal ini dilakukan karena berbagai tingkat oksidasi besi lebih reversibel dibandingkan dengan pertukaran elektron yang terjadi pada nitrogen, sulfur, atau karbon (Widihati 2002). Oksida besi memiliki empat fase, yaitu magnetit (Fe3O4), magemit (γ-Fe2O3), hematit (α-Fe2O3), dan
goetit (FeO(OH)) (Gong et al. 2009). Oksida besi (hematit) mengandung 60−75% besi. Hematit merupakan mineral berwarna merah yang terdapat dalam jumlah banyak pada batuan dan tanah (Teja & Koh 2009).
Pilarisasi oksida besi pada bentonit (Gambar 2) terjadi melalui pertukaran polikation besi dengan kation dapat tukar yang berada di antara lembaran dalam struktur bentonit. Pilarisasi dengan oksida besi mendorong terbentuknya pori dengan struktur dua dimensi. Pembentukan pilar oksida besi juga dapat menghubungkan antar satu lembaran tetrahedral-oktahedral-tetrahedral dengan lembaran lainnya (Wijaya et al. 2004). Setelah dilakukan pemilaran ke dalam ruang antarlapisan bentonit tersebut, dilanjutkan dengan kalsinasi untuk menghasilkan oksida logam yang stabil (Yuliani et al. 2010).
Gambar 2 Pilarisasi oksida besi pada bentonit.
Adsorpsi
dijerap dialirkan ke dalam kolom. Larutan yang dialirkan ke dalam kolom disebut influen dan larutan yang keluar dari kolom, yang merupakan sisa zat yang tidak terjerap disebut efluen.
Mekanisme penjerapan dapat dibedakan menjadi dua, yaitu adsorpsi secara fisika (fisisorpsi) dan secara kimia (kemisorpsi). Pada proses fisisorpsi, interaksi yang terjadi antara adsorbat dan adsorben adalah gaya Van der Waals. Molekul yang terikat lebih lemah dan energi yang dilepaskan relatif rendah, sekitar 20 kJ/mol. Di sisi lain, pada proses kemisorpsi, interaksi adsorbat dan adsorben tersedia melalui pembentukan ikatan yang lebih kuat. Kemisorpsi terjadi diawali dengan adsorpsi fisik, yaitu partikel-partikel adsorbat mendekat ke permukaan adsorben melalui gaya Van der Waals atau melalui ikatan hidrogen, kemudian diikuti oleh adsorpsi kimia berupa pembentukan ikatan yang lebih kuat (ikatan kovalen), dengan energi yang dilepaskan relatif tinggi, sekitar 100 kJ/mol (Atkins 1999).
Kromium
Kromium merupakan salah satu logam berat yang termasuk dalam unsur transisi golongan VIB periode 4. Kromium mempunyai nomor atom 24 dan nomor massa 51,996 sma, berwarna putih dengan massa jenis 7,9 g/cm3 dan memiliki titik didih 2658 ⁰C dan titk leleh 1875 ⁰C. Kromium dapat membentuk tiga macam senyawa yang masing-masing berasal dari proses oksidasi CrO (kromium oksida), yaitu +2 disebut kromium divalen, +3 disebut kromium trivalen, dan +6 disebut kromium heksavalen (Kusnoputranto 1996).
Karakteristik kromium (III) dan kromium (VI) sangat berbeda. Kromium (III) bersifat tidak beracun dalam dosis tertentu dan menjadi unsur esensial yang dibutuhkan tubuh untuk mengontrol kadar gula dalam darah. Senyawa Cr(III) bersifat toksik bagi organisme air jika konsentrasinya di atas 5.00 mg/L (Goswani & Ghosh 2005). Di sisi lain, Cr(VI) dalam konsentrasi yang rendah dapat menyebabkan iritasi kuat dan karsinogen. Nilai ambang kromium heksavalen dalam air dapat dilihat pada Tabel 1.
Tabel 1 Nilai ambang Cr(VI) dalam air Parameter Golongan [Cr] (mg/L)
Cr(VI) I 0.05 Cr(VI) II 0.05 Cr(VI) III 0.05 Cr(VI) IV 0.10
Sumber: PP No. 82 Tahun 2001 tentang pengelolaan kualitas dan pengendalian pencemaran air.
Tabel 1 menunjukkan bahwa nilai ambang Cr(VI) pada air diklasifikasikan ke dalam 4 golongan berdasarkan penggunaannya dalam kehidupan sehari-hari. Golongan I merupakan air yang digunakan sebagai air minum langsung, air golongan II merupakan air yang digunakan sebagai air baku minum, air kelas III merupakan air yang digunakan untuk keperluan perikanan dan peternakan, dan air golongan IV merupakan air yang dimanfaatkan untuk keperluan pertanian, usaha perkotaan, industri, dan pembangkit tenaga listrik.
Metode yang umum digunakan untuk pengukuran kadar Cr(VI) adalah spektroskopi sinar tampak dengan mengukur warna ungu kemerahan yang merupakan hasil reaksi antara Cr(VI) dan pereaksi 1,5-difenilkarbazida (DPC), yang memiliki rumus molekul (C6H5NHNH)2CO. Reaksi Cr(VI)
dengan DPC (Gambar 3) sangat sensitif, absorptivitas molarnya kira-kira 4.00x104 L
g-1 cm-1 (Clesceri et al. 2005).
Gambar 3 Reaksi antara DPC dan kromium heksavalen (Vogel 1990).
KMnO4, K2S2O8, dan HClO4. Selain itu,
Noroozifar & Khorasani (2003) menyatakan bahwa serium juga efektif untuk mengoksidasi kromium trivalen menjadi kromium heksavalen. Kemampuan serium dalam mengkonversi kromium trivalen menjadi kromium heksavalen sebesar 100.01% (Wijayanti 2005), nilai ini lebih baik jika dibandingkan dengan KMnO4 yang mampu
mengkonversi sebesar 91,00% (Martha 2004).
Isoterm Adsorpsi
Isoterm adsorpsi merupakan hubungan yang menunjukkan distribusi fase teradsorpsi pada permukaan adsorben dengan fase meruah saat kesetimbangan pada suhu tertentu. Isoterm yang umum digunakan, antara lain isoterm Langmuir, Freundlich, dan Dubinin-Raduskevich. Isoterm Langmuir dipelajari untuk menggambarkan pembatasan tapak aktif adsorpsi dengan asumsi bahwa tapak aktif adsorben bersifat homogen dan memiliki energi yang sama dalam mengadsorpsi adsorbat (Atkins 1999). Persamaan isoterm adsorpsi Langmuir dituliskan sebagai berikut:
Ce/Qe = 1/ Kl Qm + Ce/Qm
Isoterm adsorpsi Freundlich didasarkan asumsi bahwa adsorben memiliki permukaan yang bersifat heterogen. Tiap tapak aktif memiliki energi yang berbeda-beda, sehingga memiliki potensi adsorpsi yang berbeda-beda pula (Atkins 1999). Persamaan isoterm adsorpsi Freundlich dituliskan sebagai berikut:
Log Qe = log Kf + 1/n log Ce
Isoterm Dubinin-Raduskevich digunakan untuk mengetahui mekanisme adsorpsi. Teori ini dapat membedakan antara adsorpsi secara fisika dan kimia berdasarkan nilai energi adsorpsi yang didapat (Chen &Chen 2009). Persamaan isoterm Dubinin-Raduskevich, adalah:
Ln Qe = ln QDR + K ε2
Nilai Ce merupakan konsentrasi kesetimbangan adsorbat dalam larutan setelah adsorpsi (mg/L). Qe adalah kapasitas adorpsi (mg/g), Qm (mg/g), KL (mg/g), dan QDR
(mg/g) merupakan kapasitas adsorpsi maksimum pada persamaan isoterm Langmuir, Freundlich, dan Dubinin-Raduskevich, secara berturut-turut.
Persamaan isoterm Dubinin-Raduskevich merupakan hubungan antara ε2 sebagai sumbu x dan ln Qe sebagai sumbu y. ε merupakan potensial polanyi yang dapat ditentukan dengan persamaan berikut ini:
ε = RT ln (1 + 1/Ce)
dimana R merupakan konstanta gas ideal (8.3143 J/K.mol) dan T merupakan suhu kontak dalam Kelvin. Energi adsorpsi (Ea)
dapat ditentukan menggunakan persamaan isoterm Dubinin-Raduskevich dengan menyubstitusi konstanta Dubibin-Raduskevich K (kJ2/mol2) ke dalam persamaan berikut ini:
Ea = (-2K)-0.5
Berdasarkan nilai Ea yang diperoleh maka
dapat diketahui mekanisme adsorpsinya. Jika nilai Ea lebih kecil dari 8 kJ/mol diasumsikan
proses adsorpsi yang terjadi merupakan adsorpsi fisika, sedangkan jika nilai Ea lebih
besar dari 8 kJ/mol diasumsikan proses adsorpsi yang terjadi merupakan adsorpsi kimia (Chen & Chen 2009).
Ekstraksi Fase Padat
Ekstraksi merupakan suatu proses pengambilan senyawa target dari suatu bahan dengan menggunakan pengekstrak tertentu. Ekstraksi dapat dilakukan melalui ekstraksi fase padat atau solid phase extraction (SPE). Ekstraksi fase padat telah banyak digunakan untuk teknik pemisahan analit dari komponen lain penyusun sampel (Ferreira et al. 2007). Tujuannya antara lain pemekatan konsentrasi senyawa target.
Pemekatan konsentrasi senyawa target dari spesi yang lebih encer dapat dilakukan dengan SPE melalui proses penjerapan senyawa target dalam suatu material penjerap. Senyawa target yang telah terjerap kemudian dilepaskan kembali oleh larutan pendesorpsi dengan volume yang lebih sedikit, sehingga diperoleh senyawa target dengan kepekatan tertentu. Metode SPE yang banyak digunakan adalah metode tumpak (batch) dan lapik tetap (fixed-bed) (Poole 2003). Bahan pengekstrak yang umum digunakan adalah material berpori yang dapat menjerap zat tertentu (kontaminan).
oleh SPE ini dapat mengatasi kelemahan ekstraksi cair-cair yang dinilai kurang efektif dan efisien dalam hal penggunaan pelarut sehingga membutuhkan biaya yang cukup besar (Jing et al. 2007).
BAHAN DAN METODE
Bahan dan Alat
Bahan-bahan yang digunakan adalah bentonit asal Kecamatan Cigudeg Kabupaten. Bogor, kristal 1,5-difenilkarbazida, FeCl3.6H2O, CrCl3.6H2O, K2Cr2O7,
Fe(NH4)(SO4)2.12H2O, Ce(SO4)2.
2(NH4)2.4H2O, NaCl, NaOH, KSCN dan
Na2B4O7.10H2O. Larutan H2SO4 9 M, HCl 1
N, HNO3 2.5 M, aseton, dan air bebas ion.
Alat-alat yang digunakan adalah spektrofotometer UV-Vis Shimadzu 1700, kolom adsorpsi, X-ray Diffractometer (XRD), ayakan 60 mesh, alat ukur volumetrik, dan alat-alat kaca lainnya.
Metode
Penelitian ini terdiri atas enam tahap. Tahap pertama adalah preparasi bentonit alam dengan cara dicuci dan diperkecil ukurannya menjadi bentonit lolos ayakan 60 mesh. Tahap kedua adalah modifikasi, yaitu memodifikasi bentonit alam menjadi Na-bentonit dan bentonit termodifikasi oksida besi. Tahap ketiga adalah menentukan kondisi optimum adsorpsi bentonit alam, Na-bentonit, dan bentonit termodifikasi oksida besi meliputi penentuan pH optimum dan waktu kontak optimum. Tahap selanjutnya adalah menentukan kapasitas dan pola isoterm adsorpsi ketiga jenis bentonit tersebut. Tahap berikutnya adalah uji spesiasi kolom lapik tetap menggunakan bentonit termodifikasi oksida besi. Terakhir, karakterisasi bentonit alam, Na-bentonit, dan bentonit termodifikasi oksida besi, meliputi penentuan kadar air bentonit sebelum dan setelah preparasi, penentuan kadar besi khusus untuk bentonit termodifikasi oksida besi, penentuan keasaman, penentuan kapasitas tukar kation, dan analisis kualitatif atau pencirian ketiga jenis bentonit tersebut menggunakan X-ray Diffractometer (XRD) (Lampiran 1).
Penentuan Kadar Air Bentonit Sebelum dan Setelah Preparasi (AOAC 1984)
Sebanyak tiga buah cawan porselin dikeringkan di dalam oven dengan suhu 105
⁰
C selama 60 menit. Selanjutnya, cawan didinginkan di dalam eksikator selama 30 menit, kemudian bobot cawan kosong ditimbang. Sebanyak 3 g bentonit dimasukkan ke dalam masing-masing cawan dan dikeringkan di dalam oven selama 24 jam pada suhu 105⁰
C. Setelah itu, cawan didinginkan di dalam eksikator sekitar 30 menit, kemudian ditimbang. Pemanasan dan penimbangan diulangi sampai bobot konstan.Kadar air (%) =
Keterangan:
A = Bobot sampel sebelum dikeringkan (g) B = Bobot sampel setelah dikeringkan (g)
Preparasi Bentonit (Wijaya et al. 2005)
Bentonit sebanyak 200 g ditambahkan air bebas ion sebanyak 2000 mL kemudian diaduk menggunakan pengaduk magnetik selama 24 jam. Selanjutnya disaring dan residu dikeringkan di dalam oven pada suhu 110 ⁰C selama 24 jam. Setelah itu, bentonit yang telah kering digerus lalu diayak menggunakan ayakan 60 mesh. Hasil preparasi bentonit dikarakterisasi dengan X-ray Diffractometer (XRD).
Preparasi Na-bentonit (Wijaya et al. 2005)
Sebanyak 100 g bentonit yang telah lolos ayakan 60 mesh didispersikan ke dalam 1000 mL larutan NaCl 1 M, dilakukan pengadukan
sambil dipanaskan pada suhu 70−80 ⁰C selama 24 jam, kemudian disaring. Residu disebut bentonit hasil penjenuhan dengan NaCl 1 M selanjutnya ditambahkan 1000 mL larutan NaCl 6 M sambil diaduk selama 24 jam, kemudian disaring dan dicuci dengan air bebas ion sampai bebas ion klorida. Bentonit yang telah bebas ion klorida selanjutnya dikeringkan dalam oven pada suhu 120 ⁰C selama 24 jam. Setelah itu, Na-bentonit yang telah kering digerus lalu diayak menggunakan ayakan 60 mesh. Hasil preparasi Na-bentonit dikarakterisasi dengan X-ray Diffractometer (XRD).
Pembuatan Larutan Oligokation Besi (Wijaya et al. 2005)
Sebanyak 86.50 g FeCl3.6H2O dilarutkan
dalam 1600 mL air bebas ion sambil diaduk sehingga diperoleh larutan FeCl3 0.2 M.
Larutan ini selanjutnya diukur pH awalnya, kemudian dihidrolisis dengan penambahan
NaOH 0.2 M sampai diperoleh pH larutan sekitar dua, kemudian diaduk dalam gelas beker 2000 mL selama 24 jam pada suhu kamar. Larutan oligomer yang diperoleh selanjutnya dilakukan pemeraman selama 24 jam pada suhu kamar.
Modifikasi Bentonit dengan Oksida Besi (Wijaya et.al 2005)
Bentonit termodifikasi oksida besi dibuat dengan cara sebagai berikut. Sebanyak 10 g Na-bentonit yang didispersikan ke dalam 500 mL air bebas ion (perbandingan 50 mL air/g Na-bentonit) dan diaduk selama 24 jam tanpa pemanasan. Selanjutnya, larutan oligomer (perbandingan 25 mL/g Na-bentonit) ditambahkan ke dalam suspensi Na-bentonit tetes demi tetes sampai 250 mL, kemudian diaduk selama 24 jam pada suhu kamar. Setelah pengadukan selesai, suspensi didiamkan pada suhu kamar selama 24 jam, kemudian dilakukan sentrifugasi dengan kecepatan 1000 rpm selama 20 menit. Oligokation besi-bentonit yang diperoleh selanjutnya disaring dengan penyaring Buchner dan sedimen yang diperoleh dicuci dengan air bebes ion dan filtrat bebas dari ion klorida. Sedimen yang diperoleh kemudian dikeringkan dalam oven pada suhu 50 ⁰C. Setelah itu, bentonit yang telah kering digerus lalu diayak menggunakan ayakan 60 mesh kemudian dikalsinasi pada suhu 400 ⁰C selama 5 jam. Hasil modifikasi besi-bentonit dikarakterisasi dengan X-ray Diffractometer (XRD).
Penentuan Kadar Besi pada Bentonit Termodifikasi
Larutan standar Fe3+ 10 mg/L sebanyak
2,5; 5,0; 7,5; 10,0; 12,5; dan 17,5 mL dimasukkan ke dalam labu takar 25 mL. Ke dalam larutan tersebut, ditambahkan larutan sampel yang telah diencerkan sebanyak 500 kali (oligokation besi sebelum atau sesudah dilakukan perendaman dalam bentonit) sebanyak 5,0 mL, kemudian ditambahkan 1,0 mL H2SO4 (1:1), lalu dimpitkan dengan air
bebas ion. Sebanyak 5,0 mL larutan yang telah terbentuk dimasukkan ke dalam tabung reaksi kemudian ditambahkan 5,0 mL air bebas ion dan 2,0 mL KSCN 1 N sampai terbentuk kompleks berwarna merah. Larutan diukur serapannya menggunakan spektrofotometer pada panjang gelombang 480 nm. Blangko yang digunakan adalah larutan tanpa sampel dan standar.
Penentuan Kapasitas Tukar Kation
Sebanyak 2,5 g bentonit dimasukkan ke dalam tabung perkolasi yang telah dilapisi berturut-turut dengan filter pulp dan pasir terlebih dahulu dengan susunan (1) bagian bawah adalah filter pulp untuk menutup lubang dasar tabung dan di atasnya 2,5 g pasir, (2) bagian tengah diisi dengan 2,5 g bentonit yang telah dicampur dengan sedikit pasir, dan (3) bagian atas ditutup dengan 2,5 g pasir. Ketebalan setiap lapisan pada sekeliling tabung diupayakan sama. Selanjutnya diperkolasi dengan amonium asetat pH 7 sebanyak 2 × 25 mL dengan selang waktu 30 menit. Setelah itu, tabung perkolasi yang masih berisi contoh diperkolasi dengan 100 mL etanol 96% untuk menghilangkan kelebihan amonium. Sisa etanol yang keluar dari tabung perkolasi dibuang. Selanjutnya bentonit diperkolasi dengan NaCl 10% sebanyak 50 mL. Filtrat ditampung dalam labu takar 50 mL dan dihimpitkan dengan larutan NaCl 10%.
Filtrat sebanyak 0,5 mL diambil dari labu kemudian dimasukkan ke dalam tabung reaksi dan ditambahkan 9.5 mL air bebas ion lalu dihomogenkan. Sebanyak 2 mL cuplikan ini dimasukkan ke dalam tabung reaksi yang lain kemudian ditambahkan sebanyak 4 mL larutan sangga tartrat dan 4 mL larutan Na-fenat. Setelah itu, campuran tersebut dikocok dan didiamkan selama 4 menit. Selanjutnya, sebanyak 2 mL larutan hipoklorit 5% ditambahkan kedalam campuran tersebut lalu diaduk dan didiamkan selama 10 menit, sampai warna biru yang terbentuk stabil, kemudian larutan diukur serapannya menggunakan spektrofotometer pada panjang gelombang 636 nm.
Penentuan Keasaman Bentonit (Widihati 2002)
Bentonit sebanyak 1,0 g dimasukkan ke dalam Erlenmeyer 100 mL dan ditambahkan 25 mL larutan NaOH 1 N, Erlenmeyer ditutup rapat dan diaduk selama 24 jam, kemudian disaring. Filtrat diambil sebanyak 10 mL lalu dititrasi dengan larutan HCl 1 M. Perlakuan yang sama dilakukan terhadap larutan blangko yang hanya mengandung 10 mL larutan NaOH 1 N. Keasaman bentonit (me/g) dihitung menggunakan rumus sebagai berikut:
Keterangan:
= Volume HCl yang dibutuhkan pada titrasi blangko (mL)
= Volume HCl yang dibutuhkan pada titrasi adsorben (mL)
N HCl = Normalitas HCl = Massa bentonit (g)
Penentuan pH optimum
Sebanyak 0.5 g bentonit dimasukkan ke dalam Erlenmeyer 100 mL dan ditambahkan 25 mL larutan Cr(VI) 200 mg/L yang telah diatur pH-nya 1, 2, 3, 4, 5, 6, dan 7 dengan penambahan HCl atau NaOH 1 M. Setelah itu, diaduk menggunakan shaker selama 24 jam. Setelah itu, campuran tersebut disaring dan filtratnya dimasukkan ke dalam labu takar 1000 mL sebanyak 2.5 mL, kemudian ditera. Selanjutnya dilakukan pengukuran konsentrasi Cr(VI) pada filtrat menggunakan spektrofotometer. Hal yang sama juga dilakukan pada larutan Cr(III) untuk mengetahui pH optimum.
Kurva hubungan antara pH sebagai sumbu x dan kapasitas adsorpsi Cr(III) atau Cr(VI) (mg/g) sebagai sumbu y dibuat untuk mengetahui nilai pH optimum. Nilai pH yang memberikan adsorpsi Cr(III) atau Cr(VI) paling besar merupakan pH optimum dan digunakan sebagai acuan dalam tahap selanjutnya.
Penentuan Waktu Kontak Optimum
Sebanyak 0.5 g bentonit dimasukkan ke dalam Erlenmeyer 100 mL dan ditambahkan 25 mL larutan Cr(VI) 200 mg/L pada pH optimum yang diperoleh. Campuran diaduk pada variasi waktu 3, 6, 12, 18, dan 24 jam. Setelah itu, campuran tersebut disaring dan filtratnya dimasukkan ke dalam labu takar 1000 mL sebanyak 2.5 mL, kemudian ditera. Selanjutnya dilakukan pengukuran konsentrasi Cr(VI) pada filtrat menggunakan spektrofotometer. Hal yang sama juga dilakukan pada larutan Cr(III) untuk mengetahui waktu kontak optimum.
Kurva hubungan antara waktu (jam) sebagai sumbu x dan kapasitas adsorpsi Cr(III) atau Cr(VI) (mg/g) sebagai sumbu y dibuat untuk mengetahui waktu kontak optimum. Waktu kontak yang memberikan adsorpsi Cr(III) atau Cr(VI) paling besar merupakan waktu kontak optimum yang digunakan sebagai acuan dalam tahap selanjutnya.
Penentuan Kapasitas dan Pola Isoterm Adsorpsi (Diantarani et al. 2004)
Bentonit sebanyak 0.5 g dimasukkan ke dalam Erlenmeyer 100 mL dan ditambahkan larutan Cr(VI) sebanyak 25 mL dengan konsentrasi berturut-turut 100, 200, 300, 500, dan 700 mg/L dari larutan stok (Lampiran 2), kemudian campuran tersebut diaduk menggunakan shaker pada kondisi optimumnya. Setelah itu, campuran tersebut disaring dan filtratnya dimasukkan ke dalam labu takar 1000 mL dengan volume berturut-turut sebesar 5.0, 2.5, 2.5, 2.5, dan 1 mL kemudian ditera. Selanjutnya dilakukan pengukuran konsentrasi Cr(VI) pada filtrat menggunakan spektrofotometer. Hal yang sama juga dilakukan pada larutan Cr(III) untuk mengetahui konsentrasi optimum dan pola isotermnya.
Pola isoterm adsorpsi diperoleh dengan membuat kurva hubungan antara konsentrasi Cr(VI) atau Cr(III) dalam larutan pada kesetimbangan terhadap kapasitas adsorpsi. Kapasitas adsorpsi dihitung sebagai bobot Cr(VI) atau Cr(III) yang teradsorpsi per gram adsorben. Kapasitas adsorpsi dihitung menggunakan persamaan:
Q =
Efisiensi adsorpsi dapat dihitung dengan menggunakan persamaan:
%E =
Keterangan:
%E = Efisiensi adsorpsi (%) Q = Kapasitas adsorpsi (mg/g) V = Volume larutan (L)
Co = Konsentrasi awal larutan (mg/L)
Ca = Konsentrasi akhir larutan (mg/L)
m = Massa adsorben (g)
massa
C
C
V
(
0 a)
Pengukuran Konsentrasi Cr(III) dan Cr(VI)
Pengukuran konsentrasi Cr(III) dilakukan dengan cara sebagai berikut. Larutan sampel sebanyak 25 mL dimasukkan ke dalam labu takar 50 mL, kemudian ke dalam labu tersebut ditambahkan 10 mL larutan cerium(IV) amonium sulfat 0.4 % dalam HNO3 2.5 M, 5
tetes H2SO4 9 M, 2 mL 1,5-difenilkarbazida
(DPC) 0.25% dalam aseton, dan ditera menggunakan air bebas ion. Campuran tersebut dikocok hingga homogen. Setelah didiamkan selama 10 menit, larutan tersebut diukur serapannya pada panjang gelombang 540 nm. Larutan sampel adalah filtrat setelah perlakuan adsorpsi dan larutan kromium awal sebelum perlakuan adsorpsi yang telah diencerkan (sebanyak 400 kali, kecuali pada penentuan pola isoterm adsorpsi terdapat faktor pengenceran yang berbeda). Prosedur pengukuran konsentrasi Cr(VI) sama seperti Cr(III) hanya tanpa penambahan larutan cerium(IV) amonium sulfat.
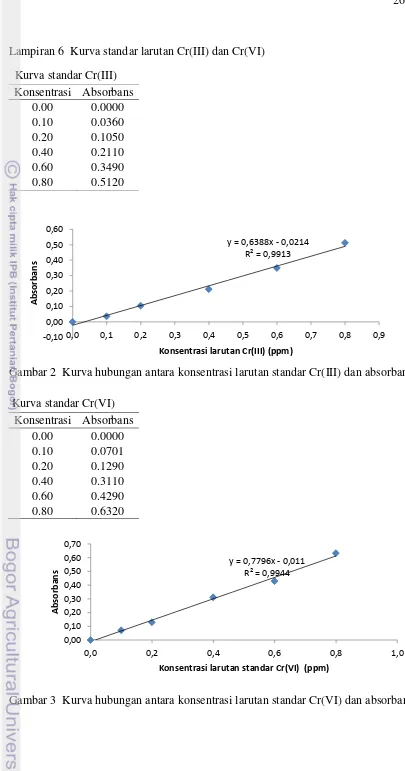
Pembuatan kurva standar Cr(III) disiapkan dengan cara sebagai berikut. Sebanyak 25 mL larutan standar Cr(III) dengan variasi konsentrasi larutan standar Cr(III) yaitu 0.0, 01, 0.2, 0.4, 0.6, dan 0.8 ppm ) dimasukkan ke dalam labu takar 50 mL. Selanjutnya perlakuan pada larutan standar sama seperti sampel larutan kromium. Prosedur pembuatan kurva standar Cr(VI) sama seperti kurva standar Cr(III) hanya tanpa penambahan larutan cerium(IV) amonium sulfat. Blangko dibuat dengan menggantikan larutan standar dengan air bebas ion. Kurva standar diperoleh dengan cara memplot nilai absorbans sebagai sumbu y dan konsentrasi larutan standar Cr(III) atau Cr(VI) sebagai sumbu x.
Kolom Adsorpsi
Kolom adsorpsi disiapkan dari 5 g bentonit termodifikasi oksida besi yang dimasukkan ke dalam kolom kaca bercerat dengan tinggi 15 cm dan diameter 1 cm. Sebelum digunakan, kolom tersebut dibilas dengan air bebas ion, kemudian dimasukkan sedikit glass wool. Bentonit yang telah dibuat menjadi slurry atau bubur (bentonit dalam air bebas ion) dimasukkan ke dalam kolom gelas tersebut melalui pinggir kolom. Bentonit yang menempel pada pinggir kolom dibilas dengan air bebas ion. Selanjutnya air dikeluarkan melalui cerat kolom dan setelah air tersisa 2 cm diatas permukaan bentonit, larutan Cr(VI) atau Cr(III) dengan konsentrasi 20 mg/L
dialirkan ke dalam kolom tersebut dengan laju alir 5 mL/menit hingga adsorben jenuh dengan kromium.
Kondisi jenuh diketahui dengan cara menampung 10 mL filtrat yang keluar dari kolom hingga fraksi ke-n. Fraksi ke-n merupakan kondisi dimana adsorben telah dijenuhi oleh larutan kromium sehingga nilai konsentrasi kromium saat keluar dari kolom (C) sama dengan konsentrasi kromium awal (C0).
HASIL DAN PEMBAHASAN
Kadar Air Bentonit
Penentuan kadar air bentonit sebelum dan setelah preparasi. Kadar air bentonit (sebelum preparasi) perlu ditentukan karena bentonit masih berupa bongkahan dan basah sementara penentuan kadar air bentonit setelah preparasi bertujuan mengetahui ada atau tidaknya air setelah preparasi atau modifikasi. Kadar air bentonit alam (sebelum preparasi) sebesar 27.80%, sedangkan setelah preparasi, meliputi bentonit alam setelah dicuci, Na-bentonit, dan bentonit termodifikasi oksida besi berturut-turut, sebesar 6.95, 7.07, dan 4.13% (Lampiran 3).
Kadar air bentonit sebelum preparasi cukup besar, sementara setelah preparasi cukup kecil. Ini menunjukkan bahwa kemampuan bentonit alam dalam menyerap air relatif besar, tetapi air tersebut cukup mudah keluar dari bentonit.
Kadar Besi Bentonit Termodifikasi Oksida Besi
Penentuan kadar besi bertujuan mengukur larutan oligokation besi yang masuk ke dalam ruang antarlapisan bentonit. Jumlah besi yang teradsorpsi sebesar 0.06 g/g adsorben dengan efisiensi sebesar 51.02% (Lampiran 4).
Penentuan kadar besi menggunakan teknik spektrofotometri dengan metode adisi standar. Adisi standar dilakukan dengan cara sejumlah tertentu larutan standar analit dengan konsentrasi yang diketahui ditambahkan ke dalam larutan sampel. Pengukuran kadar besi dengan cara mengompleks larutan Fe3+
dengan KSCN. Kompleks yang dihasilkan berwarna merah yang diukur serapannya pada panjang gelombang 480 nm. Reaksi pengompleksan Fe3+ dengan KSCN, ialah
Fe3+ + 6SCN¯
Kapasitas Tukar Kation
Kapasitas tukar kation (KTK) merupakan jumlah kation yang dapat dipertukarkan oleh bentonit. Pertukaran kation dilakukan dengan mereaksikan kation-kation dapat tukar pada ruang antarlapisan bentonit dengan NH4+.
Semakin kecil nilai KTK maka jumlah kation-kation yang dapat ditukarkan semakin rendah (Al-Jabri 2008). Nilai KTK pada bentonit alam, Na-bentonit, dan bentonit termodifikasi oksida besi dapat dilihat pada Tabel 2.
Tabel 2 Kapasitas tukar kation bentonit alam, Na-bentonit, dan bentonit
termodifikasi oksida besi
Sampel (me/100 g) KTK
Bentonit alam 50.50 Na-bentonit 11.53
Bentonit termodifikasi
oksida besi 36.41
Nilai KTK bentonit alam yang cukup besar menandakan bahwa kemampuan pertukaran ionnya baik dan merupakan parameter utama dalam menentukan mutu bentonit. Nilai KTK bergantung pada jumlah substitusi atom Al3+
terhadap Si4+ yang menghasilkan muatan
negatif pada kerangka bentonit karena kelebihan elektron. Semakin besar derajat substitusi, semakin banyak kation alkali atau alkali tanah yang diperlukan untuk menetralkan muatan negatif pada kerangka sehingga nilai KTK makin besar (Las 2005).
Nilai KTK Na-bentonit dan bentonit termodifikasi oksida besi lebih kecil dibandingkan dengan bentonit alam. Hal ini disebabkan pada Na-bentonit tapak aktif pertukaran kation telah dijenuhi oleh ion Na+, sementara pada bentonit termodifikasi sudah terdapat oksida besi sehingga NH4+ yang
berperan sebagai agen penukar kation kurang kuat dalam menggantikan kation-kation Na+
dan oksida besi yang diadsorpsi lebih kuat oleh bentonit. Agen penukar kation NH4+
kurang kuat menggantikan Na+ karena
konsentrasi kation natrium yang lebih besar dibandingkan dengan NH4+ sedangkan kurang
kuatnya NH4+ menggantikan besi karena
valensi kation besi yang lebih besar dibandingkan dengan NH4+.
Hasil pengukuran KTK yang diperoleh berbeda dengan hasil penelitian sebelumnya, namun memiliki kecenderungan yang sama, yaitu setelah mengalami modifikasi nilai KTK
menurun. Penelitian Widyaningsih tahun 2009 menyebutkan bahwa nilai KTK bentonit yang berasal dari Leuwiliang, Kabupaten Bogor sebelum dimodifikasi dengan HDTMABr sebesar 54.53 me/100 g, sedangkan setelah dimodifikasi menjadi organobentonit 25%, 50%, dan 100% berturut-turut sebesar 45.14, 37.37, dan 20.72 me/100 g. Begitu juga dengan hasil penelitian Prihatin (2010), yang melaporkan bahwa nilai KTK monmorilonit alam, Na-monmorilonit, dan monmorilonit termodifikasi oksida besi berturut-turut sebesar 36.97, 35.89, dan 26.48 me/100 g. Perbedaan nilai KTK yang diperoleh dapat disebabkan perbedaan asal adsorben.
Keasaman Bentonit
Penentuan keasaman adsorben dilakukan dengan metode titrasi asam-basa. Keasaman bentonit disebabkan oleh terlepasnya ion H+
dari gugus OH yang diikat oleh struktur tetrahedral SiO4 atau oktahedral AlO6 pada
permukaan bentonit. Ion-ion H+ yang terlepas
akan bereaksi dengan NaOH. Sisa OH- yang
tidak bereaksi dengan bentonit dititrasi dengan HCl yang telah distandardisasi.
Keasaman bentonit menurun setelah dimodifikasi dengan natrium dan oksida besi. Nilai keasaman bentonit alam, Na-bentonit, dan bentonit termodifikasi oksida besi berturut-turut sebesar 5.30, 3.46, dan 2.32 me/g (Lampiran 5). Penurunan nilai keasaman, pada Na-bentonit disebabkan natrium menempati tapak asam pada Na-bentonit sehingga OH− yang dibutuhkan lebih sedikit dibandingkan dengan bentonit alam. Nilai keasaman terendah terdapat pada bentonit termodifikasi oksida besi. Kecilnya nilai keasaman pada bentonit termodifikasi oksida besi, karena tertutupnya tapak asam akibat adanya oksida besi.
pH Optimum Adsorpsi Cr(VI) dan Cr(III)
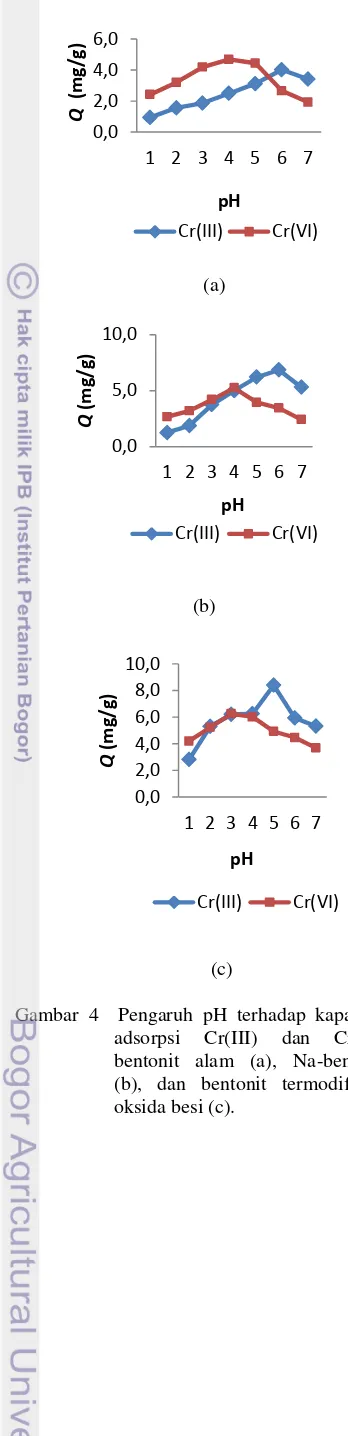
Kapasitas adsorpsi maksimum bentonit alam dan Na bentonit dicapai pada pH 4 untuk adsorpsi Cr(VI) dan pada pH 6 untuk adsorpsi Cr(III) sementara untuk bentonit termodifikasi oksida besi berturut-turut pada pH 3 dan pH 5. Kapasitas adsorpsi pada kondisi pH optimum tersebut untuk adsorpsi Cr(VI) menggunakan bentonit alam dan Na-bentonit berturut-turut sebesar 4.68 dan 5.26 mg/g adsorben, sedangkan untuk bentonit termodifikasi oksida besi sebesar 6.26 mg/g adsorben. Kapasitas adsorpsi maksimum Cr(III) menggunakan bentonit alam dan Na-bentonit berturut-turut sebesar 4.01 dan 6.86 mg/g adsorben dan menggunakan bentonit termodifikasi oksida besi sebesar 8.41 mg/g adsorben (Gambar 4). Data lengkap penetapan kapasitas adsorpsi terdapat pada Lampiran 6
−9.
Pengaturan nilai pH larutan menjadi salah satu faktor penting yang menentukan penjerapan Cr(III) dan Cr(VI), karena sangat memengaruhi bentuk molekul Cr(III) dan Cr(VI) (Monasterio et al. 2009). Menurut Hassanien et al. (2008), nilai pH optimum untuk menjerap Cr(III) dan Cr(VI) adalah 6 dan 2, sedangkan menurut Monasterio et al. (2009) nilai pH optimum untuk menjerap Cr(VI) adalah 4. Pada nilai pH<3 terjadi kompetisi dengan ion H+ dan permukaan
adsorben dapat rusak karena proses dealuminasi, sedangkan pada nilai pH=8 dapat terjadi pengendapan (Gode & Moral 2008). Oleh karena itu, rentang nilai pH yang digunakan adalah 1 sampai 7.
Kondisi pH optimum yang diperoleh sesuai penelitian Prihatin (2010) tetapi berbeda dengan hasil penelitian lainnya. Prihatin (2010) melaporkan bahwa adsorpsi maksimum ion Cr(VI) dan Cr(III) mengunakan monmorilonit termodifikasi oksida besi berturut-turut terjadi pada pH 3 dan 5. Kondisi pH optimum Cr(VI) terdapat pada pH yang relatif lebih asam (rendah) dibandingkan Cr(III). Handayani (2008) menyebutkan bahwa adsorpsi Cr(VI) pada limbah elektroplating dengan menggunakan oksida besi-monmorilonit menghasilkan kondisi optimum pada pH yang cukup rendah, yaitu 4. Begitu juga dengan penelitian Widyaningsih (2009) yang melaporkan bahwa adsorpsi maksimum Cr(VI) dengan HDTMABr-bentonit dicapai pada pH 4.
Spesies ion Cr(VI) dan Cr(III) dalam larutan bergantung pada nilai pH-nya. Pada pH rendah, spesies Cr(VI) terdapat dalam
bentuk HCrO4−, sedangkan pada pH tinggi
terdapat dalam bentuk CrO42−dan Cr2O72−
(Wahyuni et al. 2004; Wijaya et al. 2004; Correa 2009). Spesies Cr(III) berupa Cr(OH)2+ dan Cr(OH)
2+ pada pH rendah (pH
1−5), Cr(OH)3 pada pH di atas 5, dan
berbentuk anionnya, yaitu Cr(OH)4− pada pH
9 (Lach et al. 2008). Berdasarkan hal tersebut, spesies Cr(VI) yang teradsorpsi pada ketiga jenis sampel tersebut ialah HCrO4−, karena pH
optimum yang diperoleh adalah 4 dan 3. Spesies Cr(III) yang teradsorpsi pada bentonit termodifikasi oksida besi berada dalam bentuk kationnya, yaitu Cr(OH)2+ atau Cr(OH)
2+,
(a) (b) (c)
Gambar 4 Pengaruh pH terhadap kapasitas adsorpsi Cr(III) dan Cr(VI) bentonit alam (a), Na-bentonit (b), dan bentonit termodifikasi oksida besi (c).
Waktu Kontak Optimum Adsorpsi Cr(VI) dan Cr(III)
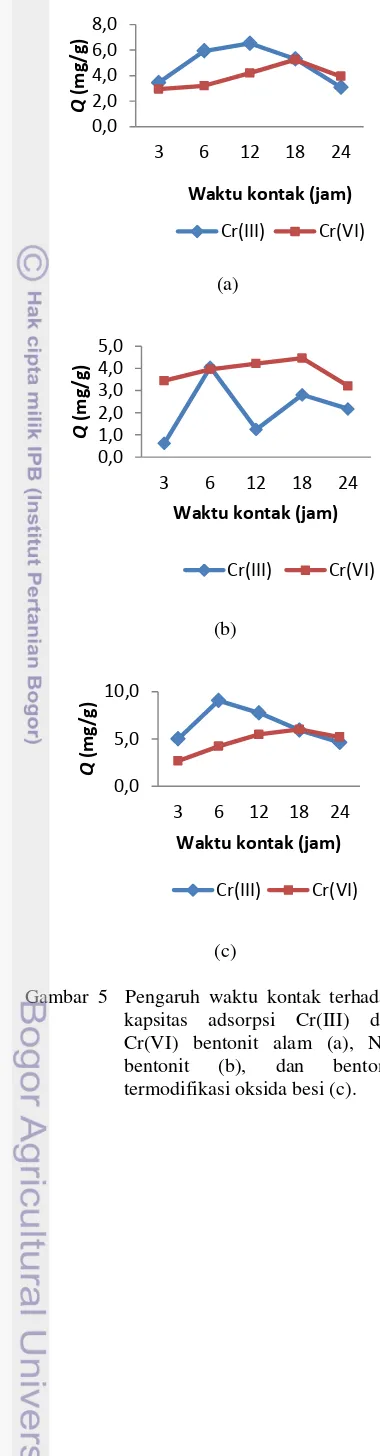
Kapasitas adsorpsi terbesar untuk adsorpsi Cr(VI) menggunakan bentonit alam, Na-bentonit, dan bentonit termodifikasi oksida besi diperoleh pada waktu kontak selama 18 jam, sedangkan untuk adsorpsi Cr(III) diperoleh pada waktu kontak berturut-turut selama 6, 12, dan 6 jam. Kapasitas adsorpsi pada kondisi waktu optimum tersebut untuk adsorpsi Cr(VI) berturut-turut sebesar 4.4, 5.25, dan 6.02 mg/g adsorben, sedangkan untuk adsorpsi Cr(III) berturut-turut sebesar 2.81, 6.53, dan 9.06 mg/g adsorben (Gambar 5). Perhitungan kapasitas adsorpsi diberikan padaLampiran 10.
Kesetimbangan adsorpsi lebih cepat dicapai pada adsorpsi Cr(III) dibandingkan dengan Cr(VI) sehingga lebih efisien dan menghasilkan kapasitas adsorpsi yang lebih besar dibandingkan Cr(VI). Hasil ini sama dengan hasil penelitian Prihatin (2010), yang melaporkan bahwa waktu kontak untuk adsorpsi Cr(III) lebih cepat daripada adsorpsi Cr(VI) pada monmorilonit termodifikasi oksida besi, berturut-turut selama 6 dan 48 jam, dengan kapasitas adsorpsi Cr(III) yang lebih besar, yaitu berturut-turut sebesar 4.83 dan 3.97 mg/g adsorben.
Penentuan waktu kontak optimum Cr(VI) berbeda dengan hasil beberapa penelitian terdahulu. Widyaningsih (2009) melaporkan bahwa waktu kontak optimum adsorpsi Cr(VI) menggunakan HDTMABr-bentonit lebih singkat, yaitu selama 4 jam dengan kapasitas adsorpsi 8.80 mg/g adsorben. Bentonit yang digunakan pada penelitian Widyaningsih (2009) berasal dari Leuwiliang dengan ukuran partikel bentonit ialah lolos ayakan 200 mesh. Begitu juga dengan penelitian Prihatin (2010) yang menyebutkan bahwa waktu kontak optimum adsorpsi Cr(VI) selama 48 jam menggunakan monmorilonit termodifikasi oksida besi. Monmorilonit yang digunakan berasal dari Trenggalek dengan ukuran partikel lolos ayakan 200 mesh. Perbedaan waktu kontak optimum ini dapat disebabkan oleh perbedaan asal adsorben yang digunakan serta ukuran partikelnya.
0,0 2,0 4,0 6,0
1 2 3 4 5 6 7
Q (m g /g ) pH Cr(III) Cr(VI) 0,0 5,0 10,0
1 2 3 4 5 6 7
Q (m g /g ) pH Cr(III) Cr(VI) 0,0 2,0 4,0 6,0 8,0 10,0
1 2 3 4 5 6 7
(a)
(b)
(c)
Gambar 5 Pengaruh waktu kontak terhadap kapsitas adsorpsi Cr(III) dan Cr(VI) bentonit alam (a), Na-bentonit (b), dan bentonit termodifikasi oksida besi (c).
Kapasitas dan Pola Isoterm Adsorpsi Cr(VI) dan Cr(III)
Kapasitas adsorpsi terbesar bentonit termodifikasi oksida besi untuk adsorpsi Cr(III) dan Cr(VI) diperoleh pada konsentrasi awal larutan yang lebih kecil dibandingkan dengan bentonit alam dan Na-bentonit. Kapasitas adsorpsi terbesar bentonit alam terjadi pada konsentrasi awal 500 mg/L untuk adsorpsi Cr(VI) dan Cr(III) dengan kapasitas adsorpsi berturut-turut 4.14 dan 4.49 mg/g adsorben (Gambar 6(a)). Konsentrasi awal adsorpsi terbesar Cr(VI) dan Cr(III) menggunakan Na-bentonit berturut-turut 300 dan 500 mg/L dengan kapasitas adsorpsi 4.97 dan 6.08 mg/g adsorben (Gambar 6(b)). Kapasitas adsorpsi Cr(VI) dan Cr(III) optimum menggunakan bentonit termodifikasi oksida besi diperoleh pada konsentrasi awal berturut-turut 200 dan 300 mg/L dengan kapasitas adsorpsi 5.85 dan 8.17 mg/g adsorben (Gambar 6(c)). Perhitungan kapsitas adsorpsi ditunjukkan pada Lampiran 11 dan 12.
Ragam konsentrasi kromium untuk penentuan kapasitas adsorpsi agar dicapai kondisi adsorben yang jenuh, sehingga adsorben dapat menjerap adsorbat secara optimal. Apabila dipilih konsentrasi yang rendah maka diperoleh nilai kapasitas adsorpsi yang kecil karena adsorbennya belum mencapai kondisi jenuh. Kecenderungan yang sama diperoleh pada bentonit alam, Na-bentonit, dan bentonit termodifikasi oksida besi, yaitu kapasitas adsorpsi meningkat sejalan dengan kenaikan konsentrasi, kemudian menurun. Penurunan ini disebabkan sejumlah Cr(VI) dan Cr(III) keluar kembali (terdesorpsi) dari permukaan.
Kapasitas adsorpsi Cr(III) dan Cr(VI) meningkat setelah adsorben dimodifikasi menjadi Na-bentonit dan bentonit termodifikasi oksida besi. Kapasitas adsorpsi tertinggi menggunakan bentonit termodifikasi oksida besi diperoleh dengan konsentrasi awal Cr(VI) lebih kecil daripada Cr(III). Hasil ini sesuai dengan penelitian Prihatin (2010) yang menyebutkan bahwa kapasitas adsorpsi Cr(VI) dan Cr(III) menggunakan monmorilonit termodifikasi oksida besi berturut-turut sebesar 3.97 dan 4.83 mg/g adsorben dengan konsentrasi awal 100 dan 200 mg/ L. Ukuran partikel monmorilonitnya lolos ayakan 200 mesh dan berasal dari Trenggalek, Jawa Timur. Hasil ini membuktikan bahwa bentonit yang berasal dari Cigudeg lebih baik daripada yang berasal 0,0
2,0 4,0 6,0 8,0
3 6 12 18 24
Q
(m
g
/g
)
Waktu kontak (jam)
Cr(III) Cr(VI) 0,0 1,0 2,0 3,0 4,0 5,0
3 6 12 18 24
Q
(m
g
/g
)
Waktu kontak (jam)
Cr(III) Cr(VI)
0,0 5,0 10,0
3 6 12 18 24
Q
(m
g
/g)
Waktu kontak (jam)
dari Trenggalek, dapat dilihat dari nilai kapasitas adsorpsinya yang lebih besar meskipun ukuran partikelnya lebih kasar, yaitu lolos ayakan 60 mesh.
(a)
(b)
(c)
Gambar 6 Pengaruh konsentrasi awal larutan terhadap kapasitas adsorpsi Cr(III) dan Cr(VI) bentonit alam (a), Na-bentonit (b), bentonit termodifikasi oksida besi (c).
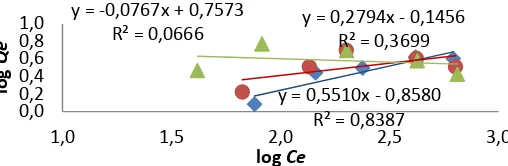
Ada tiga pola isoterm yang digunakan, yaitu isoterm Langmuir, Freundlich, dan Dubinin-Raduskevich. Isoterm Langmuir dan Freundlich digunakan untuk menentukan pola isoterm adsorpsi berdasarkan nilai linearitas terbesar (Tabel 3), sedangkan isoterm Dubinin-Raduskevich dipakai untuk
menentukan mekanisme adsorpsi berdasarkan nilai Ea(Tabel 4).
Tabel 3 Nilai linearitas adsorpsi Cr(VI) dan Cr(III)
Adsorben isoterm Jenis Linearitas (%) Cr(VI) Cr(III)
Bentonit alam Langmuir 93.20 87.85 Freundlich 83.87 75.03
Na-bentonit Langmuir 93.53 85.44 Freundlich 36.99 53.36 Bentonit
termodifikasi oksida besi
Langmuir 95.39 96.60
Freundlich 6.66 3.76
Adsorpsi Cr(VI) dan Cr(III) menggunakan bentonit alam, Na-bentonit, dan bentonit termodifikasi oksida besi mengikuti pola isoterm Langmuir. Isoterm ini menggambarkan pembatasan tapak aktif adsorpsi dengan asumsi bahwa tapak aktif adsorben bersifat homogen dan memiliki energi yang sama dalam mengadsorpsi adsorbat (Atkins 1999).
Tabel 4 Nilai Ea adsorpsi Cr(III) dan Cr(VI)
Adsorben Larutan Ea (kJ/mol)
Bentonit
alam Cr(III) Cr(VI) 0.02 0.02
Na-bentonit Cr(III) 0.03 Cr(VI) 0.03 Bentonit
termodifikasi oksida besi
Cr(III) 0.05 Cr(VI) 0.07
Nilai Ea dari persamaan isoterm
Dubinin-Raduskevich untuk adsorpsi Cr(VI) dan Cr(III) menggunakan bentonit alam dan Na-bentonit berturut-turut sebesar 0.02 dan 0.03 kJ/mol, sedangkan dengan menggunakan bentonit termodifikasi oksida besi berturut-turut sebesar 0.07 dan 0.05 kJ/mol. Perhitungan dapat dilihat pada Lampiran 13. Dapat diasumsikan bahwa mekanisme adsorpsi yang terjadi merupakan adsorpsi secara fisika karena nilai Ea yang diperoleh
lebih kecil dari 8 kJ/mol (Chen & Chen 2009). 0,00 1,00 2,00 3,00 4,00 5,00
100 200 300 500 700
Qe
(m
g
/g
)
Konsentrasi awal larutan (mg/L) Cr(III) Cr(VI) 0,0 2,0 4,0 6,0 8,0
100 200 300 500 700
Qe
(m
g
/g
)
Konsentrasi awal larutan (mg/L) Cr(III) Cr(VI)
0,0 5,0 10,0
100 200 300 500 700
Qe
(m
g
/g
)
Konsentrasi awal larutan (mg/L)
Kolom Adsorpsi
Perbedaan waktu kontak optimum antara adsorpsi Cr(VI) dan Cr(III) dengan cara batch memungkinkan untuk dilakukan spesiasi menggunakan kolom lapik tetap. Dilakukan pengaturan laju alir (laju kontak) influen (adsorbat) yang masuk ke dalam kolom adsorben dengan efluen (sisa adsorbat yang tidak terjerap) yang keluar dari kolom adsorben. Adsorpsi menggunakan kolom lapik tetap yang telah diujicobakan pada kolom kaca dengan ukuran panjang 15 cm dan diameter 1 cm dengan bobot adsorben sebanyak 5 g. Adsorben yang diisikan pada kolom adalah bentonit termodifikasi oksida besi karena nilai kapasitas adsorpsinya paling tinggi dibandingkan dengan bentonit alam dan Na-bentonit. Namun, pada pengujian terdapat kendala pada pengaturan laju alir yang berpengaruh kepada laju adsorpsi.
Hasil pengujian menunjukkan bahwa waktu yang dibutuhkan untuk keluarnya 1 tetes air bebas ion dari kolom selama 11 menit 10 detik. Mengurangi bobot adsorben dari 5 g menjadi 2.5 g mengurangi waktu yang dibutuhkan,tetapi masih cukup lama, yaitu 18 detik. Karena waktu yang dibutuhkan untuk mengalirkan air pada kolom sangat lama, pembuktian kemungkinan spesiasi berdasarkan perbedaan waktu kontak tidak dapat dilakukan pada kolom kemas manual ini.
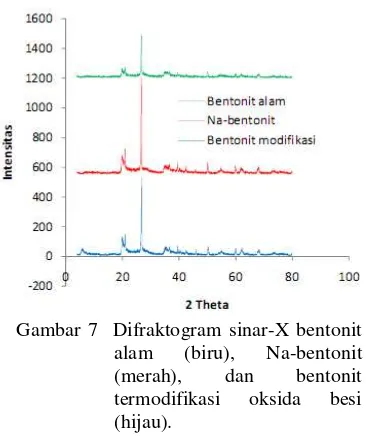
Analisis X-ray Diffractometer
Pencirian bentonit dilakukan dengan cara analisis XRD atau difraktometer sinar-X. Analisis kualitatif dan nilai kristalinitas bentonit alam, Na-bentonit, dan bentonit termodifikasi oksida besi dapat lihat pada Lampiran 14 (a, b, dan c). Inti dari analisis kualitatif adalah mencocokkan hasil difraktogram sampel dengan difraktogram yang terdapat pada data PCPDFWIN versi 1.30 JCPDS-ICDD 1997 (Lampiran 15). Difraktogram sinar-X ketiga sampel ini dapat dilihat pada Gambar 7.
Gambar 7 Difraktogram sinar-X bentonit alam (biru), Na-bentonit (merah), dan bentonit termodifikasi oksida besi (hijau).
Difraktogram ketiga jenis bentonit tersebut teridentifikasi sebagai kuarsa. Jumlah puncak yang muncul pada difraktogram sinar-X bentonit alam, Na-bentonit, dan bentonit termodifikasi oksida besi berturut-turut sebanyak 32, 24, dan 47 puncak (Lampiran 16). Kristalinitas berturut-turut sebesar 80.51, 72.77, dan 84.44% dengan 3 puncak tertinggi ditunjukkan pada Tabel 5.
Tabel 5 Tiga puncak tertinggi difraktogram sinar-X bentonit alam, Na-bentonit, dan bentonit termodifikasi oksida besi
Sampel Puncak 2θ d (Å)
Bentonit alam
26.8174 3.3217 26.6034 3.348 20.0161 4.4324
Na-bentonit
26.7102 3.3348 20.9072 4.2455 26.46.36 3.3653
Bentonit termodifikasi
oksida besi
26.7313 3.3323 20.9280 4.2413 20.0361 4.4281
Karakteristik monmorilonit terdapat pada salah satu dari ketiga puncak tertinggi difraktogram sinar-X bentonit alam, yaitu
difraktogram sinar-X bentonit alam mengandung monmorilonit ialah 2θ = 5.8373 (d = 15.1282 Å). Difraktogram sinar-X yang
mempunyai puncak 2θ = 19.92 (d001 = 4.45 Å)
dan 2θ = 5.91 (d001 = 14.95 Å) merupakan
karakteristik mineral monmorilonit (Wijaya et al. 2005). Wijaya & Fatimah (2006) juga menyebutkan bahwa puncak yang mencirikan montmorilonit adalah pada 2θ = 5.93 dan
didukung dengan puncak lain pada 2θ =
20.18, 23.57, dan 26.57. Puncak 2θ = 26.6034 pada difraktogram sinar-X bentonit alam selain mencirikan mineral kuarsa juga menjadi puncak pendukung untuk montmorilonit. Puncak-puncak lain yang mencirikan monmorilonit pada difraktogram sinar-X bentonit alam adalah 2θ = 6.2438 (d = 14.14.42 Å), 2θ = 20.2158 (d = 4.3891 Å), 2θ
= 35.0141 (d = 2.5606 Å), 2θ = 35.2340 (d = 2.5452 Å), 2θ = 62.1815 (d = 1.417 Å), sesuai dengan monmorilonit-15A (PCPDF nomor 29-1498). Monmorilonit merupakan mineral utama penyusun bentonit.
Puncak yang mencirikan adanya monmorilonit tidak terdapat pada ketiga puncak tertinggi difraktogram sinar-X Na-bentonit (Tabel 5), karena terjadi pergeseran atau pelebaran puncak. Namun, terdapat puncak-puncak lain yang mendukung adanya montmorilonit. Puncak ketiga tertinggi (26.46.36 (d = 3.3653Å)) merupakan puncak pendukung adanya mineral monmorilonit selain mencirikan mineral kuarsa. Karakteristik monmorilonit pada difraktogram sinar-X Na-bentonit muncul pada 2θ = 19.9362 (d = 4.4500 Å), puncak ini mengalami pergeseran ke kiri dan nilai d-nya meningkat dari puncak ketiga tertinggi difraktogram sinar-X bentonit alam, yang terdapat pada 2θ = 20.0161 (d = 4.4324 Å).
Modifikasi bentonit alam dengan natrium menyebabkan pelebaran atau pergeseran puncak pada difraktogram sinar-X Na-bentonit. Hal ini terlihat dari tidak munculnya puncak yang mencirikan adanya montmorilonit yang terdapat dibawah 10° karena puncak mengalami pelebaran, meningkatnya jarak antarlapis (basal spacing) dan berkurangnya jumlah puncak yang muncul pada difraktogram sinar-X Na-bentonit. Namun, nilai kristalinitas difraktogram sinar-X Na-bentonit lebih kecil dibandingkan difraktogram bentonit alam. Hal ini menunjukkan bahwa bentonit alam belum jenuh oleh natrium.
Karakteristik puncak oksida besi (hematit) tidak terlihat pada ketiga puncak tertinggi difraktogram sinar-X bentonit termodifikasi oksida besi, namun terdapat pada puncak-puncak lainnya. Dua puncak-puncak tertinggi difraktogram sinar-X bentonit termodifikasi oksida besi menunjukkan karakteristik mineral kuarsa dan satu puncak tertinggi yang lain menunjukkan karakteristik monmorilonit. Karakteristik puncak oksida besi (hematit) pada difraktogram sinar-X bentonit termodifikasi oksida besi muncul dengan intensitas puncak yang kecil pada 2θ = 35.5537 (d = 2.5230 Å) dan munculnya puncak baru pada 2θ = 33.2257 (d = 2.6943Å). Puncak-puncak pendukung terpilarnya oksida besi pada bentonit termodifikasi oksida besi terdapat pada 2θ = 35.7601 (d = 2.5089 Å), 2θ = 39.5492 (d = 2.2768 Å), 2θ = 43.7734 (d = 2.0664 Å), 2θ
= 56.0200 (d = 1.6402 Å), 2θ = 57.6129 (d = 1.5986 Å), 2θ = 62.5414 (d = 1.4840 Å), 2θ
= 64.1160 (d = 1.4513 Å). Bentonit alam sebelum dimodifikasi dengan besi telah mengandung besi (hematit) yang dicirikan pada difraktogram sinar-X bentonit alam pada
2θ = 35.6103 (d = 2.5191 Å). Peningkatan jumlah besi pada difraktogram sinar-X bentonit termodifikasi oksida dapat dilihat dari peningkatan nilai d dari puncak yang mencirikan adanya besi (hematit) yang
SIMPULAN DAN SARAN
Simpulan
Bentonit alam daerah Cigudeg, Bogor mengalami peningkatan kapasitas adsorpsi terhadap Cr(VI) dan Cr(III) setelah dimodifikasi dengan natrium dan dipilarisasi dengan oksida besi. Kapasitas maksimum untuk adsorpsi Cr(VI) pada bentonit alam, Na-bentonit, dan bentonit termodifikasi oksida besi berturut-turut sebesar 4.41, 4.97, dan 5.85 mg/g adsorben, sementara untuk adsorpsi Cr(III) berturut-turut sebesar 4.49, 6.08, dan 8.17 mg/g adsorben. Pola isoterm adsorpsi Cr(III) dan Cr(VI) mengikuti pola isoterm Langmuir dan mekanisme adsorpsinya terjadi secara fisisorpsi. Karakterisasi menggunakan difraktometer sinar-X menunjukkan pergeseran, pelebaran, dan perubahan jumlah puncak pada difraktogram Na-bentonit dan bentonit termodifikasi oksida besi
.
Spesiasi Cr(VI) dan Cr(III) menggunakan kolom adsorpsi terkendala pada rendahnya laju alir.Saran
Spesiasi yang dilakukan pada kolom adsorpsi sebaiknya menggunakan adsorben dengan ukuran yang lebih besar atau mencari pengektrak fase padat yang lain. Analisis lebih lanjut terhadap bentonit menggunakan SEM (Scanning Electron Microscopy) sebelum dan setelah modifikasi dengan oksida besi untuk mengamati morfologi permukaannya.
DAFTAR PUSTAKA
Al-Jabri M. 2008. Kajian metode penetapan kapasitas tukar kation zeolit sebagai pembenah tanah untuk lahan pertanian terdegradasi. Jurnal Standardisasi 10 (2):
56−59.
[AOAC]. 1984. Determination of water content. USA: AOAC 1984.
Atkins PW. 1999. Kimia Fisik. Edisi ke-4. Irma IK, penerjemah, Jakarta: Erlangga. Terjemahan dari: Physical Chemistry.
Chen AH, Chen SM. 2009. Biosorption of azo dyes from aqueous solution by glutaraldehyde-crosslinked chitosans. J Hazard Mater 172: 1111–1121.
Clesceri LS, Arnold EG, Andrew DE. 1989. Standard Methods for the Examination of Water and Wastewater. 20th Edition.
Washington DC: Alpha Awwa wes.
Clesceri LS, Greenberg AE, Eaton AD, Rice EW. 2005. Standard Methods for the Examination of Water and Wastewater. 21th
Edition. Washington DC: American Public Health Association
Correa GF, Becerril JJ. 2007. Chromium(VI) adsorption on boehmite. J Hazard Mater 162: 1178−1184.
Diantarani NP et al. 2008. Proses biosorpsi dan desorpsi ion Cr(VI) pada biosorben rumput laut Eucheuma spinosum. Jurnal Kimia 2: 45–52.
Ferreira SLC et al. 2007. Review of procedures involving separation and preconcentration for the determination of cadmium using spectrometric techniques. J Hazard Mater 145 : 358–367.
Gode F, Moral E. 2008. Column study on the adsorption of Cr(III) and Cr(VI) using Pumice, Yarikkaya brown coal, Chelex–
100, and Lewatit MP 62. Bioresour Technol 99: 1981–1991.
Gong J, Wang B, Zeng G, Yang C, Niu C, Niu Q, Zhou W, dan Liang Y. 2009. Removal of cationic dyes from aqueous solution using magnetic multi-wall carbon nanotube nanocomposite as adsorbent. J Hazard Mater 164:1517-1522
Goswani S, Ghosh UC. 2005. Studies on adsorption behaviour of Cr(VI) onto synthetic hydrous stannic oxide. Water SA
31(4): 597−602.
Handayani G. 2007. Preparasi dan uji adsorpsi monmorilonit terpilar besi oksida trehadap logam Cr(VI) dalam media air dan limbah electroplating [skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Jing Fan, Chunlai Wu, Yafang Wei, Chuanyun Peng, Pingan Peng. 2007. Preparation of xylanol orange fungtionalized silica gel as a selective solid phase extractor and its application for preconcentration-separation of mercury from waters. J Hazard Mater 145 : 323–
330.
Kusnoputranto H. 1996. Toksikologi Lingkungan Logam Toksik dan B3. Jakarta: Fakultas Kesehatan Masyarakat dan Pusat Penelitian Sumber Daya Manusia dan Lingkungan, UI.
Lach J et al. 2008. The adsorption of Cr(III) and Cr(VI) on activated carbon in the presence of phenol. Desalination 223: 2459–2555.
Las T. 2005. Potensi zeolit untuk mengolah limbah industri dan radioaktif. [terhubung berkala].
http://www.batan.go.id/ptlrartikelzeolit.ht ml. 20 April 2012
Lumingkewas S. 2009. Konversi Ca-bentonit menjadi Na-bentonit menggunakan teknik pertukaran ion. Jurnal Agritek 17: 935– 955.
Martha F. 2004. Penetapan limit deteksi dan limit respon linear serta pengaruh oksidasi terhadap pengukuran kromium dengan spektrofotometri sinar tampak [skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
[MENLH] Menteri Negara Lingkungan Hidup. 1995. Batas baku logam berat di perairan. Jakarta: KEP-51/MENLH/10/1995.
Monasterio RP, Altamirano JC, Martinez LD, Wuilloud RG. 2009. A novel fiber-packed column on-line preconcentration and speciation analysis of chromium in drinking water with flame atomic absorption spectrometry. Talanta 77: 1290–1294.
Noroozifar M, Khorasani-Motlagh M. 2003. Spesific extraction of chromium as tetrabutylammonium-chromate and spectrophotometric determination by diphenylcarbazide: speciation of chromium in effluent stream. Analytical Science 19: 705–708.
Poole CF. 2003. New trends in solid phase extraction. Trends in Analytical Chemistry
22 (6): 362−373.
[PP] Peraturan Pemerintah. 2001. Pengelolaan kualitas air dan pengendalian pencemaran air. Jakarta: PP nomor 82 tahun 2001.
Prihatin MA. 2010. Adsorpsi ion Cr(VI) dan Cr(III) dengan monmorilonit termodifikasi oksida besi [skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Sukandarrumidi. 1999. Bahan Galian Industri. Yogyakarta: UGM Pr.
Syuhada, Rahmat W, Jayatin, Saeful R. 2009. Modifikasi bentonit (clay) menjadi organoclay dengan penambahan surfaktan. Jurnal Nanosains dan Nanoteknologi 2: 1.
Teja AS, Koh P. 2009. Synthesis, properties, and applications of magnetic iron oxide nanoparticles. Prog Crystal Growth and Characterization of Mat 55:22-45.
Trisunaryanti W, Triwahyuni E, Sudiono S. 2005. Preparasi, modifikasi, dan karakterisasi katalis Ni-Mo/ zeolit alam dan Mo-Ni/zeolit alam. Teknoin 10 (4):
269−282.
Vogel. 1990. Analisis Anorganik Kualitatif Makro dan Semimikro. Setiono L dan Pudjaatmaka AH, penerjemah; Svehla G, editor. Jakarta: Kalman media Pusaka. Terjemahan dari: Textbook of Macro and Semimicro Qualitative Inorganic Analysis.
Widihati IAG. 2002. Sintesis lempung monmorilonit terpilar Fe2O3 dan kajian
sifat-sifat kimia fisiknya [tesis]. Yogyakarta: Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas Gajah Mada.
Widyaningsih J. 2009. Adsorpsi dan desorpsi ion Cr(VI) pada bentonit yang dimodifikasi HDTMABr [skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Wijaya et al. 2004. Sintesis komposit oksida-besi monmorilonit dan uji stabilitas strukturnya terhadap asam sulfat. Indonesian Journal of Chemistry 4: 33−42.
Wijaya et al. 2005. Sintesis Fe2O3
-monmorilonit dan aplikasinya sebagai fotokatalis untu