POTENSI SENYAWA BIOAKTIF ANTIMIKROB DAN
ANTIOKSIDAN DARI SEJUMLAH BAKTERI YANG
BERASOSIASI DENGAN SPONS
Stylotella
sp.
DANING YOGHIAPISCESSA
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa tesis yang berjudul “Potensi Senyawa Bioaktif Antimikrob dan Antioksidan dari Sejumlah Bakteri yang Berasosiasi dengan Spons Stylotella sp.” adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Februari 2016
Daning Yoghiapiscessa
RINGKASAN
DANING YOGHIAPISCESSA Potensi Senyawa Bioaktif Antimikrob dan Antioksidan dari Sejumlah Bakteri yang Berasosiasi dengan Spons Stylotella sp. Dibimbing oleh ARIS TRI WAHYUDI dan IRMANIDA BATUBARA.
Perairan Indonesia merupakan sumber berbagai senyawa bioaktif. Porifera spons adalah salah satu invertebrata yang berasosiasi secara luas dengan berbagai mikroorganisme. Mikroorganisme yang berasosiasi dengan spons diketahui merupakan produsen senyawa bioaktif perairan, hal ini dapat menjadi alternatif solusi dalam eksplorasi dan komersialisasi komponen senyawa bioaktif.
Spons dengan jenis Stylotella sp. berhasil dikoleksi dari Pulau Bira, Jakarta. Tahapan isolasi bakteri asosiatif spons Stylotella sp. dilakukan dengan menggunakan lima jenis media, dan diperoleh 138 jenis bakteri dengan morfologi koloni berbeda. Media isolasi terbaik adalah media SWC (Sea Water Complete)
dengan nilai CFU (Colony Forming Unit) sebesar 6.6 x 106 CFU/mL, sedangkan media yang kurang efektif adalah media MA (Marine Agar) dengan total bakteri sebesar 1.4 x 106 CFU/mL. Sebanyak 32% isolat terdeteksi memiliki aktivitas antimikrob pada kisaran spektrum sempit hingga luas yang kemudian digunakan pada tahap penapisan lanjutan. Uji hemolisis menunjukkan lima isolat merupakan mikroorganisme patogen yang mampu melisiskan sel darah merah.
Isolat hasil tahap sebelumnya diekstraksi dengan pelarut metanol, etil asetat dan diklorometana, kemudian ditentukan nilai Konsentrasi Hambat Minimum (KHM) yang merupakan konsentrasi terendah dari suatu bahan untuk menghambat pertumbuhan mikroorganisme. Isolat STIL 09 dan STIL 33 memiliki kisaran nilai KHM 0.5 - 5.0 mg/mL pada seluruh pelarut. Isolat STIL 37 memiliki nilai KHM paling rendah yaitu berkisar antara 0.5 – 2.0 mg/mL yang tergolong penghambata moderat. Isolat STIL 44 dan STIL 55 hanya menghambat
Pseudomonas aeruginosa dan Staphylococcus aureus dengan KHM sebesar 0.5 mg/mL.
Seluruh ekstrak mampu meredam radikal DPPH dengan kisaran 14.94 – 82.58%. Ekstrak yang paling berpotensi adalah ekstrak etil asetat isolat STIL 33 dan STIL 37 dengan IC50 (konsentrasi yang mampu menghambat radikal sebesar
50%) berturut-turut sebesar 204 dan 205 ppm. Seluruh ekstrak memiliki kapasitas antioksidan berdasarkan uji dengan metode CUPRAC. Kapasitas antioksidan tertinggi didapatkan pada ekstrak etil asetat isolat STIL 33 yaitu sebesar 1610 µmol troloks/g ekstrak.
Golongan senyawa bioaktif pada ekstrak ditentukan secara kualitatif. Secara umum seluruh ekstrak mengandung alkaloid, sedangkan sebagian mengandung terpenoid dan flavonoid. Erdasarkan analisis sekuen gen 16S rRNA, menunjukkan bahwa isolat STIL 09, STIL 33, STIL 37, STIL 44 dan STIL 55 berturut-turut memiliki kekerabatan terdekat dengan Bacillus subtilis strain JCM 1465, Pseudoalteromonas flavipulchra strain NCIMB 2033, Serratia marcescens
strain NBRC 102204, Catenococcus thiocycli strain TG 5-3 dan Vibrio natriegens
strain ATCC 14048.
SUMMARY
DANING YOGHIAPISCESSA. The Potency of Antimicrobial and Antioxidant bioactive compound from some Bacteria Associated with Sponge Stylotella sp. Supervised by ARIS TRI WAHYUDI and IRMANIDA BATUBARA.
Indonesian marine water is the source of various bioactive compounds. Porifera sponge organism is one of the invertebrates associated widely with many microorganism. Microorganism associative sponge is known as the producer of marine bioactive compound. This is can be the alternative solution in exploring and commercializing bioactive compound components.
Stylotella sp. sponge was successfully collected from Bira island, Jakarta. The isolation stages of Stylotella sp. sponge symbiont bacteria were conducted by five different media. The selection result obtained 138 types of bacteria with different morphology colony. The best isolation medium was SWC (Sea Water Complete) because it obtained the highest growth number of bacteria with total CFU (Colony Forming Unit) 6.6 x 106 CFU/mL, and the lowest number of bacteria was 1.4 x 106 CFU/mL which was from MA (Marine Agar) medium. The next 32% of 138 isolates on screening stage detected an activity of antimicrobial compound in the broad until narrow range in inhibiting the growth of tested microorganisms. Hemolytic test showed that five isolates were not used for the further analytic, due to the fact that they were detected as pathogenic microorganisms which were capable of lysing red blood cells.
The previous stage isolates were extracted by methanol, ethyl acetate, and dichloromethane. Then MIC (Minimum Inhibitory Concentration), which is the lowest concentration of a material to inhibit microorganism growth, would be determined. STIL 09 and STIL 33 isolates had MIC values 0.5 - 5.0 mg/mL in all of the solvents. STIL 37 isolate had the lowest MIC value which wass 0.5 – 2.0 mg/mL, this value was considered as moderate inhibitor. STIL 44 and STIL 55 isolates only inhibited P. aeruginosa and S. aureus with MIC value 0.5 mg/mL.
All of the extracts were able to reduce DPPH radical with approximately 14.94 – 82.58%. The most potential extracts were extract of ethyl acetate extract STIL 33 and STIL 37 isolates with IC50 (the concentration which is able to inhibit
radical for 50%) 204 and 205 ppm. All of the extracts had the antioxidant capacity based on the test with CUPRAC method. The antioxidant highest capacity was obtained from ethyl acetate extract STIL 33 isolate which was 1610 µmol troloks/g extract.
The group of bioactive compounds in the extracts were determined qualitatively. In general, all of the extracts contained alkaloid, and half of them contained terpenoid and flavonoid. Molecular identification was analyzed through gene sequence 16S rRNA. The result showed that STIL 09, STIL 33, STIL 37, STIL 44 dan STIL 55 isolates had the closest relation with Bacillus subtilis strain JCM 1465, Pseudoalteromonas flavipulchra strain NCIMB 2033, Serratia marcescens strain NBRC 102204, Catenococcus thiocycli strain TG 5-3 and
Vibrio natriegens strain ATCC 14048.
© Hak Cipta Milik IPB, Tahun 2016
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Mikrobiologi
POTENSI SENYAWA BIOAKTIF ANTIMIKROB DAN
ANTIOKSIDAN DARI SEJUMLAH BAKTERI YANG
BERASOSIASI DENGAN SPONS
Stylotella
sp.
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2016
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah SWT atas segala karunia-Nya sehingga karya ilmiah yang Potensi Senyawa Bioaktif Antimikrob dan Antioksidan dari Sejumlah Bakteri yang Berasosiasi dengan Spons Stylotella sp. akhirnya telah terselesaikan.
Penulis menghaturkan terimakasiH sebesar-besarnya kepada Prof Dr Aris Tri Wahyudi sebagai ketua komisi pembimbing dan Dr Irmanida Batubara M.Si sebagai anggota komisi pembimbing, yang telah meluangkan waktunya untuk memberikan bimbingan, nasehat, motivasi dan juga solusi pada setiap permasalahan selama penulis melaksanakan penelitian maupun dalam penyusunan karya ilmiah ini. Selain itu penulis ucapkan terima kasih kepada Prof Dr Anja Meryandini, MS selaku Ketua Program Studi Mikrobiologi IPB, beserta seluruh Dosen pada Program Studi Mikrobiologi yang telah memberikan ilmu yang sangat berharga selama menjalani studi di kampus IPB.
Ucapan terima kasih tak terhingga penulis ucapkan kepada Alm Dr. Bambang Soenarno, my beloved mom, mba ika dan adikku bambik, suamiku tersayang, serta keluarga besar Bogor, Jakarta dan Purwokerto yang sangat penulis sayangi atas semangat, doa dan kasih sayang yang telah diberikan selama ini. Penulis juga mengucapkan terima kasih kepada Bapak Beginner Subhan yang telah meluangkan waktunya dalam membantu identifikasi spons, Bapak Jaka selaku staf Laboratorium Mikrobiologi IPB, Bapak Eman dan Mba Eli selaku staf Labotarorium Kimia Analitik dan Biokimia yang telah banyak membantu penelitian. Nidia sebagai adik seperjuangan, teman-teman yang membantu penulis saat sampling spons, seluruh teman di Laboratorium Mikrobiologi IPB angkatan 2012, serta seluruh pihak yang telah memberikan doa dan dukungannya, penulis ucapkan terimakasih.
Semoga karya ilmiah ini bermanfaat.
Bogor, Februari 2016
Daning Yoghiapiscessa
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR GAMBAR vi
DAFTAR LAMPIRAN vi
PENDAHULUAN 1
Latar Belakang 1
Perumusan Masalah 3
Tujuan 4
Hipotesis Penelitian 4
Ruang Lingkup Penelitian 4
Manfaat Penelitian 4
TINJAUAN PUSTAKA 5
Potensi Perairan Indonesia 5
Potensi Bakteri yang berasosiasi dengan Organisme Spons 5
Metabolit Sekunder 7
Mikroorganisme Patogen 7
Konsentrasi Hambat Minimum 8
Komponen Senyawa Bioaktif Antioksidan 8
METODE 11
Waktu dan Tempat Penelitian 11
Alat dan Bahan 11
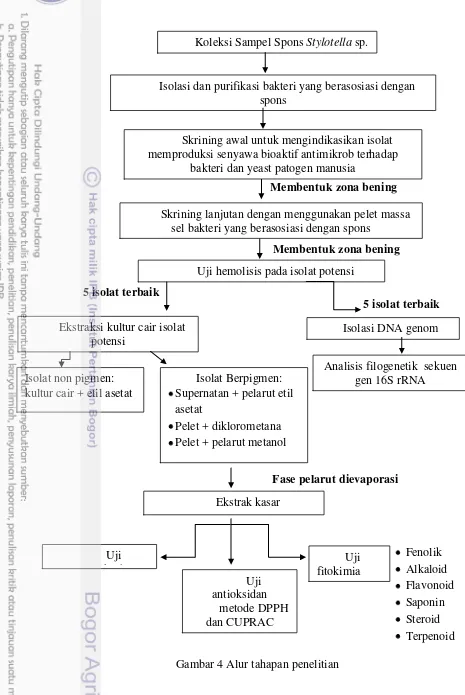
Alur Tahapan Penelitian 12
Pengambilan Sampel 13
Isolasi dan Pengkulturan Bakteri yang bersimbiosis dengan Spons 13 Penapisan Terhadap Bakteri Patogen untuk Memilih isolat Potensi 13
Uji Hemolisis 14
Ekstraksi Senyawa Bioaktif 14
Penentuan Aktivitas Antimikrob 15
Penentuan Aktivitas Antioksidan Menggunakan Metode DPPH 15 Penentuan Aktivitas Antioksidan Menggunakan Metode CUPRAC 16
Uji Kandungan Senyawa Bioaktif 16
Isolasi DNA Genom 17
Amplifikasi, Purifikasi dan Sekuensing Gen Penyandi 16S-rRNA 17
HASIL DAN PEMBAHASAN 18
Hasil 18
Pembahasan 33
SIMPULAN DAN SARAN 43
Saran 43
DAFTAR PUSTAKA 44
LAMPIRAN 49
DAFTAR TABEL
1 Jumlah CFU/mL isolat bakteri yang berasosiasi dengan spons 19 2 Aktivitas penghambatan mikroorganisme yang berasosiasi dengan
spons 22
3 Indeks zona hambat isolat bakteri yang bersimbiosis dengan spons
Stylotella sp. penghasil senyawa antimikrob 23
4 Diameter zona hambat bakteri penghasil senyawa antimikrob 24 5 Persentase rendemen ekstrak kasar isolat bakteri yang berasosiasi
dengan spons Stylotellasp. 26
6 Konsentrasi hambat minimum (KHM) ekstrak bakteri asal spons
Stylotella sp. 26
7 Aktivitas senyawa antimikrob ekstrak bakteri simbion spons Stylotella
sp. 28
8 Aktivitas antioksidan DPPH pada konsentrasi 1000 ppm dan kapasitas antioksidan CUPRAC dari beberapa isolat bakteri yang berasosiasi
dengan spons Stylotella sp. 29
9 Nilai IC50 antioksidan isolat bakteri potensi yang berasosiasi dengan
spons Stylotella sp. dalam meredam radikal DPPH 29 10 Uji Kandungan kimia ekstrak kasar lima bakteri simbion spons terbaik 30 11 Identifikasi molekuler bakteri potensi berdasarkan gen 16S rRNA 31
DAFTAR GAMBAR
1 Jumlah produk hayati laut berdasarkan filum pada tahun 2001-2010 5 2 Persentase temuan senyawa bioaktif berdasarkan filum bakteri asosiatif
spons 6
3 Struktur molekul DPPH setelah bereaksi dengan ion H dari senyawa
aktif antioksidan 10
4 Alur tahapan penelitian 12
5 (a dan b) Sampel spons Stylotella sp. yang telah berhasil dikoleksi dari Pulau Bira, (c) contoh dokumen foto spons Stylotella sp. sebagai spons
pembanding 19
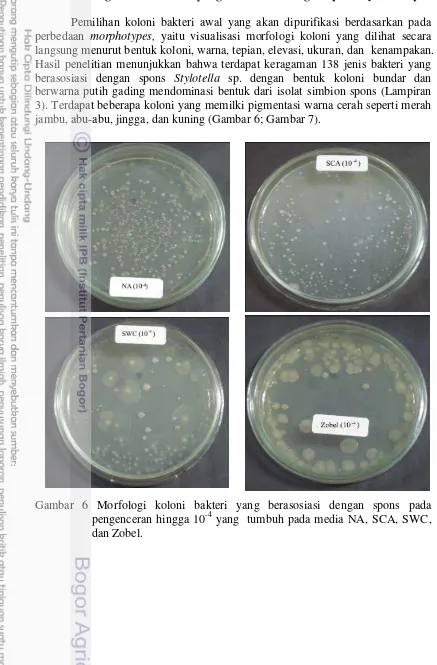
6 Morfologi koloni bakteri yang berasosiasi dengan spons pada pengenceran 10-4 yang tumbuh pada media NA, SCA, SWC, dan
Zobel. 20
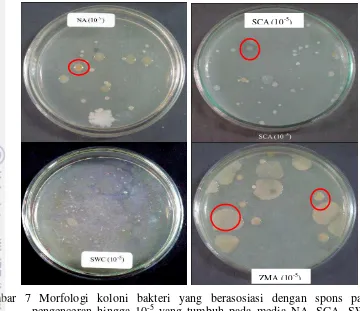
7 Morfologi koloni bakteri yang berasosiasi dengan spons pada pengenceran 10-5 yang tumbuh pada media NA, SCA, SWC dan Zobel. Beragam morfologi koloni bakteri yang berasosiasi dengan spons tumbuh pada media tersebut. Terdapat beberapa perbedaan warna (pigmentasi) yang mencolok, tidak hanya perbedaan pigmentasi, namun juga ukuran, pinggiran, bentuk dan kenampakan koloni. Pigmentasi merah jambu, abu-abu, jingga dan coklat muda ditunjukkan
8 Zona hambat yang terbentuk ditandai dengan area bening di sekitar koloni bakteri yang mengindikasikan adanya aktivitas antimikrob pada isolat bakteri yang berasosiasi dengan spons Stylotella sp. 22 9 Tahapan penapisan lanjutan dengan menggunakan pelet massa sel, zona
hambat yang ditandai dengan area bening menandakan adanya aktivitas antimikrob pada isolat bakteri yang berasosiasi dengan spons Stylotella
sp. dalam menghambat mikroorganisme uji 22
10 Uji hemolisis dengan menggunakan media agar-agar darah, zona bening yang terbentuk di sekitar koloni mengindikasikan isolat memiliki
kemampuan untuk melisiskan sel darah merah 25
11 Ekstrak bakteri yang berasosiasi dengan spons Stylotella sp. (a) Supernatan STIL 33 dilarutkan dalam etil asetat, (b) Kultur cair STIL 44 dilarutkan dalam etil asetat, (c) Kultur cair STIL 9 dilarutkan dalam etil asetat, (d) Pelet STIL 33 dilarutkan dalam metanol, (e) Pelet STIL 33 dilarutkan dalam diklorometanaEkstrak Bakteri yang berasosiasi
dengan spons Stylotella sp 25
12 Konsentrasi hambat minimum pada beberapa isolat bakteri yang berasosiasi dengan spons Stylotella sp. terhadap beberapa mikroorganisme uji. Kontrol positif : ampicillin 5 mg/mL, kontrol
negatif : etil asetat27 27
13 Produk PCR gen 16S rRNA dari beberapa bakteri yang berasosiasi dengan spons, pita DNA berukuran 1300 pb, marker 1 kb (M), (1) STIL 09, (2) STIL 33, (3) STIL 37, (4) STIL 44, (5) STIL 55 30 14 Pohon filogenetik dengan menggunakan metode neighbor-joining dari
sekuen gen 16S rRNA dari beberapa strain Bacillaceae, Enterobacteriaceae dan lima isolat potensial bakteri yang berasosiasi dengan spons Stylotella sp. dengan menggunakan metode Neighbour-joining dengan analisis bootstrap sebesar 1000. Clade 1 (bakteri gram negatif) yang terbagi menjadi 3 subclade : subclade 1a. Vibrionaceae (Vibrio, Catenococcus), sub-clade 1b. Pseudoalteromonadaceae (Pseudoalteromonas), sub-clade 1c. Enterobacteriaceae (Serratia), Clade 2 (Bakteri gram positif). Bacillaceae (Bacillus), Out group : Sulfolobus
DAFTAR LAMPIRAN
1 Peta Pulau Bira, Kepulauan Seribu, Jakarta, Indonesia 50
2 Komposisi media untuk 1 liter 51
3 Morfologi koloni isolat bakteri asosiatif spons Stylotella sp. yang berhasil diisolasi dari Pulau Bira, Kepulauan Seribu, Jakarta. 52
4 Foto hasil ekstraksi 58
5 Persentase inhibisi DPPH beberapa isolat bakteri asosiatif spons
Stylotella sp. pada konsentrasi 1000 ppm 59
6 Nilai IC50 ekstrak isolat STIL 33 60
7 Nilai IC50 ekstrak isolat STIL 37 61
8 Nilai IC50 DPPH kontrol positif troloks 62
9 Kapasitas antioksidan metode cuprac pada ekstrak isolat bakteri yang
berasosiasi dengan spons 63
10 Kapasitas antioksidan metode CUPRAC pada ekstrak bakteri yang
berasosiasi dengan spons Stylotella sp. 64
11 Sekuen gen 16S rRNA lima isolat bakteri yang berasosiasi dengan spons
1
1 PENDAHULUAN
Latar Belakang
Indonesia merupakan negara maritim dengan luas perairan mencapai tiga kali lipat dari total luas wilayah daratan, yaitu sebesar 5.8 juta km2, oleh karena itu Indonesia merupakan sumber dari senyawa bioaktif perairan. Kepulauan Seribu adalah daerah konservasi bahari dan salah satu area eksplorasi senyawa bioaktif laut. Pulau Bira merupakan salah satu gugusan Kepulauan Seribu dengan indeks jumlah keragaman sumber daya alam yang tinggi. Pulau ini terletak pada ketinggian 3 meter dpl dan terdiri atas 110 pulau dengan luas perairan mencapai 6.997.50 km2 (Mulyana 2008).
Organisme laut spons dalam beberapa dekade terakhir menjadi primadona dalam pencarian berbagai senyawa bioaktif metabolit sekunder. Senyawa bioaktif yang dihasilkan oleh spons telah banyak dilaporkan, terutama yang berpotensi dalam bidang farmasi, biomedis dan bioteknologi (Thomas et al. 2010). Senyawa bioaktif yang dihasilkan dari spons memiliki keterbatasan dalam konteks pemenuhan suplai skala industri dan merupakan bentuk eksploitasi yang berdampak pada kerusakan ekosistem perairan. Trianto et al. (2004) melaporkan bahwa ekstrak spons yang didapatkan dari Xestospongia sp. sebagai senyawa antikanker hanya berkisar 0.3% dari total berat basah spons. Keterbatasan ini akan menjadi masalah utama dalam mengembangkan senyawa bioaktif yang berasal dari organisme spons.
Spons merupakan invertebrata perairan yang berasosiasi secara luas dengan berbagai mikroorganisme, baik sebagai sumber makanan, patogen, maupun yang berasosiasi dengan mutualisme. Berbagai penelitian melaporkan adanya kesamaan komponen senyawa bioaktif pada spons dengan komponen senyawa bioaktif pada mikroorganisme simbionnya. Hal tersebut menimbulkan perspektif bahwa terdapat senyawa bioaktif yang dihasilkan spons, ternyata merupakan senyawa bioaktif yang disintesis mikroorganisme simbionnya (Brammavidhya 2013). Mikroorganisme yang berasosiasi dengan spons menempati sejumlah 40 - 60% dari jaringan spons dengan densitas 109 sel/mL dari jaringan spons. Mikroorganisme yang berasosiasi dengan spons merupakan kompetitor yang baik pada lingkungan perairan karena kemampuannya mensintesis berbagai senyawa bioaktif (Taylor et al. 2007).
Senyawa bioaktif yang dihasilkan mikroorganisme yang berasosiasi dengan spons umumnya memiliki struktur yang lebih kompleks, unik dan aktivitas yang lebih baik jika dibandingkan dengan mikroorganisme terestrial. Hal tersebut dikarenakan, pada lingkungan perairan laut tekanan kondisi lingkungan sangat tinggi, sehingga menginduksi mikroorganisme untuk mensintesis berbagai senyawa metabolit sekunder yang berperan dalam suksesi ekologi di lingkungan (Jeganathan 2013). Beberapa penelitian melaporkan bahwa mikroorganisme yang berasosiasi dengan spons menghasilkan berbagai senyawa bioaktif yang berpotensi sebagai agens antimikrob, antifungal, antioksidan, antikanker, antiinflamasi, antivirus, dan antitumor (Taylor et al. 2007).
untuk mengobati berbagai penyakit infeksi yang disebabkan oleh bakteri atau yeast patogen. Pseudomonas aeruginosa merupakan mikroorganisme patogen yang dapat menyebabkan infeksi saluran kemih, infeksi mata dan infeksi luka menimbulkan nanah berwarna hijau. Staphylococcus aureus dilaporkan dapat menyebabkan keracunan makanan, bisul bernanah, mual, muntah dan diare (Pelczhar dan Chan 1988). Candida albicans merupakan salah satu contoh yeast
patogen yang bersifat akut dan dapat menginfeksi mulut, vagina, kulit, kuku bahkan paru-paru (Made et al. 2014). Permasalahan yang muncul mendorong upaya pengembangan berbagai senyawa antibiotik baru yang dapat berperan sebagai agens terapi dari infeksi yang disebabkan oleh bakteri maupun yeast patogen. Salah satu alternatif solusi permasalahan ialah dengan melakukan eksplorasi senyawa bioaktif dari mikroorganisme yang berasosiasi dengan spons yang telah diketahui memiliki potensi untuk dimanfaatkan sebagai agens terapi berbagai penyakit infeksi. Berbagai potensi dari senyawa antimikrob yang disintesis oleh mikroorganisme yang berasosiasi dengan spons telah banyak dilaporkan. Komponen bioaktif sebagai senyawa antimikrob pada mikroorganisme yang berasosiasi dengan spons jenis Aplysina sp. yaitu isolat A23 mampu menghambat strain bakteri patogen resisten antibiotik S. aureus dan E. coli (Pastra 2012).
Komponen bioaktif antioksidan asal laut merupakan komponen senyawa bioaktif yang menjanjikan. Dewasa ini senyawa antioksidan banyak dimanfaatkan sebagai agens terapi. Hal tersebut sejalan dengan peningkatan pengetahuan masyarakat mengenai efek radikal bebas yang mampu meningkatkan resiko terjangkitnya berbagai penyakit degeneratif seperti infeksi gastrointestinal, katarak, penyakit jantung, kanker, stroke, dan asma (Hanani 2005). Konsumsi antioksidan sintetik dalam jangka panjang dikhawatirkan dapat menimbulkan efek samping dan membahayakan organ tubuh. Faktor tersebut mendorong dilakukannya pencarian berbagai senyawa antioksidan alami untuk mendapatkan senyawa antioksidan dengan aktivitas yang lebih baik dan spesifik (Kikuzaki et al.
2002). Berbagai potensi dari senyawa bioaktif yang dihasilkan oleh mikrob yang berasosiasi dengan spons, terutama senyawa antioksidan telah banyak dilaporkan. Aktivitas antioksidan dari senyawa hexadekanoic acid berhasil diisolasi dari bakteri Nocardiopsis dassonvillei MAD08 yang berasosiasi dengan spons
3
Perumusan Masalah
Indonesia memiliki letak geografis yang strategis karena dikelilingi oleh samudra Pasifik dan Hindia. Hal ini menyebabkan Indonesia kaya akan berbagai Sumberdaya perairan. Tingginya diversitas biota laut Indonesia akan meningkatkan kesempatan untuk mendapatkan berbagai sumber senyawa bioaktif baru. Nilai ekonomi industri farmasi laut Indonesia sesungguhnya lebih tinggi jika dibandingkan dengan Sumberdaya perikanan, namun eksplorasinya masih sangat rendah, hanya 10% dari estimasi nilai ekonomi senyawa bioaktif laut (Mulyana 2008).
Mikroorganisme yang berasosiasi dengan spons merupakan salah satu produsen senyawa antimikrob atau disebut dengan antibiotik. Antibiotik merupakan senyawa yang memiliki kemampuan untuk menghambat mikroorganisme dalam kadar rendah. Aktivitas penghambatan dibedakan menjadi spektrum luas dan spesifik spesies. Aktivitas antimikrob meliputi mekanisme penghambatan dengan cara mendegradasi komponen dinding sel, menghambat proses sintesis protein dan asam nukleat, mengganggu permebialitas sel, lisis sel dan inaktivasi enzim. Senyawa metabolit sekunder yang bersifat antimikrob dapat berubah strukturnya ketika diproduksi pada kondisi di laboratorium. Hal ini disebabkan karena perubahan kondisi pertumbuhan, tidak adanya tekanan lingkungan dan kompetisi dengan konsorsium bakteri di habitat asalnya (Hentschel et al. 2001).
Antioksidan adalah salah satu bentuk potensi farmasi laut Indonesia. Mikroorganisme yang berasosiasi dengan spons merupakan salah satu objek penelitian dalam rangka pencarian senyawa antioksidan baru. Hal tersebut dikarenakan spons bersimbiosis dengan berbagai mikroorganisme autotrof yang melakukan proses fotosintesis, sehingga oksigen yang dihasilkan akan memicu terjadinya stress oksidatif, selain itu ekspos dari berbagai sumber radikal bebas berupa limbah yang dibuang, toksin dan intensintas radiasi UV yang terus menerus mengindikasikan terdapatnya suatu aktivitas antioksidan pada organisme spons (Wahab et al. 2013).
Tujuan
Penelitian ini bertujuan untuk mengisolasi dan menapis bakteri yang berasosiasi dengan spons Stylotalla sp. penghasil senyawa bioaktif antimikrob yang berpotensi sebagai antioksidan, serta mendapatkan identifikasi bakteri penghasilnya berdasarkan sekuen gen 16S rRNA.
Hipotesis Penelitian
1. Isolat bakteri yang berasosiasi dengan spons memiliki kemampuan dalam menghambat bakteri dan yeast uji
2. Pemilihan jenis pelarut pada tahap ekstraksi akan mempengaruhi nilai aktivitas senyawa antimikrob dan antioksidan
3. Ekstrak senyawa bioaktif dari bakteri yang berasosiasi dengan spons memiliki aktivitas antioksidan dalam meredam radikal CUPRAC dan DPPH 4. Terdapat ekstrak isolat bakteri tertentu yang memiliki potensi tertinggi dan
dapat dikembangkan sebagai salah satu sumber antimikrob dan antioksidan natural
5. Terdapat kandungan senyawa aktif metabolit sekunder pada ekstrak bakteri yang berasosiasi dengan spons sehingga memiliki aktivitas antimikrob dan antioksidan
Ruang Lingkup Penelitian
Penelitian ini mencakup pengambilan sampel spons yang dilakukan di Pulau Bira, isolasi dan pengkulturan bakteri yang berasosiasi dengan spons, karakterisasi visual morfologi bakteri yang berasosiasi dengan spons, uji penapisan senyawa antimikrob pada bakteri dan yeast uji, analisis patogenisitas melalui uji hemolisis, ekstraksi senyawa bioaktif, penentuan aktivitas antioksidan dengan metode DPPH dan CUPRAC, penentuan nilai KHM (Konsentrasi Hambat Minimum) pada beberapa bakteri dan yeast, uji kandungan kimia, identifikasi bakteri yang berasosiasi dengan spons berdasarkan sekuen gen 16S rRNA.
Manfaat Penelitian
5
2 TINJAUAN PUSTAKA
Potensi Perairan Indonesia
Berbagai potensi sumber daya perairan Indonesia tersebar di beberapa kepulauan, terutama di daerah laut dangkal. Salah satu Pulau yang memiliki potensi farmasi laut adalah pulau Bira. Pulau Bira berada di wilayah Kepulauan Seribu dengan luas 29.13 Ha dan jumlah penduduk sebesar 504 jiwa. Pulau ini memiliki biodiversitas laut yang tinggi dengan kondisi perairan yang rendah dari pencemaran, sehingga organisme invertebrata perairan, terutama spons mudah untuk ditemukan (Lampiran 1) (Mulyana 2008). Porifera spons merupakan organisme yang menyumbangkan produk hayati tertinggi jika dibandingkan dengan filum organisme laut lainnya (Gambar 1). Jumlah total komponen yang telah berhasil diisolasi dari hewan spons dari tahun 2001 hingga 2010 mencapai lebih dari 2400 jenis produk hayati, dimana lebih dari dua puluh jenis senyawa bioaktif laut dilaporkan dari spons yang berasal dari Indonesia (Mehbub et al.
2014).
Gambar 1 Jumlah produk hayati laut berdasarkan filum organisme laut pada tahun 2001-2010 (Mehbub et al. 2014)
Potensi Bakteri yang Berasosiasi dengan Organisme Spons
Spons merupakan invertebrata multiseluler primitif (700-800 juta tahun) yang digolongkan ke dalam filum porifera. Hewan ini melekat pada suatu area substrat air laut maupun air tawar dan mendapatkan makanan dengan sistem penyaringan kolom air di sekitarnya (filter feeder) melalui ostia yang terdapat di seluruh permukaan tubuh. Spons dapat ditemui pada kedalaman 0.5 hingga ribuan meter di dasar perairan. Filum porifera ini dibagi menjadi tiga kelas, yaitu
Spons merupakan invertebrata yang banyak diteliti dalam beberapa dekade terakhir. Hal tersebut dikarenakan spons mampu menghasilkan berbagai macam senyawa bioaktif yang berperan penting dalam bidang farmakologi, bioteknologi dan biomedik. Induksi senyawa bioaktif tersebut diduga karena spons menggunakan metode filter feeder untuk memperoleh komponen nutrisi, sehingga porifera tesebut harus berkompetisi secara luas terhadap kondisi lingkungan, mikroorganisme patogen, kompetitor dan predator (kura-kura, ikan, udang). Faktor tersebut menyebabkan spons sangat bergantung pada senyawa bioaktif metabolit sekunder sebagai bentuk pertahanan utama (Perdicaris et al 2013). Menariknya ternyata diindikasikan senyawa bioaktif yang dihasilkan spons merupakan senyawa bioaktif yang disintesis oleh mikroorganisme yang berasosiasi dengan spons. Pada beberapa penelitian secara signifikan ditemukan adanya kesamaan struktur senyawa bioaktif yang berhasil diisolasi dari spons dengan taksa yang berbeda dan saling terisolasi secara geografi (niche isolation). Struktur mycalamide A dan B yang berhasil diisolasi dari spons Mycale hentscheli
di pelabuhan Dunedin (New Zealand) memiliki kesamaan struktur pada spons
Paederus beetle di Amerika Selatan (Perry et al. 1998). Dalam perpustakaan gen 16S rRNA dan DGGE diinfomasikan bahwa terdapat 14 filum bakteri yang berhasil ditemukan berasosiasi dengan spons, yaitu Acidobateria, Actinobacteria, Bacterioidetes, Chloroflexi, Cyanobacteria, Deinococcus-Thermus, Firmicutes, Gemmatimonadetes, Nitrospira, Planctomycetes, Proteobacteria, Spirochaetes, Verrucomicrobia, dan Poribacteria (Taylor et al. 2007).
Gambar 2 Persentase temuan senyawa bioaktif berdasarkan filum bakteri yang berasosiasi dengan spons (Abdelmohsen et al. 2014)
Distribusi komponen senyawa bioaktif pada mikroorganisme yang berasosiasi dengan spons didominasi oleh filum Actinobacteria dengan temuan senyawa bioaktif tertinggi, hingga mencapai hampir 50% dari seluruh temuan senyawa bioaktif. Temuan senyawa bioaktif dengan jumlah terendah terdapat pada filum bacteroidetes, yaitu sebesar 4.8 % (Gambar 2) (Abdelmohsen et al. 2014).
Bakteri yang berasosiasi dengan spons dapat hidup secara ekstraseluller dan intraseluller. Bakteri yang berasosiasi dengan dikatakan intraseluller jika secara permanen berada didalam sel inang atau nukleus. Yang berasosiasi dengan ekstraseluller terdiri dari bakteri yang hidup pada lapisan permukaan spons, yang
7
disebut dengan eksosimbion dan bakteri yang mendiami mesohil spons (endosimbion) (Lee et al. 2001). Asosiasi bakteri dan spons dapat terjadi secara mutualisme maupun parasitisme. Beberapa bentuk simbiosis mutualisme antara spons dan bakteri ialah mikroorganisme terlibat dalam sintesis senyawa bioaktif metabolit sekunder untuk meningkatkan sistem pertahanan tubuh inang spons (Dhinakaran et al. 2012). Metabolit sekunder juga memiliki peranan penting dalam komunikasi, kompetisi ekologi dan perlindungan terhadap infeksi (Radjasa
et al. 2007).
Metabolit Sekunder
Jenis senyawa bioaktif antimikrob merupakan salah satu jenis metabolit sekunder. Senyawa ini merupakan substansi hasil biosintesis turunan metabolit primer yang sudah tidak dibutuhkan lagi untuk pertumbuhan, perkembangan dan metabolisme utama mikroorganisme. Sintesis senyawa metabolit sekunder diinduksi oleh kondisi stres lingkungan dan kompetisi dengan organisme pada populasi, rendahnya intensitas cahaya, nutrisi, kompetitor, dan predator (Murniasih 2003).
Sintesis metabolit sekunder memiliki peran penting dalam suksesi ekologi organisme di lingkungan. Senyawa bioaktif ini diinduksi pada fase pertumbuhan stasioner dimana sumber nutrisi sangat terbatas. Metabolit sekunder juga berfungsi dalam kompetisi untuk mendapatkan substrat, terutama pada lingkungan perairan dengan diversitas organisme dan tekanan lingkungan yang sangat tinggi. Hal tersebut menyebabkan komponen senyawa metabolit sekunder yang diisolasi dari mikroorganisme yang berasosiasi dengan spons cenderung memiliki aktivitas yang kuat. Senyawa metabolit sekunder juga berperan dalam komunikasi dan perlindungan terhadap infeksi, melindungi inang dari predator dan kompetitor. Bagi bakteri yang berasosiasi dengan, senyawa ini dapat mencegah fagositosis dari predator, seperti amoeba (Radjasa et al. 2007). Senyawa metabolit sekunder juga merupakan salah satu bentuk faktor virulensi sehingga mikroorganisme tidak dapat dikenali oleh sistem pertahanan tubuh spons. Berbagai jenis senyawa antimikrob yang dihasilkan oleh mikrob yang berasosiasi dengan spons telah banyak dilaporkan, seperti andrimid, nukleosida, makrolida, poliketid, peptida, meridine, wondosterol, swinholide. Senyawa tersebut berpotensi baik sebagai antibakteri maupun antifungal (Lee et al. 2001).
Mikroorganisme Patogen
Mikroorganisme patogen merupakan jenis bakteri, cendawan ataupun virus yang memiliki sifat patogenisitas, selain dapat menyebabkan kerugian pada inang, mikroorganisme ini bertanggung jawab dalam menyebabkan berbagai macam penyakit. Beberapa contoh mikroorganisme patogen ialah Enteropatogenik Eschericia coli (EPEC) yang dapat mempengaruhi proses seluler, menyebabkan penyakit intestinal maupun extraintestinal, seperti diare akut, infeksi saluran urin dan meningitis (Kaper et al. 2004). Yeast patogen
fungemia, infeksi kerongkongan, penyakit kronis kandidiasis dan osteomyelitis. Senyawa metabolit sekunder sebagai antimikrob merupakan salah satu agens terapi untuk menyembuhkan berbagai penyakit yang disebabkan infeksi bakteri patogen (Desnos et al. 2008).
Konsentrasi Hambat Minimum (KHM)
Konsentrasi Hambat Minimum merupakan konsentrasi terendah dari suatu antimikrob yang memiliki kemampuan untuk menghambat pertumbuhan mikroorganisme uji. Tujuan utama dalam penentuan KHM ialah untuk mendapatkan dosis yang tepat dalam aplikasi antimikrob sebagai agens
kemoteurapeutik dan juga mendapatkan informasi sensitivitas dari mikroorganisme uji terhadap senyawa antimikrob (Madigan et al. 2006). Semakin rendah nilai konsentrasi KHM, maka aktivitas penghambatan antimikrob dan sensitivitas mikrooganisme uji semakin tinggi. Nilai KHM suatu senyawa antimikrob spesifik pada setiap strain mikroorganisme (Zahin et al. 2010).
Komponen Senyawa Bioaktif Antioksidan
Radikal bebas merupakan molekul yang mengandung elektron yang tidak berpasangan pada orbit luarnya. Radikal bebas memiliki sifat sebagai penerima elektron yang tidak stabil dan bereaktivitas tinggi. Senyawa ini memiliki kecenderungan berikatan dengan elektron molekul disekitarnya untuk melengkapi kekurangan elektron dan menghasilkan radikal baru berupa senyawa yang bersifat toksik terhadap sel. Radikal baru akan berikatan dengan molekul lain dan membentuk kembali molekul radikal, sehingga terbentuk rantai reaksi radikal dan menginduksi stress oksidatif. Aktivitas ini mengakibatkan kerusakan sel, jaringan maupun fungsi genetik yang bermuara pada oksidasi protein, lemak, asam nukleat. Aktivitas radikal bebas akan memicu timbulnya berbagai penyakit degeneratif, seperti jantung koroner, hepatitis, alzheimer, prosess penuaan, katarak yang berujung pada kanker dan hilangnya aktivitas enzim (Hanani 2005)..
Radikal bebas dapat bersumber dari luar maupun dari dalam tubuh. Radikal bebas endogen merupakan radikal yang bersumber dari proses fisiologis dan biokimia normal didalam tubuh (metabolisme oksigen), seperti fagositosis dalam respirasi, oksidasi ion logam maupun oksidasi enzimatik. Radikal eksogen merupakan radikal yang berasal dari luar tubuh (lingkungan), seperti radiasi UV, alkohol, pupuk, pestisida, polutan, logam berat, bahan pengawet, x-ray, ozon, dan asap rokok (Rohmatussolihat 2009; Wahab et al. 2013).
Terdapat berbagai metode pengukuran aktivitas antioksidan, salah satunya ialah dengan menggunakan radikal DPPH ( 2,2- diphenyl-1-picrylhydrazyl). Radikal DPPH merupakan suatu senyawa organik berupa serbuk berwarna ungu tua yang mengandung nitrogen yang tidak stabil. DPPH akan bereaksi dengan komponen senyawa aktif tertentu pada ekstrak uji yang memiliki kemampuan untuk mendonorkan atom Hidrogen (Utami 2014). Semakin banyak gugus hidroksil dari suatu senyawa maka aktivitasnya dalam menghambat radikal DPPH semakin tinggi. Penambahan larutan etanol dalam uji berperan dalam mempertahankan kestabilan DPPH (Kikuzaki et al. 2002).
Aktivitas antioksidan DPPH dapat diukur dengan menghitung besarnya persentase inhibisi, yaitu besarnya aktivitas senyawa antioksidan yang dapat meredam radikal bebas DPPH. Besarnya hambatan dianalisis dengan membandingkan absorban blangko DPPH dengan absorban sampel uji yang diukur serapan cahayanya dengan menggunakan ELISA. Persentase inhibisi dapat dihitung dengan menggunakan rumus (Andayani et al. 2008) :
x100%
AK : Absoransi kontrol radikal DPPH (blanko) pada panjang gelombang 517 nm AS : Absorbansi sampel pada panjang gelombang 517 nm
Secara kuantitatif aktivitas antioksidan dalam meredam radikal DPPH dapat ditentukan dengan parameter IC50, yaitu besarnya konsentrasi senyawa
antioksidan yang mampu menghambat 50% aktivitas radikal senyawa DPPH. Penentuan nilai IC50 diawali dengan mencari konsentrasi aktif pada senyawa uji
dengan penghitungan %inhibisi, selanjutnya konsentrasi diturunkan pada kisaran beberapa konsentrasi efektif yang dapat menunjukkan aktivitas penghambatan sebesar 50%. Nilai IC50 ditentukan melalui persamaan regresi linier % inhibisi
berbagai konsentrasi sebagai sumbu y dan konsentrasi ekstrak sebagai sumbu x. Semakin rendah nilai IC50 maka aktivitas antioksidannya semakin tinggi
(Molyneux 2004).
Cuprac (Cupric Reducing Antioxidant Capacity) merupakan salah satu metode pengukuran aktivitas antioksidan dengan melarutkan sampel uji dan beberapa reagen, yaitu CuCl2, neucuproine, dan bufer ammonium asetat yang
diatur pada pH 7. Pengaturan pH dimaksudkan untuk menjaga kestabilan reagen CUPRAC. Pencampuran tersebut akan menyebabkan terjadinya reaksi redoks dari adanya aktivitas antioksidan dengan reagen CUPRAC. Kompleks bis-neucuproine-tembaga (II) akan tereduksi dengan adanya aktivitas antioksidan sehingga akan membentuk kelat neucuproin-tembaga (I) yang serapan cahayanya dapat diukur dengan panjang gelombang maksimal 450 nm. Larutan berwarna biru dari reagen CUPRAC yang tereduksi akan mengalami perubahan warna menjadi kuning-jingga yang menandakan pembentukan kompleks Cu(I)-Nc (Apak
11
3 METODE
Waktu dan Tempat
Penelitian dilaksanakan pada bulan Juni 2014 hingga Februari 2015 di Laboratorium Mikrobiologi Departemen Biologi, Laboratorium Kimia Organik Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor dan Laboratorium Pusat Studi Penelitian Biofarmaka LPPM IPB. Penelitian ini berlangsung ke dalam beberapa tahapan. Alur kerja penelitian terangkum pada Gambar 4.
Bahan
Material sampel spons didapatkan dengan pencarian sampel spons Stylotella
sp. koleksi Pulau Bira, daerah Kepulauan Seribu, Jakarta. Mikroorganisme uji yang digunakan: EPEC (Enteropathogenic Escherichia coli), E. coli ATCC 8739, S. aureus, P. aeruginosa, C. albicans dan B. subtilis didapatkan dari koleksi Laboratorium IPBCC IPB. Media yang digunakan merupakan media agar-agar darah, media SWC (Sea Water Complete), NA (Nutrient Agar), MA Marine agar,
SCA (Starch Casein Agar), ZMA (Zobel Marine Agar). Bahan-bahan lain yang digunaka diantaranya akuades, etil asetat, diklorometana, metanol, DMSO, etanol, HCl pekat, n-amil alkohol, anhidrida asetat, kloroform-amoniak, H2SO4 2 M,
pereaksi Mayer, Dragendorf, Wagner, serbuk Mg, pereaksi FeCl3 1%, NaOH 10%,
radikal DPPH, EDTA, Lisozim, Tris HCl, Proteinase-K, PCI, master mix PCR, Agarose 1%, (Ethidium romida) EtBr, Loading Dye, ddH2O, ice gell, DPPH,
neucuproin, CuCl2, Ammonium asetat.
Alat
Beberapa alat yang digunakan dalam penelitian ini adalah coolbox,
Gambar 4 Alur tahapan penelitian Koleksi Sampel Spons Stylotella sp.
Isolasi dan purifikasi bakteri yang berasosiasi dengan spons
Skriningawal untuk mengindikasikan isolat memproduksi senyawa bioaktif antimikrob terhadap
bakteri dan yeast patogen manusia
Skrining lanjutan dengan menggunakan pelet massa sel bakteri yang berasosiasi dengan spons
13
Prosedur
Pengambilan Sampel
Pengambilan sampel spons dilakukan di Pulau Bira, Kepulauan Seribu, Indonesia dengan metode sampling secara acak. Sampel diambil dengan menggunakan teknik selam permukaan (snorkling) pada tingkat kedalaman 1.5 meter hingga 3 meter dari permukaan laut. Spons kemudian dimasukkan ke dalam plastik sampel steril yang telah berisi air laut dan diberi ruang udara, lalu sampel dimasukkan ke dalam cool box yang berisi ice gel dan dibawa ke laboratorium untuk dilakukan isolasi dan identifikasi bakteri yang berasosiasi dengan spons. Isolasi dan Pengkulturan Bakteri yang Bersimbiosis dengan Spons
Sampel spons diiris seberat 1 g dengan menggunakan pisau steril. Sampel dibersihkan dari partikel kotoran dengan menggunakan air laut steril. Potongan spons ditempatkan pada mortal dan pastel steril. Air laut steril ditambahkan sebanyak 10 mL, kemudian sampel digerus hingga halus selama 4 – 5 menit. Setelah halus, sampel dimasukkan ke dalam tabung 15 mL, kemudian dibuat seri pengenceran 10-1, 10-2, 10-3, 10-4 dan 10-5 menggunakan NaCl 0.85%, pada empat seri pengenceran terakhir disebar pada cawan petri dengan media Sea Water Complete (SWC) (5 g bacto pepton, 1 g ekstrak yeast, 3 mL gliserol, 750 mL air laut dan 250 mL akuades), Starch Casein Agar (SCA) (kasein 1 g, soluble starch
10 g, NaCl 20 g, agar-agar 20 g, akuades 1 L) , Nutrien Agar (NA) (nutrient broth
13 g, akuades 1 L, agar-agar 20 g), Zobel Marine Agar (ZMA) (zobel medium broth 40.25 g, akuades 1 L, agar-agar 20 g) dan Marine Agar (MA) (pepton 0.5 g,
yeast extract 0.1 g, air laut 1 L, agar-agar 20 g) ± 15 mL (Lampiran 2). Sampel diinkubasi pada suhu ruang selama 48 jam. Koloni yang tumbuh diidentifikasi secara morfologi. Setiap koloni yang berbeda diberi kode koloni dan dipurifikasi dengan cara digores pada media SWC. Koloni kemudian dimurnikan dengan metode kuadran dan disimpan pada agar-agar miring, sebagai kultur stok.
Penapisan Mikroorganisme Uji untuk Memilih Isolat Berpotensi
Pengujian awal aktivitas senyawa antimikrob terhadap bakteri dan khamir menggunakan teknik SWC atau PDA, Jenis medium untuk uji penghambatan terhadap antibakteri menggunakan medium SWC sedangkan untuk uji anti yeast
menggunakan PDA. Sebanyak 1 mL kultur cair mikrob yang akan diuji ( EPEC, E. coli ATCC 8739, S. aureus, P. aeruginosa, C. albicans dan B. subtilis) (umur 24 jam) dimasukkan ke dalam 100 mL medium dan dituangkan ke dalam cawan petri. Setelah itu isolat bakteri asal spons digoreskan (single streak) pada permukaannya dan diinkubasi selama 24 jam pada suhu 37oC. Senyawa antimikrob yang dihasilkan diindikasikan dengan keberadaan zona bening di sekitar koloni bakteri (Anand et al. 2006).
Pengukuran zona hambat senyawa antimikrob dari isolat bakteri yang berasosiasi dengan spons dilakukan dengan menggunakan metode Anand et al.
disentrifugasi dengan kecepatan 8000 rpm selama 5 menit. Supernatan dibuang sedangkan pelet massa sel diteteskan sebanyak 10 µL pada media SWC padat. Massa sel diinkubasi selama tiga hari pada suhu 37oC. Selanjutnya media SWC padat yang telah ditetesi massa sel isolat dituang 5 mL media semisolid NA atau PDA (untuk uji pada yeast patogen) yang telah dimasukkan isolat patogen uji sebanyak 1% dari volume media dan diinkubasi pada suhu 37oC selama 24 jam. Aktivitas penghambatan diukur melalui diameter zona jernih yang terbentuk, sehingga akan didapatkan isolat berpotensi. Aktivitas penghambatan dilakukan pada bakteri dan khamir patogen : EPEC, E. coli ATCC 8739, S. aureus, P. aeruginosa, C. albicans, dan B. subtilis.
Uji Hemolisis
Isolat bakteri yang memiliki potensi penghambatan terhadap strain
patogen pada manusia diuji patogenisitasnya dengan melakukan uji hemolisis. Isolat potensial ditumbuhkan dalam media agar-agar darah, lalu diinkubasi selama 24 jam pada suhu ruang. Zona bening yang terbentuk menandakan bahwa isolat tersebut sangat patogen terhadap manusia, karena mampu menghidrolisis media agar-agar darah, sehingga tidak dilakukan pengujian secara lanjut pada isolat tersebut (Tokasaya 2010).
Ekstraksi Senyawa Bioaktif
Isolat bakteri potensial dikulturkan pada 100 mL SWC broth sebagai kultur starter, kemudian dinkubasi selama 24 jam pada suhu 37 oC. Ekstraksi senyawa antimikrob menggunakan metode Sunaryanto et al. (2010) dan Aduol (2012) yang telah dimodifikasi, dimana 1% isolat bakteri starter dikulturkan pada 1 L media SWC. Kultur diinkubasi pada inkubator bergoyang dengan suhu 30 oC dengan kecepatan 100 rpm selama 3 hari hingga mencapai fase stasioner, setelah itu dilakukan penambahan etil asetat dengan perbandingan kultur berbanding etil asetat (1 : 0.75). Penambahan pelarut dilakukan sebanyak dua kali. Kedua fase dihomogenisasi dengan kecepatan 250 rpm selama 12 jam untuk setiap perlakukan pada suhu ruang. Kultur yang memiliki pigmen disentrifugasi pada kecepatan 8000 rpm selama 20 menit, kemudian supernatan dilarutkan menggunakan pelarut semipolar etil asetat dengan perbandingan (1 : 0.75), sedangkan pelet kultur dilarutkan dengan menggunakan pelarut nonpolar diklorometana dan pelarut polar metanol sebanyak 100 mL pada 10 g pelet. Penambahan pelarut baik pelet maupun supernatan dilakukan sebanyak 2 kali dan dihomogenisasi dengan menggunakan stirer pada kecepatan 250 rpm selama 24 jam untuk setiap perlakukan pada suhu ruang. Lapisan atas pelet yang terbentuk berupa pelarut metanol dan diklorometana dipisahkan dari residu endapan, selanjutnya larutan etil asetat, diklorometana dan metanol dikeringkan dengan menggunakan rotary evaporator pada suhu 45 oC untuk mendapatkan ekstrak kasar. Ekstrak kasar divakum dan disimpan pada suhu dibawah 5 oC untuk pengujian selanjutnya.
Penentuan Aktivitas Antimikrob
15
mg/mL; 0.1 mg/mL). Uji aktivitas senyawa antimikrob ekstrak kasar bakteri dilakukan menggunakan metode cakram berdiameter 6 mm. Cakram ditetesi 13 µL ekstrak kasar dengan lima konsentrasi bertingkat, kemudian cakram yang masih mengandung pelarut dikeringkan dengan pengering rambut dan diuapkan dengan oven pada suhu 40 oC, sehingga hanya ekstrak kasar saja yang terdapat pada kertas cakram. Kertas cakram diletakkan pada permukaan media agar-agar semisolid yang telah mengandung 1% isolat uji (umur 24 jam). Kontrol positif yang digunakan merupakan antibiotik ampicillin 5 mg/mL. Cawan diinkubasi pada suhu 37 oC selama 24 jam. KHM didefinisikan sebagai konsentrasi terendah dari substansi yang mampu menghambat pertumbuhan dari mikroorganisme uji (Fitriani 2014).
Penentuan Aktivitas Antioksidan Menggunakan Metode DPPH
Aktivitas antioksidan dianalisis menggunakan metode DPPH dengan kontrol positif absorban berupa vitamin C dengan konsentrasi 16 ppm. Ekstrak kasar sebanyak 0.01 g dilarutkan ke dalam 1 mL DMSO untuk pembuatan stok larutan 10000 ppm, kemudian ekstrak kasar bakteri potensi dilarutkan dengan etanol pada konsentrasi 1000 ppm dalam sumuran microplate. Setiap sumuran ditambahkan 100 µL radikal DPPH 0.004%. Sampel blangko merupakan DPPH yang ditambahkan 100 µL etanol. Selanjutnya sampel dalam sumuran diinkubasi selama 30 menit pada suhu 37oC dalam keadaan gelap. Absorbansi dihitung dengan menggunakan metode spektrofotometer ELISA pada panjang gelombang 517 nm (Utami et al. 2014). Aktivitas persentase peredaman dihitung dengan
AK : Absoransi kontrol radikal DPPH (blanko) pada panjang gelombang 517 nm AS : Absorbansi sampel pada panjang gelombang 517 nm
Aktivitas antioksidan pada konsentrasi 1000 ppm dengan % inhibisi > 60% dilanjutkan untuk penghitungan nilai IC50 yang dihitung berdasarkan
persamaan kurva eksponensial.
Penentuan Aktivitas Antioksidan Menggunakan Metode CUPRAC
Ekstrak kasar sebanyak 1 mL di dalam etanol ditambahkan 1 mL 7.5 x 10
-3
M Neucoprine, 1 mL 10-2 M CuCl2, 1 mL 1 M NH4Ac dan 0,1 mL H2O. Volume
total larutan yang diperoleh sebesar 4.1 mL diinkubasi selama 30 menit, kemudian dilakukan pembuatan kurva standar menggunakan troloks dengan konsentrasi 50, 75, 100, 150, 200, dan 400 µM. Absorbansi sampel dan kurva standar diukur dengan menggunakan spektrofotometer pada panjang gelombang 450 nm (Apak
Uji Kualitatif Kandungan Senyawa Bioaktif
Kandungan senyawa kimia dari isolat bakteri yang memiliki potensi antioksidan terbaik (lima ekstrak) dianalisis untuk mendeteksi adanya kandungan senyawa alkaloid, flavonoid, saponin, steroid, tanin, dan terpenoid (Harborne 1987).
Identifikasi golongan alkaloid
Sebanyak 0.1 g ekstrak kasar ditambahkan 10 mL kloroform dan 2 mL ammonia, kemudian larutan disaring, filtrat ditambahkan dengan lima tetes H2SO4
pekat 2 M. Larutan dikocok sehingga membentuk dua lapisan. Fraksi asam pada lapisan atas dipindahkan dalam tabung reaksi dan masing-masing diberi penambahan 5 tetes pereaksi Mayer, Wagner dan Dragendorf. Adanya kandungan alkaloid terlihat pada pereaksi Mayer dengan terbentuknya endapan berwarna putih, sedangkan hasil positif pada pereaksi Wagner ditandai dengan adanya endapan cokelat dan hasil positif pada pereaksi dragendorf ditandai dengan adanya endapan kuning kemerahan.
Identifikasi golongan flavonoid
Ekstrak kasar isolat bakteri potensi masing-masing ditimbang sebanyak 0.1 g lalu ditambahkan kloroform : air (1 : 1), kemudian diletakkan dalam tabung reaksi dan dikocok. Selanjutnya larutan didiamkan hingga terberntuk 2 lapisan. Lapisan atas dipindahkan kedalam tabung reaksi dan ditambahkan 0,1 g serbuk magnesium, 1 mL HCl pekat dan 1 mL amil alkohol. Campuran kemudian divortex, ekstrak positif mengandung senyawa golongan flavonoid jika terbentuk warna merah, jingga dan kuning pada lapisan amil alkohol.
Identifikasi golongan saponin
Ekstrak kasar isolat bakteri potensi masing-masing ditimbang sebanyak 0.1 g lalu ditambahkan kloroform air (1 : 1) 5 mL, kemudian diletakkan dalam tabung reaksi dan dikocok, selanjutnya larutan didiamkan hingga terberntuk 2 lapisan. Lapisan bawah disaring dengan menggunakan kertas saring. Residu berbentuk serbuk dimasukkan ke dalam beaker glass dan ditambahkan 5 mL akuades dan dipanaskan selama 5 menit hingga mendidih. Campuran didinginkan dan dikocok kuat-kuat selama 5 menit dalam keadaan tertutup, jika terbentuk buih stabil yang tidak hilang dalam waktu 10 menit, mengindikasikan adanya golongan senyawa saponin pada ekstrak bakteri potensial.
Identifikasi golongan steroid
Ekstrak kasar isolat bakteri potensi masing-masing ditimbang sebanyak 0.1 g lalu ditambahkan kloroform air (1 : 1), kemudian diletakkan dalam tabung reaksi dan dikocok. Selanjutnya larutan didiamkan hingga terberntuk 2 lapisan. Lapisan bawah disaring dengan menggunakan kertas saring. Filtrat diambil kemudian filtrat diteteskan pada plat tetes dan dikeringkan dengan proses penguapan. Larutan diberi tambahan reagen Lieberman Burchard pada residu hasil penguapan. Adanya kandungan senyawa steroid ditandai dengan terbentuknya warna biru-hijau pada larutan.
Identifikasi golongan terpenoid
17
Larutan diberi tambahan reagen Lieberman Burchard pada residu hasil penguapan. Adanya kandungan senyawa terpenoid ditandai dengan terbentuknya warna merah pada larutan.
Isolasi DNA Genom
Isolasi DNA genom isolat akteri terpilih dilakukan menggunakan metode CTAB sesuai dengan Cheng et al. (2003). Isolat stok disubkultur pada media SWC lalu diinkubasi 24 jam pada suhu ruang dengan menggunakan inkubator bergoyang. Sebanyak 1.5 mL kultur isolat dimasukkan ke dalam eppendorf, lalu disentrifugasi pada kecepatan 10000 rpm selama 8 menit. Supernatan yang terbentuk dibuang, sedangkan pelet ditambahkan dengan 250 µL Buffer TE (Tris-EDTA pH 7.6) dan dilakukan resuspensi, lalu disentrifugasi kembali dengan kecepatan 8000 rpm selama 10 menit. Suspensi ditambahkan dengan 5 µL lisozim 20 mg/mL dan dihomogenisasi dengan cara membolak-balikkan tabung, kemudian diinkubasi selama 30 menit dengan suhu 37 oC. Setelah diinkubasi, sel dilisiskan dengan penambahan 500 µL SDS 10% dan 10 µL proteinase K suspensi larutan. Suspensi dihomogenisasi dengan membolak-balikkan eppendorf, lalu diinkubasi kembali pada suhu 37oC selama 60 menit dan ditambahkan dengan 80 µL NaCl 5 M dan 100 µL CTAB 10%. Suspensi diinkubasi kembali selama 30 menit dengan suhu 65 oC.
Tahapan purifikasi dan pengendapan DNA (presipitasi) dilakukan dengan penambahan 650 µL PCI (fenol : kloroform : isoamil alkohol) (25:24:1). Suspensi disentrifugasi dengan kecepatan 14.000 rpm selama 10 menit. Supernatan yang mengandung DNA kemudian dipindahkan pada eppendorf yang berbeda, lalu ditambahkan 650 µL CI (kloroform : Isoamil alkohol) (25 : 1), kemudian dihomogenisasi secara swirling. Suspensi disentrifugasi kembali dengan kecepatan 14.000 rpm selama 10 menit. Setelah disentrifugasi maka akan terbentuk dua lapisan. Lapisan atas dipindahkan pada eppendorf steril, lalu ditambahkan etanol absolut (dua kali dari volume supernatan) dan sodium asetat (Na asetat) 3 M (10% volume supernatan), selanjutnya proses pengendapan DNA genom dengan diinkubasi selama 24 jam di freezer pada suhu -20 oC, kemudian disentrifugasi kembali pada kecepatan 13000 rpm selama 10 menit. Supernatan dibuang, kemudian pelet ditambahkan 70% etanol dingin sebanyak 1 mL. Suspensi disentrifugasi kembali dengan kecepatan 12000 rpm selama 10 menit. Supernatan dibuang, pelet dikering udarakan dengan cara membuka tutup eppendorf 1.5 mL selama 24 jam, kemudian pelet DNA dilarutkan dalam 20 µL TE/ddH2O steril, lalu disimpan pada suhu -20 oC.
Amplifikasi dan Sekuensing Gen Penyandi 16S rRNA
Amplifikasi gen 16S sRNA (1300 bp) dilakukan dengan menggunakan Gotag@ Green, primer yang digunakan 63f (5'-ACGCTTGTCTCAAAGATTA-3') dan 1387r (5′-GGGCGGWGTGTACAAGGC-3′) (Marchesi et al.
1998) masing-masing sebanyak 2 µ L, amplifikasi PCR dilakukan sebanyak 25 siklus. Gradien temperatur yang digunakan yaitu tahap pra-denaturasi selama 2 menit dengan suhu 94 oC, tahap denaturasi pada suhu 92 oC selama 30 detik,
amplifikasi PCR kemudian divisualisasi dengan menggunakan elektroforesis gel agarosa 1%.
Sekuensing produk PCR dilakukan dengan menggunakan jasa perusahaan sekuensing (Genetika Sains Indonesia, GSI). Sekuen dianalisis dengan program BLASTN pada NCBI (http://ncbi.nlm.nih.gov/). Analisis pohon filogenetik konstruksi menggunakan metode neighbor-joining tree dengan nilai bootstrap
19
4 HASIL
Profil Organisme Spons
Sampel spons diidentifikasi berdasarkan karakteristik morfologi. Sampel yang diidentifikasi harus dalam kondisi yang segar dan tidak terdapat kematian pada jaringannya, hal ini dapat ditunjukkan dengan warna spons yang tidak mengalami perubahan dan tetap cerah. Hasil karakterisasi ditunjukkan bahwa jenis sampel koleksi ialah spons Stylotella sp. Spons ini termasuk dalam famili Halichondridae, ordo Halichondrida dan kelas Demospongiae. Morfologi spons
Stylotella sp. dicirikan dengan kontur permukaan yang kasar dengan warna cenderung kekuningan, ostia menyebar pada permukaan spons (Gambar 5).
Gambar 5 (a dan b) Sampel spons Stylotella sp. yang telah berhasil dikoleksi dari Pulau Bira, (c) contoh dokumen foto spons Stylotella sp. sebagai spons pembanding (Asro et al. 2013).
Isolat Bakteri yang Berasosiasi dengan Spons
Data total perhitungan bakteri yang berasosiasi dengan spons pada berbagai jenis media ditunjukkan bahwa media SWC memiliki jumlah total bakteri tumbuh tertinggi dengan melihat dari jumlah CFU pada pengenceran tertinggi yang dapat dihitung (30-300 koloni percawan) yaitu sebesar 6.6 x 106 CFU/mL. Total bakteri terendah yaitu sebesar 1.4 x 106 CFU/mL pada media MA (Tabel 1).
Tabel 1 Jumlah CFU/mL isolat bakteri yang berasosiasi dengan spons dengan menggunakan beberapa media
Media
CFU/mL Pengenceran
10-5
SCA 6.0 x 106
ZOBEL 2.6 x 106
MA 1.4 x 106
NA 3.3 x 106
SWC 6.6 x 106
Morfologi Koloni Bakteri yang Berasosiasi dengan Spons Stylotella sp.
Pemilihan koloni bakteri awal yang akan dipurifikasi berdasarkan pada perbedaan morphotypes, yaitu visualisasi morfologi koloni yang dilihat secara langsung menurut bentuk koloni, warna, tepian, elevasi, ukuran, dan kenampakan. Hasil penelitian menunjukkan bahwa terdapat keragaman 138 jenis bakteri yang berasosiasi dengan spons Stylotella sp. dengan bentuk koloni bundar dan berwarna putih gading mendominasi bentuk dari isolat simbion spons (Lampiran 3). Terdapat beberapa koloni yang memilki pigmentasi warna cerah seperti merah jambu, abu-abu, jingga, dan kuning (Gambar 6; Gambar 7).
21
Gambar 7 Morfologi koloni bakteri yang berasosiasi dengan spons pada pengenceran hingga 10-5 yang tumbuh pada media NA, SCA, SWC dan Zobel. Beragam morfologi koloni bakteri yang berasosiasi dengan spons tumbuh pada media tersebut. Terdapat beberapa perbedaan warna (pigmentasi) yang mencolok, tidak hanya perbedaan pigmentasi, namun juga ukuran, pinggiran, bentuk dan kenampakan koloni. Pigmentasi merah jambu, abu-abu, jingga dan coklat muda ditunjukkan berturut-turut pada lingkaran a, b, c, dan d.
Potensi Senyawa Bioaktif Antimikrob
Penapisan isolat sebagai antimikrob dilakukan pada beberapa bakteri (prokariot) dan yeast uji (eukariot) yaitu P. aeruginosa, S. aureus, B. subtilis, E. coli ATCC 8739, EPEC (Enteropatogenik Escherichia coli) dan C. albicans.
Pembentukan zona bening di sekeliling isolat yang berasosiasi dengan menunjukkan adanya aktivitas penghambatan terhadap pertumbuhan bakteri uji yang diakibatkan dari aktivitas senyawa bioaktif antimikrob (Gambar 8). Terdapat 32% (45 isolat) dari 138 isolat bakteri memperlihatkan adanya aktivitas penghambatan terhadap mikroorganisme uji dengan spektrum sempit hingga luas. Aktivitas spektrum sempit ditunjukkan pada 29 isolat, sedangkan 16 isolat menunjukkan adanya penghambatan dengan spektrum luas. Isolat bakteri yang berasosiasi dengan spons Stylotella sp. mayoritas memiliki kemampuan dalam menghambat bakteri uji B. subtilis (21 isolat), diikuti dengan penghambatan terhadap EPEC sebanyak 18 isolat dan C. albicans sebanyak 8 isolat (Tabel 2; Gambar 9). Salah satu bakteri potensial yang mengandung pigmen berwarna jingga memiliki spektrum aktivitas antimikrob yang cenderung luas dan sangat
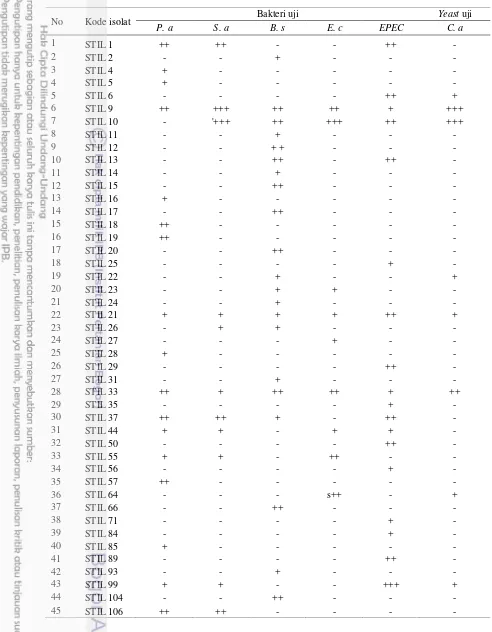
baik, karena isolat ini mampu menghambat keseluruhan isolat uji baik bakteri maupun yeast uji. Indeks Penghambatan (IP) dihitung dari perbandingan diameter koloni dan diameter zona hambat yang terbentuk (Tabel 2; Tabel 3; Tabel 4).
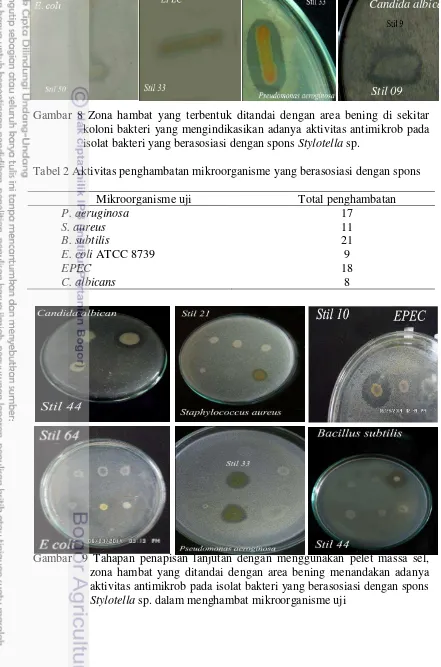
Gambar 8 Zona hambat yang terbentuk ditandai dengan area bening di sekitar koloni bakteri yang mengindikasikan adanya aktivitas antimikrob pada isolat bakteri yang berasosiasi dengan spons Stylotella sp.
Tabel 2 Aktivitas penghambatan mikroorganisme yang berasosiasi dengan spons Mikroorganisme uji Total penghambatan
P. aeruginosa 17
S. aureus 11
B. subtilis 21
E. coli ATCC 8739 9
EPEC 18
C. albicans 8
Gambar 9 Tahapan penapisan lanjutan dengan menggunakan pelet massa sel, zona hambat yang ditandai dengan area bening menandakan adanya aktivitas antimikrob pada isolat bakteri yang berasosiasi dengan spons
Stylotella sp. dalam menghambat mikroorganisme uji
Candida albicans
23
Tabel 3 Indeks zona hambat bakteri yang bersimbiosis dengan spons Stylotella
sp. penghasil senyawa antimikrob
No Kode isolat Indeks zona hambat pada bakteri dan yeast uji
27
Gambar 12 Konsentrasi hambat minimum pada beberapa isolat bakteri yang berasosiasi dengan spons Stylotella sp. terhadap beberapa mikroorganisme uji. Kontrol positif : ampicillin 5 mg/mL, kontrol negatif : etil asetat
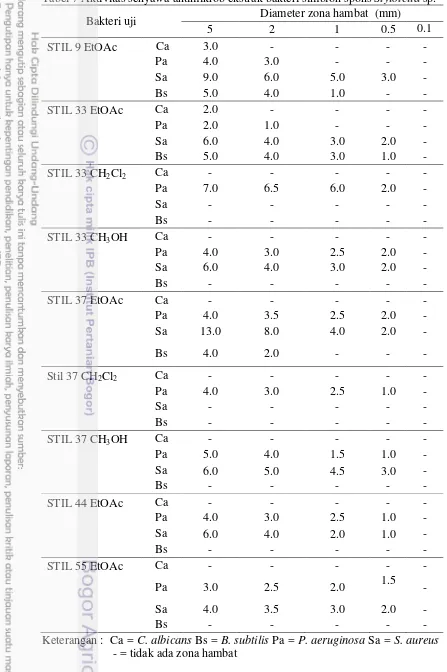
Nilai KHM bakteri yang berasosiasi dengan spons Stylotella sp. berkisar pada konsentrasi 0.5- 5.0 mg/mL. Ekstrak etil asetat isolat STIL 44 dan STIL 55 hanya mampu menghambat P. aeruginosa dan S. aureus dengan nilai KHM sebesar 0.5 mg/mL. Nilai KHM ketiga ekstrak isolat STIL 33 berada pada kisaran 0.5 – 5.0 mg/mL, sedangkan ekstrak isolat STIL 37 menunjukkan nilai KHM pada kisaran konsentrasi 0.5 – 2.0 mg/mL. Isolat STIL 9 yang diekstraksi menggunakan pelarut etil asetat mampu menghambat keseluruhan dari mikroorganisme uji baik C. albicans, P. aeruginosa, S. Aureus maupun B. subtilis dengan kisaran nilai KHM 0.5 – 5 mg/mL (Tabel 6). Berdasarkan nilai KHM dan nilai diameter zona hambat (Tabel 7) diketahui bahwa yeast uji C. albicans memiliki sensitivitas tertinggi terhadap ekstrak STIL 9 dengan nilai KHM 5 mg/mL dan diameter penghambatan sebesar 3 mm. P. aeruginosa
mampu dihambat pada konsentrasi terendah sebesar 0.5 mg/mL dengan diameter penghambatan 2 mm oleh isolat STIL 33 dan STIL 37. Mikroorganisme uji S. aureus mampu dihambat dengan nilai KHM terbaik sebesar 0.5 mg/mL, menghasilkan diameter penghambatan sebesar 3 mm dengan adanya aktivitas antimikrob dari ekstrak kasar isolat STIL 9. Sensitivitas tertinggi dari mikroorganisme uji B. subtilis terlihat pada ekstrak etil asetat dari isolat STIL 33 yang mampu dihambat pada konsentrasi 0.5 mg/mL dengan diameter zona hambat mencapai 1 mm.
STIL 33 (EtOAc)
C. albicans
29
Aktivitas Antioksidan Ekstrak Kasar
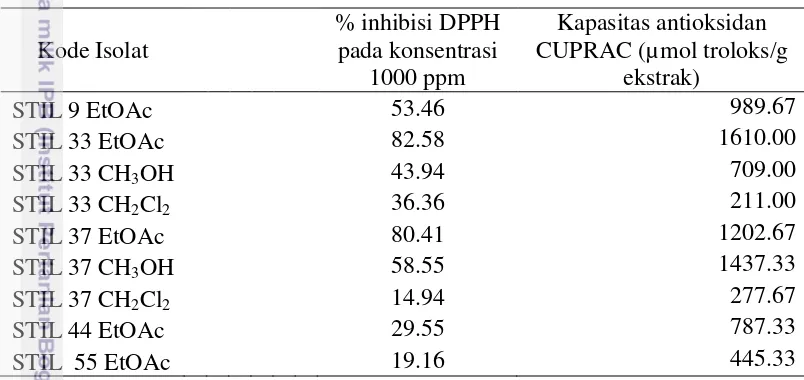
Hasil penelitian menunjukkan % inhibisi radikal DPPH isolat bakteri yang berasosiasi dengan spons Stylotella sp. berada pada kisaran 19.16 hingga 82.58% pada konsentrasi 1000 ppm (Tabel 8). Terdapat dua isolat yang memiliki % inhibisi melebihi 60% yaitu ekstrak etil asetat isolat STIL 33 etil asetat dan STIL 37, sebesar 82.58% dan 80.41% (Lampiran 5). Uji antioksidan dengan menggunakan metode CUPRAC menunjukkan kisaran kapasitas antioksidan isolat bakteri yang berasosiasi dengan spons sebesar 211.00 – 1610.00 µmol troloks/g ekstrak. Nilai kapasitas antioksidan tertinggi diperoleh dari ekstrak kasar etil asetat isolat STIL 33 sebesar 1610.00 µmol troloks/g ekstrak (Tabel 8).
Tabel 8 Aktivitas antioksidan DPPH pada konsentrasi 1000 ppm dan kapasitas antioksidan CUPRAC dari beberapa isolat bakteri yang berasosiasi dengan spons Stylotella sp.
Kode Isolat
% inhibisi DPPH pada konsentrasi
1000 ppm
Kapasitas antioksidan CUPRAC (µmol troloks/g
ekstrak)
STIL 9 EtOAc 53.46 989.67
STIL 33 EtOAc 82.58 1610.00
STIL 33 CH3OH 43.94 709.00
STIL 33 CH2Cl2 36.36 211.00
STIL 37 EtOAc 80.41 1202.67
STIL 37 CH3OH 58.55 1437.33
STIL 37 CH2Cl2 14.94 277.67
STIL 44 EtOAc 29.55 787.33
STIL 55 EtOAc 19.16 445.33
Ekstrak isolat bakteri asosiatif spons yang memiliki %inhibisi DPPH di atas 60% pada konsentrasi 1000 ppm dilanjutkan dengan analisis nilai IC50.
Berdasarkan hasil penghitungan kurva regresi linier didapatkan nilai IC50 dari
sampel ekstrak kasar isolat STIL 33 sebesar 204 ppm dan STIL 37 sebesar 205 ppm (Tabel 9; Lampiran 6; Lampiran 7).
Tabel 9 Nilai IC50 antioksidan isolat bakteri potensi yang berasosiasi dengan
spons Stylotella sp. dalam meredam radikal DPPH Kode isolat IC50 (ppm)
STIL 33 204.00
STIL 37 205.00
Kandungan Metabolit Sekunder
Kandungan metabolit sekunder ditentukan pada isolat bakteri dengan aktivitas antioksidan baik (dipilih lima terbaik). Hasil penelitian menunjukkan bahwa ekstrak isolat STIL 37 metanol, STIL 33 etil asetat dan STIL 33 metanol positif mengandung flavonoid dengan terbentuknya warna jingga pada lapisan amil alkohol. Flavonoid tidak terdeteksi pada ekstrak etil asetat isolat STIL 9 dan STIL 37. Berdasarkan uji kandungan terpenoid dan alkaloid didapatkan bahwa keseluruhan isolat positif mengandung senyawa aktif tersebut, yaitu pada isolat STIL 9, STIL 37 etil asetat, STIL 37 metanol, STIL 33 etil asetat, dan STIL 33 metanol, sedangkan tidak terdapat satupun isolat yang terdeteksi mengandung saponin maupun steroid (Tabel 10).
Tabel 10 Uji Kandungan kimia ekstrak kasar lima bakteri simbion spons terbaik Golongan
senyawa
Ekstrak kasar bakteri yang berasosiasi dengan spons STIL
09
STIL 37 (EtOAc)
STIL 37 (Metanol)
STIL 33 (EtOAc)
STIL 33 (Metanol)
Flavonoid - - + + +
Alkaloid + + + + +
Saponin - - - - -
Tanin - - - - -
Terpenoid + + + + +
Steroid - - - - -
Keterangan : + = terdeteksi, - = tidak terdeteksi
Analisis Sekuens Gen Penyandi 16S rRNA
31
Gambar 13 Produk PCR gen 16S rRNA dari beberapa bakteri yang berasosiasi dengan spons, pita DNA berukuran 1300 pb, marker 1 kb (M), (1) STIL 09, (2) STIL 33, (3) STIL 37, (4) STIL 44, (5) STIL 55
Isolat yang berasosiasi dengan spons Stylotella sp. yang memiliki potensi aktivitas penghambatan terhadap mikroorganisme uji dan peredaman terhadap radikal DPPH maupun CUPRAC diidentifikasi secara molekuler melalui analisis sekuensing gen parsial 16S rRNA. Hasil BLASTN pada deposit gen NCBI menunjukkan keseluruhan isolat memiliki identitas maksimal sebesar 100 %. Mayoritas isolat bakteri yang berasosiasi dengan spons Stylotella sp. didominasi oleh kelompok filum Proteobakteria dengan perwakilan dari kelas Gammaproteobakteria. Isolat STIL 33 menunjukkan identitas maksimal sebesar 100% dengan spesies P. flavipulchra NCIMB 2033. Isolat dengan kode STIL 37 menunjukkan identitas maksimal sebesar 100% dengan spesies S. marcescens
strain NBRC 102204. Kelompok Gammaproteobakteria lain yang ditemukan yaitu pada isolat STIL 44 yang memiliki kedekatan dengan C. thiocycli strain TG 5-3, sedangkan STIL 55 menunjukkan relasi tertinggi dengan spesies V. natriegens
strain ATCC 14048 dengan homologi sebesar 100% (Tabel 11; Lampiran 11). Tabel 11 Identifikasi molekuler bakteri potensi berdasarkan gen 16S rRNA
Kode isolat Spesies Homologi No. Akses
STIL 09 Bacillus subtilis strain JCM 1465 100% NR1132651 STIL 33 Pseudoalteromonas flavipulchra strain
NCIMB 2033
100% NR0251261
STIL 37 Serratia marcescens strain NBRC 102204
100% NR1140431
STIL 44 Catenococcus thiocycli strain TG 5-3 100% NR1048701 STIL 55 Vibrio natriegens strain ATCC 14048 100% NR1178901 Pohon filogenetik dikonstruksi menggunakan metode neighbour-joining
dengan nilai bootstrap 1000. Hasil analisis menunjukkan terbentuknya 2 jenis