ISOLASI DAN KARAKTERISASI BAKTERI ANTI QUORUM SENSING DAN EFEKTIVITASNYA MENGHAMBAT PATOGENISITAS Aeromonas
hydrophila PADA IKAN LELE DUMBO (Clarias gariepinus)
HESSY NOVITA
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI DISERTASI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa disertasi Isolasi dan karakterisasi bakteri Anti Quorum Sensing dan efektivitasnya menghambat patogenisitas Aeromonas hydrophila pada ikan lele dumbo (Clarias gariepinus) adalah karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir disertasi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Agustus 2015
RINGKASAN
HESSY NOVITA. Isolasi dan Karakterisasi Bakteri Anti Quorum Sensing dan Efektivitasnya Menghambat Patogenisitas Aeromonas hydrophila pada Ikan Lele Dumbo (Clarias gariepinus). Dibimbing oleh IMAN RUSMANA, MUNTI YUHANA, dan FACHRIYAN HASMI PASARIBU.
Serangan penyakit adalah salah satu kendala yang sering dihadapi dalam budidaya ikan lele. Penyakit akibat infeksi bakteri Aeromonas hydrophila sering terjadi pada budidaya ikan lele yang dibudidayakan secara intensif akibat ketidakseimbangan antara lingkungan, ikan, dan mikroorganisme patogen. Penanganan dalam budidaya yang kurang baik dapat menyebabkan ikan mengalami stres, sehingga daya tahan tubuhnya menurun dan mudah terserang penyakit. Antibiotika sering digunakan dalam jumlah besar untuk menghindari tingginya mortalitas dan kejadian penyakit bakteri dalam budidaya ikan, akan tetapi penggunaan antibiotika dapat mengganggu keberadaan dan keseimbangan komunitas mikroflora usus dan memicu populasi bakteri yang resisten, dengan efek jangka panjang pada keamanan produk hasil perikanan.
Oleh karena itu, penggunaan probiotik telah disarankan sebagai metode untuk mencegah berbagai penyakit dalam akuakultur. Pendekatan alternatif probiotik yang belum banyak menjadi perhatian dalam pencegahan dan mengontrol penyakit ikan yaitu penghambatan ekspresi dari gen yang menyandikan faktor virulensinya. Ekspresi gen ini diregulasi dengan sinyal komunikasi antar sel bakteri yang dikenal sebagai Quorum Sensing (QS). Anti Quorum Sensing (AQS) atau Quorum Quenching (QQ) adalah proses enzimatik untuk memutus komunikasi antar bakteri, termasuk kemampuannya dalam menimbulkan penyakit. Strategi biokontrol, melalui mekanisme enzimatik untuk memutus komunikasi antar bakteri sangat menjanjikan karena kemungkinan terjadinya resistensi bakteri sangat minimal dan sehingga dapat meningkatkan produksi budidaya ikan yang ramah lingkungan.
Tujuan dari penelitian ini adalah mengisolasi, mengkarakterisasi, dan menyeleksi bakteri anti quorum sensing, identifikasi secara biokimia dan molekuler berdasarkan 16S rDNA bakteri anti quorum sensing, identifikasi bakteri anti quorum sensing yang dapat menghasilkan enzim lactonase sebagai anti quorum sensing, dan seleksi kemampuan bakteri anti quorum sensing sebagai probiotik untuk menghambat patogenisitas Aeromonas hydrophila pada ikan lele (Clarias gariepinus). Penelitian ini terdiri atas empat tahap yaitu: isolasi dan karakterisasi bakteri Anti Quorum Sensing (AQS) pendegradasi AHL (Acyl Homoserine Lactone), identifikasi secara biokimia, molekuler (16S rDNA) dan identifikasi gen AHL laktonase (aiiA) bakteri AQS, seleksi bakteri AQS sebagai biokontrol dan bioessai bakteri AQS sebagai kandidat probiotik.
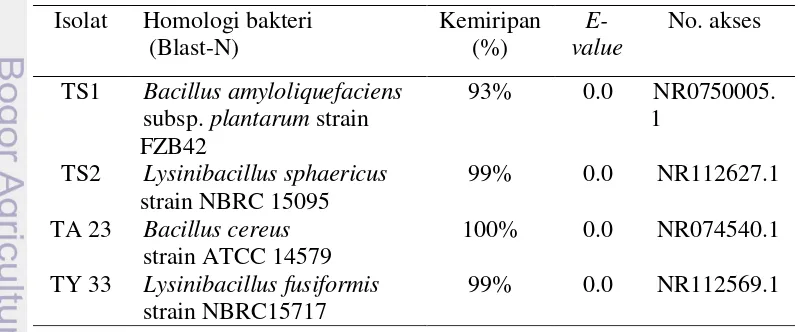
Identifikasi biokimia, molekuler berdasarkan 16S rDNA dan identifikasi gen AHL laktonase (aiiA) bakteri AQS. Empat isolat yaitu TS1 dan TS2, TA23 dan TY33 teridentifikasi berdasarkan sekuen 16S rDNA sebagai Bacillus amyloliquefaciens, Lysinibacillus sphaericus, Lysinibacillus fusiformis dan Bacillus cereus dengan persentase kemiripan masing-masing 93%, 99%, 99% dan 100%. Berdasarkan analisa gen AHL laktonase (aiiA), keempat isolat tersebut menghasilkan enzim AHL laktonase pada target pita 800 bp.
Seleksi bakteri AQS sebagai probiotik. Pemilihan bakteri AQS sebagai probiotik dalam mencegah penyakit Motile Aeromonad Septicemia (MAS) pada ikan lele, berdasarkan pada uji patogenisitas secara in vitro dan in vivo, kepekaannya terhadap antibiotik, kecepatan tumbuh, viabilitas bakteri AQS pada pakan. Hasil penelitian menunjukkan dari keempat isolat TS1, TS2, TA23 dan TY33, diperoleh 3 isolat yang tidak patogen dari uji uji patogenisitas secara in vitro dan in vivo, kepekaannya terhadap antibiotik yaitu TS1, TS2, dan TA23, dan dari kecepatan tumbuh, dan uji viabilitas, isolat TS1, TS2, dan TA23 dapat diaplikasikan sebagai probiotik.
Bioessai bakteri AQS sebagai kandidat probiotik. Ketiga isolat terpilih diberi penanda rifampisin dan diuji kemampuannya di dalam menghambat QS A. hydrophila dengan uji kultur bersama. Aplikasi isolat AQS RifR melalui pakan dan di uji tantang dengan A. hydrophila untuk melihat sintasan, laju pertumbuhan spesifik, konversi pakan, serta respon imun non spesifik yaitu indeks fagositosis, lisozim dan gambaran darah yaitu kadar hemoglobin. Hasil penelitian menunjukkan bahwa pada perlakuan dengan AQSRifR kelangsungan hidup ikan lele adalah pada perlakuan monospesies A(TS1RifR) 81%, B(TS2RifR) 78%, C(TA23RifR) 76%, dan D(multispesies TS1RifR, TS2RifR, dan TA23RifR) 93%, lebih tinggi dibandingkan dengan kontrol (31%), perlakuan multispecies (D) lebih baik dibandingkan dengan kontrol (K).
Pemberian bakteri AQS dapat menghambat infeksi A. hydrophila sehingga dapat mempertahankan kelangsungan hidup ikan. Peningkatan yang signifikan dalam parameter pertumbuhan SGR (perlakuan A(5.39%), B(5.41%), C(5.55%), D(5.69%) berbeda nyata (P<0,05) terhadap K(kontrol) (3.07%)) dan rendahnya nilai rasio konversi pakan (FCR) yang diamati pada ikan yang diberi pakan dengan AQS menunjukkan bahwa bakteri AQS dapat meningkatkan pertumbuhan ikan dimana perlakuan A(1.29), B(1.31), C(1.25) dan D(1.17) berbeda nyata (P<0,05) terhadap K(kontrol)(1.59). Kenaikan bobot ikan menunjukkan kemampuan ikan memanfaatkan pakan yang diberikan. Hasil respon imun non spesifik dari penambahan AQSRifR sebagai probiotik terhadap ikan lele menunjukkan bahwa bakteri AQSRifR dapat meningkatkan perlindungan terhadap infeksi bakteri dan ketahanan ikan lele pada infeksi A. hydrophila sehingga ikan dapat meningkat pertumbuhannya. Secara keseluruhan dapat disimpulkan bahwa bakteri AQS yang diisolasi sangat potensi untuk dikembangkan sebagai probiotik yang dapat menekan penyakit MAS yang disebabkan A. hydrophila sehingga dapat menggantikan penggunaan antibiotik.
SUMMARY
HESSY NOVITA. Isolation and Characterization of Anti Quorum Sensing Bacterial and effectiveness Inhibition pathogenicity of Aeromonas hydrophila in catfish (Clarias gariepinus). Under supervision of IMAN RUSMANA, MUNTI YUHANA, and FACHRIYAN HASMI PASARIBU.
Disease is one of the obstacles encountered in the catfish farming. Diseases caused by bacterial infection of Aeromonas hydrophila in catfish farming that intensively cultivated due to an imbalance between the environment, fish, and the pathogenic population. The poor handling cultivation can lead to fish stress, so that decreases of resistance and susceptible to disease. Antibiotics are often used in large quantities to avoid the high mortality and the incidence of bacterial diseases in fish farming, but the use of antibiotics can interfere the presence of intestinal microbiota communities and trigger resistant bacterial populations, with long-term effects on the food safety.
Therefore, the use of probiotics has been suggested as a method to prevent a variety of diseases in aquaculture. Probiotic alternative approach that has not been a concern in the prevention and control of fish diseases that inhibition of the expression of genes that encode virulence factors. Expression of these genes is regulated by a signal communication between bacterial cells known as Quorum Sensing (QS). Anti Quorum Sensing (AQS) or Quorum Quenching (QQ) is an enzymatic process to inhibited the communication between bacteria, including its ability to cause disease. Biocontrol strategy, the mechanism of enzymatic process to inhibited communication between the bacteria is very promising because of the possibility of resistance bacteria is avoided and can increase the production of environmentally friendly of aquaculture.
The purpose of this study was the isolation, characterization, and selection of anti quorum sensing bacteria, identify of biochemical and moleculer based on 16S rDNA of the anti-quorum sensing bacteria, identify the anti quorum sensing bacteria that can produce lactonase enzyme as anti quorum sensing, the selection of bacterial isolates ability of anti quorum sensing as a probiotic for pathogenicity of Aeromonas hydrophila inhibit the catfish (Clarias gariepinus). This study consisted of four steps: isolation and selection of bacterial Anti Quorum Sensing (AQS) that degrade AHL (Acyl homoserine Lactones), biochemical identification, moleculer identification with 16S rDNA gene and identification of the AHL lactonase (aiiA) AQS bacteria, selection AQS bacteria as probiotic and bioessai AQS bacteria as probiotic candidates.
Based on the analysis of AHL lactonase (aiiA) gene that the four isolates were produced enzymes of AHL lactonase in band target 800 bp.
The selection AQS bacteria as probiotic was done. Selection of AQS bacteria as probiotics in preventing disease Motile Aeromonas septicemia (MAS) in catfish, based on pathogenicity tests in vitro and in vivo, susceptibility of antibiotics, growth rate, and viability of bacteria AQS on feed. Results showed that from the four isolates and TY33, obtained three isolates that were not pathogens with pathogenicity tests in vitro and in vivo, its were TS1, TS2, TA23, susceptibility of antibiotics that isolate were TS1, TS2, TA23 and from the growth curve, and viability tested that TS1, TS2, and TA23 can be applied as probiotic.
Lastly, the bioessai AQS bacteria as candidate probiotic was done. Three isolates were chosen to label rifampicin and tested the capabilities AQS bacteria to inhibit QS of A. hydrophila with coculture, and applications AQS RifR bacteria as probiotic of feed via challenge test with A. hydrophila for survival, specific growth rate, feed conversion, and hemoglobin levels, the response non specific immune through, phagocytic index, lysozyme. That research results showed of survival on treatment with catfish were monospecies treatment A (TS1RifR) 81%, B (TS2RifR) 78%, C (TA23RifR) 76%, and D (multispecies of TS1RifR, TS2RifR , and TA23RifR) 93%, higher than the control (31%) due to the administration of probiotics that AQS can inhibit infection A. hydrophila to maintain the survival of fish which multispecies treatment of D as better than control.
AQS bacteria can significant improvement in growth parameters SGR (treatment of A(5.39%), B(5.41%), C(5.55%), D(5.69%) significantly different (P<0,05) than K (control) (3.07%)) and lower of feed conversion ratio (FCR) where treatment of A(1.29), B(1.31), C(1.25) and D(1.17) significantly different (P<0,05) than K(control) (1.59). And observed in fish fed with AQS showed that AQS bacteria can improve fish growth. The increase in weight of the fish showed the ability of fish utilize the feed. From the results of the non speifik immune response of catfish the addition of AQSRifR as probiotics showed that AQSRifR bacteria can increase survival of catfish to A. hydrophila infection so that can increased growth of the fish.
In summary, it can be concluded that the AQS bacteria isolated very potential to be developed as probiotics that can suppress MAS diseases caused by A. hydrophila and it can replace of antibiotics.
©Hak Cipta milik IPB, tahun 2015 Hak Cipta dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan yang wajar IPB
ISOLASI DAN KARAKTERISASI BAKTERI ANTI QUORUM SENSING DAN EFEKTIVITASNYA MENGHAMBAT PATOGENISITAS Aeromonas
hydrophila PADA IKAN LELE DUMBO (Clarias gariepinus)
HESSY NOVITA
Disertasi
Sebagai salah satu syarat untuk memperoleh gelar Doktor pada
Program Studi Mikrobiologi
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
Penguji pada Ujian Tertutup : 1. Dr Ir Widanarni, MSi
Staf Pengajar Departemen Budidaya Perairan Fakultas Perikanan dan Ilmu Kelautan, IPB
2. Dr Drh Angela Mariana Lusiastuti, MSi Peneliti pada Laboratorium Kesehatan Ikan
Kementrian Kelautan dan Perikanan RI
Penguji pada Ujian Terbuka : 1. Dr Ir Widanarni, MSi
Staf Pengajar Departemen Budidaya Perairan Fakultas Perikanan dan Ilmu Kelautan, IPB
2. Dr Drh Angela Mariana Lusiastuti, MSi Peneliti pada Laboratorium Kesehatan Ikan
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah SWT atas segala karunia Nya sehingga karya ilmiah ini berhasil diselesaikan. Judul yang dipilih dalam penelitian yang dilaksanakan sejak bulan September 2012 sampai September 2013 ini adalah Isolasi dan karakterisasi bakteri Anti Quorum Sensing dan efektivitasnya menghambat patogenisitas Aeromonas hydrophila pada ikan lele dumbo (Clarias gariepinus).
Disertasi ini memuat 4 tahap penelitian yang merupakan pengembangan dari naskah artikel yang diajukan ke jurnal ilmiah. Penelitian tahap 1-2 berjudul Karakterisasi Bakteri Anti Quorum Sensing (AQS) sebagai Penghambat Virulensi Penyakit pada Ikan Lele Dumbo (Clarias gariepinus) telah diterbitkan (Jurnal Riset Akuakultur-RA Vol. 10. No. 1 Tahun 2015) dan tahap 4 The Potential of Bacillus sp. as a Producer of AHL Lactonase and its Application as a Probiotic for the Prevention of MAS in Catfish (Clarias gariepinus) telah diterbitkan pada Journal of Fisheries and Aquatic Science (ISSN 1816-4927/DOI: 10.3923/jfas.2015).
Terimakasih penulis ucapkan kepada Dr Ir Iman Rusmana, MSi, Dr Munti Yuhana, SPi. MSi dan Prof Drh Fachriyan H. Pasaribu selaku pembimbing yang memberi saran dan masukan. Terima kasih disampaikan kepada Dr Ir Widanarni, MSi dan Dr Drh Angela Mariana Lusiastuti, MSi selaku penguji luar komisi atas saran dan masukkannya. Terima kasih disampaikan juga kepada ibu Prof Dr Dra Anja Meryandini, MS. yang senantiasa memberikan motivasi dan selalu mengingatkan penulis untuk segera menyelesaikan studinya. Terimakasih penulis ucapkan kepada Kementrian Kelautan dan Perikanan yang telah memberikan beasiswa periode Agustus 2009 - Juli 2012. Disamping itu, penghargaan penulis sampaikan kepada Dr Drh Angela Mariana Lusiastuti, Ir Taukhid, MSc, Dr Drh Agus Sunarto, Drs Hambali Supriadi, MSc, seluruh staf peneliti patologi dan karyawan IP4I, seluruh staf peneliti dan karyawan-karyawati lingkup Pusat Pengembangan dan Penelitian Perikanan Budidaya (P4B, Pasar Minggu), serta seluruh staf peneliti dan karyawan-karyawati Balai Penelitian dan Pengembangan Budidaya Air Tawar yang telah membantu selama pengumpulan data dan memberi masukan dalam penulisan ilmiah. Terimakasih untuk Muhammad Bunjamin, Dr Faturrahman atas bantuannya selama penelitian, dan juga teman MIK 2009, ibu Dr Alina Akhdia dan Dr ibu Siti Nurjanah, semoga kerjasama kita tetap terjalin, selamat kembali bertugas ke institusi masing-masing. Ungkapan terimakasih yang dalam juga disampaikan kepada ayah Hamdani (Alm), Ibu Lismawati, mertua bapak Yatno Suwito dan ibu Poniyarti, suami Arsam Suwito SE, dan anakku sayang Avicena Kafka Al Muzammil. Adik-adikku Ulia Fitra, Rico Hamdani, Marta Deni, Welly Suzana serta seluruh keluarga atas doa dan motivasi yang selalu memberikan semangat. Semoga karya ilmiah ini bermanfaat.
DAFTAR ISI
DAFTAR TABEL xii
DAFTAR GAMBAR xiii
DAFTAR LAMPIRAN Xv
PENDAHULUAN
Latar belakang 1
Perumusan Masalah 3
Tujuan Penelitian 4
Manfaat Penelitian 4
Hipotesis Penelitian 4
Kebaruan (Novelty) 4
Bagan Alir Penelitian 5
TINJAUAN PUSTAKA 6
Quorum Sensing 6
Mekanisme Umum Quorum Sensing 7
Quorum sensing pada Bakteri Gram negatif 7
Quorum Sensing pada Bakteri Gram positif 7
Quorum SensingHibrid 8
Quorum SensingAeromonas hydrophila 9
Disrupsi Quorum Sensing(QS) 12
Penghambatan pembentukan sinyal AHL 12
Penghambatan penyebaran sinyal AHL 13
Penghambatan penerimaan sinyal AHL 13
Pemanfaatan Bakteri Pendegradasi acyl homoserine lactone (AHL) 14
METODE PENELITIAN 16
Tempat dan waktu penelitian 16
Bahan Penelitian 16
Prosedur Penelitian 16
Alur Pelaksanaan penelitian 17
Isolasi dan Seleksi Bakteri Anti Quorum Sensing (AQS) pendegradasi
AHL 18
Sampling 18
Isolasi bakteri Anti Quorum Sensing(AQS) 18
Seleksi bakteri AQS pendegradasi AHL 18
Identifikasi biokimia dan molekuler bakteri AQS 19 Identifikasi biokimia dan fisioogi bakteri AQS
Identifikasi dan sekuensing 16S rDNA 19
Amplifikasi PCR dan sekuensing Gen aiiA 19
Seleksi Bakteri AQS Sebagai Probiotik 20
Uji patogenisitas bakteri AQS secara in vitro 20
Uji patogenisitas bakteri AQS secara in vivo 20
Uji sensitivitas terhadap antibiotik 20
Uji kecepatan tumbuh 20
Uji viabilitas bakteri AQS pada pakan 21
Bio essai Bakteri AQS Sebagai Kandidat Probiotik 21
Pengujian in vitro bakteri AQS RfR terhadap A. hydrophila 21
Persiapan pakan uji 22
Pengujian in vivo bakteri AQS RfR 22
Sampling A. hydrophila 23
Prosedur Analisis Data 23
HASIL
Isolasi dan Seleksi Bakteri Anti Quorum Sensing (AQS) Pendegradasi
AHL 25
Identifikasi Biokimia dan Molekuler Bakteri AQS 26
Seleksi Bakteri AQS sebagai Probiotik 30
Bio essai Bakteri AQS sebagai Kandidat Probiotik 34
PEMBAHASAN
Isolasi dan Seleksi Bakteri Anti Quorum Sensing (AQS) pendegradasi
AHL 41
Identifikasi Biokimia dan Molekuler Bakteri AQS 42
Seleksi Bakteri AQS sebagai Probiotik 44
Bio essai bakteri AQS sebagai kandidat Probiotik 47
KESIMPULAN DAN SARAN
Kesimpulan 55
Saran 55
DAFTAR PUSTAKA 56
LAMPIRAN 67
DAFTAR TABEL
1 Kombinasi perlakuan uji probiotik Bacillus secara in vivo 22 2 Asal dan jumlah bakteri AQS hasil isolasi dari sedimen, air kolam
pemeliharaan dan juga dari saluran pencernaan ikan lele 25 3 Diameter zona degradasi AHL oleh 4 bakteri AQS yang terpilih dengan
zona hambat yang luas 26
4 Hasil uji fisiologi dan biokimia untuk karakterisasi bakteri AQS 28 5 Hasil analisis sekuen 16S rDNA isolat TS1, TS2, TA 23 dan TY33 27 6 Homologi sekuen gen aiiA empat bakteri AQS dengan menggunakan
analisis BLAST-X 30
7 Kepekaan bakteri AQS terhadap 4 jenis antibiotik berdasarkan diameter zona hambat (mm) dengan masa inkubasi 24 jam pada suhu 28°C 31 8 Uji hemolisis bakteri AQS pada media agar darah dengan masa inkubasi 24
jam pada suhu 28°C 31
9 Uji patogenisitas bakteri AQS pada ikan lele 32
10 Hasil pertumbuhan populasi bakteri AQS dalam waktu 24 jam suhu 280C 32 11 Waktu generasi dan laju pertumbuhan pertumbuhan spesifik bakteri AQS
selama 48 jam 33
12 Viabilitas dari bakteri AQS dalam pakan setelah penyimpanan suhu 4⁰C 34 13 Waktu generasi dan laju pertumbuhan spesifik bakteri AQS tipe liar dan
bakteri AQS mutan selama 24 jam 34
14 Hasil sampling A. hydrophila dimedia pemeliharaan setelah ikan lele diuji
tantang 36
15 Kisaran parameter kualitas air media pemeliharaan pada setiap perlakuan 40
DAFTAR GAMBAR
1 Kerangka berfikir penelitian isolasi dan karakterisasi bakteri Anti Quorum Sensing dan efektivitasnya menghambat patogenisitas Aeromonas hydrophila
pada ikan lele dumbo (Clarias gariepinus) 5
2 Sistem quorum sensing Lux IR pada bakteri Gram negatif 8 3 Model quorum sensing menggunakan peptide sebagai senyawa sinyal pada
bakteri Gram positif 9
4 Contoh molekul sinyal: C4-HSL molekul sinyal pada bakteri Aeromonas hydrophila
11
5 Quorum sensing pada Aeromonas hydrophila 11
6 Strategi yang dikembangkan untuk mengganggu atau merusak sistem
quorum sensing bakteri 12
7 Bagan alur pelaksanaan penelitian isolasi dan karakterisasi bakteri anti Quorum Sensing dan efektivitasnya menghambat patogenisitas Aeromonas
hydrophila pada ikan lele 17
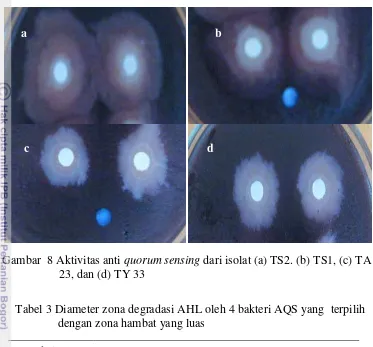
8 Aktivitas anti quorum sensing dari bakteri TS2, TS1, TA 23, dan TY 33 26
9 Hasil deteksi 16S rDNA bakteri AQS 27
dengan kelompok bakteri Bacillus yang lain dari Genebank menggunakan metode Neighbor Joining (NJ) dengan bootstrap 1000x 29 11 Hasil deteksi amplifikasi gen penyandi enzim laktonase pada bakteri AQS 29 12 Pohon Filogenetik gen aiiA dari isolatTS1, TS2, TY33, TA 23 dibandingkan
dengan bakteri penghasil laktonase lain dari Genebank menggunakan metode
Neighbor Joining (NJ) dengan bootstrap 1000x 30
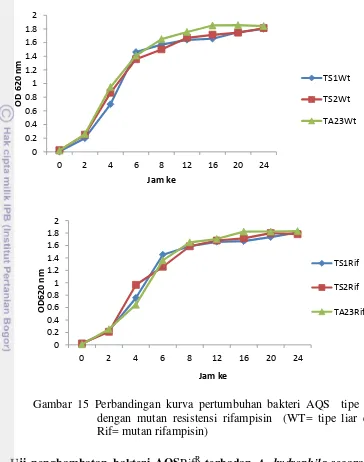
13 Uji hemolisis in vitro bakteri AQS menggunakan agar darah 31 14 Kurva kerapatan optik (Optical Density), bakteri TS1, TS2, dan TA23 33 15 Perbandingan kurva pertumbuhan bakteri AQS tipe liar dengan mutan
rifampisin (WT= tipe liar dan Rif= mutan rifampisin) 35 16 Hasil kultur bersama bakteri AQS RifR dengan A. hydrophila 36 17 Kelangsungan hidup ikan lele dumbo (C. gariepinus) pada perlakuan bakteri
AQSRifR sebagai probiotik
37 18 Laju pertumbuhan spesifik ikan lele dumbo (C. gariepinus) pada perlakuan
bakteri AQS sebagai probiotik 37
19 Rasio konversi pakan ikan lele dumbo (C. gariepinus) pada perlakuan
bakteri AQSRifR sebagai probiotik. 38
20 Kadar Hemoglobin ikan lele dumbo (C. gariepinus) pada perlakuan bakteri
AQSRifR sebagai probiotik. 39
21 Indeks fagositosis ikan lele dumbo (C. gariepinus) pada perlakuan bakteri
AQSRifR sebagai probiotik. 39
22 Lisozim ikan lele dumbo (C. gariepinus) pada perlakuan bakteri AQSRifR
sebagai probiotik 40
DAFTAR LAMPIRAN
1 Pengambilan sampel darah. 67
2 Pengukuran kadar hemoglobin (Hb) 67
3 Indeks fagositosis. 67
4 Lisozim 68
5 Rimler-Shotts (RS) digunakan untuk isolasi selektif, dan identifikasi
Aeromonas hydrophila 68
6 Diameter zona degradasi AHL oleh bakteri AQS yang dengan zona hambat
PENDAHULUAN
Latar Belakang
Penyakit ikan merupakan masalah serius yang dihadapi oleh para pembudidaya ikan, karena berpotensi menimbulkan kerugian yang dapat mencapai hampir ± 100% (Muroga 2001; Soto-Rodriguez et al. 2003). Kerugian tersebut dapat berupa kematian ikan dan penurunan kualitas ikan sehingga secara ekonomis akan berakibat pada penurunan harga. Selain itu, penyakit juga menjadi salah satu kendala dalam pengembangan beberapa komoditas strategis perikanan budidaya, baik yang berasal dari kelompok moluska, ikan dan udang.
Motile Aeromonad Septicemia (MAS) adalah penyakit pada ikan yang disebabkan oleh bakteri Aeromonas hydrophila yang banyak menyerang ikan budidaya. Bakteri ini dapat menyerang ikan budidaya di kolam tanah dan karamba. Komoditas air tawar yang dapat terinfeksi oleh A. hydrophila adalah dari jenis ikan mas (Cyprinus carpio), patin (Pangasius sp.), nilem (Osteochyllus hasselti) dan terutama pada komoditas ikan lele dumbo (Clarias gariepinus) (Taukhid 2010).
Penyakit MAS atau bercak merah ini dikenal di Indonesia sekitar tahun 1980, bakteri ini menyebabkan wabah penyakit pada ikan karper di Jawa Barat dan berakibat kematian sebanyak 125 ton (Triyanto 1990). Wabah ini kemudian menyebar ke daerah Jawa Tengah, Jawa Timur, D.I. Yogyakarta, Sulawesi Utara, dan Sulawesi Selatan (Djadjadireja et al.1983), sampai saat ini masih sering dilaporkan adanya kasus kematian ikan karena penyakit bercak merah (haemorrhagic septicaemia).
Penggunaan obat dan antibiotika dengan dosis yang tidak tepat dan dilakukan terus menerus dalam upaya penanggulangan penyakit MAS, dapat menyebabkan terjadi residu antibiotik pada ikan, resistensi pada bakteri patogen, dan dapat meningkatkan frekuensi mutasi, sehingga melahirkan generasi bakteri baru yang resisten (Chu et al. 2014). Sejauh ini, antibiotika dan obat merupakan cara lama yang sudah tidak efektif untuk mencegah penyakit pada ikan yang disebabkan oleh bakteri patogen. Sudah banyak bakteri patogen pada ikan yang tahan dan kebal terhadap antibiotik dan obat.
Sejumlah metode pencegahan dan pengendalian penyakit Motile Aeromonas Septicemia telah dilakukan yaitu meningkatkan nutrisi yang diberikan, tindakan karantina untuk mencegah transmisi patogen antar farm (Subasinghe 1997), bioaugmentasi untuk peningkatan kualitas air (Grommen & Verstraete 2002), strategi biokontrol yang telah dikembangkan meliputi: penggunaan antimikrobial, bacteriophage (Nakai & Park 2002), aplikasi probiotik (Verschuere et al. 2000), aplikasi immunostimulan (Smith et al.2003), dan vaksin (Heppell & Davis 2000).
gen-gen yang terkait dengan patogenisitas akan teraktivasi dan bakteri tersebut menjadi ganas dan menyebabkan penyakit pada inang. Dengan demikian upaya penanggulangan penyakit pada budidaya perikanan dapat dilakukan dengan memberikan agensia yang dapat merusak atau menghambat sistem quorum sensing bakteri patogen yang menginfeksi ikan, tanpa menggunakan agen yang menghambat pertumbuhan seperti antibiotik dan desinfektan yang dapat menyebabkan resistensi bakteri (De Keivit & Iglewski 2000).
Produksi eksoprotease A. hydrophila diatur oleh molekul sinyal N-Butanoyl-L-Homoserine Lactone (C4-HSL). Molekul sinyal ini juga berfungsi sebagai alat komunikasi antar sel pada suatu populasi bakteri sehingga disebut sistem quorum sensing (Swift et al. 1997). Dengan adanya molekul sinyal, bakteri mampu mengetahui kehadiran bakteri lain di lingkungannya. Konsentrasi molekul sinyal sebanding dengan jumlah bakteri yang ada. Semakin banyak populasi bakteri, semakin tinggi konsentrasi C4-HSL di lingkungan, dan apabila telah mencapai kepadatan tertentu C4-HSL ini akan mengaktifkan gen penyandi enzim protease (Taga & Bassler 2003).
Sistem quorum sensing tersebut merupakan target utama dalam upaya pengendalian infeksi A. hydrophila, yaitu dengan merusak sistem quorum sensingnya sehingga patogenisitas A. hydrophila menurun tanpa harus membunuh bakteri tersebut. Perusakan sistem quorum sensing dapat dilakukan dengan menghambat molekul sinyal C4-HSL sehingga produksi enzim protease menurun (Hentzer & Givskov 2003).
Penghambatan sistem Quorum Sensing pada bakteri patogen telah disarankan sebagai strategi baru untuk digunakan dalam akuakultur (Defoirdt et al. 2011). Quorum sensing adalah proses yang melibatkan komunikasi sel ke sel bakteri dengan berat molekul sinyal yang rendah dan memperoleh respon tergantung pada kepadatan populasi dari bakteri. Molekul sinyal AHL (N-asil homoserin lakton) dan/atau AI-2 (autoinducer2) telah ditemukan terlibat dalam pengaturan faktor virulensi dalam banyak bakteri patogen, termasuk patogen pada ikan (Defoirdt et al. 2007; Rasch et al. 2004). Bakteri yang mampu melemahkan molekul quorum sensing dapat dimanfaatkan sebagai agen biokontrol dalam akuakultur. Beberapa bakteri akuatik telah banyak diteliti untuk anti quorum sensing (Chu et al. 2011; Nakayama et al. 2009). Bacillus laut, Halobacillus salinus menghasilkan quorum quenching untuk mengganggu sistem quorum sensing dari Vibrio harveyi (Mustafa et al. 2011).
Perumusan Masalah
Pada budidaya ikan lele, serangan penyakit adalah salah satu kendala yang sering dihadapi oleh pembudidaya. Penyakit dapat muncul di suatu perairan akibat ketidakseimbangan antara lingkungan, ikan, dan mikroorganisme patogen. Penanganan dalam budidaya yang kurang baik dapat menyebabkan ikan mengalami stres, sehingga daya tahan tubuhnya menurun dan mudah terserang penyakit (Darshanee et al. 2011).
Antibiotika salah satu cara untuk mencegah, mengendalikan, dan mengobati penyakit pada akuakultur. Dengan mencegah proses penting seperti sintesis dinding sel, proliferasi DNA, dan sintesis protein (Defoirdt et al. 2011). Meluasnya penggunaan antibiotika pada akhirnya mengarah pada bakteri yang resisten terhadap antibiotik. Populasi bakteri resisten antibiotik membuat antibiotik tidak efektif, sehingga dibutuhkan antibiotika baru.
Quorum sensing (QS) adalah mekanisme di mana bakteri mengkoordinasikan ekspresi gen dalam merespon kepadatan populasi dengan memproduksi, melepaskan, dan mengenali molekul sinyal kecil yang disebut autoinducers yang mengatur berbagai fenotipe seperti pembentukan biofilm, bioluminescence, faktor virulensi dan berkontribusi pada patogenisitas bakteri. Karena sifat patogenisitas bakteri dikendalikan oleh QS, gangguan QS dapat digunakan sebagai strategi anti-infeksi baru untuk mengontrol bakteri patogen, tanpa mengganggu pertumbuhan bakteri patogen, Di bidang akuakultur, Anti Quorum Sensing (AQS) atau Quorum Quenching (QQ), dapat dilakukan oleh antagonis molekul kecil atau enzim pendegradasi sinyal (Defoirdt et al. 2004).
Tujuan Penelitian
Penelitian ini bertujuan untuk mendapatkan kandidat probiotik sebagai bakteri penghambat quorum sensing A. hydrophila penyebab penyakit Motile Aeromonad Septicemia (MAS) pada ikan budidaya dan sebagai alternatif pengganti antibiotka. Tujuan penelitian tersebut dicapai melalui 4 tahapan penelitian sebagai berikut:
1. Melakukan isolasi, karakterisasi, dan seleksi bakteri anti quorum sensing.
2. Mengidentifikasi bakteri anti quorum sensing secara biokimia dan molekuler.
3. Mengidentifikasi bakteri anti quorum sensing yang dapat menghasilkan enzim lactonase sebagai senyawa anti quorum sensing.
4. Menyeleksi kemampuan bakteri anti quorum sensing sebagai probiotik dan mengevaluasi kemampuan bakteri AQS dalam mendegradasi produksi AHL pada Aeromonas hydrophila secara in vitro dan in vivo dengan uji pada tantang ikan lele.
Manfaat Penelitian
1. Bakteri anti quorum sensing dapat digunakan sebagai agen pengendalian penyakit infeksi pada perikanan budidaya.
2. Pengendalian penyakit ikan melalui anti quorum sensing dapat mengurangi laju resistensi bakteri patogen dan ramah lingkungan. 3. Pengetahuan mengenai anti quorum sensing dapat menjadi khasanah
baru dalam pengembangan sistem biokontrol dalam budidaya perikanan air tawar.
Hipotesis Penelitian
Berdasarkan kerangka pemikiran yang dikemukakan, maka hipotesis yang dapat dirumuskan adalah: Bakteri AQS menghasilkan enzim lactonase, pendegradasi Acyl Homoserine Lactone (AHL). Bakteri AQS sebagai probiotik dapat meningkatkan sintasan dan dapat menekan kemampuan Aeromonas hydrophila untuk menginfeksi ikan lele.
Kebaruan (Novelty)
Bagan Alir Penelitian
Gambar 1. Kerangka berfikir penelitian isolasi dan karakterisasi bakteri anti Quorum Sensing dan efektivitasnya menghambat patogenisitas Aeromonas hydrophila pada ikan lele (Clarias gariepinus)
Penyakit Ikan
Aeromonas hydrophila
Anti Quorum Sensing
Isolasi, karakterisasi, seleksi, deteksi
bakteri Anti
Quorum Sensing
(AQS)
Identifikasi
Biokimia, fisiologi, 16S rDNA,
Gen penyandi Enzim
Lactonase
Seleksi bakteri
Anti Quorum Sensing
Bakteri Anti
Quorum Sensing
TINJAUAN PUSTAKA
Quorum Sensing
Quorum sensing adalah komunikasi antar sel-sel bakteri yang dimediasi oleh molekul-molekul sinyal kecil bersifat diffusible untuk mengontrol perubahan ekspresi gen sebagai respon terhadap fluktuasi kepadatan populasi. Komunikasi bakteri tidak hanya terbatas pada komunikasi antar sel dalam spesies yang sama, tetapi juga antar spesies sehingga suatu spesies dapat menangkap dan menyebarkan pesan dari atau ke spesies lainnya untuk melakukan perubahan perilaku, baik untuk kepentingan komunitas maupun untuk keuntungan salah satu spesies (Atkinson & William 2009).
QS merupakan regulasi ekspresi gen sebagai respon terhadap fluktuasi kepadatan populasi sel. Mekanisme QS bakteri didasarkan pada dua kelompok molekul sinyal yaitu AHL yang digunakan oleh Gram negatif dan molekul peptida kecil digunakan oleh bakteri Gram positif. Bahasa yang digunakan untuk komunikasi antar sel tersebut adalah molekul sinyal kecil yang disebut autoinducers. Melalui autoinducer, bakteri dapat mengatur perilakunya sesuai dengan kepadatan populasi. Fenomena quorum sensing bergantung pada prinsip bahwa ketika sel tunggal bakteri melepas autoinducers ke lingkungan, maka konsentrasinya terlalu rendah untuk dideteksi karena terencerkan di lingkungannya. Namun, ketika populasi bakteri cukup banyak, maka konsentrasi autoinducers yang disekresikan juga meningkat mencapai konsentrasi ambang. Pada konsentrasi ambang ini, sel-sel bakteri dapat mendeteksinya kembali dan mengaktivasi ekspresi gen-gen target secara bersamaan (De Kievit & Iglewski 2000). Autoinducer tersebut dilepaskan ke luar sel sehingga dapat dikenali oleh sel yang lainnya yang sama-sama menghasilkan autoinducer.
Autoinducer (AI) merupakan molekul sinyal yang disekresikan, kemudian diakumulasikan, selanjutnya diserap kembali dan dikenali oleh bakteri pada saat proses quorum sensing terjadi. Konsentrasi autoinducer sebanding dengan jumlah bakteri yang ada. Jadi dengan mendeteksi autoinducer, bakteri mampu mengetahui keberadaan bakteri disekitarnya, sehingga dalam sistem quorum sensing, bakteri dapat mendeteksi adanya bakteri lain serta fluktuasi jumlahnya di lingkungan. Selama proses tersebut, terjadi akumulasi autoinducer di luar sel dan akumulasi autoinducer sejalan dengan penambahan densitas atau kerapatan sel bakteri. Bila jumlah selnya telah mencapai kepadatan tertentu atau mencapai quorum tertentu, maka autoinducer akan diserap kembali ke dalam sel dan membentuk kompleks dengan protein pengatur pengaktivasi transkripsi (Rasmussen et al. 2005).
kesamaan nutrisi, dan menghindar dari senyawa-senyawa toksik yang membahayakan bakteri tersebut (Miller & Bassler 2001).
Sistem quorum sensing mengontrol perilaku bakteri melalui pengubahan ekspresi gen oleh molekul sinyal. Perilaku bakteri yang diatur sistem quorum sensing antara lain: luminesens, konjugasi, nodulasi, swarming, biokorosi, produksi antibiotik, sporulasi, produksi pigmen, dan yang paling penting pembentukan biofilm dan sekresi faktor virulensi seperti enzim litik, toksin, siderofor, dan pelekatan atau adhesi (Miller & Bassler 2001; De Windt et al. 2003). Quorum sensing pada patogen meningkatkan kesempatan untuk menginfeksi inang dengan menunda produksi faktor virulensinya sampai kepadatan populasinya cukup besar untuk mempengaruhi sistem imun inang (Donabedian 2003).
Mekanisme Umum Quorum Sensing
Pengaturan quorum sensing pada bakteri meliputi tiga komponen penting yaitu (i) sintesis, (ii) akumulasi, dan (iii) pengenalan molekul sinyal. Quorum sensing pada bakteri Gram Negatif. Sistem Quorum sensing bakteri Gram negatif umumnya menggunakan N- Acyl Homoserine Lactone (AHL) sebagai molekul sinyalnya. Ketika terdapat pada konsentrasi cukup tinggi molekul-molekul sinyal yang diekskresikan sel dapat berdifusi kembali ke dalam sel kemudian mengikat dan mengaktifkan protein R (aktivator transkripsi). Pada akhirnya protein R yang teraktivasi akan menginduksi ekspresi gen-gen target (De Kievit & Iglewski 2000).
LuxI merupakan protein yang mengkatalis pembentukan autoinducer AHL (Acyl Homoserine Lactone) yang tersebar ke dalam dan keluar sel. LuxR adalah tipe protein yang berikatan dengan autoinducer yang spesifik ketika konsentrasi autoinducer mencapai tingkat tertentu. Ikatan antara LuxR dengan AHL akan mengenali sekuen DNA tertentu sehingga mengaktifkan transkripsi dari sekuen gen tersebut (Gambar 2) (Taga & Bassler 2003). Molekul-molekul AHL memiliki rantai samping berupa asil dengan panjang antara 4-14 rantai karbon dengan atau tanpa substitusi gugus okso atau hidroksi, pada karbon ketiganya .
Proses-proses selular bakteri Gram negatif yang regulasinya dikontrol melalui mekanisme quorum sensing antara lain adalah: virulensi dan pembentukan biofilm pada Pseudomonas aeruginosa, virulensi pada Erwinia. carotovora dan E. chrysanthemi, patogenisitas pada Bacillus cepacia, bioluminesens pada Vibrio fischeri, nodulasi dan fiksasi N pada spesies Rhizobium, serta virulensi dan transfer TDNA pada Agrobacterium tumefaciens (De Windt et al. 2003).
(De Kievit & Iglewski 2000). Umumnya signal peptida disekresikan melalui ATP-binding cassette (ABC) transporter.
Gambar 2. Sistem quorum sensing LuxIR pada bakteri Gram negatif. Protein LuxI mengkatalis pembentukan molekul autoinducer (pentagon hijau). Autoinducer berdifusi secara bebas melewati membran sel dan berakumulasi. Pada konsentrasi autoinducer tinggi, protein Lux R akan berikatan dengan autoinducer. Ikatan antara autoinducer dengan LuxR ini akan mengaktifkan transkripsi gen target (Schauder & Bassler 2001).
Tidak seperti bakteri Gram negatif yang menggunakan protein-protein tipe LuxR (LuxR family) sebagai sensor autoinducersnya. Bakteri Gram positif menggunakan protein-protein histidin kinase untuk mendeteksi senyawa autoinducersnya. Proses relay sinyal berlangsung melalui mekanisme reaksi fosforilasi berantai (Millers & Bassler 2001). Secara ringkas model mekanisme quorum sensing pada bakteri Gram positif dapat dipaparkan pada Gambar 3.
Quorum Sensing Hibrid. Komponen dan sistem sirkuit quorum sensing hibrid merupakan kombinasi antara tipe quorum sensing pada bakteri Gram negatif dan Gram positif yang memiliki tambahan sinyal komunikasi lain yaitu AI-2. Berbeda dengan AI-1 yang berfungsi sebagai alat komunikasi antar spesies yang sama, AI-2 ini berfungsi sebagai alat komunikasi antar spesies yang berbeda jenis. Bagi bakteri yang hidup dalam suatu komunitas populasi yang beragam, misalnya pada multi-spesies biofilms, AI-2 tidak hanya berguna untuk merespon akibat perubahan jumlah densitas pada spesies yang sama, akan tetapi juga dapat digunakan untuk merespon jumlah densitas spesies lain yang hadir dalam komunitas tersebut.
atau secara paralel yang melibatkan AI-1 dan AI-2 secara bergantian atau bersamaan, seperti pada V. harveyi dan Bacillus subtilis (Henke & Bassler 2004). Sistem quorum sensing yang melibatkan AI-1 dan AI-2 sering disebut juga quorum sensing hibrid.
Gambar 3. Prekursor peptide sinyal ( dan ) hasil translasi dipotong-potong sehingga dihasilkan sinyal autoinduser peptide ( ). Peptida sinyal ditranspor keluar sel melalui ABC transporter. Ketika akumulasi dan konsentrasi peptide sinyal telah mencapai ambang stimulasi maka sinyal terdeteksi oleh protein sensor kinase (bagian dari two-component regulatory system) dan menyebabkan autofosforilasi pada residu histidinnya. Selanjutnya melalui reaksi berantai gugus fosfat tersebut ditransfer ke residu aspartat pada suatu protein regulator. Selanjutnya protein regulator yang telah terfosorilasi akan mengaktivasi ekspresi gen-gen target (Miller & Bassler 2001).
Quorum Sensing Aeromonas hydrophila
Aeromonas hydrophila tersebar luas di lingkungan air dan dapat menyebabkan penyakit pada ikan, reptil, amfibi, dan manusia (Ko et al. 2003). Bakteri ini menyebabkan penyakit pada ikan yang dikenal sebagai Motile Aeromonad Septicemia (MAS), hemorrhagic septicemia, ulcer disease, atau red-sore disease. Istilah-istilah tersebut digunakan untuk menyebut suatu penyakit pada inang berupa luka, septicemia, dan borok pada kulit ikan.
A. hydrophila bersifat patogen oportunistik yaitu dapat menyebabkan penyakit bila kondisi memenuhi syarat. Pada kondisi alami, kehadiran bakteri ini dianggap normal akan tetapi pada kondisi akuakultur yang intensif keberadaan bakteri ini patut diperhitungkan. Bakteri ini adalah bakteri Gram negatif berbentuk batang yang diisolasi dari kolam air tawar dan biasanya ditemui pada saluran pencernaan ikan. Penyakit yang diakibatkan A. hydrophila menyerang berbagai jenis spesies ikan air tawar (Swann & White 1989).
buruk. Beberapa faktor kualitas air yang dapat menyebabkan ikan rentan terserang A. hydrophila antara lain tingginya kandungan nitrit, rendahnya kandungan oksigen terlarut dalam air atau tingginya kandungan karbon dioksida terlarut (Swann & White 1989).
Gejala ikan yang terinfeksi A. hydrophila adalah kehilangan nafsu makan, abnormalitas berenang, insang pucat, kelihatan bengkak, dan borok pada kulit. Borok pada kulit tersebut dikelilingi lingkaran jaringan berwarna merah dan terdapat di beberapa tempat. Organ lain yang biasanya ikut terinfeksi adalah insang, ginjal, hati, limpa, pankreas, dan jaringan otot (Swann & White 1989). Pada katak atau amfibi lainnya, infeksi oleh A. hydrophila menyebabkan penggembungan serta warna merah pada permukaan ventral kaki dan abdomen sehingga disebut red leg disease (Anguilar et al. 1997). A. hydrophila juga dapat menular pada manusia melalui luka terbuka atau tertelan bersama air atau makanan, gejalanya adalah diare dan septicemia (Krovacek et al. 1994).
Virulensi A. hydrophila disebabkan oleh banyak faktor dan termasuk pada karakteristik permukaan dengan variasi yang luas serta memproduksi produk ekstraselluler (ECP). A. hydrophila menghasilkan enzim protease yang merupakan penyebab virulensi. Protease bersifat proteolitik, mampu mengambil persediaan nutrien dan melawan pertahanan tubuh inang sehingga berfungsi untuk berkembangnya penyakit pada inang. Enzim protease pada suatu bakteri berperan memecah ikatan peptida protein sehingga dihasilkan komponen asam amino dalam bentuk bebas yang merupakan sumber nutrien bagi bakteri. Protease mampu menghidrolisis kasein dan elastin (Cascon et al. 2000). Enzim protease ini juga dapat merusak atau mendegradasi jaringan konektif atau jaringan otot seperti kolagen, gelatin, sehingga dapat merusak jaringan tubuh inang. Enzim protease merupakan faktor virulensi utama bakteri patogen, berperan dalam perusakan jaringan inang yang akan menimbulkan infeksi pada jaringan inang tersebut (Secades & Guijarro 1999).
Gambar 4. Contoh molekul sinyal, C4-HSL – molekul sinyal pada bakteri Aeromonas hydrophila (Hentzer & Givskov 2003)
Enzim protease pada A. hydrophila ada 2 macam yaitu : serin protease dan metalloprotease. Aktivitas produksi serin protease dan metalloprotease dari A. hydrophila di bawah kontrol QS, yang juga terjadi pada produksi protease oleh Aeromonas salmonicida dan bakteri patogen yang lainnya (Vance et al. 2003). AHL yang diregulasi oleh QS untuk menghasilkan protease (Swift et al.1999) dan pembentukan biofilm (Lynch et al. 2002) pada A. hydrophila. Biofilm merupakan sebuah komunitas mikroorganisme baik sejenis ataupun berlainan jenis yang menempel pada suatu permukaan. Biofilm menyebabkan lebih dari 80% penyakit infeksi dan lebih kurang dari 65% infeksi nosokomial disebabkan oleh mikroorganisme yang berkembang dalam biofilm (Schachter 2003). Hampir semua biofilm bakteri dikendalikan oleh sistem quorum sensing dan berhubungan dengan terjadinya penyakit infeksi (Tanaka & Grossman 2004).
Serin protease, memiliki berat molekul 22 kD, stabil pada suhu 56°C selama 10 menit, memiliki aktivitas sitotoksik dan nilai LD50 sebesar 50 ng/g ikan. Sedangkan metalloprotease, memiliki berat molekul 38 kD, stabil pada suhu 56°C selama 10 menit, tidak memiliki aktivitas sitotoksik dan nilai LD50 sebesar 150 ng/g ikan ( Rodrigues et al. 1992).
Disrupsi Quorum Sensing (QS)
Penemuan quorum sensing sebagai suatu mekanisme yang digunakan secara luas dalam dunia bakteri untuk mengontrol perilaku populasinya telah dimanfaatkan untuk kepentingan dan kesejahteraan manusia. Banyak bakteri yang menggunakan quorum sensing dalam mengontrol virulensinya terhadap organisme lain, sehingga quorum sensing merupakan target baru untuk agen kemoterapeutik (Rasch et al. 2004). Pada bakteri Gram negatif, sistem quorum sensingnya menggunakan molekul sinyal AHL. Dalam perkembangan selanjutnya disrupsi quorum sensing ini disebut sebagai Quorum Sensing Inhibition atau Interference (QSI) atau Quorum Quenching (QQ). Beberapa cara yang dapat mengganggu sistem quorum sensing adalah: (i) penghambatan pembentukan, (ii) penghambatan penyebaran, dan (iii) penghambatan penerimaan sinyal AHL (Gambar 6).
Gambar 6. Strategi yang dikembangkan untuk mengganggu atau merusak sistem quorum sensing bakteri. (A) Penghambatan biosintesis sinyal molekul dengan penerapan substrat analog. (B) Pemblokiran sinyal transduksi dengan penerapan antagonis quorum sensing. (C) Inaktivasi kimia dan biodegradasi sinyal molekul. (D) Aplikasi quorum sensing antagonis untuk menurunkan ekspresi faktor virulensi pada kepadatan rendah (Defoirdt et al. 2004)
bakteri sebagai sumber nutrisi melalui jalur katabolisme asam amino dan asam lemak (Rasmussen & Givskov 2006).
Penghambatan Penyebaran Sinyal AHL. Komunikasi antar sel bakteri dapat dihambat oleh adanya penurunan konsentrasi molekul sinyal yang aktif di lingkungan. Kerusakan AHL dapat terjadi secara nonenzimatik, misalnya molekul sinyal AHL dapat dihidrolisis pada pH tinggi. Beberapa bakteri mampu mendegradasi molekul sinyal AHL secara spesifik. Pada pH lebih dari 7 aktivitas biologis AHL akan rusak karena laktonolisis (pembukaan cincin lakton). Byers et al. (2002) menyatakan bahwa luka pada jaringan tumbuhan akan mengalami kenaikan pH sebagai respon pertama terhadap infeksi buatan yang diinokulasi dengan jaringan tumbuhan yang mengalami maserasi oleh aktivitas Erwinia carotovora. Selain pH tinggi, pembukaan cincin lakton menjadi semakin cepat pada suhu yang tinggi (Rasmussen & Givskov 2006). Metode laktonolisis ini memiliki kelemahan yaitu pada kondisi pH asam, akan terjadi reaksi spontan pembentukan kembali cincin lakton. Reaksi spontan tersebut dapat dihalangi dengan cara modifikasi cincin yang sudah terbuka melalui reaksi substitusi nukleofilik atau reduksi asam karboksilat (Molina et al. 2003).
Ada 2 jenis enzim yang dapat mengkatalisis reaksi degradasi AHL yaitu aiiA dan amino acyclase (AHL acyclase). Enzim aiiA mendegradasi AHL melalui katalisis reaksi pembukaan cincin lakton. Beberapa bakteri diantaranya Bacillus cereus, B. mycoides, B. thuringiensis (Dong et al. 2000; Dong et al. 2001) diketahui menghasilkan enzim aiiA, sedangkan Pseudomonas aeruginosa PAI-A, Arthrobacter sp., Agrobacterium tumefaciens, dan Rhodococcus sp. menghasilkan enzim homolog aiiA atau homolognya (Uroz et al. 2003).
Berbeda dengan aiiA, degradasi AHL oleh enzim amino acyclase (AiiD) terjadi melalui reaksi pemotongan ikatan peptide pada rantai samping AHL. Beberapa bakteri diantaranya Variovorax paradoxus dan P. aeruginosa PAI-A telah diketahui menghasilkan enzim amino acyclase. Hasil degradasi AHL digunakan oleh bakteri-bakteri penghasil enzimnya sebagai sumber karbon, nitrogen, dan energi (Huang et al. 2003). AHL merupakan senyawa ekstraseluler, sehingga dapat dijadikan sebagai target inaktivasi dan destruksi.
Penghambatan Penerimaan Sinyal AHL. Penghambatan penghantaran molekul sinyal quorum sensing dapat dilakukan oleh molekul antagonis yang mampu bersaing atau bercampur dengan sinyal AHL asli untuk berikatan dengan reseptor LuxR. Inhibitor kompetitif strukturnya mirip (senyawa analog) dengan molekul sinyal AHL sehingga berikatan dan mengambil tempat berikatan AHL, sehingga pengaktifan faktor transkripsi tidak terjadi. Inhibitor nonkompetitif mempunyai struktur kurang mirip atau tidak mirip dengan molekul sinyal AHL, molekul ini mengikat pada sisi yang berbeda pada protein reseptor.
Patulin dari P. coprobium adalah 2 senyawa QSI asal fungi yang sangat potensial (Rasmussen & Givskov 2006).
Pemanfaatan Bakteri Pendegradasi Acyl homoserine lactone (AHL) Penyebaran bakteri pathogen menggunakan bermacam-macam molekul sinyal untuk mengatur penyebaran produksi faktor virulen (Baruah et al. 2009). Skrining untuk bakteri yang mampu memproduksi enzim, yang menginaktifkan sinyal, memblok sistem QS dari kompetitornya, belum banyak dilaporkan dan berpotensi untuk mengontrol penyakit pada akuakultur (Defoirdt et al. 2004). Disrupsi molekul sinyal-sinyal ini dapat menurunkan produksi faktor virulen tanpa mempengaruhi pertumbuhan bakteri (Rasch et al. 2004), dan metode ini dapat dimanfaatkan dalam akuakultur (Defoirdt et al. 2005).
Salah satu pendekatan untuk disrupsi QS adalah mengisolasi bakteri yang mampu mendegradasi molekul sinyal yang menyebabkan QS. Bakteri yang mampu menggunakan molekul AHL sebagai sumber karbon dan nitrogen yang berpotensi digunakan sebagai quenchers dari QS untuk mengatur fungsi-fungsi dalam bakteri patogen. Bakteri dapat mendegradasi tipe molekul sinyal seperti yang telah banyak dilaporkan dalam literatur (Dong et al.2002; Uroz et al.2003). Disrupsi QS dari berbagai jenis bakteri yang digunakan sebagai jenis probiotik baru, dan merupakan mikroba hidup yang memberikan keuntungan bagi inang (Defoirdt et al. 2007).
Mikroba penghasil senyawa analog AHL dapat digunakan sebagai komponen biokontrol. Senyawa analog AHL dapat berkompetisi dengan sinyal-sinyal bakteri patogen sehingga akan menghambat proses QS pada bakteri patogen ikan. Penghambatan proses QS dapat menurunkan atau menggagalkan proses inisiasi patogenisitas bakteri patogen. Sebagai mikroba penghasil senyawa autoinduser analog dapat digunakan mikroba yang diisolasi dari alam (tanpa rekayasa) atau mikroba yang telah direkayasa secara genetik untuk meningkatkan kemampuannya.
Bakteri penghasil enzim aiiA atau amino acyclase (AHL acyclase) dapat digunakan sebagai komponen agensia biokontrol diantaranya: Bacillus thuringiensis, B. cereus, Variovorax, Rhodococcus, dan Pseudomonas. Diantara bakteri-bakteri tersebut dapat berperan ganda, seperti B. thuringiensis yang dapat berperan sebagai biokontrol penyakit sekaligus agensia biokontrol hama.
merupakan AHL asilase yang dikodekan oleh gen quiP (Huang et al. 2006). Jenis AHL asilase yang lain yaitu AhlM dari Streptomyces sp. yang disandikan oleh ahlM. AhlM menunjukkan aktivitas deasilasi tinggi terhadap AHL dengan rantai asil panjang dari pada AHL dengan rantai pendek. Penambahan AhlM dalam media pertumbuhan dapat mengurangi akumulasi AHL dan dapat menurunkan produksi faktor virulensi, sehingga AhlM secara efektif dapat diterapkan untuk kontrol patogenisitas (Park et al. 2005). AHL asilase yang dihasilkan oleh Shewanella sp. strain MIB015 yaitu Aac yang disandikan oleh gen aac. Aac dapat mendegradasi AHL dan mereduksi pembentukan biofilm pada patogen ikan (Morohoshi et al. 2008). Beberapa bakteri asal air telah dipelajari sebagai quorum quenching (Chu et al. 2011; Nhan et al. 2010) seperti Bacillus laut, Halobacillus salinus dapat menghambat sistem quorum sensing bakteri Vibrio harveyi (Musthafa et al. 2011). Bacillus (QSI)-1, bakteri yang diisolasi dari usus ikan Carassius auratus gibelio mampu menurunkan AHLs secara in vitro dan mengurangi jumlah AHL dan aktivitas protease ekstraseluler A. hydrophila yang dikultur bersama dengan patogen ikan (Chu et al. 2011).
METODE
Tempat dan waktu penelitian
Penelitian ini dilakukan di Laboratorium Kesehatan Ikan, Balai Penelitian dan Pengembangan Budidaya Air Tawar (Balitbangdita), Bogor, Kementrian Kelautan dan Perikanan. Penelitian dilakukan dengan waktu pelaksanaan 12 bulan yaitu bulan September 2012 sampai September 2013.
Bahan Penelitian
Isolat bakteri
Bakteri Aeromonas hydrophila AHL0905-2 dalam penelitian ini berasal dari isolat koleksi Laboratorium Kesehatan Ikan, Balai Penelitian dan Pengembangan Budidaya Air Tawar (Balitbangdita), Kementerian Kelautan dan Perikanan. Biosensor AHL digunakan bakteri Chromobacterium violaceum yang diinokulasikan di media Luria Bertani (LB-Scharlau).
Ikan uji
Ikan uji yang digunakan untuk uji in vitro dan in vivo adalah ikan lele dumbo (Clarias gariepinus) yang melewati masa aklimatisasi selama 14 hari. Dilakukan pengambilan sampel uji bakteri untuk melihat apakah ikan masih bebas dari infeksi bakteri patogen.
Prosedur Penelitian
Alur Pelaksanaan penelitian
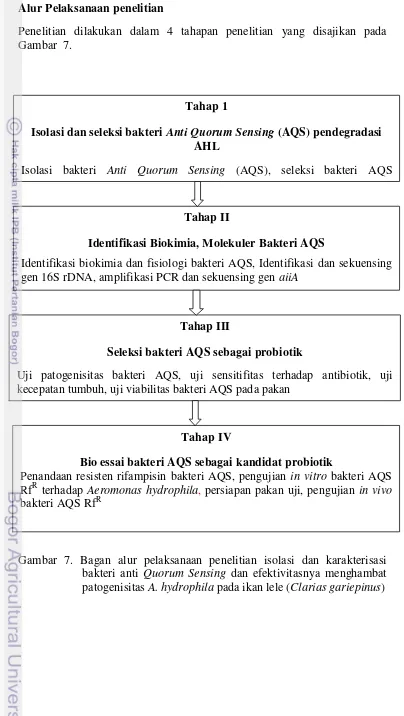
Penelitian dilakukan dalam 4 tahapan penelitian yang disajikan pada Gambar 7.
Gambar 7. Bagan alur pelaksanaan penelitian isolasi dan karakterisasi bakteri anti Quorum Sensing dan efektivitasnya menghambat patogenisitas A. hydrophila pada ikan lele (Clarias gariepinus)
Tahap 1
Isolasi dan seleksi bakteri Anti Quorum Sensing (AQS) pendegradasi AHL
Isolasi bakteri Anti Quorum Sensing (AQS), seleksi bakteri AQS pendegradasi AHL, metode disc diffusion.
Tahap II
Identifikasi Biokimia, Molekuler Bakteri AQS
Identifikasi biokimia dan fisiologi bakteri AQS, Identifikasi dan sekuensing gen 16S rDNA, amplifikasi PCR dan sekuensing gen aiiA
Tahap III
Seleksi bakteri AQS sebagai probiotik
Uji patogenisitas bakteri AQS, uji sensitifitas terhadap antibiotik, uji kecepatan tumbuh, uji viabilitas bakteri AQS pada pakan
Tahap IV
Bio essai bakteri AQS sebagai kandidat probiotik
Tahap I: Isolasi dan seleksi bakteri Anti Quorum Sensing (AQS) pendegradasi AHL
Sampling
Bakteri AQS diisolasi dari organ pencernaan, sedimen dan air kolam pemeliharaan ikan lele dumbo (C. gariepinus). Ikan lele diperoleh dari pembudidaya di sekitar daerah sentra budidaya sekitar Bogor yaitu di Parung, Ciampea dan Gunung Sindur, Provinsi Jawa Barat, Indonesia. Isolasi bakteri Anti Quorum Sensing (AQS).
Ikan lele dibedah secara aseptik dan organ pencernaan diletakkan pada cawan steril serta dibilas dengan larutan garam fisiologis steril (NaCl 0.85% pH 7.4). Bagian usus ditimbang sebanyak 1 gram, dihomogenasi dengan 9 ml larutan garam fisiologis steril. Pengenceran berseri dilakukan dari 10-2 sampai 10-10 pada media Luria Broth (triptone 10g, NaCl 10g, yeast extract 5g, aquades 950 ml). Sebanyak 100µl larutan tersebut disebar pada media Luria Agar (triptone 10g, NaCl 10g, yeast extract 5g, aquades 950 ml, agar 15g) dan diinkubasi pada suhu 28oC selama 2 hari (Chu et al. 2011). Koloni bakteri yang tumbuh dipilih berdasarkan perbedaan morfologi (ukuran, warna dan bentuk).
Sampel sedimen dan air kolam juga dilakukan isolasi bakteri AQS, yaitu sebanyak 1 gram sedimen dilarutkan ke dalam 9 ml garam fisiologis steril 0.85% dan dibuat pengenceran berseri. Sisa suspensi dipanaskan selama 10 menit pada suhu 80ºC. Sebanyak 0.1 ml dari setiap pengenceran dan suspensi yang dipanaskan tersebut masing-masing disebarkan ke media LA (Luria Agar), kemudian diinkubasi selama dua hari pada suhu 28°C. Koloni tunggal dipurifikasi pada media LA untuk mendapatkan isolat bakteri yang murni.
Isolat dari organ pencernaan, sedimen dan air kolam pemeliharaan dilakukan purifikasi berulang-ulang dengan media yang sama hingga diperoleh koloni tunggal dan seragam. Isolat murni selanjutnya diperbanyak, sebagian isolat dibuat stok dalam gliserol 20% dan sebagian lagi digunakan untuk percobaan berikutnya yang disimpan dalam media agar miring LA.
Seleksi bakteri AQS pendegradasi AHL
jam). Sebagai kontrol negatif digunakan media LB steril. Cawan diinkubasi pada suhu 28ºC selama 24 jam untuk melihat penghambatan produksi warna ungu C. violaceum, penghambatan QS terdeteksi oleh adanya cincin tidak berwarna ungu di sekitar disk, tapi masih adanya sel yang viable oleh bakteri AQS. Pengukuran dilakukan dari tepi luar disk ke tepi zona hambat AQS. Tidak terbentuknya warna ungu menunjukkan bahwa isolat menghasilkan AQS.
Tahap II: Identifikasi biokimia, molekuler bakteri AQS Identifikasi biokimia dan fisiologi bakteri AQS
Bakteri AQS yang positif menghasilkan anti QS diidentifikasi berdasarkan perbedaan karakteristik secara fisiologi dan biokimia dengan pengujian hidrolisis terhadap gula-gula dengan API 50 CHB. Data sifat biokimia dan fisiologi bakteri yang diperoleh dianalisis secara deskriptif dan dibandingkan dengan standar deskripsi dalam Bergey’s Manual of Determinative Bacteriology (Bergey and Holt 1994).
Identifikasi dan sekuensing 16S rDNA
DNA genom dari bakteri AQS diekstraksi dengan metode Gentra Puregene Yeast/Bact.Kit (Qiagen) dan amplifikasi 16S rDNA dengan
menggunakan primer oligonukleotida spesifik prokariot yakni 6γf (5’-CAG GCC TAA CAC ATG CAA GTC-γ’) dan 1γ87r (5’-GGG CGG WGT GTA CAA GGC-γ’) (Marchesi et al. 1998). Proses amplifikasi dengan siklus PCR, pradenaturasi (pre PCR) pada suhu 95oC selama 5 menit. Denaturasi pada suhu 92oC selama 30 detik, pelekatan (annealing) pada suhu 55oC selama 30 detik, dan perpanjangan (elongation) DNA pada 72oC selama 1 menit. Siklus ini diulang hingga 30 kali, pemanjangan DNA (post PCR) pada suhu 72oC selama 5 menit, dan penyimpanan (store) pada suhu 4oC. Selanjutnya produk DNA yang dihasilkan disekuens menggunakan jasa perusahaan sekuensing 1stBase Singapura. Hasil pengurutan DNA dibandingkan dengan data 16S rDNA dari GeneBank.
Bakteri yang positif dapat mendegradasi QS, selanjutnya dideteksi keberadaan dari gen aiiA (Autoinducer Inactivation) homolog dengan amplifikasi sekuen gen tersebut menggunakan PCR. Ekstraksi genom dari bakteri anti QS dengan menggunakan metode Gentra Puregene Yeast/Bact. Kit (Qiagen).
Amplifikasi PCR dan sekuensing Gen aiiA
annealing 52ºC (30 detik), pemanjangan 72ºC (1 menit); dan suhu pada final 72ºC selamat 5 menit. Untuk mengetahui kemiripan gen aiiA pada bakteri anti QS, dilakukan sekuensing dari produk PCR yang positif mengandung gen aiiA menggunakan jasa perusahaan sekuensing 1stBase Singapura. Hasil sekuen disejajarkan dengan data gen aiiA dari GeneBank menggunakan program Basic Local Alignment Search Tool-Nucleotida translation protein (BLAST-X).
Tahap III. Seleksi bakteri AQS sebagai probiotik Uji patogenisitas bakteri AQS secara in vitro
Bakteri diuji patogenisitasnya dengan digoreskan pada media agar darah. Biakan diinkubasi selama 24 jam pada suhu 28oC. Isolat dengan aktivitas gamma hemolisis atau tidak terbentuknya zona bening di sekitar koloni akan diambil untuk diuji lanjut.
Uji patogenisitas bakteri AQS secara in vivo
Bakteri pendegradasi QS yang memiliki aktivitas positif anti QS dilanjutkan dengan menguji patogenisitasnya terhadap ikan lele dengan ukuran berat ± 10 g dan panjang rata-rata ± 10.2 cm. Bakteri AQS diprekultur pada media LB pada 28oC umur 24 jam. Kemudian dibuat serial dilusi 10-2-10-9 CFU/ml menggunakan larutan fisiologis (Chu et al. 2011). Selanjutnya dilakukan penyuntikan bakteri pada ikan lele yang dipelihara dalam akuarium 60x50x40 cm dengan kepadatan 10 ekor per akuarium dengan serial dilusi 10-5,10-7, dan10-9 kemudian diprekultur dan dilakukan Total Plate Count (TPC) pada media Luria Agar. Tiap-tiap perlakuan diulang 3 kali. Pengamatan terhadap mortalitas dilakukan tiap hari selama 7 hari.
Uji sensitivitas terhadap antibiotik
Sensitivitas bakteri AQS terhadap antibiotik menggunakan metode kertas cakram. Antibiotik yang digunakan adalah antibiotik yang umum digunakan manusia dan hewan, yaitu: vancomycin, ampicilin, tetracycline, dan rifampicin.
Uji kecepatan tumbuh
Uji viabilitas bakteri AQS pada pakan
Persiapan uji viabilitas bakteri AQS pada pakan, dilakukan dengan mengkultur bakteri AQS ke 50 ml Tryptic Soya Broth (TSB DifcoTM) dan diinkubasi di inkubator selama 48 jam pada suhu 28⁰C. Kemudian kultur cair disentrifuse pada 10.000 x g selama 30 menit pada 4⁰C dan supernatannnya dibuang. Pelet sel bakteri AQS dibilas dengan phosphate buffered saline (PBS pH 7.4) dan dilarutkan kembali ke 10 ml PBS. Konsentrasi bakteri diukur dengan OD (optical Dencity) pada panjang gelombang 620 nm. Tiga pakan percobaan disiapkan dengan konsentrasi 1% penambahan bakteri AQS pada pakan yaitu TS1 1011 CFU/g pakan; TS2 1011 CFU/g pakan; TA 23 1011 CFU/g pakan (konsentrasi CFU dihitung dari uji patogenisitas). Pakan ditimbang 100 g dan disemprot dengan 1 ml pelet bakteri AQS dan disimpan 4⁰C. Untuk menentukan viabilitas bakteri AQS pada pakan, sebanyak 1g pakan yang telah disemprot dengan bakteri AQS dilarutkan ke dalam 9ml PBS steril, pH 7.4 dan disebar di media Tryptic Soya Agar (TSA DifcoTM) dengan pengenceran berseri dari 10-2 sampai 10-11 dan diinkubasi pada 28⁰C selama dua hari (Kumar et al. 2012). Kemudian diilakukan pengamatan viabilitas bakteri AQS pada pakan selama 0 hari, 14 hari, dan 21 hari selama penyimpanan 4°C dengan metode Total Plate Count (TPC).
Tahap IV: Bio essai bakteri AQS sebagai kandidat probiotik
Penandaan resistensi rifampisin bakteri AQS
Suspensi sel bakteri AQS tipe liar yang sensitif terhadap antibiotik rifampisin sebanyak 1 ml dipekatkan kemudian diencerkan dengan 100 µl PBS selanjutnya disebar pada media LA yang telah ditambah dengan 50 dan 100 µg/ml antibiotik rifampisin untuk memperoleh mutan bakteri AQS RfR. Stabilitas mutan bakteri AQS RfR diuji dengan men-sub kulturkan mutan pada media LA yang mengandung rifampisin 100 µg/ml berturut-turut setelah 48 jam sebanyak 3 kali. Untuk mengetahui perbandingan pertumbuhan antara mutan dan tipe liarnya, kurva pertumbuhan ditentukan untuk masing-masing bakteri AQS RfR dan tipe liarnya. Bakteri ditumbuhkan dalam media LB yang ditambahkan rifampisin 100 µg/ml untuk mutan dan LB cair untuk tipe liar. Untuk membuat kurva pertumbuhan bakteri maka dilakukan pengukuran dengan kerapatan optik sel pada panjang gelombang 620 nm setiap 2 jam, selama 24 jam. Laju pertumbuhan spesifik dan waktu generasi bakteri kemudian dihitung antara bakteri AQS RfR dan tipe liarnya.
Pengujian in vitro bakteri AQS RfR terhadap A. hydrophila
Persiapan pakan uji
Pakan yang digunakan dalam penelitian adalah pakan komersial dengan kadar protein 28.60%. Pakan harian diberikan dengan feeding rate (FR) 3% bobot biomassa ikan uji. Persiapan pakan dengan penambahan bakteri AQSRfR berdasarkan dosis perlakuan 1% (Wang et al. 2007) dan putih telur sebanyak 2% (V/w) kemudian di spray dan dikering anginkan. Sedang untuk kontrol pelet di spray dengan PBS dan putih telur 2% (V/w) dan dikering anginkan. Pakan diberikan pada ikan 3 kali sehari (pagi, siang, dan sore hari) selama 21 hari.
Pengujian in vivo bakteri AQS RfR
Probiotik AQS yang ditambahkan pada perlakuan TS1 RifR, TS2 RifR dan TA23 RifR dengan konsentrasi sel sebanyak 1 mL per 100 g pakan, sedangkan pada perlakuan kombinasi ditambahkan dengan konsentrasi sebanyak 0.3 ml untuk masing-masing jenis probiotik (TS1RifR, TS2RifR, TA23RifR). Bakteri patogen A. hydrophila diberikan pada media pemeliharaan dengan dosis 108 CFU/mL (Das et al. 2014) sebanyak satu kali pemberian pada akhir minggu ke 2 (H14). Perlakuan kontrol ikan lele diinfeksi dengan A. hydrophila melalui media pemeliharaan tanpa bakteri AQS RfR. Ikan uji yang digunakan adalah ikan lele dumbo dengan panjang 10.75±0.5 cm dan berat 10.685± 0.2 gram. Percobaan dilakukan pada bak plastik berukuran 60x50x40 cm3 dengan volume air 40 liter dan kepadatan 25 ekor per akuarium. Pakan diberikan secara at satiation (sampai kenyang) setiap pagi, siang dan sore hari. Selama masa pemeliharaan (21 hari), akuarium tidak disipon dan tidak dilakukan pergantian air. Pengujian dilakukan sebanyak 5 perlakuan dan tiga kali ulangan. Pengamatan dilakukan selama 21 hari, dan kemudian dihitung tingkat kelangsungan hidup, laju pertumbuhan spesifik, rasio konversi pakan, respon imun spesifik (indeks fagotosis dan lisozim) dan gambaran darah dari ikan lele. Tabel 1 Kombinasi perlakuan uji probiotik bakteri AQS secara in vitro
Perlakuan Keterangan
K Pakan komersil tanpa probiotik dan diuji tantang*.
A Pakan + 1% TS1RifR (v/w) (1mL TS1RifR (2.0 x1011 cfu/mL)/100gr pakan) (Wang 2007) dan diuji tantang*. B Pakan + 1% TS2RifR (v/w) (1mL TS2RifR (2.0 x1011
cfu/mL)/100gr pakan) (Wang 2007) dan diuji tantang*. C Pakan + 1% TA23RifR (v/w) (1mL TTA23RifR (2.0 x1011
cfu/mL)/100gr pakan) (Wang 2007) dan diuji tantang*. D Pakan + Kombinasi AQSRifR 1% (v/w) (0.3 ml TS1RifR +
0.3 ml TS2RifR +0.3 ml TA23RifR) (Wang 2007) dan diuji tantang*.