OPTIMALISASI JERAPAN KROMIUM TRIVALEN OLEH
ZEOLIT LAMPUNG DENGAN METODE LAPIK TETAP DAN
PERLAKUAN KROMIUM LIMBAH PENYAMAKAN KULIT
SUKMANDIRI ANINGRUM
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
ABSTRAK
SUKMANDIRI ANINGRUM. Optimalisasi Jerapan Kromium Trivalen oleh Zeolit Lampung dengan Metode Lapik Tetap dan Perlakuan Kromium Limbah Penyamakan Kulit. Dibimbing oleh ETI ROHAETI AZIS dan BETTY MARITA SOEBRATA.
ABSTRACT
SUKMANDIRI ANINGRUM. Optimization of Trivalent Chromium Adsorption by Lampung Zeolite Using Fixed Bed Method and Treatments of Chromium in Tannery Waste. Supervised by ETI ROHAETI AZIS and BETTY MARITA SOEBRATA.
OPTIMALISASI JERAPAN KROMIUM TRIVALEN OLEH
ZEOLIT LAMPUNG DENGAN METODE LAPIK TETAP DAN
PERLAKUAN KROMIUM LIMBAH PENYAMAKAN KULIT
SUKMANDIRI ANINGRUM
Skripsi
Sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains pada
Departemen kimia
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
PRAKATA
Alhamdulillahhirobbilaallamiin, puji dan syukur kehadirat Allah SWT atas segala rahmat dan karunia-Nya penulis dapat menyelesaikan penelitian dan karya ilmiah dengan judul Optimalisasi Jerapan Kromium Trivalen oleh Zeolit Lampung dengan Metode Lapik Tetap dan Perlakuan Kromium Limbah Penyamakan Kulit yang dilaksanakan mulai Juli 2005 sampai Februari 2006, di Laboratorium Kimia Analitik, Departemen Kimia, Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Penulis mengucapkan terima kasih kepada Ibu Dra. Eti Rohaeti, M.S dan Ibu Betty Marita Soebrata S.Si, M.Si selaku pembimbing yang telah memberikan bimbingan, saran, dan pengarahan kepada penulis dalam menyelesaikan karya ilmiah ini.
Ungkapan terima kasih penulis sampaikan untuk keluarga tercinta, Bapak, Ibu, dan adik-adik tersayang (Mpim, Adit, dan Billa) atas dukungan baik moril maupun materiil, serta doa dan kasih sayangnya. Penulis berterimakasih kepada Om Eman, Ibu Nung, dan seluruh staf serta laboran Kimia Analitik atas fasilitas dan bantuan yang telah diberikan. Terima kasih penulis ucapkan kepada Srie, Nita, Amel, Piet, Re, Wulan, Mba Tini, Tyas, Lia, Sekar, teman-teman seperjuangan Kimia 38, dan Andika atas semangat dan dukungannya.
Penulis berharap karya ilmiah ini dapat bermanfaat bagi semua pihak.
Bogor, Februari 2006
RIWAYAT HIDUP
Penulis dilahirkan di Cilacap pada tanggal 21 Februari 1983 dari ayah Darsim Arfandi dan ibu Royanah. Penulis merupakan putri pertama dari empat bersaudara.
DAFTAR ISI
Halaman
DAFTAR TABEL ... vi
DAFTAR GAMBAR vi
DAFTAR LAMPIRAN ... vii
PENDAHULUAN ... 1
TINJAUAN PUSTAKA Zeolit ... 1
Sifat Tukar Kation dari Zeolit ... 2
Jerapan ... 2
Kromium ... 3
Industri Penyamakan Kulit ... 4
BAHAN DAN METODE Bahan dan Alat ... 5
Metode Penelitian ... 5
HASIL DAN PEMBAHASAN Pencirian Zeolit Lampung ... 7
Penetapan Laju alir Optimum ... 7
Penetapan Konsentrasi Influen Optimum ... 8
Penetapan Tinggi Lapik Optimum ... 9
Penjerapan Cr3+ dengan Metode Tumpak ... 9
Perlakuan Limbah Penyamakan Kulit ... 10
SIMPULAN DAN SARAN Simpulan ... 11
Saran ... 12
DAFTAR PUSTAKA ... 12
DAFTAR TABEL
Halaman
1 Pengaruh laju alir terhadap efisiensi kolom ... 8
2 Pengaruh konsentrasi influen terhadap efisiensi kolom ... 9
3 Pengaruh tinggi lapik terhadap efisiensi kolom ... 9
4 Pengaruh waktu pemeraman endapan terhadap konsentrasi Cr3+ dalam filtrat... 10
5 Pengaruh pH terhadap Cr3+ dalam filtrat ... 11
6 Analisis ion dalam filtrat pH 8... 11
DAFTAR GAMBAR
Halaman 1 Tetrahedral-tetrahedral SiO44- dan SBU sederhana ... 22 Pola aliran dan kurva terobosan pada metode lapik tetap ... 3
3 Reaksi antara kromium heksavalen dan 1,5-difenilkarbazida ... 4
4 Kurva terobosan pada laju alir 7, 9, dan 11 mL/menit... 7
5 Pengaruh laju alir terhadap kapasitas jerapan lapik zeolit pada C/Co 0.5 ... 8
6 Kurva terobosan pada konsentrasi influen 15, 20, dan 25 ppm ... 8
7 Pengaruh konsentrasi influen terhadap kapasitas jerapan lapik zeolit pada C/Co 0.5 ... 8
8 Kurva terobosan pada tinggi lapik 6, 9, dan 11 cm... 9
9 Pengaruh tinggi lapik terhadap kapasitas jerapan lapik zeolit pada C/Co 0.5 ... 9
10 Pengaruh konsentrasi Cr3+ terhadap kapasitas jerapan zeolit dengan metode tumpak... 10
DAFTAR LAMPIRAN
Halaman
1 Bagan alir penelitian ... 15
2 Hasil analisis XRD zeolit Lampung ... 15
3 Hasil analisis kimia zeolit Lampung ... 16
4 Sifat fisika dan kimia zeolit alami ... 16
5 Analisis fraksi pada laju alir 7 mL/menit dan konsentrasi 20 ppm ... 16
6 Kurva terobosan pada laju alir 7 mL/menit dan konsentrasi 20 ppm ... 17
7 Analisis fraksi pada laju alir 9 mL/menit dan konsentrasi 20 ppm ... 17
8 Kurva terobosan pada laju alir 9 mL/menit dan konsentrasi 20 ppm ... 17
9 Analisis fraksi pada laju alir 11 mL/menit dan konsentrasi 20 ppm ... 18
10 Kurva terobosan pada laju alir 11 mL/menit dan konsentrasi 20 ppm ... 18
11 Pengaruh laju alir terhadap Wb, W, Wsat, dan efisiensi kolom ... 19
12 Analisis fraksi pada konsentrasi influen 15 ppm ... 21
13 Kurva terobosan pada konsentrasi influen 15 ppm ... 21
14 Analisis fraksi pada konsentrasi influen 25 ppm ... 21
15 Kurva terobosan pada konsentrasi influen 25 ppm ... 22
16 Pengaruh konsentrasi influen terhadap Wb, W, Wsat, dan efisiensi kolom ... 23
17 Analisis fraksi pada tinggi lapik 9 cm ... 24
18 Kurva terobosan pada tinggi lapik 9 cm ... 24
19 Analisis fraksi pada tinggi lapik 11 cm ... 24
20 Kurva terobosan pada tinggi lapik 11 cm ... 25
21 Pengaruh tinggi lapik terhadap Wb, W, Wsat, dan efisiensi kolom ... 26
22 Penentuan kapasitas jerapan zeolit terhadap Cr3+ dengan metode tumpak ... 27
23 Penentuan konsentrasi awal kromium limbah penyamakan kulit ... 27
24 Penetapan waktu pemeraman endapan pada pH 8 ... 28
25 Penetapan pH pengendapan ... 28
26 Analisis fraksi filtrat pH 9 limbah penyamakan kulit ... 28
1
PENDAHULUAN
Perkembangan ilmu pengetahuan dan teknologi mendorong berkembangnya industri. Tumbuh pesatnya industri membawa dampak positif bagi taraf hidup masyarakat, namun di sisi lain limbah buangan industri menjadi masalah karena dapat mencemari lingkungan. Industri penyamakan kulit adalah agroindustri yang mengolah kulit mentah menjadi kulit jadi. Hampir 90% industri penyamakan kulit menggunakan kromium trivalen dalam proses penyamakan karena efektif, murah, dan tersedia di pasaran. Jenis limbah yang dihasilkan dalam industri penyamakan kulit, yaitu limbah cair, limbah padat, dan limbah gas. Limbah cair maupun lumpur yang dihasilkan dengan menggunakan bahan penyamak kromium trivalen ditandai dengan warna limbah yang kebiru-biruan. Limbah tersebut dapat membahayakan lingkungan karena kromium trivalen dapat teroksidasi menjadi kromium heksavalen yang merupakan jenis bahan berbahaya dan beracun (B3) yang dapat membahayakan kesehatan (Wahyuadi 2004).
Keberadaan kromium pada limbah cair penyamakan kulit memerlukan pengolahan agar tidak mencemari lingkungan. Metode pengendapan menggunakan alkali seperti NaOH, MgO, dan Ca(OH)2 telah digunakan
untuk mengatasi pencemaran kromium trivalen dari limbah penyamakan kulit (Esmaeili et al. 2005). Pengendapan dengan alkali pada pH 8 lebih efektif pada konsentrasi kromium yang tinggi dibandingkan pada konsentrasi kromium rendah (Barros et al.
2003). Konsentrasi kromium setelah peng-endapan sebesar ± 20 ppm dan nilai tersebut masih di atas ambang batas yang diperboleh- kan berdasarkan Keputusan Menteri Negara Lingkungan Hidup (Kep51/MENLH/ 10/1995), yaitu 0.6 ppm sehingga diperlukan metode lain. Salah satu metode yang digunakan adalah penjerapan dengan menggunakan zeolit sintetis sebagai adsorben telah dilaporkan Barros et al. (2002). Zeolit sintetis NaA, NaX, dan NaY dapat menjerap kromium trivalen yang berasal dari limbah penyamakan kulit (Barros et al. 2003). Zeolit sintetis mempunyai harga yang lebih mahal dibandingkan dengan zeolit alam. Oleh karena itu, zeolit alam yang berasal dari Lampung dan termasuk sumber mineral melimpah di Indonesia menarik untuk diteliti.
Ada dua metode penjerapan, yaitu batch
(tumpak) dan fixed bed (lapik tetap). Pada
metode tumpak penjerap dan zat yang akan dijerap melalui pengocokkan dalam waktu tertentu sehingga terjadi kesetimbangan. Metode ini kurang cocok diterapkan pada industri karena membutuhkan energi lebih banyak, yaitu untuk pengocokan dan penyaringan. Hal tersebut kurang ekonomis dilihat dari segi biaya sehingga digunakan, yaitu dengan metode lapik tetap. Metode penjerapan lapik tetap umum digunakan dalam pengolahan limbah industri dalam volume yang besar (Benefield et al. 1982). Zeolit yang telah diaktivasi dengan pemanasan
ditempat-kan dalam kolom sebagai lapik dan limbah penyamakan sebagai influen.
Penelitian bertujuan menentukan kondisi optimum laju alir, konsentrasi influen, dan tinggi lapik terhadap jerapan Cr3+ oleh zeolit Lampung melalui penetapan kapasitas jerapan pada C/Co 0.5 dan efisiensi kolom, menentukan waktu pemeraman endapan dan pH pengendapan limbah penyamakan kulit, serta menentukan kapasitas jerapan zeolit terhadap filtrat hasil pengendapan limbah penyamakan kulit pada kondisi optimum kolom. Hipotesis penelitian adalah kondisi optimum laju alir, konsentrasi influen , dan tinggi lapik dapat digunakan untuk perlakuan limbah penyamakan kulit.
TINJAUAN PUSTAKA
Zeolit
Mineral zeolit pertama kali ditemukan pada tahun 1756 oleh Baron Cronsted seorang ahli mineral berkebangsaan Swedia. Kata zeolit berasal dari bahasa Yunani, yaitu zein
yang berarti mendidih dan lithos yang berarti batuan. Zeolit akan kehilangan air bila dipanaskan, sehingga disebut sebagai batu mendidih (Ming dan Mumpton 1989). Zeolit telah ditemukan dalam bentuk sedimen yang terjadi akibat proses alterasi dari debu-debu vulkanis oleh air danau. Air danau menjadi basa karena debu-debu vulkanis yang terhidroksida. Zeolit biasanya masih tercampur dengan mineral-mineral lainnya seperti kalsit, gipsum, feldspar, dan kuarsa.
Zeolit alam merupakan mineral senyawa alumino silikat terhidrasi dari kation logam alkali dan alkali tanah yang mempunyai kerangka struktur berongga. Unit pembangun kerangka zeolit adalah SiO44- dan AlO4
2
(Mx+, My2+)(Al(x + 2y)Sin-(x + 2y)O2n). mH2O
M+, M2+ adalah logam monovalen dan logam divalen. Kation-kation yang terdapat dalam tanda kurung pertama adalah kation dapat tukar (exchangable cations), sedangkan tanda kurung kedua menyatakan kation struktural (penyusun dasar) karena bersama-sama dengan atom O menyusun kerangka zeolit. m adalah suatu bilangan tertentu yang khas untuk zeolit (Ming dan Mumpton 1989).
Kerangka zeolit divisualisasikan sebagai tetrahedral-tetrahedral SiO44- dan AlO4
5-sebagai unit bangun primer (Primary Building Unit) yang bergabung bersama-sama membentuk pola geometri tertentu, yaitu unit bangun sekunder, Secondary Building Unit
(SBU). Unit bangun primer adalah tetrahedral dari 4 atom oksigen dengan ion pusat tetrahedral Si4+ dan Al3+, semua atom oksigen mengambil bagian antara 2 tetrahedral. Unit bangun sekunder merupakan susunan tetrahedral-terahedral yang membentuk cincin seperti cincin tunggal dari jenis lingkar empat, enam, delapan, dan prisma heksagonal (Gambar 1).
4
O S i O
O
O
O S i O
O
O
O S i O
O
O
O Si O
O
O
O S i O
O O (a) a a a S4R S6R S8R 4DR D6R D8R
(b)
Gambar 1 (a) Tetrahedral-tetrahedral SiO4
4-yang dihubungkan satu sama lain dengan atom O (b) SBU sederhana:
Single-4-Ring (S4R), S6R, S8R,
Double-4-Ring (D4R), D6R, dan D8R.
Klasifikasi zeolit dan tektosilikat salah satunya berdasarkan topologi. Dari pengelompokkan tersebut diperoleh 10 grup, yaitu analcime, natrolite, heulandite, philipsite, mordenite, chabazite, faujasite, laumontite, pentasil, dan clatharet. Zeolit alam di Indonesia umumnya dari jenis klinoptilolit dan mordenit. Jenis klinoptilolit mempunyai rumus kimia Na6[(AlO2)6(SiO2)30]24H2O,
sedangkan mordenit mempunyai rumus kimia Na8[(AlO2)8(SiO2)40]24H2O (Barrer
1982).
Sifat Tukar Kation dari Zeolit
Kedudukan ion silikon sebagai ion pusat pada bentuk tetrahedral dapat diganti oleh aluminium merupakan suatu proses tanpa mengalami perubahan bentuk. Penggantian suatu ion bervalensi tiga (Al3+) untuk satuion bervalensi empat (Si4+) menimbulkan muatan negatif pada struktur kerangka zeolit. Muatan ini dinetralisasi oleh kation dari golongan alkali maupun alkali tanah seperti Na+, K+, Ca2+, dan Mg2+ (Ming dan Mumpton 1989). Kation dapat tukar pada zeolit hanya terikat lemah di sekitar pusat tetrahedral Al, jadi dapat dihilangkan atau ditukar secara mudah melalui pencucian zeolit dengan larutan pekat dari kation lain. Kemampuan pertukaran ion zeolit merupakan parameter utama dalam menentukan kualitas zeolit yang digunakan. Kemampuan pertukaran dinyata- kan sebagai kapasitas tukar kation (KTK) atau
cation exchange capacity (CEC). KTK dapat dinyatakan sebagai jumlah mili ekivalen ion logam yang dapat diserap maksimum oleh 1 g zeolit dalam kondisi kesetimbangan. KTK pada zeolit sebesar 200─500 cmol/Kg terutama ditentukan oleh fungsi derajat substitusi Al3+ atau Fe3+ pada kerangka. Derajat substitusi yang besar berarti diperlukan lebih banyak kation alkali atau alkali tanah untuk menetralkannya, akibatnya KTKnya semakin besar. Zeolit sintetik A dengan nisbah Si/Al 1:1 mempunyai KTK yang lebih besar, yaitu 540 cmol/Kg daripada mordenit dengan nisbah Si/Al 5:1 dengan KTK 220 cmol/Kg (Ming dan Mumpton 1989).
Jerapan
Akumulasi partikel pada permukaan zat padat disebut jerapan (Atkins 1990). Zeolit dapat digunakan sebagai zat penjerap karena zeolit merupakan kristal yang unik dengan volume kosong yang berkisar dari 20%─50% dan luas permukaan internalnya mencapai ratusan ribu m2/kg. Penggunaan zeolit sebagai penjerap didehidrasi untuk menghilangkan air dengan cara pemanasan pada suhu 350 oC. Setelah dehidrasi, kation-kation akan kembali pada posisi di permukaan dalam dari saluran, yaitu dekat dengan Al. Sistem saluran mungkin berdimensi satu, dimensi dua, atau dimensi tiga (Ming dan Mumpton 1989).
Ada dua metode penjerapan, yaitu metode
3
sehingga terjadi kesetimbangan. Jerapan fase padat-cair ini mencapai kesetimbangan saat penjerap telah jenuh oleh zat terjerap. Zat yang tidak terjerap dipisahkan dari penjerap dengan cara penyaringan.
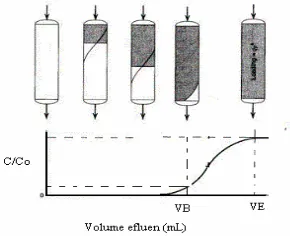
Metode lapik tetap merupakan metode penjerapan dengan menempatkan penjerap dalam kolom sebagai lapik dan zat yang akan dijerap dialirkan ke dalam kolom tersebut sebagai influen. Larutan yang keluar dari kolom merupakan sisa zat yang tidak terjerap, disebut efluen (Schroedi 1977). Mekanisme penjerapan pada metode lapik tetap dapat dijelaskan sebagai berikut: awalnya influen akan kontak dengan lapik zeolit bagian atas, lalu influen mengikuti aliran ke bawah kolom (Gambar 2). Panjang daerah lapik merupakan daerah terjadinya proses penjerapan paling besar disebut daerah jerapan. Setelah daerah lapik bagian atas jenuh, daerah jerapan akan berpindah ke bagian bawah. Saat daerah jerapan mencapai tepi lapik bawah kolom, konsentrasi efluen naik dengan cepat setelah mencapai titik break point, B (titik patah). Kurva yang memperlihatkan fenomena tersebut disebut breakthrough curve (kurva terobosan) atau kurva bentuk S.
Gambar 2 Pola aliran dan kurva terobosan pada metode lapik tetap.
Kurva terobosan merupakan hubungan antara volume efluen dengan (C/Co). Co merupakan konsentrasi influen, sedangkan C konsentrasi efluen (Benefield et al. 1982). Volume efluen saat titik patah (VB), sedangkan VE adalah volume efluen saat C/Co 0.95. Pada titik-titik tersebut dapat ditentukan kapasitas jerapannya. Selain itu, pada C/Co 0.5 ditentukan juga kapasitas jerapannya karena pada titik tersebut umumnya proses penjerapan dihentikan dan lapik harus sudah diganti. Berdasarkan kapasitas jerapan pada C/Co 0.05 dan 0.95 dapat ditentukan efisiensi kolom. Efisiensi kolom merupakan ukuran suatu lapik dapat bekerja dengan baik atau tidak. Faktor-
faktor yang memengaruhi efisiensi kolom, yaitu laju alir, konsentrasi influen, dan tinggi lapik.
Kromium
Kromium merupakan salah satu logam berat yang termasuk dalam unsur transisi golongan VI-B periode 4. Kromium mempunyai nomor atom 24 dan nomor massa 51.996 merupakan logam berwarna putih perak dan lunak jika dalam keadaan murni dengan massa jenis 7.9 g/cm3 mempunyai titik leleh 1875 oC dan titik didih 2658 oC (Sugiyarto 2003). Kromium dapat membentuk tiga macam senyawa yang masing-masing berasal dari proses oksidasi CrO (kromium oksida), yaitu +2 disebut kromium divalen, +3 disebut kromium trivalen, dan +6 disebut kromium heksavalen. Kromium divalen kurang stabil dan bersifat pereduksi kuat, kromium trivalen suatu penyusun yang stabil dan bersifat amfoter, sedangkan kromium heksavalen sebagai bahan kimia yang banyak digunakan di bidang industri (Bastarach 2002).
Kromium trivalen merupakan bentuk yang paling banyak berada di lingkungan. Kromium trivalendibutuhkan untuk kesehatan manusia, karena bersama-sama dengan insulin dapat menjaga kadar gula darah. Jumlah kromium rata-rata yang masuk ke dalam tubuh orang dewasa sehari-hari berkisar antara 0.03─0.1 mg, lebih dari 90% berasal dari makanan. Pada konsentrasi yang rendah kromium trivalen berguna untuk metabolisme karbohidrat pada mamalia dan mengaktifkan insulin. Apabila terjadi kekurangan kromium maka akan mengganggu pertumbuhan dan proses metabolisme lemak dan protein. Pada tingkat yang lebih tinggi dapat menimbulkan keracunan secara akut ditandai dengan gejala mual, sakit perut, kejang, dan koma. Keracunan secara kronis dapat mengenai organ-organ tertentu seperti efek pada paru-paru, ginjal, dan hati (Kusnoputranto 1996).
4
Beberapa metode telah digunakan untuk pengukuran kromium total dan kromium heksavalen pada berbagai material seperti tanah dan air. Salah satunya adalah spektrofo-tometri sinar tampak. Kromium heksavalen bila ditambah 1,5-difenilkarbazida (DPC) dalam larutan asam membentuk kompleks berwarna merah violet yang intensitasnya sebanding dengan banyaknya kromium heksavalen dalam contoh. Reaksi pembentukan kompleks Cr(VI) dengan DPC disajikan pada Gambar 3. Pewarnaan dengan DPC cukup sensitif dengan nilai absorptivitas molar kira-kira 40.000 Lmol-1cm-1 pada 540 nm (Clesceri 1989). Untuk mengukur kromium total dengan metode spektrofotome-tri diperlukan suatu pengoksidasi sehingga kromium dengan tingkat oksidasi lebih rendah dapat dianalisis dengan metode ini. Menurut Clesceri (1989) oksidator yang dapat digunakan diantaranya KMnO4, K2S2O8, dan
HClO4. Selain itu, Noroozifar (2003)
melaporkan bahwa serium juga efektif untuk mengoksidasi kromium trivalen menjadi kromium heksavalen. Kemampuan serium (CeIV) dalam mengkonversi kromium trivalen menjadi kromium heksavalen sebesar 100.01% (Wijayanti 2005), nilai ini lebih baik bila dibandingkan dengan KMnO4 yang
mampu mengkonversi 91.00% (Martha 2004).
2 N H HN C O N H N H
+ Cr(VI)
HN N H C N O N Cr O N NH C N H N H
Gambar 3 Reaksi antara kromium heksavalen dan 1,5-difenilkarbazida
(Clesceri et al. 1989).
Industri Penyamakan Kulit
Industri penyamakan kulit adalah industri yang mengolah kulit mentah menjadi lembaran-lembaran kulit jadi. Proses ini bertujuan mengubah kulit mentah agar tahan terhadap pengaruh mikroorganisme, kimia, dan fisik (Fahidin 1999). Proses dalam industri penyamakan kulit dapat
dikelompokkan menjadi tiga tahap, yaitu proses prapenyamakan, penyamakan, dan pasca penyamakan (Wahyuadi 2004).
Proses prapenyamakan (Beam house operations) terdiri dari beberapa tahapan. Tahapan-tahapan tersebut adalah perendaman (soaking), pengapuran (liming), pembuangan bulu dan daging (unhairing and fleshing) pembuangan kapur (deliming), pelumatan (bating), dan pemikelan (pickling). Tujuan dari proses pra penyamakan, yaitu mempersiapkan kulit untuk dimasuki bahan penyamak, menghilangkan bagian-bagian kulit yang tidak perlu, dan memperbesar pori kolagen sehingga bahan penyamak dapat masuk.
Proses penyamakan pada prinsipnya memasukkan zat penyamak ke dalam jaringan serat kulit (kolagen). Jenis bahan penyamak yang dapat digunakan, yaitu bahan penyamak nabati, sintesis, aldehid atau minyak, dan penyamakan mineral. Bahan penyamak mineral yang sering digunakan adalah Cr2(SO4)3. Kulit mengandung jenis protein
utama, yaitu kolagen yang akan bereaksi membentuk senyawa kompleks kromiumi yang menyebabkan kulit menjadi liat, lentur, dan tahan terhadap pengaruh bakteri dan suhu (Fahidin 1999).
Proses pasca penyamakan mencakup netralisasi, pewarnaan, dan pelemakan. Proses netralisasi hanya dilakukan untuk kulit-kulit yang disamak dengan kromium, sedangkan untuk kulit yang disamak dengan nabati, minyak, maupun samak sintetis tidak perlu dinetralkan. Proses penyamakan tidak mengubah penampilan dari kulit yang disamak.
5
BAHAN DAN METODE
Bahan dan Alat
Bahan-bahan yang digunakan adalah CrCl3.6H2O (Merck), Titrisol standar CrCl3
(Merck), Ce(NH4)2(SO4)3, air bebas ion,
1,5-difenilkarbazida, NaOH, H2SO4, HNO3, zeolit
alam Lampung (+20─40 mesh), perangkat lunak curve expert, dan limbah penyamakan kulit PT Sinar Gunung Putri.
Alat-alat yang digunakan adalah seperangkat spektrofotometer SPECTRONIC 20D+, neraca analitik, pH meter, Vorteks, alat kocok, kolom gelas bercerat (diameter 1cm, panjang 30 cm), corong, gelas piala, tabung reaksi, labu takar, batang pengaduk, kaca arloji, pipet volumetrik, pipet Mohr, pipet tetes, gelas ukur, tabung contoh, dan bulb.
Metode Penelitian
Penelitian meliputi beberapa tahap, yaitu preparasi zeolit, pencirian zeolit, penjerapan Cr3+ dengan metode lapik tetap dan metode tumpak, dan perlakuan limbah penyamakan kulit (Lampiran 1). Preparasi zeolit meliputi penggilingan, pengayakan, dan aktivasi. Tahap pencirian terdiri atas penentuan jenis zeolit berdasarkan hasil dari Badan Penelitian dan Pengembangan Industri, Balai Besar Keramik, Bandung. KTK berdasarkan hasil dari Puslitbang Teknologi Mineral dan Batubara, Bandung. Luas permukaan zeolit berdasarkan hasil dari Laboratorium Mekanika Reservoir, Departemen Metode Perminyakan, Bandung.
Penjerapan Cr3+ dengan metode lapik tetap dilakukan untuk penentuan kondisi optimum kolom meliputi ragam laju alir, tinggi lapik, dan konsentrasi influen. Ragam laju alir yang digunakan, yaitu 7, 9, 11 mL/menit (Barros et al. 2002), tinggi lapik zeolit yang digunakan 6, 9, 11 cm, dan konsentrasi influen (Co) 15, 20, 25 ppm. Penentuan laju alir, tinggi lapik dan konsentrasi influen optimum menggunakan larutan CrCl3.6H2O sebagai
sumber Cr3+. Influen dialirkan dalam kolom, kemudian efluen yang diperoleh ditentukan konsentrasinya dengan menggunakan metode spektrofotometri. Penentuan konsentrasi Cr3+ dalam bentuk teroksidasi, yaitu Cr(VI) dengan pengoksidasi Ce(IV) dan pengompleks 1,5-difenilkarbazida. Dari data yang diperoleh dibuat kurva terobosan menggunakan perangkat lunak curve expert sehingga dapat ditentukan kapasitas jerapan pada C/Co 0.05
,
0.5, dan 0.95 serta efisiensi kolom. Kondisi optimum laju alir, konsentrasi influen, dan tinggi lapik ditentukan berdasarkan nilai kapasitas jerapan pada C/Co 0.5 dan efisiensi kolom maksimum. Metode tumpak dilakukan untuk penentuan kapasitas jerapan tertinggi pada beberapa konsentrasi Cr3+.
Perlakuan terhadap limbah penyamakan kulit adalah sebagai berikut: pengukuran konsentrasi kromium awal, pengukuran pH awal, pengendapan dengan NaOH meliputi penetapan waktu pemeraman endapan dan pH, penjerapan filtrat hasil pengendapan dengan metode lapik tetap dan penimbangan endapan.
Preparasi zeolit
Zeolit Lampung dihaluskan dan diayak dengan ukuran +20─40 mesh, lalu dipanaskan dalam oven pada suhu 200 oC selama 4 jam. Setelah itu, zeolit hasil pemanasan disimpan dalam wadah yang kedap udara
.
Penentuan konsentrasi kromium dan kurva standar
Agar dapat dianalisis dengan spektrofotometer, maka Cr3+ perlu dioksidasi menjadi Cr6+. Oksidator yang digunakan, yaitu larutan Ce(IV) 0.4%. Larutan Ce(IV) dibuat dengan cara melarutkan 0.4 g Ce(NH4)2(SO4)3
dalam 100 mL HNO3 0.5 M. Sebanyak 10 mL
larutan contoh dimasukkan dalam tabung reaksi, kemudian ditambah 1 mL larutan Ce(IV) dan dikocok. Setelah itu ditambah 7 tetes H2SO4 18 N dan 0.2 mL
1,5-difenilkarbazida, lalu dikocok dan dibiarkan 10 menit sebelum diukur serapannya pada panjang gelombang 540 nm. Konsentrasi Cr3+ ditentukan dengan kurva standar. Pembuatan kurva standar menggunakan larutan standar Cr3+ dengan konsentrasi Cr3+ 0, 0.3, 0.5, 1.0, 1.5, 2.0, dan 2.5 ppm, prosedur selanjutnya seperti penentuan kromium larutan contoh. Pengukuran dilakukan juga pada larutan blanko. Data yang diperoleh kemudian dibuat kurva hubungan antara konsentrasi dan absorbans.
Penjerapan Cr3+ dengan metode Lapik Tetap
Persiapan kolom. Sebanyak 5 g zeolit dimasukkan dalam gelas piala yang berisi air bebas ion, kemudian zeolit dimasukkan ke dalam kolom yang sudah dilapisi glass wool
6
Penetapan kondisi optimum kolom.
Prosedur awal yang dilakukan seperti persiapan kolom. Selanjutnya larutan Cr3+ dengan konsentrasi 20 ppm dialirkan menggunakan corong pisah. Cerat kolom dan corong pisah diatur sehingga kecepatan penetesannya sama. Laju alir yang digunakan diatur sesuai dengan yang diinginkan. Tiap 20 mL efluen ditampung dalam botol contoh, prosedur selanjutnya seperti pada penentuan kromium. Dari data yang diperoleh dibuat kurva terobosan, yaitu hubungan antara volume efluen dan C/Co. Berdasarkan kurva terobosan ditentukan kapasitas jerapan pada C/Co 0.05, 0.5, 0.95 serta efisiensi kolom.
Kapasitas jerapan (Wb) pada C/Co 0.05 dihitung menggunakan persamaan:
Wb =
mz ) - La x (t
FA 0.05 0.05
Kapasitas jerapan (W) pada C/Co 0.5 dihitung menggunakan persamaan:
W =
mz ) - La x (t FA 0.5 0.5
Kapasitas jerapan pada C/Co 0.95 (Wsat) dihitung menggunakan persamaan:
Wsat=
mz ) - La x (t
FA 0.95 0.95
Efisiensi kolom dapat dihitung menggunakan persamaan:
% Efisiensi kolom = Wb x 100% Wsat
Keterangan:
t0.05 = waktu pada C/Co 0.05 (menit)
t0.5 = waktu pada C/Co 0.5 (menit)
t0.95 = waktu pada C/Co 0.95 (menit)
Wb = kapasitas jerapan pada C/Co 0.05
(mg Cr/g zeolit)
W = kapasitas jerapan pada C/Co 0.5 (mg Cr/g zeolit)
Wsat = kapasitas jerapan pada C/Co 0.95
(mg Cr/g zeolit)
FA = laju alir zat terlarut per satuan luas
penampang lapik (mg/menit cm2) La = luas daerah dibawah kurva C/Co
0.05, 0.5, dan 0.95 (menit)
mz = massa zeolit per unit area lapik (g/cm2)
Prosedur dan perhitungan tersebut dilakukan pada ragam laju alir, konsentrasi influen, dan tinggi lapik. Ragam laju alir yang digunakan 7, 9, 11 mL/menit dan penetapan laju alir optimum pada konsentrasi influen 20 ppm dan tinggi lapik 6 cm. Ragam konsentrasi influen, yaitu 15, 20, 25 ppm dan penetapan konsentrasi influen optimum pada laju alir
optimum dan tinggi lapik 6 cm.
Ragam tinggi lapik 6, 9, 11 cm dan penetapantinggi lapik optimum menggunakan laju alir dan konsentrasi influen optimum. Berdasarkan data yang diperoleh dianalisis pengaruh laju alir, konsentrasi influen, dan tinggi lapik terhadap kurva terobosan, kapasitas jerapan pada C/Co 0.5, dan efisiensi kolom.
Penjerapan Cr3+ dengan metode tumpak
Sebanyak 1 gram zeolit dimasukkan ke dalam erlenmeyer yang berisi 50 mL larutan Cr3+ 40 ppm. Campuran dikocok menggunakan alat kocok dengan kecepatan 350 rpm selama 48 jam. Sesudah itu, campuran disentrifus untuk memisahkan larutan dari zeolit. Supernatan yang diperoleh ditentukan konsentrasi Cr3+ sebagai Cr3+ yang tidak terjerap sesuai dengan prosedur penentuan kromium. Perlakuan diulangi pada ragam konsentrasi 60, 80, dan 100 ppm. Kapasitas jerapan dihitung menggunakan rumus:
Kapasitas jerapan =
m V(Co-C)
Keterangan: V = volume larutan (mL) Co = konsentrasi larutan awal (ppm) C = konsentrasi larutan akhir (ppm) m = massa zeolit (g)
Perlakuan Limbah Penyamakan Kulit Penetapan konsentrasi awal. Pengukuran konsentrasi kromium awal pada limbah cair penyamakan kulit dilakukan dengan cara mengencerkan sejumlah larutan contoh diencerkan sehingga diperoleh konsentrasi sekitar 0.1─2.5 ppm. Prosedur selanjutnya seperti prosedur penentuan kromium.
Penetapan waktu pemeraman endapan.
7
dapat ditentukan waktu pemeraman endapan optimum, yaitu yang menghasilkan pengurangan konsentrasi kromium terbesar pada larutan.
Penetapan pH. Sebanyak 100 mL limbah cair penyamakan kulit dimasukkan dalam gelas piala. Prosedur selanjutnya seperti penetapan waktu pemeraman endapan tetapi waktu pemeraman endapan yang digunakan adalah waktu pemeraman endapan optimum. Nilai pH yang digunakan, yaitu pH 8 dan 9. Dari data yang diperoleh dapat dihitung konsentrasi kromium pada filtrat dan bobot NaOH yang digunakan. Berdasarkan konsentrasi kromium yang diperoleh pada filtrat dapat ditentukan pH pengendapan.
Bobot NaOH (g) dapat dihitung menggunakan persamaan:
Bobot NaOH (g) =VNaOH x CNaOH x BM NaOH
Keterangan:
VNaOH = volume NaOH (mL)
CNaOH = konsentrasi NaOH (M)
BM NaOH = bobot molekul NaOH (g/mol)
Penjerapan filtrat hasil pengendapan dengan metode lapik tetap. Pengendapan limbah penyamakan kulit menggunakan waktu pemeraman endapan dan pH yang telah diperoleh sebelumnya. Filtrat hasil pengendapan dialirkan dalam kolom yang telah disiapkan sesuai prosedur persiapan kolom. Laju alir dan tinggi lapik yang digunakan merupakan hasil penetapan kondisi optimum kolom. Kapasitas jerapan dihitung menggunakan persamaan-persamaan seperti pada penentuan kondisi optimum kolom.
HASIL DAN PEMBAHASAN
Pencirian Zeolit Lampung
Zeolit alam memerlukan pencirian untuk mengetahui sifat-sifat fisik dan kimianya. Penampakan secara visual menunjukkan zeolit Lampung berwarna putih. Pencirian yang dilakukan diantaranya dengan difraksi sinar-X (XRD), analisis kapasitas tukar kation, dan isoterm BET (Brunauer-Emmett-Teller).
Analisis mineral dengan XRD menunjuk- kan bahwa zeolit asal Lampung mengandung klinoptilolit 94.24% dan Alpha Quartz 5.76% (Lampiran 2). Komposisi kimia menunjukkan bahwa nisbah Si/Al zeolit Lampung 5.24 (Lampiran 3). Nilai tersebut masih berada dalam kisaran nisbah Si/Al, yaitu 4.3-5.3 dapat
dilihat pada Lampiran 4. Zeolit Lampung termasuk dalam zeolit dengan kadar Si sedang. Daya pertukaran ion dari zeolit maksimum bila perbandingan Si/Al mendekati 1 (Sutarti & Rachmawati 1994). Perbedaan komposisi kimia maupun mineral zeolit alam disebabkan oleh perubahan struktur lapisan kerak bumi selama proses pembentukan mineral (Ming dan Mumpton 1989).
Nilai KTK yang diperoleh sebesar 89.62 me/100 g. Hal ini berarti bahwa 89.62 me ion NH4+ dapat bertukar dengan ion-ion yang
terkandung dalam 100 gram zeolit. Dari hasil analisis diperoleh luas permukaan spesifik zeolit Lampung 37.7768 m2/g.
Penetapan Laju Alir Optimum
Pola penjerapan zeolit terhadap Cr3+ pada beberapa laju alir disajikan dalam kurva terobosan pada Gambar 4. Kurva terobosan tersebut diperoleh berdasarkan hasil analisis fraksi efluen (Lampiran 5-10). Kurva yang diperoleh menunjukkan bahwa pada laju alir tinggi kurva semakin curam dan pendek, sedangkan pada laju alir rendah kurva lebih landai dan lebar. Laju alir 11 mL/menit menghasilkan kurva yang curam sehingga titik patah lebih cepat tercapai dan terjadi pada volume efluen 85.90 mL, sedangkan pada laju alir 7 mL/menit dan 9 mL/menit titik patah dicapai pada volume efluen yang lebih tinggi, yaitu 301.22 mL dan 106.26 mL. Oleh karena itu, kurva pada laju alir rendah lebih landai. Peningkatan laju alir juga menyebabkan volume efluen pada titik jenuh menurun sehingga kurva yang diperoleh akan lebih pendek. 0.00 0.10 0.20 0.30 0.40 0.50 0.60 0.70 0.80 0.90 1.00
0 200 400 600 800 1000 1200
Volume efluen (ml)
C/Co
7 (ml/menit) 9 (ml/menit) 11 (ml/menit
Gambar 4 Kurva terobosan pada laju alir 7, 9, dan 11 mL/menit.
8
pada laju alir 7 mL/menit lebih lama sehingga memungkinkan jumlah Cr3+ yang terjerap lebih banyak dibandingkan pada laju alir 9 dan 11 mL/menit. Laju alir yang tinggi menyebab-kan waktu kontak antara Cr3+ dalam larutan dan zeolit relatif singkat sehingga Cr3+ belum terjerap ke dalam pori zeolit, larutan harus sudah keluar kolom karena terdorong oleh larutan yang baru masuk ke kolom.
1.8786 1.3988 1.1194 0 0.5 1 1.5 2
7 9 11
Laju alir (ml/menit)
Kapasitas jerapan (mg Cr/g zeolit)
Gambar 5 Pengaruh laju alir terhadap kapasitas jerapan lapik zeolit pada C/Co 0.5.
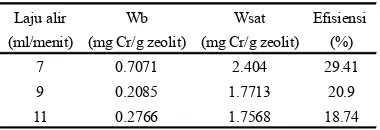
Peningkatan laju alir menyebabkan penurunan efisiensi kolom (Tabel 2 dan Lampiran 11). Efisiensi kolom tertinggi dicapai pada laju alir 7 mL/menit, yaitu 29.41%. Nilai Wb dan Wsat pada 7 mL/menit
lebih tinggi dibandingkan pada 9 dan 11 mL/menit, hal ini disebabkan oleh waktu kontak antara Cr3+ dalam larutan dengan zeolit lebih lama sehingga jumlah Cr3+ terjerap lebih banyak. Hasil tersebut mendukung penelitian yang telah dilakukan oleh Zhao et al. (1988), bahwa peningkatan laju alir menghasilkan penurunan efisiensi kolom karena pada laju alir tinggi waktu kontak zat terlarut dengan penjerap lebih cepat. Laju alir optimum pada 7 mL/menit karena mempunyai kapasitas jerapan dan efisiensi kolom maksimum.
Tabel 1 Pengaruh laju alir terhadap efisiensi kolom
Laju alir Wb Wsat Efisiensi
(ml/menit) (mg Cr/g zeolit) (mg Cr/g zeolit) (%)
7 0.7071 2.404 29.41
9 0.2085 1.7713 20.9
11 0.2766 1.7568 18.74
Penetapan Konsentrasi Influen Optimum
Pengujian pengaruh konsentrasi influen dilakukan pada laju alir optimum, yaitu 7 mL/menit dan tinggi lapik 6 cm. Kurva terobosan dengan ragam konsentrasi influen 15, 20, dan 25 ppm disajikan pada Gambar 6 yang diperoleh berdasarkan hasil analisis
fraksi efluen (Lampiran 12-15). Pengaruh konsentrasi influen terhadap kurva terobosan menurut Babu dan Gupta (2004), makin rendah konsentrasi influen makin landai dan lebar kurva yang diperoleh. Kecenderungan serupa untuk pengaruh konsentrasi terhadap kurva juga diamati pada hasil penelitian. Berdasarkan kurva terobosan yang diperoleh nampak bahwa peningkatan konsentrasi influen menghasilkan volume efluen pada titik patah menurun. Titik patah untuk konsentrasi influen 15 ppm dicapai pada volume efluen 243.49 mL, sedangkan pada konsentrasi influen 20 ppm dan 25 ppm sebesar 179.16 mL dan 118.6 mL.
0 0 .2 0 .4 0 .6 0 .8 1
0 3 0 0 6 0 0 9 0 0 12 0 0 150 0
Volume efluen (ml)
C/Co
15 ppm 20 ppm 25 ppm
Gambar 6 Kurva terobosan pada konsentrasi influen 15, 20, dan 25 ppm.
Pengaruh konsentrasi influen terhadap kapasitas jerapan pada C/Co 0.5 disajikan pada Gambar 7. Kapasitas jerapan tertinggi diperoleh pada konsentrasi influen 20 ppm, yaitu 2.1849 mg Cr/g zeolit. Pada konsentrasi 25 ppm kapasitas jerapan lebih rendah, hal tersebut dapat disebabkan oleh zeolit yang telah jenuh sehingga tidak bisa menjerap Cr3+ lagi. Selain itu, pada konsentrasi influen tinggi mengandung lebih banyak jumlah Cr3+ sehingga kerapatan Cr3+ tinggi dan terjadi persaingan Cr3+ yang tersedia untuk dijerap zeolit. 1.7455 2.1849 2.0463 0 0.5 1 1.5 2 2.5
15 20 25
Konsentrasi (ppm)
Kapasitas jerapan (mg Cr/g zeolit)
Gambar 7 Pengaruh konsentrasi influen terhadap kapasitas jerapan lapik zeolit pada C/Co 0.5.
9
pada Wsat yang diperoleh meningkat (Tabel 4
dan Lampiran 16). Pada konsentrasi influen 15 ppm diperoleh efisiensi kolom tertinggi, yaitu 33.82%. Berdasarkan nilai kapasitas jerapan yang diperoleh, maka konsentrasi influen optimum pada 20 ppm.
Tabel 2 Pengaruh konsentrasi influen terhadap efisiensi kolom
Konsentrasi Wb Wsat Efisiensi
(ppm) (mg Cr/g zeolit) (mg Cr/g zeolit) (%)
15 0.7138 2.1104 33.82
20 0.8225 2.7962 29.42
25 0.6054 2.9093 20.81
Penetapan Tinggi Lapik Optimum
Penetapan tinggi lapik optimum pada laju alir optimum 7 mL/menit dan konsentrasi influen optimum 20 ppm. Pengaruh tinggi lapik terhadap kurva terobosan disajikan pada Gambar 8 yang diperoleh berdasarkan hasil analisis fraksi efluen (Lampiran 17-20). Berda-sarkan kurva terobosan yang diperoleh nampak bahwa bertambahnya tinggi lapik menghasilkan bentuk kurva yang hampir sama. Semakin tinggi lapik, kurva yang diperoleh semakin landai dan lebar. Menurut Mc Cabe et al. (2001), meskipun bentuk kurva terobosan sama namun terjadi pergeseran titik patah. Kecenderungan serupa diperoleh pada hasil penelitian, yaitu volume efluen pada titik patah mengalami peningkatan dengan bertambahnya tinggi lapik. Hal ini disebabkan oleh daerah jerapan semakin panjang dengan bertambah- nya tinggi lapik sehingga semakin tinggi volume influen yang diperlukan untuk mencapai titik patah. Titik patah untuk tinggi lapik 11 cm dicapai pada volume efluen 627.87 mL, sedangkan pada tinggi lapik 6 cm dan 9 cm sebesar 179.63 mL dan 357.68 mL.
0 0.2 0.4 0.6 0.8 1
0 400 800 1200 1600 2000 2400
Volume efluen (ml)
C/Co
6 (c m ) 9 (c m ) 11 (c m )
Gambar 8 Kurva terobosan pada tinggi lapik 6, 9, dan 11 cm.
Hasil penelitian menunjukkan bahwa kapasitas jerapan pada C/Co 0.5 meningkat dengan bertambahnya tinggi lapik. Kapasitas jerapan maksimum dicapai pada tinggi lapik 11 cm, yaitu 1.9748 mg Cr/g zeolit (Gambar 9 dan Lampiran 21). Menurut Babu dan Gupta (2004) bahwa semakin tinggi lapik daerah jerapan semakin panjang sehingga jumlah Cr3+ lebih banyak terjerap pada lapik dan menghasilkan kapasitas jerapan yang tinggi.
1.8785 1.8838 1.9748
0 0 .5 1 1.5 2 2 .5
6 9 11
T inggi lapik (cm)
Kapasitas jerapan (mg Cr/g zeolit)
Gambar 9 Pengaruh tinggi lapik terhadap kapasitas jerapan lapik zeolit pada C/Co 0.5.
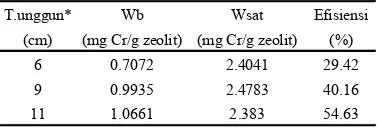
Efisiensi kolom meningkat dengan bertambahnya tinggi lapik (Tabel 6). Hal ini disebabkan oleh daerah jerapan yang panjang sehingga Cr3+ yang terjerap semakin banyak. Kapasitas jerapan pada titik patah dan titik jenuh meningkat sehingga lapik zeolit yang bekerja akan semakin besar. Efisiensi tertinggi diperoleh pada tinggi lapik 11 cm yaitu 54.63%. Hal tersebut berarti bahwa 6 cm dari tinggi lapik total dapat bekerja dengan baik.
Tabel 3 Pengaruh tinggi lapik terhadap efisiensi kolom
T.unggun* Wb Wsat Efisiensi
(cm) (mg Cr/g zeolit) (mg Cr/g zeolit) (%)
6 0.7072 2.4041 29.42
9 0.9935 2.4783 40.16
11 1.0661 2.383 54.63
* Tinggi lapik
Penjerapan Cr3+ dengan Metode Tumpak
10
1.5835 2.404 2.7094 3.0171 0 1 2 3 440 60 80 100
Konsentrasi Cr 3+ (ppm)
Kapasitas jerapan (mg Cr/g z
eo
lit)
Gambar 10 Pengaruh konsentrasi Cr3+ terhadap kapasitas jerapan zeolit dengan metode tumpak.
Metode tumpak dan lapik tetap menghasilkan nilai kapasitas jerapan yang berbeda. Kapasitas jerapan lapik zeolit pada kondisi optimum dengan metode lapik tetap, yaitu 1.9748 mg Cr/g zeolit, sedangkan pada metode tumpak diperoleh 3.0171 mg Cr/g zeolit. Nilai tersebut menunjukkan bahwa kapasitas jerapan pada metode tumpak lebih baik dibandingkan dengan metode lapik. Kapasitas jerapan yang rendah pada metode lapik tetap dipengaruhi oleh laju alir, konsentrasi influen, dan tinggi lapik. Pada metode lapik tetap, kerja lapik biasanya dihentikan pada saat C/Co 0.5 dengan pertimbangan konsentrasi efluen sudah mencapai setengah dari influen. Pada kondisi tersebut sebenarnya lapik belum jenuh dan lapik masih bekerja, lapik telah jenuh bila efluen yang keluar mencapai 95% dari konsentrasi influen.
Perlakuan Limbah Penyamakan Kulit
Limbah cair penyamakan kulit mempunyai konsentrasi Cr3+ awal 2674.13 ppm (Lampiran 23). Konsentrasi Cr3+ tersebut sangat tinggi sehingga dilakukan pengendapan menggunakan NaOH untuk menurunkan konsentrasinya. Endapan yang terbentuk adalah Cr(OH)3 yang berwarna biru.
Beberapa faktor yang memengaruhi proses pengendapan dengan NaOH diantaranya pH, waktu pemeraman endapan, dan kecepatan penambahan NaOH (Esmaeli et al. 2005).
Penetapan Waktu Pemeraman Endapan
Semakin lama waktu pemeraman endapan, konsentrasi kromium dalam filtrat semakin meningkat. Konsentrasi kromium pada filtrat menunjukkan peningkatan 16.80% pada waktu pemeraman endapan 24 jam dibandingkan pada waktu pemeraman endapan 4 jam. Hal ini dapat disebabkan oleh penambahan NaOH yang berlebih sehingga pH yang diperoleh
lebih dari 9. Menurut Esmaeli et al. (2005), pada pH lebih dari 9 endapan Cr(OH)3 dapat
larut lagi sehingga konsentrasi kromium pada filtrat akan meningkat. Akan tetapi, pada waktu pemeraman endapan 6 jam tidak menyebabkan konsentrasi kromium dalam filtrat berubah dari konsentrasi pada waktu pemeraman endapan 4 jam (Tabel 7 dan Lampiran 24). Waktu pemeraman endapan yang digunakan selanjutnya adalah 4 jam karena waktu tersebut lebih cepat dan menghasilkan konsentrasi kromium dalam filtrat yang lebih rendah dibandingkan pada waktu pemeraman endapan 6 dan 24 jam.
Tabel 4 Pengaruh waktu pemeraman endapan terhadap konsentrasi Cr3+ dalam filtrat
Waktu pemeraman endapan [Cr]filtrat
(jam) (ppm)
4 65.4299
6 67.2362
24 76.4211
Penetapan pH
11
Tabel 5 Pengaruh pH terhadap Cr3+ dalam filtrat
pH [Cr]filtrat Bobot NaOH
(ppm) (g)
8 77.0900 0.3000
9 9.7311 0.3810
Kandungan ion-ion dalam filtrat pH 8 mempunyai konsentrasi yang beragam. Ion Cr3+, K+, Mg2+, Ca2+, dan Na+ digunakan dalam proses penyamakan. Konsentrasi Cr3+ setelah pengendapan pada pH 8 lebih rendah dibandingkan dengan konsentrasi ion lain. Kandungan ion dalam limbah yang paling tinggi adalah ion natrium. Konsentrasi natrium yang tinggi, selain dari proses penyamakan diperoleh juga dari NaOH yang ditambahkan untuk pengendapan.
Tabel 6 Analisis ion dalam filtrat pH 8*
ion Konsentrasi (ppm)
Kromium 19.53
Kalium 32.28
Magnesium 2400
Kalsium 1284.5
Natrium 10200
* Hasil uji AAS Laboratorium Terpadu Institut Pertanian Bogor
Penjerapan Filtrat Hasil Pengendapan dengan Metode Lapik Tetap
Filtrat hasil pengendapan pada pH 9 digunakan sebagai influen dengan konsentrasi kromium sebesar 16,9326 ppm. Kondisi kolom yang digunakan, yaitu kondisi optimum yang telah diperoleh. Laju alir yang digunakan 7mL/menit dan tinggi lapik 11 cm. Pola penjerapan Cr3+ limbah penyamakan kulit disajikan pada Gambar 11 yang diperoleh berdasarkan hasil analisis fraksi efluen (Lampiran 26─27).
0 .0 0 0 .2 0 0 .4 0 0 .6 0 0 .8 0 1.0 0
0 50 10 0 150 2 0 0 2 50 3 0 0 3 50
Volume e flue n (ml)
Gambar 11 Kurva terobosan filtrat pH 9.
Kapasitas jerapan zeolit terhadap Cr3+ limbah penyamakan kulit, yaitu 0.1848 mg Cr/ g zeolit. Nilai tersebut lebih rendah bila
dibandingkan dengan kapasitas jerapan zeolit terhadap larutan tunggal Cr3+ pada kondisi kolom yang sama, yaitu 1.9748 mg Cr/g zeolit. Konsentrasi Cr3+ pada C/Co 0.5 dalam efluen sebesar 8.46 ppm dan nilai tersebut masih berada di atas ambang batas yang ditentukan, yaitu 0.6 ppm. Bila tujuan penjerapan agar diperoleh efluen dengan konsentrasi Cr3+ dibawah ambang batas, maka lapik harus diganti sebelum konsentrasi efluen 0.6 ppm atau kurang dari 20 mL. Menurut Barros et al. (2003), keberadaan ion lain seperti Ca2+, Mg2+, Na+, dan K+ dalam limbah akan berkompetisi dengan Cr3+ sehing-ga memensehing-garuhi penjerapan zeolit terhadap Cr3+. Hal tersebut berkaitan dengan jari-jari ion Cr3+, Ca2+, Mg2+, Na+, dan K+ masing-masing, yaitu 0.62, 1.00, 0.72, 1.20, dan 1.38 Å (Patnaik 2003) yang memungkinkan dapat terjerap oleh zeolit danberdasarkan analisis filtrat pH 8, kandungan Ca2+, Mg2+, dan Na+ cukup tinggi sehingga dapat berkom-petisi dengan Cr3+. Selain itu, berdasarkan nis- bah Si/Al yang cukup tinggi (5.24), selektivitas zeolit Lampung lebih tinggi terhadap ion monovalen dibandingkan ion divalen dan trivalen. Selektivitas zeolit yang tinggi terhadap ion trivalen ditemukan pada zeolit dengan nisbah Si/Al zeolit yang lebih rendah (Ming DW & Mumpton 1989).
SIMPULAN DAN SARAN
Simpulan
Kondisi kolom optimum pada metode lapik tetap, yaitu pada laju alir 7 mL/menit, konsentrasi influen 20 ppm, dan tinggi lapik 11 cm. Pada kondisi tersebut, diperoleh kapasitas jerapan 1.9748 mg Cr/g zeolit dan efisiensi kolom 54.63%. Pada metode tumpak diperoleh kapasitas jerapan 3.0171 mg/ g zeolit.
12
Saran
Sebaiknya dilakukan penelitian lebih lanjut menggunakan dimensi kolom (diameter dan panjang kolom) yang lebih besar dan penambahan jumlah zeolit yang digunakan. Selain itu perlu dilakukan pengujian pengaruh ion Ca+, Mg2+, Na+, dan K+ pada penjerapan zeolit Lampung terhadap Cr3+.
DAFTAR PUSTAKA
Atkins PW. 1990. Kimia Fisik. Irma IK, penerjemah. Jakarta: Erlangga. Terjemahan dari: Physical Chemistry.
Babu BV, Gupta S. 2004. Modeling and Simulation of Fixed Bed Adsorption Column: Effect of Velocity Variation.
http://discovery.bitspilani.ac.in/dicipline/
chemical/BVb/index.html [20 Des 2005].
Barrer RM. 1982. Hydrothermal Chemistry of Zeolites. London: Academic Pr.
Barros MASD, Arroyo PA, Sousa-Aguiar EF, Tavares CRG, Zola AS. 2002. Equilibrium and Dinamics Ion Exchange Studies of Cr3+ on Zeolites NaA and NaX. Maringa
24:1619-1625.
Barros MASD, Arroyo PA, Sousa-Aguiar EF, Tavares CRG, Zola AS. 2003. Binary Ion Excange of Metal Ions in Y and X Zeolites. Braz J Chem Eng 20.
Bastarache E. 2002. Chromium and Coumpounds. http://digitale fire.com/
education/toxicity/chromium. html [12 Apr 2003].
Benefield LD, F Joseph, JR Judkins, Weand BL. 1982. Process Chemistry for Water and Wastewater Treatment. New Jersey: Prentice-Hall, Inc.
Clesceri IS, Arnold EG, Andrew DE. 1989.
Standar Methods for The Examination of Water and wastewater. Ed ke-20. Washington DC: Alpha Awwa wes.
Esmaeili A, Meshdaghi nia A, Vazirinejad R. 2005. Chromium (III) Removal and Recovery from Tannery Wastewater by
Precipitation Process. Am J Appl Sci 2 10:1471-1473.
Fahidin M. 1999. Ilmu dan Teknologi Kulit. Bogor: IPB Pr.
Hendayana, Kadarohman A, Sumarna AA, Supriatna A. 1994. Kimia Analitik Instrumen. Ed ke-1. Semarang: IKIP Semarang Pr.
Kusnoputranto H. 1996. Toksikologi Lingkungan Logam Toksik dan B-3. Jakarta: Fakultas Kesehatan masyarakat dan Pusat Penelitian Sumber Daya Manusia dan Lingkungan, UI.
Martha F. 2004. Penetapan limit deteksi dan limit respon linear serta pengaruh oksidasi terhadap pengukuran kromium dengan spektrofotometri sinar tampak. [skripsi]. Bogor: Departemen Kimia, Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
McCabe WL et al. 2001. Unit Operation of Chemical Engineering. Ed ke-6. New York: McGraw Hill.
Ming DW, Mumpton. 1989. Zeolites in Soils. Di dalam: Dixon JB, Weed SB, editor.
Mineral in Soil Environments. Ed ke-2. Madison: Soil Science Society of America.
Noroozifar M, Khorasani-Motlagh M. 2003. Spesific Extraction of Chromium as Tetrabutylammonium-Chromate and Spectrophotometric Determination by Diphenylcarbazide: Speciaton of Chromium in Efluent Streams. Anal Sci
19:705-708.
Patnaik. 2003. Handbook of Inorganic Chemistry. New York: McGraw Hill.
Schroedi ED. 1977. Water dan Wastewater Treatment. New York: McGraw-Hill.
Sugiyarto HK. 2003. Dasar -dasar Kimia Anorganik Logam. Yogyakarta: UGM Press.
Sutarti M, Rachmawati M. 1994. Zeolit Tinjauan Literatur. Jakarta: LIPI.
13
go.id/balitbang/Puskim/protek_Kim/ttg_Ki m_Limbah kulit. Html [17 Jul 2005].
Wijayanti E. 2005. Ekstraksi kromium heksavalen sebagai tetrabutil amonium-kromat dan pengukuran secara spektrofotometri sinar tampak. [skripsi]. Bogor: Departemen Kimia, Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Zhao G, Li X, Li G, Zhang Q. 1988. Removal Copper from Electroplating Effluents (Potch Water) Using Clinoptilolite. Di dalam: Sherry D. Kallo HS, editor.
14
15
Lampiran 1 Bagan alir Penelitian
Variasi Ragam waktu
Pemeraman endapan
dan pH
Oven 105oC
Lampiran 2 Hasil analisis XRD zeolit Lampung
Preparasi
Karakterisasi Perlakuan
tumpak
Perlakuan Lapik tetap
XRD KTK Luas permukaan Ragam
konsentrasi
Ragam laju alir
Kondisi optimum
Ragam tinggi Ragam
Limbah Penyamakankulit
Pengendapan dengan NaOH
Zeolit
Saring
Filtrat Endapan
Perlakuankolom
16
Lampiran 3 Hasil analisis kimia zeolit Lampung
Komponen Kadar (% berat)
SiO2 70.55
Al2O3 11.89
Fe2O3 1.85
TiO2 0.08
CaO 4.85 MgO tt
Na2O 1.61
K2O 1.81
Hilang pijar 7.36
Cr2O3 tt
tt: tidak terdeteksi
Berdasarkan pengujian di Balai Besar Keramik 2005, Badan Penelitian dan Pengembangan Industri, Departemen Perindustrian R.I
Lampiran 4 Sifat fisika dan kimia zeolit alami *
Zeolit Rumus kimia
Volume kosong
(%) Rasio Si/Al
KTKteori (cmol/Kg) Clinoptilolit (Na3K3){Al6Si30O72}.24H2O 34 4,3-5,3 220
Mordenit (Na8){Al8Si40O96}.24H2O 28 4,2-5,0 220
*Breck (1974), Meier dan Olson (1978) (Dalam Ming DW & Mumpton 1989) volume kosong ditentukan berdasarkan kandungan air dalam zeolit.
Lampiran 5 Analisis fraksi pada laju alir 7 mL/menit konsentrasi 20 ppm.
Bobot zeolit 5.0796 g
[influen] 20.4532 ppm
Tinggi lapik 6 cm
Fraksi
Volume
(ml) %T A Akoreksi
Konsentrasi
(ppm) C/Co
Co 25.8 0.5884 0.5778 20.5755
1 20 94.8 0.0232 0.0126 -0.0037 0.00
5 100 89.2 0.0496 0.0390 0.0928 0.00
9 180 52.8 0.2774 0.2668 0.9233 0.05
13 260 86.0 0.0655 0.0549 1.5063 0.07
17 340 77.6 0.1101 0.0995 3.1341 0.15
21 420 61.2 0.2132 0.2026 6.8946 0.34
25 500 55.0 0.2596 0.2490 8.5863 0.42
29 580 45.4 0.3429 0.3323 11.6245 0.57
33 660 40.2 0.3958 0.3852 13.5512 0.66
37 740 39.8 0.4001 0.3895 13.7096 0.67
41 820 39.6 0.4023 0.3917 13.7894 0.67
45 900 35.0 0.4559 0.4453 15.7451 0.77
17
Lampiran 6 Kurva terobosanpada laju alir 7 mL/menit dan konsentrasi 20 ppm
Lampiran 7 Analisis fraksi pada laju alir 9 mL/menit konsentrasi 20 ppm Bobot zeolit 5.0694 g
[influen] 18.1867 ppm Tinggi lapik 6 cm
Fraksi
Volume
(ml) %T A Akoreksi
Konsentrasi
(ppm) C/Co
Co 30.4 0.5171 0.5057 19.9254
1 20 94.2 0.0259 0.0145 0.0380 0.00
5 100 56.6 0.2472 0.2358 0.9184 0.05
9 180 40.4 0.3936 0.3822 1.5011 0.08
13 260 77.6 0.1101 0.0987 3.7301 0.19
17 340 68.0 0.1675 0.1561 6.0124 0.30
21 420 61.4 0.2118 0.2004 7.7768 0.39
25 500 54.6 0.2628 0.2514 9.8053 0.49
29 580 42.6 0.3706 0.3592 14.0943 0.71
33 660 41.8 0.3788 0.3674 14.4220 0.72
37 740 39.8 0.4001 0.3887 15.2693 0.77
41 820 34.0 0.4685 0.4571 17.9913 0.90
45 900 32.2 0.4921 0.4807 18.9313 0.95
Lampiran 8 Kurva terobosan pada laju alir 9 mL/menit dan konsentrasi 20 ppm S = 0.07908575
r = 0. 97697672
Volume Effluen (ml)
C
/C
o
0 80 160 240 320 400 480 560 640 720 800 880 960
0.01 0.19 0.37 0.56 0.74 0.92 1.11
S = 0.03855176 r = 0. 99505654
Volume Effluen (ml)
C/
C
o
0 80 160 240 320 400 480 560 640 720 800 880
18
Lampiran 9 Analisis fraksi pada laju alir 11mL/menit konsentrasi 20 ppm Bobot zeolit 5.0257 g
[influen] 19.7386 ppm
Tinggi lapik 6 cm
Fraksi
Volume
(ml) %T A Akoreksi
Konsentrasi
(ppm) C/Co
Co 27.2 0.5654 0.5548 19.7386
5 100 43.0 0.3665 0.3559 1.2485 0.06
9 180 21.0 0.6778 0.6672 2.3836 0.12
13 260 57.8 0.2381 0.2275 7.7999 0.38
17 340 51.8 0.2857 0.2751 9.5357 0.47
21 420 41.6 0.3809 0.3703 13.0090 0.64
25 500 41.0 0.3872 0.3766 13.2391 0.65
29 580 41.4 0.3830 0.3724 13.0853 0.64
33 660 35.8 0.4461 0.4355 15.3872 0.75
37 740 36.0 0.4437 0.4331 15.2990 0.75
41 820 31.4 0.5031 0.4925 17.4643 0.85
45 900 32.4 0.4895 0.4789 16.9677 0.83
49 980 39.6 0.4023 0.3917 13.7894 0.67
53 1060 28.0 0.5528 0.5422 19.2794 0.94
Lampiran 10 Kurva terobosan pada laju alir 11mL/menit dan konsentrasi 20 ppm
S = 0.07976715 r = 0. 96667330
Volume Effluen (ml)
C/
Co
0 80 160 240 320 400 480 560 640 720 800 880 9601040
19
Lampiran 11 Pengaruh laju alir terhadap Wb, W, Wsat, dan efisiensi kolom
Laju alir Co B.zeolit μo ρb mz FA
t - La
(menit) Wb W Wsat Wb/Wsat Efisiensi
(ml/menit) (ppm) (g) (g/cm2) 0.05 0.50 0.95 0.05 0.5 0.95 (%)
7 20.4532 5.0796 8.9172 1.0785 6.471 0.1824 25.08 66.64 85.28 0.7071 1.8786 2.4040 0.2941 29.41 9 18.1867 5.0694 11.4649 0.7175 6.458 0.2085 11.47 43.32 54.86 0.3702 1.3988 1.7713 0.2090 20.90 11 19.7386 5.0257 14.0127 0.582 6.402 0.2766 7.62 31.71 40.66 0.3292 1.1194 1.6643 0.2033 20.33
Perhitungan:
C = konsentrasi efluen (ppm)
Co = konsentrasi influen (ppm) v = laju alir (ml/menit)
μo = laju alir per luas penampang lapik (cm/menit)
L.penampang = 0.785 cm2
ρb = densitas lapik zeolit (g/cm3)
V.lapik = 4.71 cm3 T.lapik = 6 cm
Wb = kapasitas jerapan pada C/Co 0.05 (mg Cr/g zeolit) W = kapasitas jerapan pada C/Co 0.5 (mg Cr/g zeolit) Wsat = kapasitas jerapan pada C/Co 0.95 (mg Cr/g zeolit)
FA = laju alir zat terlarut per satuan luas penampang lapik (mg/menit cm2)
La = luas daerah dibawah kurva C/Co 0.05, 0.5, dan 0.95 (menit) mz = massa zeolit per unit area lapik (g/cm2)
μo =
penampang L.
v
FA = μo x Co
ρb =
V.lapik B.zeolit
20
Wb =
mz ) La -(t x
FA 0.05 0.05
W =
mz ) La -(t x
FA 0.5 0.5
Wsat =
mz ) La -(t x
FA 0.95 0.95
Efisiensi =
sat b
W W
x 100%
Contoh perhitungan untuk laju alir 7 ml/menit
μo = 2 cm 0.785
ml/menit
7 W =
2 2 g/cm 6.471 menit 66.64 x cm mg/menit 0.1824
= 8.9172 cm/menit = 1.8786 mg Cr/g zeolit
FA = 8.9172 menit
cm x 20.4532 L
mg x
3 --3 cm L 10 W
sat =
2 2 g/cm 6.471 menit 85.28 x cm mg/menit 0.1824
= 0.1824 mg/menit cm2 = 2.4040 mg Cr/g zeolit
ρb =
3 cm 4.71 g 5.0796 Efisiensi = 2.4040
0.7071 x 100%
= 1.0785 g/cm3 = 29.41%
mz = 6 cm x 1.0785 g/cm3
= 6.471 g/cm2
Wb =
2 2 g/cm 6.471 menit 25.08 x cm mg/menit 0.1824
21
Lampiran 12 Analisis fraksi pada konsentrasi influen 15 ppm
Bobot zeolit 5.0212 g [influen] 13.2391ppm Tinggi lapik 6.0 cm Laju alir 7 mL/menit
Fraksi
Volume
(ml) %T A Akoreksi
Konsentrasi
(ppm) C/Co
Co 41.0 0.3872 0.3766 13.2391
11 220 93.8 0.0278 0.0172 0.1312 0.01
15 300 90.2 0.0448 0.0342 0.7510 0.06
19 380 84.6 0.0726 0.0620 1.7662 0.13
23 460 78.2 0.1068 0.0962 3.0122 0.23
27 540 72.0 0.1427 0.1321 4.3205 0.33
31 620 67.8 0.1688 0.1582 5.2724 0.40
35 700 64.2 0.1925 0.1819 6.1366 0.46
39 780 58.4 0.2336 0.2230 7.6363 0.58
43 860 50.8 0.2941 0.2835 9.8445 0.74
47 940 49.2 0.3080 0.2974 10.3514 0.78
51 1020 45.0 0.3468 0.3362 11.7647 0.89
55 1100 42.2 0.3747 0.3641 12.7822 0.97
59 1180 47.8 0.3206 0.3100 10.8086 0.82
63 1260 42.8 0.3686 0.3580 12.5586 0.95
67 1340 41.2 0.3851 0.3745 13.1620 0.99
Lampiran 13 Kurva terobosan pada konsentrasi influen 15 ppm
Lampiran 14 Analisis fraksi pada konsentrasi influen 25 ppm
Bobot zeolit 5.2596 g [influen] 21.9872 ppm Tinggi lapik 6 cm
Laju alir 7 mL/menit
Fraksi
Volume
(mL) %T A Akoreksi
Konsentrasi
(ppm) C/Co
Co 23.6 0.6271 0.6165 21.9872
3 60 90.6 0.0429 0.0323 0.0681 0.00
7 140 56.4 0.2487 0.2381 0.8188 0.04
11 220 25.0 0.6021 0.5915 2.1074 0.10
15 300 62.6 0.2034 0.1928 6.5363 0.30
19 380 46.0 0.3372 0.3266 11.4166 0.52
23 460 42.6 0.3706 0.3600 12.6328 0.57
27 540 34.4 0.4634 0.4528 16.0190 0.73
Lanjutan
S = 0.05055081 r = 0. 99168515
Volume Effluen (ml)
C
/C
o
0 80 160 240 320 400 480 560 640 720 800 880 9601040112012001280
22
Fraksi
Volume
(mL) %T A Akoreksi
Konsentrasi
(ppm) C/Co
31 620 34.0 0.4685 0.4579 16.2043 0.74
35 700 39.8 0.4001 0.3895 13.7096 0.62
39 780 36.0 0.4437 0.4331 15.2990 0.70
43 860 38.6 0.4134 0.4028 14.1945 0.65
47 940 28.2 0.5498 0.5392 19.1667 0.87
51 1020 24.6 0.6091 0.5985 21.3299 0.97
55 1100 29.0 0.5376 0.5270 18.7236 0.85
59 1180 24.2 0.6162 0.6056 21.5895 0.98
Lampiran 15 Kurva terobosan pada konsentrasi influen 25 ppm
S = 0.10625890 r = 0.94839179
Volume Effluen (ml) C/
Co
0 80 160 240 320 400 480 560 640 720 800 880 960 1040 1120 0.00
23
Lampiran 16 Pengaruh konsentrasi influen terhadap Wb, W, Wsat, dan efisiensi kolom
Konsentrasi Co B.zeolit ρb mz FA
t – La
(menit) Wb W Wsat Wb/Wsat Efisiensi
(ppm) (ppm) (g) (g/cm2) 0.05 0.50 0.95 0.05 0.5 0.95 (%)
15 13.2391 5.0212 0.9380 5.6281 0.1181 34.02 83.18 100.57 0.7138 1.7455 2.1104 0.3382 33.82 20 20.4532 5.0796 0.9272 5.5634 0.1824 25.09 66.64 85.29 0.1824 2.1849 2.7962 0.2942 29.42 25 21.9872 5.2596 0.8955 5.3730 0.1961 16.59 56.07 79.71 0.1961 2.0463 2.9093 0.2081 20.81
Contoh perhitungan untuk konsentrasi 15 ppm
μo = 2 cm 0.785
ml/menit
7 = 8.9172 cm/menit Wsat =
2 2
g/cm 5.2681
menit 100.57 x cm mg/menit 0.1181
FA = 8.9172 menit
cm x 13.2391 L
mg x
3 --3
cm L
10 = 2.1104 mg Cr/g zeolit
= 0.1181 mg/menit cm2
ρb =
3
cm 4.71
g
5.0212 = 0.9380 g/cm3
Efisiensi =
2.1104
0.7138 x 100% = 33.82 %
mz = 6 cm x 0.9380 g/cm3 = 5.2681 g/cm2
Wb =
2 2
g/cm 5.2681
menit 34.02 x cm mg/menit 0.1181
= 0.7138 mg Cr/g zeolit
W =
2 2
g/cm 5.2681
menit 83.18 x cm mg/menit 0.1181
24
Lampiran 17 Analisis fraksi pada tinggi lapik 9 cm
Bobot zeolit 7.1027 g
[influen] 19.9254 ppm
Laju alir 7 mL/menit
Fraksi
Volume
(mL) %T A Akoreksi
Konsentrasi
(ppm) C/Co
Co 30.4 0.5171 0.5057 19.9254
11 220 79.2 0.1013 0.0899 0.3377 0.02
17 340 62.2 0.2062 0.1948 0.7553 0.04
23 460 49.8 0.3028 0.2914 1.1396 0.06
29 580 71.6 0.1451 0.1337 5.1209 0.26
35 700 52.8 0.2774 0.2660 10.3846 0.52
41 820 55 0.2596 0.2482 9.6792 0.49
47 940 49 0.3098 0.2984 11.6754 0.59
53 1060 39.8 0.4001 0.3887 15.2693 0.77
59 1180 43 0.3665 0.3551 13.9328 0.70
65 1300 45.4 0.3429 0.3315 12.9942 0.65
71 1420 37.2 0.4295 0.4181 16.4368 0.82
77 1540 33.4 0.4763 0.4649 18.2990 0.92
Lampiran 18 Kurva terobosan pada tinggi lapik 9 cm
S = 0.08497914 r = 0. 97372181
Volume Effluen (ml)
C
/C
o
0 120 240 360 480 600 720 840 960 1080 1200 1320 1440 1560 0.0
0 0.17 0.34 0.51 0.6
25
Lampiran 19 Analisis fraksi pada tinggi lapik 11 cm
Bobot zeolit 9.0621 g
[influen] 18.8859 ppm
Laju alir 7 mL/menit
Fraksi
Volume
(mL) %T A A koreksi
Konsentrasi
(ppm) C/Co
Co 29.2 0.5346 0.5141 18.8859
23 460 74.2 0.1296 0.1091 0.4082 0.02
31 620 53.8 0.2692 0.2487 0.9186 0.05
39 780 81.6 0.0883 0.0678 2.5735 0.14
47 940 60.8 0.2161 0.1956 7.2440 0.38
55 1100 49.6 0.3045 0.2840 10.4758 0.55
63 1260 42.2 0.3747 0.3542 13.0405 0.69
71 1420 34.6 0.4609 0.4404 16.1924 0.86
79 1580 45.4 0.3429 0.3224 11.8803 0.63
87 1740 39.4 0.4045 0.3840 14.1303 0.75
95 1900 34.4 0.4634 0.4429 16.2844 0.86
103 2060 29.6 0.5287 0.5082 18.6699 0.99
Lampiran 20 Kurva terobosan pada tinggi lapik 11 cm
S = 0.10202087 r = 0. 96875606
Volume Effluen (ml)
C/
C
o
0 160 320 480 640 800 960 1120 1280 1440 1600 1760 1920 2080
26
Lampiran 21 Pengaruh tinggi lapik terhadap Wb, W, Wsat, dan efisiensi kolom
T.lapik Co B.zeolit ρb mz FA
t - La
(menit) Wb W Wsat Wb/Wsat Efisiensi
(cm) (ppm) (g) (g/cm2) 0.05 0.50 0.95 0.05 0.5 0.95 (%)
6 20.4532 5.0796 1.0785 6.4708 0.1824 25.09 66.64 85.29 0.7072 1.8785 2.4041 0.2942 29.42 9 19.9254 7.1027 1.0053 9.0480 0.1777 50.59 95.92 125.96 0.9935 1.8838 2.4738 0.4016 40.16 11 18.8859 9.0621 1.0495 11.5411 0.1684 89.22 135.34 163.31 1.3018 1.9748 2.3830 0.5463 54.63
Contoh perhitungan untuk tinggi lapik 9 cm
μo = 2 cm 0.785
ml/menit
7 = 8.9172 cm/menit W
sat =
2 2
g/cm 9.0480
menit 125.96 x cm mg/menit 0.1777
FA = 8.9172 menit
cm x 19.9254 L
mg x
3 --3
cm L
10 = 2.4738 mg Cr/g zeolit
= 0.1777 mg/menit cm2 Efisiensi =
2.4738
0.9935 x 100% = 40.16%
ρb =
3
cm 7.065
g
7.1027 = 1.0053 g/cm3
mz = 6 cm x 1.0053 g/cm3 = 9.0480 g/cm2
Wb =
2 2
g/cm 9.0480
menit 50.09 x cm mg/menit 0.1777
= 0.9935 mg Cr/g zeolit
W =
2 2
g/cm 9.0480
menit 95.92 x cm mg/menit 0.1777
27
Lampiran 22 Penentuan kapasitas jerapan zeolit terhadap Cr3+ dengan metode tumpak
Ulangan Bobot zeolit %T A Akoreksi Co Cr sisa Cr terjerap Kapasitas jerapan
(g) (ppm) (ppm) (ppm) (mg Cr/g zeolit)
1 1.0381 63.4 0.1979 0.1892 34.1468 1.4798 32.6670 1.5734
2 1.0329 68.2 0.1662 0.1575 1.2253 32.9215 1.5936
rerata 1.5835
1 1.0318 52.00 0.2840 0.2753 59.4548 10.8549 48.5999 2.3551
2 1.0067 54.40 0.2644 0.2557 10.0683 49.3865 2.4529
rerata 2.4040
1 1.031 48.20 0.3170 0.3083 79.8009 24.3559 55.4450 2.6889
2 1.0075 47.60 0.3224 0.3137 24.7927 55.0082 2.7299
rerata 2.7094
1 1.0155 34.60 0.4609 0.4522 97.6943 35.9152 61.7791 3.0418
2 1.0289 34.40 0.4634 0.4547 36.1173 61.5770 2.9924
rerata 3.0171
Perhitungan:
V = volume larutan (mL) Co = konsentrasi larutan awal (ppm) C = konsentrasi larutan akhir (ppm) m = massa zeolit (g)
Kapasitas jerapan =
m V(Co-Ca)
Contoh perhitungan pada konsentrasi Cr3+ 80 ppm
Kapasitas jerapan =
g 1.0310
ppm 55.4450) -(79.8009 ml
50
= 2.6889 mg Cr/g zeolit
Lampiran 23 Penentuan konsentrasi awal kromium pada limbah penyamakan kulit
Ulangan %T A Akoreksi Konsentrasi (ppm)
1 53.0 0.2757 0.2643 2647.8773
2 52.4 0.2807 0.2693 2700.3899
28
Lampiran 24 Penetapan waktu pemeraman endapan pada pH 8
Waktu agieng Ulangan V NaOH Bobot NaOH [Cr] filtrat Bobot endapan
(jam) (ml) (g) (ppm) (g)
4 1 9.3 0.5580 66.4262 3.5361
2 9.4 0.5640 64.4338 3.1270
rerata 65.4299 3.3315
6 1 9.6 0.5760 66.8299 2.9794
2 9.3 0.5580 67.6426 3.3322
rerata 67.2362 3.1556
24 1 9.3 0.5580 75.2988 2.6845
2 9.2 0.5520 77.5433 4.0280
rerata 76.4211 3.3563
Keterangan:
VNaOH = volume NaOH (mL)
CNaOH = konsentrasi NaOH (M)
BM NaOH = bobot molekul NaOH (g/mol)
Bobot NaOH = VNaOH x CNaOH x BM NaOH
Contoh perhitungan untuk waktu ageing 4 jam ulangan 1:
Bobot NaOH = 9.30 ml x 1.5 M x 40 g/mol = 0.558 g
Lampiran 25 Penetapan pH pengendapan
pH Ulangan VolumeNaOH Bobot NaOH [Cr] filtrat
(ml) (g) (ppm)
8 1 5.00 0.3000 77.0900
2 5.00 0.3000 77.0900
rerata 77.0900
9 1 6.40 0.3840 9.7080
2 6.30 0.3780 9.9753
rerata 9.7311
Contoh perhitungan untuk pH 8 ulangan 1:
Bobot NaOH = 5.00 ml x 1.5 M x 40 g/mol = 0.300 g
Lampiran 26 Analisis fraksi filtrat pH 9 limbah penyamakan kulit
Bobot zeolit 9.0512 g Laju alir 7 mL/menit Tinggi lapik 11cm [Filtrat awal] 16.9326 ppm
Fraksi
Volume
(mL) %T A Akoreksi
Konsentrasi
(ppm) C/Co
Co 36.6 0.4365 0.4277 16.9326
1 20 78.6 0.1046 0.0958 0.6076 0.04
2 40 61.2 0.2132 0.2044 1.5174 0.09
29
Lanjutan
Fraksi
Volume
(mL) %T A Akoreksi
Konsentrasi (ppm) C/Co
4 80 38.6 0.4134 0.4046 7.9827 0.47
5 100 43.0 0.3665 0.3577 7.0015 0.41
6 120 36.2 0.4413 0.4325 8.5662 0.51
7 140 36.2 0.4413 0.4325 8.5662 0.51
8 160 38.2 0.4179 0.4091 8.0774 0.48
9 180 35.8 0.4461 0.4373 8.6672 0.51
10 200 45.0 0.3468 0.3380 13.1765 0.78
11 220 45.8 0.3391 0.3303 12.8562 0.76
12 240 43.8 0.3585 0.3497 13.6679 0.81
13 260 40.2 0.3958 0.3870 15.2270 0.90
14 280 42.6 0.3706 0.3618 14.1729 0.84
15 300 43.4 0.3625 0.3537 13.8347 0.82
16 320 39.2 0.4067 0.3979 15.6850 0.93
Lampiran 27 Kurva terobosan filtrat pH 9 limbah penyamakan kulit
Contoh perhitungan:
Co = 16.9326 ppm
T.lapik = 11 cm
B.zeolit = 9.0512 g
μo = 8.9172 cm/menit
FA = 0.1509 mg/menit cm2
ρb = 1.0482 g/cm3
mz = 11.5302 g/cm2
t0.5 = 19.09 menit
t0.5 – La0.5 = 4.97 menit
W =
mz ) La -(t x
FA 0.5 0.5
=
2 2
g/cm 11.5302
menit 4.97 x cm mg/menit 0.1509
= 0.1848 mg Cr/g zeolit
S = 0.08839252 r = 0. 96085834
Volume Effluen (ml)
C/
C
o
0 40 80 120 160 200 240 280 320