KAJIAN PENGARUH PENAMBAHAN DIETILEN GLIKOL SEBAGAI PEMLASTIS PADA KARAKTERISTIK BIOPLASTIK
DARI POLI-β-HIDROKSIALKANOAT (PHA) YANG DIHASILKAN
Ralstronia eutropha PADA SUBSTRAT HIDROLISAT PATI SAGU
Oleh VICO DELVIA
F34102030
2006
FAKULTAS TEKNOLOGI PERTANIAN INSTITUT PERTANIAN BOGOR
Vico Delvia. F34102030. Kajian Pengaruh Penambahan Dietilen Glikol Sebagai Pemlastis pada Karakteristik Bioplastik dari Poli-β-hidroksialkanoat (PHA) yang Dihasilkan Ralstronia Eutropha Pada Substrat Hidrolisat Pati Sagu. Dibawah bimbingan Khaswar Syamsu. 2006
RINGKASAN
Plastik merupakan salah satu produk yang banyak dimanfaatkan oleh masyarakat secara besar-besaran. Plastik yang biasa digunakan saat ini adalah plastik sintetis berbasis petrokimia yang sangat sulit diuraikan secara hayati ketika dibuang ke lingkungan. Limbah plastik tergolong sampah yang tidak mudah didegradasi (dihancurkan) oleh mikroorganisme sehingga berpeluang “abadi” mengendap di tanah. Limbah sampah plastik menjadi masalah serius yang dihadapi dunia, tidak hanya pada negara-negara maju tetapi juga negara berkembang seperti Indonesia. Penggunaan Poli-β-hidroksialkanoat (PHA) sebagai bahan baku bioplastik menjadi salah satu solusi yang dapat dilakukan untuk mengatasi permasalahan yang ditimbulkan plastik sintetis ini karena PHA mampu didegradasi oleh lingkungan dan sumber bahan bakunya bersifat dapat diperbaharui (renewable).
Salah satu bakteri yang dapat memproduksi PHA di dalam sel adalah Ralstonia eutropha. Proses kultivasi R. eutropha dengan substrat hidrolisat pati sagu mampu menghasilkan PHA berupa Poli-β-hidroksibutirate (PHB) yang memiliki sifat yang mirip dengan polipropilen (PP). Proses kultivasi yang dilakukan secara fed batch mampu menghasilkan biomassa sebesar 4,04 g/l dan PHA 25-40% dari bobot biomassa. PHA yang dihasilkan memiliki sifat yang kaku dan rapuh sehingga perlu ditambahkan pemlastis untuk memperbaiki sifat ini. Pemlastis yang digunakan pada penelitian ini adalah dietilen glikol (DEG). Pembuatan lembaran bioplastik dilakukan dengan melarutkan PHA pada kloroform dan menambahkannya dengan pemlastis DEG dengan konsentrasi 0% (kontrol), 10%, 20%, 30% dan 40%. Lembaran bioplastik dengan konsentrasi DEG 0%, 10%, 20% dan 30% mampu membentuk lembaran bioplastik sedangkan pada konsentrasi diatas 40% tidak mampu membentuk lembaran bioplastik. Untuk melihat pengaruh penambahan DEG, dilakukan uji karakteristik lembaran bioplastik seperti kuat tarik, perpanjangan putus, sifat termal, derajat kristalinitas, gugus fungsi dan densitas.
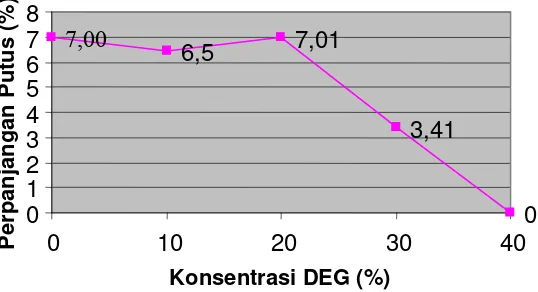
Pengujian kuat tarik dari lembaran bioplastik 0%, 10%, 20% dan 30% DEG adalah 0,12 ± 0,09 MPa; 0,11 ± 0,09 MPa; 0,07 ± 0,02 MPa; 0,03 ± 0,03 MPa yang menunjukkan bahwa penambahan DEG akan menyebabkan kuat tarik lembaran bioplastik menurun. Persen perpanjangan putus dari lembaran bioplastik 0%, 10%, 20% dan 30% DEG adalah 7,00 ± 3,44%; 6,46 ± 2,96%; 7,01 ± 0,59% dan 3,41 ± 3,30%. Persen perpanjangan putus terbaik dimiliki oleh lembaran bioplastik 20% DEG karena memiliki nilai perpanjangan putus tertinggi dan bersifat lebih plastis. Dengan sifat mekanis ini, dinyatakan bahwa bioplastik 20% DEG merupakan bioplastik terbaik.
adalah 167,51oC. Penambahan pemlastis menyebabkan penurunan titik leleh lembaran bioplastik. Begitu juga untuk derajat kristalinitas yang mengalami penurunan ketika dilakukan penambahan DEG. Derajat kristalinitas bioplastik 0% DEG adalah 50,52% sedangkan 20% DEG 31,45%.
Vico Delvia. F34102030. Study on The Addition of Diethylene Glycol (DEG) as Plasticizer on Bioplastic Characteristics of Poly-β-Hydroxyalkanoates (PHA) Produced by Ralstronia eutropha on Hydrolysed Sago Starch. Supervised by Khaswar Syamsu. 2006
SUMMARY
Plastic is a product which is used by society in many fields. Recently, plastic that is usually used is synthetic plastic which is based on petrochemical. Plastic waste is rubbish which is not easily degraded by microorganisms. Plastic waste becomes a serious problem that world faces today, not only in a developed country but also in developing country like Indonesia. One of raw material resources of bioplastic is polyhydroxyalkanoates (PHA). PHA which is produced by specific microorganism is a natural plastic seed (biopolymer). This biopolymer is one of solutions that can solve the problems of synthetic plastic because PHA is easy to degrade and its raw material is renewable.
One of bacteria which can produce PHA in its cells is Ralstonia eutropha. Cultivation process of R. eutropha with sago starch hydrolysate as substrate can produce PHA especially polyhidroxybutyrate (PHB) which has the characteristic like polypropylene (PP). Biomass of R. eutropha can be produced up to 4.04 g/l with PHA content of PHA 25-40% from the biomass. PHA is rigid and brittle. Plasticizer is added to improve this characteristic. Plasticizer which is used is diethylene glycol (DEG). Bioplastic was made by dissolving PHA in chloroform and then added with DEG at concentration 0% (control), 10%, 20%, 30% and 40%. Bioplastic with concentration DEG 0%, 10%, 20% and 30% can form a sheet of bioplastic, but concentration of more than 40% can not. Effect of DEG which is added can be evaluated by tensile strength test, elongation test, thermal characterization, degree of crystalinity, functional group and density.
Tensile strength of 0%, 10%, 20%, and 30% DEG are 0.12 ± 0.09 MPa; 0.11 ± 0.09 MPa; 0.07 ± 0.02 MPa; 0.03 ± 0.03 MPa, respectively. It shows that the addition of DEG decreases the tensile strength of bioplastic sheet. Elongation of 0%, 10%, 20%, and 30% DEG are 7.00 ± 3.44%; 6.46 ± 2.96%; 7.01 ± 0.59% dan 3.41 ± 3.30%, respectively. Bioplastic sheet with 20% DEG has the best elongation because it has the highest point and more plastic. With this mechanical characteristic, it is decided that bioplastic with 20% DEG is the best bioplastic sheet in this research. Bioplastic were then characterized for melting point, degree of crystalinity, and functional group.
Melting point of control is 168.72oC and bioplastic sheet 20% DEG is 167.51oC. The addition of plasticizer decreases the melting point of bioplastic sheet. Degree of crystalinity also decreases when bioplastic sheet is added with DEG. Crystalline degree of control is 50.52% and bioplastic 20% DEG is 31.45%.
KAJIAN PENGARUH PENAMBAHAN DIETILEN GLIKOL SEBAGAI PEMLASTIS PADA KARAKTERISTIK BIOPLASTIK
DARI POLI-β-HIDROKSIALKANOAT (PHA) YANG DIHASILKAN
Ralstronia eutropha PADA SUBSTRAT HIDROLISAT PATI SAGU
SKRIPSI
Sebagai salah satu syarat untuk memperoleh gelar
SARJANA TEKNOLOGI PERTANIAN Pada Departemen Teknologi Industri Pertanian
Fakultas Teknologi Pertanian
Institut Pertanian Bogor
Oleh Vico Delvia
F34102030
2006
FAKULTAS TEKNOLOGI PERTANIAN INSTITUT PERTANIAN BOGOR
INSTITUT PERTANIAN BOGOR FAKULTAS TEKNOLOGI PERTANIAN
KAJIAN PENGARUH PENAMBAHAN DIETILEN GLIKOL SEBAGAI PEMLASTIS PADA KARAKTERISTIK BIOPLASTIK
DARI POLI-β-HIDROKSIALKANOAT (PHA) YANG DIHASILKAN
Ralstronia eutropha PADA SUBSTRAT HIDROLISAT PATI SAGU
SKRIPSI
Sebagai salah satu syarat untuk memperoleh gelar
SARJANA TEKNOLOGI PERTANIAN Pada Departemen Teknologi Industri Pertanian
Fakultas Teknologi Pertanian
Institut Pertanian Bogor
Oleh Vico Delvia
F34102030
Dilahirkan pada tanggal 30 Maret 1985
Di Jambi
Tanggal Lulus: 18 Oktober 2006
Menyetujui,
Bogor, 31 Oktober 2006
RIWAYAT HIDUP
Vico Delvia dilahirkan di Jambi, 30 Maret 1985. Penulis merupakan anak pertama dari dua bersaudara, putri dari
pasangan Abdul Manan dan Nursiah. Penulis menyelesaikan
sekolah dasar di SD Negeri 95/IV pada tahun 1996 dan
melanjutkan ke SLTP Negeri 17 Jambi pada tahun yang sama.
Tahun 1999, Penulis menyelesaikan masa belajarnya di SLTP
dan melanjutkan ke SMU Negeri 1 Jambi (1999-2002). Pada tahun 2002, Penulis
diterima di Institut Pertanian Bogor melalui jalur USMI. Penulis masuk di
Departemen Teknologi Industri Pertanian, Fakultas Teknologi Pertanian, Institut
Pertanian Bogor.
Selama masa kuliah, Penulis aktif dalam berbagai organisasi dan kegiatan
di Universitas. Penulis bergabung dalam kepengurusan Himpunan Mahasiswa
Teknologi Industri (HIMALOGIN) sejak tahun 2003 dan memprioritaskan diri
pada bidang Public Relations HIMALOGIN. Pada tahun yang sama, Penulis bergabung sebagai anggota Paduan Suara FATETA serta menjadi Asisten
Praktikum di Departemen TIN. Penulis menyelesaikan masa kuliah di IPB pada
DAFTAR ISI
Halaman
KATA PENGANTAR ... iii
DAFTAR ISI ... v
DAFTAR TABEL... vii
DAFTAR GAMBAR ... viii
DAFTAR LAMPIRAN... ix
I. PENDAHULUAN ... 1
A. LATAR BELAKANG ... 1
B. TUJUAN ... 3
II. TINJAUAN PUSTAKA ... 4
A. POLIHIDROKSIALKANOAT... 4
B. Ralstronia eutropha... 6
C. HIDROLISAT PATI SAGU ... 9
D. PELARUT KLOROFORM ... 10
E. PEMLASTIS DIETILEN GLIKOL... 12
F. PROSES KULTIVASI PHA ... 13
G. PROSES HILIR PHA ... 16
H. PEMBUATAN LEMBARAN BIOPLASTIK ... 17
I. KARAKTERISTIK BIOPLASTIK ... 18
III.BAHAN DAN METODE ... 22
A. BAHAN DAN ALAT ... 22
1. Bahan ... 22
2. Alat ... 22
B. TAHAPAN PENELITIAN ... 23
1. Persiapan Bahan Baku Bioplastik ... 23
a. Persiapan Substrat ... 23
b. Produksi PHA secara Fed Batch ... 25
c. Proses Hilir PHA ... 26
2. Pembuatan Lembaran Bioplastik ... 27
C. ANALISIS DATA ... 28
IV.HASIL DAN PEMBAHASAN ... 29
A. PERSIAPAN BAHAN BAKU BIOPLASTIK ... 29
1. Persiapan Substrat ... 29
2. Produksi PHA secara Fed Batch... 29
3. Proses Hilir PHA ... 30
B. PEMBUATAN LEMBARAN BIOPLASTIK ... 33
C. KARAKTERISASI BIOPLASTIK... 36
1. Kuat Tarik dan Perpanjangan Putus ... 37
2. Sifat Termal ... 41
3. Derajat Kristalinitas ... 44
4. Gugus Fungsi ... 45
5. Densitas ... 48
V. KESIMPULAN DAN SARAN ... 50
DAFTAR PUSTAKA ... 52
DAFTAR TABEL
Halaman
Tabel 1. Kelarutan PHB pada berbagai pelarut... 11
Tabel 2. Komposisi media propagasi dan media fermentasi... 24
Tabel 3. Formulasi bahan dalam pembuatan lembaran bioplastik ... 34
Tabel 4. Perbandingan sifat fisik dan kimia PP, PHB, PHA dan lembaran bioplastik (DEG 20%) ... 37
KAJIAN PENGARUH PENAMBAHAN DIETILEN GLIKOL SEBAGAI PEMLASTIS PADA KARAKTERISTIK BIOPLASTIK
DARI POLI-β-HIDROKSIALKANOAT (PHA) YANG DIHASILKAN
Ralstronia eutropha PADA SUBSTRAT HIDROLISAT PATI SAGU
Oleh VICO DELVIA
F34102030
2006
FAKULTAS TEKNOLOGI PERTANIAN INSTITUT PERTANIAN BOGOR
Vico Delvia. F34102030. Kajian Pengaruh Penambahan Dietilen Glikol Sebagai Pemlastis pada Karakteristik Bioplastik dari Poli-β-hidroksialkanoat (PHA) yang Dihasilkan Ralstronia Eutropha Pada Substrat Hidrolisat Pati Sagu. Dibawah bimbingan Khaswar Syamsu. 2006
RINGKASAN
Plastik merupakan salah satu produk yang banyak dimanfaatkan oleh masyarakat secara besar-besaran. Plastik yang biasa digunakan saat ini adalah plastik sintetis berbasis petrokimia yang sangat sulit diuraikan secara hayati ketika dibuang ke lingkungan. Limbah plastik tergolong sampah yang tidak mudah didegradasi (dihancurkan) oleh mikroorganisme sehingga berpeluang “abadi” mengendap di tanah. Limbah sampah plastik menjadi masalah serius yang dihadapi dunia, tidak hanya pada negara-negara maju tetapi juga negara berkembang seperti Indonesia. Penggunaan Poli-β-hidroksialkanoat (PHA) sebagai bahan baku bioplastik menjadi salah satu solusi yang dapat dilakukan untuk mengatasi permasalahan yang ditimbulkan plastik sintetis ini karena PHA mampu didegradasi oleh lingkungan dan sumber bahan bakunya bersifat dapat diperbaharui (renewable).
Salah satu bakteri yang dapat memproduksi PHA di dalam sel adalah Ralstonia eutropha. Proses kultivasi R. eutropha dengan substrat hidrolisat pati sagu mampu menghasilkan PHA berupa Poli-β-hidroksibutirate (PHB) yang memiliki sifat yang mirip dengan polipropilen (PP). Proses kultivasi yang dilakukan secara fed batch mampu menghasilkan biomassa sebesar 4,04 g/l dan PHA 25-40% dari bobot biomassa. PHA yang dihasilkan memiliki sifat yang kaku dan rapuh sehingga perlu ditambahkan pemlastis untuk memperbaiki sifat ini. Pemlastis yang digunakan pada penelitian ini adalah dietilen glikol (DEG). Pembuatan lembaran bioplastik dilakukan dengan melarutkan PHA pada kloroform dan menambahkannya dengan pemlastis DEG dengan konsentrasi 0% (kontrol), 10%, 20%, 30% dan 40%. Lembaran bioplastik dengan konsentrasi DEG 0%, 10%, 20% dan 30% mampu membentuk lembaran bioplastik sedangkan pada konsentrasi diatas 40% tidak mampu membentuk lembaran bioplastik. Untuk melihat pengaruh penambahan DEG, dilakukan uji karakteristik lembaran bioplastik seperti kuat tarik, perpanjangan putus, sifat termal, derajat kristalinitas, gugus fungsi dan densitas.
Pengujian kuat tarik dari lembaran bioplastik 0%, 10%, 20% dan 30% DEG adalah 0,12 ± 0,09 MPa; 0,11 ± 0,09 MPa; 0,07 ± 0,02 MPa; 0,03 ± 0,03 MPa yang menunjukkan bahwa penambahan DEG akan menyebabkan kuat tarik lembaran bioplastik menurun. Persen perpanjangan putus dari lembaran bioplastik 0%, 10%, 20% dan 30% DEG adalah 7,00 ± 3,44%; 6,46 ± 2,96%; 7,01 ± 0,59% dan 3,41 ± 3,30%. Persen perpanjangan putus terbaik dimiliki oleh lembaran bioplastik 20% DEG karena memiliki nilai perpanjangan putus tertinggi dan bersifat lebih plastis. Dengan sifat mekanis ini, dinyatakan bahwa bioplastik 20% DEG merupakan bioplastik terbaik.
adalah 167,51oC. Penambahan pemlastis menyebabkan penurunan titik leleh lembaran bioplastik. Begitu juga untuk derajat kristalinitas yang mengalami penurunan ketika dilakukan penambahan DEG. Derajat kristalinitas bioplastik 0% DEG adalah 50,52% sedangkan 20% DEG 31,45%.
Vico Delvia. F34102030. Study on The Addition of Diethylene Glycol (DEG) as Plasticizer on Bioplastic Characteristics of Poly-β-Hydroxyalkanoates (PHA) Produced by Ralstronia eutropha on Hydrolysed Sago Starch. Supervised by Khaswar Syamsu. 2006
SUMMARY
Plastic is a product which is used by society in many fields. Recently, plastic that is usually used is synthetic plastic which is based on petrochemical. Plastic waste is rubbish which is not easily degraded by microorganisms. Plastic waste becomes a serious problem that world faces today, not only in a developed country but also in developing country like Indonesia. One of raw material resources of bioplastic is polyhydroxyalkanoates (PHA). PHA which is produced by specific microorganism is a natural plastic seed (biopolymer). This biopolymer is one of solutions that can solve the problems of synthetic plastic because PHA is easy to degrade and its raw material is renewable.
One of bacteria which can produce PHA in its cells is Ralstonia eutropha. Cultivation process of R. eutropha with sago starch hydrolysate as substrate can produce PHA especially polyhidroxybutyrate (PHB) which has the characteristic like polypropylene (PP). Biomass of R. eutropha can be produced up to 4.04 g/l with PHA content of PHA 25-40% from the biomass. PHA is rigid and brittle. Plasticizer is added to improve this characteristic. Plasticizer which is used is diethylene glycol (DEG). Bioplastic was made by dissolving PHA in chloroform and then added with DEG at concentration 0% (control), 10%, 20%, 30% and 40%. Bioplastic with concentration DEG 0%, 10%, 20% and 30% can form a sheet of bioplastic, but concentration of more than 40% can not. Effect of DEG which is added can be evaluated by tensile strength test, elongation test, thermal characterization, degree of crystalinity, functional group and density.
Tensile strength of 0%, 10%, 20%, and 30% DEG are 0.12 ± 0.09 MPa; 0.11 ± 0.09 MPa; 0.07 ± 0.02 MPa; 0.03 ± 0.03 MPa, respectively. It shows that the addition of DEG decreases the tensile strength of bioplastic sheet. Elongation of 0%, 10%, 20%, and 30% DEG are 7.00 ± 3.44%; 6.46 ± 2.96%; 7.01 ± 0.59% dan 3.41 ± 3.30%, respectively. Bioplastic sheet with 20% DEG has the best elongation because it has the highest point and more plastic. With this mechanical characteristic, it is decided that bioplastic with 20% DEG is the best bioplastic sheet in this research. Bioplastic were then characterized for melting point, degree of crystalinity, and functional group.
Melting point of control is 168.72oC and bioplastic sheet 20% DEG is 167.51oC. The addition of plasticizer decreases the melting point of bioplastic sheet. Degree of crystalinity also decreases when bioplastic sheet is added with DEG. Crystalline degree of control is 50.52% and bioplastic 20% DEG is 31.45%.
KAJIAN PENGARUH PENAMBAHAN DIETILEN GLIKOL SEBAGAI PEMLASTIS PADA KARAKTERISTIK BIOPLASTIK
DARI POLI-β-HIDROKSIALKANOAT (PHA) YANG DIHASILKAN
Ralstronia eutropha PADA SUBSTRAT HIDROLISAT PATI SAGU
SKRIPSI
Sebagai salah satu syarat untuk memperoleh gelar
SARJANA TEKNOLOGI PERTANIAN Pada Departemen Teknologi Industri Pertanian
Fakultas Teknologi Pertanian
Institut Pertanian Bogor
Oleh Vico Delvia
F34102030
2006
FAKULTAS TEKNOLOGI PERTANIAN INSTITUT PERTANIAN BOGOR
INSTITUT PERTANIAN BOGOR FAKULTAS TEKNOLOGI PERTANIAN
KAJIAN PENGARUH PENAMBAHAN DIETILEN GLIKOL SEBAGAI PEMLASTIS PADA KARAKTERISTIK BIOPLASTIK
DARI POLI-β-HIDROKSIALKANOAT (PHA) YANG DIHASILKAN
Ralstronia eutropha PADA SUBSTRAT HIDROLISAT PATI SAGU
SKRIPSI
Sebagai salah satu syarat untuk memperoleh gelar
SARJANA TEKNOLOGI PERTANIAN Pada Departemen Teknologi Industri Pertanian
Fakultas Teknologi Pertanian
Institut Pertanian Bogor
Oleh Vico Delvia
F34102030
Dilahirkan pada tanggal 30 Maret 1985
Di Jambi
Tanggal Lulus: 18 Oktober 2006
Menyetujui,
Bogor, 31 Oktober 2006
RIWAYAT HIDUP
Vico Delvia dilahirkan di Jambi, 30 Maret 1985. Penulis merupakan anak pertama dari dua bersaudara, putri dari
pasangan Abdul Manan dan Nursiah. Penulis menyelesaikan
sekolah dasar di SD Negeri 95/IV pada tahun 1996 dan
melanjutkan ke SLTP Negeri 17 Jambi pada tahun yang sama.
Tahun 1999, Penulis menyelesaikan masa belajarnya di SLTP
dan melanjutkan ke SMU Negeri 1 Jambi (1999-2002). Pada tahun 2002, Penulis
diterima di Institut Pertanian Bogor melalui jalur USMI. Penulis masuk di
Departemen Teknologi Industri Pertanian, Fakultas Teknologi Pertanian, Institut
Pertanian Bogor.
Selama masa kuliah, Penulis aktif dalam berbagai organisasi dan kegiatan
di Universitas. Penulis bergabung dalam kepengurusan Himpunan Mahasiswa
Teknologi Industri (HIMALOGIN) sejak tahun 2003 dan memprioritaskan diri
pada bidang Public Relations HIMALOGIN. Pada tahun yang sama, Penulis bergabung sebagai anggota Paduan Suara FATETA serta menjadi Asisten
Praktikum di Departemen TIN. Penulis menyelesaikan masa kuliah di IPB pada
DAFTAR ISI
Halaman
KATA PENGANTAR ... iii
DAFTAR ISI ... v
DAFTAR TABEL... vii
DAFTAR GAMBAR ... viii
DAFTAR LAMPIRAN... ix
I. PENDAHULUAN ... 1
A. LATAR BELAKANG ... 1
B. TUJUAN ... 3
II. TINJAUAN PUSTAKA ... 4
A. POLIHIDROKSIALKANOAT... 4
B. Ralstronia eutropha... 6
C. HIDROLISAT PATI SAGU ... 9
D. PELARUT KLOROFORM ... 10
E. PEMLASTIS DIETILEN GLIKOL... 12
F. PROSES KULTIVASI PHA ... 13
G. PROSES HILIR PHA ... 16
H. PEMBUATAN LEMBARAN BIOPLASTIK ... 17
I. KARAKTERISTIK BIOPLASTIK ... 18
III.BAHAN DAN METODE ... 22
A. BAHAN DAN ALAT ... 22
1. Bahan ... 22
2. Alat ... 22
B. TAHAPAN PENELITIAN ... 23
1. Persiapan Bahan Baku Bioplastik ... 23
a. Persiapan Substrat ... 23
b. Produksi PHA secara Fed Batch ... 25
c. Proses Hilir PHA ... 26
2. Pembuatan Lembaran Bioplastik ... 27
C. ANALISIS DATA ... 28
IV.HASIL DAN PEMBAHASAN ... 29
A. PERSIAPAN BAHAN BAKU BIOPLASTIK ... 29
1. Persiapan Substrat ... 29
2. Produksi PHA secara Fed Batch... 29
3. Proses Hilir PHA ... 30
B. PEMBUATAN LEMBARAN BIOPLASTIK ... 33
C. KARAKTERISASI BIOPLASTIK... 36
1. Kuat Tarik dan Perpanjangan Putus ... 37
2. Sifat Termal ... 41
3. Derajat Kristalinitas ... 44
4. Gugus Fungsi ... 45
5. Densitas ... 48
V. KESIMPULAN DAN SARAN ... 50
DAFTAR PUSTAKA ... 52
DAFTAR TABEL
Halaman
Tabel 1. Kelarutan PHB pada berbagai pelarut... 11
Tabel 2. Komposisi media propagasi dan media fermentasi... 24
Tabel 3. Formulasi bahan dalam pembuatan lembaran bioplastik ... 34
Tabel 4. Perbandingan sifat fisik dan kimia PP, PHB, PHA dan lembaran bioplastik (DEG 20%) ... 37
DAFTAR GAMBAR
Halaman
Gambar 1. Struktur molekul PHA... 5
Gambar 2. Struktur molekul dietilen glikol ... 13
Gambar 3. Bioreaktor kapasitas 15 liter... 26
Gambar 4. PHA kering hasil ekstraksi dengan NaOCl ... 31
Gambar 5. PHA hasil ekstraksi dengan kloroform ... 33
Gambar 6. Reaksi polimer-pelarut dan reaksi penambahan pemlastis ... 34
Gambar 7. Lembaran bioplastik dengan konsentrasi DEG 10-40% ... 35
Gambar 8. Ilustrasi struktur kimia polimer PHA dengan penambahan pemlastis DEG... 36
Gambar 9. Grafik hubungan konsentrasi DEG dan kuat tarik ... 39
Gambar 10. Grafik hubungan konsentrasi DEG dan perpanjangan putus ... 39
Gambar 11. Ilustrasi proses uji kuat tarik dan perpanjangan putus ... 41
Gambar 12. Spectra DSC ... 42
Gambar 13. Spectra FTIR ... 46
DAFTAR LAMPIRAN
Halaman
Lampiran 1. Diagram alir pembuatan hidrolisat pati sagu secara
enzimatis... 60
Lampiran 2. Diagram alir kultivasi PHA ... 61
Lampiran 3. Diagram alir proses hilir ... 62
Lampiran 4. Diagram alir proses pembuatan lembaran bioplastik ... 64
Lampiran 5. Prosedur analisis karakter lembaran bioplastik ... 65
Lampiran 6. Prosedur analisis total gula dengan metode fenol-sulfat ... 68
Lampiran 7. Contoh penghitungan selama proses penelitian... 69
Lampiran 8. Hasil pengujian kuat tarik dan perpanjangan putus ... 71
I. PENDAHULUAN
A. LATAR BELAKANG
Plastik merupakan salah satu produk yang banyak dimanfaatkan oleh
masyarakat. Penggunaan plastik dilakukan secara besar-besaran sebagai bahan
kemasan, produk rumah tangga hingga peralatan kantor dan fasilitas umum.
Plastik yang biasa digunakan saat ini adalah plastik sintetis berbasis
petrokimia yang sangat sulit diuraikan secara hayati ketika dibuang ke
lingkungan.
Limbah plastik tergolong sampah yang tidak mudah didegradasi
(dihancurkan) oleh mikroorganisme sehingga berpeluang “abadi” mengendap
di tanah. Limbah sampah plastik menjadi masalah serius yang dihadapi dunia,
tidak hanya pada negara-negara maju tetapi juga negara berkembang seperti
Indonesia. Menurut Indonesia Plastic Industries, kebutuhan plastik dari 220
juta penduduk Indonesia pada tahun 2003 mencapai sekitar 1,35 juta ton
sedangkan kemampuan pengolahan sampah oleh pemerintah hanya sekitar
20-30% saja (Anonima, 2006). Proses pengolahan yang dilakukan pemerintah pun
hanya sebatas penimbunan di area landfill. Peningkatan kesadaran masyarakat akan pentingnya kelestarian lingkungan, peranan dan kebijakan pemerintah
yang mendukung penggunaan bioplastik serta sumber substrat yang mudah
diperoleh di Indonesia akan mendukung pemanfaatan bioplastik yang
merupakan alternatif untuk memecahkan masalah penanganan limbah sampah
plastik. Selain itu, berdasarkan Laporan Biro Pusat Statistik (Badan Pusat
Statistik, 1999) mengenai proyeksi kebutuhan bioplastik diketahui bahwa
perkembangan industri bioplastik dimasa datang akan mampu menjadi industri
besar.
Salah satu sumber bahan baku bioplastik yang sudah banyak diteliti
adalah Polihidroksialkanoat (PHA). PHA yang terkandung didalam sel
mikroorganisme jenis tertentu merupakan bijih plastik alami (biopolimer).
Biopolimer ini adalah cadangan makanan bagi mikroorganisme yang apabila
sumber yang terbaharui digunakan sebagai bahan baku bioplastik karena dapat
didegradasi secara sempurna ketika dibuang ke lingkungan. PHA dapat
berfungsi sebagai plastik karena memiliki sifat-sifat seperti termoplastik atau
elastomer yang tergantung dari monomer penyusunnya. PHA memiliki
kekuatan dan kekerasan yang baik, resisten terhadap kelembaban dan
memiliki permeabilitas O2 yang sangat rendah (Van Wegen et al., 1998). Poli-β-hidroksibutirat (PHB) adalah homopolimer dari β
-hidroksibutirat yang merupakan anggota dari PHA. Polimer PHB memiliki
struktur yang mirip poli propilena (Lee, 1996). Bakteri yang dapat
memproduksi PHB di dalam sel adalah Burkholderia cepacia (Pseudomonas cepacia), Ralstonia eutropa (Alcaligenes eutrophus), Azotobacter beijerinckii, Bradyrhizobium japonicum dan beberapa spesies Rhizobium (Anderson dan Dawes, 1990).
Bidang aplikasi PHA sangat luas, namun produksi PHA masih terbatas
karena harganya yang mahal. Setiap kilogramnya dibutuhkan dana sekitar US
$16-17, sementara plastik konvensional hanya membutuhkan dana sebesar US
$1 sehingga perlu dilakukan berbagai upaya penelitian untuk menurunkan
biaya produksi PHA, salah satunya dengan penggunaan hidrolisat pati sagu
(Anonima, 2006). Potensi sagu di Indonesia sangat besar, Papua dan Maluku
memiliki hutan sagu seluas 1,25 juta hektar (ha), 148 ribu ha lahan sagu
semibudidaya di kepulauan Riau, Mentawai, Sumatera, Kalimantan, Sulawesi,
Maluku, dan Papua. Lahan sagu ini terbesar di dunia. Berdasarkan catatan
BPPT, produksi sagu saat ini mencapai 200 ribu ton per tahun, namun baru
56% saja yang dimanfaatkan dengan baik (Humas, 2006). Melihat peluang
tersebut, maka penggunaan hidrolisat pati sagu diharapkan mampu menjadi
substrat yang murah dan terbaharukan.
Untuk menghasilkan lembaran bioplastik, PHA murni perlu
ditambahkan dengan bahan-bahan tambahan seperti pemlastis, penstabil,
pewarna, anti shock dan antistatik untuk mendapatkan hasil akhir bioplastik
yang diinginkan. Saat pembuatan lembaran bioplastik, dibutuhkan suatu
pelarut untuk melarutkan PHA sehingga mempermudah proses pembuatannya.
memiliki kemampuan yang sangat baik untuk melarutkan PHA (Atkinson dan
Mavituna, 1991). Sifat rapuh dan kaku dari PHA dapat diperbaiki dengan
penambahan pemlastis dietilen glikol (DEG) yang merupakan salah satu
pemlastis yang banyak digunakan oleh industri.
Zahra (2003) telah melakukan penelitian mengenai pengaruh
penambahan dietilen glikol (DEG) terhadap karakteristik bioplastik dari PHA
dengan menggunakan substrat kultivasi berupa hidrolisat minyak sawit. PHA
yang dihasilkan memiliki derajat kristalinitas yang rendah yaitu 2,88%. Hal ini
disebabkan oleh metode pembuatan bioplastik yang dilakukan tanpa
pemanasan.
Proses pembuatan bioplastik pada penelitian ini dilakukan dengan cara
pencampuran PHA dan pelarut kloroform. Kloroform berfungsi untuk
melarutkan bahan polimer padat sehingga memudahkan pengolahan dalam
proses selanjutnya. Larutan PHA-kloroform kemudian dicampurkan dengan
pemlastis dietilen glikol agar dihasilkan suatu lembaran bioplastik yang
plastis. Proses pencampuran yang dilakukan pada penelitian ini menggunakan
suhu dan perbandingan tertentu.
B. TUJUAN
Tujuan penelitian ini adalah untuk merancang proses pembuatan
lembaran bioplastik dan mendapatkan informasi mengenai pengaruh
konsentrasi pemlastis dietilen glikol (DEG) terhadap karakteristik lembaran
bioplastik yang dihasilkan serta mengetahui konsentrasi DEG terbaik dalam
pembuatan lembaran bioplastik berbahan dasar Poli-β-hidroksialkanoat
II. TINJAUAN PUSTAKA
A. POLIHIDROKSIALKANOAT (PHA)
Poli-β-hidroksialkanoat (PHA) merupakan salah satu famili poliester
termoplastis bermolekul besar yang terbentuk secara alami atau melalui cara
bioteknologi khusus (Utz et al, 1991). Menurut Choi dan Lee (1999), polyhydroxyalkanoates (PHA) merupakan cadangan karbon intraseluler dan energi yang terakumulasi dalam sel bakteri serta terbentuk pada kondisi
pertumbuhan yang tidak seimbang. Kelompok poliester PHA terdiri dari poly-β-hydroxybutyrate (PHB), poly-β-hydroxyvalerate (PHV), poly-β -hydroxycaproate (PHC), poly-β-hydroxyheptanoate (PHH), poly-β
-hydroxyoctanoate (PHO), poly-β-hydroxynonanoat (PHN), poly-β -hydroxydecanoate (PHD), poly-β-hydroxyundecanoate (PHUD), dan poly-β -hydroxydodecanoate (PHDD) (Atkinson dan Mavituna, 1991).
PHB adalah homopolimer dari β-hidroksibutirat yang merupakan
anggota dari polihidroksialkanoat (PHA) dan digunakan sebagai sumber
energi dan cadangan karbon yang disintesis dan diakumulasikan secara
intraseluler oleh beberapa mikroorganisme pada saat nutrisi esensial seperti
nitrogen, fosfor, oksigen, sulfur terbatas namun dilain pihak sumber karbon
berlebih (Anderson dan Dawes, 1990; Lee, 1996). PHB yang merupakan
cadangan makanan bagi bakteri terbentuk sebagai granular-granular di dalam
sel. Pasokan yang tidak memadai akan membuat sel-sel mendepolimerisasi
cadangan makanan menghasilkan asam β-hidroksibutirat yang bersifat dapat
larut dan mudah dicerna (Bailey dan Ollis, 1991).
Ukuran diameter granula PHB berkisar antara 100 nm sampai 800 nm,
dan biasanya berbentuk seperti bola. PHB yang telah diisolasi memiliki
komposisi kira-kira 98% PHB dan 2% protein. PHB memiliki densitas
1,171-1,260 g/cm3, melting point antara 157-188oC, dekomposisi secara cepat dapat terjadi diatas suhu 283oC. Densitas yang lebih rendah menunjukkan densitas
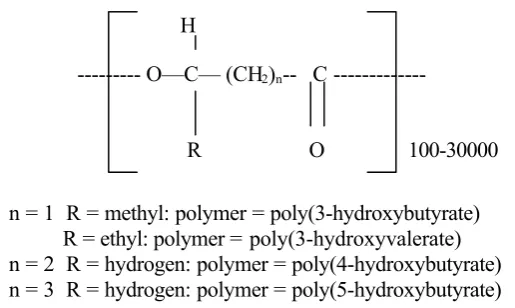
(Lafferty et al. di dalam Rehm dan Reid, 1988). Berikut adalah gambar struktur molekul PHA menurut Randall et al. (2001):
H
--- O—C— (CH2)n-- C ---
R O 100-30000
n = 1 R = methyl: polymer = poly(3-hydroxybutyrate) R = ethyl: polymer = poly(3-hydroxyvalerate) n = 2 R = hydrogen: polymer = poly(4-hydroxybutyrate) n = 3 R = hydrogen: polymer = poly(5-hydroxybutyrate)
Gambar 1. Struktur Molekul PHA (Randall et al, 2001)
Sifat dan kelebihan dari PHB adalah berbentuk kristalin, tahan panas,
dapat diproduksi dari sumber yang dapat diperbaharui, tidak beracun, tingkat
polimerisasinya tinggi dan tidak larut dalam air (Herawati, 2001). Menurut
Lee (1996), polimer PHB dapat diuraikan secara hayati sehingga dapat
dimanfaatkan sebagai pembawa bahan aktif pada obat-obatan, bahan sekali
pakai, benang bedah dan pembalut luka.
Menurut Poirer et al. (1995), PHB sering dibandingkan dengan polipropilen (PP) karena sifat fisiknya yang sama, namun PHB lebih rapuh
dengan rasio elastisitas PHB hampir dua kali lebih rendah dibandingkan
dengan PP. Meskipun PHB bersifat rapuh dan lebih sensitif terhadap pelarut
dibandingkan poliester komersial, tetapi PHB memiliki daya tahan yang lebih
besar terhadap radiasi sinar UV dan bersifat dapat didegradasi (Crueger dan
Crueger, 1984).
Aplikasi PHA difokuskan pada 3 hal yaitu kesehatan dan farmasi,
pertanian, dan kemasan produk (Lafferty et al. di dalam Rehm dan Reid, 1988; Lee, 1996). PHB dapat dikembangkan dalam berbagai bidang seperti bidang
medis sebagai benang jahit pada operasi bedah, pembalut luka, pemasangan
pembuluh darah, pemasangan tulang dan lempeng tulang, stimulasi
pembawa bahan aktif pada obat-obatan. Bidang industri, PHB dapat
digunakan sebagai pembawa bahan aktif pada herbisida, fungisida, insektisida
atau pupuk, kemasan kontainer, botol, pembungkus, kantong, dan film serta
bahan-bahan sekali pakai seperti popok bayi dan pembalut wanita (Brandl et
al. di dalam Babel dan Steinbuchel, 2001).
B. Ralstonia eutropha
Mikroorganisme dapat mensintesa PHA sekitar 30-80% dari bobot
kering selnya. Jenis mikroba yang mampu mensintesa PHA ini berjumlah
sekitar 300 jenis, namun hanya sejumlah bakteri termasuk Ralstonia eutropha,
Alcaligenes latus, Azotobacter venelandii, Chromobacterium violaceum, metilotrof, pseudomonad, dan rekombinan E. Coli yang prospektif digunakan dalam komersialisasi produksi PHA karena produktifitasnya lebih besar dari 2
g/l/jam (Lee, 1996; Lee dan Choi di dalam Babel dan Steinbuchel, 2001).
Klem di dalam Robinson et al. (1999) menyatakan berdasarkan kajian sekuens dan hibridisasi 16S RNA, Alcaligenes eutrophus sekarang dikelompokkan ke dalam genus Ralstonia dengan nama baru Ralstonia eutropha. Ralstonia eutropha merupakan bakteri kemoautotrof fakultatif yang dapat mengakumulasi poli-β-hidroksialkanoat (PHA) sebagai cadangan energi
dalam kondisi kultur yang mengandung sedikit mineral atau oksigen. Genus
Ralstonia eutropha berbentuk batang, batang bulat atau bulat dengan diameter 0,5-1,0 mikrometer dan panjang 0,5-2,6 mikrometer. Ralstonia eutropha memiliki flagel berbentuk peritrichous dan bersifat aerob obligat (Ishizaki dan Tanaka, 1991). Bakteri ini dapat tumbuh di air dan tanah, bersifat saprofit,
inhibitor pada usus vertebrata, serta dapat diisolasi dari bahan klinis seperti
darah, urin, kotoran, cairan suntikan, luka, dan kadang-kadang menyebabkan
infeksi pada manusia (Breed et al., 1974).
Menurut Byrom (1992) setelah berdiskusi dengan industri penghasil
PHA yaitu ICI, diketahui bahwa pemilihan Ralstonia sp. oleh ICI dikarenakan
berpengaruh terhadap PHA yang dihasilkan, misalnya Alcaligenes eutrophus (Ralstonia eutropha) dapat memproduksi PHB (poli-β-hidroksibutirat) menggunakan glukosa dan memproduksi PHV (poli-β-hidroksivalerat) dengan
menggunakan glukosa dan asam propionat (Ayorinde et al.,1998).
Pertumbuhan pada bakteri dan mikroorganisme lain biasanya mengacu
pada perubahan di dalam hasil panen sel dan bukan perubahan individu
organisme. Penentuan populasi bakteri terhadap waktu tertentu dapat
dilakukan dengan cara memetakan logaritma jumlah sel terhadap waktu yang
kemudian biasa disebut daur pertumbuhan normal atau kurva pertumbuhan
(Pelczar dan Chan, 2005). Pada awal pertumbuhannya, bakteri Ralstonia eutropha berada pada kondisi yang kaya glukosa sebagai sumber karbon dan mengkonsumsinya hingga “gemuk” (Fiechter, 1990). Sumber karbon yang
dapat digunakan untuk pertumbuhannya adalah glukosa, fruktosa,
D-glukonat, asetat, adipat, dan itakonat (John et al., 1994). Bakteri tersebut tumbuh menggunakan sumber nitrogen sebagai nutrisi esensialnya secara
terbatas dan perlahan, sebagian besar sumber nitrogen digunakan untuk
memproduksi kopolimer PHB-HV (Fiechter, 1990).
R. eutropha memiliki operon tunggal yang mengandung 3 jenis gen yang diperlukan untuk sintesa PHB, yaitu phbA, phbB, dan phbC. PhbA (yaitu
ketothiolase) bergabung dengan 2 molekul asetil-KoA untuk menghasilkan
asetoasetil-KoA yang kemudian direduksi menjadi R-β-hidroksibutiril-KoA
oleh phbB (yaitu suatu reduktase asetosetil-CoA yang membutuhkan
NADPH). Molekul R-β-hidroksibutiril-KoA membentuk unit monomer PHB,
kemudian dipolimerisasi melalui ikatan ester oleh phbC (yaitu suatu PHB
sintetase). Pada lingkungan yang kaya, PHB secara enzimatis didegradasi
menjadi asetil-KoA yang masuk ke jalur primer metabolisme dan
dimineralisasi menjadi karbondioksida. Degradasi dimulai oleh depolimerase
yang dikode sebagai gen phbZ (Klem, 1999).
R. eutropha menghasilkan PHB pada kondisi terbatasnya nitrogen, oksigen, dan fosfor (Klem di dalam Robinson et al, 1999). Secara umum, suplai nutrien yang tidak seimbang, misalnya nitrogen atau oksigen, akan
jalur, misalnya PHB. Babel dan Steinbuchel, (2001) menyatakan jika nitrogen
(dalam bentuk ammonia) merupakan pembatas pertumbuhan maka potensi
penggunaan asetil-KoA dan NAD(P)H menjadi terbatas. NAD(P)H yang
dilepaskan tidak dapat dikonsumsi untuk sintesa reduktif, misalnya pada asam
amino, sehingga dapat menghambat enzim sitrat sintetase (yaitu enzim yang
mengkatalisis sumber karbon menjadi asetil-KoA). Hal ini menyebabkan
terhambatnya siklus TCA sehingga asetil-KoA menjadi tersedia untuk β
-ketothiolase dan dapat memasuki jalur sintesa PHB. Pembatasan oksigen
menyebabkan peningkatan rasio NADH2/NAD intraseluler sehingga
menghambat siklus TCA dan meningkatkan ketersediaan asetil-KoA
intraseluler. Hal ini kemudian akan meningkatkan laju sintesa PHB (Atkinson
dan Mavituna, 1991). Babel dan Steinbuchel, (2001) menyatakan bahwa fosfat
juga merupakan faktor pembatas, bakteri tidak dapat menghasilkan ATP
(dengan cara memfosforilasi ADP) sehingga 2/H/ tidak dapat mengalir dan
terakumulasi sedangkan asetil-KoA menjadi tersedia. Kedua substrat tersebut
kemudian diasimilasi dan dikumpulkan secara intraseluler sebagai PHB.
Ralstonia eutropha mampu mengakumulasi PHB selama fase stationer. Dalam keadaan ini NADH/NADPH yang diakumulasikan di dalam sel dapat
mengakibatkan hambatan arus balik (feed back repression) terhadap enzim siklus asam tri karboksilat (TCA) yaitu sitran sintase yang mengkatalisis
kondensasi asetil CoA dengan oksaloasetat, sehingga asetil CoA terakumulasi.
Akumulasi asetil CoA menginduksi asetil CoA asetil transferase untuk
memulai sintesis PHB (Page, 1989). Polimer PHB akan diuraikan kembali
menjadi asetil CoA apabila mikroba membutuhkan cadangan karbon. Reaksi
yang terjadi di dalam sel adalah reaksi dapat balik. Apabila PHB dibutuhkan
maka polimer ini akan dengan cepat terurai dengan bantuan enzim
depolimerase membantu membentuk asetil CoA yang selanjutnya akan
C. HIDROLISAT PATI SAGU
Sagu merupakan tumbuhan monokotil dari keluarga Palmae, genus Metroxylon dari ordo Spadiciflorae dan pati sagu merupakan hasil ekstraksi pati dari batang empulur tanaman sagu. Di Indonesia tanaman utama
penghasil pati sagu adalah Metroxylon yang tumbuh di lahan basah dan Arenga microcarpha (sagu baruk) yang tumbuh di lahan kering (Abner dan Miftahorrahman, 2002). Setiap batang sagu mengandung sekitar 200 kg sagu
sehingga setiap hektar tanaman sagu mampu memproduksi 20-25 ton per
hektar. Menurut Deputi Kepala Badan Pengkajian dan Penerapan Teknologi
(BPPT) Bidang Agroindustri dan Bioteknologi Wahono Sumaryono di dalam
Humas (2006), kadar pati kering dalam sagu mampu mencapai 25 ton per
hektar (ha) yakni jauh diatas kandungan pati beras yang hanya 6 ton per ha
dan pati jagung yang hanya 5,5 ton. Berdasarkan data Perhimpunan
Pendayagunaan Sagu Indonesia (PPSI), produksi sagu nasional saat ini (2006)
mencapai 200.000 ton per tahun atau baru mencapai sekitar 5 persen dari
potensi sagu nasional.
Pati merupakan homopolimer glukosa dengan ikatan α-glikosidik yang
terdiri dari dua fraksi yaitu amilosa dan amilopektin. Amilosa mempunyai
struktur rantai lurus dengan ikatan α-(1,4)-D-glukosa sedangkan amilopektin
selain mempunyai rantai lurus juga mempunyai cabang dengan ikatan α
-(1,6)-D-glukosa sebanyak 4-5% dari bobot total (Winarno, 1989).
Sirup glukosa (hidrolisat pati) adalah cairan jernih dan kental dengan
komponen utama glukosa dan diperoleh dari proses hidrolisa pati dengan cara
kimia atau enzimatik (Badan Standarisasi Nasional, 1992). Suspensi pati
dalam aquades untuk hidrolisis pati sagu secara enzimatis adalah 30%
(Akyuni, 2003). Menurut Hebeda dalam Nagodawithana dan Reed (1993),
konsentrasi pati yang terlalu tinggi dapat menyebabkan proses gelatinisasi
berlangsung tidak sempurna. Konsentrasi pati yang tinggi juga dapat
mempersulit proses difusi enzim dalam substrat dan pengadukan.
Penepatan pH suspensi pati sebelum proses likuifikasi dilakukan
berdasarkan kestabilan enzim α-amilase yang menurut Olsen dalam Kearsley
6,0. Namun pH yang tinggi akan menghasilkan produk sampingan berupa
maltulosa dan hidrolisat pati sagu yang dihasilkan akan berwarna lebih gelap
(coklat).
Konversi pati secara enzimatis terdiri dari dua tahap, yaitu likuifikasi
dan sakarifikasi. Likuifikasi terjadi setelah gelatinisasi dengan adanya aktifitas
enzim α-amilase yang memecah ikatan α-1,4 di bagian dalam rantai
polisakarida secara acak menghasilkan glukosa, maltosa, maltodekstrin, dan α
-limit dekstrin dalam waktu sekitar 60 menit. Sakarifikasi dengan enzim
amiloglukosidase (AMG) akan mengubah maltodekstrin menjadi glukosa dan
memakan waktu yang lebih lama yaitu 24-96 jam (Fullbrook di dalam
Dzieldzic dan Kearsley, 1984).
Menurut Akyuni (2003) enzim α-amilase ini bekerja optimum pada
suhu 90oC dan masih bekerja aktif sampai suhu 110oC. Waktu proses
likuifikasi adalah selama 210 menit karena pada waktu tersebut mulai
dihasilkan nilai gula pereduksi yang konstan. PH hasil proses likuifikasi
ditepatkan menjadi 4-4,5 sebelum dilanjutkan ke proses sakarifikasi
menggunakan enzim amiloglukosodase (AMG). Proses sakarifikasi dilakukan
pada suhu 60oC selama 48 jam karena pada waktu tersebut nilai ekuivalen
dekstrosa sudah mencapai nilai tertinggi.
D. PELARUT KLOROFORM
Penggunaan pelarut (solvent) pada saat proses pembuatan plastik dimaksudkan untuk melarutkan bahan polimer padat sehingga memudahkan
pengolahan dalam proses selanjutnya. Pengklasifikasian jenis pelarut
didasarkan pada tingkat penguapan, struktur kimia, dan kekuatan pelarut
(Frados, 1959).
Poli-β-hidroksialkanoat (PHA) dapat larut pada berbagai pelarut
seperti kloroform, metilen klorida, etilen klorida, piridin atau campuran
diklorometan/etanol (Atkinson dan Mavituna, 1991). Van Wegen et al. (1998) menyatakan bahwa dengan metode pelarutan PHA seperti ekstraksi
metode tersebut memerlukan sejumlah besar pelarut yang mudah menguap,
bersifat toksik terhadap lingkungan dan meningkatkan total biaya produksi.
Kloroform (CHCl3) memiliki sifat tidak mudah terbakar, sangat mudah
menguap, memiliki rasa yang manis dan bau yang khas. Kloroform dapat
digunakan sebagai pelarut untuk lemak, minyak, karet, alkaloid, lilin, gutta
percha, resin dan sebagai cleansing agent. Kloroform berbahaya bila dihirup pada dosis tinggi karena dapat menyebabkan hipotensi, gangguan pernafasan
dan miokardial dan bahkan kematian (Merck, 1999).
Kloroform mendidih pada suhu 61,7oC. Kloroform larut dengan mudah
pada etanol dan eter tetapi tidak dapat bercampur dengan air. Kloroform
dihasilkan dengan mereaksikan klorin dengan etanol dan dengan mereduksi
karbon tetraklorida (CCl4). Kloroform dahulu dimanfaatkan sebagai obat bius
saat proses pembedahan namun saat ini sudah digantikan dengan bahan yang
lebih tidak beracun, obat bius yang lebih aman yaitu eter. Secara kimia,
kloroform digunakan sebagai pelarut lemak, alkaloid, iodin dan bahan lainnya.
Ketika kloroform terbuka di udara dan terkena sinar matahari maka kloroform
akan berubah menjadi gas yang beracun (Anonimb, 2006).
Tabel 1. Kelarutan PHB pada berbagai pelarut* (Bogensberger, 1985 di dalam Lafferty et al.,1988)
Kelarutan Tinggi Kloroform
Diklorometan
Di-, tri-, tetra-kloroetan Dikloroasetat
Etilenkarbonat Propilenkarbonat Trifluoroetanol Asetik anhidrid
1 N sodium hidroksida
Dimetilformamid Ethilaseto asetat Triolein
Asam asetik
Alkohol (> 3 atom C) Kelarutan Sedang Dioksan Oktanol Toluene Piridin Tidak Larut
H2O Metanol Etanol 1-propanol 2-propanol Sikloheksanol Karbontetraklorida Alkaline hidriklorit Dietilether Benzen Heksan Sikloheksanon Etil asetat Etilmetilketon Butil asetat Tributil sitrat
Menurut Lee (1996), 20 bagian pelarut digunakan untuk melarutkan 1
bagian polimer karena kekentalan larutan PHA tinggi sehingga diperlukan
jumlah pelarut yang besar. Pengaruh kelarutan pada PHB dapat diamati secara
efektif pada lapisan endapan yang terbentuk dari gel hasil pelarutan dengan
temperatur yang semakin menurun. Suhu ekstraksi yang tinggi memungkinkan
terdegradasinya molekul PHB tersebut. Penelitian degradasi akibat panas telah
dilakukan (Grassie et al. di dalam Rehm dan Reid, 1984), yaitu pada suhu
lebih dari 338oC dan kondisi vakum, PHB akan mengalami degradasi menjadi
dimer, trimer, tetramer, iso-clotonic acid dan clotonic acid.
E. PEMLASTIS DIETILEN GLIKOL
Cuq et al. (1997) mendefinisikan pemlastis sebagai molekul kecil yang tidak mudah menguap serupa dengan polimer pembentuk film. Penambahan
pemlastis pada saat proses pembuatan lembaran plastik dimaksudkan untuk
memperbaiki sifat plastik. Penambahan pemlastis pada bahan polimer
mengakibatkan terjadinya modifikasi pada susunan tiga dimensi molekul,
menurunkan gaya tarik intramolekul, meningkatkan mobilitas rantai dan
menurunkan Tg (glass transition temperature) bahan amorf. Ditambahkan oleh Cowd (1991), bahwa penurunan Tg tersebut dikarenakan pengurangan
gaya antar-rantai sehingga gerakan bagian rantai lebih mudah.
Perbedaan utama antara pemlastis dengan pelarut adalah kemampuan
penguapan kedua bahan tersebut. Pelarut lebih mudah menguap sedangkan
pemlastis tidak mudah menguap. Persyaratan ideal yang harus dimiliki suatu
pemlastis meliputi kecocokan (compatibilitas), permanen atau tidaknya pemlastis tersebut berada dalam polimer, dan efisiensi penggunaannya.
Pemlastis umumnya memiliki sifat-sifat tidak berbau, tidak berasa, tidak
beracun dan tidak mudah terbakar (Beeler dan Finney di dalam Modern
Plastics Encyclopedia, 1958).
Menurut Frados (1959) terdapat beberapa metode penambahan
pencampuran tanpa pemanasan. Pada penelitian ini, metoda penambahan
pemlastis dilakukan dengan cara hot mixing.
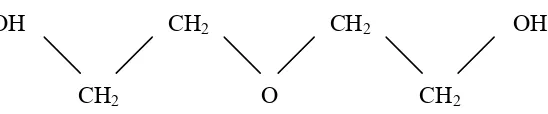
Dietilen glikol (HO-CH2-CH2-O-CH2-CH2-OH) merupakan senyawa
yang tidak berwarna, hampir tidak berbau, dan higroskopis dengan titik didih
244-245oC. Dietilen glikol dapat bercampur dengan air, alkohol, eter, aseton,
etilen glikol dan tidak dapat bercampur dengan karbon tetraklorida, benzene
[image:35.595.202.476.381.438.2]dan toluen (Merck, 1999). Struktur molekul dietilen glikol dapat dilihat pada
Gambar 2.
Menurut Bandrup et al. (1999), kelarutan pemlastis dalam polimer diperkirakan dari perbandingan nilai δ polimer dan δ yang ditambahkan. Nilai
δ merupakan nilai yang menunjukkan kuat tarik antar molekul suatu bahan. Perbedaan parameter kelarutan yang kecil (δ polimer – δ pemlastis/pelarut)
menunjukkan kelarutan yang baik.
OH CH2 CH2 OH
CH2 O CH2
Gambar 2. Struktur Molekul Dietilen Glikol (Merck, 1999).
F. PROSES KULTIVASI PHA
Dua macam media yang secara umum digunakan pada bioreaktor
adalah media buatan yang mengandung sumber karbon seperti glukosa,
fruktosa dan karbohidrat lainnya, serta CO2.(NH4)2SO4 atau amonia sebagai
sumber nitrogen. Beberapa komposisi lain seperti phospor, magnesium,
kalsium juga dibutuhkan oleh mikroorganisme (Anonim, 1999). Media
propagasi dan fermentasi mengandung berbagai komposisi yang dibutuhkan
untuk pertumbuhan R. eutropha, salah satunya adalah hidrolisat pati sagu yang merupakan sumber karbon (C) bagi R. eutropha. Kebutuhan hidrolisat pati sagu pada media adalah 30 gram per liter (Atifah, 2006).
Rasio C:N dalam biosintesis PHB sangat berpengaruh. Rasio C:N yang
Rehm dan Reid, 1988). Menurut Suryani et al. (2001) perbandingan sumber karbon (C) dan sumber nitrogen (N) 10 : 1 mampu menghasilkan rendemen
PHA oleh R. eutropha yang tertinggi. Chakroborty et al. (2004) juga melaporkan bahwa pada rasio C : N adalah 10 : 1, R. eutropha menunjukkan laju pertumbuhan spesifik dan pertumbuhan sel yang optimum bila
dibandingkan dengan rasio 5 : 1 atau 15 : 1.
Pada bioreaktor, mikroorganisme tumbuh pada kondisi yang
terkendali. Sistem biologis sangat sensitif terhadap perubahan kondisi
lingkungan, suhu, pH, konsentrasi oksigen terlarut pada proses aerob dan
parameter-parameter lain yang harus dikontrol secara hati-hati dan tepat
(Anonim, 1999).
Menurut Anonim (1999), proses produksi PHA baik secara batch, semi-batch maupun continue diketahui mampu bekerja memproduksi PHA. Namun menurut Atifah (2006), perlakuan pengumpanan pada fermentasi fed-batch berpengaruh signifikan terhadap peningkatan konsentrasi PHA dan rendemen PHA dalam sel, tetapi tidak berpengaruh terhadap peningkatan
konsentrasi sel dibandingkan dengan fermentasi secara batch. Menurut Atifah (2006), bahan yang diumpankan pada proses kultivasi adalah hidrolisat pati
sagu karena pengumpanan dengan hidrolisat pati sagu pada awal fase stationer
merupakan perlakuan terbaik untuk menghasilkan konsentrasi sel dan
konsentrasi PHA tertinggi.
Disampaikan juga oleh Atifah (2006) bahwa pertumbuhan R. eutropha pada hidrolisat pati sagu mengalami fase pertumbuhan secara logaritmik
sampai jam ke-24 kemudian melambat dan memasuki fase stationer mulai jam
ke-48. Pada jam ke-48 dilakukan pengumpanan hidrolisat pati sagu karena
diperkirakan bahwa sumber karbon yang terdapat di dalam cairan kultivasi
mulai habis sedangkan kondisi bakteri untuk dapat memproduksi PHA adalah
pada keadaan sumber karbon yang tersedia berlebih sedangkan sumber lain
seperti nitrogen sangat terbatas.
Proses pengumpanan dilakukan untuk menjaga konsentrasi sumber
karbon tetap berada pada rentang yang optimal bagi akumulasi PHA (Lee dan
umum sumber karbon yang diumpankan pada awal fase stasioner tidak banyak
digunakan untuk memperbanyak sel. Substrat dikonsumsi tidak hanya untuk
memenuhi kebutuhan karbon, energi dan komponen struktural untuk
pertumbuhan sel, namun juga digunakan untuk pemeliharaan viabilitas sel
seperti mekanisme perbaikan sel, proses transpor substrat, pemeliharaan
membran, dan pembentukan produk PHA. Dengan perlakuan pengumpanan,
sel mengalami fase stasioner yang panjang. Sampai akhir fermentasi, sel
belum masuk pada fase penurunan yaitu laju kematian lebih besar
dibandingkan laju pertumbuhan. Sel cenderung survive dengan adanya PHA di dalam sel yang berfungsi sebagai cadangan karbon/energi.
Menurut Zahra (2003), terjadi kecenderungan penurunan pH selama
kultivasi R. eutropha akibat terjadinya pembentukan asam sebagai hasil metabolisme R. eutropha. Mekanisme penurunan pH akibat penambahan amoniak (Wang et al., 1978) yaitu amoniak yang dalam keadaan terdisosiasi (NH4+) akan mengalami penggabungan dengan mikroorganisme membentuk
R-NH3 dan selanjutnya melepaskan ion H+ ke dalam kultur. PH optimum
untuk pertumbuhan bakteri umumnya adalah 6,5-7,5 sehingga jika pH
dibawah 5,0 atau diatas 8,5 akan menyebabkan pertumbuhan bakteri menjadi
tidak baik (Fardiaz, 1987).
Kim et al. (1994) menyatakan bahwa biomassa yang dihasilkan dari kultivasi R. eutropha yang dihasilkannya adalah 164 g/l dan PHB yang dihasilkan 121 g/l atau produktivitas polimer mencapai 2,42 g/l/jam. Nilai ini
merupakan nilai yang paling tinggi yang pernah dilaporkan untuk produksi
PHA dengan cara fermentasi. Sugiarti (2003) telah menghasilkan total
biomassa sebesar 4,45 g/l sedangkan Ayorinde et al. (1998) hanya menghasilkan biomassa sebesar 0,15-0,28 g/l. Menurut Lafferty et al. dalam Rehm dan Reed (1988), akumulasi PHA dapat ditingkatkan dengan membuat
kondisi pertumbuhan yang tidak seimbang misalnya ketika nutrisi seperti
nitrogen phospor atau sulfat dibatasi, ketika konsentrasi oksigen rendah atau
G. PROSES HILIR PHA
Menurut Doi (1990) dan Lee (1996), ada beberapa metode yang telah
banyak digunakan untuk memperoleh PHA. Metode itu antara lain ekstraksi
pelarut, proses digest dengan sodium hipoklorit dan proses digest secara enzimatis. Menurut Lafferty et al. dalam Rehm dan Reed (1988), proses pemisahan biomassa yang mengandung PHA biasa dilakukan dengan cara
sentrifugasi atau flokulasi dan sentrifugasi, kemudian tahap selanjutnya adalah
pemisahan PHB/PHAs dari biomassa.
Metoda ekstraksi pelarut dapat diaplikasikan pada berbagai
mikroorganisme penghasil PHA, walaupun jumlah pelarut yang dibutuhkan
besar karena larutan PHA memiliki kekentalan yang sangat tinggi (Randall et al, 2001). Menurut Lee (1996), PHA dapat larut kedalam pelarut seperti kloroform, metil klorida atau 1,2-dikloroetana. Ketiga pelarut ini dapat
digunakan untuk mengekstrak PHA dari biomassa bakteri. PHA memiliki
kelarutan yang tinggi dalam kloroform (Laffarty et al. dalam Rehm dan Reed, 1988). Doi (1990) menjelaskan metoda ekstraksi dengan kloroform. PHA di
ekstrak dengan kloroform panas dalam sebuah soxhlet apparatus selama 1
jam. Kemudian, PHA yang telah diekstrak dipisahkan dari lemak dengan
menggunakan dietil eter, heksan, methanol atau etanol. Tahap terakhir, PHA
dilarutkan kembali ke dalam kloroform dan kemudian dimurnikan dengan
heksan. Lain halnya dengan Randall et al. (2001) yang melakukan ekstraksi PHA dengan cara menambahkan 50 ml kloroform kedalam biomassa kering
dan diaduk dengan menggunakan stirer pada suhu 50oC selama 24 jam. Senior
et al. (1982) menyatakan bahwa sel kering diekstraksi dengan pelarut pada suhu diatas 40oC dan bobot pelarut saat proses ekstraksi adalah 10-100 kali
dari bobot kering sel.
Metoda digest menggunakan hipoklorit mampu memisahkan sebagian besar materi sel non-PHA selama proses. Hal ini mengakibatkan terpisahnya
PHA dari sel. Namun konsentrasi hipoklorit yang tinggi mampu mendegradasi
PHA. Proses degradasi PHA oleh hipoklorit akan meningkat seiring dengan
H. PEMBUATAN LEMBARAN BIOPLASTIK
Menurut Ramsay et al. (1993), terdapat dua macam cara pembuatan film PHB. Solvent-cast film dibuat dengan cara menuangkan larutan kloroform-PHB 5% (b/v) pada sebuah plat kaca atau teflon. Pelarut kemudian
dievaporasi dan film yang terbentuk dibiarkan selama dua minggu pada suhu
ruang untuk mencapai keseimbangan kristalinitas. Lafferty et al. di dalam Rehm dan Reid, (1998) menjelaskan bahwa derajat kristalisasi PHB sangat
dipengaruhi oleh penyiapan bahan PHB tersebut. Jika lelehan sampel PHB
(dipanaskan sampai 160oC) didinginkan secara lambat (24 jam) sampai
suhunya mencapai suhu ruang, kristalinitas PHB yang terbentuk dapat
mencapai 86%. Sampel amorf PHB dapat diperoleh dengan cara melakukan
pendinginan lelehan PHB secara cepat ke suhu ruang. Heat-pressed film dibuat dengan cara menuangkan larutan 25% PHB (b/v) pada plat kaca, lalu
dikeringkan semalam pada suhu ruang dan kemudian ditempatkan diantara
dua lembar lempeng cetakan yang dibungkus aluminium foil. PHB dalam
cetakan lalu di-press pada suhu 155-160oC pada tekanan 5000 lb/in2 selama satu menit.
Menurut Latief (2001), kemampuan suatu bahan dasar dalam
pembentukan film dapat diterangkan melalui fenomena fase transisi kaca.
Pada fase tertentu diantara fasa cair dengan padat, massa dapat dicetak atau
dibentuk menjadi suatu bentuk tertentu pada suhu dan kondisi lingkungan
yang tertentu. Fase transisi kaca biasanya terjadi pada bahan berupa polimer.
Suhu saat fase transisi kaca terjadi disebut sebagai titik fase kaca (glassy
point). Pada suhu tersebut bahan padat dapat dicetak menjadi suatu bentuk yang dikehendaki, misalnya bentuk lembaran tipis (film) kemasan.
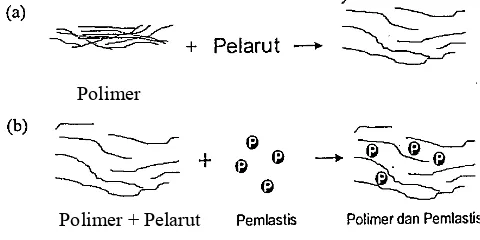
Spink dan Waychoff di dalam Modern Plastic Encyclopedia (1958) menjelaskan teori mengenai reaksi yang terjadi antara pemlastis dan suatu
polimer. Pemlastis yang ditambahkan pada suatu bahan polimer resin akan
tersisip secara fisika di antara rantai-rantai polimer tersebut. Penambahan
pemlastis dapat mengakibatkan terbentuknya ‘ikatan yang hilang’. Ikatan baru
yang terbentuk biasanya ikatan jembatan hidrogen antara polimer resin dan
Encyclopedia, 1958). Ikatan hidrogen merupakan sejenis interaksi elektrostatis diantara molekul yang hidrogennya terikat pada atom elektronegatif (F, N, O).
Ikatan tersebut terjadi akibat adanya gaya tarik-menarik elektron dari atom
elektronegatif. Kekuatan ikatan hidrogen kira-kira sepersepuluh ikatan
kovalen normal. Meskipun demikian, ikatan hidrogen mempengaruhi sifat
fisik (Sukardjo, 1985).
I. KARAKTERISTIK BIOPLASTIK
Keberhasilan suatu proses pembuatan film kemasan plastik
biodegradabel dapat dilihat dari karakteristik film yang dihasilkan.
Karakteristik film yang dapat diuji adalah karakteristik mekanik,
permeabilitas dan nilai biodegradabilitasnya (Latief, 2001).
Kuat tarik adalah tegangan regangan maksimum yang dapat diterima
sampel (Surdia dan Saito, 1995). Kuat tarik dapat dipengaruhi oleh bahan
pemlastis yang ditambahkan dalam proses pembuatan film, sedangkan
perpanjangan putus adalah perubahan panjang maksimum yang dialami
plastik pada saat pengujian kuat tarik (Datsko, 1996).
Elastisitas akan menurun seiring dengan meningkatnya jumlah bahan
pemlastis dalam film. Elastisitas adalah sifat benda yang mengalami
perubahan bentuk atau deformasi secara tidak permanen (Dede, 2006). Benda
dapat dikatakan elastis sempurna artinya jika gaya penyebab perubahan
bentuk hilang maka benda akan kembali ke bentuk semula. Banyak benda
yang bersifat elastis sempurna yaitu mempunyai batas-batas deformasi yang
disebut limit elastis sehingga jika melebihi dari limit elastik maka benda tidak
akan kembali ke bentuk semula. Sifat yang lain adalah sifat plastis atau sifat
tidak elastis dan perubahan cenderung tidak kembali ke bentuk semula,
misalnya lilin. Perbedaan antara sifat elastis dan plastis adalah pada tingkatan
dalam besar atau kecilnya deformasi yang terjadi (Dede, 2006).
Permeabilitas suatu film kemasan adalah kemampuan film melewatkan
tertentu. Nilai permeabilitas sangat dipengaruhi oleh faktor-faktor sifat kimia
polimer, struktur dasar polimer, dan sifat komponen permeant (Latief, 2001). Titik leleh (Tm) adalah suhu pada saat rantai polimer berada dalam
daerah berkristal polimer terpisah, sehingga memungkinkan polimer untuk
mengalir (meleleh). Penentuan titik leleh dilakukan dengan menggunakan
DSC (Differential Scanning Calorymetry) (Cowd, 1991). Pada DSC terdapat dua wadah kecil berbahan logam, satu diisikan sampel polimer dan yang
lainnya dengan bahan kontrol. Masing-masing wadah berisi sampel dan bahan
kontrol dipanaskan dan suhu tiap wadah dimonitor oleh sensor panas. Jika
sampel secara tiba-tiba menyerap panas selama proses transisi, perubahan
akan dideteksi oleh sensor. Perubahan ini akan menyebabkan mulai
dialirkannya arus panas yang lebih besar untuk mengganti kehilangan panas
yang terjadi. Jika perubahan ini dimonitor secara teliti, maka akan
menghasilkan ukuran suhu transisi (Allcock dan Lampe, 1981).
Aplikasi spektroskopi infra merah sangat luas baik untuk analisis
kualitatif maupun kuantitatif. Kegunaan yang paling penting adalah untuk
identifikasi senyawa organik karena spektrumnya sangat kompleks terdiri dari
banyak puncak-puncak. Spektrum infra merah dari senyawa organik
mempunyai sifat fisik yang khas, artinya kemungkinan dua senyawa
mempunyai spektrum sama adalah kecil sekali (Nur, 1989).
FTIR (Fourier Transform Infra Red Spectroscopy) digunakan untuk menganalisis gugus-gugus fungsi penyusun bioplastik. Dengan spektrum infra
merah tersebut akan dapat diketahui beberapa sifat dari suatu senyawa.
Menurut Nur (1989), teori spektoskopi absorpsi infra merah yakni senyawa
organik menyerap radiasi elektromagnetik pada daerah inframerah. Radiasi
inframerah tidak mempunyai energi yang cukup untuk mengeksitasi elektron
tapi dapat menyebabkan senyawa organik mengalami rotasi dan vibrasi.
Radiasi inframerah dengan frekuensi kurang dari 100 cm-1 atau dengan
panjang gelombang lebih dari 100 µm diserap oleh molekul organik dan dikonversi ke dalam energi rotasi molekul. Bila radiasi inframerah dengan
gelombang 1-100 µm diserap oleh molekul organik dan dikonversi ke dalam energi vibrasi molekul.
Semua molekul terdiri dari atom yang dihubungkan melalui ikatan
kimia. Atom-atom di dalam suatu molekul tidak diam melainkan bervibrasi
(bergetar) dengan frekuensi tertentu. Pergerakan internal pada sistem
meningkat jika ada energi (infra merah) melewatinya. Infra merah yang
dipancarkan pada suatu bahan akan mengakibatkan molekul-molekul bahan
menyerap energi pada bagian ikatannya sehingga sinar yang berhasil melewati
bagian tersebut akan berkurang intensitasnya. Persentase intensitas infra
merah yang diserap diplotkan dengan frekuensi sehingga diperoleh spektrum
infra merah (Kemp, 1979). Ditambahkan oleh Nur (1989), bahwa detektor
pada spektrofotometer infra merah merupakan alat yang dapat mengukur atau
mendeteksi energi radiasi akibat pengaruh panas. Signal yang dihasilkan dari
detektor kemudian direkam sebagai spektrum infra merah yang berbentuk
puncak-puncak absorpsi. Spektrum infra merah ini menunjukkan hubungan
antara absorbsi dan frekuensi atau bilangan gelombang atau panjang
gelombang. Sebagai absis adalah frekuensi (cm-1) atau bilangan gelombang
(cm-1) atau panjang gelombang (µm) dan sebagai ordinat adalah transmitant
atau absorbans.
Pengukuran derajat kristalinitas dilakukan dengan pendekatan hasil uji
DSC berdasarkan perubahan entalpi yang terjadi saat tercapai suhu pelelehan.
Menurut Hahn et al. (1995), PHA dengan derajat kristalinitas 100% akan mempunyai perubahan entalphi sebesar 146 J/g. Menurut Knapczyk dan
Simon di dalam Kent (1996), struktur molekul yang susunan keteraturannya
tinggi disebut kristalin. Daerah kristalin disebut kristalit yang berada pada
daerah matriks polimer. Struktur molekul yang susunannya tidak teratur
disebut amorf. Secara umum termoplastik yang kristalinnya tinggi, lebih
resistan terhadap pelarut dan meleleh lebih tajam pada suhu tinggi daripada
polimer amorf atau polimer yang kristalinnya rendah. Disisi lain, polimer
dengan kristalin tinggi mempunyai kekakuan yang tinggi, lebih banyak yang
Menurut Anonimc (2006), massa jenis (densitas) adalah pengukuran
massa setiap satuan volume benda. Semakin tinggi massa jenis suatu benda,
maka semakin besar pula massa setiap volumenya. Satuan SI massa jenis
adalah kg/m3, sedangkan satuan lainnya adalah g/cm3. Rumus untuk
menentukan massa jenis adalah:
Keterangan: ρ adalah massa jenis,
m adalah massa,
III.BAHAN DAN METODE
A. BAHAN DAN ALAT
1. Bahan
Bahan baku yang digunakan untuk pembuatan lembaran bioplastik
adalah poli-β-hidroksialkanoat terutama poli-β-hidroksibutirat (PHB) yang
merupakan hasil kultivasi aerob bakteri Ralstonia eutropha dengan substrat hidrolisat pati sagu. Proses kultivasi tersebut menggunakan strain bakteri Ralstonia eutropha IAM 12368 yang diperoleh dari IAM Culture Collection, Institute of Molecular and Celular Bioscience, The University
of Tokyo. Sumber karbon yang digunakan dalam substrat kultivasi adalah
hidrolisat pati sagu (Metroxylon sp) yang dipersiapkan melalui hidrolisis
enzimatis pati sagu dengan enzim α-amilase dan amiloglukosidase.
Bahan-bahan untuk kultivasi bakteri dan isolasi PHA adalah
nutrient broth, hidrolisat pati sagu, (NH4)2HPO4, K2HPO4, KH2PO4, MgSO4 0,1 M, larutan mikro elemen (FeSO4.7H2O, MnCl2.4H2O,
CoSO4.7H20, CaCl2.7H2O, CuCl2.2H2O, ZnSO4.7H2O), NaOH 0,2 M dan
4 M, H3PO4 1,33 M, antifoam, NaOCl dan methanol untuk proses hilir PHA serta kloroform yang berguna dalam pemurnian PHA. Pembuatan
lembaran bioplastik dilakukan dengan menggunakan pelarut kloroform
untuk melarutkan PHA dan dietilen glikol sebagai pemlastis.
2. Alat
Alat-alat yang digunakan untuk kultivasi PHA dan pembuatan
lembaran bioplastik adalah bioreaktor dengan volume kerja 10 liter,
sentrifuse, clean bench, hot plate, pendingin tegak, penyaring vakum, oven, waterbath shaker, termometer, neraca analitik, rotary shaking
Peralatan yang digunakan untuk karakterisasi lembaran bioplastik
adalah FTIR (Fourier Transform Infra-Red Spectrofotometer) untuk mengetahui gugus fungsi PHA dan lembaran bioplastik, DSC (Differential
Scanning Calorimetry) untuk mengetahui Tm (melting point) dan derajat kristalinitas PHA maupun lembaran bioplastik, dan Universal Testing
Machine (UTM) untuk mengetahui kuat tarik dan perpanjangan putus lembaran bioplastik.
B. TAHAPAN PENELITIAN
1. Persiapan Bahan Baku Bioplastik
Persiapan bahan baku bioplastik terdiri dari tiga tahap, yaitu
persiapan substrat, kultivasi Ralstonia eutropha, dan proses hilir PHA.
a. Persiapan Substrat
Tahap persiapan substrat meliputi proses pembuatan hidrolisat
pati sagu secara enzimatis serta persiapan kultur dan media fermentasi.
Proses pembuatan hidrolisat pati sagu dilakukan berdasarkan
penelitian dari Akyuni (2003) yang dimodifikasi dari Maiden (1970),
Fullbrook (1984) dan Subarna (1984). Proses pembuatan tersebut
dilakukan secara enzimatis yang terdiri dari dua tahap yaitu likuifikasi
dan sakarifikasi. Proses likuifikasi menggunakan enzim α-amilase dan
dilakukan pada suhu 90-95oC sedangkan proses sakarifikasi
menggunakan enzim amiliglikosidase. Diagram proses pembuatan
hidrolisat pati sagu dapat dilihat pada Lampiran 1.
Media propagasi dan fermentasi mengandung berbagai
komposisi yang dibutuhkan untuk pertumbuhan R. eutropha, salah satunya adalah hidrolisat pati sagu yang merupakan sumber karbon (C)
bagi R. eutropha. Kebutuhan hidrolisat pati sagu pada media adalah 30 gram per liter (Atifah, 2006) atau sekitar 9,608 ml untuk media
propagasi II setelah dikonversi dengan perhitungan yang dapat dilihat
Pemeliharaan kultur R. eutropha dilakukan dengan cara menyimpan kultur dalam bentuk kering-beku, selain itu juga dipelihara
dalam media cair nutrient broth pada suhu 4oC dan disegarkan setiap 2 minggu dengan kondisi inkubasi 34oC selama 24 jam untuk
pertumbuhan R. eutropha. Persiapan kultur dilakukan dengan menumbuhkan R. eutropha sebanyak 10% v/v ke dalam media propagasi I yang berupa nutrient broth (NB) steril (1 ml kultur
kedalam 9 ml NB). Nutrient broth adalah media pertumbuhan yang baik bagi bakteri sehingga R. eutropha yang merupakan bakteri gram negatif (Fardiaz, 1992) diharapkan dapat tumbuh dengan baik pula
pada media NB. Setelah propagasi I, kultur NB dikocok dalam
waterbath shaker dengan kondisi suhu 34oC dan agitasi 150 rpm selama 24 jam. Kondisi ini berdasarkan penelitian yang dilakukan
Atifah (2006).
Media fermentasi yang digunakan merupakan media E
(Ayorinde et al., 1998) yang dimodifikasi sehingga rasio C/N adalah 10 : 1 (Wicaksono, 2003), konsentrasi awal fosfat (K2HPO4) 5,8 g/l
(Atifah, 2006) dengan hidrolisat pati sagu sebagai sumber karbon,
(NH4)2HPO4 sebagai sumber nitrogen serta (NH4)2HPO4 dan KH2PO4
sebagai sumber fosfat. Sumber nitrogen (N) yang digunakan pada
kultivasi RE adalah (NH4)2HPO4. Perhitungan jumlah (NH4)2HPO4
yang dibutuhkan dapat dilihat pada lampiran 7.
Komposisi media propagasi dan media fermentasi (Atifah,
2006) dapat dilihat pada Tabel 2 berikut:
Media
Bahan Propagasi II
(90 ml)
Propagasi III (900 ml)
Fermentasi (9000 ml)
Sirup 9,608 ml 96,085 ml 960,854 ml
(NH4)2HPO4 0.566 gr 5.658 gr 56.577 gr
K2HPO4 0.522 gr 5.22 gr 52.2 gr
KH2PO4 0.342 gr 3.42 gr 34.2 gr
MgSO4 0.1 M 0.9 ml 9.0 ml 90 ml
Larutan mikroelemen (dalam g/l HCl 1 N) terdiri dari 2,78 g
FeSO4.7H2O, 1,98 g MnCl2.4H2O, 2,81 g CoSO4.7H20, 1,67 g
CaCl2.2H2O, 0,17 g CuCl2.2H2O, dan 0,29 g ZnSO4.7H2O. Hidrolisat
pati sagu ditepatkan pH-nya menjadi ±7 dengan NaOH 4 M sedangkan
media E modifikasi diset pH-nya menjadi ±7 dengan H3PO4 1,33 M.
Komposisi media fermentasi dapat dilihat pada Tabel 2. Pelarutan
masing-masing garam dalam aquades secara terpisah akan lebih mudah
terjadi bila dibandingkan dengan melarutkan seluruh garam secara
bersama-sama. Semua bahan untuk media fermentasi kecuali gula
kemudian dicampurkan secara merata. Penepatan volume media
dilakukan dengan penambahan aquades. PH campuran garam dan gula
kemudian ditepatkan menjadi 7 dengan menggunakan NaOH 4 M dan
H3PO4 1,33 M. Hidrolisat pati sagu dan media E modifikasi kemudian
disterilisasi pada wadah terpisah dengan suhu 121oC selama 15 menit
untuk menghindari reaksi pencoklatan. Selanjutnya media didinginkan
(30oC) dan siap digunakan sebagai media propagasi maupun media
fermentasi.
b. Produksi PHA secara Fed Batch
Produksi PHA dengan cara kultivasi secara fed batch dengan R. eutropha dilakukan pada