Lampiran 1. Data Pengamatan Persentase Eksplan Membentuk Tunas (%)
Perlakuan Ulangan Total Rataan
1 2 3 4 5 6
Lampiran 2. Data Transformasi Persentase Eksplan Membentuk Tunas
Arcsin √P
Perlakuan Ulangan Total Rataan
1 2 3 4 5 6
C1A1 5.74 5.74 0.41 0.41 0.41 5.74 18.43 3.07 C1A2 5.74 0.41 5.74 5.74 5.74 0.41 23.77 3.96 C1A3 0.41 5.74 0.41 5.74 5.74 0.41 18.43 3.07 C1A4 5.74 5.74 5.74 5.74 5.74 5.74 34.44 5.74 C1A5 5.74 5.74 5.74 5.74 5.74 0.41 29.10 4.85 C1A6 5.74 0.41 5.74 5.74 0.41 5.74 23.77 3.96 C2A1 0.41 0.41 0.41 5.74 0.41 5.74 13.10 2.18 C2A2 0.41 0.41 5.74 5.74 5.74 0.41 18.43 3.07 C2A3 5.74 5.74 0.41 0.41 5.74 0.41 18.43 3.07 C2A4 5.74 5.74 5.74 5.74 5.74 5.74 34.44 5.74 C2A5 5.74 0.41 0.41 5.74 0.41 5.74 18.43 3.07 C2A6 0.41 0.41 5.74 5.74 0.41 5.74 18.43 3.07 C3A1 0.41 0.41 0.41 0.41 0.41 0.41 2.43 0.41 C3A2 0.41 0.41 0.41 0.41 0.41 0.41 2.43 0.41 C3A3 0.41 0.41 0.41 0.41 0.41 0.41 2.43 0.41 C3A4 0.41 0.41 0.41 0.41 0.41 0.41 2.43 0.41 C3A5 0.41 0.41 0.41 0.41 0.41 0.41 2.43 0.41 C3A6 0.41 0.41 0.41 0.41 0.41 0.41 2.43 0.41
Total 49.96 39.30 44.63 60.63 44.63 44.63 283.79 Rataan 2.78 2.18 2.48 3.37 2.48 2.48 2.63
Lampiran 3. Data Sidik Ragam Persentase Eksplan Membentuk Tunas
SK dB JK KT F.Hit 0.05 Ket
Perlakuan
C 2 276.61 138.31 250.49 3.12 **
A 5 46.63 9.33 16.89 2.34 **
C*A (interaksi) 10 30.03 3.00 5.44 1.96 **
Galat 73 40.31 0.55
Total 107 746.86
FK= 745.694
Lampiran 4. Data Pengamatan Umur Muncul Tunas (hari)
Perlakuan Ulangan Total Rataan
1 2 3 4 5 6
Lampiran 5. Data Pengamatan Jumlah Tunas (tunas)
Perlakuan Ulangan Total Rataan
1 2 3 4 5 6
Lampiran 6. Data Transformasi Jumlah Tunas √x+0.5
Perlakuan Ulangan Total Rataan
1 2 3 4 5 6
C1A1 1.22 1.22 0.71 0.71 0.71 1.22 5.80 0.97 C1A2 1.22 0.71 1.22 1.22 1.22 0.71 6.31 1.05 C1A3 0.71 1.22 0.71 1.22 1.22 0.71 5.80 0.97 C1A4 1.22 1.22 1.22 1.22 1.22 1.22 7.35 1.22 C1A5 1.22 1.22 1.22 1.22 1.22 0.71 6.83 1.14 C1A6 1.22 0.71 1.22 1.22 0.71 1.22 6.31 1.05 C2A1 0.71 1.22 0.71 1.22 0.71 1.22 5.80 0.97 C2A2 1.22 0.71 1.22 1.22 1.22 0.71 6.31 1.05 C2A3 1.22 1.22 0.71 0.71 1.22 0.71 5.80 0.97 C2A4 1.22 1.22 1.22 1.22 1.22 1.22 7.35 1.22 C2A5 1.22 1.22 0.71 1.22 0.71 1.22 6.31 1.05 C2A6 1.22 0.71 1.22 1.22 0.71 1.22 6.31 1.05 C3A1 0.71 0.71 0.71 0.71 0.71 0.71 4.24 0.71 C3A2 0.71 0.71 0.71 0.71 0.71 0.71 4.24 0.71 C3A3 0.71 0.71 0.71 0.71 0.71 0.71 4.24 0.71 C3A4 0.71 0.71 0.71 0.71 0.71 0.71 4.24 0.71 C3A5 0.71 0.71 0.71 0.71 0.71 0.71 4.24 0.71 C3A6 0.71 0.71 0.71 0.71 0.71 0.71 4.24 0.71 Total 17.90 16.87 16.35 17.90 16.35 16.35 101.73 Rataan 0.99 0.94 0.91 0.99 0.91 0.91 0.94
Lampiran 7. Data Sidik Ragam Jumlah Tunas
SK dB JK KT F.Hit 0.05 Ket
Perlakuan
C 2 2.98 1.49 1754.92 3.12 **
A 5 0.37 0.07 87.02 2.34 **
C*A (interaksi) 10 0.20 0.02 23.94 1.96 **
Galat 73 0.06 0.00
Total 107 7.17
FK= 95.827
Lampiran 8. Data Pengamatan Panjang Tunas (cm)
Perlakuan Ulangan Total Rataan
1 2 3 4 5 6
C1A1 0.20 0.15 0.00 0.00 0.00 0.35 0.70 0.12 C1A2 2.40 0.00 2.30 0.85 0.25 0.00 5.80 0.97 C1A3 0.00 1.00 0.00 2.80 0.10 0.00 3.90 0.65 C1A4 0.35 1.50 1.20 0.50 0.90 1.70 6.15 1.03 C1A5 0.40 0.50 1.10 3.20 0.40 0.00 5.60 0.93 C1A6 0.20 0.00 0.15 0.25 0.00 0.35 0.95 0.16 C2A1 0.00 0.25 0.00 0.25 0.00 0.70 1.20 0.20 C2A2 0.40 0.00 0.30 0.70 1.30 0.00 2.70 0.45 C2A3 0.20 0.10 0.00 0.00 0.40 0.00 0.70 0.12 C2A4 1.60 1.30 1.30 1.20 0.80 1.00 7.20 1.20 C2A5 0.60 0.30 0.00 0.85 0.00 0.55 2.30 0.38 C2A6 0.30 0.00 0.70 0.25 0.00 0.30 1.55 0.26 C3A1 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 C3A2 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 C3A3 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 C3A4 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 C3A5 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 C3A6 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00
Lampiran 9. Data Transformasi Panjang Tunas √x+0.5
Perlakuan Ulangan Total Rataan
1 2 3 4 5 6
C1A1 0.84 0.81 0.71 0.71 0.71 0.92 4.69 0.78 C1A2 1.70 0.71 1.67 1.16 0.87 0.71 6.82 1.14 C1A3 0.71 1.22 0.71 1.82 0.77 0.71 5.94 0.99 C1A4 0.92 1.41 1.30 1.00 1.18 1.48 7.31 1.22 C1A5 0.95 1.00 1.26 1.92 0.95 0.71 6.79 1.13 C1A6 0.84 0.71 0.81 0.87 0.71 0.92 4.85 0.81 C2A1 0.71 0.87 0.71 0.87 0.71 1.10 4.95 0.82 C2A2 0.95 0.71 0.89 1.10 1.34 0.71 5.69 0.95 C2A3 0.84 0.77 0.71 0.71 0.95 0.71 4.68 0.78 C2A4 1.45 1.34 1.34 1.30 1.14 1.22 7.80 1.30 C2A5 1.05 0.89 0.71 1.16 0.71 1.02 5.54 0.92 C2A6 0.89 0.71 1.10 0.87 0.71 0.89 5.16 0.86 C3A1 0.71 0.71 0.71 0.71 0.71 0.71 4.24 0.71 C3A2 0.71 0.71 0.71 0.71 0.71 0.71 4.24 0.71 C3A3 0.71 0.71 0.71 0.71 0.71 0.71 4.24 0.71 C3A4 0.71 0.71 0.71 0.71 0.71 0.71 4.24 0.71 C3A5 0.71 0.71 0.71 0.71 0.71 0.71 4.24 0.71 C3A6 0.71 0.71 0.71 0.71 0.71 0.71 4.24 0.71 Total 16.08 15.39 16.16 17.72 14.98 15.34 95.68 Rataan 0.89 0.86 0.90 0.98 0.83 0.85 0.89
Lampiran 10. Data Sidik Ragam Panjang Tunas
SK dB JK KT F.Hit 0.05 Ket
Perlakuan
C 2 1.82 0.91 274.83 3.12 **
A 5 1.16 0.23 70.50 2.34 **
C*A (interaksi) 10 0.89 0.09 27.03 1.96 **
Galat 73 0.24 0.00
Total 107 7.99
FK= 84.758
Lampiran 11. Data Pengamatan Persentase Eksplan Membentuk Daun (%)
Perlakuan Ulangan Total Rataan
1 2 3 4 5 6
C1A1 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 C1A2 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 C1A3 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 C1A4 0.00 100.00 0.00 0.00 0.00 100.00 200.00 33.33 C1A5 0.00 0.00 0.00 0.00 0.00 100.00 100.00 16.67 C1A6 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 C2A1 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 C2A2 0.00 0.00 100.00 0.00 0.00 0.00 100.00 16.67 C2A3 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 C2A4 100.00 0.00 100.00 100.00 100.00 0.00 400.00 66.67 C2A5 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 C2A6 0.00 0.00 100.00 0.00 0.00 0.00 100.00 16.67 C3A1 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 C3A2 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 C3A3 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 C3A4 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 C3A5 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 C3A6 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00
Lampiran 12. Data Transformasi Persentase Eksplan Membentuk Daun
Arcsin √P
Perlakuan Ulangan Total Rataan
1 2 3 4 5 6
C1A1 0.41 0.41 0.41 0.41 0.41 0.41 2.43 0.41 C1A2 0.41 0.41 0.41 0.41 0.41 0.41 2.43 0.41 C1A3 0.41 0.41 0.41 0.41 0.41 0.41 2.43 0.41 C1A4 0.41 5.74 0.41 0.41 0.41 5.74 13.10 2.18 C1A5 0.41 0.41 0.41 0.41 0.41 5.74 7.76 1.29 C1A6 0.41 0.41 0.41 0.41 0.41 0.41 2.43 0.41 C2A1 0.41 0.41 0.41 0.41 0.41 0.41 2.43 0.41 C2A2 0.41 0.41 5.74 0.41 0.41 0.41 7.76 1.29 C2A3 0.41 0.41 0.41 0.41 0.41 0.41 2.43 0.41 C2A4 5.74 0.41 5.74 5.74 5.74 0.41 23.77 3.96 C2A5 0.41 0.41 0.41 0.41 0.41 0.41 2.43 0.41 C2A6 0.41 0.41 5.74 0.41 0.41 0.41 7.76 1.29 C3A1 0.41 0.41 0.41 0.41 0.41 0.41 2.43 0.41 C3A2 0.41 0.41 0.41 0.41 0.41 0.41 2.43 0.41 C3A3 0.41 0.41 0.41 0.41 0.41 0.41 2.43 0.41 C3A4 0.41 0.41 0.41 0.41 0.41 0.41 2.43 0.41 C3A5 0.41 0.41 0.41 0.41 0.41 0.41 2.43 0.41 C3A6 0.41 0.41 0.41 0.41 0.41 0.41 2.43 0.41 Total 12.63 12.63 23.29 12.63 12.63 17.96 91.76 Rataan 0.70 0.70 1.29 0.70 0.70 1.00 0.85
Lampiran 13. Data Sidik Ragam Persentase Eksplan Membentuk Daun
SK dB JK KT F.Hit 0.05 Ket
Perlakuan
C 2 0.01 0.01 8.76 3.12 **
A 5 0.04 0.01 9.93 2.34 **
C*A (interaksi) 10 0.03 0.00 4.09 1.96 **
Galat 73 0.06 0.00
Total 107 0.23
FK= 18.972
Lampiran 14. Data Pengamatan Jumlah Daun (helai)
Perlakuan Ulangan Total Rataan
1 2 3 4 5 6
C1A1 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 C1A2 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 C1A3 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 C1A4 0.00 2.00 0.00 0.00 0.00 4.00 6.00 1.00 C1A5 0.00 0.00 0.00 0.00 0.00 1.00 1.00 0.17 C1A6 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 C2A1 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 C2A2 0.00 0.00 1.00 0.00 0.00 0.00 1.00 0.17 C2A3 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 C2A4 3.00 0.00 4.00 4.00 3.00 0.00 14.00 2.33 C2A5 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 C2A6 0.00 0.00 4.00 0.00 0.00 0.00 4.00 0.67 C3A1 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 C3A2 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 C3A3 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 C3A4 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 C3A5 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 C3A6 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00
Lampiran 15. Data Transformasi Jumlah Daun √x+0.5
Perlakuan Ulangan Total Rataan
1 2 3 4 5 6
C1A1 0.71 0.71 0.71 0.71 0.71 0.71 4.24 0.71 C1A2 0.71 0.71 0.71 0.71 0.71 0.71 4.24 0.71 C1A3 0.71 0.71 0.71 0.71 0.71 0.71 4.24 0.71 C1A4 0.71 1.58 0.71 0.71 0.71 2.12 6.53 1.09 C1A5 0.71 0.71 0.71 0.71 0.71 1.22 4.76 0.79 C1A6 0.71 0.71 0.71 0.71 0.71 0.71 4.24 0.71 C2A1 0.71 0.71 0.71 0.71 0.71 0.71 4.24 0.71 C2A2 0.71 0.71 1.22 0.71 0.71 0.71 4.76 0.79 C2A3 0.71 0.71 0.71 0.71 0.71 0.71 4.24 0.71 C2A4 1.87 0.71 2.12 2.12 1.87 0.71 9.40 1.57 C2A5 0.71 0.71 0.71 0.71 0.71 0.71 4.24 0.71 C2A6 0.71 0.71 2.12 0.71 0.71 0.71 5.66 0.94 C3A1 0.71 0.71 0.71 0.71 0.71 0.71 4.24 0.71 C3A2 0.71 0.71 0.71 0.71 0.71 0.71 4.24 0.71 C3A3 0.71 0.71 0.71 0.71 0.71 0.71 4.24 0.71 C3A4 0.71 0.71 0.71 0.71 0.71 0.71 4.24 0.71 C3A5 0.71 0.71 0.71 0.71 0.71 0.71 4.24 0.71 C3A6 0.71 0.71 0.71 0.71 0.71 0.71 4.24 0.71 Total 13.89 13.60 16.07 14.14 13.89 14.66 86.26 Rataan 0.77 0.76 0.89 0.79 0.77 0.81 0.80
Lampiran 16. Data Sidik Ragam Jumlah Daun
SK dB JK KT F.Hit 0.05 Ket
Perlakuan
C 2 14.23 7.11 8.76 3.12 **
A 5 40.31 8.06 9.93 2.34 **
C*A (interaksi) 10 33.19 3.32 4.09 1.96 **
Galat 73 59.27 0.81
Total 107 234.73
FK= 77.965
Lampiran 17. Komposisi Media Murashige dan Skoog (MS)
(Sumber : Murashige and Skoog, 1962).
Bahan Kimia Konsentrasi Media (mg/l)
Makro Nutrien (Stok I)
NH4 NO3 1650,000
KNO3 CaCl2.2H2O MgSO4.7H2O
1900,000 440,000 370,000
KH2PO4 170,000
Mikro Nutrien (Stok II) MnSO4.H2O
ZnSO4.7H2O H3BO3
6,900 8,600 6,200
KI 0,830
Na2MoO4.2H20 0,250
CuSO4.5H2O 0,025
CoCl2.6H2O Iron (Stok III)
0,025
FeSO4.7H2O 27,800
Na2.EDTA 37,200
Vitamin (Stok IV)
Nikotinic acid 0,500
Pyridoxin HCL 0,500
Thiamine HCL 0,100
Myo-inositol 100,000
Sukrosa Agar
Lampiran 18. Komposisi Media Woody Plant Medium (WPM)
Bahan Kimia Konsentrasi Media (mg/l)
Makro Nutrien (Stok I)
NH4 NO3 400,000
MgSO4.7H2O 370,000
KH2PO4 CaCl2.2H2O Ca(NO3)2.4H2O
170,000 96,000 576,000 K2SO4
Mikro Nutrien (Stok II) H3BO3
99,000
6,200
MnSO4.H2O 16,900
ZnSO4.7H2O 8,600
Na2MoO4.2H20 0,250
CuSO4.5H2O Iron (Stok III)
0,250
FeSO4.7H2O 27,800
Na2.EDTA 37,300
Vitamin (Stok IV)
Nikotinic acid 0,500
Pyridoxin HCL 0,500
Thiamine HCL 1,000
Myo-inositol 100,000
Sukrosa Agar
Lampiran 19. Bagan Penelitian
C1A3 C1A1 C1A2 C1A4 C1A3 C1A5
C1A4 C1A6 C1A5 C1A6 C1A6 C1A4
C1A6 C1A6 C1A3 C1A5 C1A2 C1A2
C1A1 C1A1 C1A5 C1A4 C1A3 C1A2
C1A6 C1A2 C1A4 C1A2 C1A1 C1A3
C1A3 C1A5 C1A1 C1A5 C1A4 C1A1
C2A5 C2A3 C2A6 C2A2 C2A1 C2A4
C2A4 C2A6 C2A2 C2A4 C2A3 C2A2
C2A1 C2A1 C2A1 C2A6 C2A5 C2A5
C2A2 C2A4 C2A5 C2A2 C2A1 C2A3
C2A6 C2A5 C2A3 C2A3 C2A2 C2A4
C2A3 C2A1 C2A6 C2A4 C2A3 C2A5
C3A6 C3A4 C3A3 C3A6 C3A2 C3A6
C3A4 C3A1 C3A2 C3A5 C3A5 C3A4
C3A3 C3A5 C3A2 C3A6 C3A3 C3A1
C3A1 C3A3 C3A5 C3A6 C3A2 C3A5
C3A4 C3A6 C3A1 C3A2 C3A1 C3A1
Lampiran 18. Foto Penelitian
C1A1 C1A2 C1A3
C2A1 C2A2 C2A3
C3A1 C3A2 C3A3
DAFTAR PUSTAKA
Abbas, B.S. dan S. Ginting. 1981. Influence of Rootstock and Scion on Girth Increment in Rubber Trees. Buletin Balai Penelitian Perkebunan Medan 12, 145-152.
Abo, M.M. 1977. Organogensis and Embryogenesis in Callus Culture of Garlic (Allium sativum L). Plant Sci. Letter. 9:259-264.
Altman, A. and B. Loberant,. 1998. Micropropagation: clonal plant propagation in vitro, page 19-34. In: A. Altman (Ed.) Agricultural Biotechnology. Marcel Dekker Inc, New York.
Armini, A.N. M., Wattimena dan Gunawan L.W. 1992. Zat Pengatur Tumbuh. Hal 150-200. Dalam: Tim Laboratorium Kultur Jaringan Tanaman (Eds.). Bioteknologi Tanaman 1. Pusat Antar Universitas. Insitut Pertanian Bogor, Bogor.
Bhojwani S.S., 1980. In Vitro Propagation of Garlic (Allium sativum L) by Shoot Poliferation. Scientia. Horticulture. 13:47-52.
Budiman, H., 2012. Budidaya Karet Unggul Prospek Jitu Investasi Masa Depan. Pustaka Baru Press, Yogyakarta.
Chaerudin, TS, Supriatun, T & Bavadal, A, 1996, Multiplikasi Tunas Tanaman Mentha arvenis Melalui Kultur Jaringan, Fakultas MIPA Universitas Padjajaran.
Djumat, J. L. 2014. Multiplikasi In Vitro Samama (Anthocephalus macrophyllus (ROBX). HAVIL) Melalui Tunas Pucuk Dan Tunas Aksilar. Fakultas Kehutanan UNIDAR, Ambon.
Fereol, L., Chovelon, V., Causse, S., Michaux-Ferriere, N., and Kahane R., 2002. Evidence of Somatic Embryogenesis Process for Plant Regeneration in Garlic (Allium sativum L). Plant Cell Reports. 21: 197-203.
Fitriani, H. 2008. Kajian Konsentrasi BAP Dan NAA Terhadap Multiplikasi Tanaman Artemisia annua L. Secara In Vitro. Fakultas Pertanian Universitas Sebelas Maret.
Gardner, F.P., Pearce, R. B., and Mitchell, R.L., 1991. Physiology of Crop Plants. Diterjemahkan oleh H.Susilo. Universitas Indonesia Press, Jakarta. George, E. F., dan P. D. Sherrington. 1984. Plant Propagation by Tissue Culture.
Gunawan L. W., 1987. Teknik Kultur Jaringan Tumbuhan. Laboratorium Kultur Jaringan Tanaman. PAU Bioteknologi IPB. Bogor.
____________., 1988. Teknik Kultur Jaringan Tumbuhan. Laboratorium Kultur Jaringan PAU Bioteknologi. Institut Pertanian Bogor, Bogor.
____________., 1992. Teknik Kultur Jaringan Tumbuhan. Laboratorium Kultur Jaringan PAU Bioteknologi. Institut Pertanian Bogor, Bogor.
Harahap, P. S., Luthfi. A. M. Siregar, dan Y. Husni. 2014. Kajian Awal : Respon Eksplan Nodus dalam Inisiasi Tunas Mikro Tanaman Karet (Hevea brasiliensis Muell Arg.) dalam Medium MS. Jurnal Online Agroekoteknologi. Vol.3(1) : 229 – 237.
Haris, N., Sumaryono, dan M.P. Carron., 2009. Pengaruh Bahan pra-sterilan, Tutup Tabung Kultur, dan Terhadap Tingkat Kontaminasi Eksplan pada Kultur Microcutting Karet. Menara Perkebunan, 2009 77(2), Hal 89-99. Haris, N., 2013. Batang Bawah Klonal : Apakah Mungkin pada Tanaman Karet?.
www.ibriec.org, juli 2013 1(1), Hal. 20-24.
Haryanto, B., 1991. Kultur In Vitro Gladiol. Prosiding Seminar Tanaman Hias. Sub Balai Penelitian Hortikultura Cipanas. Balai Penelitian Hotrikultura, Lembang. hlm. 101-104.
Hendaryono, D. P. S., dan Ari W., 1994. Teknik Kultur Jaringan, Pengenalan dan Petunjuk Perbanyakan Secara Vegetatip. Kanisius, Yogyakarta. Jaringan Tanaman. Avery Publishing Group, Inc. Wayne – NewJersey.
Jayasree, K., Asokan, M.P., Sobha, S. L., Sankari, Ammal, K.R., Kala R.G., Jayasree, R and Thulaseedharan A. Somatic embryogenesis and plant regeneration from immature anthers of Hevea brasiliensis (Muell.) Arg. http://rubberresearch.or.id/insitute-of-india.
Jumroh, P.H. 2013. Pengaruh Periode Subkultur Terhadap Mikropropagasi Puar Tenangau (Elettariopsis sp.).Fakultas Pertanian. Universitas Sumatera Utara, Medan.
Kurilcik, A., Dapkuniene, S., Kurilcik, G., Zilinskaite, S., Zukauskas, A., P. Duchovskis. 2008. Effect Of The Photoperiod Duration On The Growth Of Chrysanthemum Plantlets In Vitro. Scientific Works Of The Lithuanian Institute Of Horticulture And Lithuanian University Of Agriculture. 27(2). Kusuma, L.A., 2010. Jurnal Kultur Jaringan Tanaman Jarak Pagar. Universitas
Kyte, L. 1983. Plant from Test Tubes: An Introduction to Micropropagation. Portland, Oregon : Timber Press.
Manurung, S. O. 1995. Penggunaan Hormon dan Zat Pengatur Tumbuh pada Kedelai. Balai Penelitian dan Pengembangan Pertanian. Pusat Penelitian dan Pengembangan Tanaman Pangan, Bogor.
Mariska, I., dan Ragapadmi, P. 2001. Perbanyakan Vegetatif Tanaman Tahunan Melalui Kultur In Vitro. J. Litbang Pertanian. 20 (1).
Mariska, I dan D. Sukmadjaja. 2003. Perbanyakan Bibit Abaka Melalui Kultur Jaringan. Balai Penelitian Bioteknologi Dan Sumberdaya Genetik Pertanian.
Montoro, P., M.P. Carron, Francoise G., Ludovic L., dan Julie L., 2012. Development of New Varietal Types Based on Rejuvenation by Somatic Embryogenesis and Propagation by Conventional Budding or Microcutting in Hevea brasilienasis.
Nugroho, P.S. 2010. Karakterisasi Biologi Isolat-Isolat Rigidoporus microporus Pada Tanaman Karet (Hevea brasiliensis) Asal Cilacap. Fakultas Pertanian Universitas Sebelas Maret, Surakarta.
Nursetiadi, E. 2008. Kajian Macam Media dan Konsentrasi BAP terhadap
Multifikasi Tanaman Manggis ( Garcinia mangostana L.) Secara Invitro. Universitas Sebelas Maret, Surakarta. Hal 11-12
Pierik, R. L. M., 1997. In Vitro Culture of Hinger Plant. Martinus Nijhoft Publisher. Netherlands.
Purwanto, A. 2008. Kajian Macam Eksplan Dan Konsentrasi Iba Terhadap Multiplikasi TanamanManggis (Garcinia mangostana L.) Secara in vitro. Fakultas Pertanian Universitas Sebelas Maret.
Salisbury, F. B., C. W. Ross. 1992. Plant Physiology. 4th edition. Belmont, California : Wadsworth Publishing Company.
Santoso, U. dan F. Nursandi., 2001. Kultur Jaringan Tanaman. Penerbit UMM, Malang.
Satria, B., Hamda, F., dan Kasli., 1999. Induksi Kalus Manggis (Garcinia mangostana L.) Melalui Kultur In Vitro. Jurnal Stigma Volume VII No. 1. Universitas Andalas, Padang.
Sianturi, H. S. D., 2001. Budidaya Tanaman Karet. Fakultas Pertanian USU. Medan.
Steenis, C. G. G. K., 2005. Flora. PT. Pradnya Paramita, Jakarta.
Sumardi. 1996. Penggunaan arang aktif pada beberapa kombinasi NAA dan BAP dalam kultur durian (Durio zibethinus Muur.) secara In vitro. Tesis S2 Program pascasarjana. Universitas Andalas, Padang. 76 hal
Sumaryono, Masna, M.S., dan Nurahaimi, H., 2012. Daya Hidup Planlet Karet Asal in vitro Microcutting pada Berbagai Periode Penutupan Sungkup Plastik dan Komposisi Media Tumbuh. Menara Perkebunan, 2012 80 (1), Hal. 25-31. Balai Penelitian Bioteknologi Perkebunan Indonesia. Bogor. Sundari, L., Luthfi. A. M. Siregar, dan D. S. Hanafiah. 2014. Kajian Awal :
Respon Eksplan Nodus dalam Inisiasi Tunas Mikro Tanaman Karet (Hevea brasiliensis Muell Arg.) dalam Medium WPM. Jurnal Online Agroekoteknologi. Vol.3(1) : 179-189.
Wereing, P.F. and Philips, I.D.J. 1981. Growth and Differentiation In Plant. Pergamon Press 3rd. Ed.
Wattimena, G. A. 1991. Zat Pengatur Tumbuh Tanaman. Pusat Antar Universitas IPB, Bogor.
Wattimena, G.A; L. W. Gunawan; N. A. Mattjik; Endang. S; N. M. A. Wiendi dan Andri. E. 1992. Bioteknologi Tanaman. Penerjemah Ahmad Sukarti Abidin. Pusat Antar Universitas Bioteknologi IPB: Bogor.
Wetherell, D. F. 1982. Pengantar Propagasi Tanaman secara In Vitro Seri Kultur Widiastoety, D. 1987. Penggunaan teknik kultur In vitro untuk perbanyakan
tanaman. Bahan latihan dan diskusi penelitian buah-buahan Malang. Pusat penelitian dan pengembangan hortikultura balai penelitian hortikultura Lembang, Malang. 1-28 hal.
Widyastuti, N. 1998. Pengaruh Intensitas Cahaya terhadap Multiplikasi Kultur Secara In Vitro. Prosiding Seminar Nasional Penerapan Teknologi Kendali dan Instrumentasi pada Pertanian. Badan Pengkajian dan Penerapan Teknologi, Jakarta.
Wulandari, S., Wan, S., dan Yossilia. 2004. Respon Eksplan Daun Tanaman Jeruk Manis (Citrus sinensis L.) Secara In Vitro Akibat Pemberiaan NAA dan BA. Jurnal Biogensis Vol. 1
BAHAN DAN METODE Tempat dan Waktu Penelitian
Penelitian ini dilaksanakan di Laboratorium Microcutting Tanaman Karet PT. Perkebunan Nusantara III Kebun Gunung Pamela Tebing Tinggi, Sumatera
Utara, Indonesia. Penelitian ini dimulai pada bulan Maret 2015 sampai dengan Juli 2015.
Bahan dan Alat Penelitian
Bahan eksplan yang digunakan dalam penelitian ini adalah bonggol (stock) yang memiliki satu mata tunas dari hasil primary culture tanaman karet dengan genotipe 91 yang merupakan koleksi dari PTPN III, komposisi media yang digunakan larutan stok media MS dan WPM sebagai media tumbuh tanaman dengan NAA dan BAP sebagai zat pengatur tumbuh (ZPT) yang digunakan. Bahan penyusun media lainnya, agar, aquades steril, dan bahan lainnya yang mendukung penelitian ini.
Alat yang digunakan dalam penelitian ini adalah Laminar Air Flow Cabinet (LAFC), tabung uji, autoklaf, steri box, timbangan analitik, rak kultur,
hot plate dengan magnetik stirer, erlenmeyer, gelas ukur, kaca tebal, pipet ukur,
pinset, gunting, scalpel, lampu bunsen, pH meter, oven, kertas plano, aluminium foil, kompor gas, minisar, mikropipet, tip, pipet tetes, dan alat-alat lainnya yang mendukung penelitian ini.
Metode Penelitian
Faktor I : Lama Penyinaran dengan 3 jenis kategori yaitu : C1 : 12 Jam Terang, 12 Jam Gelap
C2 : 24 Jam Terang C3 : 24 Jam Gelap
Faktor II : Komposisi media kultur dengan campuran zat pengatur tumbuh dengan 6 taraf yaitu :
A1 : MS + BAP 0,5 mg/l A2 : MS + BAP 1 mg/l
A3 : MS + BAP 1,5 mg/l + NAA 0,1 mg/l A4 : WPM + BAP 0,5 mg/l
A5 : WPM + BAP 0,5 mg/l + NAA 0,25 mg/l A6 : WPM + BAP 0,5 mg/l + NAA 0,5 mg/l Sehingga diperoleh kombinasi perlakuan sebagai berikut:
C1A1 C2A1 C3A1
C1A2 C2A2 C3A2
C1A3 C2A3 C3A3
C1A4 C2A4 C3A4
C1A5 C2A5 C3A5
C1A6 C2A6 C3A6
Jumlah perlakuan : 18
Jumlah ulangan : 6
Model liner dari sidik ragam penelitian sebagai berikut: Yijk = µ + αi + βj + (αβ)ij + ε ijk
i = 1,2, 3 j = 1,2,3,4,5,6 k = 1,2,3…6
Yijk = Nilai pengamatan unit percobaan pada perlakuan lama penyinaran ke-i, Media dengan campuran zat pengatur tumbuh ke-j, dan ulangan ke-k
µ = Nilai tengah umum
αi = Pengaruh lama penyinaran ke-i
βj = Pengaruh media dengan campuran zat pengatur tumbuh ke-j
(αβ)ij = Nilai tambah pengaruh interaksi lama penyinaran ke-i dan media dengan zat pengatur tumbuh ke-j
εijk = Galat percobaan
PELAKSANAAN PENELITIAN Sterilisasi Alat
Alat-alat dissecting-set dan glass ware yang akan digunakan untuk kultur in vitro dicuci dan dikeringkan. Kemudian bungkus tabung dengan plastik tahan
panas atau letakkan pada rak tabung, sedangkan untuk botol biasanya bisa langsung diletakkan pada autoklaf. Disterilkan tabung/botol dengan autoklaf pada tekanan 1 atm dan suhu 121oC selama 60 menit. Setelah itu sterilkan secara kering tabung uji/botol di dalam oven pada suhu 150oC selama 1-2 jam.
Pembuatan Media
MS (Murashige and Skoog)
Media yang digunakan adalah media Murashige and Skoog (MS) padat. Sebelum dilakukan pembuatan media MS, dilakukan pembuatan larutan stok ZPT BAP dan NAA. Larutan stok ZPT masing-masing dibuat 100 mg/100 ml. Larutan stok BAP dan NAA disaring menggunakan minisar guna meningkatkan sterilitas dari hormon tersebut dan dilakukan di Laminar Air Flow Cabinet (LAFC).
dikehendaki adalah 5,8, untuk mengatur pH yaitu menaikkan atau menurunkan pH dapat digunakan larutan NaOH dan HCl 0,1 N. Letakkan agar mikrobiologi dan dimasak di atas kompor gas sampai larutan mendidih dan bening (semua agar telah larut). Larutan dipindahkan ke erlenmeyer berukuran 3000 ml dan ditutup dengan aluminium foil. Hasil Media MS secara keseluruhan di sterilisasi dengan tekanan 1 atm pada suhu 121°C selama 20 menit di autoklaf. Setelah proses sterilisasi selesai, media dimasukkan ke ruang kultur dan dimasukkan ke ruangan Laminar Air Flow Cabinet (LAFC) untuk dibagikan ke 3 tabung erlenmeyer
berukuran 1000 ml dengan masing-masing tabung berisi 650 ml. Teteskan BAP dan NAA ke masing-masing tabung uji sesuai perlakuan. Dituangkan media ke dalam tabung uji berisikan 13 ml/tabung dan ditutup penutup tabung steril untuk multiplikasi. Sehingga didapat ± 50 tabung uji. Tabung uji diberi label sesuai dengan perlakuan. Selanjutnya disimpan dalam ruang kultur sebelum digunakan. WPM (Woody Plant Medium)
Media yang digunakan adalah media Woody Plant Medium (WPM). Sebelum dilakukan pembuatan media WPM, dilakukan pembuatan larutan stok ZPT BAP dan NAA. Larutan stok ZPT masing-masing dibuat 100 mg/100 ml. Kemudian larutan stok BAP dan NAA disaring menggunakan minisar guna meningkatkan sterilitas dari ZPT tersebut dan dilakukan di Laminar Air Flow Cabinet (LAFC).
dimasukkan ke dalam beaker glass yang telah berisi aquades 750 ml, lalu diaduk dengan menggunakan magnetik stirer sebagai pengaduk. Kemudian ditambahkan myo-inositol diaduk hingga larut. Dimasukkan larutan stok hara makro 100 ml, larutan stok hara mikro 10 ml, iron 8 ml dan vitamin 4 ml. Kemudian larutan ditepatkan menjadi 2000 ml dengan menambahkan aquades. Keasaman diukur dengan pH meter. pH yang dikehendaki adalah 5,8 untuk mengatur pH yaitu menaikkan atau menurunkan pH dapat digunakan larutan KOH dan HCl 0,1 N. Ditambahkan agar biotek dan dimasak di atas kompor gas sampai larutan mendidih dan bening (semua agar telah larut). Larutan dipindahkan ke erlenmeyer berukuran 3000 ml dan ditutup dengan aluminium foil dan diikat dengan tali plastik. Kemudian media WPM di sterilisasi dengan tekanan 1 atm pada suhu 121°C selama 20 menit di autoklaf. Setelah proses sterilisasi selesai, media dimasukkan ke ruang kultur dan dimasukkan ke Laminar Air Flow Cabinet (LAFC) untuk dibagikan ke 3 tabung erlenmeyer berukuran 1000 ml dengan masing-masing tabung berisi 650 ml. Teteskan BAP dan NAA ke masing-masing tabung uji sesuai perlakuan. Dituangkan media ke dalam tabung uji berisikan 13 ml/tabung dan ditutup dengan penutup tabung steril untuk multiplikasi. Sehingga diperoleh ± 50 tabung uji dari setiap perlakuannya. Tabung uji diberi label sesuai dengan perlakuan. Selanjutnya disimpan dalam ruang kultur sebelum digunakan.
Persiapan Ruang Tanam
yang akan dipakai harus disemprot dengan alkohol 96% dan beberapa alat seperti pinset, gunting, scalpel setelah disemprot lalu dibakar di dalam ke dalam laminar air flow cabinet selama 1 menit. Hal ini dilakukan untuk menghindari resiko
bahan penelitian terkontaminasi. Steribox dihidupkan dan disediakan alkohol 70% untuk membersihkan alat yang telah digunakan.
Multiplikasi
primer. Satu siklus tahap multiplikasi adalah empat minggu, dan tahap ini dapat diulang antara 3 – 12 siklus tergantung jumlah planlet yang diinginkan.
Pemeliharaan Eksplan dan Pengaturan Lama Penyinaran
Tabung-tabung uji diletakkan pada rak kultur di dalam ruang kultur. Ruangan ini diusahakan bebas dari bakteri dan cendawan, dimana setiap hari disemprot dengan alkohol 96% atau dan disemprot formalin agar bebas dari organisme yang menyebabkan terjadi kontaminasi. Dalam penelitian ini suhu ruangan kultur yang digunakan + 20-25°C, paling optimum 18oC. Sedangkan untuk pengaturan lama penyinaran disesuaikan dengan perlakuan. Perlakuan lama penyinaran pertama, semua kultur diletakkan di rak kultur dengan intensitas cahaya 2000 lux dengan lama penyinaran 12 jam terang dan 12 jam gelap. Perlakuan lama penyinaran kedua, tabung-tabung uji diletakkan pada rak kultur dengan intensitas cahaya 2000 lux dengan lama penyinaran 24 jam terang. Sedangkan perlakuan lama penyinaran ketiga, tabung-tabung uji diletakkan pada rak kultur yang ditutup dengan kain gelap/hitam (tanpa merubah suhu) sehingga diperoleh penyinaran dengan besaran intensitas cahaya 0 lux, serta dengan kondisi ruangan memiliki air conditioner dengan hefa yang dibersihkan selama 6 bulan sekali. Apabila mengalami kontaminasi, segera diambil dari rak kultur agar mencegah kontaminasi ke tabung lainnya.
Peubah Amatan
Persentase Eksplan Membentuk Tunas (%)
Persentase terbentuknya tunas = jumlah tunas yang terbentuk x 100% jumlah eksplan seluruhnya (per perlakuan) Umur Muncul Tunas (hari)
Umur kemunculan tunas dihitung berdasarkan hari ke berapa munculnya tunas.
Jumlah Tunas (tunas)
Dihitung pada akhir penelitian (4 Minggu Setelah Kultur) dengan menghitung banyaknya tunas baru yang terbentuk dari setiap eksplan.
Panjang Tunas (cm)
Panjang tunas diukur pada tunas tertinggi dengan menggunakan kertas milimeter yang diukur dari tempat munculnya tunas (pangkal) sampai ujung tunas tertinggi. Panjang tunas keseluruhan dari setiap perlakuan dibagi dengan jumlah ulangan. Pengukuran dilakukan pada akhir penelitian (4 Minggu Setelah Kultur). Persentase Eksplan Membentuk Daun (%)
Jumlah daun dihitung dari daun yang terbentuk yang telah terbuka sempurna pada eksplan. Pengamatan dilakukan pada akhir penelitian (4 Minggu Setelah Kultur). Persentase terbentuknya daun dihitung pada akhir penelitian dengan rumus:
Persentase terbentuknya daun = jumlah daun yang terbentuk x 100% jumlah eksplan seluruhnya (per perlakuan) Jumlah Daun (helai)
Kehadiran Kalus (visual)
Kehadiran kalus dilihat dari ada atau tidaknya kemunculan kalus dari bekas potongan/pelukaan eksplan atau dari bagian manapun dari eksplan. Pengamatan dilakukan pada akhir penelitian (4 Minggu Setelah Kultur).
Warna Kalus (visual)
Dilihat dari penampakan warna kalus yang muncul. Warna kalus dilihat pada akhir penelitian (4 Minggu Setelah Kultur).
Morfogenesis
HASIL DAN PEMBAHASAN Hasil
Dari hasil analisis data yang dilakukan, diperoleh bahwa perlakuan lama penyinaran dan komposisi media yang berbeda memberikan pengaruh nyata terhadap persentase eksplan membentuk tunas, jumlah tunas, panjang tunas, persentase eksplan membentuk daun dan jumlah daun. Interaksi keduanya juga memberikan pengaruh nyata terhadap semua peubah amatan. Akan tetapi tidak memberikan pengaruh yang nyata terhadap kehadiran kalus, warna kalus dan morfogenesis.
Persentase Eksplan Membentuk Tunas (%)
Data pengamatan dan sidik ragam terhadap parameter persentase eksplan membentuk tunas pada perlakuan lama penyinaran dan komposisi media yang berbeda dapat dilihat pada (Lampiran 1-3). Rataan persentase eksplan membentuk tunas dari perlakuan lama penyinaran dan komposisi media yang berbeda dapat dilihat pada Tabel 1.
Tabel 1. Pengaruh perlakuan lama penyinaran dan komposisi media yang berbeda terhadap persentase eksplan membentuk tunas (%) 4 minggu setelah kultur
Lama Penyinaran
Media
Rataan
A1 A2 A3 A4 A5 A6
C1 50.00abc 66.67ab 50.00abc 100.00a 83.33ab 66.67ab 69.44 C2 50.00bc 66.67abc 50.00abc 100.00a 66.67abc 66.67ab 66.67 C3 00.00c 00.00c 00.00c 00.00c 00.00c 00.00c 00.00 Rataan 33.33 44.45 33.33 66.67 50.00 44.45 45.37 Keterangan: Angka-angka yang diikuti huruf yang sama pada baris dan kolom yang sama
Tabel 1 menunjukkan bahwa persentase eksplan membentuk tunas tertinggi terdapat pada kombinasi perlakuan C1A4 dan C2A4 yaitu C1 (12 jam terang, 12 jam gelap), C2 (24 jam terang) dan A4 (WPM + BAP 0,5 mg/l) dengan rataan 100%. Sedangkan persentase eksplan membentuk tunas terendah terdapat pada kombinasi perlakuan C3A1, C3A2, C3A3, C3A4, C3A5, C3A6 yaitu C3 (24 jam gelap) dan A1 (MS + BAP 0,5 mg/l ), A2 (MS + BAP 1 mg/l), A3 (MS + BAP 1,5 mg/l + NAA 0,1 mg/l), A4 (WPM + BAP 0,5 mg/l), A5 (WPM + BAP 0,5 mg/l + NAA 0,25 mg/l), A6 (WPM + BAP 0,5 mg/l + NAA 0,5 mg/l) dengan rataan 0%. Perlakuan C1A4 dan C2A4 berbeda nyata dengan perlakuan C2A1, C3A1, C3A2, C3A3, C3A4, C3A5 dan C3A6, akan tetapi tidak berbeda nyata dengan perlakuan C1A1, C1A2, C1A3, C1A5, C1A6, C2A2, C2A3, C2A5, C2A6. Gambar eksplan sebelum dan sesudah membentuk tunas pada salah satu perlakuan dapat dilihat pada gambar 3 dan gambar 4.
[image:34.595.118.299.460.651.2][image:34.595.324.502.461.652.2]
Umur Muncul Tunas (hari)
[image:35.595.111.512.276.391.2]Data pengamatan dan sidik ragam parameter umur munculnya tunas pada perlakuan lama penyinaran dan komposisi media yang berbeda dapat dilihat pada (Lampiran 4). Rataan umur munculnya tunas dari perlakuan lama penyinaran dan komposisi media yang berbeda dapat dilihat pada Tabel 2.
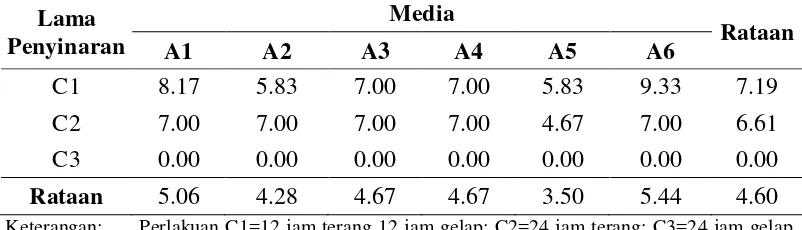
Tabel 2. Pengaruh perlakuan lama penyinaran dan komposisi media yang berbeda terhadap umur muncul tunas (hari) 4 minggu setelah kultur
Lama Penyinaran
Media
Rataan
A1 A2 A3 A4 A5 A6
C1 8.17 5.83 7.00 7.00 5.83 9.33 7.19
C2 7.00 7.00 7.00 7.00 4.67 7.00 6.61
C3 0.00 0.00 0.00 0.00 0.00 0.00 0.00
Rataan 5.06 4.28 4.67 4.67 3.50 5.44 4.60
Keterangan: Perlakuan C1=12 jam terang 12 jam gelap; C2=24 jam terang; C3=24 jam gelap. Perlakuan A1= MS + BAP 0,5 mg/l, A2= MS + BAP 1 mg/l; A3= MS + BAP 1,5 mg/l + NAA 0,1 mg/l; A4= WPM + BAP 0,5 mg/l; A5= WPM + BAP 0,5 mg/l + NAA 0,25 mg/l; A6= WPM + BAP 0,5 mg/l + NAA 0,5 mg/l.
Jumlah Tunas (tunas)
Tabel 3. Pengaruh perlakuan lama penyinaran dan komposisi media yang berbeda terhadap jumlah tunas (tunas) 4 minggu setelah kultur
Lama Penyinaran
Media
Rataan
A1 A2 A3 A4 A5 A6
C1 0.50ab 0.67a 0.50ab 1.00a 0.83a 0.67a 0.69 C2 0.50ab 0.67a 0.50ab 1.00a 0.67a 0.67a 0.67 C3 0.00b 0.00b 0.00b 0.00b 0.00b 0.00b 0.00
Rataan 0.33 0.44 0.33 0.67 0.50 0.44 0.45
Keterangan: Angka-angka yang diikuti huruf yang sama pada baris dan kolom yang sama menunjukkan tidak berbeda nyata pada Uji Jarak Berganda Duncan pada taraf 5%. Perlakuan C1=12 jam terang 12 jam gelap; C2=24 jam terang; C3=24 jam gelap. Perlakuan A1= MS + BAP 0,5 mg/l, A2= MS + BAP 1 mg/l; A3= MS + BAP 1,5 mg/l + NAA 0,1 mg/l; A4= WPM + BAP 0,5 mg/l; A5= WPM + BAP 0,5 mg/l + NAA 0,25 mg/l; A6= WPM + BAP 0,5 mg/l + NAA 0,5 mg/l.
Tabel 3 menunjukkan bahwa jumlah tunas tertinggi terdapat pada kombinasi perlakuan C2A4, C1A4, C1A5, C2A6, C2A5, C1A2, C2A2, C1A6 yaitu C1 (12 jam terang, 12 jam gelap), C2 (24 jam terang) dan A2 (MS + BAP 1 mg/l), A4 (WPM + BAP 0,5 mg/l), A5 (WPM + BAP 0,5 mg/l + NAA 0,25 mg/l), A6 (WPM + BAP 0,5 mg/l + NAA 0,5 mg/l) dengan rataan (1.00), (1.00), (0.83) dan (0.67). Sedangkan persentase jumlah tunas terendah terdapat pada kombinasi perlakuan C3A1, C3A2, C3A3, C3A4, C3A5, C3A6 yaitu C3 (24 jam gelap) dan A1 (MS + BAP 0,5 mg/l ), A2 (MS + BAP 1 mg/l), A3 (MS + BAP 1,5 mg/l + NAA 0,1 mg/l), A4 (WPM + BAP 0,5 mg/l), A5 (WPM + BAP 0,5 mg/l + NAA 0,25 mg/l), A6 (WPM + BAP 0,5 mg/l + NAA 0,5 mg/l) dengan rataan 0%. Perlakuan C2A4, C1A4, C1A5, C2A6, C2A5, C1A2, C2A2, C1A6 berbeda nyata dengan perlakuan C3A1, C3A2, C3A3, C3A4, C3A5, C3A6, akan tetapi tidak berbeda nyata dengan perlakuan C1A1, C2A1, C1A3, dan C2A3. Panjang Tunas (cm)
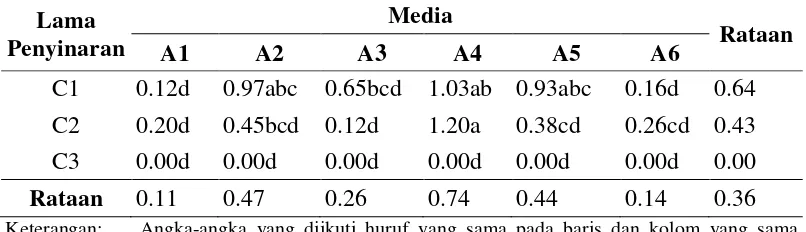
(Lampiran 8-10). Dari tabel sidik ragam menunjukkan pengaruh nyata terhadap panjang tunas pada 4 minggu setelah kultur, serta interaksi dari kedua perlakuan ini memberikan pengaruh yang nyata terhadap panjang tunas. Rataan panjang tunas dari perlakuan lama penyinaran dan komposisi media yang berbeda dapat dilihat pada Tabel 4.
Tabel 4. Pengaruh perlakuan lama penyinaran dan komposisi media yang berbeda terhadap panjang tunas (cm) 4 minggu setelah kultur
Lama Penyinaran
Media
Rataan
A1 A2 A3 A4 A5 A6
C1 0.12d 0.97abc 0.65bcd 1.03ab 0.93abc 0.16d 0.64 C2 0.20d 0.45bcd 0.12d 1.20a 0.38cd 0.26cd 0.43 C3 0.00d 0.00d 0.00d 0.00d 0.00d 0.00d 0.00
Rataan 0.11 0.47 0.26 0.74 0.44 0.14 0.36
Keterangan: Angka-angka yang diikuti huruf yang sama pada baris dan kolom yang sama menunjukkan tidak berbeda nyata pada Uji Jarak Berganda Duncan pada taraf 5%. Perlakuan C1=12 jam terang 12 jam gelap; C2=24 jam terang; C3=24 jam gelap. Perlakuan A1= MS + BAP 0,5 mg/l, A2= MS + BAP 1 mg/l; A3= MS + BAP 1,5 mg/l + NAA 0,1 mg/l; A4= WPM + BAP 0,5 mg/l; A5= WPM + BAP 0,5 mg/l + NAA 0,25 mg/l; A6= WPM + BAP 0,5 mg/l + NAA 0,5 mg/l.
C1A1, C2A3, C3A6, C3A5, C3A4, C3A3, C3A2 dan C3A1. Akan tetapi perlakuan C2A4 tidak berbeda nyata dengan C1A4, C1A2, C1A5.\
Persentase Eksplan Membentuk Daun (%)
Data pengamatan dan sidik ragam terhadap parameter persentase eksplan membentuk daun pada perlakuan lama penyinaran dan komposisi media yang berbeda dapat dilihat pada (Lampiran 11-13). Dari tabel sidik ragam menunjukkan pengaruh nyata terhadap persentase ekplan membentuk daun pada 4 minggu setelah kultur, serta interaksi antara perlakuan lama penyinaran dan komposisi media yang berbeda memberikan pengaruh yang nyata terhadap persentase ekplan membentuk daun. Rataan persentase eksplan membentuk daun dari perlakuan lama penyinaran dan komposisi media yang berbeda dapat dilihat pada Tabel 5. Tabel 5. Pengaruh perlakuan lama penyinaran dan komposisi media yang berbeda
terhadap persentase eksplan membentuk daun (%) 4 minggu setelah kultur
Lama Penyinaran
Media
Rataan
A1 A2 A3 A4 A5 A6
C1 0.00b 0.00b 0.00b 33.33b 16.67b 0.00b 36.11 C2 0.00b 16.67b 0.00b 66.67a 0.00b 16.67b 86.12 C3 0.00b 0.00b 0.00b 0.00b 0.00b 0.00b 0.00
Rataan 0.00 5.56 0.00 55.55 5.56 5.56 64.82
Keterangan: Angka-angka yang diikuti huruf yang sama pada baris dan kolom yang sama menunjukkan tidak berbeda nyata pada Uji Jarak Berganda Duncan pada taraf 5%. Perlakuan C1=12 jam terang 12 jam gelap; C2=24 jam terang; C3=24 jam gelap. Perlakuan A1= MS + BAP 0,5 mg/l, A2= MS + BAP 1 mg/l; A3= MS + BAP 1,5 mg/l + NAA 0,1 mg/l; A4= WPM + BAP 0,5 mg/l; A5= WPM + BAP 0,5 mg/l + NAA 0,25 mg/l; A6= WPM + BAP 0,5 mg/l + NAA 0,5 mg/l.
Jumlah Daun (helai)
[image:39.595.109.517.387.512.2]Data pengamatan dan sidik ragam terhadap parameter jumlah daun pada perlakuan lama penyinaran dan komposisi media yang berbeda dapat dilihat pada (Lampiran 14-16). Dari tabel sidik ragam menunjukkan bahwa perlakuan lama penyinaran dan komposisi media yang berbeda memberikan pengaruh nyata terhadap jumlah daun pada 4 minggu setelah kultur, serta interaksi dari kedua perlakuan ini memberikan pengaruh yang nyata terhadap jumlah daun. Rataan jumlah daun dari perlakuan lama penyinaran dan komposisi media yang berbeda dapat dilihat pada Tabel 6.
Tabel 6. Pengaruh perlakuan lama penyinaran dan komposisi media yang berbeda terhadap jumlah daun (helai) 4 minggu setelah kultur
Lama Penyinaran
Media
Rataan
A1 A2 A3 A4 A5 A6
C1 0.00c 0.00c 0.00c 1.00b 0.17bc 0.00c 0.19 C2 0.00c 0.17bc 0.00c 2.33a 0.00c 0.67bc 0.53 C3 0.00c 0.00c 0.00c 0.00c 0.00c 0.00c 0.00
Rataan 0.00 0.06 0.00 1.11 0.06 0.22 0.24
Keterangan: Angka-angka yang diikuti huruf yang sama pada baris dan kolom yang sama menunjukkan tidak berbeda nyata pada Uji Jarak Berganda Duncan pada taraf 5%. Perlakuan C1=12 jam terang 12 jam gelap; C2=24 jam terang; C3=24 jam gelap. Perlakuan A1= MS + BAP 0,5 mg/l, A2= MS + BAP 1 mg/l; A3= MS + BAP 1,5 mg/l + NAA 0,1 mg/l; A4= WPM + BAP 0,5 mg/l; A5= WPM + BAP 0,5 mg/l + NAA 0,25 mg/l; A6= WPM + BAP 0,5 mg/l + NAA 0,5 mg/l.
(WPM + BAP 0,5 mg/l + NAA 0,25 mg/l), A6 (WPM + BAP 0,5 mg/l + NAA 0,5 mg/l) dengan rataan (0.00). Perlakuan C2A4 berbeda nyata dengan C1A4. Perlakuan C1A4 tidak berbeda nyata dengan C2A6, C1A5 dan C2A2. Gambar eksplan membentuk daun dapat dilihat pada gambar 5.
[image:40.595.200.442.212.431.2]
Gambar 5. Eksplan Membentuk Daun
Tabel 7. Rekapitulasi Peubah Amatan Sidik Ragam pada Mikropropagasi Tanaman Karet pada Lama Penyinaran dan Komposisi Media yang Berbeda (4 minggu setelah kultur)
Peubah Amatan Perlakuan
C A C x A
Persentase Eksplan Membentuk Tunas (%) ** ** **
Umur Muncul tunas (hari) - - -
Jumlah Tunas (tunas) ** ** **
Panjang Tunas (cm) ** ** **
Persentase Eksplan Membentuk Daun (%) ** ** **
Jumlah Daun (helai) ** ** **
Kehadiran Kalus Tidak ada Tidak ada Tidak ada
Warna Kalus Tidak ada Tidak ada Tidak ada
[image:40.595.114.516.514.714.2]Kehadiran Kalus
Pada semua kultur yang dilakukan tidak ada satupun yang menunjukkan kehadiran kalus.
Warna Kalus
Karena tidak ada kalus yang terbentuk hingga akhir penelitian menyebabkan tidak adanya warna kalus yang diamati secara visual.
Morfogenesis
Berdasarkan kemunculan tunas mikro tanaman karet, maka tidak diperoleh kemunculan tunas diluar jaringan meristem aksilar (pangkal batang, ujung batang maupun bagian lain dari eksplan).
Pembahasan
mempengaruhi pertumbuhan dan morfogenesis tanaman secara in vitro adalah panjang gelombang, kerapatan flux dan durasi panjang penyinaran (fotoperiodisme). Oleh karena itu, pentingnya cahaya di kultur jaringan terletak pada pengaruhnya terhadap fotomorfogenesis bukan fotosintesis.
Pertumbuhan in vitro jaringan tanaman yang telah terorganisasi pada umumnya tidak mengalami hambatan karena cahaya, bahkan cahaya seringkali dibutuhkan untuk mendapatkan hasil yang optimal. Sebaliknya, inisiasi pembelahan sel pada eksplan dan pertumbuhan jaringan kalus kadang-kadang mengalami hambatan dengan adanya cahaya. Dalam hal ini, terdapat perbedaan yang jelas antar jaringan berbagai spesies tanaman dalam kaitannya dengan respon jaringan tersebut terhadap cahaya. Menurut Mulyaningsih and Aluh (2008) keberadaan cahaya menentukan terbentuknya kalus. Beberapa tanaman memerlukan cahaya dalam induksi kalus, regenerasi kalus, dan ada pula yang tidak memerlukan cahaya (gelap total). Teknik perbanyakan tanaman secara in vitro, umumnya diinkubasikan pada ruang penyimpanan dengan penyinaran
kecuali pada teknik perbanyakan yang diawali dengan pertumbuhan kalus. Induksi kalus dari eksplan daun pada kelapa sawit (Elaeis guineensis Jacq.) yang dilakukan oleh Balai Pengkajian dan Pengembangan Teknologi (BPPT) Serpong, Tangerang, optimal dilakukan di ruang gelap selama 2 bulan begitu juga induksi kalus dari anter karet (Hevea brasiliensis) (Jayasree, 2009). Penelitian terhadap pertumbuhan kalus dan pembentukan senyawa alkaloid kinolina pada Cinchona ledgeriana dipengaruhi oleh umur kalus dan ada tidaknya cahaya (Grace, 2005).
Pengaruh Komposisi Media yang Berbeda terhadap Mikropropagasi Tanaman Karet
Dari hasil analisis data secara statistik dapat diketahui bahwa perlakuan komposisi media yang berbeda menunjukkan pengaruh yang nyata terhadap semua peubah amatan. Akan tetapi belum menunjukkan pengaruh yang nyata terhadap kehadiran kalus, warna kalus dan morfogenesis. Hal ini diduga karena kondisi eksplan, perbandingan antara konsentrasi zat pengatur tumbuh auksin dan sitokinin pada media serta pengaruh lingkungan belum sesuai untuk mendukung pembentukan kalus. Widiastoety (1985) menyatakan bahwa pembentukan kalus biasanya terjadi jika perbandingan antara konsentrasi auksin dan sitokinin seimbang. Hal ini juga didukung oleh Sumardi (1996) yang menyatakan bahwa pertumbuhan kalus dipengaruhi oleh beberapa faktor terutama yang berhubungan langsung dengan eksplan seperti ketersediaan energi, tempat eksplan tumbuh dan kehadiran zat pengatur tumbuh terutama auksin dan sitokinin dalam media kultur dengan keseimbangan tertentu. Menurut Lee (2002) yang menyatakan bahwa interaksi antara sitokinin dan auksin berperan dalam mengontrol banyak aspek pertumbuhan dan diferensasi sel. Rasio sitokinin yang tinggi daripada auksin akan memicu terbentuknya tunas dan pada medium dengan konsentrasi sitokinin yang rendah tidak mampu membuat kalus terdiferensiasi.
Pengaruh Interaksi Lama Penyinaran dan Komposisi Media yang Berbeda terhadap Mikropropagasi Tanaman Karet
jumlah tunas, panjang tunas, persentase eksplan membentuk daun dan jumlah daun.
Pada peubah amatan persentase eksplan membentuk tunas, rataan tertinggi persentase eksplan membentuk tunas terdapat pada kombinasi perlakuan C1A4 dan C2A4 dengan rataan 100%. Sedangkan persentase eksplan membentuk tunas terendah terdapat pada kombinasi perlakuan C3A1, C3A2, C3A3, C3A4, C3A5, C3A6. Hal ini menunjukkan bahwa kombinasi perlakuan lama penyinaran dan media dengan zat pengatur tumbuh BAP tunggal maupun NAA yang lebih rendah mampu memberikan respon yang baik terhadap persentase eksplan membentuk tunas. Akan tetapi seluruh kombinasi perlakuan lama penyinaran C3 dengan berbagai jenis media dan zat pengatur tumbuh tidak memberikan respon terhadap pembentukan tunas. Hal ini diduga karena tunas tanaman karet memberikan respon terhadap faktor lingkungan seperti suhu dan cahaya. Tunas memanfaatkan cahaya untuk mendukung pertumbuhan selnya dibantu dengan adanya zat pengatur tumbuh yang ditambahkan kedalam media. Apabila dibandingkan dengan lama penyinaran 24 jam gelap dengan berbagai konsentrasi zat pengatur tumbuh menyebabkan pertumbuhan terhambat. Seperti diungkapkan oleh Gunawan (1987) eksplan memang sudah dipenuhi kebutuhan karbohidrat dari gula dan medium sehingga cahaya untuk keperluan fotosintesa tidak begitu mendesak. Tetapi cahaya amat penting untuk pengendalian perkembangan eksplan.
George and Sherrington (1984) juga menyatakan bahwa umumnya ditemukan bahwa tanaman yang tumbuh pada penyinaran panjang menunjukkan kandungan auksin endogen lebih tinggi daripada tanaman yang berhari pendek.
Pada peubah amatan jumlah tunas, rataan tertinggi jumlah tunas terdapat pada kombinasi perlakuan C2A4, C1A4, C1A5, C2A6, C2A5, C1A2, C2A2, C1A6 dengan rataan (1.00), (1.00), (0.83) dan (0.67). Sedangkan persentase jumlah tunas terendah terdapat pada kombinasi perlakuan C3A1, C3A2, C3A3, C3A4, C3A5, C3A6 dengan rataan 0%. Hal ini menunjukkan bahwa pertumbuhan tunas pada perlakuan lama penyinaran C1 maupun C2 yang dikombinasikan dengan zat pengatur tumbuh BAP tunggal maupun yang dikombinasikan dengan konsentrasi NAA yang lebih rendah lebih baik untuk pembentukan tunas. Sedangkan kondisi lama penyinaran C3 yang dikombinasikan dengan berbagai macam media dan zat pengatur tumbuh tidak memberikan respon untuk pembentukan tunas. Menurut Kieber (2002) sitokinin telah diketahui memainkan peranan penting dalam hampir semua aspek pertumbuhan dan perkembangan tanaman termasuk didalamnya pembelahan sel, inisiasi dan pertumbuhan tunas, serta perkembangan fotomorfogenesis. Fotomorfogenesis adalah dimana perubahan morfologi terutama dalam hal kultur jaringan karena adanya pengaruh cahaya.
medium WPM yang ditambahkan BAP 0,5 mg/l, medium WPM yang ditambahkan BAP 0.5 mg/l dan NAA 0.25 mg/l, dan medium WPM yang ditambahkan BAP 0,5 mg/l dan NAA 0,5 mg/l.
Pada penelitian ini peubah amatan panjang tunas tertinggi terdapat pada kombinasi perlakuan C2A4 dengan rataan 1.20 cm. Sedangkan rataan terendah terdapat pada kombinasi perlakuan C2A1, C1A6, C1A1, C2A3, C3A6, C3A5, C3A4, C3A3, C3A2, C3A1. Lama penyinaran yang lebih panjang serta media dengan konsentrasi BAP tunggal sudah cukup efektif untuk pemanjangan tunas. Komposisi medium dan zat pengatur tumbuh yang tepat serta interaksinya dengan lingkungan in vitro akan mendorong eksplan ke arah pemanjangan tunas. Hal ini diduga karena lama penyinaran memberikan pengaruh terhadap kerja kandungan hormon endogen maupun eksogen, sehingga meskipun media hanya terdapat hormon sitokinin BAP sudah mampu untuk memacu pemanjangan tunas. Hal ini sesuai dengan pendapat Wattimena (1991) yang menyatakan bahwa lama penyinaran dalam kultur jaringan mempunyai pengaruh terhadap kandungan hormon endogen. Peranan lama penyinaran dalam kultur jaringan terhadap morfogenesis mungkin dapat juga digantikan dengan penambahan zat pengatur tumbuh ke dalam medium. Di dalam morfogenesis, lama penyinaran berkaitan dengan energi yang diterima oleh jaringan. Tanaman yang tumbuh pada penyinaran panjang memiliki jumlah auksin endogen yang lebih tinggi dibandingkan pada penyinaran pendek.
pertumbuhan dan perkembangan tanaman termasuk didalamnya pembelahan sel, inisiasi dan pertumbuhan tunas, serta perkembangan fotomorfogenesis. Fotomorfogenesis adalah dimana perubahan morfologi terutama dalam hal kultur jaringan karena adanya pengaruh cahaya. Menurut Wattimena (1992) poliferasi tunas hanya memerlukan sitokinin dalam konsentrasi yang tinggi tanpa auksin atau dengan auksin dalam konsentrasi yang rendah sekali. Zat pengatur tumbuh pada eksplan tergantung dari zat pengatur tumbuh endogen dan zat pengatur tumbuh eksogen yang diserap dari media tumbuh. Zat pengatur tumbuh eksogen ini tidak selalu sama dengan zat pengatur tumbuh endogen. Tetapi kebanyakan zat pengatur tumbuh eksogen mempunyai peran yang sama dengan zat pengatur tumbuh endogen. Pada beberapa jenis tanaman atau pada tingkat selular kebutuhan akan zat pengatur tumbuh eksogen itu akan spesifik.
(1977) yang menyatakan bahwa pembentukan dan pertumbuhan tunas aksilar menjadi daun dipengaruhi oleh lingkungan, terutama faktor fisik pencahayaan, lama penyinaran (fotoperiodisme) dan suhu ruang inkubasi. Pertumbuhan tunas biasanya menjadi lebih baik pada kondisi pencahayaan yang tinggi, panjang penyinaran sangat berpengaruh dalam poliferasi dan pertumbuhan tunas. Menurut Hendaryono dan Wijayanti (1994) unsur magnesium dapat meningkatkan kandungan fosfat dalam tanaman. Fosfat merupakan bahan mentah untuk pembentukan sejumlah protein. Dengan terbentuknya protein maka pertumbuhan daun pun akan baik.
dalam tanaman. Fosfat merupakan bahan mentah untuk pembentukan sejumlah protein. Dengan terbentuknya protein maka pertumbuhan daun pun akan baik.
Menurut Fereol et al (2002), kombinasi konsentrasi sitokinin tinggi dengan auksin rendah, penting dalam pembentukan tunas dan daun. Dalam kultur jaringan kedua golongan ZPT ini terbukti berperan dalam menunjang pertumbuhan jaringan apabila digunakan pada konsentrasi yang tepat. Pada kultur in vitro kebanyakan tanaman membutuhkan sitokinin untuk pembentukan tunas
dan daun, sebaliknya auksin bersifat menghambat (Bhojwani, 1980). Hal ini juga didukung oleh Gardner et al (1991) yang menyatakan bahwa senyawa nitrogen yang terkandung dalam sitokinin berperan untuk proses sintesis asam-asam amino dan protein secara optimal yang selanjutnya digunakan untuk proses pertumbuhan dan perkembangan eksplan dalam hal ini pembentukan daun.
yang terdapat pada media WPM seperti unsur magensium yang tinggi sangat mendukung dalam pertumbuhan jaringan tanaman.
KESIMPULAN DAN SARAN Kesimpulan
Perlakuan Lama penyinaran 24 jam terang dan Media WPM + BAP 0,5 mg/l menghasilkan respon terbaik terhadap persentase eksplan membentuk tunas, jumlah tunas, panjang tunas, persentase eksplan membentuk daun dan jumlah daun.
Saran
TINJAUAN PUSTAKA Botani Tanaman
Sistematika tanaman karet menurut Steenis (2005) adalah sebagai berikut :
Kingdom : Plantae ; Divisio : Spermatophyta, Subdivisio : Angiospermae, Kelas : Dicotyledoneae, Ordo : Euphorbiales, Famili : Euphorbiaceae, Genus : Hevea, Spesies : Hevea brassiliensis Muell. Arg.
Akar tanaman karet berupa akar tunggang yang mampu menopang batang tanaman yang tumbuh tinggi ke atas. Dengan akar seperti itu pohon karet dapat
berdiri kokoh, meskipun tingginya mencapai 25 meter (Setiawan dan Andoko, 2005).
Tanaman karet merupakan tanaman yang tumbuh tinggi dan berbatang cukup besar. Tinggi pohon dewasa 15-25 meter. Batang tanaman biasanya tumbuh lurus dan memiliki percabangan tinggi di atas. Batang tanaman ini mengandung getah yang dikenal dengan nama lateks (Nugroho, 2010).
Daun karet berselang-seling, tangkai daunnya panjang dan terdiri dari 3
anak daun yang licin bertangkai, petiola pendek, hijau, dan memiliki panjang 3,5-30 cm. Helaian anak daun bertangkai pendek dan berbentuk elips atau bulat
telur, pangkal sempit dan tegang, ujung runcing, sisi atas daun hijau tua dan sisi bawah agak cerah, panjangnya 5-35 cm dan lebar 2,5-12,5 cm (Sianturi, 2001).
bunga yang tersusun atas tiga bunga (trifolia). Kedua bunga ini memiliki tangkai pendek, berbau harum, berwarna kuning untuk bunga jantan, dan kuning kehijauan untuk bunga betina. Ukuran bunga betina umumnya lebih besar dari bunga jantan yang ukurannya sekitar 5-6 mm. Penyerbukan dapat terjadi dengan penyerbukan sendiri dan penyerbukan silang (Setiawan dan Andoko, 2005).
Karet merupakan tanaman berbuah polong (diseliputi kulit yang keras) yang sewaktu masih muda buahnya berpaut erat dengan rantingnya. Buah karet dilapisi oleh kulit tipis berwarna hijau dan didalamnya terdapat kulit yang keras dan berkotak. Tiap kotak berisi sebuah biji yang dilapisi tempurung, setelah tua warna kulit buah berubah menjadi keabu-abuan dan kemudian mengering. Pada waktunya pecah dan jatuh, bijinya tercampak lepas dari kotaknya. Tiap buah tersusun atas 2-4 kotak biji. Pada umumnya berisi 3 kotak biji dimana setiap kotak terdapat satu biji. Tanaman karet mulai menghasilkan buah pada umur lima tahun dan akan semakin banyak setiap pertambahan umur tanaman (Budiman, 2012).
Buah beruang tiga, jarang yang beruang 4 hingga 6 diameter buah 3-5 cm dan terpisah 3, 4, 6. Cocci berkatup dua, pericarp berbatok, endokarp berkayu. Biji besar, bulat persegi empat, tertekan pada satu atau dua sisinya, berkilat, berwarna coklat muda, dengan noda-noda cokelat tua, panjang 2-3,5 cm dan lebar 1,5-3 cm dan tebal 1,5-2,5 cm (Sianturi, 2001).
Gambar 1. Pembibitan karet dan primary culture karet (Sumber : Montoro et al., 2012)
Kultur Jaringan
Kultur jaringan merupakan salah satu teknik perbanyakan yang menggunakan sel atau jaringan tanaman yang diisolasi dari bagian tanaman seperti protoplasma, sel atau sekelompok sel, yang selanjutnya disebut eksplan, distimulasi untuk membentuk tanaman secara utuh menggunakan media dan lingkungan tumbuh yang sesuai (Gunawan, 1988). Pada media aseptik yang mengandung unsur hara makro mikro, iron, vitamin dan zat pengatur tumbuh yang diperlukan tanaman, sel atau jaringan tersebut akan membelah dan
membentuk kalus atau organ tanaman secara langsung (tunas/akar) (Haryanto, 1991).
Teknik kultur jaringan telah digunakan dalam membantu produksi tanaman dalam skala besar melalui mikropropagasi atau perbanyakan klonal dari berbagai jenis tanaman. Jaringan tanaman dalam jumlah yang sedikit dapat menghasilkan ratusan atau ribuan tanaman secara terus menerus. Teknik ini telah digunakan dalam skala industri di berbagai negara untuk memproduksi secara komersial berbagai jenis tanaman seperti tanaman hias, tanaman buah-buahan dan kehutanan. Dengan menggunakan metoda kultur jaringan, jutaan tanaman dengan sifat genetis yang sama dapat diperoleh hanya dengan berasal dari satu mata tunas. Oleh karena itu metoda ini menjadi salah satu alternatif dalam perbanyakan tanaman secara vegetatif (Kusuma, 2010).
Dibanding dengan perbanyakan tanaman secara konvensional, perbanyakan tanaman secara kultur jaringan mempunyai beberapa kelebihan sebagai berikut : perbanyakan tanaman secara kultur jaringan menawarkan peluang besar untuk menghasilkan jumlah bibit tanaman yang banyak dalam waktu relatif singkat sehingga lebih ekonomis, tidak memerlukan tempat yang luas, dapat dilakukan sepanjang tahun tanpa bergantung pada musim, bibit yang dihasilkan lebih sehat dan memungkinkan dilakukannya manipulasi genetik (Yusnita, 2003).
mempunyai zat hormon yang mengatur pembelahan (Hendaryono dan Wijayani, 1994).
Metode mikropropagasi dapat dideskripsikan sebagai multiplikasi tanaman secara in vitro dengan menggunakan media buatan aseptik yang mengandung larutan nutrisi, bahan organik, dan zat pengatur tumbuh (ZPT). Metode mikropropagasi yang sering digunakan untuk produksi bibit secara komersial adalah teknik kultur tunas. Kultur tunas adalah perbanyakan tanaman dengan cara merangsang (proliferasi) pertumbuhan tunas aksilar atau adventif yang sudah ada pada eksplan (Sulistiani dan Yani 2012).
Proses perbanyakan tanaman karet melalui teknologi microcutting terdiri atas beberapa tahap, yaitu kultur primer (primary culture), multiplikasi, conditioning (hardening), induksi dan inisiasi perakaran serta aklimatisasi. Kultur
primer merupakan tahap penanaman eksplan pada medium pertumbuhan steril untuk menginisiasi kultur aseptik, yang merupakan tahap awal dalam teknologi kultur jaringan. Eksplan pada tahap kultur primer merupakan potongan batang tanaman karet muda yang dipelihara dalam polibag di rumah kaca dan eksplan tersebut memiliki minimal satu mata tunas aksiler (axillary bud). Dalam kondisi in vitro, eksplan yang bebas dari kontaminan dan tumbuh baik dapat diperbanyak
melalui subkultur berulang-ulang sehingga kultur primer merupakan tahap yang menentukan untuk keberhasilan dan keberlanjutan perbanyakan tanaman menggunakan teknologi tersebut (Haris et al., 2009).
Perbanyakan batang bawah tanaman karet secara klonal melalui teknologi in vitro microcutting telah berhasil dilakukan. Bibit karet yang dihasilkan melalui
pertanaman muda menunjukkan pertumbuhan yang seragam dan memiliki bentuk konikal pada batang bagian bawah (Carron et al., 2003). Teknologi in vitro microcutting karet ini kemudian berhasil diaplikasikan dan diadaptasi pada
lingkungan tropik di Indonesia (Sumaryono et al., 2012).
Perbanyakan tanaman secara in vitro dengan menggunakan kultur tunas pucuk merupakan salah satu teknik mikropropagasi yang dilakukan dengan mengkulturkan eksplan yang mengandung meristem pucuk dengan tujuan perangsangan dan perbanyakan tunas-tunas atau cabang-cabang aksilar sedangkan
kultur tunas aksilar adalah kultur mata tunas untuk merangsang munculnya tunas-tunas aksilar dari mata tunas yang dikulturkan (Djumat, 2014).
Pada tahap multiplikasi, perbanyakan dapat dilakukan dengan cara merangsang terjadinya pertumbuhan tunas cabang dan percabangan aksilar atau merangsang terbentuknya tunas pucuk tanaman secara adventif, baik secara langsung maupun melalui induksi kalus terlebih dahulu. Seperti halnya dalam kultur fase inisiasi, di dalam media harus terkandung mineral, gula, vitamin, dan hormon dengan perbandingan yang dibutuhkan secara tepat. Hormon yang digunakan untuk merangsang pembentukan tunas tersebut berasal dari golongan sitokinin seperti BAP, 2-iP, kinetin, atau thidiadzuron (TDZ) (Jumroh, 2013). Eksplan
Umumnya bagian tanaman yang digunakan sebagai eksplan adalah jaringan muda yang sedang tumbuh aktif. Jaringan tanaman yang masih muda mempunyai daya regenerasi lebih tinggi, sel-selnya masih aktif membelah diri, dan relatif lebih bersih (mengandung lebih sedikit kontaminan) (Yusnita, 2003).
Sumber asal eksplan dapat mempengaruhi pertumbuhan dan potensial morfogenetiknya. Eksplan yang berasal dari satu jenis organ misalnya, juga diketemukan adanya keragaman dalam regenerasinya. Ukuran eksplan untuk dikulturkan juga mempengaruhi keberhasilannya. Ukuran yang terlampau kecil akan kurang daya tahannya bila dikulturkan, sementara bila terlampau besar akan sulit mendapatkan eksplan yang steril. Setiap jenis tanaman maupun organ memiliki ukuran eksplan yang optimum untuk dikulturkan (Armini et al., 1992).
Fase multiplikasi dapat dibedakan atas multiplikasi awal, yang merupakan subkultur pertama setelah kultur primer, serta multiplikasi tahap lanjut yang merupakan subkultur kedua dan seterusnya. Pada fase multiplikasi awal, bahan tanam karet adalah eksplan dari pembibitan tanaman karet yang memasuki tahap akhir pada kultur primer.
Dengan demikian eksplan dapat terdiri dari 3 macam, yakni : stock explant (S), nodal explant (N), dan shoots (ST). Multiplikasi dilaksanakan melalui pemisahan masing-masing jenis eksplan pada setiap akhir periode kultur dan kemudian dikulturkan kembali pada media yang sesuai. Tahapan ini dapat dilakukan secara berulang-ulang yang ditujukan untuk memperbanyak jumlah tanaman (Haris et al., 2009).
nodus (node) dan bermacam-macam eksplan. Meristem, apex dan nodus dapat dikulturkan menjadi tunas. Tunas yang dihasilkan selanjutnya dapat digunakan sebagai sumber untuk menghasilkan tunas-tunas baru dengan menggunakan percabangan axilari. Tunas-tunas tersebut kemudian dapat dikembangkan lebih lanjut sehingga terbentuk perakaran dan akhirnya menjadi planlet (Fitriani, 2008).
Menurut Debergh dan Zimmerman (1991) banyak mikropropagasi menggunakan eksplan dari tunas apikal dan aksilar. Hanya dalam jumlah terbatas dari bagian tanaman yang digunakan sebagai eksplan lain, seperti daun dan bunga (Purwanto, 2008).
Perbanyakan tanaman karet dengan teknik microcutting memerlukan sumber eksplan yang juvenil. Sumber eksplan untuk teknik microcutting tanaman karet harus dipersiapkan dalam kondisi benar-benar juvenil. Oleh karena itu pendekatan awal dilakukan melalui penyediaan batang bawah klonal tanaman karet. Setelah pendekatan tersebut dibuktikan, konsep selanjutnya perlu disusun dan dilaksanakan, yakni pada target klon-klon yang sudah direkomendasikan dan terbukti memilih sifat-sifat unggul di lapangan (Haris et al., 2009).
Media Kultur Jaringan
Media kultur merupakan salah satu faktor penentu keberhasilan perbanyakan tanaman secara kultur jaringan. Media kultur tersebut, fisiknya dapat berbentuk cair atau padat. Komponen media kultur yang lengkap sebagai berikut : 1. Air distilasi (akuades) atau air bebas ion sebagai pelarut atau solve
2. Hara makro dan mikro
5. Zat Pengatur Tumbuh
6. Suplemen berupa bahan-bahan alami, jika diperlukan 7. Agar-agar atau gelrite sebagai pemadat media
(Yusnita, 2003).
Media yang digunakan merupakan faktor yang mendukung keberhasilan dalam kultur. Media yang digunakan dapat berbentuk padat, semi padat, dan cair. Proses pengakaran lebih baik dilakukan dalam media padat sampai terbentuk tanaman lengkap. Pembentukan bagian tanaman (morfogenesis) langsung maupun tidak langsung tergantung pada jenis dan konsentrasi yang tepat dari senyawa organik, anorganik dan zat pengatur tumbuh dalam suatu media kultur (Wattimena et al., 1992).
Kesuksesan kegiatan kultur jaringan akan sangat ditentukan dan tergantung oleh pilihan media yang digunakan. Harus diingat bahwa teknik kultur jaringan menekankan lingkungan yang cocok agar eksplan dapat tumbuh dan berkembang. Secara umum kebutuhan nutrisi kebanyakan tanaman sama, tetapi secara khusus hal tersebut berbeda. Kesamaannya adalah tanaman memerlukan hara makro dan mikro, vitamin-vitamin, karbohidrat (gula), asam amino dan N-organik, zat pengatur tumbuh, zat pemadat dan kadang ada penambahan bahan-bahan. Kebutuhan tiap tanaman berbeda pada hal komposisi dan jumlah yang diperlukan (Santoso dan Nursandi, 2001).
tinggi dan senyawa N dalam bentuk NO3- dan NH4+. Medium dasar Woody Plant Medium (WPM) dan Anderson digunakan untuk menanam tanaman
dari eksplan yang keras, umumnya digunakan untuk ta