ABSTRAK
DAVID KUSMAWAN. Identifikasi Cacing Parasitik Pada Insang dan Gambaran Leukosit Ikan Bawal Air Tawar (Colossoma macropomum) di Kabupaten Bogor. Dibimbing oleh RISA TIURIA DAN DAMIANA RITA E.
Penelitian ini bertujuan untuk mengidentifikasi cacing parasit pada Colossoma macropomum dan melihat hubungan antara infestasi cacing dengan gambaran hematologi Colossoma macropomum. Penelitian ini menggunakan 30 sampel dari Situ Daun, Ciampea, dan Cibitung Tengah. Organ yang diperiksa adalah insang dan usus. Prevalensi cacing parasit menunjukkan bahwa di Situ Daun adalah 100%, Ciampea 70%, dan Cibitung Tengah 50%. Cacing parasit yang diidentifikasi dari insang adalah subclass dari monogenea, family Diplectanidae, Oncocleidus sp, dan Tetraonchus sp. Tingkat eosinofil meningkat karena infeksi cacing parasit.
IDENTIFIKASI CACING PARASITIK PADA INSANG DAN
GAMBARAN LEUKOSIT IKAN BAWAL AIR TAWAR
(Colossoma macropomum) DI KABUPATEN BOGOR
DAVID KUSMAWAN
FAKULTAS KEDOKTERAN HEWAN
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN SUMBER
INFORMASI
Dengan ini saya menyatakan bahwa Skripsi dengan Judul “ Identifikasi Cacing Parasitik Pada Insang dan Gambaran Leukosit Ikan Bawal Air Tawar (Colossoma macropomum) di Kabupaten Bogor” adalah karya saya sendiri dan
belum pernah diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal dari karya yang diterbitkan maupun yang tidak diterbitkan dari penulis lain disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir Skripsi.
Bogor, Januari 2012
ABSTRACT
This research was aimed to identify the parasitic worm on the Colossoma macropomum and see the relationship between the infestation of worm with the hematology of Colossoma macropomum. This research used 30 samples from Situ Daun, Ciampea, and Cibitung Tengah. The organ which examined were the gills and the intestines. The prevalence of parasitic worm showed that in Situ Daun was 100%, Ciampea 70%, and Cibitung Tengah 50%. Parasitic worm that identified from gills were a subclass of monogenea, Diplectanidae family, Oncocleidus sp, and Tetraonchus sp. The level of eosinophil was increased because of infection of parasitic worm.
ABSTRAK
DAVID KUSMAWAN. Identifikasi Cacing Parasitik Pada Insang dan Gambaran Leukosit Ikan Bawal Air Tawar (Colossoma macropomum) di Kabupaten Bogor. Dibimbing oleh RISA TIURIA DAN DAMIANA RITA E.
Penelitian ini bertujuan untuk mengidentifikasi cacing parasit pada Colossoma macropomum dan melihat hubungan antara infestasi cacing dengan gambaran hematologi Colossoma macropomum. Penelitian ini menggunakan 30 sampel dari Situ Daun, Ciampea, dan Cibitung Tengah. Organ yang diperiksa adalah insang dan usus. Prevalensi cacing parasit menunjukkan bahwa di Situ Daun adalah 100%, Ciampea 70%, dan Cibitung Tengah 50%. Cacing parasit yang diidentifikasi dari insang adalah subclass dari monogenea, family Diplectanidae, Oncocleidus sp, dan Tetraonchus sp. Tingkat eosinofil meningkat karena infeksi cacing parasit.
© Hak Cipta milik IPB, tahun 2012 Hak Cipta dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah, dan pengutipan tersebut tidak merugikan kepentingan yang wajar IPB.
IDENTIFIKASI CACING PARASITIK PADA INSANG DAN
GAMBARAN LEUKOSIT IKAN BAWAL AIR TAWAR
(Colossoma macropomum) DI KABUPATEN BOGOR
DAVID KUSMAWAN
Skripsi
Sebagai salah satu syarat untuk memperoleh gelar Sarjana
Kedokteran Hewan pada Fakultas Kedokteran Hewan
Institut Pertanian Bogor
FAKULTAS KEDOKTERAN HEWAN
INSTITUT PERTANIAN BOGOR
Judul Skripsi : Identifikasi Cacing Parasitik Pada Insang dan Gambaran Leukosit Ikan Bawal Air Tawar (Colossoma macropomum) di Kabupaten Bogor
Nama : David Kusmawan NIM : B04070085
Disetujui :
Dr.drh Risa Tiuria, MS NIP 19630430 198703 2 001
Dr.drh Damiana R.E., MS NIP19620212 198601 2 001
Diketahui,
Wakil Dekan Fakultas Kedokteran Hewan Institut Pertanian Bogor
drh.H.Agus Setiyono, MS, PhD,APVet NIP 19630810 198803 1 004
RIWAYAT HIDUP
Penulis dilahirkan di Ponorogo pada tanggal 26 April 1988 sebagai anak kedua dari tiga bersaudara dari Bapak Damun, S.Pd dan Ibu Marmi, S.Pd. Pendidikan dasar ditempuh di SDN Bedikulon 02 dan SDN Padas pada tahun 1995-2001, kemudian dilanjutkan pada pendidikan menengah di SMPN 1 Ponorogo dari tahun 2001-2004. Pendidikan menengah atas di tempuh di SMAN 1 Ponorogo dari tahun 2004-2007.
PRAKATA
Puji syukur alhamdulillah penulis panjatkan kepada Allah SWT atas segala nikmat, rahmat, dan karunia yang begitu besar sehingga penulis dapat menyelesaikan skripsi yang berjudul Identifikasi Cacing Parasitik Pada Insang dan Gambaran Leukosit Ikan Bawal Air Tawar (Colossoma macropomum) di Kabupaten Bogor. Skripsi ini diajukan sebagai syarat untuk memperoleh gelar Sarjana Kedokteran Hewan dari Fakultas Kedokteran Hewan, Institut Pertanian Bogor. Penulis memilih topik penelitian ini didasarkan atas ketertarikan penulis untuk mengetahui jenis cacing parasitik yang terdapat pada ikan bawal air tawar (Colossoma macropomum).
Penulis menyadari sepenuhnya bahwa penulisan skripsi ini masih mempunyai kekurangan. Penulis mengucapkan terima kasih yang sebesar-besarnya kepada semua pihak yang telah membantu dalam perbaikan dan penulisan skripsi ini. Akhir kata semoga skripsi ini bermanfaat buat pengembangan ilmu pengetahuan dan bagi para pembaca.
Bogor, Januari 2012
UCAPAN TERIMA KASIH
Puji syukur atas segala nikmat, limpahan rahmat, serta karuniaNya yang senantiasa diberikan selama perjalanan di dalam proses penulisan skripsi ini. Shalawat serta salam senantiasa penulis haturkan kepada Rasulullah beserta para keluarga dan sahabat semoga kita bisa istiqomah di dalam mengamalkan risalahnya.
Pada kesempatan ini penulis ingin menyampaikan ucapan terima kasih yang sebesar- besarnya kepada :
1. Dr. Drh Risa Tiuria MS selaku dosen pembimbing skripsi I dan Dr. Drh Damiana Rita Ekastuti MS selaku dosen pembimbing skripsi II atas bimbingan, saran, motivasi yang begitu luar biasa.
2. Dr.Drh. Huda S Darusman, M.Si selaku dosen pembimbing akademik yang selalu memberikan inspirasi, arahan dan motivasi selama penulis melaksanakan perkuliahan.
3. Orang tua tercinta Bapak Damun dan Ibu Marmi atas lantunan doa, nasehat, dan dukungan yang begitu besar untuk menyelesaikan skripsi ini.
4. Teman seperjuangan di Kastil Ummi (akh Aminudi, Syuhada, Huda, Yusuf, Abas, Angger, Pandu, kak Miqdham, kak Bima, kak Hasan)
5. Teman kost HAMAS (Arief, Ali, Budi, kak Andi, Dimas)
6. Tim Bondo Nekat RENEWS2010 Jerman ( mbak Desty, ukhti Didi, ukhti Dini, Fia, dan akh Rahman)
7. Teman satu penelitian Arsi dan mbak Lia atas semangat dan kerjasama selama penelitian sampai akhir.
8. Teman-teman Gianuzzi 44 atas kebersamaan, inspirasi, motivasi dan semangat yang luar biasa.
9. Kak Wanda Ali Akbar (Lemigas Kementerian ESDM RI), mas Adit “preman2 Al-Fallah, serta Bang Ipon I4 (Ikatan Ilmuwan Indonesia Internasional) yang sangat menginspirasi dalam penyelesaian skripsi ini. 10. Staf laboratorium (Pak Eman dan Ibu Irawati) atas bantuannya selama
11. Semua pihak yang terlibat dalam penyelesain skripsi ini baik secara langsung
maupun tidak langsung, semoga Allah membalas semua kebaikan yang telah
dilakukan.
Bogor, Januari 2012
DAFTAR ISI
Klasifikasi Ikan Bawal (Colossoma macropomum) ... 3Morfologi Ikan Bawal (Colossoma macropomum) ... 4
Anatomi Fisiologi Ikan Bawal (Colossoma macropomum) . ... 5
Parasit Pada ikan Air Tawar... 6
Pengambilan Saluran Pencernaan dan Insang ... 19
Metode Pewarnaan ... 19
Identifikasi Jenis Cacing Parasitik ... 20
Pengamatan Differensial Leukosit ... 20
Analisa Data Tingkat Infeksi ... 21
HASIL DAN PEMBAHASAN Prevalensi Kecacingan Ikan Bawal Air Tawar... 22
Klasifikasi Cacing Parasitik... 23
Identifikasi Cacing Parasitik... 26
Karakteristik Cacing Parasitik... 27
DAFTAR TABEL
Halaman
1 Tingkat prevalensi kecacingan pada ikan bawal air tawar(Colossoma macropomum) di Bogor... 22
2 Jenis Cacing Pada Insang Ikan Bawal Air Tawar (Colossoma
macropomum)... 23
3 Jumlah Cacing Pada Insang Ikan Bawal Air Tawar (Colossoma
macropomum) wilayah tambak Daerah Situ Daun...……... 24
4 Jumlah Cacing Pada Insang Ikan Bawal Air Tawar (Colossoma
macropomum) dari wilayah tambak Daerah Ciampea ... 25
5 Jumlah Cacing Pada Insang Ikan Bawal Air Tawar (Colossoma
DAFTAR GAMBAR
1 Ikan Bawal ( Colossoma macropumum)... 04
2 Familli Monogenea... 08
3 Contoh familli Monogena Tetraonchus sp... 09
4 Contoh familli Cleidodiscus sp... 09
5 Trombosit pada ikan... 11
6 Limfosit pada darah ikan... 14
7 Monosit pada darah ikan... 15
8 Heterofil pada darah ikan... 16
9 Tetraonchus sp……... 27
10 Diplectanum sp ……... 28
11 Oncocleidus sp ………... 29
12 Sub Kelas Monogenea……... 30
DAFTAR LAMPIRAN
Halaman
1 Prevalensi Kecacingan di Tambak Situ Daun …...…… 41
2 Prevalensi Kecacingan di Tambak Ciampea... 41
BAB I
PENDAHULUAN
Latar Belakang
Ikan bawal air tawar (Colossoma macropomum) merupakan salah satu komoditas perikanan yang bernilai ekonomis cukup tinggi. Ikan ini tergolong ke dalam Famili Characidae dan genus Colossoma. Pada mulanya ikan bawal air tawar (Colossoma macropomum) diperdagangkan sebagai ikan hias, namun karena memiliki pertumbuhan yang relatif cepat dan rasa daging yang enak, maka masyarakat menjadikan ikan tersebut sebagai ikan konsumsi.
Meningkatnya kegemaran masyarakat mengkonsumsi ikan menyebabkan banyak konsumen mulai menyukai ikan bawal air tawar (Colossoma macropomum). Hal ini secara tidak langsung mendorong suplai ikan bawal untuk
konsumsi semakin meningkat.
Namun seperti makhluk hidup lainnya, ikan juga tidak pernah bebas dari ancaman berbagai jenis penyakit dan salah satu penyebab penyakit tersebut adalah parasit. Menurut Noble dan Noble (1989), parasit adalah organisme yang hidupnya dapat menyesuaikan diri dengan inang definitifnya tetapi merugikan bagi organisme yang ditempatinya.
Tujuan Penelitian
Penelitian ini bertujuan untuk mengidentifikasi jenis cacing parasitik yang terdapat pada insang ikan bawal air tawar (Colossoma macropomum) dan mengetahui tingkat infeksi cacing parasitik di tiga wilayah tambak ikan bawal (Colossoma macropomum) di daerah Situ Daun, Ciampea, dan Cibitung Tengah, serta mengetahui gambaran hematologi pada ikan bawal air tawar (Colossoma macropomum) yang terinfeksi cacing parasitik.
Manfaat Penelitian
BAB II
TINJAUAN PUSTAKA
A. Klasifikasi Ikan Bawal (Colossoma macropomum)
Klasifikasi dan tatanama ikan bawal air tawar (Colossoma macropomum) menurut Saanin (1984) adalah sebagai berikut :
Filum : Chordata Subfilum : Craniata Kelas : Pisces Subkelas : Neopterigii Ordo : Cypriniformes Subordo : Cyprinoidea Famili : Characidae Genus : Colossoma
Species : Colossoma macropomum
Ikan bawal air tawar (Colossoma macropomum) memiliki badan agak bulat, bentuk tubuh pipih, sisik kecil, kepala hampir bulat, lubang hidung agak besar, sirip dada di bawah tutup insang, sirip perut dan sirip dubur terpisah, punggung berwarna abu-abu tua, serta perut putih abu-abu dan merah (Saint-paul dalam Supriatna, 1998). Ikan bawal air tawar (Colossoma macropomum) memilki
oksigen terlarut kurang dari 0,5 mg O2/l masih memungkinkan ikan ini dapat bertahan selama beberapa jam (Djarijah 2001). Ikan bawal air tawar (Colossoma macropomum) termasuk jenis ikan omnivor (Saint-paul dalam Supriatna, 1998).
Ikan bawal air tawar (Colossoma macropomum) bersifat kanibal pada saat stadium larva. Jadi pada saat fase tersebut larva tidak boleh kekurangan makanan karena sifat kanibalnya akan muncul (Arie 2000).
Gambar 1 Ikan bawal air tawar (Colossoma macropomum) (koleksi pribadi)
B. Morfologi Ikan Bawal Air Tawar (Colossoma macropomum)
Dari arah samping, tubuh ikan bawal tampak membulat (oval) dengan perbandingan antara panjang dan tinggi 2 : 1. Bila dipotong secara vertikal, bawal memiliki bentuk tubuh pipih (compressed) dengan perbandingan antara tinggi dan lebar tubuh 4:1. Bentuk tubuh seperti ini menandakan gerakan ikan bawal tidak cepat seperti ikan lele atau grass carp, tetapi lambat seperti ikan gurame dan tambakan. Sisiknya kecil berbentuk ctenoid, di mana setengah bagian sisik belakang menutupi sisik bagian depan. Warna tubuh bagian atas abu-abu gelap, sedangkan bagian bawah berwarna putih. Pada ikan bawal dewasa, bagian tepi sirip perut, sirip anus dan bagian bawah sirip ekor berwarna merah. Warna merah ini merupakan ciri khusus ikan bawal tawar (Colossoma macropomum) sehingga oleh orang Inggris dan Amerika disebut red bally pacu (Arie 2000).
sedangkan jari-jari lainnya lemah. Sirip punggung pada ikan bawal air tawar (Colossoma macropomum) terletak agak ke belakang. Sirip dada, sirip perut dan sirip anus kecil dan jarinya lemah. Demikian pula dengan sirip ekor, jari-jarinya lemah tetapi berbentuk cagak (Arie 2000).
Ikan bawal air tawar (Colossoma macropomum) atau lebih dikenal dengan sebutan tambaqui adalah ikan introduksi yang berasal dari Amerika Latin, terutama dari Brazil. Ikan ini merupakan ikan yang potensial untuk dibudidayakan karena berbagai kelebihannya. Ikan ini mempunyai tingkat kelangsungan hidup yang tinggi (hingga 90%) dan dapat dipelihara dalam kolam dengan kepadatan yang tinggi. Ikan bawal air tawar hidup bergerombol di daerah yang aliran sungainya deras, tetapi ditemukan pula di daerah yang airnya tenang, terutama saat masih dalam kondisi benih. Di habitat asalnya, ikan ini ditemukan di sungai Orinoco di Venezuela dan sungai Amazon di Brazil (Arie 2000).
Di dalam negeri sendiri ikan bawal tawar (Colossoma macropomum) mulai digemari oleh berbagai kalangan masyarakat, terutama di Jawa Barat, DKI Jakarta, Jawa Tengah dan Jawa Timur. Dari keempat provinsi tersebut, Jawa Barat dapat dikatakan sebagai pelopor karena di provinsi inilah ikan bawal tawar pertama kali dikembangkan. Dalam satu musim tidak kurang 500 juta ekor benih dijual ke berbagai provinsi di Indonesia. Indonesia juga mengekspor ikan bawal dalam ukuran kecil atau sebagai ikan hias ke negara Hongkong dan Amerika. Sampai saat ini baru sekitar 10 % dari seluruh permintaan dapat dipenuhi (Arie 2000).
C. Anatomi dan Fisiologi Ikan Sistem Respirasi
pengeluaran limbah-limbah yang mengandung nitrogen. Kerusakan struktur yang ringan sekalipun dapat mengganggu proses pengaturan osmosis dan kesulitan di dalam pernafasan (Nabib dan Pasaribu 1989). Insang mempunyai beberapa glandula yang disebut dengan glandula brankhial. Glandula brankhial merupakan sel-sel epitel insang yang mengalami diferensiasi.
Sistem Pencernaan
Sistem pencernaan ikan pada dasarnya terdiri dari dua bagian yaitu saluran pencernaan dan kelenjar pencernaan. Setiap spesies ikan mempunyai bermacam-macam variasi saluran cerna dan kelenjarnya. Saluran pencernaan ikan terdiri dari rongga mulut, pharing, esofagus, lambung, dan usus (Hibiya 1995). Lambung ikan pada umumnya berbentuk sigmoid yang melengkung dengan banyak lipatan pada dinding dalamnya (Roberts 2001).
D. Parasit Pada Ikan Air Tawar
Parasit yang sering menyerang ikan air tawar setidaknya ada tujuh macam yaitu protozoa, coelenterata, trematoda, cestoda, moluska, dan arthropoda (Markevich 1963). Parasit yang biasa menyerang ikan yang dibudidayakan di kolam termasuk ikan bawal (Colossoma macropomum) adalah protozoa dan cacing.
tanpa bintik mata, ujung kepala seperti huruf V serta memiliki organ untuk menempel (opisthohaptor) dengan dua anchor (kait yang berbentuk seperti jangkar). Setiap anchor memiliki rata-rata 16 kait kecil. Cacing dewasa bersifat vivipar, yaitu melepaskan larva yang berbentuk seperti cacing dewasa. Larva ini akan menempel pada insang atau kulit ikan.
Cacing dewasa Dactylogyrus memiliki dua atau empat bintik mata dan memiliki alat menempel yang berbentuk jangkar (opisthohaptor). Dactylogyrus bersifat ovipar sehingga cacing dewasa akan melepaskan telur yang akan menetas menjadi larva. Larva Dactylogyrus memiliki bulu getar sebagai alat gerak di air untuk menuju insang (Markevich 1963).
Dactylogyrus cenderung melekat pada insang dengan haptor, menginfeksi
hampir semua ikan air tawar terutama cryprinid. Hal ini akan merangsang sekresi mukus yang berlebihan dan dapat menyebabkan tepi lamella insang tercabik atau luka. Pada infeksi yang beratt akan mengganggu penyerapan oksigen sehingga ikan akan kekurangan oksigen. Dactylogyrus membebaskan telur ke kolam kemudian menetas menjadi larva berbulu getar yang berenang bebas hingga menemukan inang yang sesuai. Waktu yang diperlukan dari telur hingga menjadi individu dewasa sangat tergantung suhu, pada suhu 8,5 sampai 9 ºC hanya memerlukan waktu beberapa hari, adapun pada suhu yang lebih rendah akan berlangsung beberapa minggu hingga beberapa bulan (Irianto 2005). Trematoda dari ordo Digenea juga ada yang menyerang ikan air tawar. Digenea berbeda dengan Monogenea karena memiliki siklus hidup yang tidak langsung, sehingga memerlukan inang antara dalam siklus hidupnya (Paperna 1996).
Monogenea
Kelas Monogeneasida (Gambar 2) sebagian besar merupakan cacing ektoparasit pada ikan dan amfibia. Siklus hidup cacing ini bersifat langsung atau tidak memerlukan inang antara dalam melangsungkan hidupnya. Cacing daun muda mirip dengan cacing daun dewasa. Beberapa spesies cacing ini hidup di rongga insang, rongga mulut, kandung kemih, kloaka, ureter, atau rongga tubuh hospesnya (Levine 1994).
Daur hidup Monogenea tidak melibatkan lebih dari satu inang. Cacing parasitik dewasa menempel pada inang menggunakan alat penempel yang disebut haptor atau opishaptor dan haptor yang terletak di ujung anterior disebut prohaptor. Organ ini mempunyai satu atau lebih batil hisap yang berfungsi untuk
melekatkan diri pada inang. Semakin banyak jumlah batil hisap, bagian posterior tubuh semakin besar dan berbentuk piring. Saluran pencernaan terdiri atas mulut, faring, esophagus dan usus. Mulut cacing parasitik ini terletak di anterior tubuh cacing. Usus berbentuk sederhana dengan kantong-kantong buntu kecil. Sebagian besar cacing golongan monogenea terutama menghsiap darah inag terkadang memakan lendir dan sel-sel epitel. Cacing ini termasuk hermafrodit (Noble dan Noble 1989)
Gambar 3. Tetraonchus
Gambar 4. Cleidodiscus sp.
E. Bakteri pada ikan
Beberapa bakteri pada ikan yang dapat menimbulkan penyakit antara lain Renibacterium salmoninarum yang menyebabkan bacterial kidney disease (BKD),
dua jenis bakteri gram positif yang merupakan bakteri patogen yang penting adalah Enterococcus seriolicida dan Streptococcus iniae, Mycobacterium penyebab Mycobacteriosis dan Nocardia sebagai penyebab Nocardiosis. Aeromonas salmonicida, Aeromonas hydrophila, serta Yersini ruckeri yang dapat
menyebabkan Enteric redmouth disease. Vibrio spp yang bisa menyebabkan Vibriosis. Flavobacterium spp sebagai penyebab penyakit Flavobakterial. Pesudomonas merupakan bakteri yang pada umumnya dapat bersifat aportunistik
patogen atau menyebabkan infeksi sekunder. Serratia dan Proteus yang bersifat oportunistik patogen, bakteri asam laktat seperti Lactobacillus atau Carnobacterium yang dapat menyebabkan penyakit pada ikan (Woo dan Bruno
F. Sistem Sirkulasi
Pemeriksaan darah penting artinya untuk membantu dalam meneguhkan diagnosa suatu penyakit. Penyimpangan fisiologis ikan akan menyebabkan terjadinya perubahan pada komponen-komponen darah (Wedemeyer 1990). Perubahan gambaran darah, baik secara kuantitatif maupun kualitatif dapat menentukan kondisi atau status kesehatan ikan (Wedemeyer 1990). Studi tentang hematologi dalam ikan juga telah diasumsikan lebih penting karena parameter ini merupakan indeks yang efektif dan sensitif untuk memonitor perubahan fisiologis dan patologis yang disebabkan oleh faktor-faktor seperti infeksi jamur, bakteri atau pencemaran sumber daya air. (Dick dan Dixon 2000).
Darah merupakan bagian penting dari sistem transpor di dalam tubuh. Darah merupakan jaringan berbentuk cair yang dialirkan melalui saluran vaskular, yang terdiri atas dua komponen yaitu plasma dan sel-sel darah. Darah ikan tersusun atas cairan plasma dan sel-sel darah yang terdiri dari sel darah merah (eritrosit), sel darah putih (leukosit), dan keping darah (trombosit). Di dalam plasma darah terkandung garam-garam organik (natrium klorida, natrium bikarbonat, dan natrium fosfat), protein (dalam bentuk albumin, globulin, dan fibrinogen), lemak (dalam bentuk lesitin dan kolesterol) serta zat-zat lainnya misalnya hormon, vitamin, enzim, dan nutrien (Affandi dan Tang 2002).
Darah mempunyai fungsi sebagai transport nutrien, oksigen dan karbondioksida, menjaga keseimbangan suhu tubuh dan berperan penting di dalam sistem pertahanan tubuh ( Rastogi 1997 dalam Ariaty 1991). Secara fungsional trombosit berperan dalam pembekuan darah. Monosit berfungsi sebagai makrofag, serta limfosit berfungsi sebagai penghasil antibodi untuk melawan antigen yang masuk ke dalam tubuh dan neutrofil mempunyai fungsi fagositik (Yasutake dan Wales 1983 dalam Affandi dan Tang 2002).
Trombosit
mempunyai ukuran rata-rata 4x7 μm sampai 5x13 μm (Chinabut et al. 1991). Roberts dan richard (1978) menyatakan bahwa trombosit mampu menghasilkan tromboplastin yaitu enzim yang membuat polimeri dan fibrinogen yang berperan penting di dalam proses pembekuan darah. Jika ditemukan jumlah trombosit yang meningkat di dalam darah berarti ada indikator ikan dalam proses penyembuhan luka.
Gambar 5. Trombosit pada darah ikan Eritrosit
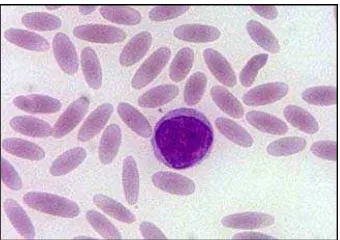
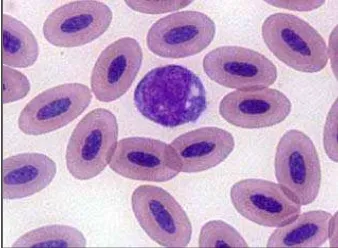
Eritrosit pada ikan berinti, berbentuk oval dengan kedua ujungnya membulat (Canfield 2006). Eritrosit yang sudah matang berukuran panjang 13-16 mikron dan lebar 7-10 mikron. Eritrosit mempunyai sitoplasma yang homogen dengan ulasan pewarnaan Giemsa. Inti eritrosit terletak di tengah-tengah, berbentuk oval, berwarna merah keunguan dan mempunyai kromatin yang kompak (Affandi dan Tang 2002). Ukuran sel yang belum matang lebih kecil dibandingkan dengan sel yang sudah matang (Canfield 2006). Eritrosit mengandung hemoglobin yang ditemukan pada seluruh jenis ikan kecuali pada ikan Chaenichthydae (ice fish) dan larva ikan sidat (Leptocephalus larvae), dimana pada ikan tersebut darah tidak berwarna. Secara umum eritrosit ikan mempunyai ukuran yang berbeda-beda untuk setiap spesiesnya (Affandi dan Tang 2002).
G. Sistem Pertahanan Tubuh Ikan
perubahan dari kondisi normal karena beberapa penyebab, yaitu penyebab dari dalam (internal) dan penyebab dari luar tubuh (eksternal) (Yuasa 2003). Penyakit pada hewan perairan dapat disebabkan oleh cacat genetik, cedera fisik, kesetidakimbangan nutrisi, benda asing dan polusi (Kinne 1980).
Penyakit ikan pada umumnya disebabkan oleh kontaminasi yang berasal dari luar tubuh (eksternal) yang terbagi atas dua, yaitu penyakit yang bersifat infeksius dan non infeksius. Penyakit non infeksius dipengaruhi oleh lingkungan, yang meliputi suhu dan kualitas air (pH, kelarutan gas, zat beracun). Penyakit infeksius bisa disebabkan oleh virus, jamur, bakteri dan parasit. Penyakit internal adalah penyakit yang disebabkan oleh faktor genetik, imunodefisiensi, saraf dan metabolik (Yuasa 2003).
Ikan memiliki sistem pertahanan tubuh untuk melawan berbagai macam penyakit. Pertahanan tubuh ikan terbagai menjadi dua sistem yaitu pertahanan non spesifik dan spesifik (Kamiso 2001). Pertahanan non spesifik merupakan pertahanan tubuh terdepan dalam menghadapi serangan berbagai mikroorganisme yang masuk karena dapat memberikan respon langsung terhadap antigen.
Respon pertahanan ikan terdiri atas respon humoral dan respon selular (Anderson 1974). Respon pertahanan tubuh seluler bersifat non spesifik yang terdiri dari sel makrofag, leukosit dan Natural Killer (NK) sel (Ellis 1978). Sistem pertahanan tubuh ikan yang mula-mula berfungsi pada awal kehidupan sistem pertahanan non-spesifik. Pertahanan non spesifik terdiri dari pertahanan pertama yaitu kulit, sisik, dan lendir (Kamiso 2001). Sisik dan kulit merupakan pelindung fisik yang melindungi ikan dari kemungkinan luka dan berperan sangat penting dalam mengendalikan osmolaritas tubuh. Kerusakan sisik dan kulit akan mempermudah agen patogen menginfeksi inang (O’Donnell et al. 1994). Sistem pertahanan tubuh kedua pada ikan yaitu darah. Pertahanan spesifik ikan baru berkembang dan berfungsi dengan baik pada umur beberapa minggu setelah telur menetas. Sistem pertahanan spesifik disebut juga sebagai respon humoral yang merupakan sistem pertahanan ketiga dan yang berperan adalah antibodi (Kamiso 2001).
disebabkan oleh penanganan yang kurang baik pada saat pemindahan ikan, perawatan atau pemanenan yang menyebabkan hilangnya mukus. Faktor lain penyebab stress pada ikan yaitu penurunan suhu air yang ekstrim yang akan mengganggu kemampuan ikan dalam melepaskan antibodi secara cepat untuk melawan benda asing ( Selye 1973).
Leukosit
Leukosit memiliki jumlah yang lebih sedikit dibandingkan dengan sel darah merah, yaitu berkisar antara 20.000/mm3 sampai 150.000/mm3 (Moyle dan Cech 1988). Bentuk sel darah putih menurut Lagler et al. (1977) adalah berbentuk lonjong sampai bulat. Guyton dan Hall (1999) melaporkan bahwa leukosit terdiri dari agranulosit (monosit dan limfosit) dan granulosit (heterofil, eosinofil dan basofil).
Leukosit mempunyai fungsi yang erat kaitannya dengan eliminasi benda asing termasuk mikroorganisme patogen. Faktor-faktor yang mempengaruhi jumlah leukosit adalah kondisi dan kesehatan tubuh ikan (Moyle dan Cech 1998). Infiltrasi granulosit muncul 12-24 jam setelah diinjeksi oleh bakteri pada ikan ranbow trout. Setelah itu persentase granulosit dan makrofag akan meningkat hingga 2 sampai 4 hari (Van Muiswinkel dan Vervoorn 2006).
Limfosit
Gambar 6. Limfosit pada darah ikan
www.vet.uga.edu
Seperti pada mamalia, ikan juga memiliki sel T dan sel B, dimana secara morfologi tidak dapat dibedakan jika menggunakan mikroskop cahaya. Kedua bentuk sel ini sama-sama mempunyai ukuran inti yang besar, yang mengisi hampir seluruh sel. Jumlah limfosit yang bersirkulasi pada ikan adalah 12x103 limfosit/mm3 (Ellis 1986 dalam Affandi dan Tang 2002).
Monosit
Monosit merupakan sel besar yang terdiri dari sitoplasma berwarna biru keabu-abuan hingga biru yang menempati sedikitnya sebagian isi sel. Bentuk intinya bervariasi, mulai dari bulat hingga oval dan bahkan kadang bertakuk atau berlekuk (Feldman et al. 2000).
Monosit pada umumnya ditemukan di dalam sirkulasi darah, dan dalam jumlah yang sedikit di limfonodus, limfa, sumsum tulang dan jaringan penunjang pada vertebrata yang lebih tinggi tingkatannya. Monosit bermigrasi dari sirkulasi darah menuju ke jaringan ketika menerima rangsangan yang sesuai dengan reseptornya. Monosit yang belum matang dapat meninggalkan sirkulasi darah, menuju dan menetap di jaringan, lalu berkembang menjadi matang yang dikenal sebagai sel fagositik makrofag (Ardelli dan Woo 2006).
Monosit pada umumnya memiliki bentuk tepi luar (outline) sel yang irregular hingga bentuk seperti psudopoda (Moyle dan Cech 1988). Lebih jauh
Gambar 7. Monosit pada darah ikan
www.vet.uga.edu
Heterofil
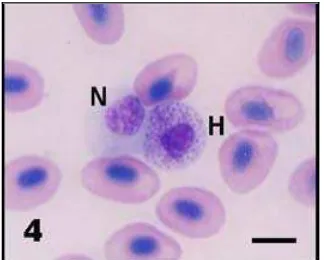
Heterofil adalah sel darah putih yang mengandung vakuola berisi lisozim untuk menghancurkan organisme yang telah difagosit. Heterofil berbentuk bundar dan berukuran besar (diameter berkisar antara 9-13µm) dengan jumlah sitoplasma yang besar dan mengandung granula. Sitoplasma berwarna biru cerah atau ungu pucat, sementara intinya berwarna biru gelap (Chinabut et al. 1991). Heterofil di dalam sirkulasi darah ikan berasal dari jaringan hematopoetik dalam ginjal dan juga limpa (Nabib dan Pasaribu 1989).
Istilah heterofil atau leukosit berinti polimorf berasal dari histologi pada manusia. Oleh karena butir-butir protoplasmanya tidak selalu berwarna netral, dan intinya tidak berkeping-keping, pada ikan dikenal dengan istilah heterofil. Persentase heterofil di dalam darah ikan berkisar antara 6-8% dari total leukosit yang bersirkulasi (Nabib dan Pasaribu 1989). Jumlah heterofil sangat bervariasi di antara spesies ikan ( Secombes 1996). Morfologi heterofil (polymorphonuclear leukocyte) pada ikan mirip dengan neutrofil pada mamalia. Jumlah heterofil pada
ikan teleost berbeda-beda (Robert dan Richard 1978). Heterofil sangat aktif dalam membunuh bakteri (Tagliasacchi dan Carboni 1997).
Gambar 8. Neutrofil dan Heterofil pada darah ikan
Eosinofil
Eosinofil atau sering disebut juga sebagai sel granular eosinofilik secara normal berada pada berbagai macam jaringan pada ikan. Sel ini berakumulasi ketika terjadi proses inflamasi, khususnya sebagai akibat infeksi parasit ( Feldmen et al. 2000).
Eosinofil mengandung sejumlah besar protein dasar dalam granulanya sehingga memberikan afinitas pada pencelupan asam. Eosinofil memiliki fungsi utama di dalam mensekresikan isi granularnya sebagai respon terhadap infeksi parasit (Ardelli dan Woo 2006).
Basofil
Persentase basofil di dalam darah ikan berkisar antara 0.17-0.194 % dan berukuran 8-12 µm (Affandi dan Tang 2002). Granula basofil bersifat basofilik. Granula berisi faktor kemotaksis eosinofil dan mediator hipersensitivitas tipe 1. Ketika ada rangsangan dari alergen yang menyebabkan terjadinya penempelan alergen pada basofil maka akan terjadi pelepasan isi kandungan basofil ( Ardelli dan Woo 2006).
METODOLOGI
Waktu dan Tempat Penelitian
Penelitian ini dilakukan pada bulan Oktober 2010 sampai bulan Juni 2011 di Laboratorium Helminthologi dan Entomologi Kesehatan Departemen Ilmu Penyakit Hewan dan Kesehatan Masyarakat Veteriner Fakultas Kedokteran Hewan Institut Pertanian Bogor.
Bahan dan Alat
Hewan yang digunakan dalam penelitian ini adalah ikan bawal air tawar (Colossoma macropomum) yang berjumlah 30 ekor yang diambil dari tiga lokasi tambak ikan bawal yang ada di Situ Daun, Ciampea, serta Cibitung Tengah dengan masing masing daerah dilakukan pengambilan sampel sebanyak 10 ekor secara acak. Bahan yang digunakan adalah NaCl fisiologis, etanol 70%, 85%, 95%, dan 100%, pewarna Acetocarmine, pewarna Giemsa 10%, xylol HCl, entellan dan aquades.
Alat Penelitian
Alat-alat yang digunakan dalam penelitian ini yaitu alat bedah/dissecting kit (gunting, scalpel, dan pinset) alas berupa gabus yang dilapisi plastik berwarna
hitam, cawan petri, lemari pendingin bersuhu 4 ºC, timbangan digital, tissue, mikroskop cahaya, mikroskop stereo dan video mikrometer, gelas obyek, cover glass, botol plastik film, dan kertas label.
Metode Penelitian
Pengambilan Sampel Ikan Bawal Air Tawar (Colossoma macropomum)
kemudian diberi aerasi dan selanjutnya dibawa ke laboratorium Helminthologi dan dimasukkan ke dalam akuarium selama satu-sampai dua hari dan diukur panjang dan bobotnya.
Pembuatan Preparat Ulas Darah, Pengambilan Cacing dari Insang dan Saluran Pencernaan
Sampel ikan bawal air tawar ditimbang terlebih dahulu dengan timbangan digital dan dilakukan pengukuran panjang tubuh ikan. Kemudian darah ikan diambil untuk membuat preparat ulas darah. Preparat ulas darah dibiarkan mengering di udara terbuka ( Samsi 2006). Sampel ikan bawal air tawar (Colossoma macropomum) ini kemudian dipreparasi dengan cara merusak bagian
otaknya kemudian langsung dipotong pada kepalanya. Bagian perut ikan disayat memanjang mulai dari kloaka sampai leher ikan. Insang dipisahkan, saluran pencernaan ikan dikeluarkan kemudian dimasukkan ke dalam cawan petri yang telah berisi larutan NaCl fisiologis. Insang yang telah dipisahkan dari bagian kepala serta saluran pencernaan yang telah disayat dimasukkan ke dalam NaCl fisiologis kemudian dilihat di bawah mikroskop stereo. Spesimen yang belum teramati disimpan kembali pada lemari pendingin bersuhu 4 ºC. Cacing parasitik yang dikoleksi dari insang dan saluran pencernaan ikan kemudian diisolasi dan disimpan pada botol yang telah diberi larutan NaCl fisiologis selama 8 jam di lemari pendingin bersuhu 4 ºC, kemudian dipindahkan ke dalam etanol 70% untuk dilakukan proses pewarnaan (Soulsby 1973)
Metode Pewarnaan
dibilas dengan ethanol 70% dan direndam dalam larutan asam alkohol ( 99 bagian ethanol 70% dan 1 bagian HCl). Setelah itu direndam selama 5 menit dengan alkohol secara bertahap untuk tujuan dehidrasi. Kemudian dilanjutkan dengan perendaman dalam xylol sampai spesimen terlihat transparan, kemudian spesimen difiksasi pada sediaan gelas obyek dengan bahan entellan sebagai media fiksasi.
Identifikasi Cacing Parasitik
Metode identifikasi cacing dilakukan setelah pewarnaan selesai. Spesimen yang telah diwarnai diamati di bawah mikroskop dan dilakukan identifikasi terhadap famili hingga genus dari sampel cacing. Di dalam identifikasi ini juga dilakukan pengukuran panjang dan lebar dari jenis cacing parasit yang ditemukan dengan menggunakan mikroskop. Identifikasi cacing dilakukan berdasarkan morfologi dan morfometri cacing dengan mengacu pada Yamaguti (1958), Grabda (1991), Woo (2006) dan Noble & Noble (1989).
Pengamatan Diferensiasi Leukosit
Pengamatan diferensiasi leukosit dilakukan untuk menentukan persentase tiap jenis leukosit yang ada di dalam darah. Pengamatan diferensial leukosit dilakukan dengan mengamati preparat ulas darah di bawah mikroskop. Pembuatan preparat ulas darah dilakukan dengan cara menempatkan setetes darah pada gelas obyek. Gelas obyek kedua diletakkan dengan sudut 45º di atas gelas obyek pertama, kemudian digeser ke belakang menyentuh darah sehingga darah menyebar.
Analisis Data Tingkat Infeksi
BAB IV
HASIL DAN PEMBAHASAN
Prevalensi Kecacingan Ikan Bawal Air Tawar (Colossoma macropomum)
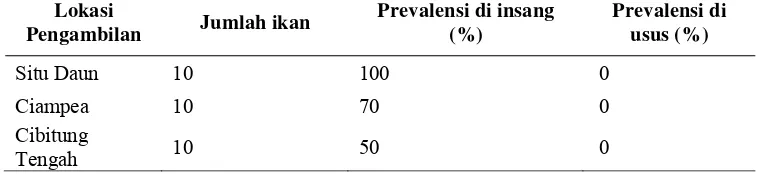
Tingkat prevalensi kecacingan pada ikan bawal air tawar dapat dilihat pada Tabel 1 di bawah ini.
Tabel 1. Tingkat prevalensi kecacingan pada ikan bawal air tawar (Colossoma macropomum) di Bogor.
Lokasi
Pengambilan Jumlah ikan
Prevalensi di insang
Tabel 1 di atas memperlihatkan perbedaan tingkat prevalensi di ketiga lokasi tambak. Perbedaan ini dimungkinkan oleh faktor intrinsik dan faktor ekstrinsik. Faktor intrinsik misalnya tingkat stress pada ikan bawal air tawar (Colossoma macropomum) yang tinggi sehingga menyebabkan sistem imun
menurun. Selain itu kekebalan individu, jenis kelamin, galur dan umur ikan juga merupakan faktor pendukung terjadinya kecacingan. Faktor ekstrinsik yang dapat menyebabkan tingginya prevalensi kecacingan di antaranya kondisi sanitasi tambak yang buruk, biosekuriti, dekatnya tambak dengan pemukiman, sistem pengairan dan sumber air kolam yang buruk.
Klasifikasi Cacing Parasitik pada Insang Ikan Bawal Air Tawar (Colossoma macropomum) di Tambak Situ Daun, Ciampea, dan Cibitung Tengah.
Hasil identifikasi cacing parasitik yang ditemukan pada insang ikan bawal air tawar (Colossoma macropomum) dikelompokkan ke dalam Fillum Plathyhelmintes dan Kelas Trematoda Sub Kelas Monogenea. Monogenea merupakan parasit yang umum ditemukan pada insang dan kulit ikan air tawar maupun air laut. Infestasi monogenea biasanya merupakan indikator sanitasi yang rendah pada kualitas air, seperti contoh tingginya amoniak dan nitrit, polusi bahan organik dan kadar oksigen yang rendah, dengan kondisi seperti tersebut monogenea dapat sangat cepat bereproduksi (Noga 2000). Klasifikasi cacing parasitik pada insang ikan bawal air tawar (Colossoma macropomum) dapat dilihat pada Tabel di bawah ini
Tabel 2. Jenis-jenis Cacing Pada Insang Ikan Bawal Air Tawar (Colossoma macropomum).
Kelas Subkelas Famili Genus
Trematoda Monogenea Tetraonchidae Tetraonchus sp
Trematoda Monogenea Diplectanidae Diplectanum sp
Trematoda Monogenea Oncocleidae Oncocleidus sp
Trematoda Monogenea -
Tabel 3. Jumlah Cacing Pada Insang Ikan Bawal Air Tawar (Colossoma macropomum) dari wilayah tambak Daerah Situ Daun.
Bobot Badan
(gram) Jumlah Cacing
Jumlah Ikan
Tabel 3 di atas menunjukkan tingkat kecacingan pada berbagai bobot badan ikan yang menjadi sampel penelitian. Jumlah cacing parasitik yang menginfeksi ikan bawal yang berasal dari tambak Situ Daun yang paling banyak terdapat pada bobot badan antara 40-50 gram dengan jumlah cacing 152 cacing dengan jumlah ikan 4 ekor. Jumlah cacing terbanyak kedua menginfestasi ikan dengan bobot badan antara 51-60 gram dengan jumlah cacing sebanyak 140 dengan jumlah ikan dengan kisaran bobot badan tersebut yang terinfeksi sebanyak 4 ekor. Dari data hasil yang diperoleh di atas dapat kita gambarkan bahwa jumlah cacing parasitik yang menginfeksi ikan bawal mempunyai korelasi yang positif terhadap kondisi bobot badan ikan. Keberadaan cacing parasitik pada ikan merupakan salah satu faktor yang dapat menurunkan bobot badan pada ikan.
Di daerah tambak ini jenis cacing parasitik yang menyerang termasuk ke dalam golongan monogenea. Parasit termasuk monogenea cenderung menginfeksi organ tertentu pada inangnya (mikrohabitat). Keberadaan parasit pada organ tertentu pada mikrohabitat kemungkinan berhubungan dengan perkembangan dan kematangan dari parasit tersebut, reproduksi atau berhubungan dengan pencarian daerah yang aman (Anshary et al. 2001). Selain itu infeksi oleh parasit golongan monogenea dapat mengakibatkan rendahnya produksi karena pertumbuhan ikan terhambat atau bahkan mematikan, juga dapat merusak penampilan fisik ikan (Sinderman 1990).
rendahnya produktivitas satwa ikan yang terinfeksi yaitu kekurusan dan tingkat reproduksi yang rendah.
Tabel 4. Jumlah Cacing Pada Insang Ikan Bawal Air Tawar (Colossoma macropomum) dari wilayah tambak Daerah Ciampea.
Bobot Badan
Tabel 4 di atas menunjukkan tingkat kecacingan pada berbagai bobot badan ikan yang menjadi sampel penelitian. Jumlah cacing parasitik yang menginfeksi ikan bawal yang berasal dari tambak di daerah Ciampea yang paling banyak terdapat pada bobot badan antara 91-100 gram dengan jumlah cacing 71 cacing dengan jumlah ikan 4 ekor. Jumlah cacing terbanyak kedua terdapat pada kelompok ikan dengan bobot terbesar yaitu antara 121-130 gram dengan jumlah cacing sebanyak 55 dengan jumlah ikan yang terinfeksi pada kisaran bobot badan tersebut sebanyak 2 ekor. Sedikit berbeda dengan data hasil jumlah kecacingan pada Tabel 3 yang secara signifikan terlihat jelas pengaruh jumlah kecacingan terhadap bobot badan ikan dan banyaknya jumlah ikan yang menginfeksi. Perbedaan jumlah cacing parasitik yang menyerang ini bisa dimungkinkan oleh perbedaan kondisi sanitasi lingkungan dan kualitas air tambak.
kolam yang tinggi. Perbedaan sistem imunitas antar spesies juga ikut berperan di dalam jumlah ikan yang terinfeksi.
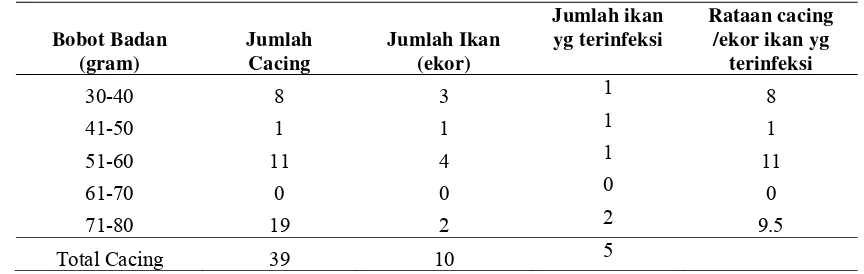
Tabel 5. Jumlah Cacing Pada Insang Ikan Bawal Air Tawar (Colossoma macropomum) dari wilayah tambak Daerah Cibitung Tengah.
Bobot Badan
Tabel 5 di atas menunjukkan tingkat kecacingan pada berbagai bobot badan ikan yang menjadi sampel. Jumlah cacing parasitik yang menginfeksi ikan bawal yang berasal dari tambak di daerah Cibitung Tengah yang paling banyak terdapat pada bobot badan tertinggi yaitu pada kisaran bobot badan antara 71-80 gram dengan jumlah cacing 19 cacing dengan jumlah ikan yang terinfeksi sebanyak 2 ekor. Jumlah cacing terbanyak kedua terdapat pada kelompok ikan dengan bobot terbesar yaitu antara 51-60 gram dengan jumlah cacing sebanyak 11 dengan jumlah ikan yang terinfeksi pada kisaran bobot tersebut sebanyak 2 ekor.
Di lokasi tambak ini jenis cacing yang menyerang juga dari golongan cacing parasitik monogenea. Pada Tabel 5 di atas menggambarkan bahwa jumlah cacing yang menginfeksi tidak selalu berkorelasi positif dengan penurunan bobot badan pada ikan bawal. Hal ini sangat dimungkinkan karena perbedaan jenis cacing (intensitas cacing parasitik) yang menginfeksi serta tingkat patogenitas dari jenis cacing parasitik yang menginfeksi.
Identifikasi Cacing Parasitik Pada Insang Ikan Bawal Air Tawar (Colossoma macropomum)
pada Yamaguti (1963), Grabda (1991), Woo (2006) dan Noble & Noble (1989). Identifikasi dilakukan dengan melakukan pengamatan di bawah mikroskop berdasarkan morfologi, ukuran tubuh dan kemiripin bentuk tubuh. Pengamatan ini hanya memungkinkan diferensiasi sampai famili dan genus.
Karakteristik Cacing Parasitik yang Ditemukan pada Insang Ikan Bawal Air Tawar (Colossoma macropomum)
Gambar 9.Tetraonchus sp
Cacing parasitik yang diidentifikasi dari insang ikan bawal air tawar (Colossoma macropomum) memiliki panjang tubuh 5,3 mm dengan lebar tubuh
0.648 mm. Bagian anterior dari cacing ini dilengkapi dengan lekukan-lekukan dan 2 spot mata, serta di bagian posterior dilengkapi dengan 2 kait (marginal hooks) yang berfungsi sebagai alat pelekat kepada inangnya. Menurut Yamaguti
(1958) cacing parasitik di atas (Gambar 9) diketahui sebagai Tetraonchus. Cacing parasitik ini mempunyai siklus hidup langsung.
Siklus hidup langsung yaitu siklus hidup yang hanya memerlukan satu inang dalam siklus hidupnya. Cacing parasit ini mengeluarkan telur dan setelah menetas akan menjadi larva yang kemudian akan berenang bebas yang disebut dengan oncomirasidium yang bergerak diantara filamen insang serta dapat menginfeksi inang dalam beberapa jam. Setelah mencapai inang, cacing parasit ini bermigrasi ke target organ dan berkembang menjadi parasit dewasa. Larva Tetraonchus sp tumbuh dan berkembang dengan baik menjadi dewasa pada
2 kait utama vitellaria
insang dengan pengaruh temperatur di atas 10º C. Gejala yang ditunjukkan dari infeksi jenis cacing parasitik ini diantaranya hipersalivasi, hiperplasia epitel, hemoragi, penurunan nafsu makan, sampai kematian.
Menurut Soulsby (1982) Tetraonchus sp termasuk ke dalam klasifikasi filum Platyhelminthes, kelas Trematoda, subkelas Monopisthocotylea, kelas Monogenea famili Tetraonchidae dan genus Tetraonchus.
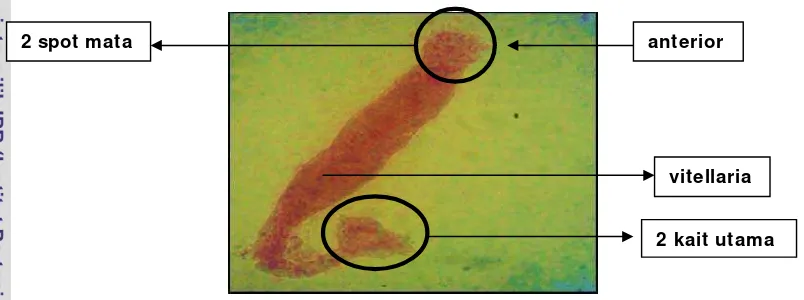
Gambar 10. Diplectanum sp
Cacing parasitik yang diidentifikasi dari insang ikan bawal air tawar (Colossoma macropomum) di atas memiliki panjang tubuh 6,21 mm dengan lebar
tubuh 3,25 mm. Cacing parasit di atas (Gambar 10) termasuk Ordo Dactylogyridae, Famili Diplectanidae, karena sering ditemui menyerang insang parasit ini juga sering disebut sebagai cacing insang. Cacing jenis ini biasa menyerang di lamella insang ikan laut (ikan kerapu, kakap, napoleon dan bawal). Parasit Diplectanum mempunyai kekhasan yang membedakannya dari spesies lain dalam ordo Dactylogyridae yang mempunyai squamodisc (satu terletak di ventral dan satu di dorsal) dan sepasang jangkar yang terletak berjauhan (Zafran et al. 1997). Pada beberapa kasus serangan parasit insang ini bisa menyebabkan kematian pada ikan yang cukup banyak. Ikan yang terserang akan mengalami gangguan dalam proses pernafasan selain itu luka yang ditimbulkan bisa menyebabkan terjadinya infeksi sekunder oleh bakteri.
Parasit yang termasuk ke dalam monogenea ini dapat berkembangbiak lebih cepat berkembang biak lebih cepat tanpa memerlukan inang perantara
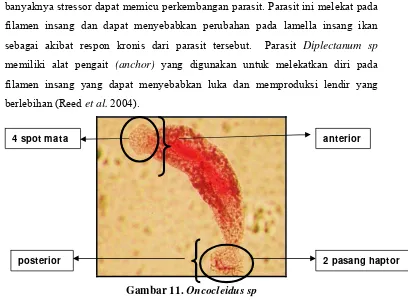
4 spot mata 2 pasang kait
sehingga dalam budidaya yang dicirikan oleh padat penebaran yang tinggi dan banyaknya stressor dapat memicu perkembangan parasit. Parasit ini melekat pada filamen insang dan dapat menyebabkan perubahan pada lamella insang ikan sebagai akibat respon kronis dari parasit tersebut. Parasit Diplectanum sp memiliki alat pengait (anchor) yang digunakan untuk melekatkan diri pada filamen insang yang dapat menyebabkan luka dan memproduksi lendir yang berlebihan (Reed et al. 2004).
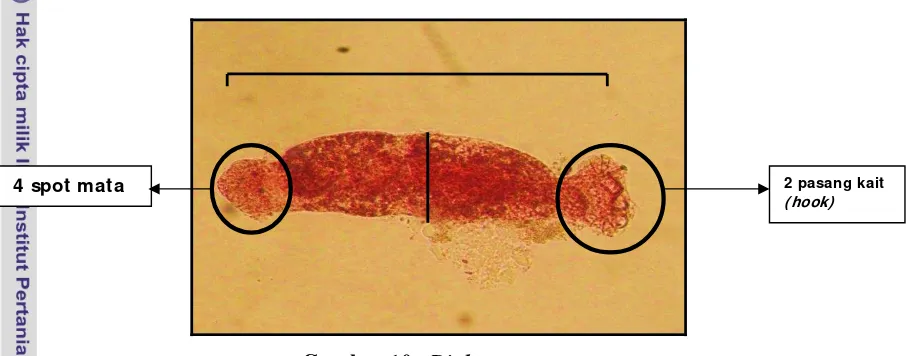
Gambar 11.Oncocleidus sp
Cacing parasitik yang diidentifikasi dari insang ikan bawal air tawar (Colossoma macropomum) di atas memiliki panjang tubuh 2.817 mm. dengan
lebar tubuh 0.147 mm. Cacing parasitik di atas (Gambar 11) termasuk ke dalam subkelas monogenea Famili Oncocleiduae.
Cacing monogenea ini juga termasuk ke dalam golongan cacing ektoparasit. Parasit ini ditemukan pada permukaan ekternal dari inang mereka. Parasit ini juga ditemukan di dalam air dan tidak diingestikan oleh inang mereka tetapi melekat dan membentuk koloni pada insang untuk menyerap nutrien inang. Cacing parasit ini kemudian melakukan perkawinan dan melepaskan telur sehingga menghasilkan kolonisasi cacing baru yang lebih banyak lagi. Cacing ektoparasit ini umumnya dianggap bisa merusak populasi ikan tangkapan seperti di hatchery. (Schmidt et al. 2009)
4 spot mata
2 pasang haptor anterior
Gambar 12. Subkelas Monogenea
Cacing parasitik yang diidentifikasi dari insang ikan bawal air tawar (Colossoma macropomum) di atas memiliki panjang tubuh 2,6 mm dengan lebar
tubuh 0,531 mm. Cacing parasitik ini tergolong ke dalam subkelas monogenea Monopistocotylea Famili Dactylogyridae atau jenis cacing yang mempunyai satu bagian haptor dan termasuk pengait (alat untuk melekatkan dengan inang).
Menurut Grabda (1991) monogenea termasuk ke dalam Kingdom Animalia dan Filum Platyhelmintes. Monogenea termasuk cacing berbentuk pipih dorsoventral, mempunyai haptor yang berfungsi untuk melekat pada inangnya. Haptor yang berada di ujung anterior dan posterior disebut opisthaptor dan haptor yang berada di ujung anterior disebut prohaptor. Haptor tersebut disertai dengan hook atau kait yang berfungsi untuk menempel pada organ. Monogenea tidak mempunyai sistem respirasi, sistem peredaran darah serta sistem rangka.
Monogenea merupakan cacing hermafrodit, sistem reproduksi jantan terdiri dari testis dan vas deferens sedangkan sistem reproduksi betina terdari dari ovarium, uterus dan vitellaria. Monogenea merupakan cacing kecil dengan ukuran satu sampai beberapa milimeter. Monogenea kebanyakan merupakan cacing parasit pada ikan dengan habitat pada insang atau sisik ikan, terkadang ditemukan juga pada saluran pencernaan ikan.
17 mm
4 spot mata
2 pasang haptor posterior
Gambaran Mikroskopis Sel Darah Ikan Bawal Air Tawar (Colossoma macropomum)
Gambaran darah ikan bawal air tawar (Colossoma macropomum) dapat dilihat pada gambar 13 di bawah ini
(Perbesaran 1000x) (Perbesaran 1000x)
(Perbesaran 1000x) (Perbesaran 1000x)
(Perbesaran 1000x) (Perbesaran 1000x)
Gambar 13. Gambaran mikroskopis sel darah ikan bawal air tawar
(Colossoma macropomum) : 13a Eritrosit (Er), 13b. Trombosit (Tr), 13c. Limfosit (L), 13d. Heterofil (H), 13e. Monosit (M), 13f. Eosinofil (Eo) (Perbesaran 1000x)
Monosit ( M)
Eritrosit( Er)
Trombosit ( Tr)
Heterofil ( H) Limfosit ( L)
13a 13b
13c 13d
13e
13f
Eosinofil (Eo)
Eosinofil
Eritrosit
Seperti pada reptil, amphibi dan unggas, salah satu ciri pembeda darah ikan bawal air tawar (Colossoma macropomum) adalah inti pada eritrosit yang matang. Ulasan darah dari ikan yang sehat menunjukkan jumlah eritrosit yang lebih besar dibandingkan sel-sel darah lainnya (Affandi dan Tang 2002).
Ikan bawal air tawar (Colossoma macropomum) yang diamati juga memiliki eritrosit (Gambar 13a.) yang berinti sama seperti ikan dari spesies lain. Tepi ujung dari eritrosit membulat sehingga bentuk sel tampak ovoid (bulat oval) seperti telur, lebih bulat dari eritrosit unggas yang cenderung agak elips. Pewarnaan menggunakan Giemsa memperlihatkan sitoplasma yang terlihat berwarna asidofilik dengan inti yang berwarna keunguan. Inti dari eritrosit terletak di tengah dengan kromatin yang kompak ( Ranzani-Paiva et al. 2003).
Limfosit
Limfosit ikan bawal air tawar (Colossoma macropomum) (Gambar 13c.) memiliki ukuran diameter rata-rata 13 µm. Memiliki inti yang hampir menutupi sitoplasma. Sitoplasma sedikit , homogen dengan warna biru mengelilingi nukleus dengan warna ungu gelap.
Heterofil
Heterofil pada ikan bawal air tawar (Colossoma macropomum) yang diamati seperti pada gambar (13d.) memiliki diameter rata-rata 12,45 µm. Menurut (Ardelli dan Woo 2006) ukuran heterofil pada ikan bervariasi (berdiameter 8-15 µm) dengan sel yang berbentuk oval dan bentuk inti tidak tetap (mulai dari bulat hingga berlobus). Ukuran, bentuk, warna dan komposisi kimia pada granul heterofil bervariasi. Sitoplasma berwarna pucat dan berisi sejumlah granul merah muda halus atau pucat tergantung pada spesies ikan. Feldmen et al. 2000 melaporkan bahwa ciri heterofil pada ikan yaitu mempunyai inti yang eksentrik dengan bentuk bulat sampai oval. Pada beberapa spesies inti ada juga yang mempunyai lobus. Pada umumnya sel heterofil memiliki inti berbentuk bulat sampai oval bertakuk (berlekuk). Inti berwarna ungu gelap dengan gumpalan kromatin yang kasar. Sitoplasma biasanya berwarna biru pucat dengan warna granul bervariasi mulai dari abu-abu, biru , serta merah.
Monosit
Bentuk monosit mempunyai kemiripan dengan limfosit, dimana monosit memiliki ukuran sel yang lebih besar dengan inti tidak berlobus dengan sejumlah besar sitoplasma yang tidak terlalu basofilik. Sitoplasma berisi vakuola dan granula azurofilik yang halus. Istilah azurofilik mengacu pada bentuk monosit yang berisi sejumlah granula sitoplasmik yang halus berwarna merah keunguan (Canfiled 2006). Ikan bawal air tawar (Colossoma macropomum) memiliki ukuran sel monosit (Gambar 13e.) yang besar dengan inti yang bertakuk (berlekuk) dan sejumlah besar sitoplasma tidak terlalu basofilik.
Eosinofil
Diferensial Leukosit
Diferensiasi leukosit meliputi hitung jenis sel limfosit, monosit, heterofil, eosinofil dan basofil dalam 100 buah sel darah putih yang dilihat di bawah mikroskop dengan pembesaran 1000x (100x10). Diferensiasi leukosit pada ikan bawal air tawar (Colossoma macropomum) dapat dilihat pada tabel berikut :
Tabel 5. Diferensiasi jenis sel leukosit ikan bawal air tawar (Colossoma macropomum) di tiga wilayah tambak.
Parameter
pertahanan tubuh yang dominan di dalam darah dan akan meningkat tajam jumlahnya bila terjadi infeksi penyakit parasiter terutama terhadap infeksi parasit cacing.
Lukistyowati et al. (2007) menjelaskan bahwa jumlah limfosit pada ikan bawal air tawar (Colossoma macropomum) berkisar antara 36 – 80 %. Hasil pengamatan untuk limfosit secara umum tambak di daerah Situ Daun memperlihatkan jumlah limfosit yang paling banyak yaitu sebesar 5.028. Angka ini masih dalam kisaran yang normal. Selain itu untuk parameter limfosit ikan bawal air tawar (Colossoma macropomum) di kedua tambak yang lain sebesar 9.24 untuk tambak wilayah Ciampea dan 3.50 untuk wilayah tambak Cibitung Tengah. Limfosit berfungsi sebagai penghasil antibodi untuk kekebalan tubuh dari gangguan penyakit (Bastiawan 2001).
Adapun pengamatan di tiga lokasi menunjukkan jumlah monosit yang paling tinggi ditemukan pada wilayah tambak Cibitung Tengah sebesar
. Hasil pengamatan ini sesuai dengan pendapat Klontz (1994) yang menjelaskan bahwa kisaran monosit berkisar 0,1-3 % akan tetapi dapat meningkat sekitar 38%. Selain itu melihat nilai hematologi monosit untuk seluruh lokasi penelitian lebih tinggi dari pernyataan para ahli ini merupakan gejala normal untuk ikan yang hidup di daerah bersuhu tropis, karena menurut Klontz (1994) bahwa nilai parameter hematologi dapat bervariasi, hal ini bisa disebabkan oleh jenis ikan, suhu, dan musim. Menurut Bastiawan et al. (2001) monosit berfungsi sebagai fagosit terhadap benda-benda asing yang berperan sebagai agen penyakit.
SIMPULAN DAN SARAN
Simpulan
Pada penelitian ini dapat disimpulkan bahwa jenis cacing parasitik yang sering menginfeksi insang ikan bawal air tawar (Colossoma macropomum) di wilayah tambak Situ Daun, Ciampea, dan Cibitung Tengah yaitu terdiri dari Tetraonchus sp, Diplectanum sp, Oncocleidus sp, serta dari subkelas Monogenea
dengan tingkat prevalensi masing-masing daerah sebesar 100%, 70%, dan 50%. Nilai eosinofil, heterofil, dan monosit pada ketiga daerah yang diperiksa menunjukkan peningkatan karena adanya infeksi cacing parasitik.
Saran
DAFTAR PUSTAKA
Affandi R, UM Tang. 2002. Fisiologi Hewan Air. Riau : University Riau Pr. Anonim. 2011. Basic Techniques in Fish Haematology. http://www.aqualex.org
terhubung berkala [diakses Maret 2011]
Anshary H K. Ogawa. 2001. Microhabitats and Mode of Attachment of Neoheterobothrium hirame, Monogenean Parasite of Japanese
Flounder. Fish Pathol, 36 (1). 21-26.
Ardelli BF, Woo PTK. 2006. Immunocompetent Cells and Their Mediators in Fin Fish di dalam : Woo PTK, Bruno DW, editor. Fish Disease and Disorder. Vol 3. Ed ke-2. UK : CABI Pub. hlm 702-724.
Ariaty L. 1991. Morfologi Darah Ikan Mas (Cyprinus carpio Linn) Nila Merah (Orechromis sp) dan Lele Dumbo (Clarias gariepinus) dari Sukabumi.
[skripsi]. Bogor. Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor.
Arie U. 2000. Budidaya Bawal Air Tawar untuk Konsumsi dan Ikan Hias. Penebar Swadaya Jakarta.
Bastiawan D, A. Wahid, M. Alifudin dan I. Agustiawan. 2001. Gambaran Darah Lele dumbo (Clarias spp) yang Diinfeksi Cendawan Aphanomyces sp pada pH yang Berbeda. Jurnal Penelitian Indonesia 7(3) : 44-47. Bhagawati, D. Petrus, H.T. dan Siti, R.1991. Mengenal Ektoparasit Penyebab
Penyakit Pada Kolam Rakyat di Desa Beji Purwokerto. Karya Ilmiah. Fakultas Biologi UNSOED. Purwokerto.
Buchmann K, Bresciani J. 2006. Monogenea (Phylum Platyhelminthes). Di dalam: Woo PTK, Bruno DW editor. Fish Disease and Disorder. Vol 3. Ed ke-2. UK : CABI Pub. hlm 297-344.
Buchmann K, Bresciani J. 2001. An Introduction to Parasitic Disease of Freshwater Trout. Denmark : DSR Pub.
Canfield PJ. 2006. Complemarative cell morphology in the peripheral blood film from exotic and native animal. Aust Vet J 76 : 793-800.
David G. 2010. Dactylogyrus. Fauna europaea versi2.4 [terhubung berkala]
http://www.faunaeur.org [14 Mei 2011].
Feldman BF, Zinkl JG, Jain NC, Schalm OW. 2000. Schalms Veterinary Hematology. Blackwell Pub.
Guyton Arthur C. and Hall John E. 1999. Buku Ajar Fisiologi Kedokteran. Setiawan I, Tengadi KA, Santoso A, penerjemah: Setiawan I, editor. Jakarta : EGC. Terjemahan dari : Textbook of Medical Physiology. Grabda J.1991. Marine Fish Parasitology. New York : Warszawa Polish
Scientific Pub.
Hibiya T. 1995. An Atlas of Fish Histology Normal and Pathological Features. (second edition). Kodansha LTD, Tokyo.
Irianto A. 2005. Patologi Ikan Teleostei. Gajah Mada University Press, Yogyakarta.
Kinne O.1980. Disease of Marine Animals.Vol. 1. General Aspects. Protozoa to Gastropoda. John Wiley dan Sons, Chichester Markevich AP.1963. Parasitic Fauna of Fresh Water Fish of the Ukrainan. London SSR.
Oldbourne Pr.
Klont.G.W,1994. Tecniques In Fish Immunology. Department of Fish and Wildlife Resources University of Idaho. Moscow : Idaho Pr.
Levine ND. 1994. Buku Pelajaran Parasitologi Veteriner. Ashadi, penerjemah. UGM Gadjah Mada Uni Press. Yogyakarta. Terjemahan dari : Textbook of Veterinary Parasitology.
Moyle PB, Cech JJ. 1988. Fish an Introduction to Ichthology Second Edition. New Jersey : Prentice Hall.
Lukistyowati W. 2007. Hematologi Ikan-ikan Air Tawar. Lembaga Penelitian Universitas Riau. Pekanbaru : Universitas Riau Pr.
Noble ER, Noble GA.1989. Parasitologi Biologi Parasit Hewan. Edisi ke-5. Ardianto, Penerjemah; Soeripto N. Editor. Yogyakarta: Gadjah Mada University Press. Terjemahan dari : Parasitology : The Biology of Animal Parasites 5th edition.
Noga E.J. 2000. Fish Disease : Diagnosis and Treatment. Lowa State University Pr.
Ranzani-Paiva, M.J.T., Rodrigues, E.L.. Veiga, M.L., Eiras, A.C. & Camp os, B.E.S. 2003. Differential leukocytes counts in “dourado”Salminus maxillous” Valenciennes, 1840, from the Mogi- Guaçu River,
Pirassiununga, SP. Brazilian Journal of Biology 63: 517-525 Samsi M. 2006. Ulas Darah. Damandiri.or.id/file/muhamadsamsiipbbab3. Pdf
[ 27 September 2011].
Schmidt, G.D. Robert, L.S Janovy Jr J.2009. Foundations of Parasitology 8th Edition McGraw Hill New York.
Selye H.1973. The evolution of the stress concept. American Scientist 61 : 692-699 Wedemeyer GA dan Yasutke. 1997. Clinical Methods for The Assessment on The Effect of Environmental Stress on Fish Health. Technical Paper of The US Departement of The Interior Fish and the Wildlife Service 89 : 1-17.
Sindermann CH.1990. Principle Disease of Marine Fish and Shellfish. 2 nd ed. San Diego : Academic Pr.
Soulsby EJL. 1973. Helminths, Arthropods and Protozoa of Domisticated Animals. London. Bailliere, Tindall and Cassell.
Taukhid. 2006. Manajemen Kesehatan dan Lingkungan. Laboratorium Riset Kesehatan Ikan. Bogor.
Tizard I.R. 1995. Immunology: An Introduction. 5th ed. New York, Orlando : Saunders College Pub.
Woo. 2006. Diplomonadida (Phylum Parabasalia) and Kinetoplastea (Phylum Euglenozoa). Di dalam : Woo PTK, Bruno DW, editor. Fish Disease and Disorder. Vol 3. Ed ke-2. UK : CABI Publising. hlm 46-204. Yamaguti, S. 1958. Systema Helminthum Vol 1. Monogenea and Aspidocotylea
Yuasa Kei dkk. 2003. Diagnosa Penyakit Ikan. Balai Budidaya Air Tawar Jambi, Ditjen Perikanan Budidaya, DKP dan JICA.
Zafran, I Koesharyani dan K Yuasa. 1997. Parasit Pada Ikan Kerapu di Panti Benih dan Upaya Penanggulangannya. Jurnal Penelitian Perikanan Indonesia. Vol III(4):16-23
Lampiran 1
Prevalensi Kecacingan di Tambak Situ Daun
=
=
Prevalensi Kecacingan di Tambak Ciampea
=
=
Prevalensi Kecacingan di Tambak Cibitung Tengah
=
BAB I
PENDAHULUAN
Latar Belakang
Ikan bawal air tawar (Colossoma macropomum) merupakan salah satu komoditas perikanan yang bernilai ekonomis cukup tinggi. Ikan ini tergolong ke dalam Famili Characidae dan genus Colossoma. Pada mulanya ikan bawal air tawar (Colossoma macropomum) diperdagangkan sebagai ikan hias, namun karena memiliki pertumbuhan yang relatif cepat dan rasa daging yang enak, maka masyarakat menjadikan ikan tersebut sebagai ikan konsumsi.
Meningkatnya kegemaran masyarakat mengkonsumsi ikan menyebabkan banyak konsumen mulai menyukai ikan bawal air tawar (Colossoma macropomum). Hal ini secara tidak langsung mendorong suplai ikan bawal untuk
konsumsi semakin meningkat.
Namun seperti makhluk hidup lainnya, ikan juga tidak pernah bebas dari ancaman berbagai jenis penyakit dan salah satu penyebab penyakit tersebut adalah parasit. Menurut Noble dan Noble (1989), parasit adalah organisme yang hidupnya dapat menyesuaikan diri dengan inang definitifnya tetapi merugikan bagi organisme yang ditempatinya.
Tujuan Penelitian
Penelitian ini bertujuan untuk mengidentifikasi jenis cacing parasitik yang terdapat pada insang ikan bawal air tawar (Colossoma macropomum) dan mengetahui tingkat infeksi cacing parasitik di tiga wilayah tambak ikan bawal (Colossoma macropomum) di daerah Situ Daun, Ciampea, dan Cibitung Tengah, serta mengetahui gambaran hematologi pada ikan bawal air tawar (Colossoma macropomum) yang terinfeksi cacing parasitik.
Manfaat Penelitian
METODOLOGI
Waktu dan Tempat Penelitian
Penelitian ini dilakukan pada bulan Oktober 2010 sampai bulan Juni 2011 di Laboratorium Helminthologi dan Entomologi Kesehatan Departemen Ilmu Penyakit Hewan dan Kesehatan Masyarakat Veteriner Fakultas Kedokteran Hewan Institut Pertanian Bogor.
Bahan dan Alat
Hewan yang digunakan dalam penelitian ini adalah ikan bawal air tawar (Colossoma macropomum) yang berjumlah 30 ekor yang diambil dari tiga lokasi tambak ikan bawal yang ada di Situ Daun, Ciampea, serta Cibitung Tengah dengan masing masing daerah dilakukan pengambilan sampel sebanyak 10 ekor secara acak. Bahan yang digunakan adalah NaCl fisiologis, etanol 70%, 85%, 95%, dan 100%, pewarna Acetocarmine, pewarna Giemsa 10%, xylol HCl, entellan dan aquades.
Alat Penelitian
Alat-alat yang digunakan dalam penelitian ini yaitu alat bedah/dissecting kit (gunting, scalpel, dan pinset) alas berupa gabus yang dilapisi plastik berwarna
hitam, cawan petri, lemari pendingin bersuhu 4 ºC, timbangan digital, tissue, mikroskop cahaya, mikroskop stereo dan video mikrometer, gelas obyek, cover glass, botol plastik film, dan kertas label.
Metode Penelitian
Pengambilan Sampel Ikan Bawal Air Tawar (Colossoma macropomum)
kemudian diberi aerasi dan selanjutnya dibawa ke laboratorium Helminthologi dan dimasukkan ke dalam akuarium selama satu-sampai dua hari dan diukur panjang dan bobotnya.
Pembuatan Preparat Ulas Darah, Pengambilan Cacing dari Insang dan Saluran Pencernaan
Sampel ikan bawal air tawar ditimbang terlebih dahulu dengan timbangan digital dan dilakukan pengukuran panjang tubuh ikan. Kemudian darah ikan diambil untuk membuat preparat ulas darah. Preparat ulas darah dibiarkan mengering di udara terbuka ( Samsi 2006). Sampel ikan bawal air tawar (Colossoma macropomum) ini kemudian dipreparasi dengan cara merusak bagian
otaknya kemudian langsung dipotong pada kepalanya. Bagian perut ikan disayat memanjang mulai dari kloaka sampai leher ikan. Insang dipisahkan, saluran pencernaan ikan dikeluarkan kemudian dimasukkan ke dalam cawan petri yang telah berisi larutan NaCl fisiologis. Insang yang telah dipisahkan dari bagian kepala serta saluran pencernaan yang telah disayat dimasukkan ke dalam NaCl fisiologis kemudian dilihat di bawah mikroskop stereo. Spesimen yang belum teramati disimpan kembali pada lemari pendingin bersuhu 4 ºC. Cacing parasitik yang dikoleksi dari insang dan saluran pencernaan ikan kemudian diisolasi dan disimpan pada botol yang telah diberi larutan NaCl fisiologis selama 8 jam di lemari pendingin bersuhu 4 ºC, kemudian dipindahkan ke dalam etanol 70% untuk dilakukan proses pewarnaan (Soulsby 1973)
Metode Pewarnaan
dibilas dengan ethanol 70% dan direndam dalam larutan asam alkohol ( 99 bagian ethanol 70% dan 1 bagian HCl). Setelah itu direndam selama 5 menit dengan alkohol secara bertahap untuk tujuan dehidrasi. Kemudian dilanjutkan dengan perendaman dalam xylol sampai spesimen terlihat transparan, kemudian spesimen difiksasi pada sediaan gelas obyek dengan bahan entellan sebagai media fiksasi.
Identifikasi Cacing Parasitik
Metode identifikasi cacing dilakukan setelah pewarnaan selesai. Spesimen yang telah diwarnai diamati di bawah mikroskop dan dilakukan identifikasi terhadap famili hingga genus dari sampel cacing. Di dalam identifikasi ini juga dilakukan pengukuran panjang dan lebar dari jenis cacing parasit yang ditemukan dengan menggunakan mikroskop. Identifikasi cacing dilakukan berdasarkan morfologi dan morfometri cacing dengan mengacu pada Yamaguti (1958), Grabda (1991), Woo (2006) dan Noble & Noble (1989).
Pengamatan Diferensiasi Leukosit
Pengamatan diferensiasi leukosit dilakukan untuk menentukan persentase tiap jenis leukosit yang ada di dalam darah. Pengamatan diferensial leukosit dilakukan dengan mengamati preparat ulas darah di bawah mikroskop. Pembuatan preparat ulas darah dilakukan dengan cara menempatkan setetes darah pada gelas obyek. Gelas obyek kedua diletakkan dengan sudut 45º di atas gelas obyek pertama, kemudian digeser ke belakang menyentuh darah sehingga darah menyebar.
Analisis Data Tingkat Infeksi
BAB IV
HASIL DAN PEMBAHASAN
Prevalensi Kecacingan Ikan Bawal Air Tawar (Colossoma macropomum)
Tingkat prevalensi kecacingan pada ikan bawal air tawar dapat dilihat pada Tabel 1 di bawah ini.
Tabel 1. Tingkat prevalensi kecacingan pada ikan bawal air tawar (Colossoma macropomum) di Bogor.
Lokasi
Pengambilan Jumlah ikan
Prevalensi di insang
Tabel 1 di atas memperlihatkan perbedaan tingkat prevalensi di ketiga lokasi tambak. Perbedaan ini dimungkinkan oleh faktor intrinsik dan faktor ekstrinsik. Faktor intrinsik misalnya tingkat stress pada ikan bawal air tawar (Colossoma macropomum) yang tinggi sehingga menyebabkan sistem imun
menurun. Selain itu kekebalan individu, jenis kelamin, galur dan umur ikan juga merupakan faktor pendukung terjadinya kecacingan. Faktor ekstrinsik yang dapat menyebabkan tingginya prevalensi kecacingan di antaranya kondisi sanitasi tambak yang buruk, biosekuriti, dekatnya tambak dengan pemukiman, sistem pengairan dan sumber air kolam yang buruk.
Klasifikasi Cacing Parasitik pada Insang Ikan Bawal Air Tawar (Colossoma macropomum) di Tambak Situ Daun, Ciampea, dan Cibitung Tengah.
Hasil identifikasi cacing parasitik yang ditemukan pada insang ikan bawal air tawar (Colossoma macropomum) dikelompokkan ke dalam Fillum Plathyhelmintes dan Kelas Trematoda Sub Kelas Monogenea. Monogenea merupakan parasit yang umum ditemukan pada insang dan kulit ikan air tawar maupun air laut. Infestasi monogenea biasanya merupakan indikator sanitasi yang rendah pada kualitas air, seperti contoh tingginya amoniak dan nitrit, polusi bahan organik dan kadar oksigen yang rendah, dengan kondisi seperti tersebut monogenea dapat sangat cepat bereproduksi (Noga 2000). Klasifikasi cacing parasitik pada insang ikan bawal air tawar (Colossoma macropomum) dapat dilihat pada Tabel di bawah ini
Tabel 2. Jenis-jenis Cacing Pada Insang Ikan Bawal Air Tawar (Colossoma macropomum).
Kelas Subkelas Famili Genus
Trematoda Monogenea Tetraonchidae Tetraonchus sp
Trematoda Monogenea Diplectanidae Diplectanum sp
Trematoda Monogenea Oncocleidae Oncocleidus sp
Trematoda Monogenea -
Tabel 3. Jumlah Cacing Pada Insang Ikan Bawal Air Tawar (Colossoma macropomum) dari wilayah tambak Daerah Situ Daun.
Bobot Badan
(gram) Jumlah Cacing
Jumlah Ikan
Tabel 3 di atas menunjukkan tingkat kecacingan pada berbagai bobot badan ikan yang menjadi sampel penelitian. Jumlah cacing parasitik yang menginfeksi ikan bawal yang berasal dari tambak Situ Daun yang paling banyak terdapat pada bobot badan antara 40-50 gram dengan jumlah cacing 152 cacing dengan jumlah ikan 4 ekor. Jumlah cacing terbanyak kedua menginfestasi ikan dengan bobot badan antara 51-60 gram dengan jumlah cacing sebanyak 140 dengan jumlah ikan dengan kisaran bobot badan tersebut yang terinfeksi sebanyak 4 ekor. Dari data hasil yang diperoleh di atas dapat kita gambarkan bahwa jumlah cacing parasitik yang menginfeksi ikan bawal mempunyai korelasi yang positif terhadap kondisi bobot badan ikan. Keberadaan cacing parasitik pada ikan merupakan salah satu faktor yang dapat menurunkan bobot badan pada ikan.
Di daerah tambak ini jenis cacing parasitik yang menyerang termasuk ke dalam golongan monogenea. Parasit termasuk monogenea cenderung menginfeksi organ tertentu pada inangnya (mikrohabitat). Keberadaan parasit pada organ tertentu pada mikrohabitat kemungkinan berhubungan dengan perkembangan dan kematangan dari parasit tersebut, reproduksi atau berhubungan dengan pencarian daerah yang aman (Anshary et al. 2001). Selain itu infeksi oleh parasit golongan monogenea dapat mengakibatkan rendahnya produksi karena pertumbuhan ikan terhambat atau bahkan mematikan, juga dapat merusak penampilan fisik ikan (Sinderman 1990).