SKRIPSI
PROLIFERASI LIMFOSIT DAN KADAR MALONALDEHIDA PADA PRODUK PEPES IKAN IRADIASI
Oleh:
KALLISTA RACHMAVIKA PUTRI F24051026
2009
FAKULTAS TEKNOLOGI PERTANIAN INSTITUT PERTANIAN BOGOR
PROLIFERASI LIMFOSIT DAN KADAR MALONALDEHIDA PADA PRODUK PEPES IKAN IRADIASI
Oleh:
KALLISTA RACHMAVIKA PUTRI F24051026
SKRIPSI
Sebagai salah satu syarat untuk memperoleh gelar SARJANA TEKNOLOGI PERTANIAN
Pada Departemen Ilmu dan Teknologi Pangan Fakultas Teknologi Pertanian
Institut Pertanian Bogor
2009
FAKULTAS TEKNOLOGI PERTANIAN INSTITUT PERTANIAN BOGOR
INSTITUT PERTANIAN BOGOR FAKULTAS TEKNOLOGI PERTANIAN
PROLIFERASI LIMFOSIT DAN KADAR MALONALDEHIDA PADA PRODUK PEPES IKAN IRADIASI
SKRIPSI
Sebagai salah satu syarat untuk memperoleh gelar SARJANA TEKNOLOGI PERTANIAN
pada Departemen Ilmu dan Teknologi Pangan Fakultas Teknologi Pangan
Institut Pertanian Bogor
Oleh:
Kallista Rachmavika Putri F24051026
Dilahirkan pada tanggal 24 November 1987 Tanggal lulus: 2 Juni 2009
Menyetujui : Bogor,
Prof. Dr. Ir. Fransiska Rungkat-Zakaria, M.Sc. Zubaidah Irawati. PhD
Dosen Pembimbing I Dosen Pembimbing II
Mengetahui,
Dr. Ir. Dahrul Syah
Kallista Rachmavika Putri. F24051026. Uji Proliferasi Limfosit dan Pengukuran Kadar Malonaldehida Pada Produk Pepes Iradiasi. Dibawah bimbingan Prof. Dr. Ir. Fransiska Rungkat-Zakaria, MSc. dan Zubaidah Irawati, Ph.D
ABSTRAK
Bahan pangan merupakan materi yang mudah mengalami kerusakan sehingga dikembangkan berbagai macam teknik pengawetan dan pengolahan bahan pangan untuk memperpanjang marketable lifedan daya simpan komoditas pangan. Salah satu metode pengawetan pangan adalah metode pengawetan iradiasi yang menerapkan penggunaan energi ionisasi untuk mengurangi kehilangan akibat kerusakan dan pembusukan serta memberikan kemungkinan bahan pangan dapat diawetkan tanpa mengalami perubahan nyata sifat alami dan kandungan gizinya. Kendala yang ada dalam penerapan teknologi iradiasi pangan adalah adanya kekhawatiran masyarakat mengenai keamanan pangan produk iradiasi akibat pembentukan radikal bebas dan senyawa radiolitik produk dari proses iradiasi pangan. Adanya senyawa radikal bebas dalam produk ditakutkan akan membentuk senyawa yang bersifat toksik, mutagenik, ataupun karsinogenik di dalam tubuh manusia Oleh karena itu, penelitian ini bertujuan untuk mengetahui pengaruh iradiasi pada sampel pepes ikan mas terhadap proliferasi sel limfosit manusia secara in vitro serta mengukur kadar malonaldehida yang terkandung dalam produk tersebut.
Prinsip pengujian toksisitas pangan iradiasi menggunakan uji proliferasi limfosit didasarkan bahwa limfosit adalah sel yang bertanggung jawab terhadap respon imun spesifik dan sensitif terhadap ketidakseimbangan oksidan-antioksidan dalam tubuh. Pengukuran kadar malonaldehida sampel pepes iradiasi juga dilakukan pada penelitian ini karena kadar malonaldehida pada umumnya menjadi indikator keberadaan radikal bebas. Pengukuran langsung bagi radikal bebas senderung tidak mungkin dilakukan karena radikal bebas bersifat tidak stabil dan cepat berubah. Pengukuran kadar malonaldehida juga berfungsi sebagai indikator kerusakan oksidatif di dalam material biologis karena malonaldehida merupakan produk peroksidasi asam lemak tak jenuh yang banyak ditemukan dalam matriks biologis.
sebesar 1.289, dan sampel pepes No Label 2008 menunjukkan nilai indeks stimulasi sebesar 1.347. Pada pengenceran 1x nilai indeks stimulasi dari sampel adalah sebagai berikut sampel pepes kontrol memiliki nilai indeks stimulasi 1.259, sampel pepes 14 Juni 2007 memiliki nilai indeks stimulasi 1.084, sampel pepes 5 April 2008 memiliki nilai indeks stimulasi 1.144, sampel pepes No Label 2008 memiliki nilai indeks stimulasi sebesar 1.344. Sedangkan pada pengenceran 2x nilai indeks stimulasi sampel adalah sebagai berikut nilai indeks stimulasi dari sampel pepes kontrol adalah 1.293, nilai indeks stimulasi sampel pepes 14 Juni 2007 adalah 1.105, sampel pepes 5 April 2008 memiliki nilai indeks stimulasi sebesar 1.169, sementara nilai indeks stimulasi dari pepes No Label 2008 adalah 0.984.
RIWAYAT HIDUP
Penulis dilahirkan di Jakarta pada tanggal 24 November 1987 dan merupakan anak pertama dari tiga bersaudara pasangan Vava Nawawi dan Yurika. Penulis menempuh Pendidikan Sekolah Dasar di SD Dharma Wiyata Lampung pada tahun 1993-1999, Pendidikan Lanjutan Tingkat Pertama di SLTP Tarakanita 2 Pluit Jakarta pada tahun 1999-2001 dan SLTP Ora et Labora BSD Tangerang pada tahun 2001-2002, lalu Pendidikan Lanjutan Tingkat Atas di SMA Santa Ursula BSD Tangerang pada tahun 2002-2005.
Penulis diterima di Institut Pertaninan Bogor pada tahun 2005 melalui jalur Seleksi Penerimaan Mahasiswa Baru (SPMB) lalu mengikuti Tahap Persiapan Bersama (TPB) selama 1 tahun dan pada tahun 2006 diterima sebagai mahasiswa di Departemen Ilmu dan Teknologi Pangan, Fakultas Teknologi Pertanian, Institut Pertanian Bogor. Selama di perkuliahan penulis menjadi anggota pada kegiatan intra kampus seperti Keluarga Mahasiswa Katolik IPB (Kemaki) dan Himpunan Mahasiswa Teknologi Pangan (HIMITEPA) serta terlibat dalam berbagai kegiatan kepanitiaan. Penulis juga berkesempatan untuk mengikuti berbagai kegiatan non akademis seperti Pelatihan Auditor Sistem Management HACCP, Pelatihan Sistem Management ISO 9000 dan ISO 22000, Pelatihan Sistem Management HALAL, dan berbagai seminar. Penulis juga pernah bekerja sebagai asisten dalam mata kuliah Praktikum Biokimia Pangan (ITP).
KATA PENGANTAR
Puji dan syukur penulis panjatkan kepada Tuhan Yang Maha Esa atas berkat dan anugerah-Nya sehingga penulis selalu diberikan kemudahan dalam menyelesaikan skripsi ini. Dalam kesempatan ini pula, penulis ingin mengucapkan terima kasih yang sangat besar kepada semua pihak yang turut membantu penulis selama menjalani masa perkuliahan, penelitian, hingga penyelesaian skripsi ini, yaitu kepada:
1. Prof. Dr. Ir. Fransiska Rungkat Zakaria, MSc selaku dosen pembimbing akademik yang telah memberikan bimbingan, arahan, dan saran selama masa kuliah, penelitian, dan penyelesaian skripsi ini.
2. Zubaidah Irawati, Ph.D selaku dosen pembimbing kedua dan koodinator proyek penelitian ‘Aspek Keamanan Pangan: Uji Toksistas Pangan Siap Saji Steril Radiasi’ atas kesempatan yang diberikan pada penulis untuk terlibat dalam proyek ini, untuk arahan, bimbingan, dan kesabarannya selama masa penelitian dan penyelesaian skripsi ini serta.
3. Pihak PATIR BATAN atas kesempatan yang diberikan untuk terlibat dalam proyek penelitian ini.
4. Dra. Waysima, Msc selaku dosen penguji yang telah memberikan banyak masukan bagi perbaikan skripsi ini.
5. Keluarga penulis : Mama, Papa, Shasa, dan Nana untuk semua doa, dukungan moril maupun fisik, motivasi, kasih sayang, dan semangat yang selalu melimpah pada penulis.
6. Randy Keegan dan keluarga untuk semua doa, semangat, penghiburan, dan kesabaran yang diberikan pada penulis selama penelitian dan penyelesaian skripsi. 7. Teman satu bimbingan dan penelitian : Kenchi, Umam, dan Kamlit untuk semua
8. Teman-teman terbaikku : Eping, Tuti, Nenek, Ella, Wagner, Bobo, Kak Azis, Tere, Wiwi, Cath, Belinda, Irene, Sisi, Sobur, Harrist, Dion, Tiu, Yuni untuk semua dorongan semangat, penghiburan, motivasi, nasehat, dan saran. You guys are rocks!
9. Seluruh dosen ITP yang telah membagi ilmu pengetahuan dan mendidik penulis. Laboran-laboran ITP : Pak Wahid, Pak Adi, Pak Sidik, Pak Yahya, dan Pak Rojak yang selalu membantu penulis selama melakukan penelitian.
10. Pihak-pihak lain yang tidak dapat disebutkan satu persatu yang telah membantu penulis baik secara langsung maupun tidak langsung dalam penyusunan skripsi ini.
Akhir kata penulis menyadari bahwa kripsi ini masih jauh dari sempurna dan tidak lepas dari berbagai kekurangan. Penulis berharap semoga skripsi ini dapat bermanfaat bagi seluruh pihak yang membutuhkan dan terhadap perkembangan Ilmu dan Teknologi, khususnya bidal Ilmu dan Teknologi Pangan.
Bogor, Mei 2009
DAFTAR ISI
HALAMAN
Kata Pengantar i
Daftar Isi iii
Daftar Tabel v
Daftar Gambar vi
Daftar Lampiran vii
I. PENDAHULUAN 1
A. Latar Belakang 1
B. Tujuan 3
II. TINJAUAN PUSTAKA 4
A. Iradiasi Pangan 4
B. Pepes Ikan Mas Iradiasi 8
C. Komponen Bioaktif dalam Pepes Ikan 11
D. Radikal Bebas 13
E. Oksidasi Lipid 15
F. Malonaldehida 17
G. Sel Limfosit Manusia 18
H. Proliferasi Limfosit 22
I. Uji Toksisitas Pada Sel Limfosit 24
III. METODOLOGI PENELITIAN 27
A. Bahan dan Alat 27
B. Metode Penelitian 28
1. Ekstraksi Sampel 28
2. Proliferasi Limfosit 29
a. Persiapan Media Kultur 29
b. Limfosit Darah Tepi 29
c. Serum Darah AB 30
3. Kadar Malonaldehida 32
4. Analisis Statistik 33
IV. HASIL DAN PEMBAHASAN 34
A. Ekstraksi Sampel 34
B. Proliferasi Limfosit 35
1. Model Pengujian Toksisitas Kultur LimfositIn Vitropada
Pepes Iradiasi 35
2. Pemgaruh Ekstrak Pepes Iradiasi Terhadap Proliferasi
Limfosit 39
3. Pengaruh Variasi Pengenceran Terhadap Proliferasi
Limfosit 43
C. Kadar Malonaldehida 44
1. Metode Spektrofotometri pada Pengukuran Kadar Malonaldehida
Pepes Iradiasi 44
2. Kadar Malonaldehida pada Pepes Iradiasi 47
V. KESIMPULAN DAN SARAN 51
A. Kesimpulan 51
B. Saran 54
DAFTAR PUSTAKA 55
SKRIPSI
PROLIFERASI LIMFOSIT DAN KADAR MALONALDEHIDA PADA PRODUK PEPES IKAN IRADIASI
Oleh:
KALLISTA RACHMAVIKA PUTRI F24051026
2009
FAKULTAS TEKNOLOGI PERTANIAN INSTITUT PERTANIAN BOGOR
PROLIFERASI LIMFOSIT DAN KADAR MALONALDEHIDA PADA PRODUK PEPES IKAN IRADIASI
Oleh:
KALLISTA RACHMAVIKA PUTRI F24051026
SKRIPSI
Sebagai salah satu syarat untuk memperoleh gelar SARJANA TEKNOLOGI PERTANIAN
Pada Departemen Ilmu dan Teknologi Pangan Fakultas Teknologi Pertanian
Institut Pertanian Bogor
2009
FAKULTAS TEKNOLOGI PERTANIAN INSTITUT PERTANIAN BOGOR
INSTITUT PERTANIAN BOGOR FAKULTAS TEKNOLOGI PERTANIAN
PROLIFERASI LIMFOSIT DAN KADAR MALONALDEHIDA PADA PRODUK PEPES IKAN IRADIASI
SKRIPSI
Sebagai salah satu syarat untuk memperoleh gelar SARJANA TEKNOLOGI PERTANIAN
pada Departemen Ilmu dan Teknologi Pangan Fakultas Teknologi Pangan
Institut Pertanian Bogor
Oleh:
Kallista Rachmavika Putri F24051026
Dilahirkan pada tanggal 24 November 1987 Tanggal lulus: 2 Juni 2009
Menyetujui : Bogor,
Prof. Dr. Ir. Fransiska Rungkat-Zakaria, M.Sc. Zubaidah Irawati. PhD
Dosen Pembimbing I Dosen Pembimbing II
Mengetahui,
Dr. Ir. Dahrul Syah
Kallista Rachmavika Putri. F24051026. Uji Proliferasi Limfosit dan Pengukuran Kadar Malonaldehida Pada Produk Pepes Iradiasi. Dibawah bimbingan Prof. Dr. Ir. Fransiska Rungkat-Zakaria, MSc. dan Zubaidah Irawati, Ph.D
ABSTRAK
Bahan pangan merupakan materi yang mudah mengalami kerusakan sehingga dikembangkan berbagai macam teknik pengawetan dan pengolahan bahan pangan untuk memperpanjang marketable lifedan daya simpan komoditas pangan. Salah satu metode pengawetan pangan adalah metode pengawetan iradiasi yang menerapkan penggunaan energi ionisasi untuk mengurangi kehilangan akibat kerusakan dan pembusukan serta memberikan kemungkinan bahan pangan dapat diawetkan tanpa mengalami perubahan nyata sifat alami dan kandungan gizinya. Kendala yang ada dalam penerapan teknologi iradiasi pangan adalah adanya kekhawatiran masyarakat mengenai keamanan pangan produk iradiasi akibat pembentukan radikal bebas dan senyawa radiolitik produk dari proses iradiasi pangan. Adanya senyawa radikal bebas dalam produk ditakutkan akan membentuk senyawa yang bersifat toksik, mutagenik, ataupun karsinogenik di dalam tubuh manusia Oleh karena itu, penelitian ini bertujuan untuk mengetahui pengaruh iradiasi pada sampel pepes ikan mas terhadap proliferasi sel limfosit manusia secara in vitro serta mengukur kadar malonaldehida yang terkandung dalam produk tersebut.
Prinsip pengujian toksisitas pangan iradiasi menggunakan uji proliferasi limfosit didasarkan bahwa limfosit adalah sel yang bertanggung jawab terhadap respon imun spesifik dan sensitif terhadap ketidakseimbangan oksidan-antioksidan dalam tubuh. Pengukuran kadar malonaldehida sampel pepes iradiasi juga dilakukan pada penelitian ini karena kadar malonaldehida pada umumnya menjadi indikator keberadaan radikal bebas. Pengukuran langsung bagi radikal bebas senderung tidak mungkin dilakukan karena radikal bebas bersifat tidak stabil dan cepat berubah. Pengukuran kadar malonaldehida juga berfungsi sebagai indikator kerusakan oksidatif di dalam material biologis karena malonaldehida merupakan produk peroksidasi asam lemak tak jenuh yang banyak ditemukan dalam matriks biologis.
sebesar 1.289, dan sampel pepes No Label 2008 menunjukkan nilai indeks stimulasi sebesar 1.347. Pada pengenceran 1x nilai indeks stimulasi dari sampel adalah sebagai berikut sampel pepes kontrol memiliki nilai indeks stimulasi 1.259, sampel pepes 14 Juni 2007 memiliki nilai indeks stimulasi 1.084, sampel pepes 5 April 2008 memiliki nilai indeks stimulasi 1.144, sampel pepes No Label 2008 memiliki nilai indeks stimulasi sebesar 1.344. Sedangkan pada pengenceran 2x nilai indeks stimulasi sampel adalah sebagai berikut nilai indeks stimulasi dari sampel pepes kontrol adalah 1.293, nilai indeks stimulasi sampel pepes 14 Juni 2007 adalah 1.105, sampel pepes 5 April 2008 memiliki nilai indeks stimulasi sebesar 1.169, sementara nilai indeks stimulasi dari pepes No Label 2008 adalah 0.984.
RIWAYAT HIDUP
Penulis dilahirkan di Jakarta pada tanggal 24 November 1987 dan merupakan anak pertama dari tiga bersaudara pasangan Vava Nawawi dan Yurika. Penulis menempuh Pendidikan Sekolah Dasar di SD Dharma Wiyata Lampung pada tahun 1993-1999, Pendidikan Lanjutan Tingkat Pertama di SLTP Tarakanita 2 Pluit Jakarta pada tahun 1999-2001 dan SLTP Ora et Labora BSD Tangerang pada tahun 2001-2002, lalu Pendidikan Lanjutan Tingkat Atas di SMA Santa Ursula BSD Tangerang pada tahun 2002-2005.
Penulis diterima di Institut Pertaninan Bogor pada tahun 2005 melalui jalur Seleksi Penerimaan Mahasiswa Baru (SPMB) lalu mengikuti Tahap Persiapan Bersama (TPB) selama 1 tahun dan pada tahun 2006 diterima sebagai mahasiswa di Departemen Ilmu dan Teknologi Pangan, Fakultas Teknologi Pertanian, Institut Pertanian Bogor. Selama di perkuliahan penulis menjadi anggota pada kegiatan intra kampus seperti Keluarga Mahasiswa Katolik IPB (Kemaki) dan Himpunan Mahasiswa Teknologi Pangan (HIMITEPA) serta terlibat dalam berbagai kegiatan kepanitiaan. Penulis juga berkesempatan untuk mengikuti berbagai kegiatan non akademis seperti Pelatihan Auditor Sistem Management HACCP, Pelatihan Sistem Management ISO 9000 dan ISO 22000, Pelatihan Sistem Management HALAL, dan berbagai seminar. Penulis juga pernah bekerja sebagai asisten dalam mata kuliah Praktikum Biokimia Pangan (ITP).
KATA PENGANTAR
Puji dan syukur penulis panjatkan kepada Tuhan Yang Maha Esa atas berkat dan anugerah-Nya sehingga penulis selalu diberikan kemudahan dalam menyelesaikan skripsi ini. Dalam kesempatan ini pula, penulis ingin mengucapkan terima kasih yang sangat besar kepada semua pihak yang turut membantu penulis selama menjalani masa perkuliahan, penelitian, hingga penyelesaian skripsi ini, yaitu kepada:
1. Prof. Dr. Ir. Fransiska Rungkat Zakaria, MSc selaku dosen pembimbing akademik yang telah memberikan bimbingan, arahan, dan saran selama masa kuliah, penelitian, dan penyelesaian skripsi ini.
2. Zubaidah Irawati, Ph.D selaku dosen pembimbing kedua dan koodinator proyek penelitian ‘Aspek Keamanan Pangan: Uji Toksistas Pangan Siap Saji Steril Radiasi’ atas kesempatan yang diberikan pada penulis untuk terlibat dalam proyek ini, untuk arahan, bimbingan, dan kesabarannya selama masa penelitian dan penyelesaian skripsi ini serta.
3. Pihak PATIR BATAN atas kesempatan yang diberikan untuk terlibat dalam proyek penelitian ini.
4. Dra. Waysima, Msc selaku dosen penguji yang telah memberikan banyak masukan bagi perbaikan skripsi ini.
5. Keluarga penulis : Mama, Papa, Shasa, dan Nana untuk semua doa, dukungan moril maupun fisik, motivasi, kasih sayang, dan semangat yang selalu melimpah pada penulis.
6. Randy Keegan dan keluarga untuk semua doa, semangat, penghiburan, dan kesabaran yang diberikan pada penulis selama penelitian dan penyelesaian skripsi. 7. Teman satu bimbingan dan penelitian : Kenchi, Umam, dan Kamlit untuk semua
8. Teman-teman terbaikku : Eping, Tuti, Nenek, Ella, Wagner, Bobo, Kak Azis, Tere, Wiwi, Cath, Belinda, Irene, Sisi, Sobur, Harrist, Dion, Tiu, Yuni untuk semua dorongan semangat, penghiburan, motivasi, nasehat, dan saran. You guys are rocks!
9. Seluruh dosen ITP yang telah membagi ilmu pengetahuan dan mendidik penulis. Laboran-laboran ITP : Pak Wahid, Pak Adi, Pak Sidik, Pak Yahya, dan Pak Rojak yang selalu membantu penulis selama melakukan penelitian.
10. Pihak-pihak lain yang tidak dapat disebutkan satu persatu yang telah membantu penulis baik secara langsung maupun tidak langsung dalam penyusunan skripsi ini.
Akhir kata penulis menyadari bahwa kripsi ini masih jauh dari sempurna dan tidak lepas dari berbagai kekurangan. Penulis berharap semoga skripsi ini dapat bermanfaat bagi seluruh pihak yang membutuhkan dan terhadap perkembangan Ilmu dan Teknologi, khususnya bidal Ilmu dan Teknologi Pangan.
Bogor, Mei 2009
DAFTAR ISI
HALAMAN
Kata Pengantar i
Daftar Isi iii
Daftar Tabel v
Daftar Gambar vi
Daftar Lampiran vii
I. PENDAHULUAN 1
A. Latar Belakang 1
B. Tujuan 3
II. TINJAUAN PUSTAKA 4
A. Iradiasi Pangan 4
B. Pepes Ikan Mas Iradiasi 8
C. Komponen Bioaktif dalam Pepes Ikan 11
D. Radikal Bebas 13
E. Oksidasi Lipid 15
F. Malonaldehida 17
G. Sel Limfosit Manusia 18
H. Proliferasi Limfosit 22
I. Uji Toksisitas Pada Sel Limfosit 24
III. METODOLOGI PENELITIAN 27
A. Bahan dan Alat 27
B. Metode Penelitian 28
1. Ekstraksi Sampel 28
2. Proliferasi Limfosit 29
a. Persiapan Media Kultur 29
b. Limfosit Darah Tepi 29
c. Serum Darah AB 30
3. Kadar Malonaldehida 32
4. Analisis Statistik 33
IV. HASIL DAN PEMBAHASAN 34
A. Ekstraksi Sampel 34
B. Proliferasi Limfosit 35
1. Model Pengujian Toksisitas Kultur LimfositIn Vitropada
Pepes Iradiasi 35
2. Pemgaruh Ekstrak Pepes Iradiasi Terhadap Proliferasi
Limfosit 39
3. Pengaruh Variasi Pengenceran Terhadap Proliferasi
Limfosit 43
C. Kadar Malonaldehida 44
1. Metode Spektrofotometri pada Pengukuran Kadar Malonaldehida
Pepes Iradiasi 44
2. Kadar Malonaldehida pada Pepes Iradiasi 47
V. KESIMPULAN DAN SARAN 51
A. Kesimpulan 51
B. Saran 54
DAFTAR PUSTAKA 55
DAFTAR TABEL
Tabel 1. Penggunaan potensial iradiasi pangan 4
Tabel 2. Dosis Iradiasi dan Aplikasinya 7
Tabel 3. Komposisi sel darah putih manusia 19
DAFTAR GAMBAR
Gambar 1. Pepes ikan mas iradiasi dan pepes ikan mas 9
Gambar 2. Sel sehat dan sel yang rusak akibat radikal bebas 15
Gambar 3. Skema tahapan oksidasi lipid 16
Gambar 4. Struktur malonaldehida 17
Gambar 5. Reaksi pembentukan kompleks MDA-TBA 18
Gambar 6. Sel limfosit manusia dan komposisi darah manusia 19 Gambar 7. Darah setelah disentrifuse, lapisan buffycoat dan larutan Histopaque,
pemisahan limfosit 30
Gambar 8. Kultur limfosit setelag inkubasi 66 jam, setelah penambahan MTT,
dan penambahan HCl-isopropanol 32
Gambar 9. Hasil pemisahan limfosit menggunakan Histopaque 37 Gambar 10. Grafik indeks stimulasi proliferasi kultur limfosit 40 Gambar 11. Hasil pewarnaan kultur limfosit menggunakan MTT 43
Gambar 12. Kurva standar larutan TEP 47
DAFTAR LAMPIRAN
Lampiran 1. Skema proses pengolahan bahan pangan dengan iradiasi 63
Lampiran 2. Komposisi limfosit manusia 64
Lampiran 3. Tabel hasil pembacaan absorbansi uji proliferasi limfosit 65
Lampiran 4. Contoh perhitungan indeks stimulasi ekstrak 67
Lampiran 5. Tabel hasil perhitungan Anova (p<0.01) pada uji proliferasi limfosit
pengenceran 1x 68
Lampiran 6. Tabel hasil perhitungan Anova (p<0.01) pada uji proliferasi limfosit
pengenceran 2x 69
Lampiran 7. Tabel hasil perhitungan Anova (p<0.01) pada uji proliferasi limfosit
pengenceran 4x 70
Lampiran 8. Tabel hasil pembacaan absorbansi pada metode pengukuran
kadar malonaldehida 71
Lampiran 9. Contoh perhitungan kadar malonaldehida sampel 72 Lampiran 10. Tabel hasil perhitungan Anova (p<0.01) pada pengukuran kadar
malonaldehida pengenceran 1x 73
Lampiran 11. Tabel hasil perhitungan Anova (p<0.01) pada pengukuran kadar
malonaldehida pengenceran 1x 74
Lampiran 12. Tabel hasil perhitungan Anova (p<0.01) pada pengukuran kadar
I. PENDAHULUAN
A. LATAR BELAKANG
Bahan pangan merupakan materi yang mudah mengalami kerusakan dan memiliki masa simpan yang terbatas. Berbagai macam teknik pengawetan dan pengolahan bahan pangan dikembangkan oleh manusia untuk memperpanjang
marketable life dan daya simpan dari komoditas pangan. Pengawetan yang dilakukan tidak semata hanya mencegah pertumbuhan dari bakteri, kapang, atau mikroorganisme lain yang menyebabkan pembusukan pada makanan, namun juga usaha untuk mencegah terjadinya oksidasi lemak yang dapat mengakibatkan ketengikan serta pencegahan perubahan warna pada makanan, misalnya akibat reaksi pencoklatan enzimatik. Metode pengawetan yang pada umumnya diaplikasikan adalah pengeringan, pemanasan, pembekuan, pengalengan, penggunaan bahan pengawet, fermentasi, dan termasuk metode iradiasi pangan.
Metode iradiasi pangan merupakan metode pengawetan yang cukup menjanjikan di masa mendatang. Proses pengawetan ini melibatkan penggunaan energi ionisasi. Iradiasi pangan sering pula disebut sebagai cold pasteurization
Di Indonesia sendiri telah dilakukan penelitian iradiasi terhadap berbagai jenis makanan berbasis ikan, daging dan unggas. Komoditi tersebut masing-masing diolah menjadi makanan siap saji seperti pepes ikan mas, rendang sapi, opor dan kare ayam. Setiap jenis produk olahan tersebut disterilkan dengan metode iradiasi pada dosis 45 kGy dalam kondisi beku (-79˚C) yang selanjutnya disimpan pada suhu 28-30oC (Irawati, 2003). Kendala yang ada dalam penerapan teknologi iradiasi pangan adalah keraguan dalam masyarakat mengenai keamanan pangan produk iradiasi akibat pembentukan radikal bebas dan senyawa radiolitik produk dari proses iradiasi pangan. Adanya senyawa radikal bebas dalam produk ditakutkan akan membentuk senyawa yang bersifat toksik, mutagenik, ataupun karsinogenik di dalam tubuh manusia. Badan FAO-WHO-IAEA sendiri pada bulan November 1980 telah menyatakan bahwa semua bahan yang diiradiasi pada dosis tidak melebihi 10 kGy aman untuk dikonsumsi manusia. Namun data teknis mengenai keamanan pangan iradiasi dosis tinggi 45 kGy, terutama di Indonesia, belum tersedia.
B. TUJUAN PENELITIAN
II. TINJAUAN PUSTAKA
A. IRADIASI PANGAN
Menurut WHO (1991), iradiasi pangan didefinisikan sebagai proses pemaparan pangan terhadap radiasi ionisasi untuk membunuh mikroorganisme, bakteri, virus atau serangga yang mungkin ada di dalam pangan. Aplikasi lain dalam penggunaan iradiasi pangan adalah menghambat perkecambahan, menunda pematangan, meningkatkan juice yield pada proses ekstraksi, dan meningkatkan rehidrasi. Pada awal mulanya bidang ini dirintis oleh Dr. Bernand E. Proctor dan Dr. Samuel A. Goldblith di tahun 1940 (Desrosier, 1988). Aplikasi penggunaan iradiasi pada berbagai produk pangan dapat dilihat pada Tabel 1.
Tabel 1. Penggunaan potensial iradiasi pangan (Brennand, 1995)
Jenis Produk Efek Iradiasi
Daging, unggas Membunuh mikroorganisme patogen pada ikan, seperti Salmonella, Campylobacter and Trichinae
Perishable foods Mencegah kerusakan; menghambat
pertumbuhan kapang; mengurangi mikroorganisme
Biji-bijian, buah Mengontrol serangga pada sayuran, menghambat kerusakan pada buah kering, bumbu dan rempah
Bawang, wortel, kentang, bawang putih, jahe
Menghambat perkecambahan
Pisang, mangga, pepaya, jambu biji, buahnon-citruslainnya
Menunda pematangan alpukat, natural juices.
Dalam prinsip pengawetan bahan pangan iradiasi, digunakan radiasi elektromagnetik yaitu radiasi yang menghasilkan foton berenergi tinggi sehingga dapat menyebabkan terjadinya ionisasi dan eksitasi pada materi yang dilaluinya. Iradiasi menyebabkan efek langsung (direct effect)dan efek tak langsung (indirect effect). Efek langsung adalah eksitasi atau ionisasi atom akibat energi ionisasi, sedangkan efek tak langsung adalah pembentukan radikal bebas akibat radiolisis dari molekul air, misalnya radikal hidroksi. Jenis iradiasi ini dinamakan radiasi pengion karena dapat menyebabkan ionisasi pada materi yang dilaluinya (Maha, 1981). Contoh radiasi pengion adalah radiasi partikel , , dan yang paling banyak digunakan yaitu gelombang elektromagnetik (Sofyan, 1984). Skema proses pengolahan bahan pangan dengan iradiasi dapat dilihat pada Lampiran 1.
Ketika suatu materi dilalui oleh radiasi pengion, energi yang melewatinya akan diserap dan menghasilkan pasangan ion. Energi yang terserap oleh tumbukan radiasi dengan partikel bahan pangan akan menyebabkan eksitasi dan ionisasi beribu-ribu atom dalam lintasannya, yang akan terjadi dalam waktu kurang dari 0,001 detik. Efek pengawetan pangan pada radiasi ionisasi berhubungan dengan kerusakan DNA yang disebabkan oleh ketidakstabilan materi genetik DNA akibat eksitasi dan ionisasi dari radiasi.
Ada tiga jenis sumber radiasi yang umumnya dapat digunakan dalam proses iradiasi pangan, yaitu:
1. Iradiasi Gamma
Sumber radiasi gamma adalah sumber yang paling umum digunakan. Radiasi gamma berasal dari radiasi foton pada bagian gamma spektrum elektromagnetik. Radioisotop yang biasanya digunakan adalah Cobalt-60 dan Cesium-137, secara teori (Doyle, 1999). Penggunaan Cobalt-60 lebih dipilih karena memiliki daya penetrasi yang besar hingga beberapa meter. Material radioaktif harus selalu dimonitor dan disimpan secara cermat untuk melindungi pekerja dan lingkungan dari sinar gamma.
2. Iradiasi Elektronik
Iradiasi elektronik menggunakan elektron yang memiliki kecepatan sangat tinggi bahkan mendekati kecepatan cahaya. Elektron merupakan suatu sumber iradiasi yang berbeda dari sumber lainnya. Radiasi elektron kurang memiliki daya penetrasi yang baik, hanya sekitar beberapa inchi.
3. Iradiasi X-ray
Sama seperti radiasi gamma, radiasi X- ray menggunakan energi foton dengan spectrum yang luas. Sumber X-ray diproduksi dengan cara menumbukkan elektron pada tantalum atau tungsten sehingga dapat digunakan sebagai sumber radioisotope. Daya penetrasi dari X-ray sebaik Cobalt-60, bahkan keuntungan dari penggunaan radiasi X-ray adalah proses ionisasi dapat dikontrol atau dihentikan dengan mengatur tumbukan elektron. Namun sistem ini memiliki kekurangan yaitu ketidakefisisiensian energi konversi dari energi elektron menjadi energi foton.
terpapar energi ionisasi dapat dilihat tingkat nilai dosis yang diterima produk. Penggunaan dosis iradiasi beserta aplikasinya pada bahan panan dapat dilihat pada Tabel 2.
Tabel 2. Dosis Iradiasi dan Aplikasinya
Dosis Rendah (0-1 kGy): Radurisation
Mencegah perkecambahan umbi-umbian (0.03-0.15 kGy)
Menghambat pematangan buah (0.25-0.75 kGy) Eliminasi parasit dan serangga (0.07-1.00 kGy)
Dosis Sedang (1-10 kGy): Radicidation
Reduksi mikroba pembusuk pada daging beku, daging unggas, danseafood beku (1.50-3.00 kGy)
Reduksi mikroba patogen pada daging beku, daging unggas, danseafood beku (3.00-7.00 kGy)
Reduksi jumlah mikroorganisme pada bumbu dan rempah untuk meningkatkan kualitas kebersihan (10.00 kGy)
Dosis Tinggi (Di atas 10 kGy):
Radappertisation
Sterilisasi daging, unggas, dan produk turunannya (25.00-70.00 kGy)
Sterilisasi untuk makanan rumah sakit (25.00-70.00 kGy) Sterilisasi untuk persediaan makanan astronot (44.00 kGy)
Komite Ahli yang dibentuk oleh FAO, IAEA, dan WHO telah berulang kali meninjau dan mendalami bukti-bukti penelitian yang berhubungan dengan kesehatan pangan iradiasi dan menyatakan bahwa makanan yang mendapat perlakuan iradiasi aman untuk dikonsumsi manusia, baik dari segi gizi, mikrobiologi, maupun toksikologi. Di Indonesia, sudah ada peraturan pemerintah yang berkaitan dengan pangan iradiasi, yaitu Peraturan Menteri Kesehatan No. 826/MENKES/PER/XII/1987 dan Surat Keputusan Menteri Kesehatan Republik Indonesia No. 152/MENKES/SK/11/1995.
B. PEPES IKAN MAS IRADIASI
Gambar 1.(a)
Bahan baku merupakan spesies Menurut Shimone berikut: kadar air antara 8.3 %, dan kadar abu
(a) Pepes ikan mas iradiasi dalam kemasan, (b)
baku ikan mas yang digunakan dalam pembuatan spesies ikan air tawar yang paling banyak dibudidayakan Shimone dan Shikata (1993), ikan mas memiliki komposisi
air antara 70.4-73.9 %, kadar protein 16.7-18.4 %, kadar abu sebesar 9.0-11.52 %. Komoditi ikan mas memiliki
dan memiliki cita rasa lumpur pada bagian senyawa geomisin (Lelana, 1983).
pembuatan pepes ikan mas iradiasi digunakan (SOP) yang telah dikembangkan dan dibakukan
iradiasi bahan pangan. Proses pengawetan iradiasi berbagai faktor yaitu tujuan dari iradiasi yang dosis aplikasi, kondisi iradiasi misalnya keberadaan
kondisi bahan pangan yang akan diiradiasi misalnya komoditi pangan. Proses pembekuan merupakan titik
pada penggunaan suhu beku -20˚C sampai -79 akibat energi ionisasi akan terperangkap dan tidak
pangan sehingga tidak terjadi rantai radikal bebas.
(b) Pepes ikan mas
pembuatan pepes ikan mas dibudidayakan di Indonesia. komposisi kimia sebagai 18.4 %, kadar lemak
6.2-mas memiliki daya awet bagian dagingnya yang
digunakan standard operating
Ikan mas, yang digunakan dalam penelitian, dibersihkan dan diberi bumbu kemudian dibungkus dengan daun pisang dan diproses panas menggunakan
inoxpran pressure cooker selama 45-60 menit pada suhu 120˚C. Pepes tersebut kemudian disimpan pada suhu -13˚C lalu dikemas menggunakan kantung laminasi PET 12μm/LDPE 2μm/Alumunium Foil 7μm/LDPE 2μm/LLDPE 50μm dalam kondisi 80% vakum (Irawati et. al., 2003). Pepes ini kemudian disterilkan dengan menggunakan radiasi pengion pada dosis minimum 45 kGy dalam kondisi beku yaitu suhu -79˚C. Dosis sterilisasi ini mengacu pada metode Association for the Advancement of Medical Instrumentation (AAMI) ISO/DIS 11137.2 berdasarkan
bioburden. Sumber radiasi pengion yang digunakan adalah Cobalt-60 dengan dosis rata-rata 5.2 kGy/jam. Proses iradiasi ini menggunakan iradiator IRKA di Badan Tenaga Nuklir Nasional Jakarta. Pepes yang sudah disterilkan selanjutnya disimpan pada suhu 28-30˚C dan dapat bertahan selama satu setengah tahun tanpa mengalami penurunan kualitas yang berarti (Irawati et. al, 2003).
Selain pepes ikan mas, produk pangan lain yang mendapatkan perlakuan pengawetan iradiasi adalah produk rendang, opor, semur, kari ayam, dan empal. Penelitian yang dilakukan terhadap sampel-sampel tersebut di atas juga menyatakan bahwa setelah masa simpan selama satu setengah tahun, kualitas dan nilai gizi dari produk tidak mengalami perubahan yang berarti.
C. KOMPONEN BIOAKTIF DALAM PEPES IKAN
Pada pembuatan pepes digunakan berbagai macam bumbu dan rempah-rempah, misalnya bawang putih, kunyit, jahe, daun sereh, lemon, dan daun salam.
Rempah-rempah yang digunakan dalam pembuatan pepes mengandung komponen bioaktif yang memiliki fungsi signifikan terhadap kesehatan maupun dapat berperan sebagai antioksidan.
1. Bawang Putih
Bawang putih (Allium sativum Linn.) mengandung komponen bioaktif alisin dan senyawa sulfida lain dalam minyak atsirinya (Whitmore dan Naidu, 2000). Alisin atau asam dialil tiosulfinat telah terbukti dapat menghambat mikroba sehingga berpotensi sebagai pengawet bahan pangan. Komponen bioaktif lainnya adalah aliin, gurwithrays, scordinin, dan ajoene (Soetomo, 1987).
2. Kunyit
Kunyit mengandung kurkumin yang dapat memberikan aktivitas sebagai antimikroba. Kurkumin memiliki sifat antibakteri, terutama pada Micrococcus pyrogenes var. Aureus karena mengandung senyawa fenolik (Ramprasad dan Siri, 1956). Kurkumin juga dapat berfungsi sebagai antioksidan, antiinflamasi, mencegah kanker serta menurunkan risiko serangan jantung (Anonim, 2006). 3. Jahe
4. Lemon
Lemon (Citrus medica Var. Lemon) banyak mengandung vitamin C yang berfungsi sebagai antioksidan (Sarwono, 1991).
5. Lengkuas
Lengkuas (Alpinia galanga (L.)Swartz) mengadung komponen bioaktif yaitu 8-pinen, 1,8-sineol, farnasen, isokariofen, dan asetokavikol asetat yang bersifat sebagai antimikroba (Rahayu, 1999). Ekstrak lengkuas juga mengandung senyawa fenolik seperti asam fenolat, turunan dehidrosinamat dan flavonoid (Duke, 1994).
6. Cabe Merah
Cabe memiliki kandungan capcaisin dan dihidrocapcaisin yang menghasilkan rasa pedas. Cabe merah juga mengandung karotenoid, yaitu capsanthin, capsorubin, carotene, dan lutein (Lukmana, 1994).
7. Daun Sereh
Daun sereh mengandung geraniol dan citronellol yang berfungsi dapat berfungsi sebagai antiseptik dan antifungal (Shadab et. al., 1992).
8. Daun Salam
D. RADIKAL BEBAS
Ketika suatu materi mengalami proses ionisasi maka akan terjadi eksitasi dan ionisasi atom dari materi tersebut akibat dari energi ionisasi. Peristiwa ini dapat menyebabkan ketidakstabilan elektron di dalam atom. Atom memiliki kondisi paling stabil pada saat elektron yang berada pada lapisan terluar memiliki pasangan elektronnya. Sedangkan yang dimaksud dengan radikal bebas adalah atom yang memiliki elektron tidak berpasangan pada lapisan kulit terluarnya dan dapat berdiri sendiri (Karlsson, 1997). Radikal bebas sangat mudah terbentuk akibat putusnya ikatan kovalen dari elektron.
Radikal bebas dapat terbentuk melalui dua cara yaitu:
1. Secara endogen : sebagai respon normal dari rantai peristiwa biokimia di dalam tubuh, baik di dalam maupun di luar sel.
2. Secara eksogen : radikal bebas timbul akibat polusi yang berasal dari luar tubuh dan bereaksi di dalam tubuh melalui inhalasi, jalur digesti, atau melalui penyerapan kulit. Misalnya akibat asap rokok, polutan, radiasi, obat-obatan, makanan tercemar, dan pestisida.
Radikal bebas memiliki kereaktifan yang sangat besar akibat elektron yang tidak stabil dan selalu berusaha mendapatkan pasangan elektron. Apabila suatu molekul terebut elektronya oleh radikal bebas maka akan terbentuk sebuah senyawa radikal baru dari molekul yang kehilangan elektronnya tersebut. Reaksi ini berjalan terus menerus sehingga disebut sebagai reaksi berantai radikal bebas. Radikal bebas yang sangat reaktif memiliki pola gerakan yang tidak beraturan sehingga dapat menimbulkan kerusakan di berbagai bagian sel (Muhilal, 1991).
Beberapa jenis radikal bebas yang dapat ditemukan dalam tubuh adalah (Gutteridge, 1995):
2. Anion superoksida radikal (O2•) : dalam larutan encer mengalami reaksi dismutase membentuk hidrogen peroksida dan oksigen.
3. Hidrogen peroksida (H2O2) : merupakan oksidan lemah yang relatif stabil, namun dengan keberadaan logam transisi dapat membentuk senyawa radikal yang reaktif. Senyawa ini dapat segera bercampur dengan air dan diperlakukan seperti molekul air oleh tubuh dan dapat berdifusi melewati membran sel.
4. Hidroksil radikal (•OH) : merupakan senyawa oksidan yang sangat berbahaya karena sangat reaktif dibandingkan dengan senyawa radikal lainnya sehingga dapat merusak sejumlah besar molekul biologis.
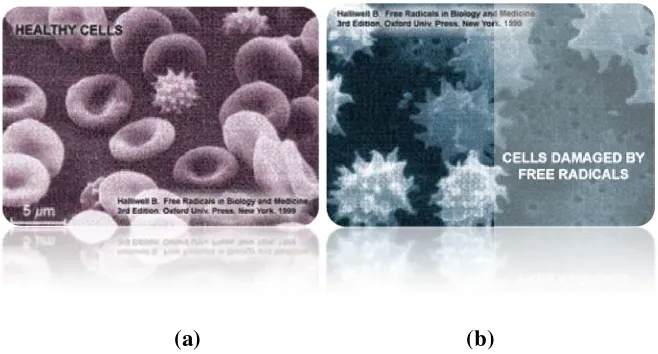
Gambar terdiri dari tiga tahap
Pada tahap
Gambar 2.(a) Sel sehat, (b) Sel yang rusak akibat
radikal bebas dalam tubuh tidak selamanya membawa Sistem imun dalam tubuh kita membutuhkan radikal pertahanannya. Selain itu senyawa asing atau jaringan ditandai oleh radikal bebas oleh sistem imun, sehingga
yang harus dibuang (Del Mastero, 1980).
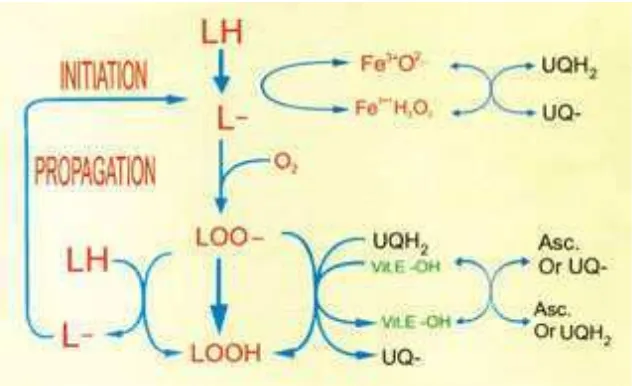
LIPID
adalah salah satu senyawa yang mudah bereaksi satunya adalah reaksi oksidasi akibat dari keberadaan
lipid umumnya melalui proses pembentukan radikal tahap yaitu inisiasi, propagasi, dan terminasi (Apriyantono, tahap inisiasi terjadi pelepasan hidrogen dari asam
radikal alkil. Hal ini terjadi karena adanya inisiator oksigen aktif, logam, dan cahaya. Radikal alkil dengan oksigen membentuk radikal peroksi yang lemak tidak jenuh lain dan membentuk hidroperoksida Radikal alkil yang terbentuk lalu akan kembali bereaksi
terus terjadi rantai reaksi radikal bebas asam lemak reaksi antara radikal alkil dengan oksigen lebih
(b) keberadaan radikal bebas . radikal bebas yang (Apriyantono, 2002). asam lemak tidak jenuh
pembentukan radikal peroksi juga lebih dominan. Reaksi terminasi sendiri biasanya melibatkan dua radikal peroksi. Tahapan peristiwa oksidasi lipid dapat dilihat pada Gambar 3.
Gambar 3.Skema tahapan dalam proses oksidasi lipid
Hidroperoksida yang berasal dari oksidasi asam lemak tidak jenuh bersifat sangat tidak stabil dan mudah berubah menjadi berbagai senyawa flavor dan produk non-volatil. Dekomposisi dari hidroperoksida akan melibatkan pemutusan gugus –OOH dan membentuk radikal alkoksi dan radikal hidroksi. Radikal alkoksi akan mengalami beta hidrolisis membentuk aldehid dan radikal alkil.
Semakin banyak jumlah ikatan rangkap pada asam lemak, maka laju oksidasi yang berjalan juga semakin cepat. Pembentukan hidroperoksida juga akan semakin besar dengan semakin banyaknya ikatan rangkap asam lemak karena dengan demikian semakin banyak pula kemungkinan posisi hidroperoksida yang dapat terjadi (Apriyantono, 2002).
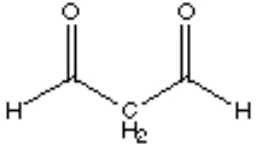
F. MALONALDEHIDA
Malonaldehida tubuh dan dapat digunakan (Bird dan Draper, pada asam lemak yang nantinya akan menghasilkan lemak lain. MDA adal sel, senyawa aldehid
Malonaldehida (MDA) merupakan produk hasil oksidasi dapat digunakan sebagai indeks ketengikan oksidatif Draper, 1984). MDA biasanya dijumpai juga sebagai
prostaglandin dan produk yang dihasilkan radikal terutama dihasilkan pada r eaksi penguraian sel. dihasilkan dari berbagai macam reaksi. Reaksi -reaksi kebocoran sistem mitokondria, oksidasi lipida, olah raga dan komponen karbohidrat serta reaksi yang
dari malonaldehida disajikan pada Gambar 4.
Gambar 4. Struktur Malonaldehida
lemak tak jenuh (PUFA) sangat mudah mengalami metilen pada bagian ikatan rangkap yang sangat oksigen dan pembentukan senyawa radikal. Oksigen
yang kehilangan hidrogen dan membentuk senyawa menghasilkan senyawa aldehid dan keton akibat
adalah salah satu senyawa aldehid yang bersifat aldehid lainnya adalah hidroaxialkenal. Konsentrasi
telah digunakan secara luas sebagai indikator Keberadaan MDA dapat mengakibatkan terjadinya ikatan
molekul sehingga menyebabkan sitotoksisitas, membran, dan modifikasi enzim dalam tubuh (Muchtadi
Conti et. al. (1991), analisa konsentrasi MDA dapat MDA dapat bereaksi dengan TBA membentuk
oksidasi lipid di dalam oksidatif dalam makanan
MDA-TBA melalui
melalui reaksi nucleophilic addition reaction. Senyawa memiliki warna merah jambu yang dapat diukur spektrofotometer pada panjang gelombang 532 nm. Reaksi
TBA pada metode pengukuran kadar malonaldehida
Gambar 5.Reaksi pembentukan kompleks MDA-TBA
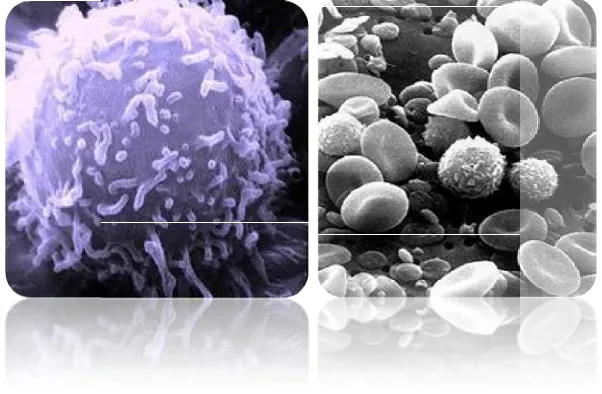
LIMFOSIT MANUSIA
adalah salah satu jenis sel darah putih dalam limfosit berperan dalam sistem perlindungan
mensekresi antibodi atau immunoglobulin respon terhadap keberadaan benda asing (Sheeler Komposisi dari sel limfosi t manusia dapat dilihat
merupakan sel dengan inti yang besar, bulat, dan manusia sekitar 3.5 x 1010 limfosit setiap hari masuk
Guyton (1987), persentase limfosit di dalam Komposisi dari sel darah putih manusia dapat dilihat penampakan dari sel darah putih dan komposis i darah
Tabel 3. Komposisi
Komposisi sel darah putih manusia (Ganong, 1979)
Sel/ml darah (rata-rata)
Batas Jumlah Normal
Persentase
9000 4000 – 11000
5400 3000 – 6000
275 150 – 300
35 0 – 100
2750 1500 – 4000
540 300 – 600
(a) (b)
Gambar 6. (a) Sel limfosit manusia, (b) Komposisi eritrosit, limfosit, monosit, neutrofil, dan
Jika dilihat di bawah mikroskop, ada dua jenis limfosit secara umum yaitu limfosit dengan granular besar dan kecil. Fungsi dari sel tersebut berhubungan dengan bentuk masing-masing. Pada umumnya limfosit granular besar disebut sel
natural killer, dan limfosit granular kecil adalah sel T dan sel B. 1. SelNatural Killer
Sel NK adalah bagian dari sistem imun alami yang ada sejak seseorang dilahirkan dan memiliki fungsi pertahanan utama dari sel tumor dan virus. Sel NK mampu membedakan sel yang terinfeksi dan sel tumor dari sel normal dengan mengenali perbedaan kadar major histocompatibility complex (MHC) kelas I pada permukaan sel. MHC adalah kumpulan gen pada genom vertebrata yang memiliki fungsi penting pada sistem imun, autoimun, dan reproduksi. MHC memiliki protein tertentu pada bagian permukaannya yang dapat mengekspresikan gen diri sendiri, sehingga dapat dibedakan dengan antigen yang berasal dari luar.
NK sel juga dikenal sebagai Large Granular Lymphocyte (LGL) karena merupakan sel dengan sejumlah besar sitoplasma dengan granula azurofilik (Kuby, 1992). Istilah ‘natural killer’diberikan karena sel ini tidak memerlukan tahap inisiasi untuk membunuh sel yang kehilangan MHC kelas I. Sel ini diaktivasi oleh respon terhadap sitokin interferon. Sel NK yang telah diaktivasi akan melepaskan granula yang bersifat sitotoksik yang menghancurkan sel abnormal (Janeway et. al., 2001).
2. Sel B
Jenis-jenis dari sel limfosit B adalah (Parham, 2005):
a. Sel B plasma (plasma sel): sel B berukuran besar yang terekspos dengan antigen dan menghasilkan antibodi dalam jumlah besar.
b. Sel B memori: terbentuk dari sel B yang teraktivasi oleh antigen tertentu yang menginvasi pada respon imun primer. Sel ini mampu hidup dalam jangka waktu yang panjang dan mampu merespon secara cepat apabila ada infeksi dari antigen yang sama.
c. Sel B-1: mengekpresi IgM lebih banyak dibandingkan IgG, reseptornya bersifat polispesifik yang menunjukkan pengenalan rendah pada berbagai macam antigen namun dapat merespons imunoglobulin lain, antigen diri, dan polisakarida dari bakteri umum.
d. Sel B-2, Sel B marginal, dan Sel B folikular. 3. Sel T
Sama seperti sel limfosit B, sel limfosit T merupakan komponen selular dalam sistem imunitas adaptif dan berfungsi dalam imunitas selular. Sel ini terbentuk saat sel stem dari sumsum tulang pindah ke kelenjar timus lalu mengalami pembelahan dan pendewasaan di dalam kelenjar thymus. Limfosit T meninggalkan kelenjar thymus dan masuk ke dalam pembuluh getah bening dan berfungsi sebagai bagian dari sistem pengawasan kekebalan (Anonim, 2006).
Di bawah mikroskop, morfologi limfosit T dan B tidak dapat dibedakan. Ada tiga jenis sel T, yaitu (Baratawidjaja, 1991):
a. Sel Thelper (Th): berperan dalam stimulasi sintesis antibodi dan aktivasi makrofag dengan cara mengsekresikan molekul protein yang disebut sitokinin.
c. Sel Tsupresor(Ts): berperan untuk menekan aktivitas sel T yang lain dan dapat menurunkan produksi antibodi sehingga berperan penting pada pengaturan toleransi imunologikal.
d. Sel Tmemory (Tm): mampu mengenali antigen spesifik dan bertahan lama setelah infeksi terjadi. Sama seperti sel B memori, sel ini juga mampu merespon secara cepat apabila terjadi pemaparan infeksi oleh antigen spesifik yang dikenali olehnya.
H. PROLIFERASI LIMFOSIT
Proliferasi adalah proses diferensiasi dan pembelahan sel secara mitosis yang merupakan fungsi biologis tubuh. Respon proliferasi sel limfosit yang diuji pada sistem in vitro dapat digunakan untuk menggambarkan fungsi limfosit dan status imun individu (Fletcher et. al., 1994). Proliferasi dari sel limfosit dapat diinduksi oleh suatu senyawa yang disebut mitogen.
Mitogen adalah senyawa yang mampu menginduksi pembelahan sel limfosit, baik sel T maupun sel B dalam presentase tinggi. Stimulasi limfosit dengan antigen atau mitogen mengakibatkan berbagai reaksi biokimia dalam sel, yaitu fosforilasi nukleoprotein, pembentukan DNA dan RNA, dan peningkatan metabolisme lemak. Beberapa mitogen hanya mampu menginduksi proliferasi sel limfosit B, beberapa yang lain hanya mampu menginduksi sel limfosit T, tetapi ada juga sebagian kecil yang mampu menginduksi keduanya secara bersamaan. Beberapa contoh dari mitogen adalah PHA (Phytohaemagglutinin), PWM (Pokeweed), Concanavalin A (Con A), dan Lipopolisakarida (LPS).
lektin. Mitogen LPS berasal dari komponen dinding sel bakteri gram negatif, yaitu
Salmonella atau Eschericia sp, dan mampu menginduksi sel B (Kresno, 1996). Aktivitas mitogenik LPS berasal dari bagian lipid yang berinteraksi dengan membran plasma dan menghasilkan aktivasi seluler (Kuby, 1992). Mitogen Con A berasal dari ekstrak tanaman kacang jack (Conavalin ensiformis). Sekitar 50-60% sel T memberikan respon terhadap stimulasi Concanavalin A (Con A) dan PHA.
Pengukuran pengujian proliferasi sel limfosit dapat dilakukan dengan melakukan pewarnaan sel menggunakan MTT. Larutan 3-[4,5-dimetilthiazol-2yl]-2,5-diphenyl tetrazolium bromide (MTT) dapat bereaksi dengan enzim suksinat dehidrogenase pada sel sehingga garam tetrazolium yang berwarna kuning menjadi kristal biru formazan yang kemudian dapat dibaca menggunakan
microplate reader (Wyllie et. al., 1998). Enzim suksinat dehidrogenase adalah enzim yang disintesis oleh mitokondria pada semua sel. Semakin banyak terbentuk warna formazan, berarti semakin banyak jumlah enzim yang menghidrolisis garam tetrazolium. Hal ini menunjukkan bahwa jumlah sel yang hidup juga banyak (Bounous et. al., 1992).
maupun negatif pada pembacaan absorbansi pada metode MTT ataupun pengambilan sel yang tidak merata pada metode pewarnaan biru tripan.
I. UJI TOKSISITAS PADA SEL LIMFOSIT
Toksisitas adalah kapasitas suatu bahan untuk memicu terjadinya reaksi berkebalikan dari mahkluk hidup yang menimbulkan efek yang tidak diharapkan oleh tubuh (Vries, 1997). Efek toksisitas sangat erat hubungannya dengan senyawa toksik. Senyawa toksik mampu membunuh sel karena menyebabkan rusaknya materi-materi genetik seperti DNA-RNA, menyebabkan denaturasi protein, dan merusak membran sel (Bitton dan Dutka, 1986).
Salah satu metode pengujian toksisitas dapat dilakukan secara in vitroyaitu dengan menggunakan sel limfosit manusia. Efek dari toksisitas suatu senyawa diamati dengan seberapa banyak sel limfosit yang mati bila dibandingkan dengan jumlah awal sel serta dengan mengamati tingkat proliferasi sel limfosit. Pengujian secarain vitro memiliki keunggulan yaitu uji yang digunakan sangat sensitif dan dampak yang ditimbulkan dapat dilihat secara langsung. Teknik pengujianin vitro
yang dikembangkan adalah teknik kultur sel.
Terdapat beberapa perbedaan karakteristik sel dalam kulturin vitrodengan sel di dalam tubuh (in vivo). Interaksi yang spesifik antar sel pada jaringan secara
in vitro hilang karena sel tersebar dan mudah bergerak, laju pertumbuhan sel semakin meningkat karena ada kemungkinan berproliferasi. Lingkungan kultur memiliki kekurangan yaitu beberapa komponen yang berpengaruh pada pengaturan homeostatik tubuh seperti sistem saraf dan sistem endokrin.
Menurut Novikoff dan Erick (1970), teknik kultur sel dapat digunakan untuk mengevaluasi dampak yang ditimbulkan dari kondisi abnormal ataupun keberadaan senyawa berbahaya pada sel, selain itu juga dapat digunakan untuk mempelajari sifat sel di luar tempat pertumbuhan alaminya. Teknik kultur sel ini biasanya juga dilakukan untuk sel limfosit. Teknik yang paling banyak digunakan dalam pengkulturan limfosit adalah tanpa agitasi dimana sel diatur berada di dasar
kondisi pertumbuhan yang mirip dengan kondisi in vivo seperti pengaturan temperatur, konsentrasi O2 dan CO2, pH, tekanan osmosis, dan kandungan nutrisi sehingga kondisi fisiologis dari kultur relatif konstan (Davis, 1994).
Kekurangan dari penggunaan kultur sel adalah hilangnya spesifitas dari sel karena pada awalnya sel bekerja secara terinteregasi dalam jaringan sedangkan di dalam kultur sel terpisah dari jaringan awal sel (Freshney, 1994). Selain kekurangan di atas, aplikasi teknik kultur sel juga harus dilakukan dalam kondisi steril sehingga membutuhkan keahlian dan ketrampilan khusus untuk mengkultur serta biaya yang relatif mahal.
Faktor yang mendukung pertumbuhan sel dalam kultur adalah media pertumbuhan sel (Malole, 1990). Media kultur sel berfungsi untuk mempertahankan pH dan osmolalitas esensial, menyediakan lingkungan yang kondusif bagi sel bertahan hidup, dan menyediakan substansi-substansi yang tidak dapat disintesis oleh sel itu sendiri. Secara umum, media kultur sel terdiri dari asam amino, vitamin, garam, glukosa, suplemen organik seperti protein, peptida, nukleotida, lipid, hormon, dan faktor pertumbuhan. Pemilihan media pertumbuhan disesuaikan dengan jenis sel yang dikultur. Media yang sering digunakan untuk mengkultur sel limfosit manusia adalah RPMI-1640 yang dikembangkan oleh Roswell Park Memorial Institute (Davis, 1994).
antimikroba yang luas, ekonomis, dan kecenderungan minimum untuk menginduksi pembentukan mikroba yang kebal.
Faktor pertumbuhan bagi sel terkadang tidak cukup hanya didapatkan dari media pertumbuhan, dibutuhkan tambahan nutrisi lain bagi pertumbuhan sel. Biasanya ditambahkan serum sebagai sumber utama faktor pertumbuhan dan faktor hormonal stimulasi pertumbuhan dan aktivitas sel. Serum yang digunakan pada umumnya adalah serum hewan yang kaya akan faktor pertumbuhan dan mengandung sedikit globulin, yaitu serum janin sapi (Fetal Bovine Serum atau
Fetal Calf Serum). Pada umumnya, serum ditambahkan dengan konsentrasi 5-20 % (Walum et. al., 1990).
III. METODOLOGI PENELITIAN
A. BAHAN DAN ALAT
Bahan baku utama yang digunakan dalam penelitian ini adalah pepes ikan mas iradiasi yang memiliki tanggal penyinaran berbeda-beda, yaitu pepes iradiasi 11 November 2006 (Pepes A), 14 Juni 2007 (Pepes B), 5 April 2008 (Pepes C), dan pepes No Label 2008 (Pepes D) serta sampel pepes kontrol yaitu pepes ikan mas yang mengalami perlakuan pengawetan dengan sterilisasi konvensional tanpa iradiasi. Sampel pepes kontrol, 14 Juni 2007, 5 April 2008, dan No Label 2008 diproduksi oleh pihak PATIR BATAN. Sementara pepes iradiasi 11 November 2006 diiradiasi oleh pihak Rel-ion. Pada pengukuran kadar malonaldehida dilakukan pengujian pada sampel A, B, C, dan D, sementara pada pengujian proliferasi limfosit hanya digunakan sampel B, C, dan D karena keterbatasan jumlah sampel A. Bahan yang digunakan untuk ekstraksi sampel adalah aquades, kertas saring,. Bahan untuk analisis proliferasi limfosit, yaitu darah manusia dari donor yang sehat, histopaque (Sigma, USA), RPMI-1640 (Sigma, USA), NaHCO3 anhidrous, gentamycin, 3-(4,5-dimethlthiazol-2-yl)-2,5-diphenyl tetrazolium bromide (MTT) (Sigma, USA), HCl-isopropanol 0.04N, larutan mitogen (Con A dan Pokeweed). Bahan yang digunakan dalam pengukuran kadar malonaldehida, yaitu larutan standar 1,1,3,3 tetraetoksipropana (TEP) (Sigma, USA), larutan PBS (phosphate buffer saline), larutan TBA 0.38 % TCA 15 % -BHT 0.5 % dalam HCl 0.25 N dingin.
malonaldehida adalah tabung reaksi, mikropipet, labu takar, waterbath, sentrifuse, tabung sentrifuse, dan spektrofotometer.
B. METODE PENELITIAN 1. Ekstraksi Sampel
Bagian daging (edible portion) dari sampel pepes ikan mas iradiasi dan pepes kontrol yang akan diujikan diambil sebanyak 15 gram untuk pengujian proliferasi limfosit dan sebanyak 10 gram untuk pengukuran kadar malonaldehida. Sampel kemudian diekstrak menggunakan aquades (perbandingan 1:1) dan dihancurkan menggunakan mortar. Hancuran sampel kemudian disaring menggunakan kain saring dan dimasukkan dalam tabung sentrifuse lalu disentrifuse dengan kecepatan 3500 rpm selama 30 menit.
Sampel yang telah disentrifuse kemudian supernatannya dipisahkan dari lemak dan minyak yang berada pada bagian paling atas. Lalu supernatannya dilewatkan pada kertas saring. Supernatan yang lolos kertas saring kemudian dilewatkan pada membran steril dengan ukuran pori 0.20 μm. Pada pengujian proliferasi limfosit digunakan ekstrak steril, namun pada pengukuran kadar malonaldehida digunakan cukup ekstrak yang lolos kertas saring.
2. Proliferasi Limfosit
(a) Persiapan Media Kultur Sel
Media yang dipergunakan untuk kultur sel limfosit adalah RPMI-1640 yang mengandung L-glutamine. Sebanyak 10.42 gram bubuk RPMI dilarutkan dalam aquabidest sebanyak 1 liter sehingga diperoleh 1 liter larutan RPMI-1640. Lalu larutan tersebut ditambahkan 2 gram NaHCO3 yang berfungsi sebagai buffer dan 10 ml gentamycin untuk mencegah pertumbuhan mikroorganisme pada media. Campuran larutan tersebut kemudian dilewatkan pada membran steril 0.22 µm hingga menjadi steril.
(b) Limfosit Darah Tepi (Nurrahman et al., 1999)
Darah dari donor yang sehat diambil secara aseptis di klinik Farfa, Dramaga, Bogor oleh seorang dokter menggunakan vacutainer darah steril. Darah tersebut kemudian dipindahkan ke dalam tabung sentrifus, pemindahan darah ini dilakukan di dalam laminar hooduntuk menjamin kesterilan proses.
Pemisahan limfosit awal dilakukan dengan sentrifuse darah selama 10 menit pada 1500 rpm. Darah akan terpisah menjadi tiga bagian, yaitu sel darah merah pada bagian bawah, lapisan buffycoat pada bagian tengah, dan plasma pada bagian atas. Lapisan buffycoatadalah bagian darah yang sebagian besar berisi sel-sel limfosit. Lapisan buffycoatini diambil dengan menggunakan mikropipet dan dilakukan pemisahan sel limfosit dengan menggunakan Histopaque
Gambar
Gambar 7. (a) Darah setelah disentrifuse dan terpisah plasma, buffycoat, dan eritrosit ,
(b) Lapisan buffycoat dan larutan Histopaque (c) Setelah disentrifuse, terjadi pemisahan
histopaque, dan limfosit.
Setelah dipisahkan, ditambahkan dengan media ml lalu disentrifuse selama 10 menit pada 1000
kali, sehinggga limfosit terpisah dari platelet,
Histopaque.
Darah AB (Nurrahman et al., 1999)
Darah dari donor bergolongan AB yang sehat diambil Dramaga, Bogor oleh seorang dokter menggunakan lalu dipindahkan ke dalam tabung sentrifus . Pemindahan
dalam laminar hood untuk menjamin kesterilan kemudian disentrifuse selama 30 menit pada 2500 rpm
bagian. Bagian yang berada di bagian atas diambil dan bagian darah tidak boleh sampai terambil. lalu dipanaskan dalam waterbath suhu 56˚C selama menggunakan membran steril 0.20μm.
(c)
diambil secara aseptis di menggunakan vacutainer emindahan darah ini sterilan proses. Darah rpm hingga terpisah diambil menggunakan bil. Bagian yang sudah
(d) Pengujian Aktivitas Proliferasi dengan metode MTT (Meiriana, 2006)
Suspensi sel limfosit dihitung menggunakan haemacytometer dengan pewarnaan biru tripan dan ditepatkan jumlahnya menjadi 2 x 106sel / ml lalu ditambahkan serum golongan darah AB sebanyak 10% dari volume akhir suspensi sel. Mula-mula ekstrak sampel dimasukkan pada masing-masing sumur pada lempeng sumur sebanyak 20 µl dan ditambahkan suspensi sel sebanyak 80 µl. Untuk kontrol standar, sumur hanya berisi RPMI dan sel, sedangkan kontrol positif, ditambahkan larutan mitogen yaitu lipopolisakarida bakteriSalmonella sp. dan pokeweed masing-masing sebanyak 20 µl. Kultur kemudian diinkubasi pada suhu 370C dengan atmosfer 5% CO2, O2 95% dan RH 96% selama 72 jam. Enam jam sebelum masa inkubasi berakhir, kultur ditambahkan dengan 10 µl larutan MTT 0.5% yang dilarutkan dalam aquades.
Setelah masa inkubasi berakhir, sebanyak 100 µl HCl-isopropanol 0.04N ditambahkan pada setiap sumur. Kemudian absorbansi masing-masing sumur diukur menggunakan ELISA reader pada panjang gelombang 570 nm. Pada penelitian ini, dilakukan pembacaan nilai absorbansi kultur dari tiga batch
Gambar dengan 2 ml larutan 0.5% BHT. Campuran selama 30 menit kemudian kemudian disentrifuse sampel diukur menggunakan Hasil pengukuran
(1,1,3,3 tetraetoksipropana) 125, 150, 175, 200,
(a) (b)
Gambar 8. (a) Kultur sel limfosit setelah inkubasi (b) Kultur sel limfosit setelah penambahan (c) Kultur sel limfosit setelah penambahan
isopropanol 0.04N
Pengujian Indeks Stimulasi (I.S) dihitung dengan berikut:
Abs ekstrak sampel Abs kontrol standar
Malonaldehida (Seligman et al., 1977)
2 ml ekstrak sampel dan kontrol yang akan diukur larutan HCl 0.25 N yang mengandung 15% TCA, Campuran tersebut kemudian dipanaskan dalam waterbath
menit kemudian didinginkan pada suhu ruang. Setelah disentrifuse pada 3000 rpm selama 15 menit. Bagian
menggunakan spektrofotometer pada panjang gelombang pengukuran sampel kemudian dibandingkan dengan kurva
tetraetoksipropana) yang memiliki variasi konsentrasi 200, dan 250 pmol/ml.
(c) TCA, 0.38% TBA, dan
4. Analisis Statistik
IV. HASIL DAN PEMBAHASAN
A. EKSTRAKSI SAMPEL
Ekstraksi adalah sebuah metode pemisahan komponen-komponen yang terlarut dari suatu campuran dengan komponen-komponen yang tidak larut dengan menggunakan pelarut yang sesuai (Leniger dan Beverloo, 1975). Metode ekstraksi padatan yang digunakan adalah mencampur seluruh bagian bahan yang akan diuji dengan pelarut, lalu bagian yang dapat terlarut dipisahkan dengan padatan tidak terlarut.
Pada penelitian ini, sebelum dilakukan pengekstrakan sampel dilakukan pengamatan subjektif terhadap bau, tekstur, dan tampilan umum pada pepes iradiasi. Tampilan umum pepes iradiasi dengan pepes kontrol tidak berbeda, bau pepes iradiasi bahkan lebih harum dibandingkan dengan pepes kontrol, namun tekstur dari pepes iradiasi lebih lunak dibandingkan dengan pepes kontrol. Bagian daging dari pepes iradiasi juga memiliki warna yang lebih kuning dibandingkan pepes kontrol, hal ini mungkin disebabkan bumbu yang lebih meresap pada bahan.
Pengekstrakan sampel dilakukan pada bagian daging ikan (edible portion) karena pada umumnya bagian tersebut yang dikonsumsi oleh masyarakat. Pelarut yang digunakan untuk ekstraksi adalah aquades sebagai pendekatan terhadap cara masyarakat dalam mengkonsumsi makanan sehari-hari, termasuk pepes, secara umum yaitu hanya minum air biasa. Perbandingan ekstraksi bahan dengan pelarut adalah 1:1.
supernatan yang lolos kertas saring kemudian dilewatkan pada membran steril dengan ukuran pori 0.20μm.
Pada pengujian proliferasi limfosit digunakan sampel steril yang dilewatkan pada membran steril, sedangkan pada pengukuran kadar malonaldehida sampel cukup digunakan ekstrak yang lolos pada kertas saring. Hal ini dilakukan karena pada teknik kultur sel dibutuhkan kondisi steril agar mencegah kontaminasi mikroorganisme yang dapat menyebabkan kesalahan pada pengujian.
Ekstrak yang akan digunakan dalam pengujian terdiri dari tiga jenis pengenceran, yaitu pengenceran satu kali, dua kali, dan empat kali. Pengenceran satu kali (1x) adalah ekstrak sampel awal yang langsung digunakan, pengenceran dua kali (2x) adalah ekstrak yang diencerkan dengan perbandingan 1:1 dari ekstrak sampel awal, dan pengenceran empat kali (4x) adalah ekstrak yang diencerkan dengan perbandingan 1:3 dari ekstrak sampel awal. Pengenceran ini dilakukan untuk mengetahui efek peningkatan ketersediaan air bebas terhadap pengujian, dimana dikhawatirkan radikal bebas yang terdapat pada sampel dapat menyerang molekul air dan membentuk radikal hidroksi yang tentunya akan mempengaruhi pengujian.
B. PROLIFERASI LIMFOSIT
1. Model Pengujian Toksisitas Kultur Limfositin vitroPada Pepes Iradiasi
Pengujian teknik kultur sel imfosit yang digunakan dalam penelitian ini termasuk dalam metode in vitro. Metode in vitro memerlukan kondisi lingkungan pertumbuhan yang sama seperti keadaaan di dalam tubuh (in vivo) agar proses biologis yang terjadi di dalam kultur sel berlangsung mendekati keadaan sebenarnya di dalam tubuh. Kondisi lingkungan yang perlu dikontrol, yaitu temperatur, pH, asupan nutrisi yang diberi, tekanan osmotik, ataupun fase gas yang sesuai (Davis, 1994). Keuntungan dari metode in vitro adalah keadaan lingkungan pertumbuhan yang cenderung lebih stabil karena dapat diamati dan diatur secara langsung, selain itu karakteristik dari sel yang ingin ditumbuhkan juga dapat diatur (Harrison, 1997).
Penggunaan membran steril dianggap cukup dalam proses sterilisasi karena mikroorganisme yang dapat mengontaminasi ekstrak tidak dapat melalui pori-pori membran. Sampel pepes yang digunakan dalam pengujian ini adalah sampel pepes B, sampel pepes C, dan sampel D. Masing-masing ekstrak kemudian diencerkan dengan perbandingan 1:1 (pengenceran 2x) dan 1:3 (pengenceran 4x) dari ekstrak sampel awal (pengenceran 1x). Pengenceran ini dilakukan untuk mengetahui efek peningkatan ketersediaan air bebas terhadap pengujian, dimana dikhawatirkan radikal bebas yang terdapat pada sampel dapat menyerang molekul air dan membentuk radikal hidroksi yang tentunya akan mempengaruhi proliferasi dari limfosit.
Menurut Singh, et. al. (2005), radiasi ionisasi akan menginduksi terbentuknya radikal bebas yang akan berinteraksi di antara sesamanya atau dengan molekul biologis yang menyebabkan pembentukan radikal bebas baru. Pembentukan radikal baru dalam matriks biologis dipercaya dapat menyebabkan kerusakan biologis bahkan dalam dosis iradiasi rendah. Beberapa dari radikal bebas ini juga bertanggungjawab atas ketidakstabilan genomik (Barcellos-Hoff, 2001).
Penelitian yang pengujian proliferasi imunomodulator pada jati belanda, dan bunga ceremai, kemuning, sedangkan ekstrak daun
proliferasi. Hal ini menyatakan mampu berperan sebagai menghambat proliferasi bagi sistem imun manusia.
Sel limfosit yang aseptis di klinik Farfa tabungvacuntainer steril. digunakan larutan Histopaque
ini mampu menahan sehingga tetap berada berada di bagian dasar. menggunakan larutan yang terkandung dalam Histopaque dapat dilihat
Gambar
yang dilakukan oleh Krismawati (2007) juga proliferasi limfosit untuk mengetahui tingkat toksisitas
pada sampel daun delima putih, daun kemuning, bunga kecombrang . Diketahui bahwa sampel kemuning, dan bunga kecombrang memicu proliferasi
daun jati belanda dengan peningkatan konsentrasi menyatakan bahwa keempat ekstrak bersifat sebagai imunomodulator, sementar a ekstrak proliferasi limfosit dan tidak dapat berperan sebagai
manusia.
yang digunakan dalam penelitian ini diisolasi Farfa Dramaga oleh seora ng tenaga ahli dengan
steril. Untuk memisahkan sel limfosit dari sel
Histopaque yang memiliki densitas 1.077 + 0.0001 menahan sel-sel agranulosit yang berdensitas rendah
berada di bagian atas, sementara sel eritrosit yang dasar. Menurut Balaban, et. al. (1987), metode larutan Histopaque dapat memisahkan lebih dari 90%
dalam darah. Hasil pemisahan sel limfosit menggunakan dilihat pada Gambar 9.
Gambar 9.Hasil pemisahan limfosit menggunakan
juga menggunakan toksisitas dan efek kemuning, daun ceremai, daun sampel daun delima putih, proliferasi sel limfosit, konsentrasi menghambat bersifat tidak toksik dan ekstrak daun jati belanda
sebagai imunomodulator
diisolasi dari darah secara dengan menggunakan sel -sel darah yang lain 0.0001 g/ml. Larutan rendah seperti limfosit yang berdensitas tinggi metode pemisahan dengan dari 90% li mfosit hidup
menggunakan larutan
Pada penelitian ini digunakan senyawa mitogen sebagai kontrol positif. Senyawa mitogen dapat memicu terjadinya proliferasi non spesifik dari sel limfosit karena senyawa ini dapat mengaktivasi hormon tirosin kinase yang merupakan faktor pertumbuhan dari sel. Hormon tirosin kinase bertanggung jawab untuk mengirimkan sinyal-sinyal yang mempengaruhi faktor transkripsi dan aktivasi gen sehingga terjadi proliferasi sel (Decker, 2001).
Senyawa mitogen yang digunakan pada penelitian ini adalah pokeweed (PWM) dan lipopolisakarida (LPS). PWM adalah senyawa mitogen yang diekstrak dari tanamanpokeweed(Phytolacca americana)dan mengandung protein lektin yang berasal dari tumbuhan. Lektin mampu mengenali perbedaan glikoprotein pada permukaan setiap sel, termasuk sel limfosit. Mitogen pokeweed dapat menginduksi proliferasi sel limfosit T dan B secara bersama-sama (Tizard, 1988). Sedangkan senyawa mitogen LPS berasal dari komponen dinding sel bakteri gram standar seperti
Salmonella typhii. LPS dapat memicu proliferasi dari sel B. Konsentrasi mitogen yang digunakan adalah 10 g/ml. Penentuan konsentrasi ini berdasarkan pada Krismawati (2007). Hasil yang diperoleh menunjukkan bahwa indeks stimulasi kontrol positif lebih tinggi bila dibandingkan dengan kontrol standar. Hal ini menunjukkan mitogen yang digunakan berfungsi dengan baik sehingga dapat memicu terjadinya proliferasi sel limfosit. Indeks stimulasi dari kontrol standar dianggap 1, sementara indeks stimulasi dari sel yang dikultur dengan mitogen Con A adalah 1.54 dan indeks stimulasi sel yang dikultur dengan mitogen LPS adalah 1.27.
asumsi berkurangnya zat-zat nutrisi yang ada untuk mendukung proses pertumbuhan sel. Medium pertumbuhan sel limfosit hanya berfungsi secara maksimal selama tiga hari, bila ingin dikultur lebih lama maka harus dilakukan penyegaran media dan penambahan glutamin.
Prinsip pengujian aktivitas proliferasi dilakukan dengan membandingkan dengan jumlah sel limfosit yang hidup tanpa penambahan ekstrak dengan sel yang ditambahkan ekstrak melalui peningkatan ataupun penurunan jumlahnya setelah inkubasi selama 72 jam. Pengukuran jumlah sel dilakukan dengan menggunakan metode MTT melalui pembacaan absorbansi kultur menggunakanmicroplate reader. Kesalahan perhitungan absorbansi dapat terjadi pada metode MTT akibat adanya kontaminasi dari bakteri ataupun khamir. Mitokondria sel bakteri juga menghasilkan enzim suksinat dehidrogenase yang dapat bereaksi dengan garam tetrazolium dari MTT sehingga menghasilkan kristal formazan berwarna biru dan menyebabkan kesalahan positif. Oleh karena itu, penelitian harus dilakukan dalam kondisi yang aseptis dan ekstrak yang digunakan harus steril untuk mengantisipasi kontaminasi yang terjadi. Tabel hasil pembacaan absorbansi uji proliferasi limfosit dapat dilihat pada Lampiran 3.
2. Pengaruh Ekstrak Pepes Iradiasi Terhadap Proliferasi Limfosit
Gambar
Gambar 10.Grafik indeks stimulasi proliferasi kultur
Perbandingan antara sampel pepes iradiasi dan sampel pepes menunjukkan bahwa sampel -sampel pepes iradiasi
lebih besar dibandingkan dengan sampel pepes memiliki nilai indeks stimulasi sebesar 1.161,
indeks stimulasi seb esar 1.356, sampel pepes C sebesar 1.289, dan sampel pepes D menunjukkan
1.347. Berdasarkan pengujian statisitik menggunakan masing-masing sampel pepes iradiasi pada pen genceran stimulasi yang tidak berbeda nyata dengan sampel pepes
99%. Selain itu saat dibandingkan nilai indeks iradiasi dan sampel pepes kontrol dengan kontrol standar
juga tidak berbeda nyata pada selang kepercayaan baik sampel pepes iradiasi maupun sampel pepes proliferasi dari limfosit maupun membunuh sel
(non-1.347
Ekstrak C Ekstrak D Kontrol Pepes
Pokeweed LPS
Pengenceran 1x Pengenceran 2x Pengenceran 4x
ultur limfosit
sampel pepes kontrol pada iradiasi memiliki nilai pepes kontrol. Sampel 1.161, sampel pepes B
C menunjukkan nilai menunjukkan nilai indeks menggunakan ANOVA genceran 1x memiliki sampel pepes kontrol pada
indeks stimulasi dari standar te rnyata nilai kepercayaan 99%. Hal ini sampel pepes kontrol tidak
Pada pengenceran 2x terlihat bahwa ekstrak pepes kontrol dengan nilai indeks stimulasi 1.259 memiliki nilai indeks stimulasi lebih besar dibandingkan dengan sampel pepes iradiasi B dan sampel pepes C yaitu dengan nilai indeks stimulasi 1.084 dan 1.144. Sedangkan sampel pepes D memiliki nilai indeks stimulasi sebesar 1.344. Pada pengujian statistik ANOVA yang digunakan terlihat bahwa nilai indeks stimulasi sampel pepes iradiasi sampel pepes kontrol pada pengenceran 2x tidak memiliki perbedaan yang nyata pada selang kepercayaan 99%. Saat dibandingkan antara nilai indeks stimulasi sampel pepes iradiasi dan pepes kontrol dengan kontrol standar ternyata nilai yang didapatkan tidak berbeda nyata pada selang kepercayaan 99%. Hal ini menyatakan bahwa baik sampel pepes iradiasi maupun sampel pepes kontrol tidak menginduksi proliferasi dari limfosit maupun membunuh sel (non-sitolitik).
Sementara itu pada pengenceran 4x terlihat bahwa sampel pepes kontrol memiliki nilai indeks stimulasi lebih besar dibandingkan dengan sampel pepes iradiasi, bahkan nilai indeks stimulasi pada sampel pepes D menunjukkan nilai yang lebih rendah dibandingkan dengan kontrol standar. Nilai indeks stimulasi dari sampel pepes kontrol adalah 1.293, nilai indeks stimulasi sampel pepes B adalah 1.105, sampel pepes C memiliki nilai indeks stimulasi sebesar 1.169, sementara nilai indeks stimulasi dari pepes D adalah 0.984. Berdasarkan pengujian statistik ANOVA yang digunakan terlihat bahwa pada pengenceran 4x, nilai indeks stimulasi sampel pepes iradiasi sampel pepes kontrol tidak memiliki perbedaan yang nyata pada selang kepercayaan 99%. Saat dibandingkan antara nilai indeks stimulasi sampel pepes iradiasi dan pepes kontrol dengan kontrol standar ternyata nilai yang didapatkan juga tidak berbeda nyata pada selang kepercayaan 99%. Hal ini menyatakan bahwa baik sampel pepes iradiasi maupun sampel pepes kontrol tidak menginduksi proliferasi dari limfosit dan sampel pepes D tidak mengurangi jumlah sel limfosit yang dikulturkan.