PENGARUH KITOSAN TERHADAP BIOLOGI
Aphis
craccivora
Koch., VEKTOR
Bean common mosaic
virus
PADA TANAMAN KACANG PANJANG
DITA MEGASARI
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN SUMBER
INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa tesis berjudul Pengaruh Kitosan terhadap Biologi Aphis craccivora Koch., Vektor Bean common mosaic virus
pada Tanaman Kacang Panjang adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, April 2016
Dita Megasari
RINGKASAN
DITA MEGASARI. Pengaruh Kitosan terhadap Biologi Aphis craccivora Koch., Vektor Bean common mosaic virus pada Tanaman Kacang Panjang. Dibimbing oleh SUGENG SANTOSO dan TRI ASMIRA DAMAYANTI.
Kacang panjang (Vigna sinensis (L.) Savi ex Hassk) adalah tanaman hortikultura yang termasuk kedalam tanaman anggota famili Fabaceae. Produksi kacang panjang di Indonesia terus mengalami penurunan dari tahun ke tahun. Kutudaun dan Bean common mosaic virus strain Black-eye Cowpea (BCMV-BlC) merupakan salah satu faktor penyebab penurunan produksi kacang panjang. BCMV sukar dikendalikan karena bersifat patogen tular benih dan dapat ditularkan oleh kutudaun sebagai vektornya. Kutudaun Aphis craccivora Koch. (Hemiptera: Aphididae) adalah spesies kutudaun yang dapat menjadi vektor BCMV penyebab penyakit mosaik. BCMV ditularkan oleh A. craccivora secara non persisten. Salah satu cara untuk mengendalikan BCMV dan vektornya adalah dengan penggunaan kitosan. Kitosan merupakan salah satu bahan yang diketahui dapat digunakan sebagai alternatif pengendalian. Kitosan dilaporkan dapat menginduksi sistem ketahanan sistemik tanaman terhadap serangan hama dan penyakit. Pada penelitian sebelumnya, kitosan komersial dengan konsentrasi 0.9% dilaporkan mampu menekan infeksi BCMV yang ditularkan oleh A. craccivora
dengan mekanisme yang belum diketahui. Penelitian ini bertujuan menguji pengaruh antixenosis, antibiosis, dan aktivitas insektisidal kitosan terhadap A. craccivora serta mekanismenya dalam menekan penularan BCMV yang ditularkan oleh A. craccivora.
dideteksi dengan metode I-ELISA, serta deteksi gen CP BCMV, PR1, dan PR3 yang dideteksi dengan metode RT-PCR.
Pengujian antixenosis kitosan terhadap kutudaun menunjukkan bahwa perlakuan kitosan berpengaruh terhadap kolonisasi dan preferensi makan kutudaun. Kolonisasi kutudaun nyata lebih rendah pada tanaman perlakuan jika dibandingkan dengan kontrol. Rerata jumlah kutudaun pada tanaman perlakuan berkisar antara 1 sampai 10 ekor per tanaman, sedangkan pada kontrol rerata jumlah kutudaun yang berkolonisasi mencapai 19 ekor. Perlakuan kitosan memiliki pengaruh antibiosis yang ditunjukkan dengan lama hidup kutudaun yang singkat, keperidian yang rendah, serta laju multiplikasi dan laju pertumbuhan intrinsik yang rendah. Perlakuan kitosan komersial dengan konsentrasi 0.9% memiliki pengaruh antibiosis terbaik terhadap kutudaun. Hasil pengujian pengaruh aktivitas insektisidal kitosan melalui metode semprot langsung dan residu menunjukkan hasil yang berbeda dalam mematikan kutudaun. Mortalitas kutudaun lebih banyak dan lebih cepat terdapat pada perlakuan metode semprot langsung.
Pengaruh perlakuan kitosan terhadap inokulasi BCMV memiliki aktivitas penekanan penularan yang baik, ditunjukkan dengan periode inkubasi yang lebih panjang, insidensi dan keparahan penyakit yang rendah serta akumulasi virus pada tanaman yang diukur menggunakan metode I-ELISA lebih rendah. Akumulasi virus pada kutudaun setelah proses makan inokulasi pada tanaman menunjukkan nilai absorbansi ELISA yang lebih tinggi jika dibandingkan dengan kontrol. Hal ini menunjukkan bahwa kitosan memiliki pengaruh penghambat makan terhadap kutudaun. Gen CP BCMV berhasil teramplifikasi pada seluruh tanaman perlakuan, baik yang diberi perlakuan kitosan murni maupun yang diberi perlakuan kitosan komersial. Ekspresi DNA gen PR3 pada tanaman perlakuan sebelum inokulasi BCMV meningkatkan endokitinase tanaman yang menyebabkan kutudaun tidak menularkan virus pada saat proses makan inokulasi. DNA gen PR1 tidak teramplifikasi baik sebelum maupun sesudah inokulasi BCMV.
SUMMARY
DITA MEGASARI. Biological Effect of Chitosan against Aphis craccivora Koch., Vector of Bean common mosaic virus on Yard Long Bean. Supervised by SUGENG SANTOSO and TRI ASMIRA DAMAYANTI.
Yard long bean (Vigna sinensis (L.) Savi ex Hassk) is a horticultural plant that belongs to family of Fabaceae. Production of yard long bean in Indonesia continues to decrease from year to year. Aphid and Bean common mosaic virus
strain Black-eye Cowpea (BCMV-BlC) are factors that causing yield loss of yard long bean. BCMV was difficult to be controlled because it is seed-borne pathogen and it can be transmitted by its vectors, i.e. aphids. Aphis craccivora Koch. (Hemiptera: Aphididae) is a species of aphids that can be a vector of BCMV that causing mosaic disease. BCMV is transmitted by A. craccivora as non persistent. One method to control BCMV and its vector is the use of chitosan. Chitosan is a material that can be used as an alternative control of many pests. Chitosan is reported as a plant systemic resistance inducer against pests and diseases. In previous research, commercial chitosan with concentration 0.9% was reported to be able to suppres BCMV infection transmitted by A. craccivora with unknown mechanism. This study aimed to examine antixenosis, antibiosis, and insecticidal effect of chitosan against A. craccivora and its mechanism in suppressing BCMV transmission by A. craccivora.
Pure chitosan with concentration 0.1%, 0.3%, 0.5%, 0.7%, 0.9 %, 1.1% and commercial chitosan with concentration 0.9% as a standard comparison were tested. Chitosan was applied by leaf spraying. The antixenosis effect of chitosan against aphids was tested by infesting 50 apterae aphids adults in the middle circle of yard long bean plants that have been sprayed with chitosan at 2 weeks after seedling. The antixenosis effect was evaluated based on the number of aphids colonize on each treated plants. The antibiosis effect of chitosan against aphids was tested by infesting 1 adult of apterae aphid on yard long bean plants that have been sprayed with chitosan at 2 weeks after seedling. The nymphs offspring born from an aphid adult of previous generation were observed at first, second and third generations. The antibiosis effect was evaluated based on the development time of the nymphs, the adult longevity, the pre-viviparity period, life cycle, reproduction period, and fecundity. The insecticidal effect of chitosan against aphids was tested by infesting 50 second instar nymphs on yard long bean plants that have been sprayed with chitosan at 2 weeks after seedling. Chitosan was applied with a direct spray and residual method. The insecticidal effect was evaluated by measuring the aphids mortality. The effect of chitosan on BCMV transmission by aphid was performed using 3 viruliferous aphids on treated plants. The incubation period, disease incidence and severity, virus accumulation in plants and aphids were detected by I-ELISA, accumulation of BCMV CP, PR1, and PR3 gene were detected by RT-PCR.
plant, while in the control plants were up to 19 aphids. The antibiosis effect of chitosan was shown by short life cycle of aphids, lower fecundity, multiplication, and intrinsic growth rate. Commercial chitosan treatment with concentration 0.9% showed the best antibiosis effect on aphids. The insecticidal effect of chitosan through direct and residual spray method showed different results on aphids mortality. The direct spray treatment caused higher and faster aphids mortality.
The effect of chitosan treatment in suppressing the inoculation of BCMV was shown by the longer incubation period, lower disease incidence and severity, and lower viral accumulation by I-ELISA. Viral accumulation in aphids after inoculation feeding on treated plants showed higher ELISA absorbance values than those on control plants. This result indicated that chitosan might have antifeedant effect on aphids. The BCMV CP gene was amplified in all plants treated with pure chitosan but not on plants treated with commercial chitosan. Expression of DNA R3 gene on treated plants before inoculation BCMV indicates the chitosan treatment increase the endochitinase that may prevent aphids in transmitting the virus during inoculation feeding period. The PR1 gene DNA was not amplified before nor after inoculation BCMV in all treatments.
© Hak Cipta milik IPB, tahun 2016
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
PENGARUH KITOSAN TERHADAP BIOLOGI
Aphis
craccivora
Koch., VEKTOR
Bean common mosaic
virus
PADA TANAMAN KACANG PANJANG
DITA MEGASARI
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Entomologi
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
Judul Tesis : Pengaruh Kitosan terhadap Biologi Aphis craccivora Koch., Vektor Bean common mosaic virus pada Tanaman Kacang Panjang
Nama : Dita Megasari
NIM : A351130061
Disetujui oleh
Komisi Pembimbing
Dr Ir Sugeng Santoso, MAgr Dr Ir Tri Asmira Damayanti, MAgr Ketua Anggota
Diketahui oleh
Ketua Program Studi Entomologi Dekan Sekolah Pascasarjana
Dr Ir Pudjianto, MSi Dr Ir Dahrul Syah, MScAgr
PRAKATA
Puji dan syukur penulis panjatkan kehadirat Allah SWT yang telah melimpahkan rahmat dan karunia-Nya sehingga penulis dapat menyelesaikan tesis
dengan judul “Pengaruh Kitosan terhadap Biologi Aphis craccivora Koch., Vektor
Bean common mosaic virus pada Tanaman Kacang Panjang” sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada program studi Entomologi, Sekolah Pascasarjana, Institut Pertanian Bogor. Penelitian ini dilaksanakan di Rumah Kaca Kebun Percobaan IPB Cikabayan Darmaga, Laboratorium Virologi Tumbuhan dan Laboratorium Taksonomi Serangga, Departemen Proteksi Tanaman, Institut Pertanian Bogor mulai bulan Maret hingga Agustus 2015.
Penulis mengucapkan banyak terima kasih kepada semua pihak yang telah membantu penulis dalam penyelesaian tugas akhir ini. Ungkapan terima kasih penulis sampaikan kepada Dr Ir Sugeng Santoso, MAgr dan Dr Ir Tri Asmira Damayanti, MAgr selaku dosen pembimbing yang telah memberikan bimbingan, arahan, dan saran yang sangat bermanfaat sejak awal penelitian hingga akhir penyusunan tesis ini. Terima kasih penulis sampaikan pula kepada Dr Ir Pudjianto, MSi selaku ketua program studi Entomologi, Dr Ir I Wayan Winasa, MSi selaku dosen penguji tamu, Dr Ir Idham Sakti Harahap MSc selaku dosen moderator dalam kolokium dan ujian tesis yang telah banyak memberikan saran dan masukan dalam penulisan tesis ini. Terima kasih penulis juga disampaikan kepada Direktorat Jenderal Pendidikan Tinggi yang telah memberikan beasiswa kepada penulis untuk menyelesaikan studi melalui Beasiswa Pendidikan Pascasarjana Dalam Negeri (BPPDN) tahun 2013.
Penghargaan dan terima kasih penulis sampaikan khususnya kepada Ibunda Dyah Wiyati dan Ayahanda Suprijanto yang telah memberikan dukungan moral maupun materiil, kasih sayang dan doa restu kepada penulis. Penulis juga menyampaikan terima kasih kepada suami Syaiful Khoiri, anak Nayaka Amirul Khoiri, bapak Yusuf, ibu Khuzaemah (Alm.), ibu Muslimah, dan adik Diyan Maharani yang telah banyak memberikan bantuan, semangat, dukungan, motivasi serta doa kepada penulis. Terima kasih juga penulis sampaikan kepada seluruh anggota laboratorium Virologi Tumbuhan, teman-teman Entomologi dan Fitopatologi serta kepada seluruh civitas akademika Departemen Proteksi Tanaman yang telah memberikan bantuan, dukungan dan motivasi dalam penyelesaian tugas akhir ini.
Semoga hasil penelitian ini dapat bermanfaat sebagai informasi dalam bidang pertanian dan dapat digunakan sebagai acuan untuk penelitian selanjutnya. Penulis menyadari masih terdapat banyak kekurangan. Kritik dan saran sangat diharapkan oleh penulis untuk perbaikan kegiatan selanjutnya.
Bogor, April 2016
DAFTAR ISI
DAFTAR TABEL xvi
DAFTAR GAMBAR xvi
DAFTAR LAMPIRAN xvi
PENDAHULUAN 1
Latar Belakang 1
Rumusan Masalah 2
Ruang Lingkup Penelitian 3
Tujuan Penelitian 4
Hipotesis 4
Manfaat Penelitian 4
TINJAUAN PUSTAKA 5
Kacang Panjang (Vigna sinensis (L.) Savi ex Hassk) 5 Kutudaun Aphis craccivora Koch. (Homoptera: Aphididae) 5
BCMV (Bean common mosaic virus) 7
Kitosan 8
Pathogenesis Related Protein (PR Protein) 9
BAHAN DAN METODE 10
Tempat dan Waktu Penelitian 10
Metode Penelitian 10
Persiapan Penelitian 10
Pelaksanaan Penelitian 11
Rancangan Percobaan dan Analisis Data 16
HASIL DAN PEMBAHASAN 17
Hasil Identifikasi Kutudaun 17
Pengaruh Antixenosis Kitosan terhadap Kutudaun 18 Pengaruh Antibiosis Kitosan terhadap Kutudaun 19 Aktivitas Insektisidal Kitosan terhadap Mortalitas Kutudaun 23 Pengaruh Perlakuan Kitosan terhadap Insidensi Penyakit, Periode
Inkubasi, dan Tipe Gejala 25
Pengaruh Perlakuan Kitosan terhadap Keparahan Penyakit dan
Akumulasi BCMV 27
Pengaruh Perlakuan Kitosan terhadap Amplifikasi Gen CP BCMV,
PR1 dan PR3 30
SIMPULAN DAN SARAN 34
Simpulan 34
Saran 34
DAFTAR PUSTAKA 35
LAMPIRAN 42
DAFTAR TABEL
1 Komposisi bahan reaksi RT-PCR BCMV 15
2 Komposisi bahan reaksi PCR 16
3 Biologi kutudaunketurunan pertama pada perlakuan kitosan 20 4 Biologi kutudaunketurunan kedua pada perlakuan kitosan 20 5 Keperidian total dan keperidian harian imago kutudaun keturunan
kedua 21
6 Rerata laju multiplikasi dan laju pertumbuhan intrinsik kutudaun
keturunan kedua 22
7 Toksisitas pengaruh aktivitas insektisidal kitosan terhadap kutudaun 24 8 Pengaruh perlakuan terhadap insidensi penyakit, periode inkubasi
virus, dan tipe gejala 26
9 Pengaruh perlakuan terhadap keparahan penyakit dan titer virus 28 10 Pengaruh perlakuan terhadap titer virus pada kutudaun 29
DAFTAR GAMBAR
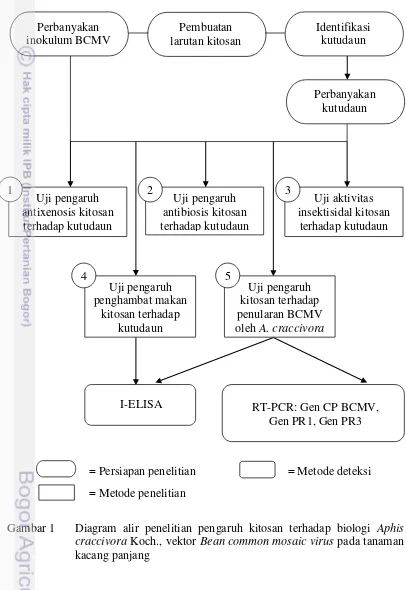
1 Diagram alir penelitian pengaruh kitosan terhadap biologi Aphis craccivora Koch., vektor Bean common mosaic virus pada tanaman
kacang panjang 3
2 Skala kategori serangan penyakit 13
3 Ciri morfologi A. craccivora. 17
4 Pengaruh perlakuan terhadap kolonisasi kutudaun 18 5 Mortalitas kutudaun pada perlakuan kitosan melalui metode semprot
langsung 23
6 Perkembangan mortalitas kutudaun pada perlakuan kitosan melalui
metode residu 24
7 Ciri fisik kutudaun akibat perlakuan kitosan 25
8 Variasi gejala pada tanaman perlakuan 27
9 Hasil amplifikasi dengan RT-PCR dan kuantifikasi DNA gen CP BCMV. Intensitas DNA diukur dengan software ImageJ. 30
10 Hasil amplifikasi dengan RT-PCR DNA gen PR1 31
Hasil amplifikasi dengan RT-PCR DNA gen PR3 32
DAFTAR LAMPIRAN
1 Sidik ragam pengaruh antixenosis kitosan terhadap kutudaun 24 JSP 43 2 Sidik ragam pengaruh antixenosis kitosan terhadap kutudaun 48 JSP 43 3 Sidik ragam pengaruh antixenosis kitosan terhadap kutudaun 72 JSP 43 4 Sidik ragam pengaruh antibiosis kitosan terhadap jumlah nimfa
5 Sidik ragam pengaruh antibiosis kitosan terhadap nimfa kutudaun
instar 1 keturunan pertama 43
6 Sidik ragam pengaruh antibiosis kitosan terhadap nimfa kutudaun
instar 2 keturunan pertama 44
7 Sidik ragam pengaruh antibiosis kitosan terhadap nimfa kutudaun
instar 3 keturunan pertama 44
8 Sidik ragam pengaruh antibiosis kitosan terhadap nimfa kutudaun
instar 4 keturunan pertama 44
9 Sidik ragam pengaruh antibiosis kitosan terhadap pre-viviparitas
kutudaun keturunan pertama 44
10 Sidik ragam pengaruh antibiosis kitosan terhadap siklus hidup
kutudaun keturunan pertama 44
11 Sidik ragam pengaruh antibiosis kitosan terhadap jumlah nimfa
pertama dari imago keturunan pertama 45
12 Sidik ragam pengaruh antibiosis kitosan terhadap nimfa kutudaun
instar 1 keturunan kedua 45
13 Sidik ragam pengaruh antibiosis kitosan terhadap nimfa kutudaun
instar 2 keturunan kedua 45
14 Sidik ragam pengaruh antibiosis kitosan terhadap nimfa kutudaun
instar 3 keturunan kedua 45
15 Sidik ragam pengaruh antibiosis kitosan terhadap nimfa kutudaun
instar 4 keturunan kedua 45
16 Sidik ragam pengaruh antibiosis kitosan terhadap pre-viviparitas
kutudaun keturunan kedua 46
17 Sidik ragam pengaruh antibiosis kitosan terhadap siklus hidup
kutudaun keturunan kedua 46
18 Sidik ragam pengaruh antibiosis kitosan terhadap lama hidup
kutudaun keturunan kedua 46
19 Sidik ragam pengaruh antibiosis kitosan terhadap keperidian total
imago kutudaun keturunan kedua 46
20 Sidik ragam pengaruh antibiosis kitosan terhadap keperidian harian imago kutudaun keturunan kedua pada hari ke-1 46 21 Sidik ragam pengaruh antibiosis kitosan terhadap keperidian harian
imago kutudaun keturunan kedua padahari ke-2 47
22 Sidik ragam pengaruh antibiosis kitosan terhadap keperidian harian imago kutudaun keturunan kedua pada hari ke-3 47 23 Sidik ragam pengaruh antibiosis kitosan terhadap keperidian harian
imago kutudaun keturunan kedua pada hari ke-4 47 24 Sidik ragam pengaruh antibiosis kitosan terhadap keperidian harian
imago kutudaun keturunan kedua pada hari ke-5 47 25 Sidik ragam pengaruh antibiosis kitosan terhadap keperidian harian
imago kutudaun keturunan kedua pada hari ke-6 47 26 Sidik ragam pengaruh antibiosis kitosan terhadap keperidian harian
imago kutudaun keturunan kedua pada hari ke-7 48 27 Sidik ragam pengaruh antibiosis kitosan terhadap laju multiplikasi
kutudaun keturunan kedua 48
28 Sidik ragam pengaruh antibiosis kitosan terhadap laju pertumbuhan
29 Sidik ragam aktivitas insektisidal kitosan dengan metode semprot langsung terhadap mortalitas kutudaun pada 24 JSP 48 30 Sidik aktivitas insektisidal kitosan dengan metode semprot langsung
terhadap mortalitas kutudaun pada 48 JSP 48
31 Sidik ragam aktivitas insektisidal kitosan dengan metode semprot langsung terhadap mortalitas kutudaun pada 72 JSP 49 32 Sidik ragam aktivitas insektisidal kitosan dengan metode residu
terhadap mortalitas kutudaun pada 48 JSP 49
33 Sidik ragam aktivitas insektisidal kitosan dengan metode residu
terhadap mortalitas kutudaun pada 72 JSP 49
34 Sidik ragam pengaruh kitosan terhadap keparahan penyakit pada 4
MSI 49
35 Sidik ragam pengaruh kitosan terhadap nilai akumulasi ELISA daun
pada 4 MSI 49
36 Sidik ragam pengaruh kitosan terhadap nilai akumulasi ELISA
PENDAHULUAN
Latar Belakang
Kacang panjang (Vigna sinensis (L.) Savi ex Hassk) adalah tanaman hortikultura yang termasuk ke dalam tanaman anggota famili Fabaceae. Kacang panjang banyak dimanfaatkan dan dibudidayakan oleh masyarakat Indonesia untuk dipanen polong dan daun mudanya sebagai sayuran (Riyadi 2006). Kacang panjang merupakan sumber protein nabati yang cukup potensial, karena banyak mengandung zat gizi, diantaranya adalah vitamin A, vitamin B, vitamin C, karbohidrat, lemak, protein, kalsium, fosfor, dan zat besi (Singh dan Singh 1992). Produksi kacang panjang di Indonesia terus mengalami penurunan dari tahun ke tahun. Pada tahun 2010 produksi kacang panjang mencapai 489 449 ton dan terus menurun hingga pada tahun 2014 produksinya hanya mencapai 450 727 ton (BPS 2015).
Damayanti et al. (2009) melaporkan bahwa terjadi ledakan penyakit di beberapa daerah di Jawa Barat (Bogor, Bekasi, Indramayu dan Cirebon) dengan gejala mosaik kuning. Salah satu virus yang berasosisasi dengan gejala mosaik kuning pada tanaman kacang panjang yang berasal dari Bubulak, Dramaga Bogor dan Sidorejo, Karanganyar Pekalongan adalah Bean common mosaic virus strain
Black-eye Cowpea (BCMV-BlC). Insidensi penyakit BCMV di lapangan dapat mencapai 100% dengan penurunan bobot polong berkisar antara 27.1%-85.2% (Susetio dan Hidayat 2014). BCMV sukar dikendalikan karena bersifat tular benih dan vektor (Hamdayanti dan Damayanti 2014).
Menurut Blackman dan Eastop (2000), kutudaun Aphis craccivora Koch. (Hemiptera: Aphididae) adalah spesies kutudaun yang dapat menjadi vektor BCMV penyebab penyakit mosaik. BCMV ditularkan oleh A. craccivora secara non persisten. Kutudaun sebagai vektor berhubungan dengan konsentrasi virus yang ditularkan, dengan asumsi setiap stilet mempunyai ukuran dan kapasitas yang sama untuk menyimpan virus (Kusnadi 1991). Aktivitas makan kutudaun pada populasi yang tinggi dapat menyebabkan malformasi pada daun, penurunan produksi, tanaman menjadi kerdil, dan akar tidak dapat berkembang (Singh dan Jackai 1985). Hal ini dikarenakan kutudaun dapat berkolonisasi dan menghisap cairan tanaman baik pada bunga, tunas, polong, dan cabang sehingga menurunkan kelangsungan hidup tanaman (Thaker et al. 1984).
Pengendalian kutudaun sebagai vektor virus telah banyak dilakukan melalui berbagai cara, diantaranya adalah sanitasi, penggunaan varietas tahan, peningkatan ketahanan tanaman inang, dan penggunaan bahan kimia sintetis (Jackai 1983). Bahan kimia sintetis banyak digunakan dalam pengendalian hama karena dapat membunuh dengan cepat. Efek samping dari penggunaan bahan kimia sintetis seperti toksisitas pada mamalia, pengguna, konsumen, organisme non sasaran, dan pencemaran lingkungan perlu diperhatikan secara serius (Alabi
et al. 2003). Penggunaan bahan kimia sintetis juga membutuhkan biaya yang cukup tinggi (Afun et al. 1991).
suatu senyawa yang dapat meningkatkan ketahanan tanaman dengan memicu aktivitas gen penginduksi ketahanan. Beberapa senyawa kimia yang telah diuji sebagai agen penginduksi ketahanan tanaman terhadap penyakit adalah asam salisilat (Zhu et al. 2004b), benzothiadiazole (Hersanti 2003), dan dikalium hidrogen fosfat (Suganda et al. 2002). Senyawa-senyawa tersebut diketahui dapat menginduksi peningkatan Pathogenesis Related Protein (PR protein) yaitu protein yang mampu menghambat perkembangan penyakit tanaman (Hammond-Kosack dan Jones 1996). PR protein berfungsi mencegah multiplikasi virus, penyebaran virus, dan lokalisasi virus (Spiegel et al. 1989).
Kitosan diketahui dapat digunakan sebagai alternatif pengendalian yang potensial karena memiliki spektrum yang luas, tidak beracun bagi organime non sasaran, dan mudah terurai (Badawy et al. 2005). Kitosan dilaporkan dapat menginduksi sistem ketahanan sistemik tanaman terhadap serangan hama dan penyakit (Boornlertnirun et al. 2008). Kitosan juga memiliki pengaruh terhadap penghambatan makan kutudaun dan aktivitas insektisidal (Zhang et al. 2003), serta memiliki pengaruh antixenosis dan antibiosis (Saguez et al. 2005). Kitosan dilaporkan memiliki pengaruh aktivitas insektisidal yang mematikan A. nerii pada tanaman oleander dan Spodoptera littoralis pada tanaman kapas di Mesir (Badawy dan El-Aswad 2012). Pengaruh aktivitas insektisidal kitosan dilaporkan mampu mematikan 70%-99% kutudaun Rhopalosiphum padi (L.),
Metopolophium dirhodum (Walker), A. gossypii (Glover), Sitobion avenae
(Fabricius), dan Myzus persicae (Sulzer) yang menyerang bunga Hyalopterus pruni (Goffroy)(Zhang et al. 2003).
Kitosan dilaporkan mampu menghambat infeksi BCMV secara mekanis sebesar 86.07% (Damayanti et al. 2013), Tobacco mosaic virus (TMV), Tobacco necrosis virus (TNV) (Chirkov 2002), Cucumber mosaic virus (CMV) (Struszczyk 2002), Peanut stunt virus (PSV) (Pospieszny 1997), Alfalfa mosaic virus (AMV) (Pospieszny dan Atabekov 1989), dan Potato virus X (Pospieszny et al. 1991). Damayanti et al. (2013) melaporkan bahwa kitosan mampu menekan infeksi BCMV melalui aplikasi kitosan pada benih, dan penyemprotan pada daun sebelum serta sesudah inokulasi mekanis BCMV. Penggunaan kitosan komersial melalui penyemprotan pada daun sehari sebelum penularan virus melalui kutudaun mampu menghambat infeksi BCMV sebesar 100% pada konsentrasi 0.9% dengan mekanisme yang belum jelas (Megasari et al. 2014).
Rumusan Masalah
Ruang Lingkup Penelitian
Ruang lingkup penelitian ini meliputi beberapa percobaan yaitu: (1) Uji pengaruh antixenosis kitosan terhadap kutudaun, (2) Uji pengaruh antibiosis kitosan terhadap kutudaun, (3) Uji aktivitas insektisidal kitosan terhadap kutudaun, (4) Uji pengaruh penghambat makan kitosan terhadap kutudaun, dan (5) Uji pengaruh kitosan terhadap penularan BCMV oleh A. craccivora.
=
Gambar 1 Diagram alir penelitian pengaruh kitosan terhadap biologi Aphis craccivora Koch., vektor Bean common mosaic virus pada tanaman kacang panjang
= Persiapan penelitian = Metode deteksi Perbanyakan
inokulum BCMV
Identifikasi kutudaun Pembuatan
larutan kitosan
Perbanyakan kutudaun
Uji pengaruh antixenosis kitosan
terhadap kutudaun 1
Uji pengaruh antibiosis kitosan terhadap kutudaun 2
Uji aktivitas insektisidal kitosan
terhadap kutudaun 3
Uji pengaruh penghambat makan
kitosan terhadap kutudaun 4
Uji pengaruh kitosan terhadap penularan BCMV oleh A. craccivora
5
I-ELISA RT-PCR: Gen CP BCMV,
Gen PR1, Gen PR3
Tujuan Penelitian
Penelitian ini bertujuan menguji pengaruh antixenosis, antibiosis, dan aktivitas insektisidal kitosan terhadap A. craccivora serta mekanisme kitosan dalam menekan penularan BCMV yang ditularkan oleh A. craccivora.
Hipotesis
Kitosan memiliki pengaruh antixenosis, antibiosis, dan aktivitas insektisidal terhadap A. craccivora serta dapat menginduksi ketahanan tanaman akibat infeksi BCMV yang ditularkan oleh A. craccivora.
Manfaat Penelitian
TINJAUAN PUSTAKA
Kacang Panjang (Vigna sinensis (L.) Savi ex Hassk)
Tanaman kacang panjang diklasifikasikan ke dalam divisi Spermatophyta, kelas Angiospermae, subkelas Dicotyledonae, ordo Rosales, famili Leguminosae, genus Vigna, spesies Vigna sinensis (L.) Savi ex Hassk. Kacang panjang berasal dari India dan Afrika Tengah, kemudian menyebar ke daerah Asia Tropis dan Indonesia. Daerah sebaran kacang panjang cukup luas dan oleh karena itu kacang panjang memiliki banyak kultivar yang sesuai dengan agroekosistem di daerah tempat tumbuhnya. Kacang panjang merupakan tanaman perdu semusim yang memiliki periode vegetatif yang relatif pendek, yaitu berkisar 60 hari. Kacang panjang biasanya dipanen polong mudanya saat berumur 45-50 hari setelah tanam (HST). Kacang panjang tumbuh merambat dengan daun majemuk, tersusun atas 3 helai. Batangnya liat dan sedikit berbulu. Bunga kacang panjang berbentuk kupu-kupu. Akarnya mempunyai bintil yang dapat mengikat nitrogen bebas dan bermanfaat untuk menyuburkan tanah (Ehlers dan Hall 1997).
Kandungan nutrisi polong muda kacang panjang dalam 100 g adalah 3.7 g protein, 0.3 g lemak, 8.5 g karbohidrat, 2.8 g serat, 114 mg kalsium, 65 mg fosfor, 1.1 mg zat besi, 1 mg natrium, 216 mg kalium, 1 035 vitamin A, 0.17 mg vitamin B1, 0.1 mg vitamin B2, 36 mg vitamin C, 1.1 mg niasin, dan menghasilkan 44 kalori (Singh dan Singh 1992).
Jenis tanah yang cocok bagi pertumbuhan kacang panjang adalah tanah bertekstur liat berpasir. Derajat keasaman tanah (pH) yang dibutuhkan adalah 5.5-6.5. Kacang panjang dapat tumbuh dengan baik pada ketinggian kurang dari 600 m dpl. Temperatur yang cocok berkisar antara 18-32 ºC dengan suhu optimal 25 ºC. Tanaman ini membutuhkan banyak sinar matahari. Curah hujan yang dibutuhkan berkisar antara 600 sampai 2 000 mm/th. Waktu tanam yang baik adalah pada awal atau akhir musim hujan (Haryanto et al. 2007).
Kutudaun Aphis craccivora Koch. (Homoptera: Aphididae)
A. craccivora Koch. termasuk dalam filum Arthropoda, sub filum Mandibulata, kelas Insecta, Ordo Homoptera, famili Aphididae, genus Aphis, spesies Aphis craccivora. A. craccivora adalah hama utama pada tanaman kacang-kacangan dan telah dilaporkan di semua benua kecuali Antartika (Nayar et al. 1976). Serangga ini bersifat kosmopolit dan polifag yang mempunyai banyak tanaman inang seperti jenis famili Leguminosae, Caricaceae, Solanaceae, Amaranthaceae dan beberapa famili tanaman lainnya (Kranz et al. 1978). A. craccivora mempunyai kemampuan hidup yang tinggi karena mampu bereproduksi secara partenogenesis (Kalshoven 1981).
2010). Siklus hidup A. craccivora pada kondisi lingkungan yang sesuai berkisar antara 5-6 hari dengan rata-rata 5.5 hari (Kranz et al. 1978).
Nimfa A. craccivora yang baru lahir berwarna hialin, kemudian secara berangsur-angsur berubah menjadi coklat dan akhirnya berwarna hitam. Nimfa yang baru lahir panjangnya 0.35 mm dan lebarnya 0.18 mm (Sutardjo 1978). Di daerah tropis reproduksi A. craccivora terjadi tanpa perkawinan (partenogenesis). Telur berkembang dalam tubuh induk dan dilahirkan dalam bentuk nimfa (Schreiner 2000). Serangga dewasa A. craccivora yang partenogenesis terdiri dari dua bentuk, yakni bentuk tidak bersayap (apterae) dan bentuk bersayap (alatae) (Blackman dan Eastop 2000).
Imago yang tidak bersayap mempunyai panjang tubuh 1.5-2 mm, kepala dan tubuhnya berwarna hitam dengan mata berwarna merah gelap hampir hitam, dan sepasang antena yang panjangnya dua pertiga panjang tubuh dan terdiri dari enam ruas. Antena tidak memiliki sensorial sekunder. Pada bagian dorsal yang berwarna hitam mengkilat, terdapat retikulasi, kecuali pada bagian ujung-ujung ruas abdomen yang memperlihatkan imbrikasi. Femur berwarna hialin sampai setengah bagian ujungnya agak hitam sampai hitam. Biasanya femur tungkai belakang lebih gelap daripada femur tungkai depan dan tengah. Tibia berwarna hampir hialin sampai pucat agak kuning atau agak coklat dan bagian ujungnya berwarna hitam. Tarsus berwarna hitam (Cottier 1953; Eastop 1961).
Bentuk kutudaun dewasa bersayap hampir sama dengan kutudaun yang tidak bersayap. Rata-rata ukuran tubuh kutudaun yang bersayap lebih kecil dibandingkan kutudaun yang tidak bersayap. Protoraks berwarna hitam dengan pita hijau sampai hijau tua tepat di depan dan di belakangnya. Skutum dan skutelum berwarna hitam. Pangkal sayap tidak berwarna sampai hijau pucat, coklat atau merah. Pembuluh-pembuluh sayap berwarna coklat sampai coklat agak hitam. Stigma berwarna kelabu coklat muda (Cottier 1953).
BCMV (Bean common mosaic virus)
BCMV termasuk ke dalam famili Potyviridae, genus Potyvirus. Potyvirus
merupakan kelompok virus terbesar yang mempunyai lebih dari 100 spesies. Partikel BCMV berbentuk filamen dengan panjang 750 nm dan lebar 12-15 nm. Tipe asam nukleatnya single stranded RNA (ssRNA/RNA utas tunggal). Kandungan asam nukleat dalam partikel virus sebesar 5%. Kandungan protein dalam coat protein sebesar 95%. Badan inklusi Potyvirus berbentuk cakra atau beberapa bentuk yang lain (Regenmortel et al. 2004). Virus ini memiliki suhu inaktivasi 50-65 ºC tergantung dari sumber inokulum, strain virus, dan kondisi lingkungan sekitar. Cairan perasan (sap) memiliki ketahanan in vitro 1-4 hari pada suhu ruang dengan batas pengenceran 10-3-10-4 (Morales dan Bos 1988).
BCMV tersebar di seluruh dunia dengan bantuan vektor dan terbawa benih. BCMV dilaporkan pertama kali di Rusia tahun 1894 kemudian di Amerika tahun 1917. Penyakit ini merupakan penyakit penting pada tanaman kacang-kacangan yang dapat menyebabkan penurunan kualitas dan hasil panen hingga 80% (Mercure 1998). Tipe gejala BCMV yang muncul tergantung dari strain virus, temperatur, dan genotip inang. Gejala yang ditunjukkan berupa mosaik pada daun utama kemudian diikuti gejala mosaik, pemucatan tulang daun (vein clearing), dan penebalan tulang daun (vein banding) (Udayashankar et al. 2010). Menurut Morales (1989) gejala BCMV dapat berupa daun menggulung ke bawah dan melengkung ke dalam, malformasi daun, mosaik yang merupakan hasil interaksi dari genotip tanaman, patogen, dan lingkungan yang ditunjukkan dengan warna hijau terang dan gelap dengan pola mosaik pada lamina daun dimulai dari trifoliet daun termuda dan menyebar dengan cepat pada seluruh sistem vaskular tanaman serta akar yang menghitam. Tanaman yang terinfeksi dapat menjadi kerdil dan menghasilkan sedikit polong yang masak lebih lambat dibandingkan dengan polong sehat.
Kitosan
Kitosan merupakan biopolimer karbohidrat alami hasil dari deasetilasi kitin, suatu komponen utama cangkang Crustaceae seperti kepiting, udang dan kerang. Kitosan adalah biopolimer alami kedua yang paling berlimpah ditemukan di alam setelah selulosa (Meyers dan Bligh 1981). Kitosan merupakan biopolimer yang tidak beracun, mudah terdegradasi, dan biokompatibel (Knorr 1984). Kitosan
merupakan heteropolimer yang terdiri dari β (1-4) 2-acetamido-2-deoksi-β -D-glucopyranose dengan berat molekul 500 000 kDa (Shahidi dan Synowiecki 1991).
Derajat deasetilasi kitosan berkisar antara 56%-99% dengan rata-rata 80%, tergantung pada spesies Crustaceae dan metode persiapan (Meyers 1995). Proses deasetilasi melibatkan penghapusan kelompok asetil dari molekul rantai kitin, meninggalkan suatu senyawa (kitosan) dengan reaktif kimia tingkat tinggi gugus amino (NH2-) yang berpengaruh terhadap sifat fisiokimia, biodegradabilitas, dan imunologi. Pigmen pada kulit Crustaceae membentuk kompleks dengan kitin
(4-keto dan tiga 4, 4’-diketo-β-karoten derivatif). Bubuk kitosan mempunyai 14 warna bervariasi dari kuning pucat hingga putih sedangkan pati dan bubuk selulosa memiliki tekstur halus dan berwarna putih (Rout 2001).
Kitosan yang bersifat antimikroba dipengaruhi oleh faktor intrinsik dan ekstrinsik seperti jenis kitosan (misalnya polos atau turunan), derajat polimerisasi, konstituen nutrisi, substrat kimia, dan kondisi lingkungan. Berat molekul kitosan yang rendah memiliki pengaruh penghambatan yang lebih besar terhadap fitopatogen dibandingkan dengan kitosan yang memiliki berat molekul yang tinggi (Hirano et al. 1989). Perbedaan berat molekul dan kandungan logam pada kitosan dapat mempengaruhi aktivitas makan kutudaun. Kandungan logam yang terdapat pada kitosan yaitu Ag, Cu, Hg, Ni, dan Zn. Semakin tinggi berat molekul kitosan dan semakin banyak kandungan logam Ag, penghambatan makan terhadap kutudaun semakin tinggi. Pengaruh aktivitas insektisidal kitosan diduga karena kemampuan menghidrolisis dietil fosfat (Badawy dan El-Aswad 2012).
Kitosan berpengaruh terhadap resistensi tanaman dari fitopatogen. Dalam beberapa penelitian, kitosan oligomer (pentamer dan heptamer) telah dilaporkan menunjukkan aktivitas yang lebih baik sebagai anti cendawan yang dipengaruhi oleh konsentrasi kitosan, pH dan suhu (Al-Hetar et al. 2011). Kitosan terbukti mampu menghambat penyebaran sistemik virus dan viroid serta meningkatkan respon hipersensitif inang terhadap infeksi patogen (Faoro et al. 2001). Kitosan menginduksi sistem pertahanan secara luas pada tanaman, salah satunya dapat menghambat penyebaran virus dan viroid pada tanaman dan meningkatkan
Systemic Acquired Resistance (SAR). Efisiensi penghambatan infeksi virus oleh kitosan tergantung pada hubungan antara inang dan virus, konsentrasi virus, dan cara aplikasi kitosan. Tingkat penekanan infeksi virus bervariasi sesuai dengan berat molekul kitosan (Kulikov et al. 2006). Kitosan mampu menekan infeksi
Alternaria alternata, Botrytis cinerea, Colletotrichum gloeosporioides (El Ghaouth et al. 1992), Erwinia amylovora, Agrobacterium tumefaciens (Helander
Pathogenesis Related Protein (PR Protein)
Sistem pertahanan tanaman terhadap serangan patogen terdiri atas pertahanan pasif dan pertahanan aktif. Mekanisme pertahanan pasif diantaranya adalah kutikula yang berlilin dan senyawa antimikroba yang bertujuan untuk mencegah terjadinya kolonisasi jaringan oleh cendawan (Osbourn 1996). Mekanisme pertahanan aktif adalah mekanisme seluler yang terinduksi oleh elisitor yang dikeluarkan oleh patogen (Kim et al. 2002). Tanaman akan bereaksi terhadap kehadiran suatu patogen dengan mengaktifkan suatu multi-komponen sistem pertahanan. Diawali dengan sinyal transduksi yang mengubah stimulus menjadi bentuk yang lain dengan melibatkan urutan reaksi biokimia di dalam sel yang dilaksanakan oleh enzim dan berhubungan melalui second messenger. Terdapat tiga mekanisme utama dalam proses penerimaan sinyal dan inisiasi transduksi sel dalam merespon sinyal dari lingkungan yaitu penerimaan sinyal oleh sel target, penguatan sinyal, dan respon seluler terhadap sinyal sehingga mengaktifkan downstream seperti pada Pathogenesis Related (PR) (Voet dan Donald 1995).
Proses interaksi pada tanaman meliputi tahapan seperti pengenalan oleh gen
R, aktivasi protein kinase, aktivasi kelompok gen Rac, fosforilasi bertingkat, dan timbulnya respon pertahanan tanaman yang berupa diproduksinya senyawa fitoaleksin dan PR protein. PR protein merupakan protein yang terakumulasi sebagai respon terhadap serangan beberapa patogen. PR protein ini dapat mendegradasi dinding sel yang tersusun oleh polisakarida, menghambat sintesis atau mungkin dapat meningkatkan resistensi terhadap beberapa patogen dan juga menunjukkan anti mikroba (Gee et al. 2001). Akumulasi PR protein pada tanaman disebabkan karena adanya infeksi lokal atau sistemik pada tanaman (Edreva 2005).
Empat belas famili dari PR protein (PR1–PR14) telah diketahui dan diidentifikasi berdasarkan fungsi atau karakteristik strukturnya. PR1 merupakan gen yang pertama kali berhasil diidentifikasi dan merupakan kelompok yang paling dominan dari PR protein (Loon dan Strein 1999). Gen PR1 pertama kali ditemukan pada tahun 1970. Sejak saat itu gen PR1 telah diidentifikasi pada tanaman Arabidopsis thaliana (kubis-kubisan), Hordeum vulgare (barley), Oryza sativa (padi), Piper longrum (lada), Solanum lycopersicon (tomat), Triticum sp. (gandum), dan Zea mays (jagung). Gen PR1 merupakan gen yang aktif sebagai reaksi tanaman terhadap infeksi patogen (Liu dan Xue 2006). Gen PR1 tidak berperan dalam menghambat patogenesitas patogen pada varietas rentan (Kurnianingsih 2008).
Gen PR3 mengkode β-1, 3-glucanase dan kitinase (Edreva 2005). Gen PR3 telah diidentifikasi pada tanaman Cicer arietinum (kacang), Cucumis sativus (mentimun), Hordeum vulgare (barley), Nicotiana tabacum (tembakau),
BAHAN DAN METODE
Tempat dan Waktu Penelitian
Penelitian ini dilaksanakan di Rumah Kaca Kebun Percobaan IPB Cikabayan Darmaga, Laboratorium Taksonomi Serangga dan Laboratorium Virologi Tumbuhan, Departemen Proteksi Tanaman, Institut Pertanian Bogor. Penelitian dilaksanakan mulai bulan Maret hingga Agustus 2015.
Metode Penelitian
Persiapan Penelitian
Identifikasi kutudaun. Kutudaun diperoleh dari pertanaman kacang panjang di Kelurahan Situ Gede, Kecamatan Bogor Barat, Kota Bogor. Identifikasi dilakukan berdasarkan buku identifikasi Blackman dan Eastop (2000), yaitu menggunakan kutudaun yang tidak bersayap (apterae). Karakter yang diamati terdiri dari kepala, abdomen, sifunkuli, kauda, dan antena.
Identifikasi kutudaun dilakukan dengan membuat preparat kutudaun. Pembuatan preparat kutudan mengacu pada Mound (2006). Kutudaun yang tidak bersayap dimasukkan ke dalam tabung reaksi yang berisi 5 mL alkohol 95% dan dipanaskan dalam penangas air selama 5 menit. Kutudaun selanjutnya dimasukkan kembali ke dalam tabung reaksi yang berisi KOH 10% dan dipanaskan hingga terlihat transparan dan dicuci dengan akuades steril sebanyak dua kali. Perlakuan selanjutnya adalah dehidrasi kutudaun, dengan cara merendam kutudaun yang telah dibersihkan dalam alkohol bertingkat secara berurutan mulai dari tingkat kepekatan 50%, 80%, 95%, dan absolut 100% selama 10 menit untuk setiap perendaman. Isi tubuh kutudaun dikeluarkan dengan cara menekan tubuh serangga tersebut menggunakan jarum dibawah mikroskop. Kutudaun yang sudah bersih diletakkan di atas gelas obyek yang diberi larutan hoyer, ditata hingga terlihat bagian-bagian tubuhnya dan ditutup dengan gelas penutup. Pembuatan slide mikroskop kutudaun dilakukan di bawah mikroskop stereo. Bagian-bagian tubuh kutudaun diamati dan diukur panjang masing-masing.
Perbanyakan kutudaun. Kutudaun yang telah diidentifikasi dibebasviruskan pada daun talas (Colocasia esculenta (L.) Schott) yang ujung tangkai daunnya dibalut dengan kapas basah. Kutudaun imago yang tidak bersayap dimasukkan ke dalam cawan petri yang berisi daun talas dan dipelihara hingga imago kutudaun melahirkan nimfa. Nimfa tersebut dipindahkan ke tanaman kacang panjang sehat varietas Parade hingga berkembangbiak untuk digunakan sebagai serangga vektor dalam penularan BCMV. Nimfa yang baru lahir tersebut bebas dari virus (Djikstra dan De Jager 1998).
Perbanyakan inokulum BCMV. Isolat BCMV strain Black-eye Cowpea
mengandung 1% mercaptoethanol dengan perbandingan 1:5 (b/v) sehingga didapatkan cairan perasan (sap). Sap dioleskan di atas permukaan daun yang telah ditaburi carborundum 600 mesh. Pengolesan dilakukan dengan menggunakan jari telunjuk, karena jari telunjuk ini sangat sensitif sehingga penekanan ke permukaan daun dapat disesuaikan dan tidak menyebabkan luka yang terlalu dalam pada permukaan daun (Djikstra dan De Jager 1998). Serbuk carborundum yang masih menempel pada permukaan daun dibilas menggunakan akuades steril yang mengalir.
Penanaman tanaman uji. Kacang panjang yang digunakan adalah kacang panjang varietas Parade. Benih kacang panjang ditanam pada polibag berukuran 30x35 cm yang diisi dengan tanah steril dan pupuk kandang dengan perbandingan 2:1. Setiap polibag ditanami dengan 3 benih kacang panjang. Pada umur 7 HST dipilih satu tanaman dengan pertumbuhan terbaik yang akan digunakan sebagai tanaman perlakuan.
Pembuatan larutan kitosan. Kitosan yang digunakan adalah kitosan murni (Biobasic) yang berasal dari cangkang kepiting (C6H11NO4)n dengan tingkat kemurnian 90% dan sebagai pembanding digunakan kitosan komersial Soft Guard Chitosan Oligo Saccharin dengan kandungan kitosan 2%. Konsentrasi kitosan murni yang digunakan dalam penelitian ini adalah 0.1%, 0.3%, 0.5%, 0.7%, 0.9%, 1.1% (KM 0.1-1.1), dan konsentrasi kitosan komersial 0.9% (KK 0.9). Kitosan murni diencerkan menggunakan asam asetat 1.5% dan aquades steril sedangkan kitosan komersial hanya diencerkan menggunakan aquades steril. Tanaman kontrol hanya disemprot menggunakan asam asetat 1.5%.
Pelaksanaan Penelitian
Uji pengaruh antixenosis kitosan terhadap kutudaun. Tanaman perlakuan yang berumur 2 MST disemprot menggunakan larutan kitosan murni dan larutan kitosan komersial sesuai dengan masing-masing perlakuan menggunakan hand sprayer mini sebanyak 3 ml kitosan/tanaman. Setiap perlakuan terdiri dari 10 ulangan. Tanaman yang telah diberi perlakuan kitosan, dimasukkan ke dalam kurungan kasa dengan susunan melingkar secara acak. Di bawah tajuk tanaman diberi alas berupa kertas karton berwarna putih. Dua puluh empat jam setelah perlakuan, 50 imago kutudaun yang tidak bersayap diinfestasikan pada bagian tengah lingkaran tanaman. Pengamatan jumlah kolonisasi kutudaun pada tanaman perlakuan dilakukan pada 24, 48, dan 72 jam setelah infestasi.
dipelihara, diamati hingga menjadi imago, melahirkan nimfa (keturunan 3), dan mati. Pengamatan dilakukan terhadap lama perkembangan nimfa, periode pre-viviparitas, siklus hidup, lama periode reproduksi, lama hidup imago, dan jumlah nimfa yang dilahirkan (Zeng et al. 1994). Laju multiplikasi (MR) dan laju pertumbuhan intrinsik (rm) dihitung menggunakan rumus:
Laju multiplikasi (MR) = jumlah nimfa yang dilahirkan/lama hidup imago (Kashyap et al. 1988)
Laju pertumbuhan intrinsik (rm) = 0.738 (log masa viviparitas)/jumlah hari mulai dari nimfa dilahirkan hingga melahirkan nimfa kembali (Wyatt dan White 1977)
Uji aktivitas insektisidal kitosan melalui metode semprot langsung terhadap kutudaun. Tanaman perlakuan yang berumur 2 MST diinfestasi 50 nimfa instar-2. Nimfa kutudaun tersebut kemudian disemprot langsung mengenai tubuhnya menggunakan larutan kitosan murni dan larutan kitosan komersial sesuai dengan masing-masing perlakuan menggunakan hand sprayer mini sebanyak dengan 3 ml kitosan/tanaman. Setiap perlakuan terdiri dari 10 ulangan. Tanaman diberi sungkup plastik untuk menghindari adanya infestasi serangga lain. Pengamatan dilakukan terhadap jumlah mortalitas kutudaun dilakukan pada 24, 48 dan 72 jam setelah perlakuan. Lethal Concentration50, 95 dihitung menggunakan analisis Probit (Finney 1971).
Uji aktivitas insektisidal kitosan melalui metode residu terhadap kutudaun. Tanaman perlakuan yang berumur 2 MST disemprot menggunakan larutan kitosan murni dan larutan kitosan komersial sesuai dengan masing-masing perlakuan menggunakan hand sprayer mini sebanyak 3 ml kitosan/tanaman. Setiap perlakuan terdiri dari 10 ulangan. Dua puluh empat jam setelah perlakuan setiap tanaman perlakuan diinfestasi 50 nimfa instar-2. Tanaman diberi sungkup plastik untuk menghindari adanya infestasi serangga lain. Pengamatan dilakukan terhadap jumlah mortalitas kutudaun dilakukan pada 24, 48, dan 72 jam setelah infestasi. Lethal Concentration50, 95 dihitung menggunakan analisis Probit (Finney 1971).
Uji pengaruh penghambat makan kitosan terhadap kutudaun. Tanaman perlakuan yang berumur 2 MST disemprot menggunakan larutan kitosan murni dan larutan kitosan komersial sesuai dengan masing-masing perlakuan menggunakan hand sprayer mini sebanyak 3 ml kitosan/tanaman. Setiap perlakuan terdiri dari 10 ulangan. Dua puluh empat jam setelah perlakuan setiap tanaman perlakuan diinfestasi 3 ekor imago kutudaun yang telah diberi periode puasa selama 30 menit dan periode makan akuisisi selama 30 menit. Kutudaun yang telah makan akuisisi dipindahkan ke tanaman perlakuan untuk periode makan inokulasi selama 120 menit. Kutudaun yang telah makan inokulasi dikoleksi dan dideteksi secara serologi.
Uji pengaruh kitosan terhadap penularan BCMV oleh A. craccivora.
Kutudaun yang digunakan merupakan kutudaun yang telah dipelihara yang dipindahkan dari tanaman kacang panjang ke dalam cawan petri untuk periode puasa selama 60 menit. Kutudaun kemudian dipindahkan ke tanaman terinfeksi BCMV yang telah bergejala untuk makan akuisisi selama 30 menit. Kutudaun yang telah makan akuisisi dipindahkan ke tanaman perlakuan sehat yang telah diberi perlakuan kitosan sehari sebelumnya untuk periode makan inokulasi selama 1 malam. Kutudaun kemudian dimatikan, tanaman dipelihara dan disiram setiap hari. Gejala yang muncul diamati setiap hari hingga 1 bulan setelah inokulasi. Peubah pengamatan yang diamati adalah sebagai berikut:
1. Periode inkubasi virus dan tipe gejala.
2. Persentase insidensi penyakit (IP) dihitung dengan rumus:
3. Persentase keparahan penyakit diamati pada 4 minggu setelah inokulasi (MSI). Skor kategori serangan penyakit yang digunakan seperti dilaporkan Megasari
et al. (2014):
Skala kategori serangan penyakit yang digunakan adalah sebagai berikut (Gambar 2):
Skor 0 = Tanaman tidak bergejala
Skor 1 = Gejala mosaik ringan dengan pemucatan tulang daun Skor 2 = Gejala mosaik sedang
Skor 3 = Gejala mosaik berat
Skor 4 = Gejala mosaik berat dengan malformasi daun yang parah, kerdil, atau mati
Gambar 2 Skala kategori serangan penyakit a. Skor 0, b. Skor 1, c. Skor 2, d. Skor 3, e. Skor 4
Deteksi BCMV secara serologi. Deteksi BCMV dilakukan pada 4 MSI. Daun kacang panjang diambil menggunakan tutup eppendorf ukuran 1.5 mL (bobot daun 1 tutup eppendorf = 0.01 g). Setiap perlakuan dibuat tiga sampel komposit. Pengaruh penghambatan makan kitosan terhadap kutudaun dideteksi setelah kutudaun makan inokulasi. Metode serologi yang digunakan untuk deteksi virus dan pengaruh penghambatan makan kitosan terhadap kutudaun adalah metode ELISA tidak langsung (Indirect-ELISA), menggunakan antiserum BCMV (Agdia, USA).
Jumlah tanaman yang bergejala
IP = x 100% Jumlah tanaman yang diamati
Sap tanaman dan sap kutudaun sebagai antigen disiapkan dengan menggerus daun kacang panjang dan kutudaun menggunakan mortar dengan bufer ekstraksi pH 9.6 (1.59 g Na2CO5, 0.293 g NaHCO3, 0.20 g NaN3 yang dilarutkan dalam 1 L air steril) dengan perbandingan 1:100 (v/v). Sebanyak 100 μL sap diisi ke dalam sumuran ELISA. Plat diinkubasi semalam pada suhu 4 ºC. Setelah itu, plat dicuci 8 kali dengan PBST (Phosphate buffer saline tween-20). Tiap sumuran diisi
dengan 100 μL antiserum BCMV (1:200) dalam ECI buffer pH 7.4 (2 g bovine serum albumin, 20 g polyvinylpyrrolidone PVP 40 000, 0.2 g NaN3 yang dilarutkan dalam 1 L air steril). Setelah itu, plat diinkubasi pada suhu 37 ºC selama 2 jam, kemudian plat dicuci 8 kali dengan PBST. Selanjutnya, masing-masing sumuran diisi dengan 100 μL enzim konjugat RaM-AP (Rabbit Antimouse IgG-Alkaline phosphatase) dalam ECI buffer dengan perbandingan (1:200) dan diinkubasi selama 1 jam pada suhu 37 ºC. Plat dicuci dengan PBST sebanyak 8 kali. Setelah plat dicuci dengan PBST, tiap sumuran diisi dengan 100 μL substrat PNP (p-nitrophenylphosphate) dan diinkubasi selama 15 sampai 60 menit pada suhu ruang. Perubahan warna diamati pada masing-masing sumuran. Hasil ELISA dianalisis secara kuantitatif dengan ELISA reader pada panjang gelombang 405 nm. Sampel dinyatakan positif jika nilai absorbansi ELISA (NAE) sampel uji 2 kali lebih besar dibandingkan kontrol negatif ELISA.
Ekstraksi RNA total. Ekstraksi RNA total secara manual mengikuti metode CTAB (Doyle dan Doyle 1987). Sebanyak 0.1 g sampel tanaman bergejala (daun) digerus menggunakan nitrogen cair dan ditambahkan 500 µL bufer ekstraksi yang mengandung (1% 2-β-mercaptoethanol). Hasil gerusan dimasukkan ke dalam tabung mikro 2 mL dan diinkubasi dalam penangas air pada suhu 65 oC selama 30 menit dan setiap 10 menit sekali dibolak-balik untuk membantu proses lisis. Setelah 30 menit tabung yang berisi sap tanaman diangkat dari penangas air dan didiamkan selama 2 menit pada suhu ruang, kemudian ditambahkan 500 µL campuran Chloroform:Isoamilalcohol (CI) (24:1). Agar tercampur dengan baik, sap dan CI divortek dengan kecepatan tinggi selama 5 menit, kemudian disentrifugasi dengan kecepatan 10 000 rpm selama 15 menit. Supernatan dipindahkan ke tabung baru dengan hati-hati, kemudian ditambahkan isopropanol dan sodium asetat (volume sebanding dengan supernatan yang diperoleh). Tabung mikro kemudian simpan pada suhu -80 oC selama 30 menit. Tabung mikro kemudian dibolak-balik sehingga terlihat benang-benang RNA, lalu disentrifugasi dengan kecepatan 10 000 rpm selama 7 menit. Setelah disentrifugasi akan terlihat pelet RNA total. Campuran supernatan dengan isopropanol dan sodium asetat dipindahkan secara hati-hati sehingga menyisakan pelet RNA. Pelet RNA yang diperoleh dicuci dengan etanol 70% sebanyak 500 µL. Pelet RNA yang telah ditambahkan etanol disentrifugasi dengan kecepatan 10 000 rpm selama 7 menit, etanol dibuang lalu tabung diletakkan secara terbalik diatas tisu selama 15 menit agar pelet kering. Pelet yang diperoleh dilarutkan dalam 50 µL bufer TE 1x (10 mM Tris-HCl pH 8.0 mM EDTA).
Tabel 1 Komposisi bahan reaksi RT-PCR BCMV
Komponen Volume (µ L)1
Bufer RT 5X
dNTP 10 mM (Thermo Scientific) (10 pmol) DTT 50 mM (Thermo Scientific) (50 pmol)
RNAse Inhibitor (Thermo Scientific) (40 unit/µ L) M-MuLV (Thermo Scientific) (200 unit/µ L) Air bebas nuklease
Oligo d(T) (Thermo Scientific) (10 pmol) RNA total
Setiap reaksi RT diinkubasi berturut-turut pada suhu 42 oC selama 60 menit dan 70 oC selama 10 menit. Produk RT selanjutnya digunakan dalam tahapan (Damayanti et al. 2009). Amplifikasi didahului dengan denaturasi awal pada suhu 94 oC selama 5 menit, dilanjutkan dengan 35 siklus yang terdiri dari denaturasi pada suhu 94 oC selama 1 menit, penempelan primer (annealing) pada suhu 68 oC selama 1 menit dan ekstensi pada suhu 72 oC selama 1 menit. Siklus terakhir ditambahkan 7 menit pada suhu 72 oC untuk tahapan sintesis dan siklus berakhir pada suhu 4 oC. DNA hasil PCR dielektroforesis pada gel agarosa.
Amplifikasi Gen PR 1. Primer yang digunakan adalah primer universal PR 1 yaitu PR1-F (5’-TAA CTA TGG AGG TAT CAA GCT GCC-3’) dan primer
PR1-R (5’-CCA GTA CGT ACG CCC GTG TGT ATA A-3’) yang berukuran ~523 pb Kurnianingsih (2008). Amplifikasi didahului dengan denaturasi awal pada suhu 94 oC selama 5 menit, dilanjutkan dengan 39 siklus yang terdiri dari denaturasi pada suhu 94 oC selama 30 detik, penempelan primer (annealing) pada suhu 55 oC selama 30 detik dan ekstensi pada suhu 72 oC selama 2 menit. Siklus terakhir ditambahkan 5 menit pada suhu 72 oC untuk tahapan sintesis dan siklus berakhir pada suhu 4 oC. DNA hasil PCR dielektroforesis pada gel agarosa.
Tabel 2 Komposisi bahan reaksi PCR
Komponen Volume (µL)1
GTG
Primer Forward
Primer Reverse
Air bebas nuklease cDNA
12.50 1.00 1.00 9.50 1.00
Total volume 25.00
1 Untuk satu reaksi
Visualisasi DNA. Visualisasi DNA hasil amplifikasi dilakukan dengan elektroforesis pada gel agarosa 1%. Sebanyak 0.3 g agarosa dicampur dengan 30 mL bufer 0.5 X TBE (Tris borate EDTA) dan dipanaskan dalam microwave
selama 2 menit hingga tercampur rata dan diamkan beberapa menit sebelum dituang pada cetakan. Setelah dituang, agarosa didiamkan selama ± 45 menit hingga mengeras. Setelah terbentuk gel dengan sumuran, sebanyak 5 µL marker
DNA dan 5 µL DNA hasil PCR dimasukkan masing-masing ke dalam sumuran gel dan dilakukan elektroforesis selama 50 menit dengan tegangan 50 volt. DNA yang telah dielektroforesis lalu direndam dalam 5% Ethidium Bromide selama 15 menit dan divisualisasi diatas UV transluminator. Pita DNA yang terbentuk pada saat elektroforesis diambil gambarnya menggunakan kamera digital.
Kuantifikasi intensitas DNA. Kuantifikasi intensitas pita DNA dikonversi menggunakan software ImageJ (imagej.net). Tinggi rendahnya intensitas DNA ditunjukkan dengan tinggi rendahnya histogram.
Rancangan Percobaan dan Analisis Data
HASIL DAN PEMBAHASAN
Hasil Identifikasi Kutudaun
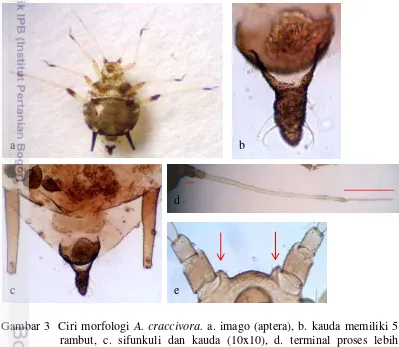
Kutudaun yang akan digunakan dalam penelitian terlebih dahulu diidentifikasi menggunakan kunci identifikasi Blackman dan Eastop (2000). Identifikasi menggunakan imago kutudaun yang tidak bersayap (apterae), berbentuk oval (seperti buah pir) dan berwarna hitam. Hasil identifikasi kutudaun yang diperoleh dari pertanaman kacang panjang di lapangan, menunjukkan bahwa spesies kutudaun tersebut adalah Aphis craccivora. Ciri-ciri penting A. craccivora
yang diamati sesuai dengan kunci identifikasi Blackman dan Eastop (2000) yaitu terminal proses lebih panjang dibandingkan dengan base antena segmen terakhir, kauda berbentuk seperti lidah yang meruncing, tuberkel antena tidak berkembang (weakly developed), sifunkuli lebih panjang jika dibandingkan dengan kauda, abdomen bagian dorsal berwarna gelap, kauda berwarna gelap, dan memiliki 4-7 rambut (Gambar 3).
Gambar 3 Ciri morfologi A. craccivora. a. imago (aptera), b. kauda memiliki 5 rambut, c. sifunkuli dan kauda (10x10), d. terminal proses lebih panjang dibandingkan dengan base antena segmen terakhir (40x10), e. tuberkel antena (10x10)
a b
c
d
Pengaruh Antixenosis Kitosan terhadap Kutudaun
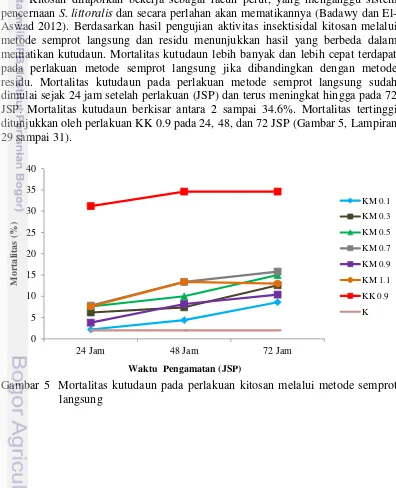
Perlakuan kitosan berpengaruh terhadap kolonisasi dan preferensi makan kutudaun. Kolonisasi kutudaun nyata lebih rendah pada tanaman perlakuan jika dibandingkan dengan kontrol. Kolonisasi kutudaun yang nyata lebih rendah pada tanaman perlakuan sudah terlihat sejak pengamatan pertama. Rerata jumlah kutudaun pada tanaman perlakuan berkisar antara 1-10 ekor per tanaman, sedangkan pada kontrol rerata jumlah kutudaun yang berkolonisasi mencapai 19 ekor. Penghambatan kolonisasi tertinggi ditunjukkan oleh perlakuan KK 0.9 (Gambar 4, Lampiran 1, 2, dan 3).
Gambar 4 Pengaruh perlakuan terhadap kolonisasi kutudaun
Kitosan yang disemprotkan pada permukaan daun diduga memiliki pengaruh antixenosis terhadap kutudaun. Antixenosis merupakan mekanisme pertahanan diri berupa morfologi, fenologi, dan bau tidak sedap dari bagian tanaman untuk menolak kehadiran hama pengganggu (Niks et al. 2011). Antixenosis dapat dievaluasi melalui penurunan jumlah kolonisasi hama (Hesler
et al. 2007). Antixenosis mungkin merupakan modal resistensi tanaman terhadap kutudaun, sehingga dapat mencegah atau menunda kolonisasi kutudaun, dan mengurangi potensi infestasi yang dapat mencapai ambang ekonomi. Pencegahan kolonisasi kutudaun dapat secara efektif mengelola populasi awal kutudaun dan proporsi keturunan yang dihasilkan. Kutudaun yang terhalang untuk menetap pada tanaman kacang panjang yang diberi perlakuan kitosan, memungkinkan kutudaun untuk terus menemukan inang yang sesuai dan potensi kutudaun untuk dimangsa predator sebelum menemukan tanaman inang yang sesuai menjadi lebih besar.
Hidrokarbon dari kitosan yang melapisi permukaan daun tanaman dapat menjadi pertahanan tanaman terhadap kolonisasi kutudaun (Woodhead dan Padgham 1988). Kolonisasi kutudaun juga dipengaruhi oleh kesuburan dan pertumbuhan tanaman, warna daun serta kondisi lingkungan pertanaman (Coleson dan Miller 2005). Tanaman kacang panjang yang disemprot menggunakan ekstrak nimba mampu menurunkan kolonisasi kutudaun. Penurunan kolonisasi kutudaun disebabkan karena zat azadirachtin pada nimba memiliki pengaruh penghambat
makan yang menyebabkan kutudaun kelaparan dan mati (Saxena 2004). Mekanisme antixenosis dilaporkan mampu menekan perkembangan populasi wereng batang coklat yang bersifat sebagai vektor virus pada tanaman padi di Asia Tenggara (Cohen et al. 1997).
Pengaruh Antibiosis Kitosan terhadap Kutudaun
Perlakuan kitosan diduga memiliki pengaruh antibiosis terhadap perkembangbiakan kutudaun, hal ini dapat dilihat berdasarkan jumlah nimfa pertama yang dilahirkan oleh imago kutudaun yang diinfestasikan pada tanaman perlakuan nyata lebih rendah jika dibandingkan dengan kontrol (Tabel 3, Lampiran 4). Antibiosis merupakan kemampuan tanaman untuk membatasi dan mereduksi perkembangbiakan hama setelah terjadi kontak dengan tanaman. Antibiosis pada serangga dapat dievaluasi dari tingginya mortalitas, rendahnya laju perkembangbiakan hama, dan menurunnya kemampuan reproduksi imago (Niks et al. 2011). Pengaruh antibiosis juga dilaporkan mampu mereduksi fekunditas A. glycines pada tanaman kedelai yang toleran (Hesler et al. 2007).
Perkembangan kutudaun terdiri atas nimfa dan imago. Kutudaun mempunyai 4 instar dalam perkembiakannya, perubahan tiap instar ditandai dengan pergantian kulit. Pada keturunan kutudaun pertama, perlakuan kitosan berpengaruh terhadap lama stadia nimfa instar 2 dan 3. Nimfa instar 2 dan 3 pada perlakuan KM 0.3 dan KK 0.9, serta nimfa instar 3 pada perlakuan KM 0.9 menunjukkan stadia nimfa lebih lama dan berbeda nyata jika dibandingkan dengan perlakuan lainnya dan kontrol. Perlakuan kitosan tidak berpengaruh nyata terhadap lama stadia nimfa instar 1 dan 4. Menurut Listihani (2015) nimfa instar 1 belum aktif mencari makanan karena nutrisi yang diperoleh dari induknya masih mampu mencukupi kebutuhan hidupnya selama instar 1, sedangkan pada nimfa instar 4 kemungkinan nimfa instar 4 telah mampu beradaptasi dengan adanya perlakuan kitosan. Pre-viviparitas pada perlakuan kitosan tidak berpengaruh secara signifikan. Siklus hidup kutudaun keturunan pertama berkisar antara 4.5-7.8 hari. Siklus hidup terlama ditunjukkan oleh perlakuan KK 0.9 (Tabel 3, Lampiran 5 sampai 10). Siklus hidup kutudaun yang lebih lama mempengaruhi laju reproduksinya dan memungkinkan musuh alami memiliki peluang yang lebih besar untuk memangsanya (Listihani 2015).
Tabel 3 Biologi kutudaunketurunan pertama pada perlakuan kitosan
Perlakuan1 Jumlah Nimfa Pertama2 Instar 1 Instar 2 Instar 3 Instar 4 Pre-viviparitas Siklus Hidup KM 0.1
1 KM (0.1-1.1): Konsentrasi perlakuan kitosan murni, KK (0.9): Konsentrasi perlakuan kitosan komersial, K: Kontrol tanpa perlakuan kitosan
2 Angka yang diikuti huruf mutu berbeda pada kolom yang sama menunjukkan hasil berbeda nyata (uji selang berganda Duncan α=0.05)
Tabel 4 Biologi kutudaunketurunan kedua pada perlakuan kitosan Perlakuan1 Jumlah Nimfa
1 KM (0.1-1.1): Konsentrasi perlakuan kitosan murni, KK (0.9): Konsentrasi perlakuan kitosan komersial, K: Kontrol tanpa perlakuan kitosan
Tabel 5 Keperidian total dan keperidian harian imago kutudaun keturunan kedua
1 KM (0.1-1.1): Konsentrasi perlakuan kitosan murni, KK (0.9): Konsentrasi perlakuan kitosan komersial, K: Kontrol tanpa perlakuan kitosan
2 Angka yang diikuti huruf mutu berbeda pada kolom yang sama menunjukkan hasil berbeda nyata (uji selang berganda Duncan α=0.05)
Perlakuan kitosan juga berpengaruh terhadap total keperidian dan keperidian harian imago kutudaun keturunan kedua jika dibandingkan dengan kontrol (Tabel 5, Lampiran 19 sampai 26). Keperidian kutudaun terendah pada tanaman perlakuan selama periode reproduksi ditunjukkan oleh perlakuan KK 0.9 dengan keperidian hariannya berkisar antara 0 sampai 5.8 ekor per hari. Menurut Kuswanto dan Budi (2007) menurunnya jumlah nimfa yang dilahirkan oleh setiap imago kutudaun dapat menurunkan populasinya. Keperidian kutudaun pada tanaman kacang panjang yang telah diberi aplikasi PGPR menurun karena protein yang diserap tidak cukup memenuhi kebutuhan nutrisinya (Listihani 2015). Kualitas pakan dapat mempengaruhi perilaku makan dan penggunaan nutrisi. Kualitas pakan yang kurang baik menyebabkan peningkatan konsumsi yang berdampak pada perpanjangan waktu perkembangan (Chown dan Nicolson 2004). Laju multiplikasi (MR) dan laju pertumbuhan instrinsik (rm) adalah kostanta yang digunakan untuk menggambarkan dinamika perkembangan sebuah populasi. Parameter ini biasa digunakan untuk mengetahui sesuai tidaknya suatu habitat dan makanan bagi pertumbuhan dan perkembangan serangga, semakin tinggi nilai MR dan rm maka semakin sesuai habitat dan makanan bagi serangga tersebut (Laamari et al. 2008). Laju multiplikasi kutudaun pada seluruh perlakuan menunjukkan nilai laju multiplikasi yang lebih rendah dan berbeda nyata jika dibandingkan dengan kontrol. Laju pertumbuhan intrinsik kutudaun pada perlakuan KK 0.9 memiliki nilai laju pertumbuhan intrinsik terendah. Nilai laju multiplikasi dan laju pertumbuhan intrinsik terendah ditunjukkan oleh perlakuan KK 0.9 (Tabel 6, Lampiran 27 dan 28). Perlakuan KK 0.9 memiliki pengaruh antibiosis terbaik yang ditunjukkan dengan lama hidup yang singkat, keperidian yang rendah, laju multiplikasi, dan laju pertumbuhan intrinsik yang rendah. Siklus hidup yang panjang berdampak pada perpanjangan waktu generasi dan penurunan generasi serta mengurangi laju multiplikasi dan laju pertumbuhan intrinsik serangga (Kingsolver 2007).
Tabel 6 Rerata laju multiplikasi dan laju pertumbuhan intrinsik kutudaun keturunan kedua
Perlakuan1 Laju Multiplikasi2 (MR) Laju Pertumbuhan Intrinsik (rm) KM 0.1
komersial, K: Kontrol tanpa perlakuan kitosan
2 Angka yang diikuti huruf mutu berbeda pada kolom yang sama menunjukkan hasil berbeda
Aktivitas Insektisidal Kitosan terhadap Mortalitas Kutudaun
Perkembangan kesehatan akibat residu pestisida pada buah dan sayur telah menggeser pola pengendalian hama dan penyakit dari penggunaan pestisida ke pengendalian secara biologi. Pestisida adalah zat atau campuran dari zat-zat tertentu baik alami maupun sintetik yang diformulasikan untuk mengendalikan hama pengganggu yang mengakibatkan kerusakan pada tanaman. Berdasarkan cara kerjanya maka pestisida dibedakan atas racun kontak dan racun perut (sistemik). Pestisida yang bersifat kontak tidak berpenetrasi ke dalam jaringan tanaman dan tidak turut serta dalam sistem vaskularisasi tanaman. Pestisida yang bersifat sistemik, racun akan masuk ke dalam organ-organ tanaman baik lewat akar, batang ataudaun (Syarief dan Hariadi 1993). Insektisida merupakan bahan yang mengandung senyawa kimia beracun yang bisa mematikan semua jenis serangga. Untuk mematikan serangga, insektisida masuk dalam tubuh serangga melalui lambung, kontak dan pernafasan (Wudianto 2007).
Pengujian aktivitas insektisidal kitosan melalui metode residu menunjukkan hasil yang kurang baik dalam mematikan kutudaun. Mortalitas kutudaun pada perlakuan metode residu baru dimulai sejak 48 JSP. Mortalitas tertinggi hanya mencapai 6.4% yang ditunjukkan oleh perlakuan KK 0.9. Perlakuan kontrol tidak menunjukkan adanya mortalitas kutudaun (Gambar 6, Lampiran 32 dan 33).
Gambar 6 Perkembangan mortalitas kutudaun pada perlakuan kitosan melalui metode residu
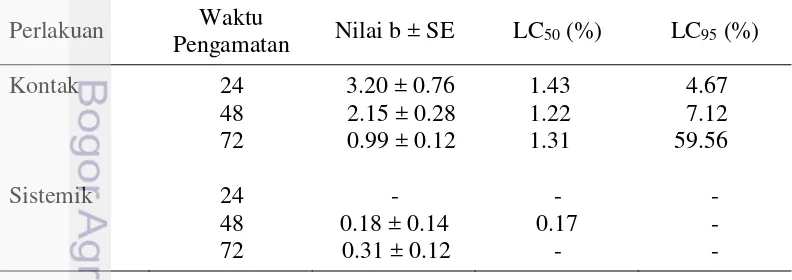
Aktivitas insektisidal kitosan dapat diukur melalui nilai LC50 dan LC95. LC50 dan LC95 merupakan konsentrasi yang dibutuhkan untuk membunuh kutudaun lebih dari 50% dan 95%. Pengaruh aktivitas insektisidal kitosan melalui metode semprot langsung pada 24 JSP memiliki nilai LC50 dan LC95 sebesar 1.43% dan 4.67%. Nilai konsentrasi tersebut lebih tinggi dari konsentrasi yang digunakan dalam pengujian ini. Aktivitas insektisidal kitosan melalui metode semprot langsung pada 24 JSP tidak dapat dihitung, hal ini mungkin disebabkan karena nilai konsentrasi yang dibutuhkan terlalu tinggi (Tabel 7). Berdasarkan hasil pengujian, kitosan tidak efektif menyebabkan mortalitas kutudaun pada konsentrasi uji, namun penambahan tinggi konsentrasi dapat menyebabkan toksisitas pada tanaman, selain itu konsentrasi kitosan yang tinggi kurang ekonomis apabila diaplikasikan di lapangan.