ANTIGEN EKSKRETORI/SEKRETORI STADIUM L3 Ascaridia galli
SEBAGAI PEMICU PEMBENTUKAN IMUNOGLOBOLIN YOLK
(IgY) PADA AYAM PETELUR
DARMAWI
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI DISERTASI DAN SUMBER INFORMASI
Dengan ini saya menyatakan bahwa disertasi Antigen Ekskretori/Sekretori Stadium L3 Ascaridia galli Sebagai Pemicu Pembentukan Imunoglobulin Yolk
(IgY) Pada Ayam Petelur adalah karya saya sendiri dengan arahan komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan manapun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir disertasi ini.
Bogor, Agustus 2007
Darmawi
RINGKASAN
DARMAWI. Antigen Ekskretori/Sekretori Stadium L3 Ascaridia galli Sebagai Pemicu Pembentukan Imunoglobulin Yolk (IgY) Pada Ayam Petelur. Dibawah bimbingan RISA TIURIA PRIOSOERYANTO, RETNO DAMAYANTI SOEJOEDONO, dan FACHRIYAN HASMI PASARIBU.
Ascaridiosis disebabkan oleh infeksi cacing nematoda parasitik Ascaridia galli. Penelitian telah dilakukan untuk mendapatkan antigen ekskretori/sekretori stadium L3 A. galli sebagai pemicu pembentukan imunoglobulin Y (IgY) anti-ascaridiosis pada ayam petelur. Dosis 6000 L2 diberikan kepada 100 ekor ayam, dan tujuh hari kemudian larva yang sudah menetas (L3) diambil kembali dari dalam usus halus. L3 dikultur secara in vitro (5 - 10/ml) dalam rosswell park memorial institute
(RPMI 1640), pH 6,8, tanpa merah fenol dalam inkubator pada temperatur 37oC dan 5% CO2 selama 3 hari. Untuk mendapatkan antigen ekskretori/sekretori, medium kultur dipekatkan dengan vivaspin 30.000 MWCO, dan kuantitas protein antigen dihitung dengan metode Bradford. Berat molekul ekskretori/sekretori ditentukan dengan sodium dodecyl sulphate polyacrylamide gel electrophoresis (SDS PAGE).
Imunisasi aktif pertama pada ayam dengan dosis 80 μg diaplikasikan secara intramuskular. Imunisasi diulang tiga kali dengan dosis 60 μg dalam interval waktu satu minggu. Pada imunisasi pertama, antigen ekskretori/sekretori dicampur dalam
fruend adjuvant complete dan imunisasi selanjutnya antigen dicampur dalam freund adjuvant incomplete. Telur ayam dikoleksi mulai hari ke-49 pascaimunisasi. Anti-ascaridiosis IgY diekstraksi dari kuning telur dengan menggunakan ammonium sulphate dan dipurifikasi melalui fast performance liquid chromatography (FPLC).
Kuantitas IgY murni ditentukan dengan metode Bradford ( = 280 nm). Antibodi dideteksi dengan uji agar gel precipitation test (AGPT) dan enzyme linked immunosorbant assay (ELISA). Deteksi antigen A. galli dilakukan secara imunohistokimia. Potensi IgY diuji terhadap populasi cacing A. galli secara in vivo. Ayam ditantang dengan dosis 1000 L2 A. galli. Ayam dimunisasi pasif setiap hari dengan dosis 0,875 mg secara oral selama 10 hari.
SUMMARY
DARMAWI. Excretory/Secretory Antigen of Ascaridia galli L3 Stage to Trigger Yolk
Immunoglobulin in Laying Hens. Under advisory of RISA TIURIA PRIOSOERYANTO, RETNO DAMAYANTI SOEJOEDONO, and FACHRIYAN HASMI PASARIBU.
Ascaridiosis caused by the nematode Ascaridia galli. A study was carried out to characterize excretory/secretory antigen of A. galli from larval stage to trigger anti-ascaridiosis yolk immunoglobulin in laying hens. A. galli L3 were recovered
from intestines of 100 heads chickens 7 days after oesophagus inoculation with 6000 L2. L3 recovered in this manner were cultured (5 – 10 ml-1) in flasks containing
rosswell park memorial institute (RPMI) 1640 media, pH 6.8, without phenol red. Cultures were incubated at 370C in 5% CO2 and culture fluid was collected after 3
days in culture. To prepare excretory/secretory antigen, culture medium were concentrated with vivaspin 30.000 MWCO, and antigen protein concentration were counted as described in Bradford method. The molecular weight of excretory/secretory antigen was determined with sodium dodecyl sulphate polyacrylamide gel electrophoresis (SDS PAGE).
Active immunizations were applied intra muscularly of chickens with an initial dose of 80 µg. The immunizations were repeated three times with dose of each 60 µg with an interval of one week. The first immunizations were excretory/secretory antigen mixed with fruend adjuvant complete and subsequently mixed with freund adjuvant incomplete. The chicken’s eggs were collected from 49 day after immunizations. Anti-ascaridiosis yolk immunoglobulin (IgY) was extracted from egg yolks by means of ammonium sulphate and purified using fast performance liquid chromatography (FPLC). The purity of anti-ascaridiosis IgY was determined by Bradford method (Ȝ = 280 nm). Antibody was detected by agar gel precipitation test (AGPT) and enzyme linked immunosorbant assay (ELISA). Antigen were detected with immunohistochemistry. Chickens were challanged with dose of 1000 L2 A. galli.
Passive immunizations were applied ten times with dose of each 0,875 mg IgY with an interval of one day intra orally.IgY anti-ascaridiosis was tested against A. galli survivalin vitro.
The result showed that percentage of L2 developed L3 was 12.7%. The
excretory/secretory antigen protein concentration was 0,595 mg/ml, the molecular weight was 28 kDa. IgY concentration after purification was 0,875 ± 0.251 mg/ml. Antibody was begun positive with AGPT at four weeks after immunization. The highest titer of serum was 2,63 ± 1,20 OD (optical density) reached at three weeks after infection and the lowest was 1,51 ± 0,48 OD can be triggered by using active immunizations. Antigen were able detected with IgY in cuticle and intestines of A. galli. Antibody levels were positively correlated with worm burden at 12 weeks after infection. Active combined with passive immunizations significantly (P < 0.05) decreased A. galli survival in intestine of laying hens. This research concluded that the excretory/ secretory antigen was able to trigger humoral immune responses against parasitic diseases caused by A. galli. Our results suggest that A. galli larvae excretory/secretory product contain protective antigen and that antibody-mediated mechanisms contribute to immune protection.
© Hak cipta cipta milik Institut Pertanian Bogor, tahun 2007 Hak cipta dilindungi
Dilarang mengutip dan memperbanyak tanpa izin tertulis dari Institut Pertanian Bogor, sebagian atau seluruhnya dalam bentuk apapun, baik cetak, fotokopi,
ANTIGEN EKSKRETORI/SEKRETORI STADIUM L3 Ascaridia galli
SEBAGAI PEMICU PEMBENTUKAN IMUNOGLOBOLIN YOLK
(IgY) PADA AYAM PETELUR
DARMAWI
Disertasi
sebagai salah satu syarat untuk memperoleh gelar Doktor pada
Program Studi Sains Veteriner
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Judul Disertasi : Antigen Ekskretori/Sekretori Stadium L3 Ascaridia
galli Sebagai Pemicu Pembentukan Imunoglobulin
Yolk (IgY) Pada Ayam Petelur
Nama Mahasiswa : DARMAWI Nomor Pokok : B063040071
Program Studi : SAINS VETERINER
Disetujui : Komisi Pembimbing
Dr. drh. Risa Tiuria Priosoeryanto, MS. Ketua
Dr. drh. Retno D. Soejoedono, MS. Prof. Dr. drh. Fachriyan H. Pasaribu Anggota Anggota
Diketahui
Ketua Program Studi Sains Veteriner Dekan Sekolah Pascasarjana
Dr.drh. Bambang P. Priosoeryanto, MS Prof.Dr.Ir. Khairil Anwar Notodiputro, MS
Tanggal Ujian: 16 Agustus 2007 Tanggal Lulus:
PRAKATA
Syukur Alhamdulillah dipanjatkan kehadhirat Allah SWT. yang telah melimpahkan rahmat dan hidayah-Nya sehingga penulis dapat menyelesaikan penulisan Disertasi yang berjudul: Antigen Ekskretori/Sekretori Stadium L3
Ascaridia galli Sebagai Pemicu Pembentukan Imunoglobulin Yolk Anti-Ascaridiosis Pada Ayam Petelur.
Ucapan terima kasih penulis sampaikan kepada Dr. drh. Risa Tiuria Priosoeryanto, MS. sebagai ketua komisi pembimbing, Dr. drh. Retno Damayanti Soejoedono, MS dan Prof. Dr. drh. Fachriyan Hasmi Pasaribu, masing-masing sebagai anggota komisi pembimbing yang telah memberikan bimbingan, arahan, dan dorongan sejak awal penulis mengikuti pendidikan. Penulis menyampaikan terima kasih kepada Dr. drh. I Wayan Teguh Wibawan, MS dan Dr. Supratman Sukowati yang bertindak selaku Penguji Luar Komisi yang telah memberikan masukan dan koreksi untuk penyempurnaan karya ini.
Terima kasih dan penghargaan yang setinggi-tingginya disampaikan kepada Dekan Fakultas Kedokteran Hewan, dan Rektor Universitas Syiah Kuala yang telah memberi kesempatan kepada penulis untuk mengikuti pendidikan program Doktor pada program studi Sains Veteriner Institut Pertanian Bogor. Terima kasih juga disampaikan kepada Direktorat Jenderal Pendidikan Tinggi, Departemen Pendidikan Nasional Republik Indonesia, dan Pemerintah Daerah Nanggroe Aceh Darussalam yang telah memberikan bantuan beasiswa masing-masing melalui Beasiswa Pendidikan Program Pascasarjana (BPPS) dan Bantuan Beasiswa Nanggroe Aceh Darussalam (BB NAD). Penulis mengucapkan terima kasih kepada Direktorat Jenderal Pendidikan Tinggi yang telah membiayai sebagian penelitian ini melalui Proyek Peningkatan Penelitian Pendidikan Tinggi Penelitian Hibah Bersaing XIII.
Karya ini dapat diselesaikan berkat adanya bantuan dari banyak pihak. Untuk itu, ucapan terima kasih dan penghargaan yang setinggi-tingginya penulis sampaikan kepada semua pihak yang telah turut serta membantu dalam penyelenggaraan pendidikan, persiapan, perencanaan, pelaksanaan, dan pengolahan data penelitian serta penulisan Disertasi ini.
Kepada ayahanda Kamaruzzaman, ibunda Fatimah, ayah dan ibu mertua Alm. H. Razali Ahmad dan bunda Alm. Hj. Siti Hawa, dan kakak-kakak, adik-adik, serta seluruh keluarga, penulis mengucapkan terima kasih atas segala doa, bimbingan, dan dorongan semangat yang telah diberikan. Kebanggaan penulis kepada istri tercinta, drh. Ummu Balqis, MSi, yang senantiasa setia dan sabar mendampingi dan selalu bersama dalam menempuh studi. Pengorbanan adinda sangat berarti dalam meraih sukses. Terima kasih kepada putra dan putri tersayang, Rahi Abdurrahman dan Rania Samira, yang telah memberikan kesejukan hati dan pengertian sehingga sangat memudahkan penulis menempuh studi.
Penulis menyadari bahwa karya ini masih banyak yang harus disempurnakan. Oleh karena itu, kritik dan saran yang dapat menyempurnakan tulisan ini kiranya dapat disampaikan kepada penulis, semoga Disertasi ini dapat bermanfaat bagi perkembangan ilmu pengetahuan.
Bogor, Agustus 2007
Wassalam,
Darmawi
RIWAYAT HIDUP
Penulis dilahirkan di Samadua, Aceh Selatan, pada tanggal 27 Agustus 1970, sebagai anak kelima dari sembilan saudara dari pasangan ayahanda Kamaruzzaman dan ibunda Fatimah. Pendidikan sarjana dan profesi dokter hewan ditempuh pada Fakultas Kedokteran Hewan Universitas Syiah Kuala (FKH-UNSYIAH), lulus tahun 1995. Sejak tahun 1997, penulis diangkat sebagai staf pengajar pada FKH-UNSYIAH. Pada tahun 2001, penulis mendapat kesempatan mengikuti pendidikan program Magister pada program studi Sains Veteriner Institut Pertanian Bogor, lulus pada tahun 2003. Pada tahun 2004, penulis melanjutkan pendidikan program Doktor pada program studi dan perguruan tinggi yang sama. Beasiswa pendidikan pascasarjana diperoleh dari Direktorat Jenderal Pendidikan Tinggi, Departemen Pendidikan Nasional Republik Indonesia melalui Beasiswa Pendidikan Program Pascasarjana (BPPS) dan Bantuan Beasiswa Pemerintah Daerah Nanggroe Aceh Darussalam (BB NAD).
DAFTAR ISI
Halaman
HALAMAN PENGESAHAN ……… i
PRAKATA ………. ii
RIWAYAT HIDUP ………... iii
DAFTAR TABEL ……….. vii
DAFTAR GAMBAR ... viii
DAFTAR LAMPIRAN ... ix
PENDAHULUAN ……… . 1
Latar Belakang ………. 1
Tujuan Penelitian ………. 4
Hipotesis ……… 4
Manfaat Penelitian ……… 4
TINJAUAN PUSTAKA ... 5
1. Cacing Ascaridia galli ... 5
2. Antigen Ekskretori/Sekretori Cacing Nematoda ... 9
3. Respons Kekebalan Unggas Terhadap Antigen ... 11
DISAIN PENELITIAN ... 15
KAJIAN PERKEMBANGAN L1, L2, DAN L3Ascaridia galli PADA AYAM PETELUR ... 16
Abstrak ... 16
Abstract ... 16
Pendahuluan ... 17
Metode Penelitian ... 18
Hasil Penelitian ... 20
Pembahasan ... 22
Kesimpulan ... 24
Saran ... 24
ISOLASI DAN KARAKTERISASI ANTIGEN EKSKRETORI/SEKRETORI
STADIUM L3Ascaridia galli ... 25
Abstrak ... 25
Abstract ... 25
Pendahuluan ... 26
Metode Penelitian ... 27
Hasil Penelitian ... 29
Pembahasan ... 31
Kesimpulan ... 33
Saran ... 33
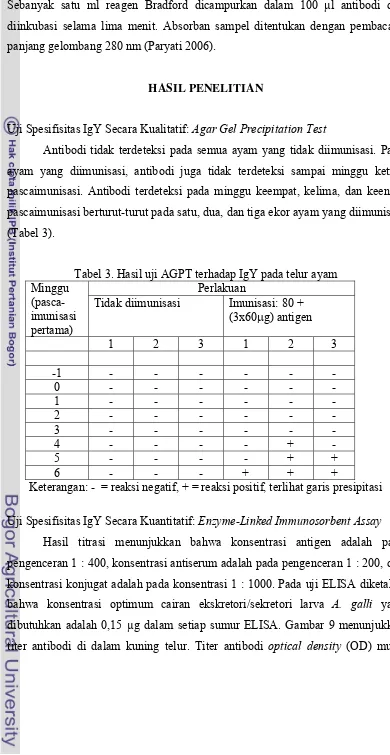
PURIFIKASI IMUNOGLOBULIN YOLK PADA KUNING TELUR DARI AYAM YANG DIIMUNISASI DENGAN ANTIGEN EKSKRETORI/ SEKRETORI STADIUM L3Ascaridia galli ... 34
Abstrak ... 34
Abstract ... 34
Pendahuluan ... 35
Metode Penelitian ... 37
Hasil Penelitian ... 40
Pembahasan ... 42
Kesimpulan ... 45
Saran ... 45
PENGUKURAN ANTIBODI AYAM PETELUR YANG DIIMUNISASI DENGAN ANTIGEN EKSKRETORI/SEKRETORI STADIUM L3Ascaridia galli MELALUI UJI ENZYME LINKED IMMUNOSORBANT ASSAY ... 46
Abstrak ... 46
Abstract ... 46
Pendahuluan ... 47
Metode Penelitian ... 48
Hasil Penelitian ... 50
Pembahasan ... 51
Kesimpulan ... 53
Saran ... 53
DETEKSI KEBERADAAN ANTIGEN Ascaridia galli DENGAN
IMUNOGLOBULIN YOLK MELALUI METODE IMUNOHISTOKIMIA.. 54
Abstrak ... 54
Abstract ... 54
Pendahuluan ... 55
Metode Penelitian ... 56
Hasil Penelitian ... 58
Pembahasan ... 59
Kesimpulan ... 60
Saran ... 60
POTENSI ANTIGEN EKSKRETORI/SEKRETORI STADIUM L3, IMUNOGLOBULIN YOLK, DAN KOMBINASINYA TERHADAP PENURUNAN POPULASI Ascaridia galli ... 61
Abstrak ... 61
Abstract ... 61
Pendahuluan ... 62
Metode Penelitian ... 63
Hasil Penelitian ... 65
Pembahasan ... 66
Kesimpulan ... 68
Saran ... 68
PEMBAHASAN UMUM ………...……… 69
KESIMPULAN UMUM ………. 77
SARAN ……….. 77
DAFTAR PUSTAKA ……….. 78
LAMPIRAN ……… 86
DAFTAR TABEL
Nomor Halaman
1. Rataan jumlah L3 dan persentase L3 terhadap dosis infeksi pada tiap-
tiap 4 ekor ayam donor dengan 5 kali ulangan 10 hari pascainfeks ... 21 2. Kuantitas protein ekskretori/sekretori larva A. galli ... 30 3. Hasil uji AGPT terhadap IgY pada telur ayam ... 40 4. Kuantitas protein kuning telur pada tiap-tiap tahapan purifikasi IgY .. 42 5. Populasi cacing A. galli secara in vivo 12 minggu pascainfeksi ... 65
DAFTAR GAMBAR
Nomor Halaman
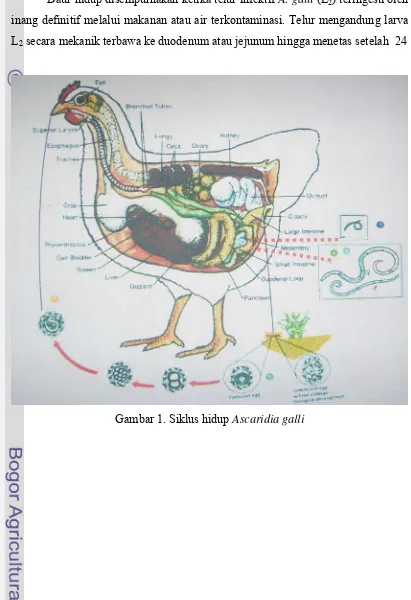
1. Siklus hidup Ascaridia galli ... 6
2. Ascaridiosis pada usus halus unggas ... 7
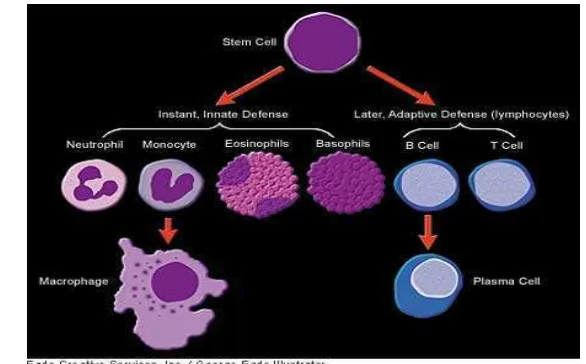
3. Sel B menjadi sel plasma penghasil antibodi ... 11
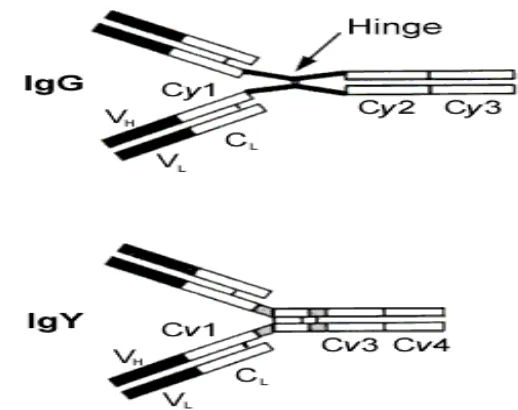
4. Hinge region yang menghubungkan C 1 dan C 2 pada IgG ... 13
5. Perbedaan IgG pada mamalia dan IgY pada unggas ... 14
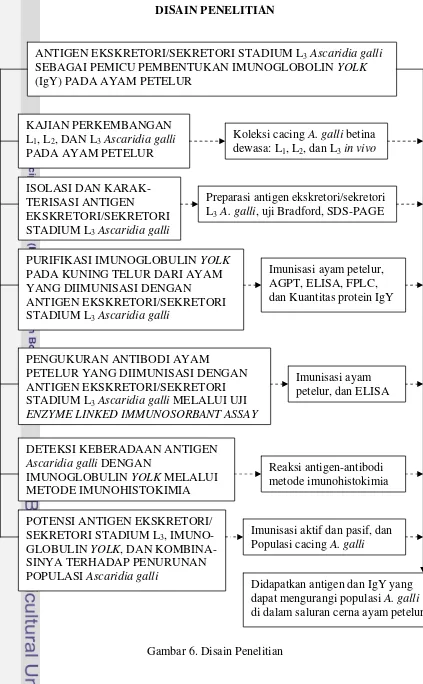
6. Disain penelitian ... 15
7. Jumlah L1 dan L2 yang berkembang dihasilkan oleh cacing A. galli betina dewasa ... 20
8. Berat molekul antigen ekskretori/sekretori L3A. galli ... 30
9. Titer antibodi di dalam kuning telur ayam ... 41
10.Kromatogram FPLC IgY anti ekskretori/sekretori A. galli ... 41
11.Titer antibodi di dalam serum ayam pada tiap-tiap kelompok ayam percobaan ... 50
12.Reaksi positif uji imunohistokimia terhadap antigen A. galli ... 58
13.Kompleks antigen-antibodi pada teknik polimer peroksidase ... 59
14.Reaksi pembentukan produk berwarna ... 59
15.Ikatan antara epitop (antigenic determinant) pada antigen dan paratop (antigen binding site) pada F(ab) antibodi ... 74
16.Mekanisme penghancuran kutikula cacing oleh sistem imunitas ... 75
DAFTAR LAMPIRAN
Nomor Halaman
1. Larutan yang digunakan pada medium RPMI 1640 ... 86
2. Larutan yang digunakan pada uji Bradford ... 86
3. Reagent SDS PAGE ………. 87
4. Larutan yang digunakan untuk FPLC ... 89
5. Larutan yang digunakan untuk Uji ELISA ... 90
6. Pewarnaan imunohistokimia ... 92
PENDAHULUAN
Latar Belakang
Prevalensi nematodosis khususnya ascaridiosis yang disebabkan oleh infeksi Ascaridia galli pada ayam petelur masih sangat tinggi sehingga dapat menimbulkan kerugian ekonomi yang sangat berarti. Meskipun tidak menimbulkan kematian, namun ayam petelur yang menderita ascaridiosis dapat menyebabkan infeksi subklinis dan anoreksia (Permin et al. 2002) sehingga menimbulkan penurunan produksi yang sangat bermakna (Dahl et al. 2002).
Ascaridiosis pada ayam petelur dapat juga menimbulkan efek imunosupresi yang rentan terhadap infeksi bakteri patogen seperti Escherichia coli (Permin et al. 2002), Salmonella enterica (Chadfield et al. 2001), dan
Pasteurella multocida (Dahl et al. 2002). Efek imunosupresi dilaporkan juga oleh Hørning et al. (2004) bahwa ayam yang telah terinfeksi cacing secara alami dan ayam yang telah diinfeksi oleh A. galli apabila divaksinasi dengan vaksin
Newcastle disease De Soto dapat menurunkan titer antibodi terhadap virus tersebut. Untuk mengatasi kerugian yang ditimbulkan oleh ascaridiosis, maka infeksi A. galli pada ayam petelur harus dikendalikan.
Salah satu metode alternatif pengendalian infeksi cacing nematoda gastrointestinal adalah secara imunologik dengan menyediakan antigen ekskretori/sekretori sebagai vaksin (Klei 1997). Penggunaan ekskretori/sekretori L3 Haemonchus contortus sebagai antigen dapat meningkatkan respons imunoglobulin G (IgG) anak domba (Vervelde et al. 2003). Penelitian Green et al. (1996) membuktikan bahwa ekskretori/sekretori L3 cacing nematoda intestinal seperti Cooperia curticei, Ostertagia circumcincta, dan Trichostrongylus colubriformis dapat mengenal antibodi di dalam serum Lama pacos. Sifat imunogenik ekskretori/sekretori Onchocerca gibsoni jantan dewasa diekspresikan melalui pembentukan antibodi spesifik pada tikus (Harnett et al. 1997).
Penelitian McKeand et al. (1995) membuktikan bahwa ekskretori/sekretori
memicu pertahanan mukosa yang ditandai dengan peningkatan jumlah sel mast mukosa dan leukosit, disertai pelepasan senyawa penghambat migrasi larva dan leukotrin di dalam mukus gastrointestinal di dalam abomasum dan usus halus domba Romney.
Respons imunitas inang definitif terhadap infeksi cacing nematoda berlangsung melalui respons imunitas seluler dan humoral (Tizard 1995). Vervelde et al. (2003) melaporkan bahwa antigen ekskretori/sekretori dapat memicu peningkatan respons sel T helper 2 (Th-2). Roitt dan Delves (2001) menyatakan bahwa reaksi sel Th-2 dapat menggertak pelepasan sitokin terutama interleukin (IL-3, IL-4 dan IL-5). Menurut Tizard (1995) IL-3 merangsang mastofoiesis berdegranulasi untuk melepaskan mediator peradangan, senyawa vasoaktif dan kemoatraktan berfungsi untuk merekrut sel eosinofil. IL-4 membangkitkan sel B menjadi sel plasma pembentuk antibodi. IL-5 merangsang aktivasi sel eosinofil untuk melepaskan mediator kimia seperti enzim hidrolitik dan zat sitotoksik. Aktivasi sitokin yang dilepaskan oleh sel Th-2 merangsang proliferasi, hiperplasia, dan pelepasan mukus yang bersifat viscoelastic gel oleh sel goblet. Mukus melindungi permukaan usus halus dari ancaman invasi, dan membatasi gerakan cacing dengan cara menutupi kutikulanya.
Mekanisme pengeluaran cacing dari dalam tubuh dijelaskan oleh Roitt dan Delves (2001) bahwa kutikula cacing nematoda Nippostrongylus brasiliensis
dirusak oleh antibodi yang disekresikan ke dalam lumen intestinal tikus. Tizard (1995) menyatakan bahwa untuk melawan infeksi cacing nematoda Toxocara canis, antibodi spesifik menutupi oral dan saluran anal (secretory pores) cacing nematoda tersebut. Cacing dijerat melalui fragment antibodi (Fab), sedangkan
Salah satu stadium yang harus dijalani cacing nematoda A. galli selama
survival di dalam tubuh ayam petelur adalah stadium L3. Seperti yang dibuktikan oleh Douch et al. (1996) dan Vervelde et al. (2003) bahwa L3 cacing nematoda melepaskan ekskretori/sekretori untuk bertahan hidup di dalam tubuh inang definitif. Ekskretori/sekretori nematoda ditanggapi oleh inang definitif sebagai substansi asing yang dapat memicu respons imunitas. Penelitian ini menjelaskan respons humoral ayam petelur terhadap ekskretori/sekretori L3 cacing nematoda
A. galli. Stadium L3 dipilih karena untuk mencapai stadium selanjutnya, L3 A.
galli menginvasi mukosa usus halus untuk menjalani fase histotrofik. Apabila respons humoral ayam petelur dapat dipicu oleh ekskretori/sekretori maka L3 mengalami blocking antibodi sebelum invasi ke jaringan sehingga L3 A. galli gagal bertahan hidup dan dapat dikeluarkan secara cepat (worm expulsion).
Pemaparan antigen ke dalam tubuh ayam akan merangsang pematangan sel B di dalam bursa fabricius menjadi sel plasma untuk menghasilkan antibodi spesifik terhadap antigen yang dipaparkan. Produksi antibodi pada ayam, selain didistribusikan ke dalam serum, antibodi juga didepositkan ke dalam kuning telur sebagai imunoglobulin yolk (IgY) (Camenisch et al. 1999; Hau dan Hendriksen 2005). Menurut Schade et al. (1999) struktur fundamental IgY berbeda dengan IgG mamalia. Rantai berat (y) IgG mempunyai berat molekul 50 kDa yang terdiri atas empat domain, yaitu satu variable domain (VH), dan tiga constant domain
(Cy1, Cy2, dan Cy3). Antara domain Cy1 dan domain Cy2 terdapat hinge region
yang mengatur fleksibilitas fragment Fab IgG. Sedangkan rantai berat (v) IgY mempunyai berat molekul 65 kDa, tidak memiliki hinge region tetapi memiliki empat constant domain (Cv1 – Cv4). Perbandingan rangkaian antara IgG dan IgY menunjukkan bahwa domain Cy2 dan Cy3 IgG berhubungan erat dengan domain
Cv3 dan Cv4 IgY, sedangkan domain Cv2 pada IgY digantikan oleh hinge region
Tujuan Penelitian
1. Untuk mengetahui berat molekul dan kuantitas protein ekskretori/sekretori yang dilepaskan oleh stadium L3A. galli.
2. Untuk mengetahui potensi ekskretori/sekretori stadium L3 A. galli sebagai antigen pemicu pembentukan imunoglobulin yolk (IgY) di dalam kuning telur dan serum ayam petelur.
3. Untuk mengetahui potensi IgY kuning telur yang dipicu oleh antigen ekskretori/sekretori stadium L3A. galli sebagai penghambat kelangsungan hidup cacing A. galli.
Hipotesis
1. Diduga bahwa stadium L3 A. galli melepaskan protein melalui ekskretori/sekretorinya.
2. Diduga bahwa ekskretori/sekretori stadium L3 A. galli berpotensi sebagai antigen pemicu pembentukan antibodi IgY di dalam kuning telur dan serum ayam petelur.
3. Diduga bahwa IgY kuning telur yang dipicu oleh antigen ekskretori/sekretori stadium L3 A. galli berpotensi sebagai penghambat kelangsungan hidup cacing A. galli.
Manfaat Penelitian
Manfaat akademik
Hasil penelitian ini diharapkan sebagai informasi bahwa ekskretori/sekretori stadium L3A. galli bersifat antigenik.
Manfaat operasional
TINJAUAN PUSTAKA
1. Cacing Ascaridia galli
Cacing A. galli tersebar secara meluas pada negara-negara di suluruh dunia. Penyebaran ascaridiosis dapat terjadi pada keadaan temperatur tropis dan sub-tropis. Ascaridiosis pada ayam pertama dilaporkan terjadi di Jerman, selanjutnya terjadi di Brazil, India, Zanzibar, Pilipina, Belgia, China, Kanada, dan Inggeris. Selain pada ayam, A. galli juga ditemukan pada jenis unggas lainnya seperti angsa, kalkun, dan pada burung liar (Permin dan Hansen 1998).
Poulsen et al. (2000) menemukan salah satu dari 18 jenis cacing gastro-intestinal yang menginfeksi ayam muda di kawasan sampah di Gana, Afrika Barat, adalah A. galli dengan prevalensi 24%. Permin et al. (1998) melaporkan bahwa diantara 26 jenis cacing, salah satunya adalah A. galli dengan prevalensi 32,3% pada musim kering dan 28,3% pada musim hujan telah diidentifikasi pada ayam yang berkeliaran di kawasan sampah di daerah Morogoro, Tanzania.
Cacing A. galli merupakan cacing terbesar dalam kelas nematoda pada unggas. Tampilan cacing dewasa adalah semitransparan, berukuran besar, dan berwarna putih kekuning-kuningan (Soulsby 1982). Cacing ini memiliki kutikula ekstraseluler yang tebal untuk melindungi membran plasma hipodermal nematoda cacing dewasa (Bankov dan Barrett 1993). Pada bagian anterior terdapat sebuah mulut yang dilengkapi dengan tiga buah bibir, satu bibir terdapat pada dorsal dan dua lainnya pada lateroventral. Pada kedua sisi terdapat sayap yang sempit dan membentang sepanjang tubuh (Calneck 1997). Permin dan Hansen (1998) mengatakan bahwa cacing jantan dewasa berukuran panjang 51 – 76 mm dan cacing betina dewasa 72 – 116 mm. Cacing jantan memiliki preanal sucker dan dua spicula berukuran panjang 1 – 2,4 mm, sedangkan cacing betina memiliki vulva dipertengahan tubuh. Telur A. galli berbentuk oval, kerabang lembut, tidak bersegmen, dan berukuran 73–92 x 45–57μm.
mencapai stadium infektif (L2) dalam waktu 10 – 20 hari tergantung kepada temperatur serta kelembaban lingkungan (Gambar 1).
Daur hidup disempurnakan ketika telur infektif A. galli (L2) teringesti oleh inang definitif melalui makanan atau air terkontaminasi. Telur mengandung larva L2 secara mekanik terbawa ke duodenum atau jejunum hingga menetas setelah 24
jam pasca ingesti. Selama penetasan gelungan larva muncul dari ujung anterior telur melewati celah terbuka keluar kedalam lumen intestinal untuk menjadi L3. Menurut Permin dan Hansen (1998) larva L3 A. galli melanjutkan fase histotropik dengan cara menanamkan dirinya pada lapisan mukosa duodenum (fase jaringan) menjadi L4. Durasi fase histotropik berlangsung selama 3 – 54 hari pasca infeksi. Setelah mengalami empat kali molting, L5 (cacing muda) akan tumbuh dan mencapai dewasa di dalam lumen duodenum (Gambar 1). Periode prepaten cacing A. galli berlangsung dalam waktu 5 – 8 minggu (Soulsby 1982), dan 11 – 15 minggu (Athaillah 1999).
Menurut Idi et al. (2004) ayam Lohman Brown yang diinfeksi A. galli
kadang-kadang dapat menimbulkan diare. Tiuria (1991) menyatakan bahwa infeksi A. galli dapat mengurangi berat badan dan menurunkan produksi telur ayam Isa Brown. Kilpinen et al. (2006) melaporkan pula bahwa bila dibandingkan dengan penurunan berat badan ayam akibat infeksi tungau Dermanyssus gallinae, infeksi A. galli menyebabkan penurunan berat badan yang signifikan. Hal ini disebabkan karena ascaridiosis dapat mengganggu efisiensi absorpsi nutrisi yang berlangasung di dalam usus halus ayam petelur. Infeksi A. galli di dalam usus halus unggas disajikan pada Gambar 2.
Gambar 2. Ascaridiosis pada usus halus unggas.
perlahan atau subklinis. Kecacingan tidak menyebabkan mortalitas tetapi menghasilkan morbiditas. Cacing parasitik bersifat sebagai organisme patogenik dan beradaptasi sebagai parasit obligat yang kehidupannya sangat tergantung kepada ketersediaan nutrisi pada inang definitif (Sander dan Schwartz 1994). Adaptasi ini menurut Kulkarni et al. (1993) dibutuhkan untuk pengelakan diri dari tanggap kebal inang definitif. Infeksi A. galli pada ayam yang normal umumnya singkat dan kadang-kadang menyebabkan kerusakan permanen (Permin et al. 1998). Tubuh ayam memiliki suatu sistem kekebalan yang dapat melindungi tubuhnya dari unsur-unsur patogen (Tizard 1995).
Penelitian tentang terapi cacing nematoda A. galli telah banyak dilaporkan oleh peneliti terdahulu. Deteksi secara biologi dan biokimiawi (Khwaja et al. 1973) menunjukkan bahwa setiap gram ekstrak tubuh cacing A. galli mengandung 10 unit acetylcholinesterase dan 0,517 – 0,705 µg histamin. Kedua substansi tersebut memiliki aktivitas neurotransmitter yang berfungsi sebagai lokomotif bagi nematoda, sehingga penentuan jenis ascarisidal yang menimbulkan paralisis pada cacing ini disarankan agar menggunakan substansi aktif yang bersifat destruktif terhadap kedua senyawa tersebut. Sander dan Schwartz (1994) membuktikan bahwa pemberian fenbendazole dosis 30,3 ppm dalam air minum untuk ayam broiler menghasilkan nilai efikasi (kemanjuran) masing-masing 69,0 – 89,6% terhadap A. galli. Pemberian garam-garam dasar ke dalam pakan dan atau air minum bagi inang definitif juga dapat mereduksi populasi A. galli yang ada dalam lumen saluran cerna ayam. Gabrashanska et al. (2004b) membuktikan bahwa pemberian 0,43 g Zn-Co-Mn per kg pakan dapat menurunkan 21,5% populasi A. galli pada 60 hari pascainfeksi.
Singh et al. (1983) menyatakan bahwa cacing A. galli mampu menyelenggarakan metabolisme asam amino. Reaksi dekarboksilasi alanine, aspartate, glutamate, serine, leucine, dan valine dapat membangkitkan ATP dan membebaskan CO2. Menurut Bankov dan Barrett (1993) ekstrak tubuh cacing A.
Sama halnya dengan nematoda yang lain, seperti Ascaris suum, Toxocara canis, Brugia malayi, Loa loa, Dictyocaulus viviparus, Dirofilaria immitis, dan
Ostertagia ostertagi, pada tubuh A. galli dibuktikan oleh Timanova et al. (1999) mengandung poliprotein. Protein yang dikenal sebagai A. galli fatty acid-binding protein (AgFABP) membentuk dimer tunggal 23 atau 24 kDa dan merupakan derivat dari precursor 60 kDA membentuk unit 12-13 kDa. Penemuan ini mengindikasikan bahwa AgFABP berperan penting terhadap suplai asam lemak yang digunakan sebagai sumber pembangkit energi untuk perkembangan stadium nematoda.
2. Antigen Ekskretori/Sekretori Cacing Nematoda
Umumnya antigen yang imunogenik adalah makromolekul protein, polisakarida, polipeptida, atau polimer sintetik misalnya polivinilpirolidon (PVP). Hanya bagian tertentu saja yang dapat berikatan dengan antigen binding side
molekul antibodi. Bagian molekul antigen yang berikatan dengan antigen binding side disebut epitop (determinant antigen) yang menentukan spesifisitas reaksi antigen-antibodi. Ikatan antigen-antibodi merupakan suatu ikatan nonkovalen antara epitop (active site) dan paratop (antigen binding site pada antibodi). Ikatan antigen antibodi tersebut adalah ikatan yang kuat karena merupakan ikatan hidrogen multipel, ikatan ion, dan interaksi hidrofobik (Perez 2000).
Jumlah epitop pada suatu antigen berbeda dengan antigen yang lain. Untuk dapat memicu pembentukan antibodi, menurut Kresno (1996) antigen suatu bahan sedikitnya harus memiliki dua epitop, dan sedikitnya satu epitop harus mampu menyulut rangsangan limfosit T. Epitop antigen yang berbeda pada suatu molekul protein dapat menyulut respons subpopulasi limfosit T yang berlainan, salah satu epitop mungkin menyulut respons limfosit T helper (Th), tetapi epitop yang lain mungkin menyulut respons limfosit T supresor (Ts). Hau dan Hendriksen (2005) menyatakan bahwa suatu epitop antigen terdiri dari lima sampai 10 asam amino. Tiap-tiap epitop menginduksi klon sel plasma yang menghasilkan antibodi terhadap epitop tertentu.
alhydrogel sebagai adjuvant dapat terproteksi dari cacing parasitik H. contortus. Anak domba yang diimunisasi dengan ekskretori/sekretori dan ditantang dengan 300 L3/kg bb dapat mereduksi 89% output kumulatif telur dan meningkatkan 54% proteksi antibodi. Seluruh anak domba yang divaksinasi, secara proporsi substansial respons antibodi dapat terdeteksi terhadap epitop glikan.
Harnett et al. (1997) membuktikan bahwa aplikasi 300 µg ekskretori/sekretori Ochocerca gibsoni jantan dewasa yang diimunisasikan 50 µg setiap hari selama enam hari berturut-turut dapat memicu respons humoral hewan percobaan. Imunisasi pertama dan kedua antigen diemulsikan dengan Freund’s complete dan incomplete adjuvant berturut-turut. Sedangkan pada empat kali
booster selanjutnya digunakan PBS. Sel-sel lymph nodus tikus BALB/c yang difusikan dengan sel-sel myeloma lestari dapat memproduksi IgM dan delapan jenis isotype IgG. Semua isotype monoklonal antibodi yang diproduksi bereaksi secara spesifik.
Menurut Yoshihara et al. (1993) cairan tubuh cacing A. suum betina dewasa dapat digunakan sebagai antigen untuk mendiagnosa ascariosis pada babi melalui uji Enzym-Linked Immunosorbent Assay (ELISA). Terbukti bahwa reaksi spesifik terjadi antara cairan tubuh cacing dengan antibodi di dalam serum babi yang diinfeksi. Fraksi protein 105 kDa dari cairan tubuh cacing dewasa bereaksi sangat spesifik dengan IgG di dalam serum babi yang diinfeksi dengan A. suum. Pada uji ELISA diketahui juga bahwa konsentrasi optimum cairan tubuh cacing yang dibutuhkan adalah 0,25 µg dalam setiap sumur ELISA, dimana setiap satu ml cairan tubuh cacing ditemukan 40 mg kandungan protein.
Ekskretori/sekretori berperan sebagai antigen protektif yang dapat memicu tanggap kebal inang definitif. Imunisasi dengan antigen ekskretori/sekretori dapat melindungi hewan percobaan dari serangan Dictyocaulus vivivarus (McKeand 1995). Ekskretori/sekretori yang merupakan komponen imunogenik telah digunakan untuk memicu pembentukan antibodi monoklonal terhadap
Onchocerca gibsoni (Harnet et al. 1997). Green et al (1996) membuktikan bahwa ekskretori/sekretori cacing nematoda dapat dikenal oleh antibodi pada hewan terinfeksi. Tiuria et al. (2003) menyatakan pula bahwa ekskretori/sekretori A. galli
3. Respons Kekebalan Unggas Terhadap Antigen
Respons kekebalan ayam dipicu oleh pemaparan antigen yang strukturnya dikenali oleh sistem kekebalan sebagai sesuatu benda asing (non-self). Antigen dapat disuguhkan kepada sistem kekebalan sebagai kompleks multiantigen (partikulat) misalnya: bakteri, virus, parasit, dan partikel artifisial atau sebagai antigen tunggal misalnya protein dan polisakarida (Leenaars dan Hendriksen 2005). Hanly et al. (1995) menyatakan bahwa sistem kekebalan dapatan (antigen-spesifik) memiliki efisiensi dan spesifisitas yang tinggi, tetapi memiliki respons yang lebih lambat daripada sistem kekebalan bawaan (innate unspecific).
Roitt dan Delves (2001) menyatakan bahwa komponen-komponen yang mendasar di dalam mekanisme respons kekebalan antigen-spesifik (adaptive defense) adalah limfosit B dan limfosit T sedangkan kekebalan non-spesifik (innate defense) diperankan oleh sel-sel neutrofil, monosit (di dalam jaringan disebut makrofag), eosinofil, dan basofil. Semua komponen dasar yang berperan pada mekanisme kekebalan tersebut berasal dari stem sel (Gambar 3). Limfosit (sel B) bertanggungjawab terhadap produksi antibodi. Limfosit (sel T) bertanggungjawab terhadap respons sitotoksik, dan sel T helper (Th) bertanggungjawab terhadap sel B dan sel T sitotoksik. Pemeliharaan (maintenance) sistem kekebalan membutuhkan komunikasi interseluler yang memperantarai hubungan sel ke sel (misalnya melalui produksi sitokin) dan sel-sel pelengkap (misalnya sel-sel fibroblast dan sel-sel endotel).
Hau dan Hendriksen (2005) membagi respons kekebalan antigen-spesifik ke dalam tiga fase yaitu: fase induktif, fase efektor, dan fase memori. Pada fase induktif, antigen dikenali sebagai benda asing (foreign) melalui monosit, sel-sel dendritik, dan sel B sebagai sel-sel penyuguh antigen (antigen-presenting cells, APC). Sel-sel dendritik mengenal seluruh antigen, sedangkan sel B menggunakan
receptor-dependent spesifik dari ikatan antigen. APC mengikat, menelan, dan memproses antigen menjadi peptide bersama-sama dengan molekul major histocompability complex (MHC1), kemudian mengeluarkannya kepermukaan APC untuk disuguhkan kepada reseptor antigen pada sel T sehingga adanya kontak yang menyebabkan sel T teraktivasi.
Pada fase efektor, respons kekebalan tergantung pada jenis antigen. Aktivasi sel T menyebabkan respons berperantara sel (terutama sel sitotoksik, misalnya antigen virus) atau sel Th untuk sel B (misalnya antigen protein). Apabila teraktivasi, sel Th menjadi lebih sensitif terhadap aksi sitokin growth factor misalnya interleukin (IL-1 dan IL-2). Sitokin menyebabkan proliferasi dan akhirnya diferensiasi sel B menjadi sel-sel plasma penghasil antibodi. Masing-masing sel plasma disandi secara genetik untuk menghasilkan antibodi tertentu yang spesifik hanya terhadap epitop tunggal antigen (Roitt dan Delves 2001).
Fase terakhir respons kekebalan antigen-spesifik adalah fase induksi memori yang terjadi setelah kontak awal dengan antigen. Fase memori terjadi berdasarkan diferensiasi sel B menghasilkan respons kekebalan sekunder dengan karakter lebih cepat dan berlangsung lebih lama daripada respons kekebalan primer. Pada respons kekebalan sekunder, antibodi memiliki aviditas yang lebih kuat dibanding dengan respons kekebalan primer (Hau dan Hendriksen 2005).
Pemaparan antigen ke dalam tubuh induk akan menghasilkan antibodi di dalam telur dengan spesifisitas antibodi yang tinggi terhadap antigen yang telah disuntikkan (Rollier et al. 2000). Antibodi induk yang ditransfer secara pasif oleh induk kepada anaknya sebagai imunoglobulin yolk (IgY) berfungsi sebagai pertahanan terhadap benda asing manakala sistem imun anak belum sempurna. IgY lebih berperan sebagai sistemik antibodi daripada sekretori antibodi, namun IgY dapat ditemukan dalam saluran pencernaan duodenum, trachea, dan seminal plasma. Mekanisme transfer IgY dari serum ke dalam kuning telur berlangsung seperti proses transfer antibodi lintas plasenta pada mamalia. IgY yang telah diproduksi oleh limfosit B akan mengalir dalam pembuluh darah ke seluruh bagian tubuh termasuk ke dalam ovarium. IgY didepositkan melalui jaringan arteri kecil ovarium-oosit ke dalam kuning telur sebagai bahan perlindungan bagi embrio yang akan berkembang (Carlander 2002).
Antigen yang dipaparkan kepada ayam dapat menggertak pelepasan interleukin (IL-4 dan IL-5) oleh sel T helper-2 (Th-2). IL-4 dapat membangkitkan sel B menjadi sel plasma pembentuk antibodi (Roitt dan Delves 2001). Terdapat tiga kelas antibodi pada unggas, yaitu imunoglobulin A (IgA), IgM, dan IgG. IgG pada unggas lebih dikenal IgY karena ada perbedaan struktur molekul dengan IgG mamalia. Pada IgG, antara C 1 dan C 2 dihubungkan oleh engsel (hinge region) seperti ditunjukkan pada Gambar 4.
Gambar 5. Perbedaan IgG pada mamalia dan IgY pada unggas
Secara struktural, molekul IgY terdiri dari dua rantai berat dan dua rantai ringan. Rantai berat tidak memiliki engsel dan tersusun atas empat domain variabel yaitu Cv1, Cv2, Cv3, dan Cv4 (Gambar 3). IgY memiliki berat molekul ~180 kDa yang masing-masing rantai beratnya ~65-68 kDa, koefisien sedimentasi 7,8 S, dan titik isoelektrik 5,7-7,6 (Chio 2002 dan Davalos-Patoja et al. 2000). Secara imunologis IgY sangat berbeda dengan IgG mamalia karena reaksi silang tidak terjadi pada IgY, sedangkan antibodi mamalia menunjukkan tingkat reaksi silang yang tinggi, dimana IgG kelinci anti-manusia akan bereaksi silang terhadap IgG mamalia lain, kecuali dengan IgG kelinci (Leenaars dan Hendriksen 2005).
DISAIN PENELITIAN
KAJIAN PERKEMBANGAN L1, L2, DAN L3Ascaridia galli
PADA AYAM PETELUR
PURIFIKASI IMUNOGLOBULIN YOLK
PADA KUNING TELUR DARI AYAM YANG DIIMUNISASI DENGAN STADIUM L3Ascaridia galli MELALUI UJI ENZYME LINKED IMMUNOSORBANT ASSAY
DETEKSI KEBERADAAN ANTIGEN
Ascaridia galli DENGAN
IMUNOGLOBULIN YOLK MELALUI
METODE IMUNOHISTOKIMIA
POTENSI ANTIGEN EKSKRETORI/ SEKRETORI STADIUM L3,
IMUNO-GLOBULIN YOLK, DAN
KOMBINA-SINYA TERHADAP PENURUNAN POPULASI Ascaridia galli
ANTIGEN EKSKRETORI/SEKRETORI STADIUM L3Ascaridia galli
SEBAGAI PEMICU PEMBENTUKAN IMUNOGLOBOLIN YOLK
(IgY) PADA AYAM PETELUR
Imunisasi aktif dan pasif, dan Populasi cacing A. galli
Koleksi cacing A. galli betina dewasa: L1, L2, dan L3in vivo
Didapatkan antigen dan IgY yang dapat mengurangi populasi A. galli
di dalam saluran cerna ayam petelur
KAJIAN PERKEMBANGAN L1, L2, DAN L3 Ascaridia galli
PADA AYAM PETELUR ABSTRAK
Tujuan penelitian ini adalah untuk menentukan perkembangan populasi L3
Ascaridia galli pada usus halus ayam petelur. Cacing A. galli betina dewasa diperoleh langsung dari lumen ayam kampung pada tempat pemotongan ayam komersial di Bogor. Telur cacing yang diperoleh dari uterus cacing betina A. galli
dewasa diinkubasikan di dalam aquadestilata steril pada temperatur kamar selama 20 – 31 hari untuk mendapatkan telur infektif (L2) A. galli. Lima kelompok (A – E) dari 100 ekor ayam jenis Isa Brown diinfeksi dengan dosis 6000 L2 A. galli. Kelompok A dan B, ayam diberi enam kali berturut-turut dosis 1000 L2 dalam interval waktu masing-masing 30 dan 60 menit setiap pemberian. Kelompok C, ayam diberi tiga kali berturut-turut dosis 2000 L2 dalam interval waktu dua jam setiap pemberian. Kelompok D, ayam diberi dua kali berturut-turut dosis 3000 L2 dalam interval waktu tiga jam setiap pemberian. Kelompok E, ayam diberi satu kali dosis 6000 L2. L3A. galli ditemukan di dalam lumen usus halus ayam setelah 10 hari pemberian L2. Hasil yang diperoleh adalah total 1.045.478 L1 dan 935.300 L2 yang dikoleksi dari 186 A. galli betina dewasa. Prosentase L1 berkembang menjadi L2 adalah 89,46% dan L2 berkembang menjadi L3 adalah 12.7%. Hanya pada kelompok E populasi L3 berkembang secara signifikan di dalam usus halus ayam. Hasil tersebut merefleksikan bahwa terjadi penurunan ketahanan terhadap ascaridiosis pada ayam yang diinfeksi dosis tinggi A. galli.
Kata kunci: Ascaridia galli, telur infektif, larva
ABSTRACT
The aim of the present study was to determine the survival of L3 populations in intestine of chickens exposed to experimental Ascaridia galli infection. Nature female adult worm were obtained from lumen of village chickens in a comercial abattoir in Bogor. The eggs obtained from uteri female adult worms were incubated in sterile aquadestilata et room temperature for 20 - 31 days developed embrionated eggs (L2). Five groups (A - E) of 100 head chickens were infected with 6000 L2 A. galli. The chickens of group A were infected six times with dose of each 1000 L2 with an interval of half hour. The chickens of group B were infected six times with dose of each 1000 L2 with an interval of one hour. The chickens of group C were infected three times with dose of each 2000 L2 with an interval of two hours. The chickens of group D were infected six times with dose of each 3000 L2 with an interval of three hours. The chickens of group E were infected one time with single dose 6000 L2. A. galli L3 were recovered from intestines of 100 heads chickens 10 days after oesophagus inoculation with 6000 L2. The result showed that total 1.045.478L1 and 935.300 L2 colected from 186 A. galli female adult worms. The percentage of L1 developed L2 is 89,46% and L2 developed L3 is 12.7%. Significant survival of L3 higher populations in intestine of chickens observed only in the group E. The results suggest that chickens infected high dose of A. galli capable decreased their defence against ascaridiosis.
PENDAHULUAN
Cacing yang hidup dan berkembang di dalam saluran gastrointestinal sering ditemukan pada unggas. Fahrimal dan Raflesia (2002) berhasil mengidentifikasi tiga jenis nematoda yang ditemukan pada ayam kampung di Nanggroe Aceh Darussalam, yaitu Ascaridia galli, Heterakis gallinae, dan
Capillaria spp., dan yang paling sering ditemukan adalah A. galli. Investigasi Eshetu et al. (2001) pada empat distrik di wilayah pinggiran Amhara (Ethiopia) menunjukkan bahwa prevalensi cacing nematoda yang menginfeksi ayam adalah
A. galli (35,58%), Heterakis gallinae (17,28%), Subulura brupti (17,60), Cheilospirura hamulosa (0,75%), dan Dyspharynx spiralis (2,62%).
Telur A. galli (L1) yang dilepaskan bersama tinja inang definitif dapat berkembang dalam waktu 10 hari atau lebih pada temperatur rendah. Perkembangan tersebut menyebabkan massa telur berubah dan dipenuhi oleh gelungan larva infektif (L2). Viabilitas L2 dapat bertahan selama tiga bulan atau lebih pada kondisi lingkungan yang terlindungi, tetapi dengan cepat terbunuh oleh kekeringan, dan cuaca panas (Soulsby 1982). Unggas dapat terinfeksi secara langsung oleh A. galli apabila L2 tertelan bersama pakan dan atau minuman yang terkontaminasi. Cacing tanah yang dimakan oleh unggas dapat menyebabkan transmisi infeksi secara mekanik, yaitu apabila cacing tanah tersebut telah menelan L2 A. galli. L2 menetas di dalam intestinum inang definitif, dan setelah 10 hari larva (L3) menjalani fase histotrofik dengan cara penetrasi ke dalam jaringan mukosa, larva kembali ke lumen tujuh hari kemudian. Cacing A. galli
tumbuh menjadi dewasa dalam waktu 5 – 8 minggu. Kadang-kadang cacing A. galli dapat berpenetrasi ke organ tubuh yang lain seperti hati dan ginjal pada ular
phyton (Taiwo et al. 2002), dan paru paru pada unggas (Soulsby 1982).
menyebabkan gastroenteritis ulseratif, hepatitis nekrotik, dan nepritis yang dapat berakhir dengan kematian (Taiwo et al. 2002).
Tujuan penelitian ini adalah untuk mengkaji keberhasilan perkembangan L1 menjadi L2 dan keberhasilan perkembangan L2 menjadi L3. L1 yang dikeluarkan dari uterus cacing A. galli betina dewasa dikaji kemampuannya untuk berkembang menjadi L2 secara in vitro. Perkembangan L3 dikaji berdasarkan variasi dosis pemberian L2 secara in vivo.
METODE PENELITIAN
Tempat dan Waktu Penelitian
Penelitian dilaksanakan di Laboratorium Helmintologi, Bagian Parasitologi dan Entomologi Kesehatan, Departemen Ilmu Penyakit Hewan Kesehatan Masyarakat Veteriner, Fakultas Kedokteran Hewan, Institut Pertanian Bogor. Waktu Penelitian berlangsung dari bulan Mei sampai Desember 2005.
Rancangan Penelitian
Cacing A. galli diperoleh dari dalam lumen usus halus ayam kampung yang terinfeksi secara alami. Percobaan I, cacing dikelompokkan berdasarkan jumlah cacing betina dewasa yang ditemukan. L1 diambil langsung dari uterus A.
interval waktu tiga jam setiap pemberian. Kelompok E, ayam diberi satu kali dosis 6000 L2. Ayam dinekropsi 10 hari setelah pemberian L2 dan jumlah L3 yang ditemukan dihitung.
Cacing A. galli Betina Dewasa
Usus ayam kampung yang diperoleh dari tempat pemotongan ayam di Bogor dibawa ke Laboratorium Helmintologi FKH IPB Bogor, disayat secara longitudinal sehingga isi usus ayam dapat diamati. A. galli dewasa yang ditemukan dibersihkan di dalam cairan aquadestilata dan diidentifikasi jenis kelaminnya berdasarkan bentuk ujung ekor dan ukuran tubuh cacing. Cacing yang memiliki bentuk ekor yang lurus dan tubuh yang lebih besar diidentifikasi sebagai cacing A. galli betina dewasa.
Telur A. galli
Cacing terpilih diamati di dalam cairan aquadestilata steril di bawah stereo mikroskop dan tubuhnya dilukai dengan ujung oese yang tajam sehingga uterusnya keluar dari tubuh cacing. Uterus ditoreh kembali sehingga telur A. galli
mengalir di dalam aquadestilata. Jumlah larva L1 yang diperoleh dari setiap cacing
A. galli betina dewasa dihitung di bawah mikroskop. Telur cacing tersebut diendapkan dan dimasukkan ke dalam eppendorf volume 1 ml aquadestilata Sebanyak 100 μl suspensi telur yang homogen dari volume endapan 1 ml tersebut diambil dan dihitung kandungan telurnya dengan tiga kali ulangan. Jumlah telur cacing ditentukan dengan cara menghitung jumlah telur dari populasi cacing yang disayat dengan rumus: 10 x rataan kandungan telur dalam 100 μl (Tiuria 1991).
Koleksi Telur Infektif (L2) A. galli
Koleksi Stadium L3A. galli
Isi lumen dan mukosa usus halus dari masing-masing kelompok ayam donor dibersihkan dengan NaCl fisiologis dan disaring dengan kain kasa untuk mendapatkan larva cacing A. galli. Larva (L3) yang masih hidup dihitung dan dikoleksi di bawah mikroskop stereo.
Analisis Data
Data diuji dengan analisis sidik ragam. Apabila terdapat perbedaan, dilanjutkan dengan uji wilayah berganda Duncan (Steel dan Torrie 1999).
HASIL PENELITIAN
Koleksi Telur Infektif (L2) A. galli
Perkembangan L1 menjadi L2 yang diperoleh dari A. galli betina dewasa disajikan pada Gambar 7. Sebanyak 186 ekor A. galli betina dewasa berhasil dikoleksi pada penelitian ini. Secara keseluruhan, cacing A. galli betina dewasa menghasilkan 1.045.478 L1 yang berhasil berkembang menjadi 935.300 L2.
0
Jumlah cacing A. galli betina dewasa (ekor)
Ju
ditoreh uterusnya, semakin banyak pula jumlah L1 yang ditemukan. Persentase perkembangan L1 menjadi L2 dari kelompok 3 , 4, 5, 6, 11, 15, dan 18 ekor cacing berturut-turut adalah 87%, 92%, 94%, 89%, 97%, 89%, dan 85%. Secara keseluruhan, persentase L1 yang berkembang menjadi L2 adalah 89,46%.
Koleksi Stadium L3A. galli
Pemberian enam kali dosis 1000 L2 pada kelompok A dan B yang dibedakan dalam interval waktu 30 dan 60 menit setiap kali pemberian menghasilkan rataan jumlah L3 yang berkembang tidak signifikan berbeda. Seperti yang disajikan pada Tabel 1, hasil yang ditemukan pada kelompok B, C, D, dan E menunjukkan bahwa rataan jumlah L3 cenderung semakin meningkat bersamaan meningkatnya pemberian dosis L2. Peningkatan rataan jumlah L3 pada kelompok E yang hanya signifikan berbeda dengan kelompok lainnya.
Secara keseluruhan, persentase L2 yang berkembang menjadi L3 adalah 12,7%. Kemampuan L3 A. galli berkembang di dalam saluran cerna ayam Isa
Brown dipengaruhi oleh besarnya dosis infeksi yang diberikan pada satu waktu. Semakin besar dosis L2 yang diberikan pada satu waktu semakin tinggi pula persentase L3 yang berkembang. Persentase perkembangan L3 yang paling rendah (8,39%) ditemukan pada kelompok A, yaitu pada ayam yang diberikan enam kali berturut-turut dosis 1000 L2 dalam interval waktu 30 menit setiap pemberian. Prosentase perkembangan L3 yang paling tinggi ditemukan pada kelompok E, yaitu pada ayam yang diberikan satu kali dosis 6000 L2 sekaligus (Tabel 1).
Tabel 1. Rataan jumlah L3 dan persentase L3 terhadap dosis infeksi pada tiap- tiap 4 ekor ayam donor dengan 5 kali ulangan 10 hari pascainfeksi _ Kelom- Dosis Frekuensi Interval wak- Rataan Prosentase (%) pok L2 pemberian tu (menit) jumlah L3 jumlah L3
A 1000 6 30 2158,8 ± 264,4 a 8,39
B 1000 6 60 2014,6 ± 256,6a 8,99
C 2000 3 120 2501,4 ± 314,4 ab 10,42
D 3000 2 180 3409,6 ± 366,6 ab 14,20
E 6000 1 - 5154,6 ± 457,6 c 21,48_
Rataan L3yang berkembang 12,70
PEMBAHASAN
Cacing A. galli betina dewasa melepaskan telur di dalam lumen intestinum inang definitif dan dikeluarkan ke lingkungan bersama tinja. Untuk mencapai stadium L2, L1 harus berada pada lingkungan yang sesuai untuk perkembangannya. Selama berada di lingkungan, L1 dihadapkan oleh kondisi lingkungan dimana tinja berada. Apabila kondisi lingkungan lembab dengan temperatur rendah, maka L1 dapat berkembang menjadi L2. Apabila kondisi lingkungan kering dengan temperatur tinggi, maka L1 gagal mencapai stadium L2.
Untuk mempertahankan kelangsungan hidupnya, cacing A. galli harus menghasilkan L1 dalam jumlah yang banyak, sehingga semakin banyak pula L1 dapat mencapai stadium L2. Pada penelitian ini, terlihat bahwa cacing A. galli mampu melepaskan ribuan L1 dari uterusnya. Secara in vitro, L1 yang berkembang menjadi L2 adalah 89,46%. Hanya 10,54% L1 yang gagal mencapai stadium L2 (Gambar 7). Banyaknya jumlah L1 yang dilepaskan oleh cacing A. galli betina dewasa, dan tingginya persentase L1 yang berkembang menjadi L2 adalah sebagai cara cacing tersebut untuk mempertahankan kelangsungan hidupnya. Apabila L2 berada di lingkungan maka peluang tertelan oleh inang definitif semakin besar.
Kemampuan A. galli melepaskan telur ke dalam tinja inang definitif bervariasi jumlahnya. Hasil riset Schou et al. (2003) merefleksikan bahwa jumlah telur A. galli yang dilepaskan ke dalam tinja dipengaruhi ukuran panjang tubuh dan jumlah cacing betina yang bertahan hidup di dalam saluran cerna serta jenis inang definitifnya. Ukuran tubuh A. galli betina yang lebih panjang dan jumlah cacing bertahan hidup yang lebih banyak berimplikasi kepada nilai telur tiap gram tinja (TTGT) yang tinggi. Telur A. galli yang dilepaskan ke dalam tinja ayam jenis
Jumlah larva A. galli yang ditemukan di dalam saluran cerna ayam setelah diberikan telur infektif dipengaruhi oleh jenis ayam yang digunakan sebagai model. Gabrashanska et al. (2004b) membuktikan bahwa pemberian dosis 1450 L2
A. galli pada ayam jantan jenis Hisex breed dapat menghasilkan rataan jumlah 340, 1 ± 76,5 larva dan prosentase L3 terhadap dosis yang diberikan setelah 10 hari pascainfeksi adalah 23,5%. Permin dan Ranvig (2001) melaporkan bahwa ayam Lohman Brown lebih tahan terhadap infeksi A. galli dibandingkan ayam
Danish Landrace, dimana worm burden dan jumlah telur cacing yang ditemukan pada ayam Danish Landrace lebih banyak.
Permin et al. (1997) melaporkan bahwa pada ayam Lohman Brown yang diinfeksi masing-masing dengan 100, 500, atau 2.500 telur infektif A. galli, setelah delapan minggu menghasilkan rata-rata establishment cacing 14,2%, 2,9%, dan 0,5%. Infeksi dosis tinggi menurunkan jumlah cacing betina, TTGT, panjang, dan berat cacing tetapi fekunditasnya tidak berbeda.
Penelitian Schou et al. (2003) membuktikan bahwa pada ayam New Hampshire yang diinfeksi pada umur 60 minggu dengan dosis tunggal 500 telur infektif A. galli ditemukan lebih banyak larva yang establish pada minggu ke3, -6, dan -9 pasca infeksi dibandingkan dengan tiga jenis ayam petelur komersial lainnya: Skalborg, Isa Brown, dan ayam hasil persilangan New Hampshire dan
Skalborg. Larva A. galli tidak ditemukan lagi di dalam saluran cerna ayam
Skalborg sejak minggu ke-6 pasca infeksi sedangkan pada saluran cerna ayam persilangan New Hampshire dan Skalborg, larva tidak ditemukan lagi sejak minggu ke-9 pasca infeksi.
KESIMPULAN
Dari hasil penelitian dapat disimpulkan bahwa keberhasilan perkembangan L1 menjadi L2 adalah 89,46%. Keberhasilan larva A. galli melangsungkan kehidupannya secara in vivo sangat dipengaruhi oleh metode dan dosis infeksi, dimana metode infeksi sekaligus dengan dosis L3 yang tinggi menghasilkan lebih banyak jumlah L3 A. galli yang establish di dalam saluran cerna ayam petelur. Secara keseluruhan jumlah L3 yang dikoleksi adalah 12,70%.
SARAN
ISOLASI DAN KARAKTERISASI ANTIGEN EKSKRETORI/SEKRETORI STADIUM L3 Ascaridia galli
ABSTRAK
Penelitian telah dilakukan untuk menyiapkan antigen ekskretori/sekretori larva (L3) A. galli. L3 diperoleh dari usus halus 100 ekor ayam tujuh hari setelah pemberian dosis 6000 L2 melalui oesofagus ayam. Sebanyak 5 – 10 ekor L3 dikultur secara in vitro dalam setiap ml medium Rosswell Park Memorial Institute (RPMI 1640), pH 6,8, tanpa merah fenol dalam inkubator pada temperatur 37oC dan 5% CO2 selama 3 hari. Medium ditambahkan 100 units ml-1 penicillin G, 100 μg ml-1 streptomycin, 5 μg ml-1 gentamycin, and 0.25 μg ml-1 kanamycin. Antigen ekskretori/sekretori dipreparasi dari produk metabolisme L3 yang dilepaskan ke dalam medium kultur. Untuk mendapatkan antigen ekskretori/sekretori, medium kultur dipekatkan dengan vivaspin 30.000 MWCO, dan kuantitas protein antigen dihitung dengan metode Bradford. Berat molekul antigen ekskretori/sekretori ditentukan dengan sodium dodecyl sulphate polyacrylamide gel electrophoresis (SDS PAGE). Hasil menunjukkan bahwa konsentrasi protein antigen ekskretori/sekretori adalah 0,595 mg/ml dengan berat molekul 28 kDa. Ekskretori/sekretori L3 A. galli kemungkinan dapat dikembangkan sebagai antigen untuk memicu respons imun terhadap penyakit parasitik yang disebabkan oleh A. galli.
Kata kunci: Ascaridia galli, ekskretori/sekretori, antigen, larva
ABSTRACT
A study was carried out to prepare excretory/secretory antigen of Ascaridia galli from larval stage. A. galli L3 were recovered from intestines of
100 heads chickens 7 days after oesophagus inoculation with 6000 L2. L3
recovered in this manner were cultured (5 – 10 ml-1) in flasks containing RPMI 1640 media, pH 6.8, without phenol red and suplemented with 100 units ml-1 penicillin G, 100 ȝg ml-1 streptomycin, 5 ȝg ml-1 gentamycin, and 0.25 ȝg ml-1 kanamycin. Cultures were incubated at 370C in 5% CO2 and culture fluid was
collected after 3 days in culture. Excretory/secretory antigen was prepared from metabolic product of L3 released in culture medium. To prepare
excretory/secretory antigen, culture medium were concentrated with vivaspin 30.000 MWCO, and antigen protein concentration were counted as described in Bradford method. The molecular weight of excretory/secretory antigen was determined with sodium dodecyl polyacrylamid gel electrophoresis (SDS PAGE). The result showed that antigen protein concentration is 0,595 mg/ml. The molecular weight of excretory/secretory antigen was 28 kDa. Our results suggest the possibility of developing an excretory/secretory antigen to trigger immune responses against parasitic diseases caused by A. galli.
PENDAHULUAN
Cacing nematoda umumnya melepaskan ekskretori/sekretori sebagai produk metabolisme parasit. Peneliti terdahulu melaporkan bahwa ekskretori/sekretori dilepaskan oleh cacing nematoda seperti Ascaris suum pada babi (Rhoads et al. 1997), Ostertagia ostertagi pada sapi (Cock et al. 1993),
Ostertagia circumcincta, Haemonchus contortus dan Trichostrongylus spp. pada ruminansia (Knox dan Jones 1990), dan Onchocerca gipsoni pada sapi (Harnett et al. 1997). Ekskretori/sekretori dapat berperan sebagai molekul antigen pemicu respons imunitas inang definitif (Rhoads et al. 1997).
Sumber antigen dapat diperoleh dari cairan tubuh cacing (body fluid) (Yoshihara et al. 1993) atau sel somatik (somatic antigen) (Siles-Lucas dan Cuesta-Bandera 1996), dan produk ekskretori/sekretori (McKeand et al. 1995; Siles-Lucas dan Cuesta-Bandera 1996; Vervelde et al. 2003; Darmawi et al. 2006b) pada setiap stadium kehidupan cacing. Cacing dapat melepaskan ekskretori/sekretori pada kondisi in vivo dan in vitro. Secara in vivo, ekskretori/sekretori dilepaskan selama cacing menjalani proses infeksi dan selama bertahan hidup pada inang definitifnya. Secara in vitro, ekskretori/sekretori dilepaskan sebagai akibat metabolisme, dan sebagai upaya cacing untuk mendapatkan nutrisi dari lingkungannya (Cock et al. 1993).
Campos et al. (2004) melaporkan bahwa antigen somatic dan ekskretori/sekretori larva L3 Anisakis simplex ditemukan dengan uji
Enzyme-Linked Immunosorbent Assay (ELISA) 24 jam pascainfeksi di dalam serum tikus yang sudah diinfeksi dengan cacing tersebut. Secara in vitro, antigen dilepaskan selama cacing menjalani kultivasi di dalam medium kultur yang sesuai. McKeand
et al. (1995) melaporkan bahwa eksplorasi antigen ekskretori/sekretori
Dictyocaulus viviparus (cacing paru pada sapi) dapat dipanen dalam setiap interval waktu 24 selama tiga hari masa kultivasi di dalam medium Rosswell Park Medium Institute (RPMI 1640).
vivaspin mengandung protein antigen 0,691 mg/ml. Yoshihara et al. (1993) membuktikan bahwa dalam setiap ml cairan tubuh cacing A. suum betina dewasa ditemukan 40 mg kandungan protein.
Penelitian Timanova et al. (1999) dan Jordanova et al. (2005) pada tubuh
A. galli dewasa mengandung poliprotein yang disebut A. galli fatty acid-binding protein (AgFABP), bersifat sebagai allergen yang mengikat asam lemak dan retinoid dengan affinitas yang kuat. Visualisasi antigen ekskretori/sekretori stadium L2 dan stadium dewasa A. galli menunjukkan berat molekul masing-masing protein adalah 35 dan 40 – 66 kDa (Tiuria et al. 2003). Namun, informasi tentang produk ekskretori/sekretori larva A. galli belum pernah dilaporkan. Ekskretori/sekretori L3 A. galli diduga mengandung protein sebagai bahan antigen. Penelitian ini dirancang untuk menyiapkan antigen dari ekskretori/sekretori larva stadium L3 A. galli. Stadium L3 dipilih menjadi fokus penelitian karena pada stadium tersebut larva A. galli akan mengalami fase histotrofik, dimana larva mengekskresi/sekresikan metabolit untuk menembus
barrier pertahanan selaput lendir mukosa saluran cerna.
Kajian terhadap ekskretori/sekretori dilakukan karena molekul biologi aktif tersebut berperan sebagai faktor invasif yang memudahkan migrasi larva ke jaringan. Ekskretori/sekretori juga berpotensi sebagai antigen karena dianggap sebagai benda asing oleh inang definitif. Dengan demikian, ekskretori/sekretori berperan untuk memfasilitasi interaksi antara cacing A. galli sebagai parasit dengan ayam petelur sebagai inang definitif. Tujuan penelitian ini adalah untuk mengetahui karakter antigen ekskretori/sekretori yang dilepaskan oleh L3 A. galli berdasarkan kuantitas protein dan berat molekul antigen.
METODE PENELITIAN
Tempat dan Waktu Penelitian
Rancangan Penelitian
Sebanyak 5 – 10 ekor L3 dikultur secara in vitro dalam setiap ml medium
Rosswell Park Memorial Institute (RPMI 1640). Antigen ekskretori/sekretori dipreparasi dari produk metabolisme L3 yang dilepaskan ke dalam medium kultur. Medium kultur dipekatkan dengan vivaspin 30.000 MWCO (Tiuria et al. 2003), dan kuantitas protein antigen dihitung dengan metode Bradford. Berat molekul antigen ekskretori/sekretori ditentukan dengan sodium dodecyl sulphate polyacrylamide gel electrophoresis (SDS PAGE).
Preparasi Antigen Ekskretori/Sekretori L3A. galli
Larva A. galli diinkubasi dalam sumur cell culture plate, masing-masing sumur diisi 25 – 50 larva dalam 5 ml medium Rosswell Park Memorial Institute
(RPMI 1640, Sigma-Aldrich), pH 6,8, tanpa merah fenol yang ditambahkan 100 unit ml-1 penisilin G, 100 μg ml-1 streptomisin, 5 μg ml-1 gentamisin, dan 0,25 μg ml-1 kanamisin dalam inkubator CO2 selama 3 hari. Campuran medium dengan ekskretori/sekretori L3 A. galli disentrifus pada 10000 g dengan temperatur 4oC selama 10 menit. Supernatan disaring dengan membran filter 0,45 μm Minisart® (Sartorius), ditampung ke dalam tabung vivaspin 30.000 MWCO dan disentrifus pada 1000 g dengan temperatur 4oC selama 10 menit. Filtrat dicuci dengan larutan
Phosphate Buffered Saline (PBS) dan disentrifus kembali 3 menit. Filtrat diambil dan dijadikan sebagai bahan antigen ekskretori/sekretori L3 A. galli (Hintz et al. 1998).
Kuantitas Protein dari Ekskretori/Sekretori L3A. galli
masing-masing dimasukkan ke tabung kuvet untuk dilihat hasil absorbansinya dengan Spectrophotometer (Siles-Lucas dan Cuesta-Bandera 1996).
Sodium Dodecyl Sulphate Polyacrylamid Gel Electrophoresis (SDS PAGE)
Visualisasi berat molekul antigen dilakukan dengan menggunakan arus listrik tegangan 40 volt dengan kuat arus 12 mA pada suhu kamar selam 2 jam. Pada elektroforesis ini disiapkan dengan poliakrilamid 12,5%, gel pengumpul 4%, buffer elektroda dan buffer sampel. Marker (penenda berat molekul protein) yang digunakan phosphprilase b (97 kD), albumin (66 kD), ovalbumin (45 kD), carbonic anhydrase (30 kD) Tripsin inhibitor (20,1 kD) dan α-lactalbumin (14,4 kD). Sampel dan marker masing-masing dimasukkan ke dalam sumur elektroforesis (Laemmli 1970). Gel diwarnai dengan Comassie blue R 250 (Serva Germany) selama 30 menit dan dipucatkan dengan larutan pencuci sampai pita-pita protein tampak jelas.
Analisis Data
Data kuantitas protein ekskretori/sekretori larva A. galli dianalisis berdasarkan persamaan regresi kurva standar Y = ax + b dari pengenceran BSA, dimana Y adalah besarnya absorpsi, a adalah koefisien regresi, x adalah konsentrasi sampel, dan b adalah suatu konstanta.
HASIL PENELITIAN
Preparasi Antigen Ekskretori/sekretori L3A. galli
Kuantitas Protein dari Ekskretori/Sekretori L3A. galli
Nilai absorbansi terhadap protein ekskretori/sekretori larva A. galli adalah 0,32. Berdasarkan persamaan regresi Y = 0,7225X – 0,0073 (R2 = 0,99) standar protein, rata-rata kuantitas protein ekskretori/sekretori larva A. galli sebelum pemekatan adalah 0,065 mg/ml dan setelah pemekatan adalah 0,595 mg/ml. Hasil uji kuantitas protein standar terhadap BSA pada UV spektrofotometer dengan panjang gelombang 280 nm (R2 = 0,99) disajikan pada Tabel 2.
Tabel 2. Kuantitas protein ekskretori/sekretori larva A. galli
Kuantitas protein (mg/ml) _____ No. sampel Sebelum pemekatan Setelah pemekatan__
1 0,057 0,636
2 0,048 0,685
3 0,072 0,574
4 0,085 0,560
5 0,063 0,520
Rata-rata 0,065 0,595 ______
Sodium Dodecyl Sulphate Polyacrylamid Gel Electrophoresis (SDS PAGE)
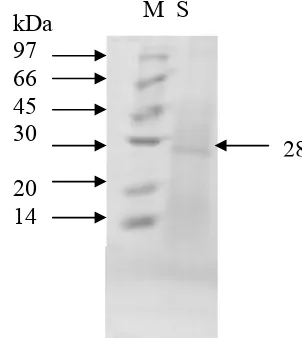
Visualisasi pita protein melalui SDS PAGE setelah pemekatan dengan Vivaspin 30.000 MWCO menunjukkan berat molekul antigen adalah 28 kDa (Gambar 8).
M S kDa
97 66 45 30 20 14
28
PEMBAHASAN
Hasil yang diperoleh pada penelitian ini menunjukkan bahwa ekskretori/sekretori larva A. galli mengandung protein dengan konsentrasi 0,065 mg/ml dan setelah dipekatkan dengan vivaspin 30.000 MWCO meningkat menjadi 0,595 mg/ml (Tabel 2). Konsentrasi tersebut diperoleh dari kultivasi 4 – 10 L3 A. galli dalam setiap ml RPMI 1640. Berat molekul protein ekskretori/sekretori larva A. galli adalah 28 kDa (Gambar 8). Penelitian terdahulu membuktikan bahwa konsentrasi protein yang dilepaskan oleh 10 ekor A. galli
betina dewasa yang dikultur dalam 20 ml medium RPMI adalah 0,380 mg/ml (Darmawi 2003).
Hasil penelitian ini mendukung temuan peneliti terdahulu bahwa sumber antigen dapat diperoleh dari cairan tubuh cacing (body fluid) (Yoshihara et al. 1993) atau dari sel somatik (somatic antigen) (Siles-Lucas dan Cuesta-Bandera 1996), dan dari produk ekskretori/sekretori (McKeand et al. 1995; Siles-Lucas dan Cuesta-Bandera 1996; Vervelde et al. 2003). Antigen cacing nematoda dapat juga diperoleh pada setiap stadium kehidupannya. Tiuria et al. (2002) telah membuktikan bahwa berat molekul antigen ekskretori/sekretori stadium L2 dan cacing dewasa A. galli berturut-turut adalah 35 kDa dan 40 – 66 kDa sedangkan antigen somatiknya adalah 45 – 66 kDa.
Pada tubuh A. galli dewasa dibuktikan oleh Timanova et al. (1999) dan Jordanova et al. (2005) mengandung poliprotein. Protein yang dikenal sebagai A. galli fatty acid-binding protein (AgFABP) dikaraterisasi melalui deduksi rantai asam amino AgFABP merefleksikan bahwa poliprotein ini bersifat sebagai antigen yang dapat memicu alergi. Alergen mengikat asam lemak dan retinoid dengan affinitas yang kuat.
Antigen cacing nematoda sering berubah-ubah seiring dengan kejadian
molting yang dialaminya. Taylor et al (1995) melaporkan bahwa cacing nematoda
Onchocerca volvulus yang sering ditemukan pada manusia di Afrika dan Amerika Selatan mempunyai beberapa antigen yang terdapat pada hypodermis dan kutikula. Berat molekul antigen polipeptida mikrofilaria O. volvulus adalah 42 kDa, pada stadium L3 dilaporkan dua jenis antigen protein masing-masing dengan berat molekul 52 dan 65 kDa, sedangkan pada stadium dewasa antigen O. volvulus tidak terdeteksi.
Yoshihara et al. (1993) menemukan antigen dengan berat molekul 105 kDa pada cairan tubuh cacing dewasa A. suum. Selama stadium transisi L3 – L4A.
suum, cacing yang ditemukan pada babi, melepaskan aminopeptidase dengan berat molekul 293 kDa. Tsuji et al (2001) membuktikan pula bahwa cDNA L3 A.
suum yang mengkode protein dengan berat molekul rendah 14 kDa apabila diikat dengan subunit tiksin B kolera dapat berperan sebagai antigen untuk menginduksi imunitas protektif terhadap infeksi A. suum pada mencit.
Variasi berat molekul antigen juga ditemukan pada cacing nematoda yang lain. Pada stadium L4, cacing Ostertagia ostertagi melepaskan ekskretori/sekretori dengan berat molekul 66, 70, dan 100 kDa (Cock et al. 1993). Ekskretori/sekretori stadium L1Trichinella spiralis mempunyai berat molekul 25 – 55 kDa (Todorova 2000). Hadas dan Stankiewicz (1997) melaporkan bahwa berat molekul proteinase pada L3 dan cacing dewasa H. contortus dan
Trichostrongylus colubriformis berkisar antara 35 – 200 kDa.
Todorova (2000) menyatakan bahwa perbedaan berat molekul ekskretori/sekretori cacing nematoda yang dilepaskan pada masing-masing stadium diperlukan untuk proses biologik parasit. Ekskretori/sekretori cacing terlibat dalam proses penetrasi ke jaringan, nutrisi parasit, anti-koagulasi, dan pengelakan respons imun inang definitif. Rhoads et al. (1997) melaporkan bahwa pelepasan ekskretori/sekretori disebabkan oleh proses perkembangan dan survival
KESIMPULAN
Berdasarkan hasil penelitian ini dapat disimpulkan bahwa stadium L3 A.
galli melepaskan ekskretori/sekretori yang mengandung protein 0,065 mg/ml dan setelah pemekatan dengan vivaspin 0,595 mg/ml dengan berat molekul 28 kDa.
SARAN