TATTY YUNIARTI
Tesis
sebagai salah satu syarat memperoleh gelar Magister Sains
pada Program Studi Teknologi Hasil Perairan
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI
Dengan ini saya menyatakan bahwa tesis Purifikasi dan Karakterisasi Kolagenase dari Organ Dalam Ikan Bandeng (Chanos chanos, Forskal) adalah karya saya dengan arahan komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Bogor, Februari 2010
ABSTRACT
TATTY YUNIARTI. Purification and Characterization of a Collagenase from Internal Organ of Milkfish (Chanos chanos, Forskal). Under direction of Tati Nurhayati and Agoes Mardiono Jacoeb.
The texture of fish is an important quality characteristic,and soft fillets are a problem for the fish industry. The quality of fish muscle will deteriorate during iced storage of raw fish. Endogenous proteases, which are able to hydrolyze different proteins in the muscle, are important early in the deterioration process. Endogenous fish muscle proteases are located in intracellular fluids and in the sarcoplasm, or they are associated with various cell organelles. In the live animal, the proteases function in muscle protein turnover. After death, the biological regulation of the enzymes is lost, and the enzymes hydrolyze muscle proteins and resolve the rigor mortis contraction. The proteolytic enzymes to be important for the textural properties of fish muscle, namely calpains, cathepsins, and collagenases.
Endogenous collagenases may break down the connective tissue in the fish muscle and thereby lead to undesirable textural changes and gaping, in addition to rendering the components of the extracellular matrix more vulnerable to attack by other proteases. So that is important to know its characterization of collagenase.
The milkfish (Chanos chanos, Forskal) is the most widely cultured marine fish in the Indonesia. Milkfish constitutes 269.530 ton of total production volume 2.625.800 ton from aquaculture. Collagenases activity in milkfish found in internal organ, and the higest was at post rigor. We observed collagenase at crude extract from milkfish internal organ at post rigor such as intestine, piloric caeca and liver.
The objectives of this study were to study where a part of internal organ has the highest collagenase activity, to purify that’s enzyme, and to characterize the enzyme with respect to it responses to pH, temperature, and inhibitors. We also observed temperature and pH stabilization of that’s collagenase and the molecular mass of the purified.
Collagenase was purified from internal organ of milkfish (Chanos chanos, Forskal), by extraction, ammonium sulfate presipitation, ion exchange chromatography on DEAE Sephadex A-50 and gel filtration on a Sephadex G-100 column. The molecular mass of the purified enzyme was estimated by gel filtration and SDS polyacrylamide gel electrophoresis (SDS-PAGE).
Crude extract from intestine had the higest collagenase activity. The purification were 114,731 fold. The optimum temperature and pH of collagenase were 50 oC and pH 7-9, it was strongly inhibited by serine proteinase inhibitor (PMSF), and that activity was increased by Ca2+ and Na+. The molecular mass of milkfish serine collagenase was estimated to be 14,63 kDa dan 27,46 kDa. Collagenase stabilized at 10-50 oC and pH 8-9.
RINGKASAN
TATTY YUNIARTI. Purifikasi dan Karakterisasi Kolagenase dari Organ Dalam Ikan Bandeng (Chanos chanos, Forskal) (Dibawah bimbingan Tati Nurhayati dan Agoes Mardiono Jacoeb).
Kolagenase adalah enzim yang dapat menghidrolisa kolagen, yaitu protein yang berbentuk serabut, terdapat hanya pada hewan, misalnya otot achilles dan pada kulit. Aktivitas kolagenase pada post mortem ikan menyebabkan kerusakan tekstur daging ikan, yaitu terpisahnya jaringan ikat daging ikan (gaping). Penelitian terdahulu menyebutkan bahwa pada ikan bandeng (Chanos chanos, Forskal) terdapat aktivitas kolagenase pada fase post rigor. Namun letak kolagenase di dalam organ dalam, aktivitas serta sifat-sifat katalitiknya belum diketahui. Hal ini diperlukan untuk mempelajari kemunduran mutu ikan bandeng. Selain itu, sebagai produk bioteknologi, kolagenase dapat digunakan sebagai alternatif sumber enzim baru, sebab sumber-sumber enzim baru masih diperlukan. Dalam penelitian ini dilakukan purifikasi dan karakterisasi kolagenase dari organ dalam ikan bandeng.
Penelitian ini bertujuan untuk menentukan letak sumber kolagenase dari organ dalam ikan bandeng beserta aktivitasnya, dan mendapatkan kolagenase yang murni beserta sifat-sifat katalitiknya. Manfaat penelitian ini adalah untuk mendapatkan informasi letak sumber kolagenase dan sifat-sifat katalitiknya sehingga dapat dimanfaatkan sesuai dengan sifatnya.
Penelitian terbagi dalam tiga tahap, yaitu preparasi, purifikasi dan karakterisasi kolagenase dari organ dalam ikan bandeng. Preparasi bertujuan untuk memisahkan organ dalam ikan bandeng yaitu hati, pilorik kaeka dan usus. Purifikasi dilakukan secara bertahap yaitu ekstraksi, pengendapan menggunakan ammonium sulfat, dialisis, kromatografi penukar ion DEAE Sephadex A-50 dan kromatografi gel filtrasi Sephadex G-100. Karakterisasi meliputi penentuan pH dan suhu optimum, pengaruh inhibitor, ion logam, kestabilan terhadap suhu, kestabilan terhadap pH dan penentuan berat molekul.
Hasil penelitian menunjukkan bahwa preparasi organ dalam ikan banding dengan berat ikan bandeng 188–547 g/ekor atau dengan berat rata-rata 375,57 g/ekor mempunyai prosentase berat usus sebesar 2,49%, hati sebesar 1,23% dan pilorik kaeka sebesar 1,26%. Prosentase ini berbeda dengan penelitian yang sebelumnya, pada spesies ikan yang lain, karena perbedaan fisiologi ikan antara seperti jenis spesies ikan, ukuran ikan, cara makan dan jenis makanan, habitat dan tingkat kematangan gonad.
Kolagenase ini telah dapat dimurnikan dengan baik. Purifikasi menghasilkan aktivitas spesifik kolagenase sebesar 20,642 U/mg dengan kelipatan pemurnian yang tinggi sebesar 114,731 kali, dan yield yang dihasilkan dari pemurnian ini adalah 1,26%. Kelipatan pemurnian ini lebih tinggi daripada kolagenase yang telah dipurifikasi dari organ dalam ikan makarel (Scomber japanicus), organ dalam ikan filefish (Novoden modestrus), pilorik kaeka ikan tuna(Thunnus thynnus) danhepatopancreas udang (Pandalus eous) Aoki et al. (2003)
Kolagense mempunyai suhu dan pH optimum 50 oC. Hal ini disebabkan karena ikan adalah hewan yang bersifat poikiloterm yaitu suhu badannya dipengaruhi oleh suhu lingkungan perairan. Perbedaan suhu lingkungan dapat menyebabkan perbedaan sifat enzim. Sifat enzim juga Enzim pada umumnya mempunyai temperatur optimum seperti temperatur sel. Kondisi pH optimum kolagenase ini adalah 7-9. Kolagenase ini tergolong dalam enzim yang bekerja dengan optimum pada pH netral cenderung basa.
Kolagenase meningkat aktivitasnya jika ditambah dengan ion Ca2+ dan Na+. Penambahan ion logam sebagai kofaktor dapat mempengaruhi stabilitas enzim. Kolagenolitik proteinase yang dipurifikasi dari usus ikan Atlantic cod (Gadus morhua) mempunyai sifat termo stabil, atau stabil pada suhu tinggi dengan penambahan ion Ca2+, tetapi tanpa ion tersebut, enzim ini tidak stabil pada suhu di atas 30 oC.
Kolagenase dihambat dengan baik oleh PMSF hingga 23%. Dari prosentase penghambatannya, kolagenase ini diduga adalah jenis serin protease. Kolagenase jenis serin umumnya ditemukan pada ikan. Tetapi kolagenase dari daging ikan Pasific rockfish (Sebastes sp), termasuk dalam jenis metallo. Diduga kolagenase ini terlibat dalam degradasi kolagen dan softening pada produk seafood.
Berat molekul kolagenase adalah 27,61 kDa dan 14,36 kDa. Kolagenase jenis serin dari berbagai sumber diketahui mempunyai berat molekul bervariasi, yaitu kurang dari 30 kDa. Kolagenase jenis metallo biasanya mempunyai berat molekul metallokolegenase bervariasi dari 30 hingga 150 kDa.
Kolagenase stabil selama penyimpanan pada suhu 10-50 oC. Selanjutnya, kolagenase mengalami penurunan aktivitasnya setelah penyimpanan pada suhu 60
o
C. Enzim-enzim dari organ pencernaan hewan laut mempunyai sifat bersifat termostabil yang rendah, erta stabil pada suhu rendah. Kestabilan aktivitas kolagenase pada suhu dingin ini, pada beberapa spesies ikan masih dapat mengakibatkan perubahan sifat tekstur daging ikan, selama penyimpanan dingin.
Kolagenase pada pH 3-4 mempunyai aktivitas yang rendah, tetapi pada pH 6-11 kolagenase mempunyai aktivitas yang masih tinggi. Aktivitas tertinggi kolagenase stabil pada pH 7-9. Hal tersebut umumnya terjadi pada proteinase dari ikan mempunyai sifat stabil pada pH netral mendekati basa.
Mengingat pemurnian kolagenase dari usus ikan bandeng ini belum sempurna, karena masih terdapat dua band, maka disarankan untuk dilakukan pemurnian lebih lanjut dengan metoda penelitian yang lain, sehingga diharapkan dapat dihasilkan kolagenase yang benar-benar murni.
©Hak Cipta milik IPB, tahun 2010
Hak Cipta dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa emncantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunanlaporan, penulisan kritik atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan yang wajar IPB.
PURIFIKASI DAN KARAKTERISASI KOLAGENASE DARI
ORGAN DALAM IKAN BANDENG (Chanos chanos, Forskal)
TATTY YUNIARTI
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
LEMBAR PENGESAHAN TESIS
Judul Proposal : Purifikasi dan Karakterisasi Kolagenase dari Organ Dalam Ikan Bandeng (Chanos chanos, Forskal)
Nama : Tatty Yuniarti NIM : C351070071
Disetujui:
Komisi Pembimbing
Dr. Tati Nurhayati, S.Pi ,M.Si Dr.rer.nat. Ir. Agoes M Jacoeb, Dpl.-Biol
Ketua Anggota
Dr. Tati Nurhayati, S.Pi, M.Si Prof. Dr. Ir. Khairil A. Notodiputro, M.S
PRAKATA
Puji syukur kehadirat Allah SWT atas segala rahmat dan karunia-Nya sehingga penelitian dengan judul Purifikasi dan Karakterisasi Kolagenase dari Organ Dalam Ikan Bandeng (Chanos chanos, Forskal) telah selesai. Tesis ini disusun sebagai salah satu syarat memperoleh gelar Magister Sains pada Program Studi Teknologi Hasil Perairan, Sekolah Pascasarjana, Institut Pertanian Bogor.
Terima kasih penulis ucapkan kepada Bapak Dr. Ir. Ruddy Suwandi, M.S, M.Phil selaku Ketua Departemen Teknologi Hasil Perairan, Ibu Dr. Tati Nurhayati, S.Pi, M.Si selaku Ketua Program Studi S2 Teknologi Hasil Perairan dan ketua komisi pembimbing serta Bapak Dr. Ir. rer.nat. Agoes Mardiono Jacoeb, Dpl.-Biol selaku anggota komisi pembimbing, serta seluruh staf pengajar pada Departemen THP, FPIK, IPB. Disamping itu, penghargaan penulis sampaikan atas ijin menjalankan tugas belajar, kepada Ibu Dr. Iin Siti Djunaidah, selaku Kepala BPSDM, Departemen Kelautan dan Perikanan, Bapak. Dr. Maimun, M.Ed selaku Direktur Sekolah Tinggi Perikanan Jakarta, Bapak Iskandar Musa, A.Pi, MM selaku Ketua Jurusan Penyuluhan Perikanan STP serta segenap rekan-rekan Sekolah Tinggi Perikanan Jakarta khususnya Jurusan Penyuluhan Perikanan. Terima kasih juga atas terselenggaranya penelitian ini yang dibiayai oleh Dana Hibah Bersaing Batch DP2M-Ditjen Dikti-DEPDIKNAS Thun 2009 atas nama Dr. Tati Nurhayati, S.Pi, M.Si.
Penulis juga menyampaikan terima kasih atas kerja sama yang baik selama penelitian, kepada Ibu Ema, Ibu Ika, Mbak Selin, Mas Wahyu, Mbak Ida, Widodo Setiyo Pranowo, Sefri, Febri, Ari, Fahrul, Zen, Nina, Kiki, Riri, Iful, Krisan, Elin, Ulina, Diah, Mbak Rita, Mbak Julin, Rafitah, Sitkun dan tanpa mengurangi rasa terima kasih ini, kepada temen-teman lain yang tidak bisa disebutkan namanya satu per satu.
Kritik dan saran yang membangun sangat penulis harapkan untuk kesempurnaan penelitian ini. Semoga penelitian bermanfaat.
Bogor, Februari 2010
RIWAYAT HIDUP
Penulis dilahirkan di Purwokerto pada tanggal 16 Juni 1975 dari Ayah M.Soetiro dan Ibu Emiliati. Penulis merupakan putri pertama dari tiga bersaudara. Tahun 2001 penulis menikah dengan Gunawan, ST, dan dikaruniai putra Rama Akbar Hanifan dan putri Diyah Ayu Vania.
Tahun 1993 penulis lulus dari SMA Negeri 2 Purwokerto dan pada tahun yang sama melanjutkan pendidikan di Program Diploma III Teknik Kimia Fakultas Teknik Universitas Diponegoro Semarang. Selanjutnya, pada tahun 1999 penulis melanjutkan pendidikan pada Program Studi Teknik Kimia, Fakultas Teknik Universitas Muhammadiyah Purwokerto.
iv
2.4 Peranan Kolagenase pada Perubahan Tekstur Daging ikan ... 9
2.5 Kolagen dan Kolagenase ... 10
2.6 Ekstraksi dan Pemurnian enzim ... 13
2.7 Elektroforesis ... 16
3 METODOLOGI ... 18
3.1 Waktu dan Tempat Penelitian ... 18
3.2 Bahan dan Alat ... 18
3.3 Metode Penelitian ... 19
3.3.1Pembuatan Kolagen dari Kulit Ikan Bandeng (Modifi- kasi Lestari 2005) ... 21
3.3.2 Preparasi Organ Dalam Ikan Bandeng (Kim et al. (2002) . 21
3.3.3 Ekstraksi Kolagenase Organ Dalam Ikan Bandeng (Kim et al. 2002) ... 22
3.3.4 Pengendapan dan Dialisis ... 22
3.3.5 Pemurnian dengan Kolom Kromatografi ... 23
3.3.6 Karakterisasi Kolagenase Organ Dalam Ikan Bandeng ... 24
3.3.7 Analisis ... 24
4 HASIL DAN PEMBAHASAN ... 28
4.1 Preparasi Organ Dalam Ikan Bandeng ... 28
4.2 Ekstraksi Kolagenase ... 29
4.3 Pengendapan ... 31
4.4 Dialisis ... 33
4.5 Kromatografi Penukar ion ... 35
4.6 Kromatografi Gel Filtrasi ... 35
4.4 Karakterisasi ... 37
4.4.1 Suhu Optimum ... 37
v
4.4.3 Pengaruh Ion Logam ... 41
4.4.4 Pengaruh Inhibitor ... 41
4.4.5 Kestabilan Terhadap Suhu ... 43
4.4.6 Kestabilan Terhadap pH ... 44
4.4.7 Penentuan Berat Molekul ... 45
5 SIMPULAN DAN SARAN ... 47
5.1 Simpulan ... 47
5.2 Saran ... 47
vi
DAFTAR GAMBAR
Halaman 1. Diagram kerangka pemikiran penelitian purifikasi dan
karakterisasi kolagenase dari organ dalam ikan bandeng
(Chanos chanos,Forskal) ... 3
2. Ikan bandeng (Chanos chanos, Forskal) ... 4
3. Anatomi ikan secara umum ... 6
4. Penampang serat daging ikan ... 10
5. Penampang jaringan penghubung pada serat daging ikan ... 10
6. Reaksi hidrolisis protein oleh enzim ... 12
7. Mekanisme kromatografi penukar ion ... 15
8. Mekanisme kromatografi gel filtrasi ... 15
9. Reaksi pembentukan gel poliakrilamide ... 16
10. Diagram alir penelitian ... 20
11. Aktivitas kolagenase pada berbagai organ dalam bandeng fase post rigor ... 29
12. Penampang dinding usus ... 30
13. Konsentrasi protein pada hasil pengendapan menggunakan ammonium sulfat 30-80 % ... 32
14. Aktivitas kolagenase hasil pemisahan dengan pengendapan menggunakan NH4(SO4)2 ... 33
15. Aktivitas kolagenase pada jenis ukuran kantong dan waktu dialisis ... 34
16. Hasil kromatografi penukar ion ... 35
17. Hasil kromatografi gel filtrasi ... 36
18. Aktivitas kolagenase dari ekstrak kasar dan hasil pengendapan pada berbagai suhu ... 39
19. Aktivitas kolagenase dari ekstrak kasar dan hasil pengendapan pada berbagai pH ... 40
20. Pengaruh ion logam terhadap ekstrak kasar dan hasil pengendapan ... 41
21. Pengaruh inhibitor spesifik terhadap ekstrak kasar dan hasil pengendapan ... 42
22. Kestabilan kolagenase terhadap suhu ... 43
23. Kestabilan kolagenase terhadap pH ... 44
vii
DAFTAR TABEL
Halaman
1. Komposisi gizi bandeng (dalam 85 g) ... 5
2. Tipe matriks kolom jenis dextran dan kisaran fraksinansinya .. 16
3. Proses kemunduran mutu ikan dan perubahan sensori yang tampak ... 21
4. Pembuatan larutan standar BSA ... 26
5. Komposisi gel penahan dan pemisah ... 27
6. Prosentase organ dalam beberapa spesies ikan dan bandeng ... 28
7. Sumber kolagenase dan metoda pemurniannya ... 31
8. Hasil pemurnian kolagenase ... 36
viii
DAFTAR LAMPIRAN
Halaman
1. Roadmap penelitian... 54
2. Tabel konversi dari g (gravity) ke rpm (revolutions per minute) ... 55
3. Ammonium sulfate precipitation table ... 56
4. Gambar organ dalam bandeng ... 57
1.
PENDAHULUAN
1.1 Latar Belakang
Ikan bandeng (Chanos chanos, Forskal) merupakan spesies penting dalam perikanan budidaya di Indonesia. Ikan bandeng menjadi salah satu produk yang mendominasi produksi perikanan budidaya, yaitu sebesar 269.530 ton dari total produksi perikanan budidaya, yaitu sebesar 2.625.800 ton (Ditjen Perikanan Budidaya 2007). Kandungan gizi ikan bandeng dalam 85 g yaitu protein 17 g, lemak 5,7 g dan karbohidrat 0,0 g (USDA SR-21 2009).
Kandungan gizi ikan bandeng menjadi tidak bernilai tinggi apabila tidak ditangani dengan baik setelah penangkapan atau pemanenan. Hal ini disebabkan ikan bandeng sebagai bahan pangan ikani sangat rentan terhadap kerusakan (highly perishabe food). Kerusakan ini dapat terjadi secara fisik, biokimiawi maupun mikrobiologi. Kerusakan daging ikan yang terjadi pada fase rigor mortis hingga fase post rigor, ditandai dengan melemasnya daging ikan (softening). Pelemasan ini bukan disebabkan oleh terpecahnya protein aktomiosin yang telah terbentuk tetapi karena kerusakan jaringan daging ikan. Kerusakan ini disebabkan oleh aktivitas enzim-enzim proteolisis yang memecah protein menjadi molekul yang lebih sederhana (autolisis) (Clucas dan Ward 1996).
Enzim-enzim proteolisis mampu menghidrolisis protein pada daging ikan. Enzim-enzim tersebut antara lain kolagenase, katepsin dan kalpain. Aktivitas kolagenase menyebabkan terpisahnya jaringan ikat daging ikan (gaping) (Hultman 2003). Enzim kolagenase memisahkan serat-serat daging ikan, yang terdapat jaringan kolagen pada serat ikan yang dihubungkan oleh myocotoma. Akibatnya tekstur ikan menjadi lembek dan protein daging ikan terpecah menjadi peptida-peptida sederhana. Peptida ini merupakan substrat bagi bakteri, sehingga setelah autolisis, peranan mikroorganisme penyebab kebusukan menjadi dominan. Hultman dan Rustrad (2004) menyatakan bahwa enzim endogeneus kolagenase mempengaruhi perubahan tekstur daging ikan (fillet) Atlantic salmon (Salmo salar) pada fase post mortem.
diketahui. Hal ini diperlukan untuk mempelajari kemunduran mutu ikan bandeng. Selain itu, sebagai produk bioteknologi, kolagenase ini dapat digunakan sebagai alternatif sumber enzim baru, sebab sumber-sumber enzim baru masih diperlukan (BPPT 2003). Oleh karena itu dilakukan purifikasi dan karakterisasi kolagenase dari organ dalam ikan bandeng.
1.2 Perumusan Masalah
Letak kolagenase pada organ dalam ikan bandeng beserta sifat-sifat katalitiknya belum diketahui. Dengan mengetahui hal-hal tersebut, maka diharapkan peristiwa yang menurunkan kesegaran mutu ikan misalnya gaping, dapat dihindari. Sifat-sifat tersebut antara lain konsentrasi enzim, substrat, produk, senyawa inhibitor dan aktivator, pH dan jenis pelarut yang terdapat pada lingkungan, kekuatan ion dan suhu Untuk mengetahui sifat-sifat tersebut, maka perlu dilakukan penelitian mengenai purifikasi dan karakterisasi kolagenase dari organ dalam ikan bandeng.
1.3 Tujuan Penelitian
Tujuan dari penelitian purifikasi dan karakterisasi kolagenase dari organ dalam ikan bandeng adalah sebagai berikut:
a. menentukan letak sumber kolagenase dari organ dalam ikan bandeng yang mempunyai aktivitas kolagenase tertinggi;
b. mendapatkan kolagenase yang murni;
c. mendapatkan sifat-sifat katalitik kolagenase yang diperoleh.
1.4 Manfaat Penelitian
1.5 Hipotesis
Hipotesis pada penelitian ini adalah:
a. terdapat kolagenase pada salah satu organ dalam ikan bandeng; b. kolagenase yang diperoleh dapat dimurnikan;
c. dapat dilakukan karakterisasi terhadap kolagenase yang diperoleh.
1.6 Kerangka Pemikiran
Ikan akan mengalami perubahan-perubahan biokimia setelah mati. Kolagenase merupakan salah satu penyebab kerusakan tekstur pada daging ikan. Karakteristik kolagenase dari organ dalam ikan bandeng hingga saat ini belum diketahui. Pada penelitian ini dilakukan purifikasi dan karakterisasi kolagenase. Roadmap penelitian disajikan pada Lampiran 1. Diagram kerangka pemikiran penelitian ini disajikan pada Gambar 1.
Gambar 1 Diagram kerangka pemikiran penelitian purifikasi dan karakterisasi kolagenase dari organ dalam ikan bandeng (Chanos chanos, Forskal).
Kerusakan tekstur daging ikan fase post rigor
Penyebab: kolagenase, kalpain, katepsin
Organ dalam mengandung kolagenase Ikan bandeng
Purifikasi
Kolagenase
•Diketahui letak sumber kolagenase
•Diketahui sifat-sifat katalitik kolagenase
Karakterisasi
• Mempelajari kemunduran mutu ikan bandeng
2.
TINJAUAN PUSTAKA
2.1 Klasifikasi Ikan Bandeng (Chanos chanos, Forskal)
Ikan bandeng (Chanos chanos, Forskal) merupakan hasil utama budidaya tambak. Badannya langsing berbentuk torpedo dengan sirip ekor yang bercabang (suatu tanda bahwa ia ikan perenang cepat), berwarna putih keperak-perakkan. Sepintas lalu ia mirip dengan ikan salem. Namun dagingnya tidak berwarna merah, melainkan putih susu, sampai di berbagai negara yang berbahasa Inggris, ia dikenal sebagai milkfish. Di laut panjang badannya bisa mencapai 1 meter, tetapi di tambak ukuran badannya tidak dapat melebihi 50 cm karena pengaruh faktor ruang dan sengaja diambil sebelum menjadi dewasa benar (Soeseno 1988).
Secara taksonomi, ikan bandeng termasuk dalam kelas Pices (bangsa ikan), subkelas Teleostei (ikan bertulang sejati), ordo Malacopterygii (ikan berjari-jari sirip lemah), keluarga Chanidae (bandeng-bandengan), genus Chanos, spesies Chanos chanos (Forskal). Dalam bahasa daerah, mereka kita kenal juga dengan nama-nama ikan bandeng, bolu, muloh dan ikan agam (Mudjiman 1991). Morfologi ikan bandeng disajikan pada Gambar 2.
Pengembangan budidaya ikan bandeng di masyarakat tidak banyak menemui kesulitan karena ikan ini memiliki keunggulan komparatif dibandingkan dengan ikan lainnya, yaitu: 1) cara pembudidayaannya relatif mudah, 2) bersifat euryhaline, toleran terhadap perubahan salinitas antara 0-158 ppt (Ismail et al. 1994), 3) bersifat herbivorous dan tanggap terhadap pakan buatan, 4) formulasi pakan buatan untuk ikan bandeng relatif mudah, 5) tidak bersifat kanibal dan mampu hidup dalam kondisi berjejal, 6) dapat dibudidayakan secara polikultur dengan spesies lainnya seperti baronang, 7) meskipun dagingnya bertulang, tetapi rasanya lezat dan di beberapa daerah memiliki tingkat preferensi konsumsi yang tinggi, dan 8) dapat digunakan sebagai umpan bagi industri penangkapan tuna (Rachmansyah et al. 1997).
Ikan bandeng sebagai bahan pangan mempunyai komposisi gizi yang diperlukan untuk pertumbuhan. Zat untuk pertumbuhan tersebut, yaitu protein, pada ikan bandeng jumlahnya tinggi. Ikan bandeng juga mengandung komponen gizi berupa mikro nutrien seperti mineral dan vitamin. Beberapa mineral tersebut antara lain, magnesium, kalsium, kalium, fosfor dan zat besi. Vitamin, baik yang larut pada lemak seperti vitamin A dan yang larut dalam air seperti vitamin B kompleks terdapat pada ikan bandeng. Komposisi gizi ikan bandeng dapat dilihat pada Tabel 1.
Tabel 1 Komposisi gizi ikan bandeng (dalam 85 g).
Zat gizi Jumlah Satuan
Kalsium 43,4 miligram
Kalium 248 miligram
Magnesium 25,5 miligram
Fosfor 138 miligram
Besi 0,3 miligram
Vitamin A 85,0 miligram
Vitamin B6 0,4 miligram
Vitamin B12 2,9 miligram
2.2 Organ Dalam sebagai Sumber Enzim Protease
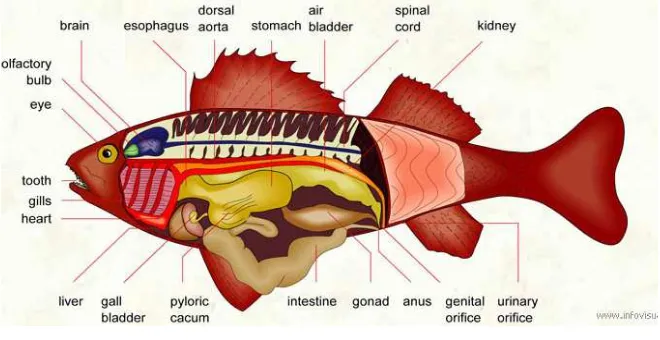
Berbagai jenis enzim protease dari ikan ditemukan pada organ dalam, terutama organ pencernaan. Organ dalam merupakan organ-organ yang berada di dalam rongga dada dan perut ikan. Organ tersebut misalnya lambung, usus halus, pilorik kaeka dan kelenjar pankreas. Sebagian organ dalam ikan mengandung enzim proteolitik. Berat organ organ ikan berbeda-beda, tergantung pada jenis makanan dan cara makan dari setiap jenis ikan. Anatomi organ dalam ikan secara umum disajikan pada Gambar 3.
Gambar 3 Anatomi ikan secara umum.
Sumber: http://www.infovisual.info/02/ 033 _en. html. [5 Januari 2010].
Pilorus atau pilorik merupakan segmen yang terletak antara lambung dan usus depan. Segmen ini sangat mencolok karena ukurannya yang mengecil atau menyempit. Pada beberapa ikan terdapat usus-usus kecil dan pendek yang disebut pyloric caeca (pilorik kaeka). Dengan menyempitnya saluran pencernaan pada segmen ini berarti bahwa segmen pilorus berfungsi sebagai pengatur pengeluaran makanan (chyme) dari lambung ke segmen usus (Fujaya 2004).
Enzim-enzim proteolisis ditemukan pada keseluruhan jaringan makhluk hidup. Distribusi dan aktivitasnya berbeda-beda. Aktivitas protease tertinggi ditemukan pada bagian organ dalam dan hati, tetapi aktivitasnya pada jaringan sangat signifikan, dimana enzim berperan dalam protein turnover. Enzim protease endogeneus dari ikan terletak pada cairan intraseluler dan sarkoplasma, atau berasosiasi dengan organel sel. Pada ikan hidup, protease berfungsi dalam protein turnover. Setelah mati, regulasi biologis terhenti, dan enzim menghidrolisis protein daging dan terlibat dalam kontraksi rigor mortis (Foegeding et al. 1996).
Aktivitas protease ditemukan pada beberapa organ dalam ikan bandeng. Tiro dan Benitez (1985) meneliti aktivitas protease dari berbagai organ dalam ikan bandeng. Terdapat aktivitas protease pada ekstrak kasar organ pencernaan, seperti esofagus, pilorik kaeka, anterior usus, posterior usus, hati dan pankreas. Aktivitas protease berbeda pada setiap organ dalam, tergantung pada jenis makanan ikan bandeng. Aktivitas protease pada lambung sangat kecil, bahkan hampir tidak terdeteksi. Hal tersebut disebabkan suasana pH yang asam yaitu pH 2,0 sehingga hanya jenis protease tertentu yang aktif pada kondisi tersebut, seperti pepsin. Beberapa enzim protease yang telah diisolasi dari organ dalam ikan antara lain, pepsin, kimosin, tripsin, kimotripsin, elastase, katepsin B, mettaloproteinase dan kolagenase (Simpson 2000; An & Vessesanguan 2000).
Protease secara umum, berdasarkan sisi aktifnya, digolongkan menjadi empat kelas. Kelas-kelas tersebut adalah serin, sistein, metallo dan aspartik protease. Protease juga digolongkan menjadi dua kelas, berdasarkan cara kerjanya. Kelas yang pertama, yaitu endopeptidase, adalah protease yang menghidrolisis ikatan peptida pada bagian tengah rantai. Kedua, yaitu eksopeptidase, yaitu protease yang terlibat dalam hidrolisis rantai peptida pada bagian terminal residu asam amino dari rantai polipeptida (Beynon & Bond 2001).
2.3 Proses Kemunduran Mutu Ikan
yang tidak baik, cara penanganan yang kurang tepat, sanitasi dan higiene yang tidak memadai, terbatasnya sarana distribusi dan sarana pemasaran dan sebagainya.
Wang et al. (1998) melaporkan bahwa setelah ikan mati, perubahan-perubahan biokimiawi berlangsung diikuti dengan perubahan-perubahan secara fisik pada dagingnya. Pada keadaan relaksasi, fosfat berenergi tinggi (ATP) diperoleh dari penguraian keratin fosfat. Adenosin trifosfat (ATP) mulai mengalami penguraian ketika konsentrasi keratin fosfat sama dengan ATP. Penurunan ATP disebut sebagai fase rigor mortis, dan fase rigor mortis secara penuh tercapai ketika ATP berkurang hingga 1 μmol/g. Pada fase ini daging ikan mengkerut dan menjadi kaku karena terbentuknya ikatan secara permanen antar protein aktin dan myosin menjadi protein kompleks aktomyosin. Pada fillet daging ikan Atlantic salmon (Salmo salar) yang diambil post mortem, fase ini dapat diperlambat dengan penyimpanan pada suhu 0 oC sehingga fase rigor mortis secara penuh dapat dicapai pada jam ke- 60 sampai dengan jam ke-70.
Daging ikan menjadi lunak pada fase rigor mortis hingga fase post rigor. Pelunakan ini bukan disebabkan oleh terpecahnya protein aktomyosin yang telah terbentuk tetapi karena kerusakan jaringan daging ikan. Kerusakan ini disebabkan oleh aktivitas enzim-enzim proteolisis yang memecah protein menjadi molekul yang lebih sederhana (autolisis). Biasanya proses autolisis diikuti dengan meningkatnya jumlah bakteri, sebab semua hasil penguraian enzim selama proses autolisis merupakan media yang sangat cocok untuk pertumbuhan bakteri dan mikroorganisme lain. Pelunakan tekstur daging ikan akibat autolisis, terjadi sebelum flavor off dan odor off akibat aktivitas bakteri (Clucas & Ward 1996).
Enzim-enzim yang terlibat dalam peristiwa autolisis antara lain: katepsin (dalam daging), tripsin, kemotripsin dan pepsin (dalam organ pencernaan), serta enzim dari mikroorganisme yang terdapat dalam tubuh ikan. Enzim-enzim yang dapat menguraikan protein berperan penting dalam proses penurunan mutu ikan. Selain itu kalpain, katepsin dan kolagenase diketahui berperan dalam perubahan sifat tekstur daging ikan pada post mortem (Hultman 2003).
ditemuakan pada daging ikan). Enzim protease ini terlibat dalam katabolisme proteiin daging, pematangan gonad selama proses sexual maturation, dan migrasi spawning (ikan tidak makan, tetapi menggunakan protein untuk mematangkan gonad). Ikan dari budidaya, perlakuan terhadap kultur dapat mempengaruhi kandungan enzim dan aktivitas enzim dalam daging ikan (Tiro & Benitez 1985; Haard 1992).
2.4 Peranan Kolagenase pada Perubahan Tekstur Daging Ikan
Tekstur daging ikan adalah indikator tingkat kesegaran mutu ikan. Kerusakan tekstur daging ikan berakibat fatal pada industri pengolahan ikan. Salah satu penyebab kerusakan tekstur daging ikan adalah enzim endogeneus kolagenase.
Endogeneus kolagenase mengakibatkan kerusakan protein fibril kolagen. Pelunakan dan pemecahan fibril kolagen ikan pelagis lebih cepat ketika ikan disimpan tanpa dibersihkan darahnya. Hal tersebut tidak terjadi pada ikan demersal. Sehingga dapat disimpulkan bahwa pelunakan daging ikan tergantung pada jenis spesies ikan (Hultman 2003). Penelitian yang dilakukan oleh Hultman dan Rustrad (2004) melaporkan tidak terjadi penghambatan yang berarti terhadap aktivitas kolagenase pada ikan salmon atlantik (Salmo salar) yang diiradiasi menggunakan sinar γ selama 3,5 jam pada suhu 20-22 oC, sedangkan enzim lain, yaitu katepsin B dapat dihambat secara signifikan, yaitu75-90%.
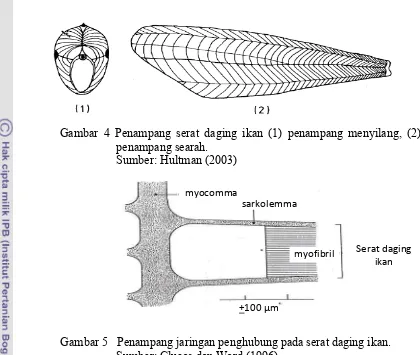
Gambar 4 Penampang serat daging ikan (1) penampang menyilang, (2) penampang searah.
Sumber: Hultman (2003)
Gambar 5 Penampang jaringan penghubung pada serat daging ikan. Sumber: Clucas dan Ward (1996)
2.5 Kolagen dan Kolagenase
Kolagen adalah protein yang berbentuk serabut, terdapat hanya pada hewan, misalnya otot achilles dan pada kulit. Kolagen merupakan jenis protein yang berupa agregat supramolekul serat. Kolagen terdiri dari tiga rantai polipeptida yang besar dan berulang dan terdiri dari lebih dari 1000 residu asam amino. Polipeptida tersebut adalah glisin-prolin dan hidroksiprolin atau Gly-X-Y, dimana residu glisin tersenbunyi pada bagian dalam rantai, dan asam amino X-Y berada di bagian permukaan rantai tripel polipeptida (Hulmes 2008). Masing-masing rantai polipeptida berisi sekitar 100 residu asam amino dengan jarak molekul rantai 3000 Å (Branden & Tooze 1998).
Kolagen mengandung kira-kira 35% glisin dan kira-kira 11% alanin; persentase asam amino ini luar biasa tinggi. Demikian pula kandungan prolin dan 4-hidroksiprolin kadarnya tinggi. Asam amino tersebut jarang terdapat pada protein selain kolagen dan elastin. Jumlah hidrosksi prolin dan prolin mencapai
myocomma
sarkolemma
Serat daging ikan myofibril
21% dari residu asam amino pada kolagen (Lehninger 1993). Kolagen pada daging dan kulit ikan mengandung lebih sedikit hidroksiplrolin, tetapi mengandung lebih banyak asam amino esensialnya dibandingkan kolagen dari daging sapi (Hargin 2001).
Kolagen dapat digolongkan menjadi dua, yaitu fibril dan non fibril. Kolagen tipe I, II, III, V, XI merupakan jenis kolagen fibril. Kolagen jenis I, II dan III menyusun sebagian besar dari kulit, tendon, tulang, dan tulang rawan (cartilage). Kolagen jenis II dan XI merupakan kolagen spesifik tulang rawan. Kolagen jenis V tersebar pada jaringan penghubung, dan kolagen jenis IV adalah penyusun membran sel. Kolagen yang lain terdapat pada permukaan kolagen fibril dan antara kolagen fibril dan membran (Sato et al. 2008). Kolagen non fibril yaitu tipe IV, VI, VII, VIII, XV terdapat bagian dalam membran sel, sel jaringan, sel epitelium, sel endotelium, otot dan sel urat syaraf (Hulmes 2008).
Kolagen dari berbagai jenis ikan telah diekstraksi. Nagai et al. (2004) mengekstraksi kolagen dari beberapa jenis ikan menggunakan NaOH 0,1 N selama 3 hari pada suhu 4 oC, kemudian dicuci, dikeringkan, disimpan pada suhu -85 oC, selanjutnya direndam dalam asam asetat 0,5 M selama 3 hari, dan disentrifuse 50.000 g selama 1 jam. Supernatan diendapkan dengan NaCl. Yield kolagen yang dihasilkan sangat tinggi, yaitu kolagen dari ikan sardin (Sardinops melanosticus) 50,9%, ikan red sea bream (Pagrus major) 37,5%, dan ikan Japanese sea bass (Lateobrax japonicus) 41,0%. Sedangkan pada penelitian yang dilakukan oleh Nomura et al. (1996), kolagen hasil ektraksi dengan asam sulfat dari ikan sardin menghasilkan yield 5%.
Yunoki et al. (2003) melaporkan bahwa kolagen dari kulit ikan relatif lebih mudah diekstrak dan menghasilkan yield yang lebih tinggi dari pada kolagen dari kulit hewan mamalia, seperti sapi. Pemanfaatan kolagen dari kulit ikan mempunyai resiko yang lebih rendah terkontaminasi patogen seperti bovine spongiform enchepalopathy (BSE) daripada kolagen dari kulit sapi. Matriks kolagen dari kulit ikan chum salmon (Oncorhynchus keta) mempunyai kelebihan yaitu lebih tahan terhadap kolagenase, daripada kolagen dari kulit sapi.
kolagenase dapat memecah tripolipeptida ini walaupun pada suhu tubuh 37 oC bahkan 4 oC dan 10 oC walaupun lebih sedikit kolagen yang terpecah.
Kolagenase adalah enzim endopeptidase yang dapat menghidrolisis kolagen. Kolagenase disintesa oleh pre-proenzim dan disekresikan sebagai proenzim yang inaktif (zimogen) berisi propeptida, domain katalitik, bagian yang kaya prolin dan domain C-terminal hemopexin (Hpx) (Visse & Nagase 2003). Reaksi hidrolisis protein oleh enzim pada umumnya ditunjukkan pada Gambar 6.
Gambar 6 Reaksi hidrolisis protein oleh enzim. Sumber: Hultman (2003).
Chung et al. (2004) menyatakan bahwa pemecahan struktur tiga rantai heliks polipeptida sebagai penyusun kolagen sangat penting pada saat perkembangan embrio, morfogenesis organ dan pembentukan serta perbaikan jaringan Kolagenolisis yang tidak normal menyebabkan tidak dapat dikendalikannya sistem regulasi sel, sehingga menyebabkan artristis, kanker, aterosklerosis, aneurisme dan fibrosis. Pada invertebrata, kolagenase termasuk dalam kelompok matriks metalloproteinase (MMP). Peranan kolagenase bukan hanya sekedar memecah kolagen, tetapi juga mengontrol fungsi seluler selama perbaikanjaringan.
Metallokolagenase terdiri dari zink yang mengandung enzim yang membutuhkan kalsium untuk kestabilan. Selain itu, metallokolagenase termasuk dalam enzim ekstraseluler yang terlibat dalam pembentukan kembali matriks ekstraseluler. Jenis enzim ini telah banyak dipelajari dari berbagai jaringan mamalia, dari bakteri, dan bisa ular (Park et al. 2002).
Penggunaan kolagenase yang cukup penting dalam bidang biomedis adalah dalam perbaikan jaringan pada peradangan, transplantasi klinis, fungsi seluler dalam penggumpalan darah, fibrinolisis dan fertilisasi (Simpson 2000) dan mempercepat proses penyembuhan luka (Rilley & Herman 2005). Kolagenase sangat efektif untuk mengempukan daging, sehingga pengeraman tidak lama untuk memperoleh daging dengan tekstur yang lunak. Penggunaan kolagenase berkembang untuk mencegah penuaan kulit pada manusia. Kolagenase dari hepatopankreas kepiting telah digunakan untuk deskinning pada cumi-cumi (Lopez & Carreno 2000).
2.6 Ekstraksi dan Pemurnian Enzim
Ekstraksi adalah proses pemisahan suatu zat berdasarkan perbedaan kelarutannya terhadap dua cairan tidak saling larut yang berbeda, biasanya air dan yang lainnya pelarut organik. Metode ekstraksi enzim pada perinsipnya mempertimbangkan beberapa hal, diantaranya adalah: sumber enzim, jenis, sifat serta bentuk ekstrak atau preparat yang diinginkan. Enzim-enzim hewan pada umumnya terletak pada organ-organ khusus seperti organ pencernaan dan jaringan. Ekstraksi enzim dari organ tersebut dilakukan dengan cara memisahkan enzim kasar dari lemak kemudian dihancurkan dengan pengontrolan suhu sehingga tidak terjadi denaturasi protein enzim (Suhartono 1989).
Apabila diinginkan produk enzim yang lebih murni, sebelum pengeringan, dilakukan penggumpalan enzim terlebih dahulu. Tahap ini disebut presipitasi. Tahap ini dapat dilakukan dengan dua jenis metode kimiawi, yaitu penambahan pelarut organik dan garam. Penambahan pelarut organik dapat menurunkan konstanta dielektrik dan menyebabkan medium kurang cocok untuk permukaan enzim yang polar. Ion garam seperti ion dari garam ammonium sulfat, yaitu ion NH4+ dan SO42- yang ditambahkan mempengaruhi kelarutan protein. Pada
konsentrasi rendah, ion-ion garam tersebut akan melingkungi molekul protein dan mencegah bersatunya molekul-molekul ini, sehingga protein melarut. Peristiwa ini disebut salting in. Pada konsentrasi tinggi, terjadi peningkatan muatan listrik disekitar protein, yang akan menarik mantel air dari koloid protein. Interaksi hidrofobik diantara sesama molekul protein pada suasana ionik yang tinggi akan menurunkan kelarutan protein. Peristiwa ini disebut salting out (Suhartono 1989).
Proses pemurnian enzim dapat dilakukan menggunakan metode kromatografi dan elektroforesis. Kromatografi didefinisikan sebagai sistem pengaliran suatu fluida melalui kolom yang mengandung matriks bahan pengisi dan substanta yang ingin dipisahkan menjadi beberapa komponen dengan adanya perbedaan daya ikat terhadap bahan pengisi. Harris dan Angel (1989) membagi metode kromatografi menjadi empat kelompok, yaitu:
a. kromatografi adsorbsi yang bekerja berdasarkan perbedaan polaritas komponen sampel;
b. kromatografi penukar ion untuk melakukan pemisahan berdasarkan perbedaan jenis muatan adsorben dan komponen sampel;
c. kromatografi filtrasi gel yang memisahkan molekul berdasarkan ukurannya; d. kromatografi afinitas yang memisahkan komponen sampel berdasarkan
interaksi biokimia antara sampel dengan ligan yang terlibat pada matriks adsorban.
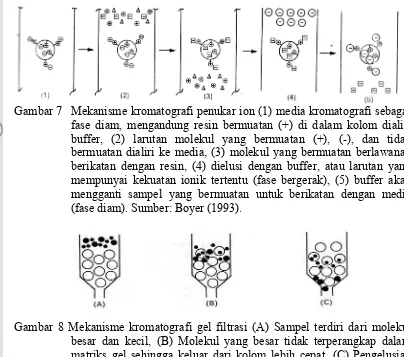
Gambar 7 Mekanisme kromatografi penukar ion (1) media kromatografi sebagai fase diam, mengandung resin bermuatan (+) di dalam kolom dialiri buffer, (2) larutan molekul yang bermuatan (+), (-), dan tidak bermuatan dialiri ke media, (3) molekul yang bermuatan berlawanan berikatan dengan resin, (4) dielusi dengan buffer, atau larutan yang mempunyai kekuatan ionik tertentu (fase bergerak), (5) buffer akan mengganti sampel yang bermuatan untuk berikatan dengan media (fase diam). Sumber: Boyer (1993).
Gambar 8 Mekanisme kromatografi gel filtrasi (A) Sampel terdiri dari molekul besar dan kecil, (B) Molekul yang besar tidak terperangkap dalam matriks gel sehingga keluar dari kolom lebih cepat, (C) Pengelusian molekul-molekul sampel. Sumber: Boyer (1993).
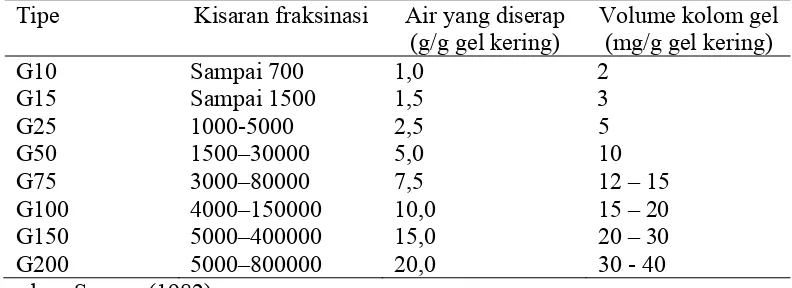
Media yang digunakan dalam memisahkan molekul-molekul yang berbeda ukurannya pada kromatografi gel filtarasi adalah dekstran yang telah mengalami reaksi cross linkage dengan bantuan epikhlorhidrin. Hasilnya adalah dekstran yang tidak larut air, tetapi dapat menyerap air dalam molekulnya sendiri. Daya serap tergantung pada jumlah cross linkage atau ikatan silang yang terjadi. Makin banyak ikatan silang, maka daya serapnya kurang baik (Scopes 1982; Harris & Angal 1989).
Tabel 2 Tipe matriks kolom jenis dextran (Sephadex) dan kisaran fraksinasinya. Tipe Kisaran fraksinasi Air yang diserap
(g/g gel kering)
Protein dapat dipisahkan satu dari yang lain oleh elektroforesis berdasarkan tanda dan jumlah muatan listrik pada gugus R dan gugus terminal amino dan terminal karboksil yang bermuatan. Seperti peptida sederhana, rantai polipeptida protein, mempunyai titik isoelektrik yang khas, yang akan mencerminkan jumlah relatif gugus R asam dan basa. Pada setiap pH tertentu, suatu campuran protein akan mengandung beberapa gugus yang bermuatan total negatif, beberapa yang bermuatan total positif dan beberapa yang tidak bermuatan. Jika campuran ini ditempatkan dalam medan listrik, maka protein yang bermuatan positif akan bergerak menuju elektroda yang bermuatan negatif, serta protein yang bermuatan total negatif akan bergerak menuju elektroda positif., serta protein yang tidak bermuatan akan tinggal diam. Molekul protein dengan densitas muatan yang relatif lebih tinggi akan bergerak menuju elektroda secara lebih cepat dibandingkan dengan protein dengan densitas muatan yang lebih rendah (Lehninger 1993).
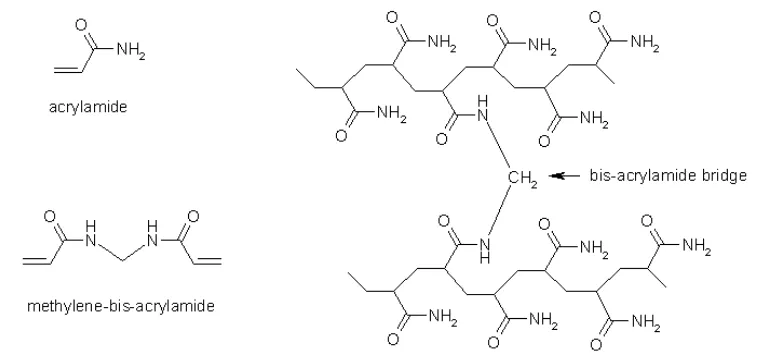
dengan ikatan silang hidrokarbon yang panjang kelompok methylen (Heidcamp 1995). Gambar 9 menunjukkan reaksi pembentukan gel poliakrilamide.
Gambar 9 Reaksi pembentukan gel poliakrilamide. Sumber: Heidcamp (1995)
3.
METODOLOGI
3.1Waktu dan Tempat Penelitian
Penelitian ini dilaksanakan pada bulan Desember 2008 sampai dengan bulan November 2009. Ikan bandeng diperoleh dari tambak di desa Dadap, Tangerang. Tempat penelitian utama dilaksanakan di Laboratorium Mikrobiologi dan Biokimia Hasil Perairan, Departemen Teknologi Hasil Perairan; Laboratorium Penyakit Hewan, Fakultas Kedokteran Hewan; dan Laboratorium Bioteknologi, Pusat Penelitian Sumberdaya Hayati dan Bioteknologi, Lembaga Penelitian dan Pemberdayaan Masyarakat, IPB.
3.2 Bahan dan Alat
Bahan utama yang digunakan pada penelitian adalah organ dalam ikan bandeng pada fase post rigor yaitu pilorik kaeka, hati dan usus. Bahan kimia yang digunakan untuk ekstraksi adalah buffer tris HCl (Applicchem), Triton-X 100 (Merck), CaCl2 (Merck). Pengendapan menggunakan ammonium sulfat
(NH4(SO4)2) teknis. Dialisis menggunakan kantong dialisis 8 MWCO dan 12
MWCO (Sigma). Bahan kimia untuk kromatografi adalah matriks DEAE-Sephadex A-50 dan DEAE-Sephadex G-100 dari Sigma.
Uji aktivitas kolagenase menggunakan bahan-bahan kimia seperti asam trikloro asetat (Merck), L-leusin (Applichem), 1-propanol (Merck), buffer tris (Applichem). Analisa protein menggunakan pereaksi Bradford yang terbuat dari commasieve brilliant blue (CBB) G-250 (Merck), ethanol 95% (Merck), asam fosfat 85% (Merck). Logam-logam yang digunakan untuk karakterisasi yaitu NaCl (Merck), CaCl2 (Merck), BaCl2(Merck), MnCl2 (Merck), dan CoCl2
(Merck).
Peralatan yang digunakan antara lain spektrofotometer sinar tampak (Yamato), sentrifus dingin (Sorvall), pH meter (Orion), inkubator (Thermoline), shaker inlubator, mikropipet (Pipetman), timbangan analitik (Sartorius), oven (Memmert), homogenizer (Nissei AM-3), magnetic stirer hot plate (Thermoline), peralatan elektroforesis dan kolom kromatografi.
3.4Metode Penelitian
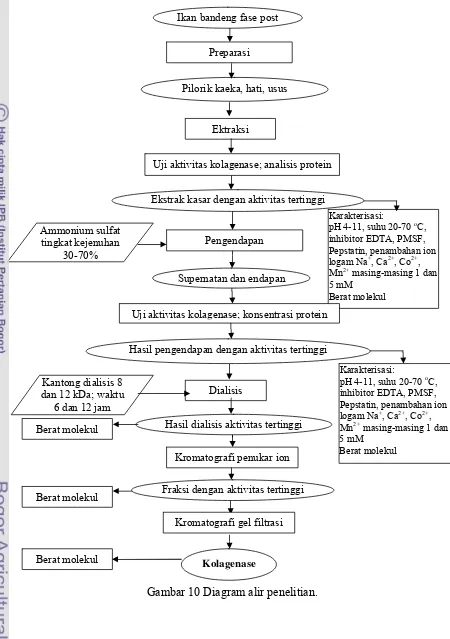
Gambar 10 Diagram alir penelitian. Pilorik kaeka, hati, usus
Ektraksi Ekstrak kasar dengan aktivitas tertinggi
Supernatan dan endapan Ikan bandeng fase post
Preparasi
Uji aktivitas kolagenase; analisis protein
Kantong dialisis 8 dan 12 kDa; waktu
6 dan 12 jam
Kromatografi penukar ion
Uji aktivitas kolagenase; konsentrasi protein
Hasil pengendapan dengan aktivitas tertinggi
3.4.1 Pembuatan Kolagen dari Kulit Ikan Bandeng (modifikasi Lestari 2005).
Tahap awal pembuatan kolagen, mula-mula kulit ikan bandeng dibersihkan dari sisa daging, lemak dan kotoran lainnya. Kulit kemudian dipotong-potong sekitar 3x3 cm untuk memudahkan perendaman dan ekstraksi sehingga larutan menjadi homogen. Setelah itu kulit direndam dalam asam asetat 1,5% selama 18 jam dengan perbandingan berat/volume (b/v) kulit: volume asam asetat adalah 1:2. Selanjutnya kulit dicuci dengan akuades hingga pH menjadi mendekati netral (sekitar 6,5). Kulit yang telah mengembang diekstrak menggunakan akuades, perbandingan b/v antara kulit:akuades sebesar 2:1. Ekstraksi dilakukan selama 3 jam pada suhu 40 oC. Hasil ekstraksi disaring dengan kertas saring menjadi larutan kolagen.
3.3.2 Preparasi Organ Dalam Ikan Bandeng (Kim et al. (2002)
Preparasi, yaitu mengumpulkan dan menyediakan sampel organ dalam ikan bandeng dari Tangerang. Ikan bandeng yang dipilih adalah ikan bandeng yang sudah berada pada fase post rigor. Organ dalam ikan bandeng dikumpulkan dan dipisahkan bagian pilorik kaeka, hati dan usus, kemudian dicuci dengan akuades dingin dan dikemas dalam kantung plastik. Jika tidak langsung diekstraksi, organ dalam yang sudah dibersihkan, segera disimpan pada suhu -20 oC sampai digunakan untuk penelitian. Pemilihan ikan bandeng fase post rigor berdasarkan pengamatan secara visual perubahan sensori ikan bandeng seperti yang disajikan pada Tabel 3.
Tabel 3 Proses kemunduran mutu ikan dan perubahan sensori yang tampak.
Indikator Pre rigor Rigor mortis Post rigor Busuk
Penampakan utuh Cerah dengan kilau metalik Tidak mengkilap warna pudar
Konsistensi Lembut dan
elastis
Keras dan elastis Tidak elastis Lembut dan
lembek Penampakan Agak
transparan
3.3.3 Ekstraksi Kolagenase Organ Dalam Ikan Bandeng (Kim et al. 2002)
Organ dalam segar yang telah dipreparasi dan dipisahkan antara pilorik kaeka, hepatopankreas dan usus, masing-masing ditambahkan buffer Tris-HCl (pH 8,0) yang terdiri dari 0,25 % Triton X-100 dan 10 mM CaCl2, perbandingan
berat: volume (b/v) organ dalam:larutan buffer sama dengan 1:5 dan dihomogenisasi dengan homogenizer.
Langkah selanjutnya homogenat disentrifugasi pada 7000xg (konversi g ke rpm terlampir pada Lampiran 2) selama 20 menit pada suhu dingin (4 oC). Endapan diekstraksi kembali dengan penambahan buffer yang sama sebanyak 3xvolume endapan. Supernatan dari hasil sentrifugasi terakhir diambil kemudian ditambah dengan 20 mM Tris-HCl (pH 8,0) yang terdiri dari 0,36 mM CaCl2 dan
dibiarkan selama 48 jam pada suhu rendah (+4 oC). Hasil ekstraksi dianalisis aktivitas kolagenasenya dan dipilih organ dalam yang mempunyai aktivitas tertinggi untuk dimurnikan lagi dengan pengendapan dan dialisis.
3.3.4 Pengendapan dan Dialisis
Ekstrak kolagenase kasar selanjutnya dimurnikan dengan penambahan ammonium sulfat dengan tingkat kejenuhan 30-80%, untuk menentukan konsentrasi garam optimal. Tabel penambahan ammonium sulfat sesuai persen kejenuhan dilampirkan pada Lampiran 3.
Pengendapan dilakukan dengan menambahkan garam ammonium sulfat padat ke dalam ekstrak kasar sedikit demi sedikit hingga dicapai konsentrasi ammonium sulfat yang diperlukan, yaitu 30%, 40%, 50%, 60%, 70% dan 80%. Selanjutnya larutan disentrifuse pada 12.000xg selama 30 menit. Endapan dan supernatan yang dihasilkan, diuji aktivitas kolagenasenya. Hasil pengendapan yang mempunyai aktivitas kolagenase tertinggi didialisis menggunakan kantong dialisis dengan ukuran molecular weight cut off (MWCO) yang sesuai.
Preparasi kantong dialisis dilakukan untuk menghilangkan sulfat yang mungkin terdapat pada kantong dialisis. Kantong dialisis dicuci menggunakan metoda Richmond et al. (1985), diacu dalam Bollag dan Edelstein (1991). Kantong dialisis direbus dalam larutan NaHCO3 2% yang mengandung EDTA 1
dengan akuades ini dilakukan dua kali. Selanjutnya kantung dialisis didinginkan dan kantung siap digunakan.
Pemilihan kantong dan waktu dialisis yang tepat dilakukan agar terjaga aktivitas kolagenase tetap tinggi. Ukuran kantong dialisis yang diujikan adalah 8.000 dan 12.000 MWCO. Waktu yang diujikan adalah 6 dan 12 jam. Buffer yang digunakan adalah buffer tris HCl 2 mM mengandung CaCl2 0,036 mM,
dengan volume 100 kali volume sampel (Scopes 1982).
3.3.5 Pemurnian dengan Kolom Kromatografi
Pemurnian enzim kolagenase dilakukan menggunakan kromatografi penukar ion dan gel filtrasi. Kromatografi penukar ion menggunakan kolom kromatografi berukuran 2,5x30 cm dengan media pendukung DEAE Sephadex A-50 yang diekuilibrasi menggunakan buffer 20 mM Tris-HCl dengan pH optimum. Matriks kolom dibuat dengan cara melarutkan 1,5 g dalam akuades bebas ion, selanjutnya perendaman dilakukan selama 12 jam. Matriks kemudian divakum selama 6 jam. Ukuran kolom adalah 1,5x40 cm. Pada awalnya, kolom dielusi menggunakan buffer tris HCl 20 mM pH 8,0 mengandung CaCl2 0,36 mM pada
yang terlarut dalam akuades bebas ion, kolom dielusi menggunakan NaCl bergradien dari 0,1-0,7 mM dalam buffer yang sama. Kecepatan rata-rata pemisahan adalah 0,5 ml/menit dan volume fraksi 5 ml. Sebanyak 62 fraksi yang dihasilkan kemudian diukur. Kolom dicuci dan dielusi menggunakan NaCl secara bertahap (0-0,7 M) pada buffer yang sama. Kecepatan aliran adalah 0,5 ml/menit, dan volume fraksi yang ditampung sebanyak 5 ml. Seluruh fraksi yang dihasilkan diuji aktivitas kolagenasenya dan konsentrasi proteinnya pada panjang gelombang 280 nm.
Kromatografi gel filtrasi menggunakan matriks Sephadex G-100. Matriks kolom dibuat dengan melarutkannya 2 g dalam akuades, kemudian direndam selama 12 jam. Matriks kemudian divakum selama 6 jam. Ukuran kolom adalah 1,5x40 cm. Kolom dielusi menggunakan buffer tris HCl 20 mM pH 8,0 mengandung CaCl2 0,36 mM. Kecepatan rata-rata pemisahan adalah 0,5 ml/menit
3.3.6 Karakterisasi Kolagenase Organ Dalam Ikan Bandeng
Karakterisasi bertujuan untuk mengetahui kondisi optimum aktivitas kolagenase sehingga penggunaannya dapat disesuaikan dengan karakter tersebut. Selain itu juga untuk mengetahui dan mengontrol kemurnian pada setiap tahap dalam proses pemurnian. Karakterisasi kolagenase meliputi penentuan suhu optimum, pH optimum, pengaruh ion logam serta pengaruh inhibitor terhadap aktivitas enzim kolagenase yang dihasilkan dari setiap tahap pemurnian. Adapun kisaran pH yang akan diujikan, yaitu 6,0-10,0; suhu 30-80 oC; pengaruh ion logam (NaCl, CaCl2 BaCl2, MnCl2 dan CoCl2) masing masing dengan konsentrasi
1 dan 2 mM; dan inhibitor EDTA, PMSF, dan pepstatin.
3.3.7 Analisis
Analisis yang dilakukan dalam penelitian ini terdiri atas uji aktivitas kolagenase, analisis kadar protein dan penentuan berat molekul.
(1) Uji aktivitas kolagenase (Moore dan Stein (1954) diacu dalam Kim et al. (2002)) yang dimodifikasi.
Aktivitas kolagenase dianalisis menggunakan metoda spektrofotometri. Sebanyak 0,1 ml larutan kolagenase ditambah dengan 5 ml larutan kolagen dan 1 ml 0,05 mM tris-HCl pada pH 8,0 yang mengandung 5 mM CaCl2. Reaksi ini
dilakukan pada suhu 37 oC selama 1 jam. Reaksi dihentikan dengan penambahan 0,2 ml 0,5% TCA. Setelah 10 menit pada suhu ruang, larutan disentrifus pada 1.800 rpm selama 20 menit. Supernatan, sebanyak 1 ml dicampur dengan 1,0 ml larutan ninhidrin, diinkubasi pada suhu 100 oC selama 20 menit, kemudian didinginkan pada suhu ruang.
Asp – Abl 1
UA = x P x Ast – Abl T
Dimana: \
A = Jumlah enzim yang menyebabkan perubahan 1 μmol substrat per menit pada suhu 37oC, pH 8,0
Asp = Absorbansi sampel
Ast = Absorbansi standar Abl = Absorbansi blanko
P = faktor pengenceran T = waktu inkubasi
(2) Analisis kadar protein (Bradford 1967)
Konsentrasi protein ditentukan menggunakan metode Bradford. Persiapan pereaksi Bradford dilakukan dengan cara melarutkan 5 mg coomassie brilliant blue jenis G-250 dalam 2,5 ml etanol 95%, lalu ditambahkan dengan 5 ml asam fosfat 85% (w/v). Jika telah larut dengan sempurna, maka ditambahkan akuades hingga 250 ml dan disaring dengan kertas saring Whatman#1 dan diencerkan 5 kali sesaat sebelum digunakan.
Konsentrasi protein ditentukan dengan cara, sebanyak 0,1 ml sampel (larutan enzim) dimasukkan ke dalam tabung reaksi. Kemudian ditambahkan sebanyak 5 ml pereaksi Bradford, diinkubasi selama lima menit dan diukur absorbannya dengan spektrofotometer pada panjang gelombang 595 nm.
Tahap terakhir membuat kurva standar dengan absorbansi sebagai ordinat (sumbu Y) dan konsentrasi protein sebagai absis (sumbu X). Berdasarkan kurva tersebut dapat ditentukan konsentrasi protein dalam sampel. Hubungan antara konsentrasi larutan standar dan serapannya (absorbansi) dinyatakan sebagai persamaan regresi linear: Y=a+bx, dimana y=serapan (absorbansi); x=konsentrasi standar (mg/ml); a=interscept dan b=slope. Komposisi volume larutan pada pembuatan larutan standar dengan konsentrasi 0,01-0,3 mg/ml dari larutan stok BSA konsentrasi 2 mg/ml disajikan pada Tabel 4.
Tabel 4 Pembuatan larutan standar BSA.
Konsentrasi BSA (mg/ml) Volume BSA (ml) Volume aquades (ml)
0 0 10,00
0,01 0,06 9,94
0,02 0,10 9,90
0,03 0,15 9,85
0,04 0,20 9,80
0,05 0,25 9,75
0,06 0,30 9,70
0,08 0,40 9,60
0,10 0,60 9,40
0,20 0,10 9,00
0,30 1,50 8,50
(3) Penentuan berat molekul
Tabel 5 Komposisi gel penahan dan gel pemisah. Nama bahan Gel penahan (4%) Gel pemisah (10%) Akrilamid 30% 0,5 ml- 3,34
Buffer gel pemisah 1,26 ml 1,25 Buffer gel pengumpul - -
SDS - - Substrat kolagen
(0,25%)
- -
TEMED 0,005 ml 0,005
APS 0,05 ml 0,05
Konsentrasi akrilamid yang digunakan dalam analisis ini adalah 10% (w/v). Deteksi SDS-PAGE dilakukan dengan melepaskan gel hasil elektroforesis dari cetakan dan diukur jarak migrasi bromphenol blue. Gel tersebut dicelup dan direndam dalam larutan fiksasi (25% methanol+12% asam asetat) selama 1 jam sambil digoyang konstan. Kemudian direndam dalam 50% (v/v) etanol selama 20 menit, kemudian diganti dengan 30% (v/v) etanol selama 2x20 menit. Larutannya diganti dengan pengembang kemudian dicuci dengan akuabidestilata. Setelah dicuci ditambahkan larutan perak nitrat (AgNO3) 0,1% selama 30 menit kemudian
4. HASIL DAN PEMBAHASAN
4.1 Preparasi Organ Dalam
Bahan utama penelitian adalah organ dalam ikan bandeng. Apabila tidak langsung digunakan untuk penelitian, sampel organ dalam dikemas dalam kantung plastik dan segera disimpan pada suhu -20 oC (Kim et al. 2002; Park et al. 2002; Byun et al 2002). Pembekuan merupakan salah satu cara penyimpanan dan amobilisasi enzim. Aoki et al. (2002) menggunakan suhu -80 oC untuk menyimpan bahan utama pemurnian kolagenase yaitu hepatopankreas udang (Pandalus oeus) sebelum diteliti. Gambar organ dalam bandeng dapat dilihat pada Lampiran 4.
Penimbangan pada setiap organ dalam dilakukan untuk mengetahui jumlah bahan utama pemurnian enzim kolagenase sehingga dapat diketahui yield hasil pemurnian. Berdasarkan hasil penimbangan, maka berat ikan bandeng 188–547 g/ekor atau dengan berat rata-rata 375,57 g/ekor mempunyai prosentase berat usus sebesar 2,49%, hati sebesar 1,23% dan pilorik kaeka sebesar 1,26%. Data hasil prosentase berat organ dalam ikan bandeng selengkapnya terlampir pada Lampiran 5.
Prosentase ini berbeda dengan penelitian yang dilakukan Heruwati (1997) pada ikan nila (Oreochromis niloticus), kakap merah (Lutjanus sp), Tongkol (Katsuwonus pelamis). Perbedaan ini disebabkan oleh perbedaan fisiologi ikan antara lain spesies ikan, ukuran ikan, cara makan dan jenis makanan, habitat dan tingkat kematangan gonad (Clucas & Ward 1996). Hasil prosentase organ dalam beberapa spesies ikan dan ikan bandeng hasil penelitian disajikan pada Tabel 6.
Tabel 6 Prosentase organ dalam beberapa spesies ikan.
Jenis ikan Pilorik Lambung Intestin Hati
Kaeka
4.2 Ekstraksi Kolagenase
Ekstraksi merupakan tahap awal pemurnian kolagenase, secara terpisah terhadap tiga organ dalam, yaitu hati, usus dan pilorik kaeka ikan bandeng yang telah berada pada fase post rigor. Pada penelitian ini, ekstraksi kolagenase menggunakan buffer Tris-HCl dengan pH 8,0 untuk menjaga lingkungan enzim, sehingga tidak terjadi perubahan pH yang ekstrim selama proses ekstraksi. Triton X-100 sebesar 0,25% w/v ditambahkan untuk memisahkan enzim kolagenase yang masih melekat pada dinding sel atau sisa polimer substrat (Suhartono 1989). Selanjutnya sebesar CaCl2 100 mM ditambahkan dalam proses ekstraksi untuk
menjaga kemungkinan terjadinya penurunan aktivitas enzim, sebab ion Ca2+ dapat digunakan sebagai kofaktor (Bollag & Edelstein 1991). Penampang organ dalam ikan bandeng disajikan pada Lampiran 4.
Hasil ekstraksi berupa ekstrak kasar kolagenase. Ekstrak kasar tersebut kemudian diuji aktivitas kolagenasenya. Hasil uji aktivitas kolagenase terhadap ekstrak kasar kolagenase memperlihatkan bahwa terdapat aktivitas kolagenase pada ketiga organ dalam tersebut. Aktivitas kolagenase beberapa organ dalam dapat dilihat pada Gambar 11. Aktivitas kolagenase tertinggi terdapat pada usus yaitu sebesar 0,141 Unit/ml dan konsentrasi proteinnya adalah 1,712 mg/ml.
0
Gambar 11 Aktivitas kolagenase pada berbagai organ dalam ikan bandeng fase post rigor.
melaporkan bahwa secara histologi, struktur dinding sel usus halus pada ikan rainbow trout (Oncorhynchus mykiss) hampir sama dengan hewan vertebtara lain. Usus halus merupakan tempat sebagian pencernaan secara kimiawi terjadi. Sebagian besar enzim pencernaan yang bekerja pada usus disekresikan oleh pankreas melalui pankreatik duct.
Khojasteh et al. (2009) juga menyatakan usus halus terbentuk dari mukosa tonika dangan jaringan penghubung tonika muskularis (di bagian dalam berbentuk lingkaran, di bagian luar searah dengan daging) dan lapisan tonika serosa. Mukosa muskolaris terdapat diantara lamina propria dan submukosa, dan kelenjar mukosal turbular. Lapisan tipis jaringan penghubung bersifat asam memisahkan mukosa dan sub mukosa. Pada permukaan mukosa terdapat villi, mengurangi lebar bagian depan dan ujung usus, dan epitelium yang membentuk lapisan tunggal kolom sel dengan basal nukleus yang mengandung nukleus, garis apical brush dan sitoplasma asidofilik. Kolagenase dari usus ini selanjutnya digunakan oleh organ-organ tertentu yang memerlukannya dengan mekanisme transport sel. Penampang dinding usus disajikan pada Gambar 12.
Gambar 12 Penampang dinding usus.
Sumber:http://www.anselm.edu/homepage/jpito cch/genbio/intestwallcells.JPG. [5 Februari 2010]
karboksipeptidase dan karboksi esterase, yang secara normal disekresikan oleh pilorik kaeka dan pankreas (An & Vessesanguan 2000).
Terdapat aktivitas kolagenase pada sisa organ dalam yaitu campuran organ seperti ginjal, lambung, pankreas, dan empedu. Adanya aktivitas tersebut, menandakan bahwa pada organ-organ tersebut juga merupakan sumber kolagenase. Kolagenase telah dimurnikan dengan metode yang berbeda pada hepatopankreas udang (Pandalus eous) (Aoki et al. 2003) dan hepatopankreas kepiting raja (Paralithodes camtschaticus) (Rudenskaya et al. 2004). Beberapa sumber kolagenase dari hewan perairan dan metode pemurniannya disajikan pada Tabel 7.
Tabel 7 Sumber kolagenase dan metoda pemurniannya.
Sumber Metode pemurnian Kelipatan pemurnian
Yield (%) Organ dalam ikan makarel
(Scomber japanicus) Park et al. (2002).
pengendapan aceton; Penukar ion DEAE Sephadex A-50; Gel filtrasi
Sephadex G-100; Penukar ion DEAE Sephacel; Gel
filtrasi G-75
39,5 0,1
Organ dalam ikan filefish (Novoden modestrus) Kim et
al. (2002) .
pengendapan ammonium sulfat; Penukar ion DEAE
Sephadex A-50 dua kali; Gel filtrasi Sephadex G-150
92,4 10,9
Pilorik kaeka ikan tuna(Thunnus thynnus) Byun et
al. (2002)
Pengendapan ekstrak kasar kolagenase dari usus ikan bandeng garam ammonium sulfat (NH4(SO4)2). Konsentrasi NH4(SO4)2 yang ditambahkan yaitu
sulfat dipilih karena sifatnya yang mudah larut, murah dan umumnya tidak mempengaruhi struktur protein pada konsentrasi tertentu (Beynon & Bond 2000).
Penambahan ammonium sulfat pada ekstrak kasar menghasilkan endapan dan supernatan, yang masing-masing diuji aktivitas kolagenasenya. Hasil uji aktivitas terhadap hasil pengendapan diperoleh aktivitas tertinggi terdapat pada endapan dengan penambahan 70% (w/v) tingkat kejenuhan NH4(SO4)2, yaitu
sebesar 0,496 unit/ml dengan konsentrasi protein sebesar 1,185 mg/ml, dan aktivitas spesifiknya 35,42 Unit/mg. Meningkatnya aktivitas enzim pada endapan hingga penambahan ammonium sulfat 70% disebabkan berkurangnya pengotor, seperti non protein (karbohidrat), protein non enzim dan lain-lain (Suhartono 1989). Konsentrasi protein pada hasil pengendapan menggunakan ammonium sulfat 30-80% disajikan pada Gambar 13.
0,000
Konsentrasi Ammonium sulfat % kejenuhan
K
Gambar 13 Konsentrasi protein pada hasil pengendapan menggunakan ammonium sulfat 30-80%. endapan supernatan
supernatan
optimumnya. Hasil uji aktivitas kolagenase pada endapan dan supernatan larutan enzim kolagenase yang ditambah dengan NH4(SO4)2 dalam berbagai tingkat
kejenuhannya disajikan pada Gambar 14.
0,000
Konsentrasi ammonium sulfat % kejenuhan
A
Gambar 14 Aktivitas kolagenase (Unit/ml) hasil pemisahan dengan pengendapan menggunakan NH4(SO4)2 . endapan
Kim et al. (2002) mengendapkan ekstrak kasar kolagenase dari organ dalam ikan filefish (Novodon modestrus) menggunakan garam NH4(SO4)2 secara
bertingkat dari 30% hingga 80% w/v tingkat kejenuhan. Park et al. (2002) menggunakan aseton dingin untuk mengendapkan ekstrak kasar kolagenase dari organ dalam ikan makarel (Scromber japanicus). Aktivitas spesifik pada pengendapan ekstrak kolagenase dari ikan filefish yaitu 145,34 Unit/mg, lebih besar dibandingkan aktivitas spesifik ekstrak kasar kolagense dari ikan makarel, yaitu 42,3 Unit/mg.
4.4 Dialisis
Dialisis dilakukan untuk mengurangi kadar garam (desalting) yang tersisa dari pengendapan menggunakan garam NH4(SO4)2. Perbedaan tekanan osmosis
dengan mengganti buffer beberapa kali akan meningkatkan kemurnian enzim (Syukri 1999).
Lama waktu diffusi dan ukuran kantong dialisis serta konsentrasi buffer menentukan hasil dialisis (Bollag & Edelstein 1991). Aktivitas kolagenase pada jenis ukuran kantong dan waktu dialisis disajikan pada Gambar 15.
0
Gambar 15 Aktivitas kolagenase pada jenis ukuran kantong dan waktu dialisis.
Aktivitas kolagenase hasil presipitasi adalah 0,496 U/ml. Setelah didialisis, aktivitas kolagenase mengalami penurunan. Dialisis selama 6 jam menggunakan kantong dialisis dengan ukuran 8 kDa MWCO, menghasilkan aktivitas tertinggi yaitu 0,451 U/ml dibandingkan dengan proses dialisis menggunakan kantong dialisis dengan ukuran 12kDa MWCO pada waktu yang sama yaitu 0,101 U/ml sedangkan proses dialisis selama 12 jam menggunakan kantong dialisis dengan ukuran 8 kDa MWCO, menghasilkan aktivitas kolagenase yaitu 0,289 U/ml dibandingkan dengan proses dialisis menggunakan kantong dialisis dengan ukuran 12 kDa MWCO pada waktu yang sama yaitu 0,079 U/ml.
Aktivitas kolagenase pada kantong yang sama yaitu 8 kDa dengan lama waktu dialisis yang berbeda menyebabkan terjadinya penurunan aktivitas kolagenase. Perlakuan fisik dapat menyebabkan turunnya aktivitas kolagenase. Pada ukuran kantong dialisis yang berbeda yaitu 12 kDa, aktivitas kolagenase mengalami penurunan yang cukup tinggi. Hal ini disebabkan karena kemungkinan adanya molekul-molekul enzim yang keluar bersamaan dengan keluarnya ion dari garam NH4(SO4)2.
4.5 Kromatografi Penukar ion
Penelitian ini menggunakan matriks DEAE Sephadex A 50. Matriks ini termasuk dalam golongan fungsional diethylaminoethyl, terbuat dari dextran, sejenis polysakarida. Dextran termasuk dalam golongan penukar ion yang lemah. Kode A-50 adalah penukar ion jenis anionik dengan kapasitas 50, artinya jumlah 50 muatan dan potensi muatannya per unit berat atau miliequivalen grup ion per miligram berat kering matrik (Boyer 1993). Hasil kromatografi pertukaran ion disajikan pada Gambar 16.
-0,1
Gambar 16 Hasil kromatografi penukar ion. (◊) absorban pada 280 nm, (■) aktivitas kolagenase
Terdapat tiga puncak aktivitas kolagenase. Aktivitas kolagenase tertinggi terdapat pada fraksi yang ke-11 sebesar 0,658 U/menit dengan absorban 0,352 pada panjang gelombang 280 nm. Fraksi yang ke-11 ini selanjutnya dimurnikan lagi menggunakan gel filtrasi.
4.6 Kromatogafi Gel Filtrasi
0
Gambar 17 Hasil kromatografi gel filtrasi. (◊) aktivitas kolagenase, (■) absorban pada 280 nm.
Aktivitas kolagenase tertinggi terdapat pada fraksi yang ke-7 sebesar 0,133 U/ml dengan absorban 0,126 pada panjang gelombang 280 nm. Gel Sephadex G-100 dapat digunakan untuk memisahkan kolagenase dengan pengotor lainnya. Tahapan proses pemurnian telah berjalan dengan baik hal ini dapat dilihat dengan peningkatan kelipatan pemurniannya Kelipatan tingkat pemurnian kolagenase disajikan pada Tabel 8. Purifikasi kolagenase dari organ dalam ikan bandeng, menghasilkan tingkat kemurnian akhir sebesar 114,371 kali dan yield sebesar 1,26%.
Tabel 8 Hasil pemurnian kolagenase.
Tahapan Volume
Ekstraksi 450 0,141 63 0,785 353,25 0,178 1,00 100,00
Hasil pengendapan
70% ZA
45 0,496 2,32 1,185 53,325 0,419 2,347 35,42
Dialisis 20 0,451 9,020 1,020 23,260 0,388 2,484 14,32
DEAE
Sephadex A-50 5 0,657 1,314 0,095 0,190 6,916 38,778 2,08
Sephadex
4.4 Karakterisasi
Faktor-faktor utama yang mempengaruhi aktivitas enzim adalah konsentrasi enzim, substrat, produk, senyawa inhibitor dan aktivator, pH dan jenis pelarut yang terdapat pada lingkungan, kekuatan ion dan suhu (Suhartono 1989). Karakterisasi kolagenase dilakukan untuk mengetahui sifat-sifat katalitik enzim sehingga dapat diketahui pula kondisi optimum aktivitas enzim. Kolagenase dari berbagai sumber, mempunyai sifat-sifat katalitik yang berbeda. Perbedaan tersebut disebabkan oleh faktor-faktor seperti spesies, umur, jenis makanan, kualitas air, suhu lingkungan. Perbedaan sifat katalitik enzim juga terdapat pada spesies yang sama yang disebabkan oleh faktor interspesies. Faktor-faktor tersebut antara lain umur, ukuran jenis kelamin, fase spawning, riwayat spawning, komposisi makanan, riwayat stress dan lain-lain (Haard 2000). Perbedaan sifat-sifat katalitik kolagenase dari berbagai sumber, termasuk mikroorganisme disajikan pada Tabel 9.
4.4.1 Suhu Optimum
Enzim memiliki aktivitas maksimum pada suhu tertentu, aktivitasnya meningkat seiring dengan peningkatan suhu hingga mencapai suhu optimum. Setelah kenaikan suhu lebih lanjut, akan menyebabkan aktivitas menurun (Pelezar & Chan 1988). Suhu optimum kolagenase yang diperoleh dari ekstrak kasar dan hasil pengendapan adalah sebesar 50 oC.
Kolagenase baik dari ekstrak kasar maupun hasil pengendapan ammonium sulfat 70% kejenuhan, mempunyai aktivitas 0,151 dan 0,36 Unit/ml pada suhu 20
o
Tabel 9 Karakteristik kolagenase dari berbagai sumber.
Sumber pH
optimum
Suhu
optimum oC Inhibitor
ion logam spesifitas substrat
Penghambat Pengaktif kDa
organ dalam ikan makarel (Scomber
japanicus) (Park et al. 2002). 7,5 55
PMSF, TLCK, Soybean
trypsin inhibitor Hg2+, Zn2+ kolagen tipe I 14,8 serin organ dalam ikan filefish (Novoden
modestrus) (Kim et al. 2002) . 7,0-8,0 55 TLCK
Zn2+, Cd2+,
Cu2+ Ni2+
K+, Li+, Ba2+,
Ca2+, Mg2+ - 27,0 serin
hepatopancreas udang (Pandalus
eous) (Aoki et al. 2003) . 7,5-8,5 40-45 PMSF , antipain - - kolagen tipe I 22,0-23,0 serin Pilorik kaeka ikan tuna (Thunnus
thynnus) (Byun et al. 2002) 7,5 55
Streptomyces strain 3B (Petrova et al.
2005) 7,5 37
Bacillus subtillus FS-2 (Nagano & Kim
1999) 9 50
Clostridium perfringens (Matshishita et
al.1994) 7,2 42 1,10-phenanthroline
Ca2+ , Mg2+
Daging ikan Pasific rockfish (Sebastes
0,000
Gambar 18 Aktivitas kolagenase dari ekstrak kasar dan hasil pengendapan kolagenase pada berbagai suhu. (◊) ekstrak kasar, (□) hasil pengendapan
Enzim pada umumnya mempunyai temperatur optimum seperti temperatur sel. Enzim yang terdapat dalam mikroorganisme yang hidup di mata air panas, mempunyai suhu optimum mendekati titik didih air. Kenaikan kecepatan reaksi di bawah temperatur optimum disebabkan oleh kenaikan energi kinetika molekul-molekul yang bereaksi. Akan tetapi bila temperatur tetap dinaikkan terus, energi kinetika molekul menjadi sedemikian besar sehingga melampaui penghalang energi untuk memecahkan ikatan-ikatan sekunder yang mempertahankan enzim dalam keadaan aktifnya atau keadaan katalitik aktif. Akibatnya struktur sekunder dan tersier hilang disertai dengan hilangnya aktivitas katalitiknya (Boyer 1993).