OPTIMALISASI
CONCEPTION RATE
(CR) HASIL
INSEMINASI BUATAN (IB) PADA SAPI PO MELALUI
METODE SINKRONISASI ESTRUS DENGAN PGF
2αDAN
SINKRONISASI OVULASI DENGAN DENGAN hCG
MUTMAINNAH
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa tesis berjudul Optimalisasi Conception
Rate (CR) Hasil Inseminasi Buatan (IB) pada Sapi PO Melalui Metode Sinkronisasi Estrus dengan PGF2α dan Sinkronisasi Ovulasi dengan hCG benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, September 2015
Mutmainnah
RINGKASAN
MUTMAINNAH. Optimalisasi Conception Rate (CR) Hasil Inseminasi Buatan
(IB) pada Sapi PO Melalui Metode Sinkronisasi Estrus dengan PGF2α dan
Sinkronisasi Ovulasi dengan hCG. Dibimbing oleh AMROZI dan LIGAYA ITA TUMBELAKA.
Penelitian sinkronisasi estrus dan sinkronisasi ovulasi untuk optimasi inseminasi buatan telah dilakukan pada 22 ekor sapi Peranakan Ongole (PO). Bertujuan untuk melihat persentase kebuntingan hasil sinkronisasi estrus dan sinkronisasi ovulasi, yaitu induk sinkronisasi estrus (K1, n=5); dara ovsynch (K2, n=6); induk ovsynch (K3, n=11). Parameter yang diamati adalah diameter korpus luteum (CL) saat sinkronisasi estrus, diamater folikel pada saat sinkronisasi dan inseminasi buatan (IB) serta persentase sapi bunting. Data yang diperoleh dianalisa secara statistik menggunakan uji Duncan. Hasil penelitian menunjukkan tidak ada perbedaan nyata (P<0,05) terhadap diameter CL pada saat sinkronisasi estrus pada semua kelompok sapi dengan rata-rata 16,63±3,79 mm. Diameter CL pada saat estrus tidak berbeda nyata antar kelompok dengan rata-rata 8,80±2,07 mm. Diameter folikel pada saat sinkronisasi ovulasi tidak berbeda nyata antar kelompok dengan rata-rata diameter folikel adalah 9,01±2,05 mm. Diameter folikel pada saat estrus dan sinkronisasi ovulasi tidak berbeda nyata antar kelompok dengan rata-rata diameter folikel 10,94±2,10 mm. Persentase kebuntingan pada K1, K2 dan K3 berturut-turut adalah 60%, 16% dan 36%. Tidak terdapat korelasi antara diameter folikel pada saat estrus dengan persentase kebuntingan. Sinkronisasi estrus pada sapi induk menghasilkan kebuntingan yang lebih tinggi dibandingkan sinkronisasi ovulasi pada sapi PO induk maupun dara (P<0,05)
Kata kunci: sapi PO, sinkronisasi estrus, sinkronisasi ovulasi, persentase conception rate.
SUMMARY
MUTMAINNAH. Optimation Conception Rate (CR) Result of Artificial
Insemination (AI) on Cattle PO with Estrus Syncronization Use PGF2α and Ovulation Syncronization with hCG. Supervised by AMROZI dan LIGAYA ITA TUMBELAKA.
The study of estrus syncronization and ovulation for optimization of artificial insemination on 22 cows ongole breed cattle were done. The Aims of the
study was to obtainthe percentage of pregnancy rate from estrus synchronization
and ovulation synchronization in cows. The cows and heifers were devided in 3 groups, K1 (n=5) cows estrus syncronization, K2 (n=6) heifers ovsynch, K3
(n=11) cows ovsynch. The diameter of the corpus luteum (CL) while
synchronizing estrus, the diameter of follicles were analysed during synchronization and artificial insemination (AI) and the percentage of pregnant cows. The data were analyzed statistically using the Duncan test. The results showed that no significant differences (P <0.05) between the diameter of CL at the time of estrus synchronization in all groups of cows with an average diameter
of CL was 16,63±3,79 mm. The Follicle diameter at the time of synchronization
between groups was not significantly different with an average follicles was
9,01±2,05 mm. During estrus and ovulation synchronization there was not
significantly different of the follicles diameter between groups with an average diameter of 10,94 ± 2,10 mm follicles. The percentage of pregnancy in K1, K2 and K3 are 60%, 16% and 36%, respectively. There is no correlation between follicular diameter during estrus and the pregnancy. Pregnancy rate between estrus synchronized werehigher than synchronized in cow or heifers of PO cattle (P< 0,05)
© Hak Cipta Milik IPB, Tahun 2015
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Biologi Reproduksi
OPTIMALISASI
CONCEPTION RATE
(CR) HASIL INSEMINASI
BUATAN (IB) PADA SAPI PO MELALUI METODE
SINKRONISASI ESTRUS DENGAN PGF
2αDAN SINKRONISASI
OVULASI DENGAN DENGAN hCG
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2015
Judul Tesis : Optimalisasi Conception Rate (CR) Hasil Inseminasi Buatan (IB)
pada Sapi PO Melalui Metode Sinkronisasi Estrus dengan PGF2α
dan Sinkronisasi Ovulasi dengan hCG
Nama : Mutmainnah
NIM : B352130081
Disetujui oleh
Komisi Pembimbing
Drh Amrozi, Ph.D Dr drh Ligaya ITA Tumbelaka, SpMP, Msc
Ketua Anggota
Diketahui oleh
Ketua Program Studi Biologi Reproduksi Dekan Sekolah Pascasarjana
Prof Dr drh Mohamad Agus Setiadi Dr Ir Dahrul Syah, MScAgr
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak November 2014 sampai dengan Maret 2015 adalah Optimalisasi Conception Rate (CR) hasil Inseminasi Buatan
(IB) pada Sapi PO Melalui Metode Sinkronisasi Estrus dengan PGF2α dan
Sinkronisasi Ovulasi dengan Hcg.
Terima kasih dan penghargaan penulis ucapkan kepada Bapak Drh Amrozi, PhD dan Ibu Dr drh Ligaya ITA Tumbelaka, SpMP, Msc selaku pembimbing, serta Ibu Drh Ni Wayan Kurniani Karja, MP, PhD sebagai penguji luar komisi atas segala saran, kritik, dan masukan yang diberikan untuk kesempurnaan karya ilmiah ini.
Penulis juga menyampaikan terima kasih kepada BPPDN DIKTI, yang telah memberikan beasiswa selama penulis menempuh pendidikan, terima kasih kepada Ibu Intan, Drh Juli Melia Msi, dan Drh Ade Octaviani serta teman-teman BRP dan IBH angkatan 2013 yang telah membantu selama penelitian, pengumpulan data, dan dukungan selama ini.
Ungkapan terima kasih juga disampaikan kepada ayah, ibu, serta seluruh keluarga, atas segala doa dan kasih sayangnya.
Semoga karya ilmiah ini bermanfaat.
Bogor, September 2015
DAFTAR ISI
DAFTAR GAMBAR xi
DAFTAR LAMPIRAN xi
1 PENDAHULUAN 1
Latar Belakang 1
Kerangka Pemikiran 2
Tujuan Penelitian 2 Manfaat Penelitian 2
2 TINJAUAN PUSTAKA 3 Sapi Peranakan Ongole (PO) 3
Sinkronisasi Estrus Menggunakan PGF2α 4
Sinkronisasi Ovulasi Menggunakan hCG 6
Inseminasi Buatan 7
Penentuan Fase Luteal, Fase Folikuler, dan Diagnosa Kebuntingan Menggunakan Ultrasonografi 8
3 MATERI DAN METODE 9
Waktu dan Tempat Penelitian 9
Alat dan Bahan 10
Penentuan Status Reproduksi 10
Sinkronisasi Estrus dan Ovulasi 10
Analisis Data 11
4 HASIL DAN PEMBAHASAN 12
Sinkronisasi Estrus, Sinkronisasi Ovulasi, dan Conception Rate Sapi 12
Gambaran CL, Folikel, dan Conception Pada Sapi PO 16
5 SIMPULAN DAN SARAN 17
Simpulan 17
Saran 17
DAFTAR PUSTAKA 17
LAMPIRAN 22
DAFTAR GAMBAR
1. Struktur kimia hormon PGF2α
2. Mekanisme Counter current PGF2α
3. Prosedur penelitian 11
4. Rata-rata diameter CL dan diameter folikel sebelum sinkronisasi 12
estrus dan sebelum IB
5. Tabel Rata-rata diameter CL dan diameter folikel sebelum 13
sinkronisasi estrus dan sebelum IB
6. Gambaran USG CL saat sinkronisasi estrus, gambar Folikel saat 16
sinkronisasi ovulasi, dan Fetus berumur 30 hari
4
Indonesia memiliki banyak bangsa sapi potong lokal diantaranya adalah sapi Peranakan Ongole (PO). Bangsa sapi ini tersebar luas di Indonesia dan bagian terbesar populasinya adalah di Pulau Jawa. Sapi PO terbentuk sekitar tahun 1900 melalui sistim persilangan dengan grading up sapi Jawa dengan sapi Ongole. Sapi PO mempunyai nilai tinggi di masyarakat yang terkenal sebagai sapi pedaging dan sapi pekerja, hal tersebut telah mendorong pengembangan sapi PO oleh peternak Indonesia. Berdasarkan penelitian Iskandar (2011) yang menyatakan
bahwa service perconception (S/C) sapi PO di dataran tinggi adalah 1.3
sedangkan di dataran rendah adalah 1.5. Menurut Nuryadi dan Wahjuningsih
(2011) menyatakan bahwa inseminasi buatan (IB) pada sapi PO menghasilkan
conception rate (CR) 75.34%, hal ini membuktikan bahwa performa reproduksi sapi PO di dataran tinggi lebih baik dibandingkan di dataran rendah. Sapi PO juga mampu beradaptasi pada lingkungan yang buruk seperti suhu dan kelembaban tinggi, kualitas pakan yang rendah, dan makanan terbatas (Diwyanto, 2009).
Berdasarkan keunggulan dan data performa reproduksinya, sapi PO dapat dikembangkan dan ditingkatkan populasinya, namun pada kenyataannya populasi sapi PO tidak dapat ditingkatkan. Potensi produksi sapi PO menunjukkan pertumbuhan yang lambat bila dibandingkan dengan bangsa sapi yang telah mengalami seleksi. Beberapa kendala yang dihadapi adalah kesalahan deteksi estrus, lambatnya penyapihan pedet di peternakan rakyat yang menyebabkan perpanjangan periode estrus pertama postpartus, dan silent heat. Optimalisasi conception rate (CR) sapi PO dapat dilakukan dengan metode sinkronisasi estrus dan sinkronisasi ovulasi.
Sinkronisasi estrus dan sinkronisasi ovulasi merupakan metode yang bertujuan menyerentakkan estrus dan ovulasi pada sekelompok ternak betina. Metode sinkronisasi estrus dan sinkronisasi ovulasi diharapkan dapat meningkatkan keberhasilan IB dengan melihat presentase conception rate (CR), selain itu dapat meningkatkan efesiensi deteksi estrus dan keseragaman umur pedet sehingga dapat meningkatkan produksi ternak secara massal (Larson et al. 2006; Waldmann, 2006).
Salah satu cara yang diterapkan untuk metode sinkronisasi estrus adalah menggunakan hormon PGF2α yang bersifat luteolitik terhadap korpus luteum (CL). Menurut Stötzel et al. (2012) pemberian PGF2α pada fase midluteal
menyebabkan luteolisis sehingga konsentrasi progesteron (P4)menurun yang akan
merangsang hipofisa anterior melepaskan Follicle Stimulating Hormone (FSH)
dan Luteinizing Hormone (LH), kedua hormon ini bertanggung jawab dalam proses folikulogenesis dan ovulasi. Menurut Peterson et al. (2011) pemberian dua
dosis PGF2α pada hari ke-5 menginduksi CL 95 sampai 100%. Metode
sinkronisasi ovulasi biasanya menggunakan Human chorionic gonadotrophin
Berdasarkan hasil penelitian tersebut optimalisasi CR pada sapi PO dapat
dilakukan dengan sinkronisasi estrus menggunakan PGF2α dan sinkronisasi
ovulasi hCG, oleh karena itu dilakukan penelitian untuk mengetahui optimalisasi CR pada sapi PO yang disinkronisasi estrus dengan PGF2α serta sinkronisasi ovulasi dengan hCG.
Kerangka Pemikiran
Peningkatan populasi sapi PO secara cepat dan massal dapat dilakukan melalui aplikasi sinkronisasi estrus dan sinkronisasi ovulasi. Metode sinkronisasi estrus dan sinkronisasi ovulasi bertujuan agar dapat mengefisienkan waktu dan tenaga dalam optimalisasi program IB. Sinkronisasi estrus dapat dilakukan dengan pemberian preparat luteolitik seperti PGF2α. Pemberian PGF2α pada fase midluteal menyebabkan luteolisis. Luteolisis menyebabkan penurunan kadar progesteron
(P4). Penurunan kadar P4 akan merangsang pelepasan FSH dan LH yang
bertanggung jawab dalam proses folikulogenesis dan ovulasi. Folikel-folikel
tersebut akan menghasilkan hormon E2 yang mampu memanifestasikan gejala
estrus dan lonjakan LH sehingga terjadi ovulasi 2 sampai 4 hari setelah pemberian
PGF2α. Pemberian hCG pada metode sinkronisasi ovulasi dapat menginduksi
ovulasi yang lebih cepat, serentak, dan dapat diprediksi waktunya, sehingga dapat
mengefektifkan reproduksi sapi PO. Penelitian ini dilakukan untuk
mengoptimalkan CR pada sapi PO yang disinkronisasi estrus dengan PGF2αdan atau disinkronisasi ovulasi dengan hCG.
Tujuan Penelitian
Mengoptimalkan CR hasil IB pada sapi PO melalui metode sinkronisasi
estrus dengan PGF2α dan sinkronisasi estrus dengan PGF2α yang dilanjutkan
disinkronisasi ovulasi dengan hCG.
Manfaat Penelitian
1. Memberikan informasi mengenai persentase CR pada sapi PO yang
disinkronisasi estrus dengan PGF2α atau dan yang disinkronisasi ovulasi dengan hCG.
2. Diharapkan agar lebih cepat mendapatkan peningkatan populasi ternak
2 TINJAUAN PUSTAKA
Sapi Peranakan Ongole (PO)
Sapi Peranakan Ongole (PO) merupakan sapi yang berasal dari persilangan antara bangsa sapi Jawa (sapi lokal) dengan bangsa sapi Ongole (India) yang berlangsung cukup lama yakni sejak tahun 1900. Persilangan tersebut merupakan
“Grading Up”, yang bertujuan untuk memperoleh ternak sapi yang dapat digunakan bagi keperluan tenaga tarik membantu petani mengolah tanah pertanian dan transportasi (Atmadilaga, 1979).
Sapi PO mempunyai ciri-ciri fisik yaitu bulu kelabu kehitam-hitaman, bagian kepala, leher, dan lutut berwarna gelap sampai hitam namun pada sapi betinanya berwarna putih, dahi cembung, telinga agak panjang dan menggantung dengan mata besar yang terlihat tenang, berpunuk besar, serta memiliki gelambir dan lipatan kulit dibawah perut. Bobot badan pada jantan dewasa sekitar 600 kg dan betinanya sekitar 450 kg. Rataan bobot badan lahir sapi PO adalah 11.31 kg sampai 12.00 kg dan rataan bobot sapih yaitu 104.13 kg sampai 108.87 kg. Pertambahan bobot badan harian (PBBH) pada sapi PO prasapih yang pernah dilaporkan adalah 0.62 kg dan lepas sapih 0.24 kg. Pada saat berumur 4 sampai 12 bulan PBBH berkisar 0.34 sampai 0.37 kg, umur 13 sampai 24 bulan berkisar 0.31 sampai 0.40 kg, umur 2 tahun berkisar 0.44 sampai 0.98 kg (Astuti, 2003).
Soenarjo (1983) melaporkan mengenai ukuran anatomis alat reproduksi normal pada sapi betina PO, yaitu panjang vagina rata-rata 21.56 cm dengan diameter rata-rata 3.11 cm, serviks uteri 5.50 cm dengan diameter 2.67, korpus uteri 2.40 dengan diameter 2.43, kornua uteri 21.24 dengan diameter 1.88 dan tuba fallopii 20.17 cm dengan diameter 0.23 cm. Sedangkan besar ovarium kiri 7.18 cc dan ovarium kanan besarnya 6.67. Panjang rata-rata simpisis pelvis pada sapi betina PO adalah 15.82 cm.
Keberhasilan peningkatan populasi sapi PO sangat terkait dengan performa reproduksinya. Faktor performa reproduksi yang penting meliputi Service per Conception (S/C), Conception Rate (CR), Days Open (DO), Calving Interval (CI). Beberapa kajian mengenai performa reproduksi sapi PO antara lain yang telah dilaporkan oleh Iskandar (2011) menyatakan bahwa S/C sapi PO untuk dataran tinggi adalah 1.3 dan dataran rendah adalah 1.5 di Propinsi Jambi. Menurut Nuryadi dan Wahjuningsih (2011) melaporkan bahwa S/C pada sapi PO adalah 1.28 hari, CR adalah 75.34%, DO adalah rata 130.27 hari, dan CI adalah rata-rata 414.97 hari.
Sinkronisasi Estrus Menggunakan PGF2α
Keberhasilan IB tergantung pada deteksi estrus yang tepat, keterlambatan deteksi estrus menyebabkan kegagalan pembuahan pada program IB (Rao et al. 2013). Gejala estrus pada sapi mungkin tidak terlalu aktif pada saat cuaca panas dan estrus berlangsung sangat singkat sekitar 12 sampai 18 jam sehingga sulit diamati (DuPonte, 2007). Aktifitas estrus biasanya berlangsung pada malam hari sehingga sering tidak terdeteksi. Rata-rata keberhasilan deteksi estrus yang rendah (<50%) pada sebagian sapi di Amerika Serikat sudah diidentifikasi sebagai faktor yang dominan penyebab inefisiensi reproduksi, untuk mengatasi deteksi estrus dan penentuan waktu inseminasi yang tepat biasanya menggunakan metode sinkronisasi estrus (Lopez et al. 2004).
Sinkronisasi estrus adalah suatu pengendalian siklus estrus yang dilakukan pada sekelompok ternak betina dengan memanipulasi mekanisme hormonal salah satunya yaitu melisiskan CL dengan pemberian preparat-preparat luteolitik yaitu PGF2α, sehingga keserentakan estrus dapat terjadi pada hari yang sama atau dalam kurung waktu 2 atau 3 hari setelah perlakuan (Larson et al. 2006). Menurut Amrozi (2004) regresi CL tersebut berkaitan dengan terjadinya apoptosis sel luteal dan pembentukan jaringan ikat yang bersifat hyperechoic sehingga terjadi penurunan konsentrasi plasma P4.
Prostaglandin merupakan asam lemak tak jenuh yang terdiri dari cincin siklopentana dibentuk dari 20 atom karbon sebagai pembentuk rantai utamanya, dan merupakan derivat dari asam prostanoic. Prostaglandin mengandung gugus hidroksil (OH) di posisi atom C nomor 11 dan C nomor 15, dan memiliki ikatan rangkap pada atom C no 13. Prostaglandin F2α bekerja secara autokrin dan parakrin yang dialirkan melalui darah menuju target di organ reproduksi yang bekerja lokal dan berinteraksi dari sel ke sel (Jaeger, 2005). Reseptor PGF2α, merupakan family protein G, yang terdiri dari tujuh domain transmembran dimana setiap reseptor PGF2α dikodekan oleh gen yang berbeda (Narumiya et al. 1999).
Menurut Senger (2005) biosintesis PGF2α pada ruminansia terjadi di dalam
membran sel epitel endometrium dan sel epitel glandular superfisial. Pada awal periode postpartum PGF2α dihasilkan oleh karankula-karankula (Frazer, 2001). Biosintesis PGF2α distimulasi oleh hormon oksitosin dari sel luteal, oksitosin berikatan dengan reseptornya sehingga membentuk ikatan OTr kompleks yang
akan mengubah asam arakidonat menjadi PGF2α. Menurut Lee et al. (2010) asam
arakidonat adalah prekursor utama untuk sintesis prostaglandin, sintesis prostaglandin dimulai ketika fosfolipase A2 sitosol menyebabkan fosfolipid
melepaskan asam arakidonat. Cyclooxygenase COX-1 dan COX-2 mengkonversi
asam arakidonat menjadi prostaglandin H2 kemudian prostaglandin H2 dikonversi menjadi PGF2α melalui prostaglandin F sintase (AKR1B5 dan
PGFS-AKR1C3). Prostaglandin F2α berikatan dengan reseptornya pada saat
menggunakan efek biologisnya secara spesifik di dalam jaringan. Katabolisme hormon prostaglandin awalnya dikontrol oleh prostaglandin 15-dehydrogenase yang mengkatabolisis PGF2α menjadi metabolit inaktif, 13, 14 dihydro-15 keto PGF2α.
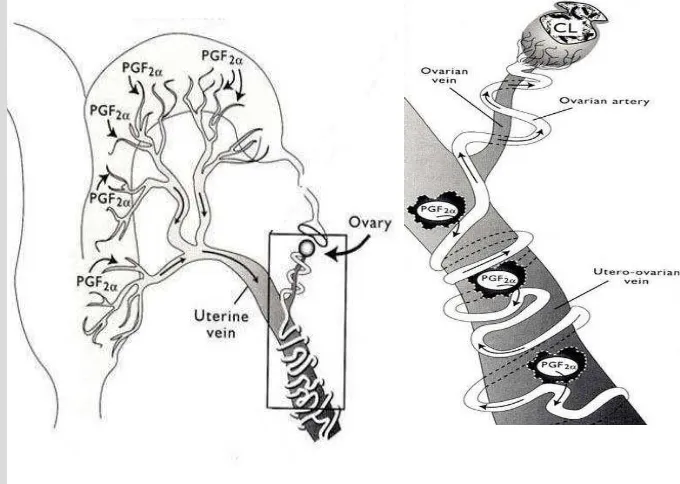
Prostaglandin F2α yang berasal dari uterus diangkut ke ipsilateral ovarium
melalui mekanisme counter current. Sistem counter current melibatkan dua
sistem pembuluh darah, dimana darah dari satu pembuluh darah mengalir ke arah
yang berlawanan menuju ke pembuluh darah di dekatnya. Prostaglandin F2α yang
disintesis oleh endometrium masuk ke vena uterina yang konsentrasinya relatif tinggi, melalui mekanisme counter current PGF2α ditransfer dari dinding vena uterina ke dalam arteri ovarium, dimana konsentrasinya yang relatif rendah. (Senger, 2005).
Gambar 2 Mekanisme Counter current PGF2α (Mc Cracken; Senger, 2005)
Prostaglandin F2α bersifat luteolytic tehadap CL yang mengakibatkan konsentrasi P4 menurun sehingga negative feedback terhadap hipotalamus hilang,
sehingga meningkatkan produksi FSH dan LH. Follicle Stimulating Hormone
merangsang perkembangan folikel yang akan meningkatkan produksi dan sekresi E2. Konsentrasi E2 yang tinggi merangsang terjadinya estrus dan memberikan
positive feedback terhadap hipotalamus sehingga menyebabkan lonjakan LH yang akan merangsang terjadinya ovulasi dari folikel dominan (Pfeifer et al. 2013).
Keberhasilan sinkronisasi estrus tergantung dari penurunan serentak kadar P4 dalam darah, serta perkembangan dan ovulasi dari folikel ovaria, PGF2α hanya
diinduksi. Penurunan konsentrasi P4 oleh PGF2α juga disebabkan adanya
mekanisme aktivasi protein kinase (PKC) yang menghambat konversi kolesterol
menjadi P4 (Salverson dan Perry, 2007). Konsentrasi progesteron 5 ng/mL pada
setiap pemberian PGF2α dan akan menurun ke <2,5 ng/mL 72 jam kemudian (Waldmann et al. 2006). Luteolisis yang tidak sempurna mengubah laju estrus dan
menginduksi folikel persisten (Twagimarungu et al. 1995). Menurunnya laju
estrus pada Bos Indicus kemungkinan disebabkan tidak memadainya regresi CL (Lemaster et al. 2001).
Luteolisis tergantung pada kematangan dan dosis pemberian PGF2α, selain itu sel luteal yang ukurannya lebih besar lebih responsif terhadap PGF2α dari pada sel luteal yang kecil (Peterson et al. 2011). Luteolisis dapat secara efektif bekerja dengan pemberian dosis tunggal PGF2α dari hari ke-6 sampai hari ke-16 siklus estrus, karena terbukti pemberian dosis tunggal PGF2α pada CL berumur 3.5 sampai 4 hari memberikan respon yang masih sangat rendah yaitu sekitar 0 sampai 20% sehingga tidak memberikan efek nyata pada penurunan konsentrasi P4 (Torres et al. 2012). Berbeda dengan pemberian dosis tunggal PGF2α terhadap
6CL ukuran yang lebih besar yakni berumur 4.5 sampai 5 hari memberikan respon luteolisis 20 sampai 80%. Menurut Peterson et al. (2011) pada metode Co-Synch pemberian PGF2α pada hari ke-5 dengan interval 6 jam dapat menginduksi regresi CL (95 sampai 100%), kemudian dilakukan IB 72 jam setelah pemberian
PGF2α angka kebuntingan pada metode ini mencapai 62.1%.
Aplikasi sinkronisasi estrus mempunyai potensi meningkatkan
kemungkinan penggunaan IB (Larson et al. 2006). Secara konsisten dapat
mencapai konsepsi lebih dari 50% pada IB terjadwal (Saldarriaga et al. 2007). Mengurangi waktu deteksi estrus, memungkinkan mengurangi CI dan meningkatkan keseragaman umur pedet (Waldmann, 2006). Sinkronisasi tidak hanya efektif untuk IB tetapi juga kawin alam, pada beberapa metode sinkronisasi estrus juga bisa meningkatkan proporsi sapi yang tidak estrus untuk mulai siklus estrus kembali. Hal ini akan menurunkan interval sapi yang tidak estrus setelah melahirkan (Perry, 2005).
Sinkronisasi Ovulasi Menggunakan hCG
Sinkronisasi ovulasi merupakan upaya menyerentakkan ovulasi pada sekelompok ternak betina, sinkronisasi ovulasi biasanya menggunakan hCG. Human Chorionic Gonadothrophin disekresikan oleh plasenta pada embrio manusia setelah 6 sampai 8 hari setelah fertilisasi, kemudian sebagian besar disintesis oleh placental syncyotiotropoblast cell (de Medeiros et al. 2009). Human Chorionic Gonadothrophin merupakan hormon glikoprotein yang terdiri dari 237 asam amino yang mempunyai sub unit α yang bersifat spesifik spesies, dan sub unit β menentukan interaksi reseptor dan efek biologi akhir (Stenman et al. 2006). Rantai β memiliki homologi rangkaian dengan LH tetapi tidak identik;
dari 145 asam amino β-hCG, 97 (67%) adalah identik dengan asam amino β-LH,
dan memiliki resistensi yang tinggi terhadap degradasi (de Medeiros et al. 2009; De Rensis et al. 2010).
Human Chorionic Gonadotropin yang mempunyai efek menyerupai LH, hCG yang diinjeksikan pada sapi akan langsung masuk ke peredaran darah dan bekerja langsung pada ovarium melalui hipotalamus selanjutnya kelenjar pitiutari, tanpa menginduksi GnRH (Filicori et al. 2005). Di ovarium hCG berikatan dengan reseptor LH pada theca interna folikel matang (Marquezini et al. 2011). Akan tetapi pemberian hCG yang berulang pada ternak menginduksi sebuah respon antibodi yang akan menetralisir molekul hCG dan mereduksi binding hCG dengan reseptornya (De Rensis et al. 2010).
Pemberian hCG dapat menginduksi ovulasi folikel dominan,
memperpanjang masa hidup CL, membentuk aksesori CL apabila diberikan pada awal fase luteal, memodifikasi dinamika gelombang folikel, dan meningkatkan frekuensi tiga gelombang folikel dominan (De Rensis et al. 2010). Aksesori CL dapat terbentuk pada saat pemberian hCG di hari ke-5 siklus estrus (Schmitt et al. 1996), hari ke-6 siklus estrus (Fricke et al. 1993), hari ke-10 sampai 16 siklus estrus (Price dan Webb, 1989). Terbentuknya aksesori CL berkontribusi dalam peningkatan konsentrasi P4 endogen (Diaz et al. 1998). Peningkatan konsentrasi
P4 akan bertahan selama 2 sampai 3 minggu dimana konsentrasi P4 yang tinggi
berperan untuk memelihara kebuntingan (De Rensis at al. 2010).
Menurut Ahmad et al. (1997) pemberian hCG dapat menginduksi siklus tiga gelombang folikuler dan ketika diinseminasi dapat menghasilkan angka konsepsi yang lebih tinggi. Menurut Twagiramungu et al. (1995) pemberian hCG pada sapi dara menginduksi ovulasi folikel dominan pada gelombang folikel pertama dan menyebabkan rekruitmen gelombang kedua terlalu cepat dan rekruitment gelombang kedua menyebabkan folikel yang terovulasikan berukuran kecil dan memiliki rentang hidup yang lebih singkat, hal ini disebabkan oleh konsentrasi progesteron yang lebih tinggi, dan konsentrasi P4 yang tinggi mengurangi
pertumbuhan folikel dominan dengan mengurangi sekresi FSH dan LH, oleh karena rentang hidup folikel yang singkat dari gelombang folikel kedua, maka durasi dan fungsional gelombang ketiga meningkat (Kinder et al. 1996).
Sinkronisaasi ovulasi menggunakan hCG pada sapi potong dapat menginduksi ovulasi folikel berdiameter <10 mm, pada sapi perah yang sedang laktasi yang ditreatment hCG menyebabkan ovulasi folikel berdiameter <10 mm
(Buttrey et al. 2010). Menurut Keskin et al. (2010) penggunaan hCG pada
aplikasi sinkronisasi ovulasi 1 500 IU pada sapi perah menghasilkan angka konsepsi 37.6%. Pemberian hCG 1 000 IU pada sapi menjelang IB menghasilkan kebuntingan 49.1% (Marquezini et al. 2011). Pemberian hCG pada sinkronisasi ovulasi diharapkan dapat menginduksi terjadinya ovulasi yang bersamaan sehingga dapat mengoptimalkan aplikasi IB berdasarkan angka CR.
Inseminasi Buatan
memperpendek musim kawin dan memberikan lebih banyak kesempatan untuk meningkatkan produktivitas selama musim kawin (Marquezini et al. 2011).
Peluang keberhasilan IB sangat dipengaruhi penentuan waktu inseminasi, memastikan sapi dalam keadaan estrus adalah faktor yang dominan dalam menentukan keberhasilan ataupun kegagalan IB dan sekaligus merupakan indikasi terjadinya ovulasi pada sapi (Perry, 2005). Waktu optimum untuk IB merupakan faktor penting yang harus diperhitungkan dalam pelaksanaan IB. Ovulasi terjadi sekitar 12 jam setelah akhir standing estrus yang memungkinkan kapasitasi spermatozoa, waktu kapasitasi merupakan proses fisiologik yang dialami oleh spermatozoa dalam saluran kelamin betina untuk memperoleh kapasitas atau kesanggupan membuahi ovum. Betina harus diinseminasi 12 sampai 24 jam setelah standing estrus dan diinseminasi lagi setiap 12 sampai 24 jam setelah IB pertama selama masih estrus, untuk memperoleh hasil yang optimal semen harus diinseminasikan ke betina 6 sampai 8 jam sebelum ovulasi, karena sel sperma dapat hidup sampai 24 jam dalam saluran reproduksi betina, lebih baik membuahi awal estrus dari pada terlambat (Troxel, 2012).
Angka konsepsi pada sapi yang diinseminasi 10 jam sesudah permulaan estrus adalah 82%, pada 20 jam sesudah permulaan estrus atau segera setelah sesudah estrus 62%, pada 30 jam sesudah permulaan estrus atau kira-kira pada waktu ovulasi, angka konsepsi menutun menjadi 28% (Tolihere, 1984). Menurut Dransfield et al. (1998) hasil konsepsi sapi yang diiseminasi empat jam setelah permulaan estrus adalah 43.1%, empat sampai delapan jam permulaan estrus adalah 50.9%, delapan sampai 12 jam setelah permulaan estrus adalah 51.1%, 12 sampai 16 jam setelah permulaan estrus 46.2%, 16 sampai 20 jam 28.1%, 20 sampai 24 jam setelah permulaan estrus 31.7%, 24 sampai 26 jam setelah permulaan 14.3 %. Persentase kebuntingan sapi dara lebih tinggi yaitu 65.4% yang diinseminasi 12 jam setelah deteksi estrus dibandingkan yang diinseminasi
72 jam setelah pemberian PGF2α dengan persentase kebuntingan 36.6% (Larson et
al. 1995). Berdasarkan data tersebut, waktu terbaik untuk inseminasi adalah mulai dari pertengahan estrus sampai 6 jam sesudah akhir estrus. Apabila muncul birahi saat pagi dilakukan IB disaat sore dan apabila muncul birahi pada saat sore maka dilakukan IB pagi besok (Toelihere, 1984).
Penentuan Fase Luteal, Fase Folikuler, dan Diagnosa Kebuntingan Menggunakan Ultrasonografi
Peralatan instrumentasi ultrasonografi modern telah tersedia dalam berbagai bentuk. Kualitas gambar yang dihasilkan dipengaruhi oleh keterampilan sonografer. Penggunaan ultrasonografi harus disertai dengan pemahaman yang baik terhadap sifat fisika ultrasonografi serta interaksi fungsi peralatan dengan
jaringan untuk memperoleh pencitraan yang baik (Goddard, 1995; Melia, 2010).
mengamati saluran reproduksi ternak adalah transrectal yaitu menggunakan transducer (probe) linear yang dimasukkan ke dalam rectum yang akan memancarkan gelombang suara ke organ reproduksi dan akan dipantulkan kembali ke probe untuk divisualisasikan pada layar monitor. Probe sendiri memiliki dua jenis yaitu linear array transducer dan convex array transducer, keduanya memiliki beberapa frekuensi yaitu 3.5, 5.0, dan 7.5 MHz. Semakin
tinggi frekuensi transducer, maka resolusi gambar akan lebih baik namun
kedalaman organ yang ditembus dangkal.
Ihnatsenka dan Boezaart (2010) menyatakan bahwa berdasarkan ekogenisitasnya, hasil sonografi akan tampil dalam tiga jenis visualisasi yakni hyperechoic, hypoechoic dan anechoic. Hyperechoic (echogenic) merupakan citra berwarna putih pada sonogram yang dapat dijumpai pada struktur seperti tulang,
udara, kolagen dan lemak, disebabkan pemantulan gelombang (echo) secara
sempurna dari struktur target (highly reflective interface). Hypoechoic (echopoor) merupakan citra berwarna abu-abu pada sonogram yang dapat dijumpai pada struktur seperti jaringan lunak, disebabkan tingkat echo yang rendah dari struktur target (intermediate reflection/transmission). Anechoic (echolucent/nonechogenic) merupakan citra berwarna hitam pada sonogram yang dapat dijumpai pada struktur seperti cairan kantung kemih, disebabkan tidak terjadi pemantulan
gelombang dari struktur target (complete transmission). Pada pemeriksaan
kebuntingan dengan USG, indikasi kebuntingan diperoleh berdasarkan pengamatan pada pencitraan layar monitor USG ditandai dengan bentukan bulatan anechoic, di sebelah dorsal vesika urinaria tampak kantong amnion, serta jika tidak terlihat adanya gambaran muskulus.
Metode USG dengan menggunakan tranduser 5 MHz secara tepat dan akurat dapat memperlihatkan gambaran uterus dan ovarium sehingga baik digunakan sebagai alat untuk penentuan fase luteal dan fase folikuler (Kasimanickam et al. 2004). Menurut Fricke (2004) folikel tampak sebagai struktur bulat, berwarna hitam (anechoic), serta berbatas tegas, ukuran folikel dominan merupakan diameter antrum folikel, tidak termasuk dinding folikel. Korpus luteum tampak sebagai struktur dengan ekhogenisitas rendah, pada layar monitor sebagai gradient berwarna abu-abu sampai putih (hypoechoic), CL juga diukur dengan cara diukur rerata diameter terpanjang dan terpendek dengan menggunakan caliper internal pada alat USG, apabila diameter CL >15 mm ditetapkan sebagai fase luteal, diameter folikel > 12 mm ditetapkan sebagai fase folikuler.
Penggunaan USG secara transrectal dianggap sebagai teknologi pendukung untuk identifikasi kebuntingan. Pada pemeriksaan kebuntingan dengan USG, indikasi kebuntingan diperoleh berdasarkan pengamatan pada pencitraan layar
monitor USG ditandai dengan bulatan anechoic di sebelah dorsal vesika urinaria
tampak kantong amnion, serta jika tidak terlihat adanya gambaran muskulus. Akurasi diagnosis kebuntingan menggunakan metode USG dengan jenis transduser 7,5 MHz tidak lebih dari 50% jika dilakukan sebelum hari 16 pasca inseminasi (Fricke, 2009).
Viabilitas fetus yang sedang berkembang dapat dipastikan ketika jantung fetus yang berdetak terlihat sebagai struktur hypoechoic berkedip. Vesikel amnion dapat dideteksi dengan USG sejak umur 9 sampai 22 hari kebuntingan akan
tampak berupa cairan anechoic dalam lumen uterus. Posisi cairan yang
(Curran et al. 1986). Sampai hari ke-25, diameter vesikel amnion masih sangat kecil sehingga hanya dapat dideteksi dengan USG frekuensi lebih dari 5 MHz, yakni sekitar 2 sampai 4 mm (Pierson and Ginther, 1984). Pada hari ke-25 sampai 30, vesikel amnion berada pada ukuran maksimal akibat akumulasi cairan, yakni berdiameter sekitar 10 mm (Kähn, 2004).
Teknik USG yang diterapkan pada industri peternakan dan lembaga penelitian ternak untuk mengefisienkan dalam mengevaluasi fungsi reproduksi dan meningkatkan manajemen reproduksi. Penggunaan USG memiliki efek positif pada kinerja reproduksi yaitu mengurangi interval antara layanan IB dengan diagnosa ada tidaknya kebuntingan pada sapi (Beal et al. 1992). Penentuan fase luteal, fase folikuler, dan diagnosa kebuntingan pada ternak merupakan komponen penting dari program manajemen reproduksi, dimana penentuan fase luteal, fase folikuker, dan diagnosa kebuntingan yang efisien dan akurat dikombinasikan dengan intervensi yang tepat menentukan keberhasilan suatu program reproduksi dan keuntungan yang diperoleh suatu peternakan (Pereira et al. 2013).
3 MATERI DAN METODE
Waktu dan Tempat Penelitian
Penelitian dilaksanakan bulan November 2014 sampai dengan Maret 2015 di Desa Cikande, Kabupaten Serang, Propinsi Banten.
Alat dan Bahan
Penelitian ini menggunakan 22 ekor sapi PO, yang terdiri dari 16 ekor sapi induk yang berumur 3,5 tahun, telah beranak minimal sekali dengan bobot badan 280 kg dan 6 ekor sapi dara yang berumur 2 tahun dengan bobot badan 250 kg telah dewasa kelamin yang ditandai dengan adanya CL dan tidak bunting. Keseluruhan sapi induk dan dara tidak menunjukan infeksi saluran reproduksi yang diamati dengan USG. Sapi diberikan pakan berupa ampas tahu, bran gandum, onggok, ketela dan rumput.
Penentuan Status Reproduksi
Sinkronisasi Estrus dan Ovulasi
Sapi dibagi dalam tiga kelompok perlakuan yaitu Kelompok 1 (K1) terdiri dari 5 ekor induk sapi PO disinkronisasi estrus menggunakan 2 ml PGF2α
(Noroprost®, Dinoprost 5mg/ml, Intervet, Chambridge) secara intra vulva
submucosal (ivsm) pada fase luteal. Kelompok 2 (K2) menggunakan enam ekor sapi dara disinkronisasi estrus dengan menggunakan PGF2α pada fase luteal dan
disinkronisasi ovulasi dengan diberikan hCG 1500 IU (Chorulon®, Intervet Chambridge) secara intravena (iv) pada saat estrus. Kelompok 3 (K3) dilakukan sinkronisasi ovulasi pada 11 ekor sapi induk seperti pada K2 (Gambar 1). Estrus diamati pagi dan sore hari dengan memperhatikan gejala estrus seperti vulva membengkak, memerah, mengeluarkan lendir, dan gelisah. Inseminasi buatan dilakukan pada hari pertama estrus, dan hari ke-2 jika masih terlihat gejala estrus.
IB dilakukan oleh inseminator yang sama menggunakan semen beku sapi
Simmental produksi Balai Inseminasi Buatan Lembang.
Pemeriksaan kebuntingan dilakukan dengan menggunakan USG pada hari ke-30 setelah IB terakhir. Kebuntingan ditandai dengan munculnya cairan anechoic dalam lumen uterus dan keberadaan fetus sebagai struktur hypoechoic dalam cairan amnion serta keberadaan kotiledon pada dinding uterus.
Analisis Data
Diameter CL dan diameter folikel sebelum injeksi PGF2α dan sebelum IB
pada setiap kelompok dianalisis menggunakan Rancangan Acak Lengkap
(ANOVA) dan jika berbeda nyata dilanjutkan dengan uji Duncan (α=0.05),
Buatan). PKB (Pemeriksaan Kebuntingan). hCG iv (intravena).
K1 (n=5) Induk Sinkronisasi
diameter CL dan diameter folikel sebelum injeksi PGF2α dan sebelum IB antar
kelompok perlakuan dianalisis menggunakan Uji t (Steel dan Torrie, 1995), dan
persentase conception rate dianalisis menggunakan Microsoft Excel® 2010.
4 HASIL DAN PEMBAHASAN
Sinkronisasi Estrus, Sinkronisasi Ovulasi, dan Conception Rate Sapi PO
Sinkronisasi estrus dan sinkronisasi ovulasi merupakan upaya
menyerentakkan estrus dan ovulasi pada sekelompok ternak betina agar dapat dilaksanakan kawin alam ataupun IB secara serentak. Sinkronisasi estrus dengan
PGF2α dan sinkronisasi ovulasi dengan hCG bertujuan untuk mengoptimalkan CR
hasil IB pada sapi PO. Metode tersebut diharapkan agar mendapatkan peningkatan populasi ternak lebih cepat dalam waktu yang singkat.
Gambar 4 Rata-rata diameter CL (A) dan diameter folikel (B) sebelum sinkronisasi estrus dan sebelum IB
Hasil penelitian menunjukkan adanya penurunan diameter CL setelah sinkronisasi estrus sebagai akibat dari pemberian PGF2α, yang fungsinya
meregresi CL, hal ini sesuai dengan hasil penelitian Melia (2010) pada sapi PO yang menunjukkan bahwa terdapat penurunan ukuran CL dari hari pertama setelah penyuntikan PGF2α (1.53±0.12 cm) sampai hari ke-3 (0.93±0.12 cm).
Regresi CL menyebabkan menurunnya konsentrasi P4 yang menimbulkan
negative feedback terhadap hipotalamus dan hipofisa anterior, sehingga konsentrasi GnRH meningkat. Selanjutnya pertumbuhan folikel dominan dapat
berlangsung dan meningkatkan produksi E2 sehingga memanifestasikan gejala
estrus. Peningkatan diameter folikel diikuti dengan peningkatan konsentrasi E2
yang menyebabkan feedback positive terhadap axis hipotalamus, sehingga
menimbulkan lonjakan LH yang menyebabkan ovulasi.
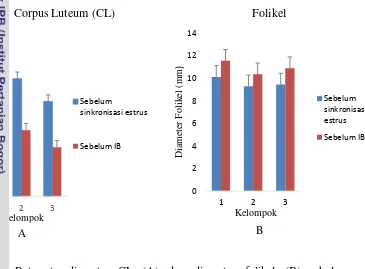
Berdasarkan hasil analisis statistika, pada tabel 1. dapat dilihat bahwa diameter CL sebelum sinkronisasi estrus pada K1, K2, dan K3 baik sapi dara maupun sapi induk tidak berbeda nyata (P>0.05), dengan rataan diameter CL adalah 16.63±3.79 mm. Setelah pemberian PGF2αterjadi proses regresi CL yang ditandai dengan penurunan diameter CL = 8.80±2.07 mm menunjukan sapi telah masuk ke fase folikuler dan menyebabkan estrus. Hal ini sesuai dengan hasil penelitian Melia (2010) pada sapi PO yang menunjukkan bahwa terdapat penurunan ukuran CL dari hari pertama setelah penyuntikan PGF2α (1.53±0.12 cm) sampai hari ke-3 (0.93±0.12 cm) dan pada saat estrus CL sudah tidak teramati lagi. Rata-rata diameter CL dan diameter folikel sebelum PGF2αdan sebelum IB
serta CR pada sapi PO disajikan pada tabel 1.
Tabel 1 Rata-rata diameter CL dan folikel saat sinkronisasi estrus (sebelum
Rerata 16.63±3.79 9.01±2.05 8.80±2.07 10.94±2.10
K1= Induk sinkronisasi estrus; K2= Dara sinkronisasi estrus+hCG; K3= Induk sinkronisasi
estrus+hCG; CL= Corpus luteum; CR= Conception rate.
Saat pemberian PGF2αmelalui ivsm, PGF2αawalnya berada pada sel-sel di
bawah kulit, bibir vulva berupa mukosa yang bergabung dengan vestibulum vagina. Mekanisme intraseluler PGF2α yang menyebabkan luteolisis adalah
vasokonstriksi pembuluh darah uteroovarian sehingga aliran darah yang menuju ke CL berkurang. Hal ini mengakibatkan iskhemia dan starvasi pada CL, iskhemia merupakan keadaan sel yang kekurangan oksigen dan starvasi merupakan keadaan sel yang kekurangan kalori, dengan demikian lisisnya CL dikontrol oleh vaskularisasi darah, transpor oksigen, nutrisi serta hormon, disamping itu hipertofi pada sel CL, hiperplasi jaringan ikat fibroblas dan vaskularisasi darah yang minim pada CL berkontribusi dalam penurunan ukuran CL (Murray et al. 1996). Lisisnya
CL disebabkan oleh mekanisme apoptosis sel, dimana PGF2α yang berikatan
dengan reseptornya yang menyebabkan aktivasi protein kinase C yang dapat menghambat sintesis kolesterol menjadi P4 (Senger, 2005).
Pemberian hormon PGF2α terhadap ternak yang berada pada fase luteal akan
efektif merangsang estrus. Menurut Laverdibre et al. (1995) persentase estrus pada saat pemberian PGF2α hari ke-7 siklus estrus mencapai 87.8%. Pemberian dua dosis PGF2α pada hari ke-5 siklus estrus menginduksi CL 95 sampai 100% (Peterson et al. 2011). Menurut penelitian Putri et al. (2013) persentase sapi estrus sapi PO setelah injeksi PGF2α pada saat fase luteal hari ke-6 sampai 16 siklus estrus mencapai 100%, sehingga pada penelitian ini digunakan USG untuk menentukan fase luteal agar setelah pemberian PGF2α dapat mencapai estrus 100%. Sejalan dengan hasil penelitian Stötzel et al. (2012) yang menyatakan bahwa pemberian PGF2α pada fase midluteal menyebabkan luteolisis sehingga konsentrasi P4 menurun, penurunan kadar P4 ini akan merangsang hipofisa anterior
melepaskan FSH dan LH, kedua hormon ini bertanggung jawab dalam proses folikulogenesis dan ovulasi, sehingga terjadi pertumbuhan dan pematangan folikel
Folikel-folikel tersebut akhirnya menghasilkan hormon E2 yang mampu
memanifestasikan gejala estrus dan lonjakan LH sehingga terjadi ovulasi 2 sampai 4 hari setelah pemberian PGF2α.
Berdasarkan hasil analisis statistika pada tabel 1. menunjukkan bahwa terjadi peningkatan diameter folikel setelah sinkronisasi estrus pada K1, K2, dan K3 baik pada sapi dara maupun pada sapi induk meskipun tidak terdapat perbedaan nyata (P>0.05). Follicle Stimulating Hormone berperan dalam proses folikulogenesis yang meliputi proses pertumbuhan dan pematangan folikel. Selama proses folikulogenesis, terjadi perkembangan folikel dalam ovarium dari sudut besarnya, jumlah lapisan sel granulosa, perkembangan sel teka interna dan eksterna, posisi sel telur di sekeliling kumulus oophorusnya, dan peningkatan volume cairan rongga folikel. Oosit berada di dalam folikel yang terdapat pada bagian korteks ovarium. Folikel mengalami berbagai tahap perkembangan yang berawal dari terbentuknya folikel primordial sampai berkembang menjadi folikel matang dan oosit siap diovulasikan (Crozet et al. 1995).
Tahap perkembangan oosit terdiri dari tiga tahap yaitu proliferasi, pertumbuhan, dan pematangan. Tahap pematangan berlangsung bersamaan dengan proses perkembangan folikel. Perkembangan oosit ditandai dengan peningkatan diameter oosit dan pertambahan ukuran dari organel-organel seperti kompleks golgi, retikulum endoplasmik halus, butir lemak, peningkatan proses transkip untuk sintesis protein. Tahap pematangan oosit ditandai dengan beberapa proses perkembangan inti oosit (Hafez and Hafez, 2000).
Pada penelitian ini presentase CR pada K1 adalah 60%, K2 adalah 16% dan K3 adalah 36%. Tingginya persentase CR pada K1 sejalan dengan hasil penelitian Peterson et al. (2011) bahwa sinkronisasi estrus dengan PGF2α yang diikuti IB 72 jam tanpa pemberian hCG mencapai angka kebuntingan 62.1%. Hal ini dapat terjadi karena secara umum waktu terjadinya estrus dan ovulasi pada sapi induk PO tidak terlalu bervariasi. Hal ini terkait dengan kondisi kesehatan sapi induk PO yang mempunyai siklus reproduksi yang teratur sehingga hasil IB dapat mencapai angka 60%.
Marquezini et al. (2011) yang menyatakan bahwa pemberian hCG pada sapi potong menghasilkan kebuntingan 38.6%, dan pemberian hCG menghasilkan
kebuntingan 36.7% (De Rensis et al. 2010). Human chorionic gonadotropin
digunakan dalam sinkronisasi ovulasi pada ternak untuk menginduksi terjadinya
ovulasi yang bersamaan sehingga dapat dilakukan IB secara serentak (Diaz et al.
1998).
Menurut Lucy et al. (1992) pada siklus estrus sapi pada fase folikuler ditemukan 2-3 gelombang folikel. Perkembangan gelombang folikel ditemukan pada saat periode metestrus dan diestrus dimana terdapat CL dari siklus estrus sebelumnya yang bersifat gonodatropin sensitif. Folikel dominan akan ditemui setelah lisisnya CL. Normalnya, ovulasi dari folikel dominan 2–3 hari setelah lisisnya CL. Sudah menjadi postulat umum bahwa hanya oosit yang telah matang yang mampu berkembang lebih lanjut membentuk embrio setelah terjadi fertilisasi, oleh karena itu tingkat kematangan oosit merupakan salah satu faktor utama keberhasilan fertilisasi. Proses pematangan oosit meliputi pematangan sitoplasma dan pematangan inti yang berhubungan dengan aktivitas sintesis RNA, pematangan inti ditandai dengan perubahan inti dari fase diploten ke MII.
Membran inti akan mengadakan penyatuan dengan vesicle membentuk Geminal
Vesicle (GV) dan kemudian akan mengalami pelepasan membran inti membentuk Germinal Vesicle Break Down (GVBD). Setelah GVBD terjadi, kromosom dibungkus oleh mikrotubulus dan mikrofilamen yang sangat mempengaruhi keberhasilan pembelahan meiosis. Oosit yang telah mengalami GVBD selanjutnya akan mencapai tahap metafase I (MI), oosit yang berada pada tahap MII merupakan oosit yang telah matang dan siap untuk dilakukan fertilisasi (Chohan and Hunter, 2003). Luteinizing Hormone sangat penting untuk maturasi oosit dan ovulasi (Shimada et al.2003).
Rendahnya persentase CR pada K3 dibandingkan dengan K1 kemungkinan diakibatkan oleh terjadinya ovulasi oosit yang belum matang dalam hal ini belum mencapai MII, dimana tingkat kematangan oosit merupakan salah satu faktor utama keberhasilan fertilisasi. Terkait dengan rendahnya persentase CR pada K3 kemungkinan disebabkan oleh adanya ovulasi sel telur yang belum mencapai tahap MII akibat percepatan pembentukan folikel dominan dengan pemberian
PGF2α diikuti dengan pemberian hCG sehingga oosit yang terovulasikan
mempunyai tingkat fertilitas yang masih rendah. Demikian pula dinyatakan oleh
Burns et al (2008) bahwa pemberian hCG menjelang IB dapat menstimulasi
ovulasi dari folikel kecil yang kemungkinan belum matang. Selain itu pemberian hCG exogenous akan bereaksi langsung terhadap folikel dominan sehingga
mempercepat proses ovulasi dibandingkan dengan LH endogenous yakni
melewati hypotalamic-pituitary axis (Filicori et al. 2005). Yavas and Wallon
(2000) juga menyatakan bahwa kemungkinandengan pemberian hCG exogenous
tidak menghasilkan pematangan folikel dominan sehingga berpotensi terhadap rendahnya angka konsepsi. Jadi, faktor yang mempengaruhi rendahnya angka CR
pada K3 adalah ketepatan waktu pemberian PGF2α berkaitan dengan tingkat
kematangan oosit.
Dikaitkan dengan angka konsepsi pada sapi dara (K2) yang diberikan hCG sebelum IB paling rendah dibandingkan dengan K1 dan K3, selain ketepatan
waktu pemberian PGF2α berkaitan dengan tingkat kematangan oosit juga
kemungkinan dapat dipengaruhi oleh kemampuan sapi dara dalam
Gambaran CL, Folikel, dan Conception Pada Sapi PO
Penggunaan USG dengan real-time mode dapat digunakan untuk
menggambarkan organ reproduksi termasuk ovarium sehingga USG dapat menggambarkan sapi tersebut berada pada fase folikuler atau fase luteal (Ginther dan Pierson 1984). Keberadaan CL dengan menggunakan teknik USG dapat diketahui secara akurat, sehingga injeksi PGF2α dapat dilakukan hanya sekali. Menurut Rovani et al. (2012) injeksi PGF2α yang dilakukan sekali penyuntikan melalui ivsm dengan dosis 5 mg pada hari ke-5 siklus estrus dapat menghasilkan estrus 68.2%.
Folikel dominan dapat dideteksi dengan menggunakan USG, sehingga pemberian hCG dapat efektif menginduksi ovulasi pada sekelompok ternak betina dan dapat dilanjutkan dengan IB. Indikasi kebuntingan diperoleh berdasarkan pengamatan pada pencitraan layar monitor USG ditandai dengan bulatan anechoic di sebelah dorsal vesika urinaria tampak kantong amnion.
Gambar 5 Gambaran USG (a) Gambar CL saat sinkronisasi estrus (b) Gambar folikel saat sinkronisasi ovulasi (c) Fetus berumur 30 hari.
Gambar 5. menunjukkan hasil pemeriksaan menggunakan USG (a) CL
menampakkan hasil sonografi hypoechoic yang merupakan warna abu-abu gelap
pada sonogram atau memperlihatkan area dengan echogenitas lebih rendah dari
pada sekelilingnya, hal ini disebabkan tingkat pemantulan gelombang (echo) yang
rendah dari struktur CL. (b) Folikel menampakkan hasil sonografi anechoic yang
5 SIMPULAN DAN SARAN
Optimalisasi CR dengan penerapan sinkronisasi estrus menggunakan PGF2α
dan sinkronisasi ovulasi menggunakan hCG lebih baik diterapkan pada populasi sapi induk agar dapat meningkatkan populasi sapi potong dengan waktu relatif singkat
DAFTAR PUSTAKA
Ahmad N, Towsend EC, Dailey RA, Inskeep EK. 1997. Relationships of hormonal patterns and fertility to occurrence of two or three waves of ovarian follicles, before and after Breeding, in Beef Cows and Heifers. Anim Reprod Sci. 49:13–28.
Amrozi, 2004. Studies of ovarian dynamics, apoptotic cells and distribution of estrogen receptor lpha in ovaries in japanese Black Cows [thesis]. Yamaguchi: The United Graduate School of Veterinary Sciences Yamaguchi University.
Astuti M. 2003. Potensi dan keragaman sumberdaya genetik sapi Peranakan
Ongole (PO). Wartazoa. 14 (4):30-39. http://www.scribd.com/doc/
6548740/sapo046. [19 November 2014].
Atmadilaga D. 1979. Politik Peternakan Indonesia. Biro Penelitian dan Aplikasi. Fakultas Peternakan. Universitas Padjajaran, Bandung.
Beal WE, Perry RC, Corah LR. 1992. The use of ultrasound in monitoring reproductive physiology of beef cattle. J. Anim. Sci, 70:924-929.
Burns MG, Buttrey BS, Dobbins CA. Martel KC, Olson, Lamb GC, Stevenson JS. 2008. Evaluation of hCG as a replacement for GnRH in ovulation-synchronization protocols before fixed time AI in beef cattle. J. Anim. Sci. 86:2539-2548.
Chohan KR and Hunter AG. 2003. Meiotic competence of bovine fetal oocytes following in vitro matangation. Anim. Reprod. Sci. 76:43-51.
Crozet N, Ali A, and Dubos MP. 1995. Developmental competence of goat oocytes from follicles of different size categories following maturation, fertilization and culture in vitro. Reprod. Fertil. 103(2):293-298.
de Medeiros SF and Norman RJ. 2006. Human chorionicgonadotrophin protein core and sugar branches heterogenety: basic and clinical insight. Hum Reprod Update. 15:69-95.
De Rensis F, Lopez-Gatius FI, Garci´a-Ispertio and Techakumpu M. 2010. Clinical use of human chorionic gonadotropin in dairy cows: An update. J. Anim.Sci. 73:1001-1008.
Diaz T, Schmitt EJ, de la Sota RL, Thatcer MJ and Thatcer WW. 1998. hCG-induced alteration in ovarian follicular dynamics during the estrous Cycle of Heifers. J. Anim.Sci. 1929:1935.
Dransfield MBG, Nebel RL, Pearson RE, Warnick LD. 1998. Timing of insemination for dairy cows identified in estrus by a radiotelemetric estrus detection system. J. Dairy Sci. 81:1874-1882.
Du Ponte WM. 2007. The basic of heat (estrus) detection in cattle. Livestock Management. University of Hawai’i at Manoa.
Filicori M, Fazleabas A, Huhtaniemi IP, Licht CV, Rao J, Tesarik MZ. 2005. Novel concepts of human chorionic gonadotropin: Reproductive system interactions and potential in the management of infertility. Fertil. Steril. 84:275–284.
Fricke PM. 2004. Reynolds LP, Redmer DA. 1993. Effect of human chorionic gonadotropin administered early in the estrous cycle on ovulation and subsequent luteal function in cows. J. Anim Sci. 71:1242-1246.
Fricke PM. 2009. Applying ultrasound tests for Managing Cows Open at Pregnancy Diagnosis. University of Wisconsin. Madison.
Goddard PJ. 1995. Veterinary Ultrasonography. Wallingford, UK: CAB
International. hlm 233-255.
Hafez ESE, Hafez B. 2000. Reproduction in Farm Animals. 7 th ed. Lea and Febiger.
Philadelphia. USA. pp. 41-46.
Ihnatsenka B dan Boezaart AP. 2010. Ultrasound: Basic understanding and learning the language. International Shoulder Journal 4(3): 55-62.
Iskandar, 2011. Performa reproduksi sapi PO pada dataran rendah dan dataran tinggi di Provinsi Jambi. J. Peternakan. 14 (1):51-61.
Jaeger JR, Whittier JC, Corah LR, Meiske JC, Olson KC, dan Patterson DJ. 1992. Reproductive response of yearling beef heifers to A melengestrol acetate Prostaglandin F2αestrus synchronization system. J.Anim. Sci. 70:2622-2627.
Kähn W. 2004. Veterinary Reproductive Ultrasonography. Die Deutsche Bibliothek. Germany.
Kasimanickam R, Duffield TF, Foster RA, Gartley CJ, Leslie KE, Walton JS, Johnson WH. 2004. Endometrial cytology and ultrasonography for the detection of subclinical endometritis in postpartum dairy cows. Theriogenology
62:9-23.
Kinder JE, Kojima FN, Bergfeld EG, Wehrman ME, Fike KE. 1996. Progestin and estrogen regulation of pulsatile LH release and development of persistent ovarian follicles in Cattle. J. Anim. Sci. 74:1424-1440.
Larson JE, Lamb GC, Stevenson JS, Johnson SK, Geary TW, Kesler DJ, Dejarnette JM, Schrick FN, DiCoztanzo A, and Arseneau JD. 2006. synchronization of estrus in suckled beef cows for detected estrous and
artificial insemination using gonadotroping-releasing hormone,
Laverdibre G, Roy G, Proulx J, Lavoie D, Dufourla JJ. 1995. Estrus synchronization effeciency of PGF2α injection in shorthorn hereford and croosbred charolais cattle not having exhibited estrus At 4 Or 7 days prior to treatment. J. Dairy Sci. 43:899-911.
Lemaster JW, Yelich JV, Kempfer JR, Fullenwider JK, Barnett CL, Fanning M, and Selph JF. 2001. Effectiveness of GnRH plus prostaglandin F2αfor estrus
synchronization in cattle of Bos indicus breeding. J. Anim. Sci. 79:309-316.
Lee J, McCracken JA., Banu SK, Rodriguez R., Nithy TK, Arosh JA, 2010. Transport of prostaglandin F(2alpha) pulses from the uterus to the ovary at the time of luteolysis in ruminants is regulated by prostaglandin
transporter-mediated mechanisms. Endocrinology. 151:3326–3335.
Lopez H, Satter LD, Wiltbank MC. 2004. Relationship between level of milk production and estrous behavior of lactating dairy cows. Anim. Reprod. Sci. 81:209-223.
Lucy MC, Savio L, Badinga RL, De La Sota, and Thatcher W. 1992. Factors that affect ovarian follicular dynamics in cattle. J. Anim. Sci. 70:3615–3626. Marquezini GH, Dahlen CR, Bird SL, and Lamb GC. 2011. Administration of
hCG to suckled beef cows before ovulation shyncronization and fixed-time insemination: replacement GnRH with hCG. J. Anim.Sci. 65:3030-3038. Melia J. 2010. Gambaran ultrasonografi organ reproduksi sapi endometritis yang
diterapi dengan kombinasi gentamicine, flumequine dan analog PGF2α
secara intra uteri. [Tesis]. Sekolah Pascasarjana, Institut Pertanian Bogor. Bogor.
Mussard ML, Burke CR, Behlke EJ, Gasser CL, Day ML. 2007. Influence of premature induction of a luteinizing hormone surge with gonadotropin-releasing hormone on ovulation, luteal function, and fertility in cattle. J. Anim. Sci. 85:937-943.
Murray RK, Granner DK, Mayes PA, Rodwell VW. 1996. Biokimia Harper. Jakarta: Buku Kedokteran EGC.
Nuryadi, Wahjuningsih S. 2011. Penampilan reproduksi sapi peranakan ongole dan peranakan limousin di kabupaten Malang. J. Ternak Tropika. 12 (1):76-81.
Narumiya S, Sugimoto Y and Ushikubi F. (1999). Prostanoid Receptors: Structures, Properties, and Functions. Physiol. Rev. 79:1193-1226.
Pfeifer LF, Leonardi CE , Castro NA, Viana JH, Siquer LG, Castilho EM, Singh J, Krusser RH, Rubin MI. 2013. The Use of PGF2α as ovulatory stimulus for timed artificial insemination in cattle. J. Dairy Sci. 81:689-695.
Perry GA, Smith MF, Lucy MC, Green JA, Parks TA, MacNeil MD, Roberts AJ,Geary TW. 2005. Relationship between follicle size at insemination and pregnancy success. PNAS 14 (102): 5268-5273.
Pereira RV, Caixeta LS, Giordano JO, Guard C, Bicalho RC. 2013. Reproductive performance of dairy cows resynchronized after pregnancy diagnosis at 31 (±3 days) after artificial insemination (AI) compared with resynchronization At 31 (±3 days) after AI with pregnancy diagnosis at 38 (±3 days) after AI. J. Dairy Sci. 96:7630-7639.
Pierson RA, Ginther OJ. 1984. Ultrasonography of the Bovine Ovary. J. Dairy Sci. 21(3):495-504
Putri NA, Suharyati S, Santosa EP. 2013. Pengaruh paritas terhadap persentase estrus dan kebuntingan sapi peranakan ongole yang disinkronisasi estrus menggunakan prostaglandin F2 alfa. Ditjennak. 31-36.
Price CA and Webb R. 1989. Ovarian Response to hCG treatment during the oestrous cycle in heifers. J Reprod Fertil. 86:303–308.
Rao S, Kumar N, Kumar P, Chaurasia S, Patel B, 2013. Heat detection techniques in cattle and buffalo: Areview. Vet. World. 6 (6):363-369.
Rovani MT, Barreta MH, Ferreira R, Gasperin BG, Antoniazzi AQ, Festugatto
R,Oliveira JFC, Gonc-alves PBD. 2012. Luteolysis after the
intravulvosubmucosal injection of prostaglandin F2a in cattle: Systemic or local mechanism. J. Dairy Sci. 148:60-66.
Saldarriaga JP, Cooper DA, Cartmill JA, Zuluaga JF, Stanko RL, Williams GL. 2007. Ovarian, hormonal, and reproductive events associated with
synchronization of ovulation and timed appointment breeding of Bos
indicus influenced cattle using intravaginal progesterone, gonadotropin releasing hormone, and PF2α. J. Anim. Sci. 85:151-162.
Salverson R dan Perry G. 2007. Understanding estrus synchronization of cattle. South Dakota State University-Cooperative Extansion Service-USDA, Pp 1-6.
Santos JE, Narciso CD, Rivera F, Thatcher WW, Chebel RC. 2010. Effect of reducing the period of follicle dominance in a timed artificial insemination protocol on reproduction of dairy cows. J. Dairy Sci. 93:2976-2988.
Schmitt EJ, Barros CM, Fields PA, Fields MJ, Diaz T, Kluge JM, Thatcher WW. 1996. A cellular and endocrine characterization of the original and induced corpus luteum after administration of a gonadotropin releasing hormone agonist or human chorionic gonadotropin on day 5 of the estrous cycle. J Anim Sci. 74:1915-1929.
Senger PL. 2005. Reproductive cyclicity–the follicular phase. In: Pathways toPregnancy and Parturition. 2nd Revised Edition. Washington State University Research & Technlogy Park. Current Conceptions, Inc. p.164-187.
Shimada M, NishiboriM, Isobe N, Kawano N, Terada T. 2003. Luteinizing hormone receptor formation in cumulus cells surrounding porcine oocytes and its role during meiotic maturation of porcine oocytes. Biol. Reprod. 68:1142-1149.
Soenarjo 1983. Beberapa faktor penyebab rendahnya efesiensi reproduksi dan usaha meningkatkannya pada ternak sapi betina peranakan ongole di daerah inseminasi buatan. Institut Pertanian Bogor. Bogor.
Stenman UH, Tiitinen A, Alfthan H, Valmu L. 2006. The classification, functions
and clinical use of different isoforms of hCG. Hum ReprodUpdate
12:769-784.
Toelihere MR. 1984. Fisiologi Reproduksi Pada Ternak. Bandung: Penerbit Angkasa. hlm 130-149.
Troxel R, 1995. Artificial insemination: University of Arkansas, United States Department of Agriculture, and County Governments Cooperating. Hlm 1-8.
Twagiramungu H, Guilbault LA, and Dufour J J. 1995. Synchronization of ovarian follicular waves with a gonadotropin-releasing hormone agonist to increase the precision of estrus in cattle: A review. J. Anim. Sci. 73:3141-3151.
Valldecabres X, Torres AG, García RE, Cuervo AJ. 2013. Use of a split or single prostaglandin F2α treatment in a 6-Day. J. Dairy Sci. 96:1647-1652.
Vallecabres-Torres X, Garcia-Rosello E, Garcia-Munoz A, Cuervo-Arango J. 2012. Effects of d-cloprostenol dose and corpus luteum age on ovulation, luteal function and morphology in nonlactating dairy cows with early corpora lutea. 95(8): 4389–4395.
Lampiran 1 Diameter Corpus Luteum (CL), Folikel (Fol) sebelum dan setelah
Sinkronisasi estrus dengan PGF2α serta dengan atau tanpa
sinkronisasi ovulasi (hCG) diikuti dengan Inseminasi Buatan dan Pemeriksaan kebuntingan setelah 30 hari setelah IB.
RIWAYAT HIDUP
Penulis dilahirkan di Paria pada tanggal 30 Januari 1990, anak ketiga dari empat bersaudara yang merupakan puteri dari pasangan A. Emme (ayah) dan Siti Rachmatan (Ibu).
Pada tahun 2008 Penulis lulus dari SMA Negeri 1 Majauleng dan pada tahun yang sama lulus Seleksi Nasional Masuk Perguruan Tinggi Negeri (SNMPTN) pada Program Pendidikan Biologi Fakultas Matematika dan Ilmu Pengetahuan Alam (MIPA) Universitas Negeri Makassar (UNM) hingga memperoleh gelar Sarjana pada tahun 2012.