KERAGAMAN JENIS
Puntius
spp. ASAL PERAIRAN
DI HUTAN HARAPAN JAMBI
ARREZA HAMSYAH FERNANDA
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa skripsi berjudul Keragaman Jenis
Puntius spp. asal Perairan di Hutan Harapan Jambi adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, September 2014
Arreza Hamsyah Fernanda
ABSTRAK
ARREZA HAMSYAH FERNANDA. Keragaman Jenis Puntius spp. asal Perairan di Hutan Harapan Jambi. Dibimbing oleh DEDY DURYADI SOLIHIN dan TEDJO SUKMONO.
Jenis Puntius spp. memperlihatkan pertambahan yang signifikan setiap tahunnya karena adanya jenis baru yang ditemukan. Penggunaan data molekuler diharapkan dapat memperkuat dalam menentukan dan mengungkap adanya jenis kriptik dan jenis baru dari Puntius di wilayah Hutan Harapan Jambi. Penelitian ini dilakukan untuk mengetahui tingkat keragaman Puntius spp. berdasarkan karakter morfologi dan molekuler. Pengambilan data morfologi dilakukan dengan mengidentifikasi karakter meristik dan mengukur karakter morfometri. Data molekuler diperoleh dengan menganalisis gen mitokondria cytochrome c oxidase subunit I (COI) secara parsial sebagai barcode. Jenis Puntius yang teridentifikasi di antaranya Puntius binotatus, Puntius tetrazona, Puntius lateristriga, Puntius gemellus, Puntius lineatus, dan Puntius sp. “Harapan”. Penentuan jenis tersebut
didasarkan atas identifikasi corak tubuh dengan diperkuat oleh data molekuler. Hasil analisis morfometri menunjukkan pembagian Puntius spp. dalam 2 kelompok pada pohon filogeni dengan sebesar 0.114. Perbedaan nukleotida berkisar antara 4 bp hingga 118 bp dari total 709 bp.
Kata kunci: cytochrome c oxidase subunit I (COI), keragaman, morfologi, pohon filogeni, Puntius spp.
ABSTRACT
ARREZA HAMSYAH FERNANDA. Diversity of Puntius spp. from body water in Harapan Rainforest Jambi. Supervised by DEDY DURYADI SOLIHIN and TEDJO SUKMONO.
The species of Puntius spp. showed a significant increase each year because of the new species addition. The use of molecular data was expected to strengthen in the disclosure and determination of new species and cryptic species of Puntius spp. in Harapan Rainforest Jambi. This research was conducted to determine the Puntius
spp. diversity based on morphological and molecular characteristics. The morphological data obtained by identifying the meristic charactersand measuring the morphometric characters. The molecular data obtained by analyzing the mitochondrial gene cytochrome c oxidase subunit I (COI) partially as barcode. The species of Puntius that has been identified were Puntius binotatus, Puntius tetrazona,Puntius lateristriga, Puntius gemellus, Puntius lineatus, and Puntius sp. “Harapan”. Species determination was based on the identification with the body style reinforced by molecular data. The results of morphometric analysis showed that the distribution of Puntius spp. divided in 2 clades in phylogeny tree with distance is 0.114. Nucleotide differences ranged from 4 bp to 118 bp from the total 709 bp.
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains
pada
Departemen Biologi
KERAGAMAN JENIS
Puntius
spp. ASAL PERAIRAN DI
HUTAN HARAPAN JAMBI
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
BOGOR 2014
Judul Skripsi : Keragaman Jenis Puntius spp. asal Perairan di Hutan Harapan Jambi
Nama : Arreza Hamsyah Fernanda NIM : G34100037
Disetujui oleh
Dr Ir Dedy Duryadi Solihin, DEA Pembimbing I
Tedjo Sukmono, SSi, MSi Pembimbing II
Diketahui oleh
Dr Ir Iman Rusmana, MSi Ketua Departemen
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah SWT atas segala karunia-Nya sehingga skripsi ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan Oktober 2013 hingga Mei 2014 ini adalah keanekaragaman ikan, dengan judul Keragaman Jenis Puntius spp. asal Perairan di Hutan Harapan Jambi.
Terima kasih penulis ucapkan kepada Bapak Dr Ir Dedy Duryadi Solihin, DEA dan Bapak Tedjo Sukmono, SSi, MSi selaku pembimbing, Bapak Prof Dr Ir Alex Hartana MSc selaku penguji serta Bapak Dr Uus Saepuloh SSi, MBiomed yang telah banyak memberi ilmu dan saran serta kesempatan untuk melaksanakan penelitian di Laboratorium Bioteknologi Pusat Studi Satwa Primata. Penghargaan penulis sampaikan kepada Bapak Ramdan, Ibu Elis, dan Ibu Sela dari Pusat Studi Satwa Primata IPB, Bapak Alfred dan Bapak Taher dari Program Pasca Sarjana Biosains Hewan IPB, Helmiyati dari Departemen Gizi IPB serta teman-teman di Laboratorium Biologi Molekuler PAU IPB yang telah membantu selama penelitian. Ungkapan terima kasih khusus disampaikan kepada ayah, ibu, seluruh keluarga, dan teman-teman IPB angkatan 2010 atas segala doa dan kasih sayangnya.
Semoga skripsi ini bermanfaat.
Bogor, September 2014
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR GAMBAR vi
DAFTAR LAMPIRAN vi
PENDAHULUAN 1
Latar Belakang 1
Tujuan Penelitian 2
METODE 2
Bahan 3
Alat 3
Prosedur Pelaksanaan Penelitian 3
HASIL DAN PEMBAHASAN 7
SIMPULAN 14
DAFTAR PUSTAKA 14
DAFTAR TABEL
1 Karakter meristik untuk identifikasi Puntius spp. 3
2 Karakter morfometri yang diukur 4
3 Penghitungan ukuran tubuh relatif Puntius spp. 5
4 Matriks jarak morfometri 8
5 Factor loading atribut ukuran tubuh relatif 9
6 Matriks perbedaan nukleotida (bp) p-distance gen COIPuntius spp. 11 7 Matriks jarak genetik p-distance gen COIPuntius spp. 11 8 Hasil blastn sekuen COI Puntius spp. terhadap data sekuen pada GenBank 13
DAFTAR GAMBAR
1 Skema pengukuran terhadap sampel 5
2 Kunci identifikasi Puntius spp. 7
3 Pohon filogeni hubungan kekerabatan jenis Puntius spp. berdasarkan analisis
morfometri 14 ukuran tubuh relatif 8
4 Hasil amplifikasi gen COI dalam gel agarosa 1.8 % 10
5 Posisi penempelan primer fish F1 dan fish R1 10
6 Konstruksi pohon filogeni Puntius spp. dari sekuen 709 bp COIPuntius spp.
dengan metode NJ 12
DAFTAR LAMPIRAN
1 Gambar sampel Puntius spp. 18
PENDAHULUAN
Latar Belakang
Indonesia memiliki kekayaan jenis ikan yang sangat tinggi. Sebanyak 8500 jenis ikan diperkirakan hidup di wilayah perairan Indonesia. Jumlah tersebut merupakan 45% dari total jenis ikan yang ada di dunia. Kottelat dan Whitten (1996) menyebutkan bahwa dari total 8500 jenis ikan, 1300 jenis di antaranya menempati wilayah perairan tawar. Menurut Wargasasmita (2002) terdapat 589 jenis ikan air tawar penghuni ekosistem perairan tawar Sumatera dengan 58 jenis termasuk kelompok ikan endemik dan 14 jenis terancam punah. Tempat-tempat yang berpotensi menghadirkan keanekaragaman ikan air tawar di antaranya sungai, rawa, dan danau yang terdapat di kawasan Hutan Harapan Jambi yang menjadi lokasi pengambilan sampel dalam penelitian ini.
Hutan Harapan merupakan kawasan restorasi ekosistem pertama dan terbesar pada areal hutan hujan tropis di Indonesia. Arealnya merupakan bekas wilayah hak pengelolaan hutan (HPH) PT Asialog dan PT Inhutani V. Kawasan Hutan Harapan memiliki berbagai tipe ekosistem perairan seperti sungai besar berarus lemah, danau, dan rawa banjiran. Kerusakan ekosistem di kawasan ini kemudian mengalami proses pemulihan dari kegiatan restorasi yang secara langsung dapat mempengaruhi struktur dan komposisi hewan termasuk ikan air tawar yang terdapat di dalamnya. Namun, penelitian yang membahas mengenai keanekaragaman ikan air tawar di Hutan Harapan Jambi masih sedikit dilakukan (Sukmono et al. 2013).
Muchlisin dan Azizah (2009) menjelaskan bahwa degradasi habitat menyebabkan turunnya kekayaan jenis dan keanekaragaman ikan. Eksplorasi biodiversitas ikan air tawar di Hutan Harapan Jambi dilakukan dalam mendukung kegiatan restorasi dan konservasi. Salah satu marga ikan di Hutan Harapan Jambi yang patut mendapat perhatian untuk dianalisis keragamannya adalah Puntius
(Sukmono et al. 2013).
Puntius adalah marga ikan air tawar yang termasuk dalam ordo
Cypriniformes dan famili Cyprinidae (Nelson 1994). Puntius termasuk bagian terbesar dari ikhtiofauna yang terdapat di Asia Tenggara dengan variasi dalam corak tubuh dan ukuran (Moghaddam et al. 2012). Secara geografis, keragaman marga
Puntius tersebar di wilayah Asia tropis. Jayaram (1991) melaporkan bahwa Puntius
memiliki keragaman berjumlah 53 jenis yang terdistribusi di seluruh India, Nepal, Bangladesh, Sri Lanka, Myanmar, Thailand, Semenanjung Malaya, kepulauan di Asia Tenggara, dan China bagian selatan. Jumlah jenis Puntius spp. memperlihatkan pertambahan yang signifikan setiap tahunnya karena adanya jenis baru yang ditemukan (Pethiyagoda et al. 2012). Froese dan Pauly (2013) mencatat bahwa jumlah jenis Puntius di dunia mencapai 139 jenis. Weber dan Beaufort (1916) menandaskan bahwa Indonesia sebagai negara di wilayah distribusi Puntius
mempunyai kekayaan Puntius sebanyak 33 jenis.
Puntius umumnya dimanfaatkan sebagai ikan hias atau konsumsi. Puntius
2
ke arah samping tidak melengkung ke belakang, dan tidak terdapat tonjolan keras (Kottelat et al. 1993).
Hasil temuan Puntius spp. di Hutan Harapan Jambi oleh Sukmono et al.
(2014) menjelaskan adanya kemiripan morfologi pada beberapa jenis. Berdasarkan kemiripan karakter morfologinya, jenis-jenis tersebut adalah Puntius gemellus, Puntius lineatus, dan Puntius sp. yang sama-sama memiliki pola garis horizontal yang berjumlah 5 pada sisi tubuh.
Seiring dengan perkembangan di bidang biologi molekuler, kajian mengenai identifikasi dan filogenetika secara molekuler pun dikembangkan mengingat data morfologi tidak cukup kuat untuk menjadi satu-satunya dasar klasifikasi. Hal tersebut perlu dilakukan karena organisme yang berkerabat jauh dapat memiliki morfologi yang serupa (jenis kriptik) akibat adanya proses adaptasi maupun evolusi sehingga berpeluang menimbulkan kesalahan dan konflik taksonomi. Penggunaan data molekuler diharapkan dapat memperkuat dalam menentukan dan mengungkap adanya jenis kriptik dan jenis baru dari Puntius di wilayah Hutan Harapan Jambi (Avise 1994).
Salah satu cara yang digunakan untuk melihat keragaman dan identitas suatu jenis di tingkat molekuler adalah dengan menganalisis gen mitokondria cytochrome oxidase subunit I (COI) secara parsial sebagai DNA barcode (Hebert et al. 2003). DNA barcoding menggunakan gen COI dapat memberikan metode yang efisien untuk identifikasi pada tingkat jenis serta berperan penting dalam penelitian taksonomi dan keanekaragaman hayati (Hajibabaei et al. 2007).
Upaya untuk menganalisis keragaman berbagai jenis Puntius spp. dirasa perlu guna mengetahui identitas dan pola kekerabatan jenis-jenis yang secara morfologi menunjukkan kemiripan. Analisis keragaman jenis Puntius spp.tersebut dilakukan dengan menerapkan metode identifikasi morfologi dan identifikasi molekuler.
Tujuan Penelitian
Penelitian ini bertujuan menganalisis keragaman dan kekerabatan ikan jenis
Puntius spp. yang berasal dari perairan di Hutan Harapan Jambi berdasarkan karakter morfologi dan molekuler.
METODE
Penelitian dilakukan di Laboratorium Bioteknologi Pusat Studi Satwa Primata dan Laboratorium Biologi Makro Departemen Manajemen Sumber Daya Perairan Institut Pertanian Bogor. Dua jenis pendekatan yang digunakan dalam penelitian ini adalah identifikasi morfologi dan DNA barcoding. Metode identifikasi morfologi dilakukan dengan menganalisis identitas berdasarkan karakter meristik dan morfometri Puntius spp. Metode DNA barcoding
3
Bahan
Bahan utama yang digunakan adalah sampel jenis Puntius spp. yang merupakan koleksi Tedjo Sukmono hasil eksplorasi di Hutan Harapan Jambi pada tahun 2012 dan 2013. Sampel jenis Puntius spp. yang dikumpulkan untuk dianalisis secara morfologi berjumlah 144 ekor sedangkan sampel yang dianalisis secara molekuler berjumlah 7 ekor.
Bahan pendukung penelitian yang digunakan adalah kit ekstraksi, kit purifikasi, phosphate buffer saline (PBS), etanol absolut, etanol 70%, master mix
PCR, Primer FishF1 (forward) (5’ -TCAACCAACCACAAAGACATTGGCAC-‘3) dan FishR1 (reverse) (5’-TAGACTTCTGGGTGGCCAAAGAATCA-’3) (Ward et al. 2005), nuclease free water,gel agarose, bufer 1x TAE, ladder, loading dye, isopropanol, dan etidium bromida.
Alat
Peralatan yang digunakan untuk pengukuran morfometri adalah kaliper dengan ketelitian 0.01 mm, pinset, pisau, loop, dan plastik sampel. Alat-alat seperti inkubator, laminar cabinet, tabung ependorf, mesin PCR, mesin elektroforesis, mesin sentrifuse, pipet mikro, mesin vortex, pemanas air, gel doc UV, tabung mikro, tabung 1.5 mL, tabung sentrifuse, dan tabung screw up digunakan untuk analisis molekuler.
Prosedur Pelaksanaan Penelitian
Identifikasi karakter meristik jenis Puntius spp.
Sampel Puntius spp. dianalisis berdasarkan 4 karakter meristik (Kottelat et al. 1993; Weber dan Beaufort 1916). Empat karakter tersebut terdiri dari jumlah sungut, corak tubuh, sisik melintang badan, dan bentuk gurat sisi (Tabel 1).
Tabel 1 Karakter meristik untuk identifikasi Puntius spp. No Karakter Keterangan
1 Jumlah sungut Banyaknya sungut pada bagian moncong.
2 Corak tubuh Jumlah dan pola garis atau pita berwarna hitam yang ada pada sisi tubuh serta warna dasar tubuh.
3 Sisik melintang badan
Banyaknya sisik diatas gurat sisi hingga pangkal sirip punggung dan di bawah gurat sisi hingga pangkal sirip perut.
4 Bentuk gurat sisi Sempurna atau tidak sempurna.
4
Pengukuran karakter morfometri
Sampel yang telah dikelompokkan dari proses identifikasi kemudian diukur karakter morfometrinya. Karakter yang diukur dari setiap sampel meliputi 15 karakter (Hubbs dan Lagler 1958) (Tabel 2). Lima belas karakter diterapkan pada pengukuran tubuh Puntius spp. (Haryono 2005) (Gambar 1)
Tabel 2 Karakter morfometri yang diukur
No Karakter Keterangan
1 Panjang total (PT) Ukuran tubuh terpanjang, diukur dari mulai moncong terdepan hingga ujung sirip ekor paling belakang.
2 Panjang baku (PB) Jarak antara moncong terdepan hingga pangkal sirip ekor.
3 Panjang kepala (PK) Jarak antara antara moncong terdepan hingga bagian paling belakang operkulum.
4 Lebar kepala (LK) Jarak paling lebar antara kedua operkulum. 5 Tinggi badan (TB) Jarak tertinggi antara bagian pangkal awal sirip
punggung dengan bagian perut pangkal awal sirip perut.
6 Panjang depan sirip punggung (PDP)
Jarak antara ujung moncong terdepan hingga awal sirip punggung.
7 Panjang pangkal sirip punggung (PPP)
Jarak antara pangkal jari-jari pertama dengan jari-jari sirip terakhir pada sirip punggung. 8 Panjang sirip dada (PSD) Jarak antara pangkal sirip hingga jari-jari
terpanjang pada sirip dada.
9 Panjang sirip perut (PSP) Jarak antara pangkal sirip hingga jari-jari sirip terpanjang pada sirip perut.
10 Panjang moncong (PM) Jarak antara ujung moncong terdepan hingga sisi terdepan diameter mata.
5
Gambar 1 Skema pengukuran terhadap sampel
Data morfometri 15 karakter pada setiap sampel kemudian dihitung nilai rata-ratanya per kelompok yang telah ditentukan. Nilai rata-rata digunakan sebagai ukuran pemusatan data karena jumlah anggota Puntius spp. pada setiap kelompok berbeda. Data morfometri rata-rata selanjutnya dibuat dalam bentuk ukuran tubuh relatif mengacu pada Soewardi et al. (1995). Ukuran tubuh relatif dibuat untuk mengatasi ketimpangan data yang dihasilkan dari 15 karakter morfometri akibat adanya perbedaan umur dan jenis kelamin pada sampel Puntius spp. Ukuran tubuh relatif diperoleh dengan membagi seluruh peubah karakter morfometri dengan karakter panjang baku (PB), sehingga data yang dihasilkan menjadi 14 peubah (Tabel 3). Ukuran tubuh relatif tersebut kemudian diolah dengan analisis gerombol dan analisis komponen utama (PCA).
Tabel 3 Penghitungan ukuran tubuh relatif Puntius spp.
Identifikasi karakter molekuler
1. Isolasi dan ekstraksi DNA Sampel jaringan diisolasi dari otot sirip dada sebelah kanan sebanyak 7 sampel Puntius spp. Selanjutnya dilakukan pencacahan dengan pisau. Proses ekstraksi DNA menggunakan kit ekstraksi DNeasy dari Qiagen. Ekstraksi mengikuti protokol dari kit ekstraksi (Lampiran 2).
2. Amplifikasi DNA Amplifikasi ruas gen COI dilakukan dengan metode
Polymerase Chain reaction (PCR) pada mesin Thermocycler Biorad
Peubah Ukuran tubuh relatif Peubah Ukuran tubuh relatif
N1 PT/PB N8 TSP/PB
N2 PK/PB N9 PSD/PB
N3 PM/PB N10 PSP/PB
N4 DM/PB N11 TSD/PB
N5 LK/PB N12 PBE/PB
N6 PDP/PB N13 TBE/PB
6
menggunakan primer FishF1 (forward) dan primer FishR1 (reverse) yang menghasilkan segmen berukuran 657 bp. Reaksi PCR dilakukan dalam volume 25 μL yang berisi master mix PCR (12.5μL), primer FishF1 (1 μL), primer FishR1 (1 μL), nuclease free water (5.5 μL), dan DNA template (5 μL). PCR dilakukan sesuai dengan metode amplifikasi Hebert et al. (2003) yang telah dimodifikasi, yaitu pra denaturasi pada suhu 94 oC selama 5 menit, denaturasi pada suhu 94 oC selama 30 detik, annealing pada suhu 52 oC selama 30 detik, ekstensi pada suhu 72 oC selama 30 detik dilakukan sebanyak 40 siklus, serta tahap pascaekstensi dengan suhu 72 oC selama 5 menit.
3. Visualisasi DNA hasil amplifikasi DNA hasil amplifikasi kemudian dianalisis dengan elektroforesis pada gel agarosa 1.8%. Proses elektroforesis menggunakan tegangan konstan 100 volt selama 45 menit. Hasil elektroforesis selanjutnya divisualisasi menggunakan Gel Doc UV. Hasil positif memperlihatkan pita DNA yang teramplifikasi sekitar sekitar 700 bp.
4. Purifikasi DNA hasil amplifikasi DNA hasil PCR yang sesuai dengan target kemudian dilakukan purifikasi. Purifikasi mengikuti protokol yang tertera pada kit purifikasi dari Qiagen (Lampiran 3).
5. Sekuensing DNA hasil amplifikasi Proses sekuensing dilakukan di First BASE Laboratories Inc. Malaysia. Sekuen yang diperoleh dari hasil sekuensing dalam 2 bentuk yaitu sekuen forward dan sekuen reverse.
Analisis data morfometri
Data ukuran tubuh relatif dari setiap kelompok Puntius spp. selanjutnya digunakan untuk menjelaskan identitas, keragaman, dan pola kekerabatan. Data dianalisis menggunakan program XLstat 2014. Tipe analisis yang digunakan adalah analisis gerombol dan analisis komponen utama (PCA) (Mattjik dan Sumertajaya 2011).
Analisis data molekuler
Sekuen mtDNA COI yang terdiri dari sekuen forward dan sekuen reverse
7
HASIL DAN PEMBAHASAN
Identifikasi karakter meristik Puntius spp.
Karakter yang diidentifikasi merupakan karakter khusus dari setiap jenis. Hasil identifikasi menemukan adanya 7 kelompok Puntius spp. (Lampiran 1). Identifikasi Puntius spp. mengacu pada kunci identifikasi Kottelat et al. (1993) serta Weber dan Beaufort (1916) yang telah dimodifikasi (Gambar 2).
Gambar 2 Kunci identifikasi Puntius spp.
Pembagian Puntius tetrazona-1 dan Puntius tetrazona-2 ditunjukkan pada determinasi kesembilan (Gambar 2). P. tetrazona-1 dan P. tetrazona-2 dibedakan oleh warna badan. P. tetrazona-1 memiliki warna badan kekuningan sedangkan P. tetrazona-2 memiliki warna kekuning-kuningan. Deskripsi karakter Puntius sp. menunjukkan karakter baru dari jenis Puntius. Puntius sp. memiliki banyak kesamaan dengan P. lineatus berdasarkan karakter meristik. Keduanya dipisahkan pada determinasi kesebelas. Corak garis horizontal kedua dan ketiga yang bersambung menjadi karakter yang mencolok untuk membedakan Puntius sp. dengan P. lineatus.
Hasil identifikasi menjelaskan bahwa di antara anggota Puntius spp. dapat dibedakan satu dengan yang lainnya berdasarkan 4 karakter khusus seperti jumlah sungut, sisik melintang badan, bentuk gurat sisi, dan corak tubuh. Corak tubuh merupakan karakter yang terpenting dari total 4 karakter yang diidentifikasi. Jumlah dan bentuk pola garis atau pita pada tubuh merupakan petunjuk khas dari morfologi
8
Analisis gerombol terhadap pengelompokkan Puntius spp.
Analisis gerombol dan analisis komponen utama terhadap Puntius spp. didasarkan pada 14 ukuran tubuh relatif. Hasil analisis pada filogeni yang terbentuk menunjukkan 2 kelompok besar yaitu ingroup (Puntius spp.) dan outgroup (C. striata) yang dipisahkan oleh jarak ketidaksamaan morfometri sebesar 0.551 (Gambar 3).
Gambar 3 Pohon filogeni hubungan kekerabatan jenis Puntius spp. berdasarkan analisis morfometri 14 ukuran tubuh relatif
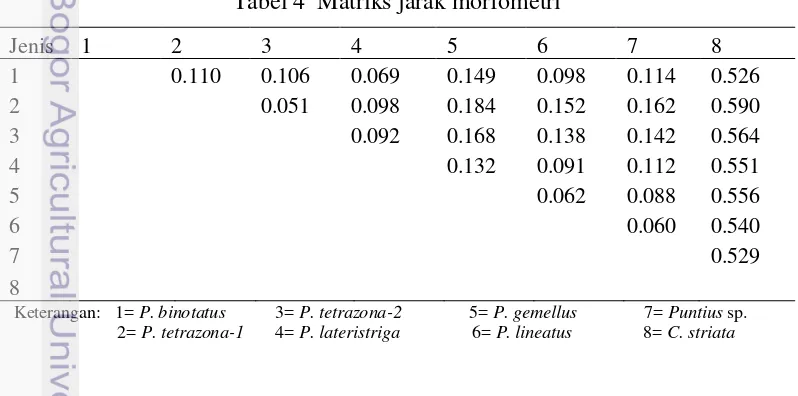
Pada kelompok ingroup memperlihatkan adanya pembagian dalam 2 subkelompok dengan jarak morfometri sebesar 0.114. Subkelompok pertama terdiri dari P. lateristriga, P. binotatus, P. tetrazona-1, dan P. tetrazona-2 sedangkan subkelompok kedua terdiri dari Puntius sp., P. lineatus, dan P. gemellus. Subkelompok pertama terbagi lagi dalam 2 kelompok kecil dengan jarak morfometri sebesar 0.088. Kelompok pertama terdiri dari P. lateristriga dan P. binotatus sedangkan kelompok kedua terdiri dari P. tetrazona-1 dan P. tetrazona-2. Subkelompok kedua terbagi dalam 2 kelompok kecil dengan jarak morfometri sebesar 0.075. Kelompok pertama terdiri dari Puntius sp. dan P. lineatus sedangkan kelompok kecil kedua berisi P. gemellus (Tabel 4).
Tabel 4 Matriks jarak morfometri
Jenis 1 2 3 4 5 6 7 8
1 0.110 0.106 0.069 0.149 0.098 0.114 0.526
2 0.051 0.098 0.184 0.152 0.162 0.590
3 0.092 0.168 0.138 0.142 0.564
4 0.132 0.091 0.112 0.551
5 0.062 0.088 0.556
6 0.060 0.540
7 0.529
8
Keterangan: 1= P. binotatus 3= P. tetrazona-2 5= P. gemellus 7= Puntius sp. 2= P. tetrazona-1 4= P. lateristriga 6= P. lineatus 8= C. striata
9
Analisis komponen utama terhadap 14 ukuran tubuh relatif Puntius spp.
Hasil analisis komponen utama menghasilkan nilai keragaman sebesar 81.92% (Lampiran 4). Jumlah komponen utama (PC1-PC7) yang dijadikan faktor untuk menjelaskan data bergantung pada nilai eigenvalue yang lebih besar dari 1 (Solimun 2013). Nilai eigenvalue yang lebih besar dari 1 diperlihatkan oleh komponen utama 1 (PC1), 2 (PC2), dan 3 (PC3). Persentase kumulatif keragaman untuk menyusun factor loading adalah lebih besar atau sama dengan 75%. Komponen utama 1 dan komponen utama 2 memiliki nilai kumulatif keragaman sebesar 81.92% (Lampiran 5). Nilai kumulatif keragaman 1 dan keragaman 2 tersebut sudah cukup untuk mewakili standar keragaman (Supranto 2004). Oleh karena itu, factor loading yang digunakan untuk menganalisis atribut ukuran tubuh relatif adalah faktor 1 (F1) dan faktor 2 (F2) (Tabel 5).
Tabel 5 Factor loading atribut ukuran tubuh relatif
Nilai tertinggi dari faktor 1 diperlihatkan oleh N10 (0.972) dan nilai tertinggi dari faktor 2 diperlihatkan oleh N2 (0.824) (Tabel 5). Peubah N10 yaitu panjang moncong dan peubah N2 yaitu panjang kepala merupakan karakter yang sangat berpengaruh pada analisis komponen utama. Dua karakter tersebut berpengaruh terhadap pengelompokkan dan keragaman Puntius spp. (Supranto 2004).
Identifikasi karakter molekuler berdasarkan gen mtDNA COI
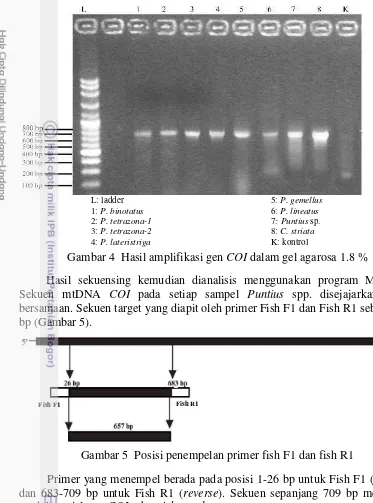
Hasil amplifikasi total gen COI target menunjukkan ukuran nukleotida yang panjangnya sekitar 700 bp (Gambar 4). Ukuran nukleotida ditentukan dengan membandingkan skala pada ladder.
Peubah F1 F2 Peubah F1 F2
N1 0.824 0.005 N8 0.780 -0.568
N2 -0.214 0.824 N9 0.627 0.739
N3 0.443 0.073 N10 0.972 0.042
N4 0.891 0.000 N11 0.930 0.189
N5 0.676 0.527 N12 0.685 -0.621
N6 0.951 -0.176 N13 0.923 0.236
10
L: ladder 5: P. gemellus
1: P. binotatus 6: P. lineatus
2: P. tetrazona-1 7: Puntius sp.
3: P. tetrazona-2 8: C. striata
4: P. lateristriga K: kontrol
Gambar 4 Hasil amplifikasi gen COI dalam gel agarosa 1.8 %
Hasil sekuensing kemudian dianalisis menggunakan program MEGA 5. Sekuen mtDNA COI pada setiap sampel Puntius spp. disejajarkan secara bersamaan. Sekuen target yang diapit oleh primer Fish F1 dan Fish R1 sebesar 657 bp (Gambar 5).
Gambar 5 Posisi penempelan primer fish F1 dan fish R1
Primer yang menempel berada pada posisi 1-26 bp untuk Fish F1 (forward) dan 683-709 bp untuk Fish R1 (reverse). Sekuen sepanjang 709 bp merupakan model parsial gen COI sebagai barcode.
Perbedaan nukleotida dan jarak genetik
Perbedaan nukleotida antarjenis Puntius spp. berkisar antara 4-118 bp (Tabel 6). Perbedaan nukleotida yang paling kecil ditunjukkan antara P. tetrazona-1 dan P. tetrazona-2 sebesar 4 bp. Jarak kekerabatan antaranggota dalam kelompok ditentukan dengan jarak genetik yang terbentuk melalui model p-distance (Tabel 7).
11 Tabel 6 Matriks perbedaan nukleotida (bp) p-distance gen COIPuntius spp.
Jenis 1 2 3 4 5 6 7 8
Tabel 7 Matriks jarak genetik p-distance gen COIPuntius spp.
Jenis 1 2 3 4 5 6 7 8
Secara keseluruhan dari 709 bp sekuen yang disejajarkan, terdapat 515 bp situs mtDNA COI Puntius spp. yang conserved dan 194 bp situs mtDNA COI
Puntius spp. yang variatif. Tamura dan Kumar (2002) menjelaskan bahwa beberapa
penyebab keragaman nukleotida disebabkan oleh adanya substitusi, delesi, dan insersi. Sekuen DNA Puntius spp. yang telah dilakukan penyejajaran menunjukkan beberapa situs yang mengalami insersi, delesi, maupun substitusi (Lampiran 6).
Pohon filogeni
Hasil konstruksi pohon filogeni mengelompokkan 7 jenis sampel Puntius spp. dalam 2 kelompok yaitu kelompok ingroup (Puntius spp.) dan kelompok outgroup
(C. striata) (Gambar 6). Dua kelompok tersebut dipisahkan oleh jarak genetik sebesar 0.100. Kelompok ingroup dibagi menjadi 2 subkelompok. Subkelompok pertama terdiri dari P. tetrazona-1 dan P. tetrazona-2 sedangkan subkelompok kedua terdiri dari P. lateristriga, P. binotatus, P. gemellus, Puntius sp., dan P. lineatus. Kedua subkelompok tersebut dipisahkan oleh jarak genetik sebesar 0.065.
12
Posisi Puntius sp. terpisah dari P. lineatus dan P. gemellus dengan nilai
bootstrap 95. Puntius sp. diduga merupakan jenis yang berbeda dengan P. lineatus
dan P. gemellus karena jarak genetiknya menunjukkan nilai sebesar 0.055. Pembagian selanjutnya menempatkan P. binotatus dan P. lateristriga dalam 1 kelompok dengan jarak genetik sebesar 0.056.
Gambar 6 Konstruksi pohon filogeni Puntius spp. dari sekuen 709 bp COI
Puntius spp. dengan metode NJ
Pada pohon filogeni, nilai bootstrap yang dihasilkan menunjukkan kekonsistenan dari dua atau lebih data nukleotida yang dibandingkan. Jika
bootstrap dilakukan sebanyak 1000 kali maka ada 1000 kali pengulangan data nukleotida untuk mendapatkan pohon filogeni. Semakin besar nilai bootstrap maka kesamaan sekuen antara 2 sampel tersebut semakin tinggi. Nilai bootstrap dapat mendukung jarak genetik yang dihasilkan antara sampel yang dibandingkan (Pereira et al. 2013).
Keragaman morfologi dan molekuler
Keragaman meristik yang diamati sangat ditentukan oleh beberapa karakter kunci yang mempengaruhi pola determinasi terhadap kelompok Puntius spp. Seperti pada proses identifikasi, corak tubuh merupakan karakter yang paling banyak menjadi penentu terhadap identitas Puntius spp. Corak tubuh dalam hal ini mencakup pola garis atau pita serta warna dasar tubuh. P. gemellus, P. lineatus, dan
Puntius sp. terdeterminasi karena perbedaan pola garis pada sisi tubuhnya. P. tetrazona-1 dan P. tetrazona-2 juga terdeterminasi akibat perbedaan warna dasar pada tubuh. Selain itu berdasarkan hasil analisis morfometri, faktor ukuran tubuh yang paling mempengaruhi keragaman Puntius spp. adalah karakter N2 (panjang kepala) dan N10 (panjang moncong).
13 Keragaman yang diperlihatkan oleh karakter molekuler (mtDNA COI)
Puntius spp. membagi sampel Puntius yang dianalisis menjadi 6 jenis dengan menempatkan P. tetrazona-1 dan P. tetrazona-2 dalam 1 kelompok. Nilai bootstrap
100 dan jarak genetik antara keduanya sebesar 0.003. Pernyataan mengenai P. tetrazona-1 dan P. tetrazona-2 sebagai 1 jenis yang sama didukung oleh penelitian Pereira et al. (2011). Pereira et al. (2011) menjelaskan bahwa jika jarak genetik antara 2 sampel ikan menghasilkan nilai kurang dari atau sama dengan 0.030 maka keduanya dinyatakan sebagai jenis yang sama dan keragaman dapat terjadi pada skala intrajenis. Sebaliknya, jika jarak genetik lebih dari 0.030 maka keduanya merupakan jenis yang berbeda. Pernyataan tersebut berlaku juga terhadap Puntius
sp. yang diduga merupakan jenis baru dari Puntius. Hal ini dikarenakan jarak genetik Puntius sp. dengan P. gemellus dan P. lineatus sebesar 0.055. Puntius sp. yang ditemukan untuk sementara diberi nama Puntius sp. “Harapan”. Penamaan ini digunakan untuk membedakannya dengan jenis Puntius baru yang ditemukan di luar Hutan Harapan Jambi.
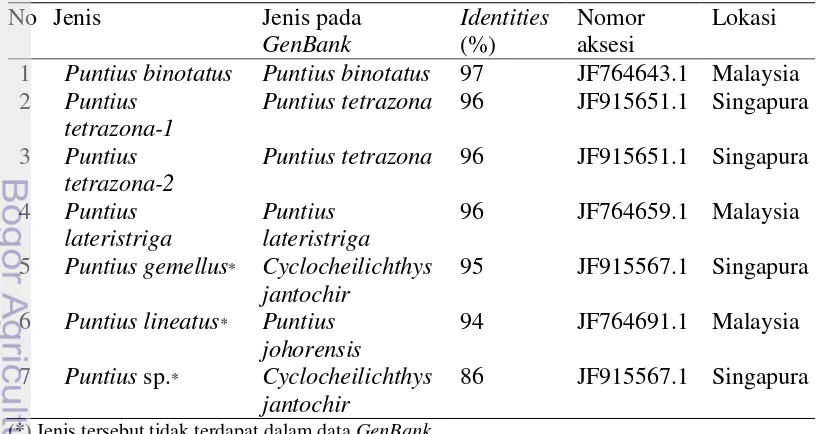
Hasil blastn (Tabel 8) menjelaskan tingkat kemiripan sekuen mtDNA COI Puntius spp. yang dianalisis dengan data sekuen DNA pada Genbank. Tingkat kemiripan (identities) dengan identitas jenis yang sesuai berkisar 96% hingga 97%. Jenis yang tidak terdapat pada Genbank yaitu P. gemellus, P. lineatus, dan Puntius
sp. menunjukkan tingkat kemiripan kurang dari 96%. Hasil blastn P. tetrazona-1
dan P. tetrazona-2 menunjukkan nilai identities kurang dari 97% yaitu sebesar 96%. Hal tersebut dimungkinkan karena jenis P. tetrazona pada Genbank berasal dari lokasi yang berbeda, yaitu Singapura. Namun demikian, seperti yang dinyatakan oleh Luca et al. (2008) bahwa tingkat kemiripan minimum dari sekuen COI di antara anggota famili Cyprinidae termasuk Puntius spp. di dalamnya adalah 85%. Semua jenis yang merujuk pada data hasil blastn Genbank merupakan anggota dari famili Cyprinidae.
Tabel 8 Hasil blastn sekuen COI Puntius spp. terhadap data sekuen pada GenBank
No Jenis Jenis pada
1 Puntius binotatus Puntius binotatus 97 JF764643.1 Malaysia
2 Puntius
tetrazona-1
Puntius tetrazona 96 JF915651.1 Singapura
3 Puntius
tetrazona-2
Puntius tetrazona 96 JF915651.1 Singapura
4 Puntius
lateristriga
Puntius lateristriga
96 JF764659.1 Malaysia
5 Puntius gemellus* Cyclocheilichthys
jantochir
95 JF915567.1 Singapura
6 Puntius lineatus* Puntius
johorensis
94 JF764691.1 Malaysia
7 Puntius sp.* Cyclocheilichthys
jantochir
86 JF915567.1 Singapura
14
SIMPULAN
Keragaman Puntius spp. dari segi meristik sangat ditentukan oleh corak tubuh. Keragaman Puntius spp. karakter morfometrinya dipengaruhi oleh ukuran tubuh N2 (panjang kepala) dan N10 (panjang moncong). Pohon filogeni dari analisis morfometri menghasilkan 2 kelompok Puntius spp. dengan jarak morfometri 0.114. Keragaman Puntius spp. yang dilihat berdasarkan runutan nukleotida mtDNA COI
memperlihatkan adanya 194 bp situs variatif dan 515 situs conserve. Pohon filogeni berdasarkan sekuen mtDNA COI membentuk 2 kelompok Puntius spp. dengan jarak genetik 0.065. Sebanyak 6 jenis Puntius berhasil diidentifikasi yaitu P. binotatus, P. tetrazona, P. lateristriga, P. gemellus, P. lineatus, dan Puntius sp. “Harapan”. Puntius sp. “Harapan” diduga merupakan jenis baru yang berasal dari Hutan Harapan Jambi.
DAFTAR PUSTAKA
Aguirre WE, Ellis KE, Kusenda M, Bell MA. 2008. Phenotypic variation and sexual dimorphism in anadromous threespine stickleback: implications for postglacial adaptive radiation. Biol Journ of the Linn Soc. 95: 455-478.
Avise JC. 1994. Molecular Markers, Natural History, and Evolution. New York (US): Chapman and Hall.
Froese R, Pauly D. 2013. Species 2000 and ITIS Catalogue of Life, 2013 Annual Checklist. Roskov Y, Kunze T, Paglinawan L, Orrell T, Nicolson D, Culham A, Bailly N, Kirk P, Bourgoin T, Baillargeon G, Hernandez F, De Wever A, editor. Reading (UK): Species 2000.
Hajibabaei M, Singer GAC, Elizabeth CL, Hebert PDN. 2007. Design and applicability of DNA barcodes in biodiversity monitoring. J BMC Biol. 5: 1-7. Haryono. 2005. Morphological comparison among striped Puntius (Pisces:
Cyprinidae) from Indonesia. Biodiversitas 6: 55-58.
Hebert PDN, Cywinska A, Ball SL, Waard JR. 2003. Biological identification through DNA barcodes. Biol Scien. 270: 313-321.
Hubbs CL, Lagler KF. 1958. Fishes of The Great Lakes Region. Michigan (US): University of Michigan Pr.
Jayaram KC. 1991. Revision of the genus Puntius Hamilton from the Indian region (Pisces: Cypriniformes: Cyprinidae: Cyprininae). Occasional Paper, Records of the Zoological Survey of Indian 135: 178.
Kottelat M, Whitten AJ, Kartikasari SN, Wirjoatmodjo S. 1993. Freshwater Fishes of Western Indonesia and Sulawesi. Singapore (SG): Periplus.
Kottelat M, Whitten T. 1996. Freshwater Biodiversity in Asia with Special
Reference to Fish. Washington (US): The World Bank.
Luca C, Dudu AA, Luca AA, Dinischiotu, Costache M. 2008. Phylogenetic relationships of Cyprinidae (Teleostei: Cypriniformes) inferred from the COX1
15 Mattjik AA, Sumertajaya IM. 2011. Sidik Peubah Ganda. Bogor (ID): Departemen
Statistika Institut Pertanian Bogor.
Moghaddam FY, Aliabadian M, Daud SK, Seifali M. 2012. Molecular phylogeny of the Puntius (Hamilton 1822) based on nuclear gene RAG2. Prog in Biol Sci. 2: 66-75.
Muchlisin ZA, Azizah S. 2009. Diversity and distribution of freshwater fishes in Aceh Water, Northern Sumatra. Indonesia. J of Zool Researc. 5: 62-79.
Nei M, Kumar S. 2000. Molecular Evolution and Phylogenetics. New York (US): OxfordUniversity Pr.
Nelson JS. 1994. Fishes of the World. 3rd ed. New York (US): J Wiley and Sons. Pereira LH, Pazian MF, Hanner R, Foresti F, Oliveira C. 2011. DNA barcoding
reveals hidden diversity ih the Neotropical freshwater: fish Piabina argentea
(Characiformes: Characidae) from Upper Parana Basin in Brazil. Mitochon DNA.
22: 87-96.
Pereira LH, Hanner R, Foresti F, Oliveira C. 2013. Can DNA barcoding accurately discriminate megadiversity Neotropical freshwater fish fauna?. BMC Gen. 14: 1-14.
Pethiyagoda R, Meegaskumbura, Maduwage K. 2012. A synopsis of the South East Asian fishes referred to Puntius (Pisces: Cyprinidae). Ichtyol Explor Freshwat.
23: 69-95.
Saitou N, Nei M. 1987. The neighbor joining method: a new method for reconstructing phylogenetic trees. Mol Biol Evol. 4: 406-425.
Soewardi K, Rachmawati R, Bengen DG, Affandi R. 1995. Penelusuran varietas ikan gurame, Osphronemus gouramy, Lacepede, dengan menggunakan analisis komponen utama. Jurnal Ilmu-ilmu Perairan dan Perikanan Indonesia 3: 1-15. Solimun. 2013. Pengukuran Variabel Laten: Model Indikator Refleksif dan
Formatif. Malang (ID): Departemen Statistika Universitas Brawijaya.
Sukmono T, Solihin DD, Rahardjo MF, Affandi R. 2013. Keanekaragaman ikan di Harapan Rainforest Jambi: eksplorasi pendahuluan. Di dalam: Simanjuntak CPH, Rahardjo MF, Zahid A, Hadie W, Haryono, editor. Keanekaragaman Ikan:
Konservasi dan Pengelolaan bagi Kesejahteraan Masyarakat Pesisir. Seminar
Nasional Ikan VII; 2012 Jun 12; Makassar, Indonesia. Bogor (ID): Pusat Penelitian Biologi LIPI. Hlm 419-430.
Sukmono T, Solihin DD, Rahardjo MF, Affandi R. 2014. Iktiofauna hutan tropis dataran rendah, Hutan Harapan Jambi. J Ikhtiol Indones, siap terbit.
Supranto J. 2004. Analisis Multivariat: Arti dan Interpretasi. Jakarta (ID): Rineka Cipta.
Taki Y, Katsuyama A, Urushida T. 1978. Comparative morphology and interspecific relationship of the Cyprinids genus Puntius. Jap Journ of Ichtyol.
25: 1-8.
Tamura K, Peterson P, Peterson N, Nei M, Kumar S. 2011. MEGA 5: molecular evolutionary genetics analysis using maximum likelihood, evolutionary distance, and maximum parsimony methods. Mol Biol Evol. 28: 2731-2739.
Tamura K, Kumar S. 2002. Evolutionary distance estimation under heterogeneous substitusion pattern among lineages. Mol Biol Evol. 19: 1727-1736.
Ward RD, Zemlak TS, Innes BH, Last PR, Hebert PDN. 2005. DNA barcoding
Australia’s fish species. Biol Scien. 360: 1847–1857.
16
Weber M, Beaufort LF. 1916. The Fishes of Indo-Australian Archipelago III.
17
18
Lampiran 1 Gambar sampel Puntius spp.
P. binotatus, berjumlah 30 ekor P. tetrazona-1, berjumlah 30 ekor
Puntius binotatus PUNTIUS SP.(P. sp. “Harapan”)
Puntius lineatus Puntius gemellus
P. tetrazona-2, berjumlah 9 ekor P. lateristriga, berjumlah 30 ekor
P. gemellus, berjumlah 30 ekor P. lineatus, berjumlah 10 ekor
19 Lampiran 2 Tahapan proses ekstraksi DNA berdasarkan protokol Qiagen
1. Hasil cacahan dimasukkan ke dalam tabung mikro dan ditambahkan larutan PBS (phosphate buffer saline) sebanyak 500 μL, buffer ATL 180 μL, dan enzim proteinase-k 20 μL.
2. Campuran dihomogenisasi dengan mesin vortex dan diinkubasi pada suhu 56 oC selama 10 menit.
3. Campuran pada tabung ditambahkan bufer AL.
4. Homogenisasi dengan mesin vortex dan diinkubasi pada suhu 56 oC selama 10 menit.
5. Campuran diangkat setelah selesai inkubasi dan ditambahkan etanol absolut sebanyak 200 μL lalu dihomogenisasi dengan mesin vortex.
6. Campuran dalam tabung mikro dipindahkan ke dalam mini spin column
sebanyak 800 μL.
7. Pemisahan sentrifugal dengan mesin sentrifuse pada 8000 rpm selama 1 menit. Sentrifus dilakukan pada 8000 rpm.
8. Tabung koleksi dibuang dan mini spin column ditempatkan pada tabung koleksi.
9. Bufer AW1 sebanyak 500 μL ditambahkan dan disentrifus selama 1 menit pada 8000 rpm selama 1 menit.
10.Tabung koleksi dibuang kembali dan mini spin column ditempatkan pada tabung koleksi, kemudian ditambahkan 500 μL bufer AW2.
11.Sentrifus selama 3 menit pada 13300 rpm untuk mengeringkan membran
DNeasy.
12.Tabung koleksi dibuang dan mini spin column ditempatkan ke dalam tabung vial ukuran 1.5 ml.
13.Sebanyak 100 μL bufer AE dipipet ke dalam membran DNeasy. Inkubasi pada suhu ruang selama 2 menit dan sentrifuse selama 1 menit pada 8000 rpm untuk mengelusi.
20
Lampiran 3 Tahapan proses purifikasi DNA berdasarkan protokol Qiagen
1. DNA hasil perbanyakan pada gel agarose 1 % dipotong di area gel cutter
(BioRad) menggunakan bantuan sinar UV.
2. Potongan gel yang berisi DNA kemudian dimasukkan ke dalam tabung mikro.
3. Tabung ditambahkan bufer QG sebanyak 3 kali volume gel agarosa. 4. Inkubasi selama 10 menit pada suhu 50 oC.
5. Pada tabung tersebut lalu ditambahkan isopropanol sebanyak 1 kali volume gel agarosa.
6. Campuran bufer isopropanol, bufer QG, dan gel agarosa yang telah larut dimasukkan ke dalam kolom membran kemudian disentrifugasi dengan kecepatan 13000 rpm selama 1 menit.
7. Cairan yang tertampung di bagian bawah kolom dibuang.
8. Kolom ditambahkan bufer QG 500 μL kemudian kolom disentrifugasi dengan kecepatan 13000 rpm selama 1 menit.
9. Cairan yang tertampung di bagian bawah dibuang dan kolom filter dipindah ke kolom penampung baru.
10.Pada kolom membran kemudian ditambahkan bufer PE sebanyak 750 μL selanjutnya disentrifugasi dengan kecepatan 13000 rpm selama 1 menit. 11.Kolom membran dipindahkan ke tabung vial dan ditambahkan nuclease free
water (NFW) 50 μL.
12.Campuran diinkubasi pada suhu kamar selama 1 menit.
21
Jenis N1 N2 N3 N4 N5 N6 N7 N8 N9 N10 N11 N12 N13 N14
P. binotatus 1.331 0.283 0.081 0.090 0.095 0.524 0.218 0.216 0.206 0.202 0.194 0.151 0.155 0.369
P. tetrazona-1 1.302 0.294 0.087 0.110 0.112 0.510 0.174 0.200 0.224 0.221 0.162 0.164 0.158 0.453
P. tetrazona-2 1.292 0.296 0.108 0.100 0.115 0.485 0.185 0.200 0.219 0.235 0.162 0.142 0.150 0.431
P. gemellus 1.264 0.263 0.074 0.096 0.093 0.468 0.131 0.218 0.174 0.189 0.131 0.160 0.131 0.307
P. lineatus 1.293 0.268 0.073 0.087 0.093 0.486 0.169 0.234 0.187 0.203 0.134 0.171 0.132 0.325
P. lateristriga 1.321 0.311 0.070 0.079 0.089 0.488 0.181 0.229 0.198 0.195 0.150 0.152 0.142 0.392
Puntius sp. 1.275 0.275 0.118 0.080 0.091 0.481 0.181 0.237 0.195 0.195 0.157 0.188 0.129 0.321
C. striata 1.215 0.306 0.070 0.052 0.086 0.351 0.634 0.102 0.187 0.122 0.108 0.104 0.104 0.190
22
Lampiran 5 Tabel eigenvalue 14 ukuran relatif Puntius spp.
Parameter PC1 PC2 PC3 PC4 PC5 PC6 PC7
Eigenvalue 8.861 2.608 1.258 0.841 0.231 0.136 0.066
23
L
ampi
ra
n
6 P
en
y
ejaj
ara
n
be
rg
anda
mt
D
NA
C
OI
Punti
us
spp. (
24
L
ampir
an 6 (
L
anjuta
25
RIWAYAT HIDUP
Penulis dilahirkan di Kebumen pada tanggal 13 Oktober 1993 dari ayah Suwarso dan ibu Tuti Wihantari. Penulis adalah putra pertama dari 2 bersaudara. Tahun 2010 penulis lulus dari SMA Negeri 1 Cikampek dan pada tahun yang sama penulis lulus seleksi masuk Institut Pertanian Bogor (IPB) melalui jalur Undangan Seleksi Masuk IPB dan diterima di Departemen Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam.
Selama mengikuti perkuliahan, penulis pernah menjadi asisten praktikum Kimia Dasar TPB pada semester genap tahun 2013, asisten praktikum Biologi Dasar TPB pada semester ganjil tahun 2013, asisten praktikum Biologi Dasar Kelas Ekstensi Gizi pada semester ganjil tahun 2013, asisten praktikum Genetika Dasar pada semester ganjil tahun 2013, dan asisten praktikum Fisiologi Tumbuhan semester genap 2014. Penulis juga aktif dalam membimbing dan mengajar privat mata kuliah Biologi Dasar dan Genetika untuk mahasiswa serta mengajar privat Biologi SMA, dan Matematika SMP. Penulis juga aktif sebagai anggota Divisi Biosains Himabio IPB tahun 2012 dan anggota Divisi Pengembangan Sumber Daya Mahasiswa Himabio IPB 2013. Bulan Juni-Juli 2013, penulis melaksanakan Praktik Lapangan di Balai Pelestarian Situs Manusia Purba Sangiran, Sragen, Jawa Tengah dengan judul Manajemen dan Penerapan Biopaleontologi terhadap fosil Bivalvia dan Mamalia di Balai Pelestarian Situs Manusia Purba Sangiran.
Penulis aktif mengikuti lomba karya tulis ilmiah tingkat mahasiswa di antaranya PKM-GT tahun 2012 dan Lomba Karsa Cipta Fakultas Matematika dan Ilmu Pengetahuan Alam tahun 2012. Penulis juga sering tampil sebagai Master of Ceremony di beberapa acara besar di tingkat Departemen dan pernah membawa Departemen Biolgi sebagai juara ketiga sepakbola dalam kompetisi olahraga dan seni FMIPA (SPIRIT 2014). Penulis pernah tampil juga sebagai pengisi acara
Welcome Party asrama Tingkat Persiapan Bersama IPB tahun 2010, Farewell Party