OPTIMASI KONDISI PRODUKSI ENZIM AMILASE DARI
BAKTERI LAUT
Bacillus
sp.
YULI CAPRIYANTI
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa skripsi berjudul Optimasi Kondisi Produksi Enzim Amilase dari Bakteri Laut Bacillus sp. adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
ABSTRAK
YULI CAPRIYANTI. Optimasi Kondisi Produksi Enzim Amilase dari Bakteri Laut Bacillus sp. Dibimbing oleh POPI ASRI KURNIATIN dan AWAN PURNAWAN.
Keanekaragaman hayati sumber daya laut yang tinggi berpotensi sebagai sumber baru dari enzim amilase. Komunitas mikroba merupakan biomasa laut terbesar yang memungkinkan banyaknya sumber baru penghasil enzim. Penelitian ini bertujuan untuk menentukan keadaan optimum kondisi lingkungan serta nutrien media produksi bakteri laut Bacillus sp. Berbagai parameter seperti konsentrasi substrat, pH produksi, suhu fermentasi, ko-substrat, dan sumber nitrogen telah ditentukan kondisi optimalnya. Metode yang digunakan adalah metode spektrofotometri. Produksi enzim amilase maksimum didapatkan pada konsentrasi substrat pati 1%, pH 7, suhu 30oC, maltosa sebagai ko-substrat produksi, dan kasein sebagai sumber nitrogen produksi dengan nilai aktivitas enzim amilase paling optimum berturut-turut sebesar 2.547 U/mL, 2.109 U/mL, 2.414 U/mL, 2.675 U/mL, dan terakhir 2.335 U/mL.
Kata kunci: aktivitas amilase, Bacillus sp., ko-substrat, optimasi, pH, substrat, suhu, sumber nitrogen
ABSTRACT
YULI CAPRIYANTI. Optimization of Production Conditions of Amylase Enzyme From Marine Bacteria Bacillus sp. Supervised by POPI ASRI KURNIATIN dan AWAN PURNAWAN.
Marine biodiversity resources have high potential as a new source of the enzyme amylase. Microbial community is the largest marine biomass that enables many new sources producing enzyme. This study aimed to determine the optimum state of environmental conditions and nutrient media production of marine bacterium Bacillus sp. Various parameters such as substrate concentration, pH production, fermentation temperature, co-substrate, and nitrogen sources have been determined the optimal conditions. The method used is the spectrophotometric method. The maximum production of amylase enzyme obtained at a concentration of 1% starch substrate, pH 7, 30°C, maltose as co-substrate production, and casein as a nitrogen source with a value most optimum amylase enzyme activity, respectively for 2.547 U/mL, 2.109 U/mL, 2.414 U/mL, 2.675 U/mL, and the last 2.335 U/mL.
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains
pada
Departemen Biokimia
OPTIMASI KONDISI PRODUKSI ENZIM AMILASE DARI
BAKTERI LAUT
Bacillus
sp.
YULI CAPRIYANTI
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
Judul Skripsi : Optimasi Kondisi Produksi Enzim Amilase dari Bakteri Laut Bacillus sp.
Nama : Yuli Capriyanti NIM : G84100066
Disetujui oleh
Popi Asri Kurniatin, SSiApt MSi Pembimbing I
Awan Purnawan, SSi MSi Pembimbing II
Diketahui oleh
Dr Ir I Made Artika, MAppSc Ketua Departemen
PRAKATA
Bismillahirrahmanirrahim
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Judul penelitian yang dilaksanakan sejak bulan Februari 2014 ini adalah Optimasi Kondisi Produksi Enzim Amilase dari Bakteri Laut Bacillus sp. Penelitian ini dilaksanakan di Laboratorium Biokatalis dan Fermentasi LIPI Cibinong, Kabupaten Bogor, Jawa Barat. Penelitian ini didanai oleh DIPA BIOREFENARY PUSLIT BIOTEKNOLOGI tahun anggaran 2014.
Terima kasih penulis ucapkan kepada Ibu Popi Asri Kurniatin, SSiApt MSi dan Bapak Awan Purnawan, SSi MSi atas bimbingan, arahan, kritik, dan sarannya. Ucapan terima kasih penulis juga sampaikan kepada Bapak Dr. Yopi, Ibu Nanik, SPt MSi, para peneliti, staf, serta sesama mahasiswa penelitian di Laboratorium Biokatalis dan Fermentasi, Bidang Bioproses Pusat Penelitian Bioteknologi-LIPI Cibinong. Penulis juga mengucapkan terima kasih kepada kedua orang tua, kakak, adik, dan seluruh keluarga atas dukungan yang selalu diberikan. Ungkapan terima kasih juga disampaikan seluruh teman sesama bimbingan, satu penelitian, serta teman-teman Biokimia 47 untuk segala doa, kasih sayang, dan dukungannya.
Semoga karya ilmiah ini bermanfaat.
DAFTAR ISI
DAFTAR GAMBAR iv
DAFTAR LAMPIRAN iv
PENDAHULUAN 1
METODE 2
Bahan dan alat 2
Metode Penelitian 2
HASIL 5
Isolat Bakteri Bacillus sp. Hasil Peremajaan 5
Konsentrasi Pati Optimum 5
pH Optimum Produksi 6
Suhu Fermentasi Optimum 7
Ko-substrat Optimum 8
Sumber Nitrogen Optimum 9
PEMBAHASAN 10
Pertumbuhan Sel Bakteri 10
Konsentrasi Pati Optimum 11
pH Optimum Produksi 12
Suhu Fermentasi Optimum 13
Ko-substrat Optimum 14
Sumber Nitrogen Optimum 14
SIMPULAN DAN SARAN 15
Simpulan 15
Saran 15
DAFTAR GAMBAR
1 Hasil peremajaan bakteri laut Bacillus sp. dalam media padat pati 0.5% 2 Pertumbuhan sel bakteri laut Bacillus sp. pada berbagai konsentrasi
substrat
3 Aktivitas enzim amilase dari bakteri laut Bacillus sp. pada berbagai
konsentrasi substrat
4 Pertumbuhan sel bakteri laut Bacillus sp. dengan berbagai kondisi pH 5 Aktivitas enzim amilase dari bakteri laut Bacillus sp. pada berbagai
kondisi pH
6 Pertumbuhan sel bakteri laut Bacillus sp. pada berbagai suhu fermentasi 7 Aktivitas enzim amilase dari bakteri laut Bacillus sp. pada berbagai suhu
fermentasi
8 Pertumbuhan sel bakteri laut Bacillus sp. pada berbagai ko-substrat 9 Aktivitas enzim amilase dari bakteri laut Bacillus sp. pada berbagai
ko-substrat
10 Pertumbuhan sel bakteri laut Bacillus sp. pada berbagai sumber nitrogen 11 Aktivitas enzim amilase dari bakteri laut Bacillus sp. pada berbagai
sumber nitrogen
DAFTAR LAMPIRAN
1 Diagram alir penelitian
2 Hasil pengukuran pertumbuhan sel pada optimasi konsentrasi substrat 3 Kurva standar D-glukosa pada optimasi konsentrasi substrat
4 Hasil pengukuran aktivitas enzim amilase pada optimasi konsentrasi substrat media produksi
5 Hasil pengukuran pertumbuhan sel pada optimasi pH media produksi 6 Kurva standar D-glukosa pada optimasi pH media produksi
7 Hasil pengukuran aktivitas enzim amilase pada optimasi pH media 8 Hasil pengukuran pertumbuhan sel pada optimasi suhu fermentasi 9 Kurva standar D-glukosa pada optimasi suhu fermentasi
10 Hasil pengukuran aktivitas enzim amilase pada optimasi suhu fermentasi 11 Hasil pengukuran pertumbuhan sel pada optimasi ko-substrat media
produksi
12 Kurva standar D-glukosa pada optimasi ko-substrat media produksi 13 Hasil pengukuran aktivitas enzim amilase pada optimasi ko-substrat
media produksi
14 Hasil pengukuran pertumbuhan sel pada optimasi sumber nitrogen media produksi
15 Kurva standar D-glukosa pada optimasi sumber nitrogen media produksi 16 Hasil pengukuran aktivitas enzim amilase pada optimasi sumber nitrogen
PENDAHULUAN
Amilase merupakan kelompok enzim yang mempunyai kemampuan untuk memutuskan ikatan glikosida yang terdapat pada amilum (Sutiamiharja 2008). Enzim ini memiliki aplikasi dengan skala yang luas. Kebutuhan amilase di dunia sangat tinggi. Pada tahun 2004 saja mencapai penjualan sekitar US $2 milyar dan diperkirakan akan terjadi peningkatan jumlah per tahun dengan laju 3.3% (Sivaramkrishnan et al. 2006). Berdasarkan data Badan Pusat Statistik (BPS), impor enzim di Indonesia tahun 2008 dan tahun 2009 mencapai US$ 20,2 juta dan US$ 20,3 juta. Pemanfaatan enzim amilase untuk sektor makanan dan minuman adalah sekitar 90% dari karbohidrase yang dihasilkan. Produksi amilase sendiri oleh Bacillus sp. lichineformis dan Aspergillus sp sekitar 300 ton enzim murni pertahun (Sivaramkrishnan et al. 2006). Amilase merupakan enzim industri yang penting yang dapat menyumbang sekitar 30% dari produksi enzim dunia (Maarel Van Der et al. 2002). Oleh karena itu, meskipun enzim amilase telah banyak diisolasi dan dikristalisasi, eksplorasi sumber amilase yang lebih efisien masih dibutuhkan (Ahmadi et al. 2010).
Saat ini mikroba yang banyak digunakan untuk produksi enzim amilase berasal dari tanah, mikroba yang berasal dari laut belum banyak dimanfaatkan. Mikroba yang hidup di laut mempunyai karakter yang spesifik, yaitu dapat bertahan pada salinitas tinggi, suhu, cahaya, dan lingkungan ekstrim lainnya. Komunitas mikroba dari jenis bakteri, arkea, protista dan fungi bersel tunggal merupakan biomasa laut terbesar. Jumlah total sel bakteri di laut diperkirakan sebanyak 3,6x1029 dengan total kandungan karbon selulernya sebesar 3x1017g (Whitman et al. 1998). Keanekaragaman yang sangat tinggi ini mendorong banyaknya penelitian yang menggunakan mikroba laut, termasuk pencarian sumber enzim amilase yang baru.
Bacillus sp. mempunyai banyak potensi sebagai sumber daya hayati laut yang dapat menunjang bioteknologi bakteri laut. Marga Bacillus merupakan salah satu bakteri yang mempunyai berbagai macam kemampuan yang dapat dikembangkan dalam industri bioteknologi karena mempunyai sifat-sifat seperti, memiliki kisaran suhu pertumbuhan yang luas, pembentuk spora, bersifat aerob atau fakultatif anaerob, memiliki kemampuan enzimatik yang beragam, dan tidak membutuhkan faktor tumbuh yang relatif mahal (Ariani 2000). Penelitian mengenai bakteri laut ini telah banyak dilakukan, seperti karakterisasi α-amilase dari bakteri laut Vibrio sp. B10.2.8 (Margareth 2007), lalu optimasi enzim amilase dari bakteri laut Bacillus sp. VITRKHB menggunakan metode RSM (Response Surface Methodology) (Rao et al. 2013), dan juga penelitian mengenai optimasi, produksi, dan pemurnian parsial dari enzim ekstraselular α-amilase Bacillus sp. marini (Ashwini et al. 2011). Selain itu bakteri laut juga digunakan untuk menghasilkan enzim lainnya, seperti enzim kitinase (Rostinawati 2008).
media, pH produksi, suhu fermentasi, ko-substrat, dan sumber nitrogen sehingga didapatkan optimalisasi produksi enzim amilase dari mikroba laut Bacillus sp.
METODE
Bahan dan alat
Bahan-bahan yang digunakan dalam penelitian ini adalah bakteri Bacillus sp., Artificial Sea Water (ASW) dari Jepang, ekstrak khamir, pepton, pati komersial, larutan buffer fosfat pH 7 0.02 M, larutan NaOH 2%, larutan HCl 10%, larutan DNS, larutan buffer standar pH 4, larutan buffer standar pH 7, larutan buffer standar pH 10, akuades, es, alkohol 96%, D-glukosa, maltosa, sukrosa, galaktosa, urea, amonium sulfat, kasein, tripton, agar, dan alumunium foil.
Peralatan yang digunakan adalah spektrofotometer UV-VIS double beam Hitachi U-3900H, oven Memmert, water bath Julabo TW20, autoklaf Tomy high pressure steam sterillizer ES-315, shaker BioShaker BR-43FL, inkubator, sentrifus Hitchi Micro Ultracentrifuge CS 150NX, laminar air flow Sanyo Bio Clean Bench MCV-B13, pH meter, ice maker, neraca analitik percisa 303A, ice box, pengaduk magnetik (stirer), vortex IKA MS 3 basic, tabung reaksi, mikropipet 10–1000 L, tabung Eppendorf 1,5 mL, tips 10-1000 L, labu Erlenmeyer 100, 250, dan 300 mL, gelas piala, gelas ukur, labu takar 10 mL, botol scott, pipet tetes, sudip, cawan petri, ose, botol semprot, termometer, bunsen, dan kuvet.
Metode Penelitian
Optimasi produksi enzim amilase dari bakteri laut Bacillus sp. dalam penelitian ini terdiri atas lima tahap penting, yaitu optimasi konsentrasi substrat media produksi, optimasi pH media produksi, optimasi suhu fermentasi, optimasi ko-substrat C media produksi, dan optimasi sumber nitrogen media produksi.
Peremajaan Bakteri Bacillus sp. (Rahmani et al. 2011).
Pembuatan Media Peremajaaan. Pembuatan media diawali dengan penyiapan bahan penyusun yang terdiri atas 3.8 gram Artificial Sea Water (ASW), 0.5 gram pati komersial, 0.5 gram agar, 0.1 gram yeast extract dan 0.5 gram pepton. Semua bahan dilarutkan di dalam 100 mL akuades kemudian disterilisasi dalam autoklaf pada tekanan 1 atm dan suhu 121ºC selama 15 menit. Lalu, media yang telah disterilisasi dituang ke dalam cawan petri.
Optimasi Media Produksi (Rahmani et al. 2011).
Terdapat beberapa parameter yang dioptimasi pada media produksi enzim amilase dari bakteri laut Bacillus sp. yang terdiri dari optimasi konsentrasi substrat, pH, suhu, ko-substrat C, dan sumber nitrogen.
Pembuatan Media Produksi. Pembuatan media diawali dengan disiapkan bahan penyusun terlebih dahulu yang terdiri atas 3.8% Artificial Sea Water (ASW), 0.1% yeast extract dan 0.5% pepton, dan pati komersial dengan analytical grade sebagai substrat media produksi. Media produksi terdiri dari media prekultur dan media kultur. Media prekultur dibuat sebanyak 10 mL, sedangkan untuk media kultur dibuat sebanyak 30 mL. Setelah itu, media disterilisasi pada 121°C selama 15 menit. Optimasi Konsentrasi Substrat. Optimasi konsentrasi substrat dilakukan pada media prekultur dan media kultur. Variasi konsentrasi substrat yang digunakan adalah konsentrasi 1%, 2.5%, dan 5%. Selanjutnya isolat yang sudah diremajakan diinokulasi ke dalam media prekultur sebanyak 1 ose secara aseptik dan diinkubasi dengan kecepatan 150 rpm selama 24 jam pada suhu 30oC. Kemudian media prekultur dimasukkan ke dalam media kultur secara aseptik dan diinkubasi kembali selama 120 jam. Setiap 24 jam dilakukan pengambilan sampel kultur sebanyak 2 mL untuk pengujian pertumbuhan sel bakteri dan aktivitas enzimnya untuk mengetahui konsentrasi optimum dalam media produksi.
Optimasi pH Produksi. Optimasi pH dilakukan dalam media produksi dengan konsentrasi substrat optimum yang telah diperoleh dari pengujian sebelumnya sebesar 1%. Variasi pH media yang digunakan adalah pH 5, pH 6, pH 7, pH 8, dan pH 9 yang sebelumnya telah diatur dengan cara menambahkan HCl atau NaOH. Selanjutnya isolat yang sudah diremajakan diinokulasi ke dalam media prekultur sebanyak 1 ose secara aseptik dan diinkubasi dengan kecepatan 150 rpm selama 24 jam pada suhu 30oC. Kemudian prekultur dimasukkan ke dalam media kultur secara aseptik dan diinkubasi kembali selama 120 jam. Setiap 24 jam dilakukan pengambilan sampel kultur sebanyak 2 mL untuk pengujian pertumbuhan sel bakteri dan aktivitas enzimnya.
Optimasi Suhu Fermentasi. Optimasi suhu fermentasi menggunakan media produksi dengan konsentrasi substrat dan pH optimum yang telah diperoleh dari pengujian sebelumnya sebesar 1% dan kondisi pH 7. Suhu fermentasi yang akan dioptimasi yaitu suhu 20oC, 30oC, 40oC, dan terakhir 50oC. Selanjutnya isolat yang sudah diremajakan diinokulasi ke dalam media prekultur sebanyak 1 ose secara aseptik dan diinkubasi dengan kecepatan 150 rpm selama 24 jam pada suhu masing-masing perlakuan. Kemudian prekultur dimasukkan ke dalam media kultur secara aseptik dan diinkubasi kembali selama 120 jam. Setiap 24 jam dilakukan pengambilan sampel kultur sebanyak 2 mL untuk pengujian pertumbuhan sel bakteri dan aktivitas enzimnya.
dilakukan pengambilan sampel kultur sebanyak 2 mL untuk pengujian pertumbuhan sel bakteri dan aktivitas enzimnya.
Optimasi Sumber Nitrogen. Optimasi sumber nitrogen menggunakan media produksi dengan konsentrasi substrat, pH, suhu fermentasi, ko-substrat optimum yang telah diperoleh dari pengujian sebelumnya yaitu konsentrasi sebesar 1%, kondisi pH 7, suhu 30oC, dan 0.5% maltosa. Masing-masing media ditambahkan variasi sumber nitrogen yaitu ammonium sulfat, urea, kasein, dan tripton dengan konsentrasi masing-masing 0.5%. Selanjutnya isolat yang sudah diremajakan diinokulasi ke dalam media prekultur sebanyak 1 ose secara aseptik dan diinkubasi dengan kecepatan 150 rpm selama 24 jam pada suhu masing-masing perlakuan. Kemudian prekultur dimasukkan ke dalam media kultur secara aseptik dan diinkubasi kembali selama 120 jam. Setiap 24 jam dilakukan pengambilan sampel kultur sebanyak 2 mL untuk pengujian pertumbuhan sel bakteri dan aktivitas enzimnya.
Analisis Aktivitas Amilase Ekstrak Kasar (Bernfeld 1995).
Aktivitas enzim amilase ditentukan dengan menggunakan metode DNS yang telah dimodifikasi dengan mereaksikan 0.25 mL larutan pati 0.5% (b/v) dalam buffer fosfat pH 7 (0.02 M) dan 0.25 mL enzim yang diperoleh dalam bentuk supernatan dari 1 mL sampel yang sebelumnya disentrifus dengan kecepatan 13000 rpm selama 15 menit pada suhu 4oC yang telah diencerkan dengan faktor pengenceran 100x, lalu diinkubasi 30°C selama 30 menit, ekstrasi enzim amilase dipertahankan pada suhu dingin yaitu minimal 4°C (Liu et al. 2011) untuk menjaga aktivitas enzim. Kemudian ditambahkan 0.75 mL DNS untuk menghentikan reaksi, lalu dihentikan kembali dengan merendam tabung reaksi berisi sampel dalam air mendidih 100°C selama 15 menit. Selanjutnya direndam dalam air es selama 10 menit. Gula pereduksi yang dibebaskan ditentukan dengan menggunakan metode DNS (Miller 1959). Warna yang terbentuk diukur dengan spektrofotometer dengan panjang gelombang 540 nm. Nilai absorbansi yang diperoleh dikonversi menjadi konsentrasi gula pereduksi (ppm) menggunakan persamaan yang didapat dari kurva standar glukosa. Satu unit aktivitas enzim (U) merupakan jumlah enzim yang mampu mengkatalis perubahan 1 µmol substrat per menit pada keadaan pengukuran optimal (Lehninger 2008). Rumus: Aktivitas enzim = a i
g x P x
Wa a i x BM g a
Pengukuran Pertumbuhan Sel Bakteri (Kosim dan Putra 2010).
HASIL
Isolat Bakteri Bacillus sp. Hasil Peremajaan
Isolat bakteri laut Bacillus sp. dapat tumbuh dalam media padat pati 0.5% pada hari ke-3. Isolat bakteri laut Bacillus sp. yang tumbuh dapat dilihat dari terbentuknya pelikel putih pada media. Isolat bakteri yang tumbuh lebih banyak membentuk koloni dan permukaan tepinya tidak rata (Gambar 1).
Gambar 1 Hasil peremajaan bakteri laut Bacillus sp. dalam media padat pati 0.5% Konsentrasi Pati Optimum
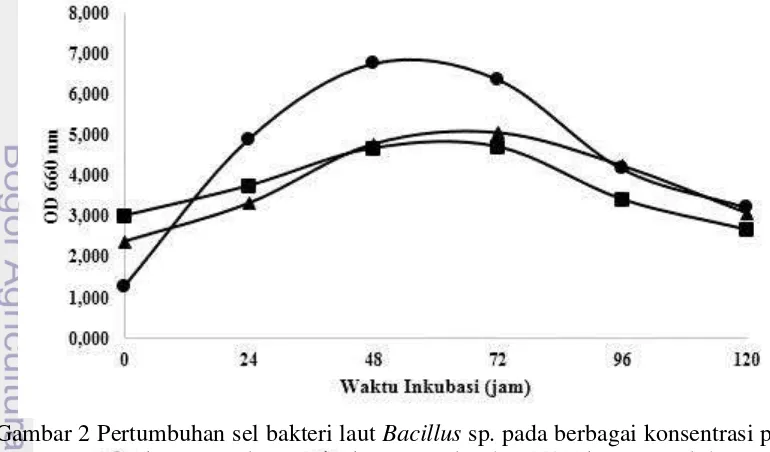
Berdasarkan hasil penelitian didapatkan bahwa fase log kurva pertumbuhan bakteri terjadi pada jam ke-48. Hal ini ditandai dengan meningkatnya nilai OD secara drastis. Fase stasioner terlihat hingga jam ke-72 dan mulai mengalami fase kematian dari jam ke-72 hingga jam ke-120 (Gambar 2). Hasil analisis aktivitas enzim amilase yang dilakukan menunjukkan puncak tertinggi terjadi pada jam ke-72 pada masing-masing konsentrasi pati yang diuji dengan aktivitas enzim sebesar 2.547 U/mL untuk konsentrasi 1%, diikuti dengan konsentrasi 2.5% sebesar 2.308 U/mL, dan 2.205 U/mL pada konsentrasi 5% (Gambar 3).
Gambar 3 Aktivitas enzim amilase dari bakteri laut Bacillus sp. pada berbagai konsentrasi pati. konsentrasi 1%, konsentrasi 2.5%, konsentrasi 5%.
pH Optimum Produksi
Titik optimum kurva pertumbuhan sel bakteri ditunjukkan pada jam ke-24 dimana pertumbuhan sel bakteri sedang berada pada fase log. Fase stasioner terlihat pada jam ke-48 hingga jam ke-72, lalu setelah jam ke-72 bakteri menuju fase kematian (Gambar 4). Hasil analisis aktivitas enzim amilase pada media produksi dengan pH 7 menunjukkan hasil paling tinggi dengan nilai sebesar 2.109 U/mL, diikuti pH 9 sebesar 1.932 U/mL, pH 6 sebesar 1.545 U/mL, lalu pH 8 sebesar 1.461 U/mL, dan terakhir pH 5 dengan nilai aktivitas enzim sebesar 1.430 U/mL. Titik optimum dicapai pada jam ke-72 pada semua kondisi pH (Gambar 5).
Gambar 5 Aktivitas enzim amilase dari bakteri laut Bacillus sp. dengan berbagai kondisi pH. pH 5, pH 6, pH 7, pH 8, pH 9.
Suhu Fermentasi Optimum
Nilai absorbansi paling tinggi pada kurva pertumbuhan sel bakteri untuk masing-masing kondisi suhu ditunjukkan pada jam ke-24, dimana pertumbuhan sel bakteri sedang dalam fase log. Titik paling optimum ditunjukkan pada kondisi suhu 30oC. Fase stasioner terjadi pada jam ke-48 hingga jam ke-72, lalu terjadi penurunan pertumbuhan sel bakteri hingga jam ke-120. Fase lag tidak terlihat pada kurva pertumbuhan (Gambar 6). Nilai aktivitas enzim amilase pada suhu 20oC, 30oC, 40oC, dan 50oC berturut-turut yaitu 1.729 U/mL, 2.414 U/mL, 1.875 U/mL, dan terakhir 0.866 U/mL. Aktivitas enzim amilase menunjukkan jam ke-72 sebagai titik paling optimum untuk semua kondisi suhu, namun aktivitas enzim amilase paling tinggi ditunjukkan oleh suhu 30oC (Gambar 7).
Gambar 7 Aktivitas enzim amilase dari bakteri laut Bacillus sp. pada berbagai suhu fermentasi. suhu 20oC, suhu 30oC, suhu 40oC, suhu 50oC.
Ko-substrat Optimum
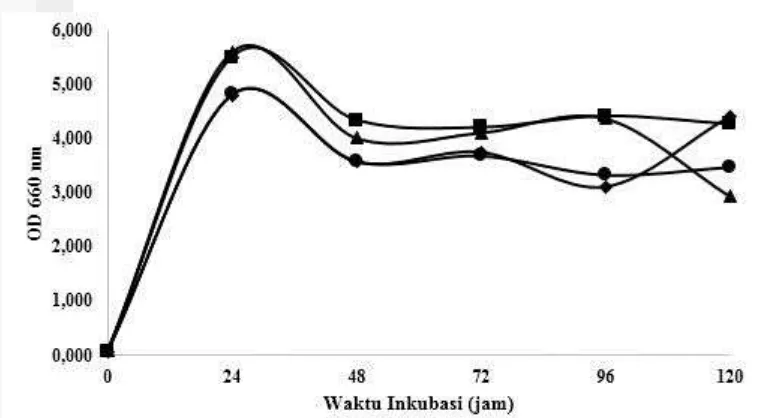
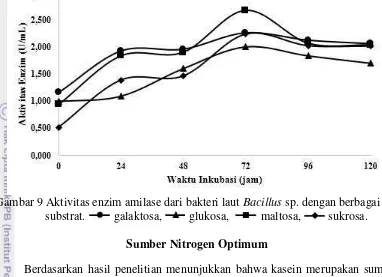
Hasil analisis pertumbuhan sel bakteri menunjukkan terjadinya fase log pada jam ke-24. Fase stasioner pada jam ke-48 dan ke-72. Setelah itu terjadi penurunan pertumbuhan sel bakteri. Titik optimum terjadi pada jam ke-24 dengan glukosa dan maltosa sebagai ko-substrat paling tinggi (Gambar 8). Aktivitas enzim amilase menunjukkan hasil paling optimum pada maltosa dengan nilai sebesar 2.675 U/mL, lalu galaktosa sebesar 2.259 U/mL, sukrosa sebesar 2.239 U/mL, dan terakhir sukrosa sebesar 2.001 U/mL. Titik optimum terjadi pada jam ke-72 dengan maltosa sebagai ko-substrat paling optimum (Gambar 9).
Gambar 9 Aktivitas enzim amilase dari bakteri laut Bacillus sp. dengan berbagai ko-substrat. galaktosa, glukosa, maltosa, sukrosa.
Sumber Nitrogen Optimum
Berdasarkan hasil penelitian menunjukkan bahwa kasein merupakan sumber nitrogen terbaik untuk bakteri laut Bacillus sp. dengan titik optimum pertumbuhan sel bakteri pada jam ke-24 dan aktivitas enzim amilase pada jam ke-72. Fase log terjadi pada jam ke-24, lalu fase stasioner terjadi pada jam ke-48 hingga jam ke-72, dan terjadi penurunan pertumbuhan sel bakteri mulai dari jam ke-72 (Gambar 10). Aktivitas enzim amilase sumber nitrogen kasein mempunyai nilai sebesar 2.335 U/mL, lalu tripton sebesar 2.143 U/mL, urea sebesar 2.106 U/mL, dan terakhir dengan ammonium sulfat dengan aktivitas enzim sebesar 1.683 U/mL (Gambar 11).
Gambar 11 Aktivitas enzim amilase dari bakteri laut Bacillus sp. pada berbagai sumber nitrogen. ammonium sulfat, kasein, tripton, urea.
PEMBAHASAN
Pertumbuhan Sel Bakteri
Pertumbuhan bakteri mengacu pada perubahan di dalam hasil panen sel (pertambahan total massa sel) dan bukan perubahan individu organisme. Umumnya, pertambahan massa bakteri berbanding lurus (proporsional) dengan pertambahan komponen selular yang lain (Pelczar dan Chan 2008). Pertumbuhan sel mempunyai beberapa tahapan atau fase yaitu fase lag, fase eksponensial, fase stasioner, dan terakhir yaitu fase kematian dimana adanya penurunan populasi sel-sel hidup. Fase-fase tersebut mencerminkan keadaan bakteri dalam kultur pada waktu tertentu. Pertumbuhan mikroorganisme akan berlangsung setelah fase lag jika populasi mikroorganisme tersebut diinokulasikan pada media pertumbuhan segar (Tedja Imas 2009). Peremajaan bakteri laut penghasil enzim amilase dilakukan dalam media pati 0.5% karena umumnya tingkat pertumbuhan maksimal telah dicapai pada kondisi tersebut. Bakteri laut Bacillus sp. tumbuh dalam media pati 0.5% saat hari ke-3 sejak ditanam.
paling tinggi atau paling optimum ketika jam ke-24 (fase log), lalu terjadi fase stasioner dikisaran jam ke-48 hingga jam ke-72. Selanjutnya terjadi fase kematian. Pada kurva pertumbuhan sel bakteri tidak terlihat adanya fase lag, hal ini dikarenakan pengukuran dilakukan 24 jam sekali, sehingga perubahan yang terjadi dalam kurun waktu kurang dari 24 jam tidak diketahui. Pertumbuhan sel bakteri mencapai titik optimum pada jam ke-24, terjadi pertumbuhan yang sangat cepat, setelah jam ke-24 semua bakteri dalam media produksi mengalami penurunan jumlah pertumbuhan sel bakteri. Suhu pertumbuhan optimum memungkinkan pertumbuhan tercepat terjadi dalam waktu yang singkat yaitu 12-24 jam (Pelczar dan Chan 2008).
Bakteri laut Bacillus sp. menunjukkan titik optimum yang berbeda pada perlakuan optimasi konsentrasi substrat dibandingkan dengan perlakuan optimasi lainnya, dimana titik optimum bakteri lebih lama terjadi. Hal ini disebabkan karena konstanta laju pertumbuhan dari bakteri memiliki nilai yang berbeda, yang tergantung pada kemampuan metabolisme bakteri tersebut (Dwipayana dan Herto 2011). Awal fase adaptasi yang dilakukan pada awal analisis juga mempengaruhi perbedaan titik optimum, dimana fase adaptasi ini dipengaruhi langsung oleh medium, lingkungan pertumbuhan, serta jumlah inokulum (Wahyu dan Ikhsan 2010). Ketidakstabilan lingkungan pada masa awal pengujian serta jumlah inokulum dari media prekultur yang berbeda yang menyebabkan adanya perbedaan titik optimum pada penelitian ini. Analisis kurva pertumbuhan bakteri dibuat untuk melihat fase-fase pertumbuhan dari bakteri (Dwipayana dan Herto 2011). Selain itu, untuk mengetahui waktu dan umur kultur mikroba yang akan dipanen (Prima Nanda 2013).
Konsentrasi Pati Optimum
Enzim α-amilase merupakan enzim yang dapat diinduksi dan umumnya
diinduksi dengan adanya pati atau produk hidrolitiknya. Pati merupakan sumber karbon yang baik untuk menginduksi produksi enzim amilase (Kumar et al. 2012). Penggunaan pati paling menjanjikan dan telah digunakan dimana-mana (Gupta et al 2003). Menurut Vishnu et al. (2014), pati diterima secara umum sebagai komponen nutrisi untuk induksi enzim amilolitik. Begitu pula menurut Hagihara et al. (2001) yang menyatakan bahwa pati merupakan sumber karbon yang baik untuk sintesis amilase oleh Bacillus sp. Konsentrasi pati yang akan digunakan dalam media kultur menjadi hal yang penting karena konsentrasi nutrien dapat mempengaruhi laju pertumbuhan dan juga produk kultur. Konsentrasi dalam penelitian yaitu konsentrasi pati 1%, 2.5%, dan 5% dipilih berdasarkan penelitian sebelumnya dengan sedikit modifikasi (Rahmani et al. 2011).
aktivitas enzim amilase yang lebih kecil dibanding dengan konsentrasi substrat 1% karena substrat pati saat dipecah menjadi molekul yang lebih sederhana jumlahnya menjadi tinggi dan menjadi penghambat. Hal tersebut dikarenakan secara kinetik konsentrasi rendah akan menjadi substrat pembatas, sedangkan konsentrasi yang tinggi akan menjadi substrat penghambat (Arnata 2009). Konsentrasi substrat yang tinggi dapat menjadi penghambat yang memperlambat proses hidrolisis.
Aktivitas enzim amilase mengalami peningkatan dari jam ke-0 hingga jam ke-72 dan menurun dari jam ke-72 hingga jam ke-120 (Gambar 2). Aktivitas enzim amilase paling tinggi dihasilkan pada saat pertumbuhan sel bakteri berada dalam fase stasioner, yaitu pada jam ke-72. Peningkatan aktivitas enzim amilase terjadi ketika jumlah substrat yang tersedia masih cukup banyak, sehingga molekul yang dihasilkan juga meningkat. Namun, pada waktu tertentu mengalami penurunan yaitu pada jam ke-72 dan seterusnya karena jumlah substrat semakin berkurang. Hal ini disebabkan telah banyak substrat yang terhidrolisis sehingga molekul yang dihasilkan cenderung menurun atau konstan (Kodri 2013).
pH Optimum Produksi
Nilai pH media pertumbuhan bakteri mempunyai peranan yang sangat penting dengan menginduksi perubahan morfologi bakteri dan sekresi enzim (Gupta et al. 2003). Nilai pH juga mempengaruhi penyerapan nutrisi dan aktivitas fisiologi mikroba sehingga mempengaruhi pertumbuhan biomassa dan pembentukan produknya. pH optimum pertumbuhan mengacu pada pH ekstraselular lingkungan sementara pH intraselular harus relatif netral untuk mencegah rusaknya makromolekul yang labil asam atau alkalin dalam sel (Tedja Imas 2009).
Berdasarkan hasil penelitian didapatkan pH optimum untuk bakteri laut Bacillus sp. yaitu pH 7 (Gambar 4). Ketika pH media produksi semakin dinaikkan, yaitu pH 8 dan pH 9 terlihat adanya penurunan jumlah aktivitas enzim amilase yang dihasilkan. Hal ini sama ketika pH media produksi berada di bawah pH 7, yaitu pH 5 dan pH 6 dimana terjadinya penurunan hasil. Hal ini sesuai dengan literatur yang ada, karena pH optimum pertumbuhan bagi kebanyakan bakteri terletak antara 6.5 dan 7.5 (Pelczar dan Chan 2008).
Suhu Fermentasi Optimum
Suhu merupakan faktor lingkungan utama yang dapat mempengaruhi pertumbuhan dan sintasan mikroorganisme. Suhu dapat mempengaruhi pola pertumbuhan bakteri, juga dapat mempengaruhi laju pertumbuhan, dan jumlah total pertumbuhan organisme (Pelczar dan Chan 2008). Sel-sel mikroba tidak dapat mengontrol suhu mereka dan karena itu menganggap suhu lingkungan sebagai habitat alami mereka. Kelangsungan hidup mikroba tergantung pada kemampuan beradaptasi pada berbagai variasi suhu yang ditemui di habitatnya (Kathleen 2005). Setiap spesies bakteri tumbuh pada suatu kisaran suhu tertentu, seperti Bacillus spp. mempunyai suhu optimum 35oC (Vidyalakshmi et al. 2009), Bacillus sp. pada suhu 40oC (Vishnu et al. 2014), Bacillus sp. VITRKHB dengan suhu optimum 45oC (Bhaskara Rao et al. 2013), dan Bacillus Subtilis pada suhu 37oC (Amutha dan Jaya Priya 2011).
Hasil penelitian menunjukkan bahwa suhu optimum untuk bakteri laut Bacillus sp. yaitu sebesar 30oC (Gambar 6). Pertumbuhan sel bakteri terlihat meningkat dimulai dari 20oC hingga mencapai suhu optimum pada suhu 30oC, lalu sedikit menurun pada suhu 40oC, dan terakhir turun drastis pertumbuhannya bahkan cenderung tidak tumbuh bakteri yang ditanam pada suhu 50oC (Gambar 6). Hal tersebut dikarenakan suhu yang terlalu rendah atau terlalu tinggi tidak memungkinkan mikroorganisme untuk tumbuh. Reaksi kimia dan enzimatik mikroorganisme meningkat jika suhu meningkat, begitu pula dengan laju pertumbuhannya. Namun, diatas suhu tertentu protein tertentu dapat mengalami denaturasi (Tedja Imas 2009). Suhu pertumbuhan optimum memungkinkan pertumbuhan tercepat terjadi dalam waktu yang singkat yaitu 12-24 jam (Pelczar dan Chan 2008). Hal ini sesuai dengan hasil yang diperlihatkan pada Gambar 6, dimana pertumbuhan sel bakteri mencapai titik puncak pada jam ke-24. Pola pertumbuhan bakteri terlihat sangat dipengaruhi suhu, karena kenaikan 10oC membuat kecepatan reaksipun naik berlipat ganda (Prescott et al. 2008).
Aktivitas enzim amilase dari bakteri laut Bacillus sp. juga mempunyai hubungan linier dengan pertumbuhan sel bakteri, yaitu mempunyai nilai optimum pada suhu 30oC (Gambar 7). Sebelum mencapai suhu 30oC terlihat bahwa aktivitas enzim amilase lebih rendah, hal ini terjadi karena pada suhu tersebut energi aktivasi yang diperlukan untuk menghidrolisis substrat belum maksimal. Lain halnya dengan suhu 50oC yang merupakan temperatur yang tinggi untuk bakteri laut Bacillus sp. ini, dimana terjadinya penurunan yang drastis yang disebabkan karena rusaknya atau matinya bakteri tersebut sehingga tidak bisa menghasilkan enzim amilase. Hasil yang sama ditunjukkan oleh bakteri Bacillus licheniformis yang mempunyai suhu optimum sebesar 30oC untuk memproduksi enzim amilase (Sankaralingam et al. 2012). Suhu 30oC memperlihatkan nilai aktivitas enzim amilase yang paling tinggi dibandingkan yang lain karena reaksi metabolisme mikroorganisme dikatalisasi
dengan baik oleh enzim (Rofi’i 2009). Nilai aktivitas enzim paling optimum pada
Ko-substrat Optimum
Sumber karbon memiliki efek untuk mengubah strain produksi ataupun kondisi lainnya (Ashwini et al. 2011). Karbon meliputi 50% dari berat kering sel dan karbon merupakan unsur utama dalam makromolekul. Sifat dan konsentrasi sumber karbon bergantung pada mikroorganisme yang akan dikulturkan (Tedja Imas 2009). Penambahan sumber karbon dalam bentuk karbohidrat berpengaruh baik untuk produksi enzim. Beberapa jenis karbohidrat seperti maltosa, sukrosa, glukosa, dan galaktosa masing-masing diuji dalam penelitian ini agar didapatkan sumber karbon lain yang dapat membantu bakteri laut Bacillus sp. untuk menghasilkan produksi optimum enzim amilase. Penambahan ko-substrat dilakukan sebagai substrat awal selama bakteri beradaptasi dengan substrat utamanya (Dwipayana dan Herto 2011)
Berdasarkan hasil penelitian menunjukkan bahwa pertumbuhan sel bakteri paling optimal terjadi pada jam ke-24 dengan maltosa dan glukosa sebagai ko-substrat yang menunjukkan titik optimum paling tinggi (Gambar 8). Lalu diikuti dengan galaktosa dan sukrosa. Aktivitas enzim amilase mulai terlihat ketika pertumbuhan sel bakteri mencapai jumlah sel bakteri optimum dan aktivitas enzim amilase mencapai titik optimum ketika pertumbuhan sel bakteri ada dalam fase stasioner yaitu pada jam ke-72. Hasil penelitian pada Gambar 9 menunjukkan bahwa aktivitas enzim amilase paling optimum dicapai oleh ko-substrat maltosa. Glukosa menunjukkan hasil yang berbanding terbalik, dimana media glukosa baik untuk pertumbuhan sel bakteri, namun tidak untuk aktivitas enzim amilase. Beberapa penelitian sebelumnya juga menunjukkan maltosa sebagai sumber karbon paling baik pada media pertumbuhan, diantaranya pada Bacillus sp. (Thippeswamy et al. 2006) dan Bacillus spp. (Grata et al. 2008). Juga, hal yang sama dilaporkan oleh Santos dan Martin (2003), dimana produksi maksimum α-amilase dari bakteri Bacillus sp. pada fase eksponensial (350 U mL-1) dengan medium yang mengandung 1% pati terlarut dan 1% maltosa.
Sumber Nitrogen Optimum
Bakteri membutuhkan nitrogen untuk pertumbuhannya. Bakteri sangat beragam dalam hal nitrogen yang dibutuhkan. Umumnya, media pertumbuhan mengandung substansi-substansi rumit tertentu seperti pepton, ekstrak daging, dan kadang-kadang ekstrak khamir yang dilarutkan dalam sejumlah air sehingga dihasilkan media yang menunjang pertumbuhan berbagai ragam bakteri dan mikroorganisme lain (Pelczar dan Chan 2008). Nitrogen juga dibutuhkan oleh sel sebagai senyawa nutrisi kunci pada pertumbuhan sel dan membantu penghancuran bahan-bahan organik (Nugraha 2006). Selain itu nitrogen mempunyai peranan penting dalam perkembangan bakteri (Kumar et al. 2012).
memproduksi enzim yang dibutuhkan untuk mensintesis senyawa (substrat) yang mengandung karbon. Keberadaan nitrogen penting untuk protein, asam nukleat, dan penyusun sel (Tedja Imas 2009). Hasil yang ditunjukkan pada optimasi sumber nitrogen ini tidak berbeda jauh nilainya dengan media kultur yang tidak ditambahkan sumber nitrogen lainnya dengan kondisi yang sama (Gambar 3). Kasein menjadi sumber nitrogen terbaik untuk bakteri dalam beberapa penelitian sebelumnya seperti Bacillus sp. megaterium BPTK5 (Kumar et al. 2012) dan Bacillus subtilis IP 5832 (Bozic et al. 2011).
SIMPULAN DAN SARAN
Simpulan
Produksi optimum enzim amilase ditemukan pada konsentrasi substrat pati 1%, pH 7, suhu 30oC, maltosa sebagai ko-substrat, dan kasein sebagai sumber nitrogen produksi dengan nilai aktivitas enzim amilase paling optimum berturut-turut sebesar 2.547 U/mL, 2.109 U/mL, 2.414 U/mL, 2.675 U/mL, dan terakhir 2.335 U/mL. Produksi enzim amilase optimum terjadi saat pertumbuhan sel bakteri pada fase stasioner yaitu jam ke-72.
Saran
Optimasi produksi enzim amilase dari bakteri laut Bacillus sp. ini sebaiknya dilanjutkan dengan optimasi pada kondisi lingkungan dan nutrien media produksi lainnya, seperti kondisi agitasi, aerasi, dan kadar garam sehingga didapatkan kondisi yang lebih optimum. Kemudian dapat dilanjutkan dengan pemurnian pada enzim amilase yang dihasilkan, analisis kinetika enzim amilase tersebut, dan pengujian lebih lanjut produksi oligasakarida yang dihasilkan agar bisa diaplikasikan lebih luas.
DAFTAR PUSTAKA
Agustini NWS dan Kusmiati. 2009. Identifikasi dan uji aktivitas antibakteri senyawa aktif secara maserasi dan digesti dalam berbagai pelarut dari mikroalga Dunaliella salina. Seminar Nasional IX Pendidikan Tinggi FKIP UNS 544-551.
Amutha K dan Jaya Priya. 2011. Effect of pH, temperature, and metal ions on amylase activity from Bacillus subtilis KCX 006. International Journal of Pharma and Bio Sciences 2(2).
Ariani Hatmanti. 2000. Pengenalan Bacillus spp. Oseana 25(1): 31-41.
dan Saccharomyces cerevisiae [Disertasi]. Bogor (ID): Institut Pertanian Bogor.
Ashwini K, Gaurav K, Karthik L, dan Bhaskara Rao KV. 2013. Optimization, production and partial purification of extracellular α-amylase from Bacillus sp. marini. Archives of Applied Science Research 3(1): 33-42.
Bernfeld P. 1955. Amylase α- and β-methodes. J Enzymol: 149-158.
Bhaskara Rao KV, Bose H, Richa K, Singh K, Karthik L, dan Kumar G. 2013. RSM mediated optimization of amylase production from marine Bacillus sp. VITRKHB. Research Journal of Pharmaceutical, Biological, and Chemical Sciences 4(4): 523-536.
Bozic N, Ruiz J, Lopez-Santin J, dan Vujcic Z. 2011. Optimization of the growth and
α-amylase production of Bacillus subtilis IP 5832 in shake flask and laboratory fermenter batch cultures. J Serb Chem Soc 76(7):965–972.
Copeland RA. 2000. Methods for Protein Analysis: A Practical Guide to Laboratory Protocols. New York: Chapman and Hall.
Dwipayana dan Herto Dwi. 2011. Identifikasi keberagaman bakteri pada lumpur hasil pengolahan limbah cat dengan teknik konvensional. Program Studi Teknik Lingkungan Fakultas Teknik Sipil dan Lingkungan Institut Teknologi Bandung, Bandung.
Grata K, Nabrdalik M, dan Latala A. 2008. Effect of different carbon sources on amylolytic activity of Bacillus spp. isolated from natural environment. Proceedings of ECOpole 2(2).
Gupta R, P Gigras, H Mohapatra, VK Goswami, dan B Chauhan. 2003. Microbial α
-amylases: A biotechnological perspective. Proc. Biochem. 38:1599-1616. Hagihara H, Igarashi K, dan Hayashi Y. 2001. Novel alpha amylase that is highly
resistant to chelating reagents and chemical oxidants from the alkaliphilic Bacillus isolate KSM-K38. Applied and Environmental Microbiology 67:1744-1750.
Kathleen. 2005. Foundation in Microbiology 5rd. New York: Mc Graw Hill.
Kodri, Bambang DA, dan Rini Y. 2003. Pemanfaatan enzim selulase dari Trichoderma reseei dan Aspergillus niger sebagai katalisator hidrolisis enzimatik jerami padi dengan pretreatment microwave. Jurnal Bioproses Komoditas Tropis 1 (1):36-43.
Kolusheva T dan Marinova A. 2007. A Study of the optimal conditions for starch hydrolysis through thermostable α-amylase. Journal of the University of Chemical Technology and Metallurgy. 42(1):93-96.
Kosim M dan Putra S. 2010. Pengaruh suhu pada protease dari Bacillus subtilis [Skripsi]. Surabaya (ID): Institut Teknologi Sepuluh November.
from cassava waste. European Journal of Experimental Biology 2(3):590-595.
Lehninger AL. 2008. Dasar-dasar Biokimia, Jilid 1. Thenawidjaja M, penerjemah. Jakarta: Erlangga. Terjemahan dari: Principles of Biochemistry.
Liu J, Zhang Z, Zhu H, Dang H, Lu J, dan Cui Z. 2011. Isolation and characterization
of α-amilase from marine Pseudomonas sp. K6-28-040. J Biotechnol 10 (14): 2733 -2740.
Margareth Pratiwi. 2007. Karakterisasi α-amilase dari bakteri laut Vibrio sp. B10.2.8 [Disertasi]. Bandung (ID): Institut Teknologi Bandung.
Miller GL. 1959. Use of dinitrosalisylic acid reagent for determination of reducing sugar. Anal Chem 31(3):426–428.
Nugraha Roni. 2006. Produksi enzim selulase oleh Penicillium nalgiovense SS240 pada substrat tandan sawit [Skripsi]. Bogor (ID): Institut Pertanian Bogor. Pelczar MJ dan Chan ECS. 2008. Dasar-Dasar Mikrobiologi. Jakarta: UI Press. Prescott, Harley LM, dan Klein. 2008. Microbiology 7th edition. USA: McGraw-Hill
Book Company.
Prima NF, Jetty N, dan Chrysanti. 2013. Pengaruh laju pertumbuhan dan waktu generasi terhadap penghambatan pertumbuhan koloni strain Klebsiella pneumoniae ATCC 700603, CT1538 dan S941 Oleh Lactobacillus bulgaricus KS1 dalam soyghurt. Universitas Padjajaran, Bandung.
Rahmani N, Yopi, Andriani A, dan Awan P. 2011. Karakteristik dan pengembangan karbohidrat dari umbi kentang hitam (Coleus tuberosus Benth), ubi kayu (Manihot esculenta) [Laporan Teknis]. Bogor: Lembaga Ilmu Pengetahuan Indonesia.
Rahmani N, Yopi, Andriani A, dan Alex Prima. 2011. Production and characterization of amylase enzyme from marine bacteria. Proceeding of the 2nd International Seminar on Chemistry: 255-259.
Rofi’i Fatkhan. 2009. Hubungan antara jumlah total bakteri dan angka katalase
terhadap daya tahan susu [Skripsi]. Bogor (ID): Institut Pertanian Bogor. Rostinawati Tina. 2008. Skrining dan identifikasi bakteri penghasil enzim kitinase
dari air laut di perairan pantai pondok Bali. Bandung (ID): Universitas Padjajaran.
Sankaralingam S, Shankar T, Ramasubburayan R, Prakash S, dan Kumar C. 2012. Optimization of culture condition for the production of amylase from Bacillus sp. licheniformis on submerged fermentation. American-Eurasian J. Agric & environ. Sci. 12 (11):1507-1513.
Santos EO dan Martinus ML. 2003. Effect product of the medium composition on formation of amylase by Bacillus sp. Brazilian Arch Biol Technol (46). Sivaramakrishnan S, Gangadharan D, Nampoothiri KD, Sossol CR, dan Pandey A.
Sutiamiharja N. 2008. Isolasi Bakteri dan Uji Aktivitas Amilase kasar Termofilik dari Sumber Air Panas Gurukinayan Karo Sumatera Utara. USU Repository. Sumatera Utara.
Tedja Imas Sunatmo. 2009. Mikrobiologi Esensial 1. Jakarta: Ardy Agency.
Thippeswamy S, Girigowda K, dan Mulimani VH. 2006. Isolation and identification
of α–amylase producing Bacillus sp. from dhal industry waste. Indian
Journal of Biochemistry & Biophysics 43:295-298.
Todar K. 2008. The Growth of Bacterial Population. Text Book Of Bacteriology. Van Der Maarel, Van Der Veen, Uitdehaaq, Leemhuis, dan Dijkhuizen. 2002.
Properties and application of starch-converting enzymes of the α-amylase family. Journal of Biotechnology 94: 137–155.
Vidyalakshmi R, Paranthaman R, dan Indhumathi J. 2009. Amylase production on submerged and fermentation by Bacillus spp. World J. Chemistry 43(4): 89-91.
Vishnu TS, Soniyamby AR, Praveesh BV, dan Hema AT. 2014. Production and optimization of extracellular amylase from soil receiving kitchen waste isolate Bacillus sp. VS 04. World Applied Sciences Journal 29 (7): 961-967. Wahyu Pamungkas dan Ikhsan Khasani. 2010. Uji pendahuluan: efektivitas Bacillus
sp. dalam peningkatan nilai nutrisi bungkil inti sawit melalui fermentasi. Prosiding Forum Inovasi Teknologi Akuakultur: 769-774.
Lampiran 1 Diagram alir penelitian
Peremajaan bakteri laut Bacillus sp.
Pembuatan media cair
Prekultur bakteri laut Bacillus sp.
Optimasi suhu fermentasi Optimasi pH media produksi
Optimasi konsentrasi substrat pati media produksi
Pengolahan data
Uji pertumbuhan sel dan uji aktivitas
enzim
Uji pertumbuhan sel dan uji aktivitas
enzim
Uji pertumbuhan sel dan uji aktivitas
enzim
Uji pertumbuhan sel dan uji aktivitas
enzim Optimasi sumber karbon media produksi
Optimasi sumber nitrogen media produksi Uji pertumbuhan sel dan uji aktivitas
Lampiran 2 Hasil pengukuran pertumbuhan sel pada optimasi konsentrasi substrat media produksi
Keterangan : FP = faktor pengenceran
Contoh perhitungan konsentrasi substrat media pati 1% jam ke-0: Fp = A1 x 10 Fp = A2 x 10
= 0.122 x 10 = 0.131 x 10 = 1.220 A = 1.310 A
Rata-rata = Ulangan 1 + Ulangan 2 = 1.220 + 1.310 = 1.265 A
2 2
Lampiran 3 Kurva standar D-glukosa pada optimasi konsentrasi substrat media produksi
Standar (ppm) Absorban (A)
Lampiran 4 Hasil pengukuran aktivitas enzim amilase pada optimasi konsentrasi
Contoh perhitungan aktivitas enzim amilase pada konsentrasi pati 1.00% jam ke-0 : S – K = sampel – kontrol = 0.441 - 0.330 = 0.111 A
y = 0.0036x + 0.0713
x (ppm) = y + 0.0713 = 0.111 + 0.0731 = 51.000 ppm 0.0036 0.0036
Aktivitas enzim U/mL = Gula pereduksi mg/ml x FP x Waktu reaksi x BM glukosa
= 0.051 mg/mL x 100 x 1000 30 x 180
= 0.944 U/mL
Lampiran 5 Hasil pengukuran pertumbuhan sel pada optimasi pH media produksi
pH Waktu Inkubasi
Lampiran 6 Kurva standar D-glukosa pada optimasi pH media produksi
Lampiran 8 Hasil pengukuran pertumbuhan sel pada optimasi suhu fermentasi
Lampiran 9 Kurva standar D-glukosa pada optimasi suhu fermentasi
Lampiran 11 Hasil pengukuran pertumbuhan sel pada optimasi ko-substrat media
Lampiran 12 Kurva standar D-glukosa pada optimasi ko-substrat media produksi
Lampiran 14 Hasil pengukuran pertumbuhan sel pada optimasi sumber nitrogen
RIWAYAT HIDUP
Penulis dilahirkan di Bogor pada tanggal 4 Juli 1992 dari ayah bernama Nasripin dan ibu bernama Lela Hidayati. Penulis merupakan anak kedua dari 3 bersaudara. Tahun 2010 penulis menyelesaikan pendidikan Sekolah Menengah Atas di SMA Negeri 5 Bogor dan pada tahun yang sama lolos seleksi masuk Institut Pertanian Bogor (IPB) melalui jalur Undangan Seleksi Masuk IPB (USMI) dan diterima di Departemen Biokimia, Fakultas Matematika dan Ilmu Pengetahuan Alam.
Selama mengikuti perkuliahan penulis pernah menjadi asisten praktikum mata kuliah Biologi Dasar tahun 2012-2013, Biokimia Umum untuk mahasiswa THP tahun ajaran 2013/2014, Biokimia Hewan untuk mahasiswa Paramedik veteriner tahun ajaran 2013/2014. Penulis juga aktif dalam kegiatan organisasi kampus, diantaranya sebagai anggota Departemen Kewirausahaan Badan Eksekutif Mahasiswa Tingkat Persiapan Bersama (BEM TPB) periode 2010/2011, sebagai anggota Departemen Minat Bakat dan Pengembangan Diri (MBM) BEM FMIPA periode 2011/2012, dan sebagai sekretaris Departemen MBM BEM FMIPA periode 2012/2013.
Penulis juga pernah aktif dalam beberapa kepanitiaan seperti panitia Pemilihan Raya Keluarga Mahasiswa 2010, Biochemistry Champion League 2011-2012, Pesta Sains Nasional 2011-2013, Gebyar Nusantara 2011, Biochemistry Fair 2011, SPIRIT FMIPA 2012-2013, Seminar Kesehatan 2012, Masa Perkenalan Kampus Mahasiswa Biokimia tahun 2012, Seminar dan Kajian Ilmiah Kehalalan 2012, ASPECT BEM FMIPA IPB 2012, Leadership Training 2012, MIPA GO FIELD 2012, IPB Green Living Movement 3 2013, dan Sehari Menjadi Mahasiswa FMIPA IPB 2013. Juni 2014, penulis mengikuti pelatihan pengenalan HACCP SNI CAC/RCP 1:2011, Bulan Juni-Juli 2012 penulis mengikuti kegiatan IPB Goes To Field di Kota Demak, Bulan Januari-Februari 2013 penulis melakukan magang di Laboratorium Biokimia BB Biogen, dan Bulan Juli-Agustus 2013 penulis melakukan Praktik Lapang di Laboratorium Biokimia, Balai Besar Penelitian dan Pengembangan Bioteknologi dan Sumberdaya Genetik (BB Biogen) Bogor dengan judul Deteksi dan Identifikasi Virus Chilli Veinal Mottle Potyvirus (ChiVMV) pada Tanaman Cabai Varietas Beauty Bell.