POTENSI PEMANFAATAN LIMBAH
PALM OIL MILL
EFFLUENT
(POME) SEBAGAI MEDIA KULTIVASI
MIKROALGA
Nannochloropsis
sp.
NURSYAFIRAH ASHARI
DEPARTEMEN ILMU DAN TEKNOLOGI KELAUTAN FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini Saya menyatakan bahwa Skripsi yang berjudul Potensi Pemanfaatan Limbah Palm Oil Mill Effluent (POME) sebagai Media Kultivasi Mikroalga Nannochloropsis sp. adalah benar merupakan hasil karya sendiri dan belum diajukan dalam bentuk apa pun kepada Perguruan Tinggi mana pun. Semua sumber data dan informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir Skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
ABSTRAK
NURSYAFIRAH ASHARI. Potensi Pemanfaatan Limbah Palm Oil Mill Effluent (POME) sebagai Media Kultivasi Mikroalga Nannochloropsis sp. Dibimbing oleh MUJIZAT KAWAROE dan TRI PRARTONO.
Nannochloropsis sp. merupakan mikroalga yang memiliki kandungan karbohidrat, protein, dan lemak tinggi serta berpotensi sebagai bahan baku biofuel. Limbah Palm Oil Mill Effluent (POME) memiliki kandungan nutrien cukup besar yang dapat menunjang pertumbuhan mikroalga. Penelitian ini bertujuan untuk membandingkan pengaruh pemberian limbah POME pada media kultivasi terhadap pertumbuhan Nannochloropsis sp. Ada 3 perlakuan yang dilakukan yaitu kontrol, penambahan limbah POME 10% (P1) dan 30% (P2) selama periode kultivasi 18 hari. Analisis yang dilakukan adalah perhitungan kepadatan sel, biomassa sel, kualitas air media kultivasi, serta kadar air, abu, lemak, karbohidrat, dan protein. Hasil menunjukkan bahwa kepadatan sel dan biomassa Nannochloropsis sp. tertinggi terjadi pada perlakuan P1. Kadar air tertinggi pada kontrol sebesar 35.73±2.60%. Kandungan lemak tertinggi pada P1 sebesar 16.21±5.13%. Kandungan abu, protein dan karbohidrat tertinggi pada P2 secara berturut-turut sebesar 58.54±15.40%, 9.82±4.48% dan 9.01±2.00%. Perlakuan POME 10% memiliki pengaruh yang berbeda nyata dan potensial untuk dikembangkan ke arah pemanfaatan biodiesel.
Kata kunci: kultivasi, mikroalga, Nannochloropsis sp., POME
ABSTRACT
NURSYAFIRAH ASHARI. Utilization of Palm Oil Mill Effluent (POME) for Media Cultivation of Microalgae Nannochloropsis sp. Supervised by MUJIZAT KAWAROE and TRI PRARTONO.
Nannochloropsis sp. is a microalgae which contains high of carbohydrate, protein, and lipid. Nanochloropsis sp. also have a potential as biofuel main compound. Palm Oil Mill Effluent (POME) have sufficient nutrient to support microalgae growth. The aim of this research was to study the influence of POME cultivation media for the growth of Nannochloropsis sp. The treatment applied was control, POME addition at 10% (P1), and 30% (P2) during cultivation period of 18 days. The observation included growth observation, Nannochloropsis sp. biomass, water quality of media culture, and also water, ash, lipid, carbohydrate, and protein content. The results showed that the highest cell abundance and biomass was found in P1. The highest water content of 35.73±2.60% was control media, while the highest lipid content of 16.21±5.13% dry biomass was found in P1 cultivation media. P2 resulted in higher ash content, protein, and carbohydrate 8.54±15.40%, 9.82±4.48% and 9.01±2.00%, respectively. P1 has significant influence for microalgae growth and potential to be developed towards the utilization of biodiesel.
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Ilmu Kelautan
pada
Departemen Ilmu dan Teknologi Kelautan
POTENSI PEMANFAATAN LIMBAH
PALM OIL MILL
EFFLUENT
(POME) SEBAGAI MEDIA KULTIVASI
MIKROALGA
Nannochloropsis
sp.
NURSYAFIRAH ASHARI
DEPARTEMEN ILMU DAN TEKNOLOGI KELAUTAN FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR BOGOR
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah SWT atas segala karunia-Nya sehingga penulis dapat menyelesaikan penelitian dengan judul “Potensi Pemanfaatan Limbah Palm Oil Mill Effluent (POME) sebagai Media Kultivasi Mikroalga Nannochloropsis sp.”
Penulis mengucapkan terima kasih kepada Ibu Dr. Ir. Mujizat Kawaroe, M.Si dan Bapak Dr. Ir. Tri Prartono, M.Sc selaku dosen pembimbing yang telah memberikan bimbingan, saran, kritik, dan arahan selama berlangsungnya penelitian hingga menyelesaikan skripsi ini. Tidak lupa penulis ucapkan terima kasih juga kepada Dr. Ir. Neviaty P Zamani selaku dosen pembimbing akademik yang selalu memberikan bimbingan dan nasihat selama penulis berada di departemen Ilmu dan Teknologi Kelautan.
Penulis mengucapkan terima kasih kepada Surfactant and Bioenergy Research Centre (SBRC) atas bantuan secara moril dan materil, serta Lab Lingkungan BDP IPB yang telah membantu dalam analisis sampel.
Ungkapan terima kasih juga penulis sampaikan kepada kedua orang tua beserta keluarga yang selalu memberikan dukungan dan doa, kemudian juga kepada teman-teman satu bimbingan (Farhan, Aryo, Nuris, Niar, Mush), Indra Cahya Wardhana, Kak Vita, Ofa, Ipeh, Bang Eko, Bang Adit, dan ITK 48 yang selalu membantu dan memberikan dukungan hingga terselesaikannya penelitian ini.
Semoga skripsi ini dapat bermanfaat untuk kemajuan ilmu pengetahuan.
DAFTAR ISI
DAFTAR TABEL x
DAFTAR GAMBAR x
DAFTAR LAMPIRAN x
PENDAHULUAN 1
Latar Belakang 1
Tujuan Penelitian 2
METODE 2
Waktu dan Tempat 2
Alat dan Bahan 2
Prosedur Kerja 3
Persiapan Inokulan Nannochloropsis sp 3
Analisis Data 7
HASIL DAN PEMBAHASAN 7
Kepadatan Sel Nannochloropsis sp. 7
Biomassa Nannochloropsis sp. 8
Kualitas Air Media Kultivasi 10
Total C, N, P pada Media Kultivasi 13
Karakteristik Nannochloropsis sp. 14
SIMPULAN DAN SARAN 17
Simpulan 17
Saran 17
DAFTAR PUSTAKA 17
LAMPIRAN 20
DAFTAR TABEL
1 Total C, N, P pada media kultivasi mikroalga 13
2 Karakteristik (%) mikroalga spesies Nannochloropsis sp. 15
DAFTAR GAMBAR
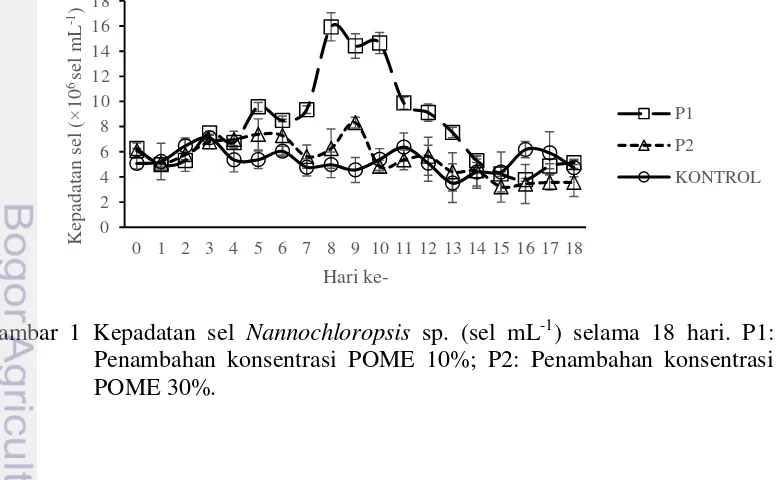
1 Kepadatan sel Nannochloropsis sp. (sel mL-1) selama 18 hari 7
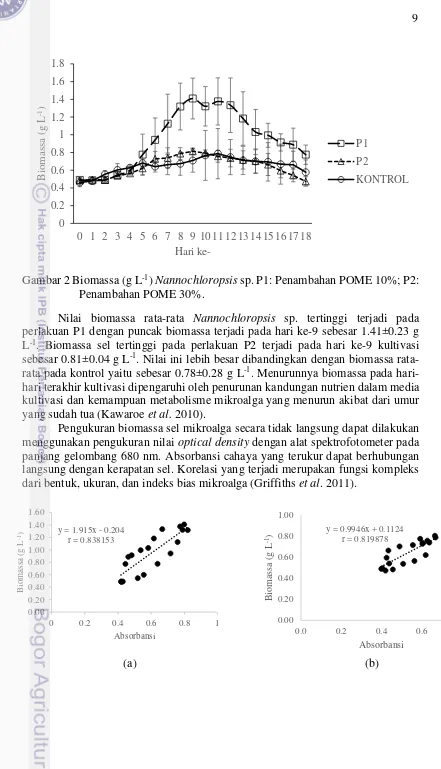
2 Biomassa (g L-1) Nannochloropsis sp. 9
3 Korelasi antara Biomassa Sel dengan Absorbansi 10 4 Suhu (°C) media kultivasi Nannochloropsis sp. selama 18 hari kultivasi 11 5 Salinitas (‰) media kultivasi Nannochloropsis sp. selama 18 hari kultivasi 12 6 Nilai pH media kultivasi Nannochloropsis sp. selama 18 hari kultivasi 12
DAFTAR LAMPIRAN
1 Perhitungan kadar Karbon 21
2 Perhitungan kadar Fosfor 21
3 Perhitungan kadar Nitrogen 21
4 Persamaan Kadar Air 22
5 Persamaan Kadar Abu 22
6 Perhitungan Karbohidrat 22
7 Perhitungan kadar Protein 22
8 Perhitungan kadar lemak 23
9 Dokumentasi 24
10 Perhitungan Analysis of Variance 25
11 Perhitungan Analysis of Variance kadar air 25
12 Perhitungan Analysis of Variance kadar abu 25
13 Perhitungan Analysis of Variance kadar karbohidrat 26
14 Perhitungan Analysis of Variance kadar lemak 26
1
PENDAHULUAN
Latar Belakang
Mikroalga adalah organisme mirip tumbuhan berukuran seluler yang tidak memiliki akar, batang, maupun daun, secara umum dikenal dengan sebutan fitoplankton. Habitat hidupnya adalah wilayah perairan di seluruh dunia. Mikroalga memiliki klorofil sebagai pigmen fotosintesis. Dengan adanya klorofil, mikroalga dapat melakukan proses fotosintesis seperti tumbuhan tingkat tinggi lainnya dan memproduksi senyawa makanan yang dibutuhkan untuk pertumbuhannya, seperti glukosa (Kawaroe et al. 2015). Mikroalga mengandung beberapa komponen penting di antaranya karbohidrat, asam lemak, dan protein sehingga mikroalga dapat dijadikan sebagai bahan baku untuk memproduksi produk turunannya. Mikroalga telah diteliti menjadi alternatif sebagai pengganti komoditas tanaman darat sebagai sumber penghasil minyak karena kemampuannya yang dapat tumbuh pada waktu singkat dengan biomassa yang melimpah (Prartono et al. 2013). Salah satu mikroalga yang menghasilkan biofuel adalah Nannochloropsis sp. (Kawaroe et al. 2010).
Mikroalga Nannochloropsis sp. memiliki sel berwarna kuning kehijauan dan tidak berflagel. Bentuk selnya seperti bola, dan berukuran kecil dengan diameter 2-4 µm. Spesies ini mampu bertahan hingga salinitas 20 ‰ (Kawaroe et al. 2010) dan merupakan salah satu mikroalga yang banyak diteliti karena kandungan asam lemak tak jenuh, khususnya EPA yang berguna untuk status vascular tubuh manusia (Hu dan Gao 2003) serta memiliki kandungan minyak hingga 68% dari total bobot kering (Chisty 2007). Unsur hara yang dibutuhkan mikroalga terdiri dari mikronutrien dan makronutrien. Makronutrien antara lain C, H, N, P, K, S, Mg, dan Ca, sedangkan mikronutrien yang dibutuhkan antara lain adalah Fe, Cu, Mn, Zn, Co, Mo, Bo, Vn, dan Si. Diantara nutrien tersebut, N dan P sering menjadi faktor pembatas pertumbuhan mikroalga. Secara umum defisiensi nutrien pada mikroalga memengaruhi penurunan kandungan protein, pigmen fotosintesis dan kandungan produk karbohidrat serta lemak (Kawaroe et al. 2010).
2
biasanya hanya diolah dengan menggunakan metode aerobic dan anaerobic pond untuk menurunkan kadar COD dan BOD, namun POME masih mengandung unsur hara seperti N dan P yang berguna sebagai nutrisi dalam pertumbuhan mikroalga (Sari et al. 2012).
Oleh karena limbah POME memiliki kandungan bahan organik yang tinggi, maka limbah POME memiliki potensi untuk dimanfaatkan sebagai sumber nutrisi bagi mikroalga. Media air limbah dapat diolah secara biologis oleh mikroalga sekaligus memberikan masukan nutrisi untuk pertumbuhannya. Mikroalga bisa memanfaatkan senyawa anorganik yang terkandung dalam limbah melalui proses fotosintesis menjadi senyawa organik dengan bantuan klorofil dan energi cahaya (Kawaroe et al. 2010). Namun, tidak semua limbah dapat digunakan untuk menunjang pertumbuhan mikroalga. Sebagai contoh, limbah cair yang berasal dari pengolahan produk susu, serbuk gergaji dari penggilingan kayu, bahan terbuang dari industri pengalengan, lignin dan karbohidrat dari bubur pulp pabrik kertas mendorong pertumbuhan jenis tertentu dari ragi, bakteri, jamur, dan protozoa yang berbahaya untuk mikroalga (Kawaroe et al. 2010). Limbah POME merupakan salah satu limbah yang berpotensi sebagai sumber nutrisi untuk menunjang pertumbuhan mikoalga, sesuai dengan penelitian yang dilakukan Sari et al. (2012) yang menyatakan bahwa mikroalga yang dikultivasi dalam limbah POME tumbuh lebih baik dibandingkan dengan yang dikultivasi dengan pupuk teknis. Pemanfaatan POME sebagai nutrisi pada tanaman dapat memaksimalkan pengolahan limbah agar menjadi limbah yang tidak berbahaya serta dapat meningkatkan produksi mikroalga.
Tujuan Penelitian
Penelitian ini bertujuan membandingkan pengaruh penggunaan limbah POME dengan konsentrasi 10% dan 30% sebagai media kultivasi mikroalga spesies Nannochloropsis sp. berikut performa pertumbuhannya.
METODE
Waktu dan Tempat
Penelitian ini dilakukan pada Mei - Agustus 2015 di Surfactant and Bioenergy Research Centre (SBRC) dan Lab Bioprospeksi Kelautan ITK IPB.
Alat dan Bahan
3 Peralatan yang digunakan adalah aerator, autoklaf, Haemocytometer, mikroskop, Erlenmeyer, kertas saring, soxhlet extractor, neraca digital, spektrofotometer, desilator, pendingin tegak, pipet gondok 10 mL dan 25 mL, pemanas listrik, gelas ukur, oven, pH meter.
Prosedur Kerja
Sterilisasi Alat dan Bahan
Sebelum melakukan proses kultivasi mikroalga alat dan bahan yang akan digunakan terlebih dahulu disterilisasi. Tujuan sterilisasi adalah untuk mematikan mikroorganisme yang dapat mengganggu keberlangsungan hidup mikroalga selama proses kultivasi. Peralatan seperti Erlenmeyer, pipet, dan peralatan gelas lainnya harus dicuci dengan air sabun dan dibilas kemudian dikeringkan. Setelah peralatan kering, alkohol 70% disemprotkan ke peralatan yang akan digunakan. Sterilisasi bahan dilakukan terhadap air laut sebagai media kultivasi. Air laut terlebih dahulu disaring menggunakan kain saring kemudian dilakukan proses autoklaf dengan suhu 121 C selama 15 menit (Kawaroe et al. 2010).
Persiapan Inokulan Nannochloropsis sp.
Inokulan Nannochloropsis sp. yang digunakan pada penelitian ini merupakan koleksi Laboratorium Mikroalga SBRC - LPPM IPB. Inokulan tersebut diperbanyak dengan cara dikultivasi untuk digunakan pada penelitian utama. Inokulan yang digunakan pada masing-masing ulangan dalam setiap perlakuan adalah 7 L. Inokulan yang digunakan pada penelitian utama merupakan Nannochloropsis sp. yang telah masuk fase pertumbuhan eksponensial.
Media POME
Setelah umur kultivasi mencapai fase eksponensial, sampel mikroalga diambil untuk dimasukan ke dalam media POME. Kultivasi mikroalga pada skala laboratorium yang dilakukan selama 18 hari pada volume 21 liter. Mikroalga dikultivasi pada toples plastik 21 L yang ditempatkan di ruangan tertutup dengan suhu 25-30 C selama 18 hari. Pada saat kultivasi mikroalga, aerasi dan pencahayaan dengan menggunakan cahaya lampu 1000 lux dilakukan selama 24 jam. Kultivasi ini menggunakan rancangan acak lengkap yang terdiri atas 3 perlakuan dengan 3 kali ulangan, dengan rincian sebagai berikut:
1. Perlakuan POME 10% (P1): Sebagai media tumbuh, sebanyak 1.4 L limbah POME dicampur dengan 12.6 L air laut dan 7 L inokulan Nannochloropsis sp., serta ditambah pemberian pupuk Walne 21 mL pada awal kultivasi.
2. Perlakuan POME 30% (P2): Limbah POME sebanyak 4.2 L dicampur dengan air laut 9.8 L dan 7 L inokulan Nannochloropsis sp, kemudian ditambah pupuk Walne 21 mL.
3. Kontrol: Kultivasi Nannochloropsis sp. dipelihara dalam 21 L media air laut ditambah pupuk Walne sebanyak 21 mL.
Perhitungan Kepadatan Sel
4
Haemocytometer berisi Nannochloropsis sp. diletakan di bawah lensa objektif mikroskop dan dihitung jumlah sel. Perhitungan jumlah Nannochloropsis sp. dilakukan dengan perbesaran 10× dan dihitung dengan bantuan hand counter. Setiap perhitungan dilakukan dengan mencacah 5 lapang pandang masing-masing 4 kali pengulangan. Setelah didapatkan jumlah sel maka nilai kepadatan sel dapat dihitung menggunakan persamaan berikut (Kawaroe et al. 2010):
= � × × (1)
Keterangan: A = Kepadatan sel (sel mL-1), � = Jumlah sel yang teramati
Biomassa mikroalga
Biomassa Nannochloropsis sp. dihitung setiap hari dengan mengambil 500 mL sampel Nannochloropsis sp. pada masing-masing perlakuan. Sebanyak 250 ppm NaOH diberikan pada sampel tersebut agar sel-sel Nannochloropsis sp. mengendap. Setelah mengendap, sampel disaring dengan menggunakan kertas saring Whatman yang telah diketahui bobot awalnya. Proses penyaringan dilakukan dengan vacuum pump hingga seluruh sel Nannochloropsis sp. tersaring. Setelah proses penyaringan selesai, kertas saring dikeringkan di dalam oven bersuhu 100
C selama 2 jam kemudian ditimbang.
Biomassa mikroalga dihitung dengan menggunakan persamaan di bawah ini (Lin et al. 2012):
= − × � � (2)
Keterangan: X = Biomassa mikroalga (g L-1); = Bobot kertas saring setelah penyaringan (g); = Bobot kertas saring sebelum penyaringan (g)
Penetapan Kerapatan Sel
Sebanyak 5 mL kultivasi pada setiap perlakuan diambil setiap hari, kemudian ditetapkan kerapatan biomassa sel dengan menggunakan sprektrofotometer pada panjang gelombang 680 nm (Griffiths et al. 2011).
Pengukuran Kualitas Air
Parameter kualitas air yang diukur antara lain: pH, suhu, dan salinitas. Parameter pH dan suhu diukur dengan menggunakan pH meter, sedangkan salinitas diukur dengan hand refraktometer.
Analisis Karbon
5 menjadi panas. Larutan didiamkan di ruang asam hingga suhu larutan kembali normal. Apabila suhu sudah normal, larutan ditambah aquades hingga volume larutan menjadi 100 mL, nilai absorbansi diukur menggunakan spektrofotometer dengan panjang gelombang 561 nm. Persamaan kadar Karbon terdapat pada Lampiran 1.
Analisis Fosfor
Fosfor (P) merupakan salah satu nutrisi yang dibutuhkan mikroalga untuk tumbuh dengan subur. Pengukuran nilai fosfor dilakukan berdasarkan metode Stanous Chloride (Day dan Underwood 2002). Sample yang dibutuhkan untuk analisis fosfor yaitu sebanyak 10 mL. Kemudian ditambahkan 2 mL HCl lalu dipanaskan di atas hot plate hingga menguap dan menyisakan 1 mL larutan. Sebanyak 25 mL aquades ditambahkan kemudian diaduk hingga homogen. Larutan yang keruh disaring terlebih dahulu menggunakan kertas saring, apabila larutan sudah jernih ditambahkan indikator PP sebanyak 4 tetes. Larutan campuran kemudian diteteskan NaOH 1 N hingga larutan berwarna merah muda, lalu teteskan HCl 1 N hingga larutan berwarna bening kembali. Larutan standard dan blanko dibuat untuk dijadikan pembanding nilai fosfor hasil analisis. Larutan standard dibuat menggunakan 1 mL induk fosfat dengan konsentrasi 1000 ppm yang kemudian diencerkan menggunakan aquades sebanyak 100 mL setelah itu dipindahkan ke gelas beaker sebanyak 25 mL, sedangkan blanko dibuat menggunakan aquades 25 mL. Masing-masing larutan ditambahkan 0.5 mL Amonium Molybdate dan SnCl2 sebanyak 5 tetes. Larutan didiamkan selama 20 menit, kemudian diukur nilai absorbansi menggunakan spektrofotometer dengan panjang gelombang 690 nm. Persamaan kadar fosfor terdapat pada Lampiran 2.
Analisis Nitrogen
Analisis Nitrogen (N) dilakukan berdasarkan metode Semimikro Kjeldahl (Day dan Underwood 2002). Analisis ini membutuhkan minimal 50 mL sampel yang kemudian ditambahkan 1 mL H2SO4 dan dipanaskan di atas hot plate selama 1 jam. Hal ini bertujuan untuk mengikat unsur nitrogen yang ada di dalam larutan. Kemudian sampel yang telah dipanaskan, dimasukan ke dalam labu ukur untuk proses destilasi. Indikator yang digunakan adalah methylene blue dan methyl red yang diberikan ke masing larutan sebanyak 2 tetes. Setelah itu, masing-masing larutan didestilasi selama 10 menit. Larutan yang telah didestilasi kemudian dititrasi menggunakan NaOH 0.05 N hingga warna larutan berubah warna menjadi kehijauan, volume titran dicatat dan nilai N dapat dihitung. Persamaan kadar nitrogen terdapat pada Lampiran 3.
Pemanenan
Pemanenan mikroalga dilakukan dengan cara flokulasi menggunakan NaOH dengan konsentrasi 150 ppm (Kawaroe et al. 2010). Kemudian timbang biomassa basah mikroalga dengan menggunakan neraca digital. Hasil panen mikroalga dikeringkan dengan menggunakan oven dengan suhu 100 C selama 6 jam untuk menghilangkan kandungan air yang tersisa. Selanjutnya dilakukan penimbangan biomassa kering mikroalga dengan menggunakan neraca digital.
Penentuan Kadar Air
6
dan dimasukkan ke dalam cawan porselen untuk dikeringkan di dalam oven selama 3 – 6 jam pada suhu 105 °C. Selanjutnya cawan yang berisi mikroalga tersebut didinginkan dalam desikator, lalu ditimbang. Persamaan kadar air terdapat pada Lampiran 4.
Penentuan Kadar Abu
Sebanyak 2 g sampel yang sudah dikeringkan dimasukan ke dalam cawan porselen yang telah diketahui bobotnya. Sampel tersebut dimasukan ke dalam tanur listrik pada suhu maksimum 550 °C sampai pengabuan sempurna. Sampel didinginkan dalam desikator, kemudian ditimbang sampai bobot tetap. Persamaan kadar abu terdapat pada Lampiran 5.
Analisis Karbohidrat
Analisis karbohidrat dilakukan dengan menggunakan metode Luff Schrool (Apriyanto 1999). Sebanyak 5 g sampel dimasukan ke dalam Erlenmeyer 500 mL lalu tambahkan 200 mL larutan HCl 3%, direflux selama 3 jam, sample kemudian didinginkan dan dinetralkan dengan larutan NaOH 30%. Apabila sudah netral, larutan tersebut dipindahkan ke dalam labu ukur 500 mL dan ditera hingga tanda garis, kemudian disaring. Sebanyak 10 mL hasil saringan dipipet ke dalam Erlenmeyer 500 mL, ditambahkan 25 mL larutan luff school dan dimasukkan beberapa butir batu didih serta 15 mL air suling. Campuran tersebut dipanaskan selama 3 menit, lalu didinginkan. Sebanyak 15 mL larutan KI 20% dan 25 mL H2SO4 25% ditambahkan perlahan-lahan, kemudian secepatnya dititar dengan larutan tio 0.1 N dengan bantuan penunjuk larutan kanji 0.5%. Persamaan kadar karbohidrat terdapat pada Lampiran 6.
Analisis Protein Kasar
Analisis protein kasar dilakukan berdasarkan metode Semimikro Kjeldahl (Apriyanto 1999). Sebanyak 0.51 g sampel Nannochloropsis sp. dimasukkan ke dalam labu kjeldahl 100 mL. Sebanyak 2 g campuran selen dan 25 ml H2SO4 pekat ditambahkan kemudian dipanaskan menggunakan pemanas listrik selama 2 jam hingga mendidih dan larutan warna menjadi jernih kehijauan. Setelah didinginkan, larutan tersebut diencerkan dan dimasukan ke dalam labu ukur 100 mL, dan ditera sampai tanda garis. Sebanyak 5 mL larutan kemudian dipipet dan dimasukan ke dalam alat penyuling dan ditambahkan 5 mL NaOH 30% dan indikator PP. selanjutnya larutan tersebut disuling selama 10 menit, sebagai penampung gunakan 10 mL larutan asam borat 2% yang telah dicampur indikator, dan kemudian dititrasi dengan larutan HCl 0.01 N. Persamaan kadar protein kasar terdapat pada Lampiran 7.
Penentuan Kadar Lemak
7 berisi lemak ditimbang untuk mengetahui kadar lemak. Persamaan kadar lemak terdapat pada Lampiran 8.
Analisis Data
Analisis Statistik
Data pertumbuhan Nannochloropsis sp. yang diperoleh diuji secara statistik untuk mengetahui pengaruh perbedaan pada setiap perlakuan dengan kontrol. Analisis sidik ragam yang digunakan adalah metode Rancangan Acak Lengkap (RAL).
= � + � + � (3)
Keterangan: Y = Pengamatan perlakuan ke-i, ulangan ke-j : μ = Rataan umum populasi; τ = Pengaruh perlakuan ke-i; ϵ = Galat perlakuan ke-i, ulangan ke-j
Rancangan ini diolah dengan menggunakan software SPSS. Data yang diperoleh dianalisis menggunakan one way analysis of variance (ANOVA) dengan tingkat kepercayaan 95% dan taraf α = 0.05 serta dilakukan uji lanjut dengan uji Duncan untuk membandingkan pengaruh perbedaan yang nyata.
HASIL DAN PEMBAHASAN
Kepadatan Sel Nannochloropsis sp.
Hasil penelitian menunjukkan bahwa Nannochloropsis sp. pada P1 memiliki kepadatan sel yang lebih tinggi dibandingkan dengan P2 dan kontrol. Kepadatan sel Nannochloropsis sp. P1 dan P2 mengalami penurunan pada hari pertama kultivasi, sedangkan kontrol mengalami peningkatan (Gambar 1). Menurunnya kepadatan sel pada P1 dan P2 diduga karena sifat limbah POME asam dan tawar sehingga dapat menurunkan pH dan salinitas media kultivasi.
8
Perubahan media kultivasi ini menyebabkan mikroalga mengalami penekanan secara fisiologis sehingga mikroalga butuh waktu untuk beradaptasi (Kawaroe et al. 2010). Peningkatan kepadatan sel pada P1 dan P2 terjadi pada hari ke-2 hingga mencapai puncak tertinggi kepadatan sel. Secara umum kepadatan sel tertinggi terjadi pada P1, sedangkan kepadatan sel terendah terjadi pada kontrol. Kepadatan sel tertinggi pada P1 terjadi pada hari ke-8 dengan jumlah kepadatan sel 15.93±1.11 ×106 sel mL-1. Perlakuan P2 kepadatan sel tertinggi terjadi pada hari ke-9 sebesar 8.32±0.42 × 106 sel mL-1. Kepadatan sel tertinggi pada kontrol terjadi pada hari ke-3 kultivasi yaitu 7.10±0.51 ×106 sel mL-1. Rendahnya kepadatan sel Nannochloropsis sp. pada kontrol diduga dipengaruhi oleh masukan nutrisi tambahan yang berasal dari limbah POME pada P1 dan P2 yang dapat menunjang pertumbuhan mikroalga seperti Karbon, Nitrogen, dan Fosfor. Hal ini sesuai dengan penelitian yang dilakukan oleh Mahdi et al. (2012) yang menyatakan bahwa limbah POME dapat mencukupi kebutuhan nutrisi yang dibutuhkan mikroalga karena adanya kandungan nutrisi cukup besar dalam limbah POME. Menurut Richmond et al. (2004) Karbon, Nitrogen, dan Fosfor merupakan nutrien penting untuk proses metabolisme sel melalui pembentukan berbagai komponen struktural dan fungsional yang dibutuhkan mikroalga untuk tumbuh.
Hasil uji statistika menunjukkan bahwa pemberian limbah POME dengan konsentrasi 10% dan 30% dapat mempengaruhi kepadatan sel spesies Nannochloropsis sp. pada taraf nyata 5%. Hasil uji analysis of variance (ANOVA) dengan metode RAL memperlihatkan bahwa nilai P < 0.0001 yang artinya lebih kecil dari nilai α = 0.05. Hasil tersebut menyatakan tolak H0 sehingga membuktikan bahwa penambahan limbah POME dapat mempengaruhi kepadatan sel Nannochloropsis sp. Hasil uji Duncan memperkuat hipotesis bahwa konsentrasi POME yang memiliki pengaruh yang paling kuat terhadap pertumbuhan mikroalga adalah perlakuan P1. Hal ini berarti perlakuan P1 memberikan pengaruh yang berbeda nyata dibandingkan perlakuan P2 terhadap kontrol untuk meningkatkan kepadatan sel Nannochloropsis sp. Hasil uji ini dapat dilihat pada Lampiran 10.
Hasil penelitian Sari et al. (2012) menunjukkan bahwa pertumbuhan mikroalga akan semakin menurun seiring dengan penambahan konsentrasi limbah POME. Hal ini diduga dipengaruhi oleh sifat dari limbah POME yang asam, tawar, dan keruh sehingga dapat menggangu pertumbuhan mikroalga. Selain itu, pada penelitian terdahulu yang dilakukan oleh Suminto dan Hirayama (1996) pada media yang memiliki nutrien terlalu tinggi akan menyebabkan pertumbuhan mikroalga terhambat karena mikroalga tersebut memerlukan waktu yang lebih lama untuk beradaptasi.
Biomassa Nannochloropsis sp.
9
Gambar 2 Biomassa (g L-1) Nannochloropsis sp. P1: Penambahan POME 10%; P2: Penambahan POME 30%.
Nilai biomassa rata-rata Nannochloropsis sp. tertinggi terjadi pada perlakuan P1 dengan puncak biomassa terjadi pada hari ke-9 sebesar 1.41±0.23 g L-1. Biomassa sel tertinggi pada perlakuan P2 terjadi pada hari ke-9 kultivasi sebesar 0.81±0.04 g L-1. Nilai ini lebih besar dibandingkan dengan biomassa rata-rata pada kontrol yaitu sebesar 0.78±0.28 g L-1. Menurunnya biomassa pada hari-hari terakhir kultivasi dipengaruhi oleh penurunan kandungan nutrien dalam media kultivasi dan kemampuan metabolisme mikroalga yang menurun akibat dari umur yang sudah tua (Kawaroe et al. 2010).
Pengukuran biomassa sel mikroalga secara tidak langsung dapat dilakukan menggunakan pengukuran nilai optical density dengan alat spektrofotometer pada panjang gelombang 680 nm. Absorbansi cahaya yang terukur dapat berhubungan langsung dengan kerapatan sel. Korelasi yang terjadi merupakan fungsi kompleks dari bentuk, ukuran, dan indeks bias mikroalga (Griffiths et al. 2011).
10
Gambar 3 Korelasi antara Biomassa Sel dengan Absorbansi (a) POME 10% (P1), (b) POME 30% (P2), (c) Kontrol
Nilai absorbansi yang terukur akan semakin tinggi diikuti dengan semakin tingginya biomassa sel Nannochloropsis sp (Gambar 3). Hal ini menunjukkan bahwa peningkatan kerapatan sel seiring dengan peningkatan biomasa sel. Hubungan keeratan antara biomassa dan absorbansi menunjukkan nilai mendekati 1, artinya kedua variable ini memiliki korelasi yang kuat. Namun, adanya kandungan klorofil saat kultivasi atau kondisi media kultivasi yang berbeda dapat menimbulkan galat. Menggunakan optical density untuk mengukur biomassa sel yang memiliki pigmen harus berhati-hati terhadap potensi besar dan sumber-sumber yang menyebabkan ketidakakuratan. Panjang gelombang 680 nm dipilih karena dapat mengukur biomassa sel yang memiliki konsentrasi pigmen tinggi seperti mikroalga Nannochloropsis sp. dengan lebih baik sehingga dapat meminimalkan galat yang terjadi (Griffiths et al. 2011).
Hasil uji statistika menunjukkan bahwa pemberian limbah POME dengan konsentrasi 10% dan 30% dapat mempengaruhi biomassa sel spesies Nannochloropsis sp.pada taraf nyata 5%. Hasil uji analysis of variance (ANOVA) dengan metode RAL memperlihatkan bahwa nilai P < 0.0001 yang artinya lebih kecil dari nilai α = 0.05. Hasil tersebut menyatakan tolak H0 sehingga membuktikan bahwa penambahan limbah POME dapat mempengaruhi biomassa sel Nannochloropsis sp. Hasil uji Duncan memperkuat hipotesis bahwa konsentrasi POME yang memiliki pengaruh yang berbeda nyata terhadap pertumbuhan mikroalga adalah perlakuan P1. Hal ini berarti perlakuan P1 memberikan pengaruh yang berbeda nyata dibandingkan perlakuan P2 terhadap kontrol untuk meningkatkan biomassa sel Nannochloropsis sp.
Kualitas Air Media Kultivasi
Nilai suhu pada setiap media kultivasi baik yang diberi limbah POME dan kontrol menunjukkan nilai yang hampir sama yaitu ±27 C. Nilai suhu yang cukup stabil ini dipengaruhi oleh kultivasi yang dilakukan skala laboratorium memiliki kondisi lingkungan yang stabil serta pengukuran suhu dilakukan pada waktu yang sama setiap harinya yaitu pada pukul 10.00 WIB. Grafik hasil pengukuran suhu yang dilakukan setiap harinya (Gambar 4) memberi informasi bahwa pada kisaran suhu tersebut mikroalga jenis Nannochloropsis sp. tetap bisa hidup dengan baik.
11 Hal ini sesuai dengan pendapat Rocha et al. (2003) yang menyatakan bahwa kisaran optimal kultivasi mikroalga Nannochloropsis sp. adalah 25±5 C.
Gambar 4 Suhu (°C) media kultivasi Nannochloropsis sp. selama 18 hari kultivasi. P1: Penambahan POME 10%; P2: Penambahan POME 30%.
Suhu mempengaruhi fisiologi mikroalga dengan mengubah kecepatan reaksi kimia dan kestabilan komponen seluler. Beberapa organisme mengatur komposisi lemak untuk mengatur ketidakstabilan membran pada suhu yang berbeda (Wagenen et al. 2012).
12
Gambar 5 Salinitas (‰) pada media kultivasi Nannochloropsis sp. selama 18 hari kultivasi. P1: Penambahan POME 10%; P2: Penambahan POME 30%. Data hasil penelitian menunjukkan bahwa adanya perbedaan salinitas yang cukup tinggi antara ketiga perlakuan. Perlakuan P2 memiliki nilai salinitas yang paling rendah dibandingkan dengan dua perlakuan lainnya. Hal ini dipengaruhi oleh limbah POME bersifat tawar sehingga apabila limbah POME dicampurkan dengan air laut akan menyebabkan salinitasnya menurun. Jadi, semakin tinggi konsentrasi limbah yang dicampurkan ke dalam media kutur maka semakin rendah salinitas media kultivasinya.
Derajat keasaman (pH) media kultivasi Nannochloropsis sp. pada P1, P2 dan kontrol memiliki nilai awal yang berbeda. Pada P1 dan P2, pemberian limbah POME menyebabkan pH awal media menjadi asam yaitu pada P1 sebesar pH = 4.89±0.05 dan pada P2 sebesar pH = 4.43±0.03, sedangkan pada kontrol pH awal sebesar pH = 7.73±0.06.
Gambar 6 Nilai pH media kultivasi Nannochloropsis sp. selama 18 hari kultivasi. P1: Penambahan POME 10%; P2: Penambahan POME 30%.
Limbah POME mengandung konsentrasi karbon yang tinggi hal ini menyebabkan pada P1 dan P2 nilai pH pada awal kutivasi menjadi rendah dan bersifat asam. Proses fotosintesis merupakan proses penyerapan karbon dalam bentuk CO2 yang terlarut dalam air, sehingga akan berakibat pada penurunan CO2 dalam air. Penurunan ini akan meningkatkan pH (Kawaroe et al. 2010). Hal ini yang menyebabkan nilai pH pada P1 dan P2 mengalami peningkatan setiap hari. Gambar 6 menunjukkan perlakuan P1 dan P2 memiliki nilai pH semakin naik setiap hari
13 akibat adanya proses fotosintesis hingga pada akhir kultivasi pH media kultivasi pada P1 menjadi pH = 8.20±0.06 dan pada P2 menjadi pH = 7.99±0.13. Nilai pH pada kontrol cenderung stabil dari awal kultivasi hingga akhir kultivasi berkisar pH = 7.73 – 8.53. Menurut Effendi (2003) pH optimum untuk kultivasi mikroalga secara umum 7 – 8.4.
Nilai pH dalam media kultivasi dapat mempengaruhi komposisi lemak pada Nannochloropsis salina (Bartley et al. 2013). Akumulasi lemak menjadi maksimum ketika sel Nannochloropsis sp. mengalami tekanan dari kondisi yang tidak sesuai sehingga pertumbuhan melambat dan energi disimpan dalam bentuk lemak (Wang et al. 2009). Hal ini diduga menjadi salah satu faktor yang menyebabkan kandungan lemak pada P1 dan P2 lebih tinggi dibandingkan dengan kontrol.
Total C, N, P pada Media Kultivasi
Hasil penelitian menunjukkan bahwa limbah POME dapat meningkatkan C, N, dan P yang terkandung dalam media kultivasi (Tabel 1). Masuknya nutrien dari lingkungan ke dalam sel mikroalga dapat terjadi dalam tiga cara, di antaranya: melalui transportasi difusi dari media ke permukaan sel, melalui transportasi adveksi yang dipengaruhi oleh gerakan air dalam lingkungan sel, dan melalui reaksi kimia di lapisan batas difusi ketika nutrien pada sistem ini tidak seimbang. Transport difusi dan adveksi tergantung dari ukuran, bentuk, dan kecepatan dari mikroalga. Karbon (C), Nitrogen (N) dan Fosfor (P) merupakan elemen yang berperan sebagai faktor pembatas pertumbuhan mikroalga serta merupakan unsur kimia yang secara alami terdapat dalam air laut (Williams et al. 2002).
Tabel 1 Total C, N, P pada media kultivasi mikroalga Perlakuan Kandungan Total
P1: Penambahan POME 10%, P2: Penambahan POME 30%
14
merupakan salah satu faktor yang menyebabkan kepadatan sel dan biomassa Nannochloropsis sp. pada P1 dan P2 mengalami peningkatan dibandingkan dengan kontrol. Pada akhir kultivasi, kadar karbon perlakuan P1 dan P2 mengalami penurunan menjadi 431.03 mg L-1 dan 701.97 mg L-1, sedangkan pada kontrol, kadar karbon pada akhir kultivasi mengalami peningkatan menjadi 886.70 mg L-1. Naiknya kadar karbon di akhir kultivasi pada kontrol diduga dipengaruhi oleh mikroalga yang mati kembali melepas karbon ke dalam perairan.
Berdasarkan hasil penelitian, media kultivasi yang memiliki kadar nitrogen tertinggi adalah perlakuan P2 dengan kadar nitrogen pada awal kultivasi sebesar 17.50 mg L-1 dan pada akhir kultivasi sebesar 17.80 mg L-1. Perlakuan P1 memiliki kadar nitrogen pada awal kultivasi sebesar 5.60 mg L-1 dan pada akhir kultivasi sebesar 5.94 mg L-1. Kontrol memiliki kadar nitrogen pada awal kultivasi sebesar 4.45 mg L-1 dan akhir kultivasi sebesar 5.94 mg L-1. Hal ini membuktikan bahwa penambahan limbah POME pada media kultivasi dapat meningkatkan kadar nitrogen. Perlakuan P1 dan P2 memiliki kandungan nitrogen pada media yang lebih besar dibandingkan pada media kontrol. Hal ini menyebabkan pertumbuhan mikroalga pada P1 dan P2 lebih baik dibandingkan dengan kontrol. Kekurangan nitrogen dapat berdampak pada penurunan jumlah fotosintesis, konversi energi fitokimia, dan sintesis protein (Borowitzka et al. 2011). Meningkatnya kadar nitrogen pada akhir kultivasi diduga disebabkan oleh Nannochloropsis sp. yang telah mati dan membusuk (Kawaroe et al. 2015). Hal ini sejalan dengan pernyataan Effendi (2003) yang menyatakan bahwa tumbuhan dan hewan yang telah mati dan membusuk merupakan salah satu sumber nutrien organik dalam perairan.
Fosfor merupakan bahan dasar untuk pertumbuhan dan berbagai proses seluler seperti transfer energi, biosintesis asam nukleat dan lemak, serta DNA (Richmond 2004). Ortofosfat merupakan bentuk fosfor yang dapat dimanfaatkan secara langsung oleh mikroalga. Ortofosfat yang masuk ke dalam tumbuhan, misalnya mikroalga, mengalami perubahan menjadi organofosfat (Effendi 2003). Total nilai fosfor kultivasi awal pada perlakuan P2 merupakan yang tertinggi dibandingkan dengan P1 dan kontrol yaitu sebesar 0.824 mg L-1. Kadar fosfor pada P1 dan kontrol masing-masing sebesar 0.611 mg L-1 dan 0.588 mg L-1. Ketersediaan fosfor juga mempengaruhi komposisi biomassa yang dihasilkan, terutama komposisi lemak dan karbohidrat (Borowitzka et al. 2011). Tingginya kandungan fosfor pada media P2 menjadi salah satu faktor tingginya karbohidrat dan lemak pada P2. Keterbatasan fosfor dapat berimbas pada perubahan metabolik, termasuk pengurangan kapasitas fotosintesis, kapasitas serapan fosfat, pergeseran protein, produksi karbohidrat dan lemak, dan biomassa sel (Borowitzka et al. 2011). Pada kultivasi akhir kadar fosfor yang terkandung dalam masing-masing perlakuan mengalami penurunan. Hal ini diduga karena fosfor telah digunakan oleh mikroalga untuk pertumbuhannya.
Karakteristik Nannochloropsis sp.
15 Tabel 2 Karakteristik kandungan gizi (%) mikroalga Nannochloropsis sp.
Kandungan Perlakuan Kadar (%)
Air P1: Penambahan POME 10%, P2: Penambahan POME 30%
Tabel 2 menunjukkan nilai rerata kadar air Nannochloropsis sp. tertinggi terdapat pada kontrol yaitu sebanyak 35.73±2.60%, sedangkan kadar air pada P1 sebesar 21.43±0.64% dan P2 sebesar 15.03±2.61%. Hasil ini cukup jauh berbeda dengan hasil penelitian Darsi et al. (2012) yaitu kadar air yang terkandung pada Nannochloropsis sp. sebesar 12.39% dan kadar air pada hasil penelitian Prartono et al. (2010) sebesar 11.02%. Nilai kandungan air yang berbeda pada setiap perlakuan pada penelitian ini diduga dipengaruhi oleh adanya perbedaan kepadatan. Selain kepadatan sel, bahan dan permukaan alat yang digunakan pada saat pengeringan akan mempengaruhi proses pengeringan sehingga akan mempengaruhi perbedaan kadar air yang diperoleh pada setiap sampel (Buckle et al. 2007). Hasil uji statistik menunjukkan bahwa kadar air Nannochloropsis sp. dengan penambahan limbah POME berbeda nyata dengan kontrol. Hasil analisis Duncan memperkuat hipotesis dengan memperlihatkan adanya perbedaan nyata pada setiap perlakuan. Hasil uji statistik kadar air dapat dilihat pada Lampiran 11.
16
meningkatkan kadar abu (Winarno 2004). Hasil uji statistik menunjukkan bahwa kadar abu Nannochloropsis sp. dengan penambahan limbah POME tidak berbeda nyata. Hasil uji statistik kadar abu dapat dilihat pada Lampiran 12.
Hasil analisis yang ditampilkan pada tabel 2 menunjukan bahwa kadar karbohidrat tertinggi terdapat pada mikroalga perlakuan P2 yaitu sebesar 9.01±2.00%, dan pada P1 sebesar 4.24±2.29%, sedangkan kadar karbohidrat yang terendah terdapat pada mikroalga kontrol yaitu sebesar 1.06±0.20%. Kadar karbohidrat pada P1 dan P2 lebih tinggi dibandingkan hasil penelitian Kawaroe et al. (2015) yang menyatakan bahwa kandungan karbohidrat Nannochloropsis sp. sebesar 1.42% pada media Walne. Adanya perbedaan kadar karbohidrat pada setiap perlakuan salah satunya disebabkan oleh perbedaan kadar nutrien dan kondisi lingkungan yang berbeda akibat adanya penambahan limbah POME dalam media kultur mikroalga. Kadar karbohidrat yang tinggi pada P2 diduga dipengaruhi oleh kandungan fosfor yang paling tinggi dibandingkan dengan P1 dan kontrol. Kandungan fosfor yang tinggi dapat meningkatkan produksi karbohidrat dalam sel mikroalga (Borowitzka et al. 2011). Berdasarkan hasil rerata perhitungan karbohirat total yang diperoleh pada penelitian ini, Nannochloropsis sp. yang dikultivasi pada media POME dan pupuk teknis tidak memiliki potensi sebagai bahan baku bioethanol karena persentase kadar karbohirat yang diperoleh belum mencapai 20%. Syarat suatu bahan yang berpotensi sebagai sumber bioethanol adalah yang memiliki kandungan karbohidrat berkisar antara 20-50% (Ben-Amotz 2008). Hasil uji statistik menunjukkan bahwa kadar karbohidrat Nannochloropsis sp. dengan penambahan limbah POME berbeda nyata. Hasil analisis Duncan memperkuat hipotesis bahwa perlakuan yang memiliki pengaruh paling kuat adalah P2. Hasil uji statistik kadar karbohidrat dapat dilihat pada Lampiran 13.
Kadar lemak Nannochloropsis sp. yang diperoleh dari penelitian ini bervariasi, dengan kadar lemak tertinggi terdapat pada Nannochloropsis sp. yang dikultivasi pada media P1 sebesar 16.21±5.13%, sedangkan kadar lemak paling rendah yaitu pada kontrol sebesar 6.39±2.60%. Hasil ini cukup jauh berbeda dengan hasil penelitian Na Gu et al. (2012) yaitu sebesar 30.81%. Kadar lemak pada perlakuan P1 dan P2 lebih tinggi dibandingkan kontrol. Hal ini dipengaruhi oleh tingginya tekanan lingkungan dalam media kultivasi yang ada pada perlakuan P1 dan P2 dibandingkan kontrol. Mikroalga memproduksi lemak pada saat mengalami tekanan (Prartono et al. 2010). Akumulasi lipid biasanya terjadi dalam periode tekanan lingkungan, sehingga dalam beberapa kasus senyawa lipid bisa ditingkatkan dengan memberikan faktor tekanan terhadap mikroalga (Kawaroe et al. 2010). Pada penelitian ini, perlakuan P1 memiliki potensi untuk aplikasi lanjutan pemanfaatan mikroalga Nannochloropsis sp. dalam pembuatan biodiesel. Kadar lemak yang berpotensi untuk dimanfaatkan sebagai biodiesel berkisar antara 8-50% bobot kering (Ben-Amotz 2008). Hasil uji statistik menunjukkan bahwa kadar lemak Nannochloropsis sp. dengan penambahan limbah POME berbeda nyata. Hasil analisis Duncan memperkuat hipotesis bahwa perlakuan yang memiliki pengaruh nyata adalah P1. Hasil uji statistik kadar lemak dapat dilihat pada Lampiran 14.
17 sebesar 3.99±1.15%. Tingginya kandungan protein Nannochloropsis sp. pada perlakuan P2 diduga dipengaruhi oleh tingginya kandungan nitrogen dalam media kultur. Ketersediaan unsur nitrogen sebagai makronutrisi yang optimum menyebabkan metabolisme pembentukan protein meningkat (Borowitzka et al. 2011). Hasil uji statistik menunjukkan bahwa kadar protein Nannochloropsis sp. dengan penambahan limbah POME tidak berbeda nyata. Hasil uji statistik kadar protein dapat dilihat pada Lampiran 15.
SIMPULAN DAN SARAN
Simpulan
Kultivasi mikroalga spesies Nannochloropsis sp. dengan penambahan limbah POME dapat meningkatkan pertumbuhan sel, peningkatan kadar lemak, karbohidrat, dan protein Nannochloropsis sp. Kultivasi yang memiliki pengaruh terhadap pertumbuhan sel Nannochloropsis sp. dan peningkatan kadar lemak Nannochloropsis sp. tertinggi terjadi pada perlakuan penambahan POME 10%, sedangkan peningkatan karbohidrat dan protein terjadi pada perlakuan penambahan POME 30%.
Saran
Saran untuk penelitian selanjutnya adalah perlu dilakukan uji nutrien media kultivasi dan analisis kadar karbohidrat, protein, lemak pada setiap fase pertumbuhan.
DAFTAR PUSTAKA
Apriyanto A. 1999. Petunjuk Laboratorium Analisis Pangan. Bogor: Graha Utama. Bartley ML, Boeing WJ, Corcoran AA, Holhuin FO, Schaub T. 2013. Effects of salinity on growth and lipid accumulation of biofuel microalga Nannochloropsis salina and invading organisms. Biomass and Bioenergy. 54: 83-88.
Ben-Amotz A. 2008. Bio-Fuel and CO2 Capture by Algae. Seambiotic NASA [internet]. [diunduh 2015 Agustus 31]. Tersedia pada: http://pathway.soe.uq.edu.au/mediawiki/images/1/17/BenAmotz.pdf.
Bligh EG, Dyer WJ. 1959. A rapid method of total lipid extraction and purification. Canadian Journal of Biochemistry and Physiology. 37(8): 911-917.
Borowitzka MA, Prasil O, Suggett DJ. 2011. Chlorophyll a Fluorescence in Aquatic Science: Methods and Applications. New York (NY): Springer.
Buckle KA, Edward RA, Fleet GH, Wooton M. 2007. Ilmu Pangan. Penerjemah: Purnomo H, editor. Jakarta (ID): UI Press. Terjemahan dari: Food Science. Darsi R, Supriadi A, Sasanti AD. 2012. Karakteristik kimiawi dan Potensi
Pemanfaatan Dunaliella salina dan Nannochloropsis sp. Fishtech. 1(1): 14-25. Day RA dan Underwood AL. 2002. Analisis Kimia Kuantitatif Edisi Keenam.
18
Griffiths MJ, Garcin C, van Hille RP, Harrison STL. 2011. Interface by pigment in the estimation of microalgal biomass concentration by optical density. Juornal of Microbiological Methods. 85: 119-123.
Hart BT, Bailey P, Edwards R. Hortlek K. 1991. A review of the salt sensitivity of the Australian fresh water biota. Hydrobiologia. 210: 105-144.
Hu H dan Gao K. 2003. Optimization of growth and fatty acid composition of a unicellular marine picoplankton, Nannochloropsis sp., with enriched carbon sources. Biotechnology letters. 25: 421-425.
Kawaroe M, Hwangbo J, Augustine D, Putra HA. 2015. Comparison of density, specific growth rate, biomass weight, and doubling time of microalgae Nannochloropsis sp. cultivated in Open Raceway Pond and Photobioreactor. Aquaculture, Aquarium, Conservaiton & Legislation International Journal of the Bioflux society. 8(5): 740-750.
Kawaroe M, Prartono T, Hwangbo J, Sunuddin A, Agustine D, Gustini AS. 2015. Effect of ethyl methane sulfonate (EMS) on cell size dan antioxidant activities of microalgae Dunaliella sp. Aquaculture, Aquarium, Conservaiton & Legislation International Journal of the Bioflux society. 8 (6): 751-759.
Kawaroe M, Prartono T, Sunuddin A, Sari D W, Augustine D. 2010. MIKROALGA: Potensi dan Pemanfaatannya untuk Produksi Bio Bahan Bakar. Bogor: IPB Press.
Kawaroe M, Sudrajat A O, Hwangbo J, Augustine D. 2015. Chemical Mutagenesis of Microalgae Nannochloropsis sp. Using EMS (Ethyl Methanesulfonate). British Journal of Applied Science & Technology. 8(5): 494-505.
Lin Q, GuN, Li Gang, Lin J, Huang J, Tan L. 2012. Effects of Inorganic Carbon Concentration on carbon Formation, Nitrate Utilization, Biomass and Oil Accumulation of Nannochloropsis oculata CS 179. Bioresource Technology. 111: 353-359.
Mahdi MZ, Titisari TN, Hadiyanto. 2012. Evaluasi Pertumbuhan Mikroalga dalam Medium POME: Variasi Jenis Mikroalga, Medium, dan Waktu Penambahan Nutrien. Jurnal Teknologi Kimia Industri. 1:312-319.
Na Gu, Lin Q, Li G, Tan Y, Huang L, Lin J. 2012. Effect of salinity on growth, biochemical composition, and lipid productivity of Nannochloropsis oculata CS 179. Life Science. 5: 1-7.
Phang SM dan Ong KM. 1988. Algal Biomass Production in Digested Palm Oil Mill Effluent. Biological Wastes. 25: 177-191.
Prartono T, Kawaroe M, Sari DW, Augustine D. 2010. Fatty Acid Content of Indonesia Aquatic Microalgae. HAYATI Journal of Biosciences. 17(4): 196-200. Prartono T, Kawaroe M, Katili V. 2013. Fatty Acid Composition of Three Diatom Species Skeletonema costatum, Thalassiosira sp. and Chaetoceros gracilis. International Journal of Environment and Bioenergy. 6(1): 28-43.
Renaud SM dan Parry DL. 1994. Microalgae for use in tropical aquaculture II, effect of salinity on growth, gross chemical composition of three species of marine microalgae. Journal of Applied Phycology. 6: 347-356.
Richmond A. 2004. Handbook of Microalgal Culture: Biotechnology and Applied Phycology. Israel (IL): Blackwell Science.
19 Sari, FYA, I Made Suryajaya A, Hadiyanto. 2012. Kultivasi Mikroalga Spirulina platensis dalam Media POME dengan Variasi Konsentrasi POME dan Komposisi Jumlah Nutrien. Jurnal Teknologi Kimia dan Industri. 1: 487-494. Suminto dan Hirayama K. 1996. Effects of Bacteria on the Growth of a Marine
Diatom Chaetoceros gracilis. Fisheries science. 62: 40-43.
Wagenen JV, Miller TW, Hobbs S, Hook P, Crowe B, Huesemann M. 2012. Effects of Light and Temperature on Fatty Acid Production in Nannochloropsis salina. Energies. 5:731-740.
Walkley A and Black IA. 1934. An Examination of Degtjareff Method for Determining Soil Organic Matter and a Proposed Modification of the Chromic Acid Titration Method. Soil Science. 37:29-37.
20
21 Lampiran 1 Perhitungan kadar Karbon
Nilai Karbon dihitung menggunakan persamaan di bawah ini.
= − − ×
Keterangan:
X = Kadar C (mg L-1) = Absorbansi sample = Absorbansi blanko
= Absorbansi larutan standar
Lampiran 2 Perhitungan kadar Fosfor
Nilai Fosfor dapat diketahui menggunakan persamaan di bawah ini.
� = − × �−
Keterangan:
�= Kandungan fosfor (mg L-1) = Absorbansi sample
= Absorbansi blanko
= Absorbansi larutan standard k= Konsentrasi standard = 1 mg L-1
Lampiran 3 Perhitungan kadar Nitrogen
Kadar nitrogen (N) dapat diketahui dengan menggunakan persamaan di bawah ini.
� = . 7∗ × �− � × � ×
Keterangan:
N = Kadar Nitrogen (mg L-1)
*1 = setiap mL NaOH 0.05 N setara dengan 0.0007 g Nitrogen Vs = mL titran 0.05 N NaOH untuk sample
22
Lampiran 4 Persamaan Kadar Air
Kadar air dapat dihitung menggunakan persamaan di bawah ini:
= × %
Keterangan: X = Kadar air (%)
= bobot sampel sesudah dikeringkan (g) = bobot sampel sebelum dikeringkan (g)
Lampiran 5 Persamaan Kadar Abu
Kadar abu dapat dihitung menggunakan persamaan di bawah ini:
= − × %
Keterangan: = Kadar abu (%)
= bobot contoh + cawan sesudah diabukan (g) = bobot cawan kosong (g)
= bobot contoh sebelum diabukan (g)
Lampiran 6 Perhitungan Karbohidrat
Kadar karbohidrat dapat dihitung menggunakan persamaan di bawah ini. C =�1× �× .9
W × %
Keterangan:
C = kadar karbohidrat %
= glukosa yang terkandung untuk ml tio yang dipergunakan (mg) dari daftar penetapan gula menurut luff-Schrool.
�� = faktor pengenceran W = bobot cuplikan dalam mg
Lampiran 7 Perhitungan kadar Protein
Kadar protein yang terkandung dapat dihitung menggunakan persamaan di bawah ini.
� = − × � × . × � × �� × %
Keterangan
P = Kadar Protein (%) = bobot cuplikan (g)
= volume NaOH 0.01 N yang dipergunakan penitaran contoh (mL). = volume NaOH yang dipergunakan penitaran blanko (mL).
23 �� = faktor pengenceran
� = faktor konversi protein secara umum (6.25) Lampiran 8 Perhitungan kadar lemak
Persentase lemak yang dihasilkan dapat dihitung menggunakan persamaan di bawah ini.
� = − × %
Keterangan
L = Kadar lemak (%)
24
Lampiran 9 Dokumentasi
Persiapan bibit mikroalga Kultivasi kontrol
Kultivasi perlakuan P1 Kultivasi perlakuan P2
Sampel mikroalga yang akan dianalisis Pasta mikroalga
25 Lampiran 10 Perhitungan Analysis of Variance
1. Pengaruh Perbedaan Perlakuan terhadap Kepadatan Sel
Hasil analysis of variance (ANOVA) kepadatan sel setiap perlakuan Sumber
Keragaman Jumlah Kuadrat
Derajat
Bebas Kuadrat Tengah F Hitung Nilai-P Perlakuan 270045350877193.030 2 135022675438596.520 11,827 <.0001
Galat 1917906491228069.000 168 11416110066833.748 Total 2187951842105262.000 170
Hasil Uji Duncan Perlakuan
N
Subset for alpha = 0.05
1 2
Duncan Kontrol 57 5303508.7719
P2 57 5471052.6316
P1 57 8049122.8070
2. Pengaruh Perbedaan Perlakuan terhadap Biomassa
Hasil analysis of variance (ANOVA) biomassa setiap perlakuan Sumber
Keragaman Jumlah Kuadrat
Derajat
Bebas Kuadrat Tengah F Hitung Nilai-P Perlakuan 3.407 2 1.703 30.003 <.0001
Lampiran 11 Perhitungan Analysis of Variance kadar air
Hasil analysis of variance (ANOVA) kadar air setiap perlakuan Sumber
Keragaman Jumlah Kuadrat
Derajat
Bebas Kuadrat Tengah F Hitung Nilai-P Perlakuan 673,835 2 336,918 72,188 <.0001
26
Hasil analysis of variance (ANOVA) kadar abu setiap perlakuan Sumber
Keragaman Jumlah Kuadrat
Derajat
Bebas Kuadrat Tengah F Hitung Nilai-P Perlakuan 50.919 2 25.460 0.223 0.806
Galat 685.090 6 114.182 Total 736.009 8
Lampiran 13 Perhitungan Analysis of Variance kadar karbohidrat
Hasil analysis of variance (ANOVA) karbohidrat setiap perlakuan Sumber
Keragaman Jumlah Kuadrat
Derajat
Bebas Kuadrat Tengah F Hitung Nilai-P Perlakuan 96.039 2 48.019 15.200 0.004
Lampiran 14 Perhitungan Analysis of Variance kadar lemak
Hasil analysis of variance (ANOVA) kadar lemak setiap perlakuan Sumber
Keragaman Jumlah Kuadrat
Derajat
Bebas Kuadrat Tengah F Hitung Nilai-P Perlakuan 171.902 2 85.951 5.831 0.039
Lampiran 15 Perhitungan Analysis of Variance kadar protein
Hasil analysis of variance (ANOVA) kadar protein setiap perlakuan Sumber
Keragaman Jumlah Kuadrat
Derajat
Bebas Kuadrat Tengah F Hitung Nilai-P Perlakuan 74.882 2 37.441 4.302 0.069
27
RIWAYAT HIDUP
Penulis dilahirkan di Jakarta pada tanggal 15 November 1993 dari ayah Drs. Muchamad Nur, M.pd dan ibu Tri Andayani. Penulis adalah putri kedua dari tiga bersaudara. Tahun 2011 penulis lulus dari SMA Negeri 13 Jakarta dan pada tahun yang sama penulis lulus seleksi masuk Institut Pertanian Bogor (IPB) melalui jalur SNMPTN tulis dan diterima di Departemen Ilmu dan Teknologi Kelautan, Fakultas Perikanan dan Ilmu Kelautan.
Selama mengikuti perkuliahan, penulis menjadi asisten praktikum Biologi Laut pada tahun ajaran 2013/2014 dan 2014/2015 serta Biologi Tumbuhan Laut pada tahun 2015/2016. Penulis aktif dalam organisasi Himpunan Mahasiswa Ilmu dan Teknologi Kelautan (HIMITEKA-IPB) sebagai sekretaris II pada periode 2012 – 2013, dan sekretaris umum pada periode 2013 – 2014. Bulan Juni-Juli 2014 penulis melaksanakan Praktik Kerja Lapang di PPN Pondokdadap dengan judul Kegiatan Usaha Perikanan Tangkap serta Implikasinya terhadap Kesejahteraan Nelayan di Pondokdadap, Kabupaten Malang, Jawa Timur.
Penulis juga pernah mengikuti Program Kreativitas Mahasiswa Artikel Ilmiah (PKM-AI) yang didanai oleh DIKTI tahun 2013 dengan judul Distribusi dan Penutupan Mangrove Pulau Tengah, Kepulauan Seribu, Jakarta dan Program Kreativitas Mahasiswa Penelitian (PKM-P) yang didanai oleh DIKTI pada tahun 2013 dengan judul Pengaruh Pola Pemberian Pakan terhadap Kandungan Protein dan Tingkat Stres Bulu Babi (Diadema setosum) sebagai Upaya Optimalisasi Hasil Budidaya. Penulis memperoleh beasiswa BBM pada tahun 2012 dan 2014.