DINAMIKA SEL HETEROKIS PADA Anabaena azollae
DALAM MEDIA
DENGAN KONSENTRASI NITROGEN BERBEDA
GORAN SURYANTI AFIFAH SULAIMAN
DEPARTEMEN MANAJEMEN SUMBERDAYA PERAIRAN
FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR
BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI
Dengan ini saya menyatakan bahwa skripsi berjudul Dinamika Sel Heterokis pada Anabaena azollae dalam Media dengan Konsentrasi Nitrogen Berbeda adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir penulisan ini.
Bogor, September 2015
Goran Suryanti Afifah Sulaiman
ABSTRAK
GORAN SURYANTI AFIFAH SULAIMAN. Dinamika Sel Heterokis pada
Anabaena azollae dalam Media dengan Konsentrasi Nitrogen Berbeda. Dibimbing oleh Niken TM Pratiwi dan Inna Puspa Ayu.
Anabaena azollae merupakan Cyanophyceae berheterokis yang bersimbiosis dengan Azolla sp. Anabaena azollae memiliki sel heterokis yang membuatnya mampu mengikat nitrogen (N2) dari udara dan mengubahnya menjadi amonium (NH4+). Penelitian ini dilakukan untuk mengkaji dinamika sel heterokis pada Anabaena azollae yang bersimbiosis dengan Azolla sp. dalam media dengan konsentrasi nitrogen berbeda. Penelitian dilakukan dengan mengamati heterokis dan perubahan konsentrasi nitrogen pada media selama 21 hari pengamatan. Hasil penelitian menunjukkan bahwa jumlah sel heterokis tertinggi terdapat pada media dengan konsentrasi nitrogen 0 mg/L. Jumlah sel heterokis berfluktuasi selama 21 hari pengamatan mengikuti konsentrasi nitrogen dalam media hidupnya. Pada awal pengamatan, peningkatan konsentrasi amonium terjadi pada perlakuan 0 mg/L dan 5 mg/L. Selanjutnya, peningkatan amonium juga terjadi pada akhir pengamatan pada semua perlakuan. Peningkatan konsentrasi amonium yang terjadi akibat dari matinya Azolla sp. dan menyebabkan terlepasnya N ke dalam media.
Kata kunci: Anabaena azollae, Azolla sp., Heterokis
ABSTRACT
GORAN SURYANTI AFIFAH SULAIMAN. The Dynamic of Anabaena azollae
Heterocyst Cell under Different Nitrogen Concentration of Culture Media. Supervised by Niken TM Pratiwi dan Inna Puspa Ayu.
Anabaena azollae is a heterocyst Cyanophyceae that has symbiosis with Azolla sp.
Anabaena azollae have heterocyst cell able to fixation nitrogen (N2) from the air and convert it into ammonium (NH4+). This study was conducted to look at the dynamics of cell heterokis on Anabaena azollae symbiotic with Azolla sp. in media with different nitrogen concentrations. Research was done by observing heterocyst and changes in the concentration of N in the media during the 21 days of observation. The results showed that the highest number of heterocyst cells observed in the media with 0 mg/L nitrogen concentration. Heterocyst cells were fluctuated during the 21 days of observation following the nitrogen concentration in the media. At the beginning of the observation increasing concentrations of ammonium occurred in the treatment of 0 mg/L and 5 mg/L. Furthermore, the increase in ammonium also occur at the end of the observation of all treatments. Increasing of ammonium concentrations was resulted by dead Azolla sp. that release nitrogen into the media.
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Perikanan dan Ilmu Kelautan
pada
Departemen Manajemen Sumberdaya Perairan
DINAMIKA SEL HETEROKIS PADA Anabaena azollae
DALAM MEDIA
DENGAN KONSENTRASI NITROGEN BERBEDA
GORAN SURYANTI AFIFAH SULAIMAN
DEPARTEMEN MANAJEMEN SUMBERDAYA PERAIRAN
FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR
BOGOR
Judul Skripsi : Dinamika Sel Heterokis pada Anabaena Azollae dalam Media dengan Konsentrasi Nitrogen Berbeda
Nama : Goran Suryanti Afifah Sulaiman NIM : C24110073
Program Studi : Manajemen Sumberdaya Perairan
Disetujui oleh
Dr Ir Niken TM Pratiwi, MSi Pembimbing I
Inna Puspa Ayu, SPi, MSi Pembimbing II
Diketahui oleh
Dr Ir Mohammad Mukhlis Kamal, MSc Ketua Departemen
PRAKATA
Puji dan syukur ke hadirat Allah SWT atas segala rahmat dan hidayah-Nya yang telah diberikan kepada penulis sehingga dapat menyelesaikan skripsi yang berjudul Dinamika Sel Heterokis pada Anabaena azollae dalam Media dengan Konsentrasi Nitrogen Berbeda. Skripsi ini disusun sebagai salah satu syarat untuk menyelesaikan studi di Manajemen Sumberdaya Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor.
Penulis menyampaikan terimakasih kepada:
1 Institut Pertanian Bogor yang telah memberikan kesempatan untuk studi 2 Beasiswa Bidikmisi yang telah memberikan bantuan biaya perkuliahan. 3 Bantuan Operasional Perguruan Tinggi Negeri (BOPTN) 2015
4 Dr Ir Luky Adrianto, MSc selaku dosen pembimbing akademik atas arahan dan masukan selama penulis melaksanakan studi
5 Dr Ir Niken TM Pratiwi, MSi selaku ketua komisi pembimbing dan Inna Puspa Ayu, SPi, MSi selaku anggota komisi pembimbing yang telah memberikan arahan, maupun kritik dan saran dalam penyelesaian penelitian ini.
6 Bapak Sulaiman, Ibu Deti Rahmawati, Kakak Sulthan dan Adik Rafi, Kak Dian, beserta keluarga yang selalu memberikan dukungan semangat dan doa.
7 Seluruh staf Laboratorium Riset Plankton (Kak Apri dan Tiyas), Laboratorium Riset Biologi Mikro (Ibu siti, Mba Aay, Kak Dede, dan Bang Reza), dan Laboratorium Riset Produktivitas Lingkungan (Proling). 8 Desy, Arinda, Gepe, Irma, Anes, Bayu, Fitri, Dini, Nana, Happy, Selia, Isra, Amir, Rosita, kak Novita, dan teman-teman MSP 48, 47, 46, 45, Asisten ITAMA, Kualitas Air, dan semua pihak yang telah membantu dalam menyelesaikan tugas akhir ini.
Demikian skripsi ini semoga dapat bermanfaat.
Bogor, September 2015
DAFTAR ISI
DAFTAR ISI xi
DAFTAR TABEL i
DAFTAR GAMBAR i
DAFTAR LAMPIRAN i
PENDAHULUAN 1
Latar Belakang 1
Perumusan Masalah 1
Tujuan Penelitian 2
METODE 3
Waktu dan Lokasi Penelitian 3
Pelaksanaan Penelitian 3
Pengumpulan Data 5
Analisis Data 6
HASIL DAN PEMBAHASAN 9
Hasil 9
Pembahasan 13
KESIMPULAN 15
DAFTAR PUSTAKA 15
LAMPIRAN 18
DAFTAR TABEL
1 Satuan, metode, dan alat untuk pengukuran kualitas air 6
2 Tabel Sidik Ragam (RAL) 7
3 Tabel sidik ragam RAL in time 8
4 Hasil pengukuran dan perhitungan laju pertumbuhan relatif dan doubling
time pada Azolla sp. 10
5 Nilai rata-rata persen nitrogen dan konversi dalam protein pada Azolla sp.
pada tiap konsentrasi perlakuan 12
DAFTAR GAMBAR
1 Skema perumumusan masalah dinamika sel heterokis pada Anabaena
azollae dalam media dengan konsentrasi nitrogen berbeda 2
2 Azolla sp. yang dijadikan inokulan 4
3 Anabaena azollae dengan sel heterokis dan sel vegetatif 5
4 Jumlah heterokis selama 21 hari pengamatan 9
5 (A) Anabaena azollae tanpa sel heterokis (B) Anabaena azollae dengan
sel heterokis 9
6 Hasil analisis parameter amonium selama penelitian 10 7 Hasil analisis parameter nitrit selama penelitian 11 8 Hasil analisis parameter nitrat selama penelitian 11 9 Hasil analisis parameter ortofosfat selama penelitian 12
DAFTAR LAMPIRAN
1 Penyimpanan media 18
2 Perhitungan konsentrasi pupuk ZA dan TSP yang digunakan 19
3 Rumus perhitungan amonium 19
4 Contoh heterokis yang teramati selama penelitian 20
5 Azolla sp. pada akhir pengamatan 22
PENDAHULUAN
Latar Belakang
Tumbuhan Azolla sp. merupakan jenis tumbuhan paku air yang mengapung dan sangat rentan terhadap kondisi lingkungan yang kering. Tumbuhan ini umumnya terdapat di perairan tergenang, terutama di sawah, rawa, dan kolam.
Azolla sp. dikenal mampu meningkatkan konsentrasi nitrogen pada lingkungan hidupnya. Oleh karena itu, Azolla sp. dapat berfungsi sebagai pupuk organik. Kemampuan Azolla sp. sebagai pupuk organik disebabkan oleh kemampuan tumbuhan ini berasosiasi dengan Anabaena azollae.
Anabaena azollae merupakan alga berfilamen yang memiliki kemampuan mengikat nitrogen (N2) langsung dari udara dan mengubahnya menjadi amonium (NH4+) dengan bantuan enzim nitrogenase (Meeks & Elhai 2002). Proses fiksasi nitrogen terjadi pada sel heterokis. Sel heterokis merupakan diferensiasi sel vegetatif yang terbentuk ketika nitrogen pada lingkungan berada dalam konsentrasi yang rendah (Wolk 1982 in Wei 1994). Sel heterokis muncul dengan interval yang hampir teratur terhadap keberadaan sel vegetatif. Letak sel heterokis dapat berada di terminal (ujung) atau interkalar (tengah) koloni (Meeks & Elhai 2002).
Penambahan lapisan glikolipid dan polisakarida di bagian luar dinding sel vegetatif, terjadi selama proses diferensiasi pada sel heterokis Anabaena azollae. Selanjutnya terbentuk pori-pori (lubang) pada ujung sel heterokis yang berfungsi menghubungkan sel heterokis dengan sel vegetatif. Sel heterokis berwarna hijau kekuningan dikarenakan hilangnya pigmen phycobiliprotein (Meeks & Elhai 2002).
Sel heterokis dan sel vegetatif saling melengkapi dalam melakukan proses metabolisme pada Anabaena azollae. Sel vegetatif berperan menyediakan gula, sedangkan heterokis menyediakan sumber nitrogen (Golden dan Yoon 2003 in
Qin et al. 2012). Sel heterokis pada rangkaian filamen memfiksasi nitrogen dan mengubahnya menjadi glutamin, selanjutnya akan dirubah menjadi karbohidrat oleh sel vegetatif melalui proses fotosintesis. Proses fotosintesis pada Cyanophyceae memanfaatkan klorofil-a dan pigmen phycobiliprotein (Cohen & Bryant 1982 in Mur et al. 1999). Pigmen tersebut menyerap cahaya hijau, kuning, dan jingga yang merupakan bagian dari spektrum (500-650 µm) (Mur et al. 1999). Buikema (1991) menjelaskan bahwa pada Cyanophyceae berheterokis seperti Anabaena, seluruh sel dalam satu rangkaian filamen akan memiliki morfologi yang sama saat kondisi nitrogen terpenuhi. Sebaliknya, sel heterokis akan terbentuk ketika sumber nitrogen (amonium atau nitrat) tidak terpenuhi pada media pertumbuhannya. Oleh karena itu, perlu dilakukan pengkajian mengenai dinamika jumlah sel heterokis pada Anabaena Azollae yang bersimbiosis dengan
Azolla sp. yang ditumbuhan dalam media dengan konsentrasi nitrogen berbeda.
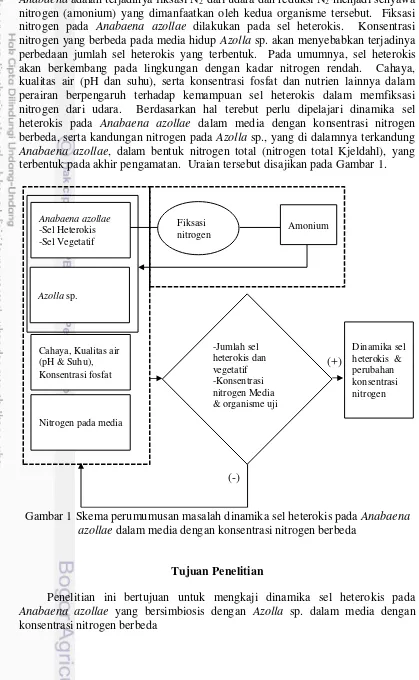
Perumusan Masalah
Azolla-2
Anabaena adalah terjadinya fiksasi N2 dari udara dan reduksi N2 menjadi senyawa nitrogen (amonium) yang dimanfaatkan oleh kedua organisme tersebut. Fiksasi nitrogen pada Anabaena azollae dilakukan pada sel heterokis. Konsentrasi nitrogen yang berbeda pada media hidup Azolla sp. akan menyebabkan terjadinya perbedaan jumlah sel heterokis yang terbentuk. Pada umumnya, sel heterokis akan berkembang pada lingkungan dengan kadar nitrogen rendah. Cahaya, kualitas air (pH dan suhu), serta konsentrasi fosfat dan nutrien lainnya dalam perairan berpengaruh terhadap kemampuan sel heterokis dalam memfiksasi nitrogen dari udara. Berdasarkan hal terebut perlu dipelajari dinamika sel heterokis pada Anabaena azollae dalam media dengan konsentrasi nitrogen berbeda, serta kandungan nitrogen pada Azolla sp., yang di dalamnya terkandung
Anabaena azollae, dalam bentuk nitrogen total (nitrogen total Kjeldahl), yang terbentuk pada akhir pengamatan. Uraian tersebut disajikan pada Gambar 1.
Gambar 1 Skema perumumusan masalah dinamika sel heterokis pada Anabaena azollae dalam media dengan konsentrasi nitrogen berbeda
Tujuan Penelitian
Penelitian ini bertujuan untuk mengkaji dinamika sel heterokis pada
3
METODE
Waktu dan Lokasi Penelitian
Penelitian ini dilaksanakan pada bulan Februari sampai April 2015. Kegiatan penelitian dilakukan pada skala laboratorium, bertempat di Laboratorium Riset Plankton, laboratorium Riset Biologi Mikro I, dan Laboratorium Riset Fisika Kimia Perairan, Bagian Produktivitas dan Lingkungan Perairan, Departemen Manajemen Sumberdaya Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor.
Pelaksanaan Penelitian
Penelitian ini dibagi menjadi dua tahapan, yaitu tahap persiapan yang meliputi penyiapan biota uji dan media cair, serta tahap penelitian dengan perancangan tertentu. Penumbuhan biota uji bertujuan untuk mempersiapkan inokulan yang selanjutnya akan diberi perlakuan. Penyiapan media cair bertujuan untuk mempersiapkan media cair yang akan digunakan sebagai media hidup organisme uji. Kegiatan penelitian meliputi perancangan penelitian dan pelaksanaan penelitian yang bertujuan mengkaji dinamika jumlah heterokis pada
Anabaena azollae dalam media dengan konsentrasi nitrogen berbeda. Penumbuhan biota uji dan penyiapan media cair
Azolla sp. yang akan dijadikan sebagai biota uji diperoleh dari kolam tanaman air daerah Gunung Bunder, Kecamatan Pamijahan, Kabupaten Bogor.
Azolla sp. yang diambil kemudian ditumbuhkan dan diperbanyak untuk dijadikan inokulan dalam penelitian. Azolla sp. diperbanyak pada kondisi semi-outdoor
dengan kondisi lingkungan (suhu dan intensitas cahaya) yang dapat ditolerir oleh organisme tersebut. Azolla sp. dapat berkembang dengan baik pada kisaran suhu 20-35°C, pada intensitas cahaya berkisar antara 25-50% dari penyinaran matahari penuh dengan intensitas cahaya 15 klux selama 12 jam setiap hari (Watanabe 1978).
4
Gambar 2 Azolla sp. yang dijadikan inokulan
Penyiapan wadah dilakukan dengan memposisikan wadah secara acak (Lampiran 1). Wadah yang digunakan adalah akuarium yang memiliki ukuran 30 cm x 30 cm x 30 cm, akuarium diisi dengan air sampai dengan ketinggian 25 cm (volume 22,5 liter). Media cair disiapkan dengan melarutkan pupuk pada masing-masing akuarium berisi air sesuai dengan konsentrasi yang ditentukan. Dilakukan pengadukan perlahan untuk memastikan pupuk terlarut dengan air pada wadah. Kegiatan penelitian
Penelitian dilakukan menggunakan rancangan acak lengkap (RAL) in time. RAL in time untuk melihat pengaruh antara perlakuan (sumber nitrogen yang berbeda) yang diberikan terhadap unit uji (jumlah sel heterokis), dengan melibatkan waktu pengamatan. Rancangan ini melibatkan waktu pengamatan terhadap organisme uji dengan harapan mampu melihat perkembangan respon selama penelitian. Pada penelitian ini, pengamatan terhadap respon heterokis dalam setiap satuan percobaan dilakukan sebanyak 11 kali dalam waktu berbeda selama penelitian. Parameter uji biomassa dan total nitrogen Kjeldahl pada penelitian ini di ujikan dengan rancangan acak lengkap (RAL). Rancangan acak lengkap digunakan untuk melihat pengaruh perlakuan terhadap unit uji tanpa melibatkan waktu pengamatan. Penelitian dipersiapkan dengan 3 perlakuan, 3 ulangan dan dilaksanakan selama 21 hari.
Sumber nitrogen yang digunakan sebagai perlakuan adalah ZA (Zwavelzuur Amoniak), dan sebagai sumber fosfor adalah TSP (Triple Super Phosfat). Konsentrasi pupuk ZA dalam bentuk nitrogen yang digunakan sebagai perlakuan adalah 0 mg/L N, 5 mg/L N, dan 10 mg/L N, sedangkan konsentrasi TSP dalam bentuk fosfor yang digunakan sama untuk semua perlakuan 30 mg/L P. Dilakukan perhitungan untuk menentukan jumlah pupuk yang digunakan untuk mendapatkan konsentrasi tersebut (Lampiran 2).
Inokulan yang ditebar pada masing-masing wadah adalah sebesar 5 gram. Bobot yang digunakan merupakan bobot basah tanaman, yang dipersiapkan sebagai berikut. Tanaman ditiriskan dengan menggunakan kain kasa selama 2 menit untuk mengurangi kandungan air. Sebelum penebaran inokulan, dilakukan pengukuran kandungan total nitrogen dengan metode keljdahl (TKN) pada organisme uji dan pengukuran unsur hara (NH3, NO3, NO2, dan PO4) pada media
5 cair. Setelah penebaran inokulan, selanjutnya dilakukan pengukuran parameter kualitas air (pH dan suhu) dan intensitas cahaya.
Pengumpulan Data
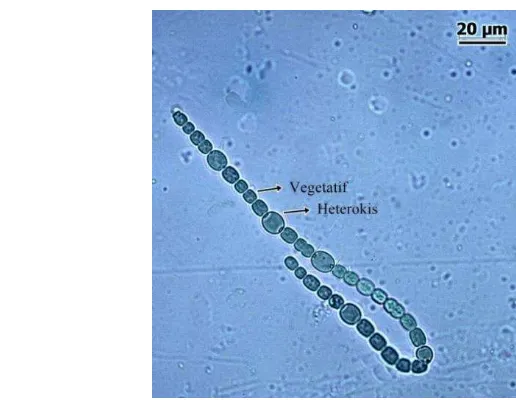
Jumlah sel Anabaena azollae
Pencacahan heterokis dilakukan untuk menghitung dan melihat perbandingan antara jumlah sel heterokis dan sel vegetatif (Gambar 3) pada setiap perlakuan (media dengan konsentrasi nitrogen berbeda). Pencacahan heterokis dilakukan pada hari ke-0 (H0) untuk melihat jumlah heterokis sebelum diberi perlakuan. Setelah diberi perlakuan, pengamatan dilakukan 2 hari sekali dimulai dari hari ke-4 penelitian. Hal ini sesuai dengan Handajani (2011) yang menyebutkan bahwa jumlah heterokis pada hari pertama hingga ketiga pengamatan tidak menunjukkan perbedaan yang signifikan.
Gambar 3 Anabaena azollae dengan sel heterokis dan sel vegetatif
Pengamatan Anabaena azollae dilakukan dengan memisahkan Anabaena azollae dari Azolla sp. yang merupakan inangnya. Sampel Azolla sp. digerus kemudian diberi akuades. Penggerusan dilakukan agar Anabaena azollae yang hidup dalam rongga tubuh Azolla sp. dapat terpisah. Anabaena azollae yang telah terpisah dari Azolla sp. ditempatkan pada kaca objek dan diamati menggunakan mikroskop dengan perbesaran 400x. Selanjutnya dilakukan pengamatan dan pencacahan terhadap sel heterokis dan sel vegetatif pada contoh. Contoh yang diamati adalah sebanyak 1000 sel dari setiap perlakuan. Setiap contoh yang diambil dari masing-masing akuarium dilakukan pengamatan dengan tiga kali ulangan.
Nitrogen total Kjeldahl
6
mewakili seluruh data awal sebelum diberi perlakuan. Pada akhir pengamatan (hari ke-21), analisis nitrogen total Kjeldahl dilakukan dengan mengambil contoh dari tiap wadah perlakuan untuk diekstrak (SNI 1992).
Kandungan unsur hara dan kualitas air
Pengukuran kandungan unsur hara (NH3, NH4+, NO3, NO2, dan PO4) dan kualitas air dilakukan untuk melihat perubahan konsentrasi nitrogen dan ortofosfat pada media hidup organisme uji. Pengukuran tersebut dilakukan dengan mengambil contoh dari media cair organisme pada setiap perlakuan, kecuali amonium (NH4+). Amonium dihitung dari nilai TAN yang merupakan nilai amonia bebas dan amonium (Lampiran 3). Parameter kualitas air, yang meliputi suhu, pH, dan intensitas cahaya diukur dengan menggunakan instrumen. Satuan, metode, dan alat yang digunakan dalam analisis unsur hara dan pengukuran parameter kualitas air disajikan pada Tabel 1.
Biomassa
Biomassa yang ditimbang adalah bobot basah Azolla sp. Pengukuran biomassa Azolla sp. dilakukan untuk melihat pengaruh proses fiksasi nitrogen dan perubahan jumlah heterokis, terhadap pertumbuhan dan perkembangan Azolla sp. pada masing-masing perlakuan. Pengukuran biomassa dilakukan pada awal (H-0) dan akhir (H-21) pengamatan.
Analisis Data
Analisis deskriptif pada heterokis
Analisis deskriptif adalah statistik yang digunakan untuk menganalisa data dengan cara mendeskripsikan, atau menggambarkan data yang telah terkumpul sebagaimana adanya tanpa bermaksud membuat kesimpulan yang berlaku umum atau generalisasi (Walpole 1982). Data setiap ulangan dirata-ratakan kemudian disajikan dalam bentuk grafik untuk mempermudah interpretasi data.
Waktu penggandaan (doubling time) Azolla sp.
Doubling time (DT) merupakan salah satu metode yang digunakan untuk mengetahui produktivitas Azolla sp. yang kemudian akan digunakan sebagai indikator dalam memanfaatkan nutrien pada media. DT adalah waktu yang dibutuhkan oleh Azolla sp. untuk menggandakan biomassa dari besarnya biomassa awal. Pendekatan yang digunakan untuk menentukan doubling time adalah pendekatan laju pertumbuhan relatif (Relative Growth Rate/RGR) yakni Tabel 1 Satuan, metode, dan alat untuk pengukuran kualitas air
Parameter Unit Metode Alat ukur
Suhu oC Probe elektroda Termometer
pH - Probe elektroda pH-meter
Intensitas Cahaya lux - Luxmeter
Nitrit mg/L Indophenol* Spektrofotometer
Nitrat mg/L Brucine* Spektrofotometer
TAN mg/L Phenate* Spektrofotometer
PO4 mg/L Molybdate Ascorbic Acid* Spektrofotometer
7 membandingkan bobot awal dengan bobot akhir biomassa selama pengamatan. Rumus yang dapat digunakan untuk menentukan nilai RGR dan DT Azolla sp. (Mitchell DS 1974) adalah sebagai berikut.
Keterangan:
RGR (Relative Growth Rate) : Pertumbuhan spesifik harian (g/hari)
ln : Logaritma natural
W0 : Bobot basah awal (g)
Wt : Bobot basah akhir (g)
ti-t0 : Waktu (hari)
DT (Doubling Time) : Waktu penggandaan biomassa (hari) Rancangan acak lengkap
Rancangan acak lengkap (RAL) digunakan untuk mengetahui pengaruh antara perlakuan yang diberikan terhadap unit uji yang disajikan dalam bentuk Anova (Tabel 2). Pada penelitian ini rancangan acak lengkap (RAL) digunakan untuk melihat pengaruh konsentrasi nitrogen terhadap Biomassa Azolla sp.
Tabel 2 Tabel Sidik Ragam (RAL) Sumber
Sumber : Mattjik dan Sumertajaya (2006) Hipotesis:
H0 : µ1 = µ2 = µ3 ; perlakuan konsentrasi nutrien berbeda tidak berpengaruh terhadap biomassa Azolla sp.
H1 : Setidaknya ada satu perlakuan konsentrasi nutrien berbeda yang berpengaruh terhadap biomassa Azolla sp.
Kesimpulan : H0 = Fhitung<Ftabel (Tolak H0)
H1 = Fhitung>Ftabel (Gagal Tolak H0/ Terima H0)
Rancangan acak lengkap in time
8
dilakukan uji ANOVA rancangan acak lengkap in time, yakni uji ANOVA terhadap perbedaan konsentrasi nitrogen yang berbeda dengan jumlah heterokis pada Anabaena azollae. Rancangan acak lengkap in time disajikan dalam bentuk tabel sidik ragam (Tabel 3).
Tabel 3 Tabel sidik ragam RAL in time
Sumber : Mattjik dan Sumertajaya (2000) Hipotesis:
H0 : µ1 = µ2 = µ3 ; perlakuan konsentrasi nitrogen berbeda tidak berpengaruh terhadap jumlah heterokis
H1 : Setidaknya ada satu perlakuan konsentrasi nitrogen berbeda berpengaruh terhadap terhadap jumlah heterokis
Kesimpulan H0 = Fhitung<Ftabel (Tolak H0)
H1 = Fhitung>Ftabel (Gagal Tolak H0/ Terima H0)
Uji lanjut Duncan multiple range test (DMRT)
Menurut Mattjik dan Sumertajaya (2000), jika dalam kesimpulan uji pengaruh diketahui bahwa perlakuan dan/atau waktu pengamatan memberikan pengaruh yang berbeda nyata, maka selanjutnya dilakukan uji pembandingan berganda (uji lanjut) untuk menentukan perlakuan dan/atau waktu pengamatan mana yang memberikan pengaruh. Dengan demikian dapat diketahui konsentrasi nitrogen mana yang memiliki pengaruh berbeda nyata terhadap perubahan jumlah heterokis pada Anabaena azollae. Uji lanjut yang digunakan adalah Duncan multiple range test (DMRT) atau uji perbandingan berganda Duncan.
Sumber
9
HASIL DAN PEMBAHASAN
Hasil
Jumlah sel heterokis pada Anabaena azollae
Jumlah heterokis pada Anabaena azollae selama penelitian menggambarkan dinamika sel heterokis dari organisme yang ditumbuhkan dalam media yang berbeda. Perlakuan 0 mg/L umumnya mengalami peningkatan jumlah sel heterokis. Jumlah heterokis berfluktuasi selama 21 hari pengamatan. Sebaliknya perlakuan 10 mg/L umumnya mengalami penurunan jumlah sel heterokis. Uji statistik menunjukkan jumlah sel heterokis berbeda nyata antar perlakuan (konsentrasi nitrogen) dan antar waktu (P<0,05).
Gambar 4 Jumlah heterokis selama 21 hari pengamatan
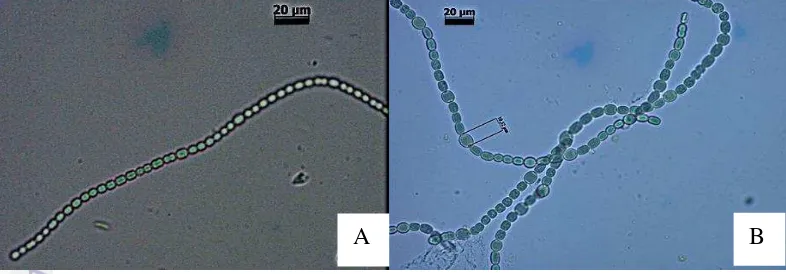
Berdasarkan penelitian yang dilakukan, dapat ditemukan serangkaian filamen tanpa heterokis dan serangkaian filamen yang memiliki sel heterokis dengan interval yang hampir teratur sepanjang selnya. Pada Anabaena azollae
yang memiliki sel heterokis, satu sel heterokis ditemukan pada setiap 2-20 sel vegetatif.
10
Pertumbuhan biomassa Azolla sp.
Pertumbuhan Azolla sp. dapat dilihat dari pertambahan bobot yang dicerminkan melalui RGR dan doubling time (DT) (Tabel 4). Azolla sp pada perlakuan 0 mg/L dapat bertambah 0,065 g/hari (RGR) dan membutuhkan waktu 10 hari untuk menggandakan diri. Nilai RGR dan DT tersebut lebih tinggi dan cepat dibandingkan dengan perlakuan lain. Uji statistik menunjukkan pertumbuhan biomassa Azolla sp. berbeda nyata terhadap perlakuan (konsentrasi nitrogen) (Fhit>Ftab).
Tabel 4 Hasil pengukuran dan perhitungan laju pertumbuhan relatif dan doubling time pada Azolla sp.
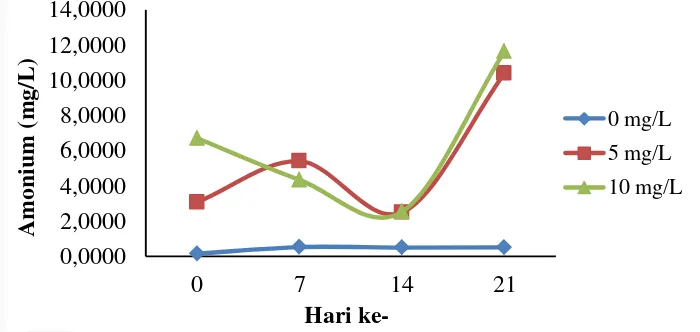
Perlakuan 0 mg/L umumnya mengalami penambahan konsentrasi amonium pada media di awal pengamatan. Sebaliknya, pada perlakuan 10 mg/L amonium pada media cair umunya mengalami penurunan nilai konsentrasi. Konsentrasi
amonium pada perlakuan 0 mg/L lebih rendah dibandingkan dengan perlakuan lainnya. Analisis statistik menunjukkan bahwa perubahan konsentrasi amonium pada media antar perlakuan (konsentrasi nitrogen) dan waktu berbeda nyata (P<0,05).
Gambar 6 Hasil analisis parameter amonium selama penelitian Nitrit (NO2)
11
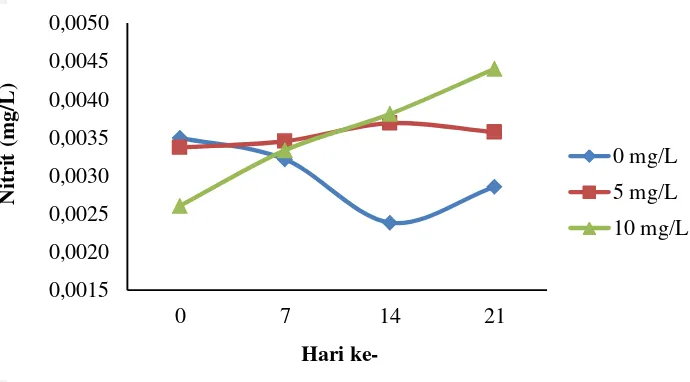
Gambar 7 Hasil analisis parameter nitrit selama penelitian Nitrat (NO3)
Hasil penelitian menunjukkan bahwa nilai nitrat selama pengamatan pada perlakuan 0 mg/L memiliki konsentrasi lebih tinggi dibandingkan perlakuan lainnya. Konsentrasi nitrat pada semua perlakuan meningkat hingga hari ke-14 penelitian, namun turun pada analisis hari ke-21. Hasil statistik yang dilakukan menyatakan bahwa perubahan konsentrasi nitrat pada media antar perlakuan (konsentrasi nitrogen) tidak berbeda nyata (P>0,05). Uji statistik perlakuan terhadap waktu pengamatan menunjukkan bahwa konsentasi nitrat berbeda nyata (P<0,05).
Gambar 8 Hasil analisis parameter nitrat selama penelitian Ortofosfat (PO4)
Konsentrasi ortofosfat mengalami penurunan pada setiap minggu pengamatan. Nilai ortofosfat pada perlakuan 10 mg/L lebih tinggi dibandingkan dengan perlakuan lainnya. Perubahan nilai tersebut dipengaruhi oleh pemanfaatan oleh alga, bakteri maupun tanaman air (Wetzel & Likens 1995). Uji statistik menunjukkan konsentrasi ortofosfat berbeda nyata terhadap perlakuan (konsentrasi nitrogen) dan waktu (P<0,05).
12
Gambar 9 Hasil analisis parameter ortofosfat selama penelitian Nitrogen total Kjeldahl (TKN)
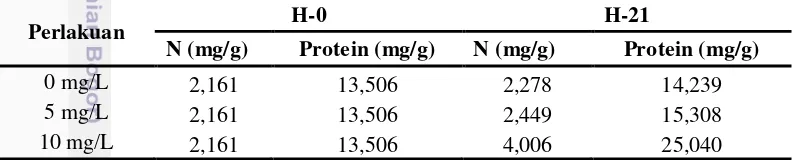
Analisis nitrogen dan protein pada Azolla sp. pada awal perlakuan sebesar 2,161 mg/g dan 13,506 mg/g. Pada akhir penelitian, diketahui bahwa persentase nitrogen tertinggi terdapat pada Azolla sp. pada perlakuan 10 mg/L sebesar 4,006 mg/g kemudian dikonversi ke dalam protein, didapatkan nilai protein sebesar
25,040 mg/g. Uji statistik menunjukkan nilai nitrogen total Kjeldahl pada Azolla sp.
berbeda nyata terhadap perlakuan (konsentrasi nitrogen) (Fhit>Ftab).
Tabel 5 Nilai rata-rata persen nitrogen dan konversi dalam protein pada Azolla sp. pada tiap konsentrasi perlakuan
Kondisi lingkungan yang diamati melalui parameter kualitas air (suhu, pH, dan intensitas cahaya) memiliki kisaran yang hampir sama untuk semua perlakuan. Hal ini disebabkan karena lokasi penelitian serta tata letak wadah terhadap penyinaran matahari adalah sejajar dan sama.
13 Pembahasan
Berdasarkan penelitian yang dilakukan dapat diketahui bahwa jumlah heterokis berfluktuasi pada ketiga perlakuan (0 mg/L, 5 mg/L, dan 10 mg/L). Fogg (1949) menjelaskan bahwa jumlah heterokis pada Anabaena berfluktuasi selama siklus pertumbuhannya, dan struktur heterokis berkembang ketika beberapa zat nitrogen spesifik dalam sel normal berada pada konsentrasi kritis. Berdasarkan pengamatan pada heterokis yang dilakukan secara visual (Lampiran 4) selama penelitian, diketahui bahwa satu sel heterokis ditemukan diantara 2-20 sel vegetatif. Anabaena azollae yang bersimbiosis dengan Azolla sp. dapat mencapai jumlah heterokis yang tinggi, Jarak antara dua sel heterokis berada diantara 3-5 sel vegetatif. Pada alga biru yang tidak bersimbiosis, jarak antara dua sel heterokis berkisar 15-30 sel vegetatif (Watanabe 1984).
Sel heterokis pada Anabaena azollae dengan media tanpa penambahan sumber nitrogen (perlakuan 0 mg/L), memiliki jumlah sel heterokis lebih tinggi dibandingkan perlakuan lainnya (Gambar 4). Terbentuknya sel heterokis tersebut terjadi karena diferensiasi sel vegetatif menjadi sel heterokis, yang merupakan respon dari kurangnya konsentrasi nitrogen pada media hidup Azolla-Anabaena. Sumber nitrogen yang cukup pada media, menyebabkan sel heterokis yang terbentuk lebih sedikit. Hal ini sesuai dengan pendapat Hill (1977), bahwa terbentuknya heterokis pada Anabaena azollae dapat dihambat oleh nitrogen yang disuplai Azolla sp.
Sel heterokis akan mengikat nitrogen dari udara dan merubahnya menjadi amonium. Sejumlah kecil amonium hasil fiksasi akan di lepaskan ke dalam air selama pertumbuhannya (Watanabe 1984). Hal ini sesuai dengan hasil penelitian, terdapat peningkatan konsentrasi amonium pada media (Gambar 6). Peningkatan amonium juga dapat disebabkan oleh Azolla sp. yang mati dan melepaskan amonium ke media hidupnya. Selama dekomposisi, nitrogen organik dimineralisasi secara cepat pada dua minggu pertama, selanjutnya laju dekomposisi berjalan lebih lambat (Watanabe 1984). Oleh karena itu, pada akhir pengamatan, konsentrasi amonium pada semua perlakuan meningkat dibandingkan dengan minggu sebelumnya. Azolla sp. yang mati ditunjukkan dengan warna daun yang kecoklatan (Lampiran 5).
14
Dinamika sel heterokis pada Azolla sp. juga dapat dilihat melalui TKN (total kjeldahl nitrogen). Nilai TKN pada perlakuan 0 mg/L lebih kecil dibandingkan dengan perlakuan lainnya. Nilai TKN yang rendah memiliki jumlah sel heterokis yang lebih tinggi, karena tidak terdapat sumber nitrogen pada media. Hal ini juga berlaku sebaliknya.
Tersedianya sumber fosfor juga menjadi salah satu faktor yang menentukan pertumbuhan Azolla-Anabaena. Orthofosfat merupakan bentuk fosfor anorganik yang dapat langsung diserap oleh alga dan tumbuhan. Konsentrasi Orthofosfat pada ketiga perlakuan selama penelitian mengalami penurunan setiap minggunya (Gambar 9). Hal ini menunjukkan adanya pemanfaatan fosfor yang digunakan untuk pertumbuhan Anabaena-Azolla. Fosfor merupakan komponen esensial yang digunakan untuk proses metabolisme (Lumpkin & Plucknett 1982 in Wegner 1997).
Uji statistik dengan rancangan acak in time menunjukkan bahwa perlakuan yang diberikan (konsentrasi nitrogen) berpengaruh nyata terhadap parameter heterokis dan Amonia. Sedangkan waktu penelitian memberikan pengaruh nyata terhadap semua parameter yang di uji yaitu heterokis, amonia, nitrit, dan nitrat. Uji lanjut yang dilakukan menunjukkan bahwa ketiga perlakuan memiliki pengaruh yang berbeda terhadap perubahan jumlah sel heterokis dan konsentrasi amonium (Lampiran 6).
RGR pada perlakuan dengan sumber nitrogen menunjukkan nilai yang lebih rendah dibandingkan dengan perlakuan tanpa sumber nitrogen. Kondisi ini terjadi karena nitrogen yang berlebihan akan menyebabkan kejenuhan sehingga menghambat metabolisme (Caicedo et al. 2000). Rendahnya sumber nitrogen (amonium atau nitrat) dalam medium meningkatkan laju pertumbuhan dari Azolla
sp. (Tuzimura et al. 1957 in Singh et al.1992). Nilai RGR yang tinggi menunjukkan kemampuan menggandakan diri (doubling time) yang cepat.
Doubling time pada penelitian ini lebih lambat dibandingkan dengan Hasan & Chakrabarti (2009). Perbedaan doubling time, dipengaruhi juga oleh suhu. Suhu mempengaruhi proses fisiologis pada tanaman berupa laju transpirasi, laju penyerapan air dan nutrisi serta fotosintesis. Suhu optimum untuk pertumbuhan Azolla berkisar 18-28°C (Tuan & Thuyet 1979 in Wegner 1997). Pada kisaran suhu tersebut, proses fiologis akan meningkat, namun bila melewati titik optimum, maka proses tersebut mulai terhambat (Sutopo 2002 in Husen 2011). Nilai suhu pada penelitian ini berkisar 27-31°C, menyebabkan proses fisiologisnya terhambat, sehingga doubling time pada penelitian ini lebih lambat dibandingkan dengan doubling time Azolla sp. pada lingkungan dengan suhu optimum. Pada lingkungan yang optimum Azolla dapat menggandakan diri dalam kisaran waktu 2-10 hari (Hasan & Chakrabarti 2009).
15 berlangsung maka akan semakin rendah nilai pH pada media (Marschner & Romheld 1983).
Dinamika sel heterokis dapat dilihat dari perubahan jumlah sel heterokis sebagai respon dari kurangnya ketersediaan nitrogen (amonium dan nitrat) pada media. Sel heterokis dapat terbentuk dan menjadi heterokis dewasa dalam waktu 15 jam (Wilcox 1973). Hal ini menunjukkan heterokis dapat cepat terbentuk sebagai respon dari kurangnya sumber nitrogen. Sesuai dengan hasil akhir penelitian ini, persentase sel heterokis tertinggi dimiliki oleh perlakuan 0 mg/L (tanpa sumber nitrogen). Perubahan sel heterokis terlihat pada minggu awal, dimana heterokis meningkat signifikan pada perlakuan 0 mg/L. Selanjutnya, jumlah sel heterokis pada Anabaena azollae berfluktuasi bergantung pada ketersediaan konsentrasi nitrogen pada media. Nitrogen yang difiksasi oleh sel heterokis dapat dilepas ke media pada saat pertumbuhan dan ketika Azolla sp. mengalami dekomposisi. Perubahan jumlah sel heterokis pada Anabaena azollae,
bermanfaat memberikan informasi mengenai peran Anabaena-Azolla dalam memperkaya nitrogen pada lingkungan hidupnya. Secara ekologi, hal ini berkaitan dengan ketersediaan nutrien khususnya nitrogen pada lingkungan perairan.
KESIMPULAN
Perlakuan konsentrasi nitrogen yang diberikan pada media pertumbuhan
Azolla sp. menghasilkan jumlah heterokis yang berbeda. Jumlah sel heterokis tertinggi terdapat pada perlakuan dengan konsentrasi nitrogen 0 mg/L yang berfluktuasi selama 21 hari pengamatan.
DAFTAR PUSTAKA
Buikema WJ, Haselkorn R. 1991. Isolation and complementation of nitrogen fixation mutants of the cyanobacterium Anabaena sp. Strain pcc 7120.
Journal of Bacteriology. 173 (6). 1879-1885.
Caicedo JR, Van Der Steen NP, Arce O, Gijzen HJ. 2000. Effect of total ammonia nitrogen concentration and pH on growth rates of duckweed (Spirodela polyrrhiza). Elsevier Science. 34(15). 3829-3835.
Eaton DA, Clebceri SL, Greenberg EA. 2005. Standard method for the examination of water and waste water, 21st Edition. Washington (US): American Public Health Association..
Fay P. 1992. Oxygen relations of nitrogen fixation in cyanobacteria. Microbiology and Molecular biology reviews. 56 (2). 340-373.
Golden JW, Yoon HS. 2003. Heterocyst development in Anabaena. Curr Opin Microbiol.( 6). 557-563.
16
Hasan MR, Chakrabarti R. 2009. Use of algae and aquatic macrophytes as feed in small-scale aquaculture. Rome: Food and Agriculture Organization (FAO).
Husen AM. 2011. Pengaruh lama dan suhu penyimpanan terhadap viabilitas bonggol pisang barangan (Musa accuminata, L). [Skripsi]. Fakultas Pertanian. Universitas Islam Riau.
Kumar K, Rodrigo AM, James WG. 2010. Cyanobacterial Heterocysts. Cold Spring Harbor Perspective Biology. 2:a000315.
Mariscal V, Harrero A, Flores E. 2007. Continuous periplasm in a filamentous, heterocyst-forming cyanobacterium. Mol Microbiol. 65. 1139-1145.
Marschner H, Romheld V. 1983. In vivo measurement of root-induced pH changes at soil-root interface: effect of plant species and nitrogen source.
Zeitschrift fur pflanzenphysiologie. 111(3). 241-251.
Mattjik AA, Sumertajaya IM. 2000. Perancangan Percobaan Dengan Aplikasi SAS dan MINITAB Jilid I. IPB-Press. Bogor.
Mattjik AA, Sumertajaya IM. 2006. Perancangan Percobaan Dengan Aplikasi SAS dan MINITAB Jilid I. IPB-Press. Bogor.
Meeks JC, Jeff E. 2002. Regulation of cellular differentiation in filamentous cyanobacteria in free-living and plant-associated symbiotic growth states.
Microbiology and Molecular biology reviews. 66 (1). 94-121.
Metzgar JS, Schneider H, Pryer KM. 2007. Phylogeny and divergence time estimates for the fern genus Azolla (Salviniaceae). Int. J. Plant Sci. 168(7). 1045-1053.
Mitchell DS. 1974. Aquatic Vegetation and its use and control. Paris (FR). UNESCO
Mur LR, Olav MS, Hans U. 1999. Toxic Cyanobacteria in Water: A Guide to Their Public Health Consequences, Monitoring and Management. Ingrid & Jamie B, editor. ISBN 0-419-23930-8.
Mursalin. 2007. Pemanfaatan kayu apu (Pistia stratiotes), kiambang (Salvinia molesta), dan gulma itik (Lemna perpusilla) dalam memperbaiki kondisi air limbah kantin. [Skripsi]. Fakultas Perikanan dan Ilmu Kelautan. Institut Pertanian Bogor.
Qin H, Chengrong P, Yongding L, Dunhai L. 2012. Differential responses of
Anabaena sp. Pcc 7120 (cyanophyceae) cultured in nitrogen-deficient and nitrogen-enriched media to ultraviolet-b radiation. Jurnal Phycol. 48. 615-625.
Sigee DC. 2005. Freshwater Microbiology. England. John Wiley & Sons, LTD. Singh PK, Singh DP, Singh RP. 1992. Growth, acetylene reduction activity,
nitrate uptake and nitrate reductase activity of Azolla caroliana and Azolla pinnata at varying nitrate levels. Biochem. Physiol. Pflanzen. 121. 121-127.
[SNI] Standart Nasional Indonesia. 1992. Cara uji makanan dan minuman. Badan Standarisasi Nasional. Jakarta.
[SNI] Standart Nasional Indonesia. 2005. Pupuk Amonium Sulfat. Badan Standarisasi Nasional. Jakarta.
17 Wagner GM. 1997. Azolla: A review of its biology and utilization. The Botanical
Review. (63). 1-26.
Walpole RA. 1982. Pengantar Statistik. Gramedia Pustaka Utama. Jakarta. Watanabe I, Ramirez CM. 1984. Relationship between soil phosphorus
availability and Azolla growth. Soil Science and Plant Nutrition. 30 (4).595-598.
Wetzel RG, Likens GE. 1995. Limnological Analyses. Springer-Verlag. New York Berlin Heidelberh (edisi 2).
Wei TF, Ramasubramanian TS, James WG. 1994. Anabaena sp. Strain Pcc 7120 ntcA gene required for growth on nitrate and heterocyst development. Jurnal of Bacteriology. 176 (15). 4473-4482.
Widiastuti. 2012. Pengukuran laju fiksasi nitrogen strain-strain Nostoc [Vaucer 1803] Bornet et Flahault 1886 dengan metode acetylene Reduction assay (ARA). [Skripsi]. Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas Indonesia. Jakarta.
18
LAMPIRAN
Lampiran 1 Penyimpanan media
a. Urutan posisi wadah terhadap sinar matahari
Keterangan:
Lokasi : Laboraturium Riset Plankton
Departemen Manajemen Sumberdaya Perairan U1, U2, dan U3 : Ulangan pada masing-masing konsentrasi
: Konsentrasi 0 mg/L : Konsentrasi 5 mg/L : Konsentrasi 10 mg/L b. Foto posisi wadah
Sinar Matahari
U 1
U 2
U 3
U 1
U 2
U 3
U 2
U 1
19 Lampiran 2 Perhitungan konsentrasi pupuk ZA dan TSP yang digunakan
SNI 02-1750-2005 menyebutkan bahwa kandungan nitrogen pada pupuk ZA sebesar 21%. Dengan demikian dapat diperoleh berat kotoran ayam yang akan digunakan dalam menentukan konsentrasi perlakuan sebagai berikut:
Konsentrasi 0 mg/L
SNI 02-0086-2005 menyebutkan bahwa kandungan Phosfat dalam bentuk P2O5 pada pupuk TSP se besar 45%. Dengan demikian dapat diperoleh berat kotoran ayam yang akan digunakan dalam menentukan konsentrasi perlakuan sebagai berikut:
Konsentrasi 30 mg/L
= 30 mg/L X 22,5 L X (100/45) = 1500 mg
= 1,5000 gr pupuk TSP
Lampiran 3 Rumus perhitungan amonium
20
21 Perlakuan 5 mg/L
22
(Lanjutan)
Lampiran 5 Azolla sp. pada akhir pengamatan
23 Lampiran 6 Rancangan acak lengkap in time
RAL in time terhadap Heterokis Source Type III Sum
of Squares df Mean Square F Sig.
Corrected Model 21137.838a 32 660.557 5.947 .000 Intercept 1531413.828 1 1531413.828 1.379E4 .000
Perlakuan 11517.960 2 5758.980 51.845 .000 Corrected Total 28469.172 98 a. R Squared = 0,742 (Adjusted R Squared = 0,618)
Uji lanjut Duncan terhadap perlakuan
Perlakuan N Subset
Uji lanjut Duncan terhadap waktu
24
RAL in time terhadap amonium Source Type III Sum
of Squares df Mean Square F Sig.
Corrected Model 467.040a 11 42.458 63.579 .000
Intercept 567.449 1 567.449 849.726 .000
Perlakuan 230.188 2 115.094 172.348 .000
Waktu 147.127 3 49.042 73.438 .000
Perlakuan *
Waktu 89.724 6 14.954 22.393 .000
Error 16.027 24 .668
Total 1050.516 36
Corrected Total 483.067 35 a. R Squared = ,967 (Adjusted R Squared = ,952)
Uji lanjut Duncan terhadap perlakuan
Perlakuan N Subset
1 2 3
1 12 .4247
2 12 5.3389
3 12 6.1470
Sig. 1.000 1.000 1.000
Uji lanjut Duncan terhadap waktu Amonium
Waktu N Subset
1 2 3
14 9 1.8434
0 9 3.3118
7 9 3.4248
21 9 7.3008
25 RAL in time terhadap nitrat
Source Type III Sum
of Squares df Mean Square F Sig.
Corrected Model 9.931a 11 .903 15.439 .000
Intercept 34.861 1 34.861 596.144 .000
Perlakuan .397 2 .198 3.391 .050
Waktu 9.233 3 3.078 52.631 .000
Perlakuan *
Waktu .302 6 .050 .860 .538
Error 1.403 24 .058
Total 46.196 36
Corrected Total 11.335 35 a. R Squared = ,876 (Adjusted R Squared = ,819)
Uji lanjut Duncan perlakuan
Perlakuan N Subset
1 2
3 12 .8726
2 12 .9549 .9549
1 12 1.1247
Sig. .412 .098
Uji lanjut Duncan terhadap waktu
Waktu N Subset
1 2 3 4
0 9 .3514
21 9 .6865
7 9 1.2205
14 9 1.6778
26
RAL in time terhadap nitrit Source Type III Sum
of Squares df Mean Square F Sig.
Corrected Model .000a 11 1.915E-5 .832 .612
Intercept .001 1 .001 26.111 .000
Perlakuan 2.200E-5 2 1.100E-5 .478 .626
Waktu 6.885E-5 3 2.295E-5 .997 .411
Perlakuan *
Waktu .000 6 1.996E-5 .867 .533
Error .001 24 2.302E-5
Total .001 36
Corrected Total .001 35 a. R Squared = ,276 (Adjusted R Squared = -,056)
Uji lanjut Duncan terhadap perlakuan
Perlakuan N Subset
1
3 12 0.0035
2 12 0.0035
1 12 .0052
Sig. .433
Uji lanjut Duncan terhadap waktu
Waktu N Subset
1
0 9 .0032
7 9 .0033
21 9 .0034
14 9 .0065
27 RAL in time terhadap ortofosfat
Source Type III Sum of Squares df Mean Square F Sig.
Corrected Model 29.000a 11 2.636 6.327 .000
Intercept 1681.000 1 1681.000 4.034E3 .000
Perlakuan 3.167 2 1.583 3.800 .037
Waktu 22.556 3 7.519 18.044 .000
Perlakuan * Waktu 3.278 6 .546 1.311 .290
Error 10.000 24 .417
Total 1720.000 36
Corrected Total 39.000 35
a. R Squared = ,744 (Adjusted R Squared = ,626)
Uji lanjut Duncan perlakuan
Waktu N Subset
1 2 3
21 9 6.0000
14 9 6.2222
7 9 7.1111
0 9 8.0000
Sig. .472 1.000 1.000
Uji lanjut Duncan terhadap waktu
Waktu N Subset
1 2 3
21 9 6.0000
14 9 6.2222
7 9 7.1111
0 9 8.0000
28
RIWAYAT HIDUP
Penulis bernama lengkap Goran Suryanti Afifah Sulaiman, lahir di Bandung, 16 Desember 1993, merupakan anak kedua dari empat bersaudara oleh pasangan Sulaiman Kasim dan Deti Rahmawati. Penulis tinggal di Kab Bogor, Jawa Barat.
Penulis berhasil masuk Institut Pertanian Bogor di Departemen Manajemen Sumberdaya Perairan, Fakultas Perikanan dan Ilmu Kelautan pada tahun 2011 melalui jalur undangan masuk perguruan tinggi negeri (UMPTN). Sebelumnya penulis menimba ilmu di SD Impres Perumnas 1 Kupang dari tahun 2000-2005, SMP Negeri 1 Kuta dari tahun 2005-2008, dan SMA Negeri 1 Cibungbulang dari tahun 2008-2011.