IDENTIFIKASI BAKTERI SELULOLITIK ASAL TANAH
SITU GEDE DENGAN TEKNIK GENETIKA MOLEKULER
BUNGA NOVIA SELPANI
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa skripsi berjudul Identifikasi Bakteri Selulolitik Asal Tanah Situ Gede dengan Teknik Genetika Molekular adalah benar karya saya dengan arahan dari komisi pembimbing yang belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Penelitian ini didanai oleh Balai Besar Bioteknologi dan Semberdaya Genetik Pertanian (BB-BIOGEN), anggaran tahun 2015. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun yang tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Agustus 2015
Bunga Novia Selpani
ABSTRAK
BUNGA NOVIA SELPANI. Identifikasi Bakteri Selulolitik Asal Tanah Situ Gede dengan Teknik Genetika Molekuler. Dibimbing oleh AKHMAD ENDANG ZAINAL HASAN dan ENY IDA RIYANTI.
Selulosa merupakan salah satu biopolimer yang melimpah di alam dan merupakan limbah pertanian yang dominan. Selulosa dapat didegradasi melalui enzim selulase menjadi glukosa. Penelitian ini bertujuan melakukan identifikasi bakteri selulolitik dan uji aktivitas enzim selulase. Metode yang dilakukan meliputi penanaman isolat dari tanah lembab, pengujian zona bening, isolasi DNA, visualisasi fragmen DNA dengan metode elektroforesis, amplifikasi gen 16S rDNA dengan polymerase chain reaction (PCR), analisis keragaman gen 16S rDNA dengan enzim EcoR1, dan analisis sekuensing DNA, serta pengukuran aktivitas enzim secara kualitatif dan kuantitatif dengan media seleksi CMC. Enam isolat yang dianalisis dengan enzim restriksi menghasilkan tiga keragaman berdasarkan perbedaan ukuran basa yaitu 1500 bp, 850 bp, dan <850 bp. Dua isolat yang dianalisis dengan GeneBank yang tersedia di NCBI, 82% identik dengan Cellvibrio fibrivorans untuk isolat D714 dan 81% identik dengan Cellvibrio gandavensis
untuk isolat J531. Isolat D714, D533, J731, dan J531 yang diuji aktivitas enzimnya mendapatkan aktivitas paling tinggi pada hari ke tujuh yaitu berturut-turut sebesar 0.1054 IU/mL, 0.0996 IU/mL, 0.101 IU/mL, dan 0.9689 IU/mL.
Kata kunci : bakteri selulolitik, enzim selulase, gen 16S rDNA
ABSTRACT
BUNGA NOVIA SELPANI. Identification Cellulolytic Bacteria from Situ Gede Soil with Genetic Molecular Technique. Supervised by AKHMAD ENDANG ZAINAL HASAN and ENY IDA RIYANTI
Cellulose is a biopolymer in nature which is dominant agricultural waste. Many practices degrade cellulose into glucose molecules by using cellulase enzyme. This research aim to identify the cellulolytic bacteria and to test cellulase activities. The methods are platting isolates, halo zone testing, DNA isolation, visualization of DNA fragmen by electrophoresis, 16S rDNA gene amplification by Polymerase Chain Reaction (PCR), 16S rDNA gene divesity analysis with restriction enzymes, DNA sequensing analysis, and enzymatic assay using CMC selective media. Six isolates were analyzed by restriction enzyme and showed three diversity of based, its differences by size. The size of the bases are 1500 bp, 850 bp, and <850 bp. Sequensing DNA by GeneBank in NCBI web are 85% indentical between Cellvibrio fibrivorans to isolate D714 and then 81% identical to Cellvibrio gandavensis to isolate J531. Enzyme activities of isolates D714, D533, J731, and J531 has been tested enzyme to get the highest activity on seventh day is 0.1054 IU/mL, 0.0996 IU/mL, 0.101 IU/mL, and 0.9689 IU/mL.
IDENTIFIKASI BAKTERI SELULOLITIK ASAL TANAH
SITU GEDE DENGAN TEKNIK GENETIKA MOLEKULER
BUNGA NOVIA SELPANI
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains
pada
Departemen Biokimia
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
PRAKATA
Puji dan syukur penulis ucapkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan Januari 2015 ini ialah inovasi biomasa, dengan judul Identifikasi Bakteri Selulotik Asal Tanah Situ Gede dengan Teknik Genetika Molekuler.
Terima kasih penulis ucapkan kepada Bapak Ahmad Endang Zainal Hasan dan Ibu Eny Ida Riyanti selaku pembimbing yang telah memberikan bimbingan dan saran terhadap penelitian ini. Di samping itu, terimakasih kepada Ibu Sukma, Pak Heri, beserta staf, teknisi , serta teman-teman praktik lapang dan penelitian Di BB-BIOGEN. Ungkapan terima kasih juga disampaikan kepada kedua orang tua tercinta, adik-adik tersayang, Keluarga Biokimia 48, serta kakak-kakak dan teman-teman, atas segala doa dan kasih sayangnya hingga karya ilmiah ini selesai.
Semoga karya ilmiah ini bermanfaat.
Bogor, Agustus 2015
DAFTAR ISI
DAFTAR GAMBAR viii
DAFTAR LAMPIRAN viii
PENDAHULUAN 1
METODE 2
Bahan dan Alat 2
Metode Penelitian 2
HASIL 5
PEMBAHASAN 10
SIMPULAN DAN SARAN 14
Simpulan 14
Saran 14
DAFTAR PUSTAKA 14
LAMPIRAN 17
DAFTAR GAMBAR
1 Hasil penanaman isolat bakteri 6
2 Pemurnian isolat bakteri dengan metode gores 6
3 Zona bening yang terbentuk 6
4 Kurva pembentukan zona bening 7
5 Analisis hasil isolasi DNA 7
6 Analisis hasil isolasi DNA lanjutan 8
7 Hasil amplifikasi dengan PCR 8
8 Analisis keragaman dengan enzim restriksi 9
9 Analisis persamaan gen 16S rDNA pada isolat D714 9
10 Analisis persamaan gen 16S rDNA pada isolat J531 9
11 Grafik aktivitas enzim selama 9 hari 10
12 Reaksi antara DNS dengan glukosa 12
DAFTAR LAMPIRAN
1 Alur penelitian 182 Kurva standar glukosa 19
3 Isolat terpilih dengan aktivitas enzim dan contoh perhitungannya 19
4 Kurva hubungan konsentrasi substrat dengan aktivitas enzim 20
5 Tabel hubungan konsentrasi substrat dan aktivitas enzim 20
6 Kurva penentuan Km dan Vmaks 20
7 Contoh perhitungan Km dan Vmaks 22
PENDAHULUAN
Indonesia merupakan negara tropis dengan kekayaan sumber biomassa yang melimpah sebagai cadangan energi. Tanaman yang bisa tumbuh sepanjang tahun menjadikan potensi besar akan sumber biomassa ini. Cadangan energi yang semakin menipis dialami oleh seluruh negara–negara di dunia, dengan tingginya konsumsi energi karena peningkatan penduduk. Pemanfaatan limbah biomassa sebagai produk utama penghasil energi beberapa telah dikembangkan dengan pesat. Kelapa sawit merupakan salah satu jenis tanaman dalam produk utama sebagai bahan baku pembuatan biodiesel. Ubi kayu juga telah dimanfaatkan sebagai bahan pembuatan bioetanol. Menurut Hazra et al. (2011), biomassa adalah limbah benda padat yang dapat dimanfaatkan sebagai sumber energi dalam bentuk bahan bakar. Sumber biomassa yang dijadikan objek dalam penelitian ini yaitu jerami padi dan limbah daun hutan.
Jerami padi merupakan salah satu limbah pertanian yang dominan di Indonesia, dengan produktivitas padi mencapai 51.35 kuintal/hektar (BPS 2014). Jerami padi paling banyak dimanfaatkan sebagai pupuk atau dibakar, pakan ternak, dan juga digunakan sebagai keperluan industri. Menurut Fatmawati (2005), jerami padi mengandung 3.2% protein kasar, 32.56% serat kasar, 1.33% lemak, 40.80% selulosa, 26.62% hemiselulosa, dan 3.78% lignin. Selulosa pada jerami padi dapat dimanfaatkan sebagai bahan baku bioetanol, namun memerlukan tahapan khusus dalam proses konversinya. Konversi selulosa menjadi glukosa dari jerami padi yaitu memerlukan hidrolisis dengan bantuan katalis.
Tahapan penting dalam biokonversi jerami padi menjadi glukosa adalah hidrolisis dengan bantuan katalis, yaitu proses degradasi selulosa menjadi gula yang lebih sederhana seperti selobiosa ataupun glukosa (Wahyuningtyas et al. 2013). Menurut Nelson dan Cox (2005), hidrolisis dapat dilakukan secara kimia dan enzimatik. Hidrolisis kimia menggunakan asam sebagai salah satu katalisnya dan enzimatik menggunakan selulase sebagai katalisnya. Taherzadeh dan Karimi (2007) menyatakan bahwa katalis dengan enzim merupakan proses yang lebih ramah lingkungan, kondisi operasi lebih lunak (pH netral dan suhu rendah), serta berpotensi memberikan hasil yang lebih tinggi dibandingkan dengan katalis asam.
Enzim selulase merupakan enzim kompleks yang terdiri dari endoglukanase, eksoglukanase, dan selobiase yang mampu mendegradasi selulosa menjadi molekul kecil yang lebih sederhana (Murashima et al. 2002). Enzim selulase dapat diproduksi oleh mikroba selulolitik baik kapang ataupun bakteri. Kapang yang biasa digunakan yaitu dari jenis Trichoderma, Aspergillus, dan Penicillum.
Sedangkan bakteri yang dapat memproduksi selulase yaitu Pseudomonas, Cellulomonas, Bacillus, Micrococcus, Cellvibrio, dan Sporosphytophaga (Lynd et al. 2002). Lamid et al. (2011) telah mengisolasi bakteri selulolitik dari rumen sapi yaitu Nitrosomonas europae, Bacillus sphaericus, Cellulomonas cellulans,
Cytophaga hutchinsoi, Achidothermas cellulyticus, Lactobacillus acidophilus, dan
Cellvibrio mixtus.
Produksi enzim selulase oleh bakteri selulolitik diharapkan dapat bermanfaat dalam menangani permasalahan menipisnya cadangan energi. Rismijana et al.
2
bioetanol melalui pemanfaatan selulosa dan hemiselulosa dalam jerami padi. Penelitian terkait produksi enzim selulase melalui mikroba telah banyak dilakukan. Seperti yang dilakukan oleh Kodri et al. (2013) memanfaatkan enzim selulase dari
Trichoderma reseei dan Aspergillus niger sebagai katalisator hidrolisis enzimatik jerami padi. Penelitian ini bertujuan melakukan identifikasi bakteri selulolitik penghasil enzim selulase dengan teknik genetika molekuler serta melakukan uji aktivitas enzim secara kualitatif dan kuantitatif.
METODE
Bahan dan Alat
Alat–alat yang digunakan terdiri dari tabung reaksi, labu Erlenmeyer, jarum inokulum (ose), cabinet laminar air flow, autoklaf, pembakar spirtus, hot plate stirrer, stirrer bar, pH meter, inkubator, mikropipet, batang L, pipet tip, mesin goyang, mesin PCR Biorad, ChemDoc, UV transminalator, penangas air, spektrofotometer Biorad, seperangkat alat elektroforesis (tray, comb, chamber), tabung Eppendorf.
Bahan–bahan yang digunakan adalah sampel tanah lembab asal Situ Gede, media Carboxil Methil Cellulase (CMC), MgSO4, MnSO4, NaCl, amonium nitrat,
NaCl 1%, akuades, alkohol teknis, congo red 0.1%, etanol 70%, etanol absolut, bufer ekstrak, kalium asetat, balok es, reagen DNS, etidium bromida, marker 1 kb,
loading dye, gel agarose 1%, larutan TAE, Kappa 2G Fast Ready Mix, MgCl2,
primer 1492R dan 27F, EcoR1 Promega, bufer enzim restriksi Promega, dan ddH2O.
Metode Penelitian
Penelitian ini dilakukan dari Januari–Maret 2015 di Laboratorium Biologi Molekuler Balai Besar Bioteknologi dan Sumberdaya Genetik Pertanian (BB-BIOGEN), Cimanggu, Bogor. Penelitian ini diawali dengan penanaman dan pemurnian sampel. Kemudian dilanjutkan dengan identifikasi bakteri secara molekular yang terdiri atas isolasi DNA, polymerase chain reaction (PCR), visualisasi fragmen DNA dengan elektroforesis, analisis gen 16S rDNA dengan enzim restriksi, dan analisis sekuensing DNA. Selanjutnya dilakukan uji aktivitas enzim secara kuantitatif dan kualitatif.
Pengambilan Sampel (Susilowati 2007)
Sampel diambil dari tanah lembab yang berasal dari tumpukan daun dan jerami asal daerah Situ Gede, Dramaga Bogor. Sampel diambil dari tanah dengan kedalaman 10 mm dari permukaan tanah yang berada di bawah tumpukan jerami dan daun dengan mengggunakan sendok.
Pengenceran Sampel (Modifikasi dari Pirzadah et al. 2014)
3
campuran tersebut dilarutkan ke dalam 9 mL akuades dan dihomogenkan. Pengenceran ini mendapatkan larutan pengenceran 10-2. Pengenceran tersebut dilakukan hingga didapatkan larutan pengenceran 10-8.
Penumbuhan Isolat Bakteri (Modifikasi dari Nurkanto 2007)
Media yang digunakan adalah media Carboxy methyl cellulose (CMC) dari Sigma C9481. Komposisi media dalam 1 L akuades yaitu 1 g (NH4)NO3, 1 g
MgSO4, 1 g MnSO4, 1 g yeast ekstrak, 10 g CMC, 1g FeSO4, 1 g NaCl, 18 g Agar.
Derajat pH diatur dengan penambahan NaOH hingga pH mencapai 7. Penumbuhan isolat bakteri menggunakan sampel hasil pengenceran 10-6 dan 10-8. Sebanyak 100 µL sampel masing–masing dipindahkan ke media CMC dan dilakukan dengan tiga kali pengulangan. Inkubasi dilakukan selama satu minggu dalam suhu 28ºC. Pembuatan Kultur Murni (Modifikasi dari Pirzadah et al. 2014)
Koloni–koloni yang didapatkan saat penumbuhan isolat bakteri yang memberikan zona bening, dipindahkan ke media baru dengan cara digores yang dilakukan secara duplo. Inkubasi dilakukan selama tiga hari dalam suhu 28oC. Koloni tunggal bakteri diberi kode J untuk sampel dari jerami dan D untuk sampel dari daun. Urutan kode kedua diberi 7 untuk pengenceran 10-8 dan 5 untuk pengenceran 10-6. Urutan kode ketiga sesuai dengan pengulangan penumbuhan isolat pada cawan petri. Urutan kode terakhir yaitu koloni tunggal yang diambil dari penumbuhan isolat bakteri. Sehingga isolat diberi nama J721 dan D511.
Uji Isolat Pendegradasi Selulosa Secara Kualitatif (Nurkanto 2007)
Koloni bakteri dibiakkan di dalam media cair, kemudian diteteskan ke media padat sebanyak 10 µL. Inkubasi dilakukan selama 3 hari dalam suhu 28oC. Setelah itu, dicuci dengan congo red 0.1% selama 30 menit, kemudian dibilas dengan NaCl 1%. Pengukuran aktivitas dilakukan dengan cara membandingkan rasio diameter zona bening dengan diameter koloni yang tetap ada.
Isolasi DNA bakteri (Modifikasi dari Zhang etal. 2013)
Koloni bakteri sebelumnya dibiakkan ke dalam media cair selama 24 jam, 250 rpm pada suhu ruang. Setelah itu, dipindahkan ke dalam tabung Eppendorf sebanyak 1.5 mL. Setiap koloni dipindahkan ke dalam dua tabung Eppendorf. Kemudian, disentrifus selama 3 menit dengan kecepatan 5000 rpm pada suhu 4oC. Supernatannya dibuang dan peletnya diambil. Setelah itu, ditambahkan lagi dengan koloni bakteri yang ada di dalam media cair sebelumnya pada volume 1.5 mL. Lalu disentrifus lagi selama 3 menit dengan kecepatan 5000 rpm pada suhu 10oC. Dan
seterusnya hingga didapatkan sel bakteri yang murni dari pelet dengan jumlah yang banyak.
4
suhu 4oC. Supernatannya dibuang dan pelet DNA ditambahkan 30 µL akuades steril
(ddH2O). Larutan DNA yang didapatkan di visualisasi dengan cara elektroforesis
DNA.
Visualisasi fragmen DNA dengan Elektroforesis
Gel yang digunakan adalah gel agarose 1 % yaitu 1 gram agarose dalam 100 mL larutan TAE. Gel dicetak di dalam kotak gel dan dimasukkan ke dalam reservoir yang diisi dengan larutan buffer TAE. Setelah itu, sampel dimasukkan ke dalam kolom gel masing–masing sebanyak 2 µL, kemudian ditambahkan 1 µL loading dye untuk pewarnaan. Marker yang digunakan adalah marker 1 kb. Setelah itu, proses pemisahan fragmen DNA dijalankan selama 30 menit. Setelah selesai 30 menit, direndam dalam EtBr dan divisualisasikan melalui program ChemDoc. Elektroforesis dilakuakan selama dua kali. Tahapan pertama sebelum PCR dan kedua setelah PCR.
Amplifikasi gen 16S rDNA dengan Polimerase Chain Reaction (Salaki et al.
2010)
Komposisi PCR 12.5 µL Kappa 2G Fast Ready Mix, 1.25 µL UFP, 1.25 µL URP, 0.5 µL MgCl2, 1 µL DNA, dan 8.5 µL H2O dicampurkan ke dalam tabung
Eppendorf. Kemudian dimasukkan ke dalam mesin PCR dengan siklus denaturasi pada suhu 95ºC selama 30 detik, anealling pada suhu 57ºC selama 60 detik, dan elongasi pada suhu 72ºC selama 60 detik, siklus diulang selama 30 kali dengan total lama reaksi selama 129 menit. Setelah 129 menit, ditunggu 10 menit hingga suhu mesin PCR sesuai dengan suhu ruang. Sampel dapat diambil dan digunakan pada tahapan sekuensing.
Uji Isolat Pendegradasi Selulosa Secara Kuantitatif
Pembuatan Kurva Standar. Kurva standar dibuat dengan menggunakan larutan glukosa dengan interval konsentrasi 0–500 ppm. Sebanyak 1 mL larutan glukosa dimasukkan ke dalam tabung secara tertutup dan ditambahkan dengan 1 mL akuades. Campuran tersebut diaduk dan ditambahkan 1 mL reagen DNS, kemudian diaduk lagi. Campuran tersebut dipanaskan dalam air mendidih selama 7 menit dan diukur absorbansinya pada panjang gelombang 540 nm.
5
IU = V enzim ×t inkubasiµmol glukosa
Keteragan:
µmol glukosa : jumlah glukosa yang dihasilkan dalam µmol V enzim : volume enzim yang direaksikan
t inkubasi : waktu inkubasi
Penentuan Km dan Vmaks (Kanti 2005). Penentuan Km dan Vmaks berdasarkan teori Michelis – Menten dan Lineweaver – Burk dengan menggunakan konsentrasi substrat yang bervariasi yaitu 0.5 %, 0.6%, 0.8%, 1.0% dan 1.2%. Sebanyak 1 mL substrat dicampurkan dengan 1 mL enzim dari media sebelumnya dan diinkubasi dalam suhu 37oC selama 1.5 jam. Kemudian ditambahkan dengan 1
mL reagen DNS dan diinkubasi dalam air mendidih selama 7 menit. Selanjutnya dihitung absorbansi pada panjang gelombang 540 nm. Dalam kinetika persamaan Michelis – Menten, Vmaks : Kecepatan reaksi akhir Km : Konstanta Michelis Analisis Keragaman Gen 16S rDNA dengan Enzim Restriksi
Komposisi campuran yang digunakan meliputi 4.0 µL DNA sampel, 0.5 µL
EcoR1 Promega, 2.0 µL bufer Promega, 1.0 µL MgCl2 , dan 12.5 µL H2O
dicampurkan ke dalam tabung Eppendorf. Kemudian diinkubasi dalam suhu 37oC selama 1.5 jam. Setelah itu, analisis keragaman gen 16S rDNA divisualisasi dengan elektroforesis, sehingga didapatkan keragaman berdasarkan perbedaan ukuran fragmen DNA-nya. Sampel dianalisis berdasarkan isolat yang tumbuh dengan perbedaan warna pada saat penanaman isolat bakteri.
Analisis Sekuens DNA
Reaksi hasil PCR kemudian ditentukan urutan basanya dengan bantuan mesin ABI PRISM sequencer di Genetic Sciences. Setelah itu, urutan basa nitrogen dianalisis dengan metode BLAST untuk identifikasi spesies dengan menggunakan fasilitas dari situs blast.ncbi.nlm.nih.gov.
HASIL
Isolat Bakteri Selulolitik pada Media CMC
6
dalam jangka waktu tiga hari. Isolat bakteri tumbuh dengan berbagai macam koloni bakteri yang dibedakan berdasarkan perbedaan warna (Gambar 1).
Gambar 1 Hasil penanaman isolat bakteri
Isolat-isolat yang didapatkan kemudian dipidahkan ke media baru dengan metode gores (Gambar 2). Isolat bakteri tumbuh dengan lima macam warna yaitu merah muda, ungu, putih, putih keruh, dan kuning. Selanjutnya untuk pengukuran aktivitas enzim dan isolasi DNA, isolat yang tumbuh diinokulasikan ke media cair.
Gambar 2 Pemurnian isolat bakteri dengan metode gores Aktivitas Enzim Selulase secara Kualitatif
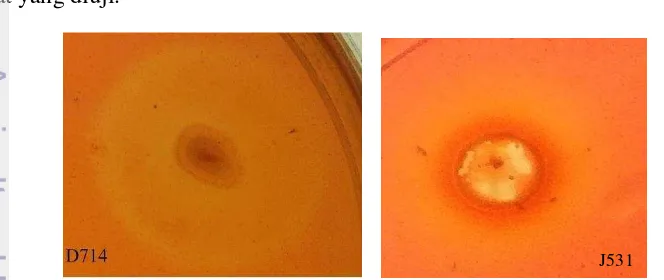
Pengukuran aktivitas enzim secara kualitatif dilakukan dengan cara mengukur indeks zona bening yang dihasilkan (Gambar 3). Indeks zona bening merupakan rasio antara diameter koloni bakteri yang tumbuh dengan diameter zona bening yang terbentuk. Pengukuran ini dilakukan dengan cara meneteskan larutan
congo red 0.1%. Sampel D714 merupakan sampel tanah yang berasal dari tumpukan daun dengan pengenceran sampel 10-8, sedangkan J531 merupakan
sampel yang berasal dari tanah yang berada di bawah tumpukan jerami dengan pengenceran sampel 10-6. Perbandingan dari hasil indeks zona bening yang terukur terdapat pada Gambar 4. Sampel yang menghasilkan zona bening sebanyak 15 dari 20 isolat yang diuji.
Gambar 3 Zona Bening yang terbentuk
7
Gambar 4 Kurva pembentukan zona bening DNA Kromosom
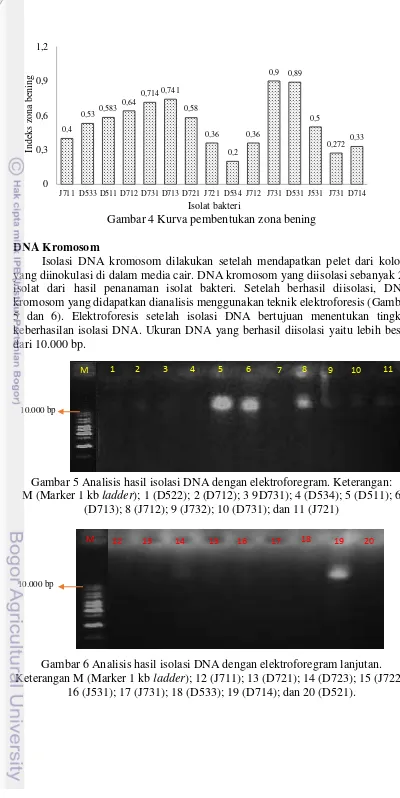
Isolasi DNA kromosom dilakukan setelah mendapatkan pelet dari koloni yang diinokulasi di dalam media cair. DNA kromosom yang diisolasi sebanyak 20 isolat dari hasil penanaman isolat bakteri. Setelah berhasil diisolasi, DNA kromosom yang didapatkan dianalisis menggunakan teknik elektroforesis (Gambar 5 dan 6). Elektroforesis setelah isolasi DNA bertujuan menentukan tingkat keberhasilan isolasi DNA. Ukuran DNA yang berhasil diisolasi yaitu lebih besar dari 10.000 bp.
Gambar 5 Analisis hasil isolasi DNA dengan elektroforegram. Keterangan: M (Marker 1 kb ladder); 1 (D522); 2 (D712); 3 9D731); 4 (D534); 5 (D511); 6
(D713); 8 (J712); 9 (J732); 10 (D731); dan 11 (J721)
Gambar 6 Analisis hasil isolasi DNA dengan elektroforegram lanjutan. Keterangan M (Marker 1 kb ladder); 12 (J711); 13 (D721); 14 (D723); 15 (J722);
J711 D533 D511 D712 D731 D713 D721 J721 D534 J712 J731 D531 J531 J731 D714
8
Amplifikon Gen 16S rDNA
Amplifikasi dilakukan setelah isolasi DNA dengan menggunakan teknik PCR. Amplifikasi gen 16S rDNA dari isolat bakteri dengan teknik PCR dilakukan dengan tiga tahapan utama yaitu denaturasi, annealling, dan elongasi. Hasil amplifikasi kemudian dianalisis dengan teknik elektroforesis (Gambar 7). Gen 16S rDNA yang diamplifikasi merupakan isolat yang membentuk zona bening dengan diameter paling besar dan menandakan aktivitas enzim selulase yang tinggi.
Gambar 7 Hasil amplifikasi DNA dengan PCR. Keterangan: M (marker) Keragaman Gen 16S rDNA
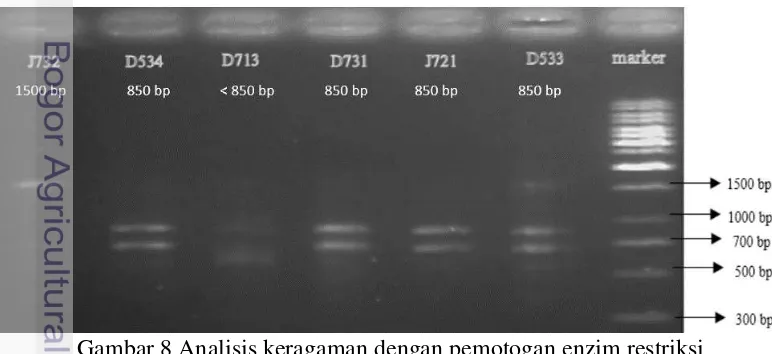
Keragaman gen 16S rDNA dengan pemotongan enzim restriksi, dipilih enam isolat hasil amplifikasi PCR dan berdasarkan perbedaan warna bakteri yang tumbuh saat penanaman isolat (Gambar 8). Amplikon yang dipilih berdasarkan perbedaan warna koloni yang tumbuh saat penanaman isolat. Berdasarkan hasil yang didapatkan, terdapat tiga jenis keragaman ukuran yaitu 1500 bp, 850 bp, dan kecil dari 850 bp. Isolat D534, D731, J721, dan D533 mempunyai keragaman yang sama dengan ukuran basa sebesar 850 bp. Isolat J732 tidak terpotong dan tetap berukuran sebesar 1500 bp. Isolat D713 berukuran kurang dari 850 bp karena potongan basa yang dihasilkan tertahan dibawah 1000 bp dan 700 bp.
Gambar 8 Analisis keragaman dengan pemotogan enzim restriksi 1500 bp
1500 bp
M
D71M
4 J731 D712
J732 D53 4
D713 D731 J72 1 J531
9
Hasil Sekuens DNA
Analisis sekuens DNA menggunakan fasilitas blastn pada web National Center for Biotechnology Information (NCBI). Data sekuens DNA telah disekuensing pada perusahaan GeneticScience. Berdasarkan perbandingan analisis data dengan GeneBank, isolat D714 mirip dengan Cellybrio fibrivorans dan isolat J531 mirip dengan Cellybrio gandavensis (Gambar 9 dan 10). Kemiripan dengan isolat D714 yaitu 82% dengan Cellybrio fibrivorans, sedangkan isolat J531 mirip 81% dengan Cellybrio gandavensis.
Gambar 9 Analisis persamaan gen 16S rDNA pada isolat D714
Gambar 10 Analisis persamaan gen 16S rDNA pada isolat J531 Aktivitas Enzim Selulase secara Kuantitatif
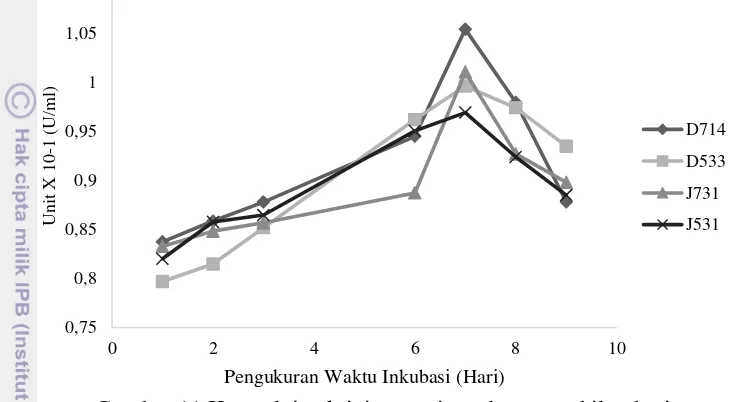
Pengukuran laju aktivitas enzim secara kuantitatif diawali dengan mengukur kurva standar glukosa yang berasal dari glukosa. Setelah itu, dilakukan pengukuran aktivitas enzim selama sembilan hari. Enzim yang diukur laju aktivitasnya berasal dari supernatan bebas koloni bakteri yang telah dipisahkan sebelumnya dengan metode sentrifugasi. Sampel yang diukur aktivitasnya adalah tiga sampel yang mempunyai zona bening terbaik. Laju aktivitas enzim didefinisikan salam satu Internasional Unit (IU) yaitu dalam 1 µmol glukosa yang dihasilkan dari degradasi substrat CMC tiap menit inkubasi (30 menit).
Hasil pengukuran laju aktivitas enzim selama masa kultivasi dapat dilihat pada Gambar 11. Laju aktivitas enzim maksimum terukur pada hari ke tujuh, dengan aktivitas enzim untuk isolat D714, D533, J531, dan J731 sebesar 1.054 × 10-1U/
mL, 0.99 × 10-1U/mL, 1.01 × 10-1U/mL, dan 0.97 × 10-1U/mL. Hasil pengukuran
10
aktivitas enzim tertinggi yang dapat dilihat dari hasil pengukuran Km dan Vmaks. Pemilihan isolat yang diuji berdasarkan pembentukan zona bening dan keberhasilan saat isolasi DNA kromosom.
Gambar 11 Kurva laju aktivitas enzim selama sembilan hari
PEMBAHASAN
Isolat Bakteri Selulolitik pada Media CMC
Substrat Carboxy Methyl Cellulose (CMC) merupakan substrat selulosa yang berbentuk amorphous sehingga dapat digunakan untuk pengujian aktivitas selulase. Bakteri yang mampu tumbuh pada media CMC menunjukkan bahwa bakteri tersebut dapat memanfaatkan selulosa sebagai salah satu sumber nutriennya terutama sumber karbon. Bakteri tersebut menghasilkan enzim selulase untuk mendegradasi selulosa menjadi glukosa (Deviani et al. 2014). Hasil penanaman isolat bakteri (Gambar 1) didapatkan dalam jangka waktu tiga hari, hal ini dikarenakan bakteri tersebut tumbuh dan dapat menyerap nutrien dengan baik mulai dari hari ketiga. Warna koloni yang didapatkan beragam yaitu ungu, putih, putih keruh, kuning keruh, dan merah muda. Isolat bakteri yang dipilih adalah isolat yang bisa menggunakan substrat CMC, yang diasumsikan mempunyai aktivitas selulolitik.
Aktivitas Enzim Selulase secara Kualitatif
Pengukuran aktivitas enzim secara kualitatif dibuktikan dengan terbentuknya zona bening. Zona bening yang terbentuk (Gambar 3) diukur diameternya dan dibandingkan dengan diameter koloni. Zona bening yang terbentuk pada lapisan substrat menunjukkan produksi enzim dari isolat sampel (Pirzadah et al. 2014). Menurut Nugraha et al. (2010), media agar menghasilkan zona bening karena adanya reaksi antara congo red dan selulosa yang telah terhidrolisis oleh enzim selulase. Hal tersebut menunjukkan adanya reaksi enzimatik yang menguraikan
11
selulosa pada media CMC menjadi glukosa. Pembilasan dengan NaCl bertujuan melunturkan warna congo red yang terdapat disekitar koloni, sehingga zona bening lebih terlihat. Indeks zona bening diukur berdasarkan perbandingan diameter zona bening yang terbentuk dengan diameter koloni. Perbedaan indeks zona ini diasumsikan adanya perbedaan aktivitas enzim selulase yang dihasilkan masing– masing isolat. Hasil pengukuran indeks zona bening pada Gambar 4 menunjukkan perbedaan yang tidak berpengaruh karena diameter masing-masing koloni yang tumbuh juga berbeda, sehingga indeks zona bening yang didapatkan tidak bisa dibandingkan. Menurut Tripati (2013), zona bening terbentuk karena congo red
dapat berikatan dengan substrat selulosa yang telah terhidrolisis menjadi glukosa sebagai hasil dari aktivitas enzim selulase, sedangkan daerah yang tidak terhidrolisis akan menampilkan warna merah.
Aktivitas Enzim Selulase secara Kuantitatif
Aktivitas enzim secara kuantitatif dinyatakan dalam satuan Internasional Unit (U/mL). Satuan Internasional Unit dinyatakan dengan 1 mikromol glukosa yang dihasilkan per menit dalam 1 mL enzim CMC-ase. Laju aktivitas enzim diukur dari banyaknya hasil glukosa yang tereduksi dari media CMC. Hasil pengukuran laju aktivitas enzim secara kuantitatif pada Gambar 11 dan kelengkapan data pada Lampiran 3 menunjukkan terjadinya peningkatan hingga hari ketujuh, artinya produksi enzim CMC-ase oleh bakteri selulolitik dapat bekerja optimal hingga hari ketujuh. Hal ini juga dapat dikaitkan dengan fase pertumbuhan bakteri yang eksponensial yaitu terjadinya peningkatan produksi enzim selulase. Setelah itu, diikuti fase stasioner dan laju kematian yang menandakan aktivitas enzim menurun.
Konsentrasi substrat berpengaruh dalam aktivitas enzim, seperti yang ditunjukkan pada Lampiran 4 dan 5. Menurut Kanti (2005), besarnya kecepatan reaksi enzimatik hampir sebanding dengan kenaikan konsentrasi substrat. Konsentrasi substrat yang rendah mengakibatkan kecepatan reaksi akan relatif lambat dan pada saat konsentrasi substrat yang tinggi kecepatan enzimatik akan berjalan dengan cepat.
Pengukuran Km dan Vmaks juga telah dilakukan. Km (konstanta Michaells) dan Vmaks (kecepatan maksimum reaksi) merupakan dua parameter kinetika enzim. Nilai Km tidak tergantung pada besarnya konsentrasi enzim, akan tetapi sebaliknya besar nilai Vmaks dipengaruhi oleh konsentasi enzim. Km diartikan sebagai ukuran afinitas enzim terhadap substrat. Semakin kecil nilai Km, aktivitas enzim semakin tinggi dan afinitasnya semakin besar. Besar nilai Vmaks ditentukan pada saat enzim telah jenuh dengan substrat (Kim 1995 dalam Kanti 2005). Lampiran 8 menunjukkan nilai Km dan Vmaks pada masing – masing isolat, seperti besar Km dan Vmaks pada isolat J531 yaitu 0.3168 %b/v dan 11.594 U/ menit.
12
Gambar 12 Reaksi antara DNS dan glukosa DNA Kromosom Bakteri Selulolitik
Ukuran DNA kromosom yang telah diisolasi terlihat jelas pada analisis elektroforesis Gambar 5 dan 6 yaitu lebih dari 10 000 bp. Menurut Demerdash (2012), ukuran molekul DNA kromosom lebih dari 10 000 bp yaitu 22 000 hingga 23 000 kb. Selain itu, Nuroniyah dan Putra (2012) menyatakan bahwa faktor lain selain ukuran molekul yang menyebabkan DNA kromosom tertahan diatas 10 000 bp dan tidak jauh dari sumur gel adalah karena konformasi DNA kromosom bakteri. DNA kromosom bakteri memiliki konformasi sirkular yang menyebabkan molekul DNA sulit melewati pori dalam agarose. Akibat konformasi DNA tersebut, kromosom DNA memiliki laju migrasi yang rendah sehingga tertahan di daerah lebih dari 10 000 bp.
Isolasi DNA kromosom bakteri dilakukan dengan menggunakan cara sentrifugasi dan mengunakan bufer ekstraksi, kalium asetat, etanol absolut, dan etanol 70% (Modifikasi dari Zhang et al. 2013). Penggunaan bufer ekstraksi yang mengandung komponen NaCl, Tris-HCl pH 8, EDTA, SDS (sodium dodecyl sulphate), dan PVP (polivinil pirolidon). Natrium klorida berfungsi memberikan kondisi ionik yang stabil sehingga molekul DNA dapat terpisah dengan komponen lainnya. Tris-HCl berfungsi sebagai larutan penyangga untuk kestabilan pH. Larutan EDTA berfungsi mengikat kation divalen yang membentuk inhibitor enzim DNA-se sehingga menjaga struktur DNA agar tidak terdegradasi. Natrium dodesil sulfat berfungsi melisiskan membran sel sehingga DNA dapat diisolasi. PVP meningkatkan presipitasi DNA terhadap etanol dingin (Sambrook dan Russell 2001). Setelah penambahan bufer ekstraksi dilakukan pemanasan dengan suhu 65ºC supaya dinding sel bakteri pecah.
Kalium asetat adalah senyawa yang dapat berikatan dengan debris sel dan protein sehingga membentuk senyawa kompleks kalium asetat-protein-debris sel. Etanol absolut digunakan dalam proses pengendapan DNA dan melarutkan molekul protein yang tersisa serta etanol 70% untuk mengendapkan pengotor yang menempel pada DNA (Fatimawali et al. 2011).
Amplifikon Gen 16S rDNA
PCR merupakan metode amplifikasi yang digunakan untuk melipatgandakan DNA dalam waktu singkat. Komponen yang digunakan dalam teknik ini yaitu kappa 2G Fast Readymix, primer 1492R dan 27F, MgCl2, DNA sampel, dan H2O.
Kappa merupakan salah satu produk dari perusahaan kappa biosistem yang merupakan generasi enzim untuk proses dan kecepatan yang tinggi, lebih cepat dari
13
merupakan primer umum yang digunakan dalam amplifikasi gen 16S rDNA. Selain itu, primer 1492R dan 27F juga membantu dalam perolehan data sekuen DNA. Penggunaan MgCl sangat berpengaruh dalam penentuan aktivitas enzim Tag
polimerase karena berfungsi sebagai kofaktor enzim.
Teknik PCR untuk amplifikasi 16s rDNA dilakukan selama 30 siklus dengan urutan tahapan umum denaturasi awal, denturasi, annealing, ekstensi, post ekstensi, dan pendinginan sampel DNA. Menurut Ratnayani et al. (2009), pita tebal yang ditunjukkan dalam Gambar 7, menandakan banyaknya jumlah DNA cetakan yang telah teramplifikasi. Makin tebal pita, maka jumlah DNA cetakan yang teramplifikasi makin banyak. Hasil analisis elektroforegram amplifikasi DNA menunjukkan ukuran basa DNA sebesar 1500 bp. Menurut Nuroniyah dan Putra (2012), molekul fragmen gen 16S rDNA memiliki ukuran 1500bp sehingga dapat disimpulkan DNA sampel berhasil teramplifikasi.
Keragaman Gen 16S rDNA
Analisis kualitas DNA yang membedakan berdasarkan ukuran yaitu menggunakan metode pemotongan fragmen DNA dengan enzim restriksi EcoR1. Selain itu, melalui pemotongan gen 16S rDNA dengan enzim restriksi, dapat membandingkan keragaman gen 16S rDNA yang satu dengan yang lainnya. Hasil analisis keragaman pada Gambar 8 menunjukkan gen 16S rDNA isolat J732 tidak terpotong dan tetap berukuran 1500 bp, isolat D534, D731, D721, dan D533 terpotong menjadi dua bagian yaitu berukuran 1000 bp dan 700 bp sehingga fragmen DNA isolat – isolat tersebut berukuran 850 bp, dan terakhir isolat D731 terpotong menjadi dua bagian yaitu berukuran <1000 bp dan <700 bp sehingga fragmen DNA isolat D731 berukuran <850 bp. hasil pemotongan gen 16S rDNA dengan fragmen yang berbeda, dapat diasumsikan bahwa terdapat keragaman sekuen pada gen 16S rDNA.
Hasil Sekuens DNA
Penentuan sekuen ribosomal 16S merupakan metode yang dapat diigunakan untuk mengidentifikasi spesies bakteri yang didasarkan atas urutan basa. DNA ribosomal 16S merupakan salah satu komponen penting dalam ekspresi genetik dan memiliki daerah bervariasi cukup untuk menentukan keeratan antar gen. Sekuensing DNA adalah metode penentuan urutan basa nukleotida suatu gen atau suatu fragmen DNA. Sekuensing berfungsi mempelajari organisasi, regulasi, dan fungsi sel. Selain itu, juga berfungsi dalam manipulasi gen di laboratorium, pembuatan penanda, dan primer, serta untuk identifikasi dan penetapan struktur gen. Keuntungan teknik ini yaitu mampu digunakan dalam identifikasi bakteri yang belum diketahui identitasnya (Heningtyas 2008). Identifikasi dalam hal ini adalah untuk isolat yang dapat diisolasi dan dapat ditumbuhkan dalam media CMC.
Bakteri yang teridentifikasi DNA pada Gambar 9 dan 10 menunjukkan bahwa, Cellvibrio fibrivorans dan Cellvibrio gandavensis yang telah teridentifikasi mirip dengan bakteri selulolitik yang telah berhasil diisolasi oleh Mergaert et al
(2003). Mergaert et al (2003) menyatakan bahwa isolat Cellvibrio fibrivorans dan
14
SIMPULAN DAN SARAN
Simpulan
Bakteri selulolitik yang berasal dari tanah lembab yang berada di bawah tumpukan limbah jerami telah berhasil diisolasi. Dua isolat dengan zona bening yang tertinggi telah diidentifikasi secara molekular dengan analisis sekuensing gen 16S rDNA yaitu isolat D714 identik 82% dengan bakteri Cellvibrio fibrivorans dan isolat J531 identik 81% dengan Cellvibrio gandavensis. Laju aktivitas enzim selulase dari 4 isolat telah diukur secara kuantitatif selama 9 hari dan laju aktivitas maksimum terukur pada hari ke tujuh. Aktivitas enzim pada isolat J531, J731, D714, dan D533 hari ketujuh masing – masing 0.97 x 10-1 U/mL, 1.01 x 10-1 U/mL, 0.99 x x 10-1 U/mL, dan 1.054 x 10-1 U/mL.
Saran
Perlu dilakukan pengujian aktivitas enzim selulase lebih lanjut menggunakan sumber karbon jerami padi untuk membuktikan bahwa enzim selulase dapat dimanfaatkan pada limbah jerami. Enzim selulase dapat dimanfaatkan oleh industri maupun pertanian sehingga perlu dilakukan pemurnian enzim.
DAFTAR PUSTAKA
[BPS] Badan Pusat Statistik. 2014. Tabel produktivitas padi di Indonesia Tahun 2014. [Internet]. [diakses 5 Juni 2015]. Tersedia pada www.bps.go.id Demerdash. 2012. A simple and inexpensive procedure for chromosomal DNA
extraction from Streptococcus thermophilis strains. Middle-East Journal of Scientific Research 11(1): 13-18.
Deviani S, Haryani Y, Jose C. 2014. Isolasi dan uji aktivitas bakteri selulolitik dari air muara daerah aliran sungai Siak wilayah kabupaten Bengkalis. JOM FMIPA
1(2): 78-88.
Fatimawali, Badaruddin, dan Yusuf. 2011. Isolasi dan identifikasi bakteri resisten merkuri dari muara sungai Sario yang dapat digunakan untuk detoksifikasi limbah merkuri. Jurnal Ilmiah Sains 11: 282-288.
Fatmawati. 2005. Komposisi kimia fraksi jerami padi (daun, pelepah, dan batang) [skripsi]. Padang (ID): Fakultas Pertanian Universitas Andalas Padang. Frank JA, Reich CI, Sharma S, Weisbaum JS, Wilson BA, Olsen GJ. 2008. Critical
evaluation of two primers commonly used for of bacterial 16S rRNA genes.
Applied and Environmental Microbiology 74(8): 2461-2470.
15
Heningtyas. 2008. Isolasi bakteri asam laktat dari berbagai makanan dan minuman tradisional dan identifikasi isolat–isolatnya secara molekular menggunakan DNA ribosomal 16S [skripsi]. Jakarta (ID): Universitas Indonesia.
Kanti. 2005. Aktinomycetes selulolitik dari tanah hutan taman nasional Bukit Duabelas, Jambi. Biodiversitas 6(2): 84-89.
Kodri, Argo BD, Yulianingsih R. 2013. Pemanfaatan enzim selulase dari
Trichoderma reseei dan Aspergillus niger sebagai katalisator hidrolisis enzimatik jerami padi dengan pretreatment microwave. JBioprosesKomoditas Tropis 1(1): 36-43.
Kusmiati dan Agustini NWS. 2010. Pemanfaatan limbah onggok untuk produksi asam sitrat dengan penambahan mineral Fe dan Mg substrat menggunakan kapang Trichoderma sp. dan Aspegillusniger. Seminar Nasional Biologi.
Lamid M, Nugroho TP, Chusniati S, Rochiman K. 2011. Eksplorasi bakteri selulolitik asal cairan rumen sapi potong sebagai bahan inokulum limbah pertanian. J Ilmiah Kedokteran Hewan 4(1): 37-42.
Lynd LR, Weimer PJ, Vanzyl VH, Pretorius IJ. 2002. Microbial celullose utilization: fundamental and biotechnology. Microbiol Rev 66: 506-517. Margaert J, Lednicka D, Goris J, Cnockaert MC, De Vos P, Swings J. 2003.
Taxonomi study of Cellvibrio strains and description of Cellvibrioostraviensis
sp. nov., Cellvibrio fibrivorans sp. nov., and Cellvibrio gandavensis sp. nov.
Int J Syst Evol Microbiol 53 (2): 465-471.
Miller GL. 1959. Use of dinitrosalicylic acid reagent for determination of reducing sugar. AnalChem 31: 426-428.
Murashima K, A. Kosugi and RH. Doy. 2002. Synergistic effects on crystalline cellulose degradation between cellulosomal cellulases from Clostridium cellulovorans. J. Bacteriol 184(18): 5088–5095.
Nelson and Cox. 2005. LehningerPrincipleofBiochemistry5thedition. New York: Freeman and Company.
Nugraha R, Ardyati T, Suharjono. 2010. Eksplorasi bakteri selulolitik yang berpotensi sebagai agen biofertilizer dari tanah perkebunan apel Kota Batu Jawa Timur. Jurnal Biotropika 2(3): 159-163.
Nurkanto. 2007. Identifikasi aktinomisetes tanah hutan pasca kebakaran Bukit Bangkirai Kalimantan Timur dan potensinya sebagai pendegradasi selulosa dan pelarut fosfat. Biodiversitas 8(4): 314-319.
Nuroniyah T dan Putra SR. 2012. Identifikasi spesies isolat bakteri S1 dengan metode analisa sekuen fragmen gen 16S rDNA. Jurnal Teknik POMITS 1(1): 1-6.
Pirzadah T, Garg S, Singh J, Vyas A, Kumar M, Gaur N, Bala M, Rehnan R, Varma A, Kumar V, and Kumar M. 2014. Characterization of actinomycetes and
16
Ratnayani K, Yowani C, Syane L. 2009. Amplifikasi fragmen 0.4 kb daerah d-loop DNA mitokondria lima individu suku Bali tanpa hubungan kekerabatan dengan metode polymerase chain reaction (PCR). Jurnal Kimia 3(1): 14-20
Rismijana, Indriani, Pitriyani. 2003. Penggunaan enzim selulase-hemiselulase pada proses deinking kertas koran bekas. Jurnal Matematika dan Sains 8(2): 67-71. Salaki CL, Sembiring L, Situmorang J, Handayani NS. 2010. Karakterisasi dan identifikasi molekular (ARDRA: amplified ribosomal DNA digestion analysis) isolat bakteri Bacillus thuringiensis berliner endogenik Indonesia sebagai agensia pengendali hama Crocidolomia binotalis Zell. Seminar Nasional Biologi; 2007 Sep 25-25; Yogyakarta, Indonesia. Yogyakarta (ID): Universitas Gajah Mada. hlm 585-591.
Sambrook and Russell 2001. Molecular Cloning 3th edition. New York: Cold Spring Harbor Labolatory Press.
Susilowati DN, Hastuti RD, Yuniarti E. 2007. Isolasi dan karakterisasi aktinomisetes penghasil enteropatogen Escherichia coli K1.1, Pseudomonas pseudomallei 02 05, dan Listeria monocytogeners 5407. J AgroBiogen 3(1): 12-23.
Taherzadeh MT and Karimi K. 2007. Enzyme-based hydrolysis processes for ethanol from lignocellulosic materials review. Bio Resources 2: 707-738. Tripati RK. 2013. Isolasi dan identifikasi bakteri aktinomisetes dengan kemampuan
selulolitik tinggi berdasarkan data sekuen parsial gen 16s rRNA [skripsi]. Jakarta (ID): Universitas Indonesia
Wahyuningtyas, Argo BD, Nugroho WA. 2013. Studi pembuatan enzim selulase dari mikrofungi Trichoderma reesei dengan substrat jerami padi sebagai katalis hidrolisis enzimatik pada produksi bioetanol. J Bioproses Komoditas Tropis
1(1): 21-25.
Widjaja A dan Gunawan S. 2012. Pengembangan teknologi produksi bioetanol generasi 2 melalui pemanfaatan selulosa dan hemiselulosa dalam jerami padi.
Prosiding inSINas.
17
18
Lampiran 1 Alur Penelitian
Sampel tanah
Isolat sampel 10-6 dan 10-8
Diencerkan dengan air steril hingga pengenceran 10-6 dan 10-8
100 µL ditumbuhkan ke media CMC, inkubasi 28oC selama 1 minggu
Isolat Bakteri
Diuji secara kualitatif dengan congo red
0.1%
Diuji secara kuantitatif dengan reagen DNS
Identifikasi molekuler (isolasi DNA, amplifikasi, sekuensing DNA, dan pemotongan dengan enzim restriksi)
Indeks zona
19
Lampiran 2 Kurva standar glukosa
Lampiran 3 Isolat yang terpilih dengan aktivitas enzimnya dan contoh perhitungan Hari
Absorbansi isolat D714 hari pertama = 0.6267
Persamaan garis dari kurva standar y = 0.0014x + 0.619 [glukosa] = . + .
0 200 400 600 800 1000 1200
20
Lampiran 4 Kurva hubungan konsentrasi substrat dengan aktivitas enzim isolat J531
Lampiran 5 Hubungan konsentrasi substrat dengan aktivitas enzim [Substrat] (%) Aktivitas enzim (g/mL menit)
J531 J731 D714 D533
Lampiran 6 Kurva penentuan Km dan Vmaks
0,7
21
Kurva penentuan Km dan Vmaks Isolat J731
y = 20,752x + 96,694
Kurva penentuan Km dan Vmaks Isolat D714
y = 16,655x + 110,78
22
Lampiran 7 Contoh perhitungan Km dan Vmaks isolat J531 Persamaan dari kurva yang didapatkan y = 27.313 x + 86.248 Kinetika Michelis – Menten Vo =
�
=
�� �
+
�Berdasarkan grafik
� = 86.248,
sehingga Vmaks =
. = 0.011594 IU/ menit.
Lalu, �
� = 27.313, sehingga Km = 27.313 × 0.011594 = 0.31688 %b/v.
Lampiran 8 Tabel hasil perhitungan Km dan Vmaks
Isolat Km (%b/v) Vmaks (IU/menit)
J531 0.3166 11.59
J731 0.1979 10.02
D714 0.2150 10.34
23
RIWAYAT
HIDUP
Penulis dilahirkan di Payakumbuh Sumatera Barat, pada tanggal 06 November 1993. Penulis merupakan anak pertama dari lima bersaudara pasangan Bapak Jon Hendril dan Ibu Nurpipanti. Penulis menyelesaikan sekolah dasar di SDN 24 Kabupaten Solok pada tahun 2005 dan melanjutkan sekolah menengah pertama di SMP Negeri 4 Solok pada tahun 2005-2008, serta SMA Negeri 2 Solok pada tahun 2008-2011. Pada tahun 2011, penulis diterima di Departemen Biokimia Institut Pertanian Bogor (IPB) melalui SNMPTN Undangan.
Selama menjalani studi di Institut Pertanian Bogor, penulis aktif dalam kegiatan dan organisasi kemahasiswaan, diantaranya menjadi anggota departemen Minat Bakat dan Pengembangan diri (MBM) Badan Eksekutif Mahasiswa Fakultas Matematika dan Ilmu Pengetahuan Alam (BEM FMIPA) tahun 2012-2013 dan Sekretaris departemen Budaya, Olahraga, dan Seni BEM FMIPA 2013-2014. Penulis juga aktif dalam berbagai kepanitiaan diantaranya staf divisi logistik dan transportasi Pesta Sains Nasional (PSN) 2012, Sekretaris Sport Competition and Art Festival (SPIRIT) FMIPA 2012, staf divisi logistik dan transportasi
International Scholarship Education Expo (ISEE) IPB 2013, Bendahara II PSN 2013, Bendahara umum PSN 2014, dan staf dana usaha siang keakraban (SIKRAB) Biokimia 2015.