ABSTRACT
HIKMA NADIATUL HUSNA. Growth and Survival of Climbing Perch Anabas testudineus Juveniles Immersed in Recombinant Giant Grouper Growth Hormone at Different Dose. Supervised by Dr. Alimuddin and Dr. Odang Carman
This research was conducted to determine the dose of immersion recombinant giant grouper growth hormone (rElGH) that generates the highest growth and survival rate of climbing perch Anabas testudineus juveniles. The dose of rElGH used was 3 mg/L, 6 mg/L, and 12 mg/L and without administration of rElGH as a control. Two hundred juveniles of 6 days after hatching (were the yolk egg absorbed) were immersed into 200 mL of rElGH solution for 2 hours. Fish were reared in aquarium (30x20x20 cm) at stocking densities of 20 fish/L. Fish were maintained for 8 weeks and fed on rotifer, Artemia nauplii and silk worm 4 times a day ad libithum and commercial diet at satiation. The results showed that the body length of 12 mg/L rGH-treated fish (4.6233 cm) were higher (P<0.05) compared to that of 6 mg/L (4.5633 cm), 3 mg/L (4.4633 cm) and control (4.4967 cm). Biomass of fish treated with rGH in a dose of 12 mg/L (529.01 g) were higher (P<0.05) compared to that of 6 mg/L (487.55 g), 3 mg/L (476.18 g) and control (416.17 g). Specific growth rate of among rGH-treated fish, and control were similar (P>0.05). Survival rate of 12 mg/L rElGH-treated fish was also higher compared with other treatments and control. Thus, immersion of fish in 12 mg/L rElGH solution can be applied to enhance the growth and survival rate of climbing perch.
ABSTRAK
HIKMA NADIATUL HUSNA. Pertumbuhan dan Kelangsungan Hidup Benih Ikan Betok yang Direndam dengan Hormon Pertumbuhan Rekombinan Ikan Kerapu Kertang pada Dosis Berbeda. Dibimbing oleh Dr.Alimuddin dan Dr.Odang Carman
Penelitian ini dilakukan untuk menentukan dosis perendaman hormon pertumbuhan rekombinan ikan kerapu kertang (rElHP) yang menghasilkan pertumbuhan dan kelangsungan hidup benih ikan betok tertinggi. Dosis rElHP yang diberikan, yaitu 3 mg/L, 6 mg/L, dan 12 mg/L serta tanpa pemberian rElHP sebagai kontrol. Benih ikan sebanyak 200 ekor yang berumur 6 hari setelah menetas (habis kuning telur) direndam ke dalam 200 mL larutan rElHP selama 2 jam. Ikan dipelihara dalam akuarium (30x20x20 cm) dengan padat tebar 20 ekor/L selama 8 minggu dan diberi pakan rotifer, naupli Artemia dan cacing sutera 4 kali dalam sehari secara ad libithum serta pakan buatan at satiation. Hasil penelitian menunjukkan bahwa panjang baku benih ikan betok yang diberi perlakuan perendaman rElHP dengan dosis 12 mg/L (4,62 cm) lebih tinggi (P<0,05) dibandingkan dengan perlakuan 6 mg/L (4,56 cm), 3 mg/L (4,46 cm), dan kontrol (4,49 cm). Biomassa ikan yang diberi perlakuan perendaman rHP dengan dosis 12 mg/L (529,01 g) juga lebih tinggi (P<0,05) daripada perlakuan 6 mg/L (487,55 g), 3 mg/L (476,18 g), dan kontrol (416,17 g). Laju pertumbuhan spesifik tidak berbeda antar perlakuan, dan kontrol (P>0,05). Tingkat kelangsungan hidup benih ikan betok perlakuan 12 mg/L lebih tinggi dibandingkan perlakuan lain, dan kontrol. Dengan demikian perendaman benih dalam larutan rElHP dengan dosis 12 mg/L dapat diaplikasikan untuk meningkatkan pertumbuhan, dan kelangsungan hidup ikan betok.
1 I. PENDAHULUAN
1.1. Latar Belakang
Ikan betok Anabas testudineus Bloch. atau dikenal dengan nama ikan papuyu di daerah Banjar, Kalimantan Selatan (Kottelat et al., 1993) merupakan salah satu ikan air tawar yang berpotensi untuk dikembangkan karena memiliki
nilai ekonomis cukup tinggi yaitu harganya dapat mencapai Rp100.000,00 per kg
(Borneonews, 2011). Budidaya ikan betok hingga saat ini masih belum banyak
dikembangkan. Salah satu hambatannya adalah pertumbuhan yang lambat dan
memerlukan waktu kurang lebih satu tahun untuk mencapai ukuran konsumsi
(70-100 gram) (Departemen Kelautan dan Perikanan, 2008).
Pertumbuhan ikan dapat ditingkatkan melalui perbaikan mutu ikan.
Perbaikan mutu ikan dapat dilakukan dengan metode seleksi, hibridisasi,
transgenesis, dan aplikasi protein rekombinan. Aplikasi metode seleksi
membutuhkan waktu relatif lama untuk mencapai efek signifikan khususnya pada
ikan yang membutuhkan waktu lama untuk mencapai matang kelamin pertama
kali (Bolivar et al., 2002). Penerapan teknologi hibridisasi juga memerlukan waktu relatif lama. Selain itu, aplikasi teknologi transgenesis dapat menghasilkan
ikan dengan tingkat perbaikan kualitas tinggi dalam waktu relatif cepat, tetapi
teknologi ini masih menimbulkan kontroversi terhadap keamanan pangan.
Sementara itu, hingga saat ini penggunaan hormon pertumbuhan rekombinan
(rHP) pada ikan dikatakan aman untuk dikonsumsi, karena rHP tidak
ditransmisikan ke keturunan selanjutnya sehingga tidak termasuk organisme
transgenik (Acosta et al., 2007).
Protein rHP cukup efektif digunakan untuk meningkatkan laju
pertumbuhan ikan. rHP merupakan polipeptida rantai tunggal dengan ukuran
sekitar 22 kDa yang dihasilkan menggunakan bioreactor/fermentor, seperti bakteri (Rousseau & Dufour, 2007 dalam Acosta et al., 2009). Penggunaan teknologi protein rHP untuk mempercepat pertumbuhan ikan sudah banyak
dilakukan pada beberapa spesies ikan dengan metode yang berbeda. Pemberian
rHP ikan mas melalui metode injeksi dengan dosis sebesar 0,1 µg/g bobot tubuh
2 dibandingkan dengan kontrol (Li et al. 2003). Pemberian jenis rHP yang berbeda pada ikan nila melalui teknik penyuntikan atau injeksi berhasil meningkatkan
bobot ikan yaitu sebesar 20,94% dengan rHP ikan kerapu kertang; 18,09% dengan
rHP ikan mas; 16,99% dengan rHP ikan gurame (Alimuddin et al., 2010). Pemberian rHP ikan mas melalui pakan Artemia pada benih ikan gurame dapat meningkatkan pertumbuhan sebesar 13% (Rahmawaty, 2011). Hasil lain diperoleh
dari pemberian protein rHP ikan gurame pada benih ikan gurame melalui metode
perendaman dengan dosis 30 mg/L sebanyak 3 kali perendaman efektif
meningkatkan pertumbuhan sebesar 75,04% dibandingkan dengan kontrol (Putra,
2011).
Pemberian rHP dapat dilakukan dengan beberapa metode, di antaranya:
perendaman/imersi (Moriyama, 1990; Acosta et al., 2007; Putra, 2011), penyuntikan/injection (Li et al., 2003; Lesmana, 2010), dan melalui pakan (Moriyama et al., 1993; Xu et al., 2001; Rahmawaty, 2011). Berdasarkan ketiga metode yang telah dilakukan, metode penyuntikan dikatakan kurang aplikatif dan
memperlihatkan respons yang lambat, sedangkan metode perendaman pada stadia
larva atau juvenil merupakan cara yang aplikatif untuk skala massal. Pada metode
perendaman diperlukan kejut salinitas. Menurut Ratnawati (2012) kejut salinitas
berfungsi untuk membuka jalur masuknya rHP melalui insang dengan
memanfaatkan mekanisme pertukaran cairan tubuh.
Protein rekombinan yang digunakan dalam kegiatan ini rElHP (hormon pertumbuhan ikan kerapu kertang Epinephelus lanceolatus) (Lesmana, 2010). Hormon ini digunakan karena tingkat produksi rHP ikan kerapu kertang pada
Escherichia coli lebih tinggi dibandingkan dengan rHP ikan gurame dan ikan mas (Irmawati et al., 2011 belum dipublikasikan). Selain itu, rElHP telah terbukti memiliki bioaktivitas dalam menginduksi pertumbuhan ikan nila (Alimuddin et al., 2010) dan ikan sidat (Aminah, 2012).
1.2. Tujuan
Penelitian ini dilakukan untuk menentukan dosis protein rHP ikan kerapu
3 II. BAHAN DAN METODE
2.1. Penelitian Pendahuluan
Penelitian pendahuluan dilakukan untuk menentukan salinitas kejut (shock salinity) untuk larva ikan betok. Larva ikan betok berumur 6 hari diberi kejut salinitas 3,0%; 2,5% dan 2,0% NaCl selama 2 menit. Selanjutnya benih ikan betok
direndam dalam larutan NaCl 0,3%; 0,5%; dan 0,7% selama 2 jam dengan satu
kali ulangan. Pada setiap perlakuan digunakan benih umur 6 hari sebanyak 100
ekor. Setelah itu ikan diperlihara selama 14 hari. Perlakuan yang memberikan
kelangsungan hidup tertinggi digunakan dalam penelitian utama.
Tabel 1. Tingkat kelangsungan hidup (survival rate/SR) benih ikan betok setelah diberi kejut salinitas selama 2 menit, dilanjutkan perendaman salinitas berbeda selama 2 jam
Kejut salinitas berbeda (%) selama 2 menit
Salinitas (%) perendaman larva selama 2 jam
0,3 0,5 0,7
3,0 46 80 48
2,5 65 58 53
2,0 54 58 54
Berdasarkan Tabel 1, dapat diketahui bahwa tingkat kelangsungan hidup
tertinggi (80%) diperoleh pada perlakuan dengan kejut salinitas NaCl 3,0% dan
perendaman pada larutan NaCl 0,5%. Salinitas tersebut selanjutnya digunakan
pada penelitian utama.
2.2. Produksi Protein rHP
Produksi protein rHP yang dilakukan pada penelitian ini menggunakan
bakteri E. coli BL21 yang mengandung pCold-I/ElHP yang dibuat oleh Lesmana (2010). Bakteri dikultur awal dalam 3 mL media LB cair yang mengandung
ampisilin dan NaOH 5M, lalu diinkubasi suhu 37 oC dengan menggunakan shaker kecepatan 200 rpm selama 18 jam. Setelah itu, dilakukan subkultur dengan
mengambil sebanyak 1% dari kultur awal dan dimasukkan ke dalam 100 ml media
LB cair mengandung ampisilin dan NaOH yang baru, lalu diinkubasi lagi pada
4 diberikan kejutan dengan suhu 15 oC selama 30 menit, ditambahkan IPTG
sebanyak 750 µL dan diinkubasi menggunakan shaker pada suhu 15 oC selama 24 jam. Bakteri hasil kultur disentrifugasi kecepatan 12.000 rpm selama 1 menit
dengan tujuan mengendapkan sel bakteri. Pelet bakteri yang diperoleh dicuci
dengan phosphate buffer saline (PBS) sebanyak 1 kali, selanjutnya disimpan dalam deep-freezer (-80 oC) hingga akan digunakan.
Inaktivasi bakteri dilakukan dengan cara pelet bakteri yang diperoleh dan
mengandung rekombinan ElHP dimasukkan ke dalam freezer -20 oC selama semalam, kemudian dimasukkan kembali ke deep-freezer (-80 oC). Lisis dinding sel bakteri dilakukan secara kimiawi menggunakan lisozim. Pelet bakteri hasil
sentrifugasi dicuci menggunakan bufer Tris-EDTA (TE) sebanyak 1 mL per 200 mg bakteri, lalu diinkubasi pada suhu 37 oC selama 20 menit. Selanjutnya, tabung
disentrifugasi pada kecepatan 12.000 rpm selama 1 menit, kemudian supernatan
dalam tabung mikro dibuang. Pelet bakteri (natan) yang diperoleh ditambahkan
500 µL larutan lisozim (10 mg dalam 1 mL bufer TE), lalu diinkubasi suhu 37 oC
selama 20 menit, selanjutnya disentrifugasi dengan kecepatan 12.000 rpm selama
1 menit. Supernatan dalam tabung mikro dibuang dan pelet yang terbentuk
merupakan protein rHP dalam bentuk badan inklusi (inclusion body). Pelet protein rHP dicuci PBS sebanyak satu kali dan disimpan dalam deep-freezer (-80 oC) hingga akan digunakan.
2.3. Rancangan Perlakuan
Penelitian ini menggunakan rancangan acak lengkap yang terdiri dari
empat perlakuan dengan tiga ulangan. Benih ikan betok yang digunakan berumur
6 hari. Ikan dipuasakan terlebih dahulu sehari sebelum diberi perlakuan. Pada
setiap perlakuan, sebanyak 200 ekor ikan betok direndam (salinity shock) dalam 200 mL media NaCl 3,0% selama 2 menit, lalu dimasukkan dalam larutan yang
mengandung rHP dengan dosis berbeda. Dosis rHP yang diuji yaitu 3 mg/L, 6
mg/L dan 12 mg/L dalam larutan NaCl 0,5% dan BSA (bovine serum albumine) 0,01%. Untuk perlakuan kontrol, ikan diberikan kejut salinitas NaCl 3,0% selama
2 menit, lalu dimasukkan dalam larutan NaCl 0,5% dan BSA 0,01% (tidak
5 2.4. Pemberian Pakan dan Pemeliharaan Ikan Betok
Ikan betok diberi pakan dengan skedul seperti disajikan pada Tabel 2. Ikan
dipelihara dalam akuarium ukuran 30x20x20 cm dengan volume air 10 liter
hingga berumur 30 hari, lalu pada akuarium dengan volume air 20 liter hingga
berumur 40 hari dan selanjutnya dipindah ke media hapa berukuran 1x1 meter.
Sampling panjang dilakukan pada awal pemeliharaan, hari ke-18, 30, dan 58.
Pada awal pemeliharaan, panjang ikan diukur menggunakan mikroskop dibantu
mikrometer dengan galat 0,05, sedangkan pada sampling kedua hingga akhir
digunakan milimeter blok untuk mengukur panjang. Sampling bobot dilakukan
pada awal pemeliharaan dan akhir pemeliharaan dengan jumlah ikan yang diambil
30 ekor per perlakuan menggunakan timbangan digital. Pergantian air sebanyak
60% dilakukan pada waktu sampling kedua, dan ketiga.
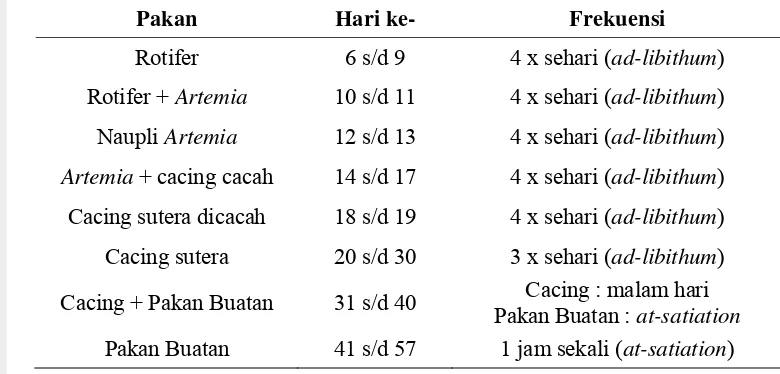
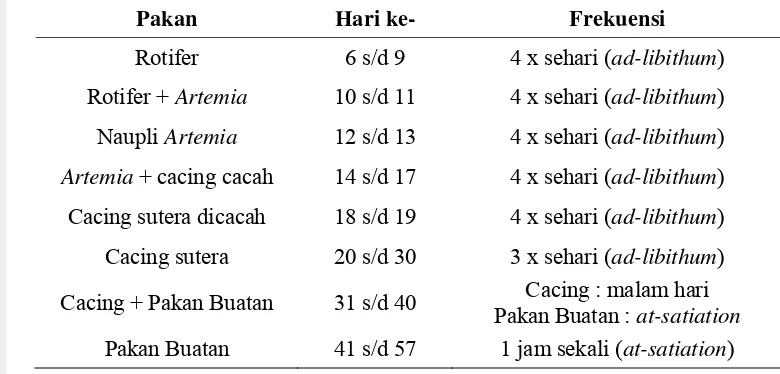
Tabel 2. Jenis dan skedul pemberian pakan pada ikan betok selama pemeliharaan
Pakan Hari ke- Frekuensi
Rotifer 6 s/d 9 4 x sehari (ad-libithum) Rotifer + Artemia 10 s/d 11 4 x sehari (ad-libithum) Naupli Artemia 12 s/d 13 4 x sehari (ad-libithum) Artemia + cacing cacah 14 s/d 17 4 x sehari (ad-libithum) Cacing sutera dicacah 18 s/d 19 4 x sehari (ad-libithum) Cacing sutera 20 s/d 30 3 x sehari (ad-libithum)
Cacing + Pakan Buatan 31 s/d 40 Cacing : malam hari Pakan Buatan : at-satiation Pakan Buatan 41 s/d 57 1 jam sekali (at-satiation)
2.5. Analisis Statistik
Parameter yang diamati pada penelitian ini meliputi pertumbuhan panjang
(panjang baku; panjang total), biomassa, rerata bobot tubuh, growth rate (GR), spesific growth rate (SGR) dan tingkat kelangsungan hidup. Parameter yang diamati tersebut dianalisis menggunakan metode sidik ragam (ANOVA) dan uji
6 III. HASIL DAN PEMBAHASAN
3.1. Hasil
3.1.1. Pertumbuhan Panjang Benih Ikan Betok
Pertumbuhan panjang benih ikan betok pada akhir penelitian setelah
perendaman 2 jam dengan protein rHP pada dosis berbeda disajikan pada Tabel 3
dan Gambar 1. Rerata panjang baku benih ikan betok yang diberi perlakuan
perendaman rHP dosis 12 mg/L (4,62 cm) adalah lebih tinggi (P<0,05)
dibandingkan perlakuan 6 mg/L (4,56 cm), 3 mg/L (4,46 cm) dan kontrol (4,49
cm). Pertambahan panjang total juga berbeda antar perlakuan (P<0,05; Tabel 3).
Rerata panjang total benih ikan betok yang diberi perlakuan perendaman rHP
dosis 12 mg/L (5,59 cm) dan dosis 6 mg/L (5,51 cm) juga lebih tinggi (P<0,05)
dibandingkan perlakuan 3 mg/L (5,430 cm), dan kontrol (5,477cm). Rerata tinggi
badan antar perlakuan tidak berbeda nyata (P>0,05; Tabel 3).
Tabel 3. Rerata panjang (cm) benih ikan betok pada perendaman rHP dengan dosis berbeda
Dosis ElHP
(mg/L) Panjang Baku Panjang Total Tinggi badan Kontrol (0) 4,49 ± 0,04a 5,47± 0,04ab 1,75 ± 0,01a
3 4,46 ± 0,03a 5,43± 0,04a 1,74 ± 0,03a 6 4,56 ± 0,06ab 5,51 ± 0,09ab 1,77 ± 0,02a 12 4,62 ± 0,03b 5,590± 0,01b 1,79 ± 0,02a
Keterangan: Huruf superskrip berbeda pada kolom yang sama adalah berbeda nyata (P<0,05). Data tersebut berdasarkan rerata dari 3 kali ulangan
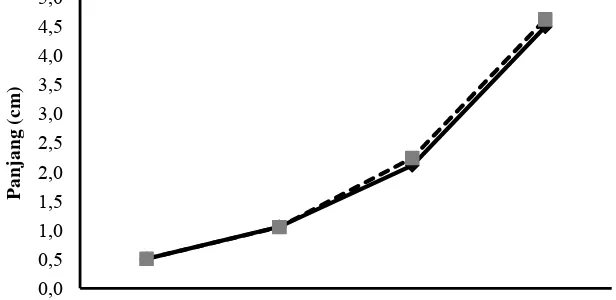
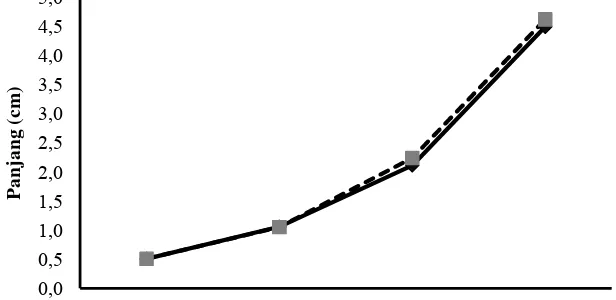
Gambar 1. Pertumbuhan panjang baku benih ikan betok perlakuan12 mg/L(■) dan kontrol (♦). Pengukuran panjang ikan dilakukan pada awal penelitian, hari ke-18, 30, dan 58 setelah perlakuan perendaman rElHP.
0,0 0,5 1,0 1,5 2,0 2,5 3,0 3,5 4,0 4,5 5,0
Sampling ke-1 Sampling ke-2 Sampling ke-3 Sampling ke-4
Pan
3 rerata dari 3 ka
9 3.2. Pembahasan
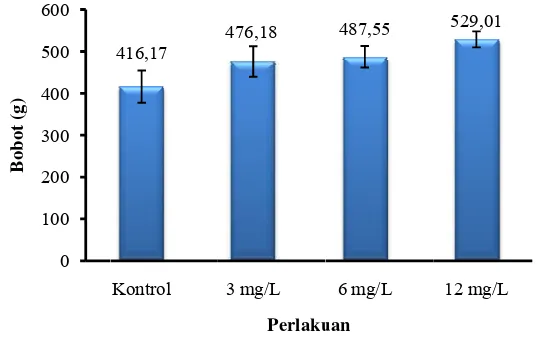
Aplikasi protein rElHP dosis 12 mg/L menunjukkan peningkatan pertumbuhan panjang dan biomassa lebih tinggi dibandingkan perlakuan lainnya
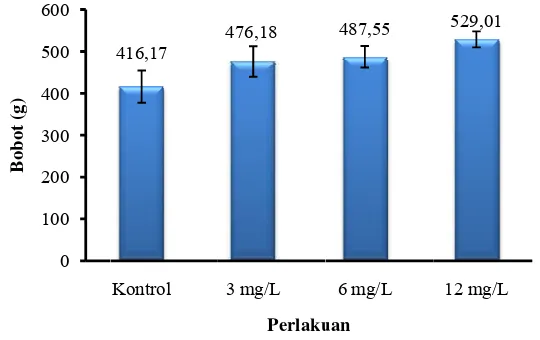
(Gambar 1 dan 2). Perlakuan rHP dosis 12 mg/L mampu meningkatkan biomassa
27,11% lebih tinggi dibandingkan dengan kontrol (P<0,05; Lampiran 1) serta
lebih tinggi 150% dibandingkan dengan yang dilakukan Pogram (2012, belum
dipublikasikan). Pogram (2012) melakukan perendaman hari ke-12 dengan dosis
12 mg/L memiliki kelangsungan hidup 30,5% setelah 35 hari pemeliharaan.
Perbedaan hasil tersebut diduga karena perbedaan umur larva saat perendaman,
penelitian ini menggunakan larva berumur 6 hari, ada kemungkinan rHP lebih
mudah terserap melalui pori-pori dan insang sehingga respons pertumbuhan dan
kelangsungan hidup yang diperoleh lebih baik. Hal yang sama juga telah
dilakukan Putra (2011) pada penelitian sebelumnya, yaitu benih ikan gurame yang
diberi perlakuan perendaman rHP ikan gurame dengan dosis 20 mg/L dan 30
mg/L berhasil meningkatkan pertumbuhan masing-masing 63,95% dan 75,04%
lebih tinggi dibandingkan dengan kontrol. Perbedaan persentase hasil antara
penelitian ini dengan penelitian sebelumnya diduga karena perbedaan rHP dan
ikan target yang digunakan. Penelitian Putra (2011) menggunakan jenis rHP yang
sama dengan ikan yang diujikan sehingga rHP ikan gurame yang diberikan dapat
diterima dengan baik oleh reseptor HP pada ikan gurame yang diujikan untuk
memicu pertumbuhan.
Pada penelitian ini diperoleh bahwa peningkatan benih ikan betok yang
diberi perlakuan rHP dosis 12 mg/L memiliki peningkatan pertumbuhan biomassa
terbaik, yaitu 1,27 kali lebih tinggi daripada kontrol. Hal tersebut hampir sama
dengan penelitian Moriyama dan Kawauchi (2004) yaitu perendaman benih
abalon dengan rsHP dosis 30 mg/L dengan frekuensi pemberian setiap 7 hari
sekali selama 84 hari pemeliharaan mampu meningkatkan bobot tubuh sebesar 1,2
kali dari kontrol. Namun pada penelitian ini perendaman hanya dilakukan satu
kali sehingga metode perendaman dalam penelitian ini lebih praktis.
Pertumbuhan ikan betok pada kontrol dan perlakuan rHP 12 mg/L
mengalami peningkatan panjang baku dari awal pemeliharaan hingga hari ke-12
10 perlakuan 12 mg/L mengalami peningkatan yang cukup tinggi yaitu 0,99 kali
menjadi 1,06 kali lipat lebih tinggi dibandingkan kontrol. Namun, pada hari ke-58
terjadi penurunan menjadi 1,02 kali lebih tinggi dibandingkan kontrol. Hal
tersebut sesuai pernyataan Acosta et al. (2009) bahwa pemberian tiGH dengan metode perendaman pada larva ikan mas koki dengan frekuensi sebanyak 3 kali
seminggu dapat meningkatkan bobot tubuh sebesar 3,5 kali lipat dari perlakuan
kontrol setelah pemeliharaan 15 hari dan menurun pada hari ke-30 yaitu hanya
sebesar 2,2 kali lipat dari perlakuan kontrol. Hal tersebut diduga terkait dengan
daya dukung wadah pemeliharaan, pada minggu ke-8 daya dukung wadah sudah
tercapai.
Perlakuan perendaman rHP dengan dosis 12 mg/L memiliki biomassa
(529,01 g) dan tingkat kelangsungan hidup (76,33%) benih ikan betok lebih tinggi
dibandingkan dengan perlakuan lain dan kontrol. Menurut Putra (2011) hal
tersebut diduga karena rHP yang diberikan memberikan pengaruh peningkatan
daya tahan tubuh khususnya terhadap stres berupa kejutan salinitas yang
diberikan. Pada penelitian Acosta et al., (2009) disampaikan bahwa pemberian rHP pada larva dapat meningkatkan kelangsungan hidup dan daya tahan terhadap
stres serta infeksi penyakit. Pemberian nHP dan rHP pada ikan rainbow trout juga efektif meningkatkan resistensi terhadap Vibrio anguillarum (Sakai et al., 1997). Pada penelitian ini kelangsungan hidup meningkat diduga juga karena
peningkatan daya tahan terhadap penyakit, meskipun pada penelitian ini tidak
dilakukan uji tantang atau pemeriksaan prevalensi penyakit. Sementara itu,
biomassa ikan terlihat meningkat 1,27 kali lipat pada minggu ke-8. Peningkatan
biomassa tersebut diduga karena pada minggu ke-7 dilakukan pemindahan ikan ke
media yang lebih besar, yaitu hapa ukuran 1x1 meter sehingga pertumbuhan ikan
lebih maksimum.
Peningkatan biomassa dan kelangsungan hidup ikan memiliki keterkaitan
dengan selera makan ikan, pada perlakuan 12 mg/L nafsu makan ikan lebih tinggi
dibanding perlakuan lain dan kontrol. Hal yang sama juga telah disampaikan oleh
11 Selain itu, apabila dilihat dari analisis keseragaman rerata bobot tubuh
akhir ikan pada Tabel 4, perlakuan 12 mg/L memiliki standar deviasi yang paling
rendah (0,014) dibandingkan perlakuan lain. Hal tersebut menandakan bahwa
ukuran ikan pada perlakuan 12 mg/L lebih seragam. Sementara itu, standar
deviasi pada kontrol terlihat paling tinggi (0,207), hal tersebut menunjukkan
bahwa tingkat keragaman ikan pada kontrol tinggi (beragam). Dengan demikian,
dapat dikatakan bahwa perlakuan perendaman rHP memiliki tingkat keseragaman
ukuran ikan yang lebih tinggi dibandingkan dengan kontrol. Ukuran ikan yang
lebih seragam dapat berimplikasi pada waktu pemanenan ikan, harga jual, dan
pendapatan pembudidaya.
Mekanisme penyerapan rHP ke dalam tubuh ikan belum diketahui secara
pasti. Namun demikian, menurut Sherwood & Harvey (1986) dalam Moriyama (1990) pemberian gonadotropin releasing hormone (GnRH) terlihat berpengaruh pada plasma ikan mas setelah pemberian melalui insang. Hal tersebut diperkuat
dengan pernyataan Smith (1982) dalam Moriyama (1990) bahwa ditemukan ditemukan radiolabeled-BSA pada insang dan epidermis ikan rainbow trout setelah perendaman dalam larutan dan diduga bahwa larutan tersebut masuk
melalui insang. Oleh karena itu diduga bahwa mekanisme masuknya rHP pada
ikan betok juga melalui insang.
Metode perendaman merupakan salah satu metode yang aplikatif
dilakukan secara massal dan mudah diterapkan oleh pembudidaya. Jumlah benih
yang direndam pada penelitian ini adalah 200 ekor/200 mL media, perendaman
dilakukan pada hari ke-6. Pemeliharaan benih ikan betok dilakukan pada media
pemeliharaan dengan volume 10 liter hingga benih berumur 23 hari, selanjutnya
benih ikan dipelihara pada akuarium dengan volume 20 liter, lalu dipindah ke
wadah yang lebih besar yaitu hapa dengan ukuran 1x1 meter agar pertumbuhan
ikan dapat lebih maksimal. Penggunaan media yang kurang sesuai dengan padat
12 IV. KESIMPULAN DAN SARAN
4.1. Kesimpulan
Pemberian rElHP dosis 12 mg/L melalui perendaman dapat meningkatkan pertumbuhan benih ikan betok.
4.2. Saran
Metode pendederan ikan betok di akuarium belum diketahui dengan baik.
Pada penelitian selanjutnya diharapkan jumlah larva yang ditebar harus
disesuaikan dengan daya dukung wadah, agar tercapai pertumbuhan yang optimal.
PERTUMBUHAN DAN KELANGSUNGAN HIDUP BENIH
IKAN BETOK YANG DIRENDAM DENGAN HORMON
PERTUMBUHAN REKOMBINAN IKAN KERAPU KERTANG
PADA DOSIS BERBEDA
HIKMA NADIATUL HUSNA
DEPARTEMEN BUDIDAYA PERAIRAN
FAKULTAS PERIKANAN DAN ILMU KELAUTAN
PERNYATAAN MENGENAI SKRIPSI DAN SUMBER
INFORMASI
Dengan ini saya menyatakan bahwa skripsi yang berjudul:
PERTUMBUHAN DAN KELANGSUNGAN HIDUP BENIH
IKAN BETOK YANG DIRENDAM DENGAN HORMON
PERTUMBUHAN REKOMBINAN IKAN KERAPU KERTANG
PADA DOSIS BERBEDA
adalah benar merupakan hasil karya yang belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Semua sumber data dan informasi yang berasal atau dikutip dari karya yang diterbitkan maupun yang tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Bogor, Mei 2012
ABSTRAK
HIKMA NADIATUL HUSNA. Pertumbuhan dan Kelangsungan Hidup Benih Ikan Betok yang Direndam dengan Hormon Pertumbuhan Rekombinan Ikan Kerapu Kertang pada Dosis Berbeda. Dibimbing oleh Dr.Alimuddin dan Dr.Odang Carman
Penelitian ini dilakukan untuk menentukan dosis perendaman hormon pertumbuhan rekombinan ikan kerapu kertang (rElHP) yang menghasilkan pertumbuhan dan kelangsungan hidup benih ikan betok tertinggi. Dosis rElHP yang diberikan, yaitu 3 mg/L, 6 mg/L, dan 12 mg/L serta tanpa pemberian rElHP sebagai kontrol. Benih ikan sebanyak 200 ekor yang berumur 6 hari setelah menetas (habis kuning telur) direndam ke dalam 200 mL larutan rElHP selama 2 jam. Ikan dipelihara dalam akuarium (30x20x20 cm) dengan padat tebar 20 ekor/L selama 8 minggu dan diberi pakan rotifer, naupli Artemia dan cacing sutera 4 kali dalam sehari secara ad libithum serta pakan buatan at satiation. Hasil penelitian menunjukkan bahwa panjang baku benih ikan betok yang diberi perlakuan perendaman rElHP dengan dosis 12 mg/L (4,62 cm) lebih tinggi (P<0,05) dibandingkan dengan perlakuan 6 mg/L (4,56 cm), 3 mg/L (4,46 cm), dan kontrol (4,49 cm). Biomassa ikan yang diberi perlakuan perendaman rHP dengan dosis 12 mg/L (529,01 g) juga lebih tinggi (P<0,05) daripada perlakuan 6 mg/L (487,55 g), 3 mg/L (476,18 g), dan kontrol (416,17 g). Laju pertumbuhan spesifik tidak berbeda antar perlakuan, dan kontrol (P>0,05). Tingkat kelangsungan hidup benih ikan betok perlakuan 12 mg/L lebih tinggi dibandingkan perlakuan lain, dan kontrol. Dengan demikian perendaman benih dalam larutan rElHP dengan dosis 12 mg/L dapat diaplikasikan untuk meningkatkan pertumbuhan, dan kelangsungan hidup ikan betok.
ABSTRACT
HIKMA NADIATUL HUSNA. Growth and Survival of Climbing Perch Anabas testudineus Juveniles Immersed in Recombinant Giant Grouper Growth Hormone at Different Dose. Supervised by Dr. Alimuddin and Dr. Odang Carman
This research was conducted to determine the dose of immersion recombinant giant grouper growth hormone (rElGH) that generates the highest growth and survival rate of climbing perch Anabas testudineus juveniles. The dose of rElGH used was 3 mg/L, 6 mg/L, and 12 mg/L and without administration of rElGH as a control. Two hundred juveniles of 6 days after hatching (were the yolk egg absorbed) were immersed into 200 mL of rElGH solution for 2 hours. Fish were reared in aquarium (30x20x20 cm) at stocking densities of 20 fish/L. Fish were maintained for 8 weeks and fed on rotifer, Artemia nauplii and silk worm 4 times a day ad libithum and commercial diet at satiation. The results showed that the body length of 12 mg/L rGH-treated fish (4.6233 cm) were higher (P<0.05) compared to that of 6 mg/L (4.5633 cm), 3 mg/L (4.4633 cm) and control (4.4967 cm). Biomass of fish treated with rGH in a dose of 12 mg/L (529.01 g) were higher (P<0.05) compared to that of 6 mg/L (487.55 g), 3 mg/L (476.18 g) and control (416.17 g). Specific growth rate of among rGH-treated fish, and control were similar (P>0.05). Survival rate of 12 mg/L rElGH-treated fish was also higher compared with other treatments and control. Thus, immersion of fish in 12 mg/L rElGH solution can be applied to enhance the growth and survival rate of climbing perch.
PERTUMBUHAN DAN KELANGSUNGAN HIDUP BENIH
IKAN BETOK YANG DIRENDAM DENGAN HORMON
PERTUMBUHAN REKOMBINAN IKAN KERAPU KERTANG
PADA DOSIS BERBEDA
HIKMA NADIATUL HUSNA
SKRIPSI
sebagai salah satu syarat untuk memperoleh gelar Sarjana Perikanan pada Program Studi Teknologi dan Manajemen Perikanan Budidaya
Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan,
Institut Pertanian Bogor
DEPARTEMEN BUDIDAYA PERAIRAN
FAKULTAS PERIKANAN DAN ILMU KELAUTAN
SKRIPSI
Judul : Pertumbuhan dan Kelangsungan Hidup Benih Ikan Betok yang Direndam dengan Hormon Pertumbuhan Rekombinan Ikan Kerapu Kertang pada Dosis Berbeda
Nama : Hikma Nadiatul Husna
Nrp : C14080005
Menyetujui,
Pembimbing I Pembimbing II
Dr. Alimuddin Dr. Odang Carman NIP. 19700103 199512 1 001 NIP. 19591222 198601 1 001
Mengetahui,
Ketua Departemen Budidaya Perairan
Dr. Odang Carman NIP. 19591222 198601 1 001
KATA PENGANTAR
Puji syukur penulis ucapkan kepada Allah SWT atas segala rahmat-Nya
sehingga penulis dapat menyelesaikan karya tulis ini. Penelitian ini telah
dilaksanakan dari bulan Januari sampai April 2012, bertempat di Laboratorium
Reproduksi dan Genetika Organisme Akuatik, Departemen Budidaya Perairan,
Fakultas Perikanan dan Ilmu kelautan, Institut Pertanian Bogor.
Beragam kata tak mudah diutarakan, hanyalah ungkapan kebahagiaan dan
terimakasih yang tulus kepada:
1. Dr. Alimuddin, selaku Pembimbing I dan Pembimbing Akademik
2. Dr. Odang Carman, selaku Pembimbing II
3. Dr. Nur Bambang Priyo Utomo, selaku Penguji Tamu dalam ujian akhir
4. Dr. Mia Setiawati, selaku Komisi Pendidikan Program S1
5. Drs. H. Afif Bintoro, MP dan Dra. Hj. Hastutiningsih, selaku orang tua
yang selalu memberikan dukungan moriil dan kasih sayang yang tidak
terkira serta Saudara-saudari tersayang Niskan WM, S.Hut, M.Sc, Aini,
Rodhia, dan Zur’an yang selalu memberikan dukungan dan semangat
6. Anna Octavera, S.Pi, M.Si, yang telah banyak membantu dalam penelitian
dan penyusunan serta penulisan skripsi ini
7. Bu Yulintine, S.Pi, M.Sc, Bu Eny, S.Pi, Mas Boyun S.Pi, Genetic’s Crew
dan Pak Aam yang telah memberikan motivasi, informasi, bimbingan serta
ilmu yang telah diberikan
8. Fajar Maulana S.Pi yang selalu memberikan dukungan dan bantuan dalam
menyelesaikan skripsi ini. Rima, Nurlatifa, Dita, Aminah, Sri, M. Firdaus,
Yadi, teman-teman Laboratorium Reproduksi dan Genetika Organisme
Akuatik, sahabat BDP 45 (2008), 44, 46 dan 47 serta berbagai pihak yang
selalu memberikan dukungan.
Semoga skripsi ini dapat bermanfaat bagi semua pihak dan berguna bagi
kesejahteraan masyarakat.
Bogor, Mei 2012
RIWAYAT HIDUP
Penulis dilahirkan di Bandar Lampung pada tanggal 13 Agustus 1990. Mengawali pendidikan di SD Negeri 2 Merapi Perumnas Way Halim pada tahun 1996 dan menyelesaikannya pada tahun 2002. Melanjutkan pendidikan di SMP Negeri 1 Bandar Lampung (2002-2005) dan SMA Negeri 1 Natar Lampung Selatan (2005-2008).
Tahun 2008 diterima di Institut Pertanian Bogor (IPB) sebagai mahasiswa Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan, melalui jalur Undangan Seleksi Masuk IPB (USMI). Selama mengikuti perkuliahan, aktif sebagai anggota Himpunan Mahasiswa Akuakultur (HIMAKUA) periode 2010-2011, dan asisten praktikum mata kuliah Dasar-dasar Genetika Ikan periode 2012.
Penulis aktif di Laboratorium Reproduksi dan Genetika Organisme Akuatik, Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan. Pada bulan Juni-Juli 2010, penulis pernah melaksanakan magang di dua tempat yaitu Balai Besar Pengembangan Budidaya Laut (BBPBL) Lampung dan Balai Budidaya Air Payau (BBAP) Situbondo. Penulis pernah menjadi anggota PKM dengan judul “Optimalisasi Metode Elektroporasi untuk Produksi Ikan Betok (Anabas testudineus Bloch.) Transgenik” kemudian menjadi ketua PKM dengan judul “Aplikasi Protein Rekombinan dalam Meningkatkan Laju Pertumbuhan Ikan Betok (Anabas testudineus Bloch.)” yang keduanya didanai oleh DIKTI. Penulis juga pernah melaksanakan praktik kerja lapangan dengan judul “Pembenihan Ikan Bawal Bintang Trachinotus blochii di Balai
DAFTAR ISI
Halaman
DAFTAR TABEL ... x
DAFTAR GAMBAR ... xi
DAFTAR LAMPIRAN ... xii
I. PENDAHULUAN ... 1 1.1. Latar Belakang ... 1 1.2. Tujuan ... 2
II. BAHAN DAN METODE ... 3 2.1. Penelitian Pendahuluan ... 3 2.2. Produksi Protein rHP ... 3 2.3. Rancangan Perlakuan ... 4 2.4. Pemberian Pakan dan Pemeliharaan Ikan Betok ... 5 2.5. Analisis Statistik ... 5
III. HASIL DAN PEMBAHASAN ... 6 3.1. Hasil ... 6 3.1.1. Pertumbuhan Panjang Benih Ikan Betok ... 6 3.1.2. Biomassa dan Rerata Bobot Tubuh Ikan ... 7 3.1.3. Kelangsungan Hidup Ikan ... 8 3.2. Pembahasan ... 9
IV. KESIMPULAN ... 12 4.1. Kesimpulan ... 12 4.2. Saran ... 12
DAFTAR PUSTAKA ... 13
x DAFTAR TABEL
Halaman
1. Tingkat kelangsungan hidup benih ikan betok setelah diberi kejut salinitas selama 2 menit dilanjutkan perendaman salinitas berbeda selama 2 jam ... 3
2. Jenis dan skedul pemberian pakan pada ikan betok selama pemeliharaan ... 5
3. Rerata panjang (cm) benih ikan betok pada perendaman rHP dengan dosis berbeda ... 6
4. Biomassa (g) dan rerata bobot tubuh akhir (g) benih ikan betok pada perendaman rHP dengan dosis berbeda ... 7
xi DAFTAR GAMBAR
Halaman
1. Perbandingan pertumbuhan panjang baku benih ikan betok perlakuan 12 mg/L dan kontrol ... 6
2. Biomassa benih ikan betok kontrol dan yang diberis perendaman rElHP dosis berbeda setelah pemeliharaan selama 8 minggu ... 7
3. Ikan betok kontrol dan yang diberi perendaman rElHP dosis berbeda setelah pemeliharaan selama 8 minggu ... 8
xii DAFTAR LAMPIRAN
Halaman
1. Analisis sidik ragam (ANOVA) dan Uji lanjut Tukey’s... 16
2. Skema penelitian pendahuluan ... 19
3. Proses produksi rHP ... 19
1 I. PENDAHULUAN
1.1. Latar Belakang
Ikan betok Anabas testudineus Bloch. atau dikenal dengan nama ikan papuyu di daerah Banjar, Kalimantan Selatan (Kottelat et al., 1993) merupakan salah satu ikan air tawar yang berpotensi untuk dikembangkan karena memiliki
nilai ekonomis cukup tinggi yaitu harganya dapat mencapai Rp100.000,00 per kg
(Borneonews, 2011). Budidaya ikan betok hingga saat ini masih belum banyak
dikembangkan. Salah satu hambatannya adalah pertumbuhan yang lambat dan
memerlukan waktu kurang lebih satu tahun untuk mencapai ukuran konsumsi
(70-100 gram) (Departemen Kelautan dan Perikanan, 2008).
Pertumbuhan ikan dapat ditingkatkan melalui perbaikan mutu ikan.
Perbaikan mutu ikan dapat dilakukan dengan metode seleksi, hibridisasi,
transgenesis, dan aplikasi protein rekombinan. Aplikasi metode seleksi
membutuhkan waktu relatif lama untuk mencapai efek signifikan khususnya pada
ikan yang membutuhkan waktu lama untuk mencapai matang kelamin pertama
kali (Bolivar et al., 2002). Penerapan teknologi hibridisasi juga memerlukan waktu relatif lama. Selain itu, aplikasi teknologi transgenesis dapat menghasilkan
ikan dengan tingkat perbaikan kualitas tinggi dalam waktu relatif cepat, tetapi
teknologi ini masih menimbulkan kontroversi terhadap keamanan pangan.
Sementara itu, hingga saat ini penggunaan hormon pertumbuhan rekombinan
(rHP) pada ikan dikatakan aman untuk dikonsumsi, karena rHP tidak
ditransmisikan ke keturunan selanjutnya sehingga tidak termasuk organisme
transgenik (Acosta et al., 2007).
Protein rHP cukup efektif digunakan untuk meningkatkan laju
pertumbuhan ikan. rHP merupakan polipeptida rantai tunggal dengan ukuran
sekitar 22 kDa yang dihasilkan menggunakan bioreactor/fermentor, seperti bakteri (Rousseau & Dufour, 2007 dalam Acosta et al., 2009). Penggunaan teknologi protein rHP untuk mempercepat pertumbuhan ikan sudah banyak
dilakukan pada beberapa spesies ikan dengan metode yang berbeda. Pemberian
rHP ikan mas melalui metode injeksi dengan dosis sebesar 0,1 µg/g bobot tubuh
2 dibandingkan dengan kontrol (Li et al. 2003). Pemberian jenis rHP yang berbeda pada ikan nila melalui teknik penyuntikan atau injeksi berhasil meningkatkan
bobot ikan yaitu sebesar 20,94% dengan rHP ikan kerapu kertang; 18,09% dengan
rHP ikan mas; 16,99% dengan rHP ikan gurame (Alimuddin et al., 2010). Pemberian rHP ikan mas melalui pakan Artemia pada benih ikan gurame dapat meningkatkan pertumbuhan sebesar 13% (Rahmawaty, 2011). Hasil lain diperoleh
dari pemberian protein rHP ikan gurame pada benih ikan gurame melalui metode
perendaman dengan dosis 30 mg/L sebanyak 3 kali perendaman efektif
meningkatkan pertumbuhan sebesar 75,04% dibandingkan dengan kontrol (Putra,
2011).
Pemberian rHP dapat dilakukan dengan beberapa metode, di antaranya:
perendaman/imersi (Moriyama, 1990; Acosta et al., 2007; Putra, 2011), penyuntikan/injection (Li et al., 2003; Lesmana, 2010), dan melalui pakan (Moriyama et al., 1993; Xu et al., 2001; Rahmawaty, 2011). Berdasarkan ketiga metode yang telah dilakukan, metode penyuntikan dikatakan kurang aplikatif dan
memperlihatkan respons yang lambat, sedangkan metode perendaman pada stadia
larva atau juvenil merupakan cara yang aplikatif untuk skala massal. Pada metode
perendaman diperlukan kejut salinitas. Menurut Ratnawati (2012) kejut salinitas
berfungsi untuk membuka jalur masuknya rHP melalui insang dengan
memanfaatkan mekanisme pertukaran cairan tubuh.
Protein rekombinan yang digunakan dalam kegiatan ini rElHP (hormon pertumbuhan ikan kerapu kertang Epinephelus lanceolatus) (Lesmana, 2010). Hormon ini digunakan karena tingkat produksi rHP ikan kerapu kertang pada
Escherichia coli lebih tinggi dibandingkan dengan rHP ikan gurame dan ikan mas (Irmawati et al., 2011 belum dipublikasikan). Selain itu, rElHP telah terbukti memiliki bioaktivitas dalam menginduksi pertumbuhan ikan nila (Alimuddin et al., 2010) dan ikan sidat (Aminah, 2012).
1.2. Tujuan
Penelitian ini dilakukan untuk menentukan dosis protein rHP ikan kerapu
3 II. BAHAN DAN METODE
2.1. Penelitian Pendahuluan
Penelitian pendahuluan dilakukan untuk menentukan salinitas kejut (shock salinity) untuk larva ikan betok. Larva ikan betok berumur 6 hari diberi kejut salinitas 3,0%; 2,5% dan 2,0% NaCl selama 2 menit. Selanjutnya benih ikan betok
direndam dalam larutan NaCl 0,3%; 0,5%; dan 0,7% selama 2 jam dengan satu
kali ulangan. Pada setiap perlakuan digunakan benih umur 6 hari sebanyak 100
ekor. Setelah itu ikan diperlihara selama 14 hari. Perlakuan yang memberikan
kelangsungan hidup tertinggi digunakan dalam penelitian utama.
Tabel 1. Tingkat kelangsungan hidup (survival rate/SR) benih ikan betok setelah diberi kejut salinitas selama 2 menit, dilanjutkan perendaman salinitas berbeda selama 2 jam
Kejut salinitas berbeda (%) selama 2 menit
Salinitas (%) perendaman larva selama 2 jam
0,3 0,5 0,7
3,0 46 80 48
2,5 65 58 53
2,0 54 58 54
Berdasarkan Tabel 1, dapat diketahui bahwa tingkat kelangsungan hidup
tertinggi (80%) diperoleh pada perlakuan dengan kejut salinitas NaCl 3,0% dan
perendaman pada larutan NaCl 0,5%. Salinitas tersebut selanjutnya digunakan
pada penelitian utama.
2.2. Produksi Protein rHP
Produksi protein rHP yang dilakukan pada penelitian ini menggunakan
bakteri E. coli BL21 yang mengandung pCold-I/ElHP yang dibuat oleh Lesmana (2010). Bakteri dikultur awal dalam 3 mL media LB cair yang mengandung
ampisilin dan NaOH 5M, lalu diinkubasi suhu 37 oC dengan menggunakan shaker kecepatan 200 rpm selama 18 jam. Setelah itu, dilakukan subkultur dengan
mengambil sebanyak 1% dari kultur awal dan dimasukkan ke dalam 100 ml media
LB cair mengandung ampisilin dan NaOH yang baru, lalu diinkubasi lagi pada
4 diberikan kejutan dengan suhu 15 oC selama 30 menit, ditambahkan IPTG
sebanyak 750 µL dan diinkubasi menggunakan shaker pada suhu 15 oC selama 24 jam. Bakteri hasil kultur disentrifugasi kecepatan 12.000 rpm selama 1 menit
dengan tujuan mengendapkan sel bakteri. Pelet bakteri yang diperoleh dicuci
dengan phosphate buffer saline (PBS) sebanyak 1 kali, selanjutnya disimpan dalam deep-freezer (-80 oC) hingga akan digunakan.
Inaktivasi bakteri dilakukan dengan cara pelet bakteri yang diperoleh dan
mengandung rekombinan ElHP dimasukkan ke dalam freezer -20 oC selama semalam, kemudian dimasukkan kembali ke deep-freezer (-80 oC). Lisis dinding sel bakteri dilakukan secara kimiawi menggunakan lisozim. Pelet bakteri hasil
sentrifugasi dicuci menggunakan bufer Tris-EDTA (TE) sebanyak 1 mL per 200 mg bakteri, lalu diinkubasi pada suhu 37 oC selama 20 menit. Selanjutnya, tabung
disentrifugasi pada kecepatan 12.000 rpm selama 1 menit, kemudian supernatan
dalam tabung mikro dibuang. Pelet bakteri (natan) yang diperoleh ditambahkan
500 µL larutan lisozim (10 mg dalam 1 mL bufer TE), lalu diinkubasi suhu 37 oC
selama 20 menit, selanjutnya disentrifugasi dengan kecepatan 12.000 rpm selama
1 menit. Supernatan dalam tabung mikro dibuang dan pelet yang terbentuk
merupakan protein rHP dalam bentuk badan inklusi (inclusion body). Pelet protein rHP dicuci PBS sebanyak satu kali dan disimpan dalam deep-freezer (-80 oC) hingga akan digunakan.
2.3. Rancangan Perlakuan
Penelitian ini menggunakan rancangan acak lengkap yang terdiri dari
empat perlakuan dengan tiga ulangan. Benih ikan betok yang digunakan berumur
6 hari. Ikan dipuasakan terlebih dahulu sehari sebelum diberi perlakuan. Pada
setiap perlakuan, sebanyak 200 ekor ikan betok direndam (salinity shock) dalam 200 mL media NaCl 3,0% selama 2 menit, lalu dimasukkan dalam larutan yang
mengandung rHP dengan dosis berbeda. Dosis rHP yang diuji yaitu 3 mg/L, 6
mg/L dan 12 mg/L dalam larutan NaCl 0,5% dan BSA (bovine serum albumine) 0,01%. Untuk perlakuan kontrol, ikan diberikan kejut salinitas NaCl 3,0% selama
2 menit, lalu dimasukkan dalam larutan NaCl 0,5% dan BSA 0,01% (tidak
5 2.4. Pemberian Pakan dan Pemeliharaan Ikan Betok
Ikan betok diberi pakan dengan skedul seperti disajikan pada Tabel 2. Ikan
dipelihara dalam akuarium ukuran 30x20x20 cm dengan volume air 10 liter
hingga berumur 30 hari, lalu pada akuarium dengan volume air 20 liter hingga
berumur 40 hari dan selanjutnya dipindah ke media hapa berukuran 1x1 meter.
Sampling panjang dilakukan pada awal pemeliharaan, hari ke-18, 30, dan 58.
Pada awal pemeliharaan, panjang ikan diukur menggunakan mikroskop dibantu
mikrometer dengan galat 0,05, sedangkan pada sampling kedua hingga akhir
digunakan milimeter blok untuk mengukur panjang. Sampling bobot dilakukan
pada awal pemeliharaan dan akhir pemeliharaan dengan jumlah ikan yang diambil
30 ekor per perlakuan menggunakan timbangan digital. Pergantian air sebanyak
60% dilakukan pada waktu sampling kedua, dan ketiga.
Tabel 2. Jenis dan skedul pemberian pakan pada ikan betok selama pemeliharaan
Pakan Hari ke- Frekuensi
Rotifer 6 s/d 9 4 x sehari (ad-libithum) Rotifer + Artemia 10 s/d 11 4 x sehari (ad-libithum) Naupli Artemia 12 s/d 13 4 x sehari (ad-libithum) Artemia + cacing cacah 14 s/d 17 4 x sehari (ad-libithum) Cacing sutera dicacah 18 s/d 19 4 x sehari (ad-libithum) Cacing sutera 20 s/d 30 3 x sehari (ad-libithum)
Cacing + Pakan Buatan 31 s/d 40 Cacing : malam hari Pakan Buatan : at-satiation Pakan Buatan 41 s/d 57 1 jam sekali (at-satiation)
2.5. Analisis Statistik
Parameter yang diamati pada penelitian ini meliputi pertumbuhan panjang
(panjang baku; panjang total), biomassa, rerata bobot tubuh, growth rate (GR), spesific growth rate (SGR) dan tingkat kelangsungan hidup. Parameter yang diamati tersebut dianalisis menggunakan metode sidik ragam (ANOVA) dan uji
6 III. HASIL DAN PEMBAHASAN
3.1. Hasil
3.1.1. Pertumbuhan Panjang Benih Ikan Betok
Pertumbuhan panjang benih ikan betok pada akhir penelitian setelah
perendaman 2 jam dengan protein rHP pada dosis berbeda disajikan pada Tabel 3
dan Gambar 1. Rerata panjang baku benih ikan betok yang diberi perlakuan
perendaman rHP dosis 12 mg/L (4,62 cm) adalah lebih tinggi (P<0,05)
dibandingkan perlakuan 6 mg/L (4,56 cm), 3 mg/L (4,46 cm) dan kontrol (4,49
cm). Pertambahan panjang total juga berbeda antar perlakuan (P<0,05; Tabel 3).
Rerata panjang total benih ikan betok yang diberi perlakuan perendaman rHP
dosis 12 mg/L (5,59 cm) dan dosis 6 mg/L (5,51 cm) juga lebih tinggi (P<0,05)
dibandingkan perlakuan 3 mg/L (5,430 cm), dan kontrol (5,477cm). Rerata tinggi
badan antar perlakuan tidak berbeda nyata (P>0,05; Tabel 3).
Tabel 3. Rerata panjang (cm) benih ikan betok pada perendaman rHP dengan dosis berbeda
Dosis ElHP
(mg/L) Panjang Baku Panjang Total Tinggi badan Kontrol (0) 4,49 ± 0,04a 5,47± 0,04ab 1,75 ± 0,01a
3 4,46 ± 0,03a 5,43± 0,04a 1,74 ± 0,03a 6 4,56 ± 0,06ab 5,51 ± 0,09ab 1,77 ± 0,02a 12 4,62 ± 0,03b 5,590± 0,01b 1,79 ± 0,02a
Keterangan: Huruf superskrip berbeda pada kolom yang sama adalah berbeda nyata (P<0,05). Data tersebut berdasarkan rerata dari 3 kali ulangan
Gambar 1. Pertumbuhan panjang baku benih ikan betok perlakuan12 mg/L(■) dan kontrol (♦). Pengukuran panjang ikan dilakukan pada awal penelitian, hari ke-18, 30, dan 58 setelah perlakuan perendaman rElHP.
0,0 0,5 1,0 1,5 2,0 2,5 3,0 3,5 4,0 4,5 5,0
Sampling ke-1 Sampling ke-2 Sampling ke-3 Sampling ke-4
Pan
3 rerata dari 3 ka
9 3.2. Pembahasan
Aplikasi protein rElHP dosis 12 mg/L menunjukkan peningkatan pertumbuhan panjang dan biomassa lebih tinggi dibandingkan perlakuan lainnya
(Gambar 1 dan 2). Perlakuan rHP dosis 12 mg/L mampu meningkatkan biomassa
27,11% lebih tinggi dibandingkan dengan kontrol (P<0,05; Lampiran 1) serta
lebih tinggi 150% dibandingkan dengan yang dilakukan Pogram (2012, belum
dipublikasikan). Pogram (2012) melakukan perendaman hari ke-12 dengan dosis
12 mg/L memiliki kelangsungan hidup 30,5% setelah 35 hari pemeliharaan.
Perbedaan hasil tersebut diduga karena perbedaan umur larva saat perendaman,
penelitian ini menggunakan larva berumur 6 hari, ada kemungkinan rHP lebih
mudah terserap melalui pori-pori dan insang sehingga respons pertumbuhan dan
kelangsungan hidup yang diperoleh lebih baik. Hal yang sama juga telah
dilakukan Putra (2011) pada penelitian sebelumnya, yaitu benih ikan gurame yang
diberi perlakuan perendaman rHP ikan gurame dengan dosis 20 mg/L dan 30
mg/L berhasil meningkatkan pertumbuhan masing-masing 63,95% dan 75,04%
lebih tinggi dibandingkan dengan kontrol. Perbedaan persentase hasil antara
penelitian ini dengan penelitian sebelumnya diduga karena perbedaan rHP dan
ikan target yang digunakan. Penelitian Putra (2011) menggunakan jenis rHP yang
sama dengan ikan yang diujikan sehingga rHP ikan gurame yang diberikan dapat
diterima dengan baik oleh reseptor HP pada ikan gurame yang diujikan untuk
memicu pertumbuhan.
Pada penelitian ini diperoleh bahwa peningkatan benih ikan betok yang
diberi perlakuan rHP dosis 12 mg/L memiliki peningkatan pertumbuhan biomassa
terbaik, yaitu 1,27 kali lebih tinggi daripada kontrol. Hal tersebut hampir sama
dengan penelitian Moriyama dan Kawauchi (2004) yaitu perendaman benih
abalon dengan rsHP dosis 30 mg/L dengan frekuensi pemberian setiap 7 hari
sekali selama 84 hari pemeliharaan mampu meningkatkan bobot tubuh sebesar 1,2
kali dari kontrol. Namun pada penelitian ini perendaman hanya dilakukan satu
kali sehingga metode perendaman dalam penelitian ini lebih praktis.
Pertumbuhan ikan betok pada kontrol dan perlakuan rHP 12 mg/L
mengalami peningkatan panjang baku dari awal pemeliharaan hingga hari ke-12
10 perlakuan 12 mg/L mengalami peningkatan yang cukup tinggi yaitu 0,99 kali
menjadi 1,06 kali lipat lebih tinggi dibandingkan kontrol. Namun, pada hari ke-58
terjadi penurunan menjadi 1,02 kali lebih tinggi dibandingkan kontrol. Hal
tersebut sesuai pernyataan Acosta et al. (2009) bahwa pemberian tiGH dengan metode perendaman pada larva ikan mas koki dengan frekuensi sebanyak 3 kali
seminggu dapat meningkatkan bobot tubuh sebesar 3,5 kali lipat dari perlakuan
kontrol setelah pemeliharaan 15 hari dan menurun pada hari ke-30 yaitu hanya
sebesar 2,2 kali lipat dari perlakuan kontrol. Hal tersebut diduga terkait dengan
daya dukung wadah pemeliharaan, pada minggu ke-8 daya dukung wadah sudah
tercapai.
Perlakuan perendaman rHP dengan dosis 12 mg/L memiliki biomassa
(529,01 g) dan tingkat kelangsungan hidup (76,33%) benih ikan betok lebih tinggi
dibandingkan dengan perlakuan lain dan kontrol. Menurut Putra (2011) hal
tersebut diduga karena rHP yang diberikan memberikan pengaruh peningkatan
daya tahan tubuh khususnya terhadap stres berupa kejutan salinitas yang
diberikan. Pada penelitian Acosta et al., (2009) disampaikan bahwa pemberian rHP pada larva dapat meningkatkan kelangsungan hidup dan daya tahan terhadap
stres serta infeksi penyakit. Pemberian nHP dan rHP pada ikan rainbow trout juga efektif meningkatkan resistensi terhadap Vibrio anguillarum (Sakai et al., 1997). Pada penelitian ini kelangsungan hidup meningkat diduga juga karena
peningkatan daya tahan terhadap penyakit, meskipun pada penelitian ini tidak
dilakukan uji tantang atau pemeriksaan prevalensi penyakit. Sementara itu,
biomassa ikan terlihat meningkat 1,27 kali lipat pada minggu ke-8. Peningkatan
biomassa tersebut diduga karena pada minggu ke-7 dilakukan pemindahan ikan ke
media yang lebih besar, yaitu hapa ukuran 1x1 meter sehingga pertumbuhan ikan
lebih maksimum.
Peningkatan biomassa dan kelangsungan hidup ikan memiliki keterkaitan
dengan selera makan ikan, pada perlakuan 12 mg/L nafsu makan ikan lebih tinggi
dibanding perlakuan lain dan kontrol. Hal yang sama juga telah disampaikan oleh
11 Selain itu, apabila dilihat dari analisis keseragaman rerata bobot tubuh
akhir ikan pada Tabel 4, perlakuan 12 mg/L memiliki standar deviasi yang paling
rendah (0,014) dibandingkan perlakuan lain. Hal tersebut menandakan bahwa
ukuran ikan pada perlakuan 12 mg/L lebih seragam. Sementara itu, standar
deviasi pada kontrol terlihat paling tinggi (0,207), hal tersebut menunjukkan
bahwa tingkat keragaman ikan pada kontrol tinggi (beragam). Dengan demikian,
dapat dikatakan bahwa perlakuan perendaman rHP memiliki tingkat keseragaman
ukuran ikan yang lebih tinggi dibandingkan dengan kontrol. Ukuran ikan yang
lebih seragam dapat berimplikasi pada waktu pemanenan ikan, harga jual, dan
pendapatan pembudidaya.
Mekanisme penyerapan rHP ke dalam tubuh ikan belum diketahui secara
pasti. Namun demikian, menurut Sherwood & Harvey (1986) dalam Moriyama (1990) pemberian gonadotropin releasing hormone (GnRH) terlihat berpengaruh pada plasma ikan mas setelah pemberian melalui insang. Hal tersebut diperkuat
dengan pernyataan Smith (1982) dalam Moriyama (1990) bahwa ditemukan ditemukan radiolabeled-BSA pada insang dan epidermis ikan rainbow trout setelah perendaman dalam larutan dan diduga bahwa larutan tersebut masuk
melalui insang. Oleh karena itu diduga bahwa mekanisme masuknya rHP pada
ikan betok juga melalui insang.
Metode perendaman merupakan salah satu metode yang aplikatif
dilakukan secara massal dan mudah diterapkan oleh pembudidaya. Jumlah benih
yang direndam pada penelitian ini adalah 200 ekor/200 mL media, perendaman
dilakukan pada hari ke-6. Pemeliharaan benih ikan betok dilakukan pada media
pemeliharaan dengan volume 10 liter hingga benih berumur 23 hari, selanjutnya
benih ikan dipelihara pada akuarium dengan volume 20 liter, lalu dipindah ke
wadah yang lebih besar yaitu hapa dengan ukuran 1x1 meter agar pertumbuhan
ikan dapat lebih maksimal. Penggunaan media yang kurang sesuai dengan padat
12 IV. KESIMPULAN DAN SARAN
4.1. Kesimpulan
Pemberian rElHP dosis 12 mg/L melalui perendaman dapat meningkatkan pertumbuhan benih ikan betok.
4.2. Saran
Metode pendederan ikan betok di akuarium belum diketahui dengan baik.
Pada penelitian selanjutnya diharapkan jumlah larva yang ditebar harus
disesuaikan dengan daya dukung wadah, agar tercapai pertumbuhan yang optimal.
13 DAFTAR PUSTAKA
Acosta J, Morales R, Morales A, Alonso M, Estrada MP. 2007. Pichia pastoris expressing recombinant tilapia growth hormone accelerates the growth of tilapia. Biotechnol Lett 29:1671–1676
, Estrada MP, Carpio Y, Ruiz O, Morales R, Martinez E, Valdes J, Borroto C, Besada V, Sanchez A, Herrera F. 2009. Tilapia somatotropin polypeptides : potent enhanchers of fish growth and innate immunity. Biotecnologia Aplicada 26: 267-272.
Alimuddin, LesmanaI, SudrajatAO, Carman O, Faizal I. 2010. Production and bioactivity potential of three recombinant growth hormones of farmed fish. Indonesian Aquaculture Journal 5(1): 11-17.
Aminah. 2012. Aplikasi Hormon Pertumbuhan Rekombinan Ikan Kerapu Kertang pada Glass eel dengan Dosis Perendaman Berbeda.
Bolivar RB, Gary F, Newkirk. 2002. Response to within family selection for body weight in Nile tilapia Oreochromis niloticus using a single-trait animal model. Aquaculture 204: 371-381
Borneonews. 2011. Harga Ikan Papuyu 2011. http://www.borneonews.co.id/news/palangkaraya/11palangkaraya/1389/har
ga-papuyu-rp100-ribu-per-kg.html. [10 Maret 2012]
Departemen Kelautan dan Perikanan. 2008. Biologi Ikan Papuyu Mandiangin: Balai Budidaya Air Tawar Mandiangin, Direktorat Jenderal Perikanan Budidaya Departemen Kelautan dan Perikanan (DKP).
Handoyo. 2012. Aplikasi Pemberian Rekombinan Hormon Pertumbuhan dengan Metode Berbeda pada Ikan Sidat (Anguilla sp.) dan Responnya [Tesis]. Sekolah Pasca Sarjana. Institut Pertanian Bogor.
Irmawati, Alimuddin, Zairin M, Suprayudi MA, Wahyudi AT. 2012. Respons Benih Ikan Gurame (Osphronemus goramy Lac.) yang Direndam dengan Hormon Pertumbuhan Ikan Mas. Jurnal Iktiologi Indonesia (IN PRESS).
Kottelat M, Whitten AJ, Kartikasari SN, Wirjoatmodjo S.1993. Freshwater Fishes of Western Indonesia and Sulawesi. Jakarta: Periplus Editions-Proyek EMDI.
Lesmana I. 2010. Produksi dan Bioaktivitas Protein Rekombinan Hormon Pertumbuhan Dari Tiga Jenis Ikan Budidaya. [Tesis]. Sekolah Pasca Sarjana. Institut Pertanian Bogor.
14 stimulation of juvenile tilapia (Oreochromis niloticus). Aquaculture 216: 329-341.
Moriyama S, Kawauchi H. 1990. Growth stimulation of juvenile salmonids by immersion in recombinant salmon growth hormone. Nippon Suisan Gakkaishi 56: 31-34.
, Hiroshi Y, Seiji S, Toshio A, Tetsuya H, and Hiroshi K. 1993. Oral administration of recombinant salmon growth hormone to rainbow trout, Oncorhynchus mykiss. Aquaculture 112: 99-106.
, Kawauchi H. 2004. Somatic growth acceleration of juvenile abalone, Haliotis discus hannai, by immersion in and intramuscular injection of recombinant salmon growth hormone. Aquaculture 229: 469-478.
Pogram RKS. 2012. Pertumbuhan dan Kelangsungan Hidup Benih Ikan Betok Umur 12 Hari yang Direndam dengan Hormon Pertumbuhan Rekombinan Ikan Kerapu Kertang pada Dosis Berbeda.
Promdonkoy B, Warit S, Panyim S. 2004. Production of a biologically active growth hormone from giant catfish (Pangasianodon gigas) in Escherichia coli. Biotechnology Lett 26: 649-653.
Putra HGP. 2011. Pertumbuhan dan Kelangsungan Hidup Benih Ikan Gurame yang Diberi Protein Rekombinan GH Melalui Perendaman dengan Dosis Berbeda [Skripsi]. Departemen Budidaya Perairan. Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor.
Rahmawaty. 2011. Pertumbuhan dan Kelangsungan Hidup Benih Ikan Gurame yang Diberi Pakan Alami yang Disuplementasi Hormon Pertumbuhan Rekombinan. [Skripsi]. Departemen Budidaya Perairan. Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor.
Ratnawati. 2012. Pertumbuhan dan Kelangsungan Hidup Benih Ikan Gurame yang Diberi Hormon Pertumbuhan Rekombinan dengan Lama Perendaman yang Berbeda. [Skripsi]. Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor.
Sakai M , Kajita Y, Kobayashi M, Kawauchi H. 1997. Immunostimulating effect of growth hormone: in-vivo administration of growth hormone in rainbow trout enhances resistance to Vibrio anguillarum infection. Veterinary Immunology and Immunopathology 57: 147-152.
LA
AM
MP
PI
IR
RA
15
16 Lampiran 1. Analisis Sidik Ragam (ANOVA) dan Uji Lanjut Tukey’s
Descriptives
Parameter Perlakuan N Mean Std.
Deviation
95% Confidence Interval for Mean
Lower
Total 12 4,5367 ,07390 4,4897 4,5836
P.Total Kontrol (0) 3 5,4767 ,04665 5,3608 5,5926
3 mg/L 3 5,4300 ,04670 5,3140 5,5460
6 mg/L 3 5,5100 ,09165 5,2823 5,7377
12 mg/L 3 5,5900 ,01000 5,5652 5,6148
Total 12 5,5017 ,07782 5,4522 5,5511
Tinggi Kontrol (0) 3 1,7567 ,01000 1,7319 1,7815
3 mg/L 3 1,7467 ,02665 1,6805 1,8129
6 mg/L 3 1,7733 ,02335 1,7153 1,8313
12 mg/L 3 1,7967 ,02335 1,7387 1,8547
Total 12 1,7683 ,02713 1,7511 1,7856
Biomassa Kontrol (0) 3 416,1733 38,57378 320,3508 511,9959 3 mg/L 3 476,1800 36,47076 385,5816 566,7784 6 mg/L 3 487,5533 25,62691 423,8926 551,2141 12 mg/L 3 529,0100 19,14772 481,4444 576,5756
Total 12 477,2292 49,75680 445,6152 508,8431
ABW Kontrol (0) 3 3,4022 ,20708 2,8877 3,9166
3 mg/L 3 3,3931 ,05659 3,2525 3,5337
6 mg/L 3 3,4124 ,06601 3,2484 3,5764
12 mg/L 3 3,4655 ,01395 3,4308 3,5001
Total 12 3,4183 ,10033 3,3545 3,4820
17
Perlakuan N Subset for alpha = 0,05 1 2
Means for groups in homogeneous subsets are displayed.
a. Uses Harmonic Mean Sample Size = 3.000.
P.Total
Tukey HSDa
Perlakuan N Subset for alpha = 0,05
1 2
Means for groups in homogeneous subsets are displayed.
18 Tinggi
Tukey HSDa
Perlakuan N Subset for alpha = 0,05 1 Means for groups in homogeneous subsets
are displayed.
a. Uses Harmonic Mean Sample Size = 3.000.
ABW
Tukey HSDa
Perlakuan N Subset for alpha = 0,05 1 Means for groups in homogeneous subsets
are displayed.
a. Uses Harmonic Mean Sample Size = 3.000.
SGR
Tukey HSDa
Perlakuan N Subset for alpha = 0,05 1 Means for groups in homogeneous subsets
are displayed. a. Uses Harmonic Mean Sample Size = 3.000.
Biomassa
Tukey HSDa
Perlakuan N Subset for alpha = 0,05 1 2
Means for groups in homogeneous subsets are displayed.
a. Uses Harmonic Mean Sample Size = 3.000.
GR
Tukey HSDa
Perlakuan N Subset for alpha = 0.05 1 Means for groups in homogeneous subsets
are displayed.
a. Uses Harmonic Mean Sample Size = 3.000.
SR
Tukey HSDa
Perlakuan N Subset for alpha = 0,05 1 Means for groups in homogeneous subsets
19 Lampiran 2. Skema Penelitian Pendahuluan
Penelitian Pendahuluan
SR terbaik sebesar 80%
setelah 14 hari
pemeliharaan
Akuarium ukuran:
30 x 20 x 20 cm Diisi :
10 liter air tawar
Lampiran 3. Proses Produksi rHP
Plate E. coli BL21
20 Lampiran 4. Dokumentasi Produksi rHP
PERTUMBUHAN DAN KELANGSUNGAN HIDUP BENIH
IKAN BETOK YANG DIRENDAM DENGAN HORMON
PERTUMBUHAN REKOMBINAN IKAN KERAPU KERTANG
PADA DOSIS BERBEDA
HIKMA NADIATUL HUSNA
DEPARTEMEN BUDIDAYA PERAIRAN
FAKULTAS PERIKANAN DAN ILMU KELAUTAN
13 DAFTAR PUSTAKA
Acosta J, Morales R, Morales A, Alonso M, Estrada MP. 2007. Pichia pastoris expressing recombinant tilapia growth hormone accelerates the growth of tilapia. Biotechnol Lett 29:1671–1676
, Estrada MP, Carpio Y, Ruiz O, Morales R, Martinez E, Valdes J, Borroto C, Besada V, Sanchez A, Herrera F. 2009. Tilapia somatotropin polypeptides : potent enhanchers of fish growth and innate immunity. Biotecnologia Aplicada 26: 267-272.
Alimuddin, LesmanaI, SudrajatAO, Carman O, Faizal I. 2010. Production and bioactivity potential of three recombinant growth hormones of farmed fish. Indonesian Aquaculture Journal 5(1): 11-17.
Aminah. 2012. Aplikasi Hormon Pertumbuhan Rekombinan Ikan Kerapu Kertang pada Glass eel dengan Dosis Perendaman Berbeda.
Bolivar RB, Gary F, Newkirk. 2002. Response to within family selection for body weight in Nile tilapia Oreochromis niloticus using a single-trait animal model. Aquaculture 204: 371-381
Borneonews. 2011. Harga Ikan Papuyu 2011. http://www.borneonews.co.id/news/palangkaraya/11palangkaraya/1389/har
ga-papuyu-rp100-ribu-per-kg.html. [10 Maret 2012]
Departemen Kelautan dan Perikanan. 2008. Biologi Ikan Papuyu Mandiangin: Balai Budidaya Air Tawar Mandiangin, Direktorat Jenderal Perikanan Budidaya Departemen Kelautan dan Perikanan (DKP).
Handoyo. 2012. Aplikasi Pemberian Rekombinan Hormon Pertumbuhan dengan Metode Berbeda pada Ikan Sidat (Anguilla sp.) dan Responnya [Tesis]. Sekolah Pasca Sarjana. Institut Pertanian Bogor.
Irmawati, Alimuddin, Zairin M, Suprayudi MA, Wahyudi AT. 2012. Respons Benih Ikan Gurame (Osphronemus goramy Lac.) yang Direndam dengan Hormon Pertumbuhan Ikan Mas. Jurnal Iktiologi Indonesia (IN PRESS).
Kottelat M, Whitten AJ, Kartikasari SN, Wirjoatmodjo S.1993. Freshwater Fishes of Western Indonesia and Sulawesi. Jakarta: Periplus Editions-Proyek EMDI.
Lesmana I. 2010. Produksi dan Bioaktivitas Protein Rekombinan Hormon Pertumbuhan Dari Tiga Jenis Ikan Budidaya. [Tesis]. Sekolah Pasca Sarjana. Institut Pertanian Bogor.
14 stimulation of juvenile tilapia (Oreochromis niloticus). Aquaculture 216: 329-341.
Moriyama S, Kawauchi H. 1990. Growth stimulation of juvenile salmonids by immersion in recombinant salmon growth hormone. Nippon Suisan Gakkaishi 56: 31-34.
, Hiroshi Y, Seiji S, Toshio A, Tetsuya H, and Hiroshi K. 1993. Oral administration of recombinant salmon growth hormone to rainbow trout, Oncorhynchus mykiss. Aquaculture 112: 99-106.
, Kawauchi H. 2004. Somatic growth acceleration of juvenile abalone, Haliotis discus hannai, by immersion in and intramuscular injection of recombinant salmon growth hormone. Aquaculture 229: 469-478.
Pogram RKS. 2012. Pertumbuhan dan Kelangsungan Hidup Benih Ikan Betok Umur 12 Hari yang Direndam dengan Hormon Pertumbuhan Rekombinan Ikan Kerapu Kertang pada Dosis Berbeda.
Promdonkoy B, Warit S, Panyim S. 2004. Production of a biologically active growth hormone from giant catfish (Pangasianodon gigas) in Escherichia coli. Biotechnology Lett 26: 649-653.
Putra HGP. 2011. Pertumbuhan dan Kelangsungan Hidup Benih Ikan Gurame yang Diberi Protein Rekombinan GH Melalui Perendaman dengan Dosis Berbeda [Skripsi]. Departemen Budidaya Perairan. Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor.
Rahmawaty. 2011. Pertumbuhan dan Kelangsungan Hidup Benih Ikan Gurame yang Diberi Pakan Alami yang Disuplementasi Hormon Pertumbuhan Rekombinan. [Skripsi]. Departemen Budidaya Perairan. Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor.
Ratnawati. 2012. Pertumbuhan dan Kelangsungan Hidup Benih Ikan Gurame yang Diberi Hormon Pertumbuhan Rekombinan dengan Lama Perendaman yang Berbeda. [Skripsi]. Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor.
Sakai M , Kajita Y, Kobayashi M, Kawauchi H. 1997. Immunostimulating effect of growth hormone: in-vivo administration of growth hormone in rainbow trout enhances resistance to Vibrio anguillarum infection. Veterinary Immunology and Immunopathology 57: 147-152.
LA
AM
MP
PI
IR
RA
15
16 Lampiran 1. Analisis Sidik Ragam (ANOVA) dan Uji Lanjut Tukey’s
Descriptives
Parameter Perlakuan N Mean Std.
Deviation
95% Confidence Interval for Mean
Lower
Total 12 4,5367 ,07390 4,4897 4,5836
P.Total Kontrol (0) 3 5,4767 ,04665 5,3608 5,5926
3 mg/L 3 5,4300 ,04670 5,3140 5,5460
6 mg/L 3 5,5100 ,09165 5,2823 5,7377
12 mg/L 3 5,5900 ,01000 5,5652 5,6148
Total 12 5,5017 ,07782 5,4522 5,5511
Tinggi Kontrol (0) 3 1,7567 ,01000 1,7319 1,7815
3 mg/L 3 1,7467 ,02665 1,6805 1,8129
6 mg/L 3 1,7733 ,02335 1,7153 1,8313
12 mg/L 3 1,7967 ,02335 1,7387 1,8547
Total 12 1,7683 ,02713 1,7511 1,7856
Biomassa Kontrol (0) 3 416,1733 38,57378 320,3508 511,9959 3 mg/L 3 476,1800 36,47076 385,5816 566,7784 6 mg/L 3 487,5533 25,62691 423,8926 551,2141 12 mg/L 3 529,0100 19,14772 481,4444 576,5756
Total 12 477,2292 49,75680 445,6152 508,8431
ABW Kontrol (0) 3 3,4022 ,20708 2,8877 3,9166
3 mg/L 3 3,3931 ,05659 3,2525 3,5337
6 mg/L 3 3,4124 ,06601 3,2484 3,5764
12 mg/L 3 3,4655 ,01395 3,4308 3,5001
Total 12 3,4183 ,10033 3,3545 3,4820
17
Perlakuan N Subset for alpha = 0,05 1 2
Means for groups in homogeneous subsets are displayed.
a. Uses Harmonic Mean Sample Size = 3.000.
P.Total
Tukey HSDa
Perlakuan N Subset for alpha = 0,05
1 2
Means for groups in homogeneous subsets are displayed.
18 Tinggi
Tukey HSDa
Perlakuan N Subset for alpha = 0,05 1 Means for groups in homogeneous subsets
are displayed.
a. Uses Harmonic Mean Sample Size = 3.000.
ABW
Tukey HSDa
Perlakuan N Subset for alpha = 0,05 1 Means for groups in homogeneous subsets
are displayed.
a. Uses Harmonic Mean Sample Size = 3.000.
SGR
Tukey HSDa
Perlakuan N Subset for alpha = 0,05 1 Means for groups in homogeneous subsets
are displayed. a. Uses Harmonic Mean Sample Size = 3.000.
Biomassa
Tukey HSDa
Perlakuan N Subset for alpha = 0,05 1 2
Means for groups in homogeneous subsets are displayed.
a. Uses Harmonic Mean Sample Size = 3.000.
GR
Tukey HSDa
Perlakuan N Subset for alpha = 0.05 1 Means for groups in homogeneous subsets
are displayed.
a. Uses Harmonic Mean Sample Size = 3.000.
SR
Tukey HSDa
Perlakuan N Subset for alpha = 0,05 1 Means for groups in homogeneous subsets
19 Lampiran 2. Skema Penelitian Pendahuluan
Penelitian Pendahuluan
SR terbaik sebesar 80%
setelah 14 hari
pemeliharaan
Akuarium ukuran:
30 x 20 x 20 cm Diisi :
10 liter air tawar
Lampiran 3. Proses Produksi rHP
Plate E. coli BL21
20 Lampiran 4. Dokumentasi Produksi rHP