ISOLASI DAN KARAKTERISASI GEN PENYANDI ENDO 1,4
β GLUKANASE DARI KAPANG
DAN
SAELI
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
ABSTRAK
SAELI. Isolasi dan Karakterisasi Gen Penyandi Endo 1,4 β glukanase dari
Kapang
dan
. Dibimbing oleh EDY
DJAUHARI PURWAKUSUMAH dan DJOKO SANTOSO.
Biomassa limbah pertanian yang mengandung selulosa merupakan bahan
baku pembuatan bioetanol yang paling murah dan banyak terdapat di alam. Bahan
baku ini dapat dihidrolisis dengan bantuan enzim selulase yang dihasilkan kapang
dan
. Enzim ini terdiri atas tiga komponen utama, yaitu endo
1,4 β glukanase,
ekso 1,4 β glukanase,
dan
β glukosidase.
Tujuan
utama
penelitian ini yaitu mengisolasi dan mengkarakterisasi gen penyandi endo 1,4 β
glukanase dari
dan
. Hipotesis yang diajukan adalah gen
penyandi endoglukanase dapat diisolasi menggunakan primer spesifik yang
dirancang berdasarkan sekuen gen yang terdapat di bank gen. Gen penyandi
endoglukanase diisolasi menggunakan teknik RT PCR (
ABSTRACT
SAELI. Isolation and Characterization of Genes Encoding Endo 1,4 β glucanase
from the Fungi of
and
. Under the
direction of EDY DJAUHARI PURWAKUSUMAH and DJOKO SANTOSO.
Agricultural waste biomass containing cellulose is the raw material for
bioethanol production and is the cheapest and most abundant in nature. It can be
hydrolyzed with the help of cellulase enzymes produced by fungus
ISOLASI DAN KARAKTERISASI GEN PENYANDI ENDO 1,4
β GLUKANASE DARI KAPANG
DAN
SAELI
Skripsi
sebagai salah satu syarat untuk memperoleh gelar
Sarjana Sains pada
Departemen Biokimia
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
Judul Skripsi : Isolasi dan Karakterisasi Gen Penyandi Endo 1,4 β glukanase
dari Kapang
dan
Nama
: Saeli
NIM
: G84051205
Disetujui
Komisi Pembimbing
Drs. Edy Djauhari PK, M.Si
Dr. Djoko Santoso
Ketua
Anggota
Diketahui
Dr. Ir. I Made Artika, M.App.Sc.
Ketua Departemen Biokimia
PRAKATA
Penulis memanjatkan puji syukur kepada Allah SWT atas segala karunia
Nya sehingga penelitian dapat diselesaikan. Penelitian yang berjudul Isolasi dan
Karakterisasi Gen Penyandi Endo 1,4 β glukanase dari Kapang
dan
ini dilaksanakan dari bulan Maret hingga
Desember 2009 di Balai Penelitian Bioteknologi Perkebunan Indonesia.
Ucapan terima kasih penulis sampaikan kepada semua pihak yang telah
membantu dalam penyelesaian penelitian ini, antara lain kepada Bapak Drs. Edy
Djauhari PK, M.Si selaku pembimbing utama, Bapak Dr. Djoko Santoso selaku
pembimbing anggota, dan Bapak Dr. Darmono Taniwiryono, M.Sc. sebagai
Kepala Balai Penelitian Bioteknologi Perkebunan Indonesia atas izinnya. Tidak
lupa penulis sampaikan terima kasih kepada orang tua penulis untuk semua doa
dan kasih sayangnya. Penulis juga berterima kasih kepada Teh Rini, Teh Niyyah,
Teh Nina, Teh Herti, Teh Alin, Teh Riana, Teh Aan, Teh Irma, dan teman teman
Biokimia 42. Untuk teman teman seperjuangan, Ellen dan Izzah serta Ratna Dewi,
Embi, Tri, dan Nunung terima kasih atas motivasinya.
Penulis menyadari bahwa banyak kekurangan dan kesalahan yang harus
diperbaiki, namun penulis berharap semoga penelitian ini dapat memberikan
manfaat bagi semua pihak yang membutuhkannya demi kemajuan ilmu
pengetahuan.
RIWAYAT HIDUP
Penulis dilahirkan di Cirebon pada tanggal 12 Mei 1987 dari ayah Sadiin
dan ibu Karwiti. Penulis merupakan anak tunggal.
Tahun 2005 penulis lulus dari SMU Negeri 1 Babakan, Cirebon dan
melanjutkan pendidikannya di IPB melaui jalur Undangan Seleksi Masuk IPB
(USMI). Penulis memilih Departemen Biokimia, Fakultas Matematika dan Ilmu
Pengetahuan Alam.
DAFTAR ISI
Halaman
DAFTAR TABEL ... viii
DAFTAR GAMBAR ... viii
DAFTAR LAMPIRAN ...
ix
PENDAHULUAN ...
1
TINJAUAN PUSTAKA
Kapang
...
2
Enzim Selulase ...
3
(RT PCR) ...
4
Isolasi dan Pengklonan Gen ...
5
Bioinformatika ...
5
BAHAN DAN METODE
Alat dan Bahan ...
6
Metode ...
6
HASIL DAN PEMBAHASAN
Isolasi RNA Total ... 10
Perancangan Primer ... 11
Amplifikasi Gen Penyandi Endo β 1,4 glukanase ... 11
Pengklonan Fragmen DNA dengan Vektor pGEM T
... 12
Analisis Sekuen Gen ... 14
Konstruksi Gen Penyandi Endo 1,4 β glukanase ke Vektor pYES2/CT . 16
Uji Ekspresi Gen Penyandi Endo 1,4 β glukanase
... 17
SIMPULAN DAN SARAN
Simpulan ... 18
Saran ... 18
DAFTAR PUSTAKA ... 18
DAFTAR TABEL
Halaman
1 Konsentrasi dan kemurnian RNA hasil isolasi ... 10
2 Karakteristik pasangan primer
dan
... 11
3 Analisis BLAST sekuen fragmen DNA
... 14
4 Analisis BLAST sekuen fragmen DNA
... 14
DAFTAR GAMBAR
Halaman
1 Kapang
... 2
2 Kapang
... 3
3 Mekanisme hidrolisis selulosa oleh enzim ... 3
4 Tahapan proses RT PCR ... 4
5 Hasil elektroforesis RNA total
dan
... 10
6 Hasil RT PCR gen target ... 12
7 Seleksi transforman
rekombinan dengan vektor pGEM T
... 13
8 Hasil elektroforesis PCR koloni dengan plasmid pGEM T
... 13
9 Hasil elektroforesis isolasi pasmid pGEM T E
... 13
10 Sekuen gen penyandi endoglukanase
... 15
11 Sekuen gen penyandi endoglukanase
... 16
12 Pemotongan dengan enzim restriksi
RI dan
I ... 17
13 Hasil elektroforesis PCR koloni
yang disipkan gen penyandi
endoglukanase
melalui vektor pYES2/CT ... 17
DAFTAR LAMPIRAN
Halaman
1 Tahapan penelitian ... 22
2 Hasil analisis BLAST terhadap sekuen
... 23
3 Hasil analisis BLAST terhadap sekuen
... 24
4 Peta restriksi vektor pGEM T
dan pYES2/CT ... 25
5 Kurva standar protein pada λ = 750 nm ... 26
6 Kurva standar glukosa pada pada λ = 575 nm ... 27
7 Kadar protein sel
rekombinan ... 28
8 Aktivitas endoglukanase sel
rekombinan ... 29
9 Analisis ANOVA dengan program komputer MINITAB 14 ... 30
PENDAHULUAN
Energi dibutuhkan oleh manusia untuk berbagai keperluan, mulai dari transportasi, perindustrian, sampai pada kebutuhan rumah tangga. Salah satu sumber energi yang banyak dimanfaatkan adalah minyak bumi. Hingga saat ini konsumsi minyak bumi, baik di negara maju maupun di negara berkembang masih sangat tinggi. Laju penggunaan minyak bumi yang tinggi telah menyebabkan persediaan minyak dunia mengalami masa krisis. Krisis energi ini dapat mengakibatkan melambungnya harga produk dan mempengaruhi mobilitas masyarakat. Selain itu, penggunaan minyak bumi yang terus menerus juga dapat menimbulkan dampak negatif terhadap lingkungan akibat efek rumah kaca.
Seiring dengan menipisnya cadangan energi minyak bumi, berbagai penelitian telah diarahkan untuk pengembangan energi alternatif terbarukan. Salah satu teknologi yang sedang dikembangkan adalah konversi biomassa yang dapat menghasilkan bahan bakar hayati berupa biodiesel, biogas, dan bioetanol. Produk produk tersebut memiliki keunggulan, yaitu terbarukan, ramah lingkungan, dan dalam beberapa hal biaya produksinya yang relatif lebih murah. Perkembangan bahan bakar hayati di Brazil dan Jepang telah berhasil mengkonversi biomassa menjadi bioetanol dari bahan dasar lignoselulosa secara efisien sebagai campuran bahan bakar bensin (Howard 2003). Bioetanol (C2H5OH) adalah cairan yang
dihasilkan melalui proses fermentasi gula dari sumber karbohidrat menggunakan bantuan mikroorganisme. Sebagai campuran bahan bakar kendaraan bermotor, produk ini lebih dikenal sebagai gasohol (campuran gasolin dan alkohol).
Produksi bioetanol umumnya menggunakan glukosa sebagai substrat fermentasi. Sementara itu, sumber bahan baku untuk pembuatan bioetanol yang paling murah dan banyak terdapat di alam adalah biomassa limbah pertanian yang mengandung selulosa. Saat ini, penanganan limbah pertanian dapat dilakukan dengan memanfaatkan selulosa yang ada pada limbah pertanian. Selulosa ini dapat dihidrolisis menjadi glukosa dengan bantuan enzim selulase. Beberapa negara maju sudah mampu memproduksi selulase secara komersial. Penjualan selulase diperkirakan mencapai 20% dari industri enzim (Howard 2003). Penggunaan enzim dalam mendegradasi senyawa polimer
di bidang industri maupun pertanian telah banyak dilakukan untuk efisiensi biaya produksi. Mahalnya harga selulase impor karena tingginya ongkos pengiriman menjadi hambatan majunya sektor pertanian dan perindustrian.
Indonesia merupakan negara yang mempunyai potensi yang sangat besar untuk menghasilkan bioetanol mengingat bahan bakar nabati ini dapat memanfaatkan kondisi geografis dan keanekaragaman hayati yang tersedia di Indonesia cukup tinggi. Usaha pengembangan teknologi enzim sedang dikembangkan untuk menjawab masalah mahalnya harga enzim impor dengan memanfaatkan sumber daya hayati yang ada di Indonesia. Salah satunya adalah eksplorasi mikrob selulolitik, seperti fungi, bakteri, dan khamir. Fungi dari genus diyakini mempunyai peranan dalam produksi enzim secara komersial, termasuk selulase (Onsori
. 2005; Okafor 2007). Krikstaponis . (2001) melaporkan bahwa kapang
yang diisolasi dari sampah organik mampu mensekresikan enzim selulase ekstraseluler. Sementara itu, beberapa studi menunjukkan bahwa kapang
mampu memproduksi enzim selulase dalam jumlah yang cukup tinggi (Abu & Ado 2004; Ikram ul Haq . 2005; Ali & Saad El Dein 2008).
Pada umumnya enzim yang diisolasi dari mikroorganisme asalnya memiliki tingkat kemurnian yang rendah bila dibandingkan dengan enzim produk rekayasa genetika. Oleh karena itu, salah satu upaya untuk meningkatkan produksi enzim adalah melalui rekayasa genetika. Namun, aktivitas enzim ini dipengaruhi oleh karakteristik gen yang diekspresikan. Karakterisasi gen penyandi endo 1,4 β glukanase dan
isolat koleksi BPBPI belum pernah dilakukan. Tujuan utama penelitian ini yaitu mengisolasi dan mengkarakterisasi gen penyandi endo 1,4 β glukanase dari
yang muncul dari konsumsi bahan bakar minyak dari fosil yang jumlahnya besar dapat diminimalkan.
TINJAUAN PUSTAKA
Kapang
Kapang adalah organisme eukariot yang tumbuh dengan cara perpanjangan hifa. Panjang hifa dipengaruhi oleh kondisi pertumbuhan. Jika tumbuh pada permukaan medium, hifa berukuran panjang, sedangkan jika di bawah permukaan (terendam), hifa akan terputus putus sehingga ukurannya lebih pendek tetapi bercabang cabang. Mikroorganisme ini dapat menyerap molekul sederhana seperti gula dan komponen lainnya yang terlarut di sekeliling hifa secara langsung. Makromolekul yang lebih kompleks seperti selulosa, pati, dan protein harus dipecah sebelum diserap ke dalam sel dengan menseksresikan beberapa enzim ekstraseluler (Fardiaz 1988).
Kapang dapat diklasifikasi ke dalam dunia Fungi, filum Eumycota, kelas Ascomycetes, ordo Moniliales, famili Moniliaceae, dan genus
(Alexopoulos 1961; Fardiaz 1989). terdapat di alam sebagai saprofit. Ciri ciri khusus yang dimiliki oleh kapang jenis ini yaitu memiliki hifa yang bersepta dan miselium bercabang, struktur koloni kompak, konidiofor septa atau nonsepta muncul dari (sel miselium yang membengkak dan berdinding tebal. Konidiofor
membengkak menjadi vesikel pada ujungnya dan memiliki fialid yang sederhana, berwarna atau tidak berwarna. Konidianya membentuk rantai yang berwarna hijau, coklat atau hitam dan tumbuh baik pada suhu 37oC atau lebih. Kapang ini tumbuh baik pada substrat dengan konsentrasi gula dan garam tinggi. Oleh karena itu, dapat tumbuh pada makanan dengan kadar air rendah (Fardiaz 1989). Kapang dari genus ini dapat menimbulkan kerusakan pada sayuran dan buah buahan dengan memanfaatkan enzim selulase untuk mendegradasi dinding sel sayuran dan buah buahan sehingga strukturnya menjadi lunak (Gandjar 2006).
Koloni berwarna hijau tua karena lebatnya konidiofor yang terbentuk dari miselia (Gambar 1). Konidianya berbentuk semibulat, berwarna
hijau, dan berdinding kasar hingga berduri. Pertumbuhan koloni lebih cepat dan lebih lebat pada media MEA ( ). Spesies ini bersifat tropik termotoleran dan banyak ditemukan pada serealia bersuhu tinggi serta telah diisolasi dari debu rumah, kompos, tanah, serasah rhizosfer tanaman kopi, kacang tanah, bawang, dan jagung.
dapat tumbuh pada suhu tinggi, yaitu 55 oC dan pada tekanan oksigen yang rendah. Spesies ini bersporulasi dengan lebat dan bersifat patogen sehingga harus berhati hati dalam menanganinya (Gandjar 1999). Selain itu, kapang ini juga dapat menimbulkan reaksi alergi dan apabila kondisi seseorang sedang menurun, kapang jenis ini dapat tumbuh di bronki paru paru (Gandjar
2006).
Gambar 1 Kapang .
Koloni terdiri atas suatu lapisan basal yang kompak berwarna putih hingga kuning dan suatu lapisan konidiofor yang lebat yang berwarna coklat tua hingga hitam. Kepala konidia berwarna hitam, berbentuk bulat, dan cenderung merekah menjadi kolom kolom pada koloni berumur tua. Konidia berbentuk bulat hingga semibulat, berwarna coklat, dan memiliki ornamentasi berupa tonjolan dan duri duri yang tidak beraturan (Gambar 2). Koloni pada media MEA ( ) lebih tipis tetapi bersporulasi lebat. Spesies ini kosmopolit di daerah tropik dan subtropik, mudah diisolasi dari tanah, udara, air, rempah rempah, kapas, buah buahan, gandum, beras, jagung, tebu, ketimun, kopi, teh, kakao, dan serasah dedaunan (Gandjar . 1999).
3
digunakan dalam proses fermentasi untuk produksi asam sitrat dengan substrat molassa pabrik gula tebu dan digunakan di industri kimia dan pangan karena harga produknya murah bila dibandingkan dengan produk yang dihasilkan melalui suatu proses kimia murni (Gandjar 2006).
Gambar 2 Kapang .
Enzim Selulase
Selulase merupakan salah satu enzim ekstraseluler yang dapat menghasilkan produk berupa glukosa dan selobiosa (Fardiaz 1988). Enzim ini mampu memecah ikatan β 1,4 glikosida yang terdapat pada selulosa (Gambar 3). Enzim selulase terdiri atas tiga enzim utama, yaitu endoglukanase atau endo 1,4 β glukanase (EC 3.2.1.4), ekso 1,4 β glukanase atau selobiohidrolase (EC 3.2.1.91),
dan β glukosidase atau selobiase (EC 3.2.1.21) (Howard . 2003; Zee 2005; Okafor 2007).
Mekanisme keja enzim selulase yaitu endoglukanase akan menyerang daerah amorf dari selulosa secara acak dan membentuk makin banyak ujung ujung nonpereduksi yang memudahkan kerja selobiohidrolase. Selobiohidrolase kemudian menghidrolisis daerah kristal dari selulosa dengan membebaskan dua unit glukosa. Kerja kedua enzim ini saling bersinergi menghasilkan unit unit sakarida yang lebih kecil berupa selobiosa dan selotetrosa. Selanjutnya, unit glukosa tersebut dihidrolisis oleh β glukosidase menghasilkan glukosa.
Endoglukanase memiliki afinitas yang tinggi terhadap serat selulosa yang memiliki kristalinitas rendah. Aktivitas enzim ini menyebabkan penurunan viskositas substrat yang dapat larut. Oleh karena itu pengukuran penurunan viskositas larutan CMC (karboksimetil selulosa) merupakan metode yang sering digunakan untuk menentukan aktivitas endoglukanase (Fikrinda 2000). Enzim ini dikenal dengan nama CMC ase (karboksimetil selulase) karena aktivitasnya yang tinggi dalam menghidrolisis substrat CMC (Lelana 2009).
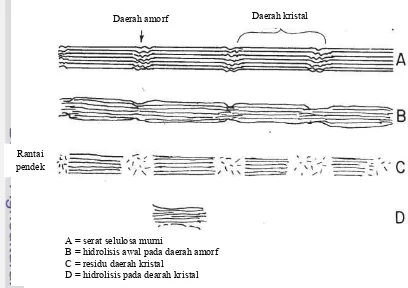
Gambar 3 Mekanisme hidrolisis selulosa oleh enzim (Okafor 2007). Daerah kristal
Daerah amorf
Rantai pendek
A = serat selulosa murni
B = hidrolisis awal pada daerah amorf C = residu daerah kristal
Berbeda dengan endoglukanase yang memiliki aktivitas hidrolisis yang tinggi pada selulosa amorf, selobiohidrolase atau aksoglukanase menunjukkan aktivitas yang tinggi terhadap selulosa kristal tetapi sangat rendah pada selulosa amorf seperti CMC. Enzim ini bereaksi sebagai eksoenzim dan melepaskan selobiosa sebagai produk utama dari selulosa kristal. Menurut Yosakawa . (2003), enzim ini berperan dalam inisiasi hidrolisis selulase pada selulosa kristal.
Enzim terakhir yang berperan pada hidrolisis selulosa yaitu β glukosidase. Enzim ini tidak menghidrolisis CMC atau selulosa tetapi menghidrolisis selooligosakarida dan selobiosa menjadi glukosa (Fikrinda 2000). Kemampuan fungi mensekresikan enzim selulase menjadikannya mampu menghidrolisis selulosa yang terdapat pada substratnya menjadi glukosa yang merupakan sumber karbon untuk pertumbuhan fungi (Irawan . 2008).
Beberapa mikroorganisme dari jenis fungi yang menghasilkan selulase antara lain !
"
# $ %
& dan
(Gandjar . 2006). Selain itu bakteri dari genus
dan bakteri Actinomycetes seperti dan % '
serta dan
dapat juga memproduksi enzim selulase (Howard . 2003). Meskipun sejumlah besar mikroorganisme dapat mendegradasi selulosa tetapi hanya sedikit mikroorganisme yang mampu memproduksi enzim yang dapat sempurna menghidrolisis selulosa kristal secara .
Menurut Howard (2003), ekso 1,4 β glukanase merupakan komponen utama dari sistem selulase fungi yaitu sekitar 40 70% dari total protein selulase dan mampu menghidrolisis daerah kristal. Kapang memproduksi endoglukanase dan β glukosidase dalam jumlah besar tetapi sedikit menghasilkan selobiohidrolase. Penggunaan selulase banyak diaplikasikan dalam industri kimia, bahan bakar, makanan, proses fermentasi, pakan ternak, tekstil, pulp, dan pertanian.
(RT PCR)
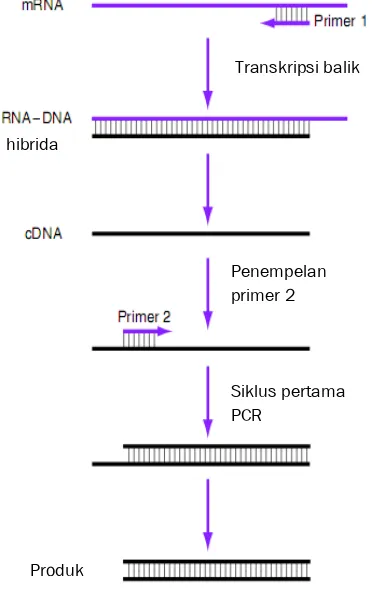
(RT PCR) adalah suatu metode yang
digunakan untuk memperbanyak salinan cDNA dengan menggunakan RNA sebagai cetakan (Sambrook & Russell 2001). Teknik RT PCR terdiri atas dua tahap, yaitu sintesis cDNA dari RNA menggunakan enzim
dan amplifikasi cDNA dengan proses PCR. RT PCR merupakan metode yang sensitif untuk mendeteksi keberadaan sampel yang spesifik sehingga dapat digunakan walaupun jumlah RNA yang dianalisis sedikit (Dale & Schantz 2002). Gambar 4 memperlihatkan tahapan proses RT PCR.
Berbeda dengan teknik PCR yang menggunakan bahan dasar DNA, teknik RT PCR ini memerlukan mRNA sebagai bahan dasar untuk amplifikasi fragmen DNA. Oleh karena itu, komponen dalam RT PCR adalah molekul mRNA, pemicu reaksi (primer), dNTPs, enzim , dan bufer reaksi. Enzim
yang digunakan untuk transkripsi balik biasanya berasal dari '
(AMV), %
( (Mo MLV), ) % * %+) yang menghambat aktivitas RNase H, atau Tth DNA
yang bersifat termostabil (Sambrook & Russell 2001).
5
Primer yang digunakan untuk sintesis cDNA dapat dibedakan menjadi oligo (dT) yang akan menempel pada ujung poli A yang terdapat pada ujung 3’ mRNA, dan primer yang akan menempel secara acak pada mRNA (Invitrogen 2003). Tahap kedua yaitu amplifikasi cDNA dengan PCR biasa yang memerlukan primer spesifik. Hasil amplifikasi dapat dideteksi melalui 30 40 siklus tergantung jumlah mRNA hasil transkripsi yang digunakan.
Isolasi dan Pengklonan Gen
Isolasi gen spesifik dari potongan kromosom eukariot dapat dilakukan dengan pendekatan isolasi DNA secara keseluruhan ( ) atau membangun cDNA dari mRNAnya. mRNA ini digunakan sebagai cetakan cDNA dengan bantuan enzim
. Perlu diperhatikan bahwa DNA yang didapatkan tidak mengandung intron (Lehninger 1982).
Penggunaan RNA dalam proses rekayasa genetika memiliki beberapa keuntungan, yaitu sekuen gen yang didapatkan merupakan representasi bagian dari gen yang diekspresikan, tidak adanya intron dalam molekul RNA, dan ukurannya relatif lebih kecil sehingga memudahkan dalam penyisipan gen ke dalam vektor (Old & Primrose 1989). Menurut Budiani . (2004), kualitas RNA merupakan salah satu faktor penting dalam berbagai penelitian seperti isolasi gen atau mRNA target yang terekspresi pada organ atau tahap perkembangan tertentu. Namun, isolasi RNA seringkali menghadapi berbagai hambatan sehingga RNA yang dihasilkan dalam keadaan terdegradasi atau terkontaminasi oleh komponen lain termasuk DNA.
Selanjutnya, DNA yang telah didapatkan disisipkan ke dalam vektor. Vektor pengklonan yang digunakan dalam penelitian ini adalah vektor pGEM T . Vektor ini mengandung gen β laktamase yang menyandi resistensi ampisilin dan gen , yang menyandi bagian peptida α dari enzim β galaktosidase. β galaktosidase adalah enzim yang mengkatalisis pemecahan laktosa menjadi glukosa dan galaktosa. Enzim ini memecah X gal (senyawa analog laktosa) menghasilkan produk berwarna biru. Penambahan IPTG (isopropil tiogalaktosidase) pada media seleksi akan menginduksi promoter gen ,(Sambrook & Russell 2001). Sementara itu, untuk ekspresi gen ke sel inang digunakan vektor pYES2/CT yang merupakan vektor untuk sel khamir.
Vektor ini umumnya dirancang agar selain dapat bereplikasi di dalam sel khamir, dapat juga bereplikasi di dalam . Begitu pula untuk proses amplifikasi DNA vektor. Oleh karena itu, vektor untuk sel khamir juga mengandung origin replikasi yang dikenali oleh bakteri serta marka seleksi untuk bakteri (Old & Primrose 1989).
Marka seleksi yang umum digunakan pada vektor adalah gen penyandi enzim yang terlibat dalam biosintesis asam amino dan gen penyandi enzim yang terlibat dalam biosintesis nukleotida. Contoh gen yang terlibat dalam biosintesis asam amino adalah
$- 3, + .2, dan 1 yang masing masing terlibat dalam biosintesis asam amino histidina, leusina, dan triptofan. Sementara itu, gen . 3 terlibat dalam biosintesis urasil. Seleksi transforman dilakukan dengan menumbuhkan sel khamir dalam media minimal (tidak mengandung asam amino dan nukleotida) sehingga sel yang tumbuh adalah sel rekombinan yang mengandung gen penyandi yang terlibat dalam biosintesis asam amino dan nukleotida (Old & Primrose 1989).
Bioinformatika
Bioinformatika adalah teknologi pengumpulan, penyimpanan, analisis, interpretasi, penyebaran, dan aplikasi dari data biologi molekuler. Perangkat utama bioinformatika yaitu / dan didukung oleh kesediaan internet dan server/ / / ' (WWW) (Aprijani & Elfaizi 2004). Bioinformatika muncul atas desakan kebutuhan untuk mengumpulkan, menyimpan, dan menganalisis data data biologi dari
' DNA, RNA, maupun protein. Pencarian ' umumnya berdasarkan hasil atau penyejajaran sekuen, baik sekuen DNA maupun protein. Metode ini digunakan berdasarkan pada kenyataan bahwa sekuen DNA atau protein bisa berbeda sedikit tetapi memiliki fungsi yang sama (Witarto 2003).
Saat ini, banyak pekerjaan bioinformatika yang berkaitan dengan teknologi ' . Penggunaan ' ini meliputi baik tempat penyimpanan ' yang bersifat umum (dapat diakses oleh banyak pengguna) seperti
# ! ( atau PDB ( ' )
maupun ' yang bersifat pribadi seperti yang digunakan oleh grup riset yang terlibat dalam proyek pemetaan gen atau '
telah dikuatkan dengan data yang disekuenkan di laboratorium. Setelah informasi dari
' diperoleh, langkah berikutnya adalah menganalisis data. Pencarian '
umumnya berdasarkan pada hasil penyejajaran sekuen (Aprijani & Elfaizi 2004).
Salah satu perangkat lunak pencari
' yang paling berhasil dan bisa dikatakan menjadi standar saat ini adalah BLAST (! + ). BLAST merupakan program pencarian kesamaan yang didisain untuk mengeksplorasi semua ' sekuen yang diminta, baik itu berupa DNA atau protein (Aprijani & Elfaizi 2004). Perangkat lunak ini telah diadaptasi untuk melakukan terhadap berbagai sekuen seperti DNA (blastn), protein (blastp), dan sebagainya. Sementara itu, perangkat lunak yang digunakan untuk melakukan terhadap sekuen terbatas yang lazim digunakan adalah ClustalX dan ClustalW (Witarto 2003).
BAHAN DAN METODE
Alat dan Bahan
Alat alat yang digunakan adalah sentrifus Beckman Coulter Allegra 4R, sentrifus Eppendorf 5417R, spektrofotometer UV VIS Beckman Coulter DU150, )
DNA Savant V110, PCR Biometra, kamera Canon / A640, Geldoc, pipet mikro, pipet Mohr, tabung Eppendorf, neraca analitik, / ' , cawan petri,
/ , peralatan elektroforesis,
/ ' , alat pemotong gel, mortar, lemari asam, tabung sentrifus 30 mL, autoklaf, Decby & 40°C, Sansio freezer 20°C, pH meter, inkubator bergoyang, dan alat gelas seperti cawan petri, gelas piala, Erlenmeyer, dan gelas ukur.
Bahan yang digunakan adalah isolat
kapang dan
koleksi Balai Penelitian Bioteknologi Perkebunan Indonesia, 1
% 2 , kit % -- " * * (Invitrogen),
$ - 2 (Roche), vektor pGEM T (Promega), vektor pYES2/CT (Invitrogen), T4 DNA ligase, bufer ligasi, media LB (Luria Bertani), media LB agar, agarosa, bufer !
EDTA (TBE) 0.5X, etidium bromida (EtBr), etanol 96%, ' (brom fenol biru 2.5%, sukrosa 40%), β merkaptoetanol, marker 1 kb plus 0 (Invitrogen)
tips pipet mikro, nitrogen cair, ddH2O,
XL1 ' , reagen DNS (3,5 ), larutan CMC ( ' ) 2%, bufer fosfat pH 4.8, bufer lisis bakteri, reagen Lowry, dan primer spesifik endo 1,4 β glukanase
dan .
Metode Isolasi RNA Total
Isolasi RNA dilakukan menggunakan
1 % 2 . Sebanyak 0.1 g kapang yang sudah digerus dengan nitrogen cair dimasukkan ke dalam Eppendorf berukuran 2 mL. Sampel ditambahkan 450 OL bufer RLT (Qiagen) dan β merkaptoetanol, campuran diekstraksi dengan cara divorteks. Selanjutnya, tabung Eppendorf diinkubasi dalam/ ' pada suhu 56 °C selama 1 3 menit. Isi larutan dipindahkan ke dalam tabung berwarna ungu dan disentrifus pada kecepatan 13000 rpm selama 2 menit, supernatan diambil dan dimasukkan ke dalam tabung yang baru. Supernatan ditambahkan 225 OL etanol 96% lalu dikocok sampai homogen. Setelah itu, campuran dimasukkan dalam tabung berwarna merah muda dan disentrifus kembali dengan kecepatan 10000 rpm selama 1 menit.
Selanjutnya, endapan yang tertinggal di dalam tabung ditambahkan dengan 700 OL bufer RW1 (Qiagen) dan disentrifus kembali pada kecepatan 10000 rpm selama 1 menit. Pelet hasil sentrifugasi dipindahkan ke dalam Eppendorf berukuran 2 mL yang baru dan ditambahkan bufer RPE (Qiagen) sebanyak 500 OL, campuran disentrifus pada 10000 rpm selama 1 menit dan supernatannya dibuang. Endapan yang tersisa ditambahkan 500 OL bufer RPE dan disentrifus dengan kecepatan 10000 rpm selama 2 menit. Hasil sentrifugasi dipindahkan ke dalam tabung berukuran 2 mL yang baru dan disentrifus kembali selama 1 menit dengan kecepatan 13000 rpm. Pelet yang didapatkan dipindahkan ke dalam tabung berukuran 1.5 mL dan ditambahkan 30 OL
/ Campuran disentrifus pada 10000 rpm selama 1 menit lalu dilakukan pengukuran konsentrasi RNA dengan spektrofotometer pada panjang gelombang 260, 280, dan 230 nm. Hasil isolasi RNA dianalisis dengan elektroforesis gel agarosa 1% dengan tegangan 25 volt selama 2 jam.
Perancangan Primer
7
diperoleh dari situs webhttp://www.ncbi.nlm. nih.gov/. Apabila gen yang diinginkan tidak terdapat pada kapang dan
maka digunakan gen kapang lain sebagai dasar untuk analisis BLAST pada situs http://www.ncbi.nlm.nih.gov/BLAST/. Perancangan primer dilakukan dengan kriteria, memiliki 18 25 pasang basa, mengandung G+C 40 60%, pasangan primer
/ dan tidak saling komplemen, tidak dapat membentuk primer dimer, pada ujung 3’ tidak mempunyai basa nukleotida T, dan memiliki (Tm) tidak melebihi 70 oC (Sambrook & Russell 2001). Kualitas hasil rancangan diuji lagi dengan bantuan program komputer# .
Amplifikasi Gen Penyandi Endo β 1,4
glukanase dengan Metode
(RT PCR)
Sintesis dilakukan dengan menggunakan kit %
--(Invitrogen). Sintesis dilakukan dengan cara sebanyak 2 Og RNA dilarutkan dalam 10 OL ddH2O.
Campuran ditambahkan oligo (dT) dan dNTP masing masing 1 OL. Campuran tersebut dipanaskan pada suhu 65 oC selama 5 menit lalu segera dimasukkan ke dalam es. Selanjutnya, campuran ditambahkan reagen yang berisi 2 RL bufer RT 10X, 4 RL 25 mM MgCl2, 2 RL 0.1 M DTT, dan 1 RL
3. ' - '
kemudian dikocok pelan. Campuran diinkubasi pada suhu 25 °C selama 2 menit kemudian ditambahkan 1 RL Super ScriptTMII RT, dihomogenkan dan diinkubasi pada suhu 25 °C selama 10 menit. Campuran diinkubasi kembali pada suhu 42 °C selama 50 menit dan 70 °C selama 15 menit. Setelah itu, campuran dimasukkan ke dalam es dan ditambahkan 1 RL RNaseH kemudian diinkubasi pada suhu 37 °C selama 20 menit. Hasilnya berupa cDNA disimpan pada suhu 20 °C. Utas cDNA yang terbentuk selanjutnya digunakan sebagai untuk amplifikasi gen penyandi endo 1,4 β glukanase.
Proses PCR dilakukan dengan cara 1 OL cDNA dilarutkan dalam campuran berisi 18.05 OL ddH2O, 2.5 OL bufer lengkap 10X,
0.5 OL dNTPs, 1 OL primer / , 1 OL primer , dan 0.2 OL (1 unit) Taq polimerase. Volume total untuk reaksi tersebut adalah 25 OL. Selanjutnya, campuran dimasukkan dalam mesin PCR dengan program suhu pradenaturasi 94 oC selama 5 menit dan dilanjutkan dengan 35 siklus yang
terdiri atas denaturasi pada 94 oC selama 45 detik, pada suhu 57 oC selama 45 detik, suhu pemanjangan 72 oC selama 1 menit 30 detik, dan 1 siklus pascapemanjangan 72 oC selama 5 menit. Hasil amplifikasi diverifikasi dengan elektroforesis gel agarosa 1% dengan tegangan 75 volt selama 45 menit. Pita yang terbentuk dibandingkan dengan marker.
Ekstraksi dan Purifikasi DNA Hasil
Amplifikasi
Bagian gel yang menunjukkan adanya fragmen DNA hasil amplifikasi dipotong dan dimasukkan dalam tabung mikro 2 mL. Fragmen DNA dari gel agarosa dimurnikan menggunakan + ( 1 ( #
2 (Invitrogen). Gel dilarutkan dengan GS1 (# ' & ) sebanyak 3X bobot gel yang diperoleh lalu dipanaskan pada suhu 50 °C selama 15 menit dan tabung dikocok setiap 3 menit sekali. Setelah 15 menit, waktu inkubasi ditambahkan 5 menit lagi.
Gel yang sudah larut dimasukkan ke dalam kolom berfilter yang tersedia dalam kit dan disentrifus 12000 rpm selama 2 menit pada suhu 25oC kemudian dibuang supernatannya. Kolom ditambahkan 500 RL GS1 dan diinkubasi selama 1 menit pada suhu ruang. Supernatan dibuang dan residu ditambahkan 700 RL bufer W9 lalu diinkubasi selama 5 menit pada suhu ruang. Setelah itu, larutan kembali disentrifus 12000 rpm pada 25 oC selama 2 menit, supernatan dibuang dan disentrifus kembali dalam keadaan kosong. Kolom ditambahkan dengan 30 RL bufer TE
/ (65 70 °C) lalu diinkubasi selama 1 menit pada suhu ruang. Kolom yang berfilter dipindahkan ke tabung mikro 1.5 mL dan disentrifus pada 12000 rpm, 25 oC selama 3 menit. Hasil elusi berupa supernatan diverifikasi dengan elektroforesis gel agarosa 1 %.
Pengklonan Fragmen DNA dengan Vektor pGEM T
Hasil amplifikasi disisipkan ke dalam vektor pGEM T (Promega) menggunakan T4 DNA ligase. Sebanyak 5 OL 2X rapid ' , 3.5 OL DNA insersi, 0.5 OL vektor pGEM T , dan 1 OL T4 DNA ligase dimasukkan ke dalam tabung dan diinkubasi selama 16 jam, 4 oC. Vektor kemudian ditransformasikan ke dalam sel
yang telah dibuat kompeten.
Preparasi sel kompeten dilakukan dengan penambahan CaCl2. Bakteri XL1 '
yang telah ditambahkan ampisilin 100 ppm pada suhu 37oC selama semalam. Sebanyak 1 mL bakteri hasil kultur diinokulasikan ke dalam 3 mL LB yang mengandung ampisilin 100 ppm dan diinkubasi dalam inkubator bergoyang pada suhu 37oC dengan kecepatan 150 rpm hingga OD mencapai 0.6. Selanjutnya, hasil inokulasi dimasukkan ke dalam tabung mikro steril, didiamkan dalam es selama 5 10 menit dan disentrifus dengan kecepatan 6000 rpm pada suhu 4oC selama 2 menit. Pelet diresuspensikan dengan 1 mL 0.1 M CaCl2dingin lalu didiamkan di es selama
15 menit. Tabung disentrifus kembali dengan kecepatan 6000 rpm pada suhu 4oC selama 2 menit. Pelet disuspensikan kembali dengan 200 OL 0.1 M CaCl2 dingin dan disimpan
pada 20oC.
Transformasi dilakukan dengan cara 200 L sel kompeten dimasukkan ke dalam tabung mikro lalu ditambahkan 10 L plasmid rekombinan hasil ligasi pGEM T dengan DNA insersi. Tabung segera dimasukkan ke dalam es selama 30 menit dan diberi perlakuan kejut panas ( () pada suhu 42 C selama 50 detik lalu diinkubasi dalam es selama 10 menit. Selanjutnya, tabung ditambahkan 800 RL campuran media LB dan glukosa 20 mM tanpa antibiotik lalu diinkubasi dalam inkubator bergoyang dengan kecepatan 150 rpm pada suhu 37oC selama 90 menit. Sel sebanyak 100 L (1/10) disebarkan di atas media seleksi (media LB agar + ampisilin + IPTG + X gal) dan sisanya disentrifus pada 3000 rpm selama 5 menit, supernatan dibuang dan disisakan sedikit lalu disebar kembali pada media seleksi (9/10). Sel diinkubasi selama 16 jam pada suhu 37oC.
PCR Koloni
Proses PCR koloni diawali dengan lisis sel oleh pemanasan pada suhu 96 oC selama 5 menit lalu suhu turun menjadi 50 oC yang berlangsung selama 90 detik. Suhu naik kembali menjadi 96 oC selama 90 detik dan turun kembali pada suhu 45 oC selama 90 detik, selama 1 menit pada suhu 96oC dan 40
o
C. Selanjutnya, campuran PCR (1.5 OL bufer 10X, 2.75 OL ddH2O, 0.3 OL dNTPs, 0.15 OL
primer / dan , serta 0.15 OL Taq polimerase) ditambahkan pada setiap sampel. Proses PCR dilanjutkan kembali dengan suhu 94oC selama 30 detik, 57 oC selama 1 menit dan 72 oC selama 1 menit. Suhu program ini berulang hingga 30 siklus. Hasil PCR koloni dianalisis dengan elektroforesis gel agarosa 1%.
Isolasi DNA Plasmid
Isolasi DNA plasmid dilakukan dengan menggunakan $ -2 (Roche). Sebanyak 4 mL kultur bakteri disentrifus pada kecepatan 8000 rpm selama 2 menit, supernatannya dibuang dan endapan yang tersisa ditambahkan 250 RL
! dan 250 RL + ! . Isi tabung dibolak balik sebanyak 6 kali kemudian diinkubasi selama 5 menit pada suhu ruang. Campuran ditambahkan 350 RL
! ! dan disentrifus pada kecepatan 12000 rpm selama 10 menit. Selanjutnya, isi tabung dipindahkan ke dalam kolom baru dan disentrifus pada 12000 rpm selama 1 menit. Supernatan dibuang dan endapan ditambahkan 500 RL4 ! I lalu disentrifus kembali pada 12000 rpm selama 1 menit. Supernatan dibuang dan endapan ditambahkan 700 OL
4 ! II kemudian disentrifus 12000 rpm selama 1 menit. Endapan disentrifus kembali pada 12000 rpm selama 1 menit dalam keadaan kosong. Filter dipindahkan ke dalam tabung mikro 1.5 mL dan ditambah 30 RL ! lalu diinkubasi 1 menit pada suhu ruang, disentrifus pada 12000 rpm selama 1 menit. Hasil isolasi selanjutnya diverifikasi dengan elektroforesis gel agarosa 1%.
Pengurutan Sekuen Gen
Pengurutan sekuen dilakukan di lembaga Charoen Phokphand, Jakarta. DNA disekuen secara dua arah yaitu / dan
dengan menggunakan primer M13 F dan M13 R. Sekuen DNA yang diperoleh selanjutnya dianalisis menggunakan program BLAST untuk membandingkan sekuen nukleotida yang diperoleh dengan sekuen nukleotida pada basis data. Analisis menggunakan BLAST bertujuan mengidentifikasi kesesuaian urutan basa yang didapatkan dengan urutan basa yang ada dalam bank data.
Pemotongan Vektor pGEM T dan
Vektor pYES2/CT
Plasmid pGEM T yang mengandung DNA rekombinan dipotong dengan enzim restriksi RI dan I. Plasmid rekombinan sebanyak 7 OL dicampur dengan 1 OL ddH2O,
1 OL bufer restriksi, 1 OL enzim RI, dan 1 OL enzim I lalu diinkubasi pada suhu 37
o
9
dilakukan proses purifikasi. Vektor ekspresi pYES2/CT juga dipotong dengan enzim restriksi yang sama untuk menghasilkan ujung lengket yang sesuai.
Penyisipan Gen Penyandi Endo 1,4 β
glukanase ke dalam Vektor pYES2/CT
Sebelum dilakukan pengklonan ke vektor pYES2/CT, terlebih dahulu dilakukan ligasi gen penyandi endo 1,4 β glukanase dengan vektor pYES2/CT (Invitrogen). Ligasi dilakukan dengan menggunakan T4 DNA ligase dan diinkubasi selama 16 jam pada suhu 4oC (Sambrook & Russell 2001). Vektor kemudian dimasukkan ke dalam XL1
' yang telah dibuat kompeten. Metode transformasi sama seperti yang sudah dijelaskan sebelumnya. rekombinan kemudian disebar dalam media LB agar yang mengandung 100 ppm ampisilin. Sel yang bukan rekombinan akan mati akibat perlakuan ampisilin. Selanjutnya, sebanyak 10 klon diambil dan dianalisis dengan PCR koloni. Hasil PCR koloni diverifikasi dengan elektroforesis gel agarosa 1%.
Plasmid dari rekombinan diisolasi dengan menggunakan $
- 2 (Roche). Isolasi dilakukan sebagaimana yang terurai dalam . % Roche. Hasil isolasi DNA plasmid diverifikasi dengan elektroforesis gel agarosa 1%.
Penentuan Kadar Protein dengan Metode
Lowry (Lowry 1951)
Pengujian kadar protein dan aktivitas endoglukanase dilakukan terhadap pelet dan supernatan sel rekombinan. Sebanyak 25 mL sel yang telah ditumbuhkan selama semalam pada suhu 37 oC dipanen dan disentrifus dengan kecepatan 10000 rpm selama 10 menit 4oC. Supernatan dipisahkan dari peletnya untuk dilakukan uji kadar protein dan aktivitas endoglukanase, sedangkan pelet ditambahkan 1 mL bufer lisis (50 mM Tris HCl pH 8.0, 5 mM EDTA, 10 mM NaCl) dan digerus dengan mortar lalu disentrifus dengan kecepatan 12000 rpm selama 10 menit 4oC. Supernatan diambil dan disimpan dalam & untuk dilakukan analisis kadar protein dan aktivitas endoglukanase.
Sebanyak 50 RL sampel dimasukkan ke dalam Eppendorf lalu ditambahkan 300 RL reagen C. Campuran divorteks dan didiamkan selama 10 menit. Selanjutnya, campuran ditambahkan 100 RL reagen D kemudian divorteks kembali dan didiamkan selama 30
menit. Campuran dibaca serapannya pada panjang gelombang 750 nm. Pengukuran dilakukan secara triplo dan larutan standar yang digunakan adalah standar BSA (!
' ).
Pengukuran Aktivitas Endoglukanase
dengan Metode DNS (Modifikasi Ghose 1987)
Sebanyak 50 RL ekstrak enzim kasar yang telah diisolasi dimasukkan ke dalam tabung reaksi lalu ditambahkan 250 RL larutan CMC (karboksimetil selulosa) 2% dan 200 RL bufer fosfat pH 4.8 hingga volume akhir campuran 500 RL. Campuran ditutup dengan aluminum foil kemudian dikocok dengan vorteks. Selanjutnya campuran diinkubasi pada suhu 48 oC selama 60 menit dan dipanaskan kembali 100 oC selama 10 menit untuk menghentikan reaksinya. Campuran ditambahkan reagen DNS sebanyak 1.5 mL lalu dipanaskan pada suhu 100 oC selama 15 menit. Campuran didinginkan selama 20 menit dan serapannya dibaca pada panjang gelombang 575 nm. Pengukuran dilakukan secara triplo. Media LB digunakan sebagai blanko untuk ekstrak enzim kasar dari supernatan, sedangkan blanko untuk ekstrak enzim kasar dari pelet menggunakan bufer lisis. Nilai konsentrasi gula pereduksi yang dihasilkan dikonversi dari nilai absorban yang terbaca melalui kurva standar, dengan glukosa sebagai larutan standar. Satu unit aktivitas enzim endoglukanase sebanding dengan satu Rmol glukosa yang dihasilkan per menit, dengan perhitungan: " + & ) ( !% ( ' 4 ( # ( . ) ( ) ( ] [
Aktivitas spesifik enzim dihitung dengan rumus: ) / ( ) / ( / + 2 + ( .
Analisis Data Aktivitas Enzim
Rancangan percobaan yang digunakan dalam penelitian ini yaitu RAL (rancangan acak lengkap) dua faktor (Mattjik & Sumertajaya 2002) dengan model linear sebagai berikut:
Yij= O + Ai+ Bj+ (AB)ij
Yij = pengamatan aktivitas endoglukanase
pada perlakuan sumber enzim ke i dan jenis plasmid ke j.
O = rataan umum
Ai = pengaruh perlakuan sumber enzim
ke i.
Bj = pengaruh perlakuan plasmid ke j
(AB)ij= pengaruh interaksi perlakuan sumber
enzim ke i dan perlakuan jenis plasmid ke j.
i = supernatan, pelet j = kontrol, pGEM T, pYES
Bentuk hipotesis yang diuji: Pengaruh utama faktor A:
H0 = A1 = … = Aa = 0 (faktor A tidak
berpengaruh)
H1= paling tidak ada satu i dimana Ai≠0
Pengaruh utama faktor B:
H0 = B1 = … = Bb = 0 (faktor B tidak
berpengaruh)
H1= paling tidak ada satu i dimana Bj≠0
Pengaruh sederhana (interaksi) faktor A dan faktor B:
H0 = (AB)11 = … = (AB)ab = 0 (interaksi
faktor A dengan faktor B tidak berpengaruh)
H1 = paling tidak ada sepasang (ij) dimana
(AB)ij≠0
Hipotesis diuji dengan ANOVA dengan nilai α= 0.05. Nilai H0 ditolak bila nilai p
kurang dari α. Hasil analisis sidik ragam dilanjutkan dengan uji Duncan.
HASIL DAN PEMBAHASAN
Isolasi RNA Total
RNA total dari dan telah berhasil diisolasi dengan menggunakan1 % 2 . Hal ini dapat dilihat pada Gambar 5. Hasil elektroforesis gel agarosa 1% menunjukkan bahwa RNA dari kapang dan
telah berhasil diisolasi. Hal ini dapat dilihat dengan adanya dua pita yang utuh berupa rRNA yang berukuran 28S dan 18S. Sambrook & Russell (2001) menjelaskan bahwa adanya kedua pita tersebut mengindikasikan bahwa RNA tersebut memiliki integritas yang baik.
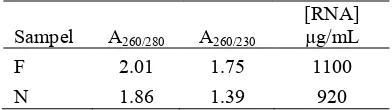
Kuantitas RNA yang telah diisolasi diukur dengan metode spektrofotometri. Hasil pengukuran kuantitas RNA yang diperoleh dari perbandingan A260/280 berkisar antara
1.86 2.01, sedangkan rasio A260/230 berkisar
antara 1.39 1.75. Rasio A260/280menunjukkan
kemurnian RNA terhadap kontaminan protein, sedangkan rasio A260/230 menunjukkan
kemurnian RNA terhadap polisakarida. Menurut Sambrook & Russell (2001), RNA memiliki kemurnian yang tinggi jika rasio A260/280 sebesar 1.80 2.00. Berdasarkan Tabel
1, dapat diketahui bahwa sampel memiliki kemurnian yang tinggi terhadap kontaminan protein.
Secara umum, tahapan isolasi RNA meliputi pemecahan dan solubilisasi membran, isolasi dan pemurnian RNA, serta pemekatan RNA. Pemecahan sel kapang dilakukan dengan cara digerus di dalam mortar dengan penambahan nitrogen cair. Penambahan nitrogen cair ini bertujuan untuk menjaga RNase dalam keadaan tidak aktif sehingga RNA yang diisolasi tidak mengalami degradasi oleh RNase. Selain itu, pembekuan sampel dengan penambahan nitrogen cair memudahkan dalam proses penggerusan.
Bufer RLT yang terdapat pada 1 % 2 mengandung guanidin tiosianat yang berfungsi untuk melisis sel dan mengendapkan protein. Bufer RW1 mengandung etanol dan guanidin tiosianat dalam jumlah sedikit untuk menghambat aktivitas nuklease (Qiagen 2006). Tahap ekstraksi sel dilakukan dengan penambahan β merkaptoetanol sebagai antioksidan agar RNA tidak rusak. Sementara itu, bufer RPE berfungsi sebagai bufer pencuci untuk menghilangkan membran (Qiagen 2006). Tahap pemekatan RNA dilakukan dengan cara pengendapan menggunakan etanol 96%.
F N
Gambar 5 Hasil elektroforesis RNA total (F) dan (N).
Tabel 1 Konsentrasi dan kemurnian RNA hasil isolasi
Sampel A260/280 A260/230
11
Kuantitas dan kualitas RNA yang baik akan mempengaruhi keberhasilan sintesis cDNA. Hal ini dikarenakan proses RT PCR yang melibatkan sintesis cDNA membutuhkan RNA dengan kemurnian yang tinggi. Menurut Budiani (2004), selain spesifitas primer, suhu penempelan dan konsentrasi MgCl2,
keberhasilan reaksi RT PCR juga sangat ditentukan oleh kualitas dan kuantitas RNA yang digunakan.
Perancangan Primer
Sekuen primer yang digunakan untuk amplifikasi PCR dapat mempengaruhi spesifitas dan sensitivitas reaksi. Perancangan primer dilakukan pada daerah terkonservasi dari sekuen gen penyandi endoglukanase yang terdapat pada situs NCBI dengan nomor akses XM 745547 untuk
Af293 dan AF331518 untuk
. Primer dirancang dengan memperhatikan beberapa parameter, meliputi panjang primer, %G+C, suhu penempelan dan Tm ( ), kestabilan ujung basa 5’ dan spesifitas ujung basa 3’ (Abd Elsalam 2003). Kriteria primer yang digunakan untuk amplifikasi yaitu panjangnya berkisar antara 18 25 pasang basa, panjang sepasang primer tidak lebih dari 3 pasang basa, memiliki jumlah basa G+C 40 60%, pasangan primer / dan tidak saling komplemen, tidak terjadi primer dimer antara / dan , pada ujung 3’ tidak mempunyai basa nukleotida T, dan memiliki (Tm) tidak melebihi 70oC (Sambrook & Russell 2001).
Sekuen primer / dianalisis menggunakan sekuen daerah
dengan urutan basa 5′ ATGAAATTCGGTAGCATTGTGC 3′ dan daerah dengan urutan basa 5′ CGCATGAAGTTTCAGAGCAC 3′ (Tabel 2). Sekuen primer untuk daerah
dan masing masing adalah
5’ TCAACCCAGGTAGGGCTCCA 3‘ dan 5‘ CCAGACCTCAAAGATATGCC 3’.
Amplifikasi Gen Penyandi Endo β 1,4 glukanase
Amplifikasi gen dilakukan dengan menggunakan teknik RT PCR. Sintesis cDNA merupakan tahap awal untuk memulai amplifikasi gen dari sampel RNA. Reaksi sintesis * cDNA membutuhkan sebuah primer. Primer yang digunakan adalah oligo (dT) dengan tujuan agar mudah terhibridisasi dengan poli(A) pada ujung 3’ yang umum dijumpai pada mRNA sel eukariot (Invitrogen 2003). Konsentrasi yang digunakan untuk sintesis adalah 2 ng/OL dan hasil cDNA yang diperoleh berjumlah seragam. Prinsip dari proses ini adalah transkripsi balik dengan menggunakan enzim yang memiliki aktivitas RNA DNA polimerase, DNA DNA polimerase, dan RNase H
(Sambrook & Russell 2001)
. RNase H ini akan mendegradsi RNA dari molekul RNA cDNA hibrida yang terbentuk setelah cDNA terbentuk.Setelah diperoleh utas cDNA, selanjutnya dilakukan proses PCR konvensional menggunakan primer spesifik Dengan mengoptimasi kondisi PCR, pada awalnya suhu penempelan dilakukan pada 60oC untuk sampel dan 57oC untuk sampel . Penerapan suhu ini berdasarkan pada Tm primer yaitu 5 10oC di bawah Tm primer (Sambrook & Russell 2001). Amplifikasi gen endoglukanase
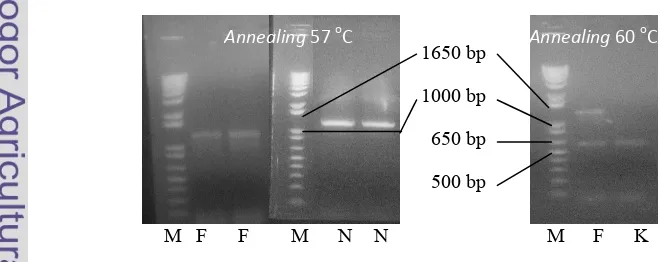
dengan menggunakan pasangan primer tersebut pada 60 oC menghasilkan dua pita yang berukuran sekitar 600 bp dan 1300 bp, sedangkan amplifikasi gen penyandi endoglukanase dengan 57oC menghasilkan pita berukuran sekitar 1300 bp (Gambar 6).
Tabel 2 Karakteristik pasangan primer dan
Sekuen Ukuran Konsentrasi (nmol)
Tm %GC
+*": 5’ ATGAAATTCGGTAGCATTGTGC 3′ 22 46.1 65 40.9
+* : 5’ TCAACCCAGGTAGGGCTCCA 3‘ 20 52.4 69 60.0
+*": 5’ CGCATGAAGTTTCAGAGCAC 3′ 20 51.2 64 50.0
Pita elektroforesis yang berukuran 600 bp pada 60 oC diduga bukan merupakan gen target. Pada suhu tersebut dapat dilihat bahwa perlakuan pada kontrol negatif juga menghasilkan pita yang berukuran sekitar 600 bp. Jika dibandingkan dengan ukuran gen yang terdapat pada NCBI maka ukuran gen tersebut jauh berbeda. Pada situs NCBI diketahui bahwa ukuran gen penyandi endoglukanase sebesar 921 bp. Dengan pertimbangan tersebut, suhu amplifikasi gen penyandi endoglukanase diturunkan menjadi 57 oC untuk mendapatkan suhu yang optimal. Hasil amplifikasi gen penyandi endoglukanase pada 57 oC menghasilkan satu buah pita berukuran sekitar 1300 bp (Gambar 6).
Pita amplifikasi gen penyandi endoglukanase diduga merupakan gen target. Hal ini dapat dilihat pada hasil amplifikasi gen penyandi endoglukanase
yang menghasilkan satu buah pita berukuran 1300 bp (Gambar 6). Jika ukuran pita ini dibandingkan dengan ukuran gen yang terdapat pada NCBI maka ukuran pita ini sama dengan ukuran gen penyandi endoglukanase yang terdapat pada NCBI yaitu 1303 bp. Namun, untuk lebih yakin bahwa pita yang berukuran 1300 bp tersebut merupakan gen penyandi endoglukanase perlu dilakukan pengurutan sekuen dan dianalisis dengan bioinformatika. Kedua pita DNA dengan 57 oC dimurnikan dari gel untuk selanjutnya dilakukan pengklonan ke sel .
Pengklonan Fragmen DNA dengan Vektor pGEM T
Tahapan pengklonan meliputi ligasi, transformasi, seleksi transforman, dan PCR koloni. Ligasi dilakukan dengan cara menggabungkan fragmen DNA dengan vektor pengklonan pGEM T (Promega). Vektor
ini disebut juga vektor T karena memiliki basa timin pada ujung 3’ sehingga vektor ini dapat menempel dengan fragmen DNA hasil amplifikasi yang memiliki kelebihan basa adenina (A) tanpa adanya tahap pemotongan dengan enzim restriksi. Proses ligasi dikatalisis oleh enzim ligase sehingga terbentuk plasmid rekombinan.
Selanjutnya, hasil ligasi ditransformasikan ke sel galur XL1' yang telah dibuat kompeten dengan perlakuan CaCl2. Titik kritis
pada proses transformasi yaitu pada tahapan
( (kejut panas) dengan tujuan membuka pori membran sel dan mengaktifkan protein Hsp ( ( ). Prinsip utama dari tahap ini yaitu terjadi lompatan suhu dari 0 oC ke 42 oC terhadap sel yang telah diberi perlakuan CaCl2. Garam tersebut
akan mempengaruhi membran sel sehingga pada saat terjadi lompatan suhu, membran menjadi permeabel terhadap molekul asing. Hal ini memudahkan plasmid rekombinan masuk ke dalam sel.
Tahap selanjutnya yaitu seleksi transforman dengan metode koloni putih biru (' / ) pada media yang mengandung antibiotik ampisilin, IPTG, dan X gal. Keberhasilan penyisipan fragmen DNA ditunjukkan oleh adanya koloni putih yang tumbuh pada media seleksi (Gambar 7). Koloni yang terbentuk pada media seleksi adalah bakteri yang memiliki plasmid. Bakteri tersebut berhasil ditransformasi, sedangkan yang tidak tertransformasi akan mati akibat perlakuan ampisilin. Adanya X gal (5 bromo 4 kloro 3 indol β D galaktopiranosida) dan IPTG (isopropil tiogalaktosidase) dapat digunakan untuk membedakan antara plasmid rekombinan dengan plasmid yang bukan rekombinan. Koloni yang berwarna putih menunjukkan sel yang mengandung plasmid yang berhasil diinsersi, sedangkan koloni yang berwarna biru mengandung plasmid yang tidak berhasil diinsersi.
M F F M N N M F K
Gambar 6 Hasil RT PCR gen target; (M) marker, (F) , (N) , dan (K) kontrol negatif.
Annealing 60 oC Annealing 57 oC
1650 bp
1000 bp
650 bp
13
Gambar 7 Seleksi transforman
rekombinan dengan vektor pGEM T .
Seleksi transforman dengan metode ' / belum tentu sesuai dengan teori. Hal ini dikarenakan produk yang dihasilkan pada proses ligasi tidak saja mengandung plasmid rekombinan tetapi juga produk produk lain, seperti vektor yang tidak tersambung ( ), fragmen DNA yang tidak tersambung dengan vektor (tidak terligasi), vektor yang tersambung tetapi tidak mengandung gen sisipan ( ), dan plasmid rekombinan dengan gen sisipan yang berbeda (Old & Primrose 1989). Oleh karena itu, perlu dilakukan proses PCR koloni untuk menghindari kesalahan seleksi transforman. Tahap ini sebagai konfirmasi untuk meyakinkan bahwa fragmen DNA telah berhasil disisipkan. Melalui proses ini, gen yang disisipkan diamplifikasi menggunakan primer spesifik dengan terlebih dahulu dilakukan lisis sel. Proses PCR koloni hampir sama dengan PCR biasa, hanya saja pada pada proses ini perlu dilakukan lisis sel rekombinan terlebih dahulu dengan mesin PCR.
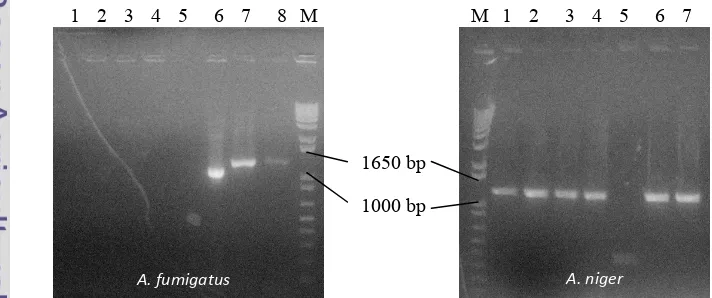
Produk PCR koloni diverifikasi pada gel agarosa 1% dengan membandingkan ukuran pita produk PCR koloni dengan ukuran pita hasil amplifikasi fragmen DNA. Gambar 8 memperlihatkan bahwa fragmen DNA telah berhasil disisipkan ke XL1 ' . Hal ini terlihat dengan adanya pita yang berukuran
sekitar 1300 bp pada elektroforegram dan .
Setelah dilakukan PCR koloni, dilakukan isolasi plasmid dari sel yang menunjukkan hasil positif pada PCR koloni (adanya pita amplifikasi) untuk selanjutnya disekuen dan dikarakterisai lebih lanjut. Gambar 9 menunjukkan elektroforegram hasil isolasi DNA plasmid dengan $
- 2 (Roche). Ukuran pita yang dihasilkan tidak berbeda dengan perkiraan ukuran plasmid rekombinan yaitu sekitar 4315 bp (ukuran pGEM T yaitu 3015 bp dan ukuran gen target sekitar 1300 bp). Dari hasil tersebut dapat dikatakan bahwa frgmen DNA target telah berhasil disisipkan ke dalam sel XL1 ' melalui vektor pGEM T .
Pada dasarnya isolasi DNA plasmid prinsipnya hampir sama dengan isolasi DNA kromosom. Hanya saja terdapat perbedaan dalam segi ukuran antara DNA plasmid dengan DNA kromosom. Perbedaan yang paling signifikan adalah dari segi ukuran. Ukuran DNA plasmid jauh lebih kecil dibandingkan dengan DNA kromosom. Selain itu, DNA plasmid memiliki perbedaan konformasi dengan DNA kromosom.
Bufer suspensi yang terdapat dalam $ - 2 mengandung Tris HCl yang memiliki kemampuan untuk menyerap ion (H+ dan OH ) sehingga dapat menjaga larutan berada pada tingkat pH yang stabil dan EDTA sebagai pengkelat ion magnesium untuk menghambat kerja enzim yang dapat mendegradasi DNA. Bufer lisis yang mengandung NaOH dan SDS berfungi melisis sel dan denaturan DNA non superkoil (Roche Applied Science 2004). Bufer ini juga akan mengendapkan sebagian besar protein dan RNA sehingga dapat dipisahkan dengan sentrifugasi.
1 2 3 4 5 6 7 8 M M 1 2 3 4 5 6 7
Gambar 8 Hasil elektroforesis PCR koloni dengan plasmid pGEM T .
A. fumigatus A. niger
1650 bp
1000 bp
M F N N
Gambar 9 Hasil elektroforesis isolasi pasmid pGEM T E ; (M) marker, (F)
, dan (N)
Analisis Sekuen Gen
Sekuen fragmen DNA yang diperoleh dari proses amplifikasi menggunakan primer spesifik menghasilkan pita dengan ukuran berkisar antara 1000 1600 bp. Besarrnya ukuran fragmen DNA yang diperoleh tidak dapat dipastikan. Oleh karena itu, perlu dilakukan analisis fragmen DNA yang telah diamplifikasi dengan cara disekuen yang selanjutnya sekuen tersebut dianalisis lebih lanjut dengan bioinformatika.
Hasil analisis sekuen fragmen DNA dengan program BLAST menunjukkan bahwa gen yang telah diisolasi merupakan gen penyandi endoglukanase dan
. Hal ini terlihat pada nilai skor yang lebih dari 150 (Tabel 3 dan Tabel 4). Tingkat
kehomologian dapat dilihat pada nilai skor (bits) dan E . Semakin tinggi nilai skor (bits), semakin tinggi pula tingkat kehomologiannya. Sebaliknya, semakin rendah nilai E , semakin mirip gen tersebut dengan yang ada pada# ! (. Di dalam dunia sekuen, untuk memastikan adanya homologi E harus kurang dari e 04 (Claverie & Notredame 2003).
Similiaritas mengindikasikan homologi suatu gen atau protein. Hasil penyejajaran nukleotida menunjukkan bahwa sekuen gen penyandi endoglukanase
memiliki kemiripan 99% dengan sekuen AFUA_6G07480 yang merupakan gen penyandi endoglukanase Af293, sementara sekuen gen penyandi endoglukanase memiliki kemiripan 99% dengan sekuen 1 . Dua gen atau fragmen DNA dikatakan homolog apabila 70% nukleotidanya atau 25% urutan asam aminonya identik, dengan panjang urutan minimal 100 (Claverie & Notredame 2003). Hasil ini menunjukkan bahwa gen penyandi endoglukanase dari kapang
dan telah berhasil diisolasi. Tampilan grafik BLAST menunjukkan tingkat kehomologian sekuen gen yang diisolasi dengan yang ada pada bank gen. Homologi relatif tinggi dicirikan dengan garis warna merah tua. Garis warna merah muda menunjukkan tingkat homologi berkisar antara 80 200 nukleotida. Untuk warna hijau menunjukkan tingkat kehomologian sedang, warna biru kurang bagus, dan warna hijau paling buruk tingkat kehomologiannya.
Tabel 3 Analisis BLAST sekuen fragmen DNA
Gen yang bersesuaian (! ) E
Af293 5 396 2e 107
NRRL 181 374 6e 101
) 317 1e 83
( / 313 6e 83
5 312 1e 82
- * *6 312 1e 82
Tabel 4 Analisis BLAST sekuen fragmen DNA
Gen yang bersesuaian (! ) E
( / 408 6e 114
5 411 2e 112
- * *6 366 1e 99
An07c0310 318 3e 93
! 318 3e 93
BCRC 31494 318 3e 93
15
GGGGCCGACGTCGCATGCTCCCGGCCGCCATGGCGGCCGCGGGAATTCGATTATGA
AATTCGGTAGCATTGTGCTCATTGCTGCTGCGGCAGGCTTCGCGGTGGCTGCTCCTG
CAAAGAGAGCTTCGGTATTTCAATGTTGGTTCCCTGTGGTAAGTTGGATTAAAAGG ACACTAACATACTGCAGGGTTCGGAAGCAATGAGTCTGGAGCAGAGTTTGGCGAAA ATACCATTCCTGGCTCTTATGTATGTTGTGCATCTGAGAGAAGTATACTGCTGCTGA CAACATCAAGGGGAAAGAATTCATCTTCCCGGACCCTTCTACAATCAGCACATTGA TCGGGAAGGGCATGAACATCTTCCGGATTCAATTCCTCATGGAGAGACTGGTGCCA AGCTCTATGACAGGCTCCTATAATGAGGAGTACCTTGCCAATCTGACATCGGTGGG TTTGAGCAGCAGCATGTTGGACTGTATGAGGCTGACTCGACCAGGTTGTGGACGCT GTCACCAAGGCAGGATCTTATGCTATTTTGGACCCACACAACTTTGGCAGATAGTG AGTAATGCCCGGCATACTGTGGACTTGTTCTACGCCACTCAGCAATGGTCAGATTAT CTCCAGCACCGACGACTTCAAAACTTCTGGCAAATCTGGCTGGAAGTCAGTCCACA TCTCGTCTCTTGAACTAGATGGCTACTCTTGGTCTGATAGCTCCTGACCCGAGTAAC ATGGTTCCGACTGACCACCTGGTCGACTCACCGGCGCTACACGATCCGCTGGGACC CTCGATATCTTGGAGCATCTGACGGCTGACTGCCACTAAAACTAGTACCCCCCGAA ATCCCAAGCCCTTCCCTAGTCCCCGAATGTTCCCATGAGCGTTCCCAAGCAAAAAGT TTTTTTTGGCTAGCCCTTTAGGATTCAAAAGAGGTGGGCGGGATAACCCGTTTGTTA CGTATTCCCCCACCATTTTTTTTTTTTTCCAAAAAGGTTCCCC
CCCCCCGGGTGGGGATACAAATTAAGCCCCCGAAAATTTCGGGCCAATTTTTGAAA ACCCGGAATGGGGGAACTTTTTTTTGGATCGCCAAAAAATTCCCCTTACCCTTGGGG GAATCGTTTTCCGGAGGGCATTACGTTTAAGGACCCCATCCTGGGTTGCCCCATGCT TAAGTTTCCAGTTGACCGTCCAGCAGATTTATTTTGGCCCCAANTTGCAAAGGAAAA CCCGCATTTGGACTTTTAACCCATCACAATGTCAATATTCCACACCGAGGATTCAAG CCTTTGGCAAATTTGGTGGAAAGTCAAGTCCAACAATCTGTCATTTTGATACTAGTA GGCTAACTCATTGGTTTTGATGAGCTTCACTGACCCCGGATGTAGACAATGAGTATC ACGACATGACCAGACACTGGTACTGAACCTCAACCAGGCCGCTATCAACGGTATCC GCGCTGCAGGAGCCACCTCGCAATACATCTTTGTGGAGGGCAACTCCTGGACCGGC GCCTGGACCTGGGCCGACGTCAATGACAACCTGAAGGCTCTGACCGACCCCCAGGA TAAGATCGTCTACGAGATGCACCAGTATCTCGACTCGGATGGATCCGGCACCGCGG AGAGCTGCGTGTCTACCACGATTGGTAAGGAGCGGGTTTCGGCCGCAACAAAGTGG CTCAAGGATAACGGCAAGGTTGGCATCATTGGTGAGTTCGCTGGTGGCGTCAATGA TCAGTGCCGGACCGCTATTTCAGGAATGCTGGAGTACTTGGCTCAGAACACAGACG TGTGGAAGGGAGCTCTCTGGTGGGCGGCTGGCCCCTGGTGGGGAAACTATATGTTC AACATGGAGCCTCCGAGCGGTGCAGCTTATGTGGGCATGTTGGACATCTTGGAGCC
CTACCTGGGTTGAATCACTAGTGAATTCGCGGCCGCCTGCAGGTCGACCATATGGG
AGAGCTCCCAACGCGTGGATGCATAGCTGAGTATCTATAGGTC Hasil pengurutan sekuen frgmen DNA
yang diperoleh menunjukkan bahwa ukuran gen yang teramplifikasi sekitar 1300 bp. Gambar 10 dan Gambar 11 menampilkan sekuen gen penyandi endoglukanase
dan yang telah diisolasi. Warna biru merupakan sekuen vektor pGEM T , sedangkan warna merah menunjukkan sekuen primer. Besarnya ukuran gen yang diperoleh belum dapat dipastikan secara tepat.
Analisis penyejajaran ( ) sekuen fragmen DNA antara / dan
dengan menggunakan program komputer
! belum dapat mempertemukan ujung ujung sekuen fragmen tersebut (data tidak ditunjukkan). Hal ini dikarenakan hasil pengurutan sekuen yang diperoleh kurang panjang, hanya dapat membaca urutan gen sekitar 400 500 bp dalam satu arah (Aminingsih 2005).
(A)
(B)
ATTGAGGCCCGACGTCGCATGCTCCCGGCCGCCATGGCGGCCGCGGGAATTCGATT
CGCATGAAGTTTCAGAGCACTCTGCTTCTTGCCGCCGCGGCTGGTTCCGCGTTGGCT
GTGCCTCATGGTCCTGGACATAAGAAGAGGGCGTCTGTGTTTGAATGTAAGCTTCC ATTTGCATTGTTGTCTCGAAGCTGACAACATAGGGTTCGGATCGAATGAGTCGGGT GCTGAATTTGGGACCAATATCCCTGGGGTTTGGGTATGTATCATTGCCAAAGTATA GGCGTATGCTGATGTCGCAGGGAACCGACTACATCTTCCCCGACCCCTCTGCCATCT CTACGTTGATTGACAAGGGGATGAACTTCTTCCGCGTCCAGTTCATGATGGAGAGG TTGCTGCCCGACTCAATGACTGGCTCATATGATGAGGAGTATCTGGCCAATTTGAC GACAGTAAGATGACTCCAGCCTGTGTTGAGTAGTGCTGACGAGTTAGGTGATAAAA GCGGTACGGACGGAGGCGCTCATGCCCTTGTTGACCCTCACAACTATGGCAGATAG TAAGTATGCAGTCCCCGTAGGTGATGCTTGCTAACAAACAGCAACGGCGAGATCAT CTCCAGCACGTCGGACTCCAGACCTTCTGGGAGACCTGGCGGGCCAGTACAAGATA CGACCTGGTCATGTTTGACCTAGTAGTACCACATCCGTCAGAATCTTGCTGACAGG CAAAAACGATTCCGACTGGACAGGATCCTGCTGACTCACCAGCAGCATACGGATCG CCCGAGTGCACAGCATAATCTCTCAAGACTCTGACCGGCCTGATGGTCACTCCCCC TGAATTCCACCCAAAATTTTTATGCCTCTATCAGTCGCCCAACGGTCAACAAAAGG CTAACCGGTGAAAAGGCTTAAACGGGCAATTAGCGGGAGAAAAAAAAAGGGGGG CGGGATTCCCAACGTTAATTTATTCCCCCCAATTTTTTTTTTTTCAAA
AAACCTAAAGAAGGCCCCCCAGTTGGGAAATCAAAATAAGCCCCCGGTTATTTCGT TTCTGAAGGTTATCTTTGAAAGTAAGGGAGCACGGGGTTCCAATGTGGTCGGCCAC TCCCTTCTTCTGTCAGGATTTCCCATAATGGGTCCGCCAACGCTAAAGGATTGCATG CCATAGGCTCCCTGTGTAGCGCGATAGTTAAAGTACGAGGGCCTCACCCTTGCCTC CACTAGCAAATAGTAGCATCCGTAGGAGCTGTACAACACACGGGAATATTCACAGT GGATTCAGCCTTTGGAGAACTGCGGCCAGACAAGAAACGACTGTCATGTTGACACT AGTAGTACCCCCATCCCGTCAAGAATCATGCTGACAAGCAGACAACGAATATCACG ACATGGACCAGATCTCGTGCTGAACCTCAACCAAGCAGCCATTAACGGCATCCGCG CCGCAGGTGCGACCAGCCAGTACATCTTCGTCGAAGGCAACTCCTGGACCGGCGCC TGGACGTGGGTCGACGTCAACGACAACATGAAGAATTTGACCGACCCCGAAGACA AGATCGTCTATGAAATGCACCAGTACCTAGACTCCGACGGTTCCGGCACCTCGGAG ACCTGCGTGTCCGAGACCATCGGAAAAGAGCGGGTCACTGAAGCTACACAGTGGC TGAAGGACAATAAGAAGGTCGGCTTCATAGGCGAATATGCCGGGGGTTCCAATGA TGTATGTCGGAGTGCCGTGTCGGGGATGCTGGAGTACATGGCGAATAACACGGACG TATGGAAGGGTGCGTCGTGGTGGGCAGCCGGGCCATGGTGGGGAGACTACATTTTC AGCCTGGAGCCCCCAGATGGAACTGCGTACACGGGTATGCTGGATATCCTGGAGGC
ATATCTTTGAGGTCTGGAATCACTAGTGAATTCGCGGCCGCCTGCAGGTCGACCAT
ATGGGAGAGCTCCCAACGCGTTGGATGCATAGCTGAGTATTCTATAGGTC (A)
(B)
Gambar 11 Sekuen gen penyandi endoglukanase ; (A) sekuen / dan (B) sekuen .
Konstruksi Gen Penyandi Endo 1,4 β glukanase ke Vektor pYES2/CT
Konstruksi gen ke dalam sel khamir diawali dengan pengklonan gen ke sel XL1 ' dengan vektor ekspresi untuk dilakukan propagasi. Hal ini dilakukan karena transformasi langsung ke dalam sel khamir memiliki tingkat keberhasilan yang rendah. Rendahnya tingkat keberhasilan ini dikarenakan khamir merupakan sel eukariot yang memiliki dinding sel yang lebih tebal daripada bakteri sehingga perlu dilakukan
penghilangan dinding sel khamir untuk mendapatkan protoplas yang bersifat utuh ( ). Proses propagasi juga dilakukan untuk memperoleh plasmid rekombinan (pYES2/CT + gen sisipan) yang lebih murni. Menurut Ito . (1983), pada umumnya transformasi ke sel khamir dilakukan terhadap protoplas dengan bantuan enzim yang mendegradasi dinding sel khamir atau melalui perlakuan kation alkali seperti litium asetat.
17
pGEM T yang membawa gen penyandi endoglukanase dipotong dengan enzim restriksi. Pemotongan dilakukan dengan cara pemotongan ganda dengan enzim yang berbeda yaitu RI dan I. Hal serupa juga dilakukan untuk vektor ekspresi pYES2/CT dengan perlakuan yang sama. Pemotongan dengan dua enzim ini akan menghasilkan ujung lengket sehingga memudahkan proses ligasi fragmen DNA ke vektor ekspresi. Pada Gambar 12 dapat terlihat bahwa pemotongan dengan enzim restriksi menghasilkan 2 pita yang berbeda ukuran. Sementara pada vektor pYES2/CT hanya menghasilkan satu pita. Selanjutnya pita pGEM T yang berukuran lebih kecil dan pita pYES2/CT dimurnikan dari gel untuk dilakukan ligasi dengan vektor pYES2/CT.
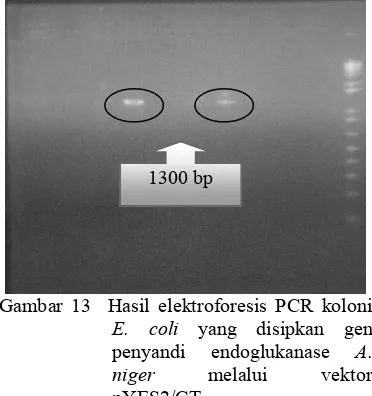
Penyisipan gen penyandi endoglukanase melaui vektor pYES2/CT ke sel sama seperti prosedur sebelumnya. Hanya saja seleksi transforman dilakukan dengan menumbuhkan sel dalam media yang mengandung ampisilin 100 ppm. Sel yang bukan rekombinan akan mati akibat perlakuan ampisilin. Sebagai konfirmasi untuk meyakinkan bahwa yang tumbuh merupakan sel rekombinan, dilakukan PCR koloni dengan menggunakan primer spesifik. Hasil PCR koloni menggunakan primer spesifik ditunjukkan pada Gambar 13. Berdasarkan hasil tersebut, dapat diketahui bahwa pada koloni nomor 4 dan 7 mengandung gen sisipan. Artinya, gen penyandi endoglukanase telah berhasil dipropagasi ke sel XL1' .
M G G Y Y
Gambar 12 Pemotongan dengan enzim restriksi RI dan I; (M) marker, (G) vektor pGEM T , dan (Y) vektor pYES2/CT.
1 2 3 4 5 6 7 8 9 10 M
Gambar 13 Hasil elektroforesis PCR koloni yang disipkan gen penyandi endoglukanase
melalui vektor pYES2/CT.
Uji Ekspresi Gen Penyandi Endo 1,4 β glukanase
Uji ekspresi dilakukan dengan mengukur aktivitas endoglukanase yang diinsersi gen penyandi endoglukanase. Seharusnya, uji ekspresi dilakukan terhadap sel khamir yang diinsersi gen penyandi endoglukanase. Namum, hal ini dilakukan untuk mengetahui bisa tidaknya vektor pYES2/CT diekspresikan ke sel . Gambar 14 menyajikan data aktivitas spesifik selulase yang diukur dengan metode DNS (Ghose 1987). Prinsip metode ini adalah pengukuran gula pereduksi yang menghasilkan warna jingga menggunakan spektrofotometer dengan panjang gelombang 575 nm. Enzim endoglukanase menghidrolisis selulosa menjadi glukosa. Glukosa tersebut diikat oleh DNS menghasilkan warna jingga. Reaksi yang terjadi yaitu terjadi reaksi oksidasi dari gugus fungsi aldehid menjadi gugus karboksil dan asam 3,5 dinitrosalisilat akan tereduksi menjadi asam 3 amino 5 dinitrosalisilat (Miller 1959).
Uji ekspresi dilakukan terhadap supernatan dan pelet rekombinan. Hal ini dimaksudkan untuk mengetahui ada tidaknya peptida sinyal dalam gen target. Selulase merupakan enzim ekatraseluler yaitu setelah diproduksi di dalam sel kemudian dikeluarkan dari sel ke substrat di sekelilingnya (Fardiaz 1988), namun disekresikannya atau tidak enzim tersebut dapat diketahui melalui ada tidaknya peptida sinyal dalam gen target. Suatu protein dapat disekresikan ke medium ekstraseluler dengan cara memilih peptida sinyal tertentu dari sel eukariot. Menurut Gaffar . (2007), ada beberapa faktor yang dapat mempengaruhi tingkat sekresi protein oleh mikrob, salah 12000 bp
5000 bp 1650 bp 1000 bp
satunya yaitu jenis peptida sinyal. Peptida sinyal biasanya memiliki daerah hidrofobik yang membentuk konformasi α heliks. Daerah ini penting untuk translokasi protein ke retikulum endoplasma sehingga penambahan hidrofobitas akan meningkatkan efisiensi translokasi.
Berdasarkan Gambar 14 dapat diketahui bahwa aktivitas endoglukanase tertinggi terdapat pada supernatan rekombinan pYES2/CT (8.8309 U/mg). Pada supernatan sel rekombinan pGEM T , aktivitas endoglukanase cukup tinggi (1.3295 U/mg) jika dibandingkan dengan supernatan sel kontrol (0.2143 U/mg). Sementara itu, pada pelet rekombinan pYES2/CT aktivitas endoglukanase lebih kecil (0.3247 U/mg) dibandingkan dengan kontrol (0.3844 U/mg), sedangkan aktivitas endoglukanase pada pelet sel rekombinan pGEM T (0.4325 U/mg) sebaliknya.
Berdasrkan uji statistika menggunakan ANOVA menunjukkan bahwa perlakuan dengan sumber enzim yang berbeda dan plasmid yang berbeda berpengaruh nyata terhadap aktivitas spesifik endoglukanase karena nilai p kurang dari α= 0.05. Selain itu, interaksi antara perlakuan sumber endoglukanase dengan perlakuan plasmid yang berbeda juga menunjukkan adanya interaksi karena nilai p kurang dari α= 0.05. Dari hasil tersebut dapat disimpulkan bahwa gen target yang disisipkan ke dalam rekombinan memiliki peptida sinyal. Artinya, gen target yang disisipkan melaui vektor pGEM T dan pYES2/CT dapat diekspresikan walaupun tingkat ekspresi pada vektor pGEM T relatif kecil.
Gambar 14 Aktivitas endoglukanase supernatan ( ) dan pelet ( ) sel rekombinan yang disisipkan gen penyandi endoglukanase .
Menurut Kulp (1975), kemampuan hidrolisis suatu enzim mikrob berbeda beda dan dapat dipengaruhi oleh sumber, substrat, dan tipe uji yang digunakan. Substrat yang digunakan dalam penelitian ini adalah CMC (karboksimetil selulosa) yang spesifik digunakan untuk mengukur aktivitas endoglukanase (Ghose 1987). Sementara tipe uji yang digunakan diacu dari Ghose (1987). Tipe uji ini hampir mirip dengan uji uji gula pereduksi yang lain hanya saja pada metode ini perlu dilakukan penetuan kadar protein sampel. Hal ini dilakukan untuk memperoleh data jumlah protein enzim dalam tiap mililiter cairan enzim (Sa’id 1987).
SIMPULAN DAN SARAN
Simpulan
Fragmen gen penyandi endoglukanase kapang dan telah berhasil diisolasi dengan menggunakan primer spesifik. Hasil pengujian elektroforesis menunjukkan bahwa gen gen tersebut memiliki ukuran sekitar 1300 bp dan analisis BLAST memperlihatkan bahwa gen gen tersebut homolog dengan gen penyandi endoglukanase yang terdapat pada bank gen. Gen penyandi endoglukanase juga telah berhasil dikonstruksi ke vektor ekspresi yang dibuktikan dengan adanya pita elektroforesis hasil PCR koloni. Sementara untuk uji ekspresi gen tersebut menunjukkan bahwa gen target telah berhasil diekspresikan ke sel XL1 ' . Aktivitas endoglukanase tertinggi terdapat pada supernatan sel rekombinan yang membawa vektor pYES2/CT (8.8309 U/mg).
Saran
Saran yang dapat diberikan yaitu diperlukan pemanjangan pengurutan sekuen untuk mendapatkan sekuen gen secara keseluruhan. Uji ekspresi sebaiknya dilakukan terhadap sel khamir yang membawa plasmid rekombinan pYES2/CT untuk memaksimalkan fungsi vektor tersebut. Selanjutnya dilakukan proses fermentasi etanol menggunakan khamir rekombinan tersebut untuk mengetahui efisiensinya.
DAFTAR PUSTAKA
19
Abu EA, Ado SA. 2004. Comparative studies on the effect of organic and inorganic nitrogen supplementation of millet and sorghum pomace on the production of three industrial enzymes by
SL.1.! ( 16: 64 70.
Alexopoulos CJ. 1961.
-% . New York: John Wiley & Sons.
Ali UF, Saad El Dein HS. 2008. Production and partial purification of cellulase complex by and
grown on water hyacinth blend.7
4: 875 891.
Aminingsih T. 2005. Identifikasi dan karakterisasi fragmen DNA genomik kakao ( ' L.) hasil PCR menggunakan primer heterologous+ "8
[tesis]. Bogor: Sekolah Pascasarjana, Institut Pertanian Bogor.
Aprijani DA, Elfaizi MA. 2004. Bioinformatika: perkembangan, disiplin ilmu dan penerapannya di Indonesia.
http://www.bioinformatika.org [26 Maret
2009].
Budiani A, Santoso D, Aswidinnoor H, Suwanto A. 2004. Kloning parsial gen penyandi enoil ACP reduktase dari mesokarp buah kelapa sawit (
Jacq.).% ( ' 72: 28 37.
Claverie JM, Notredame C. 2003.
! 0 . Indianapolis: Wiley Publishing.
Dale JW, Schantz M von. 2002. " # # . New York: John Wiley & Sons.
Fardiaz S. 1988." " Bogor: PAU IPB.
Fardiaz S. 1989. % ( ' . Bogor: Pusat Antar Universitas Pangan dan Gizi, IPB.
Fikrinda. 2000. Isolasi dan karakterisasi bakteri penghasil selulase ektremofilik dari ekosistem air hitam [tesis]. Bogor: Program Pascasarjana, Institut Pertanian Bogor.
Gaffar S, Moeis MR, Natalia D, Soemitro S. 2007. Peningkatan sekresi α amilase melalui manipulasi peptida sinyal dan efisiensi pelipatan protein dalam
[laporan penelitian]. Bandung: Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas Padjajaran.
Gandjar I, Samson RA, Tweel Vermeulen K van den, Oetari A, Santoso I. 1999.
2 ( . .
Jakarta: Yayasan Obor Indonesia.
Gandjar I, Sjamsuridzal W, Oetari A. 2006.
% ( 0 . Jakarta: Yayasan Obor Indonesia.
Ghose TK. 1987. Measurement of cellulase activities. 7 9 59: 257 268.
Howard RL, Abotsi E, Jansen van Rensburg EL, Howard S. 2003. Lignocellulose biotechnology: issues of bioconversion and enzyme production. 7 ! 2: 602 619.
Ikram ul Haq, Javed MM, Khan TS, Siddiq Z. 2005. Cotton saccharifying activity of cellulases produced by co culture of
and .
7 ! 1: 241 245.
Invitrogen. 2003. : "
. Carlsbad: Invitrogen Life Technologies.
Irawan B, Sutihat, Sumardi. 2008. Uji aktivitas enzim selulase dan lipase pada mikrofungi selama proses dekomposisi limbah cair kelapa sawit dengan pengujian kultur murni [laporan penelitian]. Lampung: Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas Lampung.
Ito H, Fukuda Y, Murata K, Kimura A. 1987. Transformation of intact yeast cells treated with alkali cations. 7 ! 153:163 168.
Krikstaponis A, Lugauskas A, Krysinska Traczyk E, Prazmo Z, Dutkiewicz J. 2001. Enzymatic activities of
Kulp K. 1975. Carbohydrates. Di dalam: Reed G, editor. & " . New York: Academic Press.
Lehninger AL. 1982. 0 *0 ! ( 7 ;. Thenawijaya M, penerjemah. Jakarta: Erlangga. Terjemahan dari:
! .
Lelana NE. 2009. Seleksi cendawan potensial penghasil enzim endoglukanase (karboksimetil selulase) dan isolasi gen penyandinya [tesis]. Bogor: Sekolah Pascasarjana, Institut Pertanian Bogor.
Lowry OH, Rosebrough NJ, Farr AL, Randall RJ. 1951. Protein measurement with the Folin phenol reagent. 7 !
193:265 275.
Mattjik AA, Sumertajaya IM. 2002.
' (
% ' 7 6 <. Bogor: IPB Press.
Miller GL. 1959. Use of dinitrosalicylic acid reagent for determination of reducing sugar.7 31:426 428.
Okafor N. 2007. %
-% ' . New
Hampshire: Science Publishers.
Old RW, Primrose SB. 1989.
# %
-# . Oxford: Blackwell Scientific Publication.
Onsori H, Zamani MR, Motallebi M, Zarghami N. 2005. Identification of over producer strain of endo β 1,4 glucanase in species: characterization of crude carboxymethyl cellulase. 7 ! 4: 26 30.
Qiagen. 2006. % $ ' ( =
. Texas: Qiagen.
Roche Applied Science. 2004. $
- 2 . Mannheim: Roche Diagnostics GmbH.
Sa’id EG. 1987. !
( " . Jakarta: Melton Putra.
Sambrook J, Russell DW. 2001. %
+ ' % . New York: Cold Spring Harbor Laboratory Press.
Witarto AB. 2003. Bioinformatika: mengawinkan teknologi informasi dengan bioteknologi, trendnya di dunia dan prospeknya di Indonesia.
http://witarto.files.wordpress.com/2008/01
/witarto bioinformatika.pdf [26 Maret
2009].
Yosakawa D, Shimizu T, Nakagawa R, Ikeda T, Nagashima K. 2003. Cloning, sequencing, and heterologous expression of a cellobiohydrolase cDNA from the Basidiomycete . ! ! ! 67:1319 1326.
Zee M van der. 2005. Biodegradability of polymers: mechanisms and evaluation methods. Di dalam: Bastioli C, editor.
$ ' ( ! ' .
23
25
Lampiran 4 Peta restriksi vektor pGEM T
dan pYES2/CT
Peta restriksi vektor pGEM T
Lampiran 5 Kurva standar protein pada λ = 750 nm
Absorban standar
!
'
[BSA] (Og/ml)
Absorban
0.0
0.000
12.5
0.081
25.0
0.120
50.0
0.194
75.0
0.264
100.0
0.422
150.0
0.503
200.0
0.612
27
Lampiran 6 Kurva standar glukosa pada pada λ = 575 nm
Absorban standar glukosa
[Glukosa] (ppm)
Absorban
0
0.000
100
0.115
200
0.417
300
0.689
400
0.969
500
1.153
Lampiran 7 Kadar protein sel
rekombinan
Kadar protein sel
rekombinan dalam supernatan
Sampel
Absorban
FP
[Protein] (Og/mL)
[Protein] (mg/mL)
Kontrol
0.553
16
2778.7392
2.7787
0.530
16
2663.1677
2.6632
0.473
16
2376.7516
2.3768
pGEM T
0.366
16
1839.0932
1.8391
0.036
16
180.8944
0.1809
0.156
16
783.8758
0.7839
pYES
0.014
16
70.3478<