NUR RACHMAN
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Dengan ini saya menyatakan bahwa tesis berjudul Keefektifan Fosfin Formulasi Cair terhadap Aphis gossypii Glover dan Macrosiphoniella sanborni
Gillette (Hemiptera: Aphididae) pada Bunga Potong Krisan adalah benar karya saya dengan arahan dari komisi pembimbing dan belum pernah diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam daftar pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, April 2015
Nur Rachman
Glover dan Macrosiphoniella sanborni Gillette (Hemiptera: Aphididae) pada Bunga Potong Krisan. Dibimbing oleh DADANG dan R YAYI MUNARA KUSUMAH.
Bunga krisan merupakan salah satu tanaman hias yang banyak diminati oleh masyarakat karena memiliki nilai estetika dan ekonomi yang tinggi. Volume ekspor tanaman hias Indonesia, khususnya bunga krisan, masih relatif rendah dibandingkan dengan negara lain. Hal ini diakibatkan oleh beberapa kendala di antaranya adalah terbawanya organisme pengganggu tumbuhan (OPT) pada bunga yang diekspor. Beberapa hama dapat menyerang bunga krisan, dua di antaranya adalah kutudaun Aphis gossypii Glover dan Macrosiphoniella sanborni Gillette.
Salah satu perlakuan karantina untuk membebaskan komoditas pertanian dari hama adalah fumigasi. Alternatif fumigan yang memiliki keefektifan yang baik adalah fosfin formulasi cair. Tujuan penelitian ini adalah menentukan konsentrasi dan lama pemaparan fosfin formulasi cair yang efektif mematikan A. gossypii dan
M. sanborni pada bunga potong krisan serta mengevaluasi kualitas bunga yang diperlakukan dengan fumigan tersebut.
Penelitian dilaksanakan dalam 5 tahapan: (1) Identifikasi serangga uji; (2) Perbanyakan A. gossypii dan M. sanborni; (3) Uji pendahuluan terhadap fase nimfa instar III dan imago; (4) Aplikasi konsentrasi dan lama pemaparan fosfin formulasi cair terhadap fase nimfa instar III dan imago A. gossypii dan M. sanborni
dan; (5) Uji validasi konsentrasi dan lama pemaparan fosfin formulasi cair yang efektif serta mengevaluasi pengaruh perlakuan terhadap kualitas bunga potong krisan.
Uji pendahuluan menunjukkan bahwa pada konsentrasi tertinggi 300 ppm, aplikasi fosfin formulasi cair terhadap imago atau nimfa instar III A. gossypii dan
M. sanborni dengan lama pemaparan 6 jam dan 12 jam belum dapat mematikan 100% serangga uji. Pada uji lanjut dengan menggunakan konsentrasi 300-700 ppm, persentase mortalitas sebesar 100% terhadap nimfa instar III dan imago A. gossypii
berturut-turut tercapai pada konsentrasi 500 ppm dan 400 ppm, sementara terhadap nimfa instar III dan imago M. sanborni berturut-turut tercapai pada konsentrasi 700 ppm dan 600 ppm, dengan lama pemaparan 12 dan 15 jam. Hasil analisis probit M. sanborni menunjukkan bahwa nilai LC50 dan LC95 terendah
ditunjukkan pada lama pemaparan 15 jam dengan nilai berturut turut 209.8 ppm dan 397.8 ppm untuk fase imago, sedangkan untuk fase nimfa instar III 213.3 ppm dan 539.4 ppm.
Aplikasi fosfin formulasi cair terhadap A. gossypii dan M. sanborni
menyebabkan kematian 100%, berturut-turut pada konsentrasi 500 ppm dan 700 ppm, dengan lama pemaparan 12 jam. Konsentrasi hingga 700 ppm dengan lama pemaparan hingga 18 jam tidak berdampak buruk terhadap kualitas bunga potong krisan.
Glover and Macrosiphoniella sanborni Gillette (Hemiptera: Aphididae) on Cut Flowers Chrysanthemum. Supervised by DADANG and R YAYI MUNARA KUSUMAH.
Chrysanthemum is flowering plant that has high aesthetic and economic values. Export volume of chrysanthemums is relatively low compared to other countries, which could be due to damage caused by insect pest. Insect pests that are usually found are Aphis gossypii Glover and Macrosiphoniella sanborni
Gillette. One control measures usually taken in quarantine is fumigation. Alternative fumigant that has high effectiveness is liquified phosphine formulations. The objectives of this study were to determine the concentration and exposure time of liquified phosphine application against these two pests and to evaluate the effect of fumigant on the quality of flowers.
The experiment was conducted in five stages: (1) Identification of test insect; (2) Mass rearing of A. gossypii and M. sanborni; (3) Preliminary test on adult and third instar nymphs; (4) Determination of liquified phosphine concentration and exposure time to adult and third instar nymphs of A. gossypii
and M. sanborni and; (5) Validation test of effective concentration and exposure time and evaluation of their effects on quality of flowers.
Preliminary test showed that treatment with highest concentration of 300 ppm, with 6 and 12 hours exposure time was not able to provide 100% mortality of test insect. In a futher test that used a concentration 300-700 ppm, the percentage of 100% mortality against third instar nymphs and adult A. gossypii
occured at a concentration of 500 ppm and 400 ppm, while third instar nymphs and adult M. sanborni occurred at a concentration 700 ppm and 600 ppm, respectively, with exposure time 12 and 15 hours. Probit analysis of M. sanborni
showed exposure time 15 hour resulted the lowest of LC50 and LC95 values. LC50
and LC95 values for adult were 209.8 ppm and 397.8 ppm, while third instar
nymphs were 213.3 ppm and 539.4 ppm, respectively.
Concentrations of fumigant causing 100% mortality were 500 ppm and 700 ppm against A. gossypii and M. sanborni, repectively with exposure time of 12 hours. These concentrations until 700 ppm and exposure time until 18 hours did not cause negative impact to the quality of cut chrysanthemum flowers.
© Hak Cipta Milik IPB, Tahun 2015
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
KEEFEKTIFAN FOSFIN FORMULASI CAIR TERHADAP
Aphis gossypii
Glover DAN
Macrosiphoniella sanborni
Gillette
(Hemiptera: Aphididae) PADA BUNGA POTONG KRISAN
NUR RACHMAN
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Entomologi
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang telah dilaksanakan sejak bulan Agustus sampai Desember 2014 ini ialah Keefektifan Fosfin Formulasi Cair terhadap Aphis gossypii Glover dan Macrosiphoniella sanborni Gillette (Hemiptera: Aphididae) pada Bunga Potong Krisan.
Terima kasih penulis ucapkan kepada Prof Dr Ir Dadang, MSc dan Dr Ir R Yayi Munara Kusumah, MSi selaku pembimbing yang telah banyak
memberi saran. Di samping itu, penghargaan penulis sampaikan kepada Dr Ir Pudjianto, MSi selaku Ketua Program Studi Entomologi dan Prof Dr Ir Sri
Hendrastuti, MSc selaku Ketua Program Studi Fitopatologi serta staf pengajar Departemen Proteksi Tanaman IPB yang telah memberikan ilmu selama penulis mengikuti pendidikan sehingga dapat dijadikan bekal penulisan karya ilmiah ini. Ucapan terimakasih juga disampaikan kepada Pimpinan Badan Karantina Pertanian yang telah memberikan beasiswa Program Khusus Karantina pada Sekolah Pascasarjana IPB dan Kepala beserta staf Balai Uji Terap Teknik dan Metode Karantina Pertanian atas bantuan sarana untuk pelaksanaan fumigasi kegiatan penelitian ini. Selain itu terima kasih kepada teman-teman satu angkatan (2013-2014) atas bantuan dan dukungannya.
Ungkapan terima kasih juga disampaikan kepada Bapak, serta seluruh keluarga, atas segala doa dan kasih sayangnya. Akhir kata penulis persembahkan untuk istri tercinta serta ananda Dzakiyya Raeesa Nur Zahra
Semoga hasil karya ini bermanfaat.
Bogor, April 2015
DAFTAR TABEL ix
DAFTAR GAMBAR ix
DAFTAR LAMPIRAN x
PENDAHULUAN 1
Latar Belakang 1
Tujuan Penelitian 2
Manfaat Penelitian 2
TINJAUAN PUSTAKA 3
Tanaman Krisan dan Peranannya sebagai Sumber Devisa 3
Kutudaun pada Tanaman Hias dan Arti Penting Ekonomi 4
Morfologi Kutudaun 6
Biologi dan Ekologi 7
Strategi Pengendalian A. gossypii dan M. sanborni 8
Fosfin Formulasi Cair sebagai Fumigan 9
BAHAN DAN METODE 14
Waktu dan Tempat 14
Alat dan Bahan 14
Penyiapan Serangga Uji 14
Identifikasi Kutudaun 14
PerbanyakanKutudaun 15
Uji Pendahuluan 15
Uji Lanjut terhadap A. gossypii dan M. sanborni 16
Uji Validasi dan Pengaruh pada Bunga Potong Krisan 16
Pelaksanaan Fumigasi 17
Analisis Data 19
HASIL DAN PEMBAHASAN 20
Hasil 20
Identifikasi Kutudaun 20
Uji Pendahuluan 22
Uji Lanjut Perlakuan Fumigasi Fosfin Formulasi Cair terhadap Imago dan Nimfa Instar III A. gossypii serta M. sanborni 24
Uji Validasi dan Pengaruh pada Bunga Potong Krisan 27
Pembahasan 29
SIMPULAN DAN SARAN 32
Simpulan 32
Saran 32
DAFTAR PUSTAKA 33
LAMPIRAN 39
1 Kutudaun pada tanaman hias di Kecamatan Pacet, Cipanas 5 2 Fosfin formulasi padat yang terdaftar untuk mengendalikan hama
gudang di Indonesia 9
3 Sifat fisiko-kimia fosfin 11
4 Sifat fisiko-kimia fosfin formulasi cair 12
5 Rekomendasi dosis fosfin formulasi cair untuk beberapa komoditas 13 6 Rata-rata persentase mortalitas imago dan nimfa instar III A. gossypii
pada beberapa konsentrasi fosfin formulasi cair dengan lama
pemaparan 6, 12, dan 18 jam 23
7 Rata-rata persentase mortalitas imago dan nimfa instar III M. sanborni
pada beberapa konsentrasi fosfin formulasi cair pada lama
pemaparan 6, 12, dan 18 jam 23
8 Rata-rata persentase mortalitas imago dan nimfa instar III A. gossypii
pada beberapa konsentrasi fosfin formulasi cair dengan lama
pemaparan 12, 15, dan 18 jam 24
9 Rata-rata persentase mortalitas imago dan nimfa instar III M. sanborni
pada beberapa konsentrasi fosfin formulasi cair dengan lama
pemaparan 12, 15, dan 18 jam 26
10 Penduga parameter toksisitas fosfin formulasi cair terhadap mortalitas imago dan nimfa instar III M. sanborni dengan lama
pemaparan 12 dan 15 jam 26
11 Rata-rata persentase mortalitas imago dan nimfa instar III A. gossypii
pada konsentrasi fosfin formulasi cair dengan beberapa lama pemaparan 28 12 Rata-rata persentase mortalitas imago dan nimfa instar III M. sanborni
pada konsentrasi fosfin formulasi cair dengan beberapa lama pemaparan 28 13 Rata-rata skor kerusakan bunga potong krisan pada pengamatan
1, 24, 48, 72, 96, dan 120 JSP 28
DAFTAR GAMBAR
1 Morfologi kutudaun; (a) morfologi umum imago kutudaun, (b) panjang antena segmen terakhir (base dan processus terminals), (c) panjang segmen terakhir rostum (R IV+V), (d) panjang kauda, (e) panjang
segmen kedua hind tarsus (HT II) (sumber: Blackman & Eastrop 1994) 7
2 Ruang fumigasi 14
3 Perbanyakan serangga uji pada bunga krisan pot 15
4 Bibit krisan yang digunakan sebagai pakan kutudaun; (a) bibit krisan tipe spray, (b) kapas basah diberikan pada bagian perakaran, (c) kotak plastik 15 5 Pelepasan fumigan; (a) tabung berisi fosfin formulasi cair,
(b) leak detector 18 8 Kutudaun A. gossypii; (a) koloni A. gossypii pada bunga
Chrysantemum spp., (b) imago bersayap, (c) imago berwarna kuning,
(d) imago berwarna hijau (perbesaran 32x) 21
9 Nimfa A. gossypii;(a) nimfa instar I, (b) nimfa instar II, (c) nimfa
instar III, (d) nimfa instar IV (perbesaran 50x) 21
10 Karakteristik imago A. gossypii; (a) imago tidak bersayap, (b) antena tuberkel, (c) terminal process antena dua kali dari dasar segmen antena
terakhir, (d) kornikel yang berwarna gelap (perbesaran 10x) 21
11 Kutudaun M. sanborni; (a) koloni M. sanborni, (b) imago bersayap,
(c) imago tidak bersayap (perbesaran 32x) 21
12 Nimfa M. sanborni; (a) nimfa instar I berwarna coklat transparan, (b) nimfa instar II berwarna coklat kemerahan (perbesaran 50x), (c) nimfa instar III, (d) nimfa instar IV berwarna coklat kehitaman (perbesaran 32x) 22 13 Perbedaan kauda nimfa dan imago M. sanborni; (a) nimfa instar IV,
(b) imago 22
14 Karakteristik imago M. sanborni; (a) imagotidak bersayap (perbesaran 4x), (b) antena tuberkel, (c) kornikel dan kauda, (d) antena
segmen III, (e) femur dan tibia (perbesaran 10x) 22
15 Respons mortalitas; (a) imago, (b) nimfa instar III A. gossypii terhadap
beberapa konsentrasi fumigan fosfin formulasi cair. —●—12 jam,
■ 15 jam, ---♦--- 18 jam 25
16 Respons mortalitas; (a) imago, (b) nimfa instar III M. sanborni terhadap
beberapa konsentrasi fumigan fosfin formulasi cair. —●—12 jam,
■ 15 jam, ---♦--- 18 jam 27
DAFTAR LAMPIRAN
1 Penampilan bunga potong krisan tipe spray varietas Zembla whitepada
konsentrasi 700 ppm 41
2 Penampilan bunga potong krisan tipe standar varietas Fiji whitepada
konsentrasi 700 ppm 42
3 Koloni kutudaun pada tanaman krisan 43
4 Bunga potong krisan 44
5 Data pengukuran suhu dan kelembapan lama pemaparan 6 jam 45
6 Data pengukuran suhu dan kelembapan lama pemaparan 12 jam 46
7 Data pengukuran suhu dan kelembapan lama pemaparan 15 jam 47
10 ANOVA persentase mortalitas nimfa instar III dan imago M. sanborni
pada beberapa konsentrasi fosfin formulasi cair dengan lama
pemaparan 6, 12, dan 18 jam 52
11 ANOVA persentase mortalitas nimfa instar III dan imago A. gossypii pada beberapa konsentrasi fosfin formulasi cair dengan lama
pemaparan 12, 15, dan 18 jam 55
12 ANOVA persentase mortalitas nimfa instar III dan imago M. sanborni pada beberapa konsentrasi fosfin formulasi cair dengan lama
pemaparan 12, 15, dan 18 jam 58
13 Hasil analisis probit aplikasi fosfin formulasi cair terhadap imago
M. sanborni dengan lama pemaparan 12 jam 61 14 Hasil analisis probit aplikasi fosfin formulasi cair terhadap nimfa
instar III M. sanborni dengan lama pemaparan 12 jam 64
15 Hasil analisis probit aplikasi fosfin formulasi cair terhadap imago
M. sanborni dengan lama pemaparan 15 jam 67 16 Hasil analisis probit aplikasi fosfin formulasi cair terhadap nimfa
instar III M. sanborni dengan lama pemaparan 15 jam 70
PENDAHULUAN
Latar Belakang
Indonesia dikenal sebagai negara yang memiliki kekayaan keanegaraman hayati termasuk flora. Berbagai jenis tanaman hias dapat tumbuh dengan baik di Indonesia. Empat jenis bunga yang diproduksi di Indonesia selain untuk pasar dalam negeri namun juga untuk pasar internasional adalah mawar (Rosa spp.), anggrek (Phalaenopsis spp.), krisan (Chrysanthemum spp.) dan sedap malam (Polianthes spp.). Bunga krisan merupakan salah satu jenis tanaman hias yang banyak diminati oleh masyarakat karena memiliki nilai estetika dan ekonomi yang tinggi. Tanaman hias ini berupa perdu yang dikenal juga dengan nama seruni atau bunga emas (golden flower) yang berasal dari Daratan Cina. Perkembangan produksi krisan di Indonesia mengalami peningkatan selama periode 2007-2013 dengan rata-rata pertumbuhan sebesar 37.12% per tahun (Ekanantari 2014). Total volume ekspor bunga ini pada tahun 2012 mencapai 79.10 ton dengan nilai US$ 1 647 127, namun mengalami penurunan pada tahun 2013 menjadi 57.05 ton dengan nilai US$ 772 117 (BPS 2014). Nilai ini masih relatif lebih rendah dibandingkan negara lain, seperti Belanda, Kolombia, Ekuador, Kenya, Jerman dan Malaysia (Van Rijswick 2015). Hal ini diakibatkan oleh beberapa kendala di antaranya adalah terdapatnya organisme pengganggu tumbuhan (OPT) pada bunga yang diekspor.
Beberapa hama dapat menyerang pertanaman bunga krisan, dua di antaranya adalah kutudaun Aphis gossypii Glover dan Macrosiphoniella sanborni
Gillette (Hemiptera: Aphididae), yang merupakan hama penting pada
Chrysanthemum indicum dan Chrysanthemum morifolium (Dixon 1998; Rostami
et al. 2012; Valizadeh et al. 2013). Selain sebagai hama, serangga ini juga dapat berperan sebagai vektor virus. Serangan kutudaun dapat menurunkan kualitas bunga krisan. Dalam perdagangan bebas dan kesepakatan tentang penerapan ketentuan sanitary and phytosanitary Organisasi Perdagangan Dunia mempersyaratkan produk-produk yang akan diperdagangan untuk tujuan ekspor harus bebas dari OPT yang belum ada di negara tujuan ekspor. Berdasarkan
International Standards for Phytosanitary Measures (ISPM) No. 34, hama yang dapat bersifat sebagai vektor harus dicegah penyebarannya (IPPC 2011). Mengingat hal tersebut maka negara pengekspor perlu memperhatikan kualitas dan kuantitas dari produk pertaniannya. Infestasi serangga pada bunga menyebabkan negara pengimpor harus melakukan fumigasi atau menolak bunga potong tersebut sehingga perlakuan karantina tanpa merusak bunga dibutuhkan sesuai dengan keinginan pasar.
Fumigasi sebagai perlakuan karantina tumbuhan bertujuan untuk membebaskan komoditas pertanian dari OPT. Hal ini sesuai dengan tujuan penyelenggaraan kegiatan karantina tumbuhan yaitu mencegah masuk dan tersebarnya OPT sehingga fumigasi sebagai perlakuan karantina harus dapat membunuh serangga hama secara sempurna (zero tolerant).
diaplikasikan serta meninggalkan residu yang rendah, dan ketiga adalah sulfur flourida yang umumnya hanya digunakan untuk perlakuan kayu dan bukan untuk makanan.
Fosfin merupakan fumigan yang digunakan sebagaipengendalian serangga hama selama beberapa dekade dan merupakan alternatif fumigan metil bromida untuk mengendalikan hama pasca panen. Fumigan ini memiliki tingkat keefektifan yang tinggi untuk desinfestasi gandum secara massal dan komoditi lainnya (Bell 2000). Sifat lain yang menyebabkan fosfin tersebar luas adalah harganya yang relatif murah, mudah diaplikasikan, meninggalkan residu yang rendah, dan dapat digunakan pada berbagai komoditi dan penyimpanan (Nayak & Collin 2008). Fosfin diketahui merupakan fumigan yang memiliki efek fitotoksisitas yang lebih rendah dibandingkan metil bromida, karbonil sulfida, dan hidrogen sianida pada bunga potong (Weller & Graver 1998), namun demikian fosfin formulasi padat memiliki beberapa kelemahan yaitu membutuhkan lama pemaparan yang cukup panjang dan berisiko apabila diaplikasikan pada komoditas dengan kadar air yang tinggi (Barantan 2013). Untuk itu dibutuhkan alternatif fosfin formulasi padat yang memiliki keefektifan yang lebih baik dan tidak menimbulkan dampak negatif bagi komoditas yang difumigasi, manusia, hewan, dan lingkungan.
Pengembangan fumigan fosfin dengan gas karbon dioksida dilakukan untuk meningkatkan daya toksisitas dari fumigan ini. Fosfin formulasi cair yang diperdagangkan pada tabung silinder bertekanan tinggi, dengan komposisi formulasi 2% PH3 (fosfin) dan 98% CO2 merupakan bahan fumigan yang tidak
mudah terbakar. Hingga saat ini belum diketahui konsentrasi dan lama pemaparan yang efektif untuk pengendalian A. gossypii dan M. sanborni pada bunga potong krisan dan pengaruhnya terhadap kualitas bunga potong krisan, sehingga penelitian terhadap fosfin formulasi cair perlu dilakukan.
Tujuan Penelitian
Menentukan konsentrasi dan lama pemaparan fosfin formulasi cair yang efektif mematikan A. gossypii dan M. sanborni serta mengevaluasi kualitas bunga yang diperlakukan fumigan tersebut.
Manfaat Penelitian
1. Sebagai masukan bagi Badan Karantina Pertanian untuk menjadi bahan pertimbangan dalam pengambilan kebijakan terkait dengan tindakan perlakuan fosfin formulasi cair
TINJAUAN PUSTAKA
Tanaman Krisan dan Peranannya sebagai Sumber Devisa
Krisan merupakan bunga potong komersial yang mudah dibudidayakan dan dikembangkan. Bunga ini memiliki masa hidup yang paling lama dibandingkan bunga potong lain dan dapat berbunga sesuai dengan waktu panen yang ditentukan. Budidaya krisan pertama kali dilakukan di Cina 3000 tahun SM, dan merupakan spesies alami dari daratan Asia Timur. Pada tahun 1735 seorang botanis Swedia, Karl Linnaeus mengintroduksi tanaman ini ke negara-negara barat.
Tanaman krisan termasuk famili Asteraceae, genus Chrysanthemum.
Chrysanthemum dalam bahasa yunani berasal dari kata chyros yang berarti emas dan anthemon yang berarti bunga, sehingga bunga ini juga dikenal sebagai bunga emas (golden flower). Tanaman krisan di Indonesia mulai dikomersialkan dan dikembangkan pada awal 1990. Tanaman ini banyak ditanam pada area lebih dari 600 m dpl. Suhu udara terbaik yang diperlukan untuk tanaman krisan di daerah tropis seperti di Indonesia adalah antara 20 dan 26 °C. Daerah sentra produsen krisan di Indonesia antara lain: Cipanas, Cisarua, Sukabumi, Lembang (Jawa Barat), Bandungan (Jawa Tengah), dan Brastagi (Sumatera Utara). Beberapa varietas krisan yang umum di pasaran yaitu C. morifolium, C. leucanthemum,
C. sperbum, C. frutescens, dan C. indicum (Djatnika 2008).
Bunga dari genus Chrysanthemum yang paling popular adalah C. indicum
dan C. morifolium yang telah dihibridisasi menjadi Dendrathema gandiflora. Bunga krisan untuk produksi umumnya dikenal dengan 2 tipe, yaitu bunga tipe spray dan bunga tipe standar. Bunga tipe spray memiliki 10 sampai 20 kuncup bunga berukuran kecil dengan diameter 2-3 cm pada satu tangkai bunga. Bunga tipe standar hanya memiliki satu bunga pada satu tangkai bunga dan bunga berukuran besar. Tanaman krisan membutuhkan cahaya yang lebih lama untuk berbunga, sehingga diperlukan penambahan cahaya dari lampu. Waktu penambahan penyinaran yang baik adalah tengah malam, antara pukul 22.30 sampai 01.00 dengan total penyinaran sekitar 150 watt pada area 9 m2 dan lampu
Kutudaun pada Tanaman Hias dan Arti Penting Ekonomi
Kutudaun merupakan salah satu organisme yang memiliki banyak keanekaragaman spesies pada daerah beriklim sedang dan terdistribusi secara luas di dunia (Jalalizand et al. 2012). Kutudaun merupakan serangga hama yang bersifat polifag. Kutudaun merusak tanaman dengan cara menghisap cairan daun, sehingga tanaman menjadi layu dan kering. Kutudaun dapat menyebabkan kerusakan secara langsung dan tidak langsung.
Kerusakan secara langsung disebabkan oleh aktifitas makan kutudaun yang menghisap nutrisi dari bagian tumbuhan seperti daun, batang, dan akar sehingga mengakibatkan bagian tumbuhan tersebut kekurangan nutrisi (Cranshaw 2004). Kerusakan yang disebabkan oleh virus yang ditularkan oleh kutudaun lebih merugikan dibandingkan dengan kerusakan yang disebabkan oleh peranannya sebagai hama. Kerugian kutudaun sebagai hama berkisar 6-25%, sedangkan sebagai vektor dapat mencapai lebih dari 80% (Kranz et al. 1978). Sebagian kecil dari spesies kutudaun memiliki saliva yang beracun, namun banyak yang merupakan vektor virus dan sangat merusak tanaman (Pedigo & Rice 2006). Besar kecilnya angka kerugian erat kaitannya dengan umur, varietas tanaman, jenis virus, dan sifat kutudaun (Kranz et al. 1978). Kerusakan secara tidak langsung disebabkan oleh kontaminasi fisik seperti eksuvia kutudaun dan produksi embun madu yang dapat menjadi media tumbuh cendawan (Sabir et al. 2012).
Kutudaun memiliki inang yang spesifik, namun ada beberapa spesies kutudaun yang dapat hidup pada banyak spesies inang (Blackman & Eastrop 2000). Serangga hama ini memiliki penyebaran yang sangat luas pada hampir setiap tanaman, baik itu berkayu, pohon, semak belukar, herbal, dan rumput (Pedigo & Rice 2006). Keberadaan kutudaun pada suatu tempat dipengaruhi oleh inang dan faktor-faktor lingkungan seperti suhu dan curah hujan (Blackman & Eastrop 1994).
Pada tanaman krisan setidaknya terdapat 6 spesies kutudaun yang menyerang pertanaman ini, di antaranya adalah Myzus persicae, M. sanborni, Brachycaudus helichrysi, A. gossypii, A. fabae, Aulocoitum cercumflexum (Sheela 2008). Menurut Tamaki & Allen (1969), A. gossypii dan M. sanborni merupakan kutudaun yang memiliki kemampuan adaptasi lebih baik dibandingkan M. persicae
pada tanaman krisan. Pada tanaman hias setidaknya terdapat 8 spesies kutudaun yang menyerang 16 spesies tanaman, terutama dari famili Acanthaceae dan Melastomataceae yang merupakan inang paling banyak terserang kutudaun. Sebanyak 6 spesies kutudaun yang ditemukan merupakan hama polifag yaitu
A. gossypii Glover, Aulacorthum solani Kaltenbach, Macrosiphum euporbiae
Thomas, M. persicae Sulzer, Neomyzus circumflexus Buckton, dan Taxoptera aurantii Boyer de Fonscolombe, sedangkan dua spesies lain yang ditemukan yaitu
di seluruh dunia. Kutudaun ini dapat membawa 50 jenis penyakit virus ke berbagai jenis tumbuhan inang lainnya.
Kutudaun krisan M. sanborni merupakan hama pada tanaman budidaya krisan
Dendranthema indicum, D. morifolium, D. frustescens; Cucumis melo (Cucurbitaceae); Compositae (Anthemis, Artemisia, dan Aster) (Blackman & Eastrop 2006). Kutudaun ini dapat membawa 5 jenis virus. Dua di antaranya merupakan virus pada tanaman krisan (Chrysanthemum virus B dan Chrysanthemum vein mottle virus strain) (Miller & Stoetzel 1997; Omoy et al. 2000; Zamani et al. 2003). Kutudaun krisan M. sanborni
umumnya menyerang pada bagian daun muda dan bakal bunga. Akibat serangan tersebut kualitas bunga akan menurun. Pada serangan yang berat tanaman akan gagal menghasilkan bunga, sehingga secara ekonomi dapat menurunkan kualitas dan nilai jual dari bunga potong tersebut (Madjdzadeh & Mehrparvar 2009).
Morfologi Kutudaun
Imago kutudaun umumnya terdiri dari dua bentuk yaitu imago bersayap dan imago tidak bersayap, dengan ciri khas dari kutudaun ini terdapat sepasang kornikel pada abdomen belakang, yang berperan sebagai pertahanan (Boror et al.
1996). Imago yang bersayap biasanya muncul bila kepadatan populasi tinggi. Serangga ini mempunyai tingkat keperidian yang tinggi, dan di daerah tropik berkembang biak secara partenogenesis dan vivipar. Embrio dapat terbentuk tanpa melalui proses pembuahan dan telah berkembang di dalam tubuh induknya, sehingga imago kutudaun tampak seperti melahirkan nimfa (Kalshoven 1981). Laju pertumbuhan kutudaun dipengaruhi oleh tingkat kelahiran, faktor lingkungan, kepadatan populasi, dan perbandingan antara serangga yang tidak produktif dengan yang masih produktif (Dixon 1985). Secara umum morfologi kutudaun dapat dideskripsikan pada Gambar 1.
Menurut Blackman & Eastrop (2000), kutudaun kapas A. gossypii
memiliki bentuk tubuh oval, berwarna hijau gelap, pada populasi tinggi berwarna kuning. Memiliki kornikel berwarna gelap dengan kauda berwarna gelap atau pucat. Aptera berukuran 0.9-1.8 mm dan alate berukuran 1.1-1.8 mm. Kutudaun krisan M. sanborni memiliki bentuk badan lonjong, berwarna coklat kemerahan sampai kehitaman. Memiliki kornikel dan kauda berwarna hitam, dengan kornikel berukuran lebih pendek dibandingkan dengan kauda. Aptera berukuran 1.0-2.3 dan alate 1.8-2.6 mm.
Gambar 1 Morfologi kutudaun; (a) morfologi umum imago kutudaun, (b) panjang antena segmen terakhir (base dan processus terminals), (c) panjang segmen terakhir rostum (R IV+V), (d) panjang kauda, (e) panjang segmen kedua hind tarsus (HT II) (sumber: Blackman & Eastrop 1994)
Biologi dan Ekologi
Kutudaun sebagian besar bereproduksi secara aseksual baik pada betina yang bersayap (alate) atau tidak bersayap (aptera). Kutudaun kapas A. gossypii
dan kutudaun krisan M. sanborni menunjukkan siklus hidup yang anholocyclic
(Roques 2006; Madjdzadeh & Mehrparvar 2009). Pertumbuhan populasi kutudaun bergantung pada tanaman inangnya. Menurut CABI (2014), perbedaan yang signifikan terjadi terhadap laju reproduksi A. gossypii yang dipelihara pada kapas, semangka, dan kacang tanah. Perbedaan yang signifikan juga ditemukan pada potensi reproduksi pada kapas, semangka, wijen, dan terong. Waktu perkembangan yang terpendek untuk A. gossypii terdapat pada kapas, sedangkan tingkat perkembangan terpanjang terdapat pada melon. Menurut Maryam (1998), tingkat populasi M. sanborni cenderung lebih tinggi pada krisan bunga putih dibandingkan krisan bunga kuning.
Kutudaun A. gossypii membutuhkan 5.2 hari untuk mencapai kematangan seksual pada kapas dengan suhu 28 °C. Suhu optimum untuk bereproduksi adalah 20-25 °C, dengan rata-rata nimfa yang dihasilkan 2.8 nimfa per hari (CABI 2014). Pada tanaman nilam A. gossypii terdiri atas 4 instar nimfa. Rata-rata lama instar I, II, III, IV berturut-turut adalah 1.8; 1.4; 1.2; dan 1.6 hari. Secara keseluruhan rata-rata lama masa nimfa adalah 6 hari. Rata-rata-rata masa preproduksi, produksi, dan pasca reproduksi berturut-turut adalah 0.7; 6.9; dan 0.3 hari. Rata-rata masa imago ialah 7.9 hari. Rata-rata masa nimfa sampai imago mati ialah 13.9 hari. Rata-rata siklus hidup dari nimfa sampai menghasilkan nimfa lagi 6.7 hari. Rata-rata banyaknya keturunan yang dihasilkan oleh seekor imago ialah 22.8 hari dan rata-rata banyaknya keturunan yang dilahirkan per hari rata-rata-rata-rata 3.9 ekor (Mardiningsih & Deciyanto 1999).
Kutudaun krisan M. sanborni memiliki siklus hidup, keperidian, dan lama hidup berturut-turut 9.75 hari, 24 ekor nimfa, dan 25 hari pada bagian daun segar, sementara pada tanaman hidup berturut-turut 10.16 hari, 32.95 ekor nimfa, dan
b c
e a
22.9 hari (Maryam 1998). Suhu optimum perkembangan M. sanborni adalah 22-25 °C, dengan rata-rata nimfa yang dihasilkan 2 nimfa per hari. Instar kedua dan ketiga lebih tahan terhadap suhu ekstrem dibandingkan nimfa instar kesatu dan keempat (Duan & Zhang 2004).
Menurut Dixon (1998), kutudaun kapas A. gossypii dan kutudaun krisan
M. sanborni merupakan hama penting pada pertanaman krisan. Kedua hama ini makan pada bagian tanaman yang yang berbeda. M. sanborni pada bagian batang yang berkembang, sedangkan A. gossypii pada bagian daun muda. Pada populasi yang tinggi hama ini dapat menyebabkan tanaman berhenti berkembang. Kehadiran satu spesies lain pada tanaman menghambat pertumbuhan spesies lainnya. Ketika populasi kutu daun A. gossypii dan M. sanborni bercampur (mixed population) kutudaun bersayap yang terbentuk memiliki persentase masing-masing populasi sebesar 55% dan 78%. Kutudaun bersayap memiliki jarak terbang yang sangat terbatas, sementara untuk penyebaran jarak jauh disebarkan melalui fase pradewasa dan imago melalui pengangkutan bahan tanaman yang terinfestasi (Roques 2006).
Strategi Pengendalian A. gossypii dan M. sanborni
Pengendalian A. gossypii dan M. sanborni di lapangan dapat dilakukan dengan beberapa teknik pengendalian seperti pengendalian kimiawi dengan menggunakan insektisida, pengendalian hayati, dan pengendalian terpadu. Kutudaun A. gossypii dan M. sanborni menjadi masalah utama pada pertanaman krisan, karena resisten terhadap insektisida sistemik (Chambers 1986; Valizadeh et al. 2013). Pengendalian hayati yang dapat dilakukan adalah dengan penggunaan cendawan Verticillium lecanii dan Beauveria bassiana; parasitoid Diaretiella rapae, Lysiphlebus spp., dan Aphidius matricariae (Hymenoptera: Brocinidae); predator Aphidoletes aphidimyza (Diptera: Cecidomyiidae) dan Metasyrphis corollae (Diptera: Syrphidae) (Parrella et al. 1999).
Pengendalian yang dilakukan pada produk pasca panen bunga potong terhadap kutudaun ketika akan diperdagangkan antar negara adalah melalui karantina. Hal ini bertujuan untuk mencegah terbawanya kutudaun pada komoditas bunga potong krisan. Salah satu perlakuan karantina yang digunakan adalah fumigasi. Menurut Barantan (2013), fumigasi adalah suatu tindakan terhadap media pembawa OPT menggunakan fumigan dalam ruang kedap udara dan waktu tertentu dapat mematikan OPT. Fumigan yang digunakan untuk bunga potong krisan adalah metil bromida (MB), fosfin formulasi padat (PH3), dan karbon dioksida (CO2) (Bond 1984;
Goerke et al. 2005; Zhang et al. 2012).
Fosfin Formulasi Cair sebagai Fumigan
Fosfin merupakan fumigan selain metil bromida yang terdaftar di berbagai negara untuk desinfestasi komoditas tahan lama. Umumnya fosfin digunakan dalam bentuk formulasi padat seperti alumunium fosfida dan magnesium fosfida. Suhu dan kelembapan tertentu diperlukan agar fosfin dapat menguap. Fosfin dengan bahan aktif alumunium fosfida 56% terdaftar untuk mengendalikan bubuk kayu kering Dinoderus sp. pada rotan. Fosfin dalam bentuk formulasi magnesium fosfida dapat melepaskan fosfin lebih cepat dan dapat digunakan pada temperatur yang rendah, misalnya 5 °C. Dalam perkembangannya fosfin juga diformulasikan dalam bentuk gas cair. Fosfin ini disimpan dalam silinder bertekanan dengan konsentrasi 2%. Fosfin terdaftar untuk mengendalikan berbagai jenis hama di gudang beras dan kumbang Lasioderma serricorne pada tembakau di penyimpanan (Hidayat 2012; Prijono 2012).
Di Indonesia terdapat enam formulasi berbahan aktif alumunium fosfida (AlP) dan empat formulasi magnesium fosfida (Mg3P2). Alumunium fosfida
diformulasikan dalam bentuk tablet (T, 5 Formulasi) atau pelet (P, 1 formulasi) dengan bahan aktif AlP 56-57%. Jenis formulasi magnesium fosfida yang terdapat di Indonesia adalah tablet (2 formulasi) dan pelat (PL- plate dan PB- plate bait
masing-masing 1 formulasi) dengan bahan aktif Mg3P2 56-66% (Tabel 2).
Formulasi pelat lebih menguntungkan daripada tablet atau pelet karena pelepasan gas fosfin lebih terkendali dan tidak meninggalkan serbuk residu (Prijono 2012).
Tabel 2 Fosfin formulasi padat yang terdaftar untuk mengendalikan hama gudang di Indonesia magnesium fosfida (Mg3P2) dengan uap air di udara menurut persamaan reaksi di
bawah ini (Bond 1984; Arifin et al. 2009; Soltani et al. 2013): AlP + 3 H2O → PH3 + Al(OH)3
Alumunium fosfida + Uap air → Fosfin + Alumunium hidroksida
Mg3P2 + 6 H2O → 2 PH3 + 3 Mg(OH)2
Proses perubahan gas fosfin terjadi apabila alumunium fosfida atau magnesium fosfida bereaksi dengan uap air di udara. Pada proses tersebut selain gas fosfin dihasilkan juga senyawa alumunium hidroksida atau magnesium hidroksida. Senyawa-senyawa ini bersifat limbah dalam fumigan fosfin. Pada senyawa alumunium fosfida atau magnesium fosfida ditambahkan bahan pelapis. Fungsi dari bahan pelapis ini adalah memperlambat terjadinya pelepasan gas dan pencegahan akumulasi konsentrasi yang tinggi di udara yang dapat mengakibatkan terjadinya kebakaran. Bahan pelapis yang digunakan adalah lilin parafin dan lapisan matriks plastik. Pada umumnya senyawa alumunium fosfida atau magnesium fosfida mulai bereaksi setelah 2-4 jam. Dekomposisi sempurna akan terjadi setelah 72 jam pada temperatur dan kelembapan yang sesuai. Pada temperatur dan kelembapan yang lebih rendah dekomposisi akan lebih lama sekitar 120 jam. Sifat fisiko-kimia fosfin dapat dilihat pada Tabel 3.
Perlakuan dengan fosfin secara berulang-ulang relatif tidak meninggalkan residu pada komoditas. Sesuai dengan ketentuan Codex Alimentarius, batas residu untuk fosfin inorganik yang diperbolehkan pada biji-bijian belum diolah 0.1 mg/kg dan 0.01 mg/kg pada biji-bijian yang telah diolah. Fumigasi dengan menggunakan fosfin harus memperhatikan sifat-sifat fisik dan kimianya, serta dalam aplikasinya membutuhkan waktu yang lebih panjang dibandingkan dengan metil bromida. Untuk itu, yang perlu diperhatikan sebelum pelaksanaan fumigasi dengan fosfin adalah ketersediaan waktu yang cukup untuk pelaksanaan fumigasi, kandungan air komoditas yang akan difumigasi, jenis komoditas, dan jenis organisme pengganggu tumbuhan yang menjadi sasaran fumigasi. Menurut Asean Food Handling Bureau
(AFHB) & Australian Centre for International Agricultural Research (ACIAR) (1989), beberapa pertimbangan dalam memilih fosfin sebagai fumigan adalah:
a. Komoditas diperlukan dalam waktu bukan kurang dari 7 hari.
b. Keberadaan Trogoderma granarium dan penggunaan metil bromida tidak dipersyaratkan.
c. Fumigasi harus dilakukan pada bungkil, biji berminyak, atau pakan. d. Perkecambahan benih merupakan faktor penting.
e. Komoditas sebelumnya telah difumigasi oleh metil bromida.
f. Masalah perubahan warna terutama pada penggunaan metil bromida pada tepung.
g. Suhu rendah kurang dari 15 °C.
h. Area yang berdekatan dengan tempat kerja dan tempat tinggal.
Tabel 3 Sifat fisiko-kimia fosfin
No Sifat Fosfin
1. Rumus molekul PH3
2. Bobot molekul (g/mol) 34.04
3. Titik didih (°C) -87.4
4. Bobot jenis (cair, kg/l) 0.75 (-90 °C)
5. Bobot jenis pada 0 °C (gas) (udara = 1.0) 1.21
6. Tekanan uap pada 30 °C (atm) 42
7. Faktor konversi g/m3 ke ppm (30 °C, 1 atm) 730
8. Batas nyala di udara (v/v) 1.79%
9. Kelarutan dalam air (v/v) 0.2
10. Bau Seperti bau karbit atau
bawang putih
Sumber: Monro (1969), Barantan (2007)
Fumigan yang umum digunakan dalam pelaksanaan tindakan karantina tumbuhan dan prapengapalan adalah metil bromida dan fosfin formulasi padat, namun fosfin formulasi padat memiliki beberapa kekurangan yaitu lama pemaparan yang cukup panjang dan berisiko apabila diaplikasikan terhadap komoditas dengan kadar air yang tinggi (Barantan 2013). Menurut Williams (2000), fumigan fosfin merupakan fumigan yang paling menjanjikan.
Pengembangan fumigan fosfin dengan gas karbon dioksida dilakukan untuk meningkatkan toksisitas dari fumigan ini. Fumigan fosfin formulasi cair dengan periode pemaparan 15-16 jam dikembangkan untuk tujuan komersil dan mendaftarkan fumigan ini untuk fumigasi pada bunga potong.
Fosfin formulasi cair merupakan salah satu alternatif fumigan pada komoditas yang bermasalah apabila difumigasi dengan fosfin formulasi padat. Fosfin formulasi cair yang diperdagangkan dikemas dalam tabung silinder bertekanan tinggi. Kandungan gas fosfin dalam tabung silinder tidak lebih dari 5%. Pada umumnya senyawa fosfin formulasi cair yang diperdagangkan mengandung 2% gas PH3 (fosfin) dan 98% gas CO2. Hal ini karena sifat fosfin
Tabel 4 Sifat fisiko-kimia fosfin formulasi cair
No Sifat Fosfin formulasi cair
1. Warna Tidak berwarna
2. Bentuk Gas
3. Bau Seperti aroma bawang putih
4. Titik didih Menyublim (perubahan wujud padat
ke gas tanpa mencair terlebih dahulu)
5. Titik leleh Menyublim (perubahan wujud padat
ke gas tanpa mencair terlebih dahulu)
6. Tekanan uap 47266mm Hg @ 25 °C
7. Densitas uap 1.53 @ 25 °C
8. Persen volatile (% wt.):100 100
9. pH Tidak berlaku
10. Titik jenuh di udara (% Vol.): Tidak berlaku
11. Tingkat penguapan Tidak berlaku
12. Kelarutan dalam air Sedikit
13. Titik nyala Tidak mudah terbakar
14. Batas mudah terbakar Campuran yang tidak mudah terbakar
15. Suhu nyala Tidak berlaku
16. Suhu dekomposisi Tidak ada
17. Koefisien partisi (rasio konsentrasi zat terlarut dalam dua cairan yang tercampur atau sedikit larut atau dalam dua padatan) (n-oktananol/air)
Tidak berlaku
18. Batas bau Tidak ada
Tabel 5 Rekomendasi dosis fosfin formulasi cair untuk beberapa komoditas
No Komoditas Jenis OPT Dosis Konsentrasi
BAHAN DAN METODE
Waktu dan Tempat
Penelitian dilaksanakan di Laboratorium Entomologi dan Gedung Workshop Fumigasi dan X-ray Balai Uji Terap Teknik dan Metode Karantina Pertanian, Jalan Raya Kampung Utan-Setu, Desa Mekar Wangi Kecamatan Cikarang Barat Kabupaten Bekasi, Jawa Barat. Penelitian dilaksanakan mulai bulan Agustus hingga Desember 2014.
Alat dan Bahan
Dalam penelitian ini alat yang digunakan adalahruang fumigasi (0.75 m x 0.75 m x 0.75 m) ditutup menggunakan plastik yang terbuat dari poly vinyl chloride (PVC), eye protection (full face mask), protective clothing (baju lengan panjang, sepatu, dan kaus kaki), self contained breathing apparatus (SCBA), selang monitor, timbangan digital, pengukur konsentrasi PH3 (Dräger X-am
7000), pendeteksi kebocoran (leak detector Dräger pac 7000), pengukur suhu dan kelembapan (Quart Precision Thermo-Hygrograph Isuzu TH-27R), dan portable blower. Bahan fumigan yang digunakan adalah fosfin formulasi cair yang mengandung 2% fosfin (PH3) dan 98% karbondioksida (CO2) dengan selang
distribusi dan gun injector, imago dan nimfa instar III A. gossypii dan M. sanborni, bibit krisan sebagai pakan, bunga potong krisan, kotak plastik (8 cm x 8 cm x 11 cm), dan kotak kertas (60 cm x 20 cm x 20 cm).
Gambar 2 Ruang fumigasi
Penyiapan Serangga Uji
Identifikasi Kutudaun
Identifikasi dilakukan dengan membuat preparat slide dari sampel serangga uji. Tahapan pembuatan preparat kutudaun sebagai berikut: (a) kutudaun direbus dalam alkohol 95% selama 3 menit, lalu ditusuk dibagian abdomen, (b) kutudaun direbus dalam KOH 10% hingga menjadi transparan, (c) dilakukan pencucian menggunakan aquades sebanyak 2 kali, (d) direndam dalam alkohol 50% selama 10 menit, (e) perendaman kembali dalam alkohol 80% selama 10
0.75 m
menit, (f) perendaman kembali dalam alkohol 95% selama 10 menit, (g) perendaman kembali dalam alkohol 100% selama 10 menit, (h) perendaman dalam minyak cengkeh selama 10 menit dan, (i) mounting dengan menggunakan canada balsam atau entelan.
Identifikasi dilakukan dengan menggunakan kunci identifikasi kutudaun Blackman & Eastrop (2000, 2006). Identifikasi dilakukan pada fase imago karena pada fase tersebut morfologi kutudaun telah sempurna. Secara umum karakter kutudaun yang menjadi ciri identifikasi adalah bentuk antena tuberkel, kauda, dan kornikel.
PerbanyakanKutudaun
Kutudaun (A. gossypii dan M. sanborni) dikoleksi dari lapangan, kemudian dipelihara dan diperbanyak pada tanaman krisan. Krisan ditanam pada pot yang ditutup kain organdi dan diletakkan di rumah kaca. Serangga uji yang digunakan adalah nimfa instar III dan imago yang berumur relatif sama.
Gambar 3 Perbanyakan serangga uji pada bunga krisan pot
Uji Pendahuluan
Pengujian pendahuluan dilakukan untuk menentukan kisaran lama pemaparan dan konsentrasi minimal fosfin formulasi cair yang akan digunakan pada uji lanjut. Pengujian pendahuluan dilakukan terhadap 30 ekor nimfa instar III atau imago A. gossypii atau M. sanborni yang diinfestasikan pada bibit krisan tipe spray (Gambar 4a). Kapas basah diberikan pada bagian perakaran untuk menjaga kesegaran tanaman selama perlakuan (Gambar 4b), kemudian diletakkan ke dalam kotak plastik (8 cm x 8 cm x 11 cm) (Gambar 4c).
Lama pemaparan yang ditetapkan adalah 6, 12, dan 18 jam dengan 5 taraf konsentrasi (0, 50, 100, 200, 300 ppm) yang diulang sebanyak 3 kali. Mortalitas serangga diamati 1 jam setelah perlakuan (JSP). Kebutuhan dosis untuk mencapai konsentrasi yang ditetapkan diperkirakan menggunakan rumus sebagai berikut:
Keterangan : KT = Konsentrasi Target (ppm PH3), KA = Konsentrasi Awal (ppm PH3)
Uji Lanjut terhadap A. gossypii dan M. sanborni
Uji lanjut dilakukan terhadap imago dan nimfa instar III A. gossypii dan
M. sanborni pada kombinasi lama pemaparan dan konsentrasi terbaik pada uji pendahuluan. Pada uji lanjut ini perlakuan diujikan pada masing-masing 1 ikat bunga potong krisan tipe spray (terdiri dari 10 bunga potong) yang pada setiap ikat bunga diinfestasikan 30 ekor imago atau nimfa instar III A. gossypii atau
M. sanborni. Bunga potong ditempatkan pada kotak kertas (60 cm x 20 cm x 20 cm) yang ditutup dengan kain kassa. Uji lanjut dilakukan terhadap 3 lama pemaparan (12, 15, dan 18 jam) dengan 6 taraf konsentrasi fosfin formulasi cair (0, 300, 400, 500, 600, 700 ppm) yang diulang sebanyak 3 kali. Mortalitas serangga diamati 1 JSP.
Uji Validasi dan Pengaruh pada Bunga Potong Krisan
Uji validasi dilakukan berdasarkan hasil uji lanjut yang memberikan persentase mortalitas 100%. Pada uji validasi dan pengaruh terhadap kualitas bunga potong ini dilakukan pada 2 perlakuan konsentrasi (0 dan 700 ppm) dengan 3 lama pemaparan (12, 15, dan 18 jam) yang diulang sebanyak 3 kali. Perlakuan diujikan pada 2 tipe bunga potong krisan yaitu tipe spray varietas Zembla white dan tipe standar varietas Fiji white dengan masing-masing 1 ikat bunga potong krisan (terdiri dari 10 bunga potong). Setiap bunga potong diinfestasikan 30 ekor imago atau nimfa instar III A. gossypii atau M. sanborni. Bunga potong ditempatkan pada kotak kertas (60 cm x 20 cm x 20 cm) yang ditutup dengan kain kassa. Setelah aplikasi fosfin formulasi cair, dilakukan penghitungan mortalitas
A. gossypii dan M. sanborni serta evaluasi kualitas bunga potong krisan.
dengan teknik skoring. Skor kerusakan bunga diamati pada bagian yang layu dan bercak pada bunga berdasarkan Park et al. (2010), sebagai berikut:
0 = tidak terjadi kerusakan (bunga sehat).
1 = kerusakan ringan, 0% < x ≤ 5% (bunga layu sedikit).
2 = kerusakan sedang, 5% < x ≤ 25% (bunga layu sebagian). 3 = kerusakan berat, x > 25% (bunga layu sebagian hingga mati).
Pelaksanaan Fumigasi
Adapun tahapan pelaksanaan fumigasi dalam penelitian ini meliputi: a. Persiapan bahan uji
Bahan uji yang digunakan dalam penelitian ini adalah imago dan nimfa instar III
A. gossypii serta M. sanborni. 30 ekor imago atau nimfa instar III A. gossypii
atau M. sanborni diinfestasikan ke bibit krisan segar atau satu ikat bunga potong dengan menggunakan kuas secara hati-hati. Uji pendahuluan menggunakan kotak plastik (8 cm x 8 cm x 11 cm). Uji lanjut dan validasi menggunakan kotak kertas (60 cm x 20 cm x 20 cm) yang ditutup menggunakan kain kassa. Masing-masing perlakuan diulang sebanyak 3 kali.
b. Peletakan bahan uji
Bahan uji yang telah disiapkan diletakkan di dalam ruang fumigasi (0.75 m x 0.75 m x 0.75 m) (volume ± 0.42 m3)), kemudian ruang fumigasi ditutup dan dipastikan kedap udara.
c. Pemasangan selang monitor
Sebelum ruang fumigasi ditutup sempurna. Pemasangan instalasi selang kapiler (selang monitor) dilakukan untuk memonitor gas fumigan. Bagian ujung selang ditempatkan pada posisi tengah ruang fumigasi dan bagian ujung lainnya ditempatkan di luar ruang fumigasi.
d. Pelepasan fumigan
Pelepasan fumigan pada setiap ruang fumigasi dilakukan dengan menggunakan selang distribusi dan gun injector (Gambar 5a dan 5b). Setelah pelepasan fumigan, dilakukan penutupan lubang pemasukan fumigan dan menempelkan tanda peringatan berbahaya pada ruang fumigasi.
e. Pengukuran konsentrasi fumigan
Pengukuran konsentrasi fumigan di dalam ruang fumigasi dilakukan untuk menentukan konsentrasi fumigan dan lama pemaparan selama proses fumigasi. Monitoring dilakukan dengan menggunakan alat pengukur konsentrasi PH3
(Dräger X-am 7000) (Gambar 6a), yang dihubungkan dengan ujung selang monitor dibagian luar ruang fumigasi (Gambar 6b).
f. Pengukuran suhu dan kelembapan
Suhu dan kelembapan udara luar di ukur dengan menggunakan Thermo-Hygrograph (Quart Precision Thermo-Hygrograph Isuzu TH-27R) (Gambar 6c).
Gambar 6 Pengukuran konsentrasi gas dan suhu ruang; (a) alat pengukur konsentrasi PH3, (b) pengamatan konsentrasi, (c) alat pengukur suhu
dan kelembapan
g. Pembebasan fumigan (aerasi)
Tahapan ini dilakukan setelah proses lama pemaparan fumigan tercapai untuk masing-masing perlakuan. Sebelum tahapan ini dilaksanakan dipastikan lingkungan tempat dilakukan fumigasi aman dari lalu lintas orang. Tahapan ini dilakukan dengan membuka salah satu sisi ruang fumigasi secara perlahan-lahan dan menggunakan bantuan blower serta belalai pembuangan fumigan (Gambar 7a). Serangga uji dikeluarkan dari ruang fumigasi setelah dilakukan pengukuran tidak ada gas yang tersisa atau ambang aman 0.03 ppm dengan menggunakan leakdetector (Dräger pac 7000)(Gambar 7b).
h. Pengamatan mortalitas serangga uji
Pengamatan serangga dilakukan di bawah mikroskop compound dengan mengamati mati atau tidaknya serangga uji tersebut. Pengamatan mortalitas juga dilakukan terhadap serangga yang tidak diberi perlakuan fumigasi (kontrol).
Analisis Data
HASIL DAN PEMBAHASAN
Hasil
Identifikasi Kutudaun
Serangga uji dari lapangan yang diidentifikasi memiliki ciri morfologi yang sama berdasarkan Blackman & Eastrop (2000, 2006). Menurut kunci identifikasi, kedua kutudaun ini termasuk ordo Hemiptera famili Aphididae subfamili Aphidinae tribe Aphidini yang merupakan spesies A. gossypii dan ordo Hemiptera famili Aphididae subfamili Aphidinae tribe Macrosiphini yang merupakan spesies M. sanborni. instar ketiga memiliki lima ruas antena, tidak memiliki setae pada marginal genital plate, dan tiga segmen pada toraks mulai terlihat dibandingkan pada instar kedua (Gambar 9c). Nimfa instar keempat memiliki enam ruas antena dan memiliki setae pada marginal genital plate (Gambar 9d). Nimfa instar kedua yang memiliki bakal sayap tampak memiliki bahu, sedangkan nimfa instar ketiga memiliki bantalan sayap kecil dan sayap yang berkembang, dan akan lebih menonjol pada nimfa instar ke empat (CABI 2014). Ciri morfologi dari A. gossypii adalah tubuh berbentuk oval (Gambar 10a), dengan ukuran aptera 0.9-1.8 mm dan alatae 1.1-1.8 mm (Blackman & Eastrop 2000, 2006). Memiliki antena tuberkel yang tidak berkembang (Gambar 10b), terminal process dari antena dua kali lebih panjang dari dasar segmen antena terakhir (Gambar 10c), kornikel cenderung berbentuk lancip dan berwarna gelap serta terdapat 4-7 helai rambut pada bagian kauda (Gambar 10d).
berwarna pucat (Gambar 14d, 14e). Kutudaun ini merupakan hama penting pada tanaman krisan yang dibudidayakan (Blackman & Eastrop 2000, 2006).
Gambar 8 Kutudaun A. gossypii; (a) koloni A. gossypii pada bunga Chrysantemum spp., (b) imago bersayap, (c) imago berwarna kuning, (d) imago berwarna hijau (perbesaran 32x)
Gambar 9 Nimfa A. gossypii; (a) nimfa instar I, (b) nimfa instar II, (c) nimfa instar III, (d) nimfa instar IV (perbesaran 50x)
Gambar 10 Karakteristik imago A. gossypii; (a) imago tidak bersayap, (b) antena tuberkel, (c) terminal process antena dua kali dari dasar segmen antena terakhir, (d) kornikel yang berwarna gelap (perbesaran 10x)
Gambar 12 Nimfa M. sanborni; (a) nimfa instar I berwarna coklat transparan, (b) nimfa instar II berwarna coklat kemerahan (perbesaran 50x), (c) nimfa instar III, (d) nimfa instar IV berwarna coklat kehitaman (perbesaran 32x)
Gambar 13 Perbedaan kauda nimfa dan imago M. sanborni; (a) nimfa instar IV, (b) imago
Gambar 14 Karakteristik imago M. sanborni; (a) imago tidak bersayap (perbesaran 4x), (b) antena tuberkel, (c) kornikel dan kauda, (d) antena segmen III, (e) femur dan tibia (perbesaran 10x)
Uji Pendahuluan
Hasil uji pendahuluan pada lama pemaparan 6, 12, dan 18 jam dengan konsentrasi 0, 50, 100, 200, 300 ppm disajikan pada Tabel 6 dan Tabel 7. Aplikasi fosfin formulasi cair terhadap imago dan nimfa instar III A. gossypii pada lama pemaparan 6 jam dan 12 jam dengan konsentrasi 300 ppm belum dapat mematikan 100% serangga uji. Rata-rata persentase mortalitas imago dan nimfa instar III
A. gossypii pada konsentrasi 300 ppm masing-masing sebesar 27.8% dan 18.9% (6 jam); 98.9% dan 80% (12 jam); 100% dan 95.6% (18 jam) (Tabel 6). Aplikasi fosfin formulasi cair terhadap imago dan nimfa instar III M. sanborni pada lama pemaparan 6 jam dan 12 jam dengan konsentrasi 300 ppm belum dapat mematikan 100% serangga uji. Rata-rata persentase mortalitas imago dan nimfa instar III
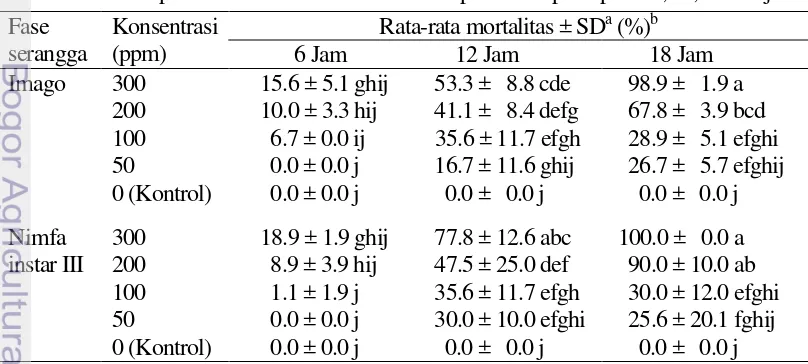
M. sanborni pada konsentrasi 300 ppm masing-masing sebesar 15.6% dan 18.9% (6 jam); 53.3% dan 77.8% (12 jam); 100% dan 98.9% (18 jam) (Tabel 7).
Perlakuan dengan lama pemaparan 18 jam, semua konsentrasi (50-300 ppm) yang diaplikasikan memberikan hasil mortalitas serangga uji yang berbeda nyata dengan kontrol (Tabel 6). Hasil analisis ragam disajikan pada Lampiran 9.
Tabel 6 Rata-rata persentase mortalitas imago dan nimfa instar III A. gossypii pada beberapa konsentrasi fosfin formulasi cair dengan lama pemaparan 6, 12, dan 18 jam
Fase yang sama menunjukan tidak berbeda nyata berdasarkan uji Tukey taraf 5%.
Aplikasi fosfin formulasi cair terhadap M. sanborni menggunakan lama pemaparan 6 jam pada semua konsentrasi (50-300 ppm) yang diaplikasikan memberikan hasil mortalitas serangga uji yang tidak berbeda nyata dengan kontrol (0 ppm). Pada perlakuan dengan lama pemaparan 12 jam, konsentrasi (100-300 ppm) terhadap fase imago memberikan hasil mortalitas serangga uji yang berbeda nyata dengan kontrol, sedangkan fase nimfa instar III konsentrasi (50-100 ppm) memberikan hasil mortalitas serangga uji yang berbeda nyata dengan kontrol. Perlakuan dengan lama pemaparan 18 jam, konsentrasi (100-300 ppm) memberikan hasil mortalitas serangga uji yang berbeda nyata dengan kontrol (Tabel 7). Hasil analisis ragam disajikan pada Lampiran 10.
Uji Lanjut Perlakuan Fumigasi Fosfin Formulasi Cair terhadap Imago dan Nimfa Instar III A. gossypii serta M. sanborni
Hasil uji lanjut aplikasi fosfin formulasi cair terhadap A. gossypii, mortalitas tertinggi dicapai pada konsentrasi 400 ppm pada semua lama pemaparan untuk imago, sedangkan untuk nimfa instar III dicapai pada konsentrasi 500 ppm pada lama pemaparan 12 dan 15 jam, sementara pada lama pemaparan 18 jam tercapai pada konsentrasi 400 ppm (Tabel 8). Perlakuan dengan lama pemaparan 12, 15, dan 18 jam pada semua konsentrasi (300-700 ppm) memberikan hasil mortalitas serangga uji yang berbeda nyata dengan kontrol (0 ppm).
Hasil analisis ragam pengaruh konsentrasi fosfin formulasi cair dan lama pemaparan terhadap mortalitas A. gossypii menunjukkan bahwa perlakuan menggunakan 2 fase A. gossypii, 6 taraf konsentrasi fosfin formulasi cair (0, 300, 400, 500, 600, 700 ppm), dan 3 lama pemaparan aplikasi fosfin formulasi cair (12, 15, dan 18 jam) berpengaruh sangat nyata terhadap respons mortalitas serangga uji (Pvalue < 0.01). Selain itu, interaksi antara perlakuan menggunakan 2 fase A. gossypii dengan 3 lama pemaparan, 2 fase A. gossypii dengan 6 taraf konsentrasi, 3 lama pemaparan dengan 6 taraf konsentrasi, serta interaksi antara ketiga perlakuan tersebut (2 fase A. gossypii, 3 lama pemaparan, 6 taraf konsentrasi) juga menunjukkan berpengaruh sangat nyata terhadap respons mortalitas serangga uji (Pvalue < 0.01) (Lampiran 11).
Pola hubungan antara konsentrasi fumigan fosfin formulasi cair dengan mortalitas imago dan nimfa instar III A. gossypii menurut lamanya pemaparan fumigan menunjukkan pola hubungan yang searah (positif), yaitu bertambahnya konsentrasi diikuti dengan meningkatnya mortalitas kedua fase A. gossypii
(Gambar 15).
Tabel 8 Rata-rata persentase mortalitas imago dan nimfa instar III A. gossypii pada beberapa konsentrasi fosfin formulasi cair dengan lama pemaparan 12, 15, dan 18 jam
700
Gambar 15 Respons mortalitas; (a) imago, (b) nimfa instar III A. gossypii terhadap
beberapa konsentrasi fumigan fosfin formulasi cair. —●—12 jam, ■15 jam, ---♦--- 18 jam
Aplikasi fosfin formulasi cair terhadap M. sanborni, mortalitas tertinggi dicapai pada konsentrasi 600 pmm untuk imago, sedangkan untuk nimfa instar III dicapai pada konsentrasi 700 ppm dengan lama pemaparan 12 dan 15 jam, sementara pada lama pemaparan 18 jam terhadap nimfa instar III dicapai pada konsentrasi 400 ppm (Tabel 9).
Hasil analisis ragam pengaruh konsentrasi fosfin formulasi cair terhadap mortalitas M. sanborni, menunjukkan bahwa perlakuan menggunakan 6 taraf konsentrasi fosfin formulasi cair (0, 300, 400, 500, 600, 700 ppm) dan 3 lama pemaparan aplikasi fosfin formulasi cair (12, 15, dan 18 jam) berpengaruh sangat nyata terhadap respons mortalitas serangga uji (Pvalue < 0.01). Selain itu, interaksi antara perlakuan menggunakan 2 fase M. sanborni dengan 3 lama pemaparan, 2 fase M. sanborni dengan 6 taraf konsentrasi, 3 lama pemaparan dengan 6 taraf konsentrasi, serta interaksi antara ketiga perlakuan tersebut (2 fase M. sanborni, 3 lama pemaparan, 6 taraf konsentrasi) juga menunjukkan berpengaruh sangat nyata terhadap respons mortalitas serangga uji (Pvalue < 0.01) (Lampiran 12).
fumigan menunjukkan pola hubungan yang searah (positif), yaitu bertambahnya konsentrasi diikuti dengan meningkatnya mortalitas kedua fase M. sanborni
(Gambar 16).
Tabel 9 Rata-rata persentase mortalitas imago dan nimfa instar III M. sanborni pada beberapa konsentrasi fosfin formulasi cair dengan lama pemaparan 12, 15, dan 18 jam
Fase yang sama menunjukan tidak berbeda nyata berdasarkan uji Tukey taraf 5%.
Nilai penduga parameter toksisitas LC50 dan LC95 terendah ditunjukkan pada lama
pemaparan 15 jam. Imago M. sanborni LC50 (209.8) dan LC95 (397.8), sedangkan nimfa
instar III LC50 (213.3) dan LC95 (539.4) (Tabel 10). Hasil analisis probit aplikasi fosfin
formulasi cair terhadap imago dan nimfa instar III M. sanborni dengan lama pemaparan 12 jam berturut-turut disajikan pada Lampiran 13 dan Lampiran 14. Hasil analisis probit aplikasi fosfin formulasi terhadap imago dan nimfa instar III M. sanborni dengan lama pemaparan 15 jam berturut-turut disajikan pada Lampiran 15 dan Lampiran 16.
Tabel 10 Penduga parameter toksisitas fosfin formulasi cair terhadap mortalitas imago dan nimfa instar III M. sanborni dengan lama pemaparan 12 dan 15 jam Fase
700
Gambar 16 Respons mortalitas; (a) imago, (b) nimfa instar III M. sanborni terhadap
beberapa konsentrasi fumigan fosfin formulasi cair. —●—12 jam, ■15 jam, ---♦--- 18 jam
Uji Validasi dan Pengaruh pada Bunga Potong Krisan
Uji validasi dan pengaruh pada bunga potong krisan dilakukan berdasarkan hasil uji lanjut yang memberikan persentase mortalitas tertinggi (100%). Uji validasi yang dilakukan pada konsentrasi 700 ppm menunjukkan persentase mortalitas 100% pada kedua fase kutudaun A. gossypii dan M. sanborni (Tabel 11 dan Tabel 12).
Tabel 11 Rata-rata persentase mortalitas imago dan nimfa instar III A. gossypii pada yang sama menunjukan tidak berbeda nyata berdasarkan uji Tukey taraf 5%.
Tabel 12 Rata-rata persentase mortalitas imago dan nimfa instar III M. sanborni pada konsentrasi fosfin formulasi cair dengan beberapa lama pemaparan yang sama menunjukan tidak berbeda nyata berdasarkan uji Tukey taraf 5%.
Pengamatan pengaruh aplikasi fosfin cair terhadap kualitas bunga krisan dengan teknik skoring disajikan pada Tabel 13.
Pembahasan
Pada uji pendahuluan perlakuan pada konsentrasi 50-300 ppm terhadap
A. gossypii dan M. sanborni dengan lama pemaparan 6 dan 12 jam menunjukkan tidak ada konsentrasi yang menyebabkan mortalitas 100%. Hal ini disebabkan kurangnya lama pemaparan fumigasi atau kurang tingginya konsentrasi yang digunakan, sehingga peningkatan konsentrasi diperlukan untuk meningkatkan persentase mortalitas. Persentase mortalitas 100% pada uji pendahuluan tercapai pada lama pemaparan 18 jam. Aplikasi fosfin formulasi cair terhadap imago
Thrips parvispinus pada bunga potong krisan efektif dilakukan pada konsentrasi 200 ppm dengan lama pemaparan 1 jam (Setyawan 2014). Menurut Karunaratne
et al. (1997), imago kutudaun dan larva lepidoptera lebih tahan terhadap fosfin dibandingkan dengan imago thrips yang diuji pada suhu 24 °C. Persentase mortalitas spesies A. gossypii lebih tinggi dibandingkan M. sanborni. Hal ini menunjukkan bahwa fumigan fosfin formulasi cair ini memberikan respons yang berbeda untuk kedua spesies kutudaun ini. Menurut Bond (1984), penyerapan fumigan fosfin dapat bervariasi antar spesies dan fase yang berbeda.
Pada uji lanjut dengan 3 lama pemaparan (12, 15, dan 18 jam) dengan 6 taraf konsentrasi (700, 600, 500, 400, 300, 0 ppm) yang dilakukan pada suhu berkisar 26-32 °C terlihat bahwa dengan adanya peningkatan konsentrasi dan penambahan lama pemaparan akan meningkatkan mortalitas kutudaun. Perlakuan pada konsentrasi terendah 300 ppm pada kedua fase A. gossypii dengan lama 73.3%, 76.7%, dan 97.8%. Mortalitas sebesar 100% untuk A. gossypii ditunjukkan pada konsentrasi 400 ppm pada fase imago, serta 500 ppm fase nimfa instar III untuk lama pemaparan 12 dan 15 jam, sedangkan untuk lama pemaparan 18 jam ditunjukkan pada konsentrasi 300 ppm untuk fase imago dan 400 ppm untuk fase nimfa instar III. Mortalitas sebesar 100% untuk M. sanborni terjadi pada konsentrasi 600 ppm untuk fase imago dan 700 ppm untuk fase nimfa instar III dengan lama pemaparan 12 dan 15 jam, sedangkan untuk lama pemaparan 18 jam tercapai pada konsentrasi 300 ppm untuk fase imago dan 400 ppm untuk fase nimfa. Hasil uji lanjut aplikasi fosfin formulasi cair menunjukkan bahwa fase nimfa instar III lebih tahan dibandingkan fase imago untuk kedua spesies kutudaun, serta M. sanborni lebih tahan dibandingkan A. gossypii. Hal ini sejalan dengan penelitian Park et al. (2010), bahwa fase nimfa kutudaun lebih tahan terhadap fosfin dibandingkan fase imago kutudaun, thrips, dan tungau. Menurut Pimentel et al. (2008), populasi dengan laju respirasi (tingkat respirasi/produksi CO2) yang lebih rendah menunjukkan tingkat mortalitas yang lebih rendah, karena
rendahnya tingkat respirasi sehingga penyerapan terhadap fumigan berkurang. Hasil analisis probit terhadap M. sanborni menunjukkan bahwa toksisitas fosfin formulasi cair bergantung pada lama pemaparan dan konsentrasi, dimana dengan meningkatnya lama pemaparan nilai LC50 dan LC95 semakin rendah
imago dengan lama pemaparan 12 dan 15 jam berturut-turut 303.1 dan 209.8 ppm, serta fase nimfa instar III berturut-turut 228.9 dan 213.3 ppm, terlihat dengan lama pemaparan yang lebih singkat persentase mortalitas sebesar 50% membutuhkan konsentrasi yang lebih tinggi dibandingkan lama pemaparan yang lebih lama. Keefektifan fosfin dalam mematikan serangga bergantung pada lama pemaparan dibandingkan konsentrasi yang digunakan (Kutz 2013). Menurut Hole et al.
(1976), penggunaan konsentrasi rendah dan lama pemaparan yang lebih lama pada fumigasi menggunakan fosfin akan lebih efektif dibandingkan konsentrasi tinggi dengan lama pemaparan yang lebih singkat. Penentuan konsentrasi fosfin formulasi cair bergantung pada jenis komoditas, lama pemaparan, jenis organisme pengganggu tumbuhan dan fase perkembangannya (Barantan 2013). Bond (1984), menyatakan selain konsentrasi dan lama pemaparan, faktor lain yang berpengaruh terhadap toksisitas fosfin adalah suhu. Peningkatan suhu dapat meningkatkan mortalitas karena dengan meningkatnya suhu maka laju respirasi akan semakin tinggi sehingga hal ini akan berkorelasi dengan banyaknya fumigan yang diserap.
Pada uji validasi aplikasi konsentrasi 700 ppm dengan lama pemaparan 12, 15, dan 18 jam menunjukkan persentase mortalitas 100% untuk kedua jenis serangga dan kedua fase serangga uji. Hasil uji validasi terhadap bunga potong krisan tidak berdampak pada kualitas bunga potong krisan tipe spray varietas Zembla white dan tipe standar varietas Fiji white, dengan persentase rata-rata kerusakan 0%, yang diamati hingga 120 JSP tidak menunjukkan penurunan kualitas bunga potong seperti layu dan timbulnya bercak bila dibandingkan dengan kontrol. Tidak adanya penurunan kualitas bunga potong krisan yang diaplikasikan dengan fosfin formulasi cair sejalan dengan penelitian yang dilakukan oleh Zhang et al. (2012), terhadap Dendranthema morifolium (white chrysanthemum) yang difumigasi menggunakan 3 taraf dosis 0.76, 1.52, 3.04 mg/l dengan lama pemaparan 2, 5, 8, dan 11 hari pada suhu 2 °C, menunjukkan hasil bahwa pada semua dosis fosfin yang diuji tidak menimbulkan perubahan pada penampilan bunga. Penelitian perlakuan fosfin formulasi cair pada konsentrasi 100, 500, 4 000 µL/L terhadap bunga Protea sp. (king protea), tulip, dan
Anigozanthos spp. (kangaroo paw) selama 2 dan 4 jam tidak menunjukkan hasil yang berbeda dibandingkan dengan bunga yang tidak diberikan perlakuan (kontrol) (Karunaratne et al. 1997).
Fumigan fosfin formulasi cair merupakan insektisida yang tergolong sebagai racun pernapasan. Fumigan bekerja dalam bentuk gas dan masuk ke dalam tubuh serangga melalui sistem trakea (Untung 1993; Yu 2008).
berbagai proses dalam sel terhambat, terjadi kerusakan jaringan, dan organisme yang keracunan mengalami kematian (Prijono 2012).
Fosfin formulasi cair yang digunakan merupakan campuran 2% fosfin dan 98% CO2. CO2 dalam campuran fumigan ini selain berfungsi sebagai gas
pembawa yang baik untuk fosfin juga berfungsi menjaga fosfin formulasi cair tidak mudah terbakar. Selain itu, menurut Barantan (2013), CO2yang digunakan
bersama dengan fosfin memiliki kecenderungan meningkatkan pernapasan serangga dan spirakel akan terbuka ketika bernapas yang akan mempercepat serangga mengambil konsentrasi mematikan dari fosfin formulasi cair, sehingga penggunaan fosfin formulasi cair lebih efesien untuk mencapai hasil yang diinginkan dan waktu fumigasi akan dipersingkat karena reaksi sinergis tersebut. Menurut EPPO (2012), pengaruh fosfin dengan karbon dioksida menunjukkan bahwa penggunaan karbon dioksida memungkinkan pengurangan konsentrasi fosfin dan mengurangi efek fitotoksisitas pada tanaman. Selain itu, konsentrasi CO2 yang tinggi pada fosfin formulasi cair dapat menghambat proses biokimia
yaitu terhambatnya sintesa etilen sehingga dapat berfungsi sebagai penghambat laju pematangan buah (Barantan 2013). Menurut Setyadjit et al. (2012), CO2
SIMPULAN DAN SARAN
Simpulan
Aplikasi fosfin formulasi cair terhadap A. gossypii dan M. sanborni pada bunga potong krisan efektif dilakukan pada konsentrasi berturut-turut 500 ppm dan 700 ppm dengan lama pemaparan 12 jam. Konsentrasi hingga 700 ppm dengan lama pemaparan hingga 18 jam tidak berdampak buruk terhadap kualitas bunga potong krisan.
Saran