ENZIM DAN KHAMIR DARI ISOLAT LOKAL
EKA YULIANA
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI
Dengan ini saya menyatakan bahwa tesis Produksi Bioetanol dari Empulur Sagu Menggunakan Enzim dan Khamir dari Isolat Lokal adalah karya saya dengan komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Bogor, Agustus 2011
Eka Yuliana
ABSTRACT
EKA YULIANA. Bioethanol Production from Sago Pith using Enzymes and Yeast from Local Isolates. Under the direction of ANJA MERYANDINI and TITI CANDRA SUNARTI.
Starch and fiber from Sago palm can be used for making bioethanol. Starch are accumulate in the pith core of sago palm steam. The pith was pretreated with conventional heating (autoclaving) or microwave. After pretreatment, the sago pith was hydrolysed using α-amylase at 95 oC. The saccharification of sago pith was conducted using consortia of three enzymes (amyloglucosidase, cellulase and xylanase) at 60 oC. Hydrolysis of sago pith was done with these commercial starch degradating enzymes and self-prepared enzymes from local isolates of cellulolytic and xylanolytic bacteria. Yeast used at the fermentation process was isolated from rotten fruits. Selection of yeast was based on their ability to consume mixed substrates of xylose and glucose; and the ethanol production. After 72 hours of fermentation the ethanol production was analyzed using Gas Chromatography. Ethanol produced from conventional heating was greater than microwave heating by using yeast isolate MP (8.11%).
© Hak Cipta milik IPB, tahun 2011
Hak Cipta dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan yang wajar IPB.
NRP : P051080021
Disetujui Komisi Pembimbing
Dr. Anja Meryandini, M.S.
Ketua Anggota
Dr. Ir. Titi Candra Sunarti, M.Si
Diketahui
Ketua Program Studi Dekan Sekolah Pascasarjana IPB Bioteknologi
Prof. Dr. Suharsono, DEA Dr. Ir. Dahrul Syah, M.Sc.Agr
PRAKATA
Alhamdulillahirabbilalamin, puji dan syukur penulis panjatkan kepada Allah
SWT atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan.
Judul yang dipilih dalam penelitian yang dilaksanakan sejak bulan Juni 2010 ini
ialah Produksi Bioetanol dari Empulur Sagu Menggunakan Enzim dan Khamir
dari Isolat Lokal.
Terima kasih penulis haturkan kepada Dr. Anja Meryandini, MS. dan Dr. Ir.
Titi Candra Sunarti, M.Si. selaku pembimbing, serta Dr. Ir. Aris Tjahjoleksono,
DEA selaku penguji luar komisi yang telah memberi saran. Penulis juga
menghaturkan terima kasih kepada ibu, ayah, seluruh keluarga dan sahabat atas
segala doa dan kasih sayangnya.
Semoga karya ilmiah ini bermanfaat.
Bogor, Agustus 2011
Eka Yuliana
RIWAYAT HIDUP
Penulis dilahirkan di Jatibaru, Tanjung Bintang pada tanggal 9 Juli 1984 dari ibunda Erdawati, S.Pd.I dan ayahanda Herman. Penulis merupakan putri pertama dari dua bersaudara.
DAFTAR ISI
Halaman
DAFTAR TABEL ... xix
DAFTAR GAMBAR ... xxi
DAFTAR LAMPIRAN ... xxiii
PENDAHULUAN ... 1
Latar Belakang ... 1
Tujuan Penelitian ... 2
TINJAUAN PUSTAKA ... 3
Empulur sagu ... 3
Pati ... 4
Lignoselulosa ... 6
Pre-treatment untuk Bahan Lignoselulosa ... 8
Iradiasi Gelombang Mikro ... 10
Enzim Hidrolisis ... 11
Bioetanol ... 12
METODE PENELITIAN ... 13
Waktu dan Tempat Penelitian ... 13
Bahan dan Alat ... 13
Metode ... 13
HASIL DAN PEMBAHASAN ... 19
Isolasi dan Seleksi Khamir Unggul ... 20
Penyiapan Enzim ... 24
Hidrolisis Empulur sagu... 25
Produksi Bioetanol ... 31
SIMPULAN DAN SARAN ... 35
DAFTAR PUSTAKA ... 37
DAFTAR TABEL
Halaman
1 Komposisi empulur sagu kering ... 4
2 Karakteristik amilosa dan amilopektin ... 5
3 Stándar mutu pati sagu ... 6
4 Pengaruh pre-treatment terhadap bentuk biomassa ... 9
5 Karakteristik enzim selulolitik dan xilanolitik dari isolat lokal ... 11
6 Hasil pengukuran konsumsi substrat dan kadar etanol pada fermentasi gula murni ... 21
7 Karakteristik enzim ... 24
8 Komposisi proksimat empulur sagu ... 25
9 Komposisi serat empulur sagu ... 26
10 Pengaruh waktu sakarifikasi terhadap total gula, gula pereduksi, dan derajat polimerisasi (DP) yang dihasilkan ... 29
DAFTAR GAMBAR
Halaman
1 Struktur granula pati ... 4
2 Struktur amilosa dan amilopektin ... 5
3 Struktur selulosa ... 6
4 Struktur hemiselulosa ... 7
5 Struktur lignin ... 7
6 Pengaruh pre-treatment terhadap akses enzim pendegradasi ... 8
7 Diagram alir penelitian... 14
8 Sistem fermentasi dalam labu erlenmeyer menggunakan labu leher angsa ... 17
9 Buah-buahan busuk sebagai sumber isolat ... 19
10 Pertumbuhan isolat dari buah pada media YMEA... 20
11 Pertumbuhan isolat khamir dari buah busuk pada media YGC yang diperkaya tetrasiklin (0.05 g/l). ... 21
12 Akumulasi pertambahan volume CO2 13 Struktur empulur sagu menggunakan mikroskop cahaya terpolarisasi perbesaran 100x ... 27
pada fermentasi glukosa dan glukosa-xilosa ... 22
14 Struktur serat empulur sagu menggunakan mikroskop cahaya terpolarisasi perbesaran 100x. ... 31
DAFTAR LAMPIRAN
Halaman
1 Prosedur analisis parameter ... 42
2 Prosedur pengujian aktivitas selulase dan xilanase ... 47
3 Metode analisis proksimat, kandungan pati dan komponen serat ... 49
4 Pembuatan media isolasi, seleksi, dan penyegaran isolat ... 54
PENDAHULUAN
Latar Belakang
Saat ini produksi bahan bakar fosil semakin menurun karena sumbernya
yang semakin menipis di lapisan bumi, sedangkan kebutuhan energi dunia
termasuk Indonesia semakin hari semakin meningkat namun tidak disertai dengan
produksi energi yang memadai. Oleh sebab itu perlu dikembangkan suatu energi
alternatif. Salah satunya adalah bioetanol dari biomassa yang mengandung pati
dan lignoselulosa.
Meskipun konversi material berpati dan lignoselulosa sudah banyak
diteliti, namun terdapat kendala akibat tingginya biaya enzim dan besarnya energi
yang dibutuhkan untuk proses. Oleh karena itu pemilihan proses yang efisien dan
biaya rendah untuk konversi biomassa menjadi etanol sangat penting agar dapat
meningkatkan pemanfaatan biomassa sebagai substitusi bahan bakar fosil.
Sagu (Metroxylon sp.) merupakan tanaman yang ideal untuk bahan baku pemanis berbasis pati dan bahan baku etanol. Pengembangan agroindustri berbasis
sagu akan memberi keuntungan secara ekonomi dan sosial pada daerah tertinggal
di Indonesia bagian timur. Beberapa hasil penelitian juga telah mengkonversi pati
dan bahan lignoselulosik menjadi sirup glukosa dan dilanjutkan menjadi etanol.
Proses konversi pati atau bahan lignoselulolitik meliputi hidrolisis pati, selulosa,
dan hemiselulosa menjadi gula-gula sederhana, kemudian fermentasi gula menjadi
etanol oleh khamir dan bakteri.
Penggunaan khamir lebih disukai dari pada bakteri karena ukuran sel yang
besar dan dinding sel yang padat sehingga memudahkan pemanenan dan daur
ulang proses. Selain itu khamir tidak mudah terkontaminasi oleh bakteri dan virus.
Secara kuantitatif rendemen alkohol dari heksosa dalam fermentasi menggunakan
khamir pada kondisi optimal dapat mencapai 90% (Boyles 1984).
Proses hidrolisis dapat dilakukan dengan hidrolisis enzimatis. Hidrolisis
pati dikatalisis oleh enzim amilolitik. Hidrolisis selulosa dan hemiselulosa
dikatalisis oleh enzim selulolitik dan xilanolitik. Pada proses hidrolisis terdapat
beberapa faktor yang mempengaruhi seperti jenis substrat, aktivitas enzim, dan
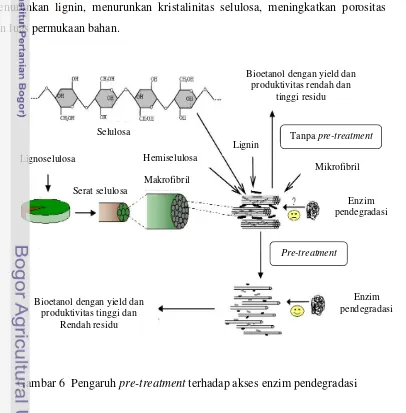
namun bahan lignoselulosik harus diberi perlakuan pendahuluan untuk
menurunkan lignin, menurunkan kristalinitas selulosa, meningkatkan porositas
dan luas permukaan bahan.
Pemanasan dengan microwave dapat digunakan secara langsung untuk konversi biomassa berpati menjadi etanol, sementara lignoselulosa mengalami
pre-treatment. Rendahnya waktu kontak dan konsumsi energi pada saat operasi
microwave, akan menurunkan pembentukan produk sekunder yang tidak diinginkan. Pemanasan dengan microwave dapat mengkonversi langsung pati menjadi gula dalam waktu yang relatif rendah. Dibandingkan dengan pemanasan
konvensional, laju reaksi hidrolisis pati menjadi glukosa meningkat 100 kali
dengan penggunaan iradiasi microwave (Kunlan et al. 2001). Lebih lanjut, Nikolic
et al. (2008) juga menyatakan bahwa microwave treatment dalam durasi yang singkat dapat menghancurkan susunan struktur kristalin pati.
Tujuan
Penelitian ini bertujuan untuk memanfaatkan bakteri dan khamir isolat
lokal dalam memperbaiki proses sakarifikasi pati dan serat sagu secara langsung
dari empulur sagu menggunakan proses enzimatis, untuk menghasilkan gula-gula
sederhana dalam produksi bioetanol.
Tujuan khusus
1. Mengisolasi dan seleksi khamir isolat unggul yang akan digunakan untuk
produksi bioetanol.
2. Mengkaji proses produksi gula sederhana yang efisien melalui penggunaan
empulur sagu dalam proses enzimatis.
3. Meningkatkan perolehan gula sederhana melalui perlakuan awal biomassa
(pati dan serat) menggunakan perlakuan microwave.
4. Meningkatkan perolehan gula sederhana melalui penggunaan enzim
amilolitik, selulolitik dan xilanolitik secara simultan.
5. Produksi etanol dari hidrolisat empulur sagu menggunakan khamir varietas
Empulur Sagu
Tanaman sagu termasuk tumbuhan monokotil dari famili Palmae, sub famili Calamoideae, genus Metroxylon, spesies Eumetroxylon. Tanaman ini banyak ditemukan di hutan hujan dan toleran terhadap pH tanah yang asam dan
mengandung unsur Al, Fe dan Mn yang tinggi. Fase vegetatif tanaman ini berada
pada 7-15 tahun setelah penanaman dan selama masa inilah pati diakumulasi pada
batang. Pati sagu akan maksimum pada saat sebelum tahap berbuah (10-13 tahun
setelah penanaman). Ukuran dari batang sagu dan kandungan patinya bergantung
pada jenis sagu, umur dan habitat pertumbuhannya.
Sagu (Metroxylon sp.) dikenal sebagai tanaman penghasil karbohidrat. Sebagai sumber karbohidrat, tanaman sagu memiliki keunggulan dibandingkan
dengan tanaman penghasil karbohidrat lain karena relatif sudah tersedia lahan
yang telah ditanami sehingga dapat langsung dimanfaatkan, berkembang biak
dengan anakan sehingga panen dapat berkelanjutan tanpa melakukan peremajaan
ataupun penanaman ulang, dapat dipanen dan diolah tanpa musim, resiko terkena
hama penyakit tanaman kecil, dan tingkat pemanfaatannya masih sedikit
(Bustaman 2008).
Areal sagu Indonesia sangat luas yaitu sekitar 1,128 juta ha (Bustaman
2008). Setiap satu batang pohon sagu rata-rata mengandung 200-400 kg pati sagu
(Safitri et al. 2009). Pati sagu diisolasi dari batang sagu. Batang sagu bagian dalam disebut empulur. Pada saat ekstraksi, empulur sagu yang digunakan harus
segar dan segera diproses, karena jika ditunda akan mengakibatkan pati menjadi
kecoklatan akibat aktivitas enzim katalisis reaksi oksidasi senyawa polifenol
menjadi kuinon (Onsa et al. 2000).
Empulur sagu kering didominasi pati (81.51-84.72%) dan serat
(3.20-4.20%). Bagian tengah batang sagu mengandung pati lebih tinggi dibandingkan
bagian luar (Tabel 1). Batang sagu yang diekstraksi patinya akan menyisakan
ampas sebagai limbah. Konversi langsung empulur sagu menjadi glukosa akan
menghemat penggunaan air dan energi untuk ekstraksi dan pengeringan pati,
Tabel 1. Komposisi empulur sagu kering
Sumber : Fujii et al. (1986), data dalam % basis kering, kecuali kadar air
Pati
Pati sagu umumnya berwarna putih, bersifat tidak larut dalam air, tidak
berasa dan tidak berbau. Granula pati sagu berbentuk elips agak terpotong,
permukaannya datar, dan berukuran 15-65 μm. Granula pati terdiri atas bagian
kristalin yang dibentuk oleh amilopektin dan amilosa, serta daerah amorf yang
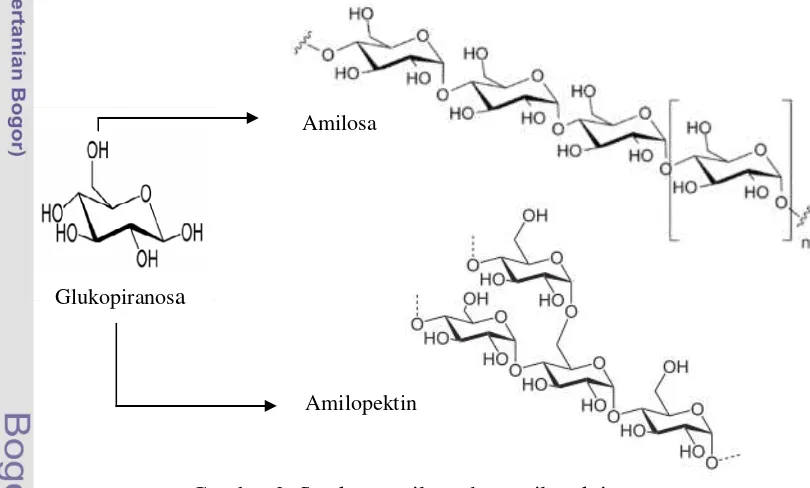
mengandung titik percabangan dari amilopektin (Zhang et al. 2006), yang ditunjukkan oleh Gambar 1.
Gambar 1 Struktur granula pati
Pati mengandung dua komponen utama yaitu 20%-30% amilosa dan
70%-80% amilopektin, yang keduanya merupakan polimer dengan konformasi glukosa
pada 4C1. Pati merupakan homopolimer glukosa dengan ikatan α-glikosidik. Pati terdiri atas dua fraksi yang dapat dipisahkan dengan air panas, fraksi terlarut
disebut amilosa dan fraksi tidak terlarut disebut amilopektin. Tabel 2 berikut
adalah karakteristik dari amilosa dan amilopektin.
Daerah kristalin
Tabel 2 Karakteristik amilosa dan amilopektin
Karakteristik Amilosa Amilopektin
Struktur dasar Linear Bercabang
Stabilitas dalam larutan Retrodegradasi Stabil
Derajat polimerisasi 103 104-10
Panjang rantai rata-rata
5
103 20-25
Hidrolisis oleh β-amilase 87% 54%
λmaks kompleks iodin 650 nm 550 nm
Sumber: Aiyer (2005)
Amilosa mempunyai struktur lurus dengan ikatan α-(1,4)-D-glikosidik
sedangkan amilopektin mempunyai struktur bercabang dengan ikatan α -(1,6)-D-glikosidik sebanyak 4-5% dari berat total (Winarno 1995). Struktur kimia amilosa
dan amilopektin dapat dilihat pada Gambar 2.
Gambar 2 Struktur amilosa dan amilopektin
Mutu pati sagu ditentukan oleh ukuran, bentuk, aroma, rasa dan faktor
lainnya. Pati sagu yang diperdagangkan harus memenuhi standar mutu yang telah
ditetapkan. Badan Standarisasi Nasional mengeluarkan Standar Nasional
Indonesia untuk mutu pati sagu yang dapat dilihat pada Tabel 3 berikut. Glukopiranosa
Amilosa
Tabel 3 Standar mutu pati sagu (SNI 01-3729-1995)
Karakteristik Kriteria
Kadar air (% b/b) Maks. 13
Kadar abu (% b/b) Maks. 0.5
Kadar serat kasar (% b/b) Maks. 0.11
Derajat asam (ml NaOH 1N/100g) Maks. 4
Kadar SO2 (mg/kg) Maks. 30
Kehalusan (lolos ayakan 100 mesh) % b/b Min. 95
Total Plate Count (koloni/g) Maks. 10 Jenis pati lain selain pati sagu
6
Tidak boleh ada
Sumber: Dewan Standarisasi Nasional (1995)
Lignoselulosa
Komponen lain dari empulur sagu yaitu serat (selulosa, hemiselulosa, dan
lignin). Selulosa merupakan polimer glukosa yang membentuk rantai linier dan
dihubungkan oleh ikatan β-1,4-glikosidik. Struktur linier ini menyebabkan selulosa bersifat kristalin. Molekul-molekul selulosa memiliki kecenderungan
membentuk ikatan hidrogen intramolekul dan intermolekul. Hidrolisis sempurna
selulosa menghasilkan glukosa, sedangkan hidrolisis tidak sempurna
menghasilkan selobiosa dan oligosakarida. Struktur selulosa dapat dilihat pada
Gambar 3.
Gambar 3 Struktur selulosa
Hemiselulosa merupakan rantai polimer bercabang dari berbagai jenis
monomer gula-gula anhidro yang dapat dikelompokkan berdasarkan
penyusunnya, yaitu heksosa (glukosa, mannosa, galaktosa), pentosa (xilosa,
arabinopiranosa, arabinofuranosa), asam heksuronat (glukoronat, metil
glukoronat, galakturonat) dan deoksi heksosa (rhamnosa dan fruktosa). Struktur
lebih mudah larut dari pada selulosa. Gambar 4 berikut merupakan struktur dari
hemiselulosa.
Gambar 4 Struktur hemiselulosa
Lignin yaitu polimer yang terdiri atas unit fenil propana melalui ikatan eter
dan ikatan karbon. Terdapat tiga jenis fenil propionic alkohol yang merupakan
monomer lignin yaitu coniferyl alkohol (guaiacyl propanol), coumaryl alkohol (p -hydroxyphenyl propanol) dan sinapyl alkohol (syringyl alkohol). Secara umum
struktur lignin cukup kompleks dan adanya ikatan aril-alkil dan ikatan eter
menyebabkan lignin tahan terhadap hidrolisis (Judoamidjojo et al. 1989). Struktur lignin dapat dilihat pada Gambar 5.
.
Gambar 5 Struktur lignin (Sixta, 2006)
Rantai methoxyl Gugus fenol
Cincin aromatik
Gugus alkohol Ikatan eter (-O-)
Pre-teatment untuk Bahan Lignoselulosa
Hidrolisis bahan lignoselulosa dapat dilakukan dengan cara asam atau
enzim, namun membutuhkan perlakuan pendahuluan (pre-treatment) untuk mempermudah reaksi oleh enzim. Pre-treatment yang diberikan haruslah efisien dan mampu melepaskan struktur kristalin selulosa, dapat mengembangkan sisi
amorf dan melepaskan lignin (disebut delignifikasi). Menurut Fengel dan
Wegener (1995) delignifikasi idealnya menghilangkan lignin namun tidak
menyebabkan kerusakan pada komponen holoselulosa (selulosa dan
hemiselulosa).
Tujuan utama proses pre-treatment adalah untuk memperbesar akses enzim dalam melakukan hidrolisis. Akses enzim dapat ditingkatkan dengan cara
menurunkan lignin, menurunkan kristalinitas selulosa, meningkatkan porositas
dan luas permukaan bahan.
Sejumlah reaksi heterogen terjadi pada hidrolisis menggunakan asam pada
konsentrasi rendah dan menyebabkan terbentuknya “hydrocellulose”, yaitu produk dengan derajat polimerisasi yang rendah namun kristalinitas yang lebih
tinggi. Hidrolisis selulosa sangat dipengaruhi oleh derajat kristalinitas dan bentuk
swelling selulosa. Kinetika hidrolisis selulosa secara asam sangat tergantung pada ikatan hidrogen, sehingga sangat berguna untuk memungkinkan terjadinya proses
sakarifikasi biomassa. Contoh yang diberi perlakuan asam 65% mampu mengubah
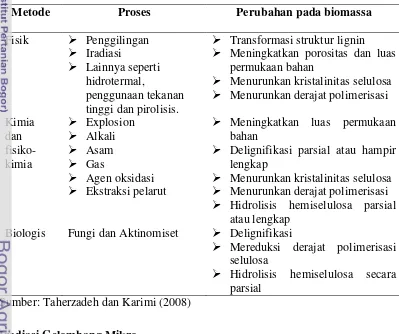
bentuk serat selulosa menjadi selulosa berbentuk seperti gel (Xiang et al. 2003). Proses pre-treament dapat dilakukan melalui beberapa metode yaitu secara fisik, kimia atau fisiko kimia, dan biologis. Tabel 4 memperlihatkan metode pre-treatment dan bentuk biomassa setelah mengalami proses perlakuan pendahuluan.
Tabel 4 Pengaruh pre-treatment terhadap bentuk biomassa
Metode Proses Perubahan pada biomassa
Fisik Penggilingan
Meningkatkan porositas dan luas permukaan bahan
Delignifikasi parsial atau hampir lengkap
Menurunkan kristalinitas selulosa
Menurunkan derajat polimerisasi
Hidrolisis hemiselulosa parsial atau lengkap
Biologis Fungi dan Aktinomiset Delignifikasi
Mereduksi derajat polimerisasi selulosa
Hidrolisis hemiselulosa secara parsial
Sumber: Taherzadeh dan Karimi (2008)
Iradiasi Gelombang Mikro
Gelombang mikro merupakan gelombang elektromagnetik yang berada
GHz. Microwave domestik dan industrial dioperasikan pada 900 MHz – 2,45 GHz. Jantung dari microwave disebut dengan megatron yang akan menghasilkan radiasi listrik. Pada frekuensi 2,45 GHz, energi foton yang dibawa microwave sekitar 1 joule per mol. Jika bahan yang mengandung molekul polar dan ion
diradiasi oleh microwave maka radiasi ini akan mepercepat proses kimia, biologi, dan fisik (Sridar 1998). Keuntungan menggunakan microwave yaitu energi yang dibutuhkan rendah, prosesnya beragam dan selektif, dapat bekerja secara otomatis
dan waktu yang dibutuhkan relatif singkat (Datta 2001).
Iradiasi microwave pada bahan akan menyebabkan dua efek yaitu efek termal dan non termal. Efek termal yaitu dengan mempercepat pemanasan dan
efek non termal dengan mengintensifkan tumbukan antar partikel yang
selanjutnya akan mempengaruhi laju reaksi (Keshwani 2009).
Peran Iradiasi Microwave terhadap Degradasi Pati dan Lignoselulosa
Penelitian tentang penggunaan pemanasan microwave untuk degradasi pati telah digunakan untuk bahan seperti gandum, beras, kentang dan jagung, baik
dalam larutan air maupun asam. Kebanyakan kajian menggunakan microwave oven 2450 MHz. Konsentrasi pati bervariasi antara 1-50%, namun umumnya 10%
pati (Yu et al. 1996 dan Kunlan et al. 2001), sedangkan pada konsentrasi yang lebih tinggi telah dilakukan oleh Khan et al. (1979), Palav dan Seetharaman (2006) dan Nikolic et al. (2008). Hanya sedikit peneliti yang mencantumkan suhu seperti Yu et al. (1996) dan Tsubaki et al. (2009). Sebagian besar hanya
mencantumkan derajat power yang digunakan atau persentase dari power (Kunlan
et al. 2001, Palav dan Seetharaman 2006, Nikolic et al. 2008).
Tsubaki et al. (2009) melaporkan proses pelarutan pati pada suhu tinggi, sebagian besar pati larut pada suhu 200 sampai 220 oC namun diikuti oleh dekomposisi produk menjadi produk sekunder yang memberi warna kegelapan.
Waktu terlama yang telah digunakan adalah 10 menit, namun proses hidrolisis
pati berjalan sempurna kurang dari 10 menit. Perlakuan pemanasan pati dengan
Enzim Hidrolisis
Proses hidrolisis dapat dilakukan menggunakan asam maupun secara
enzimatis. Hidrolisis asam akan menghasilkan etanol dengan yield yang rendah
menimbulkan masalah korosi dan menghasilkan produk samping yang dapat
menghambat proses fermentasi (Safitri et al. 2009). Hidrolisis enzimatis bersifat spesifik dan ramah lingkungan. Enzim yang digunakan untuk hidrolisis pati yaitu
enzim amilolitik sedangkan selulosa dihidrolisis oleh selulolitik dan hemiselulosa
oleh xilanolitik.
Enzim amilolitik bekerja menghidrolisis polisakarida (pati) menjadi
gula-gula sederhana. Enzim amilolitik yang digunakan untuk mendegradasi pati adalah
α-amilase yang akan memecah pati menjadi maltosa. Enzim ini bekerja memutus
ikatan α-(1,4)-glikosidik pada amilosa, amilopektin dan glikogen. Ikatan α
-(1,6)-glikosidik tidak dapat diputus oleh α-amilase namun dapat dibuat menjadi cabang-cabang yang lebih pendek (Dordick 1991). Amiloglukosidase juga merupakan
enzim amilolitik yang bekerja memecah ikatan α-(1,4), α-(1,6), α-(1,3), α-(1,2),
dan α-(1,1) glikosidik. Enzim ini bekerja lebih lambat dibandingkan enzim α -amilase.
Enzim selulolitik bekerja mengkonversi selulosa menjadi glukosa. Enzim
ini terdiri atas kompleks endo-β-1,4-glukanase, kompleks ekso- β-1,4-glukanase,
dan β-1,4-glukosidase. Enzim ini dapat mengkonversi selulosa menjadi glukosa.
Enzim xilanolitik terdiri dari kompleks 1,4-β-endoxilanase, β-xilosidase, α
-L-arabionofuronase, α-glukoronidase, asetil xilan esterase dan asam fenolat. Enzim ini bekerja mengkonversi xilan menjadi xilosa.
Tabel 5. Karakteristik Enzim Selulolitik dan Xilanolitik dari Isolat Lokal
Karakterisitk
Enzim
Selulase1) Xilanase2)
Mikroorganisme BakteriIsolat J Streptomyces 234-P16
Suhu optimum (oC) 60 90
pH optimum 6.5 5.0
Waktu optimum (hari) 7 5
Aktivitas puncak (U/ml) 0.057 0.27
Bioetanol
Etanol (etil alkohol) merupakan cairan yang mudah menguap, mudah
terbakar, tak berwarna, memiliki bau khas alkohol, dan merupakan alkohol yang
paling sering digunakan dalam kehidupan sehari-hari. Etanol termasuk ke dalam
alkohol rantai tunggal, denga2H5
dengan berat molekul 46,07 g/mol. Etanol dapat dibuat dari bahan nabati yang
mengandung gula, pati atau lignoselulosa yang dikenal dengan istilah bioetanol.
Bioetanol dapat diproduksi melalui proses fermentasi oleh khamir. Khamir
merupakan jamur bersel satu yang bersifat mikroskopis, tidak memiliki flagel,
tetapi ada beberapa yang membentuk filamen, bersifat saprofit dan parasit.
Khamir tumbuh baik pada kondisi aerobik, walaupun demikian beberapa khamir
dapat tumbuh pada kondisi anaerobik. Khamir dapat tumbuh dan memfermentasi
gula menjadi etanol pada pH 3.5-6.0 dan suhu 28-35 oC. Fermentasi etanol memerlukan waktu 30-72 jam dengan suhu optimum untuk fermentasi antara
25-30 o
Khamir akan mengubah gula sederhana menjadi etanol melalui jalur
Embden Meyerhoff-Parnas (EMP). EMP mengubah glukosa menjadi asam piruvat
melalui reaksi oksidasi-reduksi. Asam piruvat yang dihasilkan kemudian
didekarboksilasi menjadi asetaldehida lalu mengalami dehidrogenasi sehingga
terkonversi menjadi etanol.
C, dan kadar gula berkisar antara 10-18% (Paturau 1969).
Bioetanol dapat diproduksi dari berbagai biomassa hasil pertanian, namun
secara tradisional bahan hasil pertanian yang digunakan adalah yang mengandung
gula dan pati. Gula sederhana dapat langsung digunakan oleh khamir, sedangkan
pati dapat dengan mudah dikonversi dahulu menjadi glukosa oleh enzim atau
asam, kemudian difermentasi oleh khamir menjadi etanol. Varga et al. (2004) memproduksi etanol dari jagung, limbah jagung dan tongkol jagung dan
Tempat dan Waktu Penelitian
Penelitian dilakukan di Laboratorium Bioteknologi Hewan dan Biomedis
Pusat Penelitian Sumberdaya Hayati dan Bioteknologi serta Laboratorium
Bioindustri, Fakultas Teknologi Pertanian, Institut Pertanian Bogor pada bulan
Juni – November 2010.
Bahan dan Alat
Bahan
Bahan-bahan yang digunakan antara lain empulur sagu, bakteri isolat lokal
penghasil enzim selulase (Bakteri isolat J) dan penghasil enzim xilanase
(Streptomyces 234P-16) koleksi Laboratorium Mikrobiologi, Departemen Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor,
media untuk isolasi: Yeast Malt Extract Agar (YMEA), Yeast Glucose Chloramphenicol (YGC), Potato Dextose Agar (PDA), Potato Dextose Broth (PDB), nutrien untuk produksi biotenol (NPK dan ZA), glukosa, xilosa, bufer
sitrat dan fosfat, ekstrak khamir, agar-agar, xilan oatspelt, reagen DNS, akuades,
kapas, tissue, dan alkohol 96%.
Alat
Peralatan yang digunakan antara lain Hammer mill, Microwave oven merk SHARP tipe R-348 C dengan output 1000 W, Reaktor untuk produksi bioetanol,
Gas Chromatography serta instrumen dan peralatan gelas.
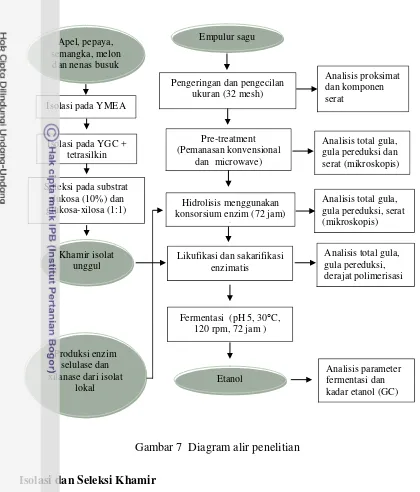
Metode Penelitian
Penelitian dilaksanakan dalam empat tahap yang meliputi (1) isolasi dan
seleksi khamir, (2) penyiapan enzim, (3) hidrolisis empulur sagu dan (4) produksi
Gambar 7 Diagram alir penelitian
Isolasi dan Seleksi Khamir
Isolasi khamir dilakukan terhadap 5 macam buah yang telah membusuk
yaitu apel, melon, nenas, pepaya dan semangka yang berasal dari toko buah lokal.
Isolasi dilakukan dengan menimbang 1 g sampel buah-buahan secara aseptis.
Kemudian dibuat serial pengenceran hingga 10-4 dalam larutan fisiologis NaCl 0.85%. Sebanyak 1 ml sampel dari serial pengenceran 10-3 dan 10-4 diinokulasikan pada media YMEA (yeast malt extract agar) pada suhu ruang selama 48 jam. Koloni yang tumbuh kemudian diisolasi kembali dari mikroba lain dengan cara
menginokulasi pada mediaYGC (yeast glucose chloramphenicol) yang diperkaya tetrasiklin. Inkubasi dilakukan selama 48 jam pada suhu ruang. Koloni khamir
kemudian dimurnikan dengan teknik kuadran hingga diperoleh isolat koloni
tunggal dan dipindahkan pada media PDA (potato dextrose agar).
Isolat khamir yang diperoleh kemudian diseleksi berdasarkan
kemampuannya mengkonsumsi substrat dengan cara memfermentasikan isolat
khamir pada media yang mengandung glukosa (10%) dan campuran
glukosa-xilosa (1:1) selama 72 jam kemudian diuji kinerjanya melalui analisis perubahan
total gula dan gula pereduksi, pembentukan volume CO2
Penyiapan Enzim
dan kadar etanol yang
dihasilkan dengan GC (Gas Chromatography). Prosedur analisis total gula dan gula pereduksi disajikan pada Lampiran 1.
Produksi Enzim Xilanase
Produksi enzim xilanase dilakukan berdasarkan hasil penelitian
Meryandini et al. (2008), yaitu dimulai dengan kultivasi Streptomyces 234P-16 pada media agar xilan 0.5% selama 5 hari pada suhu ruang. Komposisi media
agar-agar xilan terdiri atas xilan 0.5 %; sukrosa 10.3 %; ekstrak khamir 1%; dan
agar-agar 2%. Setelah itu dilakukan inokulasi 2 cockborer koloni pada media xilan cair. Inkubasi dilakukan menggunakan shaker selama 5 hari pada suhu 28
o
Produksi Enzim Selulase
C. Ekstrak kasar enzim dipanen dengan sentrifugasi pada 240 rpm selama 5
menit. Aktivitas enzim ditentukan berdasarkan pembentukan gula sederhana
(xilosa) yang diuji menggunakan metode DNS (Miller 1959). Prosedur analisis
gula sederhana metode DNS disajikan pada Lampiran 1.
Produksi enzim xilanase dilakukan berdasarkan hasil penelitian
Meryandini et al. (2009) yaitu dengan menumbuhkan Bakteri Isolat J pada media agar-agar CMC dengan komposisi CMC 1%; MgSO47H2O 0.02%; KNO3 0.075%; K2HPO4 0.05%; FeSO47H2O 0.002%; CaCl2 0.004%; ekstrak khamir 0.2%; glukosa 0.1%; dan agar 2%. Pengkulturan isolat dilakukan selama 2 hari
pada suhu 30 oC. Sebanyak 1-2 loop bakteri diinokulasikan dalam 100 ml media CMC cair selama 2 hari pada suhu ruang. Ekstrak kasar enzim dipanen dengan
sentrifugasi pada 240 rpm selama 5 menit dan diuji aktivitasnya sebagai
Hidrolisis empulur sagu
a. Pre-treatment (perlakuan pendahuluan) empulur sagu
Sebelum pre-treatment, bahan baku berupa empulur sagu terlebih dahulu diparut dan dikeringkan dengan sinar matahari kemudian dilanjutkan dengan
pengeringan menggunakan oven pada suhu 50 o
Pre-treatment dilakukan pada 50 ml empulur sagu dengan konsentrasi 8% melalui pemanasan konvensional (105
C selama 24 jam dan digiling
hingga berukuran 35 mesh. Komponen kimia empulur sagu dianalisis sebagai
komponen proksimat (air, abu, lemak, protein, serat kasar dan karbohidrat) dan
komponen serat (hemiselulase, selulase, lignin). Prosedur analisis proksimat dan
komponen serat disajikan pada Lampiran 3.
o
b. Likuifikasi
C, 15 menit) atau pemanasan microwave pada power level 50% (500 W) selama 2 menit (Derosya 2010). Perubahan komposisi karbohidrat akan dianalisis dengan total gula, gula pereduksi (Miller
1959) dan derajat polimerisasi hidrolisat pati. Perubahan pada struktur pati dan
serat dianalisis dengan pengamatan mikroskopik. Prosedur analisis total gula dan
gula pereduksi disajikan pada Lampiran 1.
Proses likuifikasi dilakukan dengan menambahkan enzim α-amilase
komersial (thermamyl) menurut metode dari penelitian sebelumnya yaitu 1.75 U/g (Akyuni 2004) kemudian diinkubasi selama 3 jam pada suhu 95 o
c. Sakarifikasi
C. Perubahan
komposisi karbohidrat akan dianalisis dengan total gula, gula pereduksi (Miller
1959) dan derajat polimerisasi hidrolisat pati.
Pada tahap ini ditentukan kondisi sakarifikasi empulur sagu yang telah
mengalami pre-treatment. Proses sakarifikasi dilakukan dengan menambahkan konsorsium 3 enzim yaitu amiloglukosidase komersial (dextrozyme) 0.3 U/g,
selulase 1 U/g dan xilanase 1 U/g pada suhu 60 oC. Proses berlangsung selama 120 jam dan perubahan komposisi karbohidrat akan dianalisis dengan total gula,
gula pereduksi (Miller 1959) dan derajat polimerisasi hidrolisat pati. Perubahan
pada struktur pati dan serat dianalisis dengan pengamatan mikroskopik. Prosedur
analisis total gula, gula pereduksi dan derajat polimerisasi disajikan pada
Produksi Bioetanol
Produksi etanol menggunakan khamir isolat unggul hasil isolasi dengan
menggunakan produk sakarifikasi yang dihasilkan dari tahap sebelumnya dan
diperkaya dengan pupuk (NPK dan ZA). Fermentasi berlangsung secara tertutup
tanpa aerasi. Desain peralatan untuk proses fermentasi disajikan pada Gambar 8.
Evolusi CO2 yang dilepaskan dari sistem diukur dan dihitung sebagai laju pembentukan gas per 6 jam selama 12 jam pertama dan dilanjutkan per 12 jam
hingga 72 jam. Setelah 72 jam, kultur ditetapkan pHnya, kandungan total gula
residu (Dubois et al. 1956), gula pereduksi (Miller 1959), total asam (titrasi asam), dan parameter fermentasi seperti Yp/s (perolehan g produk per g substrat)
dan ∆S/S (penggunaan substrat). Konsentrasi etanol ditentukan dengan Gas Chromatography (GC). Prosedur analisis total gula, gula pereduksi, total asam dan parameter fermentasi disajikan pada Lampiran 1.
Gambar 8 Sistem fermentasi dalam labu Erlenmeyer menggunakan labu leher angsa.
waterbath shaker labu leher angsa
H2SO4 pekat
selang plastik bak plastik
sumbat karet
Isolasi dan seleksi khamir isolat unggul
Proses ini diawali dengan mengisolasi khamir dari 5 macam buah yang
mengandung air dan gula sederhana dalam jumlah tinggi yaitu apel, melon, nenas,
pepaya dan semangka yang telah membusuk dengan asumsi bahwa proses
pembusukan diakibatkan oleh khamir. Gambar 9 berikut adalah kondisi buah yang
digunakan sebagai sumber isolat.
Gambar 9 Buah-buahan busuk sebagai sumber isolat. (a) apel, (b) melon, (c) nenas, (d) pepaya, (e) semangka.
Buah-buahan merupakan bahan pangan yang mengandung glukosa cukup
tinggi sehingga khamir dapat tumbuh optimal dalam gula sederhana seperti
glukosa maupun gula kompleks disakarida yaitu sukrosa. Lathar et al. (2010) menyatakan bahwa khamir dapat diisolasi dari berbagai sumber alami seperti
daun, bunga dan buah. Kerusakan buah-buahan akibat benturan dapat
menyebabkan kerusakan struktur jaringan pada buah, sehingga menjadi inang
yang tepat bagi khamir untuk tumbuh. Kerusakan yang disebabkan oleh
pertumbuhan khamir ditandai dengan terbentuknya bau asam dan bau alkohol,
(a) (b) (c)
serta terbentuknya lapisan pada permukaan, misalnya kerusakan pada sari buah
(D’Mello 2003). Akibat dari pertumbuhan khamir tersebut buah-buahan
mengalami kebusukan.
Isolasi khamir dari buah dilakukan menggunakan media YMEA (Yeast Malt Extract Agar) pada suhu 30 oC selama 48 jam hingga diperoleh 23 isolat. Gambar 10 berikut merupakan isolat khamir yang tumbuh pada media YMEA.
Gambar 10 Pertumbuhan isolat dari buah pada media YMEA. (a) apel, (b) melon, (c) nenas, (d) pepaya, (e) semangka.
Isolat yang diperoleh kemungkinan merupakan campuran beberapa jenis
mikroba seperti khamir, bakteri atau kapang karena YMEA merupakan media
umum untuk pertumbuhan khamir. Lathar et al. (2010) juga melakukan isolasi khamir dari 17 jenis buah pada media MYPG (malt extract 0.3%, yeast extract 0.3%, peptone 0.5%, glucose 1%, agar 3%) pH 6.5, suhu 26 o
Bervariasinya isolat yang diperoleh menyebabkan perlunya dilakukan
isolasi khamir dari mikroba lain. Isolasi ini dilakukan dengan menumbuhkan
isolat pada media YGC (Yeast Glucose Chloramphenicol) yang diperkaya C selama 48 jam.
Isolat yang diperoleh bukan hanya khamir tetapi juga terdapat kapang dan bakteri.
Hal ini terjadi karena kadar gula dan air yang tinggi pada buah-buahan menjadi
pendukung bagi pertumbuhan mikroba selain khamir.
(a) (b)
tetrasiklin (Lampiran 4). Pertumbuhan isolat pada media YGC yang diperkaya
tetrasiklin juga cukup bervariasi, beberapa isolat dapat tumbuh dengan baik dan
beberapa yang lain tidak tumbuh (Gambar 11). Isolat yang tidak tumbuh diduga
bakteri atau jamur karena tidak mampu tumbuh pada media yang mengandung
kloramfenikol dan tetrasiklin yang berfungsi sebagai antibiotik.
Gambar 11 Pertumbuhan isolat khamir dari buah busuk pada media YGC yang diperkaya tetrasiklin (0.05 g/l).
Dari hasil isolasi didapatkan 12 isolat dengan ciri-ciri terlihat pada
Lampiran 5. Isolat ini kemudian dimurnikan dan diseleksi berdasarkan
kemampuannya menggunakan substrat glukosa dan campuran glukosa-xilosa
(1:1). Fermentasi dilakukan Selama 72 jam pada suhu 30 o
Tabel 6 Hasil pengukuran konsumsi substrat dan kadar etanol pada fermentasi menggunakan gula murni
C sehingga diperoleh 4
isolat dengan persentase penggunaan substrat terbesar (Tabel 6).
% Penggunaan substrat Kadar etanol (%)
Isolat Glukosa Glukosa-xilosa Glukosa Glukosa-xilosa
MP 60.9 36.0 2.49 1.58
H 64.2 27.7 3.13 1.51
SB 71.1 48.2 1.68 1.14
K 65.9 32.8 1.09 1.32
Dari hasil seleksi terlihat bahwa isolat MP dan H menghasilkan etanol dua
kali lebih besar pada substrat glukosa dibandingkan campuran glukosa-xilosa. Hal
ini diduga bahwa kedua isolat hanya mampu mengkonversi glukosa saja pada
substrat campuran. Isolat SB dan K menghasilkan etanol dalam kadar tidak jauh
berbeda baik pada substrat glukosa maupun campuran glukosa-xilosa. Hal ini Isolat tumbuh
diduga bahwa kedua isolat tersebut mampu menggunakan kedua jenis substrat.
Isolat khamir yang mampu mengkonversi xilosa juga dilaporkan oleh Rao et al. (2008) yang berhasil mengisolasi 374 isolat khamir dari buah-buahan dan 27
diantaranya mampu mengasimilasi xilosa.
Kemampuan khamir dalam mengkonversi substrat menjadi etanol juga
dapat dilihat dari peningkatan volume CO2 yang dihasilkan selama fermentasi (Gambar 12). Berdasarkan kurva akumulasi pertambahan volume CO2 pada isolat MP dan H terlihat bahwa pertambahan volume CO2 baik pada substrat glukosa maupun campuran glukosa-xilosa menunjukkan hasil yang hampir sama. Isolat
MP dan H mengkonversi substrat glukosa 5% dalam campuran glukosa-xilosa
(1:1) maupun glukosa 10% menjadi etanol dengan konsentrasi yang hampir sama.
Ini menunjukkan bahwa kedua isolat memiliki kemampuan penggunaan substrat
yang rendah. Gambar 12 berikut adalah akumulasi pertambahan volume CO2 pada isolat MP dan H.
Gambar 12 Akumulasi pertambahan volume CO2 pada fermentasi glukosa dan glukosa-xilosa (1:1). (a) isolat MP, (b) dan isolat H.
Pengamatan CO2
C
yang terbentuk selama proses fermentasi oleh kedua
isolat merupakan pendekatan untuk mengetahui kadar etanol secara tidak
langsung berdasarkan reaksi fermentasi berikut:
6H12O6 2C2H5OH + 2CO2
Dari persamaan reaksi tersebut dapat dijelaskan bahwa kadar etanol yang
dihasilkan oleh glukosa setara dengan kadar CO2 yang dihasilkan. Pengamatan terhadap volume CO2 yang dihasilkan selama fermentasi juga dilakukan oleh Bonciu et al. (2010). Perubahan CO2 tersebut secara tidak langsung digunakan untuk menentukan kadar etanol yang dihasilkan oleh isolat khamir dari hidrolisat
inulin. Kadar etanol ditentukan dari volume CO2 dikalikan dengan 1.045 hasil persamaan Gay-Lussac. Secara teoritis setiap molekul glukosa diubah menjadi 2
molekul etanol dan 2 molekul CO2
Pengamatan terhadap perubahan volume CO
atau dalam dasar berat 51.1% gula diubah
menjadi etanol dan 48.9% diubah menjadi karbondioksida.
2 digunakan sebagai data pendukung bahwa kedua isolat mampu menghasilkan CO2 sebagai produk samping dari fermentasi. Hasil pengamatan menunjukkan bahwa kedua isolat
mampu menghasilkan CO2 dalam fermentasi dan diduga hasil tersebut sebanding dengan etanol yang dihasilkan karena sistem fermentasi disusun agar reaksi
berlangsung secara anaerob. Seiring dengan lama fermentasi terjadi peningkatan
akumulasi CO2
Pada awal fermentasi, khamir memerlukan oksigen untuk pertumbuhan,
tetapi setelah terjadi akumulasi CO
yang dihasilkan hingga pada waktu tertentu peningkatan tersebut
tidak terlalu signifikan. Hal ini menunjukkan bahwa kedua isolat mampu
mengkonversi gula hasil hidrolisis enzimatis menjadi etanol dan ketika substrat
mulai habis terjadi penurunan laju pembentukan etanol.
2 reaksi berubah menjadi anaerob. Pada kondisi anaerobik, khamir memetabolisme glukosa menjadi etanol, sebagian besar
melalui jalur Embden Meyerhof Parnas. Setiap mol glukosa terfermentasi
menghasilkan dua mol etanol, CO2 dan ATP. Oleh karena itu, secara teoritis setiap g glukosa memberikan 0,51 g etanol. Pada kenyataannya etanol yang
dihasilkan biasanya tidak melebihi 92-95% dari hasil teoritis karena sebagian
juga dapat terjadi dan menghasilkan gliserol, asam asetat, asam laktat, suksinat,
asetaldehid, furfural, dan 2,3-butanediol. Etanol yang dihasilkan merupakan
toksin bagi sel khamir saat konsentrasinya mencapai 8-18% berat. Namun hal ini
dipengaruhi jenis khamir dan kondisi metabolik dari kultur. Fermentasi oleh
khamir mengalami hambatan saat konsentrasi etanol mencapai 11% volume
(Glazer dan Nikaido 2007).
Penyiapan enzim.
Penelitian ini menggunakan empat jenis enzim hidrolisis dimana dua
diantaranya yaitu selulase dan xilanase diperoleh dari isolat lokal hasil penelitian
sebelumnya. Tabel 7 berikut menyajikan karakteristik masing-masing enzim yang
digunakan.
Amiloglukosidase2) 4.5 60 145
Selulase3) 6.5 60 0.057
Xilanase4) 5.0 90 0.27
Sumber: 1)Wibisono (2004), 2)Akyuni (2004), 3)Sinaga (2010), 4)
Berdasarkan karakteristik enzim di atas, pada tahap likuifikasi digunakan
enzim α-amilase yang berlangsung pada suhu optimum dari α-amilase yaitu 95 Meryandini et al. (2008)
o C.
Pada tahap sakarifikasi digunakan konsorsium tiga enzim yaitu amiloglukosidase,
selulase dan xilanase pada suhu 60 oC. Pemilihan suhu tersebut didasarkan pada suhu optimum terendah dari ketiga enzim tersebut yaitu amiloglukosidase dan
selulase pada suhu 60 oC. Enzim xilanase memiliki kestabilan pada kisaran suhu 50-75 oC, namun memiliki aktivitas 41 % dari aktivitas maksimumnya. Suhu mempengaruhi kinerja enzim dimana enzim akan bekerja optimum pada suhu
optimumnya. Penurunan suhu optimum tidak menurunkan kinerja enzim sedrastis
peningkatan suhu proses. Suhu yang terlalu tinggi dapat menurunkan aktivitas
Penggunaan amiloglukosidase dan selulase secara bersamaan akan
menyebabkan rusaknya granula pati sehingga terbentuk rongga untuk penetrasi
enzim. Jika hanya digunakan enzim amiloglukosidase atau selulase saja, hanya
bagian permukaan granula pati yang akan diserang (Wong et al. 2007). Enzim selulase akan berperan pada awal proses yaitu menjadikan granula pati lebih
terbuka sehingga amiloglukosidase berkesempatan menghidrolisis bagian dalam
granula pati (Safitri et al. 2009). Selanjutnya enzim xilanase akan bekerja menghidrolisis komponen xilan pada serat menjadi xilosa sehingga meningkatkan
perolehan gula-gula sederhana.
Hidrolisis empulur sagu
Perlakuan pendahuluan (pre-treatment) pada empulur sagu
Bahan baku yang berupa empulur sagu yang digunakan berasal dari industri
rakyat di daerah Cihampar, Bogor dengan kadar air yang masih cukup tinggi yaitu
17.9% sehingga perlu dikeringkan menggunakan oven pada suhu 50 o
Tabel 8 Komposisi proksimat empulur sagu
C selama 24
jam. Empulur kering kemudian dihancurkan menggunakan hammer mill hingga lolos ayakan 35 mesh. Pengecilan ukuran pada empulur sagu dapat meningkatkan
luas permukaan bahan sehingga nantinya akan mempermudah akses enzim
penghidrolisis. Pati dan serat harus dikecilkan ukurannya agar dapat berinteraksi
dengan air secara baik (Retno et al. 2009). Selanjutnya empulur sagu dianalisis komposisinya yang meliputi komponen proksimat dan kandungan pati seperti
tersaji pada Tabel 8.
Protein (% basis kering) 2.36
Karbohidrat (by difference) (% basis kering) 78.12
Empulur sagu merupakan bahan baku untuk produksi pati sagu. Dari hasil
analisis proksimat diketahui bahwa empulur sagu mengandung 73% pati.
Kandungan pati yang tinggi ini juga dilaporkan oleh Fujii et al. (1986) bahwa empulur sagu kering didominasi oleh pati (81.51- 84.72%), sedangkan menurut
Safitri et al. (2009) tepung empulur sagu mengandung pati sebesar 57.25%. Kandungan pati pada tanaman sagu bergantung pada jenis sagu, umur dan habitat
pertumbuhannya. Selain pati juga terdapat komponen serat sebesar 7.84 %. Fujii
et al. (1986) juga melaporkan bahwa empulur sagu kering mengandung komponen serat 3.20-4.20%, sedangkan Safitri et al. (2009) menyatakan bahwa tepung empulur sagu mengandung 31.59% serat. Serat kasar merupakan komponen yang
terdiri atas dinding sel, pektin, selulosa, hemiselulosa, lignin dan pentosan.
Komposisi serat pada empulur sagu disajikan pada Tabel 9.
Tabel 9 Komposisi serat empulur sagu
Komponen Nilai
Selulosa (%) 10.36
Hemiselulosa (%) 2.24
Lignin (%) 1.40
Berdasarkan analisis komposisi serat, empulur sagu mengandung bagian
selulosa terbesar yaitu 10.36% dibandingkan dengan hemiselulosa 2.24%. Selain
itu, ternyata empulur sagu masih mengandung lignin sebesar 1.40% sehingga
diperlukan proses pre-treatment diperlukan untuk meningkatkan akses enzim dalam melakukan hidrolisis. Akses enzim dapat ditingkatkan dengan cara
menurunkan lignin, menurunkan kristalinitas selulosa, meningkatkan porositas
Gambar 13 Struktur empulur sagu menggunakan mikroskop cahaya terpolarisasi perbesaran 100x. (a) sebelum pre-treatment, (b) setelah pemanasan konvensional, (c) setelah pemanasan microwave.
Empulur sagu sebelum pre-treatment memperlihatkan bahwa struktur granula pati masih utuh dan serat masih kompak (Gambar 13a). Hal ini dapat
dilihat dari sifat birefringence granula pati yang berwarna biru kuning dan juga warna serat yang masih biru, yang memperlihatkan sifat kristalinitasnya. Warna
kehitaman pada serat merupakan komponen fenolik dari lignin. Lignin memiliki
struktur yang sangat kompak dan tahan terhadap hidrolisis.
Berbeda dengan empulur sagu setelah pre-treatment (Gambar 13b dan 13c) yang memperlihatkan struktur dari granula pati yang telah mengalami gelatinisasi
sehingga terjadi proses swelling yang menyebabkan hilangnya sifat birefringence pati. Pemanasan menyebabkan energi kinetik molekul-molekul air menjadi lebih
kuat dari daya tarik-menarik antara molekul pati dalam granula, sehingga air dapat
masuk ke dalam pati dan pati akan membengkak. Granula pati dapat membengkak
luar biasa dan pecah sehingga tidak dapat kembali pada kondisi semula. Dalam
kondisi ini granula pati akan lebih mudah diserang oleh enzim-enzim hidrolisis.
Begitu pula dengan struktur serat yang mulai rusak (kristalinitasnya
menurun) sehingga menjadi lebih amorf dan menjadi lebih rentan terhadap
hidrolisis. Hal ini dapat dilihat dari perubahan warna biru pada serat yang mulai
memudar bahkan ada yang menjadi kekuningan. Pembengkakan ukuran yang
merupakan perbesaran pori akibat iradiasi gelombang mikro memungkinkan
masuknya enzim dan air ke bagian lebih dalam serat dan memberikan kesempatan
enzim untuk infiltarsi dan menghidrolisis serat menjadi gula sederhana (Magara
dan Koshijima 1990). Pada struktur lignin juga mulai rusak dan dapat dilihat dari
warna hitam yang mulai menghilang setelah pretreatment. Iradiasi microwave menyebabkab pemanasan terjadi pada suhu tinggi sehingga menghasilkan
karbohidrat, oligosakarida dan monosakarida serta melarutkan lignin akibat
putusnya ikatan eter (β-O-4) dan lignin-karbohidrat(Tsubaki et al. 2009).
Struktur pati dan serat pada pemanasan konvensional atau microwave tidak memperlihatkan perbedaan yang jelas (Gambar 13b dan 13c). Namun menurut
Palav dan Seetharaman (2006), pada pemanasan microwave granula pati akan kehilangan birefringence sebelum swelling sedangkan pada pemanasan konvensional, swelling dan kehilangan birefringence granula terjadi hampir bersamaan. Selama konduksi panas, terjadi perusakan pada susunan rantai
amilopektin yang membantu swelling pada daerah amorf granula pati. Pada pemanasan microwave, pecahnya granula pati terjadi akibat gerak vibrasi molekul polar selama pemanasan. Kehilangan kristalinitas pada pemanasan microwave juga dapat terjadi pada suhu yang lebih rendah dibandingkan pemanasan
konvensional. Hal ini terjadi karena pemanasan microwave secara langsung akan mempengaruhi kristalinitas dan merusak susunan lamela amilopektin akibat
vibrasi molekul polar selama iradiasi. Kristalinitas akan hancur sebelum
membentuk transisi gelas pada daerah amorf granula sehingga tidak terjadi
swelling.
Likuifikasi dan Sakarifikasi
Proses hidrolisis dapat dilakukan menggunakan asam maupun secara
enzimatis. Hidrolisis menggunakan asam memiliki kelemahan karena dapat
menimbulkan masalah korosi pada reaktor dan menghasilkan produk samping
yang dapat menghambat produk fermentasi (Gozan et al. 2007). Hidrolisis enzimatis bersifat spesifik dan ramah lingkungan. Pada tahap likuifikasi
digunakan enzim α-amilase yang akan memecah amilosa dan amilopektin pada
molekul pati. Pemecahan amilosa oleh α-amilase terjadi dalam dua tahap. Tahap pertama adalah degradasi amilosa menjadi amilosa rantai pendek kemudian
menjadi maltosa dan maltotriosa yang terjadi secara acak. Degradasi terjadi sangat
cepat dan diikuti dengan penurunan viskositas dengan cepat. Tahap kedua berjalan
yang tidak acak. Kerja α-amilase pada molekul amilopektin akan menghasilkan glukosa, maltosa, dan berbagai jenis α-limit dekstrin, yaitu oligosakarida yang
terdiri dari 4 atau lebih residu gula yang mengandung ikatan α-1,6 (Winarno
1995).
Selanjutnya hidrolisis molekul maltosa menjadi glukosa dilakukan oleh
enzim amiloglukosidase. Selain mengkonversi komponen maltosa menjadi
glukosa, enzim ini juga memutus ikatan α-1,6 pada dekstrin. Amiloglukosidase
bekerja lebih lambat dibandingkan enzim α-amilase. Pada tahap sakarifikasi digunakan konsorsium 3 enzim yaitu amiloglukosidase, selulase dan xilanase.
Dengan ini diharapkan memperbesar perolehan gula sederhana karena xilanase
dan selulase diharapakan mampu mengkonversi komponen serat menjadi gula
sederhana. Tabel 10 memperlihatkan perubahan komposisi karbohidrat selama
proses sakarifikasi.
Tabel 10 Pengaruh waktu sakarifikasi terhadap total gula, gula perduksi dan derajat polimerisasi (DP) yang dihasilkan
Tahap/ Pemanasan konvensional Pemanasan microwave
Jam ke- Gula
Pada Tabel 10 terlihat bahwa proses likuifikasi baik pada pemanasan
konvensional maupun microwave dapat meningkatkan konsentrasi gula pereduksi akibat pemecahan molekul pati menjadi glukosa. Peningkatan total gula juga
terjadi pada tahap ini akibat terbentuknya gula selain pati seperti glukosa, maltosa
konsentrasi gula pereduksi juga mengalami peningkatan. Hal ini disebabkan
enzim amiloglukosidase memecah maltosa, maltotriosa dan dekstrin yang
merupakan hasil proses likuifikasi menjadi glukosa. Peningkatan konsentrasi gula
pereduksi akibat penambahan enzim amiloglukosidase juga dilaporkan oleh Wong
et al. (2007). Konsentrasi gula pereduksi pada pati sagu tergelatinisasi setelah hidrolisis dengan amiloglukosidase meningkat sebesar 76,80%. Selain akibat kerja
amiloglukosidase, peningkatan konsentrasi gula pereduksi pada proses
sakarifikasi juga disebabkan oleh enzim penghidrolisis serat (selulase dan
xilanase). Enzim selulase akan memecah selulosa menjadi glukosa. Enzim
xilanase juga akan memecah monomer-monomer xilan dari hemiselulosa menjadi
xilosa.
Sebaliknya selama proses hidrolisis baik pada pemanasan konvensional
maupun microwave, terjadi penurunan nilai derajat polimerisasi (DP). Penurunan nilai DP disebabkan oleh meningkatnya monomer-monomer yang terbentuk
selama hidrolisis molekul pati dan serat oleh enzim. Setelah 72 jam hidrolisis,
terjadi peningkatan kembali nilai DP kemungkinan disebabkan oleh
penggabungan kembali monomer-monomer (repolimerisasi) menjadi
polidekstrosa (Safitri et al. 2009).
Waktu sakarifikasi terbaik berada pada jam ke 72, baik pada pemanasan
konvensional maupun microwave yang dapat dilihat dari nilai DP terendah. Nilai DP yang dihasilkan oleh pemasan konvensional dan microwave adalah sama yaitu
DP 1.3. Namun efisiensi penggunaan microwave terlihat dari waktu kontak yang singkat. Pemanasan dengan microwave dapat mengkonversi langsung pati menjadi gula dalam waktu yang relatif rendah. Dibandingkan dengan pemanasan
konvensional, laju reaksi hidrolisis pati menjadi glukosa meningkat 100 kali
dengan penggunaan iradiasi microwave (Kunlan et al. 2001). Selanjutnya Nikolic et al. 2008 menyatakan bahwa pemanasan microwave mempengaruhi swelling dan gelatinisasi granula pati dan sangat efisien merusak susunan kristalin pati dan
serat. Hal ini dapat meningkatkan susceptibility (sifat penerimaan) enzim yang diperlukan agar proses hidrolisis berlangsung efisien sehingga meningkatkan
Struktur serat empulur sagu menggunakan mikroskop cahaya terpolarisasi
memperlihatkan bahwa sebelum hidrolisis komponen serat masih cukup banyak
yang utuh (Gambar 14.1.a dan 14.1.b). Ini dapat dilihat dari warna biru pada serat
yang masih cukup banyak. Setelah hidrolisis terlihat bahwa struktur serat menjadi
rusak akibat kerja enzim penghidrolisis serat (selulase dan xilanase). Pada
pemanasan konvensional, hidrolisis serat hanya terjadi pada sisi-sisi serat. Hal ini
dapat dilihat dari warna kekuningan hanya ada pada bagian sisi serat. Berbeda
dengan pemanasan microwave, serat mengalami kebocoran dan warna kuning cukup banyak hingga bagian tengah serat. Hal ini menunjukkan bahwa pada
pemanasan microwave menyebabkan struktur kristalinitas serat berubah menjadi amorf sehingga penerimaan enzim meningkat dan enzim selulase dan xilanase
mampu mengkonversi serat menjadi oligosakarida. Struktur serat empulur sagu
sebelum dan setelah hidrolisis disajikan pada Gambar 14.
Gambar 14 Struktur serat empulur sagu menggunakan mikroskop cahaya terpolarisasi perbesaran 100x. (1a) pemansan konvensional sebelum hidrolisis, (1b) pemanasan microwave sebelum hidrolisis, (2a) pemanasan konvensional setelah hidrolisis, (2b) pemanasan microwave setelah hidrolisis.
Produksi etanol
Gula-gula sederhana hasil tahap sakarifikasi difermentasi menjadi etanol
dengan penambahan starter khamir (10%) dan nutrient pupuk (NPK dan ZA).
(a) (b)
(1)
Fermentasi berlangsung pada suhu 30 o
Tabel 11 Hasil pengukuran parameter fermentasi empulur sagu
C, pH 5, selama 72 jam. Pemanfaatan
substrat (∆S/S) oleh isolat MP dan H memperlihatkan hasil yang tidak jauh
berbeda, baik pada pemanasan konvensional maupun microwave. Hal ini menunjukkan bahwa kedua isolat mampu menggunakan substrat. Selain
kemampuan isolat dalam memanfaatkan substrat juga dilihat rendemen produk
yang terbentuk setiap gram substrat yang terpakai oleh mikroba (Yp/s). Dari nilai
Yp/s terlihat bahwa isolat MP menghasilkan rendemen produk yang lebih besar
dibandingkan isolat H. Hal ini menunjukkan bahwa isolat MP mengkonversi
substrat menjadi etanol, sedangkan isolat H selain mengkonversi substrat menjadi
etanol juga memanfatkannya untuk pembentukan asam organik, seperti asam
piruvat, asam laktat, atau asam asetat yang merupakan hasil reaksi samping pada
produksi etanol (Glazer dan Nikaido 2007). Kecenderungan isolat khamir
mengubah substrat menjadi asam organik dapat dilihat dari total asam dan kadar
etanol yang dihasilkan. Isolat H memiliki nilai total asam yang lebih tinggi
dibandingkan isolat MP, sebaliknya kadar etanol yang dihasilkan oleh isolat H
justru lebih kecil dibandingkan isolat MP. Hasil pengukuran parameter fermentasi
disajikan pada Tabel 11.
Isolat MP Isolat H
Parameter Pemanasan Pemanasan Pemanasan Pemanasan
Konvensional Microwave Konvensional Microwave
∆S/S 0.68 0.67 0.71 0.73
Yp/s 0.85 0.61 0.47 0.42
Total asam (mg/ml) 85.33 104.53 98.13 119.46
Kadar etanol (%) 8.11 7.06 5.77 4.28
Kadar etanol (g/l) 63.95 55.69 45.54 33.78
Jika membandingkan proses pre-treatment, total asam pada pemanasan microwave lebih tinggi dibandingkan dengan pemanasan konvensional. Hal ini
berkebalikan dengan kadar etanol yang dihasilkan oleh pemanasan microwave justru lebih kecil dari pemanasan konvensional. Ini diduga bahwa penggunaan
Iradiasi microwave menyebabkan terbentuknya senyawa hidroksi metil furfural (HMF) yang merupakan inhibitor dalam proses fermentasi etanol. Senyawa ini
terbentuk akibat degradasi lebih lanjut dari monosakarida karena reaksi
menggunakan microwave terjadi pada suhu yang sangat tinggi yaitu 200 oC (Tsubaki et al. 2009). Selain itu lignin yang terlarut akibat pemanasan pada suhu tinggi juga merupakan senyawa inhibitor dalam proses fermentasi. Hal yang sama
juga ditunjukkan oleh akumulasi pertambahan volume CO2 hasil fermentasi (Gambar 15). Pertambahan volume CO2 pada pemanasan konvensional lebih tinggi dibandingkan dengan pemansan microwave baik pada isolat MP maupun H.
SIMPULAN
Isolat khamir yang berasal dari buah melon (MP) dan pepaya (H) busuk
memiliki kemampuan untuk memanfaatkan substrat glukosa, serta mampu
mengkonversi hasil hidrolisis empulur sagu menjadi etanol.
Perlakuan pendahuluan/pretreatment menggunakan microwave tidak memberi pengaruh yang nyata dalam menghasilkan gula sederhana, yaitu total
gula (24-25 mg/ml) dan DP 1.3. Namun perlakuan microwave mempengaruhi struktur mikroskopik serat yang membuatnya menjadi lebih amorf.
Empulur sagu mengandung pati (73%) dan serat kasar (7.8%) dalam
jumlah yang cukup tinggi, sehingga berpotensi digunakan sebagai bahan baku
bioetanol. Pada proses likuifikasi digunakan enzim α-amilase, namun proses sakarifikasi digunakan konsorsium enzim yang diperoleh dari isolat lokal (selulase
dan xilanase) serta amiloglukosidase komersial pada suhu 60o
Isolat MP mampu menghasilkan etanol lebih tinggi (7.06-8.11%)
dibandingkan dengan isolat H (4.28-5.77%). Perlakuan microwave menyebabkan
terjadinya penurunan kadar etanol yang dihasilkan (4.28-7.06) dibandingkan
pemanasan konvensional (5.77-8.11%). Produksi etanol terbaik dihasilkan dari
isolat MP dengan pemanasan konvensional (8.11%).
C.
SARAN
Disarankan perlu dilakukan optimasi komposisi substrat dan kondisi
proses fermentasi agar terlihat jelas kemampuan isolat khamir dalam
menggunakan substrat dan menghasilkan etanol, dan melakukan identifikasi serta
Aiyer PV. 2005. Amylases and their applications. Afr J Biotechnol 4(13): 1525-1529.
Akyuni D. 2004. Pemanfaatan pati sagu (Metroxylon sp.) untuk pembuatan sirup
glukosa menggunakan α-amilase dan amiloglukosidase [skripsi]. Bogor: Fakultas Teknologi Pertanian, Institut Pertanian Bogor.
Bonciu C, Cristiana T, Gabriela B. 2010. Yeast isolation and selection for bioethanol production from inulin hydrolyzates. Innovat Rom Food Biotechnol (6).
Boyles D. 1984. Bio Energy-technology, Thermodynamics, and Cost. Weat Sussex: Ellis Horwood Limited.
Bustaman S. 2008. Strategi pengembangan bioetanol berbasis sagu di Maluku. Perspektif 7(2): 65-79.
D’Mello JPF. 2003. Food Safety. Contaminants and Toxins. Edinburg: CAB International.
Datta, AK. 2001. Fundamentals of Heat and Moisture Transport for Microwaveable Food Product and Process Development. Handbook of Microwave Technology for Food Applications. New York: Marcel Dekker Inc.
Derosya V. 2010. Sakarifikasi empulur sagu (Metroxylon sagu) dengan konsorsium enzim amilolitik dan holoselulolitik [skripsi]. Bogor: Fakultas Teknologi Pertanian, Institut Pertanian Bogor.
Dordick JS. 1991. Biocatalysts for industry. New York: Plenum press.
Dubois M, Gilles KA, Hamilton JK, Rebers PA, Smith F. 1956. Colorimetric method for determination of sugars and related substances. J Anal Chem 28(3):350-356.
Fengel D, Wegener G. 1995. Kimia Kayu, Reaksi Ultrastruktur: Terjemahan S. Hardjono. Yogyakarta: UGM Press.
Fujii S, Kishihara S, Komoto M. 1986. Studies on improvement of sago starch quality. Di dalam: Protect mankind from hunger, and the earth from devastation. Proceeding 3rd
Glazer AN, Nikaido H. 2007. Microbial Biotechnology, Fundamentals of Applied Microbiology 2
International sago symposium; Tokyo, 20-23 Mei 1986. Jepang: The Sago Palm Society. hlm 186-192.
nd
Judoamidjojo RM, Said EG, Hartoto L. 1989. Biokonversi. Depdikbud. Dirjen Pendidikan Tinggi. Bogor: Pusat Antar Universitas Bioteknologi, Institut Pertanian Bogor.
Keshwani DR. 2009. Microwave pretreatment of swichgrass for bioethanol production. [disertasi]. North Carolina: Biological and Agricultural Engineering. Raleigh.
Khan AW, Trottier TM, Patel GB, Martin SM. 1979. Nutrient requirement for the degradation of cellulose to methane by a mixed population of anaerobes. JGen Microbiol 112: 365-372.
Kunlan L, Lixin X, Jun L, Jun P, Guoyoing C, dan Zuwei X. 2001. Salt-assisted acid hydrolysis of starch to D-glucose under microwave irradiation. Carbohyd Res 331: 9-12.
Lathar PK, Sharma A, Thakur I. 2010. Isolation and random amplified DNA (RAPD) analysis of wild yeasts species from 17 different fruits. J Yeast Fungal Res 1(8): 146-151.
Magara K, Konhijima T. 1990. Low level of enzymatic susceptibility of microwave pre-treated softwood. Mokuzai: 611-617.
Meryandini A, Sunarti TC, Pratiwi FMR. 2008. Using Streptomyces xylanase to produce xylooligosaccaride from corncob. Biotropia 15(2): 19-128.
Meryandini A, Widosari W, Maranatha B, Sunarti TC, Rachmania N, Satria H. 2009. Isolasi bakteri selulolitik dan karakterisasi enzimnya. Makara Sains 13(1): 33-38.
Miller GL. 1959. Use of dinitrosalycilic acid reagent for determination of Reducing Sugar. JAnal Chem (31): 426-428.
Nikolic S, Mojovic L, Rakin M, Pejin D, Savic D. 2008. A microwave-assisted liquefaction as a pretratment for bioethanol production by simultaneous saccharification and fermentation of corn meal. CI and CEQ 14(4): 231-232.
Onsa GH, N. Saari, J. Selamat, J. Bakar. 2000. Latent polyphenol oxidases from sago log (Metroxylon sagu); partial purification, activation, and some properties. J Agric Food Chem 48: 5041−5045
Palav T, Seetharaman K. 2006. Mechanism of starch gelatinization and polymer leaching during microwave heating. Carbohydr Polym 65: 364-370.
Paturau JM. 1969. By Product of the cane sugar industry: an introduction to their industrial utilization. Amsterdam: Elsevier Scientific Publ Co.
Rao RS, Bhandra B, Shivaji S. 2008. Isolation and characterization of ethanol-producing yeasts from fruits and tree barks. Appl Microbiol 47(1): 19-24. Retno DE, Enny KA, Fadillah. 2009. Studi awal reaksi simultan sakarifikasi dan
Safitri R, Surosos L, Supitasari NS, Suyanto, Wulandari AP, Andayaningsih P, Haska N. 2009. Pengaruh berbagai konsentrasi asam sulfat dan enzim pada hidrolisis tepung empulur batang sagu (Metroxylon sagu rottb.), kombinasi hidrolisis kimiawi dan enzimatis terhadap kandungan gula pereduksi. Di dalam: Biomass Utilization for Alternative Energy and Chemicals. Prosiding Seminar Nasional Teknik Kimia; Bandung, 23 Apr 2009. Bandung: Perhimpunan Teknik Kimia Indonesia. hlm 314-321.
Sinaga N. 2010. Penampisan bakteri selulolitik untuk produksi prebiotik dari tongkol jagung [skripsi]. Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Sixta H. 2006. Multistage kraft pulping. Handbook of pulp. Weinheim: Wiley-Vch Verlag Gmbh & Co.
Sridar V. 1998. Microwave radiation as a catalyst for chemical reactions. Curr Sci 74 (5): 446-450.
Standar Nasional Indonesia (SNI). 1995. Pati sagu SNI 01-3729-1995. Pusat Standarisasi Industri. Departemen Perindustrian.
Taherzadeh MJ, Karimi K. 2008. Pretreatment of lignocelllulosic wastes to improve ethanol and biogas production: A Review. Int J Mol Sci 9: 1621-1651.
Tsubaki S, Nakauchi M, Ozaki Y, Azuma J. 2009. Microwave heating for solubilization of polysaccharide and polyphenol from soybean residue (Okara). Food Sci Technol Res 15(3): 307-314.
Varga E, Szengyel Z, Réczey K. 2002. Chemical pretreatments of corn stover for enhancing enzymatic digestibility. Appl Biochem Biotechnol 98: 73-88 Wibisono G. 2004. Hidrolisis enzimatis pati umbi-umbian Indonesia dengan alfa
amilase (bakterial) dan amilase pankreatin [skripsi]. Bogor: Fakultas Teknologi Pertanian, Institut Pertanian Bogor.
Winarno FG. 1995. Enzim pangan. Jakarta: Gramedia pustaka utama.
Wong CW, Muhammad SKS, Dzulkifly MH, Saari N, Ghazali HM. 2007. Enzymatic prodyction of linear long-chain dextrin from sago (Metroxylon sagu) starch. Food Chem 100: 774-780.
Xiang Q, Lee YY, Pettersson PO, Torget RW. 2003. Heterogeneous aspects of acid hydrolysis of alpha-cellulose. Appl Biochem Biotechnol 105– 108 :505–514.
Yu HM, Chen ST, Suree P, Nuansri R, Wang KT. 1996. Effect of microwave irradiation on acid-catalyzed hydrolysis of starch. Organic Chem 61: 9608– 9609.
Lampiran 1 Prosedur analisis parameter
1. Penentuan kadar total gula (Metode Phenol H2SO4
− Pembuatan kurva standar total gula
, Dubois 1956)
Pembuatan kurva standar total gula diperoleh dari pengukuran absorbansi
campuran glukosa-xilosa (1:1) pada berbagai konsentrasi (disajikan pada
Tabel di bawah). 1 ml larutan standar dimasukkan ke dalam tabung reaksi,
ditambahkan 0,5 ml larutan fenol 5% dan divortex. Setelah itu ditambahkan
2,5 ml H2SO4
Konsentrasi glukosa-xilosa (mg/ml)
pekat secara cepat, divortex, dan didinginkan selama 20 menit.
Setelah dingin larutan divortex dan diukur absorbansinya pada panjang
gelombang 490 nm.
Absorbansi (terkoreksi)
0,00 0,00
0,01 0,19
0,02 0,29
0,03 0,46
0,04 0,63
0,05 0,76
− Penentuan total gula sampel
Metode pengujian sampel sama dengan pembuatan kurva standar total gula,
tetapi 1 ml larutan gula standar diganti dengan 1 ml sampel. Kadar total gula
sampel diperoleh dari persamaan kurva standar dengan y sebagai nilai absorbansi
2. Penentuan kadar gula pereduksi (Metode Dinitrosalisilic acid, Miller
1959)
− Pembuatan pereaksi Dinitrosalisilic acid (DNS)
NaOH 10 g, K-NaTartarat 182 g, dan Na2SO4 0,5 g dilarutkan dalam 1000 ml H2
− Pembuatan kurva standar glukosa-xilosa
O steril dan diaduk menggunakan stirer tanpa pemanasan. Setelah semua
bahan terlarut ditambahkan DNS 10 g sedikit demi sedikit dan dilakukan
pengadukan sampai terlarut sempurna.
Pembuatan kurva standar diperoleh dari pengukuran absorbansi campuran
glukosa-xilosa standar (1:1) pada berbagai konsentrasi (disajikan pada Tabel di
bawah). 1 ml larutan standar dimasukkan ke dalam tabung reaksi, ditambahkan
1 ml larutan DNS dan divortex. Setelah itu larutan dipanaskan pada suhu
100°C selama 15 menit dan didinginkan sekitar 5 menit. Setelah dingin larutan
diukur absorbansinya pada panjang gelombang 540 nm.
Konsentrasi glukosa-xilosa (mg/ml)
Absorbansi (terkoreksi)
0,00 0,00
0,05 0,06
0,08 0,14
0,10 0,20
0,15 0,33
0,20 0,46
0,25 0,62