UJI KETAHANAN TANAMAN KEDELAI (Glycine max (L.) Merr.) HASIL
RADIASI SINAR GAMMA (M2) PADA CEKAMAN ALUMINIUM
SECARA IN VITRO
SKRIPSI
OLEH: Dinda Marizka
060307029/BDP-Pemuliaan Tanaman
PROGRAM STUDI PEMULIAAN TANAMAN DEPARTEMEN BUDIDAYA PERTANIAN
FAKULTAS PERTANIAN UNIVERSITAS SUMATERA UTARA
ABSTRAK
DINDA MARIZKA : Uji Ketahanan Tanaman Kedelai (Glycine max (L.) Merrill) Hasil Radiasi Sinar Gamma (M2) Pada Cekaman Aluminium Secara In Vitro, dibimbing oleh Ir. E. Harso Kardhinata, MSc dan Ir. Isman Nuriadi.
Pada tanah masam tingkat keracunan Al sangat tinggi, sehingga pertumbuhan tanaman terganggu, maka diperlukan keragaman genetik yang toleran terhadap Al. Untuk mendapatkan keragaman genetik yang lebih terarah, metode mutasi dengan menggunakan radiasi sinar gamma digabungkan dengan pengujian secara in vitro sehingga dapat membantu pengembangan tanaman yang toleran terhadap cekaman Al. Untuk itu suatu penelitian telah dilakukan di laboratorium kultur jaringan, Fakultas Pertanian, Universitas Sumatera Utara pada Januari sampai Maret 2010 menggunakan Rancangan Acak Lengkap faktor ganda yaitu dosis radiasi gamma (0 krad, 10 krad, 20 krad, dan 30 krad) dan konsentrasi AlCl3 (0 ppm, 150 ppm, 350 ppm, dan 450 ppm). Parameter yang diamati adalah persentase hidup, tinggi planlet, jumlah akar, jumlah daun, bobot total planlet, dan bobot akar.
Hasil penelitian menunjukkan bahwa dosis radiasi berbeda nyata terhadap jumlah daun, bobot akar, dan bobot total planlet. Konsentrasi aluminium tidak berpengaruh nyata terhadap semua parameter. Interaksi perlakuan berpengaruh nyata terhadap bobot total planlet.
ABSTRACT
DINDA MARIZKA : The resistant test of soybean (Glycine max (L.) Merrill) as the result of gamma radiation (M2) at aluminium stress by invitro culture, supervised by
Ir. E. Harso Kardhinata,MSc and Ir. Isman Nuriadi.
In the acid soil the level of Al poisoning is very high, and then annoy the plant growth, so it needed various genetics which tolerant to Al. To get more directive various genetics, mutation’s method which uses gamma radiation is combined with in vitro testing, so it can help plant development for Al tolerance. Therefore, the reaserch was held at plant tissue culture laboratory, faculty of agriculture, University of North Sumatera from January to March 2010. The research used completely randomized design with two factors. The first factor was dose of gamma radiation (0 krad, 10 krad, 20 krad, and 30 krad) and the second factor was concentration of AlCl3 (0 ppm, 150 ppm, 300 ppm, and 400 ppm). Parameter observed were : the
percetage of life, plantlet height, the number of root, the number of leaf, total weight of plantlet, and weight of root.
The result showed the radiation significantly affected to the number of leaf, total weight of plantlet, and weight of root. Consentration of AlCl3 not significantly
affected on all parameters. The interaction of the double factors significantly affected to total weight of plantlet.
RIWAYAT HIDUP
Penulis lahir di Medan pada tanggal 6 November 1988 dari ayah
Afifuddin, SE. dan ibu Dwi Wardani, S.Si. Penulis merupakan putri pertama dari dua
bersaudara.
Tahun 2006 penulis lulus dari SMA Negeri 3, Medan dan pada tahun yang
sama masuk ke Fakultas Pertanian USU melalui jalur ujian tertulis Seleksi
Penerimaan Mahasiswa Baru. Penulis memilih program studi Pemuliaan Tanaman,
Departemen Budidaya Pertanian.
Selama mengikuti perkuliahan, penulis menjadi asisten Pemuliaan Tanaman
Lanjutan (TA. 2008-2009), asisten Bioteknologi Pertanian (TA. 2009-2010), dan
menjadi anggota pengajian Nahdatussuban.
Penulis melaksanakan praktek kerja lapangan (PKL) di Balai Penelitian Karet
Sungei Putih di Desa Sungei Putih, Kecamatan Galang, Kabupaten Deli Serdang pada
KATA PENGANTAR
Puji dan syukur penulis ucapkan kepada Allah SWT, atas segala rahmat dan
karuniaNya sehingga penulis dapat menyelesaikan skripsi yang berjudul Uji
Ketahanan Tanaman Kedelai (Glycine max (L.) Merrill) Hasil Radiasi Sinar Gamma (M2) Pada Cekaman Aluminium Secara In Vitro.
Pada kesempatan ini penulis mengucapkan terima kasih kepada kedua orang
tua penulis yang telah membesarkan, merawat dan mendidik penulis serta kepada
Bapak Ir. E. Harso Kardhinata, MSc selaku ketua komisi pembimbing dan
Bapak Ir. Isman Nuriadi selaku anggota komisi pembimbing yang telah membimbing
dan memberikan berbagai masukan berharga kepada penulis sampai pada ujian akhir.
Penulis juga mengucapkan terima kasih kepada adikku tersayang Iqbal
yang menjadi penyemangat selama perkuliahan. Terima kasih juga kepada
Wahyu Tata Mualim, 7 kurcaci (PET ’06), 10 brothers, kakak dan abang angkatan
2005, adik-adik angkatan 2007, adik-adik angkatan 2008 serta semua rekan
mahasiswa yang tidak dapat disebutkan satu per satu yang telah membantu penulis
dalam penelitian dan menyelesaikan skripsi ini. Semoga skripsi ini bermanfaat bagi
seluruh pihak yang memerlukan.
Penulis menyadari bahwa skripsi ini jauh dari sempurna. Oleh karena itu,
penulis mengharapkan kritik dan saran yang bersifat membangun demi kesempurnan
skripsi ini.
Medan, Juni 2010
DAFTAR ISI
Pemuliaan Tanaman dengan Radiasi Sinar Gamma ... 11
Cekaman Aluminium ... 17
BAHAN DAN METODE PENELITIAN Tempat dan Waktu Penelitian ... 20
Bahan dan Alat ... 20
Persiapan Bahan Tanaman ... 24
Penanaman Eksplan... 25
Pemeliharaan Eksplan ... 25
Pengamatan Parameter ... 26
Persentase Tumbuh (%) ... 26
Tinggi Plantlet (cm) ... 26
Jumlah Daun (helai) ... 26
Bobot Total Planlet (g) ... 26
Bobot Akar (g) ... 26
HASIL DAN PEMBAHASAN Hasil ... 27
Persentase Hidup (%) ... 27
Tinggi Planlet (cm) ... 27
Jumlah Akar (helai) ... 28
Jumlah Daun (helai) ... 28
Bobot Total Planlet (g) ... 39
Bobot Akar (g) ... 30
Pembahasan ... 31
Pengaruh dosis radiasi sinar gamma terhadap pertumbuhan tanaman kedelai hasil radiasi sinar gamma (M2) secara in vitro... 31
Pengaruh konsentrasi aluminium ... 33
Pengaruh interaksi antar dosis radiasi sinar gamma dan konsentrasi aluminium ... 35
KESIMPULAN DAN SARAN Kesimpulan ... 36
Saran ... 36
DAFTAR TABEL
Hal
1. Rataan persentase hidup (%) dengan perlakuan radiasi dan AlCl3 ... 27
2. Rataan tinggi planlet (cm) dengan perlakuan radiasi dan AlCl3 ... 28
3. Rataan jumlah akar (helai) dengan perlakuan radiasi dan AlCl3 ... 28
4. Rataan jumlah daun (helai) dengan perlakuan radiasi dan AlCl3 ... 29
5. Rataan bobot total planlet (g) dengan perlakuan radiasi dan AlCl3 ... 30
DAFTAR LAMPIRAN
Hal
1. Deskripsi Varietas Kedelai ... 41
2. Bagan Penelitian... 42
3. Jadwal Kegiatan ... 43
4. Komposisi Media Dasar MS ... 44
5. Data pengamatan persentase hidup (%) ... 45
6. Transformasi akar kuadrat x+0.5 data pengamatan persentase hidup ... 45
7. Daftar sidik ragam persentase hidup (%) ... 46
8. Data pengamatan tinggi planlet (cm) ... 47
9. Transformasi akar kuadrat x+0.5 data pengamatan tinggi planlet ... 47
10. Daftar sidik ragam tinggi planlet (cm) ... 48
11. Data pengamatan jumlah akar (helai) ... 49
12. Transformasi akar kuadrat x+0.5 data pengamatan jumlah akar ... 49
13. Daftar sidik ragam data pengamatan jumlah akar (helai) ... 50
14. Data pengamatan jumlah daun (helai)... 51
15. Transformasi akar kuadrat x+0.5 data pengamatan jumlah daun ... 51
16. Daftar sidik ragam jumlah daun (helai) ... 52
17. Data pengamatan bobot total planlet (g) ... 53
18. Transformasi akar kuadrat x+0.5 data pengamatan bobot total planlet ... 53
19. Daftar sidik ragam bobot total planlet (g) ... 54
20. Data pengamatan parameter bobot akar (g)... 55
21. Transformasi akar kuadrat x+0.5 data pengamatan parameter bobot akar ... 55
22. Daftar sidik ragam bobot akar (g) ... 56
ABSTRAK
DINDA MARIZKA : Uji Ketahanan Tanaman Kedelai (Glycine max (L.) Merrill) Hasil Radiasi Sinar Gamma (M2) Pada Cekaman Aluminium Secara In Vitro, dibimbing oleh Ir. E. Harso Kardhinata, MSc dan Ir. Isman Nuriadi.
Pada tanah masam tingkat keracunan Al sangat tinggi, sehingga pertumbuhan tanaman terganggu, maka diperlukan keragaman genetik yang toleran terhadap Al. Untuk mendapatkan keragaman genetik yang lebih terarah, metode mutasi dengan menggunakan radiasi sinar gamma digabungkan dengan pengujian secara in vitro sehingga dapat membantu pengembangan tanaman yang toleran terhadap cekaman Al. Untuk itu suatu penelitian telah dilakukan di laboratorium kultur jaringan, Fakultas Pertanian, Universitas Sumatera Utara pada Januari sampai Maret 2010 menggunakan Rancangan Acak Lengkap faktor ganda yaitu dosis radiasi gamma (0 krad, 10 krad, 20 krad, dan 30 krad) dan konsentrasi AlCl3 (0 ppm, 150 ppm, 350 ppm, dan 450 ppm). Parameter yang diamati adalah persentase hidup, tinggi planlet, jumlah akar, jumlah daun, bobot total planlet, dan bobot akar.
Hasil penelitian menunjukkan bahwa dosis radiasi berbeda nyata terhadap jumlah daun, bobot akar, dan bobot total planlet. Konsentrasi aluminium tidak berpengaruh nyata terhadap semua parameter. Interaksi perlakuan berpengaruh nyata terhadap bobot total planlet.
ABSTRACT
DINDA MARIZKA : The resistant test of soybean (Glycine max (L.) Merrill) as the result of gamma radiation (M2) at aluminium stress by invitro culture, supervised by
Ir. E. Harso Kardhinata,MSc and Ir. Isman Nuriadi.
In the acid soil the level of Al poisoning is very high, and then annoy the plant growth, so it needed various genetics which tolerant to Al. To get more directive various genetics, mutation’s method which uses gamma radiation is combined with in vitro testing, so it can help plant development for Al tolerance. Therefore, the reaserch was held at plant tissue culture laboratory, faculty of agriculture, University of North Sumatera from January to March 2010. The research used completely randomized design with two factors. The first factor was dose of gamma radiation (0 krad, 10 krad, 20 krad, and 30 krad) and the second factor was concentration of AlCl3 (0 ppm, 150 ppm, 300 ppm, and 400 ppm). Parameter observed were : the
percetage of life, plantlet height, the number of root, the number of leaf, total weight of plantlet, and weight of root.
The result showed the radiation significantly affected to the number of leaf, total weight of plantlet, and weight of root. Consentration of AlCl3 not significantly
affected on all parameters. The interaction of the double factors significantly affected to total weight of plantlet.
PENDAHULUAN
Latar Belakang
Kedelai (Glycine max L. Merr.) merupakan sumber bahan baku utama bagi
kelangsungan berbagai industri antara lain tempe dan tahu. Kacang-kacangan
memiliki prospek yang multiguna, sehingga memiliki prospek yang cerah untuk
dikembangkan. Indonesia memiliki ketergantungan yang tinggi terhadap impor
kacang-kacangan, terutama kacang kedelai. Padahal, Indonesia memiliki
peluang yang sangat besar untuk meningkatkan produksi kacang-kacangan
(Fachruddin, 2007). Untuk menurunkan volume impor kedelai, pemerintah terus
berupaya meningkatkan produksi kedelai, terutama dengan memanfaatkan lahan
masam (Notohadiprawiro, 1983).
Berdasarkan Badan Pusat Statistik (2010) produksi kedelai tahun 2009
(ATAP) sebesar 974,51 ribu ton biji kering, meningkat sebanyak 198,80 ribu ton
(25,63 persen) dibandingkan tahun 2008. Produksi kedelai tahun 2010 (ARAM II)
diperkirakan sebesar 927,38 ribu ton biji kering, menurun sebanyak 47,13 ribu ton
(4,84 persen) dibandingkan tahun 2009. Penurunan produksi diperkirakan terjadi
karena penurunan luas panen seluas 44,35 ribu hektar (6,14 persen), sedangkan
produktivitas diperkirakan mengalami kenaikan sebesar 0,19 kuintal/hektar
(1,41 persen).
Pada tanah asam, kelarutan Al dan Fe tinggi. Akibatnya, pada pH sangat
Kelarutan beberapa unsur menurun, ditambah lagi dengan adanya keracunan Al dan
Fe (Rosmarkam dan Yuwono, 2002).
Salah satu upaya yang perlu dilakukan adalah menemukan varietas unggul.
Untuk merakit varietas unggul tersebut, ketersediaan sumber genetik yang
mempunyai keragamanan tinggi sangat dibutuhkan. Semakin tinggi keragaman
genetik plasma nutfah, semakin tinggi peluang untuk memperoleh varietas unggul
baru yang mempunyai sifat yang diinginkan (Indriani, dkk, 2008).
Beberapa cara untuk memperluas keragaman genetik dalam seleksi dapat
ditempuh antara lain dengan cara mengumpulkan material koleksi lokal, introduksi
dari luar negeri, persilangan dan dengan mutasi buatan. Mutasi buatan pada
hakekatnya berusaha untuk merombak susunan gen di dalam kromosom. Mutasi
buatan tersebut dapat dilakukan dengan menggunakan sinar radioaktif seperti sinar
gamma, sinar-X, dan dapat juga digunakan bahan kimia tertentu seperti : ethyl
methane sulphonate (EMS), diethyl sulphate (dES), Cholchisin, dan lain-lain
(Chope, dkk, 1974).
Sinar gamma merupakan gelombang elektromagnetik yang bergerak dengan
kecepatan sangat tinggi, hampir menyamai kecepatan cahaya. Arahnya tidak
dipengaruhi medan magnet dan mempunyai daya ionisasi kecil serta daya tembus
yang tinggi. Sinar gamma mempunyai panjang gelombang yang lebih pendek
daripada sinar-X sehingga mempunyai energi yang lebih tinggi (Soeminto, 1985).
Untuk mendapatkan keragaman yang lebih terarah, metode mutasi
sangat berguna untuk menghasilkan populasi somaklon yang memiliki karakteristik
unggul tertentu sehingga dapat membantu pengembangan galur tanaman yang toleran
terhadap cekaman kekeringan, Al tinggi, hama dan penyakit. Dengan teknik kultur
jaringan dapat diseleksi secara in vitro dalam media yang sesuai. Intensitas seleksi
dapat diperkuat dan dapat dibuat lebih homogen sehingga meningkatkan frekuensi
didapatkannya tanaman dengan sifat yang diinginkan (Sutjahjo, 2006).
Dari uraian di atas, maka penulis tertarik untuk melakukan penelitian
pengujian ketahanan tanaman kedelai terhadap cekaman aluminium secara
in vitro.
Tujuan Penelitian
Untuk mengetahui pertumbuhan tanaman kedelai generasi M2 dibawah
cekaman Aluminium secara in vitro.
Hipotesis Penelitian
1. Ada pengaruh dosis radiasi sinar gamma terhadap pertumbuhan tanaman kedelai
hasil radiasi sinar gamma (M2) secara in vitro.
2. Ada pengaruh konsentrasi aluminium terhadap pertumbuhan tanaman kedelai
hasil radiasi sinar gamma (M2) secara in vitro.
3. Ada pengaruh interaksi antara dosis radiasi sinar gamma dan konsentrasi
aluminium terhadap pertumbuhan tanaman kedelai hasil radiasi sinar gamma
Kegunaan Penelitian
1. Sebagai salah satu syarat untuk dapat memperoleh gelar sarjana di Fakultas
Pertanian Universitas Sumatera Utara, Medan.
TINJAUAN PUSTAKA
Botani Tanaman
Menurut Sharma (1993), tanaman kedelai diklasifikasikan sebagai
berikut:
Kingdom : Plantae
Divisio : Spermatophyta
Subdivisio : Angiospermae
Class : Dicotyledoneae
Ordo : Polypetales
Family : Papilonaceae
Genus : Glycine
Species : Glycine max (L.)
Kedelai mempunyai susunan genom diploid (2n) dengan 20 pasang
kromosom, beberapa jenis liar kedelai juga mempunyai 20 pasang kromosom.
Kedelai yang ditanam sekarang diperkirakan berasal dari jenis liar
Glycine soja = Glycine usunensis. Glycine soja mempunyai bentuk polong dan biji yang hampir sama dengan kedelai biasa, tetapi tumbuhnya merambat dan kulit bijinya
sangat tebal, sehingga embrio dan keping bijinya terlindungi dengan baik
Kedelai berakar tunggang, pada tanah subur dan gembur akar dapat tumbuh
sampai kedalaman 150 cm. Pada akar kedelai terdapat bintil akar yang merupakan
koloni-koloni dari bakteri Rhizobium yaponicum. Pada tanah-tanah yang telah
mengandung bakteri Rhizobium, bintil akar mulai terbentuk pada umur 15 – 20 hari
setelah tanam. Pada tanah yang belum pernah ditanam kedelai bakteri Rhizobium
tidak terdapat dalam tanah sehingga bintil akar tidak terbentuk
(Departemen Pertanian, 1990).
Kedelai adalah tanaman setahun yang tumbuh tegak (tinggi 70-150 cm),
menyemak, berbulu halus (pubescens), dengan system perakaran luas
(Rubatzky dan Yamaguchi, 1997). Batang dapat membentuk 3-6 cabang. Tipe
pertumbuhan dapat dibedakan menjadi 3 macam yakni indeterminit, diterminit dan
semi diterminit (Departemen Pertanian, 1990).
Terdapat empat tipe daun yang berbeda, yaitu kotiledon atau daun biji, daun
primer sederhana, daun bertiga, dan daun profila. Daun primer sederhana berbentuk
telur (oval) berupa daun tunggal (unifoliat) dan bertangkai sepanjang 1-2 cm, terletak
bersebrangan pada buku pertama di atas kotiledon. Daun-daun berikutnya daun
bertiga (trifoliat), namun adakalanya terbentuk daun berempat atau daun berlima
(Hidayat, 1985).
Susunan bunga ditangkai axilar atau rangkaian terminal dengan 3-30 bunga;
bunganya kecil, berwarna ungu atau putih; kelopaknya berbentuk pipa
(Van der Maesen and Somaatmadja, 1992). Corolla (mahkota bunga) terdiri atas
berkembang membentuk seludang yang mengelilingi putik, sedangkan stamen yang
ke sepuluh terpisah bebas (Poehlman and Sleper, 1995).
Biji kedelai berkeping dua terbungkus kulit biji dan tidak mengandung
jaringan endosperma. Embrio terletak diantara keping biji. Warna kulit biji kuning,
hitam, hijau, atau coklat. Pusar biji (hilum) adalah jaringan bekas biji melekat pada
dinding buah, bentuk biji kedelai pada umumnya bulat lonjong, tetapi ada juga yang
bundar atau bulat agak pipih (Departemen Pertanian, 1990).
Kultur In Vitro
Kultur jaringan atau budidaya in vitro adalah suatu metode untuk mengisolasi
bagian dari tanaman seperti protoplasma, sel, jaringan atau organ yang serba steril,
ditumbuhkan pada media buatan yang steril, dalam botol kultur yang steril, dan dalam
kondisi yang aseptik dan lingkungan yang terkontrol, sehingga bagian-bagian tersebut
dapat memperbanyak diri dan beregenerasi menjadi tanaman yang lengkap
Kemampuan sel untuk berdiferensiasi disebut totipotensi. Ke arah mana
sel-sel tanaman dapat diinduksi untuk mengekspresikan totipotensinya, sangat tergantung
pada sejumlah variabel termasuk faktor eksplan, komposisi medium, zat pengatur
tumbuh, dan stimulus fisik, seperti cahaya, suhu dan kelembaban. Setiap variabel
dapat berbeda pengaruhnya terhadap setiap organ tanaman tertentu dan berdasarkan
tujuan pengkulturan. Diantara faktor-faktor tersebut, lima variabel utama harus
medium dasar, keterlibatan zat pengatur tumbuh, serta faktor-faktor lingkungan
di mana kultur ditempatkan (Zulkarnain, 2009).
Perbaikan tanaman melalui variasi somaklonal dapat dilakukan dengan
beberapa cara, antara lain melalui kultur jaringan dan radiasi. Variasi somaklonal
melalui kultur jaringan umumnya terjadi pada kultur kalus akibat pengaruh media
kultur, sedangkan variasi somaklonal melalui radiasi dapat dilakukan secara fisik
dengan menggunakan sinar gamma atau secara kimiawi. Untuk megarahkan
keragaman yang timbul akibat pengaruh radiasi, setelah diradiasi, eksplan
ditanam dalam media kultur yang mengandung agen seleksi (seleksi in vitro). Teknik
ini telah menghasilkan beberapa nomor tanaman potensial, seperti nilam dengan
kadar minyak lebih tinggi, padi dan kedelai tahan aluminium, padi tahan kekeringan,
dan pisang tahan layu Fusarium
Dalam perbanyakan tanaman secara kultur jaringan, eksplan merupakan faktor
penting penentu keberhasilan. Umur fisiologis, umur ontogenik, ukuran eksplan, serta
bagian tanaman yang diambil merupakan hal-hal yang harus dipertimbangkan dalam
memilih eksplan yang akan digunakan sebagai bahan awal kultur. Umumnya, bagian
tanaman yang digunakan sebagai eksplan adalah jaringan muda yang sedang tumbuh
aktif. Jaringan tanaman yang masih muda mempunyai daya regenerasi lebih tinggi,
sel-sel masih aktif membelah diri, dan relatif lebih bersih (mengandung lebih sedikit
kontaminan) (Yusnita, 2003).
Penggunaan embrio tanaman sebagai eksplan dikenal dengan kultur embrio
kultur jaringan untuk mendapatkan tanaman yang viabel. Faktor-faktor yang
mempengaruhi kultur embrio yaitu genotip, hasil perkembangan embrio setelah
diisolasi, kondisi tanaman induk, zat hara dalam media, cahaya dan suhu
(Gunawan, 1988).
Walaupun tanaman dapat diperoleh dari sejumlah besar genotip, kemampuan
beregenerasi setiap genotip berbeda. Pengaruh genotip pada proliferasi sel dapat
dilihat pada kapasitas regeneratifnya. Pada umumnya tanaman dikotil lebih mudah
berproliferasi daripada tanaman monokotil. Selain itu, tanaman gymnospermae
memiliki kapasitas regeneratif yang lebih terbatas dibandingkan dengan tanaman
angiospermae (Zulkarnain, 2009).
Hampir dapat dipastikan bahwa kesuksesan kegiatan kultur jaringan akan
sangat ditentukan dan tergantung oleh pilihan media yang digunakan. Harus diingat
bahwa teknik kultur jaringan menekankan lingkungan yang cocok agar eksplan dapat
tumbuh dan berkembang. Lingkungan yang cocok, sebagian akan terpenuhi bila
media yang dipilih mempertimbangkan apa-apa yang diperlukan oleh tanaman.
Secara umum kebutuhan nutrisi kebanyakan tanaman sama, tetapi secara khusus hal
tersebut berbeda. Kesamaannya adalah tanaman memerlukan hara makro dan mikro,
vitamin-vitamin, karbohidrat (gula), asam amino dan N-organik, zat pengatur
tumbuh, zat pemadat dan kadang ada penambahan bahan-bahan seperti air kelapa,
ekstrak ragi, jus tomat, ekstrak kentang, buffer organik, ataupun arang aktif.
Kebutuhan tiap tanaman berbeda pada hal komposisi dan jumlah yang diperlukan
Medium MS yang direvisi (Murashige dan Skoog, 1962) adalah yang paling
luas penggunaannya dibandingkan dengan media dasar lainnya. Medium MS yang
direvisi-selanjutya disebut MS-banyak digunakan, terutama pada mikropropagasi
tanaman dikotil dengan hasil yang memuaskan. Hal itu dikarenakan medium MS
memiliki kandungan garam-garam yang lebih tinggi daripada media lain, disamping
kandungan nitratnya juga tinggi (Zulkarnain, 2009).
Kondisi lingkungan yang menentukan keberhasilan kultur jaringan meliputi
cahaya, suhu dan komponen atmosfer. Cahaya dibutuhkan untuk mengatur proses
foto morfogenetik tertentu. Dalam teknik kultur jaringan tanaman, cahaya dinyatakan
dengan dimensi lama penyinaran, intensitas dan kualitasnya. Prof. Murashige
menyarankan untuk mengasumsikan kebutuhan lama penyinaran pada kultur jaringan
tanaman merupakan pencerminan dari kebutuhan perioditas tanaman yang
bersangkutan di lapangan. Kualitas cahaya mempengaruhi arah diferensiasi jaringan.
Energi radiasi dekat spektrum ultra violet dan biru merupakan kualitas cahaya yang
paling efektif untuk merangsang pembentukan tunas, sedangkan pembentukan akar
dirangsang oleh cahaya merah dan sedikit cahaya biru. Untuk itu, pada tahap
multiplikasi tunas digunakan untuk pencahayaan dengan lampu fluorescent (TL).
Secara umum, intensitas cahaya yang optimum untuk tanaman pada kultur tahap
inisiasi kultur adalah 0-1000 lux, tahap multiplikasi sebesar 1000-10000 lux, tahap
pengakaran sebesar 10000-30000 lux, dan aklimatisasi sebesar 30000 lux
Suhu juga berpengaruh terhadap kesehatan tanaman yang dikulturkan. Suhu
yang umum digunakan untuk pengkulturan berbagai jenis tanaman adalah
260 – 200 C. Untuk kebanyakan tanaman, suhu yang terlalu rendah (kurang dari
200 C) dapat menghambat pertumbuhan, dan suhu yang terlalu tinggi (lebih dari
320 C) menyebabkan tanaman merana. Namun pada kultur tanaman yang biasanya
memerlukan suhu rendah untuk pertumbuhan terbaiknya, seperti stroberi, suhu yang
diperlukan juga lebih rendah (Yusnita, 2003).
Faktor penting lain yang juga perlu mendapat perhatian, adalah pH yang harus
diatur sedemikian rupa sehingga tidak mempengaruhi fungsi membran sel dan pH
dari sitoplasma. Pengaturan pH selain memperhatikan kepentingan fisiologi sel, juga
harus mempertimbangkan faktor-faktor kelarutan dari garam-garam penyusun media,
pengambilan (uptake) dari zat pengatur tumbuh dan garam-garam lain, dan efisiensi
pembekuan agar-agar. Sel-sel tanaman membutuhkan pH yang sedikit asam berkisar
antara 5.5-5.8 (Gamborg dan Shyluk 1981). Pengaturan pH, biasa dilakukan dengan
menggunakan NaOH (atau kadang-kadang KOH) atau HCl pada waktu semua
komponen sudah dicampurkan, seringkali setelah sterilisasi pH-nya berubah. Pada
umumnya terdapat penurunan pH setelah disterilkan dalam autoklaf. Untuk mencapai
pH sekitar 5.7-5.9, Mann dkk dalam George dan Sherrington (1984) membuat pH 7.0
dalam media yang belum disterilkan. Untuk menghindarkan perubahan pH yang
cukup besar, Murashige dan Skoog menyarankan agar dilakukan pemanasan untuk
melarutkan agar-agar dan memanaskan beberapa menit media dalam autoklaf, baru
disterilkan dalam autoklaf. Dalam wadah yang besar media disterilkan dan kemudian
dititrasi dengan NaOH atau HCl steril sampai pH yang diinginkan. Selanjutnya media
dituang ke dalam wadah kultur steril yang telah dipersiapkan di dalam laminar air
flow cabinet. Cara ini juga digunakan dalam penelitian yang menggunakan media
dengan pH rendah untuk tujuan seleksi (Gunawan, 1988).
Pemuliaan Tanaman dengan Radiasi Sinar Gamma
Mutasi adalah perubahan susunan atau konstruksi dari gen maupun kromosom
suatu individu tanaman, sehingga memperlihatkan penyimpangan (perubahan) dari
individu asalnya dan bersifat baka (turun-temurun). Mutasi dapat terjadi secara
alamiah, tetapi frekuensinya sangat rendah, yaitu 10-6 pada setiap generasi. Untuk
mempercepat terjadinya mutasi dapat dilakukan secara buatan dengan memberikan
perlakuan-perlakuan sehingga terjadi mutasi (induced mutation). Mutasi pada
tanaman dapat menyebabkan perubahan-perubahan pada bagian-bagian tanaman
baik bentuk maupun warnanya juga perubahan pada sifat-sifat lainnya
(Herawati dan Setiamihardja, 2000).
Mutasi dapat terjadi pada setiap bagian tanaman dan fase pertumbuhan
tanaman, namun lebih banyak terjadi pada bagian yang sedang aktif mengadakan
pembelahan sel seperti tunas, biji dan sebagainya. Secara molekuler, dapat dikatakan
bahwa mutasi terjadi karena adanya perubahan urutan (sequence) nukleotida DNA
kromosom, yang mengakibatkan terjadinya perubahan pada protein yang dihasilkan
Tujuan pemuliaan mutasi adalah (1) untuk memperbaiki satu atau beberapa
karakter khusus dari suatu kultivar/galur, (2) untuk membentuk penanda morfologi
(warna, rambut, braktea, dan lain-lain) sebagai identitas pada galur-galur harapan,
(3) untuk membentuk galur mandul jantan yang berguna bagi pembentukan kultivar
hibrida, (4) untuk mendapatkan karakter khusus dalam genotipe yang telah
beradaptasi (Herawati dan Setiamihardja, 2000).
Baik mutagen kimia maupun mutagen fisika memiliki energi nuklir yang
dapat merubah struktur materi genetik tanaman. Perubahan yang terjadi pada materi
genetik dikenal dengan istilah mutasi (mutation). Secara relatif, proses mutasi dapat
menimbulkan perubahan pada sifat-sifat genetis tanaman baik ke arah positif maupun
negatif, dan kemungkinan mutasi yang terjadi dapat juga kembali normal (recovery).
Mutasi yang terjadi ke arah “sifat positif” dan terwariskan (heritable) ke
generasi-generasi berikutnya merupakan mutasi yang dikehendaki oleh pemulia tanaman pada
umumnya. Sifat positif yang dimaksud adalah relatif tergantung pada tujuan
pemuliaan tanaman
Menurut Mugiono (2001) macam dan tipe mutagen fisis adalah sebagai
berikut :
1. Sinar X
Dihasilkan dari tabung sinar X, tegangannya relatif rendah dengan panjang
2. Sinar Gamma
Dipancarkan dari isotop radioaktif, panjang gelombang lebih pendek dari sinar X,
lebih kuat daya tembusnya, dikenal dengan sinar kuat.
3. Sinar Ultraviolet
Panjang gelombangnya terletak antara sinar X (50 – 0,15 A°) dan cahaya yang
terlihat (7.800 – 3.800 A°). Panjang gelombang yang paling efektif untuk
membuat mutasi adalah 2.000 A°.
4. Partikel Alfa
Berasal dari inti beberapa isotop yang tidak stabil bermuatan positif dengan daya
tembus rendah.
5. Partikel Beta
Berasal dari isotop yang tidak stabil, bermuatan negatif, dengan daya tembus
lebih besar daripada partikel alfa.
6. Neutron
Dipancarkan dari inti isotop radioaktif tertentu dengan daya tembus kuat dan
mempunyai arti penting dalam pemuliaan mutasi sebagai mutagen.
Iradiasi adalah suatu pancaran energi yang berpindah melalui
partikel-partikel yang bergerak dalam ruang atau melalui gerak gelombang cahaya.
Zat yang dapat memancarkan iradiasi disebut zat radioaktif. Zat radioaktif adalah zat
yang mempunyai inti atom tidak stabil, sehingga zat tersebut mengalami transformasi
spontan menjadi zat dengan inti atom yang lebih stabil dengan mengeluarkan partikel
atau sifat sinar tertentu. Proses tranformasi spontan ini disebut peluruhan, sedangkan
akibat peluruhan inti atom dapat berupa partikel alfa, beta, dan sinar gamma. Pada
umumnya sinar gamma yang digunakan untuk radiasi adalah hasil peluruhan inti
atom Cobalt-60. Cobalt-60 adalah sejenis metal yang mempunyai karateristik hampir
sama dengan besi/nikel (Sinaga, 2000).
Pengaruh penyimpanan terhadap materi yang telah diradiasi bergantung pada
kadar air dan ketersediaan oksigen. Pada biji yang terlalu kering reaksi oksigen
dengan ion radikal bebas akan terus berlangsung dan akan membentuk senyawa
peroksida yang merusak. Untuk mengurangi kerusakan tersebut, biji yang telah
diradiasi disimpan dalam suhu rendah (00C) (Mugiono, 2001).
Mutasi tidak dapat diamati pada generasi M1, kecuali yang termutasi adalah
gamet haploid. Adanya mutasi dapat ditentukan pada generasi M2 dan seterusnya.
Semakin tinggi dosis, maka semakin banyak terjadi mutasi dan makin banyak pula
kerusakannya. Hubungan antara tinggi bibit dan kemampuan hidup tanaman M1
dengan frekuensi mutasi, membuktikan bahwa penilaian kuantitatif terhadap
kerusakan tanaman M1 dapat digunakan sebagai indikator dalam permasalahan
pengaruh dosis pada timbulnya mutasi (Mugiono, 2001).
Kerusakan fisiologis kemungkinan dapat disebabkan karena kerusakan
kromosom dan kerusakan sel di luar kromosom. Kedua kerusakan tersebut sukar
dibedakan karena keduanya terjadi pada generasi M1 sebagai akibat dari perlakuan
mutagen. Kerusakan tersebut merupakan gangguan fisiologis bagi pertumbuhan
tanaman. Besarnya kerusakan fisiologis tergantung pada besarnya dosis yang
fisiologis yang timbul dan berakhir kematian (lethalitas). Kerusakan fisiologis hanya
terjadi pada generasi M1 sedangkan mutasi gen, mutasi kromosom dan mutasi
sitoplasma akan diturunkan pada generasi berikutnya (Mugiono, 2001).
Perlakuan radiasi akan menyebabkan kerusakan sel atau terhambatnya
metabolisme sel karena adanya gangguan sintesa RNA sehingga sintesis enzim yang
diperlukan untuk pertumbuhan terhambat. Dengan adanya gangguan struktur DNA
akan menyebabkan enzim yang dihasilkan kehilangan fungsinya. Perlakuan radiasi
dapat menyebabkan enzim yang merangsang pertunasan menjadi tidak aktif, sehingga
pertumbuhan tanaman terhambat (Cassaret,1961).
Mutasi gen kloroplas atau mitokondria sering disebut mutasi diluar inti atau
extranuclear mutation. Mutasi pada gen kloroplas dapat menyebabkan kerusakan gen mutan (defective mutant genes) yang kemudian dapat mengganggu proses fotosintesis
pada daun. Alhasil, dampak mutasi gen kloroplas sering diekspresikan dengan
munculnya gejala warna belang pada daun tanaman, misalnya warna belang
hijau-putih pada tanaman Pelargonium dan Mirabilis jalapa (bunga pukul empat)
Perlakuan dengan mutagen dapat menyebabkan pula sterilitas, yaitu:
hambatan pertumbuhan sehingga menghalangi pembungaan, terbentuknya bunga
yang tidak sempurna, terbentuknya bunga dengan tepung sari mandul, pembentukan
embrio yang gugur sebelum masak, biji terbentuk tetapi tidak mampu berkecambah
Pengaruh peningkatan dosis mutagen terhadap kerusakan fisiologis
memberikan kurva sigmoid, dimana kerusakan atau kematian tidak terjadi sekaligus
sesuai dengan meningkatnya dosis. Hal ini menunjukkan bahwa suatu molekul atau
sel yang peka maka molekul atau sel tersebut akan rusak atau mati. Sebaliknya
apabila yang terkena radiasi adalah molekul atau sel yang tidak peka maka sel atau
molekul tersebut tidak mati. Makin tinggi dosis makin banyak terjadi mutasi dan
makin tinggi pula kerusakannya (Mugiono, 2001).
Penggunaan energi seperti sinar gamma pada tanaman akan memberikan
pengaruh yang baik di bidang pertanian, dengan perlakuan dosis radiasi sinar gamma
dengan dosis yang tepat diperoleh tanaman yang mempunyai sifat-sifat yang seperti
hasil tinggi, umur pendek, tahan terhadap penyakit tetapi kenyataan yang ditimbulkan
tidak semuanya memenuhi harapan (Suryowinoto, 1987).
Kepekaan dari jaringan tanaman terhadap radiasi tidak hanya dipengaruhi oleh
dosis radiasi, tetapi juga dipengaruhi oleh tingkat ontogeni sel dan fase dari siklus sel.
Selain itu juga dipengaruhi oleh kemampuan sel-sel dalam jaringan tanaman untuk
memperbaiki diri dari kerusakan yang disebabkan oleh iradiasi (Hendro 1981).
Iradiasi sinar gamma dapat berpengaruh terhadap perubahan fisiologis
regeneran. Perubahan tersebut berkaitan dengan energi iradiasi yang diserap oleh
jaringan tanaman sehingga menyebabkan stimulasi sintesis auksin endogen
terganggu. Selain perubahan fisiologis, perubahan genetic dapat terjadi akibat iradiasi
sinar gamma. Perubahan fisiologis dan genetik dapat diekspresikan dengan adanya
perubahan penampilan fenotipik regeneran yang sangat bervariasi. Pada umumnya,
albino yang muncul. Pada generasi selanjutnya, kerusakan fisiologis berangsur pulih.
Sel-sel yang mengalami kerusakan mengalami recovery, sedangkan gen termutasi
dapat diwariskan pada generasi berikutnya (Maluszynski et al., 1995).
Cekaman Aluminium
Tanaman dijumpai tumbuh pada tanah dengan rentang pH antara
3 sampai 9, dan keasaman yang ekstrem ini merupakan suatu cekaman yang
diadaptasi oleh beberapa spesies. Pada tanah ber-pH rendah, yang mestinya banyak
mengandung H2PO4-, konsentrasi ion aluminium sering tinggi menyebabkannya
mengendap sebagai aluminium fosfat. Konsentrasi aluminium yang cukup tinggi pada
tanah masam (yang pH nya dibawah 4,7) dapat menghambat pertumbuhan beberapa
spesies, tidak hanya efeknya yang merusak ketersediaan fosfat, tapi tampaknya juga
karena penghambatan penyerapan besi dan karena efek beracun secara langsung
terhadap metabolisme tumbuhan (Salisbury and Ross, 1995).
Kisaran zat-zat yang dapat mempengaruhi pertumbuhan tanaman amat luas
dan pengaruh khusus racun-racun ini amatlah banyak untuk diuraikan. Sebagai
contoh, Foy, et al., (1978) mengemukakan pendapat bahwa aluminium sendiri dapat
meningkatkan fosfat pada permukaan akarnya dan mengurangi respirasi akar,
pembelahan sel, kakunya dinding sel dan pengambilan serta pemanfaatan Ca, Mg, P,
K dan H2O (Fitter and Hay, 1991).
Aluminium dalam bentuk Al3+ merupakan yang paling beracun bagi tanaman.
aluminium yang paling menghambat perpanjangan akar. Keracunan aluminium pada
tanah masam bukan hanya akibat pH yang rendah dan konsentrasi aluminium total
yang tinggi tetapi juga perbandingan aluminium organik dan aluminium yang
berkaitan dengan senyawa organik seperti asam malat, sitrat, oksalat atau senyawa
fenol (Hanum, 2008).
Menurut Fitter and Hay (1991) beberapa jenis tanaman dapat tumbuh pada
tanah-tanah yang mengandung tingkat ion toksik yang dapat mematikan untuk spesies
lain. Terdapat empat mekanisme utama hingga hal tersebut terjadi:
1. Penghindaran (escape) fenologis-apabila stress yang terjadi pada tanaman bersifat
musiman, tanaman dapat menyesuaikan siklus hidupnya, sehingga tumbuh dalam
musim yang sangat cocok saja;
2. Eksklusi-tanaman dapat mengenal ion yang toksik dan mencegah agar tidak
terambil sehingga tidak mengalami toksisitas;
3. Penanggulangan (ameliorasi)-tanaman barangkali mengabsorbsi ion tersebut,
tetapi bertindak demikian rupa untuk meminimumkan pengaruhnya. Jenisnya
meliputi pembentukan kelat (chemilation), pengenceran, lokalisasi atau bahan
ekskresi;
4. Toleransi-tanaman dapat mengembangkan sistem metabolis yang dapat berfungsi
pada konsentrasi toksik yang potensial, mungkin dengan molekul enzim.
Gejala pertama yang tampak dari keracunan Al adalah sistem perakaran yang
tidak berkembang (pendek dan tebal) sebagai akibat penghambatan perpanjangan sel.
penyerapan hara, bergabung dengan dinding sel, dan menghambat pembelahan sel
(Hanum, 2008).
Tanaman yang mampu beradaptasi pada Al tinggi disebabkan oleh tanaman
tersebut yang memiliki suatu mekanisme tertentu untuk menekan pengaruh buruk Al
sehingga tidak mengganggu serapan hara dan air, juga mampu mengefisienkannya
(Blum, 1996).
Kemampuan pertumbuhan tanaman pada tanah dengan kandungan Al tinggi,
adalah dengan menghasilkan eksudat akar (dalam bentuk anion-anion asam organik,
gula, vitamin, asam amino, purin, nukleotida, ion-ion anorganik, dan sebagainya).
Senyawa-senyawa ini membantu perakaran tanaman terhindar dari akibat buruk ion
Al, sehingga akar sebagai fungsi penyerap hara dan air dapat menjalankan fungsinya
(Felix dan Donald, 2002).
Menurut Oktavidiati (2002) ada beberapa kriteria yang telah ditetapkan untuk
menentukan apakah suatu tanaman toleran atau tidak terhadap cekaman Al. Samuael
et al., (1997) yang menyatakan bahwa kriteria bagi tanaman yang toleran terhadap
cekaman Al yaitu:
1). Akar mampu untuk tumbuh terus dan ujung akarnya tidak mengalami kerusakan,
2) Ion Al sedikit yang ditranslokasikan ke bagian atas dan sebagian besar ditahan di
BAHAN DAN METODE
Tempat dan Waktu Penelitian
Penelitian dilaksanakan di Laboratorium Kultur Jaringan Tanaman Fakultas
Pertanian Universitas Sumatera Utara, Medan dari bulan Januari sampai dengan
Maret 2010.
Bahan dan Alat
Bahan-bahan yang digunakan dalam penelitian ini adalah embrio kacang
kedelai M2 varietas Anjasmoro hasil tanaman M1 yang diberi radiasi sinar gamma
dengan dosis 0 krad, 10 krad, 20 krad dan 30 krad, aluminium klorida (AlCl3), bahan
penyusun media MS, deterjen, larutan benlate (benomyl), akudes steril, NaOH, HCl,
tepung agar, betadine, Clorox, Tween 20, alkohol kertas saring, kertas sampul, label,
kapas, kertas millimeter dan bahan-bahan pendukung penelitian ini.
Alat-alat yang digunakan dalam penelitian ini adalah Laminar Air Flow
Cabinet (LAFC), autoklaf, timbangan analitik, rak kultur, hot plate dengan pengaduk
magnetik, erlenmeyer, gelas ukur, Beaker glass, labu takar, cawan petri, pipet, pinset,
batang pengaduk, handsprayer, termometer, lampu bunsen, pH meter, sarung tangan,
masker, aluminium foil, botol kultur, scalpel, spatula dan alat pendukung penelitian
Metode Penelitan
Penelitian ini dilakukan dengan menggunakan Rancangan Acak Lengkap
(RAL) faktorial yang terdiri dari dua faktor:
Faktor I: Benih kedelai varietas Anjasmoro hasil tanaman yang telah diberi sinar
gamma yang terdiri dari 4 taraf, yaitu:
R0 = benih dari tanaman tanpa penyinaran sinar gamma (kontrol)
R1 = benih M2 dari tanaman yang diradiasi 10 krad
R2 = benih M2 dari tanaman yang diradiasi 20 krad
R3 = benih M2 dari tanaman yang diradiasi 30 krad
Faktor II: Konsentrasi AlCl3 yang terdiri dari 4 taraf yaitu:
A0 = 0 ppm
A1 = 150 ppm
A2 = 300 ppm
A3 = 450 ppm
Dari faktor perlakuan di atas diperoleh 16 kombinasi perlakuan yaitu:
R0A0 R0A1 R0A2 R0A3
R1A0 R1A1 R1A2 R1A3
R2A0 R2A1 R2A2 R2A3
R3A0 R3A1 R3A2 R3A3
Jumlah kombinasi : 16
Jumlah ulangan : 6
Jumlah eksplan/botol : 1
Analisis Data
Model linier yang digunakan untuk Rancangan Acak Lengkap (RAL)
Faktorial sebagai berikut:
i= 1,2,3,4, j=1,2,3,4 k=1,2,3,4,5,6 Dimana:
Yijk : Hasil pengamatan dari faktor benih M2 hasil penyinaran sinar gamma pada
taraf ke-i, konsentrasi AlCl3 pada taraf ke-j dan pada ulangan ke-k.
µ : Nilai tengah
αi : Efek dosis radiasi sinar gamma pada taraf ke-i.
βj : Efek konsentrasi AlCl3 pada taraf ke-j.
(αβ)ij : Efek interaksi antara dosis radiasi sinar gamma pada taraf ke-i dengan
konsentrasi AlCl3 pada taraf ke-j.
εijk : Efek galat dari kedua faktor yaitu dosis radiasi sinar gamma pada taraf ke-i,
konsentrasi AlCl3 pada taraf ke-j dan ulangan ke-k.
Data hasil penelitian yang berpengaruh nyata dilanjutkan dengan uji beda
rataan berdasarkan Uji Jarak Berganda Duncan (DMRT) pada taraf 5%
P
ELAKSANAAN PENELITIANSterilisasi Alat-Alat
Semua peralatan seperti botol kultur, cawan petri, gelas piala, erlenmeyer,
pinset, scalpel, pipa skala dan alat-alat gelas lainnya terlebih dahulu dicuci dengan
deterjen dan dibilas dengan air, selanjutnya dikeringkan. Alat-alat seperti cawan petri,
pinset, scalpel, dan pipa skala dibungkus dengan kertas sampul, sedangkan
erlenmeyer dan gelas ukur permukaannya ditutup dengan aluminium foil. Untuk
pembuatan media kapas steril, kapas dimasukkan ke cawan petri bersih dan dibasahi
dengan akuades steril, kemudian cawan petri yang telah berisi kapas ditutup dengan
aluminium foil. Semua peralatan disterilkan dalam autoklaf pada suhu 1210C dengan
tekanan 17,5 psi selama 60 menit.
Pembuatan Media
Media yang digunakan dalam penelitian ini adalah media dasar Murashige
and Skoog (MS) padat dengan penambahan AlCl3 dengan konsentrasi sesuai dengan perlakuan. Tahap pertama dalam pembuatan media adalah membuat larutan stok
bahan kimia hara makro, hara mikro, larutan ion, sukrosa dan myo inositol.
Untuk pembuatan media 4 liter dilakukan dengan mengisi beaker glass dengan
aquadest steril sebanyak 500 ml. Kemudian ditambahkan hara makro, larutan ion,
hara mikro, 40 ml larutan vitamin yang diambil dari larutan stok, 0,4 g myo-inositol,
Penambahan bahan-bahan tersebut harus dilakukan secara berurutan dan bahan-bahan
tersebut harus larut secara homogen, setiap bahan yang dimasukkan harus larut
terlebih dahulu sebelum masuk bahan berikutnya. Kemudian larutan ini dimasukkan
ke dalam gelas ukur setelah itu ditambahkan aquadest steril hingga volume mencapai
4 liter sambil diaduk hingga merata. Lalu dibagi menjadi empat bagian sehingga
masing-masing menjadi 1000 ml. Setiap bagian diberi AlCl3 sesuai dengan perlakuan.
Keasaman diukur dengan menetapkan pH yang dikehendaki yaitu 5,8. Jika pH terlalu
rendah maka ditambahkan NaOH 1 N dan jika pH terlalu tinggi maka ditambahkan
HCl 1 N.
Tepung agar sebanyak 8 g ditambahkan ke dalam setiap perlakuan sesuai
dengan dosis, lalu dipanaskan di atas piring pemanas dengan pengaduk magnetik
sampai larutan menjadi bening (semua agar telah larut). Media siap dipindahkan ke
dalam botol kultur steril (ukuran botol 200 ml) dan dibagi sesuai dengan banyak
ulangan serta jumlah sampel. Setiap botol berisi 25 ml media. Kemudian botol
tersebut ditutup dengan aluminium foil dan diberi label sesuai dengan perlakuan.
Media dalam botol tersebut disterilkan dengan menggunakan autoklaf dengan tekanan
17,5 psi, suhu 1210C selama 15 menit. Selanjutnya dapat disimpan dalam ruang
kultur dengan suhu 240 C sebelum digunakan.
Persiapan Bahan Tanaman
Bahan tanaman berupa benih kacang kedelai yang akan digunakan terlebih
dahulu dikecambahkan secara steril selama 3-4 jam agar embrio mudah diisolasi.
15 menit setelah itu dibilas dengan akuades steril sebanyak tiga kali. Selanjutnya
direndam dalam larutan benlate selama 15 menit dan dibilas dengan akuades steril
sebanyak tiga kali, kemudian biji kacang kedelai disterilkan dengan larutan Clorox
20 % selama 10 menit, dan direndam dalam larutan betadin 10 % selama 5 menit.
Pada setiap tahap biji-biji kacang kedelai dibilas dengan akuades steril sebanyak tiga
kali. Benih-benih tersebut kemudian dikecambahkan di dalam cawan petri steril yang
telah berisi kapas (telah disterilisasi; disebut dengan medias kapas steril).
Benih-benih kacang kedelai disimpan di ruang kultur selama 3-4 jam untuk inisiasi embrio.
Penanaman Eksplan
Eksplan yang akan ditanam adalah embrio dari biji yang sudah
dikecambahkan selama 3-4 jam. Isolasi embrio dilakukan secara aseptik di LAFC
dimana embrio dipisahkan dari bagian kotiledon secara hati-hati supaya tetap utuh.
Eksplan embrio kemudian direndam dengan larutan betadin lalu dibilas dengan
akuades steril sebanyak tiga kali dan dikeringkan di atas kertas saring steril dalam
cawan petri. Eksplan embrio siap ditanam dalam media MS dengan memakai pinset
steril dengan mengarahkan mulut botol ke lampu bunsen. Setiap botol diisi satu
eksplan embrio lalu ditutup dengan aluminium foil.
Pemeliharaan Eksplan
Botol-botol yang telah berisi eksplan dan ditutup dengan aluminium foil
diletakkan pada rak kultur sesuai dengan bagan penelitian di rung kultur. Suhu
intensitas cahaya 2000 lux. Ruangan kultur diusahakan bebas dari bakteri dan jamur
dengan cara menyemprotkan botol kultur dengan alkohol 96 % setiap hari.
Pengamatan Parameter
Persentase Hidup (%)
Persentase hidup dihitung pada akhir penelitian dengan rumus:
Tinggi Plantlet (cm)
Tinngi plantlet diukur dengan menggunakan kertas millimeter yang diukur
dari pangkal tanaman hinnga titik tumbuh tanaman dilakukan pada akhir penelitian.
Jumlah Akar (helai)
Jumlah akar dihitung dari jumlah akar yang terbentuk dari leher akar pada
setiap eksplan yang dilakukan pada akhir penelitian.
Jumlah Daun (helai)
Jumlah daun dihitung dari daun yang terbentuk yang telah terbuka sempurna
dari setiap eksplan yang dilakukan pada akhir penelitian.
Bobot Total Plantlet (g)
Bobot total plantlet dihitung dengan menimbang seluruh bagian
Bobot Akar (g)
Bobot akar dihitung dengan menimbang semua akar yang terbentuk pada
HASIL DAN PEMBAHASAN
Hasil
Data hasil penelitian dan analisis sidik ragam (Lampiaran 5 hingga 21)
menunjukkan bahwa dosis radiasi sinar gamma berpengaruh nyata pada parameter
jumlah daun, parameter bobot akar dan bobot total planlet. Interaksi antara dosis
radiasi sinar gamma dengan konsentrasi aluminium klorida (AlCl3) berpengaruh
nyata pada parameter bobot total planlet.
Persentase Hidup (%)
Hasil sidik ragam (lampiran 7) memperlihatkan bahwa perlakuan radiasi sinar
gamma, perlakuan aluminium klorida dan interaksi antara radiasi dan aluminium
klorida (AlCl3) tidak berpengaruh nyata terhadap persentase hidup.
Rataan persentase hidup dengan perlakuan radiasi dan aluminium klorida
(AlCl3) dapat dilihat pada Tabel 1.
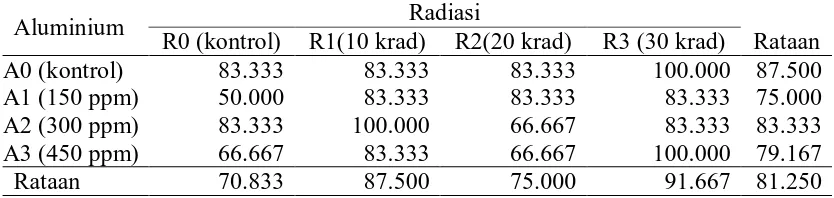
Tabel 1. Rataan persentase hidup (%) dengan perlakuan radiasi dan AlCl3
Aluminium Radiasi
Rataan R0 (kontrol) R1(10 krad) R2(20 krad) R3 (30 krad)
A0 (kontrol) 83.333 83.333 83.333 100.000 87.500
A1 (150 ppm) 50.000 83.333 83.333 83.333 75.000
A2 (300 ppm) 83.333 100.000 66.667 83.333 83.333 A3 (450 ppm) 66.667 83.333 66.667 100.000 79.167
Tinggi Planlet (cm)
Hasil sidik ragam (lampiran 10) memperlihatkan bahwa perlakuan radiasi
sinar gamma, perlakuan aluminium klorida dan interaksi antara radiasi dan
aluminium klorida (AlCl3) tidak berpengaruh nyata terhadap tinggi planlet.
Rataan tinggi planlet dengan perlakuan radiasi dan aluminium klorida (AlCl3)
dapat dilihat pada Tabel 2.
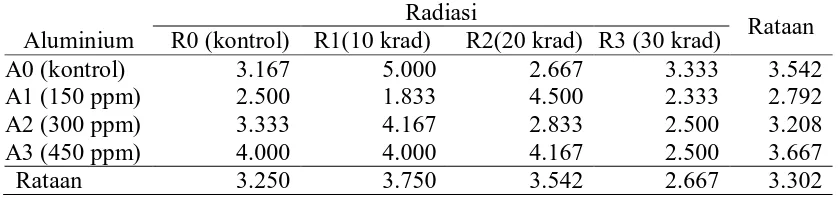
Tabel 2. Rataan tinggi planlet (cm) dengan perlakuan radiasi dan AlCl3
Aluminium
Hasil sidik ragam (lampiran 13) memperlihatkan bahwa perlakuan radiasi
sinar gamma, perlakuan aluminium klorida dan interaksi antara radiasi dan
aluminium klorida (AlCl3) tidak berpengaruh nyata terhadap jumlah akar.
Rataan jumlah akar dengan perlakuan radiasi dan aluminium klorida (AlCl3)
dapat dilihat pada Tabel 3.
Tabel 3. Rataan jumlah akar (helai) dengan perlakuan radiasi dan AlCl3
Jumlah Daun (helai)
Hasil sidik ragam (lampiran 16) memperlihatkan bahwa perlakuan radiasi
sinar gamma berpengaruh nyata terhadap jumlah daun, dan perlakuan aluminium
klorida dan interaksi antara radiasi dan aluminium klorida (AlCl3) tidak berpengaruh
nyata terhadap jumlah akar.
Rataan jumlah daun dengan perlakuan radiasi dan aluminium klorida (AlCl3)
dapat dilihat pada Tabel 4.
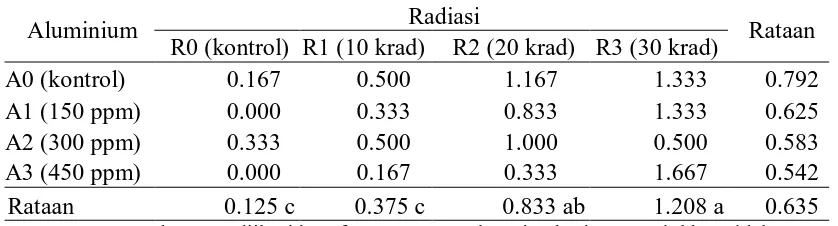
Tabel 4. Rataan jumlah daun (helai) dengan perlakuan radiasi dan AlCl3
Aluminium Radiasi Rataan
R0 (kontrol) R1 (10 krad) R2 (20 krad) R3 (30 krad)
A0 (kontrol) 0.167 0.500 1.167 1.333 0.792
A1 (150 ppm) 0.000 0.333 0.833 1.333 0.625
A2 (300 ppm) 0.333 0.500 1.000 0.500 0.583
A3 (450 ppm) 0.000 0.167 0.333 1.667 0.542
Rataan 0.125 c 0.375 c 0.833 ab 1.208 a 0.635
Keterangan : Angka yang diikuti huruf yang sama pada setiap baris menunjukkan tidak berbeda nyata pada Uji Jarak Berganda Duncan taraf 5%.
Tabel 4 menunjukkan bahwa rataan jumlah daun pada R3 tidak berbeda nyata
dengan R2, namun berbeda nyata dengan R1 dan R0, R0 berbeda nyata dengan R1.
Jumlah daun yang tertinggi pada R3 (1.208 helai) dan terendah pada R0 (0.125 helai).
Bobot Total Planlet (g)
Hasil sidik ragam (lampiran 19) memperlihatkan bahwa perlakuan radiasi
sinar gamma dan interaksi antara radiasi dan aluminium klorida (AlCl3) berpengaruh
nyata terhadap bobot total planlet. Dan perlakuan aluminium klorida tidak
Rataan bobot total planlet dengan perlakuan radiasi dan aluminium klorida
(AlCl3) dapat dilihat pada Tabel 5.
Tabel 5. Rataan bobot total planlet (g) dengan perlakuan radiasi dan AlCl3
Aluminium Radiasi Rataan
R0 (kontrol) R1 (10 krad) R2 (20 krad) R3 (30 krad)
A0 (kontrol) 0.062 e-j 0.112 b-f 0.145 bc 0.141 bcd 0.115 A1 (150 ppm) 0.035 j 0.074 e-j 0.159 b 0.107 b-g 0.094 A2 (300 ppm) 0.050 g-j 0.070 e-j 0.116 b-e 0.094 c-h 0.083 A3 (450 ppm) 0.042 h-j 0.073 e-j 0.093 c-i 0.268 a 0.119 Rataan 0.047 c 0.082 c 0.128 b 0.153 a 0.103 Keterangan : Angka yang diikuti huruf yang sama pada setiap baris dan kolom
menunjukkan tidak berbeda nyata pada Uji Jarak Berganda Duncan taraf 5%.
Tabel 5 menunjukkan bahwa interaksi dengan kombinasi perlakuanR3A3
berbeda nyata dengan semua kombinasi perlakuan. R2A1 tidak berbeda nyata dengan
R2A0, R3A0, R2A3, R1A0 dan R3A1 namun berbeda nyata dengan R3A3, R3A2, R2A3,
R1A1, R1A2, R1A3, R0A0, R0A1, R0A2, dan R0A3. R0A1 tidak berbeda nyata dengan
R1A1, R1A2, R1A3, R0A0, R0A1, R0A2, dan R0A3 namun berbeda nyata dengan R3A3,
R2A1, R3A2, dan R2A3. Bobot total planlet yang tertinggi pada R3A3 (0.268 g) dan
terendah pada R0A1 (0.035 g).
Bobot Akar (g)
Hasil sidik ragam (lampiran 21) memperlihatkan bahwa perlakuan radiasi
sinar gamma berpengaruh nyata terhadap bobot akar, dan perlakuan aluminium
klorida, namun interaksi antara radiasi dan aluminium klorida (AlCl3) tidak
Rataan bobot akar dengan perlakuan radiasi dan aluminium klorida (AlCl3)
dapat dilihat pada Tabel 6.
Tabel 6. Rataan bobot akar (g) dengan perlakuan radiasi dan AlCl3
Aluminium Radiasi Rataan
R0 (kontrol) R1 (10 krad) R2 (20 krad) R3 (30 krad)
Keterangan : Angka yang diikuti huruf yang sama pada setiap baris menunjukkan tidak berbeda nyata pada Uji Jarak Berganda Duncan taraf 5%.
Tabel 6 menunjukkan bahwa rataan bobot akar pada R2 tidak berbeda nyata
dengan R3, namun berbeda nyata dengan R0 dan R1. Dan R0 tidak berbeda nyata
dengan R1. Bobot akar yang tertinggi pada R2 (0.041 g) dan terendah pada
R0 (0.015 g).
Pembahasan
Pengaruh dosis radiasi sinar gamma terhadap pertumbuhan tanaman kedelai hasil radiasi sinar gamma (M2) secara in vitro.
Dari hasil analisis statistik diperoleh data bahwa tingkat radiasi berpengaruh
nyata pada parameter jumlah daun, bobot akar dan bobot total planlet.
Jumlah daun yang tertinggi terdapat pada perlakuan radiasi R3 (30 krad)
(1.208 helai) dan jumlah daun semakin menurun seiring dengan turunnya dosis
radiasi sedangkan jumlah daun yang terendah terdapat pada perlakuan radiasi R0
(0 krad) (0.125 helai). Dapat diketahui bahwa gangguan fisiologis bagi pertumbuhan
generasi M2 mulai kembali stabil (tidak mengalami kerusakan fisiologis), sesuai
dengan literatur Mugiono (2001) yang menyatakan kerusakan fisiologis hanya terjadi
pada generasi M1 sedangkan mutasi gen, mutasi kromosom dan mutasi sitoplasma
akan diturunkan pada generasi berikutnya.
Bobot akar yang tertinggi terdapat pada perlakuan radiasi R2 (20 krad)
(0.041 g) dan bobot akar yang terendah terdapat pada perlakuan radiasi R0 (0 krad)
(0.015 g). Dari hasil dapat diketahui bahwa tidak terjadi kerusakan fisiologis yang
diwariskan dari generasi M1 ke generasi M2, disamping itu dosis radiasi yang
diberikan berada pada dosis yang sesuai untuk pertumbuhan tanaman kedelai
(contohnya untuk parameter bobot akar) yang nantinya dapat mendukung untuk
menghasilkan tanaman yang memiliki sifat unggul. Hal ini sesuai dengan pernyataan
Suryowinoto (1996) bahwa penggunaan energi seperti sinar Gamma pada tanaman
akan memberikan pengaruh yang baik di bidang pertanian, dengan perlakuan dosis
radiasi sinar Gamma dengan dosis yang tepat diperoleh tanaman yang mempunyai
sifat-sifat yang seperti hasil tinggi, umur pendek, tahan terhadap
penyakit tetapi kenyataan yang ditimbulkan tidak semuanya memenuhi harapan.
Bobot total planlet yang tertinggi terdapat pada perlakuan R3 (30 krad)
(0.153 g) dan terendah pada perlakuan R0 (0 krad) (0.047 g). Diduga bahwa kisaran
dosis radiasi yang diaplikasikan merupakan dosis yang sesuai untuk tanaman kedelai
sehingga pada tanaman pada generasi kedua tidak mengalami kerusakan, melainkan
sel-sel tanaman kedelai yang terkena mutasi berangsur mengalami pemulihan dari
kerusakan sel yang terjadi pada generasi pertama yang umumnya mengalami
yang menyatakan bahwa pada generasi selanjutnya, kerusakan fisiologis berangsur
pulih. Sel-sel yang mengalami kerusakan mengalami recovery, sedangkan gen
termutasi dapat diwariskan pada generasi berikutnya
Pengaruh konsentrasi aluminium
Hasil analisis statistik diperoleh bahwa konsentrasi aluminium tidak
berpengaruh nyata pada parameter persentase hidup, tinggi planlet, jumlah daun,
jumlah akar dan bobot akar.
Persentase hidup yang tertinggi terdapat pada perlakuan aluminium
A0 (0 ppm) sebesar 87.500 % sedangkan yang terendah pada perlakuan A2
(300 ppm) sebesar 75.000 %. Ini disebabkan kemampuan tanaman yang mampu
beradaptasi dengan lingkungan tumbuhnya, karena keberadaan aluminium yang
semakin meningkat pada media tumbuh tidak menghambat tanaman untuk hidup dan
tidak menunjukkan perbedaan yang nyata dengan tanaman kontrol (tanpa
aluminium). Hal ini sesuai dengan literatur Blum (1996) bahwa tanaman yang
mampu beradaptasi pada Al tinggi disebabkan oleh tanaman tersebut yang memiliki
suatu mekanisme tertentu untuk menekan pengaruh buruk Al sehingga tidak
mengganggu serapan hara dan air, juga mampu mengefisienkannya.
Tinggi planlet yang tertinggi terdapat pada perlakuan aluminium
A0 (0 ppm) (4.317 cm) dan terendah terdapat pada perlakuan A3 (440 ppm)
(2.425cm) begitu juga dengan parameter jumlah daun, jumlah daun yang tertinggi
terdapat pada perlakuan (A0) 0 ppm (0.792 helai) dan terendah pada perlakuan (A3)
perlakuan kontrol (0 ppm), ini merupakan hal yang wajar karena pada
media tidak mengandung aluminium, zat yang dapat menghambat pertumbuhan
tanaman, tetapi berdasarkan analisis secara statistik tidak terdapat perbedaan yang
nyata antara perlakuan A0 (0 ppm) dan A3 (450 ppm). Hal ini diduga karena faktor
genetik tanaman yang tetap mampu menahan sebagian besar ion Al pada bagian akar
sehingga ion Al sedikit yang ditranslokasikan ke bagian atas. Ini sesuai dengan
Samuael et al., (1997) yang menyatakan bahwa kriteria bagi tanaman yang toleran
terhadap cekaman Al yaitu: 1). Akar mampu untuk tumbuh terus dan ujung akarnya
tidak mengalami kerusakan, 2) Ion Al sedikit yang ditranslokasikan ke bagian atas
dan sebagian besar ditahan di akar.
Jumlah akar yang tertinggi terdapat pada perlakuan aluminium
A3 (450 ppm) (3.667 helai) sedangkan yang terendah pada perlakuan aluminium A1
(150 ppm) (2.792 helai). Hasil pengamatan parameter jumlah akar menunjukkan
kemampuan tanaman kedelai untuk mampu beradaptasi dengan kandungan Al yang
tinggi, sehingga tidak mengganggu fungsi akar. Pertumbuhan perakaran yang tidak
terganggu ini disebabkan karena kemampuan tanaman menghasilkan eksudat akar
yang membantu akar mencegah aluminium masuk ke dalam system perakaran. Hal
ini sesuai dengan pernyataan Felix and Donald (2002) bahwa kemampuan
pertumbuhan tanaman pada tanah dengan kandungan Al tinggi, adalah dengan
menghasilkan eksudat akar (dalam bentuk anion-anion asam organik, gula, vitamin,
asam amino, purin, nukleotida, ion-ion anorganik, dan sebagainya).
Pengaruh interaksi antara dosis radiasi sinar gamma dan konsentrasi aluminium.
Hasil analisa data statistik diperoleh data bahwa interaksi dosis radiasi sinar
gamma dan konsentrasi aluminium berpengaruh nyata pada parameter bobot total
planlet.
Bobot total planlet yang tertinggi terdapat pada perlakuan (R3A3) radiasi
30 krad dan Aluminum 450 ppm (0.268 g) dan terendah terdapat pada perlakuan
(R0A1) radiasi 30 krad dan Aluminum 450 ppm (0.035 g). Ini disebabkan karena
pertumbuhan tanaman dipengaruhi oleh faktor genetik dan lingkungan yang
mempengaruhi pertumbuhan planlet. Mutan kedelai varietas anjasmoro yang telah
diradiasi dengan dosis 30 krad memiliki kemampuan untuk memperbaiki diri dari
kerusakan yang disebabkan oleh radiasi sehingga mampu bertahan dengan kondisi
media yang mengandung aluminium dengan konsentrasi 450 ppm, karena planlet
mampu menghasilkan eksudat akar yang membantu akar mencegah aluminium masuk
ke dalam sistem perakaran. Hal ini sesuai dengan pernyataan Felix and Donald
(2002) bahwa kemampuan pertumbuhan tanaman pada tanah dengan kandungan Al
tinggi, adalah dengan menghasilkan eksudat akar (dalam bentuk anion-anion asam
organik, gula, vitamin, asam amino, purin, nukleotida, ion-ion anorganik, dan
sebagainya). Senyawa-senyawa ini membantu perakaran tanaman terhindar dari
akibat buruk ion Al. Disamping itu Hendro (1981) menyatakan bahwa kepekaan dari
jaringan tanaman terhadap radiasi tidak hanya dipengaruhi oleh dosis radiasi, tetapi
dipengaruhi oleh kemampuan sel-sel dalam jaringan tanaman untuk memperbaiki diri
KESIMPULAN DAN SARAN
Kesimpulan
Dari hasil penelitian yang dilakukan dapat ditarik kesimpulan sebagai
berikut:
1. Dosis radiasi sinar gamma yang diberikan pada tanaman M1 memberikan pengaruh
yang nyata pada parameter jumlah daun, bobot akar dan bobot total planlet pada
generasi M2 secara in vitro. Semakin tinggi dosis radiasi gamma mengakibatkan
semakin tinggi jumlah daun, bobot akar dan bobot total planlet. Namun tidak
berpengaruh nyata pada parameter persentase hidup, tinggi planlet, jumlah akar
dan bobot total planlet.
2. Pada perlakuan aluminium yang diberikan tidak berpengaruh nyata pada parameter
persentase hidup, tinggi planlet, jumlah akar dan bobot total planlet, jumlah daun
dan bobot akar pada generasi M2 secara in vitro.
3. Terdapat respon interaksi antara radiasi gamma dan varietas pada bobot total
planlet. Dosis radiasi pada tanaman memiliki kepekaan yang berbeda terhadap
perlakuan aluminium sehingga menimbulkan pengaruh yang berbeda pada bobot
Saran
Agar dilakukan penelitian lebih lanjut dengan menambah konsentrasi
aluminium untuk mengetahui ketahanan tanaman kedelai hasil mutasi radiasi sinar
DAFTAR PUSTAKA
Bangun, M. K., 1991, Rancangan Percobaan. Fakultas Pertanian USU, Medan.
Badan Pusat Statistik, 2010. Berita Resmi Statistik, Produksi Padi, Jagung, dan Kedelai (Angka Tetap Tahun 2009 dan Angka Ramalan II Tahun 2010). Berita Resmi Statistik No.43/07/Th.XIII, 1 Juli 2010.
Blum, A. 1996. Crop Responses to Drought and The Interpretation of Adaptation. Plant Growth Reg. 20: 135-148. dalam Hanum, C., W. Q. Mugnisjah, S. Yahya, D. Sopandy, K. Idris, A. Sahar, 2007. Pertumbuhan Akar Kedelai pada Cekaman Aluminium, Kekeringan dan Cekaman Ganda Aluminium dan Kekeringan. Agritrop, Vol. 26, No. 1.
Cassaret, A. P., 1961 . Radiation Bilology. Prentise. Hall Inc. Englewood Clif: New Jersey. dalam Hartati, S., 2000. Penampilan Genotip Tanaman Tomat (Lycopersicum esculentum Mill.) Hasil Mutasi Buatan pada Kondisi Stress Air dan Kondisi Optimal. Agrosains Volume 2 No 2, 2000.
Chope, P. R., V. K. Shinde, and Wadhokar, R. S., 1974. Late Flowering Radiation Induced Mutants in Swarna. Sorghum News latter. dalam Sundardi, dkk., 1991. Aplikasi Isotop dan Radiasi dalam Bidang Pertanian, Pertenakan, dan Biologi. Risalah Pertemuan Ilmiah, Jakarta, 30-31 Oktober 1990. BATAN, Jakarta.
Departemen Pertanian. 1990. Upaya Peningkatan Produksi Kedelai. Balai Informasi Pertanian Sumatera Utara, Medan.
Fachruddin, L. 2007. Budidaya Kacang-Kacangan. Kanisius, Yogyakarta.
Felix, D.D. aand A.P. Donald. 2002. Root Exudates as Mediators of Mineral Acquisition in Low-Nutrient Environment. Plant and Soil. 245:35-47. dalam Hanum, C., W.Q. Mugnisjah, S.Yahya, D. Sopandy, K. Idris dan A. Sahar, 2007. Pertumbuhan Akar Kedelai pada Cekaman Aluminium, Kekeringan dan Cekaman Ganda Aluminium dan Kekeringan. Agritrop, 26 (1):13-18.
Fitter, A. H and R. K. M. Hay. 1991. Fisiologi Lingkungan Tanaman. Penerjemah Sri Andani dan Purbayanti. UGM Press, Yogyakarta.
Gunawan, L. W. 1988. Teknik Kultur Jaringan. Institut Pertanian Bogor, Bogor.
Hanum, C. 2008. Ekologi Tanaman. Universitas Sumatera Utara, Medan.
Hendro, W. 1981. Mutagenesis and in vitro selection. In: T.A. Thorpe (Ed.). Plant Tissue Culture, Methods and Application in Agriculture. Acad. Press. New York. p.: 155–180. Dalam Fauza, H., M. H. Karmana, N. Rostini dan I, Mariska, 2005. Pertumbuhan dan Variabilitas Fenotipik Manggis Hasil Iradiasi Sinar Gamma. Zuriat volume 16, No.2, Juli-Desember.
Herawati, T dan R. Setiamihardja. 2000. Pemuliaan Tanaman Lanjutan. Program Pengembangan Kemampuan Peneliti Tingkat S1 Non Pemuliaan Dalam Ilmu Dan Teknologi Pemuliaan. Universitas Padjadjaran, Bandung.
Hidayat, O.O. 1985. dalam Somaatmadja, S., M. Ismunadji, Sumarno, M. Syam, S.O. Manurung dan Yuswadi, 1985. Morfologi Tanaman Kedelai. Balai Penelitian Tanaman Pangan, Bogor.
Perbaikan Tanaman Melalui Variasi Somaklonal [30 November 2009].
Alami [5 Desember 2009].
[28 Februari 2008].
Indriani, F. C., Sudjindro, Arifin, N. S., dan Lita S. 2008. Keragaman Genetik Plasma Nutfah Kenaf (Hibisus cannabinus L.) dan Beberapa Species yang Sekerabat
Berdasarkan Analisis Isozim. Dikutip dari:
Maluszynski M, Ahloowalia BS, Sigurbjörnsson B. 1995. Application of in Vivo and
in Vitro Mutation Techniques for Crop Improvement. Euphytica 85:303-315. dalam Qosim, W. A., R. Purwanto, G. A. Wattimena, Witjaksono, 2007.
Pengaruh Iradiasi Sinar Gamma terhadap Kapasitas Regenerasi Kalus Nodular Tanaman Manggis. Hayati Journal of Biosciences. Vol. 14, No. 4., p 140-144.
Seleksi In Vitro terhadap Cekaman Aluminium dan pH Rendah. Jurnal AgroBiogen 1(2):73-75.
Mugiono. 2001. Pemuliaan Tanaman dengan Teknik Mutasi. Badan Tenaga Nuklir Nasional, Pusat Pendidikan dan Pelatihan, Jakarta.
Murashige, T. dan Skoog. 1962. A Revised Medium for Rapid Growth and Bio Assays with Tobacco Tissue Cultures. Physiologia Plantarum. dalam Zulkarnain, 2009. Kultur Jaringan Tanaman; Solusi Perbanyakan Tanaman Budi Daya. Bumi Aksara, Jakarta.
Notohadiprawiro, T. 1983. Persoalan Tanah Masam dalam Pembangunan Pertanian di Indonesia. Buletin Fakultas Pertanian Universitas Gadjah Mada 18: 44-47. dalam. Mariska, I., E. Sjamsudin, D. Soepandie, S. Hutami, A. Husni, M. Kosmiatin, A. Vivi, 2004. Peningkatan Ketahanan Tanaman Kedelai terhadap Aluminium melalui Kultur In Vitro. Jurnal Litbang Pertanian, 23 (2).
Oeliem, T. M. H., S. Yahya, D. Sofia, dan Mahdi. 2008. Perbaikan Genetik Kedelai Melalui Mutasi Induksi Sinar Gamma untuk Menghasilkan Varietas Unggul dan Tahan terhadap Cekaman Kekeringan. USU, Medan.
Rosmarkam, A dan N. Yuwono. 2002. Ilmu Kesuburan Tanah. Kanisius, Yogyakarta.
Poehlman, J. M. and D. A. Sleper. 1995. Beerding Field Crops. Pamina Publishing Corporation, New Delhi.
Rubatzky, V. E dan M. Yamaguchi. 1997. Sayuran Dunia, Prinsip, Produksi dan Gizi. Edisi Kedua. Penerjemah Catur Herison. ITB Press, Bandung.
Samuel T.D, Kucukakyuz, K,, Rincon-Zachary M,. 1997. Al Partitioning Patterns and Root Growth as Related to Al Sensitivity and Al Tolerance in Wheat. Plant Physiol 113:527-534. dalam Oktavidiati, E., 2002. Mekanisme Toleransi Tanaman Terhadap Stress Aluminium. Makalah Falsafah Sains Program Pasca Sarjana, IPB
Santoso, U. dan F. Nursandi, 2001. Kultur Jaringan Tanaman. Penerbit UMM, Malang.
Sharma, O. P. 1993. Plant Taxonomy. Tata McGraw Hill Poblishing Company Limited, New Delhi.
Sinaga R. 2000. Pemanfaatan Teknologi Iradiasi dalam Pengawetan Makanan. Prosiding 2 Seminar Ilmiah Nasional dalam Rangka Lustrum IV Fakultas Biologi Universitas Gadjah Mada, Penerbit MEDIKA, Yogyakarta.
Soeminto B. 1985. Manfaat Tenaga Atom untuk Kesejahteraan Manusia. CV Karya Indah, Jakarta.
Suryowinoto, M. 1987. Tenaga Atom dan Pemanfaatannya dalam Biologi Pertanian. Kanisius. Yogyakarta.
Sutjahjo, S. H. 2006. Seleksi In Vitro untuk Ketegangan terhadap Aluminium pada Empat Genotipe Jagung. Jurnal Akta Agrosia Vol. 9 no.2 hlm 61-66 Jul-Des 2006.
Van der Maesen, L. J. G. and Somaatmadja, S. 1992. Plant Resources of South-East Asia. Prosea. Bogor-Indonesia.
Yusnita. 2003. Kultur Jaringan Cara Memperbanyak Tanaman Secara Efisien. Agromedia Pustaka, Jakarta.