PERTUMBUHAN UDANG VANAME
Litopenaeus vannamei
TITA NOPITAWATI
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN SUMBER
INFORMASI
Dengan ini saya menyatakan bahwa tesis Seleksi Bakteri Probiotik dari Saluran Pencernaan untuk Meningkatkan Kinerja Pertumbuhan Udang Vaname Litopenaeus vannamei adalah karya saya dengan arahan dosen
pembimbing dan belum pernah diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalan teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Bogor, Februari 0 0
Tita Nopitawati
TITA NOPITAWATI. Probiotics Selections from White Shrimp Gut to Increased Growth Performance of White Shrimp Litopenaeus vannamei.
Under direction of WIDANARNI and DEDI JUSADI.
The effect of probiotics isolated from white shrimp gut Litopenaeus vannamei
M ,Z ,K9 and S supplemented into the diet on enzym activities, growth performance of white shrimp and digestibility was investigated. A triplicate experiment were conducted using ,0 g white shrimp. Each shrimp was fed on the diet supplemented with either probiotics produce amylase M , produce lypase Z , produce protease Z , produce amylase,lypase and protease S or control no supplementation of probiotics . Regardless of the strain, the application of probiotics significantly increased the bacteria population in the shrimp gut, thereby digestibility, protein and lipid retention, food efficiency and growth of shrimp significantly improved. On the other hand, shrimp fed on the diet supplemented with K9 probiotics had the best growth performance. Therefore, K9 is the best probiotics isolated from the white shrimp gut to use as a supplementarydiet for white shrimp.
Keywords : probiotics, growth performance, digestibility, white shrimp.
RINGKASAN
TITA NOPITAWATI. Seleksi Bakteri Probiotik dari Saluran Pencernaan untuk Meningkatkan Kinerja Pertumbuhan Udang VanameLitopenaeus vannamei. Dibimbing oleh WIDANARNI dan DEDI JUSADI.
Kualitas pakan sangat menentukan laju pertumbuhan udang. Pakan yang dikonsumsi oleh udang tidak semuanya dapat dicerna namun ada yang dikeluarkan dalam bentuk limbah berupa feses dan sisa metabolisme lain seperti urin dan amoniak. Besarnya pakan yang dikeluarkan menjadi feses tergantung dari kesesuaian komponen pakan dengan kemampuan enzimatik di saluran pencernaan udang atau daya cerna. Pakan yang berkualitas selain dihasilkan dari sumber bahan pakan juga dapat dihasilkan dengan penambahan enzim dalam pakan. Peningkatan enzim pencernaan eksogen dengan memanfaatkan bakteri saluran pencernaan pada ikan telah banyak dilaporkan. Adanya informasi tentang peranan bakteri dalam saluran pencernaan yang memiliki kemampuan enzimatis atau mampu menyumbangkan enzim kecernaan endogen sehingga membantu proses penyerapan makanan,maka dibuat suatu rancangan penelitian untuk menyeleksi bakteri dari saluran pencernaan udang sebagai probiotik untuk meningkatkan kinerja pertumbuhan udang vaname.
Penelitian ini dilakukan dalam dua tahap secara in vitro dan in vivo. Penelitian in vitro meliputi isolasi bakteri kandidat probiotik, seleksi bakterikandidat probiotik yang terdiri dari uji aktivitas proteolitik, lipolitik dan amilolitik, uji ketahanan terhadap asam lambung dan garam empedu, uji pertumbuhan bakteri, ujiaktivitas antagonistik terhadap bakteri patogen, uji penempelan, uji patogenitas bakteri kandidat probiotik. Uji in vivo meliputi:Uji pakan percobaan pada udang vaname yaitu: uji pertumbuhan dengan beberapa parameter yang dianalisis seperti laju pertumbuhan udang, konversi pakan, retensi protein, populasi bakteri, tingkat kelangsungan hidup dan konsumsi pakan. Uji daya cerna pakan dan uji aktivitas enzim saluran pencernaan. Penelitian ini menggunakan Rancangan Acak Lengkap dengan perlakuan dan ulangan.Pakan yang diujikan terdiri dari A pakan komersial yang ditambah isolat terbaik penghasil amilase isolat M ,B pakan komersial yang ditambah isolat terbaik penghasil lipase isolat Z ,C pakan komersial yang ditambah isolat terbaik penghasil protease isolat K9 , D pakan komersial yang ditambah isolat terbaik penghasil amilase, lipase dan protease S , E pakan komersial yang tidak ditambahkan probiotik.
populasi bakteri yang menempel per mm2. Bakteri probiotik ini juga telah teruji tidak bersifat patogen. Bakteri pobiotik yang terpilih yaitu K9, Z3, M2 dan S3 memenuhi persyaratan untuk dijadikan sebagai probiotik.
Pemberian pakan yang ditambahkan bakteri probiotik yang memiliki aktivitas enzim memberikan pengaruh yang nyata (P<0,05) terhadap kinerja pertumbuhan udang vaname dibandingkan dengan pertumbuhan udang yang diberikan pakan kontrol atau tanpa penambahan probiotik. Hasil terbaik pertumbuhan udang vaname ditunjukkan oleh perlakuan K9 yaitu pemberian pakan yang ditambah isolat yang memiliki aktivitas enzim protease. Kecernaan yang tinggi menyebabkan protein dan energi nutrien pakan yang dapat diserap udang akan lebih tinggi sehingga energi akan lebih banyak tersimpan untuk pertumbuhan.Perlakuan K9 juga menunjukkan hasil konversi pakan yang paling baik dibandingkan lainnya.Penambahan probiotik pada pakan komersial terhadap udang uji juga memberikan pengaruh yang nyata pada populasi bakteri di saluran pencernaan udang uji dibandingkan kontrol. Hal ini memacu peningkatan aktivitas enzim endogenous yang diproduksi oleh bakteri dalam saluran pencernaan. Enzim protease yang disekresikan oleh isolat K9 mampu meningkatkan kinerja pertumbuhan udang vaname.
Kelangsungan hidup udang uji memberikan hasil yang tidak berbeda nyata antar perlakuan. Hal ini mungkin diakibatkan oleh kuantitas serta kualitas pakan yang diberikan cukup untuk mempertahankan kebutuhan pokok udang serta lingkungan yang terjaga dengan baik selama pemeliharaan.
Kata kunci : probiotik, kinerja pertumbuhan, kecernaan, udang vaname
©(akCiptaMilik IPB, tahun 0 0
(akCiptadilindungiUndang‐Undang
Dilarangmengutipsebagianatauseluruhkaryatulisinitanpamencantumkanatau menyebutkansumbernya.Pengutipanhanyauntukkepentinganpendidikan, penelitian, penulisankaryailmiah, penyusunanlaporan, penulisankritik, atautinjauansuatumasalah;
danpengutipantersebuttidakmerugikankepentingan yang wajar IPB.
DilarangmengumumkandanmemperbanyaksebagianatauseluruhKaryatulisdal ambentukapa pun tanpaizin IPB
PERTUMBUHAN UDANG VANAME
Litopenaeus vannamei
TITA NOPITAWATI
Tesis
Sebagai salah satu syarat untuk memperoleh gelar
Magister Sains pada
Program Studi Ilmu Akuakultur
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Litopenaeus vannamei
Nama : Tita Nopitawati
NIM : C151070171
Disetujui
Komisi Pembimbing
Dr. Widanarni
Dr. Dedi Jusadi
Ketua
Anggota
Diketahui
Ketua Program Studi
Dekan Sekolah Pascasarjana
Ilmu Akuakuktur
Prof. Dr. Enang Harris Prof. Dr. Ir. Khairil Anwar Notodiputro, MS.
PRAKATA
Puji syukur penulis panjatkan kepada Allah SWT atas segala karuniaNya
sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam
penelitian yang dilaksanakan sejak bulan November 2008 ini adalah probiotik
dengan judul Seleksi Bakteri Probiotik dari Saluran Pencernaan untuk
Meningkatkan Kinerja Pertumbuhan Udang Vaname Litopenaeus vannamei.
Terima kasih penulis ucapkan kepada Dr. Widanarni dan Dr. Dedi Jusadi
selaku dosen pembimbing, Dr. Nur Bambang Priyo Utomo selaku dosen penguji
yang telah banyak membantu serta memberikan saran. Di samping itu,
penghargaan penulis sampaikan kepada Bapak I Made Suitha A.Pi, Ibu Nurdiana
S.Pi, ibu Khotim A.Md beserta seluruh staf Balai Layanan Usaha Produksi
Perikanan Budidaya (BLUPPB) Karawang atas kesempatan yang diberikan untuk
melakukan penelitian di BLUPPB Karawang. Ungkapan terima kasih penulis
sampaikan kepada orang tua (Otong Suryaman Alm & Tinah Rostini), suami
Nanang Sujana S.Pi dan putra tersayang Gavin Farandhya atas doa, cinta dan
kasih sayang, pengertian serta dorongan yang selalu diberikan. Penulis juga
mengucapkan terima kasih kepada teman-teman Akuakultur 2007 untuk
kebersamaanya selama ini dan Bapak Ranta atas bantuannya selama penelitian.
Semoga karya ilmiah ini bermanfaat.
Bogor, Februari 2010
Penulis dilahirkan di Ciamis, 24 November 1978 dari Ayah Otong
Suryaman (Alm) dan Ibu Tinah Rostini. Penulis merupakan putri ketiga dari tiga
bersaudara.
Penulis menyelesaikan pendidikan SMA pada tahun 1997 dan diterima di
Institut Pertanian Bogor melalui jalur Undangan Seleksi Masuk IPB pada tahun
1997. Penulis memilih jurusan Budidaya Perairan Fakultas Perikanan dan Ilmu
Kelautan dan lulus pada tahun 2001.
Setelah menyelesaikan pendidikan di IPB penulis bekerja di perusahaan
swasta selama 5 tahun. Penulis menikah pada tahun 2004 dengan Nanang Sujana
S.Pi dan telah dikaruniai seorang putra bernama Gavin Farandhya berumur 5
tahun. Pada tahun 2007 penulis melanjutkan pendidikan pascasarjana dan
memilih mayor Ilmu Akuakultur. Pada tanggal 5 Februari 2010 penulis lulus
dengan penelitian berjudul Seleksi Bakteri Probiotik dari Saluran Pencernaan
untuk Meningkatkan Kinerja Pertumbuhan Udang Vaname Litopenaeus
i
DAFTAR ISI
Halaman
DAFTAR TABEL ... ii
DAFTAR GAMBAR ... vi
DAFTAR LAMPIRAN ... vii
PENDAHULUAN
Latar Belakang ... 1
Tujuan dan Manfaat Penelitian ... 2
TINJAUAN PUSTAKA
Sifat Umum Udang Vaname ... 4
Kebutuhan Nutrisi Udang ... 4
Aplikasi Bakteri sebagai Probiotik dalam Akuakultur... 5
Enzim Pencernaan ... 7
BAHAN DAN METODE
Waktu dan Tempat Penelitian ... 10
Prosedur penelitian ... 10
Isolasi Bakteri Kandidat Probiotik ... 10
Seleksi Bakteri Kandidat Probiotik ... 11
1. Uji Aktivitas Proteolitik, Lipolitik dan Amilolitik ... 11
2. Uji Ketahanan terhadap Asam Lambung dan Garam Empedu ... 11
3. Uji Pertumbuhan Bakteri... 11
4. Uji Aktivitas Antagonistik terhadap Bakteri Patogen ... 12
5. Uji Penempelan ... 12
6. Uji Patogenisitas Bakteri Kandidat Probiotik ... 13
Uji Pakan Percobaan pada Udang Vaname ... 13
1. Uji Pertumbuhan ... 14
2. Uji Daya Cerna Pakan ... 17
3. Uji Aktivitas Enzim Saluran Pencernaan ... 17
Analisis Data ... 18
HASIL DAN PEMBAHASAN
Hasil ... 19
Isolasi Bakteri kandidat Probiotik dari Saluran Pencernaan Udang ... 19
Seleksi Bakteri Kandidat Probiotik ... 19
1. Aktivitas Proteolitik, Lipolitik dan Amilolitik ... 19
3. Fase Pertumbuhan Bakteri ... 21
4. Aktivitas Antagonistik terhadap Bakteri Patogen ... 23
5. Penempelan Bakteri Kandidat Probiotik ... 24
6. Aktivitas Patogenitas ... 24
Pakan Percobaan pada Udang Vaname ... 25
1. Pertumbuhan Udang ... 25
2. Aktivitas Enzim Saluran Pencernaan ... 26
Pembahasan ... 27
KESIMPULAN ... 31
SARAN ... 31
DAFTAR PUSTAKA ... 32
iii
DAFTAR TABEL
Halaman
1 Komposisi proksimat pakan komersial yang digunakan ... 13
2 Pertumbuhan relatif (PR), kelangsungan hidup (SR), konversi pakan (KP),
retensi protein (RP), kecernaan total (KT) dan kecernaan protein (KP)
DAFTAR GAMBAR
Halaman
1 Tempat pemeliharaan udang dan tandon air ... 14
2 Hasil aktivitas proteolitik, lipolitik dan amilolitik ... 19
3 Diameter hidrolisis enzim oleh isolat proteolitik, lipolitik dan amilolitik ... 20
4 Selisih log (CFU/ml) antara jumlah isolat pada pH 2,5 dengan pH normal
setiap periode pengamatan ... 20
5 Selisih log (CFU/ml) antara jumlah isolat pada pH 7,5 dengan pH normal
setiap periode pengamatan ... 21
6 Kurva nilai kerapatan optik (
Optical density
) ... 22
7 Aktivitas antagonistik bakteri kandidat probiotik
terhadap
V.harveyi...
23
8 Diameter zona hambat bakteri kandidat probiotik
v
DAFTAR LAMPIRAN
Halaman
1 Prosedur uji hidrolisis protein, lemak dan karbohidrat ... 39
2 Prosedur analisa proksimat ... 41
3 Prosedur analisa Cr
2O
3pakan dan feses... 45
4 Prosedur analisis aktivitas enzim ... 47
5 Luas zona hasil hidrolisis protein, lemak dan karbohidrat ... 49
6 Uji ketahanan asam lambung ... 50
7 Data
optical density
bakteri selama 24 jam ... 51
8 Uji konfrontasi dan antagositik bakteri ... 52
9 Data penempelan bakteri pada substrat ... 52
10 Data bobot tubuh udang vaname selama pemeliharaan ... 53
11 Laju pertumbuhan relatif udang vaname selama
pemeliharaan (60 hari) ... 54
12 Kecernaan protein udang vaname ... 55
13 Retensi protein udang vaname ... 56
14 Perhitungan retensi protein udang vaname ... 57
15 Konversi pakan ... 58
16 Rata-rata tingkat kelangsungan hidup (%) udang vaname selama pemeliharaan
(60 hari) ... 59
17 Data kualitas air selama pemeliharaan udang vaname ... 60
18 Aktivitas enzim amilase, lipase dan protease udang vaname ... 62
19 Jumlah Populasi bakteri pada udang vaname ... 62
Latar Belakang
Kualitas pakan sangat menentukan laju pertumbuhan udang. Pakan yang
dikonsumsi oleh udang tidak semuanya dapat dicerna namun ada yang
dikeluarkan dalam bentuk limbah berupa feses dan sisa metabolisme lain seperti
urin dan amoniak. Besarnya pakan yang dikeluarkan menjadi feses tergantung
dari kesesuaian komponen pakan dengan kemampuan enzimatik di saluran
pencernaan udang atau daya cerna. Pakan yang berkualitas selain dihasilkan dari
sumber bahan pakan dapat juga dihasilkan dengan penambahan enzim dalam
pakan. Pada umumnya pakan dicerna secara optimal dengan bantuan enzim dari
saluran pencernaan udang sehingga energi yang dihasilkan dapat digunakan untuk
memacu pertumbuhan udang.
Di dalam saluran pencernaan udang terdapat bakteri yang menghasilkan
enzim pencernaan yang dapat merombak nutrien makro yang masuk melalui
pakan untuk kebutuhan udang tersebut. Kehadiran enzim dalam saluran
pencernaan sangat mempengaruhi daya cerna udang. Penggunaan probiotik
berhasil meningkatkan keseimbangan bakteri pada saluran pencernaan yang
mengakibatkan peningkatan penyerapan makanan (Parker 1974; Fuller 1989).
Murni (2004) menyatakan bahwa penambahan bakteri probiotik Bacillus sp. ke
dalam pakan menyebabkan adanya peningkatan aktivitas enzim protease dan
amilase sehingga kecernaan protein dan karbohidrat meningkat. Dengan
demikian maka protein dan energi nutrien pakan yang dapat diserap saluran
pencernaan akan lebih banyak dan mengakibatkan pertumbuhan meningkat. Hal
ini berarti protein dan energi yang dapat disimpan oleh tubuh juga akan lebih
tinggi yang berakibat pada tingginya retensi nutrien dan laju pertumbuhan.
Probiotik dapat menguntungkan bagi inangnya karena adanya kemampuan
enzimatis (Fuller & Turvy 1971; Parker 1974), memiliki kemampuan mensintesis
biotin, Vitamin B12 (Sugita et al. 1991) dan enzim hidrolitik seperti amilase
(Sugita et al. 1998) dan protease (Hoshino et al. 1997). Enzim-enzim khusus
2
kompleks menjadi molekul sederhana sehingga akan mempermudah pencernaan
lanjutan dan penyerapan oleh saluran pencernaan udang. Dengan penyerapan
pakan yang tinggi maka diharapkan energi nutrien terserap lebih dan digunakan
untuk pertumbuhan.
Peningkatan enzim pencernaan eksogen dengan memanfaatkan bakteri
saluran pencernaan pada ikan telah banyak dilaporkan (Clarke et al. 1993; Das
dan Tripathi 1991; Opuszynski dan Shireman 1994; Hoshino et al. 1997; Xue et
al. 1999; Robertson et al. 2000; Spanggaard et al. 2000; Jankauskiene 2002).
Bairagi et al. (2002) melaporkan bakteri aerobik yang terdapat pada saluran
pencernaan sembilan ikan tawar yang diteliti mampu menghasilkan enzim yang
memfasilitasi penggunaan pakan dan kecernaan. Hasil penelitian Aslamyah
(2006) menunjukkan bahwa bakteri pada saluran pencernaan ikan bandeng
berperan dalam fungsi fisiologis saluran pencernaan dengan menyumbangkan
enzim protease, lipase dan amilase endogen masing - masing sebesar 41,33; 36,12
dan 22,51%. Hasil penelitian Wang (2007) menyatakan bahwa penambahan
probiotik (campuran Rhodobacter sphaeroides dan Bacillus sp.) dalam pakan
menghasilkan peningkatan bobot tubuh udangvaname.
Adanya informasi tentang peranan bakteri dalam saluran pencernaan yang
memiliki kemampuan enzimatis atau mampu menyumbangkan enzim kecernaan
eksogen sehingga membantu proses penyerapan makanan maka dibuat suatu
rancangan penelitian untuk menyeleksi bakteri dari saluran pencernaan udang
sebagai probiotik untuk meningkatkan kinerja pertumbuhan udang vaname.
Pemilihan probiotik yang diisolasi dari saluran pencernaan udang diharapkan akan
lebih mudah dalam beradaptasi dengan lingkungan saluran pencernaan sehingga
mampu hidup dan berkembang membantu proses pencernaan.
Tujuan dan Manfaat Penelitian
Penelitian ini bertujuan untuk mendapatkan bakteri yang mempunyai
aktivitas enzim protease, lipase dan amilase dari saluran pencernaan untuk
meningkatkan kecernaan pakan dan kinerja pertumbuhan udang vaname. Hasil
probiotik terutama yang berkaitan dengan nutrisi, dan penambahan bakteri dalam
TINJAUAN PUSTAKA
Sifat Umum Udang Vaname
Nama lain dari udang vanameadalah Pacific White Shrimp, West Coast White
Shrimp. Taksonomi udang vaname adalah sebagai berikut :
Kingdom : Animalia
Subkingdom : Metazoa
Filum : Arthropoda
Kelas : Crustacea
Subkelas : Malacostraca
Ordo : Decapoda
Subordo : Dendrobrachiata
Famili : Penaeidae
Genus : Penaeus
Subgenus : Litopenaeus
Spesies : Litopenaeus vannamei
Ciri-ciri udang vaname yaitu bertubuh putih bening, warna tubuh bercorak
kebiru-biruan dari kromatofor yang berwarna biru dan berpusat di antara batas
uropod dan telson (Robertson et al.1993). Kisaran parameter kualitas air yang
optimal untuk pertumbuhan vaname antara lain pada suhu 26°C - 30°C, oksigen terlarut > 5mg/L dan alkalinitas 150-200 mg/L serta salinitas 5-35%o (Lester &
Pante 1992). Aktivitas makan udang dipengaruhi oleh intensitas cahaya (Sumere &
Kontara 1987) sesuai dengan sifat alami udang yaitu nokturnal (aktif pada malam
hari).
Kebutuhan Nutrisi Udang
Protein tidak hanya dibutuhkan untuk pertumbuhan jaringan namun juga
digunakan sebagai sumber energi. Karena kebutuhan ini maka peningkatan protein
dalam pakan diperlukan untuk memenuhi kebutuhan dasar yang dapat
meningkatkan pertumbuhan. Kandungan asam amino yang diberikan pada udang
50-80% protein tubuh, sebagian dapat diganti bersamaan dengan nutrien lain.
Kebutuhan protein udang berukuran 0-0,5 gram adalah 40% (Akiyama et al. 1992).
Kebutuhan protein pada spesies omnivora seperti vaname lebih rendah
dibandingkan spesies karnivora seperti Penaeus japonicus (Guillaume 1997).
Kecernaan protein berkisar antara 75-93%, namun pada Litopenaeus
vannamei ditemukan aktivitas enzim pencernaan untuk beradaptasi dengan
komposisi pakan (Guillaume 1997). Asam amino esensial yang dibutuhkan
krustase adalah: arginina, histidina, isoleusina, leusina, lisina, metionina,
fenilalanina, threonina, triptofan dan valina. Sedangkan kebutuhan fosfolipid
sebesar 2% dalam pakan terutama fosfatidikolin, kolesterol atau fitosterol serta
highly unsaturated fatty acids (HUFA), polyunsaturated fatty acids (PUFA).
Penelitian terbaru melaporkan manfaat fosfatidikolin dalam meningkatkan
ketahanan terhadap stress (Cotteau et al. 1996). Komponen fosfolipid dapat
meningkatkan pertumbuhan dan kelangsungan hidup udang. Empat asam lemak
yang berperan penting pada krustase yaitu linoleic (18:2 n-6), linolenic (18:3 n-3),
eicosapentanoid (EPA) (20:5 n-3) dan docosahexanoic (DHA) (22:6 n-3).
Kebutuhan lemak bervariasi tergantung dari habitat, suhu, jaringan, siklus hidup
dan fase molting (Shiau 1998). Kecernaan karbohidrat berkisar 80-90% namun
bisa berbeda karena sumber atau derajat gelatinisasinya setelah diproses (Cousin et
al.1996).
Aplikasi Bakteri sebagai Probiotik pada Akuakultur
Penelitian penggunaan probiotik dalam hewan akuatik meningkat seiring
dengan permintaan akuakultur yang ramah lingkungan (Gateouspe 1999). Definisi
probiotik menurut Verschuere et al. (2000) yaitu mikrob hidup yang memiliki
pengaruh yang menguntungkan terhadap inang dengan cara meningkatkan
penggunaan pakan dan nilai nutriennya, meningkatkan respon imun inang terhadap
penyakit atau meningkatkan kualitas lingkungan. Menurut Fuller (1992), probiotik
merupakan makanan tambahan dalam bentuk mikrob hidup yang diberikan sebagai
suplemen dengan tujuan untuk meningkatkan kesehatan. Seiring perkembangan
6
bakteri lain yang mempunyai pengaruh menguntungkan bagi kesehatan dan
kehidupan inangnya (Salminen et al. 1999).
Menurut Irianto (2003), pada dasarnya ada 3 model kerja probiotik yaitu:
menekan populasi bakteri melalui kompetisi dengan memproduksi
senyawa-senyawa antimikrob atau melalui kompetisi nutrisi dan tempat pelekatan di dinding
intestinum, merubah metabolisme bakteri dengan meningkatkan atau menurunkan
aktivitas enzim, dan menstimulasi imunitas melalui peningkatan kadar antibodi atau
aktivitas makrofag. Sementara Verschuere et al. (2000) menjabarkan beberapa
kemungkinan model kerja probiotik yaitu: produksi senyawa penghambat,
kompetisi senyawa kimia atau ketersediaan energi, kompetisi tempat penempelan,
peningkatan respon imun, perbaikan kualitas air, interaksi dengan fitoplankton,
sumber makro dan mikronutrien, dan memproduksi enzim untuk membantu
pencernaan makanan.
Pada ikan Salmon Atlantik dan Rainbow trout yang diberi pakan dengan
penambahan bakteri probiotik Carnobacterium sp. dengan konsentrasi 5 x 1010
sel/kg pakan, isolat dapat hidup dengan baik di saluran pencernaan ikan tersebut.
Setelah 14 hari dilakukan uji tantang dengan bakteri Aeromonas salmonicida,
Yersinia ruckeri, Vibrio ordalii dan Vibrioa anguillarum hasilnya menunjukkan
efektivitas pengurangan penyakit yang disebabkan bakteri patogen tersebut kecuali
Vibrio anguillarum (Robertson et al. 2000). Beberapa imunostimulan seperti
glukan, lipopolisakarida dan peptidoglikan telah dilaporkan mampu menstimulasi
fungsi selular pada udang (Gullian et al. 2004). Selain itu pengaruh probiotik
sebagai pakan tambahan yang mampu meningkatkan imun terhadap bakteri patogen
Vibrio sp. dan WSSV juga telah dilakukan (Itami et al. 1998; Gullian et al. 2004).
Penambahan bakteri probiotik pada ikan air tawar juga telah dilakukan pada ikan
gurame dengan penambahan bakteri Bacillus sp. namun tidak menunjukkan
perbedaan yang nyata antar perlakuan terhadap pertumbuhan walaupun berbeda
nyata dengan kontrol. Dosis yang dipakai adalah 1,0 x 109; 1,5 x 109; 2,0 x 109; 2,5
x 109; 3,0 x 109 CFU/100g pakan dan kontrol. Hasil penelitian Murni (2004)
menunjukkan bahwa penambahan probiotik Bacillus sp. dalam pakan buatan dapat
meningkatkan kecernaan, efisiensi pakan dan pertumbuhan ikan gurame dengan
penambahan yaitu meningkatkan nilai pakan, kontribusi enzim dalam saluran
pencernaan, menghambat bakteri patogen, anti mutan gen dan anti karsinogen,
menunjang pertumbuhan dan meningkatkan respon imun (Mohanty et al. 1993;
1996; Sharma and Bhukhar 2000; Veschuere et al. 2000; Spanggard et al. 2001;
Ziaei Nejad et al. 2006; Wang et al. 2005; Wang and Xu 2006; Wang 2007).
Bakteri remedian (Bacillus sp.) telah dimanfaatkan pada pemeliharaan larva udang
windu dan memberikan pengaruh positif pada pertumbuhan karena bakteri dan
enzim yang dihasilkannya akan ikut termakan dan membantu proses pencernaan
dalam saluran pencernaan udang (Handayani et al. 2000).
Peningkatan kualitas air juga dapat dilakukan dengan penambahan
probiotik. Baru-baru ini juga dilaporkan bahwa penggunaan probiotik komersial
dalam tambak vaname dapat menurunkan konsentrasi nitrogen dan fosfor (Wang et
al. 2005).
Enzim pencernaan
Enzim adalah protein yang disintesis didalam sel dan dikeluarkan dari sel
penghasilnya melalui proses eksositosis. Enzim pencernaan yang diekresikan
dalam rongga pencernaan berasal dari sel-sel mukosa lambung, pilorik kaeka,
pankreas dan mukosa usus. Aktivitas enzim sangat erat kaitannya dengan
perkembangan sistem pencernaan (Walford & Lam 1993).
Sel-sel mukosa lambung menghasilkan enzim protease dengan aktivitas
proteolitik optimal pada pH rendah. Cairan pankreas banyak mengandung tripsin
yaitu suatu protease yang aktivitasnya optimal sedikit di bawah alkalis, di samping
itu cairan ini juga mengandung amilase, maltase dan lipase.
Aktivitas enzim pencernaan meningkat dengan meningkatnya umur larva
karena organ penghasil enzim juga semakin sempurna. Haryati (2002) menjelaskan
bahwa aktivitas enzim pepsin, tripsin, lipase, dan amilase meningkat sejalan dengan
dengan peningkatan umur dan ukuran tubuh pada ikan bandeng. Peningkatan
terbesar yaitu pada saat larva berumur 10 hari, sedangkan aktivitas enzim tripsin
terjadi pada umur 15 hari. Sampai umur 30 hari aktivitas enzim pepsin belum
8
Aktivitas enzim lipase telah diteliti oleh Borlongan (1990). Organ
pencernaan utama yang mensekresikan lipase adalah usus, pankreas dan pilorik
kaeka. Ikan yang mendapatkan pakan berupa diatom dan uniseluler dengan
kandungan lemak kasar 1,98% mempunyai aktivitas lipase yang lebih tinggi pada
organ utama yang mensekresi enzim tersebut dibandingkan dengan yang diberi
pakan alga hijau berfilamen dengan kandungan lemak kasar 0,98%. Ikan bandeng
secara efektif dapat beradaptasi terhadap tingkat lemak dalam pakan. Hal ini
menunjukkan bahwa aktivitas enzim berkorelasi dengan komposisi pakan yang
dikonsumsi.
Aktivitas enzim udang vaname telah diteliti oleh Wang (2008) dimana pada
stadia larva aktivitas protease vaname tidak berbeda antara yang diberikan pakan
dengan probiotik atau tanpa penambahan probiotik, namun pada stadia postlarva
1-2 dan 7-8 aktivitas proteasenya paling tinggi dan berbeda dengan udang yang
diberikan pakan tanpa penambahan probiotik. Penambahan probiotik juga
memberikan pengaruh terhadap aktivitas amilase dibandingkan udang yang
diberikan makanan tanpa probiotik begitupun dengan aktivitas lipase udang
vaname.
Enzim amilase, protease dan lipase mempengaruhi pencernaan makanan di
usus anterior. Protease yang disebut juga endopeptidase merupakan kelompok
enzim pencernaan udang yang bertanggung jawab lebih dari 60% dari kecernaan
total protein dalam udang (Galgani et al. 1984, 1985; Tsai et al 1986). Protease
merupakan enzim yang paling banyak berperan dalam hidrolisis protein.
Sedangkan dalam hidrolisis karbohidrat adalah amilase seperti yang ditunjukkan
ikan mas (Zonneveld et al. 1991). Keberadaan enzim dalam pakan akan
meningkatkan daya cerna bahan makanan. Penelitian yang dilakukan Lemos et al.
2000 tentang derajat hidrolisis pakan udang penaeid dengan sumber protein yang
terdiri dari: tepung ikan menhaden, tepung kedelai, tepung limbah tuna, tepung ikan
putih dan tepung langostilla dengan ekstrak enzim pencernaan udang pada
konsentrasi 1 ml/10 g pakan menghasilkan derajat hidrolisis protein berkisar dari
23,20 sampai 33,99%. Aktivitas tripsin dan kemotripsin Litopenaeus vannamei
lebih tinggi pada udang yang diberikan protein kualitas rendah (tepung menhaden
Penelitian Aslamyah (2006) menunjukkan bahwa bakteri Carnobacterium
sp. mampu menghidrolisis karbohidrat pakan sebesar 20,00 sampai 57,87 mg pada
jumlah inokulum 1010 CFU/ml dan 20,00 sampai 58,13 mg pada jumlah inokulum
1012 CFU/ml dan bakteri tersebut berperan dalam fungsi fisiologis saluran
pencernaan dengan menyumbangkan enzim protease, lipase dan amilase endogen
BAHAN DAN METODE
Waktu dan Tempat Penelitian
Penelitian ini dimulai dengan tahap isolasi dan seleksi bakteri kandidat
probiotik yang dilakukan di Laboratorium Kesehatan Ikan, Departemen Budidaya
Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor (IPB)
mulai bulan November 2008 sampai Februari 2009. Tahap selanjutnya yaitu
pemeliharaan udang vaname dilakukan di Balai Layanan Usaha Produksi
Budidaya (BLUPPB) Karawang Jawa Barat dari bulan Juli sampai September
2009. Setelah pemeliharaan selanjutnya dilakukan analisa enzim di Laboratorium
Bakteriologi, Pusat Antar Universitas (PAU), IPB dan analisa kecernaan serta
analisa proksimat dilakukan di Laboratorium Nutrisi Departemen Budidaya
Perairan, Fakultas Perikanan dan Ilmu Kelautan, IPB.
Prosedur Penelitian Isolasi Bakteri Kandidat Probiotik
Sumber inokulum didapat dari isi saluran pencernaan udang vaname fase
dewasa dengan ukuran rata-rata 10-15 g yang dilakukan dengan cara
mengeluarkan saluran pencernaan udang. Saluran pencernaan ditimbang dan
diukur panjangnya kemudian digerus dan diencerkan. Setiap 1g saluran
pencernaan diencerkan dengan 9 ml larutan fisiologis (NaCl 0,85%) steril.
Sampel hasil pengenceran kemudian ditumbuhkan pada media seawater complete
(SWC) yang dibuat dari 1,25 g bakto pepton, 0,25 g yeast ekstrak, 750 ml air laut,
250 ml akuades dan 3 ml gliserol. Sebagai sumber energi untuk bakteri
proteolitik, lipolitik dan amilolitik masing-masing digunakan susu (kasein),
minyak zaitun dan tepung kanji (pati).
Kultur cair bakteri dilakukan dalam suasana aerob pada suhu 29°C selama 20-24 jam. Kultur selanjutnya diencerkan sampai 10-7 dan kemudian
ditumbuhkan kembali pada media SWC yang telah ditambahkan sumber energi.
Seleksi Bakteri Kandidat Probiotik
Seleksi probiotik dilakukan dengan mengamati bakteri yang mampu
menghidrolisis kasein, pati dan lemak (Lampiran 1). Tahap seleksi bakteri untuk
mendapatkan kandidat probiotik terdiri dari :
1. Uji Aktivitas Proteolitik, Lipolitik dan Amilolitik
Pengujian ini bertujuan untuk mengukur besarnya kemampuan aktivitas
proteolitik, lipolitik dan amilolitik dari masing masing isolat yang diuji melalui uji
hidrolisis protein, lemak dan karbohidrat (Lampiran 1). Aktivitas protease
ditandai dengan zona bening di sekeliling isolat yang ditumbuhkan pada media
agar sedangkan isolat yang tidak mampu menghidrolisis protein tidak terbentuk
zona di sekitar isolat. Hasil aktivitas lipase ditandai dengan adanya warna hijau
terang pada isolat yang ditumbuhkan dan aktivitas amilase ditandai dengan warna
sekeliling isolat menjadi kuning cerah sedangkan isolat yang tidak mampu
menghidrolisis karbohidrat warna sekeliling isolat gelap.
2. Uji Ketahanan terhadap Asam Lambung dan Garam Empedu
Kemampuan bakteri untuk bertahan dalam lambung yang berpH rendah dan
saluran pencernaan yang ber-pH basa diuji dengan ketahanan asam lambung dan
garam empedu. Metode ini mengacu pada Ngatirah et al. (2000) yaitu dengan
menginokulasikan 1 ml isolat bakteri ke dalam satu seri tabung yang berisi 9 ml
larutan media steril dengan pH 2,5 (diatur dengan penambahan HCL) dan pH 7,5
(diatur dengan penambahan NaOH) dan selanjutnya diinkubasi pada suhu 29°C. Selanjutnya sel bakteri yang tumbuh dihitung dengan metode hitungan cawan
setiap 2 jam selama 8 jam. Ketahanan terhadap asam lambung dan garam empedu
ditentukan oleh selisih jumlah koloni antara kontrol dan perlakuan. Semakin kecil
selisihnya maka semakin tahan terhadap asam lambung dan garam empedu.
3. Uji Pertumbuhan Bakteri
Pencapaian fase ekponensial bakteri dapat ditentukan dengan fase
pertumbuhan bakteri. Persiapan kultur dilakukan dengan cara menginokulasikan
0,1 ml isolat bakteri ke dalam 10 ml media kultur cair dan diinkubasi selama 24
12
pada suhu 29°C. Pertumbuhan bakteri diamati setiap 2 jam dengan mengukur nilai kerapatan atau optical density (OD) dengan menggunakan alat
spektrofotometer dengan panjang gelombang 620 nm (Hadioetomo 1990).
4. Uji Aktivitas Antagonistik terhadap Bakteri Patogen
Uji ini dilakukan untuk mengetahui kemampuan bakteri kandidat probiotik
dalam menghambat bakteri patogen. Bakteri patogen yang digunakan adalah
Vibrioharveyi. Pertama dilakukan kultur cair bakteri patogen dan setiap kandidat
probiotik. Selanjutnya dari kultur cair diambil 0,1 ml dan ditambahkan 0,9 ml
larutan fisiologis steril. Untuk bakteri patogen diambil 0,1ml dan kemudian
disebar di cawan. Kertas saring steril dicelupkan pada suspensi kandidat
probiotik dan diletakkan di atas media padat SWC yang telah disebar dengan
V.harveyi. Biakan bakteri ini diinkubasi pada suhu 29°C selama 24 jam dan diamati zona bening sebagai hasil bahwa kandidat probiotik dapat menghambat
V. harveyi.
5. Uji Penempelan
Uji ini mengacu pada metode berdasarkan Dewanti & Wong (1993) yang
menggunakan lempeng baja. Terlebih dahulu lempeng baja disterilkan dengan
cara direndam dalam larutan deterjen yang dipanaskan sampai mencapai suhu 40 -
45°C selama 24 jam, kemudian lempeng baja dibilas dengan air panas 40 - 50°C sampai bersih lalu dikeringanginkan, selanjutnya diautoklaf pada suhu 121°C selama 20 menit.
Pengujian dilakukan dengan cara meletakkan lempeng baja di dalam
erlenmeyer 1 L dengan posisi berdiri. Erlenmeyer sebelumnya telah diisi dengan
250 ml SWC steril dan telah diinokulasi 1 ml kultur segar bakteri. Erlenmeyer
ditutup dengan alumunium foil dan ditempatkan dalam shaker selama 24 jam
pada suhu 29°C. Setelah 24 jam lempeng baja dibilas dengan larutan buffer fosfat (BF). Kemudian permukaan lempeng diseka secara merata dengan menggunakan
swab. Swab dimasukkan ke dalam tabung reaksi yang berisi 10 ml BF dan
divortex selama 1 menit. Selanjutnya dilakukan pengenceran serial dan dihitung
populasi bakteri dengan metode hitungan cawan.
Jumlah bakteri yang tumbuh pada media dalam erlenmeyer juga dihitung
mL buffer Fosfat. Selanjutnya dilakukan penghitungan populasi bakteri yang
tumbuh dengan metode hitung cawan. Bakteri yang mampu membentuk biofilm
dengan baik akan mampu menempel pada substrat yaitu usus.
6. Uji Patogenisitas Bakteri Kandidat Probiotik
Uji patogenisitas dilakukan untuk melihat apakah bakteri yang diberikan
bersifat patogen atau tidak terhadap udang. Uji ini dilakukan dengan cara
menyuntikkan bakteri kandidat probiotik secara intramuskular dengan konsentrasi
106 CFU/ml sebanyak 0,1 ml/ekor. Udang dipelihara selama 7 hari dan diamati
kelangsungan hidupnya setiap hari. Pada akhir pemeliharaan tingkat
kelangsungan hidup udang dihitung dan dibandingkan dengan kontrol yakni
udang yang disuntik dengan larutan fisiologis. Kandidat probiotik yang akan
digunakan adalah bakteri yang tidak bersifat patogen yang tidak menyebabkan
udang sakit dan mati pada saat uji patogenitas ini.
Uji Pakan Percobaan pada Udang Vaname
Pakan yang digunakan yaitu pakan komersial (Tabel 1) dan ditambahkan
kandidat probiotik. Sebelum dicampurkan ke dalam pakan dilakukan kultur cair
bakteri kandidat probiotik yang ditempatkan dalam shaker dengan suhu 29°C
dengan kecepatan 180 rpm dan dilakukan pemanenan sesuai waktu pencapaian
fase eksponensial. Hasil kultur bakteri yang didapat dipindahkan ke dalam tabung
ulir dan disentrifuse selama 15 menit dengan kecepatan 4000 rpm. Hasil endapan
bakteri probiotik inilah yang dicampurkan ke dalam pakan. Probiotik sebanyak
10g/kg (Wang et al. 2007) ditambahkan ke dalam pakan dengan cara
disemprotkan secara merata menggunakan spuit dengan menambahkan 2% kuning
telur.
Tabel 1. Komposisi proksimat pakan komersil yang digunakan
Komposisi Proksimat
Kandungan (%)
14
Komposisi : Fish meal, shrimp meal, squid meal, soybean meal, wheat flour, soy lecithin, squid oil, fish oil, immune stimulant, vitamin, mineral, anti mold and anti oksidant
Sumber : Luxindo 39 3A
Pakan yang diberikan pada percobaan ini terdiri dari :
A: Pakan komersial yang ditambah isolat terbaik penghasil amilase (isolat
M2)
B: Pakan komersial yang ditambah isolat terbaik penghasil lipase (isolat
Z3)
C: Pakan komersial yang ditambah isolat terbaik penghasil protease (isolat
K9)
D: Pakan komersial yang ditambah isolat terbaik penghasil amilase, lipase
dan protease (S3)
E: Pakan komersial yang tidak ditambahkan probiotik
Selanjutnya pakan ini diberikan pada udang selama percobaan pemeliharaan
untuk selanjutnya dilakukan :
1. Uji Pertumbuhan
Pemeliharaan udang dilakukan pada wadah plastik ukuran 90L sebanyak 15
buah (Gambar 1). Bagian samping ditutup plastik warna hitam dengan tujuan
untuk menurunkan intensitas cahaya sesuai dengan sifat udang yang aktif pada
malam hari (nokturnal). Sebelum digunakan, semua peralatan diberi desinfektan
dengan kaporit. Wadah plastik diisi air yang berasal dari tambak udang dengan
ketinggian 70%. Air dari tambak disaring terlebih dahulu dan diberi desinfektan
dengan kaporit 30 ppm kemudian dinetralkan dengan Na-thiosulfat 10 ppm dan
diaerasi tinggi. Air disterilkan selama 3 hari dan pada hari keempat udang
dimasukkan ke dalam wadah plastik.
Udang dengan bobot rata-rata 8,35 ± 0.16 g dan panjang 10,14 ± 0,21cm
ditebar dengan kepadatan 30 ekor per wadah. Pemeliharaan udang dilakukan
selama 60 hari dan diberi pakan satiation sebanyak lima kali sehari, yaitu pukul
06.00, 10.00, 14.00, 18.00 dan 21.00. Jumlah pakan yang diberikan sebanyak 5
% dari bobot tubuh udang dan selanjutnya disesuaikan dengan pertambahan bobot
tubuh udang vaname. Penggantian air dilakukan 3 hari sekali sebanyak 10% dan
penyiponan dilakukan setiap pagi hari untuk membersihkan sisa pakan dan feses.
Jumlah pakan yang diberikan selama pemeliharaan ditimbang dan dicatat untuk
menghitung efisiensi pakan. Untuk mengetahui laju pertumbuhan udang
dilakukan sampling setiap 10 hari sekali. Pengukuran kualitas air dilakukan pada
awal, tengah dan akhir pemeliharaan meliputi salinitas, pH, suhu, dissolve
oksigen (DO) dan amoniak. Untuk uji pertumbuhan ini dianalisis beberapa
parameter yaitu :
1. Laju pertumbuhan relatif udang
Laju pertumbuhan relatif dihitung menggunakan rumus menurut Takeuchi (1988)
yaitu:
PR = Wt-Wo x 100%
Wo
Dimana :
Wo = Bobot ikan awal (g)
Wt = Bobot ikan akhir (g)
PR = Pertumbuhan relatif
2. Konversi Pakan (KP)
Konversi pakan dihitung berdasarkan rumus menurut Takeuchi (1988) yaitu :
KP = F x 100% (Wt +Wd ) - Wo
Dimana :
KP = Konversi pakan (%)
Wo = Bobot rata rata ikan uji pada awal penelitian (g)
Wt = Bobot rata rata ikan uji pada waktu t (g)
Wd = Bobot udang yang mati selama penelitian (g)
16
3. Retensi Protein
Retensi protein dapat diketahui dengan melakukan analisis proksimat
kadar protein (Lampiran 2) terhadap pakan, serta tubuh udang awal dan akhir
penelitian. Rumus yang dipakai berdasarkan Takeuchi (1988) :
RP = Pt-Po x 100 Pe
Dimana :
RP = Retensi protein (%)
Po = bobot protein dalam tubuh ikan pada waktu 0 (g)
Pt = bobot protein dalam tubuh ikan pada waktu t (g)
Pe = bobot protein yang dikonsumsi ikan (g)
4. Populasi bakteri
Populasi bakteri yang terdapat dalam saluran pencernaan udang dan feses
udang vaname dihitung pada awal dan akhir percobaan dengan metode hitungan
cawan. Hal ini dilakukan untuk melihat ada atau tidaknya perbedaan populasi
setelah diberikan pakan uji. Sampel saluran percernaan udang dan feses digerus
secara terpisah dan setiap 1 g saluran pencernaan diencerkan dengan 9 ml larutan
fisiologis steril. Kemudian hasil pengenceran ditumbuhkan pada media agar
padat.
5. Tingkat kelangsungan hidup
Tingkat kelangsungan hidup diamati setiap periode pengamatan 10 hari
sampai akhir penelitian dan penghitungannya menggunakan rumus sebagai
berikut (Effendie 1997) :
S = Nt x 100 No Dimana :
S = Derajat kelangsungan hidup (%)
Nt = Jumlah udang uji pada akhir penelitian ( ekor )
No = Jumlah udang uji pada awal penelitian ( ekor )
6. Konsumsi Pakan
Konsumsi pakan dihitung dengan cara menimbang jumlah pakan awal
ditimbang untuk mengetahui jumlah pakan yang dikonsumsi udang setiap hari
selama masa pemeliharaan.
2. Uji Daya Cerna Pakan
Pengujian daya cerna pakan dilakukan secara terpisah dari uji pertumbuhan.
Pakan yang akan digunakan dihaluskan menjadi serbuk dan ditambahkan 0,6 %
Cr2O3 sebagai indikator kecernaan dan CMC sebesar 20 g/kg pakan sebagai
perekat (Watanabe 1988). Selanjutnya pakan serbuk dibuat pelet lagi dan
dikeringkan. Pakan diberikan pada udang selama seminggu dan pada hari ketujuh
dilakukan pengumpulan feses udang dengan cara menyipon akuarium dengan
selang kecil dan ditampung dalam ember. Selanjutnya disaring dan feses yang
terkumpul ditempatkan pada botol film untuk selanjutnya dianalisa (Lampiran 3).
Feses yang terkumpul dikeringkan dalam oven bersuhu 110°C selama 4-6 jam. Selanjutnya dilakukan analisa kandungan Cr2O3 terhadap feses yang sudah
dikeringkan (Lampiran 4).
Nilai kecernaan dihitung berdasarkan Takeuchi (1988) :
Kecernaan protein (%) = 1-(a’/a )/(b’/b) x 100
Kecernaan Total (%) = 1-(a’/a) x 100
Keterangan :
a = % Cr2O3 dalam pakan
a’ = % Cr2O3 dalam feses
b’ = % protein dalam feses
b = % protein dalam pakan
3. Uji Aktivitas Enzim Saluran Pencernaan
Uji aktivitas enzim dilakukan pada saluran pencernaan udang di akhir
penelitian. Hal ini dilakukan untuk mengetahui ada atau tidaknya pengaruh dari
penambahan probiotik pada pakan yang diberikan dibandingkan kontrol. Udang
diambil sebanyak 6 ekor dari setiap akuarium kemudian dibedah untuk diambil
saluran pencernaannya. Preparasi ekstrak enzim saluran pencernaan udang ini
dilakukan pada suhu 4°C. Saluran pencernaan udang kemudian dicuci dengan akuades dan dikeringkan dengan kertas penghisap. Selanjutnya usus ditimbang
dan dihomogenkan dengan menambahkan larutan buffer 10 ml. Setelah homogen
18
yang akan digunakan pada pengujian selanjutnya yaitu aktivitas enzim (Lampiran
3).
Analisis Data
Data hasil isolasi dan seleksi bakteri kandidat probiotik serta aktivitas enzim
saluran pencernaan udang dianalisa secara deskriptif sedangkan data hasil uji
pertumbuhan dan kecernaan dianalisa secara statistika. Rancangan yang
digunakan adalah Rancangan Acak Lengkap (RAL) dan menggunakan analisa
ragam dengan tingkat kepercayaan 95% dan dilanjutkan dengan uji Duncan untuk
Hasil
Isolasi Bakteri Kandidat Probiotik dari Saluran Pencernaan Udang
Hasil isolasi bakteri kandidat probiotik dari saluran pencernaan udang
didapat total sebanyak 30 isolat bakteri untuk diseleksi lebih lanjut. Isolat bakteri
ini diambil berdasarkan koloni yang berbeda. Morfologi koloni isolat bakteri
yang didapat adalah bulat sedang, tidak beraturan, warna krem; bulat besar
menipis ke pinggir, tepian bergerigi, warna krem; bulat melebar, tepi berserabut,
warna bening; bulat, menipis ke tepi, warna bening.
Seleksi Bakteri Kandidat Probiotik
1. Aktivitas Proteolitik, Lipolitik dan Amilolitik
Hasil uji aktivitas proteolitik, lipolitik dan amilolitik terhadap bakteri
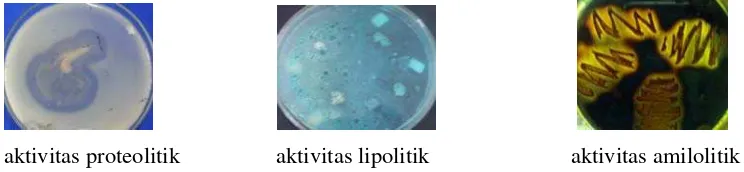
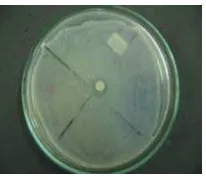
kandidat probiotik disajikan pada Gambar 2. Hasil uji aktivitas proteolitik
ditandai dengan adanya zona bening di sekeliling koloni isolat, aktivitas lipolitik
ditunjukkan dengan adanya warna hijau di sekeliling koloni isolat dan aktivitas
amilolitik ditandai zona kuning bening di daerah isolat yang ditumbuhkan.
[image:35.612.131.503.434.520.2]
aktivitas proteolitik aktivitas lipolitik aktivitas amilolitik
Gambar 2 Hasil aktivitas proteolitik, lipolitik dan amilolitik.
Hasil pengukuran luas diameter hasil aktivitas disajikan pada Gambar 3 dan
Lampiran 5. Dari hasil pengukuran diameter hidrolisis protease didapatkan tiga
isolat dengan diameter tertinggi sebesar 20 mm yaitu K9, K19 dan Z1. Isolat
yang mampu menghidrolisis lipase paling tinggi yaitu isolat Z5 dengan diameter
12 mm disusul Z3 diameter 9 mm dan isolat yang mampu menghidrolisis amilase
paling tinggi yaitu M1 dan M2 dengan diameter 15 mm. Isolat-isolat tersebut
selanjutnya diuji lanjut berdasarkan tahapan seleksi bakteri probiotik. Adanya
0
isolat-isolat tersebut mampu memanfaatkan sumber energi yaitu kasein, lemak
[image:36.612.132.508.131.286.2]dan pati yang ditambahkan pada media menjadi sumber karbon.
Gambar 3 Diameter hidrolisis enzim oleh isolat proteolitik, lipolitik dan amilolitik.
2. Ketahanan terhadap Asam Lambung dan Garam Empedu
Toleransi terhadap asam merupakan salah satu syarat penting suatu isolat
untuk dijadikan kandidat probiotik. Hasil dari pengujian ketahanan terhadap asam
lambung dan garam empedu disajikan pada Gambar 4, Gambar 5 dan Lampiran 6
[image:36.612.131.507.421.619.2]Gambar 5 Selisih log (CFU/ml) antara jumlah isolat pada pH 7,5 dengan pH normal.
Hasil pengujian terhadap asam lambung menunjukkan bahwa isolat S3 dan
K9 memiliki selisih terkecil yang berarti lebih tahan terhadap pH asam lambung
dibandingkan isolat lainnya. Isolat harus tahan terhadap pH asam lambung untuk
mampu bertahan hidup dalam saluran pencernaan. Apabila sel bakteri terpapar
pada kondisi yang sangat asam maka membran sel dapat mengalami kerusakan
dan berakibat pada hilangnya komponen-komponen intraseluler seperti Mg, K dan
lemak dari sel tersebut. Pada akhirnya kerusakan ini dapat mengakibatkan
kematian sel (Bender & Marquis 1987). Hasil pengujian terhadap garam empedu
menunjukkan bahwa isolat K9 merupakan isolat yang paling mampu beradaptasi
karena selisih log populasinya paling kecil diantara semua isolat.
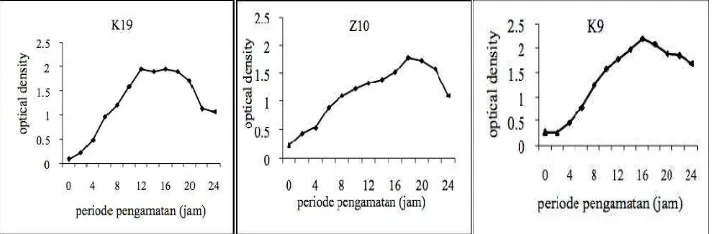
3. Fase Pertumbuhan Bakteri
[image:38.612.134.493.81.198.2]
4. Aktivitas Antagonistik terhadap Bakteri Patogen
Hasil uji aktivitas antagonistik ditunjukkan pada Gambar 7. Isolat bakteri
kandidat probiotik rata-rata memiliki daya hambat terhadap bakteri patogen yaitu
V.harveyi dimana aktivitas ini ditandai dengan adanya zona hambat di sekeliling
[image:39.612.252.355.200.290.2]isolat yang ditanam.
Gambar 7 Aktivitas antagonistik bakteri kandidat probiotik terhadap V. harveyi.
Hasil pengukuran zona hambat isolat kandidat probiotik disajikan pada
Gambar 8 dan Lampiran 8. Kandidat probiotik diharapkan mampu menekan
pertumbuhan bakteri patogen dalam saluran pencernaan. Hal ini dapat terjadi
karena kandidat yang mampu menekan pertumbuhan bakteri patogen mampu
menghasilkan antibakteri. Pemilihan probiotik salah satu kriterianya berdasarkan
kemampuannya memiliki aktivitas antagonistik dimana pada penelitian ini
[image:39.612.131.507.485.660.2]ditujukan untuk bakteri patogen udang yatu Vibrio harveyi.
Dari hasil uji aktivitas antagonistik didapatkan hasil bahwa bakteri kandidat
probiotik rata-rata mampu menekan pertumbuhan V.harveyi. Zona hambat terbaik
dihasilkan oleh isolat S2 dengan diameter 13 mm namun ada satu isolat yang
tidak mampu menghambat bakteri patogen yaitu isolat bakteri Z10.
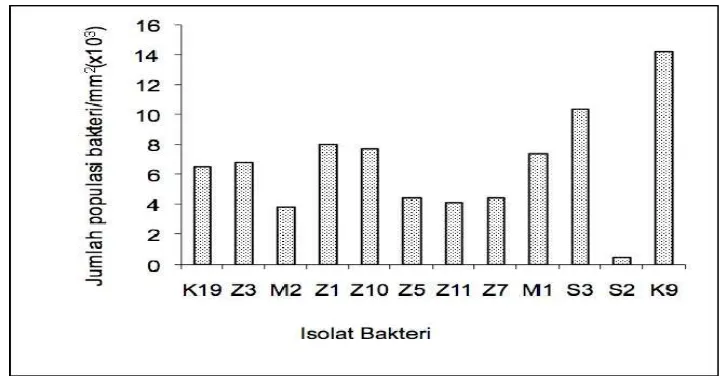
5. Penempelan Bakteri Kandidat Probiotik
Faktor penempelan atau adherence factor merupakan faktor yang dimiliki
oleh bakteri untuk menempel dan membentuk biofilm pada permukaan padat
(Characklis 1990). Hal yang mempengaruhi sifat penempelan bakteri pada
permukaan padat adalah sifat hidrofobisitas antar sel bakteri, jarak antar sel dan
adanya reseptor pada sel inang (Zita & Hermannson 1997). Uji penempelan
terhadap kandidat probiotik memberikan hasil yang berbeda pada setiap kandidat
probiotik seperti ditunjukkan pada Gambar 9 dan Lampiran 9. Untuk kandidat
probiotik terpilih (Z3, K9, S3 dan M2) menunjukkan adanya kemampuan
menempel pada substrat. Isolat K9 memiliki jumlah koloni 14.000 koloni /mm2
[image:40.612.129.492.400.591.2]yang artinya isolat ini mampu menempel dengan baik.
Gambar 9 Hasil uji penempelan bakteri kandidat probiotik pada lempeng baja.
6. Aktivitas Patogenisitas
Hasil yang didapat dari uji patogenisitas membuktikan bahwa kandidat
dibuktikan dari hasil kelangsungan hidup udang 100 % . Udang yang disuntik
dengan isolat bakteri kandidat probiotik mampu bertahan hidup selama masa uji
dan kondisi tubuhnya tidak ada perbedaan dengan udang kontrol atau yang
disuntik dengan larutan fisiologis. Dengan hasil ini maka kandidat probiotik
dapat diaplikasikan sebagai probiotik pada penambahan pakan yang akan
diberikan pada udang.
Pakan Percobaan Udang vaname
1. Pertumbuhan Udang
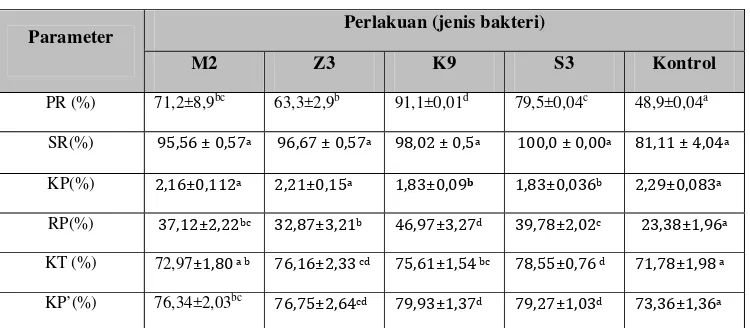
Hasil uji pertumbuhan disajikan pada Tabel 2 yang meliputi beberapa
parameter yang dianalisis. Pemberian pakan yang ditambahkan kandidat
probiotik yang memiliki aktivitas enzim memberikan pengaruh yang nyata
(P<0,05) terhadap pertumbuhan udang vaname dibandingkan dengan
pertumbuhan udang yang diberikan pakan kontrol atau tanpa penambahan
[image:41.612.134.509.421.585.2]probiotik.
Tabel 2 Pertumbuhan relatif (PR), kelangsungan hidup (SR), konversi pakan (KP), retensi protein (RP), kecernaan total (KT) dan kecernaan protein (KP’) udang vaname
Parameter Perlakuan (jenis bakteri)
M2 Z3 K9 S3 Kontrol
PR (%) 71,2±8,9bc 63,3±2,9b 91,1±0,01d 79,5±0,04c 48,9±0,04a
SR(%) 9 , ± 0, a 9 , ± 0, a 9 ,0 ± 0, a 00,0 ± 0,00a , ± ,0 a
KP(%) , ±0, a , ±0, a , ±0,09b , ±0,0 b , 9±0,0 a
RP(%) , ± , bc , ± , b ,9 ± , d 9, ± ,0 c , ± ,9 a
KT (%) 72,97± , 0 a b , ± , cd , ± , bc , ±0, d , ± ,9 a
KP’(%) 76,34±2,03bc , ± , cd 9,9 ± , d 9, ± ,0 d , ± , a
Keterangan : (p<0,05) Huruf yang berbeda pada garis yang sama menunjukkan perbedaan antar perlakuan.
Hasil terbaik pertumbuhan udang vaname ditunjukkan oleh perlakuan K9
yaitu pemberian pakan yang ditambah isolat yang memiliki aktivitas enzim
protease dan selanjutnya perlakuan S3 yaitu pemberian pakan yang ditambah
udang vaname pada kedua perlakuan ini lebih baik dibandingkan perlakuan
lainnya (Lampiran 10 dan Lampiran 11). Hal ini diduga karena dengan kecernaan
protein yang tinggi yaitu 79,93%± , Lampiran sehingga mampu meningkatkan retensi protein sebesar ,9 %± , Lampiran dan Lampiran . Perlakuan K9 juga menunjukkan hasil konversi pakan yang baik yaitu , ±0,09 (Lampiran 15) yang berarti bahwa pakan yang dibutuhkan untuk menjadikan kg daging sebesar 1,83 kg dan ini lebih efektif dalam penggunaan
protein baik sebagai sumber energi atau sebagai zat pembangun tubuh sehingga
protein yang tidak tercerna dan keluar dalam bentuk sisa metabolisme dapat
dikurangi. Kelangsungan hidup selama pemeliharaan udang vaname menunjukkan
tidak ada perbedaan yang nyata antara perlakuan dengan kontrol (Lampiran 16).
Selama pemeliharaan salinitas air ‰ sesuai dengan kondisi di tambak udang, DO berkisar di ,0‐ , dan amoniak berkisar di 0,0 ‐0,0 dan p( berkisar pada , ‐ ,9 Lampiran .
3. Aktivitas Enzim Saluran Pencernaan
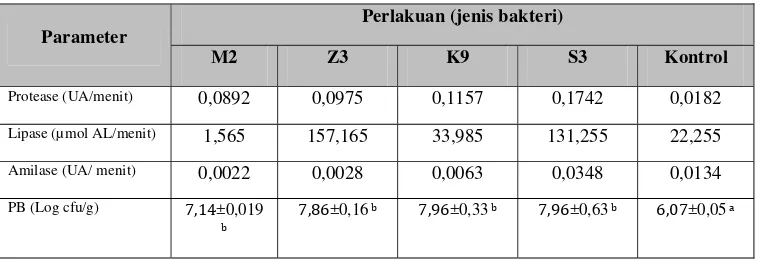
Hasil uji aktivitas enzim saluran pencernaan udang disajikan pada Tabel 3
dan Lampiran 18. Dari hasil analisis aktivitas enzim pada saluran pencernaan
udang didapatkan aktivitas enzim protease, lipase dan amilase saluran udang yang
sejalan dengan kemampuan bakteri dalam menghidrolisis protein, lemak dan
karbohidrat pada uji in vitro. Sehingga bakteri yang mampu menghidrolisis
protein, lemak dan karbohidrat ini pada saat ditambahkan ke dalam pakan mampu
[image:42.612.134.515.560.693.2]menyumbangkan enzim eksogenous pada udang vaname.
Tabel 3 Aktivitas enzim protease, lipase, amilase dan populasi bakteri (PB)
Parameter
Perlakuan (jenis bakteri)
M2 Z3 K9 S3 Kontrol
Protease (UA/menit) 0,0892 0,0975 0,1157 0,1742 0,0182
Lipase (µ mol AL/menit) 1,565 157,165 33,985 131,255 22,255
Amilase (UA/ menit) 0,0022 0,0028 0,0063 0,0348 0,0134
PB (Log cfu/g) , ±0,019 b ,
Keterangan : (p<0,05) Huruf yang berbeda pada garis yang sama menunjukkan perbedaan antar perlakuan.
Penambahan probiotik pada pakan komersial terhadap udang uji juga
memberikan pengaruh yang nyata pada populasi bakteri di saluran pencernaan
udang uji (Tabel 3 dan Lampiran 19). Hal ini memacu peningkatan aktivitas
enzim endogenous yang diproduksi oleh bakteri dalam saluran pencernaan. Ini
dibuktikan dengan populasi bakteri yang lebih tinggi pada saluran pencernaan
udang uji pada perlakuan M2, Z3, K9 dan S3 dibandingkan kontrol. Peningkatan
populasi bakteri sejalan dengan aktivitas enzim protease, lipase dan amilase pada
saluran pencernaan udang vaname.
Pembahasan
Seleksi probiotik dari saluran pencernaan udang vaname menghasilkan
kandidat probiotik yang mampu mensekresikan enzim yaitu enzim protease (K9),
enzim lipase (Z3) dan enzim amilase (M2) ataupun ketiga enzim baik protease,
lipase dan amilase (S3). Isolat K9 sebagai bakteri proteolitik yaitu bakteri yang
mampu mensekresikan enzim protease yang akan merombak protein menjadi
asam amino. Isolat Z3 sebagai bakteri lipolitik yaitu bakteri yang mampu
mensekresikan enzim lipase yang akan mencerna trigliserida dan menghasilkan
asam lemak rantai panjang dan gliserol. Sedangkan isolat M2 sebagai bakteri
amilolitik yaitu bakteri yang mampu mensekresikan enzim amilase yang akan
mendegradasi pati menjadi maltosa dan glukosa yang kemudian diangkut ke
dalam sitoplasma sel dan digunakan sebagai sumber karbon dan energi.
Syarat lain suatu bakteri dapat dijadikan kandidat probiotik adalah mampu
bertahan pada paparan pH asam dan basa dengan selisih log populasi yang kecil
antara pH normal dengan pH asam dan pH normal dengan pH basa. Hal ini
sangat penting karena bakteri probiotik harus mampu untuk bertahan pada pH
asam lambung dan setelah itu probiotik akan akan berhadapan dengan garam
empedu yang ber-pH basa. Bakteri yang mampu bertahan pada pH rendah atau
asam dinyatakan bersifat asam atau resisten terhadap asam lambung dan yang
berhasil bertahan pada pH basa dinyatakan resisten terhadap garam empedu (Chou
memiliki ketahanan terhadap pH asam dan basa dan tetap hidup sampai akhir
pengamatan 8 jam. Hal ini diduga karena isolat diseleksi dari saluran pencernaan
yang sudah beradaptasi dengan kondisi asam lambung dan garam empedu pada
saluran pencernaan.
Peran lainnya yang harus dimiliki suatu bakteri untuk dapat dijadikan
kandidat bakteri probiotik yaitu mampu menghasilkan senyawa antibakteri yaitu
peptida yang disintesis dalam ribosom sehingga menghambat perkembangan
bakteri patogen khususnya V.harveyi yang banyak terdapat pada saluran
pencernaan udang vaname dan mampu menjaga keseimbangan bakteri dalam
saluran pencernaan.
Supaya mampu hidup dan berkembang dengan baik pada saluran
pencernaan maka kandidat probiotik harus mempunyai kemampuan menempel
sehingga mampu mengkolonisasi substrat dengan baik. Apabila tidak mampu
mengkolonisasi maka bakteri probiotik akan terlepas oleh konstraksi usus
(Havenaar et al. 1992). Kandidat probiotik yang terpilih memiliki jumlah koloni
yang relatif tinggi menempel pada substrat.
Penambahan probiotik pada pakan komersial terhadap udang uji juga
memberikan pengaruh yang nyata pada populasi bakteri di saluran pencernaan
udang uji. Ini dibuktikan dengan populasi bakteri yang lebih tinggi pada saluran
pencernaan udang uji pada perlakuan M2, Z3, K9 dan S3 dibandingkan kontrol.
Hal ini memacu peningkatan aktivitas enzim endogenous yang diproduksi oleh
bakteri dalam saluran pencernaan (Ziaei-Nejad et al. 2006). Peningkatan populasi
bakteri sejalan dengan aktivitas enzim protease, lipase dan amilase pada saluran
pencernaan udang vaname. Dari hasil aktivitas enzim terlihat bahwa enzim
protease yang membantu penyederhanaan protein menjadi asam amino memiliki
preferensi yang lebih besar digunakan sebagai energi oleh udang dibandingkan
dengan enzim lipase atau enzim amilase sehingga mampu meningkatkan
pertumbuhan.
Penambahan probiotik ke dalam pakan komersial juga memberikan
udang yang diberikan pakan komersial yang ditambah probiotik penghasil enzim
protease menghasilkan pertumbuhan tertinggi dibandingkan perlakuan lainnya
dan hal ini didukung dengan retensi protein yang tinggi serta kecernaan protein
yang tinggi. Kecernaan yang tinggi menyebabkan protein dan energi nutrien
pakan yang dapat diserap udang lebih tinggi sehingga energi akan lebih banyak
tersimpan untuk pertumbuhan. Kecernaan pakan meningkat dengan adanya
penambahan probiotik dalam pakan dibandingkan dengan pakan tanpa
penambahan probiotik. Hal ini sesuai dengan hasil penelitian Handayani et al.
(2000) bahwa bakteri pengurai yang ikut termakan akan membantu proses
pencernaan dalam saluran pencernaan udang karena bakteri ini mampu
memproduksi enzim protease, amilase serta lipase dan meningkatkan
keseimbangan bakteri dalam saluran pencernaan. Enzim‐enzim khusus yang dimiliki oleh bakteri ini sangat membantu dalam pemecahan molekul kompleks menjadi molekul sederhana sehingga akan mempermudah pencernaan lanjutan dan penyerapan oleh saluran pencernaan udang.
0
baik yang artinya dengan jumlah konsumsi pakan yang sama Lampiran 0 udang perlakuan K9 lebih mampu memanfaatkan protein pakan sehingga protein yang keluar dalam bentuk amoniak akan berkurang dan hal ini berdampak baik bagi lingkungan. Selain itu dengan nilai konversi pakan yang jauh lebih rendah dibandingkan kontrol maka hal ini sangat menguntungkan bagi usaha budidaya udang.
Dari hasil penelitian ini kelangsungan hidup udang uji memberikan hasil
yang tidak berbeda nyata antar perlakuan. Hal ini diakibatkan oleh kuantitas
serta kualitas pakan yang diberikan cukup untuk mempertahankan kebutuhan
Dari saluran pencernaan udang vaname diperoleh 4 isolat potensial bakteri
kandidat probiotik penghasil enzim protease (K9), lipase (Z3), amilase (M2) dan
menghasilkan enzim protease, lipase dan amilase (S3). Penambahan probiotik K9
pada pakan mampu meningkatkan kinerja pertumbuhan udang sehingga probiotik
K9 berpotensi untuk dijadikan probiotik komersial.
SARAN
Dari hasil penelitian ini maka disarankan penggunaan probiotik K9 dalam
DAFTAR PUSTAKA
Akiyama DM, Dominy WG, Lawrence AL. 1992. Penaeid shrimp nutrition. in : Marine shrimp culture: Principles and Practise (ads A. W. fast and L. J. Lester). pp.535-566. Elsevier science, New York.
Arellano CF. Olmos SJ. 2002. Thermostable 1-4 and 1-6 glucosidase enzymes from Bacillus sp isolated from a marine environment. World J microbial, Biotechnology 18, 791-795.
Aslamyah S. 2006. Penggunaan mikroflora saluran pencernaan sebagai probiotik untuk meningkatkan pertumbuhan dan kelangsungan hidup ikan
bandeng. [Disertasi]. Bogor: Program Pascasarjana, Institut Pertanian Bogor.
Bairagi A, Ghosh KS, Sen SK, Ray AK. 2002. Enzyme producing bacterial flora isolated from fish digestive tracts. Aquaculture International 10 : 109-121.
Bender GR, Marquis RE. 1987. Membrane ATP ases and acid tolerance of Actinomyces viscosus and Lactobacillus casei. Appl Environ Microbiol 53:2124-2128.
Bergmeyer HU, Grassi M. 1983. Methods of Enzymatic Analysis. Volume ke-2. Weinheim: Verlag Chemie.
Borlongan TG. 1990. Studies on the lipases of milkfish Chanos-chanos. Aquaculture 89:315-325.
Brock JA, Main KL. 1994. A Guide to the common problems and diseases of cultured Penaeus vannamei. 242 pp. World Aquaculture Society, Baton Rouge. Los Angeles, USA.
Characklis WG. 1990. Biofilm processes. Jon Willey and Sons. Inc
Clark DJ, Lawrence AL, Swakon DHD. 1993. Apparent chitin digestibility in penaeid shrimp. Aquaculture, 109(1)51-57.
Cho CY, Slingr Y, Baylay HS. 1982. Bioenergenetic of salmon fishes energetic intake, expenditure and productivity. Comp Biochemistry physiology 73B(1): 25-41.
Cousin M, Cuzon GM, Guillaume J. 1996. Digestibility of starch in Penaeus vannamei: in vivo and in vitro study on eight sample of various origin. Aquaculture, 147:(3-4)261-73.
Cotteau P, Camara MR, Sorgeloos P. 1996. The effect of different level and source of dietary phospatydilcholine on the growth, survival, stress resistance, and fatty acid composition of postlarval Penaeus vannamei. Aquaculture, 147 (3-4) 261-73.
Clarke RTJ, Bauchop T. 1977. Microbial Ecology of Gut. London. New York. San Fransisco : Academic Press.
Das KM. Tripathy SD. 1991. Studies on the digestive enzymes of grass carp, Ctenopharingodon idella Val. Aquaculture 92: 11-21.
Dewanti R, Wong ACL. 1995. Influence of culture conditions on biofilm formation by E.coli 157:H7. Food microbiology 67:456-456
Ding X et al. 2004. Effects of probiotics on growth and activities of digestive enzymes of Penaeusvannamei. J.Fish Sci. China 11, 580-584
Fuller R. 1989. Probiotics in man and animal. Microbiology 66 :365-378.
Fuller R. Turvy A. 1971. Bacteria associated with the intestinal wall of the fowl (Gallus domesticus). Journal of Applied Bacteriology 34:617-622.
Fuller R. 1992. Probiotics. The Scientific Basic. London, New York, Tokyo, Melbourne, Madras: Chapman and Hall.
Gatesoupe, FJ. 1999. The use of probiotics in aquaculture. Aquaculture 180,147-165.
Galgani ML, Benyamin Y, Ceccaldi HJ. 1984. Identification of digestive proteinase of Penaeus kerathurus (Forskal) : a comparison and moult cycle. Comp. Biochem. Physiol.118A,1267-1271.
Galgani ML, Benyamin Y, Van WA, 1985. Purification, properties and immunnoassays of trypsin from the shrimp Penaeus japonicus. Comp. Biochem. Physiol.81B,447-452.
Gullian M, Thompson F, Rodriguez J. 2004. Selection of probiotic bacteria and study of their immunostimulatory effects in Penaeus vannamei. Aquaculture 233,1-14.
34
Hadioetomo RS. 1990. Penuntun Praktikum Mikrobiologi Pangan I. Bogor. Jurusan Teknologi Pangan dan Gizi. Fakultas Teknologi Pertanian. Institut Pertanian Bogor.
Handayani R, Kokarkin C, Astuti SM. 2000. Pemanfaatan enzim bakteri remedian pada pemeliharaan larva udang windu. (Laporan Penelitian). Jepara : Balai Budidaya Air Payau.
Haryati. 2002. Respon larva ikan bandeng (Chanos chanos Forskal) terhadap pakan buatan dalam sistem pembenihan (disertasi). Bogor: Program Pascasarjana, Institut Pertanian Bogor.
Havenaar R, Brink BT, Huis JHJ. 1992. Selection of strain probiotics use. Chapman and Hall, London.
Hoshino T et al. 1997. Isolated of Pseudomonas sp. of fish intestine excretion an active protease at low temperature. Lett. Applied Microbiology 25:70-72.
Itami T et al. 1998. Enhancement of disease resistance of kuruma shrimp, Penaeus japonicus, after oral administration of peptidoglican derived from Bifidobacterium thermophilum. Aquaculture 164: 277-288.
Irianto A, Austin B. 2003. Probiotic in aquaculture (Rev). Journal of Fish Disease 25, 633-642.
Jankauskiene R. 2002. Bacterial Flora of Fishes from Aquaculture: The genus Lactobacillus. Institute of Ecology Akademijos 2, Vilnius 2600. Lithuania, e-mail:ekoi@ekoi.lt. http//www.hbu.Cas.C2-ResLim 2002-PRINT-151-154 pdf.
Lemos D, Ezquerra JM, Garcia Carreno FL. 2000. Protein digestion in penaeid shrimp: digestive proteinase, proteinase inhibitors and feed digestibility . Aquaculture 186,89-105
Lester LJ, and Pante JR. 1992. Penaeidae Temperature and Salinity Responses. In : Marine Srimp Culture : Principle and Practise (eds Fast AW and Lester LJ.) pp.515-34. Elsevier, Amsterdam, Nedherlands.
Mohanty SN, Swain SK, Tripathy SD. 1993. Growth and survival of rohu spawn fed on a liver basal diet. J. Inland Fish.Soc.India 25 (2),41-45.
Mohanty SN, Swain SK, Tripathy SD. 1996. Rearing of Ctala (Catla catla Ham) spawn on formulated diets. J. Aquac.Trop.11, 253-258
pertumbuhan ikan gurame. [Tesis]. Sekolah Pascasarjana Institut Pertanian Bogor.
Nakayama A, Yano Y, Yoshida K. 1994. New method for isolating barophiles from intestinal content of deep-sea fishes retrieved from abyssal zone. Applied and Enviromental Microbiology. 60 (11):4210-4212.
Opuszynski K, Shireman JV. 1994. Herbivorous Fishes, Culture and Use for Weed Management. Florida. London, Tokyo: Cooperation with USFWS National Fisheries Research Centre Gainesville, CRC Press Boca Raton Ann Arbor.
Robertson L, Lawrence AL, Castile F. 1993. Interaction of salinity and feed protein level on growth of Penaeus vannamei. Journal of Applied aquaculture, 2 (1)43-54.
Robertson PAW et al. 2000. Use of carnobacterium sp. as a probiotic for atlantic salmon (Salmo salar L.) and rainbow trout (Oncorhynchus mykiss, Walbaum). Aquaculture .185:235-243.
Sugita H, Miyajima C, Deguchi Y. 1991. The vitamin B12-producing ability of the intestinal microflora of freshwater fish. Aquaculture.165: 269-280.
Sugita H, Hirose Y, matsuo N, Deguchi Y. 1998. Production of the antibacterial substance by bacillus species strain NM12, an intestinal bacterium of Japanese coastal fish. Aquacultur