KAPPA-KARAGENAN SEBAGAI IMUNOSTIMULAN
UNTUK PENGENDALIAN PENYAKIT
INFECTIOUS MYONECROSIS (IMN)
PADA UDANG VANAME,
Litopenaeus
vannamei
DIAN FEBRIANI
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Dengan ini saya menyatakan bahwa tesis dengan judul Kappa-Karagenan sebagai Imunostimulan untuk Pengendalian Penyakit Infectious Myonecrosis (IMN) pada Udang Vaname (Litopenaeus vannamei) adalah karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Bogor, Juni 2012
DIAN FEBRIANI. Kappa-Carrageenan as an Immunostimulant for Infectious Myonecrosis (IMN) Disease Control on Whiteleg Shrimp Litopenaeus vannamei. Under direction of SUKENDA and SRI NURYATI
The modulation on nonspesific immune response, growth and disease resistance of Litopenaeus vannamei against IMNV was aimed on this studied. Briefly, the experiment had comprised two stages. The first stage studied dose of k-carrageenan administration at rate 5, 10, and 15 g kg-1 feed for 4 weeks rearing, while the later studied about frequency of administration of the best outcoming dose including daily, 7 days interval, and 14 days interval administration for 5 weeks rearing. Both of stages had positive and negative control, and done in complete randomized design where the performance based on dynamic of immunity and shrimp growth were measured during rearing, while survival rate, clinical signs and histophatology were observed after challenged. Shrimp were fed three times a day at feeding rate of 4-5% of body weight day-1. Challenge test was performed by mean feeding the shrimp with IMNV via oral route at rate 10% of body weight during 3 consecutive days, than observed for 14 days. The results showed that shrimp which administered with k-carrageenan at rate of 15 g kg-1 feed had best performance than other aplications. The shrimp’s hemocyte count, phagocytic activity, phenoloxidase activity, and relative growth were 12±0,72 x 106 cell ml-1; 34,67±0,58%; 0,511±0,10 and 86.15% respectively. After challenged, the survival rate was 85±7.07%. Moreover, in the next stage work, aplication in 14 days interval gave 88.57% in relative growth and 93±5,8% in survival rate, higher than other aplications. They were confirmed by visual gross sign and histopathology that appeared as well as PCR test. Then, it was concluded that, the administration of k-carrageenan at rate 15 g kg-1 and present in 14 days interval had better immunostimulatory effect to enhance nonspesific immune response and elevate disease resistance of whiteleg shrimp juveniles against IMNV.
Penyakit Infectious Myonecrosis (IMN) pada Udang Vaname Litopenaeus vannamei. Dibimbing oleh SUKENDA dan SRI NURYATI.
Penyakit IMN (Infectious Myonecrosis) yang menyerang udang vaname Litopenaeus vannamei di Indonesia telah mengakibatkan kerugian yang cukup besar. Tingkat kematian yang ditimbulkan oleh penyakit ini bisa mencapai 70%. Penggunaan vaksin dan kemoterapi diketahui tidak efektif untuk pengendalian penyakit ini. Alternatif pengendalian penyakit yang dapat digunakan adalah dengan pemberian imunostimulan. Kappa-karagenan merupakan salah satu bahan yang berasal dari rumput laut, yang dapat digunakan sebagai imunostimulan. Kappa-karagenan diketahui memiliki senyawa bioaktif polisakarida sulfat yang dapat memodulasi sistem imun dan sebagai antiviral. Penelitian ini bertujuan menguji pemberian kappa-karagenan dengan dosis dan frekuensi pemberian yang tepat dalam meningkatkan respons imun dan resistensi terhadap serangan IMNV (infectious myonecrosis virus).
Penelitian ini terdiri dari dua tahapan yang berlangsung dari Juni 2011 sampai Februari 2012, di Laboratorium Kesehatan Ikan Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor. Analisis PCR (polymerase chain reaction) dilaksanakan di Balai Uji Standarisasi Kesehatan Ikan, Kementrian Kelautan dan Perikanan, Jakarta. Udang vaname yang digunakan adalah benih SPF (specific pathogen free) yang berasal dari hatchery PT Central Pertiwibahari, Lampung yang berukuran 2,9±0,1 g ekor-1. Udang dipelihara dalam kondisi terkontrol dan diberi pakan tiga kali sehari dengan FR (feeding rate) sebesar 4-5% dari bobot biomassa hari-1. Sebagai langkah biosecurity maka air, wadah dan peralatan pemeliharaan didesinfeksi.
Kappa-karagenan yang digunakan merupakan hasil ekstraksi rumput laut Kappaphycus alvarezii dari laboratorium Bioteknologi THP, yang dicampurkan ke pakan komersial udang dengan cara di coating. Infeksi IMNV pada udang vaname diberikan secara oral dengan FR 10% selama tiga hari, menggunakan bagian otot udang yang telah terinfeksi IMNV dengan tanda-tanda gejala klinis bagian abdomen dari arah ekor berwarna merah pada ruas terakhir.
Penelitian tahap satu adalah menentukan dosis pemberian k-karagenan terbaik yang terdiri dari tiga perlakuan dan kontrol (kontrol positif dan kontrol negatif). Udang yang digunakan berukuran 4.9±0.32 g. Pemberian perlakuan berlangsung selama empat minggu dan dilanjutkan dengan menginfeksikan IMNV pada udang uji. Perlakuan yang diberikan berupa dosis pemberian k-karagenan sebesar K: 0, A: 5, B: 10 dan C: 15 g kg-1 pakan udang. Pengamatan yang dilakukan meliputi respons imun, pertumbuhan relatif dan resistensi udang vaname setelah diinfeksi dengan IMNV.
selanjutnya udang vaname diinfeksi dengan IMNV. Pengamatan yang dilakukan meliputi pertumbuhan relatif dan resistensi udang setelah diinfeksi dengan IMNV. Respons imun dan pertumbuhan relatif diamati setiap minggu saat pemberian perlakuan, sebelum udang vaname diinfeksi dengan IMNV. Respons imun yang diamati dalam penelitian ini, meliputi total hemosit, diferensiasi hemosit, aktifitas fagositik dan phenoloxidase. Resistensi udang vaname diamati setelah diinfeksi dengan IMNV yang meliputi kelangsungan hidup, pemeriksaan gejala klinis, histopatologi dan konfirmasi keberadaan IMNV dengan PCR. Rancangan yang digunakan yaitu rancangan acak lengkap (RAL) dengan 3 ulangan pada masing-masing perlakuan. Perbedaan setiap perlakuan pada parameter imun, kelangsungan hidup dan pertumbuhan relatif udang vaname di analisis keragamannya menggunakan ANOVA. Bila terdapat perbedaan antar perlakuan, maka dilakukan uji lanjut menggunakan uji Duncan. Data pengamatan gejala klinis, histopatologi dan konfirmasi PCR di analisis secara deskriptif.
Pemberian k-karagenan melalui pakan pada udang vaname dalam penelitian ini, dapat meningkatkan parameter imun yang tercermin dari meningkatnya jumlah total hemosit, perbedaan pengaruh pada diferensiasi hemosit, aktifitas fagositik dan phenoloxidase selama waktu pengamatan. Seluruh parameter imun yang diamati menunjukkan hasil yang berbeda secara nyata antara perlakuan dengan kontrol (P<0.05). Pemberian k-karagenan dosis 15 g kg-1 pakan (C) memperlihatkan nilai total hemosit, aktifitas fagositosis dan phenoloxidase tertinggi dengan nilai berturut-turut sebesar (12.00±0.72) x 106 sel ml-1, 34.67±0.58% dan 0.511±0.10. Udang vaname yang telah diinfeksi dengan IMNV menunjukkan hasil kelangsungan hidup yang berbeda nyata antara perlakuan dengan kontrol (P<0.05). Kelangsungan hidup tertinggi terjadi pada pemberian k-karagenan dosis 15 g kg-1 pakan (C) dan frekuensi pemberian selama 14 hari dengan interval pemberian 7 hari (C14), dengan nilai masing-masing sebesar 85±7.07% dan 90±0.0%. Demikian pula halnya dengan gejala klinis terendah, terjadi pada pemberian tersebut. Berdasarkan hasil pengamatan histopatologi, udang vaname yang diinfeksi dengan IMNV menunjukkan abnormalitas pada jaringan otot dan hepatopankreasnya. Konfirmasi keberadaan IMNV menggunakan PCR menunjukkan beberapa sampel positif terinfeksi IMNV dan pada udang yang tidak diinfeksi IMNV menunjukkan hasil PCR yang negatif. Pemberian k-karagenan memberikan dampak yang positif terhadap pertumbuhan relatif udang vaname. Pertumbuhan relatif tertinggi terjadi pada dosis 15 g kg-1 yaitu 86.15% dan pada frekuensi pemberian selama 14 hari dengan interval 7 hari sebesar 88.57%.
© Hak Cipta milik IPB, tahun 2012
Hak Cipta dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan yang wajar IPB
INFECTIOUS MYONECROSIS (IMN)
PADA UDANG VANAME,
Litopenaeus
vannamei
DIAN FEBRIANI
Tesis
Sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Program Studi Ilmu Akuakultur
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Nama : Dian Febriani
NIM : C 151090031
Disetujui
Komisi Pembimbing
Dr. Ir Sukenda, MSc Dr. Ir. Sri Nuryati, MSi
Ketua Anggota
Diketahui
Ketua Program Studi Dekan Sekolah Pascasarjana Ilmu Akuakultur
Prof. Dr. Enang Harris, M.S. Dr. Ir. Dahrul Syah, M.Sc. Agr
Puji dan syukur penulis panjatkan kehadirat Allah SWT yang telah memberikan rahmat dan karunia-Nya sehingga penulisan tesis dengan judul
“Kappa-Karagenan sebagai Imunostimulan untuk Pengendalian Penyakit Infectious Myonecrosis (IMN) pada udang vaname Litopenaeus vannamei” dapat diselesaikan. Pemilihan tema tersebut merupakan salah satu cara memperkaya khasanah literatur mengenai alternatif pengendalian penyakit IMN pada udang vaname yang telah mewabah dan menyebabkan penurunan produksi udang di Indonesia.
Ucapan terima kasih yang tak terhingga penulis sampaikan kepada : 1. Komisi Pembimbing Bapak Dr. Sukenda dan Ibu Dr. Sri Nuryati yang telah
memberikan bimbingan dan arahannya selama penelitian dan penyusunan tesis ini.
2. Ibu Dr. Mia Setiawati selaku penguji luar komisi atas saran dan masukannya untuk kesempurnaan tesis ini.
3. Ketua Program Studi Ilmu Akuakultur IPB Bapak Prof. Dr. Enang Harris beserta jajaran staf pengajar yang telah memberikan ilmunya selama penulis menempuh pendidikan.
4. Departemen Pendidikan Nasional Direktorat Jenderal Pendidikan Tinggi (DIKTI) yang telah memberikan bantuan beasiswa pendidikan melalui BPPS. 5. Direktur Politeknik Negeri Lampung yang telah memberikan izin studi
6. Bapak Dr. Agung Setiarto beserta staf Marine Research Center PT Central Pertiwibahari yang telah membantu penulis dalam melaksanakan penelitian. 7. Balai Uji Standarisasi Kesehatan Ikan dan Balai Besar Riset Air Laut
Lampung, KKP
8. Ibu Linawati Hardjito, PhD dan Ibu Julie Ekasari, MSc atas bantuannya 9. Bapak Ranta di Laboratorium Kesehatan Ikan IPB, Bang Rahman dan
teman-teman Akuakultur 2009 atas kerjasamanya
10.Ibunda Mardiani dan Ibu Sudiah, Ayahanda Syaiful Kasim dan Bapak Achmar atas doa dan kasih sayangnya
11.Suami tercinta M. Mufidil Achjar beserta ananda tersayang (Fayyaza Aqila Syafitri Achjar, Fadhlil Isad Achjar dan Fauzia Latifa Achjar) dengan setulus hati atas segala dukungan moril dan materil, mendampingi penulis dalam cinta dan doa.
Akhir kata, semoga tesis ini bermanfaat.
Bogor, Juni 2012
DAFTAR TABEL ……….. iv
DAFTAR GAMBAR ………. v
DAFTAR LAMPIRAN………... vi
I PENDAHULUAN……… 1
1.1 Latar Belakang……… 1
1.2 Perumusan Masalah………. 4
1.3 Tujuan dan Manfaat……….... 5
1.4 Hipotesis……….. 5
II TINJAUAN PUSTAKA……….. 7
2.1 Infectious Myonecrosis Virus………... 7
2.2 Sistem Imunitas Udang………... 10
2.3 Imunostimulan………. 11
2.3.1 Rumput Laut……….. 13
2.3.2 Kappa-karagenan………... 15
III METODE PENELITIAN………. 19
3.1 Waktu dan Tempat Penelitian………... 19
3.2 Bahan dan Alat Penelitian………... 19
3.3 Rancangan Percobaan………... 20
3.4 Kappa-karagenan dan Penyiapan Pakan………... 20
3.5 Prosedur Infeksi IMNV………... 21
3.6 Prosedur Penelitian Tahap Satu………... 21
3.6.1 Menguji Pengaruh Pemberian Kappa-karagenan terhadap Parameter Imun Udang Vaname... 21 3.6.2 Menguji Pengaruh Pemberian Kappa-karagenan terhadap Resistensi Udang Vaname dari Serangan IMNV... 22
IMNV... 22
3.8 Pengukuran Parameter Pengamatan……….... 23
3.8.1 Total Hemosit (Blaxhall dan Daishley 1973) ………... 23
3.8.2 Diferensiasi Hemosit (Martin dan Graves 1995)……… 23
3.8.3 Aktifitas Fagositosis (Anderson dan Siwicki 1993)…… 24
3.8.4 Aktifitas Phenoloxidase(PO) (Liu dan Chen 2004)…... 24
3.8.5 Pemeriksaan Virus dengan Metode PCR……… 25
3.8.6 Pemeriksaan Gejala Klinis……….. 25
3.8.7 Histopatologi………... 25
3.8.8 Kelangsungan Hidup………... 26
3.8.9 Pertumbuhan Relatif……… 26
IV HASIL DAN PEMBAHASAN... 27
4.1 Hasil... 27
4.1.1 Parameter Imun Udang Vaname diberi Dosis Kappa-karagenan Berbeda... 27
4.1.2 Resistensi Udang Vaname diberi Dosis Kappa-karagenan Berbeda terhadap Serangan IMNV... 32
4.1.3 Resistensi Udang Vaname pada Frekuensi Pemberian Kappa-karagenan Berbeda terhadap Serangan IMNV…... 35
4.1.4 Pertumbuhan Udang Vaname pada Dosis dan Frekuensi Pemberian Kappa-karagenan Berbeda……… 39
4.2 Pembahasan... 40
V KESIMPULAN... 51
DAFTAR PUSTAKA... 53
1 Total hemosit udang vaname diberi k-karagenan 0(K), 5(A), 10(B) dan 15(C) g kg-1pakan selama empat minggu pengamatan……… 28 2 Persentase diferensiasi hemosit udang vaname diberi k-karagenan
0(K), 5(A), 10(B) dan 15(C) g kg-1 pakan selama empat minggu
pengamatan………... 29 3 Aktifitas fagositik udang vaname diberi k-karagenan 0(K), 5(A),
10(B) dan 15(C) g kg-1pakan selama empat minggu pengamatan……. 31 4 Aktifitas Phenoloxidase udang vaname diberi k-karagenan 0(K), 5(A),
10(B) dan 15(C) g kg-1pakan selama empat minggu pengamatan……. 32 5 Kelangsungan hidup udang vaname diberi k-karagenan 0(K- dan K+),
5(A), 10(B) dan 15(C) g kg-1 pakan setelah diinfeksi IMNV pada
6-12 dpi……….. 33
6 Pengamatan perkembangan gejala klinis luar (visual), kelangsungan hidup (SR), histopatologi jaringan otot dan hepatopankreas serta PCR udang vaname diberi dosis k-karagenan berbeda setelah diinfeksi IMNV... 34 7 Kelangsungan hidup udang vaname tidak diberi k-karagenan
(K- dan K+), diberi k-karagenan setiap hari (C1), tujuh hari (C7) dan 14 hari (C14) setelah diinfeksi IMNV ……….... 36 8 Pengamatan perkembangan gejala klinis luar (visual), histopatologi
jaringan otot dan hepatopankreas serta PCR udang vaname dengan frekuensi pemberian k-karagenan berbeda setelah diinfeksi IMNV... 37 9 Pertumbuhan udang vaname selama perlakuan dosis sebelum diinfeksi
dengan IMNV... 39 10 Pertumbuhan udang vaname selama perlakuan frekuensi sebelum diinfeksi
1 Gejala klinis (visual) IMN pada udang vaname
(Poulos et al.2006)……... 9
2 Histologi jaringan otot dan organ limfoid udang vaname terinfeksi IMNV... 9
3 Mekanisme system pertahanan krustasea (Smith et al. 2003)... 12
4 Struktur kimia fucoidan pada alga coklat (Wijesekara et al. 2011)... 14
5 Struktur kimia karagenan pada alga merah (Wijesekara et al.2011) ... 14
6 Struktur kimia ulfan pada alga hijau (Wijesekara et al. 2011)... 14
7 Total hemosit udang vaname diberi k-karagenan 0(K), 5(A), 10(B) dan 15(C) g kg-1 pakan selama empat minggu pengamatan... 28
8 Persentase diferensiasi hemosit udang vaname diberi k-karagenan 0(K), 5(A), 10(B) dan 15(C) g kg-1 pakan selama empat minggu pengamatan... 29
9 Aktifitas fagositik udang vaname diberi k-karagenan 0(K), 5(A), 10(B) dan 15(C) g kg-1 pakan selama empat minggu pengamatan... 31
10 Aktifitas phenoloxidase udang vaname diberi k-karagenan 0(K), 5(A), 10(B) dan 15(C) g kg-1 pakan selama empat minggu pengamatan... 32
11 Kelangsungan hidup udang vaname diberi k-karagenan 0(K), 5(A), 10(B) dan 15(C) g kg-1 pakan selama empat minggu pengamatan... 33
12 Kelangsungan hidup udang vaname tidak diberi k-karagenan (K- dan K+), diberi k-karagenan setiap hari (C1), tujuh hari (C7) dan 14 hari (C14) setelah diinfeksi dengan IMNV... 36
13 Gejala klinis udang vaname terinfeksi IMNV dengan bobot skoring menengah/++ (A), berat/+++ (B) dan tidak terinfeksi (C)... 38
1 Analisis ragam serta uji lanjut Duncan total hemosit udang vaname diberi k-karagenan dosis 0(K), 5(A), 10(B) dan 15(C) g kg-1 pakan selama empat minggu pengamatan... 59 2 Analisis ragam serta uji lanjut Duncan persentase sel hialin udang
vaname diberi k-karagenan dosis 0(K), 5(A), 10(B) dan 15(C) g kg-1
pakan selama empat minggu pengamatan... 62 3 Analisis ragam serta uji lanjut Duncan persentase granular udang
vaname diberi k-karagenan dosis 0(K), 5(A), 10(B) dan 15(C) g kg-1
pakan selama empat minggu pengamatan... 65 4 Analisis ragam serta uji lanjut Duncan persentase sel semi-granular
udang vaname diberi k-karagenan dosis 0(K), 5(A), 10(B) dan 15(C)
g kg-1 pakan selama empat minggu pengamatan... 68 5 Analisis ragam serta uji lanjut Duncan aktifitas fagositik udang
vaname diberi k-karagenan dosis 0(K), 5(A), 10(B) dan 15(C) g kg-1
pakan selama empat minggu pengamatan... 71 6 Analisis ragam serta uji lanjut Duncan aktifitas phenoloxidase udang
vaname diberi k-karagenan dosis 0(K), 5(A), 10(B) dan 15(C) g kg-1
pakan selama empat minggu pengamatan... 74 7 Analisis ragam serta uji lanjut Duncan kelangsungan hidup udang
vaname diberi k-karagenan dosis 0(K), 5(A), 10(B) dan 15(C) g kg-1
pakan setelah diinfeksi IMNV pada 6-12 dpi... 77 8 Analisis ragam serta uji lanjut Duncan kelangsungan hidup udang
vaname tidak diberi k-karagenan (K- dan K+), diberi k-karagenan setiap hari (C1), tujuh hari (C7) dan 14 hari (C14) setelah diinfeksi
IMNV pada 8-14 dpi... 81 9 Analisis ragam serta uji lanjut Duncan pertumbuhan bobot udang
vaname diberi k-karagenan dosis 0(K), 5(A), 10(B) dan 15(C) g kg-1
pakan selama empat minggu pengamatan... 85 10 Analisis ragam serta uji lanjut Duncan pertumbuhan bobot udang
*Tanda titik dibaca sebagai desimal
I. PENDAHULUAN
1.1 Latar Belakang
Udang merupakan komoditas penting yang harus dikembangkan, karena permintaan konsumsi dalam maupun luar negeri cukup tinggi. Pemerintah telah mencanangkan budidaya udang sebagai salah satu komoditas unggulan revitalisasi perikanan sejak tahun 2005. Berdasarkan data yang dikeluarkan oleh Direktorat Jendral Perikanan Budidaya tahun 2009, produksi udang vaname (Litopenaeus vannamei) adalah sebesar 3.63%*. Kementerian Kelautan dan Perikanan sendiri telah menargetkan pada periode tahun 2009–2014, produksi udang dapat meningkat sebesar 74.75%, yaitu dari 400 ribu ton menjadi 699 ribu ton, yang terdiri atas udang vaname (L.vannamei) dan udang windu (Pennaeus monodon) (KKP 2010). Keberhasilan produksi tersebut sangat didukung oleh keberhasilan dari budidaya. Namun banyak kendala yang harus dihadapi dalam budidaya udang, salah satunya adalah adanya serangan penyakit.
Salah satu penyakit yang dapat menyebabkan kerugian besar dalam kegiatan budidaya udang adalah penyakit Infectious Myonecrosis (IMN). Penyakit IMN di Indonesia pada tahun 2009 telah mengakibatkan kerugian sebesar 300 milyar rupiah (KKP 2010). Tingkat kematian yang ditimbulkan oleh penyakit IMN pada udang vaname budidaya berkisar antara 40-70%. Nilai FCR (feeding convertion rate) pada udang yang terinfeksi IMN juga mengalami kenaikan dari FCR normal, yaitu berkisar 1.5 – 4.0 atau bahkan lebih (OIE 2009). Prevalensi IMN dapat mencapai 100% pada daerah dimana virus tersebut merupakan enzootic dalam tambak udang vaname. Dampak lain dari penyakit ini adalah lambatnya pertumbuhan udang, penyebaran penyakit yang cepat dan penampakan udang yang buruk, sehingga dapat menurunkan harga jualnya.
keberadaannya pada tahun 2006 (Taukhid and Nur’aini 2008) pada usaha budidaya udang vaname di Situbondo, Jawa Timur (Senapin et al. 2007). Udang vanamesendiri merupakan udang introduksi dari Brazil, yang masuk secara resmi ke Indonesia pada tahun 2001. Saat ini penyakit IMN telah terdeteksi keberadaannya di Jawa Timur, Bali, Nusa Tenggara (Taukhid and Nur’aini 2008) dan Lampung.
Penyakit IMN disebabkan oleh virus yang berasal dari family totiviridae (totivirus), genus Giardiavirus (Walker and Winton 2010), memiliki genom tidak bersegmen ds-RNA (double stranded-RNA), 7560 bp dan kapsid berbentuk isometrik (Tang et al. 2008). Penggunaan vaksin dan kemoterapi telah dilaporkan tidak efektif untuk penyakit ini (OIE 2009). Sejumlah tindakan pencegahan dan pengobatan masih terus dikembangkan. Salah satu alternatif pengendalian penyakit udang yang disebabkan oleh IMNV adalah menerapkan sistem biosekuriti, menggunakan benih SPF (specific pathogen free) atau SPR (Spesific pathogen resistant) dan pemberian imunostimulan atau probiotik. Penggunaan antibiotik dan vaksin pada pengendalian penyakit udang yang disebabkan oleh virus tidaklah efektif. Penggunaan antibiotik hanya direkomendasikan untuk pengobatan sejumlah penyakit yang disebabkan oleh bakteri, selain itu penggunaan antibiotik yang tidak tepat, dilaporkan mempunyai dampak negatif pada lingkungan akuatik dan residunya dapat membahayakan kesehatan manusia yang mengkonsumsinya (Reed et al. 2004). Pencegahan penyakit dengan vaksinasi merupakan metode yang efektif untuk mengendalikan penyakit pada ikan, namun tidak demikian bagi udang karena udang tidak memiliki antibodi (Jory 1997). Mekanisme pertahanan udang sangat bergantung pada kekebalan bawaan (innate immunity) yang luar biasa efektif dalam mengenali dan menangkal serangan pathogen (Rusaini and Owens 2010). Saat ini mulai dikembangkan alternatif pengendalian penyakit pada udang terutama yang diakibatkan oleh infeksi virus, dengan memanfaatkan bahan-bahan alami yang bersifat imunostimulan dan antiviral.
*Tanda titik dibaca sebagai desimal
bioaktif, yang memproduksi berbagai karakteristik metabolit sekunder dengan spektrum aktifitas yang luas, sebagai senyawa sitostatik, antiviral, antelmintik, antifungal dan aktifitas antibakteri yang telah terdeteksi terdapat dalam alga hijau, alga coklat dan alga merah (Newman et al. 2004). Dikatakan oleh Wijesekara et al. (2011), dinding sel dari alga laut kaya akan polisakarida sulfat (SPs) seperti fukoidan dalam alga coklat, karagenan dalam alga merah dan ulvan dalam alga hijau. Polisakarida sulfat ini mengeluarkan senyawa bioaktif yang menguntungkan yang bersifat sebagai anti koagulan, antiviral, anti oksidatif, anti kanker dan aktivasi modulasi imun. Alga laut adalah sumber penting polisakarida sulfat non-hewani dengan struktur kimia yang polimer-polimernya bervariasi sesuai spesies alga (Costa 2010).
Neushul (1990) menyatakan polisakarida sulfat dari alga merah memiliki spektrum antivirus yang luas, dan bertindak menghambat aksi virus tidak hanya pada permukaan sel virus herpes (virus DNA) dan HIV (virus RNA) tetapi juga bertindak sama baiknya di dalam sel maupun eksternal sel. Ekstrak ganggang merah basah, diketahui aktif terhadap retrovirus. Dikatakan pula bahwa karagenan, yang merupakan polisakarida dinding sel dari alga merah, masuk ke dalam sel yang terinfeksi HSV (herpes simplex virus) dan menghambat virus tersebut. Selain itu, karagenan juga mengganggu fusi (pembentukkan syncyticum) antar sel yang terinfeksi HIV dan menghambat reverse transcriptase retroviral enzim spesifik.
hubungannya sebagai imunostimulan, di antaranya adalah, Epinephelus fuscoguttatus yang diberi pakan mengandung sodium alginate atau k-karagenan, imunitasnya meningkat setelah dua minggu, bersamaan dengan meningkatnya resistensi melawan V. alginoliticus (Cheng et al. 2008). Penelitian lainnya yaitu pemberian berbagai jenis karagenan melalui injeksi terhadap L. vannamei yang diinfeksi dengan V. alginoliticus, dapat meningkatkan total hemosit, aktivitas phenoloxidase, respiratory burst dan aktivitas fagositik setelah 24 jam secara signifikan (Yeh and Chen 2008). Suryati (2010) dalam thesisnya menyatakan pemberian k-karagenan melalui injeksi dapat meningkatkan respons imun spesifik pada ikan lele dumbo (Clarias sp), yang terukur dari kadar hematokrit, hemoglobin, jumlah sel darah merah, jumlah sel darah putih, diferensial leukosit dan indeks fagositik.
1.2 Perumusan Masalah
Dampak serangan penyakit IMN pada udang vaname sangatlah besar. Hingga saat ini belum ditemukan pengendalian yang tepat terhadap penyakit ini. Udang merupakan hewan invertebrate yang memiliki sistem imun yang primitif dibandingkan hewan vertebrate, karena udang tidak memproduksi antibodi (pertahanan spesifik). Mekanisme pertahanan udang sangat bergantung pada kekebalan bawaan (innate immunity), yaitu sistem pertahanan non-spesifik, yang terdiri dari komponen seluler dan komponen humoral yang sangat efektif dalam menangkal serangan pathogen (Rusaini and Owens 2010).
Salah satu alternatif pengendalian penyakit viral yang dapat dikembangkan adalah penggunaan k-karagenan dari rumput laut K. alvarezii, yang merupakan salah satu spesies dari alga merah. Karagenan sendiri adalah family dari polisakarida sulfat, yang diisolasi dari alga merah dan diketahui bersifat sebagai imunostimulan dan juga bersifat antiviral (Wijesekara et al. 2011).
*Tanda titik dibaca sebagai desimal
dalam pemberian imunostimulan untuk mencapai proteksi yang optimal. Pemberian imunostimulan yang berkelanjutan diperlukan untuk lebih memberikan kemampuan imun (Cheng et al. 2004).
Pemberian k-karagenan dari K. alvarezii, melalui pakan diharapkan mampu meningkatkan respons imun udang vaname dan dengan pemberian dosis dan frekuensi yang tepat diharapkan dapat meningkatan pertumbuhan dan resistensi udang terhadap serangan IMNV. Respons imun pada udang tergambar dari meningkatnya parameter imun dan resistensi udang tergambar dari kelangsungan hidup udang yang terinfeksi. Parameter imun yang mengekspresikan respons imun pada udang, berupa total hemosit, aktifitas fagositik, aktifitas phenoloxidase, diferensiasi hemosit yang terdiri dari sel hialin, sel granular dan semi granular (Yeh and Chen 2009).
1.3Tujuan dan Manfaat
Tujuan dari penelitian ini adalah (1) menguji pengaruh pemberian k-karagenan melalui pakan dalam meningkatkan respons imun udang vaname (2) Mengevaluasi resistensi udang vanamedari serangan IMNV yang telah diberi k-karagenan dengan dosis yang berbeda, dan (3) mengevaluasi frekuensi pemberian k-karagenan yang efektif pada udang vaname terhadap serangan IMNV.
Manfaat yang diharapkan dari hasil penelitian ini adalah dapat menjadi bahan aplikasi bagi pengendalian penyakit IMN dalam budidaya udang vaname di Indonesia.
1.4Hipotesis
II. TINJAUAN PUSTAKA
2.1 Infectious Myonecrosis Virus
Infectious myonecrosis virus (IMNV) adalah virus yang menyebabkan penyakit IMN (infectious myonecrosis) pada udang penaeid. IMNV biasa menyerang udang penaeid, yaitu L. vannamei (natural infections), Pennaeus stylirostis dan Pennaeus monodon (experimental infectious) (OIE 2009). IMNV
berasal dari family totiviridae (totivirus), genus Giardiavirus (Walker and Winton 2010), memiliki genom tidak bersegmen ds-RNA (double
stranded-RNA), 7560 bp dan kapsid berbentuk isometrik (Tang et al. 2008). Partikel IMNV berbentuk ikosahedral berdiameter 40 nm (OIE 2007). Sebagian besar famili Totiviridae memiliki kekurangan dalam mentransmisikan (menyebarkan) virion melalui media ekstraseluler dalam siklus hidupnya (Lightner et al. 2004). Kebanyakan, penyebarannya melalui vertikal di dalam sel atau horizontal dengan hypal anastomiasis kecuali GLV dan IMNV. IMNV merupakan satu-satunya virus dari famili Totiviridae yang diketahui menyebabkan penyakit pada inangnya (Tang et al. 2008).
Krustasea adalah inang bagi virus IMNV terutama udang-udang penaeid. Infeksi oleh IMNV pada udang vaname (L.vannamei) menyebabkan mortalitas
yang tinggi dan menyebabkan kerugian ekonomi yang signifikan (Lightner et al. 2004). Namun infeksi IMNV pada udang P. monodon dan P. stylirostris tidak menimbulkan kematian (Tang et al. 2005). Dampak yang besar dari penyakit IMN adalah infeksi yang terjadi pada stadia juvenil 2-3 g (Coelho et al. 2009) dan juga pada udang dewasa hingga 12 g (Nunes et al. 2004).
(Walker and Winton 2010). Tingkat kematian yang ditimbulkan penyakit IMN pada udang vaname budidaya berkisar antara 40-70%. Nilai FCR pada udang yang terinfeksi IMNV mengalami kenaikan dari FCR normal, yaitu berkisar 1.5–4.0 atau bahkan lebih (OIE 2009).
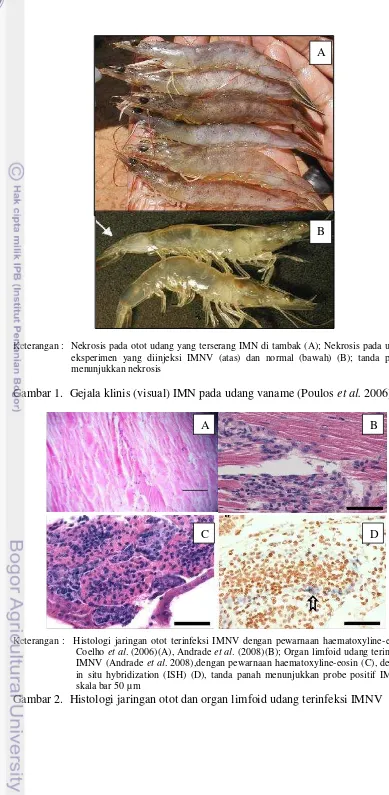
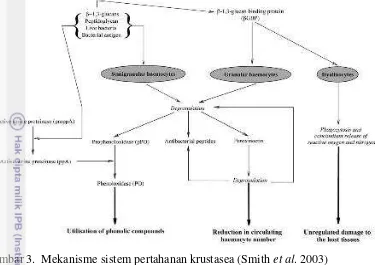
Organ target atau jaringan inang yang terinfeksi terjadi pada striated muscles (otot skeletal), jaringan konektif, hemosit dan sel parenkimal organ limfoid (OIE 2007). Gejala klinis penyakit IMN dapat dilihat secara visual seperti pada Gambar 1, yaitu terlihat berwarna putih pada bagian ototnya mengakibatkan otot kehilangan transparansi. Warna putih pada otot merupakan nekrosis pada otot skeletal akibat infeksi IMNV (Poulos et al. 2006). Gejala klinis lain dapat dilihat melalui histologi jaringan otot atau organ limfoid dengan pewarnaan haematoxylin-eosin (Gambar 2). Pada histologi jaringan otot ditemukan badan inklusi basophilic tunggal maupun berganda pada sitoplasma di dekat nukleus (Tang et al. 2005), dapat pula ditemukan berupa gumpalan nekrosis yang multifocal pada jaringan otot tersebut. Sedangkan pada histologi organ limfoid ditemukan hipertropi sel limfoid yang berupa akumulasi lymphoid organ speroids (LOS)( (Andrade et al. 2008). Beberapa udang vaname yang mampu bertahan hidup dalam populasi yang telah terinfeksi dapat menjadi pembawa IMNV sepanjang hidupnya, dan meskipun tidak terdokumentasi secara ilmiah, dapat dipercaya virus ditularkan pada keturunannya dengan transmisi secara vertikal (OIE 2009).
Keterangan : Nekrosis pada otot udang yang terserang IMN di tambak (A); Nekrosis pada udang eksperimen yang diinjeksi IMNV (atas) dan normal (bawah) (B); tanda panah menunjukkan nekrosis
Gambar 1. Gejala klinis (visual) IMN pada udang vaname (Poulos et al. 2006)
Keterangan : Histologi jaringan otot terinfeksi IMNV dengan pewarnaan haematoxyline-eosin, Coelho et al. (2006)(A), Andrade et al. (2008)(B); Organ limfoid udang terinfeksi IMNV (Andrade et al. 2008),dengan pewarnaan haematoxyline-eosin (C), dengan in situ hybridization (ISH) (D), tanda panah menunjukkan probe positif IMNV; skala bar 50 µ m
Gambar 2. Histologi jaringan otot dan organ limfoid udang terinfeksi IMNV A
B
A B
Pengaruh suhu dan salinitas merupakan faktor yang perlu dipertimbangkan pada terjadinya infeksi penyakit ini, Diperlukan pengontrolan yang ketat walaupun sampai saat ini belum terdapat data eksperimen yang menunjang. Penggunaan vaksin dan kemoterapi telah dilaporkan tidak efektif untuk penyakit ini (OIE 2009). Sejumlah tindakan pencegahan dan pengobatan masih terus dilaporkan dan selalu mengalami perkembangan.
2.2 Sistem Imunitas Udang
Sistem imun adalah gabungan sel, molekul dan jaringan yang berperan dalam resistensi terhadap infeksi. Sistem imun diperlukan tubuh untuk mempertahankan keutuhannya terhadap bahaya yang dapat ditimbulkan berbagai bahan dalam lingkungan hidup. Resistensi dapat dilihat dari kelangsungan hidup maupun respons imun yang diberikan berupa reaksi yang dikoordinasi sel-sel, molekul-molekul terhadap mikroba dan bahan lainnya (Baratawidjaja 2006).
Sistem imun pada udang masih primitif (tidak memiliki sel memori), berbeda dengan vertebrata yang mempunyai antibodi spesifik atau komplemen. Invertebrata seperti udang tidak mempunyai immunoglobulin yang berperan dalam mekanisme kekebalan tubuh. Respons imun ini dasar utamanya pada aktivitas sel darah atau hemosit, dimana faktor imunoreaktif disimpan dalam keadaan inaktif dan dihasilkan ketika terjadi stimulasi oleh serangan asing (Soderhall and Cerenius 1992).
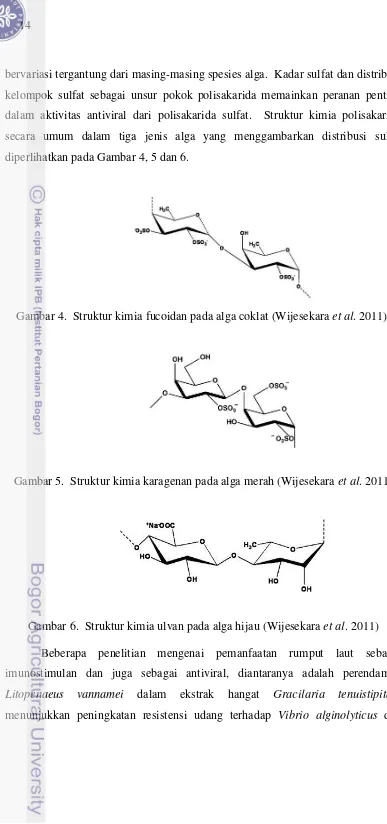
Hemosit memainkan peran pokok dalam sistem imun. Mereka merubah partikel asing dalam haemocoel dengan fagositosis, enkapsulasi dan pengumpulan nodular. Hemosit juga memegang bagian dalam penanganan gumpalan luka seluler dan pengenalan proses koagulasi melalui pembentukkan faktor yang dibutuhkan bagi pembekuan plasma, pembawa dan pembentuk dalam sistem proPO (prophenoloxidase). Mereka juga terlibat dalam sintesis dan
pembongkaran pada molekul penting hemolim, seperti α2-macroglobulin (α2M), aglutinin dan peptide antibacterial (Rodriguez and Moullac 2000).
potensial. Hemogram terdiri dari total haemocyte count (THC) dan differential haemocyte count (DHC). Terdapat 3 jenis sel hemosit pada udang penaeid, yaitu sel hialin (haemocyte agranular), large granular haemocyte dan small granular haemocyte (Rodriguez and Moullac 2000). Sel hialin berukuran 6-13 µm, memiliki perbandingan inti lebih besar dari sitoplasma dan memiliki sedikit granul sub-mikron. Semi-granular memiliki ukuran 10-20 µm, merupakan sel dengan perbandingan inti lebih sedikit dari sitoplasma dan memiliki granul sub-mikron dan mikron serta adanya granul refractile. Semi-granular memiliki kemampuan mengenali dan merespons partikel unsur atau molekul asing atau dikenal sebagai sel aktif dalam enkapsulasi. Sel granular berukuran 12-25 µm, merupakan sel dengan perbandingan inti lebih rendah dari sitoplasma berisi butiran halus dan bertanggung jawab dalam mengaktifkan sistem proPO (Ramu dan Zakaria 2000). Sel semi-granular dan granular melakukan fungsi sistem proPO sedangkan sel hialin melakukan fagositosis dalam sistem imunitas krustasea (Wang dan Chen 2006).
Gambar 3. Mekanisme sistem pertahanan krustasea (Smith et al. 2003)
2.3 Imunostimulan
sel bakteri dan bahan asal jamur sedangkan sintetik contohnya levamisol. Imunosupresi adalah suatu tindakan untuk menekan repons imun. Kegunaannya terutama pada kasus transplantasi untuk mencegah reaksi penolakan dan pada berbagai penyakit inflamasi yang menimbulkan kerusakan atau gejala sistemik, seperti autoimun atau auto-inflamasi (HTA 2004).
2.3.1 Rumput Laut
Salah satu kekayaan alam laut yang mulai banyak dikembangkan sebagai
makanan kesehatan, obat-obatan dan imunostimulan adalah alga/rumput laut (Bansemir et al. 2006). Rumput laut atau seaweeds digolongkan ke dalam divisi
Thallophyta dengan empat kelas besar, yaitu Chlorophyceae (alga hijau), Phaeophyceae (alga coklat), Rhodophyceae (alga merah) dan Cyanophyceae (alga hijau biru). Rumput laut sudah lama dikenal di Indonesia sebagai makanan dan obat tradisional. Beberapa rumput laut yang telah dibudidayakan di Indonesia adalah Gracilaria verrucosa, G. gigas, G. lichenoides, G. confervoides, Eucheuma denticulatum dan Kapaphycus alvarezii (Anggadiredja et al. 1996).
Metabolit primer dari rumput laut, umumnya merupakan senyawa polisakarida dan bersifat hidrokoloid seperti karagenan, agar, alginat digunakan sebagai senyawa additive dalam industri farmasi. Metabolit primer asam-asam amino sebagai sumber gizi, serta metabolit sekunder yang merupakan senyawa bioactive substances dikembangkan dan dimanfaatkan sebagai obat (Angadiredja et al. 1996).
bervariasi tergantung dari masing-masing spesies alga. Kadar sulfat dan distribusi kelompok sulfat sebagai unsur pokok polisakarida memainkan peranan penting dalam aktivitas antiviral dari polisakarida sulfat. Struktur kimia polisakarida secara umum dalam tiga jenis alga yang menggambarkan distribusi sulfat diperlihatkan pada Gambar 4, 5 dan 6.
Gambar 4. Struktur kimia fucoidan pada alga coklat (Wijesekara et al. 2011).
Gambar 5. Struktur kimia karagenan pada alga merah (Wijesekara et al. 2011)
meningkatkan parameter imunitas udang, hal tersebut mengindikasikan adanya
pengaruh proteksi pada udang yang terinfeksi V. alginolyticus (Yeh and Chen 2009). Polisakarida dari beberapa spesies rumput laut dapat
menstimulasi aktifitas respiratory burst dari fagosit turbot, yaitu proses yang berperan penting dalam membunuh mikroba (Castro et al. 2006). Pemberian secara oral ekstrak fucoidan dari Sargassum polycystum dapat mengurangi dampak infeksi WSSV pada P. monodon (Chotigeat et al. 2004). Polisakarida dari alga hijau Acrosiphonia orientalis yang diberikan secara oral selama 14 hari dapat mempertinggi jumlah total hemosit, diferensial hemosit, aktivitas phenoloxidase dan kelangsungan hidup P. monodon yang diinfeksi WSSV (Manilal et al. 2009).
2.3.2 Kappa-karagenan
Karagenan menurut Kamus Istilah Pangan dan Nutrisi (FTP UGM 2002) adalah bahan tambahan makanan yang digunakan untuk memperbaiki tekstur, diekstraksi dari ganggang merah Rhodophyceae, disusun dari unit-unit galaktosa sulfat yang bersifat polianion. Karagenan dibedakan berdasarkan posisi dan jumlah gugus sulfat yang diikat oleh unit digalaktan. Polimer karagenan memiliki berat molekul antara 105-106 Da. Karagenan akan bereaksi dengan protein dalam suatu medium asam atau dengan adanya Ca.
penghambat pembentukan formasi syncytium. Anionic charges dalam kelompok sulfat diduga efektif dalam menghambat aktifitas enzim reverse transcriptase pada virus (Wijesekara et al. 2011). Karagenan dalam alga merah, juga diketahui mampu memicu lekosit tikus untuk memproduksi TNF-α sebagai respon terhadap lipopolisakarida bakteri (Ogata et al. 1999). Walaupun demikian beberapa tipe dari karagenan terlihat merusak fungsi dari makrofag (Schmidt et al. 1993).
Evaluasi aktivitas antivirus polisakarida sulfat dari ekstrak rumput laut Undaria pinnatifida, Splachnidium rugosum, Gigartina atropurpurea dan Plocamium cartilagineum melawan HSV-1 dan HSV-2. Ekstrak ini menunjukkan potensi aktivitas antiviral ketika ditambahkan selama jam pertama infeksi viral tetapi inaktif ketika ditambahkan setelahnya. Selain itu, polisakarida sulfat dari alga merah juga mampu menghambat secara invitro dan invivo infeksi dari flavivirus seperti demam berdarah dengue dan yellow fever virus. Hasil Dalam banyak studi, aktifitas antiviral polisakarida sulfat telah diperlihatkan dengan reduksi plaq dan atau oleh assay penghambatan pertumbuhan virus. Terdapat sejumlah keuntungan lebih lainnya dari bahan antiviral ini, seperti biaya produksi yang murah, memiliki spektrum antivirus yang luas, cytotoxicity rendah, relatif aman dan dapat diterima luas, mengakibatkan polisakarida sulfat dari ekstrak alga laut, seperti karagenan berpeluang sebagai kandidat obat di masa mendatang (Wijesekara et al. 2011).
Komponen utama karagenan adalah 1,3-ikatan α-D-Galaktosa dan 1,4-ikatan 3,6-anhydro β-D-Galaktosa dengan empat sulfat dalam sub unit glukosa pada k-karagenan, 4 sulfat dalam sub unit glukosa dan 2 sulfat dalam sub
III. METODE PENELITIAN
3.1 Waktu dan Tempat Penelitian
Penelitian ini berlangsung pada bulan Juni 2011 sampai dengan bulan Februari 2012. Pemeliharaan dan pemberian perlakuan serta analisa parameter imun dan histopatologi udang vaname dilakukan di Laboratorium Kesehatan Ikan, Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan, IPB. Analisis PCR (Polimerase chain reaction) dilakukan pada awal dan akhir perlakuan di Balai Uji Standarisasi Kesehatan Ikan, KKP Jakarta.
3.2 Bahan dan Alat Penelitian
Udang uji yang digunakan adalah udang vaname (Litopenaeus vannamei) SPF (specific pathogen free), berukuran 2.9±0.1 g, didatangkan dari hatchery PT Central Pertiwibahari di Suak, Lampung. Udang vaname ditampung terlebih dahulu dalam bak fiber yang dilengkapi aerasi dan menggunakan sistem resirkulasi selama dua minggu pada suhu ruangan. Selama aklimatisi udang diberi pakan komersial tiga kali sehari dengan FR 4-5% dari bobot total udang. Kemudian, udang didistribusikan ke dalam 15 unit akuarium, masing-masing berisi air dengan volume 30.6 liter. Air media untuk pemeliharaan yang bersalinitas 25 ppt difilter dan disterilkan terlebih dahulu dengan menggunakan Ca-hypoclhoride (CaCO3) sebesar 30 ppm.
Bahan yang digunakan sebagai imunostimulan adalah tepung kappa-karagenan yang diekstrak dari rumput laut Kappaphycus alvarezii, berasal
dari Laboratorium Bioteknologi THP IPB. Virus yang digunakan untuk infeksi adalah IMNV (Infectious Myonecrosis Virus) yang diperoleh dari udang hidup yang terinfeksi IMNV, dan diberikan secara oral. Bahan desinfektan yang digunakan terdiri dari Ca-hypochloride (kaporit) dan alkohol. Bahan-bahan kimia lain yang digunakan dalam mengukur parameter imun adalah methanol, pewarna giemsa, asam sitrat, L-DOPA(Sigma D9628), trypsin (Sigma T4799), sodium
cacodylate (Sigma C0250) MgCl2, NaCl, CaCl, dan anti koagulan
Peralatan yang digunakan meliputi akuarium berukuran 60x30x35 cm sebanyak 15 buah dan bak fiber berukuran 150x100x50 cm, masing-masing dilengkapi dengan aerasi dan menggunakan sistem resirkulasi. Peralatan lainnya yang digunakan yaitu, bak fiber satu ton berdiameter 150 cm sebagai bak penampungan air laut bersih dan steril yang dilengkapi dengan peralatan aerasi. Alat-alat yang digunakan untuk pemeriksaan parameter imun udang meliputi sirynge satu ml, kaca obyek dan penutupnya, hemositometer, mikropipet, mikrotube (eppendorf 1.5), yellow tip, blue tip, sentrifus, mikroskop, alat penghitung (hand counter), autoklaf, spektrofotometer, petridish dan gelas Beaker.
3.3 Rancangan Percobaan
Penelitian yang dilakukan terdiri dari dua tahapan. Penelitian tahap satu yaitu menguji pengaruh pemberian k-karagenan melalui pakan dengan dosis yang berbeda dalam meningkatkan respons imun udang vaname dan resistensi udang vaname dari serangan IMNV. Penelitian tahap dua adalah menguji frekuensi pemberian k-karagenan yang efektif dalam mengendalikan serangan IMNV pada udang vaname.
Rancangan percobaan yang digunakan yaitu rancangan acak lengkap (RAK) dengan tiga ulangan pada masing-masing perlakuan. Parameter imun, kelangsungan hidup dan pertumbuhan udang vaname di analisis keragamannya menggunakan ANOVA. Bila terdapat perbedaan antar perlakuan, maka dianalisis lebih lanjut dengan menggunakan uji lanjut Duncan. Sedangkan data PCR, data pengamatan gejala klinis yang meliputi skoring dan histopatologi di analisis secara deskriptif.
3.4 Kappa-Karagenan dan Penyiapan Pakan
telah ditimbang tersebut dilarutkan dalam sedikit air, kemudian dicampurkan secara merata dengan pakan komersial yang telah disiapkan, dan dikering-anginkan pada suhu ruang. Setelah pakan kering, kemudian dilapisi (coating) dengan putih telur dan dikering-anginkan kembali pada suhu ruang. Pakan yang telah siap dimasukkan dalam wadah plastik dan disimpan dalam lemari pendingin hingga saat akan digunakan.
3.5 Prosedur Infeksi IMNV
Infeksi IMNV pada udang vaname dilakukan secara oral. Udang yang digunakan untuk menginfeksi IMNV adalah udang yang telah terinfeksi dan memperlihatkan gejala klinis otot pada ruas terakhir berwarna merah. Terlebih dahulu udang dibersihkan dari kepala, karapas dan ekor, sehingga didapatkan bagian otot/daging udang secara utuh, lalu dihancurkan dan dihomogenkan. Setelah itu ditimbang sesuai dengan kebutuhan dan otot udang yang terinfeksi tersebut diberikan kepada udang sebagai pakan tiga kali sehari selama tiga hari berturut-turut (Coelho et al. 2009) sebesar 10% dari biomassa udang vaname uji (Fadilah 2010).
3.6 Prosedur Penelitian Tahap Satu
3.6.1 Menguji Pengaruh Pemberian Kappa-Karagenan terhadap Parameter Imun Udang Vaname
3.6.2 Menguji Pengaruh Pemberian Kappa-Karagenan terhadap Resistensi Udang Vaname dari Serangan IMNV
Resistensi udang vaname diamati setelah udang vaname yang diberi perlakuan selama empat minggu, diinfeksi dengan IMNV. Udang vaname yang telah diberi perlakuan pakan yang ditambahkan k-karagenan dengan dosis berbeda selama empat minggu, selanjutnya diinfeksi dengan IMNV secara oral. Pada tahap ini terdiri dari tiga perlakuan dan kontrol (kontrol positif dan kontrol negatif), dengan masing-masing tiga ulangan. Udang vaname yang diinfeksi telah mencapai ukuran 10.77±1.32 g. Penginfeksian IMNV berdasarkan prosedur infeksi IMNV (subbab 3.5). Setelah diinfeksi IMNV, udang vaname diberi pakan udang komersial dan diamati selama dua minggu. Pengamatan yang dilakukan meliputi kelangsungan hidup, gejala klinis dan histopatologi serta konfirmasi keberadaan IMNV pada udang vaname dengan PCR (polymerase chain reaction).
3.7 Prosedur Penelitian Tahap Dua
3.7.1 Mengevaluasi Frekuensi Pemberian Kappa-Karagenan terhadap Resistensi Udang Vaname dari Serangan IMNV
Penelitian tahap dua adalah menentukan frekuensi pemberian k-karagenan dengan menggunakan dosis terbaik (C: 15 g kg-1 pakan) yang didapatkan pada penelitian tahap satu. Penelitian tahap dua ini terdiri dari perlakuan :
Kontrol (+) dan (-) : Pemberian pakan tanpa k-karagenan
Perlakuan C1 : Pemberian k-karagenan setiap hari selama lima minggu Perlakuan C7 : Pemberian k-karagenan selama tujuh hari secara berulang
dengan interval pemberian tujuh hari (minggu ke-1,3,5) Perlakuan C14 : Pemberian k-karagenan selama 14 hari secara berulang
dengan interval pemberian tujuh hari, pada minggu ke-1 dan 4
12.2±1.01 g. Pemeliharaan setelah infeksi menggunakan pakan komersial berlangsung selama selama dua minggu. Pengamatan resistensi meliputi kelangsungan hidup, gejala klinis, histopatologi, serta konfirmasi keberadaan IMNV dengan PCR.
3.8 Pengukuran Parameter Pengamatan
Parameter pengamatan dalam penelitian ini meliputi parameter imun, pemeriksaan gejala klinis, histopatologi dan kelangsungan hidup serta konfirmasi keberadaan IMNV dengan PCR pada udang vaname. Sebagai data penunjang dilakukan pula pengukuran pertumbuhan. Parameter imun yang diukur adalah total hemosit, diferensiasi hemosit, aktifitas fagositosis, dan phenoloksidase. 3.8.1 Total Hemosit (Blaxhall dan Daishley 1973)
Hemolim diambil sebanyak 0.1 ml dibagian pangkal kaki jalan ke-5 dengan syringe 1 ml yang sudah berisi antikoagulan Na-sitrat sebanyak 0.3 ml, kemudian dihomogenkan selama lima menit. Tetesan pertama hemolim pada syringe dibuang, selanjutnya hemolim diteteskan ke haemositometer dan dihitung jumlah selnya per ml dibawah mikroskop cahaya dengan pembesaran 40 kali. Total hemosit dihitung dengan menggunakan rumus :
Total Hemosit Keterangan:
FP = Faktor Pengenceran
3.8.2 Diferensiasi Hemosit (Martin dan Graves 1995)
Hemolim yang telah diambil dari udang uji diteteskan pada gelas objek dan dibuat ulasan, kemudian dikeringkan di udara dan difiksasi dengan metanol 100% selama lima menit. Setelah itu dikeringkan udara kembali dan diwarnai dengan larutan giemsa 10% selama 10 menit, dicuci dalam air mengalir selama 30 detik dan dibiarkan kering. Preparat diamati menggunakan mikroskop cahaya dengan pembesaran 100 kali dan dibedakan menurut jenisnya yaitu sel hialin, semi granular dan granular. Persentase jenis hemosit dihitung dengan menggunakan rumus :
3.8.3 Aktifitas Fagositik (Anderson dan Siwicki 1993)
Hemolim 0.1 ml dimasukkan kedalam mikroplate dan dicampur secara
merata dengan 25 μl bakteri Staphylococcus aureus dan diinkubasi selama 20
menit. Hemolim sebanyak 5 μl diteteskan pada objek glas dan dibuat preparat ulas lalu dikeringkan. Fiksasi dengan metanol 100% selama lima menit dan diwarnai dengan giemsa selama 15 menit. Aktivitas fagositik diukur berdasarkan persentase sel-sel fagosit yang melakukan fagositosis. Aktifitas fagositik dihitung dengan menggunakan rumus :
3.8.4 Aktifitas Phenoloxidase (PO) (Liu and Chen 2004)
Aktifitas phenoloxidase diukur menggunakan spektrofotometer. Pengamatan dilakukan dengan melihat perekaman pembentukan dopachrome yang dihasilkan dari L-dihydroxyphenylalanine (L-DOPA). Hemolim disentrifuse
pada 1000 rpm pada suhu 4oC selama 20 menit. Cairan supernatan dibuang dan pellet dibilas dengan cacodylate-citrate buffer hingga 1 ml (sodium cacodylate 0.01 M, sodium chloride 0.45 M, trisodium citrate 0.10 M, pH 7.0) kemudian disentrifus ulang. Pellet selanjutnya dicampur dengan cacodylate buffer hingga 200 µl (sodium cacodylate 0.01 M, sodium chloride 0.45 M, calcium chloride 0.01 M dan magnesium chloride 0.26 M, pH 7.0). Larutan kemudian dibagi dua, Larutan pertama sebanyak 100 µl diinkubasi selama 10 menit pada suhu 25oC dengan 50 µl trypsin (1 mg ml-1), sebagai elicitor kemudian ditambahkan 50 µl
3.8.5 Pemeriksaan Virus dengan Metode PCR
Pemeriksaan virus dengan metode PCR dilakukan guna mengkonfirmasi keberadaan virus pada udang vaname uji yang akan digunakan dalam perlakuan dan pada saat setelah diinfeksi. Pemeriksaan virus dengan metode PCR menggunakan metode standar dari OIE (2009).
3.8.6 Pemeriksaan Gejala Klinis
Pemeriksaan gejala klinis dilakukan setelah infeksi dengan IMNV. Pengamatan gejala klinis dilakukan melalui skoring berdasarkan jenis perubahan gejala yang terjadi (Angka 2005). Parameter gejala klinis yang digunakan
berdasarkan modifikasi dari penentuan kelompok gejala klinis dalam Costa (2009), yaitu terinfeksi tanpa symptom termasuk kategori tingkat infeksi
ringan dengan skor (+), gejala dengan sedikit warna putih lebam di dalam jaringan pada bagian beberapa segmen abdomen termasuk kategori menengah dengan skor (++), gejala dengan sebagian besar jaringan abdomen berwarna putih lebam termasuk kategori berat dengan skor (+++) dan gejala dengan bagian abdomen dari arah ekor berwarna merah (jaringan mati) termasuk kategori berat dengan skor (++++).
3.8.7. Histopatologi
3.8.8 Kelangsungan Hidup
Tingkat kelangsungan hidup udang dihitung dengan menggunakan rumus:
Keterangan:
SR = Tingkat Kelangsungan Hidup
Nt = Jumlah udang yang hidup pada akhir pengamatan (ekor) No = Jumlah udang pada awal pengamatan
3.8.9 Pertumbuhan Relatif
Penghitungan pertumbuhan relatif udang dilakukan sebagai data penunjang, untuk mengetahui pertumbuhan yang terjadi selama perlakuan.
Pertumbuhan relatif udang vannamei dihitung berdasarkan rumus (Affandi and Tang 2002) :
Keterangan
Wr = pertumbuhan relatif udang (%) Wt= Bobot rata-rata akhir udang (g) Wo= Bobot rata-rata awal udang (g)
Wt – Wo
Wr = x 100
IV. HASIL DAN PEMBAHASAN
4.1 Hasil
4.1.1 Parameter Imun Udang Vaname diberi Dosis Kappa-Karagenan Berbeda
Parameter imun udang vaname yang diamati untuk mengetahui pengaruh pemberian k-karagenan yang berbeda, meliputi total haemocyte count (THC) dan differential haemocyte count (DHC) yaitu jumlah total hemosit persatuan volume (Lampiran 1) dan perbandingan jenis sel hemosit yang terkandung di dalamnya, yaitu sel hialin, sel granular dan sel semi-granular (Lampiran 2, 3 dan 4). Parameter imun lainnya yang diamati adalah aktifitas fagositik dan phenoloxidase (Lampiran 5 dan 6).
Total hemosit udang vaname yang diberi k-karagenan mengalami peningkatan mulai minggu ke-1 hingga minggu ke-3 pengamatan, kemudian mengalami penurunan pada minggu ke-4 pengamatan, kecuali perlakuan A dan B (Tabel 1 dan Gambar 7). Hasil analisis ragam dan uji lanjut Duncan (Lampiran 1)
menunjukkan bahwa pada minggu ke-1 dan ke-2 perlakuan, pemberian k-karagenan 5 (A) dan 10 (B) g kg-1 pakan memperlihatkan total hemosit yang
Tabel 1. Total hemosit udang vaname diberi k-karagenan 0(K), 5(A),10 (B) dan 15(C) g kg-1 pakan selama empat minggu pengamatan
Perlakuan Total Hemosit ( x106 sel ml-1)
Minggu 0 Minggu 1 Minggu 2 Minggu 3 Minggu 4
K 4.70±0.21a
5.60±0.46a 5.47±0.15a 6.97±0.45a 6.67±0.15a
A 5.05±0.24a
8.47±0.25b 9.57±0.35b 7.10±0.44a 6.50±0.20a
B 4.95±0.21a
8.93±0.71b 9.87±0.15b 9.00±0.72b 8.20±0.20b
C 4.71±0.25a
10.23±0.23c 11.33±0.40c 12.00±0.72c 10.33±0.15c
Huruf superscript yang berbeda pada kolom yang sama menunjukkan berbeda nyata antar perlakuan (P<0.05)
Gambar 7. Total hemosit udang vaname diberi k-karagenan 0(K), 5(A), 10(B) dan 15(C) g kg-1 pakan selama empat minggu pengamatan
Persentase sel hialin udang vaname yang diberi pakan dengan k-karagenan sebesar 5(A), 10(B) dan 15(C) g kg-1 pakan, serta perlakuan kontrol memperlihatkan kenaikan nilai setiap minggunya, mulai dari minggu ke-0 hingga minggu ke-4 (Tabel 2 dan Gambar 8). Selama empat minggu pengamatan persentase sel hialin berkisar antara (42.7 - 55.6)%. Berdasarkan analisis ragam dan uji lanjut Duncan (Lampiran 2), persentase sel hialin berbeda nyata (P<0.05) terjadi mulai minggu ke-2 hingga minggu ke-4 pengamatan. Pada minggu ke-3, terlihat perbedaan secara nyata pada taraf 0.05 antara masing-masing perlakuan A, B, C dan juga kontrol. Nilai persentase sel hialin tertinggi terlihat pada minggu ke-3 pemberian k-karagenan 15 g kg-1 pakan (C), yaitu sebesar 55.6±0.06%.
Tabel 2. Persentase diferensiasi hemositudang vaname diberi k-karagenan 0(K), 5(A), 10(B) dan 15(C) g kg-1 pakan selama empat minggu pengamatan Perlakuan Persentase Diferensiasi Hemosit (%)
Minggu 0 Minggu 1 Minggu 2 Minggu 3 Minggu 4 Hialin
K 44.9±0.08a 48.8±0.27a 48.9±0.03a 50.3±0.06a 51.2±0.06a A 42.7±0.23a 49.6±0.16a 51.3±0.11 ab 51.8±0.07b 51.8±0.15a B 43.4±0.11a 49.1±0.21 a 51.3±0.32 ab 53.8±0.06c 53.4±0.08ab C 45.3±0.10a 49.8±0.06a 53.6±0.25b 55.6±0.06d 54.3±0.16b
Semi-Granular
K 36.0±1.28a 32.05±3.01a 32.2±0.65a 33.0±1.05b 33.9±1.25b A 36.9±2.90a 32.7±0.65a 30.9±2.22 a 30.2±0.40a 31.1±0.41a B 35.6±1.55a 33.4±2.11 a 30.8±1.95 a 29.3±0.58a 30.8±0.25a C 35.7±1.04a 32.9±0.73a 29.8±1.57a 29.6±0.40a 31.1±1.49a Granular
K 19.1±1.80a 18.8±0.32a 19.0±0.17a 16.5±0.90a 16.1±0.32a A 20.3±1.69a 18.7±0.30a 17.7±1.32 a 16.4±0.69a 16.5±0.75a B 21.0±1.01a 18.2±0.45 a 18.2±0.77 a 16.8±0.83a 16.4±0.09a C 19.01±1.41a 18.3±0.51a 17.2±1.82a 14.8±0.63b 14.6±0.13b Huruf superscript yang berbeda pada kolom yang sama menunjukkan berbeda nyata antar perlakuan (P<0.05)
Gambar 8. Persentase diferensiasi hemosit udang vaname diberi k-karagenan 0(K), 5(A), 10(B) dan 15(C) g kg-1 pakan selama empat minggu pengamatan
Persentase sel granular memiliki kisaran nilai sebesar (14.6 - 21.0)% selama empat minggu pengamatan. Hasil analisis ragam sel granular dan uji lanjut
Duncan (Lampiran 3), pada minggu ke-0 hingga minggu ke-2 pengamatan menunjukkan tidak terdapat perbedaan yang nyata (P<0.05) antar perlakuan dan juga kontrol. Persentase sel granular berbeda nyata (P<0.05) terjadi mulai minggu ke-3 hingga minggu ke-4 perlakuan yaitu antara pemberian k-karagenan 15 g kg-1 pakan (C) dibandingkan dengan pemberian k-karagenan 5(A) dan 10(B) g kg-1 pakan dan juga kontrol seperti di perlihatkan pada Tabel 2 dan Gambar 8.
Persentase sel semi-granular memiliki kisaran nilai sebesar (29.3 - 36.9)% selama empat minggu pengamatan. Hasil analisis ragam dan uji lanjut Duncan (Lampiran 4) pada minggu ke-0 hingga minggu ke-2 pengamatan menunjukkan tidak terdapat perbedaan nyata (P<0.05) antar perlakuan dan juga kontrol. Persentase sel semi-granular berbeda secara nyata (P<0.05) terjadi mulai minggu ke-3 hingga minggu ke-4 perlakuan yaitu antara kontrol dibandingkan dengan pemberian k-karagenan 5(A), 10(B) dan 15(C) g kg-1 pakan, seperti di perlihatkan pada Tabel 2 dan Gambar 8.
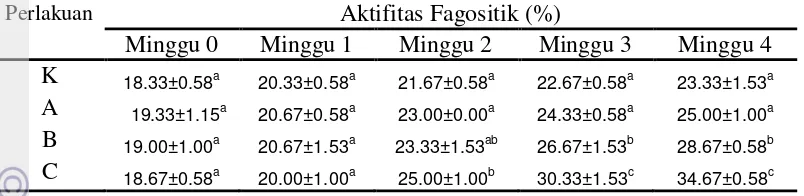
Tabel 3. Aktifitas fagositik udang vaname diberi k-karagenan 0(K), 5(A), 10(B) dan 15(C) g kg-1 pakan selama empat minggu pengamatan
Perlakuan Aktifitas Fagositik (%)
Minggu 0 Minggu 1 Minggu 2 Minggu 3 Minggu 4
K 18.33±0.58a
20.33±0.58a 21.67±0.58a 22.67±0.58a 23.33±1.53a
A 19.33±1.15a
20.67±0.58a 23.00±0.00a 24.33±0.58a 25.00±1.00a
B 19.00±1.00a
20.67±1.53a 23.33±1.53ab 26.67±1.53b 28.67±0.58b
C 18.67±0.58a
20.00±1.00a 25.00±1.00b 30.33±1.53c 34.67±0.58c
Huruf superscript yang berbeda pada kolom yang sama menunjukkan berbeda nyata antar perlakuan (P<0,05)
Gambar 9. Aktifitas fagositik udang vaname diberi k-karagenan 0(K), 5(A), 10(B) dan 15(C) g kg-1 pakan selama empat minggu pengamatan Aktifitas phenoloxidase udang vaname yang diukur dengan optical density pada panjang gelombang 490 nm, menunjukkan peningkatan nilai aktifitas phenoloxidase selama empat minggu masa pengamatan. Aktifitas phenoloxidase udang vaname yang diberi k-karagenan memiliki kisaran nilai sebesar (0.143 - 0.511), sedangkan kontrol hanya memiliki kisaran nilai sebesar (0.156 - 0.222). Berdasarkan analisis ragam dan uji lanjut Duncan (Lampiran 6), aktifitas phenoloxidase pada minggu ke-1, 3 dan 4 pengamatan menunjukkan adanya perbedaan nyata (P<0.05) antara perlakuan kontrol dan pemberian k-karagenan 5 g kg-1 pakan (A) dibandingkan dengan 10(B) dan 15(C) g kg-1 pakan. Sementara itu, aktifitas phenoloxidase pada minggu ke-2 menunjukkan hasil berbeda nyata (P<0.05) antara perlakuan kontrol dibandingkan dengan perlakuan pemberian k-karagenan lainnya (perlakuan A, B dan C). Aktifitas phenoloxidase tertinggi terdapat pada pemberian k-karagenan 15 g kg-1 pakan (C),
yang ditunjukkan mulai minggu ke-1 dan minggu ke-2 masing-masing sebesar 0.280 - 0.411 yang terus meningkat hingga puncaknya di minggu ke-3 sebesar 0.511±0.10 dan agak menurun pada minggu ke-4 pengamatan menjadi 0.418±0.05 (Tabel 4 dan Gambar 10).
Tabel 4. Aktifitas phenoloxidase udang vaname diberi k-karagenan 0(K), 5(A), 10(B) dan 15(C) g kg-1 pakan selama empat minggu pengamatan Perlakuan Aktifitas Phenoloxidase (O.D 490 nm)
Minggu 0 Minggu 1 Minggu 2 Minggu 3 Minggu 4
K 0.156±0.09a 0.176±0.05a 0.206±0.05a 0.222±0.03a 0.178±0.05a A 0.143±0.09a 0.232±0.01ab 0.347±0.05 b 0.343±0.12ab 0.330±0.11ab B 0.166±0.06a 0.262±0.03 b 0.404±0.04 b 0.451±0.07b 0.343±0.10b C 0.151±0.10a 0.280±0.04b 0.411±0.10b 0.511±0.10b 0.418±0.05b Huruf superscript yang berbeda pada kolom yang sama menunjukkan berbeda nyata antar perlakuan (P<0,05)
Gambar 10. Aktifitas phenoloxidase udang vaname diberi k-karagenan 0(K), 5(A), 10(B) dan 15(C) g kg-1 pakan selama empat minggu pengamatan
4.1.2 Resistensi Udang Vaname diberi Dosis Kappa-Karagenan Berbeda Terhadap Serangan IMNV
pada 12 dpi berbeda nyata (P<0.05) antar perlakuan dan kontrol (Tabel 5 dan Gambar 11). Kelangsungan hidup udang vaname kontrol negatif (K-) yang tidak diberi k-karagenan dan juga tidak diinfeksi IMNV bernilai 100%, tidak berbeda nyata dengan kelangsungan hidup udang vaname yang diberi pakan 15 g kg-1 pakan (C) yang bernilai 85±7.07%, namun berbeda nyata dengan ke tiga perlakuan lainnya (perlakuan A,B dan K+). Kelangsungan hidup udang vaname yang diberi 10 g kg-1 pakan (B) sebesar 45±7.07% berbeda nyata dibandingkan dengan kelangsungan hidup udang vaname yang diberi karagenan 5 g kg-1 pakan (A) dan juga perlakuan K+ (yang tidak diberi k-karagenan namun diinfeksi IMNV), yang masing-masing hanya bernilai (25 – 15)%.
Tabel 5. Kelangsungan hidup udang vaname diberi k-karagenan 0 (K- dan K+), 5(A), 10(B) dan 15(C) g kg-1 pakan setelah diinfeksi IMNV pada Huruf superscript yang berbeda pada kolom yang sama menunjukkan berbeda nyata antar perlakuan (P<0,05); dpi (days post infection)
Pengamatan perkembangan gejala klinis luar (visual) udang vaname
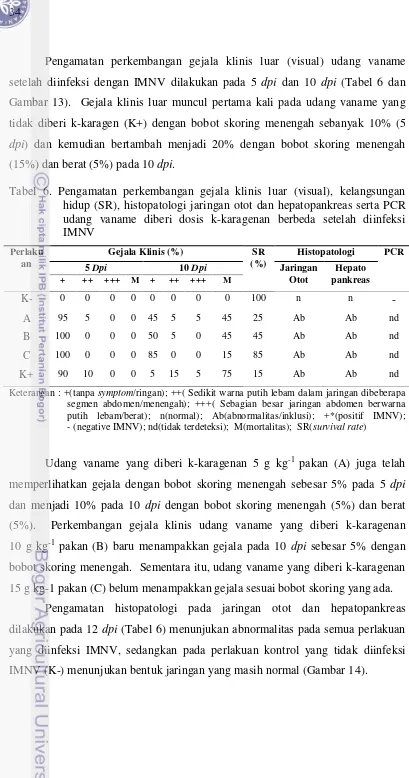
Tabel 6. Pengamatan perkembangan gejala klinis luar (visual), kelangsungan hidup (SR), histopatologi jaringan otot dan hepatopankreas serta PCR udang vaname diberi dosis k-karagenan berbeda setelah diinfeksi IMNV
Keterangan : +(tanpa symptom/ringan); ++( Sedikit warna putih lebam dalam jaringan dibeberapa segmen abdomen/menengah); +++( Sebagian besar jaringan abdomen berwarna putih lebam/berat); n(normal); Ab(abnormalitas/inklusi); +*(positif IMNV); - (negative IMNV); nd(tidak terdeteksi); M(mortalitas); SR(survival rate)
Udang vaname yang diberi k-karagenan 5 g kg-1 pakan (A) juga telah memperlihatkan gejala dengan bobot skoring menengah sebesar 5% pada 5 dpi dan menjadi 10% pada 10 dpi dengan bobot skoring menengah (5%) dan berat (5%). Perkembangan gejala klinis udang vaname yang diberi k-karagenan 10 g kg-1 pakan (B) baru menampakkan gejala pada 10 dpi sebesar 5% dengan bobot skoring menengah. Sementara itu, udang vaname yang diberi k-karagenan 15 g kg-1 pakan (C) belum menampakkan gejala sesuai bobot skoring yang ada.
4.1.3 Resistensi Udang Vaname pada Frekuensi Pemberian Kappa-Karagenan Berbeda Terhadap Serangan IMNV
Evaluasi frekuensi pemberian k-karagenan meliputi pengamatan kelangsungan hidup, perkembangan gejala klinis, histopatologi dan konfirmasi keberadaan IMNV pada udang vaname yang diberi pakan tanpa k-karagenan (K- dan K+), yang diberi k-karagenan setiap hari (C1), tujuh hari (C7) dan 14 hari (C14) setelah diinfeksi dengan IMNV.
Pengamatan kelangsungan hidup udang vaname pada 14 dpi menunjukkan hasil yang lebih baik pada udang vaname yang telah diberi k-karagenan (80 - 90)% dibandingkan dengan udang vaname yang diberi pakan
Tabel 7. Kelangsungan hidup udang vaname tidak diberi k-karagenan (K- dan K+), diberi k-karagenan setiap hari (C1), tujuh hari (C7) dan 14 hari (C14) setelah diinfeksi IMNV pada 8-14 dpi
Perlakuan Kelangsungan hidup (%) Huruf superscript yang berbeda pada kolom yang sama menunjukkan berbeda nyata antar perlakuan (P<0,05)
Gambar 12.Kelangsungan hidup udang vaname tidak diberi k-karagenan (K- dan K+), diberi k-karagenan setiap hari (C1), tujuh hari (C7), 14 hari (C14) setelah di infeksi dengan IMNV
Pengamatan perkembangan gejala klinis luar (visual) udang vaname pada tahap ini dilakukan pada 5 dpi dan 10 dpi (Tabel 8). Gejala klinis luar muncul pertama kali pada udang vaname yang tidak diberi k-karagen (K+) dengan bobot skoring menengah (7%) pada 5dpi dan kemudian bertambah dengan bobot skoring menengah (7%) dan berat (3%) pada 10 dpi. Sementara itu, ke-4 perlakuan lainnya (C1, C7, C14 dan K-) belum menampakkan gejala sesuai bobot skoring yang ada. Udang vaname yang diberi k-karagenan tujuh hari (C7) baru menampakkan gejala klinis sebanyak 3% dengan bobot skoring menengah pada 10 dpi. Udang vaname yang diberi k-karagenan setiap hari (C1) dan 14 hari (C14) belum menampakkan gejala sesuai bobot skoring yang ada. Deteksi PCR menunjukkan hasil positif IMNV pada udang vaname perlakuan K+, C7 dan C14.
Udang vaname perlakuan K-, yaitu kontrol yang tidak diinfeksi IMNV menunjukkan hasil PCR negatif IMNV.
Tabel 8. Pengamatan perkembangan gejala klinis luar (visual), kelangsungan hidup (SR), histopatologi jaringan otot dan hepatopankreas serta PCR udang vaname dengan frekuensi pemberian k-karagenan berbeda setelah diinfeksi IMNV
Keterangan : +(tanpa symptom/ringan); ++( Sedikit warna putih lebam dalam jaringan dibeberapa segmen abdomen/menengah); +++( Sebagian besar jaringan abdomen berwarna putih lebam/berat); n(normal); Ab(abnormalitas/inklusi); +*(positif IMNV); - (negative IMNV); nd(tidak terdeteksi); M(mortalitas); SR(survival rate)
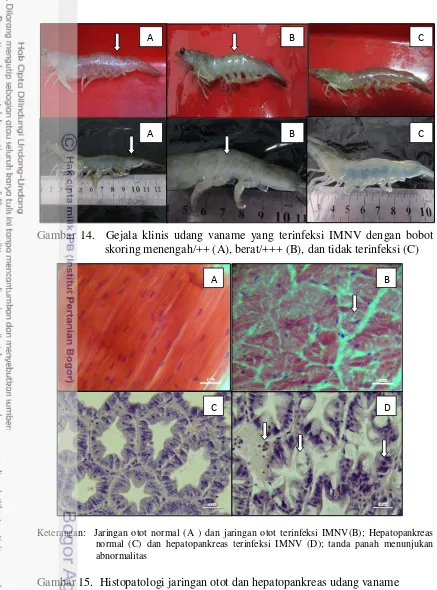
Gambar 14. Gejala klinis udang vaname yang terinfeksi IMNV dengan bobot skoring menengah/++ (A), berat/+++ (B), dan tidak terinfeksi (C)
Keterangan: Jaringan otot normal (A ) dan jaringan otot terinfeksi IMNV(B); Hepatopankreas normal (C) dan hepatopankreas terinfeksi IMNV (D); tanda panah menunjukan abnormalitas
Gambar 15. Histopatologi jaringan otot dan hepatopankreas udang vaname
A B C
A B C
A
C
D B
4.1.4 Pertumbuhan Udang Vaname pada Dosis dan Frekuensi Pemberian Kappa-Karagenan yang Berbeda
Pemberian k-karagenan dengan dosis pemberian yang berbeda dan frekuensi pemberian yang berbeda pula, memberikan pengaruh yang positif terhadap pertumbuhan udang vaname selama masa perlakuan (Tabel 9 dan 10). Tabel 9. Pertumbuhan udang vanameselama perlakuan dosis sebelum di infeksi
dengan IMNV *Huruf superscript yang berbeda pada kolom yang sama menunjukkan berbeda nyata antar perlakuan (P<0,05); W (Bobot udang); Wr (Pertumbuhan relatif)
Pemberian k-karagenan dengan dosis berbeda, menghasilkan bobot akhir yang berbeda nyata (P<0.05). Berdasarkan analisis ragam dan uji lanjut Duncan, terdapat perbedaan pengaruh perlakuan pada udang vaname yang diberi pakan tanpa k-karagenan (K) dan udang vaname yang diberi pakan 5 g kg-1 pakan (A) jika dibandingkan dengan udang vaname yang diberi k-karagenan 10(B) dan 15(C) g kg-1 pakan. Pertumbuhan relatif tertinggi terjadi pada kelompok udang vanameyang diberi k-karagenan 15 g kg-1 pakan (C), yaitu sebesar 86.15%. Tabel 10. Pertumbuhan udang vaname selama perlakuan frekuensi sebelum di *Huruf superscript yang berbeda pada kolom yang sama menunjukkan berbeda nyata antar perlakuan (P<0,05); W (Bobot udang); Wr (Pertumbuhan relatif).