PENDIDIKAN FORMAL (SD s.d S1)
Tahun 2005 – 2010 : Jurusan Kimia FMIPA, Universitas Lampung
Periode 2006-2007 : Anggota HIMAKI UNILA
Tahun 2006-2007 : Beasiswa Supersemar
Tahun 2007-2008 : Beasiswa BBM
NAMA
: Fera Yuliyantina
Tempat, Tanggal Lahir : Bandar Lampung, 10 Februari 1987
Jenis Kelamin : Perempuan
Agama : Islam
Status Penikahan : Belum menikah
ASISTEN PRAKTIKUM YANG PERNAH DIJABAT
HOBI
PELATIHAN YANG PERNAH DIIKUTI
Isolasi Dan Karakterisasi Enzim Amilase Dari Actinomycetes Isolat Lumpur Hutan Bakau
Kimia Dasar I dan 2 untuk Fakultas Pertanian
Traveling
Internet
Kunjungan Ilmiah Mahasiswa (HIMAKI UNILA, 2006)
Kunjungan Ilmiah Mahasiswa (HIMAKI UNILA, 2007
Karya Wisata Ilmiah (BEM FMIPA UNILA, 2007)
ABSTRAK
ISOLASI DAN KARAKTERISASI ENZIM AMILASE DARI ACTINOMYCETES
ISOLAT LUMPUR HUTAN BAKAU
Oleh Fera Yuliyantina
Pada penelitian ini enzim amilase diisolasi dari isolat actinomycetes yang berasal dari lumpur hutan bakau, Pantai Teluk Lampung. Isolat terpilih yang mempunyai aktivitas amilolitik terbesar yaitu isolat ANLd-2b-3. Penelitan ini bertujuan untuk mengisolasi dan mengkarakterisasi enzim amilase yang ditumbuhkan pada mineral salt medium. Enzim amilase yang dikeluarkan oleh actinomycetes diisolasi dengan sentrifugasi, kemudian ekstrak kasar enzim tersebut dimurnikan dengan pengendapan terfraksi menggunakan amonium sulfat dan dilanjutkan dengan dialisis. Aktivitas enzim amilase ditentukan dengan Metode Mendels dan kadar protein ditentukan dengan Metode Lowry. Hasil penelitian menunjukkan bahwa pertumbuhan actinomycetes menghasilkan enzim amilase dengan aktivitas tertinggi pada waktu 120 jam dan pada pH 7. Isolasi enzim amilase dari isolat
actinomycetes meningkatkan aktivitas enzim, berturut-turut dari aktivitas unit sebesar 1,4 U/mL, dengan aktivitas spesifik 5,4 U/mg pada ekstrak kasar enzim menjadi aktivitas unit sebesar 2,6 U/mL, dan aktivitas spesifik 7,4 U/mg pada fraksi amonium sulfat, dengan tingkat kemurnian yang lebih tinggi yaitu 1,37 kali lebih murni dibandingkan ekstrak kasar enzim. Hasil karakterisasi terhadap enzim amilase hasil pemurnian memberikan nilai optimum pada suhu 50 oC, pH 7 dan waktu inkubasi 30 menit. Perhitungan kinetika reaksi enzim amilase menunjukkan harga KM sebesar 3,15 mg mL-1 dan Vmaks sebesar 30,6 mol
I. PENDAHULUAN
A. Latar Belakang
Indonesia merupakan negara kepulauan yang sebagian besar terdiri dari lautan. Banyak
keanekaragaman mikroorganisme yang terkandung didalamnya, salah satu yang dimiliki
adalah ekosistem hutan bakau. Menurut Das et al., (2006) hutan bakau merupakan
ekosistem yang memiliki situasi ideal pada interfase antara daratan dengan lingkungan laut
dan kaya akan mikroorganisme yang beragam seperti bakteri, jamur, dan actinomycetes.
Hutan bakau merupakan salah satu daerah yang termasuk ke dalam lingkungan laut yang
didominasi oleh beberapa jenis pohon bakau yang mampu tumbuh berkembang pada
daerah pasang surut pantai berlumpur serta bertoleransi terhadap kadar garam.
Bakau dapat tumbuh dengan baik pada habitat atau kondisi lingkungan yang relatif sulit,
yaitu lingkungan yang memiliki abrasi air laut tinggi, kadar air yang berubah-ubah pada
saat pasang dan surut, dan lingkungan yang rawan pencemaran, dimana tanaman lain tidak
dapat tumbuh dengan baik. Oleh karena itu hutan bakau merupakan ekosistem dengan
karakteristik unik, yang memiliki keanekaragaman organisme akuatik dan
mikroorganisme-mikroorganisme. Salah satu mikrorganisme tersebut adalah actinomycetes
Actinomycetes adalah suatu kelompok mikroorganisme yang morfologinya merupakan
bentuk peralihan antara bakteri dan fungi (Alexander, 1977). actinomycetes merupakan
mikroorganisme yang paling efisien dalam menggunakan substrat. Atas dasar
kemampuannya yang jarang dijumpai pada mikroorganisme lain itulah, maka dipilih
actinomycetes pada penelitian kali ini dan karena itu pula para ahli telah mengembangkan
media isolasi yang hanya menguntungkan bagi pertumbuhan actinomycetes dibandingkan
mikroorganisme yang lain (Suwandi, 1993). Isolasi mikroorganisme dari lumpur laut telah
menghasilkan mikroorganisme yang tidak ditemukan pada lingkungan terestrial (Magarvey
et al., 2004).
Suhartono (1989) mengatakan bahwa enzim ekstraseluler yang diperoleh dari
mikroorganisme lebih menguntungkan karena mikoorganisme dapat berkembang biak
dengan cepat, tidak memerlukan lahan yang luas, biaya produksi relatif murah dan mudah
dikontrol. Salah satu cara untuk memproduksi enzim yang sering dilakukan pada saat ini
adalah dengan cara membiakkan mikroba penghasil enzim yang dikehendaki pada media
tertentu. Enzim yang dihasilkan actinomycetes dipengaruhi jenis senyawa organik yang
diuraikan sebagai sumber karbon maupun energi (Alexander, 1977).
Sebagian besar actinomycetes menghasilkan berbagai macam enzim berupa enzim
ekstraseluler, salah satunya adalah enzim amilase. Amilase merupakan enzim yang paling
penting dan keberadaannya paling besar, pada bidang bioteknologi, enzim ini
diperjualbelikan sebanyak 25% dari total enzim yang lainya. Amilase didapatkan dari
Amilase yang berasal dari mikroorganisme banyak digunakan dalam industri, hal ini
dikarenakan mikroorganisme periode pertumbuhanya pendek (Oliveira, 2008).
Menurut McTigue, et al. (1995), isolasi mikroorganisme penghasil enzim amilase makin
banyak dilakukan karena peranan enzim amilase dalam dunia industri sangat penting.
Untuk memproduksi enzim dalam jumlah yang banyak dan memiliki aktivitas yang tinggi,
maka perlu diperhatikan faktor-faktor yang penting seperti kondisi pertumbuhan
mikroorganisme, cara isolasi serta jenis substrat yang digunakan.
Pada penelitian ini dilakukan isolasi dan karakterisasi enzim amilase dari actinomycetes
isolat yang berasal dari endapan lumpur hutan bakau. Enzim amilase ekstraseluler dari
actinomycetes diisolasi dengan sentrifugasi, kemudian ekstrak kasar enzim tersebut
dimurnikan dengan metode fraksinasi menggunakan ammonium sulfat dan dilanjutkan
dengan dialisis. Selanjutnya enzim yang dihasilkan dilakukan karakterisasi meliputi
penentuan: pH optimum, suhu optimum, waktu inkubasi optimum, penentuan nilai Km dan
Vm. Aktivitas enzim ditentukan dengan metode Mendels dan kadar protein ditentukan
dengan metode Lowry.
Tujuan Penelitian ini adalah :
1. Mempelajari pH, temperatur, dan waktu inkubasi optimum kondisi pertumbuhan
actinomycetes untuk memproduksi enzim amilase.
2. Mengisolasi dan memurnikan enzim amilase dari isolat actinomycetes yang berasal dari
endapan lumpur hutan bakau.
3. Menentukan karakteristik enzim amilase hasil isolasi dan pemurnian.
C. Manfaat Penelitian
Manfaat penelitian ini diharapkan agar dapat memanfaatkan potensi lumpur hutan bakau
sebagai sumber mikroorganisme potensial penghasil enzim amilase yang belum digali
secara keseluruhan serta menambah informasi mengenai actinomycetes lumpur hutan
II. TINJAUAN PUSTAKA
A. Hutan Bakau
Hutan bakau merupakan suatu kelompok jenis tumbuhan yang hidup dengan baik di pesisir
pantai tropis sampai subtropis yang memiliki fungsi istimewa pada lingkungan yang
mengandung kadar garam dan bentuk lahan berupa pantai dengan kondisi tanah anaerob
(Irwanto, 2007). Hutan bakau tumbuh pada habitat atau kondisi lingkungan yang relatif
sulit, yaitu lingkungan yang memiliki abrasi air laut tinggi, kadar air yang berubah-ubah
pada saat pasang dan surut, dan lingkungan yang rawan pencemaran, dimana tanaman lain
tidak dapat tumbuh dengan baik (Tomlinson, 1999).
Indonesia merupakan tempat komunitas bakau terbaik dan terluas di dunia, lebih kurang
3,7 juta ha atau 21,8 % dari luas bakau di dunia yang berkisar 15.429.000 ha, dimiliki
Indonesia. Hutan bakau berfungsi menjaga daratan dari gerusan ombak serta tempat hidup
dan berkembang biaknya biota laut, termasuk mikroorganisme. Hutan bakau merupakan
ekosistem dengan karakteristik unik, yang memiliki keanekaragaman organisme akuatik
dan mikroorganisme-mikroorganisme, seperti bakteri, jamur, dan actinomycetes dan
lumpur adalah salah satu sumber daya lingkungan bakau (Magarvey et al., 2004; Suryanto
B. Mikroorganisme
Sel merupakan unit struktural dan fungsional organisme hidup. Organisme terkecil terdiri
dari sel tunggal. Ada dua kelas utama sel, yaitu sel prokariotik dan sel eukariotik (Albert et
al., 1994). Sel prokariot memiliki struktur sederhana, pertumbuhan selnya cepat dan
mudah, serta mekanisme yang relatif sederhana dalam proses reproduksi. Sel prokariot
bereproduksi dengan cara aseksual yang sangat sederhana. Organisme ini tumbuh hingga
ukurannya berlipat ganda, kemudian membelah diri menjadi sel anak yang identik
(Lehninger, 1998). Sel eukariot merupakan divisi terbesar dari organisme hidup, yaitu
seluruh organisme yang ada di bumi, termasuk hewan, tumbuhan, fungi, dan protozoa.
Termasuk pada sel eukariotik, nukleus dan sitoplasma terdapat sebagai dua kompartemen
yang terpisah oleh membran inti (Wolfe dan Stephen, 1993).
1. Faktor yang Mempengaruhi Pertumbuhan Mikroorganisme
Faktor yang sangat berpengaruh terhadap pertumbuhan mikroorganisme yaitu suhu,
konsentrasi substrat, waktu inkubasi, dan pH. Di dalam proses metabolisme terjadi suatu
rangkaian reaksi kimia, dimana kenaikan temperatur sampai pada nilai batas tertentu, dapat
mempercepat proses metabolisme. Tetapi temperatur tinggi melebihi temperatur
maksimum akan menyebabkan denaturasi protein dan enzim. Hal ini akan mengakibatkan
terhentinya metabolisme (Suriawira, 2003). Pada dasarnya mikroorganisme dapat tumbuh
jika kemampuan adaptasi mikroorganisme terhadap perubahan lingkungan sangat tinggi
oleh tempat hidup awal mikroorganisme dan tempat mikroorganisme tersebut
dikembangkan guna untuk pembelajaran.
Nilai pH dari lingkungan juga sangat mempengaruhi pertumbuhan mikroorganisme. Pada
mikroorganisme tertentu yang hidup pada pH yang tinggi maka mikroorganisme ini tidak
akan hidup pada pH yang rendah. Hal ini disebabkan adanya nilai pH yang tinggi maka
mikroorganisme ini tidak akan dapat mempengaruhi pertumbuhan mikroorganisme (Chan,
2001). Konsentrasi substrat juga sangat mempengaruhi pertumbuhan mikroorganisme. Semakin banyak kandungan substrat maka pertumbuhan akan mikroorganisme semakin
cepat dengan semakin cepatnya perkembangkan fisiologis mikroorganisme.
2. Nutrien Bagi Pertumbuhan Mikroorganisme
Mikroorganisme memerlukan nutrien dengan komposisi tertentu untuk tumbuh dan
membelah diri. Keperluan nutrien meliputi unsur makro esensial dan unsur mikro asensial.
Unsur makro esensial terlibat dalam proses metabolisme sel, sedangkan unsur mikro
esensial digunakan untuk mengaktifkan enzim, mensintesis vitamin, dan berperan dalam
sporulasi (Suhartono, 1989). Nutrien dasar bagi mikroorganisme harus mengandung sunber
energi untuk tumbuh seperti unsur karbon, unsur nitrogen dan logam. Sejumlah mineral
dan unsur hara terdapat dalam tubuh mikroba untuk menjalankan fungsi khusus yaitu : K,
Ca, Mg, Fe, Co, Cu, Zn, dan Mo. Dengan sendirinya kandungan kimiawi ini
mempengaruhi kebutuhan nutrien untuk menunjang pegadaan sel dan pertumbuhannya
Nutrien yang tergolong sebagai sumber energi diantaranya adalah senyawa hasil oksidasi
dari lemak, protein, ammonium, karbohidrat, dan gula-gula sederhana, selain itu beberapa
mikroorganisme dapat memanfaatkan metana dan methanol sebagai sumber energi.
Kebutuhan akan sumber karbon dipenuhi oleh adanya CO2 atau gula, pati dan karbohidrat
lainnya (Wang et al., 1978).
Sumber karbon, nitrogen, dan mineral utama fosfat, merupakan zat makanan utama bagi
pertumbuhan mikroorganisme. Berbagai sumber makanan baik yang bersifat organik
maupun anorganik tersedia di alam. Pemilihan sumber makanan untuk menumbuhkan
mikroorganisme yang diinginkan dalam produksi enzim tergantung pada jenis
mikroorganisme dan kebutuhannya serta ketersediannya di lingkungan industri fermentasi
dan faktor ekonomis lainnya (Suhartono, 1989).
3. Fase Pertumbuhan Mikroorganisme
Pertumbuhan mikroorganisme untuk menghasilkan produk tertentu mempunyai siklus
pertumbuhan tertentu tergantung produk yang akan dihasilkan. Fase pertumbuhan
mikroorganisme dibagi menjadi empat diantaranya fase lag (adaptasi), fase eksponensial,
fase stasioner, dan fase menurun (Dwidjoseputro, 2003).
a. Fase adaptasi, pada saat ini mikroorganisme baru beradaptasi dengan lingkungan
barunya. Pada fase ini belum terjadi pembelahan sel dan berlangsung cepat atau lambat
b. Fase eksponensial, pada saat ini mikroorganisme memulai pertumbuhan dan
pembelahan guna perbanyakan populasinya sesuai kondisi lingkungannya. Saat ini
mikroorganisme mengalami pertumbuhan yang tertinggi tetapi tidak berlangsung lama
karena pertumbuhan dibatasi oleh jumlah nutrien dan penimbunan zat racun sebagai
hasil metabolisme sekunder.
c. Fase stasioner, pada saat ini mikroorganisme memiliki jumlah yang tidak berimbang
dengan jumlah substrat sehingga bakteri akan mengalami kematian. Pertumbuhan
mikroorganisme terhenti dan terjadi akumulasi produk didalam sel atau media
fermentasi. Dengan terakumulasinya produk pada media fermentasi akan mengganggu
proses sintesis enzim. Pada fase ini sel-sel menjadi lebih tahan terhadap keadaan
ekstrim seperti panas, dingin, radiasi, dan bahan kimia.
d. Fase menurun (kematian), pada fase ini sebagian mikroorganisme mulai mengalami
kematian. Jumlah sel yang mati semakin lama akan semakin banyak, dan kecepatan
kematian dipengaruhi oleh kondisi nutrien, lingkungan, dan jenis jasad renik.
Pada setiap fase pertumbuhan mikroorganisme selalu melakukan pembelahan yang bersifat
mitosis terhadap inti sehingga dapat menghasilkan dua organisme yang morfologis identik
dan memiliki sifat fisiologis yang identik.
Actinomycetes merupakan mikroorganisme tanah yang memiliki sifat-sifat yang umum
dimiliki oleh bakteri dan jamur. Terlihat dari luar seperti jamur (eukariotik), namun
organisme ini sesuai dengan semua kriteria untuk sel prokariotik, yaitu : dinding selnya
mengandung asam muramat, tidak mempunyai mitokondrion, mengandung ribosom 70s,
tidak mempunyai pembungkus nukleus, garis tengah selnya berkisar dari 0,5 – 2,0 m, dan
dapat dimatikan atau dihambat oleh banyak antibiotik bakteri (Rao, 1994). Menurut
Alexander, 1997, actinomycetes memiliki dinding sel fungi terdiri dari selulosa dan kitin.
Hal tersebut sejalan dengan Lay dan Hastowo (1992), yang mengatakan bahwa
actinomycetes merupakan kelompok bakteri bersifat gram positif.
Walaupun actinomycetes dikatakan sebagai mikroorganisme peralihan antara bakteri dan
fungi (Alexander, 1977), tetapi actinomycetes mempunyai ciri yang khas, yang cukup
membatasinya menjadi satu kelompok yang jelas berbeda. Pada medium cair,
pertumbuhan actinomycetes ditandai dengan keruhnya medium dan terbentuk lapisan tipis
di permukaan medium. Menurut Rao (1994), pada lempeng agar, actinomycetes dapat
dibedakan dengan mudah dari bakteri, dimana koloni bakteri tumbuh dengan cepat dan
berlendir, sedangkan actinomycetes muncul perlahan dan berbubuk serta melekat erat pada
permukaan agar, berikut merupakan isolat actinomycetes yang ditumbuhakan pada agar
plate dalam media ISP-2 seperti terlihat pada Gambar 1. Rentang pH dan temperatur yang
cocok untuk pertumbuhan actinomycetes ini sekitar 6,5 – 8,0 dan 25 – 300C. Namun, ada
Gambar 1. Isolat Actinomycetes pada media ISP-2 (Guntari, 2009)
Actinomycetes umumnya terdapat di tanah, tanah kompos, di air tawar maupun air laut.
Beberapa contoh actinomycetes dari genus Streptomycetes, Micromonospora,
Nocardioform, dan Actinomaduras diketahui dapat hidup di air laut. Actinomycetes tidak
toleran terhadap tanah asam dan jumlahnya menurun pada pH 5,0 (Rao, 1994). Habitat
actinomycetes tersebar luas di alam biasanya bersifat aerob, artinya memerlukan oksigen
bebas, sehingga untuk pertumbuhannya tergantung pada persediaan oksigen. Tetapi ada
juga beberapa spesies yang dapat hidup pada keadaan kurang oksigen, dan dijumpai juga
anggota genus actinomycetes yang bersifat anaerob (Alexander, 1977).
Sumber energi bagi pertumbuhan actinomycetes dapat berupa karbohidrat, asam amino,
asam lemak, steroid, dan bahan organik lainnya, tetapi beberapa actinomycetes ada yang
menggunakan selulosa, hemiselulosa sebagai sumber
karbon. Pada umumnya bahan mineral yang dibutuhkan actinomycetes untuk pertumbuhan
adalah fosfor, kalsium, dan sulfur, sedangkan magnesium, sodium, seng dan besi berperan
Menurut jutono (1980), medium yang baik untuk menumbuhkan actinomycetes adalah
medium yang mengandung glukosa, gliserol atau tepung sebagai sumber karbon; nitrat atau
kasein sebagai sumber nitrogen dan mineral-mineral tertentu seperti NaCl, K2HPO4,
MgSO4.7H2O, CaCo3, FeSO4.7H2O. Inkubasi biasanya selama 2-7 hari.
D. Enzim
Enzim adalah biokatalis yang diperlukan oleh semua sel hidup untuk melangsungkan
berbagai reaksi kimia di dalam, di luar, dan antar sel. Enzim berfungsi sebagai biokatalis
untuk reaksi-reaksi pokok metabolisme didalam sel seperti metabolisme protein dan
metabolisme glukosa (Judoamijojo et al, 1989).
Setiap sel mengandung banyak macam enzim, yang masing-masing mempunyai
kemampuan serta spesifitas tertentu untuk mengubah suatu molekul kimia menjadi
molekul lain yang berbeda sifat, dan kimianya (Wirahadikusuma, 1987). Enzim memiliki
beberapa keistimewaan dibandingkan katalis kimia dalam reaksinya enzim memiliki
substrat spesifik tertentu yang dapat dikatalisis, enzim dapat
bekerja pada suhu ruang, pH tertentu, serta tidak menimbulkan masalah pencemaran dalam
penggunaannya (Judoamijojo et al, 1989).
Berdasarkan tempat kerjanya enzim dapat dikelompokkan dalam enzim intraselluler atau
endoenzim yang bekerja di dalam sel dan tidak disekresikan keluar sel dan bertujuan untuk
mengkatalisis reaksi kimia yang terjadi di luar sel. Enzim ekstraselluler berfungsi
sehingga dapat mudah dimanfaatkan oleh mikroba tersebut, oleh karena itu semua enzim
hidrolase (Judoamijojo et al, 1989).
Klasifikasi enzim terdiri dari dua cara yaitu, penamaan enzim secara trivial atau secara non
.sistematik misalnya pepsin, tripsin, katalase tidak menerangkan sifat dan macam reaksi
yang terjadi sedangkan penamaan dan klasifikasi enzim secara sistematik telah ditentukan
oleh suatu badan internasional bernama : Commission on Enzim of the international union
of Biochemistry (CEIUB). Dalam sistim yang baru ini enzim dibagi menjadi sub bagian.
Dalam beberapa hal tertentu, penanaman trivial masih dipakai, yaitu bila nama
sistematiknya terlalu panjang. Klasifikasi enzim CEIUB meliputi nama golongan , nomor
kode dan cara reaksi yang dikatalisernya dan tiap golongan utama terbagi menjadi
kelompok kelompok enzim berdasarkan gugus substrat yang diserangnya (Lehninger,
1988).
1. Enzim Amilase
Enzim Amilase ( E.C.3.2.1 ) adalah enzim yang dapat menghidrolisis pati. Hidrolisis
enzim oleh amilase pertama-tama menghasilkan polimer berantai pendek
yang disebut dekstrin, kemudian disakarida, maltosa, dan glukosa (Rahman, 1992).
Berdasarkan penamaan dan klasifikasi secara CEIUB, amilase merupakan enzim kelas 3,
hidrolase, dan subkelas 2.1, glukosa hidrolase, sehingga dapat ditulis enzim amilase
Beberapa sel mikroorganisme melepaskan enzim yang berperan di dalam dan di luar sel.
Fungsi utama eksoenzim adalah untuk melangsungkan perubahan nutrien di lingkungan
sehingga memungkinkan nutrien tersebut memasuki sel. Misalnya amilase mengurai pati
menjadi unit-unit gula yang lebih sederhana (Pelezar, 1986 dalam Mariana, 2003). Enzim
amilase termasuk enzim hidrolase, yaitu suatu enzim yang memerlukan air untuk memecah
pati menjadi molekul-molekul yang lebih kecil, produk akhir pemecahan berupa glukosa
seperti terlihat pada Gambar 2.
(C6H10O5)n + n(H2O) n(C6H12O6)
Pati air amilase glukosa
Gambar 2. Reaksi penguraian pati yang bereaksi dengan air menghasilkan glukosa dengan
bantuan amilase (Winarno, 1986)
Selama ini mikroorganisme penghasil enzim amilase banyak dihasilkan dari bakteri dan
jamur, tetapi ternyata actinomycetes juga dapat menghasilkan enzim hidrolase salah
satunya yaitu amilase. Selain itu actinomycetes berpotensi menghasilkan
senyawa metabolit sekunder, enzim selulase,enzim protease dan enzim kitinase (Magarvey
et al., 2004).
Pada uji aktivitas dasar hidrolisis pati pada enzim amilase, mikroorganisme ditumbuhkan
pada media yang mengandung nutrien dan pati. Mikroorganisme yang mampu membentuk
amilase dalam media yang mengandung zat pati, akan menghidrolisis pati yang ada pada
medium uji sehingga terbentuk zona bening di sekitar daerah pertumbuhan mikroorganisme
warna biru kehitaman di sekitar pertumbuhan mikroorganisme, namun bila pati
terhidrolisis, maka daerah-daerah yang tidak mengandung pati lagi akan tampak jernih
(Lay, 1994).
2. Mekanisme Katalisis Enzim
Enzim dapat mengkatalisi suatu reaksi jika enzim dapat terlebih dahulu membentuk
kompleks enzim-substrat. Secara langsung pengikatan enzim dengan substrat pada enzim
terjadi pada bagian sisi aktif enzim ini dapat digambarkan sebagi proses awal katalisis
enzim. Jika enzim telah melakukan pembentukan ikatan antara enzim dengan substrat
dengan membentuk molekul kompleks enzim substrat, pembentukan molekul ini sangat
dipengaruhi oleh bentuk dari sisi aktif enzim dan kespesifikan substrat. Ada dua jenis teori
yang mendukung dalam penjelasan pembentukkan kompleks enzim substrat, teori pertama yang diajukan oleh Fisher yaitu teori “Lock and Key”, seperti yang terlihat pada Gambar 3.
Pada teori ini kerja katalitik enzim dapat terjadi jika sisi aktif enzim memiliki kecocokan
dengan substrat.
Gambar 3. Mekanisme Reaksi enzim model Lock and Key (Collins, 2001)
Sedangkan teori kedua adalah teori yang diajukan oleh Koshland yaitu teori “Induced Fit”.
menginduksi suatu perubahan bentuk pada bentuk sisi aktif enzim (Fersht, 1977). Selain
sisi aktif terdapat juga sisi lain pada enzim yang dapat membentuk ikatan dengan molekul
lain. Enzim yang memiliki sisi pengikatan selain sisi aktif inilah yang biasa disebut sebagi
enzim alosterik seperti terlihat pada Gambar 4.
Gambar 4. Mekanisme Reaksi Enzim Model Induced Fit (Carr, 2005)
3. Faktor yang Mempengaruhi Aktivitas Enzim
Inhibitor dapat meminimalkan kerja enzim karena membentuk ikatan dengan sisi aktif
enzim sehingga mengganggu proses pembentukkan dan kestabilan ikatan kompleks
enzim-substrat. Mekanisme inhibitor yang berkaitan dengan sisi aktif enzim dapat bersifat
kompetitif dan nonkompetitif. Inhibitor bersifat kompetitif
jika inhibitor memiliki kemiripan dengan substrat sehingga sisi aktif enzim akan terhalang
untuk melakukan pengikatan dengan substrat, lain halnya dengan inhibitor nonkompetitif
yang hanya memilki sedikit kemiripan dengan substrat sehingga sisi aktif masih dapat
berikatan dengan substrat. Sedangakan induser adalah suatu zat tertentu yang dapat
mengaktifkan kerja dari enzim.
Pada proses kerja katalisis enzim suhu inkubasi sangat mempengaruhi kerja dari enzim,
suhu inkubasi yang lebih tinggi dari suhu optimum kerja enzim dapat menyebabkan
protein enzim. Nilai pH juga dapat mempengaruhi kerja dari enzim adanya perubahan pH
akan menyebabkan adanya efek zwitter ion, yaitu keadaan dimana pH muatan positif dan
negatif jumlahnya sama yang dapat mempengaruhi titik isoelektrik protein enzim sehingga
enzim akan mengalami perubahan konformasi dan perubahan bentuk sisi aktif.
Konsentrasi substrat juga mempengaruhi aktivitas enzim, pada keadaan substrat yang
berlebih maka akan terjadi kejenuhan pembentukkan kompleks enzim substrat sehingga
substrat tidak diubah menjadi produk (Arbianto, 1989).
4. Pengukuran parameter reaksi enzim
Didalam perhitungan kinetika reaksi enzim jumlah senyawa yang terlibat perlu diketahui
untuk memperoleh kesimpulan kuantitatif. Jumlah enzim yang diperlukan untuk
mengkatalisi reaksi biokimia jauh lebih kecil dibandingkan dengan konsentrasi substrat
yang digunakan dan produk yang dihasilkan.
Konsentrasi substrat dan produk biasanya dinyatakan dalam satuan molar, milimolar atau
mikromolar (Suhartono, 1989). Menurut perjanjian internasional satu unit aktivitas enzim
adalah jumlah enzim yang mengakibatkan transformasi satu mikromol (10-6 mol) substrat permenit pada suhu 25oC dalam keadan optimum system tersebut. Wirahadikusumah (1981), menyatakan bahwa aktifitas spesifik adalah jumlah unit aktifitas enzim permiligram
protein.
Dalam sejarah kinetika enzim yang menjadi tonggak penting adalah penelitian Leonard
Michaelis dan Menten pada tahun 1913, menghasilkan persamaan Michaelis-Menten.
Dalam menjalakan aktifitasnya, enzim (E) mula-mula bergabung dengan substrat (S) untuk
membentuk komplek enzim substrat (ES) dalam reaksi reversible. Komplek (ES) lalu
terurai dalam reaksi reversible selanjutnya menghasilkan produk pereaksi (P) dan enzim
bebas (E) (Lehninger, 1988).
E + S ES E + P
Untuk menyatakan hubungan yang tepat antara konsentrasi substrat dengan kecepatan
reaksi enzimatik. Michaelis-Menten menyatakan sebagai berikut:
V maks [S]
Pada saat V mencapai ½ Vmaks maka persamaan menjadi
Vmak [S]
½ Vmaks =
Km + [S]
Km = [S]
Jadi Km dapat diartikan konsentrasi substrat yang dibutuhkan untuk mencapai ½ Vmak.
Harga Km yang tetap untuk keadaan reaksi tertentu (pH dan suhu terentu) merupakan salah
satu ukuran yang mencirikan enzim tersebut. Harga Km tidak tergantung kepada
konsentrasi substrat maupun konsentrasi enzim yang bereaksi (Suhartono, 1989) seperti
ditunjukan pada Gambar 5.
Gambar 5. Grafik antara V dan [S] pada Persamaan Michaelis-Menten.
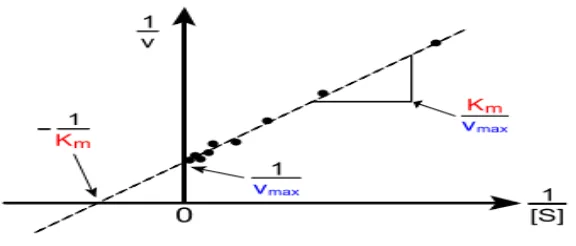
6. Grafik linier persamaan Michaelis-Menten
Lineweaver dan Burk pada tahun 1934 dan beberapa peneliti telah mengadakan
transformasi linier dari persamaan Michaelis-Menten tersebut menjadi :
1 Km 1 1
= + V Vmaks Vmaks S
Gambar 6. Grafik Lineweaver-Burk.
Grafik pada gambar 6 dikenali sebagi Grafik Lineweaver-Burk. Grafik ini digunakan secara
luas dalam menghitung nilai-nilai Km dan Vmaks dari suatu reaksi enzimatis (Suhartono,
1989).
E. Isolasi Dan Pemurnian Enzim
Dalam pengerjaan isolasi, hal yang harus diperhatikan adalah lokasi enzim tersebut pada
organisme. Menurut lokasinya, enzim dapat bersifat intraseluler yaitu enzim yang
sekresikan oleh organisme dan bekerja di luar sel organisme tersebut (Chan dan Pelezar,
1998). Ekstraksi enzim ekstraseluler lebih mudah daripada yang
intraseluler, karena tidak memerlukan pemecahan sel. Disamping itu, enzim yang
dikeluarkan dari sel mudah dipisahkan dari pengotor lain dan tidak banyak bercampur
dengan bahan-bahan isi sel lainnya (Gumbira, 1987). Tahapan proses isolasi serta
pemurnian enzim yang paling dasar menurut Darwis dan Sukara (1990) serta Judoamijojo
et al (1989) adalah sebagai berikut
Proses ini bertujuan untuk mengeluarkan enzim dari sel atau konstituen seluler. Pada
proses ini diperlukan perusakan atau penghancuran dinding sel secara fisik, mekanik, atau
kimiawi. Proses ini dilakukan untuk mengeluarkan enzim intraseluler dari dalam sel.
b. Sentrifugasi (pemusingan)
Molekul-molekul dengan berat molekul tinggi dapat mengendap dengan cepat bila
disentrifugasi dengan kecepatan tinggi. Kecepatan pengendapan molekul bergantung pada
beberapa faktor seperti besar molekul, bentuk molekul, dan viskositas larutan. Tetapi
kecepatan pengendapan molekul tersebut sangat bergantung pada berat molekulnya. Makin
besar berat molekulnya maka akan semakin cepat suatu zat terendapkan.
c. Fraksinasi
Cara pemurnian enzim yang umum dilakukan adalah dengan proses pengendapan bertahap
atau biasa disebut fraksinasi. Pengendapan protein yang sering dilakukan adalah
pengendapan dengan senyawa elektrolit menggunakan garam ammonium
sulfat. Penambahan senyawa elektrolit kedalam larutan enzim akan menyebabkan
menurunnya kelarutan enzim tersebut, sehingga terbentuk endapan protein. Garam
amonium sulfat sering digunakan dalam pengendapan enzim dan protein. Hal ini
disebabkan kebanyakan enzim tahan terhadap garam tersebut, memiliki daya pengendapan
yang cukup besar, mempunyai efek penstabil terhadap kebanyakan enzim (Soedigdo,
1998). Selain itu, garam ammonium sulfat memiliki kelarutan yang besar dalam air, dapat
Penambahan ammonium dilakukan dengan meningkatkan kejenuhan dari larutan enzim.
Pembagian fraksinya sebagai berikut: (0-20)%jenuh; (20-40)%jenuh; (40-60)%jenuh;
(60-80)%jenuh; (80-100)%jenuh. Pengendapan ini dikenal sebagai salting out.
d. Dialisis
Pada isolasi enzim sering dilakukan dialisis untuk memisahkan protein atau enzim dari
ion-ion (garam) dengan menggunakan membrane berdasarkan difusi. Proses ini terjadi karena
adanya perbedaan tekanan osmosa antara cairan yang ada di dalam membran dengan cairan
yang berada di luar membran. Membran yang digunakan adalah selofan berbentuk selang.
Sampel dimasukkan ke dalam kantung selofan, kemudian kantung tersebut dimasukkan ke
dalam larutan buffer. Molekul dengan berat molekul lebih kecil dari
20000 dalton dapat melewati membran, sedangkan molekul dengan berat molekul yang
lebih besar akan tertahan di dalam. Molekul-molekul kecil akan terdifusi keluar dari
membran sampai tekanan osmotic antara sample dan buffer yang digunakan telah seimbang
(Reed et al, 1998). Sehingga buffer atau air di luar membrane dialysis harus diganti
beberapa kali supaya semua ion dalam larutan dapat dihilangkan (Lehninger, 1998).
F. Karakterisasi Enzim
Kebutuhan industri terhadap enzim yang semakin meningkat dan bervariasi selain
menuntut adanya upaya peningkatan produksi jumlah enzim, juga mengharuskan adanya
kondisi yang tepat sehingga aktivitas enzim maksimum. Sebagian besar proses
karakterisasi yang dilakukan berdasarkan penentuan pH, suhu, dan jenis substrat (Long-Liu
et al, 1998).
Tingkat aktivasi enzim di pengaruhi oleh beberapa faktor, antara lain suhu, konsentrasi
protein, kondisi buffer dan penambahan ion-ion tertentu (McDonald, 1996). Untuk
menjaga stabilitas aktivitas enzim hal yang perlu diperhatikan adalah integritas struktur tiga
dimensi dari sisi aktif. Selain itu juga harus diperhatikan faktor-faktor yang mempengaruhi
stabilitas enzim antara lain suhu, kekuatan ion, pH, buffer, ada atau tidaknya substratnya
konsentrasi protein, waktu inkubasi dan ada atau tidaknya activator dan inhibitor (Long-Liu
et al, 1998). Faktor pH perlu diperhatikan didalam karakteristik enzim karena perubahan
pH pada reaksi enzim
sangat mempengaruhi stabilitas enzim, aktivitas enzim terhadap activator dan inhibitor,
aktivitas enzim terhadap substrat dan kecepatan konversi substrat menjadi produk
III. METODE PENELITIAN
A. Tempat dan Waktu Penelitian
Penelitian ini dilakukan di Laboratorium Biomassa, Jurusan Kimia Fakultas Matematika
dan Ilmu Pengetahuan Alam, Universitas Lampung, dimulai dari bulan November 2009
sampai Mei 2010.
B. Alat dan Bahan
Dalam penelitian ini alat-alat yang digunakan adalah, shaker, spektrofotometer UV,
incubator (Memmer Germany INCO2), autoklaf (speed clave model HV-25L), magnetic
stirrer (Wiggen Hauser), sentrifus (HITACHI CF16RX II), neraca analitik, lemari
pendingin, Micro Plate Reader (Hospitex Diagnostix), laminar air flow Cabinet (ESCO),
penangas air (Wiggen Hauser), kertas saring, termometer, cawan petri, dan peralatan gelas
lainnya seperti labu erlenmeyer, gelas beker, labu takar, tabung reaksi, spatula, pipet tetes
dan lain-lain.
Bahan-bahan yang digunakan adalah medium ISP-2 (yeast extract, malt ekstrak, dekstrosa,
dan agar), air laut steril, Mineral salt medium (FeSO4.7H2O, K2HPO4, MgSO4.7H2O,
tartarat, Reagent Folin-Ciocelteau, alkohol 70 %, BSA, aquades, dan kantung selofan.
C. Metode Penelitian
1. Penyiapan Media dan Larutan Pereaksi
a. Pembuatan Media Pemeliharaan Actinomycetes (Media ISP-2)
Sebanyak 4 g yeast extract, 10 g malt ekstrak, 4 g dekstrosa, dan 20 g agar dilarutkan
dalam 1 L air laut steril kemudian disterilisasi pada temperatur 121 oC, 1 atm, selama 15 menit (Margavey, et al., 2004).
b. Pembuatan Media Produksi (Mineral Salt Medium)
Dalam 1 L air laut steril pada pH 7 ditambahkan komposisi Mineral salt medium (w/v) %
yaitu FeSO4.7H2O, K2HPO4, MgSO4.7H2O, CaCl2, NaCl, dan pati. Kemudian disterilisasi
pada temperatur 121 oC, 1 atm, selama 15 menit.
c. Pembuatan Pereaksi Untuk Pengukuran Aktivitas Amilase Metode Mendels
Pereaksi asam dinitrosalisilat : 1 % asam dinitrosalisilat, 0,2 % fenol, 0,05 % Na2SO3, 1 %
NaOH, 40 % 1 mL garam Rochel (Na-K tartarat). Semua zat dicampurkan dan
ditambahkan volumenya hingga 100 ml.
2. Larutan B : 5 ml larutan 1% CuSO4.5H2O ditambahkan ke dalam larutan 1% Na-K
tartarat.
3. Larutan C : 2 ml larutan B ditambahkan 100 ml larutan A
4. Larutan D : Reagent Folin-Ciocelteau 1N dengan aquades 1 : 1
2. PeremajaanIsolat Actinomycetes
Isolat actinomycetes yang digunakan yaitu isolat actinomycetes yang berasal dari lumpur
hutan bakau. Isolat actinomycetes yang telah diberi nama ANLd-2b-3, 12, dan
ANL-4, adalah isolat actinomycetes yang didapatkan dari penelitian sebelumnya dan digunakan
pada penelitian kali ini (Guntari, 2009). Dari ketiga isolat actinomycetes tersebut,
selanjutnya dilakukan peremajaan isolat actinomycetes dengan megunakan media
pemeliharaan actinomycetes, yaitu Media ISP-2.
3. Uji Amilolitik
Uji kemampuan actinomycetes dalam menghidrolisis amilum dengan menggunakan
mineral salt medium yang menggandung 1% pati dalam air laut. Setelah disterilisasi dan
media dibiarkan memadat dalam cawan petri, selanjutnya diambil masing-masing 1 ose
isolat actinomycetes dan ditanam dalam media yang telah memadat tersebut dengan metode
tusuk. Selanjutnya setelah diinkubasi selama 7 hari, media tersebut dialirkan larutan iodin
dan diamati terbentuknya zona bening disekitar koloni actinomycetes tersebut dan diukur
indeks amilolitik zona bening dari masing-masing media dengan isolat actinomycetes yang
4. Penentuan Kondisi Optimum Pertumbuhan Actinomycetes.
Media yang digunakan untuk mengetahui kondisi pertumbuhan optimum produksi enzim
amilase adalah Mineral Salt Medium. Pada media diberikan kondisi pertumbuhan yang
diamati meliputi pH dan waktu inkubasi. Variasi pH yang dilakukan adalah 6; 6,5; 7; 7,5
dan 8. Variasi waktu inkubasi yang dilakukan adalah 24, 48, 72, 96, 120, 144, 168, 192,
216 dan 240 jam.
Pada seluruh perlakuan diukur aktivitas amilase dan jumlah selnya. Uji ini positif bila
menghasilkan larutan kompleks berwarna merah bata/kuning. Untuk mengukur jumlah sel
dilakukan dengan menggunakan spektrofotometer pada panjang gelombang 600 nm. Dari
data hasil pengukuran OD600 dapat diketahui kondisi pertumbuhan optimum yang tepat
untuk pertumbuhan actinomycetes. Kondisi pertumbuhan optimum yaitu keadaan optimum
yang mempunyai aktivitas enzim amilase paling tinggi pada seluruh perlakuan yang
meliputi variasi pH, temperatur dan waktu.
5. Penyiapan Inokulum.
Isolat bakteri yang telah ditumbuhkan pada media ISP-2 selama 2-7 hari diinokulasi ke
dalam Erlenmeyer 250 ml yang berisi 100 ml Mineral Salt Medium
pada pH optimum, temperatur optimum, dan waktu inkubasi optimum. Biakan ini yang
disebut starter atau inokulum.
Sebanyak 2 % inokulum dipindahkan ke dalam 500 mL media fermentasi secara aseptis
dan diinkubasi pada temperatur pertumbuhan optimum, pH optimum dan waktu inkubasi
optimum, untuk memperoleh jumlah maksimum enzim yang diproduksi actinomycetes
tersebut.
7. Isolasi Enzim Amilase
Isolasi protein enzim dilakukan dengan menggunakan metode sentrifugasi. Metode ini
digunakan untuk memisahkan enzim dari sel-selnya. Media fermentasi yang telah
diinkubasi menggunakan shaker inkubator selanjutnya disentrifugasi dengan
kecepatan 3500 rpm selama 30 menit pada suhu 40 C. Filtrat yang diperoleh disebut ekstrak kasar enzim, terhadap ekstrak kasar enzim tersebut dilakukan pengukuran volume,
uji aktifitas enzim dan pengukuran kadar protein menggunakan metode Lowry.
8. Pemurnian Enzim Amilase
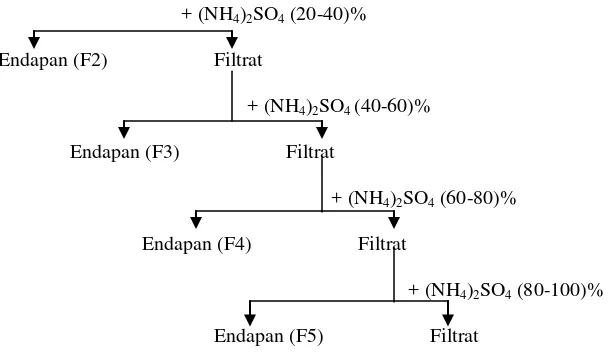
a. Fraksinasi Dengan Amonium Sulfat
Proses pemurnian berikutnya adalah fraksinasi ekstrak kasar enzim dengan menggunakan
garam ammonium sulfat.
Ekstrak kasar enzim amilase
+ (NH4)2SO4 (0-20)%
+ (NH4)2SO4 (20-40)%
Gambar 7. Skema Proses Fraksinasi Enzim dengan Penambahan Ammonium Sulfat
Skema proses pengendapan dengan penambahan ammonium sulfat dijelaskan seperti
Gambar 7 diatas. Setelah itu endapan protein enzim dipisahkan dari cairannya dengan
sentrifugasi pada kecepatan 6500 rpm selama 15 menit. Kemudian endapan yang diperoleh
dari tiap fraksi dilarutkan dalam buffer pospat pH 7.
b. Dialisis
Endapan enzim dari tiap fraksi yang telah dilarutkan dalam buffer pospat pH 7,
dimasukkan ke dalam kantung selofan dan didialisis dengan buffer pospat pH 7 selama ±30
jam dalam suhu dingin. Terhadap hasil dialisis dilakukan pengujian aktifitas enzim metode
Mandels dan ditentukan kadar proteinnya.
9. Karakterisasi Enzim
Semua pengukuran pada seluruh perlakuan yang meliputi variasi pH, temperatur, waktu
a. Penentuan Temperatur Optimum
Untuk mengetahui suhu optimum dari enzim hasil isolasi,maka dilakukan pengukuran
aktifitas enzim dengan metode mendels dan variasi suhu yang digunakan adalah 40, 50, 60,
70 dan 80oC.
b. Penentuan pH Optimum
Untuk mengetahui pH optimum dari enzim hasil isolasi, dilakukan pengukuran aktifitas
enzim dengan metode Mandels, dengan variasi pH yang digunakan adalah 6,0; 6,5; 7,0;
7,5; dan 8,0.
c. Penentuan Waktu Inkubasi Maksimum
Untuk mengetahui waktu inkubasi optimum dari hasil isolasi, dilakukan pengukuran
aktifitas enzim menggunakan metode Mandels dengan variasi waktu inkubasi 10, 20, 30,
40 dan 50 menit.
d. Penentuan Nilai Km dan Vmaks
Ke dalam beberapa tabung reaksi dimasukkan larutan substrat (amilum) dengan konsentrasi
berturut-turut 0,50; 1; 1,50; 2,0; 2,5 dan 3 mg/ml. Pengerjaan selanjutnya sama dengan
pengukuran aktifitas enzim metode Mandels, dengan menggunakan data hasil penentuan
suhu, pH, dan waktu inkubasi maksimum
optimum. Nilai Km dan Vm ditentukan dengan menggunakan kurva Lineweaver-burk.
Metode ini didasarkan atas glukosa yang terbentuk dari hasil hidrolisis pati oleh amilase
(Mandels et al., 1976). Sebanyak 0,5 ml enzim, 0,5 ml larutan 0,1 % pati dicampur lalu
diinkubasi selama 30 menit pada suhu 60oC. Setelah itu ditambahkan 2 ml pereaksi DNS (asam dinitrosalisilat) didihkan selama 10 menit pada penangas air dan didinginkan.
Sedangkan kontrol 0,5 ml enzim amilase dipanaskan sampai mendidih, lalu ditambahkan 2
ml DNS dan 0,5 ml substrat. Pengukuran aktifitas enzim meliputi aktivitas unit dan
aktivitas spesifik. Setelah dingin serapannya diukur menggunakan spektrofotometer
UV-VIS pada 540 nm. Kadar glukosa yang terbentuk ditentukan dengan menggunakan kurva
standar glukosa.
11. Penentuan Kadar Protein Metode Lowry
Sebanyak 0,1 ml larutan enzim dan 0,9 ml air direaksikan dengan 5 ml larutan C. Larutan
didiamkan selama 10 menit dalam suhu kamar, kemudian ditambahkan 1 mL reagent
Folin-Ciocelteau 1 N. Larutan didiamkan selama 30 menit pada suhu kamar. Warna biru
yang terbentuk dibaca serapannya pada panjang gelombang 660 nm dengan menggunakan
spektrofotometer. Konsentrasi protein ditentukan dengan menggunakan larutan standar
Bovin Serum Albumin (Lowry, 1951).
Pembiakan actinomycetes pada media pertumbuhan optimum
Keterangan :
* : Hanya Uji aktifitas enzim dengan metode Mandels
IV. HASIL DAN PEMBAHASAN
A. Isolat Actinomycetes Amilolitik Terpilih
1. Isolat Actinomycetes Terpilih
Peremajaan isolat actinomycetes dilakukan dengan tujuan sebagai pemeliharaan isolat
actinomycetes agar nantinya dapat terus digunakan sampai pada akhir penelitian dan
menjaga kelangsungan hidup isolat actinomycetes itu sendiri. Biasanya peremajaan
actinomycetes ini dilakukan 3-4minggu sekali setelah dilihat pada sumber-sumber nutrien
makanan bagi pertumbuhan actinomycetes tersebut akan mulai habis digunakan. Isolat
yang digunakan pada proses peremajaan isolat actinomyetes ini didapatkan dari penelitian
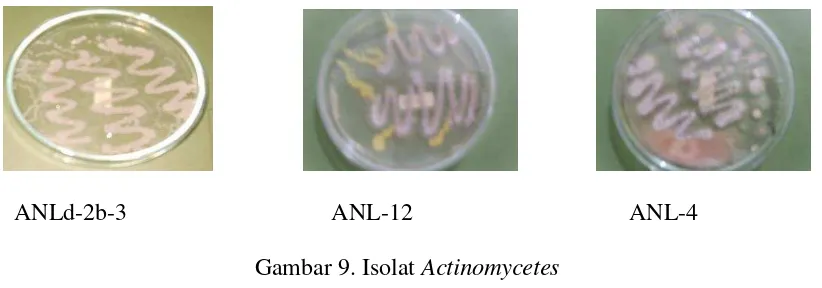
sebelumnya, yaitu isolat ANLd-2b-3, ANL-14 dan ANL-12 (Lina, 2009). Dipilihnya ketiga
isolat actinomycetes tersebut berdasarkan pertumbuhan yang lebih baik karena tidak
adanya kontaminan dibandingkan dengan isolat-isolat actinomycetes yang ada.
Pertumbuhan isolat actinomycetes yang sempurna baru dapat terlihat selama 7 hari. Biakan
ANLd-2b-3 ANL-12 ANL-4
Gambar 9. Isolat Actinomycetes
Isolat actinomycetes ANLd-2b-3 mempunyai warna keabu-abuan, isolat actinomycetes
ANL-12 mempunyai warna kuning keabuan dan isolat actinomycetes ANL-4 mempunyai
warna kuning kecoklatan. Sedangkan bentuk dari ketiga isolat diatas mempunyai bentuk
yang hampir sama yaitu ketiganya memiliki hifa atau percabangan, berbubuk, tebal, dan
pertumbuhannya lebih lama di bandingkan bakteri, oleh sebab itu pertumbuhan isolat
actinomycetes ini umumnya muncul dengan perlahan antara 7-10 hari baru dapat terlihat
bentuk isolatnya.
2. Aktivitas Amilolitik Terpilih
Uji amilolitik dilakukan dengan tujuan memilih salah satu isolat actinomycetes dari ketiga
isolat actinomycetes yang ada, yang kemudian akan digunakan sebagai sumber enzim
amilase yang akan dihasilkan, dengan cara melihat isolat actinomycetes mana yang
mempunyai aktivitas enzim amilase paling besar. Pengujiannya dilakukan dengan melihat
Amilase merupakan enzim yang mampu menghidrolisis molekul amilum menjadi glukosa
atau oligosakarida. Dengan indikator larutan Iodin tersebut akan memberikan warna bening
yang menandakan bahwa isolat actinomycetes dapat menghidrolisis amilum.
Ketiga isolat menunjukkan hasil yang positif dengan larutan iodin yang membentuk zona
bening. Daerah zona bening tersebut adalah daerah hasil hidrolisis amilum. Kemudian
ketiga isolat itu dihitung indeks amilolitiknya. Indeks amilolitik diartikan sebagai hasil bagi
diameter zona bening dengan diameter koloni.
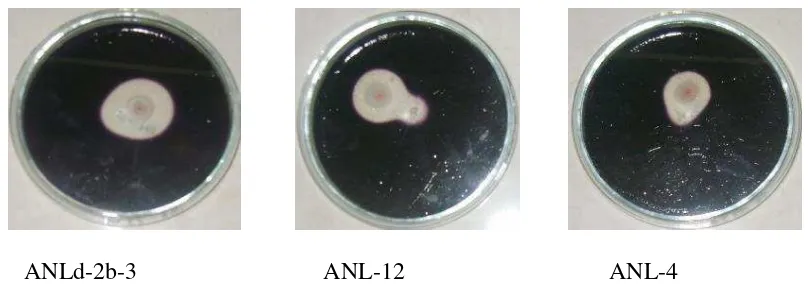
Dari hasil yang telah dilakukan pada ketiga isolat actinomycetes maka diperoleh gambar
hasil zona bening dan data indeks amilolitiknya, seperti disajikan pada Gambar 10 dan
Tabel 1. Hasil penelitian menunjukkan bahwa isolat ANLd-2b-3 mempunyai kemampuan
amilolitik yang lebih besar dibandingkan dua isolat lainnya.
ANLd-2b-3 ANL-12 ANL-4
Gambar 10. Hasil Uji Amilolitik pada actinomycetes
Tabel 1. Indeks Amilolitik dari berbagai isolat actinomycetes
Nama Isolat
Diameter Koloni (cm)
Diameter Zona Bening
ANLd-2b-3 1,7 2,6 1,529
ANL-12 1,4 2,0 1,428
ANL-4 1,6 1,8 1,128
B. Kondisi waktu dan pH optimum pertumbuhan Actinomycetes.
Penentuan kondisi optimum pertumbuhan actinomycetes perlu dilakukan untuk mengetahui
lingkungan optimum pertumbuhan actinomycetes dan mendapatkan kondisi terbaik dalam
memproduksi enzim. Diharapkan enzim yang diproduksi akan lebih maksimal atau
mempunyai aktivitas enzim yang tinggi. Proses ini dilakukan sebelum proses isolasi
enzim.
Pada proses penentuan kondisi optimum pertumbuhan actinomycetes isolat ANLd-2b-3
didapatkan pH optimum dan waktu optimumnya yaitu pada pH 7 dan waktu 120 jam.
Sedangkan dari hasil penelitian sebelumnya yang dilakukan oleh Bruhlmann, et al
didapatkan pH dan waktu inkubasi optimum actinomycetes yaitu pada pH 7,3 dan waktu 4
hari (96 jam).
Berikut merupakan kurva pertumbuhan actinomycetes dapat dilihat pada Gambar 11 (dari
0
Gambar 11. Hubungan antara jumlah sel (OD600) dan aktivitas unit amilase
dengan lama waktu fermentasi
Dari Gambar 11 dapat dilihat fase eksponensial pertumbuhan actinomycetes tercapai pada
waktu inkubasi 96 jam. Produksi enzim amilase dengan aktivitas tertinggi pada waktu
inkubasi 120 jam, atau pada awal fase stasioner pertumbuhan actinomycetes.
Setelah didapatkan waktu pertumbuhan optimum actinomycetes dalam menghasilkan
enzim amilase dengan aktivitas tertinggi, kemudian ditentukan pH optimum pertumbuhan
actinomycetes. Hasil pengukuran absorbansi pada panjang gelombang 600nm menggunakan metode densitas optikal (OD600) didapatkan pH optimum pada pH 7 dengan absorbansi sebesar
OD600 = 0,165. Kurva kondisi optimum actinomycetes pada variasi pH dapat dilihat pada
0
Gambar 12. Hubungan antara jumlah sel (OD600) dengan pH pada saat fermentasi
C. Inokulum dan Enzim Amilase Hasil Produksi
Penyiapan inokulum atau media starter ini dilakukan dengan tujuan untuk mendapatkan
enzim yang diproduksi lebih banyak dan maksimal. Media starter atau inokulum diinkubasi
selama waktu inkubasi pertumbuhan optimum dan pH optimum, yaitu waktu inkubasi
selama 120 jam dengan pH 7.
D. Aktivitas Enzim Amilase Hasil Isolasi
Setelah actinomycetes diinkubasi selama 120 jam dengan pH 7 dalam media fermentasi,
setelah itu dilakukan pemisahan enzim amilase dari konstituen seluler lainnya sehingga
diperoleh ekstrak kasar enzim. Proses isolasi enzim dilakukan dengan mensentrifugasi
media fermentasi dengan kecepatan 3500 rpm selama 30 menit. Pada proses isolasi ini
diperoleh ekstrak kasar enzim sebanyak 469 ml dari 500 ml media fermentasi, dengan
aktivitas unit 1,4 U/mL, kadar protein 0,26 mg/mL, dan aktivitas spesifik 5,4 U/mg.
1. Hasil Fraksinasi dengan Amonium Sulfat
Proses fraksinasi dengan penambahan garam ammonium sulfat kedalam larutan enzim akan
menyebabkan menurunnya kelarutan enzim tersebut, sehingga terbentuk endapan protein.
Dengan adanya penambahan garam, kelarutan protein akan meningkat hal ini dikarenakan
karena pada konsentrasi garam yang tinggi, garam akan lebih cenderung mengikat air dan
menyebabkan agregasi Sehingga molekul protein mengalami pengendapan. Peristiwa ini
disebut salting out. Proses fraksinasi ini dilakukan pada suhu 0-4oC, hal ini betujuan agar kemungkinan hilangnya aktivitas enzim oleh adanya denaturasi dapat diminimalkan.
Pemurnian enzim pada tahap pertama ini dilakukan dengan menambahkan garam amonium
sulfat dalam 5 tingkat fraksi kejenuhan Fraksi kejenuhan amonium sulfat yang digunakan
pada penelitian ini adalah (0-20)%, (20-40)%, (40-60)%, (60-80)%, dan (80-100)% jenuh.
Pada tahapan pemurnian ini tidak dilakukan uji aktivitas unit, kadar protein dan aktivitas
spesifiknya tetapi pengujiannya dilakukan setelah tahap dialisis. Hal ini dilakukan agar
garam yang ada dalam larutan enzim dapat terpisah terlebih dahulu, sehingga garam yang
digunakan untuk mengendapkan protein tidak mempengaruhi pengukuran aktivitas enzim
amilasenya, yang menyebabkan aktivitas unit enzim amilase menurun.
2. Aktivitas Dialisis Terpilih
Proses pemurnian dialisis dilakukan karena adanya molekul garam dari hasil fraksinasi
yang dapat mempengaruhi aktivitas dan kestabilan enzim. Oleh karena itu, dengan
agar didapatkan enzim dengan aktivitas lebih tinggi dan kemurnian meningkat. Tahapan
dialisis ini dilakukan pada kondisi dingin untuk mencegah terjadinya kerusakan protein
enzim yang dimurnikan dan juga dilakukan dengan menggunakan membran berdasarkan
difusi partikel zat terlarut yang menyebabkan protein enzim akan terpisah dari ion-ion
garamnya dan membran yang digunakan adalah kantung selofan (Reed et al, 1998).
Pada setiap pergantian buffer phospat yang dilakukan setiap 4 jam sekali, dilakukan
pengujian dengan cara meneteskan larutan Ba(OH)2 0,1M pada buffer untuk mengetahui
masih ada tidaknya garam ammonium sulfat pada enzim. Jika pada larutan buffer tersebut
tidak terdapat endapan putih setelah ditetesi larutan Ba(OH)2, maka tahap dialisis telah
selesai.
Gambar 13 (Lampiran 2, Tabel 6) menunjukan hubungan antara fraksi enzim pada berbagai
tingkat kejenuhan amonium sulfat setelah didialisis dengan aktivitas unit enzim amilase.
0
Pada Gambar diatas dapat dilihat enzim amilase yang memiliki aktivitas unit tertinggi yaitu
pada fraksi (40-60)% sebesar 2.6 U/mL. Pada fraksi-fraksi sesudah fraksi (40-60)%, masih
terlihat tinggi aktivitas enzimnya, yang menandakan bahwa amonium sulfat masih dapat
mengendapkan protein enzim pada fraksi-fraksi tersebut. Aktivitas unit tiap fraksi berbeda
karena dipengaruhi oleh tinkat kejenuhan garam amonim sulfat yang semakin meningkat.
Berikut adalah Tabel Pemurnian enzim amilase dari actinomycetes pada berbagai tahap
pemurnian. Dapat dilihat bahwa pada Tabel di bawah ini terjadi peningkatan aktivitas dan
tingkat kemurnian enzim amilase pada tahap pemurnian dialisis dari fraksi (40-60) %
dibandingkan dengan ekstrak kasar.
Tabel 2. Hasil Pemurnian Enzim Amilase
Tahap
Volume Aktivitas Aktivitas Kadar Aktivitas Tingkat
Perolehan (%) Enzim Unit Total Protein Spesifik kemurnian
(mL) (U/mL) (U) (mg/mL) (U/mg) (kali)
Hasil dialisis menunjukan aktivitas enzim yang meningkat dengan tingkat kemurnian yang
lebih tinggi yaitu 1,37 kali lebih murni dibandingkan ekstrak kasar dan dengan perolehan
10 %.
Pada proses karakterisasi enzim ini dilakukan agar dapat diaplikasikan pada kebutuhan
industri terhadap enzim yang semakin meningkat dan bervariasi yang menuntut adanya
upaya peningkatan produksi jumlah enzim.
1. Suhu Optimum Enzim Amilase
Aktivitas tertinggi (U/mL) enzim hasil pemurnian dari actinomycetes dapat dilihat pada
Gambar 14. Suhu optimum enzim amilase berdasarkan Gambar 14 adalah 500C (dari data tabel 7, Lampiran 2 ).
Gambar 14. Penentuan suhu optimum enzim amilase
Pada Gambar di atas, aktivitas enzim semakin meningkat seiring dengan kenaikan suhu
sampai pada suhu optimum. Setelah mencapai aktivitas maksimum pada suhu optimum,
aktivitas enzim akan menurun seiring dengan kenaikan suhu. Pada suhu kurang dari 50 oC kestabilan enzim cukup tinggi namun kemampuan hidrolisis pati oleh enzim tidak berjalan
secara maksimal. Dengan meningkatnya temperatur (suhu) akan menyebabkan
rotasi dari enzim sehingga peluang enzim dan substrat untuk bertumbukan dan bereaksi
meningkat, dan produk yang dihasilkan akan semakin bertambah pula.
Akan tetapi diatas temperatur optimum, aktivitas enzim menurun tajam. Hal ini terjadi
karena enzim mulai mengalami perubahan konformasi yang menyebabkan sisi aktifnya
tidak sesuai lagi dengan substrat. Hal ini dikarenakan gugus reaktifnya mengalami
hambatan untuk memasuki sisi aktif enzim sehingga struktur enzim akan mengalami
kerusakan dan aktivitas enzim semakin menurun (Suhartono, 1989).
2. pH Optimum Enzim Amilase
Aktivitas optimum amilase dicapai pada pH 7, hal ini disebabkan karena pada kondisi pH
7, gugus pemberi atau penerima proton yang penting pada sisi katalitik enzim berada pada
tingkat yang diinginkan sehingga aktivitas katalitiknya tinggi dan karena terjadinya
perubahan ionisasi pada gugus ionik sisi enzim tersebut yang
mempengaruhi sisi aktifnya, maka hal ini menyebabkan enzim dapat mengikat substrat
lebih efektif dan mengubahnya menjadi produk.
Dibawah pH optimum, ion H+ akan berikatan dengan gugus NH2- bebas membentuk NH3+,
sehingga ikatan hidrogen dari amina (NH2) dengan gugus karbonil dalam molekul protein
enzim akan putus dan menyebabkan perubahan konformasi pada pusat aktif enzim.
Sedangkan diatas pH optimum , ion OH- akan berikatan dengan atom hidrogen dari molekul enzim membentuk H2O, sehingga ikatan hidrogen yang ada dalam molekul protein
mengalami penurunan aktivitas hingga laju reaksi mencapai nol. Laju reaksi akan menurun
dikarenakan perubahan gugus yang bermuatan akan menyebabkan perubahan konformasi
lipatan pada enzim sehingga konformasi sisi aktif enzim ikut terpengaruh akibatnya
aktivitas enzim akan menurun dengan adanya perubahan konformasi dari sisi aktif enzim.
Hal ini juga disebabkan karena telah berkurangnya komponen didalam medium yang
menjadi penginduksi sintesis enzim atau substrat (Abianto, 1989).
0
Gambar 15. Penentuan pH optimum enzim amilase
Aktivitas unit amilase (U/mL) optimum hasil pemurnian dari actinomycetes adalah pada
pH 7 (Tabel 8, lampiran 2) dapat dilihat pada Gambar 15.
3. Waktu Optimum Enzim Amilase
Aktivitas tertinggi (U/mL) enzim hasil pemurnian dari actinomycetes dapat dilihat pada
Gambar 16. Waktu optimum enzim amilase berdasarkan Gambar 16 adalah 30 menit (dari
0
Gambar 16. Penentuan waktu inkubasi optimum enzim amilase
Pada Gambar di atas, aktivitas enzim semakin meningkat seiring dengan bertambahnya
waktu inkubasi sampai pada waktu optimum. Setelah mencapai aktivitas maksimum pada
waktu optimum, aktivitas enzim akan menurun seiring dengan bertambahnya waktu
inkubasi. Hal ini dapat disebabkan adanya perbedaan waktu yang dibutuhkan oleh setiap
enzim untuk bereaksi dengan substrat. Namun ada saatnya jumlah produk menjadi konstan
sementara waktu terus meningkat, yang biasa dikenal sebagai istilah turunnya laju reaksi
(product over time). Hal ini disebabkan karena jumlah substrat yang berkurang ataupun
hasil dari reaksi enzim
atau produk menghambat pembentukkan dari kompleks enezim substrat sehingga aktivitas
enzim akan semakin menurun nilainya.
4. KM dan Vmaks Enzim Hasil Pemurnian.
Kecepatan reaksi enzim akan meningkat seiring dengan meningkatnya konsentrasi substrat
sampai pada suatu harga yang memberikan kecepatan reaksi tetap. Pada keadaan tersebut,
menjadi lebih jenuh dan tidak dapat bereaksi lebih cepat. Harga KM dari suatu enzim
berfungsi untuk mengetahui konsentrasi dari subsrat yang menghasilkan laju reaksi
maksimum.
Grafik Penentuan harga KM dan Vmaks enzim amilase dapat dilihat pada Gambar 17.
y = 0.103x + 0.0327
Gambar 17. Grafik Lienweaver-Burk enzim amilase
Berdasarkan data pada Gambar tersebut, laju reaksi meningkat seiring dengan
meningkatnya konsentrasi substrat. Jika konsentrasi substrat terus dinaikan, akan ada suatu
saat enzim jenuh dengan substratnya sehingga peningkatan konsentrasi substrat tidak lagi
meningkatkan laju reaksi dan walaupun substrat terus mengalami penambahan,
pembentukan kompleks enzim substrat tidak lagi dimungkinkan, keadaan ini disebut laju
Dari persamaan Lineweaver-burk diperoleh harga Vmaks hasil pemurnian sebesar 30,6 mol
mL-1 menit-1 , sedangkan nilai KM sebesar 3,15 mg mL-1 (dari data pada Tabel 10,
Lampiran 3).
V. SIMPULAN DAN SARAN
5.1 Simpulan
Berdasarkan hasil penelitian yang telah dilakukan, dapat disimpulkan bahwa :
1. Isolat ANLd-2b-3 mempunyai kemampuan menghidrolisis amilase yang lebih besar
dibandingkan isolat ANL-14 dan ANL-12. Kondisi optimum pertumbuhan isolat
ANLd-2b-3 dalam memproduksi enzim amilase optimum pada pH 7 dan waktu 120
jam.
2. Pada ekstrak kasar enzim amilase didapatkan aktivitas unit sebesar 1,4 U/mL, kadar
protein 0,26 mg/mL, dengan aktivitas spesifik 5,4 U/mg dan pada fraksinasi dengan
amonium sulfat fraksi (40-60)% jenuh setelah didialisis didapatkan aktivitas unit
sebesar 2,6 U/mL, kadar protein 0,35 mg/mL, dan aktivitas spesifik 7,4 U/mg dengan
tingkat kemurnian 1,37 kali.
3. Kondisi optimum kerja enzim amilase dari actinomycetes isolat ANLd-2b-3 pada suhu
500C, pH 7 dan waktu inukubasi optimum 30 menit. Nilai Vmaks sebesar 30,6 mol mL-1
5.2 Saran
Dari hasil penelitian yang telah dilakukan dapat disarankan adanya penentuan kondisi suhu
optimum pertumbuhan actinomycetes dan diharapkan adanya penelitian lanjutan mengenai
DAFTAR ISI
Halaman
DAFTAR TABEL ... v
DAFTAR GAMBAR ... vi
I. PENDAHULUAN... 1
A. Latar Belakang... 1
B. Tujuan Penelitian... 4
C. Manfaat Penelitian... 4
II. TINJAUAN PUSTAKA... 5
A. Hutan Bakau ... 5
B. Mikroorganisme ... 6
1. Faktor yang mempengaruhi pertumbuhan mikroorganisme ... 6
2. Nutrien bagi pertumbuhan mikroorganisme ... 7
3. Fasepertumbuhan mikroorganisme ... 8
C. Actinomycetes...10
D. Enzim ...12
1. Enzim Amilase ... 13
2. Mekanisme Katalisis Enzim ...15
5. Persamaan Michaelis-Menten ... 18
6. Grafik Linier Persamaan Michaelis-Menten ... 20
E.. Isolasi dan Pemurnian Enzim ... 20
F. Karakterisasi Enzim ... 23
III. METODOLOGI PENELITIAN ... 25
A. Tempat dan Waktu Penelitian ... 25
B. Alat dan Bahan ... 25
C. Metode Penelitian... 26
1. Penyiapan Media dan Larutan Pereaksi ... 26
2. Peremajaan Isolat Actinomycetes ... 27
3. Uji Amilolitik ... 27
4. Penentuan Kondisi Optimum Pertumbuhan... 28
5. Penyiapan Inokulum ... 28
6. Produksi Enzim Amilase ... 29
7. Isolasi Enzim Amilase ... 29
8. Pemurnian Enzim Amilase ... 29
a. Fraksinasi dengan Amonium Sulfat ... 29
b. Dialisis ... 30
9. Karakterisasi Enzim ... 31
10. Pengujian Aktifitas Amilase Metode Mendels... 32
A. Isolat Actinomycetes Amilolitik Terpilih ... 34
1. Isolat Actinomycetes Terpilih ... 34
2. Aktivitas Amilolitik Terpilih ... 35
B. Kondisi Waktu dan pH Optimum Pertumbuhan Actinomycetes ... 37
C. Inokulum dan Produksi Enzim Amilase ... 39
D. Aktivitas Enzim Amilase Hasil Isolasi ... 39
E. Enzim Amilse Hasil Pemurnian ... 40
1. Hasil Fraksinasi dengan Amonium Sulfat ... 40
2. Aktvitas Dialisis Terpilih... 41
F. Enzim Amilase Hasil Karakterisasi... 43
1. Suhu Optimum Enzim Amilase ... 43
2. pH Optimum Enzim Amilase ………...…..… 44
3. Waktu Optimum Enzim Amilase ………... 46
4. KM dan Vmaks Enzim Hasil Pemurnian………... 47
V. SIMPULAN DAN SARAN………...………... 49
A. Simpulan ... 49
B. Saran ... 50
DAFTAR PUSTAKA ... 51
DAFTAR PUSTAKA
Albert, B., Bray, D., Lewis, J., Raff, M., Roberts, K., and Watson, J. D. 1994. Biologi Molekular Sel, edisi kedua, jilid I. Alih Bahasa oleh Alex Tri Kanjono W. PT. Gramedia Pustaka Utama. Jakarta. Hal : 278-281
Alexander, M. 1977. Introduction of soil Microbiology, Second Edition. John Willey and Sons. Inc. New York. Hal : 467-468
Arbianto, P. 1989. Biokimia Konsep-Konsep Dasar. Departemen Pendidikan dan Kebudayaan Direktorat Jendral Pendidikan Tinggi. Jakarta. Hal : 48-50
Blaber, M. 1998. Molecular Biology and Biotechnology. Sb.fsu.edu.com.
Boyer, F. R. 1993. Modern Experimental Biochemistry. The Benjamn/Cummings Publishing Company, Inc. California. Hal : 275-276
Bruhmann, F., Kim, K.S., Zimmerman, W., and Fietcher, A. 1993. Pectinolytic Enzyme from actinomycetes for the Degumming of Ramie Bast Fibers. Appliedd and environmetal microbiology. P. 2107-2112 Vol 60, No.6.
Carr, S. M. 2005. Induced Fit Model. www. Noun.ca/biology/scar/Induced-Fit. Model.html. Diakses pada tanggal 22 Juni 2009. 16.19 WIB.
Chan, E. C. S., dan Pelezar, M. J. Jr. 1988. Dasar-dasar Mikrobiologi. UI Press. Jakarta. Hal : 33-34
Collins, E.M. 2001. Lock and Key Model. http:/waynesword.palomar/molecul.htm. Diakses pada tanggal 22 Juni 1009. 16.08 WIB.
Darwis, A. A dan Sukara. 1990. Teknologi Mikrobial. Pusat Antar Universitas. Institut Pertanian Bogor. Bogor. Hal : 71-74
Das, S., Lyla, P.S. dan Ajmal, K. 2006. Marine Microbial Diversity and Ecology : Importance and future perspectives. Current Science. Vol. 90 No.10. (2006)
Fersht, A. 1977. Enzyme Structure and Mechanism. W.H Freeman and Company. San Franscisco. Hal : 45-47
Foster, R. L. 1980. The Nature Enzymology. Halsted Press Book. John Willey and sons. New York. Hal : 65-69
Frobisher. 1970. Fundamentals of Microbiology. WB SaundersCompany. Phidelphia. London. Toronto. Hal : 52-58
Gumbira, S.E. 1987. Bioindustri, Penerapan Teknologi Fermentasi. PT. Mediyatama Sarana Perkasa. Jakarta. Hal : 124-126
Guntari, L.F. 2009. Isolasi dan Seleksi Actinomycetes Penghasil Enzim Selulase Dari Lumpur Hutan Bakau Pantai Ringgung Perairan Teluk Lampung. [Skripsi]. Universitas Lampung. Bandar Lampung.
Irwanto, 2007. Suksesi Hutan Mangrove Pulau Marsegu. Http://Irwantoshut.Com/ Dibuka pada 10 September 2009, pukul 14.00 WIB
Judoamijojo, M., A.A Darwis, dan E.G. Said. 1992. Teknologi Fermentasi. PAU Bioteknologi. IPB. Rajawali Press. Jakarta. Hal : 54-58
Jutono. 1980. Penentun Mikrobiologi Umum Untuk Perguruan Tinggi. Departemen Mikrobiologi Fakultas Pertanian UGM. Yogyakarta. Hal : 211-213
Laay, B. dan S. Hastowo., 1992. Mikrobiologi. Rajawali Press. Jakarta.Hal : 28-31
Lehninger, A. 1988. Dasar-dasar Biokimia. Penerjemah: Thenawidjaya M. Erlangga. Jakarta. Hal : 84-89
Long-Liu, L., Charng-Cherng, C and Wen-Hwei, H. 1998. Production and Properties of raw atarch-degrading amylase from the thermophilic and alkalophilic Bacillus sp.
TS-23.Biotechnol.appl. biochem. 28:61-68.
Lowry, O.H., N.J., Rosebrough, A.L., Farr, and R.J. Randall. 1951. Protein measurement with the Folin phenol reagent, J. Biol. Chem., 193-265.
Mandels, M., A. Raymond, and R. Charles. 1976. Measurement of Saccharyfying Celluase.
Biotech & Bioeng. Symp. No 6. Jhon Willey & Sons Inc.
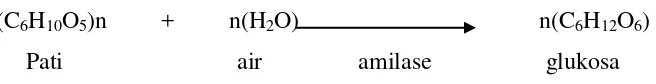


![Gambar 5. Grafik antara V dan [S] pada Persamaan Michaelis-Menten.](https://thumb-ap.123doks.com/thumbv2/123dok/275608.107293/22.612.179.463.253.392/gambar-grafik-v-s-persamaan-michaelis-menten.webp)