ABSTRAK
ISOLASI DAN KARAKTERISASI AKTIVITAS ENZIM α- AMILASE PADA KECAMBAH KEDELAI PUTIH (Glycine max (L). Merill) DAN KACANG HIJAU
(Phaseolus radiatus) DI BAWAH PENGARUH MEDAN MAGNET
Oleh
Widia Angraini
Kedelai putih (Glycine max (L.) Merill) dan kacang hijau (Phaseolus radiatus) merupakan tanaman yang banyak dimanfaatkan sebagai bahan pangan karena kandungan protein dan karbohidratnya yang sangat tinggi. Protein dan karbohidrat juga diperlukan oleh biji dalam proses perkecambahannya. Saat berkecambah, karbohidrat dalam biji dalam bentuk amilum diurai menjadi senyawa yang lebih sederhana oleh enzim α-amilase. Aktivitas enzim dapat dipengaruhi oleh faktor lingkungan, salah satunya medan magnet.
Medan magnet diketahui dapat mempercepat proses perkecambahan dan sintesis protein serta aktivitasnya di dalam sel. Namun responnya untuk setiap tanaman berbeda-beda. Tujuan penelitian ini adalah mengisolasi dan mengetahui karakterisasi α-amilase pada perkecambahan biji legum yang diberi perlakuan medan magnet. Penelitian dilaksanakan di Laboratorium Botani dan Laboratorium Biomolekuler Jurusan Biologi FMIPA Universitas Lampung pada Mei-Juli 2012. Percobaan disusun dalam Rancangan Kelompok Teracak Lengkap dengan ulangan sebagai kelompok. Untuk pengukuran enzim tiap kelompok diulang 3 kali (triplo). Perlakuan yang digunakan adalah lama pemaparan kuat medan magnet 0,1 mT terdiri dari lama control (0 menit), 7’48’’, 11’44’’ dan 15’36’’. Dan jenis legum yang digunakan yaitu kedelai putih dan kacang hijau. Parameter yang akan diukur adalah aktivitas α-amilase. Perbedaaan aktivitas α-amilase pada tiap perlakuan dianalisis dengan perbandingan rata-rata aktivitas enzim.
Hasil penelitian menunjukkan bahwa medan magnet mempengaruhi perkecambahan dan aktivitas α-amilase kecambah legum. Lama pemaparan medan magnet yang baik untuk mempercepat perkecambahan kedelai putih adalah 15’36 sedangkan untuk kacang hijau adalah 11’44’’ dan 15’36’’.
I. PENDAHULUAN
A. Latar Belakang
Tumbuhan merupakan organisme yang tidak dapat bergerak bebas yang pertumbuhan dan perkembangannya sangat dipengaruhi oleh faktor lingkungan sekitar seperti suhu,
kelembaban, cahaya, dan medan magnet.
Medan magnet dapat berpengaruh terhadap pertumbuhan berbagai jenis tanaman, namun
sampai saat ini mekanisme pengaruhnya belum bisa dijelaskan dengan baik (Saragih dkk., 2010). Pada hewan, medan listrik dan medan magnet diduga dapat menimbulkan
efek negatif. Beberapa penemuan menunjukkan bahwa medan magnet statik dapat mempengaruhi sistem biologi, khususnya pada sel yang tereksitasi seperti otot dan syaraf (Itegin dan Gunay, 1993). Pemaparan medan magnet sebesar 7 mT menyebabkan
terjadinya kerusakan DNA (Jajte et al., 2001). Menurut SITH (2009), pemaparan gelombang elektromagnetik pada suatu organisme (sel hewan dan mikroorganisme)
dapat menyebabkan perubahan pada struktur DNAnya dan akan mempengaruhi proses sintesis protein di dalamnya sehingga pada akhirnya dapat terekspresikan dalam sifat fisiologis maupun morfologis organisme tersebut.
Selain itu dengan kekuatan medan magnet sebesar 6 mT dapat menyebabkan terjadinya perubahan struktur permukaan membran plasma dan permukaan sel hewan (Chionna et
al., 2003).
Pada perlakuan selama 5 menit, efek medan magnet berpengaruh langsung terhadap
besar tegangan listrik yang digunakan maka semakin besar pula penurunan jumlah mikroorganisme. Kematian mikroba akibat pemberian magnet diduga dipengaruhi oleh
kerusakan struktur sel, seperti rusaknya membran sitoplasma sel. Meskipun secara alamiah membran sitoplasma mampu disintesis kembali tetapi dengan tegangan tinggi, kerusakan berbentuk lubang pada membran luar dari sel tidak mampu diperbaiki lagi,
sehingga memungkinkan terjadinya mobilisasi senyawa makromolekul keluar sel yang menyebabkan kematian (Alberts et al., 2002).
Dampak medan magnet pada tumbuhan menunjukkan pengaruh yang berbeda dengan terhadap sel-sel hewan. Pada tumbuhan, beberapa penelitian menunjukkan adanya
pengaruh positif dari medan magnet, misalnya untuk meningkatkan kecepatan pertumbuhan dan perkembangan tumbuhan.
Batas ambang kuat medan magnet yang aman bagi manusia menurut World Health
Organization (WHO) yaitu 0,1 mT dan ambang batas kuat medan magnet menurut International Radiation Protection Association (IRPA)adalah sebesar 0,5 mT.
Menurut Agustrina (2008), kuat medan magnet 165 A/m dapat mempengaruhi kecepatan
perkecambahan kedelai dan kacang hijau. Adanya medan magnet dapat membuat biji mampu berkecambah dengan cepat namun tidak berpengaruh secara signifikan terhadap
peningkatan laju pertumbuhan kecambah tersebut. Perkecambahan dan pertumbuhan biji sangat dipengaruhi oleh ketersediaan air dalam medium pertumbuhan untuk diabsorbsi. Air dapat memacu aktivitas enzim-enzim metabolisma perkecambahan. Pemaparan
medan magnet dapat menyebabkan meningkatnya potensial air dan dapat mempercepat hidrasi air pada sel biji. Menurut Aladjadjian dan Ylieva (2003), pengaruh medan
dan menyerap energi medan magnet yang kemudian ditransformasikan secara kimia sehingga meningkatkan jumlah energi yang diserap oleh biji.
Pemaparan kuat medan magnet 200 μT pada benih gandum dan biji bunga matahari
dapat meningkatkan laju perkecambahannya (Nagy, dkk, 2005) Kuat medan magnet
sebesar 581 A/m dapat mempengaruhi panjang batang, berat basah, berat kering, dan lebar berkas pengangkut pada perkecambahan kedelai (Glycine max (L.) Merill)
(Kamelia, 2005).
Saat berkecambah, biji memerlukan enzim perkecambahan sebagai katalisator berbagai
proses biokimia. Enzim yang sangat penting sebagai pengontrol perkecambahan biji adalah enzim α – amilase yang berperan dalam menguraikan cadangan makanan tersedia
dalam bentuk amilum menjadi senyawa yang lebih sederhana sehingga dapat
dimanfaatkannya sebagai sumber energi untuk perkecambahan. Enzim adalah protein
yang sangat peka terhadap pengaruh fisik dan kimia, sehingga struktur molekulnya dapat dengan mudah mengalami perubahan bentuk atau modifikasi (SITH, 2009). Hal-hal yang dapat menyebabkan modifikasi struktur protein suatu organisme antara lain adalah
pH, panas, aliran listrik, medan magnet dan beberapa zat kimia.
Biji kedelai putih dan kacang hijau digunakan sebagai tanaman uji dalam penelitian karena kedelai merupakan tanaman pangan dengan kandungan karbohidrat dan protein yang sangat tinggi juga nilai ekonomi yang tinggi, Kedelai dan kacang hijau
dimanfaatkan dalam jumlah banyak untuk keperluan industri, misalnya industri kecap, tempe, minuman ringan dan lain sebagainya. Karena permintaan pasar yang cenderung
menghasilkan kedelai dan kacang hijau yang berkualitas baik dan menghasilkan produksi yang tinggi untuk memenuhi kebutuhan pasar. Selain itu, pertumbuhan kedelai dan
kacang hijau juga relatif cepat dan memungkinkan untuk tumbuh di dalam skala laboratorium.
Hasil penelitian sebelumnya menunjukkan bahwa kuat medan magnet 0,1 mT sampai dengan 50 mT dapat mempengaruhi pertumbuhan. Penelitian tentang pengaruh medan
magnet terhadap tanaman tomat menunjukkan bahwa lama pemaparan medan magnet selama 7 menit 48 detik, 11 menit 44 detik, dan 15 menit 36 detik meningkatkan luas stomata, panjang stomata, tinggi dan berat segar tanaman, diameter parenkim, dan xilem
serta cenderung meningkatkan perkecambahan dan petumbuhan tomat (Sari, 2011).
Berdasarkan data di atas maka dalam penelitian ini digunakan kuat medan magnet 0,1 mT dengan lama pemaparan medan magnet selama 0 menit (kontrol), 7 menit 48 detik,
11 menit 44 detik , dan 15 menit 36 detik.
B. Tujuan Penelitian
Tujuan dari penelitian ini adalah:
1. Mengisolasi α- amilase dari kecambah kedelai putih dan kacang hijau yang diberi perlakuan lama pemaparan kuat medan magnet 0,1 mT yang berbeda-beda. 2. Mengetahui karakterisasi aktivitas α-amilase di dalam kecambah yang tidak
dipengaruhi kuat medan magnet dan yang dipengaruhi kuat medan magnet pada fase
perkecambahan yang berbeda.
Manfaat penelitian ini adalah untuk:
1. Mendapat isolat α-amilase dari kecambah legum yang diberi perlakuan lama pemaparan medan magnet.
2. Memperoleh informasi tentang karakterisasi α-amilase dari kecambah legum.
D. Kerangka Pemikiran
Kedelai dan kacang hijau merupakan salah satu jenis tanaman yang banyak dimanfaatkan
oleh manusia. Kandungan protein yang sangat tinggi menjadikan kedelai dan kacang hijau sebagai salah satu sumber makanan bagi manusia. Biji kedelai rendah kolesterol dan mengandung asam lemak tak jenuh yang dapat mencegah arteriosklerosis sehingga
sangat baik untuk meningkatkan kesehatan. Biji kacang hijau memiliki kandungan antioksidan yang sangat tinggi dan baik untuk menjaga keasaman lambung. Selain
memiliki kandungan protein yang tinggi di dalam bijinya, kedelai dan kacang hijau juga memiliki kandungan karbohidrat, lemak, air dan mineral lainnya.
Dalam biji kedelai dan kacang hijau, karbohidrat, protein, dan lemak digunakan sebagai sumber energi untuk perkecambahan, proses pembelahan, dan pemanjangan sel-sel kecambah. Pada awal pertumbuhan, protein berperan dalam membentuk protoplasma,
dan untuk membentuk protein lain yang nantinya akan membentuk sitoplasma, mitokondria, ribosom, nukleus, kromatin dan juga enzim-enzim.
Proses perkecambahan memerlukan sumber energi berupa glukosa yang didapat dari perombakan amilum oleh suatu enzim hidrolase yaitu amilase. Amilase yang bekerja di
Enzim α- amilase akan mengubah amilosa dan amilopektin menjadi maltosa dan glukosa serta mengubah dekstrin menjadi maltosa dan glukosa, kemudian maltosa diubah
menjadi glukosa oleh maltase. Enzim β- amilase mengubah amilosa menjadi glukosa yang larut dalam air dan dapat ditranslokasikan, sementara itu amilopektin akan diubah menjadi dekstrin yang tidak bisa ditranslokasikan. Proses pengangkutan glukosa yang
berasal dari perombakan amilum ini akan terus berlanjut sampai tanaman siap membuat sendiri makanannya.
Medan magnet telah banyak digunakan untuk mendukung pertumbuhan dan
perkembangan tanaman terutama dalam hal perkecambahan biji. Jika medan magnet
dapat memacu perkecambahan pada biji, maka diduga medan magnet juga dapat berpengaruh terhadap aktivitas α- amilase yang ada di dalam biji tersebut mengingat α
-amilase merupakan enzim yang berperan penting dalam proses perkecambahan terutama dalam perombakan amilum menjadi glukosa.
Penelitian tentang pemaparan kuat medan magnet 0,2 mT pada tanaman tomat dengan lama pemaparan selama 3 menit 54 detik , 7 menit 48 detik, 11 menit 42 detik, dan 15
menit 36 detik menyebabkan terjadinya pertambahan luas stomata, panjang stomata, pertambahan tinggi dan berat segar tanaman, pertambahan diameter parenkim, dan
pelebaran xilem. Kuat medan magnet sebesar 581 A/m dapat mempengaruhi panjang batang, berat basah, berat kering, dan lebar berkas pengangkut pada perkecambahan kedelai (Glycine max (L.) Merill). Kuat medan magnet yang dapat berpengaruh pada
Berdasarkan penjelasan di atas, maka dalam penelitian ini akan digunakan kuat medan magnet 0,1 mT dengan lama pemaparan 0 menit (kontrol), 7 menit 48 detik, 11
menit 44 detik dan 15 menit 36 detik. Penelitian ini dilakukan untuk mengamati aktivitas enzim α- amilase pada biji dan kecambah kedelai serta kacang hijau di bawah
pengaruh medan magnet.
E. Hipotesis
II. TINJAUAN PUSTAKA
A. Biologi Tanaman 1. Klasifikasi
Dalam dunia Taksonomi Tumbuhan, kedelai dan kacang hijau dapat diklasifikasikan
sebagai berikut: a. Kedelai
Secara Taksonomi, kedelai dapat diklasifikasikan sebagai berikut:
Regnum : Plantae
Divisio : Magnoliophyta
Class : Magnoliopsida Ordo : Fabales
Family : Fabaceae/ Leguminoceae
Genus : Glycine
Species : Glycine max (L). Merill (Kedelai Putih)
(Adisarwanto, 2005).
b. Kacang Hijau
Secara Taksonomi, kacang hijau dapat diklasifikasikan sebagai berikut:
Regnum : Plantae
Divisio : Magnoliophyta Class : Magnoliopsida
Ordo : Fabales
Genus : Phaseolus
Species : Phaseolus radiatus Linn (Plantamor, 2008)
2. Morfologi a. Kedelai
Kedelai merupakan tanaman dikotil semusim yang memiliki sistem perakaran tunggang, batang berkambium dan percabangan sedikit. Tinggi tanaman berkisar
10 – 200 cm, tumbuh tegak dan berdaun lebat. Morfologi daunnya beragam, ada yang berdaun lebar dan lebat, ada juga yang berdaun sempit. Tanaman yang berdaun lebar dan lebat dapat menghasilkan biji yang lebih banyak dibandingkan
dengan yang berdaun sempit (Lamina, 1989).
i) Buah
Kedelai memiliki buah yang berbentuk polong. Jumlah buah dalam tiap
tanaman bervariasi tergantung varietas, kesuburan tanah dan jarak tanam. Warna polong ketika pertama terbentuk adalah hijau, namun berubah selama proses pematangan menjadi kehitaman atau kuning kecoklatan dan berbulu.
Setiap polong berisi 1 – 4 biji, tetapi biasanya hanya 2 biji saja (Suastika dkk., 1997).
ii)Biji
Biji kedelai memiliki biji berkeping dua dengan embrio yang terletak diantara
keping biji yang tidak terbungkus kulit biji (Suprapto, 1992). Kulit biji terdiri dari tiga lapisan yaitu epidermis, hypodermis dan parenkim (Henderson, 1973;
hitam. Pada kulit biji terdapat pusar (hilum) yang berwarna coklat, hitam atau putih. Pusar biji (hilum) adalah jaringan bekas biji melekat pada dinding buah.
Di ujung pusar terdapat lubang kecil yang terbentuk pada saat pembentukan biji yang disebut mikrofil. Kedelai tidak memiliki jaringan endosperm. Bagian terbesar dari kedelai adalah kotiledon yang berisi cadangan makanan
yang mengandung karbohidrat, lemak dan protein yang akan berguna untuk proses perkecambahan. Suhu optimum untuk perkecambahan adalah 27º - 30º
C (Suprapto, 1992).
iii) Perakaran
Kedelai memiliki sistem perakaran tunggang yang terbentuk dari calon akar. Beberapa akar sekunder, cabang akar sekunder dan cabang akar adventif
tumbuh dari bagian bawah hipokotil (Adie dan Krisnawati, 2004). Akar kedelai juga seringkali membentuk akar adventif yang tumbuh dari
bagian bawah hipokotil. Pada umumnya akar adventif terjadi karena cekaman tertentu, misalnya kadar air tanah yang terlalu tinggi (Suastika dkk., 1997).
Pada akar tanaman kedelai terdapat bintil-bintil akar yang merupakan
kumpulan bakteri pengikat nitrogen, Rhizobium japonicum. Bakteri bintil akar
mampu mengikat nitrogen langsung dari udara dalam bentuk gas N2 yang
kemudian digunakan kedelai setelah dioksidasi menjadi nitrat (NO3). Terjadi
simbiosis mutualisme antara bakteri bintil akar dengan kedelai. Bakteri ini
biasanya terdapat di dalam tanah, jika tanah tersebut ditanami kedelai maka bintil akar akan mulai terbentuk dalam waktu sekitar 15-20 hari setelah tanam
iv) Batang
Batang kedelai dapat mencapai tinggi sekitar 30-100 cm. Percabangan akar sedikit, hanya sekitar 3 – 6 cabang. Banyaknya cabang ini dapat berkurang dan bahkan tidak bercabang sama sekali jika jarak antar tanaman rapat.
Batang tanaman kedelai berasal dari poros embrio, bagian atas poros berakhir dengan epikotil yang pendek dan hipokotil akan membentuk batang (Lamina,
1989).
Tipe pertumbuhan batang ada tiga, yaitu terbatas (determinate), tidak terbatas
(indeterminate), dan setengah terbatas (semi-indeterminate). Ciri khas tipe terbatas yaitu tanaman pendek sampai sedang, berbunga serentak, ujung
batang hampir sama besar dengan batang bagian tengah dan daun batang tengah sama besar dengan daun teratas. Tipe tidak terbatas mempunyai
ciri-ciri tanaman sedang sampai tinggi, ujung batang lebih kecil dari bagian tengah, berbunga secara bertahap dari bawah keatas dan tumbuh terus-menerus. Sedangkan tipe setengah terbatas memiliki ciri yang mencakup
tipe terbatas dan tidak terbatas (Pauji, 2009).
Batang kedelai berwarna ungu. Saat keping biji belum jatuh atau setelah memasuki fase kecambah, batang dapat dibedakan menjadi dua yaitu hipokotil dan epikotil. Hipokotil adalah bagian batang di bawah keping biji
v) Daun
Daun tanaman kedelai memiliki dua bentuk yang dominan, yaitu bentuk saat
stadia kotiledon dan bentuk daun bertangkai tiga (triofoliate leaves). Bentuk daun stadia kotiledon memiliki dua helai daun tunggal dan tumbuh saat tanaman masih dalam bentuk kecambah sedangkan daun bertangkai tiga
(triofoliate leaves) tumbuh setelah tanaman melewati masa perkecambahan (Adisarwanto, 2005).
Daun tunggal memiliki tangkai pendek sedangkan daun bertangkai tiga
letaknya berselang-seling. Masing-masing daun berbentuk oval hingga lancip,
tipis dan berwarna hijau. Pada ketiak tangkai daun majemuk akan muncul tunas atau bunga. Daun akan menguning dan gugur setelah tua dimulai dari
daun yang menempel di bagian bawah batang (Rubatzky dan Yamaguchi, 1998). Terdapat bulu-bulu halus pada permukaan daun (Adisarwanto, 2005)
Secara keseluruhan terdapat empat tipe daun pada tanaman kedelai, yaitu tipe kotiledon atau daun biji, primer sederhana, daun bertangkai tiga, dan daun
profila namun bisa juga terbentuk daun bertangkai empat ataupun lima. Daun primer berbentuk oval, berupa daun tunggal (unifoliat), panjang tangkainya
mencapai 1 – 2 cm dan letaknya bersebrangan dengan buku pertama di atas kotiledon (Hidayat, 1985).
vi)Bunga
Kedelai memiliki bunga yang bergerombol. Bunga tersebut terdiri dari 3 –
bunga yang terdiri dari 5 petala yang menutupi sebuah pistilum dan 10 stamen atau benang sari. Stamen kesepuluh terpisah bebas dan Sembilan stamen
lainnya membentuk seludang yang mengelilingi putik (Poehlman dan Sleper, 1995).
Bunga kedelai berwarna lembayung atau putih dan kecil. Bentuk
pembungaannya berupa tandan aksilar atau terminal berisi 3 – 30 kuntum bunga. Benang sari berupa bonggol dan daun kelopak berbentuk tabung.
Bentuk polong agak bengkok dan pipih biasanya berisi dua atau tiga butir biji tetapi ada juga yang berisi lima butir biji (Maesen dan Somaatmadja, 1992).
Kedelai memiliki bunga sempurna yaitu mempunyai alat kelamin jantan dan betina. Bunganya terletak pada ruas – ruas batang dengan warna ungu atau
putih. Penyerbukan terjadi saat mahkota bunga masih menutup sehingga kemungkinan kawin silang alami sangat kecil. Walau telah terjadi
penyerbukan secara sempurna, tidak semua bunga dapat menjadi polong karena 60% bunga rontok sebelum membentuk polong (Adisarwanto, 2005).
b. Kacang Hijau
Tanaman kacang hijau dapat ditemui di seluruh tempat di Indonesia. Tanaman ini
dapat tumbuh di dataran rendah maupun pada ketinggian 500 m di atas permukaan laut. Jenis kacang hijau yang biasa diperdagangkan adalah jenis kacang hijau dengan biji besar dan kacang hijau dengan biji kecil. Biasanya, kacang hijau biji
i) Buah
Buah kacang hijau berbentuk polong yang bulat silindris atau pipih dengan
ujung agak runcing atau tumpul dengan panjang polong berkisar 5-16 cm. Setiap polong berisi 10-15 biji. Polong muda berwarna hijau dan akan
berubah menjadi kecoklatan atau kehitaman setelah tua. Pada polong terdapat
rambut-rambut pendek atau bulu (Purwono dan Hartono, 2005).
ii) Biji
Biji kacang hijau memiliki ukuran yang lebih kecil dibandingkan dengan biji kacang lainnya. Kebanyakan warna bijinya adalah hijau kusam atau hijau
mengkilap, namun ada juga yang berwarna kuning kecoklatan atau kehitaman dan coklat (Andrianto dan Indarto, 2004).
iii) Perakaran
Sistem perakaran kacang hijau adalah tunggang dengan cabang yang banyak. Berdasarkan penyebaran cabang-cabang akarnya, sistem perakaran kacang hijau dikelompokkan kedalam dua kategori yaitu mesophytes dan xerophytes.
Sistem perakaran mesophytes mempunyai banyak cabang akar pada
permukaan tanah dengan tipe pertumbuhannya menyebar, sistem perakaran
xerophytes memiliki akar cabang lebih sedikit dan memanjang ke arah bawah (Purwono dan Hartono, 2005). Pada akar tanaman kacang hijau terdapat nodul atau bintil akar. Semakin banyak nodul akarnya maka akan semakin
iv)Batang
Kacang hijau memiliki batang yang berukuran kecil, berbulu, berwarna hijau
kemerahan atau kecoklatan. Batang berbentuk bulat dan berbuku-buku. Setiap buku menghasilkan satu tangkai daun, kecuali untuk daun pertama yang terbentuk sepasang dan letaknya saling berhadapan. Batang tumbuh tegak
mencapai ketinggian 30-110 cm dan cabangnya tersebar kemana-mana (Rukmana, 1997).
v) Daun
Kacang hijau memiliki daun trifoliate, tterdiri dari 3 helaian, bentuk daun
terletak bersilangan. Tangkai daun berwarna hijau tua atau hijau muda dengan panjang tangkai melebihi panjang daun (Andrianto dan Indarto, 2004).
vi) Bunga
Bunga kacang hijau termasuk bunga kupu-kupu dan merupakan bunga berumah satu atau memiliki kelamin ganda. Bunga berwarna kuning
kehijauan atau kuning pucat. Proses penyerbukan terjadi pada malam hari. Pada pagi hari bunga akan mekar dan menjadi layu pada sore hari (Purwono
dan Hartono, 2005).
3. Manfaat
Kedelai banyak digunakan sebagai bahan makanan karena memiliki kandungan protein yang tinggi. Pada tubuh manusia, protein berfungsi sebagai pembangun
Kedelai mengandung isoflavin yang mampu mencegah penyakit kanker, seperti kanker paru-paru, kanker usus, kanker perut dan kanker rahim. Isoflavin kedelai
ternyat juga bersifat antiaging yang sangat baik untuk membantu menangkal radikal bebas yang dapat menyebabkan penuaan dini. Kandungan serat cepat larut
dalamkedelai dapat menurunkan kolesterol dalam darah dan juga gula dalam darah
sehingga membantu mencegah terjadinya diabetes. Serat kasar pada kedelai terdiri dari zat-zat pembakar lemak dalam tubuh, usus dan pembuluh darah yang mampu
mencegah terjadinya Atherosclerosis. Kedelai juga mengandung banyak kalsium sehingga membantu mencegah osteoporosis (Ihsan, 2011).
Kacang hijau banyak dimanfaatkan sebagai bahan pangan. Kandungan protein yang
dimilikinya juga tinggi dan sangat baik bagi tubuh manusia. Kacang hijau
mengandung kalsium dan fosfor yang bermanfaat untuk memperkuat tulang. Asam
folat yang terkandung dalam kacang hijau juga sangat penting untuk ibu hamil karena sangat baik bagi perkembangan saraf bayi di dalam kandungan dan juga untuk
meningkatkan kecerdasan bayi. Kacang hijau juga dapat mengobati berbagai macam
penyakit seperti beri -beri, radang ginjal, tekanan darah tinggi, keracunan alkohol dan pestisida, mengurangi gatal karena biang keringat, muntaber, menguatkan fungsi
limpa dan lambung, impotensi, TBC, jerawat, mengatasi flek hitam di wajah, dan menurunkan demam.
B. Perkecambahan
Perkecambahan merupakan suatu rangkaian peristiwa penting yang terjadi pada biji
ini dipengaruhi oleh viabilitas biji, usaha pemecahan dormansi, air dan juga kondisi lingkungan (Haryadi, 1979). Menurut Copeland (1972) perkecambahan adalah suatu
aktivitas pertumbuhan dan perkembangan embrio dari biji sampai menjadi tanaman muda (Abidin, 1984).
Dalam proses berkecambah, terdapat perubahan morfologi, fisiologi dan biokimia pada biji tersebut. Ada lima tahap dalam proses perkecambahan:
1. Imbibisi
Perkecambahan biji dimulai dengan proses penyerapan air oleh biji diikuti dengan
melunaknya kulit biji serta terjadinya hidrasi sitoplasma. Suplai oksigen ke sel-sel hidup akan meningkat jika dinding sel kulit biji dan embrio menyerap air sehingga
menyebabkan pernafasan menjadi aktif (Manurung dan Ismunadji, 1988; Kozlowski, 1972b).
Imbibisi pada perkecambahan biji dipengaruhi oleh beberapa faktor internal dan eksternal. Faktor internal yang berpengaruh yaitu permeabilitas selaput biji, luas
permukaan biji, komposisi kimia air pada biji, sedangkan faktor eksternalnya yaitu suhu, tekanan osmotik air dan lama imbibisi. Peningkatan kadar air pada biji selain
dapat meningkatkan suplai oksigen ke sel- sel juga dapat mengaktifkan enzim-enzim hidrolase untuk perombakan cadangan makanan (Mugnisyah, 1999).
2. Proses aktivasi enzim dan kegiatan-kegiatan di dalam sel serta naiknya respirasi.
3. Penguraian cadangan makanan seperti karbohidrat, protein, lemak menjadi bentuk yang dapat larut dalam air sehingga mudah ditranslokasikan ke bagian-bagian sel
cadangan makanan yang terdapat pada kotiledon. Enzim- enzim yang berperan
dalam proses pencernaan cadangan makanan pada kotiledon adalah enzim α-amilase,
β- amilase dan protease.
4. Proses asimilasi cadangan makanan yang telah diurai kedaerah meristematik yaitu ke bagian embrio untuk digunakan sebagai energi dalam pembentukan sel-sel baru
(Sutopo, 1988).
5. Proses pertumbuhan dan pembelahan sel terjadi di daerah titik tumbuh embrio/ zigot
(Sutopo, 1988).
Ada dua macam tipe perkecambahan biji, yaitu perkecambahan epigeal dan hipogeal.
1. Perkecambahan epigeal
Dalam perkecambahan ini, hipokotil tumbuh memanjang sehingga plumula dan
kotiledon terangkat ke atas (permukaan tanah). Kotiledon dapat melakukan fotosintesis selama daun belum terbentuk. Contoh tumbuhan yang mengalami
perkecambahan ini adalah kacang hijau, kedelai, bunga matahari dan kacang tanah. Organ pertama yang muncul ketika biji berkecambah adalah radikula. Radikula ini kemudian akan tumbuh menembus permukaan tanah. Untuk tanaman dikotil yang
dirangsang dengan cahaya, ruas batang hipokotil (daun lembaga) akan tumbuh lurus ke permukaan tanah mengangkat kotiledon dan epikotil. Epikotil akan memunculkan
daun pertama kemudian kotiledon akan rontok ketika cadangan makanan di dalamnya telah habis digunakan oleh embrio (Campbell et al., 2009).
Dalam proses perkecambahan ini, epikotil tumbuh memanjang kemudian plumula tumbuh ke permukaan tanah menembus kulit biji. Kotiledon akan tetap berada di
dalam tanah. Contoh tumbuhan yang mengalami perkecambahan ini adalah kacang ercis, kacang kapri, jagung, dan rumput-rumputan.
Gambar 1. Perkecambahan biji (Campbell et al., 2009)
Biji yang berkecambah belum memiliki kemampuan untuk mensintesis cadangan makanan sendiri. Kebutuhan karbohidrat didapatkan dari cadangan makanan yang telah ada, yaitu pada kotiledon. Umumnya cadangan makanan pada biji berupa
amilum (pati). Pati tidak dapat ditransportasi ke sel-sel lain, oleh karena itu pati harus diubah terlebih dahulu kedalam bentuk gula yang terlarut dalam air
(Dwidjoseputro, 1978).
Secara morfologis, perkecambahan adalah suatu proses yang meliputi pembelahan
dan pemanjangan sel yang dikaitkan dengan pertumbuhan aksis embrionik.
Pertumbuhan aksis embrionik adalah proses keluarnya radikula dan plumula dari kulit
Pertumbuhan aksis embrionik terjadi karena dua peristiwa yaitu pembesaran sel yang
telah ada sebelumnya dan pembentukan sel-sel baru. Sel-sel baru terbentuk karena proses pembelahan sel yang terjadi pada titik tumbuh radikula dan plumula. Proses-proses yang terjadi pada saat pembesaran sel adalah Proses-proses biokimia, air, gula, asam
amino, perubahan ion-ion organik menjadi protein, asam nukleat, polisakarida serta molekul-molekul kompleks lainnya. Senyawa yang dihasilkan oleh proses-proses itu
selanjutnya akan diubah menjadi organela, dinding sel, membran sel dan lain-lain sampai terbentuk suatu jaringan dan organ (Salisbury, 1995).
Secara fisiologis, perkecambahan merupakan proses terjadinya sejumlaah perubahan fisiologis pada embrio dalam benih yang berada dalam kondisi dorman sehingga
menyebabkan ia berkembang menjadi tumbuhan muda.
Proses perkecambahan secara fisiologis terdiri dari 3 tahapan, yaitu:
1. Perembesan air kedalam benih (imbibisi) 2. Pengaktifan proses metabolisme, dan 3. Perkecambahan (Kozlowski, 1972b).
Perkecambahan biji dimulai dengan proses penyerapan air oleh biji diikuti dengan
melunaknya kulit biji serta terjadinya hidrasi sitoplasma. Suplai oksigen ke sel-sel hidup akan meningkat jika dinding sel kulit biji dan embrio menyerap air sehingga menyebabkan pernafasan menjadi aktif. Proses perkecambahan dapat terjadi jika kulit
Dalam tahap ini, kadar air benih naik menjadi 25-35%, sehingga kadar air di dalam benih itu mencapai 50-60%, dan hal ini menyebabkan pecah atau robeknya kulit
benih. Air juga merupakan sarana masuknya oksigen ke dalam biji. Dinding sel yang kering hampir tidak permeabel untuk gas, tetapi apabila dinding sel diimbibisi oleh air , maka gas akan masuk kedalam sel secara difusi. Hal tersebut dikarenakan selain
membutuhkan air, biji yang akan berkecambah juga memerlukan suhu sekitar 10-40°C dan oksigen. Apabila dinding sel kulit biji dan embrio menyerap air, maka
suplai oksigen yang disalurkan ke sel-sel hidup meningkat sehingga proses pernafasan menjadi lebih aktif. Sebaliknya CO2 yang dihasilkan oleh pernafasan tersebut lebih
mudah untuk berdifusi keluar (Manurung dan Ismunadji, 1988 Kozlowski, 1972b).
Pada tahap pengaktifan metabolisme, kadar air dalam benih bertambah menjadi
30-40%. Laju respirasi yang meningkat akibat imbibisi akan mengaktifkan enzim-enzim yang terdapat dalam biji sehingga terjadi proses perombakan cadangan makanan
(katabolisme). Enzim-enzim yang teraktifasi pada proses perkecambahan ini adalah enzim hidrolitik seperti:
a. α-amilase dan β-amilase, merombak pati menjadi gula (glukosa, fruktosa, dan
sukrosa),
b. Ribonuklease, merombak ribonukleotida endo-α-glukanase,
c. Glukanfosfatase, merombak senyawa yang mengandung P, d. Lipase, merombak lemak menjadi gliserin dan asam lemak, e. Protease, merombak senyawa protein menjadi asam amino.
Proses penguraian cadangan makanan biji terjadi agar zat-zat makanan tersebut dapat terlarut dalam air sehingga bisa diedarkan keseluruh bagian dari biji terutama pada
difusi atau osmosis antar sel dan digunakan sebagai energi untuk pertumbuhan. Perombakan cadangan makanan melibatkan dua proses, yaitu: katabolisme
karbohidrat, anabolisme dan metabolisme lemak (Kozlowski, 1972b; Mayer dan Poljakoff-Mayber, 1989).
Dalam proses katabolisme akan dihasilkan ATP. Proses anabolisme (sintesis protein) akan menghasilkan senyawa protein. Protein katabolisme dan anabolisme terjadi
secara berurutan. Hasil dari kedua proses ini akan digunakan untuk pembentukan sel-sel baru, pembentukan protoplasma dan organela sel-sel baru untuk keperluan
perkecambahan dan pertumbuhan kecambah selanjutnya. Proses metabolisme lemak
terjadi setelah semua proses imbibisi, aktivasi enzim, dan katabolisme cadangan makanan berjalan. Melalui proses ini lemak akan dirombak oleh enzim lipase dan
enzim lainnya, yang mendorong inisiasi pertumbuhan embrio. Keseluruhan proses perombakan cadangan makanan ini akan berlangsung terus dan merupakan
pendukung dari pertumbuhan kecambah sampai tanaman dewasa (Kozlowski, 1972b; Mayer dan Poljakoff-Mayber, 1989).
C. Enzim Amilase
Enzim merupakan protein, yaitu suatu polipeptida yang mempunyai bobot molekul yang
sangat bervariasi. Disamping berat molekul yang berbeda- beda protein mempunyai sifat yang berbeda-beda pula. Ada protein yang mudah larut dalam air, tetapi ada juga yang sukar larut dalam air. Protein sangat peka terhadap pengaruh fisika dan zat kimia. Dengan
adanya pengaruh tersebut dapat menyebabkan perubahan dalam struktur molekulnya. Perubahan fisik yang terlihat saat protein mengalami perubahan dalam strukturnya
terjadi koagulasi dan kemudian presipitasi. Hal-hal yang dapat menyebabkan protein mengalami perubahan struktur molekul dan terdenaturasi antara lain adalah pengaruh
suhu, pH, aliran listrik, medan magnet dan juga gaya tekanan (Poedjadi, 2009).
Enzim amilase merupakan salah satu jenis enzim hidrolase. Enzim amilase berperan
dalam perombakan amilum menjadi glukosa, fruktosa ataupun sukrosa. Ada dua macam enzim amilase yaitu α-amilase dan β-amilase (Dwijoseputro, 1987).
Enzim amilase tergolong dalam endoenzim karena dapat memecah pati secara acak pada bagian dalam molekul. Setiap molekul enzim mengandung satu ion Ca2+ (Winarno, 1983).
Enzim amilase dapat bekerja secara optimal pada pH 5 – 7. Enzim ini sangat stabil bila
dipanaskan pada suhu-suhu tertentu. Suhu yang optimal untuk aktivitas enzim amilase adalah 40 – 80ºC (Wirahadikusumah, 1989).
Enzim β- amilase mempunyai nomor E.C. 3.2.1.2, berdasarkan nomenklatur bernama 1,4
–α – glukanmaltohidrolase. Enzim ini dapat memecah ikatan glikosidik mulai dari
gugus reduksi suatu rantai substrat (Winarno, 1983).
Enzim α-amilase mempunyai nomor kode E.C 3.2.1.1, berdasarkan nomenklatur
bernama 1,4 –α – glukanglukanohidrolase. Enzim ini terdapat pada tanaman, jaringan mamalia dan mikrobia (Winarno, 1983). Enzim amilase terdapat pada semua tumbuhan
rasa yang manis, rasa manis ini berasal dari perombakan amilum menjadi glukosa oleh enzim amilase (Hgenimana, 1994)
Penelitian tentang enzim amilase yang pernah dilakukan adalah tentang aktivitas dan karakteristik enzim amilase pada biji nangka, kedelai, jagung, sorgum, kacang hijau,
wijen, gandum dan jarak kepyar.
Seperti dalam organisme lainnya, biji kedelai dan kacang hijau juga memiliki sejumlah enzim yang berperan dalam proses biokimia yang terjadi di dalam sel kacang tersebut. Salah satu enzim yang memiliki peranan penting dalam pertumbuhan dan
perkembangannya adalah enzim amilase. Enzim amilase pada padi, kedelai, kacang tanah, kacang hijau dan tumbuhan lainnya merupakan enzim yang mengkatalis
pemecahan (hidrolisis) senyawa pati menjadi komponen-komponen yang lebih kecil seperti glukosa, maltosa dan limit dekstrin. Pati terdiri dari amilosa dan amilopektin.
Proses pemecahan pati dalam biji dilakukan oleh 2 macam enzim yaitu α –amilase dan β
– amilase (Abidin, 1984).
Enzim α – amilase tidak terdapat pada biji yang masih kering. Enzim ini baru terbentuk
ketika awal proses perkecambahan. Pembentukan enzim ini dipicu oleh hormon
giberelin. Enzim β – amilase sudah terdapat pada biji sejak awal (Kamil, 1982).
Giberelin akan disintesis di dalam embrio bersamaan dengan proses imbibisi. Giberelin kemudian akan melewati lapisan aleuron dan masuk ke dalam endosperm melalui proses
difusi. Sel-sel lapisan aleuron kemudian akan mengalami perubahan metabolisme dan menerima stimulasi dari giberelin yang mendorong terbentuknya enzim amilase. Enzim
dan menyebabkan terjadinya proses hidrolisis senyawa pati menjadi glukosa dan maltosa (Bewley and Black, 1985).
Enzim α –amilase dan β – amilase merupakan enzim yang sama-sama berperan dalam
menguraikan amilum, namun kedua enzim ini memiliki cara kerja yang berbeda. Enzim
α – amilase akan merombak amilosa dan amilopektin menjadi glukosa dan maltosa serta
mengubah dekstrin menjadi maltosa dan glukosa. Kerja enzim α – amilase dibantu juga
oleh enzim maltase yang berfungsi mengkatalis reaksi perombakan maltosa menjadi
glukosa. Enzim β – amilase pada waktu awal perkecambahan akan merombak amilum
dalam cadangan makanan menjadi glukosa yang bersifat larut dalam air sehingga dapat
ditranslokasikan ke bagian sel-sel yang lain, sedangkan amilopektin akan dirombak oleh
enzim β – amilase menjadi dekstrin yang tidak larut dalam air. Akibat dari peristiwa ini,
pasokan glukosa ke embrio meningkat sehingga radikula akan bertambah besar dan dapat menembus kulit biji (Kamil, 1982).
Selama perkecambahan, kandungan protein meningkat. Hal ini disebabkan karena terjadinya pembentukan asam-asam amino essential yang merupakan penyusun protein
yang diperlukan untuk proses pertumbuhan kecambah (Lopez dan Escobedo, 1989).
Menurut Kruger (1991) dalam Satyanti (2001) selama perkecambahan akan terjadi peningkatan jumlah enzim lipase dan amilase yang digunakan untuk mendegradasi lemak dan karbohidrat menjadi komponen metabolik yang diperlukan untuk pertumbuhan biji.
Protein merupakan komponen dari enzim, sehingga apabila selama perkecambahan terjadi peningkatan jumlah enzim maka otomatis jumlah protein juga akan semakin
Untuk memperoleh enzim amilase dari biji suatu tanaman dapat dilakukan melalui proses
ekstraksi dan homogenisasi. Ekstraksi enzim dilakukan dengan menggunakan blender dan pelarut buffer. Setelah di blender, homogenate disaring kemudian disentrifugasi berdasarkan berat partikel dan perbedaan ukuran yang tersuspensi. Partikel-partikel yang
berbeda bentuk dan berat molekul ini kemudian akan mengendap dengan kecepatan yang berbeda beda. Setelah itu barulah enzim dapat diperoleh (Darwis dan Sukara, 1990).
Metode yang digunakan untuk mendeteksi keberadaan glukosa dalam suatu jaringan dan organ dapat dilakukan dengan Dinitrosilisilat (DNS) (Chaplin and Kennedy, 1994).
Nilai absorban glukosa diperoleh melalui pengukuran serapan sinarnya dengan
spektrofotometer yang kemudian dapat digunakan untuk melihat aktivitas enzim α
-amilase. Satu unit aktivitas enzim amilase merupakan satu μ mol produk glukosa yang terbentuk dari amilum per satuan waktu inkubasi dalam keadaan optimal (Nurhalim,
1992).
Selain dengan metode DNS, pengukuran keberadaan glukosa untuk mengetahui aktivitas
enzim amilase dapat juga dilakukan dengan metode Samogyi – Nelson dan metode Fuwa (Mulyani, 2011).
Metode Samogyi - Nelson adalah metode pengujian aktivitas enzim amilase dengan berdasarkan keberadaan gula pereduksi. Enzim α – amilase dapat diketahui aktivitasnya
dengan mengukur nilai absorbansi sinar tampaknya dengan spektrofotometri pada
panjang gelombang 660 nm. Pati yang dihidrolisis oleh enzim α – amilase akan
dengan Cu-alkalis sehingga menghasilkan suatu endapan yang berwarna merah mata, endapan ini adalah bentuk dari Cu2O yang nantinya akan direaksikan lagi dengan
arsenomolibnat. Hail dari reaksi ini adalah endapan yang berwarna hijau kebiruan. Konsentrasi Cu yang tereduksi sebanding dengan konsentrasi Cu2O, sedangkan
konsentrasi Cu2O sebanding dengan konsentrasi gula pereduksi (Mulyani, 2011).
Metode Fuwa merupakan suatu metode yang digunakan untuk mengukur aktivitas enzim
amilase berdasarkan reaksi antara amilosa dengan iodine yang menghasilkan kompleks heliks yang memberikan warna biru yang khas (Mulyani, 2011).
Metode pengukuran aktivitas enzim dengan metode fuwa adalah melihat reaksi yang terjadi antara iodin dan amilum dalam sampel. Iodin yang bereaksi dengan amilum akan
menghasilkan warna biru yang khas. Menurut Nur (1989), absorbsi maksimum dari larutan berwarna pada spektrofotometer terjadi pada daerah warna yang berlawanan,
misalnya larutan merah akan menyerap radiasi maksimum pada daerah warna hijau. Dengan kata lain warna yang diserap adalah warna komplementer dari warna yang diamati.
Berikut adalah perkiraan panjang gelombang warna dalam daerah cahaya tampak pada
spektrofotometri menurut Skoog dan West (1971) :
D. Medan magnet
1. Sifat Kemagnetan Benda
Semua unsur yang terdapat di bumi,termasuk unsur-unsur hara penyusun jaringan
tumbuhan dan senyawa organik di dalam sitoplasma tumbuhan, secara kemagnetan dapat dibedakan menjadi unsur dengan sifat kemagnetan feromagnetik, paramagnetik dan diamagnetik. Unsur-unsur tersebut diduga terpengaruh polarisasi/ magnetisasinya
oleh keberadaan medan magnet di sekitarnya. Medan magnet yang terdapat di sekitar unsur yang mempunyai sifat kemagnitan paramagnetik dan feromagnetik dapat
menyebabkan kedua unsur tersebut mengalami magnetisasi yang searah dengan medan magnet tersebut, sedangkan bila medan magnet tersebut terdapat di sekitar
unsur dengan sifat kemagnetan diamagnetik dapat menyebabkan unsur itu mengalami magnetisasi dengan arah yang berlawanan dengan medan magnet yang
mempengaruhinya itu (Reitz, dkk., 1994).
Paramagnetisme merupakan suatu bentuk magnetisme yang hanya terjadi karena
adanya suatu medan magnet eksternal. Material paramagnetik tertarik oleh medan magnet sehingga memiliki permeabilitas magnetis relatif lebih besar dari satu. Unsur yang bersifat paramagnetik tidak dapat mempertahankan magnetismenya atau daya
Ferromagnetisme adalah sebuah fenomena dimana sebuah material dapat mengalami magnetisasi secara spontan, dan merupakan satu dari bentuk kemagnetan yang paling
kuat (Alonso dan Finn, 1992).
Diamagnetisme adalah sifat suatu benda untuk menciptakan suatu medan magnet
ketika dikenai medan magnet. Sifat ini menyebabkan efek tolak menolak.
Diamagnetik merupakan salah satu bentuk magnet yang cukup lemah (Alonso dan
Finn, 1992).
Pemaparan medan magnet dapat berpengaruh terhadap protein. Protein dapat mengalami perubahan dalam struktur molekulnya dan dapat menyebabkan protein
tersebut terdenaturasi. Medan magnet mempengaruhi pergerakan muatan-muatan dalam protein dan juga ikatan penyusun protein tersebut.
Beberapa jenis ikatan tersebut misalnya, yaitu : a. Ikatan elektrostatik.
b. Ikatan hidrogen.
c. Interaksi hidrofob antara rantai seeping non polar. d. Interaksi dipol-dipol,dan
e. Ikatan disulfide yaitu suatu ikatan kovalen.
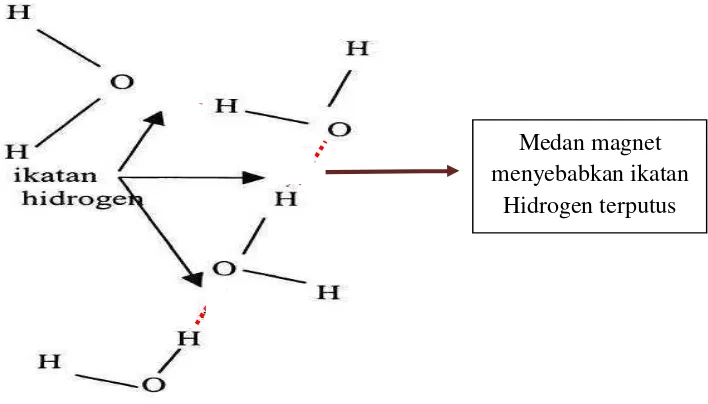
Pemaparan medan magnet dapat menyebabkan ikatan-ikatan tersebut terlepas, misalnya pada ikatan hidrogen yang terjadi antara dua rantai polipeptida atau lebih. Jika ikatan-ikatan dalam protein tersebut terlepas, protein dapat mengalami perubahan
Pada tanaman, medan magnet dapat memutuskan ikatan hidrogen dalam air sehingga menyebabkan molekul-molekul air banyak yang terbebas dan potensial air serta daya
hidrasinya meningkat (Roniyus, 2005). Apabila potensial air meningkat maka semakin cepat air menghidrasi dinding benih (Prawitasari, 2006).
Gambar 2. Ikatan Hidrogen pada molekul air (Susana, 2003)
Magnet memiliki dua kutub, yaitu kutub utara dan kutub selatan. Garis-garis medan magnet bergerak dari arah kutub utara ke arah kutub selatan magnet tersebut (Halliday
dan Resnick, 1986). Medan magnet memiliki arah gaya yang dapat digambarkan dengan garis-garis khayal. Semakin menjauh dari sumber magnet, maka akan
semakin kecil pengaruh medan magnet tersebut (Supiyanto, 2002).
Medan magnet menyebabkan ikatan
Hidrogen terputus
UTARA
N
S
Gambar 3. Arah gaya medan magnet (Storr,2012).
Adanya paparan medan magnet dapat mempengaruhi setiap unsur, molekul ataupun senyawa lainnya termasuk juga molekul-molekul penyusun jaringan tumbuhan (Agustrina, 2008). Dalam sel tumbuhan terdapat sitoplasma. Sitoplasma terdiri dari
berbagai materi kimiawi, molekul, senyawa, organel dan ion-ion yang memiliki momen dwikutub (Fessenden dan Fessenden, 1991). Ion-ion dalam sel tumbuhan
tersebut bergerak dengan arah yang tidak teratur dan menyebabkan pergerakan sitoplasma juga menjadi tidak beraturan (Agustrina, 2008).
2. Induksi Magnetik Sumbu Solenoida
Solenoida merupakan suatu rangkaian kawat tembaga yang terdiri dari loop-loop.
Rangkaian kawat ini akan menghasilkan medan magnet jika dialiri dengan arus listrik. Solenoida dapat dimanfaatkan sebagai sumber medan magnet buatan
(Giancoli, 2001).
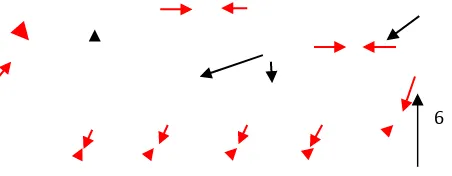
Arus listrik berputar berlawanan arah dengan jarum jam, medan magnet mengarah ke atas
I B
Magnet secara umum dibedakan menjadi dua, yaitu magnet alami dengan sifat kemagnetan tetap dan magnet buatan dengan sifat kemagnetan yang tidak tetap.
Medan magnet buatan dapat dibuat dari benda-benda logam yang dialiri dengan arus listrik. Besarnya medan magnet yang di inginkan dapat dibuat dengan menyesuaikan arus listrik yang dialirkan pada benda logam tersebut (Maharta, 1999).
Arah medan magnetik dapat ditentukan dengan aturan tangan kanan. Jika arah arus
sesuai dengan arah melingkar jari tangan kanan arah ibu jari menyatakan arah medan magnet.
Gambar 5. Kaidah tangan kanan (Agung, 2009)
Besar induksi magnetik pada solenoida ditentukan pada pusat sumbu dan ujung sumbu solenoida. Besar induksinya dapat diturunkan dari hukum Biot-Savart
(Tripler, 1996).
Keterangan:
B = kuat medan magnet pada titik P (Tesla)
μ0 = adalah permeabilitas ruang hampa (Wb/Am)
n = jumlah lilitan persatuan luas panjang (m-1)
a = jarak dari ujung atas lilitan kawat tembaga ke ujung atas tabung
silinder (m)
b = jarak dari ujung bawah lilitan kawat tembaga ke ujung bawah tabung silinder (m)
III. METODE PENELITIAN
A. Waktu dan Tempat Penelitian
Penelitian dimulai bulan Juni 2012 di Laboratorium Botani dan Laboratorium Molekuler, Jurusan Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas
Lampung.
B. Alat dan Bahan 1. Alat
Alat-alat yang digunakan dalam penelitian ini adalah solenoid dengan kuat medan
magnet sebesar 0,1 mT yang terdapat di Laboratorium Botani, cawan petri, gelas ukur, micropipet, microtube, jarum suntik 1mL dan 5mL, spatula, tabung reaksi, waterbath shaker, kompor listrik, alu dan mortal, neraca analitik, neraca Ohaus,
kertas merang, aluminium foil, tissue, pinset, plastik untuk pembuatan es, botol-botol kecil untuk tempat larutan (buffer, iodine, pati), sentrifuge, spektrofotometri, alat
tulis, dan kertas label.
Gambar 6. Medan magnet dan solenoida (Agustrina, 2008).
2. Bahan
Bahan-bahan yang digunakan dalam penelitian ini adalah kacang hijau dan kedelai putih, antibiotik chloramphenicol dan amoxcilin, buffer phosfat 200mL dengan pH 6, substrat enzim (pati), akuades, larutan iodine, larutan HCl I N dan es batu.
C. Pelaksanaan Penelitian 1. Persiapan Bahan
Kegiatan persiapan bahan meliputi:
a. Pemilihan biji
Biji kedelai putih diperoleh dari BPSB (Balai Pengawasan Sertifikasi Benih) Tanaman Lampung dan biji kacang hijau diperoleh dari kebun petani di Natar,
Lampung Selatan.
Kedelai putih yang digunakan adalah varietas Wilis dan kacang hijau yang
digunakan adalah varietas lokal. Biji dipilih dalam ukuran dan bentuk yang seragam (berasal dari jenis yang sama). Biji pilihan kemudian dimasukkan kedalam cawan petri yang telah dilapisi dengan kertas merang. Satu cawan petri
bisa diisi dengan 20 biji. b. Pembuatan larutan iodine
6
Sebanyak 2 gram KI dimasukkan kedalam 10 mL akuades. Kemudian ditambahkan dengan 0,2 gram I2. Setelah semuanya larut, lalu ditambahkan
akuades sampai volume akhir mencapai 100 mL (yang ditambahkan kira-kira 90 mL).
c. Pembuatan buffer Phosfat pH 6
Sebanyak 27,598 gram NaH2PO4 dilarutkan ke dalam 1000 mL akuades. Hasil
yang didapat adalah larutan NaH2PO4 0,2 M. Lalu sebanyak 35, 598 gram
Na2HPO4 juga dilarutkan kedalam 1000 mL akuades. Hasil yang didapat adalah
larutan Na2HPO4 0,2 M.
Buffer yang digunakan sebanyak 200 mL. 100 mL berasal dari campuran
NaH2PO4 dan Na2HPO4 (jumlah yang dicampurkan dari tiap-tiap larutan
disesuaikan dengan pH yang diinginkan, kemudian campuran tersebut ditambah
dengan 100 mL akuades.
x mL NaH2PO4 + y mL Na2HPO4 larutan 200 mL (pH 6)
A. 0,2 M NaH2PO4 diambil sebanyak 87,7 mL
B. 0,2 M Na2HPO4 diambil sebanyak 12,3 mL
Kedua larutan dicampur kemudian ditambah dengan 100 mL akuades. Setelah
itu, larutan di tempatkan dalam suatu botol dan ditutup dengan aluminium foil. d. Pembuatan substrat enzim
Pati ditimbang sebanyak 0,1 % dari 200 gram pati, yaitu sebanyak 0,2 gram. Setelah ditimbang, pati ditaruh di dalam Erlenmeyer dan ditambah 200 mL akuades. Larutan pati kemudian di panaskan sampai mendidih di tas kompor
2. Perlakuan Kecambah
Sebanyak 20 biji kedelai dan kacang hijau ditaruh dalam cawan petri yang sudah
dilapisi dengan kertas merang dan diberi akuades kemudian ditetesi dengan tiga tetes larutan amoxcilin dan tiga tetes chloramphenicol. Untuk uji kontrol, kedelai dan kacang hijau hanya direndam dalam akuades dan antibiotik. Untuk uji sampel,
kedelai dan kacang hijau direndam dengan akuades yang ditambah dengan antibiotik selama 15 menit kemudian diberi perlakuan kuat medan magnet 0,1 mT dengan lama
pemaparan selama 7 menit 48 detik, 11 menit 44 detik, dan 15 menit 36 detik, setelah itu dilakukan pengamatan/ pengukuran sesuai dengan waktu yang ditentukan.
Pengukuran aktivitas enzim α-amilase kecambah kedelai dan kacang hijau ini
dilakukan berdasarkan:
1. Kecambah utuh (kotiledon dan hipokotil) saat:
- Umur kecambah (12 jam, 1 hari, 2 hari, 3 hari, 4 hari, 5 hari, 6 hari, dan 7
hari).
- Tinggi hipokotil (1 cm, 3 cm, 5 cm, 7 cm, dan 9 cm).
Gambar 7. Kotiledon dan hipokotil (Geochembio, 2012). 2. Kotiledon kecambah pada saat tinggi hipokotil 1 cm, 3 cm, 5 cm, 7 cm, dan 9 cm.
Gambar 8. Kotiledon (Geochembio, 2012). Kotiledon
3. Hipokotil kecambah pada saat tinggi hipokotil 1 cm, 3 cm, 5 cm, 7 cm, dan 9 cm.
Gambar 9. Hipokotil (Geochembio, 2012)
Setiap bagian kecambah yang diukur diambil sebanyak 0,5 gram
4. Ekstraksi Enzim
Untuk mendapatkan ekstrak enzim, sample kecambah tanpa kulit biji ditimbang sebanyak 0,5 gram lalu digerus di dalam mortal dengan suhu 4ºC (dalam wadah yang berisi es batu) dan ditambah 2 mL buffer Phosfat. Kedelai yang sudah dihaluskan
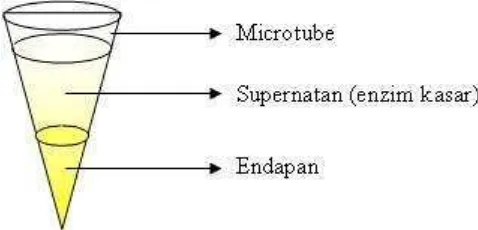
dimasukkan ke dalam microtube kemudian di sentrifuge dengan kecepatan 10.000 rpm selama tiga menit. Dengan metode sentrifuge inilah enzim yang akan diukur
aktivitasnya itu diisolasi. Bagian supernatan diambil sebagai enzim kasar (Suhari, 2001). Bagian supernatan yang diisolasi itu diukur aktivitas enzim α-amilasenya dan kemudian dapat dilihat karakterisasinya. Pembagian antara supernatan dan endapan
dalam microtube setelah di sentrifuge dapat dilihat pada Gambar 9.
5. Pengujian Aktivitas Enzim α-amilase
Pengujian aktivitas enzim α- amilase dilakukan dengan menggunakan metode Fuwa.
Metode Fuwa merupakan suatu metode yang digunakan untuk mengukur aktivitas dari enzim amilase berdasarkan reaksi antara amilosa dengan iodine yang
menghasilkan kompleks heliks yang memberikan warna biru yang khas. Untuk uji
kontrol dilakukan dengan cara menambahkan 250 μL enzim dengan 250 μL HCl 1N
di dalam tabung reaksi lalu diinkubasi dalam waterbath shaker selama 10 menit
dengan suhu 30ºC. Setelah itu, dicampur dengan 250 μL pati lalu 250 μL iodine
kemudian ditambahkan 4 mL akuades.
Untuk uji sampel, sebanyak 250 μL enzim ditambah dengan 250 μL pati di dalam
tabung reaksi lalu diinkubasi di waterbath shaker selama 10 menit pada suhu
30ºC. Setelah diinkubasi, ditambah dengan 250 μL HCl lalu 250 μL iodine
kemudian ditambah dengan 4 mL akuades.
Setelah semua larutan ditambahkan, kontrol dan sampel kemudian diukur aktivitas
enzim α-amilasenya dengan spektrofotometri. Metode yang digunakan dalam
penentuan aktivitas enzim α-amilase ini adalah dengan metode Fuwa. Panjang
gelombang yang digunakan dalam pengukuran untuk kontrol dan sampel adalah 575 nm (Skoog dan West, 1971).
Dalam penelitian penentuan aktivitas enzim α-amilase dari biji kedelai dan kacang
hijau ini, variable terikat yang digunakan adalah aktivitas enzim α-amilase yang
sedangkan variabel bebas dalam penelitian ini adalah lama pemaparan medan magnet.
Aktivitas enzim α-amilase diukur pada:
a. Kecambah utuh (kotiledon dan hipokotil) saat:
- Umur kecambah (12 jam, 1 hari, 2 hari, 3 hari, 4 hari, 5 hari, 6 hari, dan 7 hari).
- Tinggi hipokotil (1 cm, 3 cm, 5 cm, 7 cm, dan 9 cm).
b. Kotiledon kecambah pada saat tinggi hipokotil 1 cm, 3 cm, 5 cm, 7 cm, dan 9 cm. c. Hipokotil kecambah pada saat tinggi hipokotil 1 cm, 3 cm, 5 cm, 7 cm, dan 9 cm.
2. Analisis Data
Penelitian ini dilakukan dengan menggunakan Rancangan Kelompok Teracak
Lengkap dengan 3 ulangan yang dijadikan sebagai kelompok dan setiap kelompok diulang 3 kali (triplo), perlakuan menggunakan medan magnet dengan kuat medan
magnet 0,1 mT yang dibedakan berdasarkan lama pemaparan medan magnet yaitu selama:
1. 0 menit (kontrol)
2. 7 menit 48 detik 3. 11 menit 44 detik, dan
4. 15 menit 36 detik
Data yang diperoleh berupa nilai absorbansi enzim α-amilase akan dihitung
Aktivitas =A K −A S e
A K x FP X 2 X 4
Keterangan:
FP = Faktor Pengenceran
Perbedaan nilai aktivitas enzim α-amilase pada tiap-tiap lama pemaparan medan
magnet akan dianalisis dengan perbandingan rata-rata aktivitas yang diperoleh dari
V. SIMPULAN DAN SARAN
A. Simpulan
Kesimpulan yang diperoleh dari penelitian ini adalah:
1. Perlakuan pemaparan medan magnet dengan kuat medan magnet 0,1 mT pada lama
pemaparan yang berbeda-beda mempengaruhi perkecambahan dan aktivitas enzim α -amilase pada tanaman legum.
2. Lama pemaparan medan magnet yang baik untuk mempercepat perkecambahan kedelai putih adalah selama 15 menit 36 detik (15’36’’) sedangkan lama pemaparan medan magnet yang baik untuk mempercepat perkecambahan kacang hijau adalah
selama 11 menit 44 detik (11’44’’) dan 15 menit 36 detik (15’36’’).
B.Saran
ISOLASI DAN KARAKTERISASI AKTIVITAS ENZIM α- AMILASE PADA KECAMBAH KEDELAI PUTIH (Glycine max (L). Merill) DAN KACANG HIJAU
(Phaseolus radiatus) DI BAWAH PENGARUH MEDAN MAGNET
Oleh
WIDIA ANGRAINI
Skripsi
Sebagai salah satu syarat untuk mencapai gelar SARJANA SAINS
pada Jurusan Biologi
Fakultas Matematika dan Ilmu Pengetahuan Alam
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS LAMPUNG
ISOLASI DAN KARAKTERISASI AKTIVITAS ENZIM α- AMILASE PADA KECAMBAH KEDELAI PUTIH (Glycine max (L). Merill) DAN KACANG HIJAU
(Phaseolus radiatus) DI BAWAH PENGARUH MEDAN MAGNET
(Skripsi)
Oleh
WIDIA ANGRAINI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS LAMPUNG
RIWAYAT HIDUP
Penulis lahir di Baturaja, Sumatera Selatan pada tanggal 25 September 1990. Penulis merupakan anak kedua dari tiga bersaudara, putri dari
Bapak Arlius dan Ibu Indiarti. Memiliki seorang kakak perempuan bernama Siska Ariani, S.Sos., dan seorang adik laki-laki bernama Eko
Ronalddi.
Jenjang pendidikan yang pernah ditempuh penulis untuk pertama kali diawali di Taman
Kanak-kanak Aisyiah 1 tahun 1996-1997, kemudian dilanjutkan di Sekolah Dasar Negeri 08 Putri dan lulus pada tahun 2002. Setelah itu penulis melanjutkan ke Sekolah Menengah
Pertama Negeri 02 Baturaja dan lulus pada tahun 2005. Kemudian penulis menempuh pendidikan Sekolah Menengah Atas Negeri 01 Baturaja dan lulus pada tahun 2008.
Pada tahun 2008, penulis mengikuti Seleksi Penerimaan Mahasiswa Baru (SPMB) dan terdaftar sebagai mahasiswa Jurusan Biologi Fakultas Matematika dan Ilmu Pengetahuan
Alam Universitas Lampung. Selama menjadi mahasiswa, penulis aktif di organisasi
Himpunan Mahasiswa Biologi (HIMBIO) sebagai Anggota Bidang Keilmuan dan Ekspedisi (2009-2010), kemudian penulis dipercaya menjadi Sekretaris Bidang Keilmuan dan Ekspedisi
(2010-2011). Penulis pernah menjadi asisten praktikum Fisiologi Hewan 1 untuk mahasiswa Jurusan Pendidikan Biologi Fakultas Keguruan dan Ilmu Pendidikan (FKIP), Fisiologi
Tumbuhan 1, dan Ichtyologi untuk mahasiswa Jurusan Biologi Fakultas Matematika dan Ilmu
MOTTO
“Jadikanlah sabar dan shalat sebagai penolongmu. Dan sesungguhnya
yang demikian itu sungguh berat, kecuali bagi orang-orang yang
khusyu’..”
(QS.2:45), Al Quran
“Seorang yang membawa tambang lalu pergi mencari dan mengumpulkan kayu
bakar lantas dibawanya ke pasar untuk dijual dan uangnya digunakan untuk
mencukupi kebutuhan dan nafkah dirinya maka itu lebih baik dari seorang yang
meminta-minta kepada orang-orang yang terkadang diberi dan kadang ditolak”. (Mutafaq’alaih), Hadist
“Jika Allah menolong kamu, maka tak adalah orang yang dapat
mengalahkan kamu; jika Allah membiarkan kamu (tidak memberi
pertolongan), maka siapakah gerangan yang dapat menolong kamu
(selain) dari Allah sesudah itu? Karena itu hendaklah kepada
Allah saja orang-orang mukmin bertawakkal”.
(QS.3:160), Al Quran
“Allah tidak membebani seseorang melainkan sesuai dengan kesanggupannya”.
(QS.2:286), Al Quran
Sebuah kesuksesan itu tidak bisa diperoleh dengan semerta-merta.
Suatu pengorbanan yang besar menjadi warna utama dalam
MENGESAHKAN
1. Tim Penguji
Ketua : Dr. Sumardi, M.Si. ………
Sekretaris : Dra. Tundjung Tripeni H., M.S. ………
Penguji
Bukan Pembimbing : Dr. Rochmah Agustrina ………
2. Dekan Fakultas Matematika dan Ilmu Pengetahuan Alam
Prof. Suharso, Ph.D. NIP 196905301995121001
Judul Skripsi : ISOLASI DAN KARAKTERISASI AKTIVITAS ENZIM α-AMILASE PADA KECAMBAH
KEDELAI PUTIH (Glycine max (L). Merill) DAN KACANG HIJAU (Phaseolus radiatus) DI BAWAH PENGARUH MEDAN MAGNET Nama Mahasiswa : Widia Angraini
No. Pokok Mahasiswa : 0817021064
Jurusan : Biologi
Fakultas : Matematika dan Ilmu Pengetahuan Alam
MENYETUJUI 1. Komisi Pembimbing
Dr. Sumardi, M.Si. Dra. Tundjung Tripeni H., M.S. NIP. 196503251991031003 NIP. 195806241984032002
2. Ketua Jurusan Biologi FMIPA