PENDAHULUAN
Lipid peroksida merupakan suatu molekul yang terbentuk dari peroksidasi lipid, yaitu reaksi penyerangan oleh radikal bebas terhadap asam lemak tak jenuh majemuk atau poly unsaturated fatty acid
(PUFA) yang mengandung sedikitnya tiga ikatan rangkap. Reaksi ini dapat terjadi secara alami di dalam tubuh yang diakibatkan oleh pembentukan radikal bebas secara endogen dari proses metabolisme tubuh. Radikal bebas endogen antara lain bisa ditimbulkan oleh proses reduksi oksigen menjadi H2O pada rantai transpor elektron di
mitokondria.
Untuk mengontrol peroksidasi lipid dapat digunakan senyawa antioksidan yang
berperan sebagai penangkap (scavenger)
radikal bebas. Ada dua jenis antioksidan berdasarkan cara kerjanya, yaitu antioksidan pencegah yang mengurangi inisiasi rantai dan antioksidan pemutus rantai yang mempengaruhi propagasi rantai.
Diabetes melitus adalah salah satu penyakit atau kelainan metabolik yang paling sering dijumpai dalam masyarakat. Diabetes melitus ini merupakan penyakit degeneratif, yaitu penyakit akibat fungsi atau struktur dari jaringan atau organ tubuh yang secara progresif menurun karena usia atau pengaruh gaya hidup. Penderita diabetes pada umumnya mengalami hiperglikemia. Hiperglikemia ini disebabkan tubuh kekurangan insulin atau insulin yang ada tidak bekerja secara efektif, sehingga glukosa dalam darah tidak dapat dimanfaatkan oleh sel, yang kemudian memicu proses glukoneogenesis dan mobilisasi asam lemak dari jaringan adiposa untuk memenuhi kebutuhan energi sel. Mobilisasi asam lemak tersebut kemungkinan meningkatkan resiko terjadinya serangan terhadap PUFA. Oleh sebab itu, sangat mungkin ada hubungan antara hiperglikemia dengan kadar lipid peroksida pada darah dan hati seseorang.
Ada beberapa perlakuan atau kondisi dapat digunakan untuk menstimulasi terjadinya lipid peroksida seperti: defisiensi vitamin E, hiperkolesterolemia, dan kondisi hiperglikemia. Stimulasi lipid peroksida melalui kondisi hiperkolesterolemia dilakukan dengan memberikan diet lemak tinggi (Alviani 2007). Pada penelitian ini, kondisi yang dipilih untuk menstimulasi lipid peroksida adalah hiperglikemia yang diinduksi dengan cara memberikan STZ
secara intraperitoneal.
Dewasa ini penggunaan herbal dalam pengobatan komplementer dan alternatif di Indonesia kian meningkat. WHO memperkirakan 80% dari penduduk dunia saat ini menggunakan obat-obatan yang berasal dari bahan tanaman untuk berbagai aspek kesehatan masyarakat (Suganda 2002).
Selain makin populernya perilaku back to
nature, pengobatan alternatif tersebut sekaligus juga merupakan salah satu sumber pelayanan kesehatan yang mudah diperoleh, terjangkau oleh masyarakat luas, dan memiliki efek samping yang relatif kecil (aman). Convention on Biological Diversity (CBD) menyebutkan bahwa nilai pasar sediaan herbal yang meliputi produk jadi dan bahan baku mencapai US$ 43 milyar (Sampurno 2002). Berdasarkan data ini bila potensi tumbuhan obat di Indonesia dapat dikelola dengan benar maka bukan saja kebutuhan dalam negeri dapat terpenuhi, tetapi juga berpeluang menjadi sumber devisa negara. Hal ini didukung pula dengan tersedianya sumber daya alam dan keanekaragaman hayati yang berlimpah di Indonesia.
Salah satu herbal tradisional yang telah umum beredar dan dikonsumsi oleh masyarakat adalah buah pare, namun pada umumnya masyarakat hanya menggunakan pare sebagai salah satu bahan pangan dalam masakan. Beberapa sumber menyebutkan bahwa pare mengandung senyawa seperti flavonoid yang merupakan antioksidan. Sebagai antioksidan, senyawa flavonoid akan bereaksi dengan radikal bebas sehingga menghasilkan produk yang stabil sehingga kerusakan sel dapat dikurangi (Cadenas dan Packer 2002). Oleh sebab itu, pare diduga memiliki potensi antioksidan, namun pembuktian ilmiah mengenai pengaruh pemberian ekstrak pare terhadap kadar lipid peroksida hati tikus yang diinduksi dengan streptozotosin (STZ) belum ada.
2
TINJAUAN PUSTAKA
Pare (Momordica charantia)
Pare atau bitter gourd adalah tanaman yang tumbuh di daerah tropis, yaitu daerah Amazon (Amerika Selatan), Afrika Timur, Asia, dan Karibia (Taylor 2002). Di Indonesia tanaman pare hampir terdapat di seluruh daerah, sehingga dikenal dengan banyak nama lokal. Tanaman pare memiliki dua varietas yang terkenal, yaitu charantia
dan muricata. Varietas charantia disebut juga pare putih yang mempunyai ciri-ciri buah lonjong besar, berwarna hijau muda dan tidak begitu pahit. Varietas muricata lebih kecil atau pendek dan pahit.
Menurut Rukmana (1997) tanaman ini diklasifikasikan sebagai berikut: kerajaan Plantae, divisi Spermatophyta, subdivisi Angiospermae, kelas Dicotyledonae, ordo Curcubitales, famili Curcubitaceae, genus
Momordica, dan spesies Momordica
charantia L.
Rasa pahit pada daun dan buah disebabkan oleh sejenis glikosida yang disebut momordicin atau charantin. Buah pare mempunyai kegunaan yang luas, di antaranya untuk mengobati berbagai penyakit seperti diabetes, wasir, kerusakan hati, diare, sakit kuning, menambah produksi air susu ibu, sariawan, batuk, dan obat luka sehingga membuat pare digolongkan ke dalam obat-obatan tradisional.
Selain sebagai sayuran, sebagian masyarakat memanfaatkan pare untuk pengobatan berbagai jenis penyakit. Di Amerika, jus dari buah pare segar banyak dimanfaatkan untuk terapi penderita human immunodeficiency virus (HIV). Dari beberapa penelitian telah berhasil diisolasi suatu protein aktif dari biji pare yang berfungsi sebagai inhibitor sintesis protein yang dinamakan MAP 30.
Gambar 1 Buah pare
Kelompok protein ini disebut ribosom
inactivating protein atau RIP (Minami et al. 1992). Kondoe di dalam Budianto (2003) juga mengatakan bahwa RIP juga terdapat pada anggota famili Cucurbitaceae lainnya yaitu Luffa cylindrica dan Trichosantes kirilowii. Kelompok RIP ini merupakan protein yang dapat dimanfaatkan baik dalam bidang pertanian maupun kesehatan. Lin Huang et al. (1999) melaporkan bahwa MAP 30 yang diisolasi dari biji pare adalah suatu protein bioaktif yang dapat melawan sel tumor. Jackson dan Jones di dalam Budianto
et al. (2003) menyebutkan bahwa bahan aktif yang terkandung dalam buah pare, yaitu momordikosida K dan L dapat berperan dalam menghambat spermatogenesis dan bersifat reversibel, sehingga dapat digunakan sebagai kontrasepsi pada pria. Hal serupa juga dilaporkan oleh Girini et al. (2005), yakni kandungan glikosida triterpen dalam buah pare dapat menghambat motilitas dan viabilitas spermatozoa.
Tanaman pare diduga mengandung senyawa bioaktif yang bersifat hipoglikemik yaitu charantin (Taylor 2002). Senyawa ini tergolong fitosterol atau glikosida kompleks. Diduga ekstrak buah pare dapat meningkatkan laju metabolisme sel melalui peningkatan dan penggunaan glukosa oleh sel target yang efeknya bersifat antidiabetik.
Selain charantin, buah pare juga
mengandung hydroxytryptamine, vitamin A, B, dan C. Sedangkan bijinya mengandung momordisin. Buah pare juga dikatakan mengandung saponin, flavonoid, polifenol serta glikosida cucurbitacin
.
Buah pare yang dianggap baik sebagai sayuran maupun buah secara tradisional telah digunakan sebagai herbal anti-diabetes dan jus buahnya atau buah mentahnya secara ilmiah telah terbukti dapat menurunkan kadar glukosa darah pada uji dengan hewan percobaan maupun uji klinis pada manusia. Misalnya, uji ekstrak air,methanol, dan kloroform buah mentah pare pada tikus percobaan dengan dosis 20 mg/kg berat badan dapat menurunkan kadar glukosa darah puasa sebesar 48%, sebanding dengan penggunaan obat antidiabetika oral sintetik glibenklamida. Uji toksisitas yang dilakukan juga membuktikan bahwa ekstrak buah pare tersebut aman untuk dikonsumsi (Subroto 2006).
3
meningkatkan sekresi insulin, asupan glukosa jaringan, sintesis glikogen otot hati, oksidasi glukosa, dan menurunkan glukoneogenesis hati. Dalam percobaan dengan hewan pare terbukti memiliki mekanisme mirip dengan insulin dalam menurunkan kadar gula darah. Penelitian menunjukkan bahwa buah muda pare mengandung peptida aktif yang dinamakan MC6 yang berukuran 10 kD. Peptida tersebut terdiri dari 3 peptida aktif (MC6.1, MC6.2, dan MC6.3) yang terbukti
memiliki aktivitas hipoglikemik (Subroto 2006).
Dosis yang direkomendasikan untuk buah pare tergantung pada sediaannya. Dosis untuk tingtur berkisar antara 5 mL hingga 50 mL tiga kali sehari. Namun demikian, karena rasanya pahit maka sediaan pare dapat juga berbentuk tablet atau kapsul. Dosis untuk kapsul yang berisi bubuk kering berkisar antara 3-15 g/hari atau bila dalam bentuk ekstrak kering setara dengan 100-200 mg, 3 kali sehari.
Paten terbaru tentang pare di Kantor Paten Amerika Serikat yang diberikan kepada Pushpa Khanna dari India dengan no. US6,831,162 B2 lebih mengungkap khasiat biji buah pare sebagai antidiabetes. Paten tersebut mengungkap tentang isolasi senyawa yang dinamakan polipeptida-K dari biji buah pare. Senyawa dalam bentuk bubuk amorf tersebut diformulasikan dalam berbagai bentuk seperti tablet dan produk-produk
edible seperti biskuit dan permen karet yang tidak ditelan dengan segera.
Uji klinis yang dilakukan terhadap lebih dari 500 pasien diabetes menunjukkan bahwa sediaan yang mengandung 12 mg hingga 70 mg polipeptida-K tersebut cukup efektif dalam mengaktifkan insulin yang sudah non-aktif dan dapat meremajakan pankreas tergantung dari kekronisan kondisi patologi dari masing-masing individu pasien. Selain dapat menurunkan kadar gula darah, polipeptida-K juga mengendalikan hipertensi dengan cara mengendalikan total kolesterol, HDL, LDL, VLDL, dan trigliserida.
Radikal bebas, Antioksidan, dan Lipid Peroksida
Radikal bebas adalah suatu atom atau molekul yang memiliki satu atau lebih elektron tidak berpasangan dan sangat reaktif (Muhilal 1991). Radikal bebas, disimbolkan dengan tanda (•), dapat terbentuk secara endogen sebagai hasil proses metabolisme tubuh, atau secara eksogen misalnya melalui
proses adsorpsi radiasi (UV, sinar tampak, panas) dan melalui reaksi redoks (Gitawati 1995). Salah satu peluang terbentuknya radikal bebas secara endogen yaitu pada peristiwa reduksi oksigen di dalam rantai transpor elektron. Proses reduksi oksigen ini menghasilkan radikal superoksida (O2-•),
hidrogen peroksida (H2O2), dan radikal
hidroksil (OH•) sebagai zat perantara. Radikal bebas dalam upaya menstabilkan dirinya akan mencari pasangan elektron dari molekul lain. Di dalam tubuh, radikal bebas ini akan menarik elektron dari makromolekul di sekitarnya seperti protein, karbohidrat, lipid, maupun DNA yang merupakan bagian dari sel. Jika terjadi kerusakan pada unsur-unsur tersebut, pada akhirnya akan mengarah pada kerusakan sel (Halliwel&Gutteridge 1985).
Lipid peroksida adalah suatu molekul yang terbentuk dari peroksidasi lipid. Peroksidasi lipid adalah reaksi yang terjadi antara radikal bebas dengan PUFA yang mengandung sedikitnya tiga ikatan rangkap (Halliwell & Gutteridge 1985). Reaksi peroksidasi lipid diawali oleh pengambilan sebuah atom hidrogen dari gugus metilena (-CH2) pada PUFA oleh radikal bebas. Pada
tahap ini terjadi pembentukan radikal bebas karbon (-CH-•) yang disebabkan adanya ikatan rangkap pada asam lemak yang dapat melemahkan ikatan antara atom C dan H yang berdekatan dengan ikatan rangkap, sehingga atom H mudah diambil oleh radikal bebas. Tahap selanjutnya yaitu penstabilan radikal bebas karbon melalui penataan ulang ikatan rangkap, sehingga terbentuk diena terkonjugasi. Apabila diena terkonjugasi
bereaksi dengan O2, maka akan terbentuk
radikal lipid peroksida (ROO•). Hadirnya radikal peroksida ini dapat memudahkan pengambilan atom hidrogen dari molekul lipid lain, sehingga tahap ini disebut sebagai tahap propagasi. Radikal peroksida selanjutnya dapat bergabung dengan atom H yang lain membentuk lipid hidroperoksida dan radikal bebas yang baru. Jalur lain yang ditempuh oleh radikal peroksida yaitu dengan membentuk peroksida siklik yang disebut dengan enderoperoksida. Tahap terminasi terjadi bila radikal lipid peroksida bereaksi dengan antioksidan atau senyawa biologi seperti protein (Tabel 1).
4
Tabel 1 Tahapan reaksi pembentukan radikal bebas
Tahapan Reaksi 1. Inisiasi RH + OH 2.
Propagasi
R• + O2
ROO• + RH → ROOH + R• 3.
Terminasi
ROO• + ROO•→ ROOR + O2
ROO• + R• → ROOR R• + R•
tubuh seperti besi (Fe) dan tembaga (Cu) dapat mengkatalisis penguraian lipid hidroperoksida hingga membentuk produk yang berbahaya seperti epoksida, keton, asam, dan aldehida. Beberapa contoh aldehida yang dihasilkan dari peruraian peroksida adalah malondialdehida (MDA) dan 4-hidroksinonenal. Kedua produk aldehida tersebut dapat menyerang protein terutama pada gugus thiol (-SH) dan gugus
amino (-NH2), sehingga enzim-enzim yang
membutuhkan senyawa-senyawa tersebut untuk aktivitasnya akan terhambat bila peroksidasi lipid sedang berlangsung (Sulistyo 1998).
Konsentrasi lipid peroksida yang berlebih pada darah maupun organ dapat mengakibatkan berbagai penyakit degeneratif. Menurut Yagi (1994) bila kadar lipid peroksida di hati meningkat, maka lipid peroksida ini dapat keluar dan akan merusak organ atau jaringan lain. Pada manusia, lipid peroksida dalam darah akan meningkat seiring dengan bertambahnya usia, tetapi jumlahnya tidak boleh melebihi konsentrasi normalnya, yaitu 4 nmol/mL.
Konsentrasi lipid peroksida dapat diukur dengan metode asam tiobarbiturat (TBA) yang akan mengukur adanya MDA (malondialdehida) sebagai produk reaksi peroksidasi lipid. Asam tiobarbiturat akan bereaksi dengan gugus karbonil dari MDA, yaitu satu molekul MDA akan berikatan dengan dua molekul TBA. Reaksi ini akan menghasilkan senyawa kompleks berwarna merah yang serapannya dapat diukur secara spektrofotometri (Gambar 2).
Gambar 2 Reaksi antara TBA dengan MDA Sumber: Halliwel&Gutteridge (1985)
Untuk mengontrol radikal bebas, dapat digunakan senyawa-senyawa yang berperan sebagai penangkap radikal bebas atau dikenal sebagai antioksidan. Antioksidan didefinisikan sebagai senyawa yang dapat memberikan elektron kepada radikal bebas. Proses antioksidasi dapat terjadi pada enzim yang berperan mengubah senyawa radikal bebas menjadi senyawa yang lebih stabil. Misalnya enzim superoksida dismutase (SOD) yang mengubah radikal O2- menjadi
H2O2 dan O2.
O2- + O2- + H+ + H+ SOD H2O2 + O2
Mekanisme kerja antioksidan pada senyawa radikal bebas ada tiga macam, yaitu (1) antioksidan primer yang berperan untuk mengurangi pembentukan radikal bebas baru dengan cara memutus reaksi berantai dan mengubahnya menjadi produk yang lebih stabil. Antioksidan primer ini terdiri atas superoksida dismutase (SOD), katalase, dan glutation peroksidase. Ketiga contoh antioksidan tersebut dapat mengubah radikal superoksida menjadi air. (2) antioksidan sekunder yang berperan untuk mengikat radikal bebas dan mencegah amplifikasi senyawa radikal. Antioksidan sekunder terdapat pada vitamin C, vitamin B, vitamin E, betakaroten, dan senyawa-senyawa fitokimia. (3) antioksidan tersier yang berperan dalam mekanisme biomolekuler. Antioksidan tersier terdiri atas enzim perbaikan DNA dan metionin sulfoksida reduktase (Kartikawati 1999)
5
fitokimia. Fitokimia merupakan antioksidan alami yang terdapat pada tanaman. Beberapa contoh fitokimia, yaitu golongan karotenoid, flavonoid, fitostrerol, dan polifenol. Senyawa turunan fenol tersebar luas dalam tumbuhan dan beberapa diantaranya lebih efektif dibandingkan dengan senyawa antioksidan sintetik (Muhilal 1991). Fitokimia yang umum terdapat pada tumbuhan tingkat tinggi antara lain asam askorbat (vitamin C), karoten, flavonoid, saponin, tanin, dan tokoferol. Zat antioksidan alami lain adalah isoflavon. Isoflavon termasuk golongan isoflavonoid yang merupakan isomer flavon. Senyawa ini banyak terkandung pada tanaman kacang-kacangan, terutama kacang kedelai.
Streptozotosin
Streptozotosin (2-deoksi-2-(3-metil-3-(nitrosoureido)-D-glukopiranosa) merupakan
senyawa hasil sintesis Streptomycetes
achromogenes dan digunakan untuk menginduksi diabetes pada hewan coba,baik diabetes melitus tergantung insulin (IDDM) atau tidak tergantung insulin (NIDDM). Struktur STZ dicirikan dengan adanya metilnitrourea yang berikatan pada atom C ke-2 glukosa (Gambar 3).
Menurut Ganda dalam tulisan Szkudelski (2001) penggunaan dosis yang digunakan pada tikus untuk menginduksi IDDM secara intravena di antara 40 dan 60 mg/kg BB, berhasil juga secara intraperitoneal dengan dosis yang sama atau lebih tinggi, dan kurang efektif di bawah 40 mg/kg BB, meskipun juga tergantung spesiesnya. Dengan suntikan STZ sebanyak 50 mg/kg BB secara intravena pada tikus, kadar glukosa darah dapat meningkat sampai sekitar 15mM (270 mg/dL) setelah 2 minggu).
Senyawa STZ masuk ke dalam sel-β
pankreas melalui glucose transporter 2
(GLUT 2). Ekspresi GLUT 2 yang tereduksi akibat kerja STZ sebagai zat diabetogenik
Gambar 3 Struktur STZ
ditemukan oleh Schenedl dan Thulesen. Metabolisme STZ dalam sel akan membentuk komponen karbamoilasi seluler, karbamoilasi intermolekular dan komponen seluler alkilasi. Pada tahap awal, STZ akan diubah menjadi senyawa isosianat dan melepaskan metilnitrourea. Isosianat dapat membentuk berbagai macam senyawa karbamoilasi intramolekuler. Metilnitrourea yang dilepaskan membentuk metildiazohidroksida yang dapat menyisipkan gugus alkil pada berbagai macam komponen seluler seperti
DNA, protein, atau bereaksi dengan H2O
membentuk metanol.
Sifat diabetogenik STZ diduga terjadi karena kerusakan DNA dalam sel-sel B pancreas. Elsner et al. (2000) melaporkan bahwa penyebab kematian sel-sel B pankreas hasil induksi STZ adalah alkilasi DNA. Di samping itu kerusakan DNA pada sel B diduga juga akibat aktivitas senyawa oksigen reaktif dari nitrit oksida (NO). Senyawa STZ adalah donor NO yang telah ditemukan sebagai penyebab kerusakan sel pulau pankreas, dengan cara meningkatkan aktivitas guanilil siklase. Dalam mitokondria, NO juga akan meningkatkan aktivitas xanthin oksidase dan menurunkan oksigen yang berdampak pada penghambatan siklus Krebs, sehingga terjadi pembatasan produksi ATP dalam mitokondria yang kemudian menyebabkan deplesi nukleotida
dalam sel β dan pada akhirnya
mengakibatkan kerusakan DNA (Szkudelski 2001). Dalam jumlah terbatas NO memainkan peranan penting dalam tubuh manusia, misalnya sebagai molekul sinyal, membantu regulasi aliran darah, melawan infeksi, dan mematikan sel tumor. Sebaliknya, dalam jumlah berlebih NO dapatmenjadi berbahaya misalnya memicu inflamasi kronik, menggangu fungsi otak, dan merestriksi aliran darah. Selain itu, apabila NO bertemu dengan radikal superoksida, NO akan menjadi radikal bebas yang lebih aktif dan dapat merusak sistem antioksidan serta protein dalam tubuh (Packer dan Colman 1999).
BAHAN DAN METODE
Bahan dan Alat
Bahan-bahan yang digunakan dalam penelitian ini adalah: sampel hati tikus
5
fitokimia. Fitokimia merupakan antioksidan alami yang terdapat pada tanaman. Beberapa contoh fitokimia, yaitu golongan karotenoid, flavonoid, fitostrerol, dan polifenol. Senyawa turunan fenol tersebar luas dalam tumbuhan dan beberapa diantaranya lebih efektif dibandingkan dengan senyawa antioksidan sintetik (Muhilal 1991). Fitokimia yang umum terdapat pada tumbuhan tingkat tinggi antara lain asam askorbat (vitamin C), karoten, flavonoid, saponin, tanin, dan tokoferol. Zat antioksidan alami lain adalah isoflavon. Isoflavon termasuk golongan isoflavonoid yang merupakan isomer flavon. Senyawa ini banyak terkandung pada tanaman kacang-kacangan, terutama kacang kedelai.
Streptozotosin
Streptozotosin (2-deoksi-2-(3-metil-3-(nitrosoureido)-D-glukopiranosa) merupakan
senyawa hasil sintesis Streptomycetes
achromogenes dan digunakan untuk menginduksi diabetes pada hewan coba,baik diabetes melitus tergantung insulin (IDDM) atau tidak tergantung insulin (NIDDM). Struktur STZ dicirikan dengan adanya metilnitrourea yang berikatan pada atom C ke-2 glukosa (Gambar 3).
Menurut Ganda dalam tulisan Szkudelski (2001) penggunaan dosis yang digunakan pada tikus untuk menginduksi IDDM secara intravena di antara 40 dan 60 mg/kg BB, berhasil juga secara intraperitoneal dengan dosis yang sama atau lebih tinggi, dan kurang efektif di bawah 40 mg/kg BB, meskipun juga tergantung spesiesnya. Dengan suntikan STZ sebanyak 50 mg/kg BB secara intravena pada tikus, kadar glukosa darah dapat meningkat sampai sekitar 15mM (270 mg/dL) setelah 2 minggu).
Senyawa STZ masuk ke dalam sel-β
pankreas melalui glucose transporter 2
(GLUT 2). Ekspresi GLUT 2 yang tereduksi akibat kerja STZ sebagai zat diabetogenik
Gambar 3 Struktur STZ
ditemukan oleh Schenedl dan Thulesen. Metabolisme STZ dalam sel akan membentuk komponen karbamoilasi seluler, karbamoilasi intermolekular dan komponen seluler alkilasi. Pada tahap awal, STZ akan diubah menjadi senyawa isosianat dan melepaskan metilnitrourea. Isosianat dapat membentuk berbagai macam senyawa karbamoilasi intramolekuler. Metilnitrourea yang dilepaskan membentuk metildiazohidroksida yang dapat menyisipkan gugus alkil pada berbagai macam komponen seluler seperti
DNA, protein, atau bereaksi dengan H2O
membentuk metanol.
Sifat diabetogenik STZ diduga terjadi karena kerusakan DNA dalam sel-sel B pancreas. Elsner et al. (2000) melaporkan bahwa penyebab kematian sel-sel B pankreas hasil induksi STZ adalah alkilasi DNA. Di samping itu kerusakan DNA pada sel B diduga juga akibat aktivitas senyawa oksigen reaktif dari nitrit oksida (NO). Senyawa STZ adalah donor NO yang telah ditemukan sebagai penyebab kerusakan sel pulau pankreas, dengan cara meningkatkan aktivitas guanilil siklase. Dalam mitokondria, NO juga akan meningkatkan aktivitas xanthin oksidase dan menurunkan oksigen yang berdampak pada penghambatan siklus Krebs, sehingga terjadi pembatasan produksi ATP dalam mitokondria yang kemudian menyebabkan deplesi nukleotida
dalam sel β dan pada akhirnya
mengakibatkan kerusakan DNA (Szkudelski 2001). Dalam jumlah terbatas NO memainkan peranan penting dalam tubuh manusia, misalnya sebagai molekul sinyal, membantu regulasi aliran darah, melawan infeksi, dan mematikan sel tumor. Sebaliknya, dalam jumlah berlebih NO dapatmenjadi berbahaya misalnya memicu inflamasi kronik, menggangu fungsi otak, dan merestriksi aliran darah. Selain itu, apabila NO bertemu dengan radikal superoksida, NO akan menjadi radikal bebas yang lebih aktif dan dapat merusak sistem antioksidan serta protein dalam tubuh (Packer dan Colman 1999).
BAHAN DAN METODE
Bahan dan Alat
Bahan-bahan yang digunakan dalam penelitian ini adalah: sampel hati tikus
6
(TBA) 1.0% dalam pelarut asam asetat 50%, akuades, n-butanol:piridin (15:1 v/v), dan 1,1,3,3-tetrametoksi propana (TMP) 6 M sebagai stok larutan standar. Sedangkan bahan untuk preparasi homogenat dan analisis hati tikus antara lain: KCl dingin 1.15%, sodium dodesil sulfat (SDS) 8.1%, NaOH 1 M, asam asetat 20%, akuades, dan kertas saring.
Alat-alat yang digunakan dalam penelitian ini adalah mikropipet,
homogenizer, penangas air, vortek, neraca analitik, sentrifus Hettich Universal d7200, pH meter, spektrofotometer, dan alat-alat gelas.
Metode Penelitian
Ekstraksi Buah Pare (Markham 1988)
Buah pare (Momordica charantia) diiris tipis-tipis dan dimasukkan ke dalam oven dengan temperatur 60 °C sampai menjadi bahan kering. Selanjutnya bahan kering ditumbuk sampai halus sehingga memperoleh serbuk halus yang homogen. Ekstraksi buah pare dilakukan dengan maserasi di dalam alkohol absolut (98%) dengan perbandingan 1:3 selama 10 jam. Setelah 10 jam larutan alkohol disaring sehingga diperoleh larutan alkohol yang mengandung ekstrak buah pare. Kemudian ekstrak cair tersebut diuapkan dengan pemanas listrik (sokhlet) untuk memisahkan alkohol dengan ekstrak pare. Suspensi ekstrak pare dilakukan dengan mencampurkan ekstrak bebas alkohol dengan 1% carboxyl methyl cellulose (CMC).
Rancangan Percobaan
Hewan uji yang digunakan adalah tikus jantan Sprague Dawley dewasa dengan usia 16 minggu. Tikus diadaptasikan selama dua minggu untuk menyeragamkan cara hidup dan makannya. Tikus kemudian dibagi menjadi 3 kelompok utama. Kelompok yang pertama adalah kelompok normal yang hanya diberi pakan standar dan akuades (10 ekor). Kelompok kedua adalah kelompok tikus yang diinduksi STZ secara bertahap (3 kali penyuntikan intraperitoneal dengan selang waktu 1 hari) dosis total 55 mg/kg BB dengan pembagian 20; 20; dan 15 mg/kg BB (30 ekor), kelompok ketiga adalah kelompok tikus yang diinduksi STZ dengan dosis tunggal 35 mg/kg BB (30 ekor).
Setelah mengalami hiperglikemia, tikus-tikus pada kelompok 2 dan 3 dibagi lagi
menjadi 3 subkelompok, yaitu kelompok kontrol negatif (diberi akuades), kelompok yang diberi ekstrak pare dosis rendah (125 mg/kg BB), dan kelompok yang diberi ekstrak pare dosis rendah (575 mg/kg BB). Pemberian ekstrak pare dilakukan setiap hari selama 2 bulan. Setelah 2 bulan semua tikus lalu dinekropsi untuk diambil hatinya dan dianalisis lipid peroksidanya. Tidak semua hati yang dinekropsi dianalisis, namun minimal hanya empat ulangan untuk tiap kelompok. Jumlah ulangan ini ditentukan berdasarkan persamaan berikut (Hanafiah 2005):
(t-1)(r-1) ≥15 Keterangan: r =jumlah ulangan t = jumlah perlakuan
Pengukuran Konsentrasi Lipid Peroksida (Yagi 1994)
Pembuatan kurva standar. Kurva standar dibuat dengan menggunakan larutan stok pereaksi 1,1,3,3-TMP 6 M. Stok TMP 6 M tersebut diambil 1 L dan diencerkan menjadi 100 mL stok dengan konsentrasi 60
M. Stok 60 M tersebut kemudian diencerkan menjadi 0.3, 0.75, 0.9, 1.5, 1.8, 3.0, dan 6.0 M. Larutan dari tiap-tiap konsentrasi tersebut dipipet sebanyak 4 mL ke dalam tabung reaksi. Lalu msing-masing tabung ditambah 1 mL TBA 1.0% dalam pelarut asam asetat 50%, dipanaskan di penangas air mendidih pada suhu 95°C selama 60 menit, kemudian didinginkan pada suhu kamar. Setelah inkubasi tersebut, warna larutan yang diperoleh adalah merah muda. Semakin tinggi konsentrasi TMP, intensitas warna tersebut semakin tinggi Selanjutnya pada masing-masing tabung ditambahkan 1.0 mL akuades dan 5 mL n-butanol:piridin (15:1 v/v), dicampur dengan vorteks, lalu disentrifugasi pada kecepatan 3000 rpm selama 15 menit. Setelah disentrifus akan terbentuk dua fase larutan. Lapisan atas berwarna merah muda yang terbentuk (fase organik) pada larutan diambil, lalu serapannya diukur pada =532 nm dengan spektrofotometer.
7
homogenat ke dalam tabung reaksi tertutup secara duplo. Selanjutnya ke dalam tiap tabung ditambahkan 0.2 mL SDS 8.1% dan 1.5 mL asam asetat 20%, serta diatur menjadi pH 3.5 oleh NaOH 1 M dengan pH meter. Kisaran pH awal sebelum ditambahkan NaOH adalah 2.5, dan volume NaOH yang ditambahkan sekitar 0.7 ml. Selanjutnya ditambahkan 0.7 mL akuades dan 1.5 mL TBA 1.0 % dalam pelarut dalam pelarut asam asetat 50%, dipanaskan di penangas air mendidih pada suhu 95°C selama 60 menit, kemudian didinginkan pada suhu kamar. Setelah inkubasi tersebut, warna larutan yang diperoleh adalah merah muda. Selanjutnya pada tiap tabung ditambahkan 1.0 mL akuades dan 5 mL n-butanol:piridin (15:1 v/v), dicampur dengan vorteks, lalu disentrifugasi pada kecepatan 4000 rpm selama 10 menit. Lapisan atas berwarna merah muda yang terbentuk (fase organik) pada larutan diambil, lalu serapannya diukur pada 532 nm dengan spektrofotometer.
Analisis Statistik
Data konsentrasi lipid peroksida hati dianalisis secara statistik, yaitu analisis ragam (ANOVA) untuk percobaan dua faktor dalam rancangan acak lengkap (faktorial RAL), dilanjutkan dengan uji Duncan menggunakan program Statistical Analysis System (SAS). Model rancangan percobaan tersebut adalah sebagai berikut (Mattjik dan Sumertajaya 2002):
Yijk = µ + αi + βj + (αβ)ij + εijk
Keterangan:
Yijk = nilai pengamatan pada faktor A
(dosis STZ) taraf ke-i, faktor B (dosis pare) taraf ke-j, dan ulangan ke-k
µ = komponen aditif dari rataan
αi = pengaruh utama faktor A,
i=1,2
βj = pengaruh utama faktor B, j=1,2,3
(αβ)ij = komponen interaksi dari faktor A
dan faktor B
εijk = pengaruh acak yang menyebar
normal
i1 = kelompok induksi STZ dosis
bertahap
i2 = kelompok induksi STZ dosis
tunggal
j1 = kelompok ekstrak pare dosis 0
mg/kg BB (kontrol negatif)
j2 = kelompok ekstrak pare dosis 125
mg/kg BB
j3 = kelompok ekstrak pare dosis 575
mg/kg BB
HASIL DAN PEMBAHASAN
Pengaruh STZ terhadap Bobot Badan Tikus
Data sekunder (Lampiran 5) memperlihatkan hasil pengukuran bobot badan (BB) tikus. Pada tikus kelompok normal, diperoleh rataan BB pada awal percobaan sebesar 318.4±25.77 g, dan pada akhir percobaan (minggu ke-12) sebesar 386.28±26.94 g, atau meningkat sebesar 21.32%. Kelompok kontrol positif yang diinduksi STZ secara bertahap pada awal dan akhir percobaan berturut-turut sebesar 294.44±25.60 g dan 262.12±51.73 g atau turun sebesar 10.98 %. Sedangkan kelompok kontrol positif STZ dosis tunggal pada awal dan akhir percobaan berturut-turut sebesar 306.07±20.33 g dan 246.0±60.93 g atau turun sebesar 19.62% (Gambar 4). Penurunan BB kelompok kontrol positif tikus yang diinduksi STZ secara bertahap mau pun STZ dosis tunggal secara statistika bermakna (p < 0.05) dibandingkan dengan peningkatan BB kelompok normal. Hasil ini menunjukkan bahwa tikus yang diinduksi STZ sangat mungkin sudah menjadi diabetes.
Pada kondisi diabetes, tubuh mengalami defisiensi insulin atau insulin yang ada tidak dapat bekerja secara efektif, sehingga glukosa dalam darah tidak dapat dimanfaatkan oleh sel untuk memenuhi kebutuhan energi. Insulin merupakan hormon protein yang berinteraksi dengan reseptor sel targetnya untuk meningkatkan permeabilitas sel terhadap glukosa sehingga glukosa dapat masuk ke dalam sel. Defisiensi insulin ini lalu memicu proses glukoneogenesis, yaitu pembentukan glukosa dari sumber selain karbohidrat misalnya piruvat, laktat, senyawa antara siklus asam sitrat, dan asam amino tertentu hasil katabolisme protein. Katabolis-
7
homogenat ke dalam tabung reaksi tertutup secara duplo. Selanjutnya ke dalam tiap tabung ditambahkan 0.2 mL SDS 8.1% dan 1.5 mL asam asetat 20%, serta diatur menjadi pH 3.5 oleh NaOH 1 M dengan pH meter. Kisaran pH awal sebelum ditambahkan NaOH adalah 2.5, dan volume NaOH yang ditambahkan sekitar 0.7 ml. Selanjutnya ditambahkan 0.7 mL akuades dan 1.5 mL TBA 1.0 % dalam pelarut dalam pelarut asam asetat 50%, dipanaskan di penangas air mendidih pada suhu 95°C selama 60 menit, kemudian didinginkan pada suhu kamar. Setelah inkubasi tersebut, warna larutan yang diperoleh adalah merah muda. Selanjutnya pada tiap tabung ditambahkan 1.0 mL akuades dan 5 mL n-butanol:piridin (15:1 v/v), dicampur dengan vorteks, lalu disentrifugasi pada kecepatan 4000 rpm selama 10 menit. Lapisan atas berwarna merah muda yang terbentuk (fase organik) pada larutan diambil, lalu serapannya diukur pada 532 nm dengan spektrofotometer.
Analisis Statistik
Data konsentrasi lipid peroksida hati dianalisis secara statistik, yaitu analisis ragam (ANOVA) untuk percobaan dua faktor dalam rancangan acak lengkap (faktorial RAL), dilanjutkan dengan uji Duncan menggunakan program Statistical Analysis System (SAS). Model rancangan percobaan tersebut adalah sebagai berikut (Mattjik dan Sumertajaya 2002):
Yijk = µ + αi + βj + (αβ)ij + εijk
Keterangan:
Yijk = nilai pengamatan pada faktor A
(dosis STZ) taraf ke-i, faktor B (dosis pare) taraf ke-j, dan ulangan ke-k
µ = komponen aditif dari rataan
αi = pengaruh utama faktor A,
i=1,2
βj = pengaruh utama faktor B, j=1,2,3
(αβ)ij = komponen interaksi dari faktor A
dan faktor B
εijk = pengaruh acak yang menyebar
normal
i1 = kelompok induksi STZ dosis
bertahap
i2 = kelompok induksi STZ dosis
tunggal
j1 = kelompok ekstrak pare dosis 0
mg/kg BB (kontrol negatif)
j2 = kelompok ekstrak pare dosis 125
mg/kg BB
j3 = kelompok ekstrak pare dosis 575
mg/kg BB
HASIL DAN PEMBAHASAN
Pengaruh STZ terhadap Bobot Badan Tikus
Data sekunder (Lampiran 5) memperlihatkan hasil pengukuran bobot badan (BB) tikus. Pada tikus kelompok normal, diperoleh rataan BB pada awal percobaan sebesar 318.4±25.77 g, dan pada akhir percobaan (minggu ke-12) sebesar 386.28±26.94 g, atau meningkat sebesar 21.32%. Kelompok kontrol positif yang diinduksi STZ secara bertahap pada awal dan akhir percobaan berturut-turut sebesar 294.44±25.60 g dan 262.12±51.73 g atau turun sebesar 10.98 %. Sedangkan kelompok kontrol positif STZ dosis tunggal pada awal dan akhir percobaan berturut-turut sebesar 306.07±20.33 g dan 246.0±60.93 g atau turun sebesar 19.62% (Gambar 4). Penurunan BB kelompok kontrol positif tikus yang diinduksi STZ secara bertahap mau pun STZ dosis tunggal secara statistika bermakna (p < 0.05) dibandingkan dengan peningkatan BB kelompok normal. Hasil ini menunjukkan bahwa tikus yang diinduksi STZ sangat mungkin sudah menjadi diabetes.
Pada kondisi diabetes, tubuh mengalami defisiensi insulin atau insulin yang ada tidak dapat bekerja secara efektif, sehingga glukosa dalam darah tidak dapat dimanfaatkan oleh sel untuk memenuhi kebutuhan energi. Insulin merupakan hormon protein yang berinteraksi dengan reseptor sel targetnya untuk meningkatkan permeabilitas sel terhadap glukosa sehingga glukosa dapat masuk ke dalam sel. Defisiensi insulin ini lalu memicu proses glukoneogenesis, yaitu pembentukan glukosa dari sumber selain karbohidrat misalnya piruvat, laktat, senyawa antara siklus asam sitrat, dan asam amino tertentu hasil katabolisme protein. Katabolis-
8
Gambar 4 Bobot badan tikus (g) kelompok normal (I), kontrol positif STZ bertahap (II),
dan kontrol positif STZ tunggal (III) me protein akibat defisiensi insulin terjadi melalui perombakan protein otot atau cadangan protein tubuh yang berakibat pada penurunan bobot badan (Lehninger 1994).
Selain karena katabolisme protein, penurunan bobot badan juga terjadi karena defisiensi insulin akan memicu mobilisasi triasilgliserol dari jaringan adiposa (lipolisis). Triasilgliserol ini kemudian diubah menjadi asam lemak bebas untuk dioksidasi dan menghasilkan energi. Mobilisasi triasilgliserol menyebabkan cadangan lemak yang tersimpan dalam adiposa berkurang sehingga bobot badan akan berkurang. Mobilisasi asam lemak juga meningkatkan resiko terjadinya serangan radikal bebas terhadap PUFA atau peroksidasi lipid, karena semakin banyak molekul asam lemak yang dapat diserang.
Hati merupakan salah satu organ yang vital bagi tubuh. Seluruh proses metabolisme sebagian besar terjadi di hati. Hati mengolah dan mensintesis berbagai zat yang diangkut ke bagian tubuh lainnya. Peroksidasi lipid hati mengakibatkan gangguan pada membran sel mikrosom hati, yaitu gelembung bermembran yang dibentuk melalui pemecahan retikulum endoplasma sel eukariot. Segala fungsi yang terjadi pada membran sel mikrosom ini akan turut dirusak, termasuk di antaranya fungsi enzimatik. Menurut Gibson & Skett (1991), aktivitas enzimatik yang diamati dalam retikulum endoplasma hati di antaranya adalah enzim untuk biosintesis trigliserida, katabolisme asam lemak, katabolisme dan biosintesis kolesterol, serta glukosa 6-fosfatase. Selain itu tingginya kadar lipid peroksida akan menyebabkan akumulasi trigliserida pada sel hati, dan kemudian menyebabkan nekrosis hati. Nekrosis adalah kematian sel akibat kerusakan berat yang ditandai dengan kerusakan struktur seluler secra menyeluruh diikuti lisisnya sel dan inflamasi jaringan (Vegad 1996). Perubahan awal pada sel yang mengalami nekrosis adalah kariopiknosis (inti mengecil dan warnanya menjadi lebih jelas sampai hitam). Jadi kondisi diabetes yang parah dan berkepanjangan akan menyebabkan peroksidasi lipid terutama di hati
Pengaruh STZ terhadap Lipid Peroksida Hati Tikus
Hasil analisis lipid peroksida hati tikus dari semua kelompok pada akhir percobaan (minggu ke-12) dirangkum dalam Tabel 2. Tabel 2 Lipid peroksida hati tikus pada akhir
percobaan
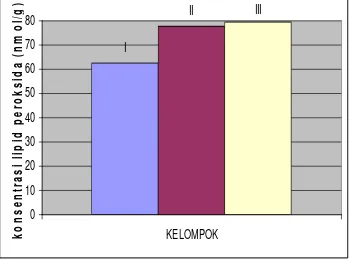
Kelompok Rata-rata konsentrasi lipid peroksida (nmol/g) I 75.421±31.24 II 60.144±10.34 III 58.984±5.75 IV 57.488±11.69 V 62.400±6.90 VI 77.641±22.62 VII 79.359±13.84 Keterangan: tikus kelompok normal (I), kontrol positif STZ bertahap (II), STZ bertahap dan pare dosis rendah (III), STZ bertahap dan pare dosis (IV), kontrol positif STZ tunggal (V), STZ tunggal dan pare dosis rendah (VI), STZ tunggal dan pare dosis tinggi (VII) I II III 0 10 20 30 40 50 60 70 80 kelompok k o n sen tr as i l ip id p e ro ksi d a (n m o l/ g )
Gambar 5 Konsentrasi lipid peroksida (nmol/g) kelompok normal (I), kontrol positif
STZ bertahap (II), dan kontrol positif STZ tunggal (III)
Konsentrasi lipid peroksida hati tikus kelompok normal setelah 12 minggu adalah 75.421±31.24 nmol/g pada usia tujuh bulan. Nilai ini lebih rendah dibandingkan dengan hasil Alviani (2007) yaitu nilai lipid peroksida hati kelompok normal pada usia lima bulan sebesar 87.10 nmol/g. Sedangkan menurut Sayogya (2002), kadar lipid peroksida hati tikus galur Sprague-Dawley
kelompok normal dengan usia 8.5 bulan adalah sebesar 100.46 nmol/g. Perbedaan ini bisa dikarenakan ketidaksamaan umur dan faktor lingkungan yang berbeda seperti pakan, stress, dan lingkungan yang berbeda. Usia hidup tikus yang lebih lama memungkinkan tikus lebih banyak terpapar oleh radikal bebas baik endogen mau pun eksogen, selain juga disebabkan makin lemahnya fungsi hati (Ruswandi 2005). Lata
9
peningkatan lipid peroksida darah kelinci yang sengaja dibuat stress dengan amobilisasi. Stress juga dikatakan sebagai faktor yang dapat memicu radikal bebas secara berlebih. Lipid peroksida dapat pula bertambah sebagai hasil dari meningkatnya pelepasan trigliserida dari jaringan adiposa untuk membentuk kortikosteroid sebagai respon terhadap stress (Singhal et al. 1997).
Konsentrasi lipid peroksida hati kelompok yang disuntik STZ dosis bertahap sebesar 60.14±10.34 nmol/g atau turun sebesar 20.25% dibanding kelompok normal, sedangkan konsentrasi lipid peroksida hati kelompok yang disuntik STZ dengan dosis tunggal sebesar 62.40±5.75 nmol/g atau turun 17.26% dibandingkan dengan kelompok normal (Gambar 5). Perbedaan konsentrasi lipid peroksida antar kelompok tersebut tidak nyata (p > 0.05), sehingga dikatakan STZ yang diberikan baik secara bertahap maupun dosis tunggal tidak memberikan efek naiknya lipid peroksida. Hasil ini sejalan dengan penelitian Sayogya (2002) yang melaporkan bahwa kadar lipid peroksida hati tikus
Sprague-Dawley jantan usia 8.5 bulan yang diinduksi dengan STZ dosis 37 mg/kg BB tidak mengalami perubahan yang bermakna dibandingkan kelompok kontrol yang diberi akuades dan pakan standar.
Pada kelompok kontrol positif STZ, baik yang diinduksi secara bertahap maupun dosis tunggal, tidak didapati efek STZ terhadap kadar lipid peroksida hati tikus. Tidak didapatinya efek STZ dapat dikarenakan sel
β-pankreas tikus belum rusak sepenuhnya
oleh STZ, sehingga sekalipun sudah mengalami hiperglikemia, namun tidak sampai menyebabkan disfungsi endotel sebagaimana yang dilaporkan Widyastuti (2000) pada monyet ekor panjang, yaitu bahwa kondisi hiperglikemia dapat mendorong disfungsi endotel yang menyebabkan peningkatan radikal bebas su peroksida. Radikal bebas superoksida ini akan memicu radikal-radikal lainnya yang dapat meningkatkan peroksidasi lipid.
Konsentrasi Lipid Peroksida Hati Tikus yang Diberi Ekstrak Pare
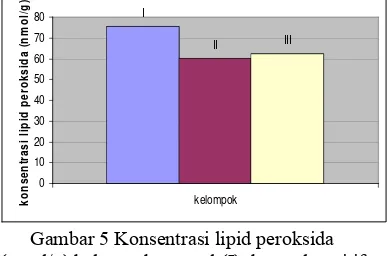
Konsentrasi lipid peroksida hati tikus yang disuntik STZ secara bertahap dan diberi dosis pare 125 mg/kg BB adalah 58.98±5.75 nmol/g atau turun sebesar 1.93% dibandingkan kelompok kontrolnya, sedangkan kelompok yang diberi pare dengan dosis lebih tinggi yaitu 575 mg/kg BB
sebesar 57.49±11.69 nmol/g atau turun 4.43% dibandingkan kelompok kontrol (Gambar 6). Perbedaan konsentrasi lipid peroksida antar kelompok tersebut tidak nyata (p > 0.05).
Pada kelompok tikus yang disuntik STZ dengan dosis tunggal, konsentrasi lipid peroksida hati kelompok yang diberi dosis pare 125 mg/kg BB adalah 77.64±22.62 nmol/g atau naik sebesar 24.42% dibandingkan kelompok kontrol, sedangkan kelompok yang diberi pare dengan dosis lebih tinggi yaitu 575 mg/kg BB sebesar 79.36±13.84 nmol/g atau naik 27.18% dibandingkan kelompok kontrol (Gambar 7). Kenaikan konsentrasi tersebut mungkin dikarenakan respon tubuh tikus terhadap pare bervariasi, atau pun juga faktor stress. Perbedaan konsentrasi lipid peroksida antar kelompok tersebut juga tidak nyata (p > 0.05), sehingga dapat dikatakan bahwa pada penelitian ini pemberian ekstrak pare baik dosis rendah maupun tinggi belum mempengaruhi konsentrasi lipid peroksida hati tikus.
I II III
0 10 20 30 40 50 60 70 80 KELOMPOK ko n sen tr a si l ip id p er o ksi d a (nm ol /g)
Gambar 6 Konsentrasi lipid peroksida hati (nmol/g) tikus kontrol positif STZ bertahap (I), STZ bertahap dan pare dosis rendah (II),
STZ bertahap dan pare dosis tinggi (III)
I II III 0 10 20 30 40 50 60 70 80 KELOMPOK k ons e nt ra s i l ip id p er o k si d a (nm ol /g)
10
STZ tunggal dan pare dosis rendah (II), STZ tunggal dan pare dosis tinggi (III)
Hasil penelitian ini belum memperlihatkan pengaruh ekstrak pare untuk mengurangi kadar lipid peroksida hati. Selama ini pare memang lebih diterima dan digunakan oleh masyarakat tradisonal sebagai alternatif untuk menurunkan kadar gula darah bagi penderita diabetes, belum dikatakan secara pasti bahwa pare memiliki kemampuan antioksidan yang baik. Perlu diperhatikan bahwa pada penelitian ini rancangan yang digunakan lebih bertujuan untuk mendapatkan hewan model diabetes dengan kadar gula darah tinggi (hiperglikemia) yang stabil. Hal ini berarti kenaikan lipid peroksida hati tikus hiperglikemia pada rancangan yang dipakai ini belum cukup signifikan untuk dapat melihat pengaruh dari pare itu sendiri, terlihat dari nilai konsentrasi lipid peroksida hati yang tidak berbeda nyata antara kelompok normal dengan kelompok kontrol positif STZ baik yang disuntikkan secara bertahap maupun dengan dosis tunggal. Oleh karena itu belum tertutup kemungkinan untuk membuktikan bahwa pare memang mampu mengurangi kadar lipid peroksida hati, sebab dilihat dari kandungannya, pare memang mengandung senyawa yang bersifat antioksidan seperti vitamin C, vitamin A, flavonoid, dan polifenol (Taylor 2002).
Ada beberapa perlakuan yang dapat diberikan apabila ingin meningkatkan konsentrasi lipid peroksida hati secara signifikan. Salah satunya yang telah diketahui adalah dengan memberikan tiikus percobaan perlakuan pakan kolesterol dan induksi propil tiourasil (PTU). Alviani (2007) melaporkan lipid peroksida hati kelompok tikus yang dibuat hiperlipidemia dengan perlakuan pakan kolesterol 1.5% serta dicekok PTU (0.01%) dengan dosis 0.5 mg/kg BB selama delapan minggu percobaan sebesar 523.55 nmol/g, lebih besar lima kali lipat dibandingkan kelompok normal yaitu 87.10 nmol/g.
SIMPULAN DAN SARAN
Simpulan
Konsentrasi lipid peroksida hati tikus yang diinduksi STZ secara bertahap atau pun dengan dosis tunggal tidak mengalami perubahan secara nyata dibandingkan dengan kelompok normal. Konsentrasi lipid
peroksida hati tikus yang diberi ekstrak pare dosis rendah (125 mg/kg BB) dan dosis tinggi (575 mg/kg BB) juga tidak mengalami perubahan secara nyata dibandingkan dengan kelompok kontrol positif masing-masing.
Saran
Perlu dilakukan penelitian lebih lanjut terhadap konsentrasi lipid peroksida hati dengan penambahan perlakuan untuk menginduksi peningkatan lipid peroksida yang lebih nyata misalnya dengan induksi PTU ataupun pemberian pakan kolesterol. Untuk ekstrak pare juga dibuat variasi dosis yang lebih besar sehingga terlihat pengaruh yang jelas terhadap konsentrasi lipid peroksida hati tikus.
DAFTAR PUSTAKA
Alviani. 2007. Khasiat ramuan ekstrak daun jati Belanda terhadap peroksidasi lipid hati tikus hiperlipidemia. [Skripsi]. Bogor: Program Studi Biokimia FMIPA IPB.
Budianto R, Qomariah N, dan Suhartono E. 2003. Potensi infus daun pare (Momordica charantia) sebagai penghambat kerusakan protein akibat reaksi glikosilasi secara in vitro. J Obat Tradisional 8:1-5.
Cadenas E, dan Packer L. 2002. Handbook of Antioxidant. 2nd Ed. St Louis, Missouri: Mosby-Year Book Inc.
Elsner M, Guldbakke B, Tiedge M, Munday R, Lenzen S. 2000. Relative importance of transport and alkylation for pancreatic beta-cell toxicity of STZ. Diabetologia
43:1528-1533.
Gibson GG, Skett P. 1991. Pengantar
Metabolisme Obat. Aisyah I, penerjemah.
Jakarta: UI Press.
Girini MM, Ahamed RN, Aladakatti RH. 2005. Effect of graded doses of Momordica charantia seed extract on rat sperm: scanning electron microscope study, J Basic Clin Physiol Pharmacol
16(1):53-66.
Gitawati R. 1995. Radikal bebas, sifat dan peran dalam menimbulkan kerusakan
atau kematian sel. Cermin Dunia
KHASIAT ANTIOKSIDAN EKSTRAK PARE: KAJIAN
IN
VIVO
PADA TIKUS HIPERGLIKEMIA
CHRISTIAN
PROGRAM STUDI BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
KHASIAT ANTIOKSIDAN EKSTRAK PARE: KAJIAN
IN
VIVO
PADA TIKUS HIPERGLIKEMIA
CHRISTIAN
Skripsi
sebagai salah satu syarat untuk memperoleh gelar
Sarjana Sains pada
Program Studi Biokimia
PROGRAM STUDI BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
ABSTRAK
CHRISTIAN. Khasiat Antioksidan Ekstrak Pare: Kajian
In Vivo
pada Tikus
Hiperglikemia. Dibimbing oleh SULISTIYANI dan ERNI SULISTIAWATI.
Dewasa ini diabetes merupakan gangguan metabolik dengan prevalensi
yang tinggi. Kondisi diabetes dapat memicu timbulnya radikal bebas yang dapat
membahayakan sel, antara lain melalui reaksi peroksidasi lipid. Salah satu herbal
tradisional yang banyak dikonsumsi masyarakat untuk mengatasi diabetes adalah
buah pare. Penelitian ini bertujuan menguji potensi antioksidasi ekstrak buah pare
(
Momordica charantia
) terhadap konsentrasi lipid peroksida hati tikus
hiperglikemia.
Tikus jantan
Sprague Dawley
dewasa dibagi menjadi 3 kelompok utama.
Kelompok pertama adalah kelompok normal yang hanya diberi pakan standar dan
akuades. Kelompok kedua diinduksi STZ secara bertahap (3 kali penyuntikan
intraperitoneal dengan selang waktu 1 hari) dengan dosis total 55 mg/kg BB, dan
kelompok ketiga diinduksi STZ dengan dosis tunggal 35 mg/kg BB. Setelah
mengalami hiperglikemia, tikus pada kelompok 2 dan 3 dibagi lagi menjadi 3
subkelompok, yaitu kelompok kontrol positif (diberi akuades), kelompok yang
diberi ekstrak pare dosis rendah (125 mg/kg BB), dan kelompok yang diberi
ekstrak pare dosis rendah (575 mg/kg BB). Pemberian ekstrak pare dilakukan
selama 2 bulan. Analisis lipid peroksida hati dilakukan dengan metode TBA.
ABSTRACT
CHRISTIAN. Antioxidant Effect of Bitter Gourd Extract:
In Vivo
Study on
Hiperglycemic Rats. Under the direction of SULISTIYANI and ERNI
SULISTIAWATI.
Diabetes is a metabolic syndrome with high prevalention. Diabetic
condition may lead to production of free radical, which can be harmful to human
body by promoting a reaction known as lipid peroxidation. Bitter gourd have
been used widely as traditional medicine for diabetes treatment. In this research,
the antioxidation potential of bitter gourd (
Momordica charantia
) fruit extract and
it’s effect to lliver lipid peroxide was tested
in vivo
in hyperglycemic rat.
Sprague Dawley male rats were divided into three groups. First group was
normal group. Second group was injected with multiple dose STZ (3 times
intraperitoneal injection with one day interval) 55 mg/kg body weight (BW), and
the third group was injected with single dose STZ 35 mg/kg BW. Hiperglycemic
rats in group 2 and 3 was divided into 3 subgroups: control group (only given
aquades), low dose group (125 mg/kg BW bitter gourd extract), and higher dose
group (575 mg/kg BW bitter gourd extract). Bitter gourd extract was given for 2
months. Liver lipid peroxide was analyzed with tiobarbituric acid method.
The result of this experiment shows that bitter gourd fruit extract didn’t
have any effect to liver lipid peroxide concentration. Induction with STZ caused
diabetes to rats, but didn’t cause a significant increasement to liver lipid peroxide
concentration. Inthis experiment, low or higher dose bitter gourd extract
treatment didn’t effect the concentration of liver lipid peroxide.
Judul : Khasiat Antioksidan Ekstrak Pare: Kajian
In Vivo
pada Tikus
Hiperglikemia
Nama : Christian
NIM :
G44103050
Disetujui
Komisi Pembimbing
drh. Sulistiyani, M.Sc, Ph.D
Dr. drh. Erni Sulistiawati, Sp.P
1Ketua Anggota
Diketahui
Dekan Fakultas Matematika dan Ilmu Pengetahuan Alam
Dr. Ir. Yonny Koesmaryono, MS
NIP. 131473999
PRAKATA
Puji dan syukur penulis panjatkan kepada-Nya Yang Maha Pemurah,
karena hanya berkat kebaikan dan kemurahan-Nya penulis dapat menyelesaikan
karya ilmiah ini. Tema yang dipilih dalam penelitian ini adalah lipid peroksida
hati, dengan judul Khasiat Antioksidan Ekstrak Pare: Kajian
in vivo
pada Tikus
Hiperglikemia. Karya ilmiah ini disusun berdasarkan hasil penelitian yang telah
dilaksanakan sejak bulan Mei sampai Juli 2007 di Laboratorium Biokimia,
Departemen Biokimia FMIPA, IPB, Bogor.
Penulis mengucapkan terimakasih kepada drh. Sulistiyani, M.Sc., Ph.D
dan Dr. drh. Erni Sulistiawati, Sp.P
1selaku komisi pembimbing atas segala ilmu
dan bimbingan yang diberikan kepada penulis. Pada kesempatan ini penulis juga
menyampaikan terima kasih kepada keluarga di rumah atas doanya; seluruh staf
Laboratorium Biokimia atas segala bantuan dan kemudahan; serta kepada teman
seperjuangan di laboratorium: Henry, Adi, Metty, Dwi, Uci, Dewi, Ratna, Eka,
Uci, dan semua teman Biokimia 40 atas perhatian dan dukungannya.
Akhir kata penulis sangat menyadari bahwa karya ilmiah ini masih
memiliki kekurangan, karena itu dengan rendah hati penulis mengharapkan kritik
dan masukan agar hasil dari penelitian ini nantinya dapat berguna bagi siapa saja
yang membutuhkannya. Semoga karya ilmiah ini bermanfaat dalam bidang ilmu
pengetahuan.
Bogor, September 2007
Christian
RIWAYAT HIDUP
Penulis dilahirkan di Jakarta pada tanggal 14 Mei 1985 dari ayah Heeri
Pius Tjahjana dan Mariska Mariana. Penulis merupakan anak kedua dari empat
bersaudara. Tahun 2003 penulis lulus dari SMU Santa Ursula BSD dan pada
tahun yang sama lulus seleksi masuk IPB melalui jalur Seleksi Penerimaan
Mahasiswa Baru (SPMB) pada Program Studi Biokimia, yang pada waktu itu
masih tergabung dengan Departemen Kimia, Fakultas Matematika dan Ilmu
Pengetahuan Alam (FMIPA).
Selama mengikuti perkuliahan, penulis pernah menjadi asisten praktikum
Kimia Dasar pada tahun akademik 2005/2006. Penulis juga pernah melaksanakan
Praktik Kerja Lapangan (PKL) di Laboratorium Nutrisi, Balai Besar Riset
Perikanan dan Budidaya Laut (BBRPBL) Gondol, Bali, selama periode Juli
sampai Agustus 2006. Selain itu penulis pernah aktif di beberapa organisasi
kemahasiswaan, antara lain Keluarga Mahasiswa Katolik (Kemaki) dan
Community of Research and Education in Biochemistry
(CREB’s) pada periode
DAFTAR ISI
Halaman
DAFTAR GAMBAR... ix
DAFTAR LAMPIRAN………...………..……… ix
PENDAHULUAN... 1
TINJAUAN PUSTAKA
Pare (
Momordica charantia
)…..………...
2
Radikal bebas, antioksidan, dan lipid peroksida...……….………. 3
Streptozotosin...…..………...
5
BAHAN DAN METODE
Bahan dan Alat...
5
Metode ...
5
HASIL DAN PEMBAHASAN
Pengaruh STZ terhadap Bobot Badan Tikus...
7
Pengaruh STZ terhadap Lipid Peroksida Hati Tikus...
8
Konsentrasi Lipid Peroksida Hati Tikus yang Diberi Ekstrak Pare 9
SIMPULAN DAN SARAN...
11
DAFTAR PUSTAKA……….
11
DAFTAR GAMBAR
Halaman
1 Buah pare... 2
2 Reaksi antara TBA dengan MDA... 4
3 Struktur streptozotosin (STZ)... 5
4 Bobot badan tikus (g) kelompok normal (I), kontrol positif STZ bertahap
(II), dan kontrol positif STZ tunggal (III)...…...…... 7
5 Konsentrasi lipid peroksida (nmol/g) kelompok normal (I), kontrol positif
STZ bertahap (II), dan kontrol positif STZ tunggal (III)... 8
6 Konsentrasi lipid peroksida hati (nmol/g) tikus kontrol positif STZ bertahap
(I), STZ bertahap dan pare dosis rendah (II), STZ bertahap dan pare dosis
tinggi (III)... 9
7 Konsentrasi lipid peroksida hati (nmol/g) tikus kontrol positif STZ tunggal
(I), STZ tunggal dan pare dosis rendah (II), STZ tunggal dan pare dosis
tinggi (III)... 9
DAFTAR LAMPIRAN
Halaman
1 Pengukuran konsentrasi lipid peroksida hati...………. 14
2 Penentuan panjang gelombang maksimum untuk lipid peroksida...……… 15
3 Hasil kurva standar TMP...……….. 16
4 Data lipid peroksida hati tikus...………... 18
5 Data bobot badan...……….. 19
PENDAHULUAN
Lipid peroksida merupakan suatu molekul yang terbentuk dari peroksidasi lipid, yaitu reaksi penyerangan oleh radikal bebas terhadap asam lemak tak jenuh majemuk atau poly unsaturated fatty acid
(PUFA) yang mengandung sedikitnya tiga ikatan rangkap. Reaksi ini dapat terjadi secara alami di dalam tubuh yang diakibatkan oleh pembentukan radikal bebas secara endogen dari proses metabolisme tubuh. Radikal bebas endogen antara lain bisa ditimbulkan oleh proses reduksi oksigen menjadi H2O pada rantai transpor elektron di
mitokondria.
Untuk mengontrol peroksidasi lipid dapat digunakan senyawa antioksidan yang
berperan sebagai penangkap (scavenger)
radikal bebas. Ada dua jenis antioksidan berdasarkan cara kerjanya, yaitu antioksidan pencegah yang mengurangi inisiasi rantai dan antioksidan pemutus rantai yang mempengaruhi propagasi rantai.
Diabetes melitus adalah salah satu penyakit atau kelainan metabolik yang paling sering dijumpai dalam masyarakat. Diabetes melitus ini merupakan penyakit degeneratif, yaitu penyakit akibat fungsi atau struktur dari jaringan atau organ tubuh yang secara progresif menurun karena usia atau pengaruh gaya hidup. Penderita diabetes pada umumnya mengalami hiperglikemia. Hiperglikemia ini disebabkan tubuh kekurangan insulin atau insulin yang ada tidak bekerja secara efektif, sehingga glukosa dalam darah tidak dapat dimanfaatkan oleh sel, yang kemudian memicu proses glukoneogenesis dan mobilisasi asam lemak dari jaringan adiposa untuk memenuhi kebutuhan energi sel. Mobilisasi asam lemak tersebut kemungkinan meningkatkan resiko terjadinya serangan terhadap PUFA. Oleh sebab itu, sangat mungkin ada hubungan antara hiperglikemia dengan kadar lipid peroksida pada darah dan hati seseorang.
Ada beberapa perlakuan atau kondisi dapat digunakan untuk menstimulasi terjadinya lipid peroksida seperti: defisiensi vitamin E, hiperkolesterolemia, dan kondisi hiperglikemia. Stimulasi lipid peroksida melalui kondisi hiperkolesterolemia dilakukan dengan memberikan diet lemak tinggi (Alviani 2007). Pada penelitian ini, kondisi yang dipilih untuk menstimulasi lipid peroksida adalah hiperglikemia yang diinduksi dengan cara memberikan STZ
secara intraperitoneal.
Dewasa ini penggunaan herbal dalam pengobatan komplementer dan alternatif di Indonesia kian meningkat. WHO memperkirakan 80% dari penduduk dunia saat ini menggunakan obat-obatan yang berasal dari bahan tanaman untuk berbagai aspek kesehatan masyarakat (Suganda 2002).
Selain makin populernya perilaku back to
nature, pengobatan alternatif tersebut sekaligus juga merupakan salah satu sumber pelayanan kesehatan yang mudah diperoleh, terjangkau oleh masyarakat luas, dan memiliki efek samping yang relatif kecil (aman). Convention on Biological Diversity (CBD) menyebutkan bahwa nilai pasar sediaan herbal yang meliputi produk jadi dan bahan baku mencapai US$ 43 milyar (Sampurno 2002). Berdasarkan data ini bila potensi tumbuhan obat di Indonesia dapat dikelola dengan benar maka bukan saja kebutuhan dalam negeri dapat terpenuhi, tetapi juga berpeluang menjadi sumber devisa negara. Hal ini didukung pula dengan tersedianya sumber daya alam dan keanekaragaman hayati yang berlimpah di Indonesia.
Salah satu herbal tradisional yang telah umum beredar dan dikonsumsi oleh masyarakat adalah buah pare, namun pada umumnya masyarakat hanya menggunakan pare sebagai salah satu bahan pangan dalam masakan. Beberapa sumber menyebutkan bahwa pare mengandung senyawa seperti flavonoid yang merupakan antioksidan. Sebagai antioksidan, senyawa flavonoid akan bereaksi dengan radikal bebas sehingga menghasilkan produk yang stabil sehingga kerusakan sel dapat dikurangi (Cadenas dan Packer 2002). Oleh sebab itu, pare diduga memiliki potensi antioksidan, namun pembuktian ilmiah mengenai pengaruh pemberian ekstrak pare terhadap kadar lipid peroksida hati tikus yang diinduksi dengan streptozotosin (STZ) belum ada.
2
TINJAUAN PUSTAKA
Pare (Momordica charantia)
Pare atau bitter gourd adalah tanaman yang tumbuh di daerah tropis, yaitu daerah Amazon (Amerika Selatan), Afrika Timur, Asia, dan Karibia (Taylor 2002). Di Indonesia tanaman pare hampir terdapat di seluruh daerah, sehingga dikenal dengan banyak nama lokal. Tanaman pare memiliki dua varietas yang terkenal, yaitu charantia
dan muricata. Varietas charantia disebut juga pare putih yang mempunyai ciri-ciri buah lonjong besar, berwarna hijau muda dan tidak begitu pahit. Varietas muricata lebih kecil atau pendek dan pahit.
Menurut Rukmana (1997) tanaman ini diklasifikasikan sebagai berikut: kerajaan Plantae, divisi Spermatophyta, subdivisi Angiospermae, kelas Dicotyledonae, ordo Curcubitales, famili Curcubitaceae, genus
Momordica, dan spesies Momordica
charantia L.
Rasa pahit pada daun dan buah disebabkan oleh sejenis glikosida yang disebut momordicin atau charantin. Buah pare mempunyai kegunaan yang luas, di antaranya untuk mengobati berbagai penyakit seperti diabetes, wasir, kerusakan hati, diare, sakit kuning, menambah produksi air susu ibu, sariawan, batuk, dan obat luka sehingga membuat pare digolongkan ke dalam obat-obatan tradisional.
Selain sebagai sayuran, sebagian masyarakat memanfaatkan pare untuk pengobatan berbagai jenis penyakit. Di Amerika, jus dari buah pare segar banyak dimanfaatkan untuk terapi penderita human immunodeficiency virus (HIV). Dari beberapa penelitian telah berhasil diisolasi suatu protein aktif dari biji pare yang berfungsi sebagai inhibitor sintesis protein yang dinamakan MAP 30.
Gambar 1 Buah pare
Kelompok protein ini disebut ribosom
inactivating protein atau RIP (Minami et al. 1992). Kondoe di dalam Budianto (2003) juga mengatakan bahwa RIP juga terdapat pada anggota famili Cucurbitaceae lainnya yaitu Luffa cylindrica dan Trichosantes kirilowii. Kelompok RIP ini merupakan protein yang dapat dimanfaatkan baik dalam bidang pertanian maupun kesehatan. Lin Huang et al. (1999) melaporkan bahwa MAP 30 yang diisolasi dari biji pare adalah suatu protein bioaktif yang dapat melawan sel tumor. Jackson dan Jones di dalam Budianto
et al. (2003) menyebutkan bahwa bahan aktif yang terkandung dalam buah pare, yaitu momordikosida K dan L dapat berperan dalam menghambat spermatogenesis dan bersifat reversibel, sehingga dapat digunakan sebagai kontrasepsi pada pria. Hal serupa juga dilaporkan oleh Girini et al. (2005), yakni kandungan glikosida triterpen dalam buah pare dapat menghambat motilitas dan viabilitas spermatozoa.
Tanaman pare diduga mengandung senyawa bioaktif yang bersifat hipoglikemik yaitu charantin (Taylor 2002). Senyawa ini tergolong fitosterol atau glikosida kompleks. Diduga ekstrak buah pare dapat meningkatkan laju metabolisme sel melalui peningkatan dan penggunaan glukosa oleh sel target yang efeknya bersifat antidiabetik.
Selain charantin, buah pare juga
mengandung hydroxytryptamine, vitamin A, B, dan C. Sedangkan bijinya mengandung momordisin. Buah pare juga dikatakan mengandung saponin, flavonoid, polifenol serta glikosida cucurbitacin
.
Buah pare yang dianggap baik sebagai sayuran maupun buah secara tradisional telah digunakan sebagai herbal anti-diabetes dan jus buahnya atau buah mentahnya secara ilmiah telah terbukti dapat menurunkan kadar glukosa darah pada uji dengan hewan percobaan maupun uji klinis pada manusia. Misalnya, uji ekstrak air,methanol, dan kloroform buah mentah pare pada tikus percobaan dengan dosis 20 mg/kg berat badan dapat menurunkan kadar glukosa darah puasa sebesar 48%, sebanding dengan penggunaan obat antidiabetika oral sintetik glibenklamida. Uji toksisitas yang dilakukan juga membuktikan bahwa ekstrak buah pare tersebut aman untuk dikonsumsi (Subroto 2006).
3
meningkatkan sekresi insulin, asupan glukosa jaringan, sintesis glikogen otot hati, oksidasi glukosa, dan menurunkan glukoneogenesis hati. Dalam percobaan dengan hewan pare terbukti memiliki mekanisme mirip dengan insulin dalam menurunkan kadar gula darah. Penelitian menunjukkan bahwa buah muda pare mengandung peptida aktif yang dinamakan MC6 yang berukuran 10 kD. Peptida tersebut terdiri dari 3 peptida aktif (MC6.1, MC6.2, dan MC6.3) yang terbukti
memiliki aktivitas hipoglikemik (Subroto 2006).
Dosis yang direkomendasikan untuk buah pare tergantung pada sediaannya. Dosis untuk tingtur berkisar antara 5 mL hingga 50 mL tiga kali sehari. Namun demikian, karena rasanya pahit maka sediaan pare dapat juga berbentuk tablet atau kapsul. Dosis untuk kapsul yang berisi bubuk kering berkisar antara 3-15 g/hari atau bila dalam bentuk ekstrak kering setara dengan 100-200 mg, 3 kali sehari.
Paten terbaru tentang pare di Kantor Paten Amerika Serikat yang diberikan kepada Pushpa Khanna dari India dengan no. US6,831,162 B2 lebih mengungkap khasiat biji buah pare sebagai antidiabetes. Paten tersebut mengungkap tentang isolasi senyawa yang dinamakan polipeptida-K dari biji buah pare. Senyawa dalam bentuk bubuk amorf tersebut diformulasikan dalam berbagai bentuk seperti tablet dan produk-produk
edible seperti biskuit dan permen karet yang tidak ditelan dengan segera.
Uji klinis yang dilakukan terhadap lebih dari 500 pasien diabetes menunjukkan bahwa sediaan yang mengandung 12 mg hingga 70 mg polipeptida-K tersebut cukup efektif dalam mengaktifkan insulin yang sudah non-aktif dan dapat meremajakan pankreas tergantung dari kekronisan kondisi patologi dari masing-masing individu pasien. Selain dapat menurunkan kadar gula darah, polipeptida-K juga mengendalikan hipertensi dengan cara mengendalikan total kolesterol, HDL, LDL, VLDL, dan trigliserida.
Radikal bebas, Antioksidan, dan Lipid Peroksida
Radikal bebas adalah suatu atom atau molekul yang memiliki satu atau lebih elektron tidak berpasangan dan sangat reaktif (Muhilal 1991). Radikal bebas, disimbolkan dengan tanda (•), dapat terbentuk secara endogen sebagai hasil proses metabolisme tubuh, atau secara eksogen misalnya melalui
proses adsorpsi radiasi (UV, sinar tampak, panas) dan melalui reaksi redoks (Gitawati 1995). Salah satu peluang terbentuknya radikal bebas secara endogen yaitu pada peristiwa reduksi oksigen di dalam rantai transpor elektron. Proses reduksi oksigen ini menghasilkan radikal superoksida (O2-•),
hidrogen peroksida (H2O2), dan radikal
hidroksil (OH•) sebagai zat perantara. Radikal bebas dalam upaya menstabilkan dirinya akan mencari pasangan elektron dari molekul lain. Di dalam tubuh, radikal bebas ini akan menarik elektron dari makromolekul di sekitarnya seperti protein, karbohidrat, lipid, maupun DNA yang merupakan bagian dari sel. Jika terjadi kerusakan pada unsur-unsur tersebut, pada akhirnya akan mengarah pada kerusakan sel (Halliwel&Gutteridge 1985).
Lipid peroksida adalah suatu molekul yang terbentuk dari peroksidasi lipid. Peroksidasi lipid adalah reaksi yang terjadi antara radikal bebas dengan PUFA yang mengandung sedikitnya tiga ikatan rangkap (Halliwell & Gutteridge 1985). Reaksi peroksidasi lipid diawali oleh pengambilan sebuah atom hidrogen dari gugus metilena (-CH2) pada PUFA oleh radikal bebas. Pada
tahap ini terjadi pembentukan radikal bebas karbon (-CH-•) yang disebabkan adanya ikatan rangkap pada asam lemak yang dapat melemahkan ikatan antara atom C dan H yang berdekatan dengan ikatan rangkap, sehingga atom H mudah diambil oleh radikal bebas. Tahap selanjutnya yaitu penstabilan radikal bebas karbon melalui penataan ulang ikatan rangkap, sehingga terbentuk diena terkonjugasi. Apabila diena terkonjugasi
bereaksi dengan O2, maka akan terbentuk
radikal lipid peroksida (ROO•). Hadirnya radikal peroksida ini dapat memudahkan pengambilan atom hidrogen dari molekul lipid lain, sehingga tahap ini disebut sebagai tahap propagasi. Radikal peroksida selanjutnya dapat bergabung dengan atom H yang lain membentuk lipid hidroperoksida dan radikal bebas yang baru. Jalur lain yang ditempuh oleh radikal peroksida yaitu dengan membentuk peroksida siklik yang disebut dengan enderoperoksida. Tahap terminasi terjadi bila radikal lipid peroksida bereaksi dengan antioksidan atau senyawa biologi seperti protein (Tabel 1).
4
Tabel 1 Tahapan reaksi pembentukan radikal bebas
Tahapan Reaksi 1. Inisiasi RH + OH 2.
Propagasi
R• + O2
ROO• + RH → ROOH + R• 3.
Terminasi
ROO• + ROO•→ ROOR + O2
ROO• + R• → ROOR R• + R•
tubuh seperti besi (Fe) dan tembaga (Cu) dapat mengkatalisis penguraian lipid hidroperoksida hingga membentuk produk yang berbahaya seperti epoksida, keton, asam, dan aldehida. Beberapa contoh aldehida yang dihasilkan dari peruraian peroksida adalah malondialdehida (MDA) dan 4-hidroksinonenal. Kedua produk aldehida tersebut dapat menyerang protein terutama pada gugus thiol (-SH) dan gugus
amino (-NH2), sehingga enzim-enzim yang
membutuhkan senyawa-senyawa tersebut untuk aktivitasnya akan terhambat bila peroksidasi lipid sedang berlangsung (Sulistyo 1998).
Konsentrasi lipid peroksida yang berlebih pada darah maupun organ dapat mengakibatkan berbagai penyakit degeneratif. Menurut Yagi (1994) bila kadar lipid peroksida di hati meningkat, maka lipid peroksida ini dapat keluar dan akan merusak organ atau jaringan lain. Pada manusia, lipid peroksida dalam darah akan meningkat seiring dengan bertambahnya usia, tetapi jumlahnya tidak boleh melebihi konsentrasi normalnya, yaitu 4 nmol/mL.
Konsentrasi lipid peroksida dapat diukur dengan metode asam tiobarbiturat (TBA) yang akan mengukur adanya MDA (malondialdehida) sebagai produk reaksi peroksidasi lipid. Asam tiobarbiturat akan bereaksi dengan gugus karbonil dari MDA, yaitu satu molekul MDA akan berikatan dengan dua molekul TBA. Reaksi ini akan menghasilkan senyawa kompleks berwarna merah yang serapannya dapat diukur secara spektrofotometri (Gambar 2).
Gambar 2 Reaksi antara TBA dengan MDA Sumber: Halliwel&Gutteridge (1985)
Untuk mengontrol radikal bebas, dapat digunakan senyawa-senyawa yang berperan sebagai penangkap radikal bebas atau dikenal sebagai antioksidan. Antioksidan didefinisikan sebagai senyawa yang dapat memberikan elektron kepada radikal bebas. Proses antioksidasi dapat terjadi pada enzim yang berperan mengubah senyawa radikal bebas menjadi senyawa yang lebih stabil. Misalnya enzim superoksida dismutase (SOD) yang mengubah radikal O2- menjadi
H2O2 dan O2.
O2- + O2- + H+ + H+ SOD H2O2 + O2
Mekanisme kerja antioksidan pada senyawa radikal bebas ada tiga macam, yaitu (1) antioksidan primer yang berperan untuk mengurangi pembentukan radikal bebas baru dengan cara memutus reaksi berantai dan mengubahnya menjadi produk yang lebih stabil. Antioksidan primer ini terdiri atas superoksida dismutase (SOD), katalase, dan glutation peroksidase. Ketiga contoh antioksidan tersebut dapat mengubah radikal superoksida menjadi air. (2) antioksidan sekunder yang berperan untuk mengikat radikal bebas dan mencegah amplifikasi senyawa radikal. Antioksidan sekunder terdapat pada vitamin C, vitamin B, vitamin E, betakaroten, dan senyawa-senyawa fitokimia. (3) antioksidan tersier yang berperan dalam mekanisme biomolekuler. Antioksidan tersier terdiri atas enzim perbaikan DNA dan metionin sulfoksida reduktase (Kartikawati 1999)
5
fitokimia. Fitokimia merupakan antioksidan alami yang terdapat pada tanaman. Beberapa contoh fitokimia, yaitu golongan karotenoid, flavonoid, fitostrerol, dan polifenol. Senyawa turunan fenol tersebar luas dalam tumbuhan dan beberapa diantaranya lebih efektif dibandingkan dengan senyawa antioksidan sintetik (Muhilal 1991). Fitokimia yang umum terdapat pada tumbuhan tingkat tinggi antara lain asam askorbat (vitamin C), karoten, flavonoid, saponin, tanin, dan tokoferol. Zat antioksidan alami lain adalah isoflavon. Isoflavon termasuk golongan isoflavonoid yang merupakan isomer flavon. Senyawa ini banyak terkandung pada tanaman kacang-kacangan, terutama kacang kedelai.
Streptozotosin
Streptozotosin (2-deoksi-2-(3-metil-3-(nitrosoureido)-D-glukopiranosa) merupakan
senyawa hasil sintesis Streptomycetes
achromogenes dan digunakan untuk menginduksi diabetes pada hewan coba,baik diabetes melitus tergantung insulin (IDDM) atau tidak tergantung insulin (NIDDM). Struktur STZ dicirikan dengan adanya metilnitrourea yang berikatan pada atom C ke-2 glukosa (Gambar 3).
Menurut Ganda dalam tulisan Szkudelski (2001) penggunaan dosis yang digunakan pada tikus untuk menginduksi IDDM secara intravena di antara 40 dan 60 mg/kg BB, berhasil juga secara intraperitoneal dengan dosis yang sama atau lebih tinggi, dan kurang efektif di bawah 40 mg/kg BB, meskipun juga tergantung spesiesnya. Dengan suntikan STZ sebanyak 50 mg/kg BB secara intravena pada tikus, kadar glukosa darah dapat meningkat sampai sekitar 15mM (270 mg/dL) setelah 2 minggu).
Senyawa STZ masuk ke dalam sel-β
pankreas melalui glucose transporter 2
(GLUT 2). Ekspresi GLUT 2 yang tereduksi akibat kerja STZ sebagai zat diabetogenik
Gambar 3 Struktur STZ
ditemukan oleh Schenedl dan Thulesen. Metabolisme STZ dalam sel akan membentuk komponen karbamoilasi seluler, karbamoilasi intermolekular dan komponen seluler alkilasi. Pada tahap awal, STZ akan diubah menjadi senyawa isosianat dan melepaskan metilnitrourea. Isosianat dapat membentuk berbagai macam senyawa karbamoilasi intramolekuler. Metilnitrourea yang dilepaskan membentuk metildiazohidroksida yang dapat menyisipkan gugus alkil pada berbagai macam komponen seluler seperti
DNA, protein, atau bereaksi dengan H2O
membentuk metanol.
Sifat diabetogenik STZ diduga terjadi karena kerusakan DNA dalam sel-sel B pancreas. Elsner et al. (2000) melaporkan bahwa penyebab kematian sel-sel B pankreas hasil induksi STZ adalah alkilasi DNA. Di samping itu kerusakan DNA pada sel B diduga juga akibat aktivitas senyawa oksigen reaktif dari nitrit oksida (NO