SKRINI DAR
ING FITO RI BEBER
(Tith
HA
PROGRA
UNIV
OKIMIA D RAPA EKS
honia diver
ANNA SA
NI
AM EKST
FAKU
VERSITA
DAN UJI A STRAK D
rsifolia (H
SKRIPS
OLEH
ANTI P. SI
IM 10152
TENSI SA
ULTAS FA
AS SUMA
MEDAN
2013
AKTIVIT DAUN KEM Hemsley) A
SI
:
IBAGAR
24075
ARJANA
ARMASI
ATERA U
N
TAS ANTIB MBANG B A. Gray)
RIANG
A FARMA
I
UTARA
BAKTER BULAN
ASI
S
ANT
DiajuSKRININ
TIBAKTE
(
Titho
ukan untuk gelar HPROGRA
UNIV
NG FITOK
ERI DAR
KEM
onia diver
k melengka Sarjana Fa Univers HANNA SA NAM EKST
FAKU
VERSITA
KIMIA D
RI BEBER
MBANG B
rsifolia
(H
SKRIPS
api salah sa armasi pad sitas Suma
OLEH: ANTI P. SI NIM 101524
TENSI SA
ULTAS FA
AS SUMA
MEDAN
2013
DAN UJI A
RAPA EK
BULAN
Hemsley) A
SI
PENGESAHAN SKRIPSI
SKRINING FITOKIMIA DAN UJI AKTIVITAS
ANTIBAKTERI DARI BEBERAPA EKSTRAK DAUN
KEMBANG BULAN
(
Tithonia diversifolia
(Hemsley) A. Gray)
OLEH:
HANNA SANTI P. SIBAGARIANG NIM 101524075
Dipertahankan di hadapan Panitia Penguji Skripsi Fakultas Farmasi Universitas Sumatera Utara Pada tanggal: Oktober 2013
Pembimbing I, Panitia Penguji,
Drs. Suryadi Achmad, M.Sc., Apt. Dra. Masfria, M.S., Apt. NIP 195109081985031002 NIP 195707231986012001
Drs. Suryadi Achmad, M.Sc., Apt.
NIP 195109081985031002
Pembimbing II, Drs. Panal Sitorus, M.Si., Apt. NIP 195310301980031002
Drs. Awaluddin Saragih, M.Si., Apt. Dra. Herawaty Ginting, M.Si., Apt. NIP 195008221974121002 NIP 195112231980032002
Medan, Oktober 2013 Fakultas Farmasi
Universitas Sumatera Utara Dekan,
KATA PENGANTAR
Segala puji syukur penulis sampaikan ke hadirat Allah SWT yang telah
melimpahkan rahmat dan karunia-Nya, sehingga penulis dapat melaksanakan
penelitian dan menyelesaikan penulisan skripsi ini. Tujuan penelitian ini adalah
untuk melakukan”Skrining Fitokimia Dan Uji Aktivitas Antibakteri Dari
Beberapa Ekstrak Daun Kembang Bulan (Tithonia diversifolia (Hemsley)
A. Gray). Skripsi ini diajukan sebagai salah satu syarat untuk memperoleh
gelar Sarjana Farmasi pada Fakultas Farmasi Universitas Sumatera Utara.
Pada kesempatan ini penulis menyampaikan terima kasih yang
sebesar-besarnya kepada:
1. Bapak Prof. Dr. Sumadio Hadisahputra, Apt., selaku Dekan Fakultas
Farmasi Universitas Sumatera Utara yang telah memberikan fasilitas
sehingga penulis dapat menyelesaikan pendidikan.
2. Bapak Drs. Suryadi Achmad, M.Sc., Apt., dan Bapak Drs. Awaluddin
Saragih, M.Si., Apt., yang telah membimbing dengan penuh kesabaran,
tulus dan ikhlas selama penelitian hingga selesainya penulisan skripsi ini.
3. Ibu T. Ismanelly Hanum, S.Si., M.Si., Apt., selaku penasehat akademis
yang memberikan bimbingan kepada penulis selama ini.
4. Bapak dan Ibu staf pengajar Fakultas Farmasi Universitas Sumatera Utara
yang telah mendidik selama perkuliahan.
5. Ibu Dra. Masfria, M.S., Apt., Bapak Drs. Panal Sitorus, M.Si., Apt, dan
Ibu Dra. Herawaty Ginting, M.Si., Apt., yang telah memberikan masukan,
Penulis mengucapkan terima kasih yang tak terhingga kepada kedua
orang tua, Ayahanda Bisler Sibagariang, Ibunda Sanggum Silaban, Suami,
Abang, Adik dan Sahabatku atas do’a, motivasi dan pengorbanan yang tulus
baik moril maupun materil. Terima kasih juga kepada teman-teman Farmasi
angkatan 2010, kakak-kakak dan adik-adik yang juga turut memberi motivasi
dan do’a dalam penyelesaian skripsi ini.
Penulis menyadari bahwa skripsi ini masih banyak kekurangannya, oleh
karena itu sangat diharapkan kritik dan saran yang bersifat membangun dari
semua pihak guna perbaikan skripsi ini. Akhir kata penulis berharap semoga
skripsi ini bermanfaat bagi ilmu pengetahuan khususnya bidang Farmasi.
Medan, September 2013 Penulis
SKRINING FITOKIMIA DAN UJI AKTIVITAS ANTIBAKTERI DARI BEBERAPA EKSTRAK DAUN KEMBANG BULAN
(Tithonia diversifolia (Hemsley) A. Gray)
ABSTRAK
Daun kembang bulan (Tithonia diversifolia (Hemsley) A. Gray) termasuk suku Asteraceae. Daun kembang bulan secara tradisional digunakan sebagai obat luka atau luka lebam dan sebagai obat sakit perut kembung. Penelitian ini bertujuan untuk mengetahui golongan senyawa kimia dan aktivitas antibakteri ekstrak daun kembang bulan.
Karakterisasi simplisia meliputi pemeriksaan makroskopik, mikroskopik, penetapan kadar air, penetapan kadar sari larut dalam air, penetapan kadar sari larut dalam etanol, penetapan kadar abu total dan penetapan kadar abu tidak larut dalam asam. Skrining fitokimia dilakukan terhadap serbuk simplisia dan ekstrak daun kembang bulan. Ekstraksi dilakukan dengan cara perkolasi berkesinambungan menggunakan pelarut n -heksan, etilasetat dan etanol 70%. Uji aktivitas antibakteri dilakukan secara in
vitro menggunakan metode difusi agar dengan mengukur diameter zona
hambat sekitar punch hole.
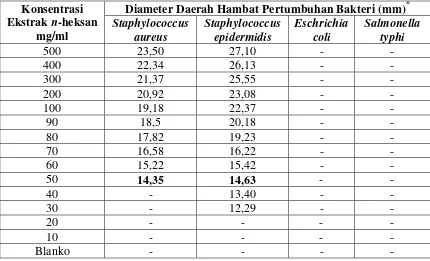
Hasil karakterisasi simplisia daun kembang bulan diperoleh kadar air 7,99%, kadar sari yang larut dalam air 22,95%, kadar sari yang larut dalam etanol 15,27%, kadar abu total 5,25% dan kadar abu yang tidak larut dalam asam 0,29%. Berdasarkan hasil pemeriksaan skrining fitokimia terhadap serbuk simplisia daun kembang bulan terdapat kandungan senyawa kimia golongan steroid/triterpenoid, glikosida, flavonoid, saponin dan tanin. Hasil pemeriksaan skrining fitokimia pada ekstrak n-heksan hanya terdapat kandungan senyawa kimia golongan steroid/triterpenoid, ekstrak etilasetat terdapat kandungan senyawa kimia golongan glikosida dan flavonoid serta ekstrak etanol terdapat kandungan senyawa kimia golongan steroid/triterpenoid, glikosida, flavonoid, saponin dan tanin. Ekstrak daun kembang bulan mempunyai aktivitas antibakteri terhadap bakteri Staphylococcus aureus dan Staphylococcus epidermidis, pada bakteri Escherichia coli dan Salmonella typhi tidak mempunyai aktivitas antibakteri. Hasil uji aktivitas dari ekstrak n-heksan tersebut diperoleh Konsentrasi Hambat Minimum (KHM) bakteri
Staphylococcus aureus sebesar 50 mg/ml dan bakteri Staphylococcus
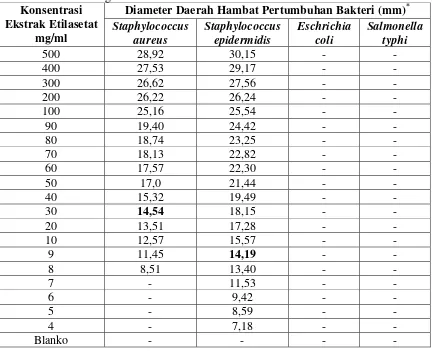
epidermidis sebesar 30 mg/ml, hasil uji aktivitas dari ekstrak etilasetat tersebut diperoleh Konsentrasi Hambat Minimum (KHM) bakteri Staphylococcus
aureus sebesar 8 mg/ml dan bakteri Staphylococcus epidermidis sebesar 4
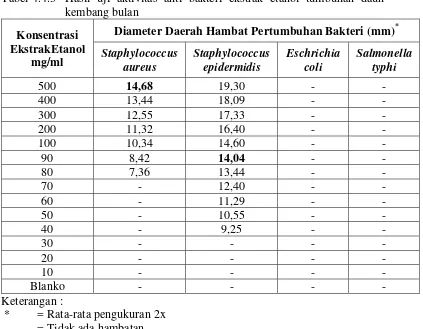
mg/ml, dan hasil uji aktivitas dari ekstrak etanol tersebut diperoleh Konsentrasi Hambat Minimum (KHM) bakteri Staphylococcus aureus sebesar 50 mg/ml dan bakteri Staphylococcus epidermidis sebesar 40 mg/ml.
PHYTOCHEMICAL SCREENING AND ANTIBACTERIAL ACTIVITY TEST OF EXTRACT OF KEMBANG BULAN LEAVES (Tithonia
diversifolia (Hemsley) A. Gray)
ABSTRACT
Kembang bulan leaves (Tithonia diversifolia (Hemsley) A. Gray) are included in the Asteraceae family. Kembang bulan leaves are traditionally used to cure wounds or bruises, stomachache and bloating. This study aims to determine the class of chemical compounds and antibacterial activity of kembang bulan leaves extract.
Simplex characterization included macroscopic and microscopic investigation, determination of water level, water-soluble extract level, ethanol-soluble extract level, total ashes level and acid-inethanol-soluble ashes level. Phytochemical screening was performed on simplex and extract of kembang bulan leaves. Fractionation was carried out by continuous percolation using n -hexane, ethylacetate and ethanol 70% as the solvent. Antibacterial activity test was performed in vitro using agar diffusion method by measuring the diameter of inhibition zone around punch hole.
Results of kembang bulan leaves simplex characterization showed water level 7.99%, water-soluble extract level 22.95%, ethanol-soluble extract level 15.27%, total ashes level 5.25% and acid-insoluble ashes level 0.29%. Simplex phytochemical screening showed the presence of glycoside, saponin, flavonoid, tannin and steroid/triterpenoid compounds. While, phytochemical screening of n-hexane extract contained only steroid/triterpenoid compounds, ethylacetate extract contained glycoside and flavonoid compounds and ethanol extract contained saponin, flavonoid and tannin compounds. Extract of kembang bulan leaves showed antibacterial activity on bacteria Staphylococcus
aureus and Staphylococcus epidermidis and no inhibition on bacteria
Eschericia coli and Salmonella typhi. Activity tests of n-hexane extract showed minimum inhibition concentration (MIC) on bacteria Staphylococcus aureus was 50 mg/ml and bacteria Staphylococcus epidermidis was 30 mg/ml. Activity tests of ethylacetate extract showed minimum inhibition concentration (MIC) on bacteria Staphylococcus aureus was 8 mg/ml and bacteria Staphylococcus epidermidis was 4 mg/ml and activity tests of ethanol extract showed minimum inhibition concentration (MIC) on bacteria Staphylococcus aureus was 50 mg/ml and bacteria Staphylococcus epidermidis was 40 mg/ml.
DAFTAR ISI
JUDUL
PENGESAHAN SKRIPSI
KATA PENGANTAR
ABSTRAK
ABSTRACT
DAFTAR ISI
DAFTAR TABEL
DAFTAR GAMBAR
DAFTAR LAMPIRAN
BAB I PENDAHULUAN
1.1 Latar Belakang
1.2 Perumusan Masalah
1.3 Hipotesis
1.4 Tujuan Penelitian
1.5 Manfaat Penelitian
BAB II TINJAUAN PUSTAKA
2.1 Uraian Tumbuhan
2.1.1 Habitat dan Daerah Tumbuh
2.1.2 Morfologi
2.1.3 Sistematika Tumbuhan
2.1.4 Nama Lain
2.1.5 Khasiat dan Penggunaan
2.2 Kandungan Kimia
2.2.1 Steroid dan Triterpenoid
Halaman
i
ii
iii
v
vi
vii
xii
xiii
xiv
1
1
3
3
4
4
5
5
5
5
6
6
6
7
2.2.2 Glikosida
2.2.3 Flavonoid
2.2.4 Saponin
2.2.5 Tanin
2.3 Ekstraksi
2.4 Bakteri
2.4.1 Klasifikasi Bakteri
2.4.2 Fase Pertumbuhan Bakteri
2.4.3 Uji Aktivitas Antimikroba
BAB III METODE PENELITIAN
3.1 Tempat Pelaksanaan Penelitian
3.2 Metode Penelitian
3.3 Alat dan Bahan
3.3.1 Alat
3.3.2 Bahan
3.4 Penyediaan Sampel
3.4.1 Pengumpulan Bahan
3.4.2 Identifikasi Sampel
3.4.3 Pengolahan Bahan
3.5 Pemeriksaan Karakterisasi Simplisia
3.5.1 Pemeriksaan organoleptik
3.5.2 Pemeriksaan Makroskopik
3.5.3 Pemeriksaan Mikroskopik
3.5.4 Penetapan Kadar Air
3.5.5 Penetapan Kadar Abu Total
3.5.6 Penetapan Kadar Abu Tidak Larut dalam Asam
8
9
10
10
11
13
13
17
21
23
23
23
23
23
24
24
24
25
25
25
25
25
26
26
27
3.5.7 Penetapan Kadar Sari yang Larut dalam Air
3.5.8 Penetapan Kadar Sari yang Larut dalam Etanol
3.6 Pembuatan Larutan Pereaksi
3.6.1 Besi (III) klorida 1%
3.6.2 Bouchardat
3.6.3 Dragendorff
3.6.4 Mayer
3.6.5 Molish
3.6.6 Asam Klorida 2N
3.6.7 Asam Sulfat 2N
3.6.8 Natrium Hidroksida 2 N
3.6.9 Kloralhidrat
3.6.10 Liebermann-Bouchard
3.6.11 Timbal (II) asetat 0,4 M
3.7 Skrining Fitokimia
3.7.1 Pemeriksaan Steroid/triterpenoid
3.7.2 Pemeriksaan Alkaloida
3.7.3 Pemeriksaan Glikosida
3.7.4 Pemeriksaan Flavonoid
3.7.5 Pemeriksaan Saponin
3.7.6 Pemeriksaan Tanin
3.8 Pembuatan Ekstrak Daun Kembang Bulan
3.9 Sterilisasi Alat dan Bahan
3.10 Pembuatan Media
3.10.1 Pembuatan Nutrien Agar (NA)
3.10.2 Pembuatan Muller Hinton Agar (MHA)
3.10.3 Pembuatan Nutrien Broth (NB)
3.11 Pembuatan Suspensi Standar Mc.Farland
3.12 Pembiakan Bakteri
3.12.1 Pembuatan Stok Kultur Bakteri
3.12.2 Pembuatan Inokulum Bakteri
3.13 Pembuatan larutan Uji dengan Berbagai Konsentrasi
3.13.1 Pembuatan Larutan Uji Ekstrak n-Heksan, Etilasetat
dan Etanol
3.14 Pengujian Aktivitas Antibakteri Ekstrak n-Heksan, Etilasetat dan Etanol
BAB IV HASIL DAN PEMBAHASAN
4.1 Hasil Identifikasi Tumbuhan
4.2 Hasil Pemeriksaan Karakterisasi
4.2.1 Hasil Pemeriksaan Karakterisasi Simplisia
4.2.2 Hasil Skrining Fitokimia
4.3 Hasil Perkolasi
4.4 Hasil Uji Aktivitas Antibakteri Ekstrak Daun Kembang Bulan terhadap Bakteri Staphylococcus aureus, Staphylococcus epidermidis, Escherichia coli dan Salmonella typhi
BAB V KESIMPULAN DAN SARAN
DAFTAR TABEL
Tabel 4.2.1
Tabel 4.2.2
Tabel 4.4.1
Tabel 4.4.2
Tabel 4.4.3
Hasil Pemeriksaan Karakterisasi Simplisia
Hasil Skrining Fitokimia
Hasil Uji Aktivitas Antibakteri Ekstrak n-Heksan Tumbuhan Daun Kembang Bulan
Hasil Uji Aktivitas Antibakteri Ekstrak Etilasetat Tumbuhan Daun Kembang Bulan
Hasil Uji Aktivitas Antibakteri Ekstrak Etanol Tumbuhan Daun Kembang Bulan
Halaman
39
40
42
43
DAFTAR GAMBAR
Gambar 1.
Gambar 2.
Gambar 3.
Gambar 4.
Gambar 5.
Gambar 6.
Gambar Tumbuhan Daun Kembang Bulan
Gambar Daun Kembang Bulan
Gambar Simplisia dan Serbuk Simplisia Daun Kembang Bulan
Gambar Mikroskopik Secara Melintang dan Serbuk Simplisia Daun Kembang Bulan
Gambar Pengujian Aktivitas Antibakteri Ekstrak Daun Kembang BulanTerhadap Bakteri Gram Positif
Gambar Pengujian Aktivitas Antibakteri Ekstrak Daun Kembang BulanTerhadap Bakteri Gram Negatif
Halaman 54
54
55
56
69
DAFTAR LAMPIRAN Lampiran 1. Lampiran 2. Lampiran 3. Lampiran 4. Lampiran 5. Lampiran 6. Lampiran 7 . Lampiran 8. Lampiran 9. Lampiran 10. Lampiran 11. Lampiran 12. Lampiran 13. Lampiran 14.
Hasil Identifikasi Tumbuhan Daun Kembang Bulan
Gambar Tumbuhan Daun Kembang Bulan
Gambar Mikroskopik Daun Kembang Bulan
Perhitungan Data
Bagan Penelitian
Bagan Pengolahan Bahan Tanaman
Bagan Pembuatan Ekstrak n-Heksan, Etilasetat dan Etanol Serbuk Simplisia Daun Kembang Bulan
Bagan Uji Aktivitas Antibakteri dari Larutan Uji
Hasil Pengukuran daerah Hambat pertumbuhan Bakteri Ekstrak Daun Kembang Bulan
Gambar Zona Hambat Ekstrak Tumbuhan Daun Kembang Bulan Terhadap Bakteri Staphylococcus aureus
Gambar Zona Hambat Ekstrak Tumbuhan Daun Kembang Bulan Terhadap Bakteri Staphylococcus epidermidis
Gambar Zona Hambat Ekstrak Tumbuhan Daun Kembang Bulan Terhadap Bakteri Escherichia coli
Gambar Zona Hambat Ekstrak Tumbuhan Daun Kembang Bulan Terhadap Bakteri Salmonella typhi
Gambar Zona Hambat Uji Blanko Pelarut
n-Heksan, Etilasetat dan Etanol
SKRINING FITOKIMIA DAN UJI AKTIVITAS ANTIBAKTERI DARI BEBERAPA EKSTRAK DAUN KEMBANG BULAN
(Tithonia diversifolia (Hemsley) A. Gray)
ABSTRAK
Daun kembang bulan (Tithonia diversifolia (Hemsley) A. Gray) termasuk suku Asteraceae. Daun kembang bulan secara tradisional digunakan sebagai obat luka atau luka lebam dan sebagai obat sakit perut kembung. Penelitian ini bertujuan untuk mengetahui golongan senyawa kimia dan aktivitas antibakteri ekstrak daun kembang bulan.
Karakterisasi simplisia meliputi pemeriksaan makroskopik, mikroskopik, penetapan kadar air, penetapan kadar sari larut dalam air, penetapan kadar sari larut dalam etanol, penetapan kadar abu total dan penetapan kadar abu tidak larut dalam asam. Skrining fitokimia dilakukan terhadap serbuk simplisia dan ekstrak daun kembang bulan. Ekstraksi dilakukan dengan cara perkolasi berkesinambungan menggunakan pelarut n -heksan, etilasetat dan etanol 70%. Uji aktivitas antibakteri dilakukan secara in
vitro menggunakan metode difusi agar dengan mengukur diameter zona
hambat sekitar punch hole.
Hasil karakterisasi simplisia daun kembang bulan diperoleh kadar air 7,99%, kadar sari yang larut dalam air 22,95%, kadar sari yang larut dalam etanol 15,27%, kadar abu total 5,25% dan kadar abu yang tidak larut dalam asam 0,29%. Berdasarkan hasil pemeriksaan skrining fitokimia terhadap serbuk simplisia daun kembang bulan terdapat kandungan senyawa kimia golongan steroid/triterpenoid, glikosida, flavonoid, saponin dan tanin. Hasil pemeriksaan skrining fitokimia pada ekstrak n-heksan hanya terdapat kandungan senyawa kimia golongan steroid/triterpenoid, ekstrak etilasetat terdapat kandungan senyawa kimia golongan glikosida dan flavonoid serta ekstrak etanol terdapat kandungan senyawa kimia golongan steroid/triterpenoid, glikosida, flavonoid, saponin dan tanin. Ekstrak daun kembang bulan mempunyai aktivitas antibakteri terhadap bakteri Staphylococcus aureus dan Staphylococcus epidermidis, pada bakteri Escherichia coli dan Salmonella typhi tidak mempunyai aktivitas antibakteri. Hasil uji aktivitas dari ekstrak n-heksan tersebut diperoleh Konsentrasi Hambat Minimum (KHM) bakteri
Staphylococcus aureus sebesar 50 mg/ml dan bakteri Staphylococcus
epidermidis sebesar 30 mg/ml, hasil uji aktivitas dari ekstrak etilasetat tersebut diperoleh Konsentrasi Hambat Minimum (KHM) bakteri Staphylococcus
aureus sebesar 8 mg/ml dan bakteri Staphylococcus epidermidis sebesar 4
mg/ml, dan hasil uji aktivitas dari ekstrak etanol tersebut diperoleh Konsentrasi Hambat Minimum (KHM) bakteri Staphylococcus aureus sebesar 50 mg/ml dan bakteri Staphylococcus epidermidis sebesar 40 mg/ml.
PHYTOCHEMICAL SCREENING AND ANTIBACTERIAL ACTIVITY TEST OF EXTRACT OF KEMBANG BULAN LEAVES (Tithonia
diversifolia (Hemsley) A. Gray)
ABSTRACT
Kembang bulan leaves (Tithonia diversifolia (Hemsley) A. Gray) are included in the Asteraceae family. Kembang bulan leaves are traditionally used to cure wounds or bruises, stomachache and bloating. This study aims to determine the class of chemical compounds and antibacterial activity of kembang bulan leaves extract.
Simplex characterization included macroscopic and microscopic investigation, determination of water level, water-soluble extract level, ethanol-soluble extract level, total ashes level and acid-inethanol-soluble ashes level. Phytochemical screening was performed on simplex and extract of kembang bulan leaves. Fractionation was carried out by continuous percolation using n -hexane, ethylacetate and ethanol 70% as the solvent. Antibacterial activity test was performed in vitro using agar diffusion method by measuring the diameter of inhibition zone around punch hole.
Results of kembang bulan leaves simplex characterization showed water level 7.99%, water-soluble extract level 22.95%, ethanol-soluble extract level 15.27%, total ashes level 5.25% and acid-insoluble ashes level 0.29%. Simplex phytochemical screening showed the presence of glycoside, saponin, flavonoid, tannin and steroid/triterpenoid compounds. While, phytochemical screening of n-hexane extract contained only steroid/triterpenoid compounds, ethylacetate extract contained glycoside and flavonoid compounds and ethanol extract contained saponin, flavonoid and tannin compounds. Extract of kembang bulan leaves showed antibacterial activity on bacteria Staphylococcus
aureus and Staphylococcus epidermidis and no inhibition on bacteria
Eschericia coli and Salmonella typhi. Activity tests of n-hexane extract showed minimum inhibition concentration (MIC) on bacteria Staphylococcus aureus was 50 mg/ml and bacteria Staphylococcus epidermidis was 30 mg/ml. Activity tests of ethylacetate extract showed minimum inhibition concentration (MIC) on bacteria Staphylococcus aureus was 8 mg/ml and bacteria Staphylococcus epidermidis was 4 mg/ml and activity tests of ethanol extract showed minimum inhibition concentration (MIC) on bacteria Staphylococcus aureus was 50 mg/ml and bacteria Staphylococcus epidermidis was 40 mg/ml.
BAB I PENDAHULUAN
1.1 Latar Belakang
Indonesia merupakan salah satu negara penghasil tanaman obat yang
potensial dengan keanekaragaman hayati yang dimilikinya. Keanekaragaman
hayati Indonesia menempati urutan ketiga terbesar di dunia setelah Brazil dan
Zaire. Jika dilihat dari keanekaragaman floranya, cukup banyak jenis tumbuhan
yang dapat dimanfaatkan sebagai tanaman obat (Hernani, 2004).
Pengunaan obat tradisional semakin disukai dari pada obat yang dibuat
secara kimia, oleh karena mahalnya obat-obatan kimia membuat masyarakat
beralih ke tumbuhan. Penggunaan tumbuhan di masyarakat terutama untuk
mencegah penyakit, menjaga kesegaran tubuh maupun mengobati penyakit
(Mursito, 2001).
Banyak tumbuh-tumbuhan mengandung golongan senyawa kimia
seperti flavonoid yang menunjukkan sifat antimikroba. Beberapa golongan
fenol seperti flavonoid, tanin dan senyawa fenol lainnya berfungsi sebagai alat
pertahanan bagi tumbuhan untuk melawan mikroorganisme patogen (Hayet, et
al., 2008).
Tumbuhan kembang bulan (Tithonia diversifolia (Hemsley) A.Gray)
merupakan salah satu tumbuhan yang secara tradisional digunakan masyarakat
untuk menyembuhkan berbagai penyakit. Daun kembang bulan mengandung
senyawa steroid/triterpenoid, glikosida, flavonoid, saponin dan tanin
Penggunaan tumbuhan kembang bulan digunakan untuk
menyembuhkan luka dan untuk menyembuhkan sakit perut kembung, penyakit
lepra dan penyakit lever (Anonim, 2012; Hutapea, 1994). Di Kabupaten
Tapanuli Utara, pada umumnya masyarakat memakai tumbuhan kembang
bulan untuk menyembuhkan luka, penggunaannya dengan cara daunnya
diremas-remas ditangan kemudian ditempelkan pada kulit yang luka, untuk
menyembuhkan sakit perut dan sebagai pupuk.
Berdasarkan uraian di atas, maka perlu dilakukan uji aktivitas
antibakteri daun kembang bulan secara perkolasi berkesinambungan dengan
menggunakan pelarut n-heksan, etilasetat, dan etanol 70% yang mempunyai
aktivitas antibakteri terhadap bakteri Staphylococcus aureus, Staphylococcus
epidermidis, Escherichia coli dan Salmonella typhi. Sebelumnya dilakukan
pemeriksaan makroskopik, mikroskopik, penetapan kadar abu total, penetapan
kadar abu tidak larut asam, penetapan kadar air, penetapan kadar sari larut
1.2 Perumusan Masalah
1. Bagaimana karakteristik dari simplisia daun kembang bulan (Tithonia
diversifolia (Hemsley) A. Gray).
2. Golongan senyawa kimia apa yang terdapat pada ekstrak n-heksan,
etilasetat dan etanol dari daun kembang bulan.
3. Apakah ekstrak n-heksan, etilasetat dan etanol pada daun kembang bulan
mempunyai aktivitas antibakteri terhadap bakteri Staphylococcus aureus,
Staphylococcus epidermidis, Escherichia coli dan Salmonella typhi.
1.3Hipotesis
1. Karakteristik simplisia daun kembang bulan dapat diperoleh dengan
menggunakan prosedur dalam Materia Medika Indonesia.
2. Ekstrak n-heksan pada daun kembang bulan mengandung senyawa
steroid/triterpenoid, pada ekstrak etilasetat mengandung senyawa glikosida
dan flavonoid serta pada ekstrak etanol mengandung senyawa
steroid/triterpenoid, glikosida, flavonoid, saponin dan tanin.
3. Ekstrak n-heksan, etilasetat dan etanol pada daun kembang bulan
mempunyai aktivitas antibakteri terhadap pertumbuhan bakteri
Staphylococcus aureus, Staphylococcus epidermidis, Escherichia coli dan
1.4Tujuan Penelitian
1. Untuk mengetahui karakteristik dari simplisia daun kembang bulan.
2. Untuk mengetahui golongan senyawa kimia pada ekstrak n-heksan,
etilasetat, dan etanol daun kembang bulan
3. Mengetahui adanya aktivitas antibakteri ekstrak n-heksan, etilasetat dan
etanol pada daun kembang bulan terhadap bakteri Staphylococcus aureus,
Staphylococcus epidermidis, Escherichia coli dan Salmonella typhi.
1.5 Manfaat Penelitian
1. Hasil penelitian ini diharapkan dapat memberikan informasi tentang
karakteristik simplisia dan golongan senyawa kimia pada simplisia dan
ekstrak daun kembang bulan.
2. Hasil penelitian ini diharapkan dapat memberikan informasi tentang
khasiat antibakteri dari ekstrak n-heksan, etilasetat dan etanol pada daun
kembang bulan terhadap bakteri Staphylococcus aureus, Staphylococcus
epidermidis, Escherichia coli dan Salmonella typhi.
3. Hasil penelitian ini diharapkan dapat mendukung program pemerintah
dalam penelitian dan pengembangan obat tradisional.
BAB II
TINJAUAN PUSTAKA
2.1 Uraian Tumbuhan
2.1.1 Habitat dan daerah tumbuh
Tumbuhan Kembang Bulan (Tithonia diversifolia (Hemsley) A. Gray)
umumnya tumbuh liar di tempat-tempat curam, misalnya di tebing-tebing, tepi
sungai dan selokan. Tumbuhan ini sekarang banyak ditanam sebagai tanaman
hias karena warna bunganya yang kuning indah dan sebagai pagar untuk
mencegah kelongsoran tanah. Termasuk tumbuhan tahunan yang kerap tumbuh
di tempat terang dan banyak sinar matahari langsung. Tumbuh dengan mudah
di tempat atau di daerah berketinggian 5-1500 m di atas permukaan laut
(Anonim, 2012).
2.1.2 Morfologi
Tumbuhan Kembang Bulan merupakan tumbuhan perdu yang tegak
dengan ketinggian lebih kurang 5 m. Batang tegak, bulat, berkayu, dan
berwarna hijau. Daunnya tunggal, bertoreh sampai setengah panjang tulang
daun, bergerigi, berseling, panjang 26-32 cm dan lebar 15-25 cm, ujung dan
pangkal daun runcing, pertulangan menyirip, berwarna hijau. Bunga
merupakan bunga majemuk yang terdapat di ujung ranting, berbentuk cawan,
tangkai bulat, kelopak berbentuk tabung, berbulu halus, hijau. Mahkota
berlekatan, berbentuk pita, halus, dan berwarna kuning. Benang sari bulat,
kuning, putik melengkung, kuning. Buahnya bulat, jika masih muda berwarna
hijau setelah tua berwarna coklat. Bijinya bulat, keras, dan berwarna coklat.
2.1.3 Sistematika tumbuhan
Sistematika tumbuhan kembang bulan (Hutapea, 1994) adalah sebagai
berikut:
Divisi : Spermatophyta
Subdivisi : Angiospermae
Kelas : Dicotyledoneae
Bangsa : Asterales
Suku : Asteraceae
Marga : Tithonia
Jenis : Tithonia diversifolia (Hemsley) A. Gray
2.1.4 Nama lain
Tumbuhan kembang bulan memiliki nama lain yaitu Mirasolia
diversifolia Hemsley (Widyaningrum, 2011), dengan nama daerah
rondose-moyo, sibunga-bunga atau sipahit-pahit (Tapanuli Utara), harsaga (Jawa),
kirinyu (Sunda), kayu paik (Minang). Nama asing adalah Mary Gold, Shrub
Sunflower, Mexican Sunflower (Inggris), Mirasol (Guatemala), Yellow Flower
(Portugis) (Anonim, 2012).
2.1.5 Khasiat dan penggunaan
Tumbuhan kembang bulan digunakan sebagai obat luka atau luka
lebam, dan sebagai obat sakit perut kembung. Untuk obat sakit perut kembung
dipakai ± 7 gram daun segar, dicuci, direbus dengan 2 gelas air selama
25 menit, setelah dingin disaring. Hasil saringan diminum sekaligus
2.2 Kandungan Kimia
Tumbuhan kembang bulan mengandung senyawa kimia yaitu
steroid/triterpenoid, glikosida, flavonoid, saponin dan tanin.
2.2.1 Steroid dan Triterpenoid
Steroid adalah triterpena yang kerangka dasarnya sistem cincin siklo
pentana perhidrofenantren. Uji yang biasa digunakan adalah reaksi
Liebermann-Burchard yang dengan kebanyakan triterpen dan steroida
memberikan warna hijau-biru (Harborne, 1987).
Triterpenoid adalah senyawa yang kerangka karbonya berasal dari enam
satuan isoprena dan secara biosintesis diturunkan dari hidrokarbon C30 asiklik,
yaitu skualena. Senyawa triterpenoid dan steroid berstruktur siklik dengan
berbagai gugus fungsi yang melekat padanya, seperti gugus alkohol, aldehid
atau asam karboksilat. Mereka berupa senyawa tidak berwarna, berbentuk
kristal, sering kali memiliki titik leleh tinggi dan bersifat aktif optik (Harborne,
1987).
Triterpenoid dapat dipilah menjadi sekurang-kurangnya empat
golongan senyawa : triterpena sebenarnya, steroid, saponin, dan glikosida
jantung. Triterpena tertentu menjadi terkenal karena rasanya, terutama
kepahitannya (Harborne, 1987).
2.2.2 Glikosida
Glikosida adalah senyawa yang terdiri atas gabungan dua bagian, yaitu
bagian gula dan bukan gula. Keduanya dihubungkan oleh ikatan berupa
karbon. Bagian gula disebut glikon sementara bagian bukan gula disebut
bagian aglikon atau genin. Apabila glikon dan aglikon saling terikat maka
senyawa ini disebut sebagai glikosida. Jembatan oksigen yang menghubungkan
glikon-aglikon ini sangat mudah terurai oleh pengaruh asam, basa, enzim, air
dan panas. Semakin pekat kadar asam atau basa maupun semakin panas
lingkungannya maka glikosida akan semakin mudah dan cepat terhidrolisis.
Jika terhidrolisis maka molekul akan pecah menjadi dua bagian, yaitu gula dan
bukan gula (Gunawan, 2004).
Berdasarkan hubungan ikatan antara bagian gula dan bukan gula,
glikosida dibagi (Robinson, 1995):
1. C-glikosida, jika atom C menghubungkan bagian gula dan bukan gula.
Contoh: aloin.
2. O-glikosida, jika atom O menghubungkan bagian gula dan bukan
gula. Contoh: salisin.
3. N-glikosida, jika atom N menghubungkan bagian gula dan bukan
gula. Golongan ini sebagian gulanya bukan gula sebenarnya tetapi
derivatnya. Contoh: vidarabin.
4. S-glikosida, jika thiol (SH) yang menghubungkan bagian gula dan
bagian bukan gula.
Contoh: sinigrin.
2.2.3 Flavonoid
Flavonoid memiliki 15 atom karbon dalam inti dasarnya yang
mempunyai struktur C6-C3-C6 yaitu dua cincin aromatik yang dihubungkan
(Markham, 1988). Flavonoid merupakan salah satu golongan fenol alam
terbesar.
Flavonoid mencakup banyak pigmen dan terdapat pada seluruh dunia
tumbuhan. Sebagai pigmen bunga, flavonoid berperan untuk menarik perhatian
burung dan serangga penyerbuk bunga. Beberapa derivat flavonoid antara lain
khalkon, auron, flavonon, dihidrokhalkon dan isoflavon. Derivat ini disebut
“flavonoid minor” karena penyebaran masing-masing kelas ini terbatas
terdapat secara sporadik (misalnya flavonon) atau terbatas pada sangat sedikit
taksa tumbuhan misalnya isoflavon pada leguminosae dan iridaceae (Harborne,
1987).
Menurut perkiraan, kira-kira 2% dari seluruh karbon yang difotosintesis
oleh tumbuhan diubah menjadi flavonoid atau senyawa yang berkaitan erat
dengannya. Berdasarkan struktur kimianya sebagian tanin adalah flavonoid.
Flavonoid juga merupakan salah satu golongan fenol alam yang terbesar
(Markham, 1988).
2.2.4 Saponin
Saponin adalah glikosida triterpena dan sterol yang terdapat pada lebih
dari 90 suku tumbuhan. Saponin merupakan senyawa aktif permukaan dan
bersifat seperti sabun, serta dapat dideteksi berdasarkan kemampuannya
membentuk busa dan menghemolisis sel darah. Saponin diberi nama demikian
karena sifatnya yang seperti sabun (bahasa Latin “sapo” berarti sabun). Pada
larutan yang sangat encer saponin sangat beracun untuk ikan dan tumbuhan
yang mengandung saponin telah digunakan sebagai racun ikan sejak dahulu
penting karena dapat digunakan sebagai bahan baku untuk sintesis hormon
steroid yang digunakan dalam bidang kesehatan (Robinson, 1995).
Pembentukan busa yang mantap sewaktu mengekstraksi tumbuhan atau
pada waktu memekatkan ekstrak tumbuhan merupakan indikasi akan adanya
saponin (Harborne, 1987).
2.2.5 Tanin
Tanin adalah senyawa yang berasal dari tumbuhan, yang mampu
mengubah kulit hewan yang mentah menjadi kulit siap pakai karena
kemampuannya menyambung silang proteina. Tanin tumbuhan dibagi menjadi
dua golongan, yaitu tanin terkondensasi dan tanin terhidrolisis. Kadar tanin
yang tinggi mempunyai arti penting bagi tumbuhan yakni pertahanan bagi
tumbuhan dan membantu mengusir hewan pemakan tumbuhan. Tanin
terkondensasi terdapat pada paku-pakuan, gimnospermae, dan angiospermae,
sedangkan tanin terhidrolisis penyebarannya terbatas pada tumbuhan berkeping
dua. Beberapa tanin terbukti mempunyai antioksidan dan menghambat
pertumbuhan tumor (Harborne, 1987).
2.3 Ekstraksi
Ekstraksi adalah kegiatan penarikan kandungan kimia yang dapat larut
sehingga terpisah dari bahan yang tidak larut dengan menngunakan pelarut
cair. Senyawa aktif yang terdapat dalam berbagai simplisia dapat digolongkan
kedalam golongan minyak atsiri, alkaloida, flavonoida dan lain-lain. Dengan
diketahuinya senyawa aktif yang dikandung simplisia akan mempermudah
Pembagian metode ekstraksi menurut Depkes (2000) adalah:
A. Cara Dingin 1. Maserasi
Maserasi adalah proses pengekstrakan simplisia menggunakan pelarut
dengan beberapa kali pengocokan atau pengadukan pada temperatur ruangan
(kamar).
Maserasi kinetik dilakukan dengan pengadukan yang kontinu
(terus-menerus). Remaserasi dilakukan dengan pengulangan penambahan
pelarut setelah dilakukan penyaringan maserat pertama dan seterusnya.
2. Perkolasi
Perkolasi adalah ekstraksi dengan menggunakan pelarut yang selalu
baru sampai penyarian sempurna, umumnya dilakukan pada temperatur
ruangan. Proses ini terdiri dari tahapan pengembangan bahan, tahap maserasi
antara, dan tahap perkolasi sebenarnya (penetesan/penampungan ekstrak) yang
terus menerus sampai ekstrak yang diinginkan habis tersari. Tahap
pengembangan bahan dan maserasi antara dilakukan dengan maserasi serbuk
menggunakan cairan penyari sekurang-kurangnya 3 jam, hal ini penting
terutama untuk serbuk yang keras dan bahan yang mudah mengembang.
B. Cara Panas 1. Refluks
Refluks adalah ekstraksi dengan pelarut pada temperatur titik didihnya,
selama waktu tertentu dan jumlah pelarut yang relatif konstan dengan adanya
2. Sokletasi
Sokletasi adalah ekstraksi menggunakan pelarut yang selalu baru,
umumnya dilakukan dengan alat khusus sehingga terjadi ekstraksi kontinue
dan jumlah pelarut relatif konstan dengan adanya pendingin balik.
4. Digesti
Digesti adalah maserasi dengan pengadukan kontinue pada temperatur
yang lebih tinggi dari temperatur ruangan yaitu pada temperatur 40-50oC.
5. Infundasi
Infus adalah penarikan sari larutan pada suhu 90oC-98oC, menggunakan
pelarut air selama 15 menit.
6. Dekoktasi
Dekok adalah penarikan sari larutan pada suhu 90oC-98oC,
menggunakan pelarut air selama 15 menit.
2.4 Bakteri
Nama bakteri berasal dari kata “bakterion” (bahasa Yunani) yang
berarti tongkat atau batang. Sekarang namanya dipakai untuk menyebutkan
sekelompok mikroorganisme yang bersel satu, pembiakan dengan cara
pembelahan diri, serta demikian kecilnya sehingga hanya tampak dengan
mikroskop (Dwidjoseputro, 1978).
2.4.1 Klasifikasi bakteri
Berdasarkan bentuk morfologinya, maka bakteri dapat dibagi atas tiga
a. Golongan basil
Golongan basil berbentuk serupa tongkat pendek, silindris. Basil dapat
bergandengan dua-dua, atau terlepas satu sama lain, yang
bergandeng-gandengan panjang disebut streptobasil, yang dua-dua disebut diplobasil.
b. Bentuk kokus
Golongan kokus merupakan bakteri yang bentuknya serupa bola-bola
kecil. Golongan ini tidak sebanyak golongan basil. Kokus ada yang
bergandeng-gandengan panjang berupa rantai, disebut streptokokus, ada yang
bergandengan dua-dua, disebut diplokokus, ada yang mengelompok berempat,
disebut tetrakokus, kokus yang mengelompok serupa kubus disebut sarsina.
c. Golongan spiral
Golongan spiral merupakan bakteri yang bengkok atau
berbengkok-bengkok berupa spiral. Bakteri ini tidak banyak terdapat, karena itu merupakan
golongan yang paling kecil, jika dibandingkan dengan golongan kokus maupun
golongan basil.
Jenis bakteri yang digunakan dalam penelitian ini adalah Staphylococcus
aureus, Staphylococcus epidermidis, Escherichia coli dan Salmonella typhi.
a. Bakteri Staphylococcus aureus
Sistematika bakteri Staphylococcus aureus menurut (Dwidjoseputro,
1988) adalah sebagai berikut:
Divisi : Protophyta
Kelas : Schizomycetes
Suku : Micrococcaceae
Marga : Staphylococcus
Jenis : Staphylococcus aureus
Staphylococcus aureus merupakan bakteri gram positif, aerob atau
anaerob fakultatif berbentuk bola atau kokus berkelompok tidak teratur,
diameter 0,8–1,0 µm, tidak membentuk spora dan tifak bergerak, koloni
berwarna kuning. Bakteri ini tumbuh cepat pada suhu 37oC tetapi paling baik
membentuk pigmen pada suhu 20-25oC. Koloni pada pembenihan padat
berbentuk bulat halus, menonjol dan berkilau membentuk berbagai pigmen.
Bakteri ini terdapat pada kulit, selaput lendir, bisul dan luka. Dapat
menimbulkan penyakit melalui kemampuannya berkembang biak dan
menyebar luas dalam jaringan (Jawetz, et al., 2001).
b. Bakteri Staphylococcus epidermidis
Sistematika bakteri Staphylococcus epidermidis menurut (Breed, et al.,
1957) adalah sebagai berikut:
Divisi : Protophyta
Kelas : Schizomycetes
Bangsa : Eubacteriales
Suku : Micrococcaceae
Marga : Staphylococcus
Jenis : Staphylococcus epidermidis
Staphylococcus epidermidis merupakan bakteri gram positif, aerob atau
anaerob fakultatif berbentuk bola atau kokus berkelompok tidak teratur,
berwarna putih bakteri ini tumbuh cepat pada suhu 37oC. Koloni pada
pembenihan padat berbentuk bulat halus, menonjol, berkilau, tidak
menghasilkan pigmen, berwarna putih porselen sehingga Staphylococcus
epidermidis disebut Staphylococcus albus, koagulasi-negatif dan tidak meragi
manitol (Jawetz, et al., 2001).
c. Bakteri Escherichia coli
Klasifikasi dari bakteri ini menurut (Breed, et al., 1957) adalah:
Divisi : Protophyta
Kelas : Schizomycetes
Bangsa : Eubacteriales
Suku : Enterobacteriaceae
Marga : Escherichia
Species : Escherichia coli
Escherichia coli adalah bakteri Gram negatif, berbentuk batang panjang,
berderet seperti rantai. Escherchia coli dapat menfermentasi glukosa dan
lactosa membentuk asam dan gas. Escherichia coli dapat merombak
karbohidrat dan asam-asam lemak menjadi asam dan gas serta dapat
menghasilkan gas karbondioksida dan heterogen (Pelczar, 1998).
Escherichia coli banyak di temukan didalam usus besar manusia sebagai
flora normal, tetapi bila kesehatan menurun, bakteri ini dapat bersifat patogen
terutama akibat toksin yang dihasilkan. Escherichia coli umumnya tidak
menyebabkan penyakit bila berada dalam usus, tetapi dapat menyebabkan
penyakit pada saluran kencing, paru, saluran empedu dan saluran otak
diare, saluran kemih, pneumonia, meninggitis pada bayi yang baru lahir, dan
infeksi luka (Gibson, 1996).
d. Bakteri Salmonella typhi
Klasifikasi dari bakteri ini menurut (Breed, et al., 1957) adalah:
Divisi : Protophyta
Kelas : Schizomycetes
Bangsa : Eubacteriales
Suku : Enterobacteriaceae
Marga : Salmonella
Species : Salmonella typhi
Salmonella typhi merupakan bakteri gram negatif, bersifat motil
(bergerak), bakteri anaerob fakultatif. Berbentuk batang pendek berderet
seperti rantai.
Salmonella typhi tidak dapat menfermentasi glukosa dan laktosa, tidak
menghasilkan asam dan gas dari glukosa. Bakteri ini tumbuh secara optimal
pada suhu sekitar 35-370C. Salmonella typhi biasanya ditemukan pada
jaringan limfa saluran pencernaan kemudian masuk ke dalam nodus limfa dan
aliran darah. Salmonella typhi dapat menyebabkan penyakit demam tifoid
(Gibson, 1996).
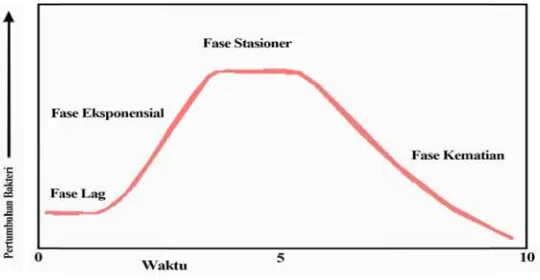
2.4.2 Fase Pertumbuhan Bakteri
Fase pertumbuhan bakteri meliputi fase lamban, fase logaritma, fase
a. Fase La
Fase
baru. Ciri
perubahan
b. Fase Lo
Fase
baru.
Ciri-bakteri ba
dengan laj
c. Fase St
Dala
fase ini be
jumlah sel
d. Fase Pe
Cir
sel-sel bar
laju kemat
amban (lag e ini merupa
– ciri fase
n dalam kom
ogaritma (e e ini terjadi
-ciri fase ini
aru mening
ju yang sam
tatis (statio am fase ini
eberapa sel m
l yang hidup
enurunan (
ri-ciri fase i
ru karena ju
tian mengal
G
g phase)
akan fase p
ini yaitu ti
mposisi dan
exponential
setelah sel b
i yaitu sel m
gkat secara
ma dan kead
onary phase
kecepatan t
mati sedang
p menjadi te
(period of d ini yaitu sel
umlah nutri
lami percep
Gambar 2.1:
penyesuaian
idak ada pe
bertambah
l phase)
bakteri men membelah d eksponens daan pertum e) tumbuh sam
gkan yang l
etap.
decline) ata
l yang mati
isi berkuran
patan menja
grafik pertu
n bakteri ter
ertambahan ukurannya nyesuaikan dengan laju sial, massa mbuhan seim ma dengan ain tumbuh
u Fase Kem
i lebih cepa
ng, terjadi a
di eksponen umbuhan ba rhadap suat populasi, s . diri terhada yang konsta
menjadi d
mbang.
kecepatan m
h dan memb
matian
at dari pada
akumulasi z
nsial.
akteri
tu lingkung
el mengala
ap lingkung
an, jumlah s
dua kali lip
mati. Ciri-c
belah sehing
terbentukn
[image:33.595.185.455.581.721.2]Faktor yang mempengaruhi pertumbuhan mikroorganisme meliputi
temperatur, pH, tekanan osmotik, oksigen dan nutrisi dalam media
pertumbuhan (Pratiwi, 2008).
1. Temperatur
Pertumbuhan bakteri sangat dipengaruhi oleh temperatur. Setiap
mikroorganisme mempunyai temperatur optimum yaitu temperatur di mana
terjadi kecepatan pertumbuhan optimal dan dihasilkan jumlah sel yang
maksimal. Temperatur yang terlalu tinggi dapat menyebabkan denaturasi
protein sedangkan temperatur yang sangat rendah aktivitas enzim akan terhenti.
Berdasarkan batas temperatur dibagi atas tiga golongan (Pratiwi, 2008):
a. psikrofil, tumbuh pada temperatur -5 sampai 30oC dengan optimum
10 sampai 20oC.
b. mesofil, tumbuh pada temperatur 10 sampai 45oC dengan optimum
20 sampai 40oC.
c. termofil, tumbuh pada termperatur 25 sampai 80oC dengan optimum
50 sampai 60oC.
2. pH
Bakteri memiliki pH optimum yang terletak antara 6,5 dan 7,5. Namun
ada beberapa mikroorganisme yang dapat tumbuh pada keadaan yang sangat
asam atau alkali (Pelczar, 1986).
3. Tekanan osmosis
Osmosis merupakan perpindahan air melewati membran semipermeabel
karena ketidakseimbangan material terlarut dalam media. Medium yang baik
larutan hipotonik air akan masuk ke dalam sel sehingga menyebabkan sel
membengkak, sedangkan dalam larutan hipertonik air akan keluar dari sel
sehingga membran plasma mengerut dan lepas dari dinding sel (plasmolisis)
(Pratiwi, 2008; Lay, 1996).
4. Oksigen
Berdasarkan kebutuhan oksigen dikenal mikroorganisme dibagi
menjadi 5 golongan yaitu (Pratiwi, 2008):
a. Anaerob obligat, hidup tanpa oksigen, oksigen toksik terhadap golongan ini.
b. Anaerob aerotoleran, tidak mati dengan adanya oksigen.
c. Anaerob fakultatif, mampu tumbuh baik dalam suasana dengan atau tanpa
oksigen.
d. Aerob obligat, tumbuh subur bila ada oksigen dalam jumlah besar.
e. Mikroaerofilik, hanya tumbuh baik dalam tekanan oksigen yang rendah
5. Nutrisi
Nutrisi merupakan substansi yang diperlukan untuk biosintesis dan
pembentukan energi. Berdasarkan kebutuhannya, nutrisi dibedakan menjadi
dua yaitu makroelemen (elemen yang diperlukan dalam jumlah banyak) dan
mikroelemen (trace element yaitu elemen nutrisi yang diperlukan dalam
jumlah sedikit).
Bahan nutrisi untuk pertumbuhan mikroorganisme terdapat pada media.
Media juga dapat digunakan untuk membedakan mikroorganisme dengan
Bermacam-macam media pertumbuhan yaitu:
1. Media sintetik yaitu media yang komponen penyusunnya sudah diketahui.
2. Media kompleks yaitu media yang tersusun dari komponen yang secara
kimia tidak diketahui dan merupakan kebutuhan nutrisi mikroorganisme.
3. Media selektif adalah media yang mendukung pertumbuhan
mikroorganisme tertentu dengan menghambat pertumbuhan
mikroorganisme lainnya.
4. Media diferensial digunakan untuk membedakan kelompok mikroorganisme
dan dapat digunakan untuk identifikasi (Pratiwi, 2008; Lay, 1996).
2.4.3 Uji aktivitas antimikroba
Uji kepekaaan terhadap obat antimikroba pada dasarnya dapat
dilakukan melalui tiga cara, yaitu:
a. Metode dilusi
Cara ini digunakan untuk menentukan kadar hambat minimum (KHM)
dan kadar bunuh minimum (KBM) dari obat antimikroba.
Prinsip dari metode dilusi adalah sebagai berikut:
Menggunakan satu seri tabung reaksi yang diisi media cair dan
sejumlah tertentu sel mikroba yang diuji. Kemudian masing-masing tabung
diuji dengan obat yang telah diencerkan secara serial. Seri tabung diinkubasi
pada suhu 37oC selama 18-24 jam dan diamati terjadinya kekeruhan pada
tabung. Konsentrasi terendah obat pada tabung yang ditunjukkan dengan hasil
biakan yang mulai tampak jernih (tidak ada pertumbuhan mikroba) adalah
dengan tidak adanya pertumbuhan koloni mikroba adalah KBM dari obat
terhadap bakteri uji (Pratiwi, 2008).
b. Metode difusi
Metode yang paling sering digunakan adalah metode difusi agar dengan
menggunakan cakram kertas, cakram kaca, pencetak lubang. Prinsip metode ini
adalah mengukur zona hambatan pertumbuhan bakteri yang terjadi akibat
difusi zat yang bersifat sebagai antibakteri di dalam media padat melalui
pencadang. Daerah hambatan pertumbuhan bakteri adalah daerah jernih di
sekitar cakram.
Luas daerah hambatan berbanding lurus dengan aktivitas antibakteri,
semakin kuat daya aktivitas antibakterinya maka semakin luas daerah
hambatnya. Metode ini dipengaruhi oleh banyak faktor fisik dan kimia,
misalnya: pH, suhu, zat inhibitor, sifat dari media dan kemampuan difusi,
ukuran molekul dan stabilitas dari bahan obat (Jawetz, et al., 2001).
c. Metode turbidimetri
Pada cara ini digunakan media cair, pertama dilakukan penuangan
media kedalam tabung reaksi, lalu ditambahkan suspensi bakteri, kemudian
dilakukan pemipetan larutan uji, dilakukan inkubasi. Selanjutnya dilakukan
pengukuran kekeruhan, kekeruhan yang disebabkan oleh pertumbuhan bakteri
diukur dengan menggunakan instrumen yang cocok, misalnya nephelometer
setelah itu dilakukan penghitungan potensi antimikroba (Depkes, 1995).
BAB III
METODE PENELITIAN
3.1 Tempat Pelaksanaan Penelitian
Penelitian ini dilaksanakan di Laboratorium Farmakognosi Fakultas
Farmasi USU dan Balai Laboratorium Kesehatan Daerah Provinsi Sumatera
Utara, di jalan Wiliem Iskandar Pasar V Barat I No. 4 Medan.
3.2 Metode Penelitian
Penelitian ini dilakukan dengan metode eksperimental. Dengan tahapan
meliputi pengumpulan dan pengolahan sampel, karakterisasi simplisia, skrining
fitokimia, pembuatan ekstrak n-heksan, etilasetat, dan etanol, serta uji aktivitas
antibakteri secara in vitro dengan metode difusi agar menggunakan pencetak
lubang (punch hole) terhadap bakteri Staphylococcus aureus, Staphylococcus
epidermidis, Escherichia coli dan Salmonella typhi.
3.3 Alat dan Bahan 3.3.1 Alat
Alat yang digunakan dalam penelitian ini adalah alat-alat gelas, autoklaf
(Fisons), blender (Philips), bola karet, desikator, cawan porselen berdasar rata,
freeze dryer (Modulio), inkubator (Fiber Scientific), jangka sorong, jarum ose,
Laminar Air Flow Cabinet (Astec HLF 1200L), lemari pendingin (Toshiba),
mikroskop, neraca kasar (Sun), neraca listrik (Vibra AJ), oven (Memmert),
penangas air (Yenaco), pinset, pipet mikro (Eppendorf), rotary evaporator
(Haake D), silinder logam, alat maserasi, alat destilasi air, kertas perkamen,
3.3.2 Bahan
Bahan penelitian yang digunakan adalah daun kembang bulan, etanol
96% (teknis), etanol 70% (teknis), air suling, suspensi Mc. Farland, Mueller
Hinton Agar (Difco), Nutrient agar (Difco), larutan Nutrien Broth (Difco),
aquadest steril, biakan bakteri Staphylococcus aureus ATCC 25923,
Staphylococcus epidermidis ATCC 25924, Eschericia coli ATCC 25922 dan,
Salmonella typhi ATCC 25925.
Bahan kimia yang digunakan adalah berkualitas pro analisa yaitu £ naftol,
asam klorida pekat, toluena, asam asetat anhidrida, asam asetat glasial, asam
nitrat pekat, asam sulfat pekat, benzen, besi (III) klorida, bismut (III) nitrat,
etanol, etilasetat, n-heksan, iodium, isopropanol, kalium iodida, kloralhidrat,
kloroform, metanol, natrium hidroksida, natrium klorida, natrium sulfat
anhidrat, raksa (II) klorida, serbuk magnesium dan timbal (II) asetat.
3.4 Penyediaan sampel 3.4.1 Pengumpulan bahan
Sampel yang digunakan adalah daun kembang bulan (Tithonia
diversifolia (Hemsley) A. Gray) yang diperoleh dari Kecamatan
Siborong-borong, Kabupaten Tapanuli Utara, Provinsi Sumatera Utara.
Pengambilan sampel dilakukan secara purposive yaitu tanpa membandingkan
dengan tumbuhan yang sama dari daerah lain.
3.4.2 Identifikasi sampel
Identifikasi sampel dilakukan oleh “Herbarium Bogoriense”, Bidang
3.4.3 Pengolahan bahan
Daun kembang bulan dibersihkan dari kotoran dengan cara mencuci di
bawah air mengalir hingga bersih dan ditiriskan, lalu ditimbang berat basah,
kemudian dikeringkan dalam lemari pengering pada suhu 40-500C. Daun
kembang bulan dianggap kering apabila sudah rapuh, lalu ditimbang berat
kering. Selanjutnya sampel diserbukkan dengan menggunakan blender, lalu
disimpan dalam wadah plastik di tempat yang terlindung dari cahaya sebelum
digunakan.
3.5 Pemeriksaan Karakterisasi Simplisia 3.5.1 Pemeriksaan organoleptik
Pemeriksaan secara organoleptik meliputi pemeriksaan warna, bau dan
rasa dari daun segar dan simplisia daun kembang bulan.
3.5.2 Pemeriksaan makroskopik
Pemeriksaan makroskopik dilakukan dengan mengamati bentuk luar
dari daun segar dan simplisia daun kembang bulan, dapat dilihat pada
Lampiran 2, halaman 54-55.
3.5.3 Pemeriksaan mikroskopik
Pemeriksaan mikroskopik dilakukan terhadap daun segar dan serbuk
simplisia. Daun segar dipotong tipis secara melintang, kemudian letakkan di
atas kaca preparat lalu diteteskan larutan kloralhidrat dan dipanaskan diatas api
bunsen kemudian ditutup dengan kaca penutup dan diamati di bawah
mikroskop. Pemeriksaan mikroskopik dilakukan terhadap serbuk
dengan kloralhidrat dan ditutup dengan kaca penutup, kemudian dilihat
dibawah mikroskop. Pemeriksaan mikroskopik dilakukan terhadap daun
kembang bulan segar dan serbuk simplisia untuk melihat struktur anatomi
tumbuhan tersebut secara lengkap, dapat dilihat pada Lampiran 3, halaman 56.
3.5.4 Penetapan kadar air
Penetapan kadar air dilakukan dengan metode Azeotropi (Destilasi
Toluena). Alat meliputi labu alas 500 ml, alat penampung, tabung penerima 5
ml berskala 0,05 ml, pendingin, tabung penyambung, pemanas.
Cara kerja: Kedalam labu alas bulat di masukkan 200 ml toluen dan 2 ml air
suling, destilasi selama 2 jam, biarkan menjadi dingin selama 30 menit dan
volume air dalam tabung penampung dibaca. Selanjutnya ke dalam labu
dimasukkan 5 gram serbuk simplisia lalu dipanaskan hati-hati selama 15 menit.
Setelah toluena mendidih, kecepatan tetesan diatur yaitu 2 tetesan per detik
sampai sebagian air terdestilasi, kemudian kecepatan destilasi dinaikkan
sampai 4 tetes per detik. Setelah semua air terdestilasi, bagian dalam pendingin
dibilas dengan toluena. Destilasi dilanjutkan selama 5 menit, kemudian tabung
penampung dibiarkan dingin sampai sama dengan suhu kamar.
Setelah air dan toluena memisah sempurna, dibaca volume air dengan
ketelitian 0,05 ml. Selisih kedua volume air yang dibaca sesuai dengan
kandungan air di dalam bahan yang diperiksa. Kadar air dihitung dalam persen
(WHO, 1992). Hasil dapat dilihat pada Tabel 4.2.1, halaman 39.
3.5.5 Penetapan kadar abu total
Sebanyak lebih kurang 2 g serbuk simplisia yang telah digerus dan
ditara, kemudian diratakan. Krus dipijarkan pada suhu 6000C sampai arang
habis, kemudian didinginkan dan ditimbang sampai diperoleh bobot tetap.
Kadar abu dihitung terhadap bahan yang telah dikeringkan di udara (Depkes,
1989). Hasil dapat dilihat pada Tabel 4.2.1, halaman 39.
3.5.6 Penetapan kadar abu tidak larut dalam asam
Abu yang telah diperoleh dari penetapan kadar abu total dididihkan
dengan 25 ml asam klorida 2N selama 5 menit, bagian yang larut dalam asam
dikumpulkan, disaring melalui kertas saring dipijarkan pada suhu 6000C
sampai bobot tetap, didinginkan kemudian ditimbang. Kadar abu yang tidak
larut dalam asam dihitung terhadap bahan yang telah dikeringkan di udara
(Depkes, 1989). Hasil dapat dilihat pada Tabel 4.2.1, halaman 39.
3.5.7 Penetapan kadar sari larut dalam air
Sebanyak 5 g serbuk simplisia yang telah dikeringkan diudara
dimaserasi selama 24 jam dalam 100 ml air kloroform (2,5 ml kloroform dalam
air suling 1000 ml), dalam labu bersumbat sambil sesekali dikocok selama
6 jam pertama kemudian dibiarkan selama 18 jam. Disaring, sejumlah 20 ml
filtrat pertama diuapkan sampai kering dalam cawan dangkal berdasar rata
yang telah ditara dan sisa dipanaskan pada suhu 1050C sampai diperoleh bobot
tetap. Kadar sari yang larut di dalam air dihitung terhadap bahan yang telah
dikeringkan di udara (Depkes, 1989). Hasil dapat dilihat pada Tabel 4.2.1,
halaman 39.
3.5.8 Penetapan kadar sari larut dalam etanol
Sebanyak 5 g serbuk simplisia yang telah dikeringkan di udara
sambil dikocok sesekali 6 jam pertama dan dibiarkan selama 18 jam dan
disaring. Sejumlah 20 ml filtrat ditara. Sisanya dipanaskan dalam oven pada
1050C sampai diperoleh bobot konstan kadar sari yang larut didalam air
dihitung terhadap bahan yang telah dikeringkan diudara (Depkes, 1989). Hasil
dapat dilihat pada Tabel 4.2.1, halaman 39.
3.6 Pembuatan Larutan Pereaksi
Pembuatan larutan pereaksi besi (III) klorida 1%, Bouchardat,
Dragendorff, Mayer, Molish, asam klorida 2 N, asam sulfat 2 N, kloralhidrat,
natrium hidroksida 2 N, Liebermann-Bouchard (Timbal (II) asetat 0,4 M.
3.6.1 Besi (III) klorida 1%
Sebanyak 1 g besi (III) klorida dilarutkan dalam air suling hingga 100
ml kemudian disaring.
3.6.2 Bouchardat
Sebanyak 4 g kalium iodida ditimbang, kemudian dilarutkan dalam air
suling, ditambahkan iodium sebanyak 2 g dan dicukupkan dengan air suling
hingga 100 ml.
3.6.3 Dragendorff
Sebanyak 0,85 g bismut (III) nitrat ditimbang, kemudian dilarutkan
dalam 100 ml asam asetat glasial ditambahkan 40 ml air suling. Pada wadah
lain ditimbang 8 g kalium iodida lalu dilarutkan dalam 20 ml air suling, lalu
campurkan kedua larutan sama banyak, ditambahkan 20 ml asam asetat glasial
3.6.4 Mayer
Sebanyak 1,35 g raksa (II) klorida dilarutkan dalam 60 ml air suling.
Pada wadah lain sebanyak 5 g kalium iodida dilarutkan dalam 10 ml air lalu
campurkan keduanya dan ditambahkan air suling hingga 100 ml.
3.6.5 Molish
Sebanyak 3 g £-naftol ditimbang, kemudian dilarutkan dalam asam
nitrat 0,5 N hingga volume 100 ml. (Depkes, 1995)
3.6.6 Asam klorida 2 N
Sebanyak 17 ml asam klorida pekat dilarutkan dalam air suling hingga
volume 100 ml.
3.6.7 Asam sulfat 2 N
Sebanyak 5,4 ml asam sulfat pekat kemudian diencerkan dengan air
suling hingga 100 ml.
3.6.8 Natrium hidroksida 2 N
Sebanyak 8,002 g kristal natrium hidroksida dilarutkan dalam air suling
hingga 100 ml.
3.6.9 Kloralhidrat
Sebanyak 50 g kloralhidrat dilarutkan dalam 20 ml air suling (Depkes,
1979).
3.6.10 Liebermann-Bouchard
Sebanyak 5 ml asam asetat anhidrida dicampurkan dengan 5 ml asam
3.6.11 Timbal (II) asetat 0,4 M
Sebanyak 15,17 g timbal (II) asetat dilarutkan dalam air bebas
karbondioksida hingga 100 ml (Depkes, 1989).
3.7 Skrining Fitokimia
Skrining fitokimia terhadap simplisia dan ekstrak n-heksan, etilasetat
dan etanol daun kembang bulan meliputi pemeriksaan senyawa
steroid/triterpenoid, alkaloida, glikosida, flavonoid, saponin, dan tanin.
3.7.1 Pemeriksaan steroid/triterpenoid
Sebanyak 1 g serbuk simplisia dimaserasi dengan 20 ml n-heksan
selama 2 jam, disaring, filtrat diuapkan dalam cawan penguap, dan pada
sisanya ditambahkan 20 tetes asam asetat anhidrat dan 1 tetes asam sulfat pekat
(pereaksi Liebermann-Burchard). Apabila terbentuk warna ungu atau merah
yang berubah menjadi biru hijau menunjukkan adanya steroid/triterpenoid
(Farnsworth, 1966).
3.7.2 Pemeriksaan Alkaloida
Serbuk simplisia ditimbang sebanyak 0,5 g kemudian ditambahkan 1 ml
asam klorida 2 N dan 9 ml air suling, dipanaskan air selama 2 menit,
didinginkan lalu disaring. Filtrat dipakai untuk percobaan berikut :
b. Diambil 3 tetes filtrat, lalu ditambahkan 2 tetes pereaksi Mayer
c. Diambil 3 tetes filtrat, lalu ditambahkan 2 tetes pereaksi Bouchardat
d. Diambil 3 tetes filtrat, lalu ditambahkan 2 tetes pereaksi Dragendrof
Alkaloida dianggap positif jika terjadi endapan atau paling sedikit dua atau tiga
3.7.3 Pemeriksaan glikosida
Serbuk simplisia sebanyak 3 g, lalu disaring dengan 30 ml campuran
etanol 95% dengan air (7:3) dan 10 ml asam klorida 2N, direfluks selama 2
jam, didinginkan dan disaring. Diambil 20 ml filtrat, ditambahkan 25 ml air
suling dan 25 ml timbal (II) asetat 0,4 M, dikocok, didiamkan 5 menit lalu
disaring. Filtrat disari dengan 20 ml campuran isopropanol dan kloroform
(2:3), dilakukan berulang sebanyak 3 kali. Sari air dikumpulkan dan diuapkan
pada temperatur tidak lebih dari 50oC. Sisanya dilarutkan dalam 2 ml metanol.
Larutan sisa digunakan untuk percobaan berikut: 0,1 ml larutan percobaan
dimasukkan dalam tabung reaksi dan diuapkan di atas penangas air. Pada sisa
ditambahkan 2 ml air dan 5 tetes pereaksi Molish. Kemudian secara
perlahan-lahan ditambahkan 2 ml asam sulfat pekat melalui dinding tabung,
terbentuknya cincin berwarna ungu pada batas kedua cairan menunjukkan
adanya glikosida (Depkes, 1978).
3.7.4 Pemeriksaan flavonoid
Sebanyak 10 g serbuk simplisia kemudian ditambahkan 100 ml air panas,
dididihkan selama 5 menit dan disaring dalam keadaan panas, filtrat yang
diperoleh kemudian diambil 5 ml lalu di tambahkan 0,1 g serbuk Mg dan 1 ml
HCl pekat dan 2 ml amil alkohol, dikocok, dan dibiarkan memisah. Flavonoid
positif jika terjadi warna merah, kuning, jingga pada lapisan amil alkohol
(Farnsworth, 1966).
3.7.5 Pemeriksaan Saponin
Serbuk simplisia ditimbang sebanyak 0,5 g dan dimasukkan ke dalam
dikocok kuat-kuat selama 10 menit. Jika terbentuk busa setinggi 1-10 cm yang
stabil tidak kurang dari 10 menit dan tidak hilang dengan penambahan 1 tetes
asam klorida 2 N menunjukkan adanya saponin (Depkes, 1978).
3.7.6 Pemeriksaan tanin
Sebanyak 0,5 g serbuk simplisia disari dengan 10 ml air suling, disaring
lalu filtratnya diencerkan dengan air suling sampai tidak berwarna. Diambil 2
ml larutan lalu ditambahkan 1 sampai 2 ttes pereaksi besi (III) klorida. Terjadi
warna biru atau hijau kehitaman menunjukkan adanya tanin (Farnsworth,
1966).
3.8 Pembuatan ekstrak daun kembang bulan (Tithonia diversifolia
(Hemsley) A. Gray).
Pembuatan ekstrak dilakukan secara perkolasi berkesinambungan
menggunakan tiga pelarut. Cara kerja: sebanyak 250 gram serbuk simplisia
halus dimasukkan ke dalam wadah kaca dan dibasahi dengan n-heksan dalam
wadah tertutup rapat, kemudian dimaserasi selama 3 jam. Massa dipindahkan
sedikit demi sedikit ke dalam perkolator sambil tiap kali ditekan dengan
hati-hati, kemudian cairan penyari n-heksan dituangkan secukupnya sampai
cairan mulai menetes dan di atas simplisia masih terdapat selapis cairan
penyari, perkolator ditutup dan dibiarkan selama 24 jam. Kran perkolator
dibuka dan diatur cairan menetes dengan kecepatan 1 ml/menit dan dipasang
reservoir penyari sehingga tetap dapat dipertahankan selapis cairan penyari
diatas serbuk simplisia sampai cairan yang keluar tidak berwarna lagi atau
cairan yang terakhir keluar bila diuapkan tidak meninggalkan sisa (Depkes,
evaporator setelah itu diuapkan hingga diperoleh ekstrak kental dan ditimbang.
Kemudian ampasnya dikeringkan lalu diperkolasi kembali dengan
menggunakan pelarut berturut-turut etilasetat dan etanol 70%, prosedur
dilakukan sama seperti yang diatas.
3.9. Sterilisasi Alat dan Bahan
Alat-alat yang digunakan dalam uji aktivitas antibakteri ini, disterilkan
terlebih dahulu sebelum dipakai. Alat-alat gelas disterilkan didalam oven pada
suhu 170°C selama 1 jam. Media disterilkan di autoklaf pada suhu 121°C
selama 15 menit. Jarum ose dan pinset dengan lampu bunsen (Lay,1994).
3.10 Pembuatan Media
3.10.1Pembuatan Nutrient Agar
Komposisi: Beef extract 3,0 g
Peptone 5,0 g
Agar 15,0 g
Cara pembuatan: ditimbang sebanyak 23 g serbuk nutrient agar kemudian
disuspensikan dalam erlenmeyer dengan air suling yang ditambahkan sedikit
demi sedikit hingga 1000 ml, dipanaskan hingga mendidih sambil sekali-kali
diaduk sampai bahan larut sempurna dan jernih. Tutup erlenmeyer dengan
kapas yang dilapisi dengan aluminium foil. Disterilkan di dalam autoklaf pada
suhu 121oC tekanan 2 atm selama 15 menit (Difco Laboratories, 1977).
3.10.2 Pembuata Muller Hinton Agar (MHA)
Komposisi: Beef infusion from 300 g
Starch 1,50 g
Bacto – Agar 17,0 g
pH = 7,4
Cara pembuatan: ditimbang sebanyak 36 g serbuk MHA kemudian
disuspensikan dalam erlenmeyer dengan air suling yang ditambahkan sedikit
demi sedikit hingga 1000 ml, dipanaskan hingga mendidih sambil sekali-kali
diaduk sampai bahan larut sempurna dan jernih. Tutup erlenmeyer dengan
kapas yang dilapisi dengan aluminium foil. Disterilkan di dalam autoklaf pada
suhu 121oC tekanan 2 atm selama 15 menit (Difco laboratories, 1977).
3.10.3 Pembuatan Nutrient Broth (NB)
Komposisi: Beef extract 3 g
Bacto Pepton 5 g
Ditimbang sebanyak 8 gram serbuk nutrient broth kemudian
disuspensikan dalam erlenmeyer dengan air suling yang ditambahkan sedikit
demi sedikit hingga 1000 ml, dipanaskan sebentar sambil sekali-sekali diaduk
sampai terbentuk larutan jernih. Tutup erlenmeyer dengan kapas yang dilapisi
aluminium foil. Disterilkan di dalam autoklaf pada suhu 121oC tekanan 2 atm
selama 15 menit (Difco Laboratories, 1977).
3.11 Pembuatan Suspensi Standar Mc. Farland
Suspensi Standar Mc. Farland adalah suspensi yang menunjukkan
konsentrasi kekeruhan bakteri sama dengan 108 CFU/ml.
Komposisi: Larutan Asam sulfat 1% 9,5 ml
Cara pembuatan: dicampur kedua larutan tersebut dalam tabung reaksi
dikocok dan dihomogenkan. Apabila kekeruhan suspensi bakteri uji adalah
sama dengan kekeruhan suspensi standar, berarti konsentrasi suspensi bakteri
adalah 106 CFU/ml (Power, 1988).
3.12 Pembiakan Bakteri
3.12.1 Pembuatan Stok Kultur Bakteri
Biakan bakteri Staphylococcus aureus dari strain utama diambil dengan
jarum ose steril dengan metode sinambung pada permukaan nutrien agar
miring, ditutup mulut tabung reaksi dengan kapas. Diinkubasi selama 18-24
jam pada suhu 37oC. Dilakukan prosedur yang sama terhadap bakteri
Staphylococcus epidermidis, Escherichia coli dan Salmonella typhi
(Depkes, 1995).
3.12.2 Pembuatan Inokulum Bakteri
Bakteri Staphylococcus aureus hasil inkubasi diambil dengan jarum ose
steril lalu disuspensikan kedalam tabung yang berisi 10 ml larutan nutrien
broth steril, kemudian dihomogenkan hingga diperoleh kekeruhan suspensi
bakteri yang sama dengan kekeruhan suspensi standar Mc. Farland, ini berarti
konsentrasi suspensi bakteri adalah 108 CFU (Colony Forming Unit)/ml.
Setelah itu dilakukan pengenceran dengan memipet 0,1 ml biakan bakteri
(108 CFU/ml), dimasukkan kedalam tabung steril yang berisi larutan nutrien
broth sebanyak 9,9 ml dan dikocok homogen maka diperoleh suspensi bakteri
dengan konsentrasi 106 CFU/ml. Dilakukan prosedur yang sama terhadap
bakteri Staphylococcus epidermidis, Escherichia coli dan Salmonella typhi
3.13 Pembuatan Larutan Uji dengan Berbagai Konsentrasi
3.13.1 Pembuatan larutan uji ekstrak n-heksan, etilasetat, dan etanol
Sebanyak 1 gram ekstrak n-heksan dilarutkan dengan pelarut n-heksan
hingga 2 ml maka konsentrasi ekstrak adalah 500 mg/ml kemudian dibuat
pengenceran. Selanjutnya larutan tersebut diencerkan kembali dengan ekstrak
n-heksan dengan konsentrasi 400 mg/ml; 300 mg/ml; 200 mg/ml; 100 mg/ml;
90 mg/ml; 80 mg/ml ; 70 mg/ml; 60 mg/ml; 50 mg/ml; 40 mg/ml; 30 mg/ml;
20 mg/ml; 10 mg/ml; 9 mg/ml; 8 mg/ml; 7 mg/ml; 6 mg/ml; 5 mg/ml; 4 mg/ml;
3 mg/ml; 2 mg/ml; 1 mg/ml. Dilakukan prosedur yang sama terhadap ekstrak
etilasetat dengan pelarut etilasetat dan ekstrak etanol dengan pelarut etanol.
3.14 Pengujian Aktivitas Antibakteri Ekstrak n-Heksan, Etilasetat, dan Etanol Daun Kembang Bulan.
Sebanyak 0,1 ml suspensi bakteri konsentrasi 106 CFU/ml dimasukkan
ke dalam cawan petri kemudian ditambahkan 20 ml media MHA cair
(45-50oC) lalu dihomogenkan dan didiamkan hingga media memadat.
Selanjutnya dibuat lubang dengan pencetak lubang dan diteteskan larutan
ekstrak mulai dari konsentrasi 500 mg/ml hingga pengenceran 10 mg/ml
masing-masing 0,1 ml pada lubang dan sebagai kontrol diteteskan 0,1 ml
larutan n-heksan, etilasetat dan etanol 96%. Ditutup cawan petri dan
dibungkus. Didiamkan selama 10-15 menit kemudian diinkubasi pada suhu
37oC selama 18-24 jam. Setelah itu diukur diameter hambat pertumbuhan
bakteri pada daerah bening di sekitar lubang dengan menggunakan jangka
sorong. Dilakukan prosedur yang sama terhadap bakteri Staphylococcus
BAB IV
HASIL DAN PEMBAHASAN
4.1 Hasil Identifikasi Tumbuhan
Hasil identifikasi tumbuhan dilakuka