PENGGUNAAN KITOSAN MAGNETIK NANOPARTIKEL
UNTUK MENYERAP LOGAM KADMIUM (Cd) DAN
TEMBAGA (Cu) DENGAN MENGGUNAKAN
SPEKTROFOTOMETER SERAPAN ATOM(SSA)
TESIS
OLEH :
AINUN MARDHIYAH DAULAY 097006018/KIM
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS SUMATERA UTARA
PENGGUNAAN KITOSAN MAGNETIK NANOPARTIKEL
UNTUK MENYERAP LOGAM KADMIUM (Cd) DAN
TEMBAGA (Cu) DENGAN MENGGUNAKAN
SPEKTROFOTOMETER SERAPAN ATOM(SSA)
TESIS
Diajukan Sebagai Salah Satu Syarat untuk Memproleh Gelar
Magister Sains dalam Program Studi Ilmu Kimia Pada Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Sumatera Utara
Oleh
AINUN MARDHIYAH DAULAY
097006018/KIM
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
UNIVERSITAS SUMATERA UTARA
MEDAN
2011
Judul Tesis : PENGGUNAAN KITOSAN MAGNETIK
NANOPARTIKEL UNTUK MENYERAP LOGAM KADMIUM (Cd) DAN TEMBAGA (Cu) DENGAN MENGGUNAKAN SPEKTROFOTOMETER
SERAPAN ATOM (SSA)
Nama Mahasiswa : AINUN MARDHIYAH DAULAY Nomor Pokok : 097006018
Program Studi : Ilmu Kimia
Fakultas : Matematika dan Ilmu Pengetahuan Alam
Menyetujui Komisi Pembimbing
(Prof. Dr. Harry Agusnar, M.Sc, MPhil) (Prof. Dr. Zul Alfian, M.Sc)
Ketua Anggota
Ketua Program Studi Dekan FMIPA
(Prof. Basuki Wirjosentono, MS. PhD) (Dr. Sutarman, MSc)
Telah diuji pada
Tanggal : 22 Juni 2011
__________________________________________________________________
PANITIA PENGUJI TESIS
Ketua : Prof. Dr. Harry Agusnar, M.Sc, MPhil
Anggota : 1. Prof. Dr. Zul Alfian, M.Sc
2. Prof. Basuki Wirjosentoso, MS. Ph.D
3. Prof. Dr. Harlem Marpaung
4. Dr. Darwin Yunus Nasution, MS
5. Prof. Dr. Yunazar Manjang
PERNYATAAN ORISINALITAS
PENGGUNAAN KITOSAN MAGNETIK NANOPARTIKEL
UNTUK MENYERAP LOGAM KADMIUM (Cd) DAN
TEMBAGA (Cu) DENGAN MENGGUNAKAN
SPEKTROFOTOMETER SERAPAN ATOM(SSA)
Dengan ini saya menyatakan bahwa tesis ini tidak terdapat karya yang pernah diajukan untuk memperoleh gelar kesarjanaan di suatu perguruan tinggi dan sepanjang sepengetahuan saya juga tidak terdapat karya atau pendapat yang pernah ditulis diterbitkan oleh orang lain, kecuali secara tertulis diacu dalam naskah dan disebutkan dalam daftar pustaka.
Medan, Juni 2011 Penulis
PERNYATAAN PERSETUJUAN PUBLIKASI KARYA ILMIAH UNTUK KEPENTINGAN AKADEMIS
Sebagai sivitas akademika Universitas Sumatera Utara, saya yang bertanda tangan di bawah ini :
Nama : AINUN MARDHIYAH DAULAY
Nomor Pokok : 097006018 Program Studi : Ilmu Kimia Jenis Karya Ilmiah : Tesis
Demi pengembangan ilmu pengetahuan, menyetujui untuk memberikan kepada Universitas Sumatera Utara Hak Bebas Royalti Non-Eksklusif (Non-exclusif Royalty Free Right) atas Tesis saya yang berjudul :
PENGGUNAAN KITOSAN MAGNETIK NANOPARTIKEL UNTUK MENYERAP LOGAM KADMIUM (Cd) DAN TEMBAGA (Cu) DENGAN MENGGUNAKAN SPEKTROFOTOMETER SERAPAN ATOM (SSA)
Besserta perangkat yang ada (jika diperlukan). Dengan Hak Bebas Royalti Non-Eksklusif ini, Universitas Sumatera Utara berhak menyimpan, mengalih media, memformat, mengelola dalam bentuk data base, merawat dan mempublikasikan Tesis saya tanpa meminta izin dari saya selama tetap mencantumkan nama saya sebagai penulis dan sebagai pemegang dan atau sebagai pemilik hak cipta.
Demikian pernyataan ini dibuat dengan sebenarnya.
Medan, Juni 2011
Penulis
Ainun Mardhiyah Daulay
PENGGUNAAN KITOSAN MAGNETIK NANOPARTIKEL
UNTUK MENYERAP LOGAM KADMIUM (Cd) DAN
TEMBAGA (Cu) DENGAN MENGGUNAKAN
SPEKTROFOTOMETER SERAPAN ATOM(SSA)
ABSTRAK
Kitosan merupakan salah satu medium yang digunakan sebagai penyerap (absorbsi) ion logam kadmium (Cd) dan tembaga (Cu) dalam air limbah. Pembuatan kitosan magnetik nanopartikel bertujuan untuk mengefektifkan daya serap (absorbsi) kitosan terhadap limbah ion logam berat dengan cara memperluas permukaan kitosan tersebut. Teori kinetika laju reaksi menyatakan bahwa semakin luas permukaan suatu zat maka reaksi akan semakin cepat. Variasi konsentrasi larutan diperlukan untuk menemukan pada konsentrasi berapa larutan kitosan magnetik nanopartikel tersebut efektif untuk menyerap (mengabsorbsi) logam kadmium (Cd+2) dan tembaga (Cu+2). Kitosan magnetik nanopartikel mempunyai daya serap optimum pada logam Cd sebesar 90,04% dan pada logam Cu sebesar 99,12 % dengan waktu kontak 30 menit . Analisa spektoskopi FTIR menunjukkan bahwa panjang gelombang NH= 3448,72 cm-1 ; C-H= 2877,79 cm-1 ; C=O = 1651,07 cm-1 ; C-N=1257,59 cm-1. Data ini menunjukkan bahwa terdapat senyawa kitosan dalam larutan tersebut. Analisa FESEM didapatkan permukaan kitosan magnetik nano yang lebih besar dan merata sehingga memungkinkan untuk menyerap (mengabsorbsi) ion logam kadmium (Cd+2) dan ion logam tembaga (Cu+2) lebih efektif yaitu pada berat molekul tinggi.
Kata kunci : Kitosan, partikel, kitosan nano, mengabsorbsi
A USEFUL MAGNETIC CHITOSAN NANOPARTICLE TO ABSORB HEAVY METAL CADMIUM (Cd) AND CUPRUM (Cu)
WITH ATOMIC ABSORBTION SPECTROSCOPY
ABSTRACT
Chitosan is one of the medium which is used as absorber of Cd metal and Cu metal. The making of magnetic chitosan nanoparticle to cause chitosan absorptive power to heavy metal liquid waste and cooler essence by expanding the substance the chitosan itself. The theory of reaction quick kinetic states that the more wider the substance of the essence so the reaction will be the more faster. The solution concentrate variation is needed to find that concentration of how much magnetic chitosan nanoparticle solution become effective to absorb Cd metal and Cu metal. The absorptive power from high molecule of heavy magnetic chitosan nanoparticle has optimum absorptive for Cd metal amount of 90,04% and Cu metal amount of 99,12 % during 30 minutes. Spectroscopy analysis FTIR showed that a long unbroken wave N-H=3448,72 cm-1 ; C-H=2877,79 cm-1 ; C=O = 1651,07 cm-1 ; C-N=1257,59 cm-1. This data showed that there is chitosan compound in that solution. FESEM analysis is got that magnetic chitosan nanoparticle substance is bigger and flat so it is possible to absorb Cd metal and Cu metal waste is more effective, that is weight in high molecule.
Key words : Chitosan, particle, nano chitosan, absorptive
ii
KATA PENGANTAR
Alhamdulillah Kepada Allah SWT yang Maha mengatur dan memelihara alam beserta segala isinya dengan penuh rasa kasih dan sayangnya sehingga tesis ini dapat diselesaikan dengan judul : PENGGUNAAN KITOSAN MAGNETIK NANOPARTIKEL UNTUK MENYERAP LOGAM KADMIUM (Cd) DAN
TEMBAGA (Cu) DENGAN MENGGUNAKAN SPEKTROFOTOMETER
SERAPAN ATOM (SSA).
Penyelesaian tesis ini merupakan syarat untuk menyelesaikan tugas dan ujian Sekolah Pascasarjana pada Ilmu Kimia USU Medan. Secara khusus rasa terima kasih yang sebesar-besarnya kepada :
1. Rektor USU Bapak Prof. Dr. Syahril Pasaribu DTM&H. MSc, (CTM), Sp.A.(K) atas kesempatan dan fasilitas yang diberikan selama kuliah di Sekolah Pascasarjana Kimia USU.
2. Dekan FMIPA USU Bapak Dr. Sutarman, MSc., atas kesempatan menjadi mahasiswa Program Magister Sains pada Program Pascasarjana FMIPA Universitas Sumatera Utara .
3. Ketua Program Studi Magister Kimia USU Medan Bapak Prof. Basuki Wirjosentono MS, PhD. Dan Sekretaris Program Studi Bapak Dr. Hamonangan Nainggolan, MSc.
4. Pembimbing I dan II Bapak Prof. Dr. Harry Agusnar, MSc M.Phil dan Bapak Prof. Dr. Zul Alfian, MSc dengan penuh kesabaran membimbing penulis sehingga selesainya tesis ini.
5. Seluruh staf dosen dan pegawai Sekolah Pascasarjana Kimia USU Medan yang telah mendidik dan membantu penulis selama mengikuti perkuliahan di Sekolah Pascasarjana USU Medan.
6. Kepala Sekolah, Staf guru dan Tata usaha SMAN 1 Batangonang yang telah banyak memberikan dukungan dan semangat kepada penulis
7. Seluruh keluarga terutama suami, kedua orangtua dan ibu mertua yang penuh pengertian sehingga selesai menamatkan studi di Sekolah
Pascasarjana USU Medan.
Penulis menyadari dengan sepenuhnya bahwa tesis ini masih jauh dari sempurna oleh karena itu penulis mengharapkan saran dan masukan dari semua pihak hingga sempurnanya tesis ini dan dapat bermanfaat bagi kita semua.
Medan , Juni 2011 Penulis
Ainun Mardhiyah Daulay
iv
RIWAYAT HIDUP
DATA PRIBADI
Nama lengkap berikut gelar : AINUN MARDHIYAH DAULAY, S.Pd Tempat dan tanggal lahir : Padangsidimpuan, 12 Juli 1979
Alamat rumah : Jl. Raja Inal siregar Batunadua
Padangsidimpuan
Telepon / Faks / Hp : -
Email : -
Instansi tempat bekerja : SMA N 1 Batangonang
Alamat kantor : desa Pintu Padang, Kec. Batangonang
Kab. Padang Lawas Utara
Telepon / Faks / Hp : -
DATA PENDIDIKAN
SD : SD Muhammadiyah 3 P.Sidimpuan tahun 1987 SMP : MTSs Maarif Muslimin P.Sidimpuan tahun 1992
SMA : MAN 1 P.Sidimpuan tahun 1995
Strata 1 : Universitas Sumatera Utara tahun 1998 Strara 2 : Universitas Sumatera Utara tahun 2009
DAFTAR ISI
Halaman
ABSTRAK i
ABSTRAC ii
KATA PENGANTAR iii
DAFTAR ISI vi
DAFTAR TABEL ix
DAFTAR GAMBAR x
BAB 1 : PENDAHULUAN 1 1.1. Latar Belakang 1
1.2. Rumusan Permasalahan 3
1.3. Tujuan Penelitian 3 1.4. Manfaat Penelitian 3
1.5. Lokasi Penelitian 3
BAB 2 : TINJAUAN PUSTAKA 4 2.1. Kitin 4
2.2. Kitosan 5
2.3. Faktor-faktor yang Mempengaruhi Penyerapan Ion Logam oleh Kitosan 8 2.4. Magnetik Nanopartikel 9
2.5. Adsorpsi 10
2.6. Interaksi Logam dengan Kitin dan Kitosan. 11
2.7. Spektrofotometer Serapan Atom 12
BAB 3 : METODOLOGI PENELITIAN 16
3.1. Lokasi Penelitian 16
3.2. Bahan 16
vi
3.3. Alat 16
3.4. Prosedur Penelitian 17
3.4.1. Pembuatan Fe3O4 magnetik nanopartikel 17
3.4.2. Pembuatan kitosan – Fe3O4 magnetik nanopartikel 17
3.4.3. Persiapan Larutan Stok Cd(II) dan Cu(II) 17
3.4.4. Adsorpsi kitosan magnetik nanopartikel terhadap logam kadmium (Cd) Dan tembaga (Cu) 16 18
3.4.4.1. Pengaruh waktu kontak 18
3.4.4.2. Pengaruh konsentrasi logam Cd(II) dan Cu(II) 18
3.5. Prosedur Kerja 19
3.5.1. Pembuatan Fe3O4 magnetik nanopartikel 19
3.5.2. Pembuatan kitosan magnetik – Fe3O4 20
3.5.3. Persiapan larutan stok Cd(II) dan Cu(II) 20
3.5.4. Adsorpsi kitosan magnetik nanopartikel terhadap logam kadmium (Cd) Dan tembaga (Cu) 21
3.5.4.1. Pengaruh waktu kontak 21
3.5.4.2. Pengaruh konsentrasi logam Cd 22
BAB 4 : HASIL DAN PEMBAHASAN 23
4.1. Adsorpsi kitosan magnetik nanopartikel terhadap logam Cd(II) dan Cu(II) 23
4.1.1. Kalibrasi larutan standar logam Cd(II) dan Cu(II) 23
4.1.1.1. Kalibrasi larutan standar logam Cd(II) 23
4.1.1.2. Kalibrasi larutan standar logam Cu(II) 25
4.1.2. Pengaruh variasi waktu kontak 27
4.1.3. Pengaruh variasi konsentrasi logam Cd(II) dan Cu(II) 30
4.1.3.1. Pengaruh variasi konsentrasi logam Cd(II) 30
4.1.3.2. Pengaruh variasi konsentrasi logam Cu(II) 31
4.2. Studi Analisis 32
4.2.1. Analisis FTIR 32
4.2.2. Analisis SEM 34 BAB 5 : KESIMPULAN DAN SARAN 32
5.1. Kesimpulan 35
5.2. Saran 35
DAFTAR PUSTAKA 36
LAMPIRAN
viii
DAFTAR TABEL
Halaman
Tabel 2.1. Karakteristik kitin 5
Tabel 2.2. Karakteristik kitosan 6
Tabel 4.1. Data kalibrasi larutan standar Cd(II) dengan Konsentrasi 0,5 – 5 ppm 23
Tabel 4.2. Data kalibrasi larutan standar Cu(II) dengan Konsentrasi 0,5 – 3 ppm 25
Tabel 4.3. Data variasi waktu kontak logam Cd dari 10 – 60 menit 27
Tabel 4.4. Data variasi waktu kontak logam Cu dari 10 – 60 menit 28
Tabel 4.5. Data variasi konsentrasi logam Cd(II) dari 1 – 60 ppm 30
Tabel 4.6. Data variasi konsentrasi logam Cu(II) dari 1 – 60 ppm 31
Tabel 4.7. Data FTIR masing-masing sampel 33
DAFTAR GAMBAR
Halaman Gambar 2.1. Diagram sederhana dari Spektrofotometer Serapan
Atom 15
Gambar 4.1. Kurva kalibrasi larutan standar Cd(II) 24 Gambar 4.2. Kurva kalibrasi larutan standar Cu(II) 26 Gambar 4.3. Kurva variasi waktu kontak sampel terhadap
penyerapan Logam Cd(II) 28 Gambar 4.4. Kurva variasi waktu kontak sampel terhadap
Penyerapan Logam Cu(II) 28 Gambar 4.5. Kurva variasi konsentrasi larutan Cd terhadap
Penyerapan Logam 31 Gambar 4.6. Kurva variasi konsentrasi logam Cu (II) terhadap
Penyerapan Logam 32 Gambar 4.7. Analisis SEM magnetik nanopartikel dengan
perbesaran 1000x 34
x
PENGGUNAAN KITOSAN MAGNETIK NANOPARTIKEL
UNTUK MENYERAP LOGAM KADMIUM (Cd) DAN
TEMBAGA (Cu) DENGAN MENGGUNAKAN
SPEKTROFOTOMETER SERAPAN ATOM(SSA)
ABSTRAK
Kitosan merupakan salah satu medium yang digunakan sebagai penyerap (absorbsi) ion logam kadmium (Cd) dan tembaga (Cu) dalam air limbah. Pembuatan kitosan magnetik nanopartikel bertujuan untuk mengefektifkan daya serap (absorbsi) kitosan terhadap limbah ion logam berat dengan cara memperluas permukaan kitosan tersebut. Teori kinetika laju reaksi menyatakan bahwa semakin luas permukaan suatu zat maka reaksi akan semakin cepat. Variasi konsentrasi larutan diperlukan untuk menemukan pada konsentrasi berapa larutan kitosan magnetik nanopartikel tersebut efektif untuk menyerap (mengabsorbsi) logam kadmium (Cd+2) dan tembaga (Cu+2). Kitosan magnetik nanopartikel mempunyai daya serap optimum pada logam Cd sebesar 90,04% dan pada logam Cu sebesar 99,12 % dengan waktu kontak 30 menit . Analisa spektoskopi FTIR menunjukkan bahwa panjang gelombang NH= 3448,72 cm-1 ; C-H= 2877,79 cm-1 ; C=O = 1651,07 cm-1 ; C-N=1257,59 cm-1. Data ini menunjukkan bahwa terdapat senyawa kitosan dalam larutan tersebut. Analisa FESEM didapatkan permukaan kitosan magnetik nano yang lebih besar dan merata sehingga memungkinkan untuk menyerap (mengabsorbsi) ion logam kadmium (Cd+2) dan ion logam tembaga (Cu+2) lebih efektif yaitu pada berat molekul tinggi.
Kata kunci : Kitosan, partikel, kitosan nano, mengabsorbsi
A USEFUL MAGNETIC CHITOSAN NANOPARTICLE TO ABSORB HEAVY METAL CADMIUM (Cd) AND CUPRUM (Cu)
WITH ATOMIC ABSORBTION SPECTROSCOPY
ABSTRACT
Chitosan is one of the medium which is used as absorber of Cd metal and Cu metal. The making of magnetic chitosan nanoparticle to cause chitosan absorptive power to heavy metal liquid waste and cooler essence by expanding the substance the chitosan itself. The theory of reaction quick kinetic states that the more wider the substance of the essence so the reaction will be the more faster. The solution concentrate variation is needed to find that concentration of how much magnetic chitosan nanoparticle solution become effective to absorb Cd metal and Cu metal. The absorptive power from high molecule of heavy magnetic chitosan nanoparticle has optimum absorptive for Cd metal amount of 90,04% and Cu metal amount of 99,12 % during 30 minutes. Spectroscopy analysis FTIR showed that a long unbroken wave N-H=3448,72 cm-1 ; C-H=2877,79 cm-1 ; C=O = 1651,07 cm-1 ; C-N=1257,59 cm-1. This data showed that there is chitosan compound in that solution. FESEM analysis is got that magnetic chitosan nanoparticle substance is bigger and flat so it is possible to absorb Cd metal and Cu metal waste is more effective, that is weight in high molecule.
Key words : Chitosan, particle, nano chitosan, absorptive
ii
BAB 1
PENDAHULUAN
1.1. Latar Belakang
Telah diketahui bahwa ion-ion logam berat seperti Pb2+, Cd2+, Hg2+, Ni2+, dan Cu2+ dapat menyebabkan masalah-masalah kesehatan yang berat pada hewan dan manusia karena ion-ion logam tersebut secara spesifik dapat mengikat protein, asam nukleat dan metabolisme kecil dalam organisme makhluk hidup. Ini menyebabkan perubahan atau penghilangan fungsi biologi dan dapat merusak kontrol homeostatik logam-logam esensial (Martin R.B, 1998). Sebagai contoh Pb2+ dapat menghalangi homobiosintesis, menghambat beberapa enzim-enzim zink, berinteraksi dengan asam nukleat dan RNA untuk mempengaruhi sintesis protein, dan berkumpul di struktur tulang yang rapuh. Ion-ion logam beracun ini bertahan dalam aliran limbah dari pertambangan, pembangkit tenaga listrik, pabrik elektronik, dan penyamak kulit (Boddu V.M, 2003).
Berbagai teknik dan proses telah dikembangkan untuk memisahkan ion-ion logam berat yang sangat berbahaya dari dalam air, diantaranya dengan penukaran ion, pengendapan kimia, dan dengan adsorpsi. Adsorpsi merupakan metode yang aman, tidak memberikan efek samping yanng membahayakan kesehatan, tidak memerlukan peralatan yang rumit dan mahal, serta mudah pengerjaannya (Liu, 2009). Pada metode adsorpsi logam menjadi adsorbat yang akan diserap oleh adsorben yaitu bahan padat dengan luas permukaan besar. Menggunakan biosorben murah seperti limbah agrikultur, material tanah liat, biomassa, dan limbah pengolahan makanan laut mungkin salah satu alternatif teknologi air limbah karena bisorben tersebut tidak mahal dan mampu menurunkan tingkat ion-ion logam berat.
Kitosan merupakan polimer yang pemanfaatannya telah banyak digunakan sebagai adsorben untuk penyerapan logam-logam di perairan. Kitosan mempunyai
2
sifat tidak beracun dan dapat terbiodegradasi. Kitosan juga memiliki gugus fungsi yang dapat digunakan sebagai ligan untuk berkoordinasi dan bereaksi (Marganof, 2002). Selain karena karakteristik kitosan yang istimewa, pemanfaatan kitosan juga didukung oleh bahan bakunya yang berlimpah. Kitosan diperoleh dari deasetilasi kitin yang merupakan salah satu material penyusun eksoskleton dari serangga golongan crustaseae seperti udang dan kepiting (Ogawa, 2004). Modifikasi kitosan telah banyak dilakukan untuk meningkatkan daya serapnya terhadap ion logam. Agusnar, H (2006) telah meneliti ikatan silang kitosan dengan glutaraldehida sebagai pelapis filter fiber glass untuk menyerap logam krom (III) sebesar 99,7 %. Aritonang, S. (2009) telah meneliti kitosan nanopartikel untuk menurunkan konsentrasi Cu2+ sebesar 93,66 %. Dan menurut Melani, H (2010) kitosan magnetik nanopartikel bersumber dari kulit udang mampu menyerap logam Cr sebesar 98,44%.
Saat ini banyak penelitian dilakukan dengan teknologi nano. Hal tersebut disebabkan bentuk nano mempunyai pori-pori dengan ukuran kecil sehingga memperluas daerah penyerapan dan bentuk magnetik akan mengaktifkan amina dari kitosan agar penyerapan lebih baik. Salah satu penggunaan teknologi nano yaitu magnetik nanopartikel yang digunakan untuk melapisi beberapa surfaktan untuk anti penggumpalan yang diakibatkan oleh interaksi dipol magnet antara partikel. Magnetik nanopartikel biasanya terdiri dari pusat magnet dan cangkang polimer dengan gugus fungsi yang aktif dan istimewa untuk berbagai aplikasi.
Selanjutnya, sebagian besar studi menunjukkan bahwa nanopartikel itu memiliki kapasitas adsorpsi yang luar biasa untuk ion-ion logam beracun dalam air. Keberhasilan sintesis dispersi magnetik nanopartikel terutama besi oksida nanopartikel memberikan metode yang tepat untuk menyelidiki teknik separasi magnetik karena karakter spesifiknya. Magnetik nanopartikel memiliki kemampuan meningkatkan jumlah air limbah dalam waktu singkat dan dapat diseparasi secara tepat dari air limbah, selanjutnya magnetik nanopartikel ini disesuaikan dengan
3
polimer, molekl-molekul baru, atau material anorganik untuk memberikan reaktivitas permukaan (Rocher V, 2008).
Penelitian mengenai kitosan sebagai penyerap ion logam telah banyak dilakukan. Demikian pula penggunaan magnetik nanopartikel telah banyak dilakukan untuk penyerapan ion logam. Namun demikian belum ada penelitian mengenai kitosan magnetik nanopartikel yang digunakan untuk penyerapan logam kadmium (Cd2+) dan tembaga (Cu2+). Timbul keinginan untuk melihat pengaruh berat molekul dalam bentuk nanopartikel untuk menyerap Cd dan Cu dengan memakai SSA.
1.2Rumusan Permasalahan
Berdasarkan uraian di atas maka dapat diambil rumusan permasalahan sebagai berikut :
Apakah kitosan magnetik nanopartikel mampu menurunkan konsentrasi logam Cd2+ dan Cu2+ dengan menggunakan SSA
1.3Tujuan Penelitian
Untuk mengetahui kitosan magnetik nanopartikel dapat menurunkan konsentrasi logam Cd2+ dan Cu2+ dengan menggunakan SSA
1.4Manfaat Penelitian
Memberikan informasi mengenai pemanfaatan kitosan magnetik nanopartikel untuk penanggulangan pencemaran oleh logam-logam Cd2+ dan Cu2+ .
1.5Lokasi Penelitian
BAB 2
TINJAUAN PUSTAKA 2.1Kitin
Nama kitin berasal dari bahas Yunani yaitu chiton, pertama kali diberikan oleh Odier pada tahun 1923, yang artinya sampul atau baju. Kitin merupakan polisakarida linear yang mengandung N-asetil-D-glukosamina yang terikat β, dimana pada hidrolisis akan menghasilkan 2-amino-2-deoksi-D-glukosa. Rumus umumnya adalah (C8H13O5N)n . Secara kimiawi kitin merupakan polimer (1,4)-2-asetamido-2-deoksi-β-D-glukosamin (Marganof, 2002).
Kitin merupakan salah satu material penyusun eksoskleton dari serangga dan golongan crustaseae yang dapat diuraikan dengan enzim kitinase (Ogawa et.al, 2004). Zat ini ditemukan di banyak tempat di seluruh dunia. Zat kitin adalah komponen utama dari dinding sel jamur, serta mulut bangsa chepalopoda, termasuk cumi-cumi dan gurita (mulut bangsa cumi-cumi ini mirip dengan paruh burung nuri yang miring, dan mulut ini sangat keras). Kitin merupakan senyawa organik yang berwarna putih, keras, dan tidak elastis. Kitin dapat diperoleh dari kulit sotong, kulit udang, kulit kepiting dan cangkang blangkas. Kulit udang mengandung protein (25% - 40%), kitin (15% - 20%), dan kalsium karbonat (45% - 50%). Kulit kepiting mengandung protein (15,6% - 32,2%), dan kalsium karbonat (53,7% - 78,4%). Pada umumnya isolasi kitin dilakukan dari kulit udang dan kepiting karena mudah diperoleh dan memiliki kandungan kitin yang cukup banyak. (Marganof, 2002).
Menurut metode Alimuniar dan Zainuddin (2004), bahan seperti kulit udang terlebih dahulu dicuci bersih, kemudian direndam dengan NaOH selama 24 jam. Selanjutnya dilakukan pencucian hingga pH netral. Kemuudian dilakukan perendaman HCl 2 M selama 24 jam. Setelah itu dicuci dengan air suling hingga pH netral. Selanjutnya kitin yang dihasilkan dikeringkan pada suhu kamar.
5
Menurut Widodo (2005), kitin mempunyai kadar nitrogen tidak lebih dari 70% dan memiliki kelarutan yang sangat rendah di dalam air dan pelarut-pelarut lainnya. Selain itu, karena reaktivitas kimianya yang rendah maka pengolahan kitin sangat sulit dan terbatas.
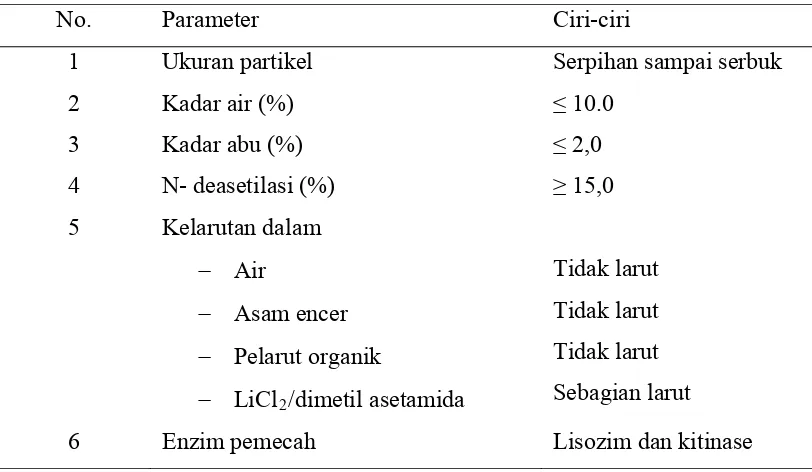
Tabel 2.1. Karakteristik kitin
No. Parameter Ciri-ciri
1 Ukuran partikel Serpihan sampai serbuk
2 Kadar air (%) ≤ 10.0
3 Kadar abu (%) ≤ 2,0
4 N- deasetilasi (%) ≥ 15,0
5 Kelarutan dalam
Air
Asam encer
Pelarut organik
LiCl2/dimetil asetamida
Tidak larut Tidak larut Tidak larut Sebagian larut
6 Enzim pemecah Lisozim dan kitinase
Sumber : Purwaningsih, (1994)
2.2 Kitosan
Kitosan atau β-1,4,2-amino-2-deoksi-D-glukosa merupakan turunan dari kitin melalui proses deasetilasi dengan menggunakan basa kuat pada temperatur yang cukup tinggi. Nama kitosan diberikan oleh Hoppe-Seiler pada tahun 1994 yang membuat kitosan dengan cara merefluks kitin dalam larutan KOH pada suhu 180oC tanpa terjadi pemutusan rantai polimernya (Muzzarelli, 1977).
6
selama 6 hari. Kemudian disaring dan dicuci sampai pH netral. Kitosan yang diperoleh dikeringkan pada suhu kamar.
Kitosan adalah padatan amorf putih yang bersifat tidak larut dalam air tetapi sedikit larut dalam HCl, HNO3, H3PO4, dan di samping itu, kitosan juga bersifat polielektrolit sehingga dapat dengan mudah berinteraksi dengan zat-zat organik lainnya seperti protein. Dengan demikian, kitosan relatif lebih banyak digunakan pada berbagai bidang industri terapan dan industri kesehatan daripada kitin (Marganof, 2002).
Kitosan telah digunakan di berbagai bidang industri seperti industri makanan aditif, kosmetik, material pertanian, dan untuk antibakterial. Kitosan juga sering digunakan sebagai adsorben pada ion logam dan spesies organik. Hal ini disebabkan oleh adanya gugus amino dan gugus hidroksil dari rantai kitosan yang dapat dijadikan sebagai tempat untuk berkoordinasi dan bereaksi (Juang, 2002). Atom nitrogen pada gugus amina menyediakan pasangan elektron bebas yang dapat bereaksi dengan kation logam. Pada pH asam, gugus amina terprotonasi sehingga meningkatkan kelarutan kitosan yang bersifat tidak larut dalam pelarut alkali dan pada pH netral (Bernkop dkk, 2004).
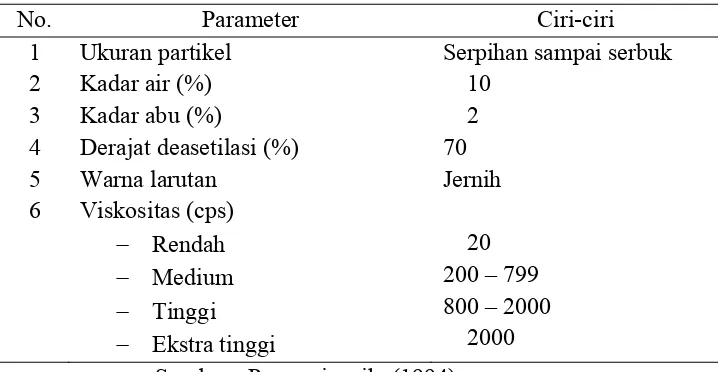
Tabel 2.2. Karakteristik kitosan
No. Parameter Ciri-ciri
1 Ukuran partikel Serpihan sampai serbuk
2 Kadar air (%) 10
3 Kadar abu (%) 2
4 Derajat deasetilasi (%) 70
5 Warna larutan Jernih
6 Viskositas (cps)
Rendah
Medium
Tinggi
Ekstra tinggi
20 200 – 799 800 – 2000
2000 Sumber : Purwaningsih, (1994)
7
Beberapa aplikasi dan fungsi kitosan adalah sebagai berikut :
a. Pengolahan limbah, kitosan berfungsi sebagai bahan koagulasi/flokulasi untuk limbah cair, penghilang ion-ion logam dari limbah
b. Bidang pertanian, kitosan berfungsi sebagai bahan antimikrobial dan sebagai pupuk
c. Industri tekstil, kitosan berfungsi sebagai serat tekstil, meningkatkan ketahanan warna
d. Bidang bioteknologi, kitosan berfungsi sebagai bahan immobilasi enzim e. Kosmetik, kitosan berfungsi untuk rambut dan kulit
f. Bidang fotografi, kitosan berfungsi untuk melindungi film dari kerusakan g. Bidang biomedis, berfungsi untuk mempercepat penyembuhan luka,
bahan campuran obat, menurunkan kadar kolesterol
Sifat kationik, sifat biologi dan sifat kimia larutan kitosan adalah sebagai berikut : 1. Sifat kationik
a. Jumlah muatan positif tinggi : satu muatan per unit gugus glukosamin, jika banyak material bermuatan negatif (seperti protein) maka muatan positif kitosan berinteraksi kuat dengan permukaan negatif.
b. Flokulan yang baik : gugus NH3+ berinteraksi dengan muatan negatif dari koloid
c. Mengikat ion-ion logam ( Fe, Cu, Cd, Hg, Pb, Cr, Ni, dll ) 2. Sifat biologi
a. Dapat terdegradasi secara alami b. Polimer alami
c. Nontoksik 3. Sifat kimia
8
b. Gugus amino yang reaktif
c. Gugus hidroksil yang reaktiif ( C3-OH, C6-OH ) yang dapat membentuk senyawa turunannya
Parameter dasar yang dapat digunakan untuk karakterisasi kitosan adalah derajat deasetilasi, berat molekul polimer, dan sifat kristalnya. Parameter ini mempengaruhi sifat fisika-kimianya. Derajat deasetilasi pada kebanyakan kitosan biasanya lebih rendah dari 95%. Produk dengan deasetilasi yang cukup tinggi lebih diminati untuk aplikasi biomedis. Untuk memperoleh hasil yang diinginkan, parameter ini dapat dimodifikasi. Derajat deasetilasi dapat diturunkan dengan reasetilasi sedangkan berat molekul melalui depolimerisasi menggunakan asam.
2.3 Faktor-faktor yang mempengaruhi penyerapan ion logam oleh kitosan
Pada kitosan ada beberapa faktor yang dapat mempengaruhi proses penyerapan ion logam, di antaranya :
a) Berat molekul dan derajat deasetilasi kitosan
Berat molekul dan derajat deasetilasi memainkan peranan yang penting dalam proses kelarutan dan penyerapan. Kitosan merupakan hasil dari deasetilasi kitin, yaitu proses pergantian gugus amida menjadi amina. Derajat deasetilasi kitin dan kitosan dapat diperoleh dari spektra FTIR masing-masing senyawa (Khan dkk, 2002)
Pertambahan nilai derajat deasetilasi menyebabkan bertambahnya jumlah gugus amina bebas sehingga menurunkan berat molekulnya. Dengan bertambahnya gugus amina bebas maka bertambah juga tempat untuk berkoordinasi dan bereaksi (Milot dkk, 1998)
b) Ukuran kitosan
Kitosan biasanya dihasilkan dalam bentuk kepingan atau serbuk. Kedua bentuk ini mudah hancur dan mengembang menyebabkan kapasitas serapan
9
dan kuantitas serapan menurun sehingga tidak stabil dalam larutan berair (Rorrer, 1999)
Kitosan dalam bentuk larutan atau gel dapat meningkatkan kapasitas serapannya. Kitosan yang telah dimodifikasi dengan magnetik nanopartikel juga dapat meninngkatkan kapasitas serapannya. Erdawati (2008), telah meneliti penyerapan kitosan magnetik nanopartikel terhadap logam Ni (II) meningkat dari 86,95 mg/gram oleh kitosan menjadi 477,8 mg/gram.
c) pH Kitosan
Kapasitas serapan kitosan terhadap ion logam menurun jika pH diturunkan. Hal ini terjadi akibat adanya persaingan ion hidronium dan gugus amina dalam penyerapan ion logam.
d) Temperatur
Mckay dkk (1989) telah melakukan penelitian dengan menggunakan serbuk kitosan untuk menyerap ion logam Cu2+, Hg2+, Ni2+, dan Zn2+ secara isoterm dan pemanasan pada temperatur 25 – 60oC pada pH netral. Hasil yang diperoleh yaitu terjadinya penurunan kapasitas penyerapan dengan pertambahan temperatur.
e) Waktu Penyerapan
Pengaruh waktu optimum terhadap proses penyerapan ion logam sangat besar terhadap kadar serapan. Quian dkk (2000) melaporkan bahwa dengan waktu 8 menit didapati hasil proses penyerapan ion logam Se (VI) sebanyak 95%.
2.4 Magnetik Nanopartikel
10
mikroskop atomik (AFM), penghamburana cahaya dinamik (DLS), X-ray mikroskop fotoelektron (XPS) dan bubuk X-ray diftaktometri (XRD) (Anisa dkk, 2003).
Fe3O4 merupakan magnetik nanopartikel yang telah digunakan sesuai denngan sifat spesifiknya yaitu superparamagnetik, tidak beracun, dan ukurannya yang kecil. Fe3O4 dihasilkan dari endapan campuran FeCl2.4H2O dan FeCl3.6H2O dalam suasana basa (dengan kehadiran NH4Cl), reaksinya menurut Dung (2009) adalah sebagai berikut :
FeCl2.4H2O + FeCl3.6H2O + 8 NH4OH → Fe3O4 + 8NH4Cl + 20H2O Magnetik nanopartikel digunakan untuk melapisi beberapa surfaktan untuk anti penggumpalan yang diakibatkan oleh interaksi dipol magnet antar partikel. Magnetik nanopartikel biasanya terdiri dari pusat magnet dan cangkang polimer yang mempunyai gugus fungsi yang aktif dan istimewa untuk berbagai aplikasi. Aplikasi yang paling terkenal dari teknologi magnetik yaitu kromatografi bioafinitas, penanggulangan limbah air, penghentian enzim aatau biomolekul lain, dan preparasi uji imunilogi.
2.5 Adsorpsi
Adsorpsi adalah proses akumulasi substansi di permukaan antara dua fase yang terjadi secara fisika dan kimia, atau proses terserapnya molekul-molekul pada permukaan eksternal atau internal suatu padatan. Akumulasi yang terjadi dapat berlangsung pada proses cair-cair, cair-padat dan padat-padat. Adsorben adalah bahan padat dengan luas permuakaan dalam yang besar. Permukaan yang luas ini terbentuk karena banyaknya pori yang halus pada padatan tersebut. Adsorben dapat berbentuk granulat (ukuran butiran sebesar beberapa mm) atau bentuk serbuk sesuai dengan tujuan penggunaannya. Beberapa bahan yang dapat digunakan sebagai adsorben di antaranya yaitu : karbon aktif, silika gel, dan zeolit (McCabe dkk, 1999).
11
Adsorpsi yang terjadi karena adanya gaya tarik dari permukaan adsorban dan energi kinetik molekul adsorbat, dapat berupa adsorpsi fisika, adsorpsi kimia dan adsorpsi isoterm. Pada adsorpsi fisika terjadi gaya van der waals antara molekul adsorbat dan adsorben untuk berikatan. Hal ini terjadi akibat perbedaan energi gaya tarik elektrostatik sehingga adsorpsi fisika merupakan reversibel. Sedangkan adsorpsi kimia merupakan interaksi antara elektron-elektron pada permukaan adsorben dengan molekul-molekul adsorbat membentuk ikatan yanng lebih kuat dibandingkan dengan adsorpsi fisika dimana prosesnya berlangsung secara irreversibel.
Proses adsorpsi berlangsung dalam 3 tahap yaitu : pergerakan molekul-molekul adsorbat menuju permukaan adsorben, penyebaran molekul-molekul adsorbat ke dalam rongga-rongga adsorben, dan penarikan molekul-molekul adsorbat oleh permukaan aktif membentuk ikatan yang sangat cepat.
2.6Interaksi Logam dengan Kitin dan kitosan
Folsom (1986 dalam Melani (2010)) mengemukakan bahwa interaksi antara ion logam dengan ligan pada umumnya berasal dari alam, berlangsung melalui proses pertukaran kation, yang secara garis besar dibedakan menjadi tiga kelompok yaitu :
1. Interaksi pertukaran kation cepat melibatkan ion Na, K, Mg, Ca, Li, Cs, Rb, Sr dan Ba. Kation-kation ini cenderung membentuk kompleks dengan ligan oksigen menghasilkan senyawa kompleks yang relatif stabil sehingga ligan mengalami pertukaran yang cepat di air.
12
3. Interaksi pertukaran kation lamabat yang melibatkan ion logam Cu(II), Cr(III), Ti(II), Cd(II), Ag(I), Hg(II). Kation kation ini memiliki afinitas yang kuat dengan ligan yang mengandung N dan S.
Kemampuan kitin dan kitosan untuk mengadakan interaksi dengan ion logam disebabkan senyawa tersebut mengandung gugus fungsional utama yaitu amida dan amina. Amida merupakan gugus aktif yang mempunyai ikatan rangkap parsial sebagai akibat adanya ikatan rangkap pada gugus karbonilnya, sedangkan gugus aktif amina tidak memiliki ikatan rangkap. Kitin dan kitosan memiliki kemampuan mengikat ion-ion logam karena elektron nitrogen yang terdapat dalam gugus-gugus amino tersubstitusi dapat memantapkan ikatan dengan ion-ion logam transisi.
Interaksi kitosan dengan ion logam terjadi karena proses pengkompleksan dimana penukaran ion, penyerapan dan pengkhelatan terjadi selama proses berlangsung. Kitosan menunjukkan afinitas yang tinggi pada logam transisi golongan tiga, begitu pula pada logam yang
bukan golongan alkali dengan konsentrasi rendah (Muzzarelli, 1977). 2.7Spektrofotometri Serapan atom (SSA)
2.7.1. Prinsip kerja alat
Larutan sampel diaspirasikan ke suatu nyala dan unsur-unsur di dalam sampel diubah menjadi uap atom sehingga nyala mengandung atom unsur-unsur yang dianalisis. Beberapa di antara atom akan tereksitasi secara termal oleh nyala, tetapi kebanyakan atom tetap tinggal sebagai atom netral dalam keadaan dasar (ground state). Ato-atom dalam keadaan dasar ini kemudian menyerap radiasi yang diberikan oleh sumber radiasi yang terbuat dari unsur-unsur yang bersangkutan. Panjang gelombang yang dihasilkan oleh sumber radiasi adalah sama dengan panjang gelombang yang diadsorpsi oleh atom dalam nyala. Adsorpsi ini mengikuti hukum Lambert-Beer yakni absorbansi berbanding lurus dengan panjang nyala yang dilalui sinar dan konsentrasi uap atom dalam nyala. Kedua variabel ini sulit
13
untuk ditentukan tetapi panjanng nyala dapat dibuat konstan sehingga absorbansi hanya berbanding langsung dengan konsentrasi anallit dalam larutan sampel.
2.7.2. Teknik-teknik Analisis
a. Metode Kurva kalibrasi
Dalam metode ini dibuat suatu seri larutan standar dengan berbagai konsentrasi dan absorbansi dari larutan tersebut diukkur dengan SSA. Langkah selanjutnya adalah membuat grafik antara konsentrasi dengan absorbansi yang akan merupakan garis lurus melewati titik nol. Konsentrasi larutan sampel dapat dicari setelah absorbansi larutan sampel diukkur dan diintrapolasikan ke dalam kurva yang diperoleh dengan menggunakan program regresi linear pada kurva kalibrasi.
b. Metode Adisi Standar
Metode ini dipakai secara luas karena mampu meminimalkan kesalahan yang disebabkan oleh kondisi lingkungan (matriks) sampel dan standar. Dalam metode ini dua atau lebih sejumlah volume tertentu dari sampel dipindahkan ke dalam labu takar, satu larutan diencerkan sampai volume tertentu, kemudian diukur absorbansinya tanpa ditambah dengan zat standar, sedangkan larutan yang lain sebelum diukur absorbansinya ditambah terlebih dahulu dengan sejumlah tertentu larutan standar dan diencerkan seperti pada larutan yang pertama. Menurut hukum Lambert-Beer akan berlaku hal-hal berikut :
Ax = K Cx ... (1) At = K (Cs + Cx) ...(2) Dimana :
K = a b
Cx = konsentrasi zat sampel
Cs = konsentrasi zat standar yang ditambahkan ke larutan sampel Ax = absorbansi zat sampel
14
Jika kedua persamaan di atas digabung akan diperoleh : Cx = Cs [Ax / (At – Ax)] ...(3)
Konsentrasi zat dalam sampel (Cx) dapat dihitung dengan mengukur Ax dan At dengan spektrofotometer. Jika dibuat suatu seri penambahan zat standar dapat pula dibuat suatu grafik antara At vs Cs, garis lurus yang diperoleh diekstrapolasikan ke At = 0, sehingga diperoleh :
Cx = Cs [Ax / (0 – Ax)] ...(4) Cx = Cs [Ax / (– Ax)] ...(5) Cx = - Cs ...(6)
2.7.3. Komponen-komponen SSA
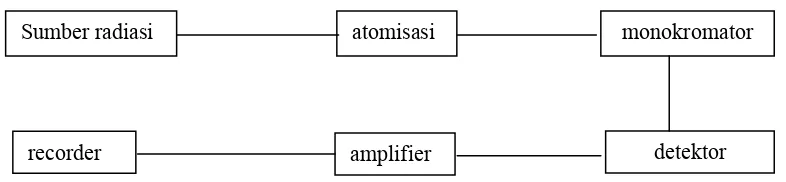
a. Sumber Radiasi
Sebagai sumber radiasi berupa lampu katoda berongga, pada lampu berongga ini digunakan lampu berlapis logam yang sama dengan logam yang akan dianalisis, karena lampu ini mempunyai tinngkat energi sama dengan atom logam yang akan dianalisis maka akan mengabsorbsi panjang gelombang dari lampu katoda berongga. Sesudah atom logam mengabsorpsi panjang gelombang maka akan tereksitasi tidak stabil dan akan kembali pada keadaan dasar sambil memancarkan radiasi kembali.
b. Atomisasi
Atomisasi dapat dilakukan dengan nyala api. Fungsi pokok nyala api adalah untuk mengubah unsur logam yang akan dianalisis menjadi atom-atom bebas yang masih dlam keadaan dasarnya.
c. Monokromator
Monokromator dalam instrumentasi SSA berfungsi untuk meneruskan panjang gelombang emisi dari lampu katoda berongga yang diadsorpsi paling kuat oleh atom-atom di dalam nyala api dan menahan garis-garis emisi lain dari lampu katoda berongga yang tidak digunakan untuk analisis.
15
d. Detektor
Berfungsi sebagai pengolah sinar radiasi menjadi sinyal-sinyal listrik. e. Amplifier
Berfungsi sebagai penguat sinyal listrik yanng dihasilkan oleh detektor. f. Rekorder
Berfungsi untuk menampilkan bentuk sinyal listrik menjadi satuan yang dapat dibaca.
Gambar 2.1. Diagram sederhana dari spektrofotometer Serapan Atom (SSA) Sumber radiasi atomisasi
detektor amplifier
recorder
BAB 3
METODOLOGI PENELITIAN
3.1. Lokasi Penelitian
Penelitian ini dilaksanakan di laboratorium kimia Analitik FMIPA USU, dilakukan selama 4 bulan dari mulai bulan Januari – April 2011.
3.2. Bahan
Bahan yang digunakan dalam penelitian ini adalah : Kitosan p. a (Fluka)
NH3 p. a merck CH3COOH p. a E merck Aquades
H2SO4 p. a merck
HNO3 p. a merck
Kertas Saring Whatman
FeSO4. 7 H2O p. a E merck
3.3 Alat
Alat yang digunakan dalam penelitian ini adalah : Neraca analitis mettler A. E 200
Gelas Ukur pyrex
Gelas Kimia pyrex Corong Pisah pyrex Pipet Volume pyrex Indikator universal
SSA shimadzu
FTIR Fourier transform infra red
17
FESEM
Flat kaca pyrex
Erlenmeyer pyrex
Tabung reaksi pyrex
3.4. Prosedur Penelitian
3.4.1 Pembuatan Fe3O4 magnetik nanopartikel (Dung, KTD et.al, 2009)
Fe3O4 magnetik nanopartikel diperoleh dengan mencampurkan FeCl3.6H2O dan FeSO4.7H2O dengan perbandingan 2 : 1. Tambahkan NaOH sehingga pH menjadi 9. Aduk selama 1 jam pada suhu 80oC. Pisahkan endapan yang terbentuk dengan penyaringan. Bilas endapan dengan etanol dan kemudian dengan aquades. Keringkan pada suhu 60oC di dalam oven dan simpan di tempat kering.
3.4.2. Pembuatan kitosan- Fe3O4 magnetik nanopartikel (Dung, KTD et.al, 2009)
Fe3O4 magnetik nanopartikel ditambahkan ke dalam larutan kitosan 2% dalam asam asetat 5% dengan perbandingan 1:1. Aduk campuran sambil tambahkan setetes demi setetes larutan pengemulsi yang mengandung 30 mL paraffin dan 0,5 mL CMC. Aduk selama 5 jam pada suhu kamar. Kemudian tambahkan secara perlahan 50 mL glutaraldehid 25% dan diaduk sampai terbentuk endapan. Endapan kitosan magnetik nanopartikel yang terbentuk didiamkan dan disaring. Bilas endapan kitosan magnetik nanopartikel dengan etanol. Keringkan pada suhu 30oC di dalam oven dan simpan di tempat yang kering.
3.4.3. Persiapan larutan stok Cd(II) dan Cu(II)
18
3.4.4. Adsorpsi Kitosan magnetik nanopartikel Terhadap Logam kadmium (Cd2+) dan tembaga (Cu2+)
3.4.4.1. Pengaruh waktu kontak
100 mg kitosan magnetik nanopartikel dicampurkan dengan 200 mL larutan logam Cd(II) dengan konsentrasi 10 ppm. Campuran dikondisikan pada pH optimum yang didapatkan dari prosedur di atas. Pengadukan dilakukan dengan variasi waktu 10, 20, 30, 40, 50, dan 60 menit. Endapan yanng terbentuk disaring dan diukur kadar logam Cd(II) yang terkandung dalam filtratnya menggunakan SSA. Perlakuan yang sama dilakukan untuk penentuan pengaruh waktu kontak terhadap logam Cu(II).
3.4.4.2. Pengaruh konsentrasi logam Cd(II) dan Cu(II)
100 mg kitosan magnetik nanopartikel dicampurkan dengan 200 mL larutan logam Cd(II) dengan konsentrasi 1, 5, 10, 20, 40, dan 60 ppm. Campuran dikondisikan pada pH optimum yang didapatkan dari prosedur di atas. Pengadukan dilakukan pada waktu optimum yang diperoleh pada prosedur di atas. Endapan yanng terbentuk disaring dan diukur kadar logam Cd(II) yang terkandung dalam filtratnya menggunakan SSA. Perlakuan yang sama dilakukan untuk penentuan pengaruh waktu kontak terhadap logam Cu(II).
3.5. Prosedur Kerja
3.5.1. Pembuatan Fe3O4 magnetik nanopartikel (Dung, KTD et.al, 2009)
+ NaOH hingga pH 9
aduk selama 1 jam pada suhu80oC
disaring
dibilas dengan etanol dan aquades
dikeringkan pada suhu 60oC
FeCl3.6H2O + FeSO4.7H2O ( 2 :
Endapan Filtrat
19
3.5.2. Pembuatan Kitosan - Nanomagnetik Fe3O4 (Dung, KTD et.al, 2009)
+ Nanomagnetik Fe3O4 (1:1)
-aduk selama 5 jam + medium dispersi
(30 ml parafin + 0,5 ml CMC) + 50 ml glutaraldehid 25 %
- cuci dengan etanol
- keringkan pada suhu 30oC - simpan di tempat yang kering Larutan kitosan 2 %
Campuran kitosan ‐ nanomagnetik
Terbentuk endapan
20
Kitosan magnetik nanopartikel
3.5.3. Persiapan larutan stokCd(II) dan Cu(II)
Aliquot
Larutan Cd(II) 0,5; 1; 2; 3; 4 dan 5 ppm Larutan standar
3.5.4. Adsorpsi Kitosan magnetik nanopartikel Terhadap Logam kadmium (Cd2+) dan tembaga (Cu2+)
3.5.4.1. Pengaruh waktu kontak
+ 200 mL larutan Cd2+ dengan
konsentrasi 10 ppm
diatur pH dengan variasi 3 – 6
diaduk dengan variasi waktu 10, 20, 30, 40, 50, dan 60 menit
disaring
diukur kadar Cd2+
menggunakan SSA
100 mg kitosan magnetik nanopartikel
Campuran
Endapan
Endapan Filtrat
21
22
3.5.4.2. Pengaruh konsentrasi logam Cd2+
+ 200 mL larutan Cd2+ dengan Konsentrasi 1,5,10,20,40 dan 60 ppm
diatur pH optimum
diaduk dengan waktu optimum
disaring
diukur kadar Cd2+ menggunakan SSA 100 mg kitosan magnetik nanopartikel
Campuran
Endapan
Endapan
Hasil Filtrat
BAB 4
HASIL DAN PEMBAHASAN
4.1. Adsorpsi Kitosan Magnetik Nanopartikel Terhadap Logam Cd (II) dan Cu(II)
Penentuan adsorpsi kitosan magnetik nanopartikel terhadap logam Cd (II) dan Cu(II) diamati dari dua variasi yaitu variasi waktu kontak, dan variasi konsentrasi logam Cd(II) dan Cu(II). Sisa konsentrasi logam Cd(II) dan Cu(II) yang tidak terserap oleh kitosan magnetik nanopartikel dapat diamati menggunakan Spektrofotometer Serapan Atom (SSA) dengan mengukur serapan sisa logam Cd(II) dan Cu(II) dengan persamaan garis regresi dapat ditentukan konsentrasi logam Cd(II) dan Cu(II) yang tidak terserap.
4.1.1. Kalibrasi Larutan Standar Logam Cd(II) dan Cu(II)
4.1.1.1. Kalibrasi Larutan Standar Logam Cd(II)
Kalibrasi larutan standar logam Cd(II) dilakukan dengan menggunakan larutan standar Cd(NO3)2 1000 ppm yang telah tersedia.
Tabel 4.1. Data Kalibrasi Larutan Standar Cd(II) dengan Konsentrasi 0,5 – 5 ppm
Konsentrasi logam Cd(II) (ppm) Serapan 0,5
1,0 2,0 3,0 4,0 5,0
0,0922 0,1858 0,3252 0,4884 0,6136 0,7845
Data serapan logam Cd(II) yang ditunjukkan pada Tabel 4.1 merupakan pengolahan data dari Lampiran dan dari serapannya dapat ditentukan persamaan garis regresinya yang ditunjukkan pada Gambar 4.1. Persamaan garis regresi untuk kurva dapat diturunkan dengan metode Least Square pada Tabel di bawah ini.
y = 0,150x + 0,025
25
i larutan kadmium sisa yang tidak diserap kitosan berada
Perhitu ko at ditentukan sebagai berikut : = 0,025
Persamaan garis regresi : Y = 0,15X + 0,025
Kurva kalibrasi di atas dibuat dari konsentrasi 0,5 – 5 ppm karena diharapkan serapan atau konsentras
pada rentang tersebut.
ngan efisien korelasi (r) dap r = { (Xi . X)(Yi . Y) }
lasi pada penetapan kadar Fe dengan spektroskopi serapan atom
.1.1.2
kan dengan menggunakan
ibrasi Larutan Standar Cu(II) dengan Konsentrasi 0,5
Konsentrasi lo )
= 0,998 Jadi, koefisien kore adalah (r) = 0,998
4 . Kalibrasi Larutan Standar Logam Cu(II)
Kalibrasi larutan standar logam Cu(II) dilaku larutan standar Cu(NO3)2 1000 ppm yang telah tersedia T
abel 4.2. Data Kal – 3 ppm
27
itu (r) dapat ditentukan sebagai berikut : = 0,05
Persamaan garis regresi : Y = 0,261X + 0,0,05 Perh ngan koefisien korelasi
r = { (Xi . X)(Yi . Y) }
tapan kadar Fe dengan spektroskopi
4.1.2. P
u dengan konsentrasi dari
T v –
Waktu kontak Penyerapa ) Penyerapan %)
= 0,992
Jadi, koefisien korelasi pada pene serapan atom adalah (r) = 0,992
engaruh variasi waktu kontak
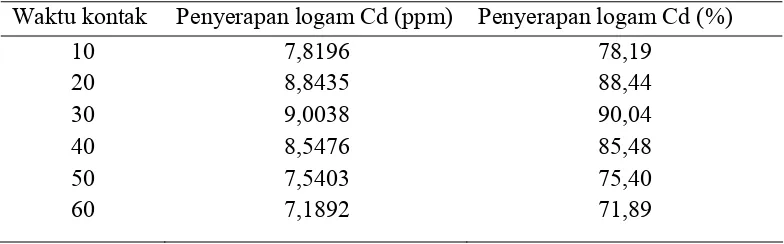
Variasi waktu kontak dilakukan dengan menggunakan larutan Cd dan Cu 10 ppm. Pengolahan data yang diperoleh dari data SSA (Lampiran ) dengan cara mengurangkan konsentrasi awal larutan Cd dan larutan C
data pengukuran SSA dapat dilihat pada tabel berikut : abel 4.3. Data ariasi waktu kontak dari 10 60 menit
28
ambar 4.3. kurva variasi waktu kontak sampel terhadap penyerapan logam
T v –
Waktu kontak Penyerapan ) Penyerapan u (%) abel 4.4. Data ariasi waktu kontak dari 10 60 menit
logam Cu (ppm logam C
ambar 4.4. kurva variasi waktu kontak sampel terhadap penyerapan logam
29
Penurunan kadar ion Cd dan Cu dalam sample dinyatakan dalam (%) dengan membandingkan konsentrasi Cd dan Cu yang terserap terhadap konsentrasi awal seperti pada persamaan berikut ini :
% penyerapan kitosan = [Cd] awal – [Cd] akhir x 100% [Cd] awal
Variasi waktu kontak antara kitosan magnetik nanopartikel dengan logam Cd(II) dan Cu(II) ditujukan untuk melihat waktu kesetimbangan adsorpsi kitosan magnetik nanopartikel terhadap larutan kadmium (Cd) dan tembaga (Cu). Proses penyerapan kitosan magnetik nanopartikel terhadap logam Cd(II) dan Cu(II) menyerupai pembentukan senyawa kompleks, dimana adanya peristiwa adsorpsi. Dari waktu kontak 10 menit, proses adsorpsi berbanding lurus dengan penambahan waktu kontak. Peningkatan proses adsorpsi terjadi sampai waktu kontak 30 menit, dimana kitosan magnetik nanopartikel sudah mencapai kesetimbangan adsorpsi sehingga dapat disimpulkan bahwa waktu optimum penyerapan kitosan magnetik nanopartikel terhadap logam Cd(II) dan Cu(II) adalah 30 menit.
Dari data yang ada peristiwa adsorpsi menurun setelah waktu kontak lebih besar dari 30 menit karena pada saat ini kitosan magnetik nanopartikel sudah mengalami proses desorpsi atau penguraian kembali logam Cd(II) dan Cu(II) dari kitosan magnetik nanopartikel.
Banyak logam-logam berat yang mampu diserap oleh Kitosan Nanopartikel, antara lain : Cu2+, Zn2+, Fe2+, Co2+, dan lain-lain. Biasanya logam-logam berat tersebut ada pada limbah cair industri yang dibuang ke sungai atau ke laut yang akhirnya mempunyai dampak cukup besar terhadap ekosistem lingkungan mengakibatkan terjadinya ketidakseimbangan alam. Berdasarkan kekuatan medan ligan dalam spektrokimia sebagai berikut :
CN - > NO2- > NH3 > H2O > F - > OH - > Cl - > Br - > I .
30
penolakan dalam medan magnet disebut sifat diamagnetik. Jika ada electron yang tidak berpasangan maka akan mengalami penarikan oleh medan magnet disebut sifat paramagnet. Makin banyak electron yang tidak berpasangan makin kuat sifat paramagnetiknya. Keadaan seperti ini menyatakan bahwa gugus amino lebih kuat medan ligannya dibandingkan gugus hidroksil. Pada laju reaksi, makin luas
permukaan maka daya serapnya makin baik.
4.1.3. Pengaruh Variasi Konsentrasi Logam Cd(II) dan Logam Cu(II)
4.1.3.1. Pengaruh Variasi Konsentrasi Logam Cd(II)
Variasi konsentrasi logam Cd(II) dilakukan pada kondisi waktu kontak optimum yaitu 30 menit. Data pada tabel 4.4 merupakan pengolahan data dari Lampiran dengan mengurangkan konsentrasi awal larutan Cd dengan konsentrasi dari data pengukuran SSA.
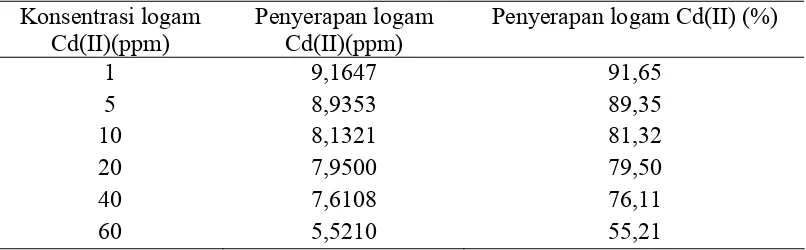
Tabel 4.5. Data Variasi Konsentrasi Logam Cd(II) dari 1 – 60 ppm
Konsentrasi logam Cd(II)(ppm)
Penyerapan logam Cd(II)(ppm)
Penyerapan logam Cd(II) (%) 1
5 10 20 40 60
9,1647 8,9353 8,1321 7,9500 7,6108 5,5210
91,65 89,35 81,32 79,50 76,11 55,21
31
Gambar 4.5. Kurva Variasi Konsentrasi Larutan Kadmium (Cd) Terhadap Penyerapan Logam
Data pada tabel 4.5 dapat diamati bahwa penyerapan kitosan magnetik nanopartikel terhadap logam Cd(II) dari 1 sampai 60 ppm terjadi pengurangan serapan dari 91,65 % menjadi 55,21 %. Penurunan serapan kitosan magnetik nanopartikel dapat disebabkan oleh kondisi kitosan magnetik nanopartikel yang mulai jenuh.
4.1.3.2. Pengaruh Variasi Konsentrasi Logam Cu(II)
Tabel 4.6. Data Variasi Konsentrasi Logam Cu(II) dari 1 – 60 ppm
Konsentrasi logam Cu(II)(ppm)
Penyerapan logam Cu(II)(ppm)
32
Gambar 4.6. Kurva Variasi Konsentrasi Larutan Tembaga (Cu) Terhadap Penyerapan Logam
Dari data pada tabel 4.6 dapat diamati bahwa penyerapan kitosan magnetik nanopartikel terhadap logam Cd(II) dari 1 sampai 5 ppm adalah 100 %. Pada konsentrasi yang lebih besar yaitu 10 -20 ppm terjadi pengurangan serapan menjadi 98,74 – 98,27 %. Dan pada konsentrasi 40 – 60 ppm terjadi pengurangan yang signifikan yaitu 95,01 – 90,82 %. Penurunan serapan kitosan magnetik nanopartikel disebabkan oleh kondisi kitosan magnetik nanopartikel yang mulai jenu.
4.2. Studi Analisis
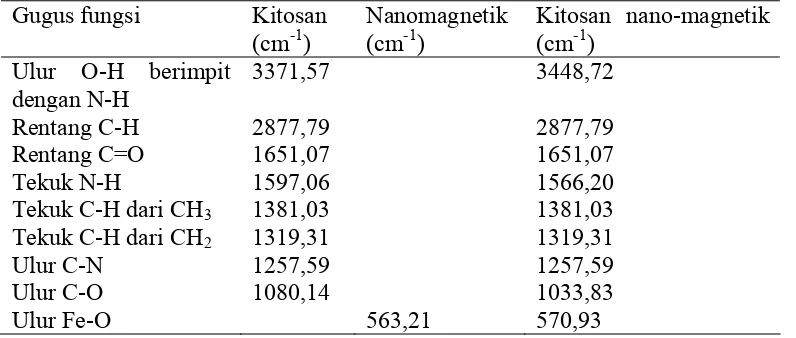
4.2.1. Analisis FTIR
Dari hasil analisis FT . IR didapatkan bahwa dalam sampel ada kitosan
ditunjukkan oleh data yang didapatkan sesuai dengan panjang gelombang yang ada
dalam literatur ( Fesenden JR 1999 ).
Analisis FTIR dilakukan untuk melihat gugus-gugus yang ada pada sampel dari serapannya pada bilangan gelombang tertentu dan perubahan gugus yang ada setelah adanya reaksi dengan senyawa lain.
33
Tabel 4.7. Data FTIR masing-masing sampel
Gugus fungsi Kitosan (cm-1)
Nanomagnetik (cm-1)
Kitosan nano-magnetik (cm-1)
Ulur O-H berimpit dengan N-H
Tabel 4.7 menampilkan serapan gugus yang ada pada setiap sampel. Dari tabel 4.7 dapat diamati bahwa gugus-gugus fungsi yang seharusnya ada pada kitosan terdapat pada sampel kitosan magnetik nanopartikel. Pada setiap data FTIR yang mengandung kitosan, masih terdapat ulur C=O dari amida sekunder yang berada pada rentang 1820 – 1680 cm-1 yang menunjukkan bahwa masih adanya amida dari kitin yang tidak mengalami deasetilasi. Hal itu disebabkan karena derajat deasetilasi setiap variasi kitosan < 100 %.
Pada daerah 3650 – 2400 cm-1 terdapat ulur O –H yang berimpitan dengan N-H. Untuk membedakan serapan O-H dan N-H dapat dilihat dari bentuk puncaknya. N-H mempunyai satu puncak lebar dan lebih tajam, sedangkan O-H mempunyai satu atau dua puncak tajam yang lebih lemah. Keberadaan ulur O-H dan N-H diperjelas dengan adanya serapan tekuk N-H dan serapan tekuk O-H.
34
4.2.2. Analisis SEM
Analisis SEM dilakukan untuk melihat permukaan penampang melintang
dan membujur suatu specimen secara mikroskopis dengan perbesaran 2000 x sehingga tofografi pada pori-pori permukaan terlihat dengan jelas seperti ditunjukkan pada Gambar 4. Dimana seluruh permukaan magnetik nanopartikel dapat terlihat dengan jelas.
Gambar 4.7. Analisis SEM magnetik nanopartikel dengan perbesaran 2000 x
BAB 5
KESIMPULAN DAN SARAN
5.1. Kesimpulan
Dari hasil penelitian yang telah dilakukan dapat disimpulkan bahwa :
1. Kitosan magnetik nanopartikel mampu menurunkan kadar konsentrasi logam kadmium (II) sebanyak 90,04 % dan logam tembaga (II) sebanyak 99,12 % pada waktu kontak selama 30 menit.
2. Dari analisis FT-IR didapatkan gugus-gugus yang sesuai dengan panjang gelombang kitosan magnetik nanopartikel
5.2. Saran
Dari hasil penelitian ini, penulis menyarankan agar dilakukan penelitian Kitosan magnetik nanopartikel terhadap logam-logam berat berbahaya lain yang dapat mencemari lingkungan seperti logam Cr, Ni, Fe, dan lain-lain dengan menggunakan kitosan magnetik nanopartikel dalam bentuk membran . Diharapkan kepada pihak industri agar mempergunakan kitosan magnetik nanopartikel untuk penyerapan logam-logam berbahaya yang mencemari lingkungan.
DAFTAR PUSTAKA
Agusnar, H. 2006. Penggunaan Glutaraldehida kitosan untuk penurunan Konsentrasi Ion Logam Ni2+ dan Cr3+ Menggunakan Ekstraksi Fasa padat. Disertasi FMIPA USU.
Alimuniar, A. & Zainuddin, R., 2004. An Economical Technique for Producing Chitosan. Elsevier applied Science
Anisa, M., Daar, S.A & Singer, A.P. 2003. Nanotechnology 14 R9-13. Doi : 10.1088/09574484/14/3/201. Journal of Nanoscience and Nanotechnology. Aritonang, P.S., 2009. Studi Penggunaan Kitosan Nanopartikel sebagai Bahan
Penyalut pada Zeolit Alam untuk Menurunkan Konsentrasi Ion Cu+2 dalam Larutan Teh Hitam.Tesis. FMIPA. Universitas Sumatra Utara. Bernkop, A., Hornof, M. Guggi, D, 2004. Thiolated chitosans. Europian Journal of
Parmaceutics And Biopharmaceutics, 9-17. Austria. Boddu, V.M.; Abburi, K.; et.al, Environ Sci. Technol, 2003
Dung, K.T.D. Hai, H.T. phuc, H.L. Long, D.B. 2009. Preperation and characterization of Magnetic nanoparticles with chitosan coating. Journal of Physics ; Conference Series 187 Vietnam.
Erdawati, 2008. Kapasitas adsorpsi kitosan dan kitosan nanomagnetik terhadap ion Ni(II). Jurusan kimia FMIPA Universitas Negeri Jakarta. Jakarta.
Juang, S.R. Wu, C.F & Tseng, L.R. 2002. Use of chemically modified chitosan beads for Sorptio And enzyme immobilation. Advances in enviromental Research. Taiwan.
Khan, A.T., dkk. 2002. Reporting degree of deacetylation values of chitosan : the influence Of analytical methods. Journal Pharm Pharmaceut Sci Malaysia. Liu, X., Hu, Q., Fang, Z., X., Zhang, 2009, Magnetic chitosan nanocomposites : A
useful Recyclable Tool for Heavy Metal Ion Removal
36
Marganof,2002. Potensi Limbah Udang sebagai penyerap logam berat (timbal, kadmium, dan Tembaga) di perairan.
McCabe, Smith, J., Peter, H., 1999. Operasi Teknik Kimia. Jilid 2. Erlangga. Jakarta.
Mckay, G., Blair, H.S., & Hindon, A. 1989. Equilibrium studies for the sorption of metal into Chitosan. Journal Chemistry.vol 28A.
Melani, H., 2010. Pengaruh Berat Molekul Kitosan Magnetik Nanopartikel untuk Menyerap Logam Krom Menggunakan SSA. Tesis. FMIPA. USU.
Millot, C., Mcbrien, J. Allen, S., & Guibal, E., 1998. Influence of psicochemical and structur Characteristic of chitosan falkes on molybdate sorption. Journal Applied Polymer Science.
Muzzarelli, R.A.A., 1977. Chitin. Perganon Press. New York.
Ogawa, Kozo, Yui, Toshifumi, & Kenji O, 2004, Three D Structures of Chitosan. International Journal of Biological Macromolecul.
Quian, S., dkk. 2000. Studies of adsorption behavior of crosslinked chitosan for Cr(VI) and Se(VI). Journal Applied Polymer Science. Vol 77
Rocher, V., Siaugue, J.M., Bee, A. Water Res. 2008.
Rorrer, G.L., & Way, J.D. 1999. Chitosan beads to remove heavy metals from wastewater. Oregon State University.
Widodo, Agus, Mardiah, & Praseto, A. 2005. Potensi Kitosan dari Sisa Udang sebagai Koagulan Logam Berat Limbah Cair Industri tekstil. ITS. Surabaya.
39
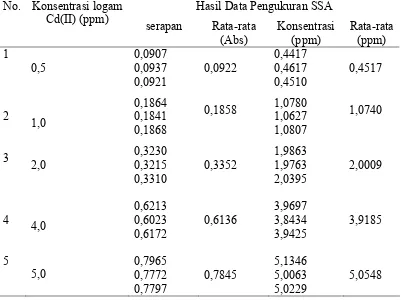
Tabel 1.Data Kalibrasi Larutan Standar Cd(II) dengan konsentrasi 0,5–5 ppm
Hasil Data Pengukuran SSA No. Konsentrasi logam
40
Tabel 2.Data Kalibrasi Larutan Standar Cu(II) dengan Konsentrasi 0,5 – 3 ppm
Hasil Data Pengukuran SSA No. Konsentrasi logam
41
Tabel 3. Data Adsorpsi Kitosan Magnetik Nanopartikel Terhadap Logam Cd (II) dengan Variasi Waktu Kontak
42
Tabel 4. Data Adsorpsi Kitosan Magnetik Nanopartikel Terhadap Logam Cu (II) dengan Variasi Waktu Kontak
43
Tabel 5. Data Adsorpsi Kitosan Magnetik Nanopartikel Terhadap Logam Cd (II) dengan Variasi Konsentrasi
Hasil Data Pengukuran SSA No. Konsentrasi logam
Tabel 6. Data Adsorpsi Kitosan Magnetik Nanopartikel Terhadap Logam Cu (II) dengan Variasi Konsentrasi
Hasil Data Pengukuran SSA No. Konsentrasi logam