KADAR FENOL TOTAL DAN BIOAKTIVITAS FLAVON DARI
KULIT KACANG TANAH SEBAGAI ANTIOKSIDAN DAN
ANTIPROLIFERASI TERHADAP SEL KANKER HELA
AIKA LATIFAH ALAWIYAH
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN SUMBER
INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa tesis berjudul Kadar Fenol Total dan Bioaktivitas Flavon dari Kulit Kacang Tanah sebagai Antioksidan dan Antiproliferasi terhadap Sel Kanker HeLaadalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya limpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Oktober 2016
Aika Latifah Alawiyah
AIKA LATIFAH ALAWIYAH. Kadar Fenol Total dan Bioaktivitas Flavon dari Kulit Kacang Tanah sebagai Antioksidan dan Antiproliferasi terhadap Sel Kanker HeLa. Dibimbing oleh SUMINAR SETIATI ACHMADI dan GUSTINI SYAHBIRIN.
Kulit kacang tanah umumnya menjadi limbah atau dimanfaatkan sebagai pakan ternak saja. Kadar fenol total suatu bahan memiliki korelasi dengan aktivitas antioksidan, sehingga kadar fenol total dapat memengaruhi bioaktivitas tersebut. Oleh karena itu, penelitian ini bertujuan menentukan kadar senyawa fenol dan bioaktivitasnya sebagai antioksidan serta mengevaluasi isolat flavon dari kulit kacang tanah sebagai antiproliferasi pada sel kanker HeLa.
Sampel diekstraksi dengan teknik refluks menggunakan pelarut etanol kemudian difraksionasi. Fraksi etil asetat diperoleh melalui teknik ekstraksi cair-cair dari ekstrak etanol dan pemisahan selanjutnya menggunakan kromatografi kolom gravitasi untuk mendapatkan isolat flavon. Kadar fenol total dari ekstrak etanol dan fraksi etil asetat ditentukan menggunakan metode Folin-Ciocalteau. Hasil uji menunjukkan kadar fenol total ekstrak etanol dan fraksi etil asetat masing-masing 262 dan 532 mg/g ekstrak. Aktivitas antioksidan dari ekstrak etanol dan fraksi etil asetat dievaluasi menggunakan metode penangkapan radikal 2,2-difenilpikrilhidrazil (DPPH) yang masing-masing menghasilkan IC50 32 dan
19 µg/mL.
Isolat flavon diidentifikasi menggunakan spektrofotometer ultraviolet-tampak dan menghasilkan pita serapan di daerah 342, 297.5, dan 220 nm. Spektrum massa dari isolat dengan menggunakan teknik kromatografi cair-spektrometri massa memperlihatkan fragmen dengan m/z 271. Namun, spektrum menunjukkan bahwa fraksi yang mengandung apigenin ini belum sepenuhnya murni.Penghambatan proliferasi sel kanker HeLa menggunakan metode reaksi 3-(4,5–dimetil tiazol-2-il)-2,5-difeniltetrazolium bromida (MTT) mengungkap bahwa isolat flavon kulit kacang tanah memiliki potensi moderat dengan nilai IC50
34 µg/mL.
SUMMARY
AIKA LATIFAH ALAWIYAH. Total Phenol Content and Flavone Bioactivity of Peanut Hulls as Antioxidant and Antiproliferation toward HeLa Cancer Cells. Supervised by SUMINAR SETIATI ACHMADI and GUSTINI SYAHBIRIN.
Peanut hulls are mostly wasted or used as animal feed. Total phenol content of a substance correlates with antioxidant capacity, so that the total phenol content can affect the bioactivity. Therefore, this study aimed to determine the total phenolic content and antioxidant activity as well as evaluating the flavones isolated from the peanut shell as an anti-proliferation of HeLa cancer cells.
The extraction was done by refluxing the ground sample in ethanol and further fractionated. Ethyl acetate fraction obtained through the technique of liquid-liquid extraction of the ethanol extract was further separated by gravity column chromatography to obtain flavones. The total phenol content of the ethanol extract and the ethyl acetate fraction was determined using Folin-Ciocalteau method, giving 262 and 532 mg/g extract, respectively. The antioxidant activity of both extracts was evaluated using 2,2-diphenylpicrylhydrazyl (DPPH) radical scavenging method, giving IC50 of 32 and
19 µg/mL, respectively.
The flavone isolate was further identified by ultraviolet-visible spectrophotometer, resulting absorption bands at 342, 297.5, and 220 nm. The mass spectrum of the isolate based on liquid chromatography-mass spectrometry techniques revealing fragment of the m/z 271 peak. However, the spectra indicate that the fraction containing apigenin is not completely pure. Inhibition toward proliferation of HeLa cancer cells was evaluated for the flavones using 3-(4,5– dimethyl tyazol-2-yl)-2,5-diphenyltetrazolium bromide (MTT) reaction method. The results showed that the flavone has moderate potency in inhibiting the proliferation of HeLa cancer cells with IC50 value of 34 µg/mL.
© Hak Cipta Milik IPB, Tahun 2016
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
KADAR FENOL TOTAL DAN BIOAKTIVITAS FLAVON DARI
KULIT KACANG TANAH SEBAGAI ANTIOKSIDAN DAN
ANTIPROLIFERASI TERHADAP SEL KANKER HELA
AIKA LATIFAH ALAWIYAH
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Kimia
SEKOLAH PASCASARJANA INSTITUTE PERTANIAN BOGOR
rahmat dan karunia-Nya sehingga karya ilmiah ini dapat terselesaikan. Tema penelitian ini adalah Kadar Fenol Total dan Bioaktivitas Flavon dari Kulit Kacang Tanah sebagai Antioksidan dan Antiproliferasi terhadap Sel Kanker HeLa yang diselesaikan sejak bulan November 2015 sampai Juli 2016.
Penulis mengucapkan terima kasih kepada Ibu Prof Ir Suminar Setiati Achmadi, PhD selaku Ketua Komisi Pembimbing dan Ibu Dr Dra Gustini Syahbirin, MS selaku Anggota Komisi Pembimbing, atas segala waktu, arahan, bimbingan, serta motivasi yang diberikan kepada penulis, Dr dr Irma H Suparto selaku Penguji Luar Komisi yang telah memberikan banyak saran untuk perbaikan karya ilmiah ini, terima kasih kepada bapak Sabur, semua rekan peneliti di Laboratorium Kimia Organik, serta rekan-rekan mahasiswa Program Studi S-2 Kimia yang telah banyak membantu dalam menyelesaikan penelitian ini. Ungkapan terima kasih juga disampaikan kepada ayah, ibu, suami, saudara-saudariku dan teman-teman atas doa, dukungan dan kasih sayangnya.
Semoga karya ilmiah ini bermanfaat
Bogor, Oktober 2016
PENDAHULUAN
Latar Belakang
Kacang tanah adalah tumbuhan palawija terbesar setelah kacang kedelai. Produksinya tersebar luas di setiap daerah Indonesia. Daerah Jawa Timur, Jawa Tengah, dan Jawa Barat menjadi pusat produksi utama kacang tanah. Berdasarkan data statistik Tanaman Pangan dan Holtikultura tahun 2010-2014, Sukabumi sebagai penghasil terbesar ketiga di Provinsi Jawa Barat setelah Garut dan Cianjur (Dinas Pertanian Tanaman Pangan 2014). Mayoritas masyarakat memanfaatkan tanaman kacang tanah bagian bijinya saja, sedangkan kulit luarnya hanya sebagai bahan pakan ternak atau limbah. Faktanya, berbagai manfaat dapat dihasilkan dari limbah kulit luar kacang tanah karena keberadaan senyawa golongan fenol seperti eriodiktiol (Qiu et al. 2012), polifenol (Zhang et al. 2013), 5.7-dihidroksikromon, dan luteolin (Sheng et al. 2014). Dari kajian peneliti terdahulu diketahui bahwa senyawa fenolik ini bersifat farmakologi, yaitu sebagai antibakteri (Zhang et al. 2013), antiinflamasi (Haryoto et al. 2010), dan aktivitas larvasidal (Velu et al. 2015). Bioaktivitas antioksidan telah diketahui dari senyawa 5.7-dihidroksikromon, eriodiktiol, dan luteolin dengan kadar masing-masing 0.59, 0.92, dan 2.36 mg/g dalam ekstrak metanol. Selain itu, pada konsentrasi 500 µg/mL ekstrak metanol kulit luar kacang tanah mampu menginhibisi peroksidase pada sistem asam linoleat hingga 80 % (Win et al. 2011). Kapasitas antioksidan sejalan dengan kadar senyawa pada suatu bahan. Hasil penelitian Husni et al. (2014) pada rumput laut membuktikan bahwa kadar total senyawa fenol berkorelasi positif dengan kapasitas antioksidannya. Kadar fenol total yang tinggi menunjukkan aktivitas antioksidan yang tinggi dan dapat secara efektif menghambat pertumbuhan sel kanker (Vuong et al. 2014).
Kanker serviks menjadi permasalahan serius bagi wanita. Kanker ini merupakan penyakit mematikan kedua setelah kanker payudara yang terjadi pada wanita. Pada tahun 2012, wanita yang mengidap kanker serviks mencapai 84% dari kasus baru yang terjadi di seluruh dunia (WHO 2016). Telah banyak ditemukan beberapa pengobatan secara medis untuk mengatasi permasalahan kanker ini. Salah satu senyawa fenolik, yaitu flavon, diidentifikasi berpotensi sebagai antioksidan maupun antikanker. Apigenin termasuk ke dalam golongan flavon yang diketahui potensinya sebagai antioksidan. Gao et al. (2012) telah mengidentifikasi apigenin dalam fraksi etil asetat dari Cajanus cajan dan aktivitasnya sebagai antioksidan yang kuat dengan nilai IC50 μ .
Apigenin juga mampu menghambat proses oksidasi asam linoleat (Liu et al. 2012). Potensi sebagai antioksidan dari flavon menyebabkan senyawa ini juga berperan dalam menghambat tumbuhnya sel kanker seperti sel kanker paru-paru (MRC-5), payudara (MCF7), usus besar (HT-29), dan serviks (HeLa) masing-masing dengan nilai IC50 sebesar dan μ
antiproliferasi isolat golongan flavon dari kulit luar kacang tanah secara in vitro
pada sel HeLa.
Tujuan Penelitian
Penelitian ini diharapkan memperoleh kadar fenol total tinggi, sehingga dapat berpengaruh besar pada aktivitas antioksidan dan antiproliferasi isolat golongan flavon dari kulit luar kacang tanah secara in vitro pada sel kanker HeLa.
Manfaat Penelitian
Hasil kajian ini diharapkan dapat berkontribusi dalam mengembangkan kulit kacang tanah sebagai antioksidan dan antikanker pada pengobatan secara herbal.
BAHAN DAN METODE
Alat dan Bahan
Sampel yang digunakan adalah kulit luar kacang tanah yang diperoleh dari Kabupaten Sukabumi. Sampel dibersihkan dan dikeringkan dengan cara diangin-anginkan untuk menghindari rusaknya senyawa yang terdapat pada sampel tersebut (Haryoto et al. 2010). Bahan uji dijadikan serbuk berukuran 0.18 mm (Hamadou et al. 2014). Bahan-bahan lainnya yang diperlukan ialah reagen Folin-Ciocalteau, standar asam galat, reagen 2,2-difenilpikrilhidrazil (DPPH), sel Vero (ATCC CCL 81), sel HeLa (ATCC CCL 2), medium Dulbecco’s Modified Eagle
Medium (DMEM), 3-(4,5–dimetil tiazol-2-il)-2,5-difeniltetrazolium bromida (MTT) (Sigma), fetal bovin serum (FBS), dimetil sulfoksida (DMSO), dan Doksorubisin.
Alat analitis yang digunakan ialah 3 perangkat ekstraksi (soklet, ultrasonikator, dan refluks) sebagai tahap awal untuk proses pemisahan senyawa target (Lampiran 1), seperangkat alat kromatografi, microplate 96-well,
microplate mixer, ELISA microplate reader (BIO RAD i-Mark 11421), inkubator CO2 (Thermo Forma), spektrofotometer ultraviolet-tampak (UV-Vis) HITACHI
UV/Vis Spectrophotometer U2800, dan kromatografi cair-spektrometer massa (LC-MS) merek Waters Acquity.
Waktu dan Tempat
3
Penentuan Kadar Air
Cawan porselen dikeringkan terlebih dahulu selama 30 menit di dalam oven pada suhu 105 °C, kemudian didinginkan dalam eksikator dan ditimbang hingga mendapatkan bobot konstan dari cawan. Sebanyak 1 g serbuk sampel diletakkan ke dalam cawan dan dipanaskan pada suhu 105 °C selama 3 jam di dalam oven. Cawan yang berisi sampel didinginkan kembali dalam eksikator selama 30 menit, kemudian ditimbang, dilakukan beberapa kali pengulangan hingga diperoleh bobot konstan. Nilai kadar air sampel dihitung berdasarkan rumus:
Keterangan:
A = Bobot cawan kosong
B = Bobot cawan + sampel sebelum pengeringan dalam oven C = Bobot cawan + sampel setelah pengeringan dalam oven
Uji Kualitatif Golongan Fenol dan Flavonoid (Harborne 1987)
Uji fitokimia untuk fenol dan flavonoid secara kualitatif dilakukan pada serbuk kulit kacang tanah dan ekstrak kasar. Sebanyak 1 g sampel uji dilarutkan dalam 10 mL air sambil dikocok selama 1 menit, kemudian ditambahkan 2 tetes HCl 1 N. Lapisan air pada proses tersebut diambil 2 mL dan ditambahkan FeCl3.
Keberadaan senyawa golongan fenol ditandai dengan timbulnya warna ungu, biru tua, atau hitam kehijauan. Uji spesifik dari senyawa flavonoid dilakukan juga untuk sampel uji. Sebanyak 1 g sampel ditambah 10 mL air panas dan dididihkan selama 5 menit, disaring, dan diuji filtratnya. Ke dalam filtrat ditambahkan 0.5 g serbuk Mg, 1 mL HCl pekat, dan 1 mL amil alkohol, kemudian dikocok secara kuat. Keberadaan flavonoid ditunjukkan dengan warna merah/kuning/jingga pada lapisan amil alkohol.
Ekstraksi Flavon (Qiu et al. 2012), (Fidrianny et al. 2014), (Velu et al. 2015)
Serbuk kulit kacang tanah (20 g) diekstraksi terlebih dahulu dengan menggunakan 3 cara ekstraksi (soksletasi, ultrasonikasi, dan refluks) untuk memperoleh metode ekstraksi terbaik dengan pelarut etanol 96% masing-masing 250 mL. Metode ekstraksi refluks digunakan sebagai metode ekstraksi terbaik berdasarkan kandungan kadar fenol yang terdapat dalam ekstrak kasar kulit kacang tanah. Serbuk kulit kacang tanah (900 g) diekstraksi menggunakan metode ekstraksi terpilih (refluks) selama 210 menit, kemudian disaring dan filtratnya dievaporasi menggunakan evaporator putar di bawah vakum pada suhu 35 ºC, sehingga diperoleh ekstrak etanol kental. Rendemen ekstrak dihitung berdasarkan rumus:
Rendemen ekstrak =
-heksana dan etanol. Fraksi etanol selanjutnya dihidrolisis menggunakan HCl 2N selama 3 jam pada suhu 100 C, kemudian disaring sehingga diperoleh filtrat hasil hidrolisis. Fraksi yang telah terhidrolisis kemudian difraksionasi menggunakan etil asetat 4500 mL, selanjutnya diuji kadar fenol total dan aktivitas antioksidannya.
Penentuan Kadar Fenol Total Menggunakan Metode Folin-Ciocalteau (Farmakope Herbal Indonesia 2011)
Ekstrak kental dari hasil ekstraksi menggunakan soksletasi, ultrasonikasi, dan refluks ditentukan kadar senyawa fenol totalnya. Dari setiap ekstrak diambil 10 mg untuk dilarutkan ke dalam 50 mL metanol p.a. Setiap sampel uji (1 mL) ditambahkan 5 mL reagen Folin-Ciocalteau. Setelah diinkubasi selama 8 menit pada suhu ruang, ke dalam larutan ditambahkan NaOH 1% sebanyak 4 mL, kemudian diinkubasi kembali selama 1 jam. Absorbansnya diukur pada panjang gelombang 730 nm menggunakan spektrofotometer UV-Vis. Larutan asam galat dengan beragam konsentrasi digunakan sebagai standar. Ekstrak etanol dari metode ekstraksi terbaik dan fraksi etil asetat juga ditentukan kadar fenol total dengan metode yang sama.
Uji Aktivitas Antioksidan (Hussain et al. 2012)
Ekstrak kasar dan fraksi etil asetat dibuat dalam berbagai ragam konsentrasi (10-150 µg/mL) dan asam askorbat dijadikan sebagai kontrol positif. Larutan uji (2 ml) ditambahkan 10 mL reagen DPPH. Larutan blanko disiapkan dengan melarutkan DPPH dalam etanol tanpa tambahan larutan uji. Campuran dikocok kuat, setelah itu diinkubasi selama 30 menit pada suhu ruang dan diukur absorbansnya pada panjang gelombang 517 nm.
Nilai serapan larutan DPPH sebelum dan sesudah penambahan sampel dihitung sebagai persen inhibisi (% inhibisi) dengan rumus sebagai berikut:
% inhibisi = Keterangan:
Akontrol = Absorbans tidak mengandung sampel
Asampel = Absorbans sampel
Selain itu, kapasitas antioksidan dari sampel ditentukan berdasarkan perhitungan nilai IC50.
Isolasi Flavon (Kang et al. 2010)
Eluen terbaik dipilih terlebih dahulu untuk mengisolasi senyawa flavon menggunakan kromatografi lapis tipis (KLT). Pelat KLT yang digunakan adalah jenis silika G60F254. Fraksi etil asetat ditotolkan pada pelat KLT, setelah
5
(DCM):metanol. Hasil elusi dari KLT diamati di bawah lampu UV pada panjang gelombang 254 dan 366 nm untuk memvisualkan pola noda yang dihasilkan.
Fraksi etil asetat (4.13 g) diimpregnasi ke dalam 12.39 g silika gel hingga semua sampel terserap dalam silika. Fraksionasi dilakukan menggunakan kromatografi kolom gravitasi yang dielusi secara gradien mulai dari n-heksana, n -heksana:DCM, DCM, DCM:metanol, dan metanol. Fraksi dari kolom kromatografi yang diperoleh kemudian diidentifikasi kandungan senyawa flavonnya menggunakan KLT, spektrofotometer UV-Vis, dan LC-MS, selanjutnya diujikan bioaktivitasnya sebagai antioksidan dan antiproliferasi pada sel kanker HeLa.
Uji Aktivitas Antiproliferasi Flavon pada Sel HeLa (Radji et al. 2010)
Isolat flavon diujikan terlebih dahulu pada sel Vero untuk menentukan ragam konsentrasi yang diperlukan dalam uji sel kanker. Ragam konsentrasi yang aman pada pengujian terhadap sel Vero kemudian dipilih untuk diujikan pada sel kanker HeLa. Larutan uji diencerkan menjadi sederet konsentrasi yang telah ditentukan dengan menggunakan pelarut DMSO.
Pada penelitian ini, konsentrasi tertinggi yang digunakan sebesar 200 µg/mL dan konsentrasi terendah sebesar 12.5 µg/mL dengan angka kelipatan seri konsentrasi 2. Ragam konsentrasi diambil yang tidak merusak sel Vero. Sel Vero dan sel HeLa ditumbuhkan terlebih dahulu dalam medium pertumbuhan sel. Media tumbuh untuk sel Vero dan sel HeLa adalah DMEM dengan tambahan masing-masing 10% FBS dan 1% penisilin-streptomisin.
Sebanyak μ suspensi sel dala ediu di asukkan ke dala pelat yang terdiri atas 96 sumur, kemudian diinkubasi selama 24 jam dalam inkubator CO2 dengan konsentrasi 5% pada suhu 37 C. Ekstrak etanol, fraksi etil asetat,
dan isolat flavon dilarutkan dengan pelarut DMSO dalam berbagai ragam konsentrasi yang telah ditentukan sebelumnya, kemudian dimasukkan μ ke dalam sel yang telah disiapkan. Selanjutnya pelat diinkubasi dalam inkubator CO2
5% selama 48 jam pada suhu 37 oC. Selain itu dibuat suatu larutan kontrol pembanding, yaitu media DMEM tanpa larutan uji dan Doksorubisin sebagai kontrol positif. Setelah diinkubasi 48 jam, media di setiap sumur dalam pelat dikeluarkan. Reagen MTT ditambahkan sebanyak 10 µL/sumur, kemudian diinkubasi kembali selama 4 jam hingga terbentuk formazanberwarna ungu pada sel hidup. Larutan SDS 1% ditambahkan pada setiap sumur dan didiamkan selama 24 jam pada suhu kamar. Absorbans diukur dengan menggunakan spektrofotometer ELISA reader pada panjang gelombang 595 nm.
Penghambatan pertumbuhan sel kanker dihitung menurut rumus berikut: Persentase inhibisi =
Nilai IC50 ditentukan dengan menggunakan persamaan regresi linear yang
HASIL DAN PEMBAHASAN
Identitas Botani dan Simplisia
Bagian kulit luar kacang tanah yang dijadikan sebagai objek utama dalam penelitian ini diidentifikasi di Herbarium Bogoriens, Bidang Botani Pusat Penelitian Biologi-LIPI Bogor. Spesimen dinyatakan termasuk ke dalam keluarga
Leguminosae, spesies Arachis hypogaea L.
Kandungan Fenol dan Flavonoid
Kandungan senyawa pada kulit kacang tanah didominasi oleh golongan fenol, yaitu flavonoid yang ditandai dengan warna kuning hingga hijau kehitaman (Gambar 1). Hal ini terjadi karena penambahan FeCl3 yang mengakibatkan
terbentuknya kompleks Fe3+ polifenol. Kompleks senyawa tersebut hasil dari pasangan elektron yang didonorkan oleh atom oksigen pada polifenol terhadap Fe3+ yang memiliki orbital d kosong dengan membentuk ikatan kovalen koordinat.
A B
Gambar 1 Hasil uji fitokimia fenol pada serbuk (A) dan ekstrak etanol (B)
Uji fitokimia untuk flavonoid juga dilakukan terhadap serbuk dan ekstrak. Hasil uji menunjukkan bahwa serbuk dan ekstrak etanol mengandung flavonoid yang ditandai dengan warna kuning pada lapisan amil alkohol (Gambar 2). Identifikasi keberadaan flavonoid adalah setelah pemutusan ikatan glikosida oleh serbuk Mg dan HCl pekat. Flavonoid yang terbebas ikatan dengan gula kemudian ditarik oleh amil alkohol, sehingga amil alkohol menjadi berwarna kuning yang mengindikasikan terbentuknya garam flavilium (Marlinda et al. 2012).
A B
7
Berdasarkan uji fitokimia fenol dan flavonoid pada serbuk dan ekstrak sampel, intensitas warna hijau kehitaman dan kuning mengindikasikan bahwa kulit kacang tanah mengandung senyawa golongan fenol, khususnya flavonoid. Selain itu alkaloid, triterpenoid, steroid juga ditemukan dalam kulit kacang tanah, tetapi dengan kadar yang sedikit dibandingkan dengan senyawa fenol (Velu et al. 2015).
Ekstrak Flavon
Senyawa golongan flavon dapat diekstraksi dengan berbagai metode ekstraksi seperti maserasi, soksletasi, refluks, dan ultrasonikasi. Pada penelitian ini dilakukan ekstraksi pendahuluan menggunakan 3 jenis ekstraksi, yaitu soksletasi, refluks, dan ultrasonikasi dengan pelarut etanol untuk menentukan metode ekstraksi terbaik pada tahap selanjutnya. Metode ekstraksi non-konvensional lebih efisien dalam mengekstraksi senyawa flavonoid dan rendemen yang dihasilkan lebih banyak (Zeidan et al. 2014).
Berdasarkan ekstraksi pendahuluan menggunakan 3 metode, rendemen ekstrak etanol melalui refluks lebih tinggi di antara 2 metode lainnya (Tabel 1). Pengaruh suhu dan waktu ekstraksi pada refluks menentukan keefektifan ekstraksi flavon dari serbuk sampel. Sama halnya seperti metode refluks, soksletasi menggunakan indikator suhu tetapi hanya menghasilkan rendemen kasar setengah dari cara refluks meskipun waktu ekstraksi 2 kali lipat lebih lama karena kontak langsung yang minimum antara pelarut dengan sampel. Cara ultrasonikasi ternyata kurang efisien dalam mengekstraksi flavon dari matriks simplisia. Walaupun metode ini menggunakan bantuan gelombang ultrasonik dalam memecahkan dinding sel dari suatu matriks simplisia, tetapi diperlukan waktu ekstraksi dan suhu yang optimum agar diperoleh rendemen ekstrak yang lebih tinggi. Rendemen ini digunakan sebagai salah satu faktor dalam pemilihan metode ekstraksi terbaik. Ekstraksi simplisia dari 900 g yang menggunakan metode terpilih (refluks) menghasilkan rendemen 5.56 % dengan bobot ekstrak 44.7 gram (Lampiran 2).
menunjukkan bahwa metode refluks menghasilkan rendemen ekstrak lebih tinggi, yakni 9.6%. Dari penelitian sebelumnya dilaporkan bahwa maserasi kulit kacang tanah hanya menghasilkan rendemen 0.01% ekstrak kasar (Haryoto et al. 2010). Berbagai parameter harus dikendalikan dalam metode refluks ini seperti faktor suhu, waktu ekstraksi, pelarut, dan nisbah pelarut:sampel. Pada penelitian ini serbuk direfluks pada suhu 70 C selama 210 menit. Proses ekstraksi dengan suhu di bawah 80 C bertujuan meminimumkan degradasi senyawa flavonoid (Ghasemzadeh 2014).
Ekstrak yang dihasilkan dari metode refluks kemudian difraksionasi secara bertingkat menggunakan corong pisah yang bertujuan memisahkan senyawa berdasarkan kelarutannya dengan tingkat kepolaran yang berbeda. Ekstrak difraksionasi terlebih dahulu menggunakan n-heksana 2700 mL untuk memperoleh senyawa yang bersifat nonpolar seperti lipid/lemak. Sari hasil fraksionasi ini diperoleh rendemen fraksi n-heksana dan etanol masing-masing sebesar 2.40 dan 37.60 g. Fraksi bebas lemak (33.60 g) selanjutnya difraksionasi menggunakan etil asetat yang sebelumnya dihidrolisis dahulu menggunakan HCl 2 N. Hidrolisis ini dimaksudkan untuk memutuskan ikatan glikosida dari senyawa agar mendapatkan aglikon. Pada umumnya senyawa flavonoid pada tanaman tersedia dalam bentuk flavonoid glikosida, sehingga diperlukan hidrolisis asam untuk memperoleh flavonoid aglikon (Irianti et al. 2015). Rendemen fraksi etil asetat lebih tinggi dibandingkan fraksi etanol (Tabel 2). Hal ini mengindikasikan bahwa senyawa flavon aglikon banyak terekstraksi pada pelarut etil asetat.
Tabel 2 Rendemen ekstrak hasil fraksionasi
Fraksi Massa
Fraksi etil asetat 17.97 44.90
Kadar Fenol Total
9
ion fenolat yang mereduksi asam heteropoli menjadi kompleks molibdenum-tungsten.
Kadar fenol total dari kulit kacang tanah ditetapkan pada 3 ekstrak dari cara refluks, soksletasi, dan ultrasonikasi sebagai langkah pendahuluan untuk penentuan metode ekstraksi terbaik. Kadar fenol ini juga ditetapkan pada ekstrak etanol hasil dari metode terbaik (refluks) dan fraksi etil asetat. Asam galat digunakan sebagai standar yang tergolong ke dalam asam fenol sederhana turunan dari asam hidroksibenzoat. Berdasarkan absorbans yang dihasilkan, kurva standar dibuat untuk digunakan dalam penentuan kadar fenol total dari sampel uji (Lampiran 3).
Pada kurva standar asam galat diperoleh persamaan y=0.0056x-0.0249 dengan tingkat keakuratan dan ketelitian yang baik berdasarkan nilai R yang dihasilkan mendekati 1. Persamaan tersebut digunakan dalam menentukan konsentrasi dari sampel uji dengan menggunakan data absorbans.
Kadar fenol total tertinggi diperoleh dari metode ekstraksi menggunakan refluks (Tabel 3). Metode refluks ini beberapa kali lipat lebih efektif dalam mengekstraksi senyawa seperti fenol dan flavonoid karena perlakuan panas dapat membebaskan dan mengaktifkan bobot molekul rendah dari subunit molekul polimer dengan bobot molekul tinggi (Hatam et al. 2013). Kadar fenol total dari 900 g simplisia adalah 262.30 mg GAE/g ekstrak. Kadar fenol dari peneliti sebelumnya dengan sampel yang sama dan dengan cara refluks adalah 69.10 mg GAE/g ekstrak (Fidrianny et al. 2014), sedangkan menggunakan metode ultrasonikasi dan maserasi oven mikrogelombang biasa masing-masing adalah 5.94 mg GAE /g (Hussain et al. 2011) dan 7.79 mg GAE/g ekstrak (Mulyadi et al. 2014). Kadar fenol dari ekstrak etanol kasar yang dihasilkan pada penelitian ini sangat nyata berbeda dengan penelitian-penelitian sebelumnya. Hal ini dapat disebabkan oleh faktor tempat tumbuh, yakni pengaruh perbedaan suhu, kondisi tanah, curah hujan, kelembapan, dan intensitas cahaya (Susanti et al. 2012). Berbagai faktor tersebut menyebabkan konstituen kimia pada tumbuhan menjadi beragam (Rohaeti et al. 2011).
Tabel 3 Kadar fenol total dari ekstrak hasil peragaman metode ekstraksi
Metode ekstraksi
Ultrasonikasi 37.32 3.73 1.60b
a
(Fidrianny et al. 2014)
b
(Zhang et al. 2013)
fenol total (Auliawan 2014). Gambar 3 berikut memperlihatkan reaksi hidrolisis asam dalam memutuskan fenol glikosida:
Gambar 3 Reaksi pemutusan ikatan fenol glikosida menggunakan hidrolisis asam
Tabel 4 Kadar fenol total ekstrak etanol dan fraksi etil asetat
Sampel uji Fenol total (mg GAE/g ekstrak)
Kadar fenol total kulit kacang tanah
(%)
Ekstrak etanol 262.30 26.2
Fraksi etil asetat 531.90 53.2
Aktivitas Antioksidan
Kadar fenol total dalam sampel dapat berkaitan dengan bioaktivitasnya sebagai antioksidan. Ekstrak etanol dan fraksi etil asetat memiliki potensi tinggi dalam menangkap radikal DPPH. Metode DPPH dipilih sebagai metode untuk mengevaluasi aktivitas antioksidan karena lebih cepat, mudah, terpercaya, dan tidak memerlukan pereaksi atau alat khusus dalam pengukurannya. DPPH merupakan radikal yang stabil dan tidak mudah hancur dalam air, metanol, atau etanol. Delokalisasi dari radikal ini menimbulkan warna ungu tua ditandai dengan pita serapan di daerah 520 nm dalam larutan etanol. Ketika DPPH bereaksi dengan senyawa antioksidan, maka radikal DPPH menghasilkan bentuk yang tereduksi ditandai dengan warna ungu tua yang berubah menjadi kuning berdasarkan reaksi pada Gambar 4.
Gambar 4 Reaksi DPPH dengan senyawa antioksidan (Molyneux 2004)
11
dengan ekstrak kasar yang masih banyak bercampur komponen pengganggu bioaktivitas senyawa seperti lemak dan lilin (Hernani et al. 2007). Flavon, flavanol, dan flavonol lebih banyak tertarik oleh pelarut etil asetat karena sifat kepolarannya yang kurang polar. Senyawa ini memiliki sejumlah gugus hidroksil yang mampu menyediakan hidrogen yang bertanggung jawab dalam menangkap radikal DPPH (Zhou et al. 2011, Wen et al. 2014). Persamaan regresi diperoleh dari hubungan antara persentase penangkapan radikal dan konsentrasi bahan uji (Lampiran 4), selanjutnya digunakan untuk menentukan konsentrasi 50% penangkapan radikal (IC50) dari bahan uji dengan tingkat keakuratan dan
ketelitian yang baik berdasarkan nilai R mendekati 1.
Pada penelitian ini, ekstrak etanol memiliki kapasitas antioksidan yang kuat dengan nilai IC50 36.36 µg/mL. Hussain et al. (2011) telah melaporkan bahwa
kapasitas antioksidan dari esktrak etanol kulit kacang tanah sebesar 38.90 µg/mL. Dapat dikatakan bahwa kapasitas antioksidan pada penelitian ini sedikit lebih besar dibandingkan dengan sebelumnya. Setelah pemurnian menggunakan etil asetat aktivitas antioksidan menjadi lebih tinggi dengan nilai IC50 18.68 µg/mL.
Berbagai faktor mempengaruhi kapasitas antioksidan dari suatu bahan uji seperti kandungan senyawa fenol dan kadar total senyawa. Senyawa fenol dan polifenol sebagian besar tersebar pada berbagai jenis tanaman. Telah ditemukan bahwa senyawa fenol memiliki aktivitas antioksidan berdasarkan sifat gugus hidroksil yang terdapat pada fenol mampu menangkap radikal. Senyawa fenol ini melepaskan atom hidrogen dari gugus hidroksil untuk diikat oleh radikal dan menghasilkan radikal fenoksil yang sifatnya stabil (Aksoy et al. 2013).
Faktor lainnya ialah efek dari hidrolisis asam pada ekstrak yang menghasilkan senyawa aglikon pada fraksi etil asetat. Kapasitas antioksidan senyawa aglikon lebih tinggi dibandingkan dengan bentuk glikosidanya karena gula yang terikat pada gugus hidroksil dapat mengganggu penangkapan radikal, sehingga menurunkan efisiensi aktivitasnya (Irianti et al. 2015). Aktivitas antioksidan dari kulit ari dan biji kacang tanah telah dilaporkan dalam penelitian Gaafar et al. (2015) dengan menggunakan berbagai metode uji, di antaranya penangkapan radikal DPPH, pengkelat ion Fe, reaksi reduksi, dan uji ABTS• . Berdasarkan uji DPPH, ekstrak aseton mempunyai aktivitas antioksidan dengan kategori kuat pada nilai IC50 ≤ I 50≤ ( dan )
Sementara itu, kapasitas antioksidan untuk isolat flavon tidak jauh berbeda dengan fraksi etil asetat yang memiliki nilai IC50 19.66 µg/mL. Ekstrak etanol
Tabel 5 Korelasi antara kadar fenol total dan kapasitas antioksidan Kapasitas antioksidan sampel Kadar fenol total
Ekstrak etanol -1.000**
Fraksi etil asetat -1.000**
**korelasi signifikan pada level 0.01
Isolat Flavon
Fraksi etil asetat yang terhidrolisis dimurnikan untuk mendapatkan flavon. Fraksi ini dipilih berdasarkan sifat kepolaran dari flavon yang kurang polar sehingga dapat terlarut dalam eter, kloroform, atau etil asetat (Markham 1988). Senyawa flavon yang banyak terekstraksi oleh etil asetat merupakan indikasi untuk kapasitas antioksidan sehingga fraksi etil asetat cenderung memiliki aktivitas antioksidan yang lebih kuat dibandingkan dengan fraksi lainnya (Choudhary et al. 2015). Eluen terbaik untuk mendapatkan flavon ialah campuran DCM:metanol.
Fraksionasi menggunakan kromatografi kolom gravitasi dari fraksi etil asetat menghasilkan 589 vial. Setelah digabungkan berdasarkan kesamaan pola noda pada pelat KLT (DCM:metanol 29:2 sebagai pengembang) diperoleh 14 subfraksi (Lampiran 6). Berdasarkan profil KLT (Gambar 5), subfraksi L memiliki jumlah noda sedikit, jelas, dan rendemen tinggi (24.9 %) dibandingkan dengan subfraksi lainnya. Warna noda berupa biru pendar dengan nilai Rf = 0.33 dan kuning dengan nilai Rf = 0.23 diamati di bawah sinar UV pada panjang gelombang 254 dan 366 nm.
254 nm 366 nm
Gambar 5 Profil KLT 14 subfraksi
Analisis menggunakan KLT dengan eluen forestal (HCl pekat:HOAc:H2O)
13
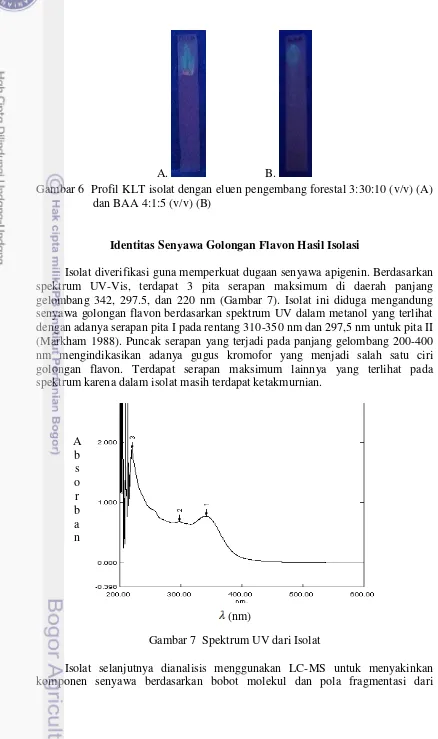
A. B.
Gambar 6 Profil KLT isolat dengan eluen pengembang forestal 3:30:10 (v/v) (A) dan BAA 4:1:5 (v/v) (B)
Identitas Senyawa Golongan Flavon Hasil Isolasi
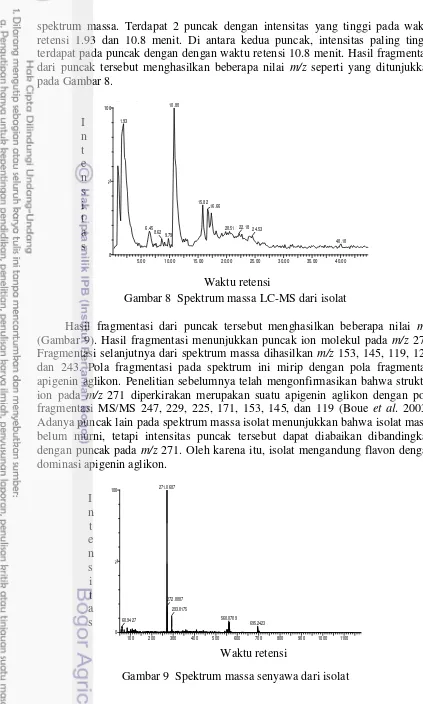
Isolat diverifikasi guna memperkuat dugaan senyawa apigenin. Berdasarkan spektrum UV-Vis, terdapat 3 pita serapan maksimum di daerah panjang gelombang 342, 297.5, dan 220 nm (Gambar 7). Isolat ini diduga mengandung senyawa golongan flavon berdasarkan spektrum UV dalam metanol yang terlihat dengan adanya serapan pita I pada rentang 310-350 nm dan 297,5 nm untuk pita II (Markham 1988). Puncak serapan yang terjadi pada panjang gelombang 200-400 nm mengindikasikan adanya gugus kromofor yang menjadi salah satu ciri golongan flavon. Terdapat serapan maksimum lainnya yang terlihat pada spektrum karena dalam isolat masih terdapat ketakmurnian.
Gambar 7 Spektrum UV dari Isolat
Isolat selanjutnya dianalisis menggunakan LC-MS untuk menyakinkan komponen senyawa berdasarkan bobot molekul dan pola fragmentasi dari
A b s o r b a n
spektrum massa. Terdapat 2 puncak dengan intensitas yang tinggi pada waktu retensi 1.93 dan 10.8 menit. Di antara kedua puncak, intensitas paling tinggi terdapat pada puncak dengan dengan waktu retensi 10.8 menit. Hasil fragmentasi dari puncak tersebut menghasilkan beberapa nilai m/z seperti yang ditunjukkan pada Gambar 8.
5.00 10.00 15.00 20.00 25.00 30.00 35.00 40.00
%
Gambar 8 Spektrum massa LC-MS dari isolat
Hasil fragmentasi dari puncak tersebut menghasilkan beberapa nilai m/z
(Gambar 9). Hasil fragmentasi menunjukkan puncak ion molekul pada m/z 271. Fragmentasi selanjutnya dari spektrum massa dihasilkan m/z 153, 145, 119, 121, dan 243. Pola fragmentasi pada spektrum ini mirip dengan pola fragmentasi apigenin aglikon. Penelitian sebelumnya telah mengonfirmasikan bahwa struktur ion pada m/z 271 diperkirakan merupakan suatu apigenin aglikon dengan pola fragmentasi MS/MS 247, 229, 225, 171, 153, 145, dan 119 (Boue et al. 2003). Adanya puncak lain pada spektrum massa isolat menunjukkan bahwa isolat masih belum murni, tetapi intensitas puncak tersebut dapat diabaikan dibandingkan dengan puncak pada m/z 271. Oleh karena itu, isolat mengandung flavon dengan dominasi apigenin aglikon.
100 200 300 400 500 600 700 800 900 1000 1100
%
0 100
Fraksi L_160524_3 65 (10.799) 1: Sca 271.0687
15
Aktivitas Antiproliferasi Flavon terhadap Sel HeLa
Senyawa fenolik seperti flavon berperan penting sebagai penghambat pertumbuhan berbagai sel kanker seperti kanker servix (HeLa), payudara (MCF7), usus (HT-29), dan paru-paru (MRC-5) (Beara et al., 2012). Pada penelitian ini diuji aktivitas antiproliferasi dari isolat flavon dari kulit kacang tanah terhadap sel kanker HeLa. Suatu bahan uji dapat dikatakan sebagai penghambat proliferasi sel kanker jika memiliki sifat toksisitas tinggi terhadap sel tersebut. Namun, sitotoksisitas bahan uji terhadap sel kanker harus mempertimbangkan efek samping terhadap sel normal dalam tubuh. Jika nilai IC50 > 100 µg/mL, maka
bahan uji dikatakan aman bagi tubuh karena efek sitotoksik pada sel Vero dimulai dari konsentrasi tersebut (Budi et al. 2000). Oleh karena itu, uji toksisitas dari bahan uji (ekstrak kasar, fraksi etil asetat, dan isolat flavon) dilakukan terlebih dahulu pada sel Vero guna menentukan batas konsentrasi yang aman terhadap sel Vero. Ragam konsentrasi yang digunakan adalah 200, 150, 100, 50, 25, dan 12.5 µg/mL. Hasil uji toksisitas pada sel Vero dari ketiga bahan uji memperlihatkan kemampuan penghambatan berbeda (Lampiran 7). Ketiga sampel bersifat toksik terhadap sel Vero pada konsentrasi lebih dari 150 µg/mL masing-masing dengan kematian untuk ketiga sampel adalah 50.6, 49.9, dan 64.2% dengan nilai IC50
masing-masing 253.8, 161.02, dan 152.83 µg/mL. Konsentrasi bahan uji di atas 150 µg/mL telah mampu mematikan sel normal yang mengakibatkan kerusakan membran, sehingga biru tripan akan berikatan dengan protein dalam sel yang mengindikasikan sel mati ditandai adanya tampak biru berdasarkan pengamatan secara mikroskopik (Nurani 2012). Oleh karena itu konsentrasi ≤ 150 µg/mL aman digunakan pada sel Vero meskipun memiliki sitotoksik terhadap sel kanker HeLa. Gambar 10 berikut ini merupakan pengamatan sitotoksik bahan uji pada sel Vero secara mikroskopik.
A. B. C.
Gambar 10 Sel Vero sebelum penambahan isolat flavon (A), penambahan isolat pada konsentrasi < 200 µg/mL ( ) dan konsentrasi ≥ µg/mL (C)
Ekstrak etanol, fraksi etil asetat, dan isolat diujikan pada sel kanker HeLa dengan ragam konsentrasi yan sa a ≤ 150 µg/mL. Hasil uji menghasilkan nilai persentase penghambatan dan nilai IC50 yang berbeda, masing-masing 79.5,
73.74, 34.11 µg/mL (Lampiran 8). Berdasarkan National Cancer Institute (NCI) Amerika, nilai 30 < IC50 <100 dapat dikatakan bahan uji memiliki sitotoksisitas
ekstrak kasar dan fraksi etil asetat. Isolat didominasi oleh kandungan apigenin yang telah teridentifikasi sebelumnya menggunakan instrumen LC-MS. Persentase penghambatan dari isolat pada sel HeLa mencapai 82% pada 150 µg/mL. Dosis ini setara dengan pemberian Doxorubicin pada konsentrasi 0.5 µg/mL (Tabel 8). Doxorubicin dijadikan sebagai kontrol positif karena memiliki sitotoksik yang kuat terhadap sel HeLa dengan IC50 0.374 µM. Persentase
penghambatan Doxorubicin pada sel HeLa dapat mencapai 83% setelah 72 jam inkubasi pada dosis tertentu (Aliabadi et al. 2010). Gambar 11 menunjukkan perbedaan penghambatan proliferasi ketiga bahan uji pada konsentrasi 75 µg/mL secara pengamatan mikroskopik terhadap sel kanker HeLa; isolat pada penelitian ini lebih mampu menghambat proliferasi sel tersebut ditandai dengan banyak sel-sel yang mengalami apoptosis.
A. B. C.
Gambar 11 Penghambatan proliferasi bahan uji ekstrak etanol (A), fraksi etil asetat (B), dan isolat (C) terhadap sel kanker HeLa pada konsentrasi 150 µg/mL.
Bioaktivitasnya sebagai agen penghambat pertumbuhan sel kanker berhubungan dengan keberadan senyawa aktif dalam bahan uji. Sampel kulit kacang tanah banyak mengandung senyawa golongan fenol yang diduga selain memiliki peran penting sebagai antioksidan, juga sebagai antiproliferasi pada sel kanker. Ekstrak tanaman yang mengandung senyawa golongan flavonoid telah diujikan sifat sitotoksiknya terhadap beberapa sel kanker secara in vitro, seperti sel HeLa, MCF7, HT-29 dan MRC-5. Dari hasil penelitian (Beara et al. 2012), ekstrak sangat sensitif toksisitasnya terhadap sel HeLa dan MCF7 masing-masing pada dosis 443.90 dan 179.27 µg/mL. Apigenin yang dominan pada isolat ini memiliki daya hambat proliferasi sel kanker HeLa yang kuat seperti halnya senyawa krisin dan luteolin. Bigovic et al. (2011)menemukan ekstrak bunga
Helichrysum plicatum yang mengandung apigenin aglikon dan berpotensi kuat dalam melawan sel kanker HeLa di antara sel kanker lainnya dengan nilai IC50
42.1 µg/mL.
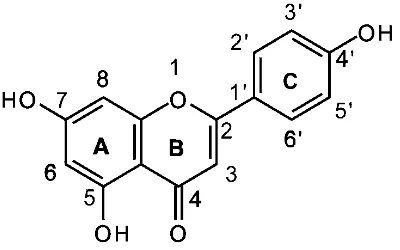
17
Gambar 12 Struktur apigenin
Senyawa flavon (seperti apigenin, luteolin, dan kuersetin) memiliki toksisitas yang lebih besar dibandingkan dengan senyawa flavanon (seperti taxifolin, naringenin, dan eriodiktiol) yang hanya memiliki ikatan tunggal pada C2-C3 berdasarkan perbedaan nilai EC50. Kehadiran gugus fungsi lainnya seperti
gugus karbonil pada C4 memengaruhi tingginya sitotoksisitas. Flavonoid yang memiliki gugus karbonil pada C4 memiliki efek sitotoksik yang lebih besar pada waktu inkubasi 24 dan 48 jam dibandingkan dengan senyawa tanpa gugus karbonil di C4. Apigenin tidak memiliki gugus hidroksil di C3 seperti luteolin dan eriodiktiol, tetapi hal ini justru meningkatakn sitotoksisitasnya hingga 2-10 kali dibandingkan dengan senyawa yang memiliki gugus hidroksil di C3 (Plochmann
et al. 2007).
Apigenin memiliki potensi yang kuat dalam mencegah pertumbuhan sel kanker serviks (HeLa) dengan pencapaian nilai IC50 35.89 µM. Proses
penghambatan proliferasi ini dapat melalui berbagai jalur apoptosis sel, di antaranya melalui proses menahan siklus sel yang menyebabkan pertumbuhan sel kanker, modulasi pada jalur p53, dan pengaturan yang dilakukan oleh Bcl-2. Ketiga jalur penghambatan proliferasi ini mengarah pada apoptosis kematian sel HeLa. Gen penekan tumor p53 dianggap sebagai faktor utama dalam menjaga keseimbangan antara pertumbuhan dan kematian sel serta memberikan peranan penting dalam menghambat pertumbuhan tumor hingga menginduksi apoptosis sel (Zheng et al. 2005).
SIMPULAN DAN SARAN
Kulit kacang tanah memiliki kadar fenol total yang tinggi dengan nilai kadar pada ekstrak etanol 262.30 mg GAE/g dan 531.90 mg GAE/g pada fraksi etil asetat. Terdapat korelasi positif antara kadar fenol total dan kapasitas antioksidan berdasarkan analisis korelasi Pearson (p < 0.01, r = -1). Kadar fenol total pada fraksi etil asetat lebih tinggi dibandingkan dengan ekstrak etanol, sehingga kapasitas antioksidan fraksi etil asetat lebih besar dengan nilai IC50 18.68 µg/mL
34.11 µg/mL. Berdasarkan penelitian ini teruji bahwa limbah kulit kacang tanah dijadikan sebagai obat herbal yang bermanfaat bagi kesehatan.
Isolat dari kulit kacang pada penelitian ini belum menghasilkan senyawa tunggal, sehingga perlu dimurnikan lebih lanjut menggunakan metode pemisahan seperti kromatografi lapis tipis preparatif. Selain itu diperlukan pengujian terhadap berbagai sel kanker sebelum bahan uji ini dapat dinyatakan sebagai obat kanker.
DAFTAR PUSTAKA
[WHO] World Health Organization. 2016. Human papillomavirus (HPV) and cervical cancer [internet]. [diunduh pada 2016 Oktober 30]. Tersedia pada: http://www.who.int/mediacentre/factsheets/fs380/en.
Abidin L, Mujeeb M, Mir SR, Khan SA, Ahmad A. 2014. Comparative assessment of extraction methods and quantitative estimation of luteolin in the leaves of Vitex negundo Linn. by HPLC. Asian Pacific Journal of Tropical Medicine. 7:5289-5293.doi:10.1016/S1995-7645(14)60248-0. Aksoy L, Kolay E, Agilonu Y, Aslan Z, Kargioglu M. 2013. Free radical
scavenging activity, total phenolic content, total antioxidant status, and total oxidant status of endemic Thermopsis turcica. Saudi Journal of Biological Sciences. 20(2013):235–239.doi:10.1016/j.sjbs.2013.02.003.
Aliabadi HS, Minaiyan M, Dabestan A. 2010. Cytotoxic evaluation of doxorubicin in combination with simvastatin against human cancer cells.
Research in Pharmaceutical Sciences. 5(2):127-133.
Auliawan R dan Cahyono B. 2014. Efek hidrolisis ekstrak daun iler (Coleus scutellarioides) terhadap aktivitas inhibisi enzim α-glukosidase. Jurnal Sains dan Matematika. 22(1):15-19.
Beara IN, Lesjak MM, Orcic DZ, Simin ND, Cetojevic DD, Bozin BN, Mimica NM. 2012. Comparative analysis of phenolic profile, antioxidant, anti-inflammatory and cytotoxic activity of two closely-related Plantain species:Plantago altissima L. and Plantago lanceolata L. LWT-Food Science and Technology. 47(2012):64-70.doi:10.1016/j.lwt.2012.01.001.
Bigovic D, Savikin K, Jankovic T, Menkovic N, Zdunic G, Stanojkovic T, Djuric Z. 2011. Antiradical and cytotoxic activity of different Helichrysum plicatum
flower extracts. Natural Product Communication. 6(6):819-822.
Boue SM, Wientjes CHC, Shih BY, Cleveland TE. 2003. Identification of flavone aglycones and glycosides in soybean pods by liquid chromatography–tandem mass spectrometry. Journal of Chromatography. 991(2003):61– 68.doi:10.1016 / S0021-9673(03)00209-7.
Budi DS, Baskara AANN, Putra PP, Faiqoh Z, Solikhah EN. 2013. Saat parasit membasmi parasit: uji efektivitas ekstrak benalu sebagai terapi malaria baru. Universitas Gadjah Mada. 1-7.
19
Dinas Pertanian Tanaman Pangan. (2014). Produksi Kacang Tanah Menurut Kabupaten dan Kota Tahun 2010 - 2014 di Jawa Barat. Jawa Barat: Dinas Pertanian Tanaman Pangan.
Farmakope Herbal Indonesia. 2011. Penetapan Kadar Fenol Total Cara Folin Ciocalteu. Jakarta (ID): Penerbit Departemen Kesehatan Republik Indonesia. Fidrianny I, Puspitasari N, Singgih M. 2014. Antioxidant activities, total flavonoid, phenolic, carotenoid of various hells extracts from four species of legumes. Asian Journal of Pharmaceutical and Clinical Research. 7(4):42-46.
Gaafar AA, Mahmoud KM, Salama ZA. 2015. Antioxidant potential activity and cytotoxicity effects of different parts of peanuts (Arachis hypogaea L.).
International Journal of Pharma and Bio Sciences. 6(3):19-32.
Gao Y, Zhao J, Zu Y, Fu Y, Liang L, Luo M, Wang W, Efferth T. 2012. Antioxidant properties, superoxide dismutase and glutathione reductase activities in HepG2 cells with a fungal endophyte producing apigenin from pigeon pea [Cajanus cajan(L.) Millsp.]. Food Research International. 49(2012):147–152.doi:10.1016/j.foodres.2012.08.001.
Ghasemzadeh A dan Jaafar HZE. 2014. Optimization of reflux conditions for total flavonoid and total phenolic extraction and enhanced antioxidant capacity in pandan (Pandanus amaryllifolius Roxb.) Using Response Surface Methodology. Hindawi.1-10.doi:10.1155/2014/523120.
Hamadou AH, Xu Y, Jiang Q, Xia W, Siddeeg A. 2014. Evaluation of antioxidant efficacy of ethanolic and methanolic extracts from peanut hulls in silver carp oil during accelerated oxidation. International Journal of Nutrition and Food Sciences. 3(2):104-110.doi: 10.11648/j.ijnfs.20140302.23.
Harborne JB. 1987. Metode Fitokimia, Penuntun Cara Modern Menganalisis Tumbuhan. Kosasih P, Iwang SJ, penerjemah. Bandung (ID): ITB.
Haryoto, Yuliati KS, Wahyuningtyas N. 2010. Efek antiinflamasi ekstrak etanol kulit kacang tanah (Arachis hypogaea L) pada tikus putih jantan galur wistar yang diinduksi karagenin. Pharmacon. 11(1):7-11.
Hatam SF, Suryanto E, Abidjulu J. 2013. Aktivitas antioksidan dari ekstrak kulit nanas (Ananas comosus (L) Merr). Pharmacon. 2(1):1-11.
Hernani, Marwati T, Winarti C. 2007. Pemilihan pelarut pada pemurnian ekstrak lengkuas (Alpinia galanga) secara ekstraksi. Jurnal Pascapanen. 4(1):1-8. Husni A, Putra DR, Lelana IYB. 2014. Aktivitas antioksidan Padina sp. pada
berbagai suhu dan lama pengeringan. Jurnal Pengolahan dan Bioteknologi Perikanan. 9(2):165-173.
Hussain AI, Chatha SAS, Noor S, Arshad MU, Khan ZA, Rathore HA, Sattar MZA. 2011. Effect of extraction techniques and solvent systems on the extraction of antioxidant components from peanut (Arachis hypogaea l.) hulls. Food Analytical Method. 1-8.doi:10.1007/s12161-011-9325-y.
Irianti T, Puspitasari A, Machwiyyah L, Rabbani HR. 2015. The activity of radical scavenging of 2,2-diphenyl-1-pycrilhydrazil (DPPH) by ethanolic extracts of mengkudu leaves (Morinda citrifolia l.), brotowali stem (Tinospora crispa l.), its water fraction and its hydrolized fraction.
Traditional Medicine Journal. 20(3):140-148.
NF-κ and M PKs activation pathways in HM -1 cells. Molecules. 15:385-398.doi:10.3390/molecules15010385.
Liu B, Yang J, Zhu X, Lv G. 2012. Improvement of the antioxidant activity of apigenin in linoleic acid system by o-prenylation. Journal of Medicinal Plants Research. 6(2):181-186.doi:10.5897/JMPR11.053.
Markham, KR. 1988. Cara Mengidentifikasi Flavonoid. Padmawinata K, penerjemah; Niksolihin S, editor. Bandung (ID): Penerbit ITB. Terjemahan dari: Techniques of Flavonoid Identification.
Marlinda M, Sangi MS, Wuntu AD. 2012. Analisis senyawa metabolit sekunder dan uji toksisitas ekstrak etanol biji buah alpukat (Persea americana Mill.).
Jurnal MIPA UNSRAT. 1(1):24-28.
Molyneux, Philip. 2004. The use of the stable free radical diphenylpicryl-hydrazyl (DPPH) for estimating antioxidant activity. Songklanakarin Journal Science Technology. 26(2):211-219.
Mulyadi T, Diharja RC, Indraswati N, Ayucitra A. 2012. Ekstraksi senyawa fenolik dari limbah kulit kacang tanah sebagai antioksidan alami menggunakan metode domestic microwave maceration. Seminar Nasional Teknik Kimia Soebardjo Brotohardjono IX [Internet]. [diunduh 2015 Okt 26];1-6. Tersedia pada:http://eprints.upnjatim.ac.id/4114/1/B5.pdf.
Nurani, LH. 2012. Uji sitotoksitas dan antiproliferatif sel kanker payudara t47d dan sel vero biji Nigella sativa,L. Jurnal Ilmiah Kefarmasian. 2(1):17-29 Plochmann K, Korte G, Koutsilieri E, Richling E, Riederer P, Rethwilm A,
Schreier P, Scheller C. 2007. Structure–activity relationships of Flavonoid-induced cytotoxicity on human leukemia cells. Archives of Biochemistry and Biophysics 460(2007):1–9.doi:10.1016/j.abb.2007.02.003.
Qiu J, Chen L, Zhu Q, Wang D, Wang W, Sun Xin, Liu X, Du F. 2012. Screening natural antioxidants in peanut shell using DPPH–HPLC–DAD–TOF/MS methods. Food Chemistry. 135(2012):2366-2371.doi: 10.1016/j.foodchem.2012.07.042.
Radji M, Aldrat H, Harahap Y, Irawan C. 2010. Uji sitotoksisitas buah merah, mahkota dewa dan temu putih terhadap sel kanker serviks. Jurnal Farmasi Indonesia. 5(1):41-47.
Rohaeti E, Heryanto R, Rafi M, Wahyuningrum A, Darusman LK. 2011. Prediksi kadar flavonoid total tempuyung (Sonchus arvensis L) menggunakan kombinasi spektroskopi IR dengan regresi kuadrat terkecil parsial. Jurnal Kimia. 5(2):101-108.
Sak, K. 2014. Cytotoxicity of dietary flavonoids on different human cancer types.
Pharmacognosy. 8(16):122-146.doi:10.4103/0973‑7847.134247.
Sheng S, Zhang L, Chen G. 2014. Determination of 5,7-dihydroxychromone and luteolin in peanut hulls by capillary electrophoresis with a multiwall carbon nanotube/poly (ethylene terephthalate) composite electrode. Food Chemistry.
145(2014):555-561.doi:org/10.1016/j.foodchem.2013.08.118.
Susanti H, Alfian R. 2012. Determination of total phenolic content of methanolic extracts red rosell (Hibiscus sabdariffalinn) calyxs in variation of growing area by spectrophotometry. Jurnal Ilmiah Kefarmasian. 2(1):73 -80.
21
Mosquito Research. 2(1):01-08.
Vuong QV, Sadeqzadeh E, Hirun S, Goldsmith CD, Zammitt N, Bowyer MC, Sakoff JA, Thorne RF, Weidenhofer J, Scarlett CJ. 2014. Phenolic compounds, antioxidant and anti-cancer properties of the australian maroon bush Scaevola spinescens (Goodeniaceae). Bioanalysis & Biomedicine. S12: 1-7.doi:10.4172/1948-593X.S12-002.
Wen L, Wu D, Jiang Y, Prasad KN, Lin S, Jiang G, He J, Zhao M, Luo W, Yang B. 2014. Identification of flavonoids in litchi (Litchi chinensis Sonn.) leaf and evaluation of anticancer activities. Journal of Functional Foods.
6(2014): 555–563.doi:10.1016/j.jff.2013.11.022.
Win MM, Hamid AA, Baharin BS, Anwar F, Sabu MC, Pakdek MS. 2011. Phenolic co pounds and antio idant activity of peanut’s skin hull raw kernel and roasted kernel flour. 43(3): 1635-1642.
Zeidan S, Hijazi A, Rammal H, Kobaissi A, Badran B. 2014. Extraction of phenolic compounds and flavonoids from eryngiumcreticum L. by conventional and non-conventional extraction techniques. World Journal of Pharmacy and Pharmaceutical Sciences. 3(7):1889-1898.
Zhang G, Hu M, He L, Fu P, Wang L, Zhou J. 2013. Optimization of microwave-assisted enzymatic extraction of polyphenols from waste peanut shells and evaluation of its antioxidant and antibacterial activities in vitro. Food and Bioproducts Processing. 91(2013):158-168. doi.org/10.1016/j.fbp.2012.0.
Zheng PW, Chiang LC, Lin CC. 2005. Apigenin induced apoptosis through p53-dependent pathway in human cervical carcinoma cells. Life Sciences. 76(2005):1367–1379.doi:10.1016/j.lfs.2004.08.023.
Zhou K, Wang H, Mei W, Li X, Luo Y, Dai H. 2011. Antioxidant activity of
papaya seed extracts. Molecules.
23
Lampiran 1 Diagram Alir Metode Penelitian
Serbuk kulit luar kacang tanah
Residu Ekstrak etanol
Fraksi n-heksana Fraksi etanol
Fraksi etanol Fraksi etil asetat
Diekstraksi dengan
Dipartisi n-heksana
Dihidrolisis oleh HCl Partisi etil asetat
Ekstraksi berbantu
Ultrasonikasi Sokletasi Refluks
Metode estraksi terbaik berdasarkan kadar fenol total
Ekstraksi sampel dengan etanol 96%, uji fitokimia, uji kadar fenolik total
Dievaporasi
Dievaporasi Dievaporasi
Fraksionat etil asetat Fraksionat etanol
Fraksionat n-heksana
Uji fitokimia, kadar fenolik total, antioksidan
Fraksionat mengandung flavon
Pemisahan menggunakan kromatografi kolom gravitasi KLT (eluen BAA dan Forestal)
Uji antioksidan
Uji antiproliferasi terhadap sel Vero dan HeLa
Analisis menggunakan Spektrofotometer UV-Vis,
LC-MS
Lampiran 2 Rendemen ekstrak
Rendemen ekstrak hasil metode terpilih (refluks)
25
Lampiran 3 Data penentuan kadar fenol total pada ekstrak dari 3 metode
Hasil absorbans standar asam galat
Konsentrasi Asam galat
Absorbans sampel kulit kacang tanah dari 3 metode ekstraksi
Pengenceran Ekstrak berdasarkan
Absorbans sampel kulit kacang tanah dari metode ekstraksi terpilih (refluks)
Pengenceran Absorbans (pengulangan) Absorbans rata-rata
Lanjutan Lampiran 3
Kadar ekuivalen asam galat untuk ekstrak dari metode terpilih (Refluks)
y : menunjukkan absorbansi
x : menunjukkan konsentrasi sampel
y = 0,0056 x – 0,0249
µg GAE/mL
Kadar fenol total dari ekstrak dengan metode ekstraksi terpilih :
= 262300
27
Lampiran 4 Antioksidan ekstrak etanol, fraksi etil asetat, dan isolat flavon
Aktivitas penangkapan radikal DPPH bahan uji
Konsentrasi sampel (µg/mL)
Penangkapan radikal (%) Konsentrasi Asam
Penangkapan radikal (%) Konsentrasi Asam
Kurva hubungan konsentrasi dan persentase penangkapan radikal DPPH oleh ekstrak etanol, fraksi etil asetat, dan isolat flavon
a. Kurva hubungan konsentrasi dan persentase inhibisi ekstrak etanol
Lanjutan lampiran 4
b. Kurva hubungan konsentrasi dan persentase inhibisi dan fraksi etil asetat
c. Kurva hubungan konsentrasi dan persentase inhibisi dan isolat flavon
Nilai IC50 dari ekstrak etanol, fraksi etil asetat, dan isolat
29
Kurva hubungan konsentrasi dan persentase penangkapan radikal DPPH oleh standar asam askorbat
Nilai IC50 dari asam askorbat
Lampiran 5 Hasil analisis korelasi Pearson antara kadar fenol total dan aktivitas antioksidan
Correlations
VAR00001 VAR00002 VAR00001 Pearson
Correlation 1 -1,000
**
Sig. (2-tailed) .
N 2 2
VAR00002 Pearson
Correlation -1,000
**
1
Sig. (2-tailed) .
N 2 2
**. Correlation is significant at the 0.01 level (2-tailed). Keterangan:
31
Lampiran 6 Hasil analisis KLT 14 subfraksi
Subfraksi Rf Warna noda di bawah lampu UV 366
Lampiran 7 Hasil uji sampel terhadap sel Vero
Data persentase penghambatan pertumbuhan sel Vero oleh ekstrak etanol, fraksi etil asetat, dan isolat flavon
Sampel Konsentrasi
Nilai IC50 penghambatan proliferasi sel Vero oleh sampel uji
A. Ekstrak etanol
-40,00 -20,00 0,00 20,00 40,00 60,00
Lampiran 8 Hasil uji sampel terhadap sel kanker HeLa
Data persentase penghambatan pertumbuhan sel kanker HeLa oleh ekstrak etanol, fraksi etil asetat, dan isolat
Sampel Konsentrasi
Nilai IC50 penghambatan proliferasi sel kanker HeLa oleh sampel uji
RIWAYAT HIDUP