PEMBERIAN PROBIOTIK
Saccharomyces cerevisiae
DAN
PREBIOTIK MANNAN OLIGOSAKARIDA UNTUK
PENGENDALIAN INFEKSI
Aeromonas hydrophila
PADA IKAN MAS
Cyprinus carpio
HAEZY SATRIANI CAHYA WIDYASTUTI
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa tesis berjudul Pemberian Probiotik
Saccharomyces cerevisiae dan Prebiotik Mannan Oligosakarida untuk
Pengendalian Infeksi Aeromonas hydrophila pada Ikan Mas Cyprinus carpio
adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Februari 2016
Haezy Satriani Cahya Widyastuti
RINGKASAN
HAEZY SATRIANI CAHYA WIDYASTUTI. Pemberian Probiotik
Saccharomyces cerevisiae dan Prebiotik Mannan Oligosakarida untuk Pengendalian Infeksi Aeromonas hydrophila pada Ikan Mas Cyprinus carpio.
Dibimbing oleh WIDANARNI dan DEDI JUSADI.
Aeromonas hydrophila merupakan bakteri penyebab penyakit motile aeromonad septicaemia (MAS) yang menyerang berbagai ikan budidaya air tawar, termasuk ikan mas C. carpio, menyebabkan terjadinya kematian yang tinggi hingga mencapai 90%. Beberapa strategi alternatif yang aman untuk pengendalian penyakit bakterial diantaranya adalah probiotik, prebiotik, dan sinbiotik. Manipulasi respons imun organisme akuatik dan kinerja pertumbuhan dapat diberikan melalui pakan. Pada beberapa penelitian, pakan yang mengandung imunostimulan dapat meningkatkan kerja sistem imun non spesifik pada ikan. Penelitian ini bertujuan untuk mengevaluasi pengaruh pemberian probiotik
S. cerevisiae, prebiotik mannan oligosakarida, dan gabungan keduanya (sinbiotik) melalui pakan terhadap imunitas dan kinerja pertumbuhan ikan mas yang diuji tantang A. hydrophila.
Desain eksperimen yang digunakan pada penelitian ini adalah rancangan acak lengkap yang terdiri atas lima perlakuan dengan tiga ulangan. Pada pengujian in vivo, ikan mas (6,24±0,02 g), dipelihara di akuarium (40 x 30 x 30 cm3; volume 40 L), dengan kepadatan 10 ekor per akuarium. Ikan uji diberi pakan secara at satiation dengan frekuensi tiga kali sehari, yakni pada pukul 08.00 WIB, 12.00 WIB, dan 16.00 WIB selama masa pemeliharaan. Ikan diberi perlakuan pakan tanpa suplementasi yakni kontrol positif (K+) dan kontrol negatif (K-), pakan perlakuan probiotik S. cerevisiae 0,2% (Pro), prebiotik MOS 0,2% (Pre), dan gabungan probiotik 0,2% dan prebiotik 0,2% (Sin). Uji tantang bakteri
A. hydrophila dilakukan pada hari ke-33, melalui injeksi intramuscular (IM) dengan dosis 10-7 CFU mL-1. Kematian ikan diamati setiap hari selama 10 hari. Pengambilan data parameter imunitas dan kepadatan bakteri patogen di organ hati dan ginjal dilakukan pada hari ke-34, 37, dan 41. Variabel pengamatan kinerja pertumbuhan meliputi, bobot akhir (Wt), jumlah konsumsi pakan (JKP), Specific Growth Rate (SGR), Feed Convertion Ratio (FCR), kelangsungan hidup dan rasio panjang usus (RPU), dan total probiotik S. cerevisiae dan total bakteri di usus ikan mas. Respons imunitas yang diamati terdiri dari jumlah sel darah merah (eritrosit), sel darah putih (leukosit), hematokrit, hemoglobin, aktivitas fagositosis,
dengan kontrol. Total S. cerevisiae pada usus mengindikasikan bahwa probiotik yang diberikan mampu bertahan hidup pada saluran pencernaan inang dan melakukan fungsi-fungsinya.
Terjadi peningkatan parameter gambaran darah pada hari ke-30 sebelum uji tantang, yang meliputi eritrosit (Et), hemoglobin (Hb), hematokrit (Ht), leukosit (Lc), aktivitas fagositik (AF), dan respiratory burst (RB) pada perlakuan probiotik, prebiotik, dan sinbiotik dan menunjukkan hasil yang lebih tinggi dibandingkan dengan kontrol. Pasca uji tantang terjadi fluktuasi nilai parameter gambaran darah pada setiap perlakuan, untuk parameter SDM, Hb, dan Ht pada H-34 mengalami penurunan, dan mulai meningkat kembali pada hari ke-37 hingga hari ke-41, karena merupakan proses recovery. SDM, Hb, dan Ht pada perlakuan sinbiotik menunjukkan nilai yang lebih baik, diikuti dengan prebiotik dan probiotik dibandingkan dengan kontrol positif. Parameter SDP, aktivitas fagositik, dan respiratory burst, setelah dilakukan uji tantang mengalami peningkatan dimulai dari hari ke-34 hingga hari ke-37, dan turun pada hari ke 41. Perlakuan probiotik, prebiotik, dan sinbiotik menunjukkan nilai yang lebih tinggi dibandingkan dengan kontrol positif. Kelangsungan hidup ikan mas setelah diuji tantang oleh bakteri A. hydrophila pada perlakuan probiotik (50,00±0,0 %), prebiotik (56,67±5,7 %), dan sinbiotik (63,3±5,7 %), menunjukkan hasil yang lebih tinggi dibandingkan dengan kontrol positif (20,0±10%). Total bakteri
A. hydrophila pada organ hati dan ginjal dengan jumlah yang tinggi terdapat pada hari ke-34 hingga ke-37. Pada hari ke-34 dan ke-37 total bakteri A. hydrophila
perlakuan probiotik, prebiotik, dan sinbiotik pada kedua organ menunjukkan hasil yang lebih rendah dibandingkan dengan kontrol positif. Pada hari ke-41, terjadi penurunan total bakteri A. hydrophila pada organ target, perlakuan prebiotik dan sinbiotik pada organ hati menunjukkan hasil yang lebih rendah dibandingkan dengan perlakuan probiotik dan kontrol positif, sedangkan pada organ ginjal perlakuan sinbiotik menunjukkan total bakteri terendah dibandingkan dengan probiotik. Ini menunjukkan bahwa suplementasi probiotik, prebiotik, dan sinbiotik mampu meningkatkan ketahanan tubuh ikan mas terhadap infeksi A. hydrophila.
SUMMARY
HAEZY SATRIANI CAHYA WIDYASTUTI. Administration of probiotic
Sacharomyces cerevisiae and prebiotic mannan oligosaccharide to control
Aeromonas hydrophila infection in Cyprinus carpio. Supervised by WIDANARNI and DEDI JUSADI.
Aeromonas hydrophila is a bacteria that responssible for motile aeromonad septicaemia (MAS) disease that attacks numerous freshwater aquaculture fish, including common carp C. carpio and eventually causing in high rate of mortality up to 90%. Several alternatives strategies that safe to prevent and control bacterial diseases are currently developed and applied on aquaculture activities, among others are using probiotic, prebiotic, and synbiotic. Immune responsse and growth performance of aquatic organism can be manipulated through feed. In various studies, feeds with immunostimulant are capable of increasing performance of non-specific immune system on fish. This study therefore was carried out to evaluate the effect of probiotic S. cerevisiae, MOS, and synbiotic of both through feed on the immunity and growth performance of common carp challenged against A. hydrophila.
Experimental design used in this study was completely randomized design consisted of five treatments and three replications. For in vivo test, carp (6.24±0.02 g), reared in aquariums (40 x 30 x 30 cm3; volume 40 L), with stocking density of 10 fishes each aquarium. During rearing period, fish fed on the diet three times a day at 08.00 am, 12.00 pm, and 04.00 pm (Western Indonesia Time). Fish were fed on commercial diet or either without any suplementation in control positif (K+), and control negative (K-), on suplemented with probiotic (0.2% S. cerevisiae), prebiotic ( 0.2% MOS), and synbiotic (0.2% S. cerevisiae + 0.2% MOS). Challenged test was on day 33 by injecting 0.1 mL pathogenic bacteria A. hydrophila at 107 CFU mL-1 by intramuscular (IM) injection. The death of fish were observed for 10 days. Data retrieval on immunity parameters and density of pathogenic bacteria in liver and kidney was carried out on day 34, 37, and 41. Observation variabels consist of growth ferformance, there were final body weight (Wt), feed intake (JKP) and specific growth rate (SGR), feed convertion ratio (FCR), survival rate (SR), intestinal length ratio (ILR), quantification of total intestinal bacteria and total probiotic S. cerevisiae in intestine. Immune responsse parameters observed in this study were erythrocytes, leukocytes, hematocrit, hemoglobin, phagocytic activity, respiratory burst, and quantificationtotalA. hydrophila inliver and kidney.
The result showed that the supplementation of feed containing probiotic
that probiotics S. cerevisiae that was given could survive in the digestive tract of the host.
An increase haematological parameter on day 30 before the challenge test, which include erythrocytes (Et), hemoglobin (Hb), hematocrit (Ht), leukocytes (Lc), phagocytic activity (AF), and the respiratory burst (RB) at treatment probiotic, prebiotic, and sinbiotic and showed a higher result compared to the control. Sinbiotic treatments showed higher result as compared with the treatment probiotic, prebiotic and positive control on each parameter of blood. Post-challenge test, the haematological parameter values fluctuated on each treatment, for the parameters erythrocyte, hemoglobin, and hematocrit in the H-34 decreased, and began to rise again on day 37 to day 41, indicated recovery process took place after infection on tested fish. Erythrocytes, hemoglobin, and hematocrit in synbiotic treatment showed a better value, followed by prebiotic and probiotic compared with the positive control. Leukocytes, phagocytic activity, and respiratory burst, after the challenge test had increased starting from day 34 to day 37, and decrease at day 41. Treatment probiotic, prebiotic, and synbiotic showed a higher value compared to the control positive. Survival rate of carps after challenged by A. hydropila in treatment probiotic (50.00 ± 0.0%), prebiotic (56.67 ± 5.7%), and sinbiotic (63.3 ± 5.7%), showed higher result compared with positive controls (20.0 ± 10%). Total bacteria A. hydrophila in the liver and kidneys with a high amount contained at day 34 until 37. On day 34th and 37th total bacteria A. hydrophila treatment probiotic, prebiotic, and synbiotic in both organs showed lower result than positive control. On day 41, there was a decrease in total bacteria A. hydrophila in liver and kidney, treatment prebiotic and synbiotic in the liver showed a lower result compared with the treatment probiotic and positive control. This suggests that supplementation probiotic, prebiotic, and synbiotic were able to increase the resistance of carp againts A. hydrophila.
© Hak Cipta Milik IPB, Tahun 2016
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Ilmu Akuakultur
PEMBERIAN PROBIOTIK
Saccharomyces cerevisiae
DAN
PREBIOTIK MANNAN OLIGOSAKARIDA UNTUK
PENGENDALIAN INFEKSI
Aeromonas hydrophila
PADA IKAN MAS
Cyprinus carpio
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2016
Judul Tesis : Pemberian Probiotik Saccharomyces cerevisiae dan Prebiotik Mannan Oligosakarida untuk Pengendalian Infeksi Aeromonas hydrophila pada Ikan Mas Cyprinus carpio
Nama : Haezy Satriani Cahya Widyastuti NIM : C151130241
Disetujui oleh Komisi Pembimbing
Dr. Ir. Widanarni, M.Si Ketua
Dr. Dedi Jusadi Anggota
Diketahui oleh
Ketua Program Studi Ilmu Akuakultur
Dr.Ir. Widanarni, M.Si
Dekan Sekolah Pascasarjana
Dr. Ir. Dahrul Syah, M.Sc Agr
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wata’ala atas segala karunia-Nya sehingga tesis ini berhasil diselesaikan. Penelitian dilaksanakan bulan Maret hingga Agustus 2015 dengan judul Pemberian Probiotik
Saccharomyces cerevisiae dan Prebiotik Mannan Oligosakarida untuk Pengendalian Infeksi Aeromonas hydrophila pada Ikan Mas Cyprinus carpio.
Penulis mengucapkan terima kasih kepada Dr. Ir. Widanarni, M.Si dan Dr. Dedi Jusadi selaku komisi pembimbing, atas bimbingan dan saran pada penyelesaian karya imiah ini, serta Dr. Dinar Tri Soelistyowati, DEA selaku dosen penguji luar komisi pada ujian tesis penulis. Selain itu, penghargaan penulis sampaikan kepada DIKTI yang telah memberikan Beasiswa Pendidikan Pascasarjana Dalam Negeri (BPPDN) tahun 2013 kepada penulis. Ungkapan terima kasih juga disampaikan kepada suami tercinta Yudhi Romansyah, S.IK, ayah, ibu, adik, dan ibu Rohmania serta seluruh keluarga atas segala doa, dukungan, dan kasih sayangnya. Penulis sampaikan pula terima kasih dan penghargaan kepada teman-teman Ilmu Akuakultur 2013, teman-teman Laboratorium Kesehatan Organisme Akuatik, serta adik-adik tingkat atas dukungan dan bantuannya selama penelitian. Semoga tesis ini bermanfaat.
Bogor, Februari 2016
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR GAMBAR vi
DAFTAR LAMPIRAN vi
1 PENDAHULUAN 1
Latar Belakang 1
Perumusan Masalah 1
Tujuan dan Manfaat Penelitian 2
Hipotesis 2
2 METODE 3
Waktu dan Tempat Penelitian 3
Rancangan Percobaan 3
Prosedur Penelitian 3
Variabel Pengamatan 4
Analisis Data 8
3 HASIL DAN PEMBAHASAN 8
4 SIMPULAN DAN SARAN 16
Simpulan 16
Saran 16
DAFTAR PUSTAKA 16
LAMPIRAN 20
DAFTAR TABEL
1 Desain eksperimen penelitian 3
2. Kinerja pertumbuhan pada ikan mas selama 30 hari pemeliharaan 8
DAFTAR GAMBAR
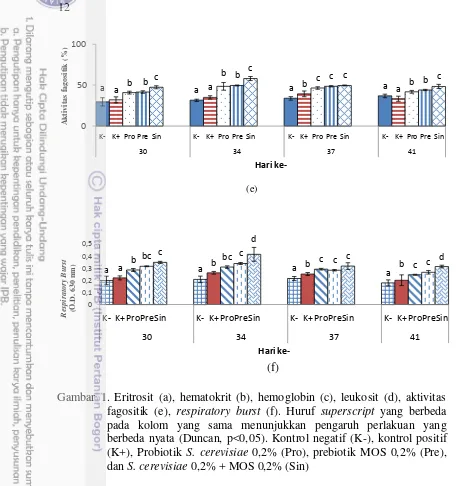
1 Eritrosit (a), hematokrit (b), hemoglobin (c), leukosit (d), aktivitas fagositik (e), respiratory burst (f). Huruf superscript yang berbeda pada kolom yang sama menunjukkan pengaruh perlakuan yang berbeda nyata (Duncan, p<0,05). Kontrol negatif (K-), kontrol positif (K+), Probiotik S. cerevisiae
0,2% (Pro), prebiotik MOS 0,2% (Pre), dan S. cerevisiae 0,2% + MOS
0,2% (Sin) 12
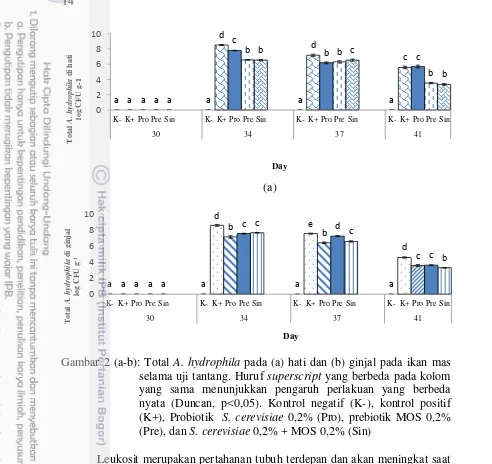
2 Total A. hydrophila pada (a) hati dan (b) ginjal pada ikan mas selama uji tantang. Huruf superscript yang berbeda pada kolom yang sama menunjukkan pengaruh perlakuan yang berbeda nyata (Duncan, p<0,05). Kontrol negatif (K-), kontrol positif (K+), Probiotik S. cerevisiae 0,2% (Pro), prebiotik MOS 0,2% (Pre), dan S. cerevisiae 0,2% + MOS 0,2%
(Sin) 14
3 Kelangsungan hidup ikan mas pasca uji tantang. Huruf superscript yang sama menunjukkan pengaruh perlakuan yang berbeda nyata (Duncan, p<0,05). Kontrol negatif (K-), kontrol positif (K+), probiotik S. cerevisiae 0,2% (Pro), prebiotik MOS 0,2% (Pre), dan S. cerevisiae 0,2% + MOS
0,2% (Sin) 15
DAFTAR LAMPIRAN
1 Pola kematian ikan mas pasca uji tantang 20
2 Kit API 20C AUX V4.0 pada pengujian S. cerevisiae 21 3 Gejala klinis ikan mas yang terserang A. hydrophila : dropsy (A), nekrosis
1
PENDAHULUAN
Latar Belakang
Aeromonas hydrophila merupakan bakteri penyebab penyakit motile aeromonad septicaemia (MAS) yang merugikan kegiatan budidaya. Infeksi bakteri A. hydrophila menyebabkan terjadinya pembengkakan jaringan, dropsy,
nekrosis, ulcer, perdarahan (hemorrhagic) sehingga menyebabkan terjadinya kematian yang tinggi hingga mencapai 90% (Azad et al. 2001). Infeksi MAS menyerang berbagai ikan budidaya air tawar, termasuk ikan mas Cyprinus carpio, ikan mas merupakan salah satu spesies ikan penting dalam akuakultur (Jeney et al. 2009).
Antibiotik biasanya digunakan untuk mengontrol penyakit bakterial secara cepat, termasuk penyakit MAS (Jeeva et al. 2013), tetapi penggunaan antibiotik memiliki kelemahan, yakni mengakibatkan residu dalam tubuh ikan dan resistensi bakteri sehingga penggunaannya dibatasi dalam akuakultur (Sakai 1999). Beberapa strategi alternatif yang aman untuk pencegahan dan pengendalian penyakit bakterial tengah dikembangkan dan diterapkan pada kegiatan budidaya, di antaranya adalah probiotik, prebiotik, dan sinbiotik (Nayak 2010). Manipulasi respons imun organisme akuatik dan kinerja pertumbuhan dapat diberikan melalui pakan. Pada beberapa penelitian, pakan yang mengandung imunostimulan dapat meningkatkan kerja sistem imun non spesifik pada ikan (Sakai 1999).
Probiotik adalah mikroorganisme hidup yang menguntungkan inang karena kemampuannya memproduksi senyawa inhibitor, bersaing untuk bahan kimia dan tempat pelekatan dengan bakteri patogen, merangsang fungsi kekebalan tubuh, menghasilkan atau merangsang senyawa enzimatik, dan meningkatkan keseimbangan mikrob (Balcazar et al. 2006). Probiotik yang
digunakan dalam penelitian ini adalah ragi Saccharomyces cerevisiae.
S. cerevisiae merupakan bio-produk alami, dinding selnya mengandung senyawa imunostimulan seperti (1-3)-β-D-glukan, (1-6)-β-D-glukan, (1-4)-α-(1→3)-β -D-glukan, mannoprotein kompleks, kitin dan organel sel nukleotida (Kwiatkowski
et al. 2009). Pemberian yeast dapat meningkatkan imunitas (Kwiatkowski et al.,
2009; Rodriguez et al. 2003; Pinpimai et al. 2015), dan dapat meningkatkan kinerja pertumbuhan (Lara-Flores et al. 2003; Tawwab et al. 2008). S. cerevisiae
merupakan produk yang mudah diperoleh, selalu tersedia, dan bersifat stabil (Rad et al. 2013).
2
aksi keduanya (Reid et al. 2003). Kombinasi S. cerevisia dan MOS (sinbiotik) pada ikan tilapia Oreochromis niloticus menunjukkan imunitas dan kinerja pertumbuhan yang lebih baik dibanding pemberian masing-masing
Sacharomyces cerevisia dan MOS secara tunggal (Elala et al. 2013). Akan tetapi pada penelitian Ai et al. (2011), suplementasi sinbiotik Bacillus subtilis dan FOS pada juvenil yellow croacker Larimichthys crocea tidak memberikan pengaruh yang berbeda terhadap kinerja pertumbuhan dan respons imun dibandingkan dengan dengan pemberian masing-masing B. subtilis dan FOS secara tunggal.
Perumusan Masalah
Aeromonas hydrophila merupakan bakteri penyebab penyakit motile aeromonad septicaemia (MAS) yang menyerang berbagai ikan budidaya air tawar, termasuk ikan mas. Beberapa strategi alternatif yang aman untuk pencegahan dan pengendalian penyakit bakterial tengah dikembangkan dan diterapkan pada kegiatan budidaya, di antaranya adalah probiotik, prebiotik, dan sinbiotik. Manipulasi respons imun organisme akuatik dan kinerja pertumbuhan dapat diberikan melalui pakan. Pakan yang mengandung imunostimulan diharapkan mampu meningkatkan kerja sistem imun non spesifik pada ikan. Penggunaan probiotik S. cerevisiae, prebiotik mannan-oligosakarida, dan gabungan keduanya (sinbiotik) melalui pakan diharapkan mampu memberikan efek positif terhadap imunitas dan kinerja pertumbuhan ikan mas yang diuji tantang A. hydrophila.
Tujuan dan Manfaat Penelitian
Penelitian ini bertujuan untuk mengevaluasi pengaruh pemberian
S. cerevisiae, mannan-oligosakarida, dan gabungan keduanya (sinbiotik) melalui pakan terhadap imunitas dan kinerja pertumbuhan ikan mas yang diuji tantang
A. hydrophila. Manfaat yang ingin dicapai dari penelitian ini adalah dengan pemberian probiotik, prebiotik dan sinbiotik diharapkan mampu meningkatkan imunitas dan kinerja pertumbuhan pertumbuhan ikan mas.
Hipotesis
3
2
METODE
Waktu dan Tempat Penelitian
Penelitian ini dilaksanakan pada bulan Maret 2015 hingga Agustus 2015 bertempat di Laboratorium Kesehatan Ikan, Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor.
Rancangan Percobaan
Penelitian ini dilakukan dengan metode eksperimen yang menggunakan rancangan acak lengkap dengan lima perlakuan (Tabel 1) dan tiga ulangan. Tabel 1. Desain eksperimen penelitian
Perlakuan Keterangan
Kontrol negatif (K-) Pemberian pakan basal tanpa penambahan bahan uji, serta diinjeksi dengan phosphate buffered saline (PBS)
Kontrol positif (K+) Pemberian pakan basal tanpa penambahan bahan uji, serta diinjeksi bakteri A. hydrophila
Probiotik (Pro)
Prebiotik (Pre)
Sinbiotik (Sin)
Pemberian pakan dengan penambahan probiotik S. cerevisiae 0,2%, serta diinjeksi bakteri A. hydrophila
Pemberian pakan dengan penambahan prebiotik MOS 0,2%, serta diinjeksi bakteri A. hydrophila
Pemberian pakan dengan penambahan probiotik S. cerevisiae 0,2% + prebiotik MOS 0,2%, serta diinjeksi bakteri A. hydrophila
Ikan mas yang digunakan adalah strain Majalaya, dengan bobot rata-rata 6,24±0,02 g, berasal dari pembudidaya di daerah Parung, Bogor. Sebelum digunakan ikan tersebut dilakukan aklimatisasi selama 2 minggu, kemudian disebar pada akuarium yang berdimensi 40 x 30 x 30 cm3 dan volume 40 L, dengan kepadatan 10 ekor masing-masing akuarium. Pada penelitian ini digunakan 6 akuarium untuk masing-masing perlakuan, 3 akuarium digunakan untuk pengamatan parameter kelangsungan hidup, dan 3 akuarium lainnya digunakan untuk pengambilan sampel darah untuk parameter imunitas. Ikan uji diberi pakan secara at satiation dengan frekuensi tiga kali sehari, yakni pada pukul 08.00 WIB, 12.00 WIB, dan 16.00 WIB selama masa pemeliharaan. Kondisi kualitas air dijaga dengan dilakukan penggantian air melalui teknik siphon sebanyak 50% setiap 2-3 hari sekali. Selama masa pemeliharaan, nilai kualitas air meliputi suhu air 28-31º C, pH 7,2-7,6, DO 4,5-6,4 mg/L, TAN 0,03-0,11 mg/L.
Prosedur Penelitian Persiapan pakan uji
4
viabilitas untuk mengetahui kepadatan ragi. Viabilitas ragi S. cerevisiae pada penelitian ini adalah 9,1±0,02 log CFU g-1. Prebiotik yang digunakan adalah manan oligosakarida komersial merk BIO-MOS® (Alltech) yang berasal dari dinding sel ragi S. cerevisiae. Sebelum digunakan, dilakukan uji kandungan β-glukan kuantitatif dari bahan uji S. cerevisiae dan MOS di laboratorium Vicomas Cibinong berdasarkan metode Hozova et al. (2007) dengan menggunakan alat spektrofotometer. Pada penelitian ini kandungan β-glukan kuantitatif dari S. cerevisiae sebesar 10,56% sedangkan untuk MOS sebesar 21,64%. Pakan yang diberikan adalah pellet apung komersial PF1000 (Prima Feed) dengan kadar protein 39%. Proses pembuatan pakan uji dilakukan dengan teknik coating. Empat jenis pakan uji dipersiapkan, yang terdiri dari pakan Pro ( S. cerevisiae 0,2%), Pre (MOS 0,2%), Sin (S. cerevisiae 0,2% + MOS 0,2%), dan pakan tanpa penambahan bahan uji untuk perlakuan kontrol negatif dan kontrol positif. Bahan pakan uji tersebut dicampurkan dengan menggunakan
binder putih telur sebanyak 2% (v/v) dan air sebagai pelarut 6% (v/w). Pakan yang telah dicampur kemudian dikeringkan dengan oven pada suhu 35º C.
Penyiapan Bakteri
Isolat bakteri patogen A. hydrophila yang digunakan berasal dari koleksi Instalasi Penelitian dan Pengembangan Pengendalian Penyakit Ikan (IPPPPI), Depok Indonesia. Bakteri A. hydrophila yang digunakan dikarakterisasi dengan menggunakan kit API 20E. Bakteri tersebut ditumbuhkan dalam medium TSA (Tripticase Soy Agar). Satu ose koloni bakteri diambil dan ditumbuhkan dalam medium TSB (Tripticase Soy Broth) dengan volume 5 mL, selanjutnya diinkubasi dalam waterbath shaker pada suhu 29º C dengan kecepatan 140 rpm selama 24 jam. Kepadatan A. hydrophila yang diperoleh sebesar 10-9 CFU mL-1. Stok bakteri tersebut kemudian dilakukan pengenceran berseri sebanyak dua kali untuk mendapatkan kepadatan 10-7 CFU mL-1 (dosis LD50) untuk uji tantang.
Uji Tantang
Ikan mas yang telah diberi perlakuan, pada hari ke-3 setelah 30 hari pemeliharaan dilakukan penyuntikan bakteri patogen A. hydrophila pada perlakuan kontrol positif, Pro, Pre, dan Sin dengan kepadatan 107 CFU mL-1 sebanyak 0,1 mL secara intramuscular (IM), kematian ikan diamati selama 10 hari. Pengambilan data parameter imunitas dan kepadatan bakteri patogen di organ hati dan ginjal dilakukan pada hari ke-34, 37, dan 41.
Variabel Pengamatan Kinerja Pertumbuhan
Kinerja pertumbuhan ikan mas yang diberi paka uji dengan perlakuan Pro, Pre, dan Sin dievaluasi melalui kinerja pertumbuhan, yang di amati meliputi Bobot akhir (Wt), Jumlah Konsumsi Pakan (JKP), Specific Growth Ratio (SGR),
5
Total probiotik S. cerevisiae dan total bakteri di usus ikan mas
Sebanyak 0,1 g usus ikan uji di ambil dari masing-masing perlakuan, kemudian digerus dan dihomogenkan dengan 0,9 mL Phospate Buffered Saline
(PBS) steril dan dilakukan pengenceran berseri, selanjutnya disebar pada medium Glucose Yeast Agar (GYA) + Chlorampenicol 50 µg/mL untuk total probiotik S. cerevisiae dan untuk total bakteri usus disebar pada TSA. Total probiotik dan total bakteri di usus dihitung pada hari ke-30.
Respons Imun pada Ikan Mas Pengambilan Sampel Darah
Dua ekor ikan dari setiap akuarium perlakuan diambil darahnya dan digabungkan (pull) dijadikan satu ulangan, sebelumnya ikan-ikan tersebut dibius terlebih dahulu dengan Ocean free special arowana stabilizer sebanyak 0,6 ppm, darah diambil dari bagian pembuluh caudal. Syringe dan tabung Eppendorf dibilas dengan Na-sitrat 3,8 % untuk mencegah koagulasi darah. Pengambilan dan penyimpanan darah ke dalam tabung dilakukan dengan hati-hati untuk mengurangi risiko kerusakan sel darah.
Total Eritrosit
6
Darah dalam pipet dihomogenkan selama 3-5 menit sehingga darah tercampur rata. Dua tetes pertama larutan darah dalam pipet tersebut dibuang, selanjutnya larutan darah tersebut diteteskan di atas hemasitometer yang telah diletakkan gelas penutup di atasnya. Berikut ini adalah rumus perhitungan total eritrosit :
∑Eritrosit (sel/mm3) = ∑sel terhitung ×
× faktor pengenceran
Hematokrit
Hematokrit diamati dengan menggunakan metode Anderson dan Siwicki (1993). Darah dihisap dengan tabung kapiler (mikrohematokrit) hingga ¾ bagian tabung, lalu ujung tabung ditutup dengan crytoceal. Selanjutnya, tabung mikrohematokrit yang berisi darah disentrifugasi pada kecepatan 3000 rpm selama 5 menit. Kadar hematokrit ini menunjukkan banyaknya sel darah (digambarkan dengan padatan/endapan) dalam cairan darah. Perhitungan hematokrit dilakukan dengan cara membandingkan, panjang endapan darah (a) terhadap panjang total seluruh darah (b). Berikut ini adalah rumus perhitungan kadar hematokrit:
Hematokrit (%) = × 100
Pengukuran Kadar Hemoglobin (Hb)
Pengukuran kadar Hb dilakukan dengan metode Sahli yang mengkonversi darah ke dalam bentuk asam hematin setelah darah ditambah dengan asam klorida. Pertama-tama darah dihisap dengan pipet sahli sampai skala 0,2 ml, bersihkan ujung pipet dengan kertas tisu. Lalu pindahkan darah dalam pipet ke dalam tabung Hb-meter yang telah diisi HCl 0,1 N sampai skala 10 (merah), homogenkan dan biarkan selama ± 3 menit. Kemudian aquades ditambahkan ke dalam tabung sampai warna darah dan HCl tersebut sewarna dengan larutan standar yang ada dalam Hb-meter tersebut. Skala dibaca dengan melihat permukaan cairan dan dicocokkan dengan skala tabung Sahli yang dilihat pada skala jalur g% (kuning) yang menunjukkan banyaknya Hb per 100 ml darah (Wedemeyer dan Yasutake 1977).
Total Leukosit
Total leukosit dihitung menggunakan metode Blaxhall dan Daisley (1973). Darah dihisap menggunakan pipet hemasitometer berbulir putih sampai skala 0,5 lalu diencerkan dengan larutan Turk’s hingga skala 11. Larutan tersebut kemudian dihomogenkan dengan membentuk pola angka delapan selama 3-5 menit. Selanjutnya, larutan pada bagian ujung pipet dibuang sebanyak dua tetes. Tetesan berikutnya dimasukkan ke dalam hemasitometer yang telah diberi kaca penutup. Rumus untuk perhitungan total leukosit :
∑Leukosit (sel/mm3) = ∑sel terhitung ×
7
Aktivitas Fagositik
Aktivitas fagositik dihitung berdasarkan metode Anderson dan Siwicki (1993). Darah sebanyak 50 µL dimasukkan ke dalam microtube, kemudian ditambahkan 50 µL suspensi bakteri Staphylococcus aureus dalam PBS dan dihomogenkan, selanjutnya diinkubasi pada suhu 28 °C selama 20 menit. Selanjutnya dari campuran tersebut diambil sebanyak 5 µL untuk dibuat preparat ulas. Preparat ini difiksasi dengan metanol selama 5 menit dan dikeringkan, selanjutnya direndam dalam larutan giemsa selama 15 menit. Preparat tersebut kemudian dicuci dalam air mengalir dan dikeringkan. Pengamatan dilakukan menggunakan mikroskop dengan perbesaran 400x. Aktivitas fagositik dihitung berdasarkan pada persentase dari 100 sel fagosit yang menunjukkan aktivitas fagositosis. Berikut adalah rumus untuk menghitung aktivitas fagositik :
Aktivitas Fagositik (%) =
×100
Respiratory Burst
Aktivitas respiratory burst dihitung menggunakan prinsip reduksi dari
nitroblue tetrazolium (NBT) yang menghasilkan formazan yang merupakan jumlah ukuran jumlah anion superoksida. Darah sebanyak 50 µL dimasukkan ke dalam lubang-lubang microplate titer kemudian diinkubasi selama satu jam pada suhu 37º C. Selanjutnya supernatan yang terbentuk dibuang dan dibilas dengan 50 µL phosphate buffered saline (PBS) sebanyak tiga kali. Larutan NBT 0,2% kemudian ditambahkan sebanyak 50 µL dan diinkubasi selama satu jam pada suhu 37º C. Setelah diinkubasi selama satu jam kemudian larutan NBT 0,2% tersebut dibuang dan darah tersebut difiksasi dengan menggunakan 50 µL metanol konsentrasi 100% selama 2 menit. Setelah difiksasi, kemudian dibilas tiga kali dengan menggunakan metanol konsentrasi 30% dan dikeringkan. Sebanyak 60 µL 2 N KOH dan 70 µL dimethyl sulphoxide (DMSO) ditambahkan pada masing-masing lubang microplate titer untuk melarutkan hasil endapan formazan blue yang terbentuk. Optical density (OD) hasil endapan
formazan blue diukur pada panjang gelombang 630 nm menggunakan
microplate reader (Divyagnaneswari et al. 2007).
.
Jumlah kepadatan bakteri A. hydrophila pada organ target
8
Analisis Data
Penelitian dilakukan menggunakan rancangan acak lengkap dengan lima perlakuan dan tiga ulangan. Data dianalisis menggunakan ANOVA melalui program SPSS 16 dengan tingkat selang kepercayaan 95%, jika signifikan maka akan diuji lanjut dengan uji lanjut Duncan’s.
HASIL DAN PEMBAHASAN
Hasil penelitian ini menunjukkan bahwa pemberian pakan yang mengandung probiotik S. cerevisiae, prebiotik MOS, dan sinbiotik dapat meningkatkan SGR, JKP, dan bobot akhir (wt), serta nilai FCR yang lebih rendah dibandingkan dengan kontrol. Bobot akhir (Wt) pada perlakuan Sin menunjukkan hasil tertinggi (16,39±0,23), diikuti dengan perlakuan Pre (15,59±0,21) dan Pro (14,30±0,17) dibandingkan dengan K- (12,69±0,47) dan K+ (12,46±0,16) (p<0,05, Tabel 2). Nilai SGR pada perlakuan Sin (3,28±0,04) menunjukkan hasil tertinggi dibandingkan perlakuan Pro, Pre dan kontrol. FCR pada perlakuan Sin dan Pre tidak berbeda nyata (p>0,05, Tabel 2) dan menunjukkan nilai yang lebih rendah dibandingkan dengan perlakuan Pro dan kontrol.
Bakteri usus total (TBC) pada perlakuan Pre (8,64±0,03) menunjukkan nilai tertinggi dan diikuti oleh perlakuan Sin (8,37±0,1), sedangkan untuk perlakuan Pro, K-, dan K+ menunjukkan hasil yang tidak berbeda nyata (p<0,05). Nilai rasio panjang usus (RPU) menunjukkan bahwa perlakuan Pro, Pre, dan Sin antar perlakuan tidak berbeda nyata tetapi nilai RPU ketiga perlakuan tersebut berbeda nyata dengan kontrol (p<0,05).
Tabel 2. Kinerja pertumbuhan pada ikan masselama 30 hari pemeliharaan.
Parameter Perlakuan
K- K+ Pro Pre Sin
Wo (g) 6,24±0,05a 6,23±0,04a 6,25±0,01a 6,26±0,03a 6,21±0.04a
Wt (g) 12,69±0,47a 12,46±0,16a 14,30±0,17b 15,59±0,21c 16,39±0,23d
JKP (g) 112,77±6,7 a 115,68±7,1 a 129,83±4,1 b 131,65±3,0 b 140,21±7,9b
SGR 2,39±0,15a 2,33±0,06a 2,81±0,04b 3,08±0,03c 3,28±0,04d
FCR 1,75±0,11c 1,76±0,12c 1,61±0,02b 1,40±0,01a 1,38±0,01a
TBC (log CFU g-1) 7,91± 0,03a 7,89±0,01a 7,96±0,01a 8,64±0,03c 8,37±0,1b
TSCC(log CFU g-1) 1,30±0,30a 1,30±0,30a 3,81±0,02b 1,36±0,10a 3,78±0,02b
RPU 1,33±0,02a 1,33±0,02a 1,79±0,25b 1,92±0,13b 1,91±0,12b
KH (%) 100a 100a 100a 100a 100a
Huruf superscript yang berbeda pada kolom yang sama menunjukkan pengaruh perlakuan yang berbeda nyata (Duncan, p<0,05). Wo = bobot ikan awal, Wt = bobot ikan akhir, JKP=Jumlah konsumsi pakan, SGR = Specific growth rate, FCR = Feed conversion ratio, TBC = Total bacterial count, TSCC = Total S. cerevisiae count, RPU = Rasio Panjang Usus, KH = Kelangsungan hidup. K- = kontrol negatif, K+ = kontrol positif, Pro = Probiotik, Pre = prebiotik, Sin = sinbiotik.
9 mampu melakukan kolonisasi, melekat dan bertahan hidup pada dinding epitelial di saluran pencernaan inang untuk melakukan fungsi-fungsinya (Balcazar et al.
2008). S. cerevisiae dapat berkontribusi terhadap kinerja pertumbuhan karena kandungan beberapa peptida yang dihasilkan dapat meningkatkan regulasi dan kerja enzim pencernaan, diantaranya pada polisakarida kompleks termasuk selulosa dan pemanfatan fosfor organik (phytic acid) sehingga dapat meningkatkan kecernaan (Arup dan Bidhan 2011). Berdasarkan Tawwab et al.
(2008), penambahan S. cerevisiae sebesar 0,2% pada pakan ikan nila selama 12 minggu dapat meningkatkan kinerja pertumbuhan yang meliputi bobot akhir (Wt), SGR, dan FCR dibandingkan dengan kontrol.
Kandungan sakarida pada prebiotik menyediakan sumber energi bagi bakteri komensal selama proses fermentasi pada saluran pencernaan (Roberfroid 2000). Total bakteri pada saluran usus ikan mas yang diberi perlakuan prebiotik dan sinbiotik menunjukkan nilai yang lebih tinggi dibandingkan dengan probiotik dan kontrol. Populasi mikroba usus yang menguntungkan berperan dalam meningkatkan penyerapan dan pemanfaatan nutrien, memproduksi enzim, asam amino, shortchain fatty acids, vitamin dan meningkatkan kecernaan (Nayak et al. 2010). Prebiotik MOS dapat menstimulus pertumbuhan beberapa
lactic acid bacteria (LAB) yang menguntungkan pada saluran usus inang yakni
B. bifidobakteria dan Lactobacilli, keduanya dapat meningkatkan kecernaan dan penyerapan nutrien (Dimitroglou et al. 2011). Ahmad et al. (2013), melaporkan bahwa dosis MOS 0,2% pada pakan ikan nila meningkatkan bobot akhir (Wt), SGR, dan FCR dibandingkan dengan kontrol. Selain itu, berdasarkan Torrecilas
et al. (2011), MOS memiliki reseptor manosa yang dapat mengikat dan memblokir reseptor glikoprotein yang spesifik pada permukaan sel bakteri patogen. Hal ini yang menyebabkan bakteri patogen cenderung mudah melekat pada reseptor MOS dibanding pada sel-sel epitelial usus dan akan mudah wash out dari saluran pencernaan tanpa melakukan kolonisasi pada saluran usus sehingga mengurangi kompetisi pelekatan dengan bakteri yang menguntungkan. Peningkatan morfologi usus dan mukosal epitelium yang sehat dapat meningkatkan pemanfaatan nutrien pakan sehingga dapat meningkatkan kinerja pertumbuhan ikan mas.
Gabungan dari S. cerevisiae dan MOS pada penelitian ini menghasilkan kinerja pertumbuhan yang terbaik dibandingkan probiotik dan prebiotik yang diberikan secara tunggal. Hal ini disebabkan karena adanya sinergi dari kedua manfaat yang dihasilkan dari probiotik dan prebiotik. Hasil ini selaras dengan hasil dari penelitian Elala et al. (2013), gabungan antara S. cerevisiae dan MOS dengan masing-masing dosis 0,2% pada ikan nila yang diuji tantang beberapa patogen memberikan hasil kinerja pertumbuhan dan imunitas yang lebih baik dibandingkan pemberian S. cerevisiae dan MOS secara tunggal.
10
Oncorhynchus mykiss (Dimitrouglou et al. 2009), European sea bass
Dicentrarchus labrax (Torrecilas et al. 2011). Begitu juga dengan pemberian
S. cerevisiae dapat meningkatkan panjang usus dan pelipatan lapisan mukosal pada ikan nila (Pinpimai et al. 2015). Berdasarkan Gatessoupe et al. (2007), probiotik memiliki kemampuan untuk memproduksi polyamine yang berperan dalam proliferasi, mempercepat pertumbuhan dan regenerasi jaringan usus, sedangkan prebiotik menyediakan sumber energinya.
Suplementasi Pro, Pre, dan Sin pada penelitian ini menunjukkan jumlah konsumsi pakan yang lebih tinggi dibandingkan dengan kontrol, dan selaras dengan peningkatan bobot akhir (Wt) pada setiap perlakuan. Jumlah konsumsi pakan yang tinggi inilah yang menyebabkan terjadinya peningkatan pertumbuhan. Berdasarkan Tawwab et al. (2011), jumlah konsumsi pakan, pemanfaatan nutrien, dan kecernaan nutrien yang tinggi, dapat meningkatkan deposit nutrien dalam tubuh ikan dalam bentuk protein atau lemak tubuh.
Terjadi peningkatan total eritrosit (Et), hemoglobin (Hb), dan hematokrit (Ht) pada ikan uji yang diberi perlakuan Pro, Pre dan Sin pada hari ke-30 sebelum uji tantang. Hasil terbaik terdapat pada perlakuan Sin (p<0,05) (Gambar 1). Pada hari ke-30 sebelum uji tantang, nilai Et pada perlakuan Pro (2,24±0,06), Pre (2,24± 0,14), Sin (2,63±0,11), kontrol negatif (1,96±0,06), dan kontrol positif (1,99±0,09). Nilai Ht pada Pro (34,10±0,67), Pre (30,00± 0,50), Sin (34,22±0,25), kontrol negatif (23,00±2,65), dan kontrol positif (22,17±2,93). Selanjutnya untuk nilai Hb pada perlakuan Pro (8,80±0,34), Pre (9,36± 0,15), Sin (10,16±0,47), kontrol negatif (6,9±0,36), dan kontrol positif (6,73±0,64).
Peningkatan Et, Hb, dan Ht selaras dengan hasil penelitian suplementasi
12
(e)
Gambar 1. Eritrosit (a), hematokrit (b), hemoglobin (c), leukosit (d), aktivitas fagositik (e), respiratory burst (f). Huruf superscript yang berbeda pada kolom yang sama menunjukkan pengaruh perlakuan yang berbeda nyata (Duncan, p<0,05). Kontrol negatif (K-), kontrol positif (K+), Probiotik S. cerevisiae 0,2% (Pro), prebiotik MOS 0,2% (Pre), dan S. cerevisiae 0,2% + MOS 0,2% (Sin)
Pasca uji tantang, terjadi penurunan pada kadar hematokrit, hemoglobin, dan eritrosit pada hari ke-34 dan ke-37. Berdasarkan Harikhrisnan et al. (2003), bakteri A. hydrophila memiliki toksin β-hemolisin dan aerolisin yang dapat menyebabkan terjadinya penurunan kadar eritrosit, hematokrit dan hemoglobin yang dapat mengakibatkan anemia, serta mengakibatkan gangguan pada organ-organ haematopoisis. Terdapat korelasi yang kuat antara eritrosit, Hb, dan Ht, penurunan kadar eritrosit diikuti oleh penurunan Hb dan Ht. Akan tetapi pada perlakuan probiotik, prebiotik, dan sinbiotik menunjukkan nilai yang lebih baik dibandingkan dengan kontrol positif. Berdasarkan Arup dan Bidhan (2011), probiotik dan prebiotik mampu menstimulus proses haematopoisis. Peningkatan kembali Hb, Ht, dan Et pada hari ke-41 mengindikasikan terjadinya proses
recovery pasca infeksi pada ikan uji.
Terjadi peningkatan parameter leukosit (Lc), aktivitas fagositik (AF), dan
13 Pre, dan Sin menunjukkan hasil yang lebih tinggi dibandingkan dengan kontrol (Gambar 1). Leukosit pada perlakuan Pro (9,96±0,15), Pre (9,53± 0,23), Sin (11,20±0,20), kontrol negatif (8,30±1,13), dan kontrol positif (8,16±0,76). AF pada perlakuan Pro (40,95±1,695), Pre (41,67± 1,50), Sin (47,48±0,20), kontrol negatif (29,67±1,13), dan kontrol positif (29,67±0,76). Respiratory Burst pada perlakuan Pro (0,286±0,012), Pre (0,316± 0,03), Sin (0,348±0,01), kontrol negatif (0,199±0,03), dan kontrol positif (0,220±0,01).
Meningkatnya aktivitas fagositosis, respiratory burst, dan total leukosit pada perlakuan Pro, Pre, dan Sin setelah pemberian pakan uji selama 30 hari disebabkan karena bahan immunostimulan yang terdapat pada S. cerevisiae dan MOS. Imunostimulan yang terkandung pada S. cerevisiae adalah β-glukan, mannoprotein kompleks, kitin dan organel sel nukleotida (Kwiatkowski et al.
2009) dan MOS juga mengandung β-glukan dan mannose (Sang dan Fotedar 2010). Imunostimulan memiliki reseptor spesifik terhadap sel-sel fagositik (neutrofil, monosit, dan makrofaga) dan berikatan dengan molekul reseptor pada permukaan sirkulasi dan jaringan fagosit. Ikatan tersebut dapat meningkatkan aktivitas fagositik dalam proses penelanan, killing, dan mencerna bakteri (Elala
et al. 2013). Sel-sel fagositik memiliki fungsi yang penting dalam pertahanan tubuh. Bersamaan dengan aktivitas tersebut, terjadi pelepasan sinyal molekul (cytokines) yang dapat merangsang pembentukan sel-sel darah putih yang baru (Ellis 2001). Hal ini yang menyebabkan terjadinya peningkatan pada sel darah putih meskipun belum terjadi infeksi (Elala et al. 2013).
Pada penelitian ini perlakuan Sin menunjukkan nilai yang lebih baik dibandingkan dengan perlakuan Pro, Pre, dan kontrol, hal ini sejalan dengan penelitian Elala et al. (2013), pemberian sinbiotik S. cerevisiae dan MOS mampu meningkatkan parameter imunitas ikan nila yang meliputi eritrosit, hematokrit, hemoglobin, indeks fagositik, lisozim, alternative complement activity (ACH50), dan cytokine TNFα dibandingkan pemberian secara tunggal.
Terjadi kenaikan nilai aktivitas fagositosis, respiratory burst, dan leukosit pasca uji tantang, yakni pada hari ke-34 hingga ke-37 hal ini disebabkan oleh adanya mekanisme perlawanan dari tubuh ikan terhadap bakteri
14
(a)
Gambar 2 (a-b): Total A. hydrophila pada (a) hati dan (b) ginjal pada ikan mas selama uji tantang. Huruf superscript yang berbeda pada kolom yang sama menunjukkan pengaruh perlakuan yang berbeda nyata (Duncan, p<0,05). Kontrol negatif (K-), kontrol positif (K+), Probiotik S. cerevisiae 0,2% (Pro), prebiotik MOS 0,2% (Pre), dan S. cerevisiae 0,2% + MOS 0,2% (Sin)
Leukosit merupakan pertahanan tubuh terdepan dan akan meningkat saat terjadi infeksi pada tubuh. Peningkatan aktivitas respiratory burst berkorelasi dengan peningkatan proses killing bakteri patogen oleh aktivitas fagositik (Sharp dan Secombes 1993), dan aktivitas respiratory burst pada fagositosis ini diukur dengan reduksi NBT oleh radikal superoksida intraseluler yang diproduksi oleh leukosit (Sakai 1999). Pada hari ke-41 total bakteri di organ memiliki nilai yang lebih rendah dibandingkan hari ke-34 dan 37, aktivitas fagositik, respiratory burst, dan leukosit juga sejalan mengalami penurunan pada hari tersebut.
15
Gambar 3. Kelangsungan hidup ikan mas pasca uji tantang. Huruf superscript
yang berbeda pada kolom yang sama menunjukkan pengaruh perlakuan yang berbeda nyata (Duncan, p<0,05). Kontrol negatif (K-), kontrol positif (K+), Probiotik S. cerevisiae 0,2% (Pro), prebiotik MOS 0,2% (Pre), dan S. cerevisiae 0,2% + MOS 0,2% (Sin)
Selain memiliki kandungan imunostimulan, S. cerevisiae juga memproduksi protease dan siderofor ekstraselular yang dapat berikatan dengan laktoferin (Gatesoupe et al. 2007). Kemampuan tersebut bersifat antagonistik bagi beberapa patogen, yang virulensinya iron dependent (Calvente et al. 1999). Secara tidak langsung prebiotik MOS dapat meningkatkan respons imun non spesifik dengan cara menyediakan sumber energi bagi bakteri yang menguntungkan di usus, sehingga dapat meningkatkan status kesehatan inang. Secara langsung MOS bekerja dengan mengaktivasi fagositik, neutrofil, lisozim, dll, melalui interaksi dengan pattern recognition receptors (PRR) dan berasosiasi dengan microbe associated molecullar patterns (MAMPs) (Song et al. 2014). Disamping itu, komponen dari prebiotik atau produk yang dihasilkan dari probiotik dapat pula berinteraksi dengan gut associated lymphoid tissue
(GALT) untuk menginduksi respons imun inang (Dimitroglou et al. 2011). Pada penelitian ini, kandungan β-glukan kuantitatif dalam pakan Pro sebesar 0,21 g/kg pakan, Pre 0,43 g/kg pakan, dan Sin 0,64 g/kg pakan. Hasil kinerja pertumbuhan dan imunitas menunjukkan bahwa dibandingkan dengan kontrol, perlakuan Sin menunjukkan hasil yang terbaik, diikuti oleh perlakuan Pre dan Pro. Hal ini berkaitan dengan kandungan β-glukan yang terkandung dalam masing-masing perlakuan, semakin tinggi nilai β-glukan pada pakan perlakuan menunjukkan hasil yang terbaik. β-glukan merupakan komponen imunostimulan yang utama pada S. cerevisiae dan MOS yang berkaitan dengan stimulasi peningkatan respons imun non-spesifik. Pada beberapa penelitian, suplementasi β-glukan mampu meningkatkan ketahanan tubuh inang, diantaranya pada Gilthead seabream (Sparus aurata) yang diinfeksi
Photobacterium damselae (Couso et al. 2003), black tiger prawns Penaeus monodon yang diuji tantang white spot syndrome virus (WSSV) (Chang et al.
2003). Selain itu juga β-glukan mampu meningkatkan kinerja pertumbuhan, diantaranya pada yellow croaker Pseudosciena crocea (Ai et al. 2007), udang vaname Litopenaeus vannamei (López et al. 2003).
16
Interaksi diantara bakteri yang menguntungkan pada saluran usus, morfologi usus, pemanfaatan nutrien dan sistem imun yang baik merupakan faktor-faktor yang berpengaruh terhadap kinerja pertumbuhan dan kelangsungan hidup ikan mas yang di uji tantang bakteri A. hydrophila. Pada penelitian ini, perlakuan Pro memberikan hasil peningkatan kelangsungan hidup sebesar 150%, Pre 183,35%, dan Sin 216,65% dibandingkan dengan kelangsungan hidup kontrol positif (20±10%), hal ini selaras dengan hasil penelitian Cerezuela et al.
(2012), pemberian inulin dan Bacillus subtilis mampu meningkatkan kelangsungan hidup Sparus aurata yang diinfeksi Photobacterium damselae
3
SIMPULAN DAN SARAN
Simpulan
Pemberian probiotik S. cerevisiae, prebiotik MOS, dan sinbiotik mampu meningkatkan kinerja pertumbuhan, respons imun, dan kelangsungan hidup ikan mas yang diuji tantang A. hidrophyla. Perlakuan sinbiotik memberikan hasil yang terbaik di antara perlakuan yang diberikan.
Saran
Perlakuan sinbiotik memberikan hasil yang terbaik, sehingga sinbiotik ini disarankan untuk diuji coba di skala lapangan pada kegiatan budidaya ikan mas.
DAFTAR PUSTAKA
Ai Q, Xu H, Mai K, Xu W, Wang J, Zhang W. 2011. Effects of dietary supplementation of Bacillus subtilis and fructooligosaccharide on growth performance, survival, non-specific immune response and disease resistance of juvenile large yellow croaker Larimichthys crocea.
Aquaculture. 317 : 155-161.
Ai Q, Mai K, Zhang L, Tan B, Zhang W, Xu W, Li H. 2007. Effects of dietary β-1, 3 glucan on innate immune responsse of large yellow croaker
Pseudosciaena crocea. Fish and Shellfish Immunology. 22: 394–402. Ahmad MH, El-Mousallamy A, Awad SMM, El-Naby AAA. 2013. Evaluation
of Bio-Mos® as a feed additive on growth performance, physiological and immune responsses of Nile tilapia Oreochromis niloticus (L).
Journal of Applied Sciences Research. 9 : 6441-6449.
Anderson DP, Siwicki AK. 1993. Basic hematology and serology for fish health programs. Paper presented in second symposium on diseases in Asian Aquaculture “Aquatic Animal Health and the Evironment”.
17 Arup T, Bidhan PC. 2011. Oral administration of baker’s yeast Saccharomyces cerevisiae acts as a growth promoter and immunomodulator in Labeo rohita (Ham.). Journal of Aquaculture Research and Development. 2:1– 7.
Azad IS, Rajendran KV, Rajan JJS, Vijayan KK, Santiago TC .2001. Virulence and histopathology of Aeromonas hydrophila (Sah 93) in experimentally infected tilapia Oreochromis mossambicus (L.). Journal of Aquaculture in the Tropics.16:265-275
Balcázar JL, Id B, Ruiz-Zarzuela I, Cunningham D, Vendrell D, Muzquiz JL. 2006. The role of probiotics in aquaculture. Veterinary Microbiology.
114 : 173–186.
Blaxhall PC, Daisley KW. 1973. Routine haematological methods for use with fish blood. Journal of Fish Biology. 5:577-581.
Calvente V, Benuzzi D, de Tosetti MIS. 1999. Antagonistic action of siderophores from Rhodotorula glutinis upon the postharvest pathogen
Penicillium expansum. International Biodeterioration and Biodegradation . 47:167–172.
Cerezuela R, Cuesta A, Meseguer, Esteban JMA. 2008. Effects of inulin on gilthead seabream Sparusaurata L. innate immune parameters. Fish and ShellfishImmunology. 24:663–668.
Chang CF, Su MS, Chen HY, Liao IC. 2003. Dietary β-1,3-glucan effectively improves immunity and survival of Penaeus monodon challenged with white spot syndrome virus. Fish and Shellfish Immunology. 15 :297– 310.
Couso N, Castro R, Magarinos B, Obach A, Lamas J. 2003. Effect of oral
administration of glucans on the resistance of gilthead seabream Sparrus
aurata to pasteurellosis. Aquaculture. 219: 99–109.
Dimitroglou A,MerrifieldD, SpringP, SweetmanJ, MoateR, DaviesSJ. 2011. Effects of mannan oligosaccharide (MOS) supplementation on growth performance, feed utilisation, intestinal histology and gut microbiota of gilthead sea bream Sparus aurata. Aquaculture. 300:182-188.
Dimitroglou A, Merrifield DL, Moate R, Davies SJ, Spring P. 2009. Dietary mannan oligosaccharide supplementation modulates intestinal microbial ecology and improves gut morphology of rainbow trout Oncorhynchus mykiss (Walbaum). Journal of Animal Science. 87: 3226-323
Divyagnaneswari M, Christybapita D, Dinakaran MR. 2007. Enhancement of non specific immunity and disease resistance in Oreochromis mossambicus by Solanum trilobatum leaf fractions. Fish and Shellfish Immunology. 23:249–59.
Elala NA, Marzouk M, Moustafa M. 2013. Use of different Saccharomyces cerevisiae biotic forms as immune-modulator and growth promoter for
Oreochromis niloticus challenged with some fish pathogens.
International Journal of Veterinary Science and Medicine. 1: 21–29. Ellis AE. 2001. Innate host defense mechanism of fish againts viruses and
bacteria.Developmental and Comparative Immunology. 25 : 827-839. Gatesoupe FJ. 2007. Live yeasts in the gut: natural occurrence, dietary
18
Goddard S. 1996. Feed Management in Intensive Aquaculture. New York (US): Chapman and Hall. 194 p.
Harikrishnan R, Nisha RM, Balasundaram C. 2003. Haematological and biochemical parameters in common carp Cyprinus carpio, following herbal Enterococcus infection in tilapia treatment for Aeromonas hydrophila infection. Aquaculture. 221: 41–50.
Hozová B, Kuniak U, Moravèíková P. Alena G. 2007. Determination of water-insoluble β-Glucan in the whole-grain cereals and pseudocereals. Czech Journal of Food Sciences.6: 316–324.
Huisman EA. 1987. Principles of Fish Production. Netherland (NL): Wageningen Agricultural University Press.
Janda JM, Abbott SL. 2010. The genus Aeromonas: Taxonomy, pathogenicity and infection.Clinical Microbiology Reviews. 23: 35-73.
Jeney Z, Riicz T, Thompson KD, Poobalane S, Ard L, Adams A, Jeney G. 2009. Differences in the antibody responsse and survival of genetically clifferent varieties of common carp Cyprinus carpio L. vaccinated with a commercial Aeromonas salmonicida / A. hydrophila vaccine and chalenged with A. hydrophila. Fish Physiology and Biochemistry. 35: 677 -682.
Jeeva SN, Packia LCJ, Raja BJ, Vasudevan A. 2013. Studies on antibiotic subsceptibility of Aeromonas hydrophila isolated from gold fish
Carassius auratus. International Journal of Current Microbiology and Applied Sciences . 2: 7-13.
Kwiatkowski S, Thielen U, Glenny P, Moran C. 2009. A study of
Saccharomyces cerevisiae cell wall glucans. The Institute of Brewing & Distilling.115:151-158.
Lara-Flores M, Novoa OMA, Guzman MBE, Lopez MW. 2003. Use of the bacteria Streptococcus faecium and Lactobacillus acidophilus, and the yeast Saccharomyces cerevisiae as growth promoters in Nile tilapia
Oreochromis niloticus. Aquaculture. 216:193–201.
Mansour MR, Akrami R, Ghobadi SH, Denji KA, Ezatrahimi N, Gharaei A. 2011. Effect of dietary mannan oligosaccharide (MOS) on growth performance, survival, body composition, and some hematological parameters in giant sturgeon juvenile Huso huso (Linnaeus, 1754). Fish Physiology and Biochemistry. 38:829-835.
Mehrabi Z, Firouzbakhsh A, Jafarpour A. 2011. Effects of dietary supplementation of synbiotic on growth performance, serum biochemical parameters and carcass composition in rainbow trout Oncorhynchus mykiss fingerlings. Journal of Animal Physiology and Animal Nutrition.
96:474-81.
Nayak SK. 2010. Probiotics and immunity: a fish perspective. Fish Shellfish Immunology. XXX: 1–13.
Pinpimai K, Rodkhum C, Chansue N, Katagiri K, Maita M, Pirarat N. 2015. The study on the candidate probiotic properties of encapsulated yeast,
Saccharomyces cerevisiae JCM7255, in Nile tilapia Oreochromis niloticus. Research in Veterinary Science. 102 : 103–111.
19 performance, feed utilization and body biochemical composition of Nile tilapia Oreochromis niloticus fingerlings. World Journal of Fish and Marine Sciences. 5: 88-95.
Reid G, Sanders ME, Gaskins R, Gibson G, Mercenier A, Rastall B.2003. New scientific paradigms for probiotics and prebiotics. Journal of Clinical Gastroenterology, 37:105–118.
Roberfroid MB. 2000. Prebiotic and probiotic : are they functional foods?. The American Journal of Clinical Nutrition. 71: 1682-1687.
Rodriguez A, Cuesta A, Ortuno J, Esteban MA, Mesequer J. 2003.
Immunostimulant properties of a cell wall-modified whole
Saccharomyces cerevisiae strain administered by diet to seabream Sparus aurata L.. Veterinary Immunology and Immunopathology. 96: 183–192.
Sakai M. 1999. Current research status of fish immunostimulant. Aquaculture. 172: 63-92.
Sang HM, Fotedar R. 2010. Effects of dietary beta 1,3-glucan on the growth, survival, physiological and immune responsse of marron Cherax tenuimanus (Smith, 1912). Fish Shellfish Immunology. 28:957–60.
Song SK, Beck BR, Kim D, Park J, Kim J, Kim HD, Ringø E. 2014. Prebiotics as immunostimulants in aquaculture: A review. Fish and Shellfish Immunology. 40: 40-48.
Sharp GJE, Secombes CJ. 1993. The role of reactive oxygen species in the killing of bacterial fish pathogen Aeromonas salmonicida by rainbow trout macrophages. Fish and Shellfish Immunology. 3: 119–129.
Takashima F, Hibiya T. 1995. An Atlas of Fish Histology: Normal and Pathological Features, Kodansha Ltd., Tokyo, Japan
Tawwab MA, Abdel-Rahman MA, Nahla-Ismael EM. 2008. Evaluation of commercial live bakers’ yeast, Saccharomyces cerevisiae as a growth and immunity promoter for fry Nile tilapia Oreochromis niloticus (L.) challenged in situ with Aeromonas hydrophila. Aquaculture. 280: 185– 189.
Torrecillas S, Makol A, Caballero MJ, Montero D, Robaina L, Real F, Sweetman J, Tort L, Izquierdo MS. 2007. Immune stimulation and improved infection resistance in European sea bass Dicentrarchus labrax
fed mannan oligosaccharides. Fish and Shellfish Immunology. 23:969-81 TorrecilIas S, Makol A, Santana TB, Caballero MJ, Montero D, Sweetman J,
Izquierdo M. 2011. Reduced gut bacterial translocation in European sea bass Dicentrarchus labrax fed mannan oligosacharides MOS. Fish and Shellfish Immunology. 30 : 674-681.
20
Lampiran 1. Pola kematian ikan mas pasca uji tantang
0 1 2 3 4 5 6 7 8 9
1 2 3 4 5 6 7 8 9 10
Ju
m
lah
k
u
m
u
la
ti
f
(e
k
or
)
Hari Pola Kematian
k-
k+
pro
pre
22
Lampiran 3. Gejala klinis ikan mas yang terserang A. hydrophila : dropsy (A), nekrosis (B), hemorraghi (C), ulcer (D).
A
B
C
23
RIWAYAT HIDUP
Penulis dilahirkan di Sumedang pada tanggal 26 Oktober 1990 dari pasangan Bapak Subandi dan Ibu Tita Juwita. Penulis merupakan anak pertama dari dua bersaudara. Penulis menyelesaikan pendidikan sekolah menengah atas di SMAN I Cimalaka, Sumedang pada tahun 2007. Pada tahun yang sama penulis masuk IPB melalui jalur Undangan Seleksi Masuk IPB (USMI) pada program studi Teknologi dan Manajemen Perikanan Budidaya, Fakultas Perikanan dan Ilmu Kelautan. Pendidikan Sarjana diselesaikan pada tahun 2012. Pada tahun 2013, penulis berkesempatan menempuh pendidikan Magister di Sekolah Pascasarjana IPB, pada program studi Ilmu Akuakultur melalui program Beasiswa Pendidikan Pascasarjana Dalam Negeri (BPPDN) DIKTI.
Selama menempuh pendidikan magister, penulis menjadi asisten pada praktikum mata kuliah Dasar-dasar Mikrobiologi Akuatik pada program pendidikan S-2. Karya ilmiah dengan judul “Administration of probiotic
Sacharomyces cerevisiae and prebiotic mannan oligosacharide to control