EFEKTIVITAS KOLAGEN KULIT IKAN PATIN (Pangasius sp.)
SEBAGAI MATRIKS EKSTRASELULER PADA KULTUR
IN VITRO SEL TULANG TIKUS
HERMAN
FAKULTAS KEDOKTERAN HEWAN INSTITUT PERTANIAN BOGOR
BOGOR 2016
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa skripsi berjudul Efektivitas Kolagen Kulit Ikan Patin (Pangasius sp.) sebagai Matriks Ekstraseluler pada Kultur In Vitro Sel Tulang Tikus adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Agustus 2016 Herman NIM B04120207
ABSTRAK
HERMAN. Efektifitas Kolagen Kulit Ikan Patin (Pangasius sp.) sebagai Matriks Ekstraseluler pada Kultur In Vitro Sel Tulang Tikus. Dibimbing oleh WAHONO ESTHI PRASETYANINGTYAS dan KUSDIANTORO MOHAMAD.
Penelitian ini bertujuan menguji efektivitas kolagen yang diekstrak dari kulit ikan patin (KP) (Pangasius sp.) dibandingkan dengan kolagen sapi komersial (KS) dan gelatin ikan komersial (GI) sebagai matriks ekstraseluler (ECM) pada kultur in vitro sel tulang tikus. Sel tulang diisolasi dari tikus umur lima hari, dikultur dalam Dulbecco’s modified eagle’s medium (DMEM) selama tujuh hari, dan diamati tingkat proliferasi (PDT), persentase, serta diameter osteoblas dan osteosit. Perbedaan osteoblas dan osteosit ditentukan berdasarkan pengamatan morfologi sel kultur dengan pewarnaan Alizarin red. Data dianalisis menggunakan ANOVA dan uji Duncan. Hasil penelitian menunjukkan nilai PDT dan persentase osteoblas dan osteosit tidak berbeda nyata pada semua kelompok perlakuan. Diameter osteoblas pada perlakuan KP lebih kecil dibandingkan KS (P<0.05) tetapi tidak berbeda nyata dibandingkan GI. Diameter osteosit pada kelompok KP (18.38 µm) lebih kecil dari KS (19.27 µm), tetapi lebih besar dari GI (17.67 µm) (P<0.05). Kolagen kulit ikan patin (Pangasius sp.) sebagai matriks ekstraseluler pada kultur sel tulang tikus secara in vitro dapat mempertahankan proliferasi dan diferensiasi sel dengan efektifitas lebih rendah dari kolagen sapi komersial, tetapi lebih baik dari gelatin ikan komersial.
ABSTRACT
HERMAN. The Effectiveness of Catfish (Pangasius sp.) Skin Collagen as Extracellular Matrix in In Vitro Culture of Rat Bone Cells. Supervised by WAHONO ESTHI PRASETYANINGTYAS and KUSDIANTORO MOHAMAD.
This study aims to examine the effectiveness of catfish (Pangasius sp.) skin collagen (KP) compared to commercial calf skin collagen (KS) and fish skin gelatin (GI) as extracellular matrix (ECM) in in vitro culture of rat bone cells. Bone cells from five days old rat were cultured in Dulbecco's modified eagle's medium (DMEM) for seven days and evaluated for population doubling time (PDT), number and diameter of osteoblasts and osteocytes. Identification of osteoblasts and osteocytes were determined by morphological observation using Alizarin red staining. Data were analyzed using ANOVA and Duncan test. The results of this study showed that all treatments were not significantly different against the value of PDT and the percentage of osteoblasts and osteocytes. Diameter of osteoblast in KP group was significantly lower compared than KS group (P<0.05) but not significantly different than GI group. The diameter of osteocyte in KP group was significantly lower than KS group but higher than GI group (P<0.05). Catfish skin collagen as ECM in in vitro culture of rat bone cells can maintain cells proliferation and differentiation with effectiveness lower than commercial calf collagen, but better than commercial fish gelatin.
Keywords: catfish collagen, extracellular matrix, in vitro culture, rat bone cells
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Kedokteran Hewan
pada
Fakultas Kedokteran Hewan
EFEKTIVITAS KOLAGEN KULIT IKAN PATIN (Pangasius sp.)
SEBAGAI MATRIKS EKSTRASELULER PADA KULTUR
IN VITRO SEL TULANG TIKUS
FAKULTAS KEDOKTERAN HEWAN INSTITUT PERTANIAN BOGOR
BOGOR 2016
HERMAN
PRAKATA
Puji syukur penulis panjatkan kehadirat Allah subhanahu wa ta’ala atas segala rahmat dan karunia-Nya sehingga skripsi yang berjudul “Efektivitas Kolagen Kulit Ikan Patin (Pangasius sp.) sebagai Matriks Ekstraseluler pada Kultur In Vitro Sel Tulang Tikus” dapat diselesaikan.
Ucapan terima kasih penulis sampaikan kepada Ibu, Bapak, Kakak, Adik, dan seluruh keluarga atas segala doa, dukungan, kepercayaan, dan kasih sayang yang dilimpahkan kepada penulis. Penulis menyampaikan terima kasih kepada Drh Wahono Esthi Prasetyaningtyas, MSi, PAVet dan Drh Kusdiantoro Mohamad, MSi, PAVet selaku dosen pembimbing skripsi yang senantiasa memberikan dukungan, saran, motivasi, serta masukan dalam pengerjaan penelitian dan penulisan skripsi. Terima kasih kepada Prof Drh Arief Boediono, PhD, PAVet(K) atas saran dan pengetahuan yang diberikan selama penelitian. Terima kasih kepada Drh Supratikno, MSi, PAVet sebagai dosen pembimbing akademik atas bimbingan dan arahan selama penulis menempuh studi di FKH IPB. Terima kasih kepada Pak Wahyudin, AMd yang telah membantu selama penelitian dan teman-teman “embrio penuh warna” (Yusa, Senna, Sam, Riki, Alisa, Septi, kakak-kakak pascasarjana) atas bantuan dan kerja sama selama penelitian. Terima kasih kepada teman-teman astrocyte (FKH 49), sahabat KITA IA, sahabat balioradar, dan keluarga KEMAS Bogor. Penulis juga mengucapkan terima kasih kepada Pemerintah Daerah Kabupaten Sumbawa Barat sebagai pemberi dana beasiswa utusan daerah serta PT Newmont Nusa Tenggara sebagai pemberi dana beasiswa prestasi.
Semoga karya ilmiah ini bermanfaat.
Bogor, Agustus 2016 Herman
DAFTAR ISI
DAFTAR TABEL xiv
DAFTAR GAMBAR xiv
DAFTAR LAMPIRAN xiv
PENDAHULUAN 1
Latar Belakang 1
Tujuan Penelitian 1
Manfaat Penelitian 2
TINJAUAN PUSTAKA 2
Kolagen sebagai Matriks Ekstraseluler 2
Sel Tulang 3
Kultur Sel In Vitro 3
METODE 4
Waktu dan Tempat 4
Alat dan Bahan 4
Prosedur dan Tahapan Kerja 5
Evaluasi Hasil Kultur 6
HASIL DAN PEMBAHASAN 7
Tingkat Proliferasi Sel Tulang 7
Identifikasi Jenis-jenis Sel Tulang 8
Persentase Jenis-jenis Sel Tulang Sebelum dan Setelah Kultur 9
Diameter Osteoblas dan Osteosit 10
SIMPULAN DAN SARAN 12
Simpulan 12
Saran 12
DAFTAR PUSTAKA 12
LAMPIRAN 15
DAFTAR TABEL
1 Nilai PDT sel tulang tikus hasil kultur pada berbagai jenis matriks
ektraseluler 7
2 Persentase osteoblas dan osteosit sebelum dan setelah kultur 10 3 Diameter osteoblas dan osteosit pada kultur sel tulang tikus pada
berbagai jenis matriks ektraseluler 11
DAFTAR GAMBAR
1 Sel tulang tikus yang dikultur secara in vitro pada berbagai matriks
ekstraseluler 7
2 Morfologi sel tulang tikus hasil kultur yang diwarnai dengan
pewarna-an Alizarin red 9
DAFTAR LAMPIRAN
1 Komposisi asam amino pada kolagen sapi dan kolagen Pangasiano-
PENDAHULUAN
Latar Belakang
Kolagen atau gelatin digunakan dalam kultur jaringan sebagai matriks ekstraseluler. Matriks ekstraseluler merupakan substrat tempat perlekatan, proliferasi, dan diferensiasi sel pada sistem kultur in vitro (Freshney 1986; Trappmann et al. 2012; Yamada et al. 2014). Matriks ekstraseluler yang digunakan selama ini berasal dari kolagen atau gelatin sapi dan babi yang diimpor dari berbagai negara. Indonesia pada tahun 2013 telah mengimpor lebih dari 3 800 ton gelatin senilai Rp 300 milyar untuk memenuhi kebutuhan dalam negeri (Iqbal et al. 2015).
Ikan patin (Pangasius djambal Bleeker) merupakan spesies ikan asli Indonesia. Permintaan fillet ikan patin oleh industri makanan semakin meningkat, sedangkan kulit, sisik, sirip, tulang, dan kepala dianggap sebagai limbah (Suryaningrum 2008). Pemanfaatan limbah ikan memiliki nilai tambah ekonomi dan telah digunakan sebagai sumber untuk isolasi kolagen alternatif. Kolagen alternatif diperlukan sebagai pengganti kolagen sapi maupun babi karena alasan kultur, budaya, dan agama.
Kolagen dari kulit ikan memiliki jenis yang sama dengan kolagen dari kulit mamalia, yaitu kolagen tipe I yang banyak dijadikan sebagai matriks ekstraseluler dalam kultur jaringan (Pati et al. 2010). Kebutuhan kolagen di laboratorium sangat bergantung pada impor. Kolagen impor memiliki harga yang relatif mahal dan membutuhkan waktu mobilisasi yang cukup lama, sehingga kolagen dari ikan dapat dijadikan sebagai alternatif substrat kultur. Hardyanti (2014) berhasil mengisolasi kolagen dari kulit ikan patin (Pangasius sp.) tetapi belum dilakukan pengujian efektifitas kolagen tersebut sebagai matriks ekstraseluler dalam kultur in vitro.
Tulang merupakan jaringan ikat khusus yang berfungsi sebagai alat penyokong, perlekatan, perlindungan, dan penyimpanan mineral (Djuwita et al. 2012). Osteoblas merupakan sel tulang yang dapat berproliferasi dan berdiferensiasi menjadi osteosit. Osteoblas menghasilkan prakolagen yang merupakan bakal matriks tulang. Ferreira et al. (2012) dan Hintze et al. (2012) melaporkan bahwa kolagen sebagai matriks ekstraseluler memiliki sifat osteogenik yang mendukung diferensiasi sel, morfogenesis, dan metabolisme seluler pada jaringan tulang.
Tujuan Penelitian
Penelitian ini bertujuan menguji efektivitas kolagen yang diisolasi dari kulit ikan patin (Pangasius sp.) dibandingkan dengan kolagen dan gelatin komersial sebagai matriks ekstraseluler pada kultur in vitro terhadap proliferasi dan diferensiasi sel tulang tikus.
2
Manfaat Penelitian
Penelitian ini diharapkan dapat memberikan informasi mengenai kemampuan proliferasi dan diferensiasi sel tulang tikus terhadap kolagen hasil isolasi dari kulit ikan patin (Pangasius sp.) sebagai matriks ekstraseluler pada kultur in vitro sehingga dapat digunakan sebagai kolagen alternatif dalam kegiatan kultur jaringan.
TINJAUAN PUSTAKA
Kolagen sebagai Matriks Ekstraseluler
Kolagen merupakan protein dengan jumlah terbesar di dalam tubuh vertebrata dan invertebrata dengan kisaran 30% dari total protein. Kolagen pada mamalia, burung, dan ikan terdapat di kulit, tendon, tulang rawan dan jaringan ikat, sedangkan pada avertebrata kolagen terdapat pada dinding sel (Singh et al. 2011). Kolagen dan gelatin (derivat dari kolagen) telah digunakan dalam industri makanan, farmasi, kosmetik, dan bioteknologi (Liu et al. 2015).
Kolagen tersusun atas tiga rantai heliks (triple-helical) yang memiliki susunan asam amino glisina 33%, prolina 10%, hidroksiprolin 10%, dan beberapa asam amino yang lain. Kolagen yang berasal dari sapi memiliki hidroksiprolin lebih tinggi daripada kolagen yang berasal dari jenis ikan Aluterus monoceros (Ahmad et al. 2010). Kolagen dikategorikan berdasarkan bentuk menjadi tipe I, II, III, V dan XI (fibril forming), tipe IV dan VII (network forming), serta tipe IX dan XII (fibril associated) (Parenteau-Bareil et al. 2010). Produk kolagen tipe I banyak digunakan dalam kultur sel. Kolagen tipe I umumnya ditemukan di kulit, tulang, dan tendon, terdiri atas dua rantai α1 dan satu rantai α2 (Kleinman et al. 1981).
Kolagen banyak diekstrak dari tulang dan kulit mamalia. Penelitian tentang alternatif kolagen mamalia telah banyak dilakukan, yaitu isolasi kolagen dari ikan dan hewan invertebrata seperti ubur-ubur (Silvipriya et al. 2015). Kolagen ikan memiliki karakter yang sama dengan mamalia, yaitu kolagen tipe I. Penelitian Hardyanti (2014) melaporkan bahwa kolagen ikan patin berasal dari kolagen tipe I yang menunjukkan berat molekul dan pita protein yang sama dengan kolagen sapi yang digunakan sebagai kontrol.
Kolagen dalam bidang medis diaplikasikan untuk pengobatan penyakit regeneratif pada tulang atau luka karena trauma (Ferreira et al. 2012). Hal ini umum dilakukan karena kolagen memiliki imunogenisitas yang rendah, sehingga sangat tepat diaplikasikan pada individu yang memiliki sistem imun yang lemah. Bioaktivitas kolagen dengan struktur nanofibril yang berukuran nanometer sangat mendukung percepatan proses persembuhan penyakit seperti gangguan pada tulang, penyakit vaskular, dan penyakit sistem urogenital (Parenteau-Bareil et al. 2010).
Kolagen dalam kultur jaringan digunakan sebagai substrat matriks ektraseluler untuk tempat tumbuh sel. Matriks ektraseluler diproduksi oleh sel epitel dan sel stroma termasuk fibroblas, osteoblas, dan sel epitel basal. Kolagen berperan mendukung struktur dan pengikatan bagian protein matriks ektraseluler dari sel, interaksi faktor pertumbuhan (growth factor), reseptor sinyal (signal receptors), serta perlekatan molekul-molekul yang memediasi antar sel (Kim et al. 2011). Kolagen sebagai matriks ektraseluler juga dapat meningkatkan proliferasi dan
3 diferensiasi sel (Guo et al. 2013; Liu et al. 2014). Struktur kolagen yang berukuran 50-500 nm sangat mendukung untuk pertumbuhan sel dengan baik sebagai sarana penyaluran nutrisi dari medium ke dalam sel (Guo et al. 2013).
Sel Tulang
Tulang merupakan bagian tubuh yang memiliki fungsi utama sebagai pembentuk rangka dan alat gerak tubuh, pelindung organ-organ internal, serta tempat penyimpanan mineral (Ca, P). Proses pembentukan tulang atau osifikasi terjadi pada masa perkembangan fetus (prenatal) dan setelah individu lahir (pascanatal). Perkembangan tulang panjang terjadi sampai individu mencapai dewasa (Djuwita et al. 2012). Tulang panjang tersusun atas beberapa bagian, yakni diafise, epifise, dan metafise. Diafise tersusun atas korteks tulang yang padat, sedangkan metafise dan epifise tersusun atas trabekula seperti lubang jejaring yang nantinya akan membentuk korteks tulang. Perkembangan tulang pada individu dewasa tersusun atas korteks (80%) dan trabekula (20%) (Clarke 2008).
Tiga jenis sel utama penyusun tulang yaitu osteoblas, osteosit, dan osteoklas. Osteoblas berasal dari derivat mesenchymal stem cells (MSCs) dan merupakan sel penyusun tulang (4-6%) yang memiliki bentuk bulat sampai kuboid. Sel ini menunjukkan karakteristik morfologi sel yang aktif mensintesis protein, memiliki retikulum endoplasma yang banyak, dan badan Golgi yang berukuran besar. Osteoblas menghasilkan osteoid atau matriks tulang. Osteoblas memiliki kemampuan berproliferasi dan berdiferensiasi (Florencio-Silva et al. 2015).
Osteosit merupakan sel akhir dari diferensiasi osteoblas dan berfungsi membentuk jaringan untuk mendukung struktur tulang dan metabolisme tulang. Osteosit berada di antara lakuna dan memiliki penjuluran sitoplasma yang disebut kanalikuli. Kanalikuli berfungsi menghubungkan antara satu osteosit dengan osteosit yang lain dan menyalurkan nutrisi dari pembuluh darah kapiler ke osteosit (Clarke 2008).
Osteoklas merupakan sel besar multinukleus yang berfungsi dalam reabsorpsi tulang. Morfologi osteoklas memiliki mitokondria yang banyak, retikulum endoplasma, lisosom, vakuola, serta badan Golgi yang berkembang baik dan mengitari inti sel. Struktur tersebut mengindikasikan bahwa osteoklas dengan aktif mensintesis protein, produksi energi, dan menghasilkan enzim lisosom (Nakamura 2007).
Kultur Sel In Vitro
Kultur in vitro didefinisikan sebagai teknik untuk menumbuhkan dan memelihara jaringan atau sel-sel dari organisme multiseluler di luar tubuh pada wadah khusus dengan kondisi lingkungan menyerupai kondisi tubuh. Beberapa hal yang perlu disesuaikan dengan kondisi tubuh, yaitu temperatur, kelembaban, nutrisi, dan kondisi bebas kontaminan (Butler 2004). Pemeliharaan kultur in vitro dilakukan pada lingkungan steril, temperatur 37 °C, kadar CO2 5%, dan pada pH 7.2-7.4 (optimal) (Freshney 1986). Kultur sel asal hewan memiliki beberapa tujuan, antara lain: mengetahui fisiologi normal, proses biokimia atau metabolisme sel,
4
menguji pengaruh senyawa kimiawi atau obat pada tipe sel yang spesifik, dan lain-lain (Butler 2004).
Keberhasilan suatu kultur in vitro ditentukan oleh komponen-komponen utama seperti medium, serum, antibiotik, dan faktor pertumbuhan (Halim et al. 2010). Medium berperan untuk menciptakan kondisi lingkungan dengan pH, tekanan osmotik, dan faktor pendukung lain yang dapat membantu pertumbuhan sel untuk tumbuh dan berkembang secara optimal. Tingkat keasaman medium in vitro diatur oleh sistem bufer, yaitu gas CO2 di inkubator dan ion bikarbonat yang ditambahkan ke dalam medium. Serum yang ditambahkan dalam medium kultur memiliki fungsi utama sebagai faktor hormonal yang menstimulasi pertumbahan sel, menyediakan biomatriks yang mendukung perlekatan sel, mineral, lipid, dan lain-lain (Freshney 1986). Antibiotik dibutuhkan untuk menghindari kontaminasi mikroorganisme yang dapat mengganggu pertumbuhan dan perkembangan sel. Faktor pertumbuhan dapat ditambahkan untuk menginduksi pertumbuhan, mempertahankan proliferasi, dan mennginduksi proses diferensiasi (Halim et al. 2010). Faktor pertumbuhan yang umum ditambahkan dalam medium kultur in vitro adalah insulin yang berperan mendorong sel dalam keberlangsungan metabolisme glukosa dan asam amino. Selain insulin, mineral mikro seperti Se juga diperlukan dalam medium kultur in vitro yang berperan terhadap keberlangsungan proses enzimatis sel atau jaringan yang dikultur (Freshney 1986).
METODE
Waktu dan Tempat
Penelitian ini dilaksanakan pada bulan Januari sampai Juni 2016 di Laboratorium Embriologi, Bagian Anatomi Histologi dan Embriologi, Departemen Anatomi Fisiologi dan Farmakologi, Fakultas Kedokteran Hewan, Institut Pertanian Bogor.
Alat dan Bahan
Alat yang digunakan dalam penelitian ini antara lain gunting bedah, pinset, timbangan digital, mikropipet, inkubator CO2, laminar air flow, mikroskop Olympus Ix70-S8F2 yang dilengkapi dengan kamera tuscen 3.0 MP, cawan petri 30x10 mm (Corning®), cover glass, mikrofilter 0.22 µm, spoit 1 dan 10 mL, gelas ukur, gelas piala, improved haemasitometer Neubaeur, counter, centrifuge swinged-rotor, hot plate, dan vortex.
Bahan yang digunakan antara lain anak tikus (Rattus norvegicus) strain Sprague Dawley (SD) umur lima hari, kolagen kulit ikan patin diperoleh dari penelitian sebelumnya (Hardyanti 2014), gelatin from cold water fish skin (G7041 Sigma, USA), dan collagen from calf skin (C9791 Sigma, USA), Dulbecco’s phosphate buffered saline (DPBS) (21600-051 Gibco, USA), medium kultur dulbecco modified eagle medium (DMEM) (31600-026 Gibco, USA), NaHCO3 (D-6100 Merck, DE), asam amino non-esensial (26K23051 Sigma, USA), gentamycin (Sigma, USA), new born calf serum (NBCS Sigma, USA), insulin transferrin
5 selenium (ITS) (I3145 Sigma, USA), Alizarin red (Merck, DE), alkohol 70%, ketamine (Troy Laboratories Pty Limited, AU) dan xylazin (Troy Laboratories Pty Limited, AU).
Prosedur dan Tahapan Kerja
Rancangan Percobaan dan Analisis Data
Perlakuan terdiri atas tiga kelompok, yaitu gelatin ikan komersial (GI), kolagen sapi komersial (KS), dan kolagen ikan patin (KP) hasil isolasi pada penelitian sebelumnya (Hardyanti 2014). Masing-masing perlakuan dilakukan dengan tiga kali ulangan untuk diameter dan persentase jenis sel, empat kali ulangan untuk population doubling time (PDT). Medium kultur diganti setiap 2 hari sekali dan kultur dilakukan sampai hari ke-7. Parameter yang diamati yaitu tingkat proliferasi, serta persentase dan diameter osteoblas dan osteosit. Analisis data menggunakan ANOVA dan uji lanjut Duncan dengan menggunakan program SPSS Statistics 22.
Persiapan Cawan Petri
Cawan petri dilapisi dengan 1 mL gelatin ikan untuk kelompok pertama (GI), 1 mL kolagen sapi untuk kelompok kedua (KS), dan 1 mL kolagen kulit ikan patin untuk kelompok ketiga (KP) masing-masing dengan konsentrasi 0.1% (b/v). Cawan petri didiamkan selama 1 jam pada suhu ruang, kemudian dibilas menggunakan 1 mL PBS dan didiamkan selama 5 menit hingga kering. Medium kultur mDMEM yang ditambahkan NaHCO3 0.1%, NEAA 0.1%, gentamycin 0.1%, NBCS 10%, dan ITS 0.1% sebanyak 2 mL dimasukkan ke dalam cawan petri selanjutnya diprakondisikan dengan cara diinkubasi dalam inkubator dengan kadar CO2 5% suhu 37 °C.
Isolasi dan Kultur Sel Tulang
Isolasi dan kultur sel tulang menggunakan metode Susana (2014). Anak tikus (Rattus norvegicus) strain Sprague Dawley (SD) umur lima hari dikorbankan dengan cara dianastesi menggunakan sediaan ketamin-xylazin. Euthanasi dengan cara dislokasi servikalis dilakukan setelah tikus teranastesi sempurna. Sel tulang diisolasi dari tulang femur dan tibia. Sumsum tulang dibersihkan dengan cara dibilas dengan PBS. Tulang dikerik menggunakan blade dan disuspensi di dalam PBS yang ditambahkan serum 0.1% (PBS+serum). Suspensi tulang disentrifugasi dengan kecepatan 200 G selama 10 menit. Pencucian dengan cara sentrifugasi dilakukan dengan PBS+serum sebanyak empat kali dan mDMEM satu kali. Jumlah sel dihitung sebelum ditanam menggunakan hemositometer. Sel dengan konsentrasi 3x104 sel/mL dimasukkan ke dalam cawan petri yang berisi 2 mL medium mDMEM dan diinkubasi di dalam inkubator CO2 5% pada suhu 37 °C.
Disosiasi Sel Kultur (Tripsinasi)
Disosiasi merupakan proses pemisahan sel dari sekumpulan sel dan pemisahan sel dengan matriksnya (detachment). Medium mDMEM di dalam cawan petri dibuang, selanjutnya dibilas dengan 2 mL PBS. Sebanyak 2 mL PBS dan 100 µL trypsin 0.1% dimasukkan ke dalam cawan petri, selanjutnya diinkubasi pada suhu 37 °C selama 5-8 menit. Proses tripsinasi dihentikan dengan menambahkan 2
6
mL PBS+serum ke dalam suspensi. Suspensi disentrifugasi dengan kecepatan 200 G selama 10 menit menggunakan PBS+serum sebanyak tiga kali. Sel dihitung menggunakan hemositometer sebagai jumlah sel akhir. Sel yang telah terdisosiasi digunakan untuk perhitungan tingkat proliferasi population doubling time (PDT), pengukuran diameter sel, dan persentase sel.
Pewarnaan Sel Tulang Hasil Kultur
Pewarnaan Alizarin red digunakan untuk mendeteksi deposit kalsium dalam sel (Vater et al. 2011). Sel hasil dari proses tripsinasi diulas di atas object glass kemudian difiksasi menggunakan paraformaldehid 4% pada suhu ruang selama 2 jam. Ulasan dibilas dengan PBS pH 4.2 sebanyak dua kali dan dikeringkan di udara. Sejumlah 200 µL Alizarin red 2% diteteskan di atas ulasan, selanjutnya diinkubasi pada suhu 37 °C selama 1-2 jam. Larutan Alizarin red dibilas dengan PBS pH 4.2 sebanyak dua kali dan dikeringkan di udara. Sel diamati di bawah mikroskop untuk menghitung persentase dan diameter osteoblas dan osteosit.
Evaluasi Hasil Kultur
Penghitungan Tingkat Proliferasi Sel Berdasarkan PDT
Population doubling time (PDT) adalah waktu yang diperlukan oleh populasi sel untuk menjadi jumlah dua kali dari jumlah semula (Davis 2011). Tingkat proliferasi sel dihitung berdasarkan PDT dengan menghitung jumlah sel pada saat awal kultur (H0) dan setelah kultur (H7). Perhitungan jumlah sel awal dan akhir dilakukan menggunakan improved hemositometer Neubauer, dengan rumus:
Jumlah sel (sel/mL) = (jumlah sel pada 5 kotak/5) x faktor pengenceran x 104 Sementara itu, penghitungan PDT dilakukan dengan rumus:
Penghitungan Persentase Osteoblas dan Osteosit
Perhitungan persentase sel dilakukan masing-masing terhadap 100 sel osteoblas dan 100 sel osteosit. Perhitungan dilakukan menggunakan mikroskop dengan perbesaran 10x40. Perhitungan dilakukan terhadap masing-masing kelompok perlakuan sebanyak tiga kali ulangan.
Pengukuran Diameter Osteoblas dan Osteosit
Pengukuran diameter osteoblas dan osteosit dilakukan pada masing-masing 10 osteoblas dan 10 osteosit. Pengukuran diameter dilakukan menggunakan mikroskop dengan lensa okuler yang dilengkapi mikrometer pada perbesaran 10x40. Masing-masing perlakuan dilakukan dengan tiga kali ulangan.
7
HASIL DAN PEMBAHASAN
Tingkat Proliferasi Sel Tulang
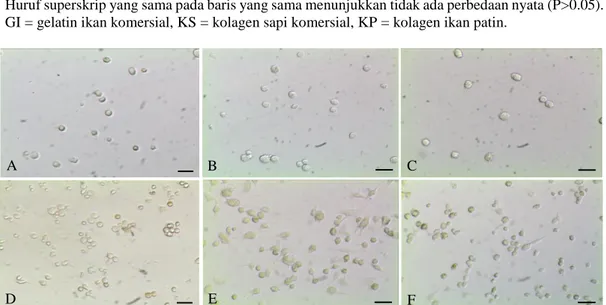
Population doubling time (PDT) adalah waktu yang diperlukan oleh populasi sel untuk mencapai dua kali lipat dari jumlah semula (Davis 2011). Nilai PDT kultur sel tulang tikus pada masing-masing perlakuan matriks ektrsaseluler GI, KS, dan KP tidak berbeda nyata secara berturut-turut adalah 2.48 ± 0.15 hari, 2.28 ± 0.22 hari, dan 2.35 ± 0.16 hari. Kondisi sel tulang dalam kultur in vitro pengamatan pada hari ke-2 dan hari ke-6 menunjukkan pertumbuhan sel yang merata (Gambar 1). Binderman et al. (1974) menyatakan bahwa sel tulang memiliki nilai PDT sekitar 2-4 hari. Nilai PDT pada masing-masing perlakuan disajikan pada Tabel 1.
Tabel 1 Nilai PDT sel tulang tikus hasil kultur pada berbagai jenis matriks ektraseluler
Ulangan Population doubling time (PDT) (hari)
GI KS KP 1 2.56 2.56 2.34 2 2.56 2.34 2.56 3 2.56 2.05 2.34 4 2.26 2.17 2.17 Rata-rata 2.48 ± 0.15a 2.28 ± 0.22a 2.35 ± 0.16a
Huruf superskrip yang sama pada baris yang sama menunjukkan tidak ada perbedaan nyata (P>0.05). GI = gelatin ikan komersial, KS = kolagen sapi komersial, KP = kolagen ikan patin.
Gambar 1 Sel tulang tikus yang dikultur secara in vitro pada berbagai matriks ekstraseluler. Pengamatan kultur pada hari ke-2 pada GI (A), KS (B), dan KP (C). Pengamatan kultur pada hari ke-6 pada GI (D), KS (E), dan KP (F). GI = gelatin ikan komersial, KS = kolagen sapi komersial, KP = kolagen ikan patin. Bar = 30 µm
Nilai PDT kultur sel tulang tikus pada ketiga perlakuan matriks ekstraseluler menunjukkan tidak ada perbedaan yang nyata (P>0.05). Nilai PDT yang semakin kecil menandakan proliferasi sel terjadi semakin cepat. Perlakuan KP menunjukkan nilai PDT tidak berbeda nyata dibandingkan dengan GI dan KS. Hal ini membuktikan bahwa penggunaan kolagen patin sebagai matriks ekstraseluler dapat
E F
B
A C
8
meningkatkan kecepatan proliferasi sel tulang sama baiknya dengan kolagen atau gelatin komersial. Sel tulang yang memiliki kemampuan berproliferasi adalah osteoblas karena osteoblas merupakan sel yang berasal dari mesenchymal stem cells (MSCs) dan memiliki kemampuan berproliferasi dan berdiferensiasi (Florencio-Silva et al. 2015).
Beberapa faktor yang dapat meningkatkan proliferasi osteoblas antara lain jenis medium kultur dan suplemen yang digunakan termasuk penggunaan matriks ekstraseluler. Penambahan insulin-like growth factor 1 (IGF-1) dalam kultur sel tulang seperti yang dilaporkan oleh Zhang et al. (2012) dapat meningkatkan proliferasi osteoblas melalui jalur Akt dan MAP kinase. IGF-1 juga meningkatkan sintesis kolagen tipe I dan menghambat degradasi kolagen pada diferensiasi osteoblas. Medium kultur mDMEM pada penelitian ini diberi suplemen ITS (insulin transferrin selenium) dimana insulin dalam ITS memiliki peran meningkatkan proliferasi dan diferensiasi sel. Yang et al. (2010) menyatakan bahwa insulin meningkatkan proliferasi sel melalui jalur Erk-1/2 dan PI3K. Menurut Guo et al. (2013), di dalam matriks ekstraseluler yang digunakan dalam kultur terdapat faktor pertumbuhan, salah satunya BMP (bone morphogenic protein) yang berperan dalam meningkatkan proliferasi osteoblas.
Identifikasi Jenis-jenis Sel Tulang
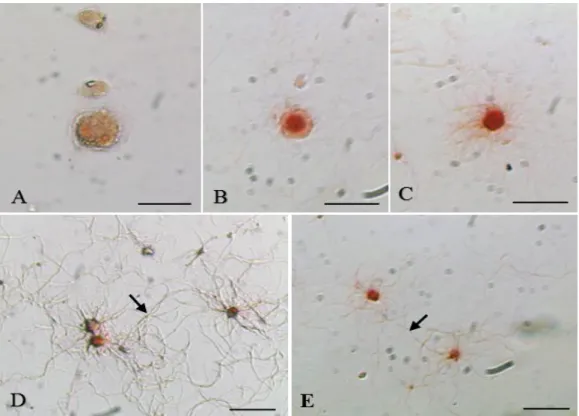
Perbedaan morfologi sel-sel tulang hasil kultur diamati dengan mikroskop cahaya menggunakan pewarnaan Alizarin red. Pewarnaan ini mendeteksi deposit kalsium atau proses mineralisasi oleh sel tulang. Sel tulang yang menghasilkan kalsium akan tampak berwarna merah (Vater et al. 2011; Liu et al. 2014), sehingga osteosit akan mengambil warna lebih merah dibanding osteoblas. Dengan demikian, osteoblas dan osteosit dapat dibedakan dari segi warna, bentuk, dan ukuran (Gambar 2).
Osteoblas muda menyerap sedikit warna merah dibandingkan dengan osteoblas matang (Gambar 2A). Osteoblas muda merupakan sel tulang yang menunjukkan aktivitas alkalin fosfatase (ALP) menuju tahap osteoblas matang (Capulli et al. 2014). Vater et al. (2011) menyatakan bahwa pewarnaan Alizarin red bersifat asam, sehingga keberadaan ALP yang bersifat alkali menyebabkan osteoblas muda sedikit menyerap warna merah. Osteoblas dalam keadaan aktif berbentuk bulat dan dalam keadaan tidak aktif berbentuk pipih. Osteoblas yang aktif memiliki retikulum endoplasma yang besar, kompleks aparatus golgi, dan vakuola yang tersusun atas struktur fibril yang menghasilkan prakolagen serta proteoglikan (Florencio-Silva et al. 2015).
Osteoblas matang merupakan fase transisi osteoblas sebelum berdiferensiasi menjadi osteosit. Gambar 2B menunjukkan bahwa osteoblas matang menyerap lebih banyak warna merah dibandingkan osteoblas muda. Hal ini karena pewarnaan Alizarin red dapat mendeteksi osteocalcin (OCN) yang merupakan salah satu komponen dari mineralisasi sel tulang. Hu et al. (2005) menyatakan bahwa pematangan osteoblas ditandai dengan meningkatnya sintesis kolagen tipe I, gen Osx, dan sintesis protein matriks tulang seperti OCN. Osteoblas matang memiliki banyak retikulum endoplasma dan kompleks badan Golgi. Osteoblas pada tahap ini akan berdiferensiasi menjadi osteosit atau mengalami apoptosis (Jilka et al. 1998).
9
Gambar 2 Morfologi sel tulang tikus hasil kultur yang diwarnai dengan pewarnaan Alizarin red. (A) Osteoblas muda, (B) Osteoblas matang, (C) Osteoid osteosit, (D) Osteosit muda, (E) Osteosit tua. Kanalikuli (tanda panah). Bar = 30 µm
Diferensiasi osteoblas menjadi osteosit melalui beberapa tahapan, yaitu osteoid osteosit, pra-osteosit, osteosit muda, dan osteosit matang atau tua (apoptosis) (Franz-Odendaal et al. 2006). Osteoid osteosit (Gambar 2C) merupakan sel transisi perubahan dari osteoblas menjadi osteosit (Dallas dan Bonewald 2015). Keberadaan osteoid osteosit diregulasi oleh osteoblas. Jumlah osteoid osteosit erat kaitannya dengan aktivitas osteoblas. Osteosit akan melekat pada lakuna dan memiliki jumlah yang paling banyak dibandingkan sel tulang yang lain. Osteosit memiliki penjuluran sitoplasma yang disebut kanalikuli. Kanalikuli merupakan dendritik dari sitoplasma osteosit yang menghubungkan antar lakuna dan antar sitoplasma osteosit. Osteosit muda memiliki diameter yang lebih besar dan kanalikuli yang lebih banyak dari osteosit tua (Gambar 2D) (Nakamura 2007). Kanalikuli penting sebagai jalur suplai nutrisi dan oksigen dari kapiler darah menuju osteosit. Osteosit tua (Gambar 2E) memiliki sedikit kanalikuli dan ukuran selnya lebih kecil dari osteosit muda (Susana 2014).
Persentase Jenis-jenis Sel Tulang Sebelum dan Setelah Kultur
Jumlah dan diameter sel dapat menggambarkan terjadinya proliferasi dan diferensiasi sel. Beberapa faktor yang dapat menimbulkan ekspresi dari sifat suatu sel dalam kultur antara lain medium kultur yang digunakan, waktu kultur, dan penambahan komponen yang dapat menginduksi proliferasi dan diferensiasi sel.
10
Komponen tersebut dapat berupa hormon atau suplemen yang ditambahkan ke dalam medium kultur (Halim et al. 2010).
Persentase jenis-jenis sel tulang pada kondisi sebelum kultur mencerminkan proporsi sel in vivo, sebaliknya persentase jenis-jenis sel tulang in vitro menunjukkan jenis sel yang mengalami proliferasi dan atau diferensiasi. Persentase osteoblas maupun osteosit sebelum dan setelah kultur menunjukkan perbedaan yang nyata (P<0.05), tetapi persentase pada ketiga perlakuan setalah kultur in vitro tidak berbeda nyata. Persentase osteoblas dan osteosit sebelum dan setelah kultur secara lengkap disajikan pada Tabel 2. Persentase osteoblas pada kondisi in vivo (sebelum kultur) memiliki nilai yang sangat rendah dari osteosit, yaitu 7.40 ± 4.76%. Hasil ini sesuai dengan pernyataan Florencio-Silva et al. (2015) bahwa osteoblas memiliki jumlah 4-6% dari total komponen sel tulang.
Tabel 2 Persentase osteoblas dan osteosit sebelum dan setelah kultur Ulangan Sebelum Kultur Setelah Kultur GI KS KP Osteoblas (%) 1 12.82 76.32 73.40 73.17 2 5.46 72.55 73.87 73.28 3 3.91 71.43 70.73 71.96 Rata-rata 7.40 ± 4.76a 73.43 ± 2.56b 72.67 ± 1.70b 72.80 ± 0.73b Osteosit (%) 1 87.18 23.68 26.60 26.83 2 94.54 27.45 26.13 26.72 3 96.09 28.57 29.27 28.04 Rata-rata 92.60 ± 4.76b 26.57 ± 2.56a 27.33 ± 1.70a 27.20 ± 0.73a
Huruf superskrip yang berbeda pada baris yang sama menunjukkan adanya perbedaan yang nyata (P<0.05). GI = gelatin ikan komersial, KS = kolagen sapi komersial, KP = kolagen ikan patin.
Persentase osteosit pada kultur in vitro menunjukkan perbedaan yang nyata dengan kondisi in vivo (P<0.05), tetapi persentase pada ketiga perlakuan secara in vitro tidak menunjukkan perbedaan yang nyata. Persentase osteosit secara in vivo memiliki nilai sangat tinggi dari osteoblas, yaitu 92.60 ± 4.76%. Hasil ini sesuai dengan pernyataan Florencio-Silva et al. (2015) bahwa osteosit merupakan sel utama penyusun tulang dengan jumlah 90-95%.
Peningkatan jumlah osteoblas pada kultur in vitro menunjukkan bahwa kemungkinan hanya osteoblas yang mengalami proliferasi. Penurunan persentase osteosit setelah kultur menunjukkan bahwa osteosit memiliki jumlah yang tetap atau tidak berproliferasi, serta tidak terdapat indikasi yang menunjukkan diferensiasi dari osteoblas menjadi osteosit. Hasil ini sesuai dengan yang dilaporkan oleh Kalajzic et al. (2013) bahwa osteosit merupakan sel tulang yang tidak aktif bermitosis dan merupakan hasil akhir dari diferensiasi osteoblas (Florencio-Silva et al. 2015). Tidak adanya perbedaan yang nyata pada persentase osteoblas dari ketiga perlakuan menunjukkan ketiga jenis matriks ekstraseluler memiliki kemampuan yang sama di dalam menunjang proliferasi sel in vitro.
Diameter Osteoblas dan Osteosit
Nilai diameter osteoblas dan osteosit hasil kultur pada berbagai matriks ekstraseluler secara lengkap disajikan pada Tabel 3. Diameter osteoblas dalam kultur in vitro sel tulang tikus pada perlakuan KS berbeda secara nyata dengan
11 perlakuan GI dan KP (P<0.05). Nilai diameter tersebut masih berada dalam kisaran normal diameter osteoblas, yaitu 20-30 µm (Kierszenbaum 2002).
Tabel 3 Diameter osteoblas dan osteosit pada kultur sel tulang tikus pada berbagai jenis matriks ektraseluler
Ulangan GI KS KP Diameter Osteoblas (µm) 1 24.73 27.24 24.01 2 24.79 27.41 24.55 3 24.06 26.13 25.12 Rata-rata 24.52 ± 0.41a 26.93 ± 0.69b 24.56 ± 0.56a Diameter Osteosit (µm) 1 17.51 19.52 18.27 2 17.62 19.14 18.68 3 17.88 19.14 18.20 Rata-rata 17.67 ± 0.19a 19.27 ± 0.22c 18.38 ± 0.26b
Huruf superskrip yang berbeda pada baris yang sama menunjukkan adanya perbedaan yang nyata (P<0.05). GI = gelatin ikan komersial, KS = kolagen sapi komersial, KP = kolagen ikan patin.
Diameter osteosit pada ketiga perlakuan secara in vitro menunjukkan perbedaan yang nyata (P<0.05). Nilai diameter tersebut masih berada pada kisaran normal diameter osteosit, yaitu 9-20 µm (Kogianni dan Noble 2007). Osteosit merupakan sel akhir dari diferensiasi osteoblas. Proses diferensiasi ditunjukkan dari perubahan diameter osteoblas menjadi osteosit (Djuwita et al. 2012) atau terjadinya perubahan morfologi (Gambar 2) dan penurunan ukuran sel (Susana 2014).
Nilai diameter baik osteoblas maupun osteosit pada perlakuan KP memiliki nilai di antara nilai KS dan GI. Konsisten dengan data pada Tabel 1 dan Tabel 2, data pada Tabel 3 menunjukkan nilai KP juga berada di antara nilai KS dan GI. Hal ini menunjukkan bahwa penggunaan kolagen ikan patin sebagai matriks ektraseluler berpengaruh terhadap diferensiasi osteoblas menjadi osteosit serta dapat mempertahankan nilai diameter osteoblas dan osteosit saat terjadi mineralisasi. Pernyataan ini seperti yang dilaporkan oleh Liu et al. (2014), bahwa penggunaan kolagen sebagai matriks ekstraseluler berpengaruh terhadap diferensiasi osteoblas menajadi osteosit dan mendukung proses mineralisasi.
Berdasarkan nilai PDT, persentase, serta diameter osteoblas dan osteosit diketahui bahwa penggunaan kolagen ikan patin efektif dapat meningkatkan proliferasi dan diferensiasi terhadap sel tulang tikus yang dikultur. Hal ini didukung oleh pernyataan Guo et al. (2013) dan Liu et al. (2014), bahwa penggunaan kolagen sebagai matriks ekstraseluler dapat meningkatkan proliferasi dan menginduksi diferensiasi osteoblas. Kolagen ikan patin diketahui berasal dari kolagen tipe I yang banyak ditemukan di jaringan ikat seperti kulit, tulang, dan tendo (Singh et al. 2011; Hardyanti 2014). Kolagen kulit ikan memiliki jenis yang sama dengan kolagen kulit mamalia, yaitu kolagen tipe I yang banyak dijadikan matriks ekstraseluler dalam kultur jaringan (Pati et al. 2010).
Sel dalam kultur in vitro untuk dapat tumbuh memerlukan substrat sebagai tempat perlekatan. Salah satu substrat yang sering digunakan, yaitu kolagen dan gelatin. Sel akan mendapat sinyal dari fibronektin yang berada dalam medium kultur kemudian adanya gravitasi akan menempel pada matriks ektraseluler (Freshney 1986). Hidroksiprolin dan glisina merupakan asam amino dalam jumlah besar pada kolagen yang berperan menjaga stabilitas kolagen. Kolagen diketahui memiliki efek terhadap karakteristik pertumbuhan sel, serta memodulasi sifat sel
12
seperti adhesi, proliferasi dan diferensiasi (Yamada et al. 2014). Kim et al. (2011) melaporkan bahwa kolagen sebagai matriks ekstraseluler mendukung pertumbuhan sel karena kolagen merupakan media yang baik dalam pengikatan protein, reseptor sel, dan memediasi transfer faktor pertumbuhan antar sel. Osteoblas dalam perkembangannya akan mensintesis prakolagen yang akan berperan dalam proses mineralisasi sel tulang. Bioaktivitas kolagen sebagai ECM memiliki dimensi nanofibril dengan diameter 50-500 nm yang berperan penting dalam perlekatan, proliferasi, dan diferensiasi sel. Struktur kolagen yang berukuran nano ini sangat mendukung pertumbuhan sel dengan baik karena nutrisi dari medium dapat tersuplai dengan optimal ke dalam sel (Guo et al. 2013).
SIMPULAN DAN SARAN
Simpulan
Kolagen dari kulit ikan patin (Pangasius sp.) sebagai matriks ekstraseluler pada kultur sel tulang tikus secara in vitro dapat mempertahankan proliferasi dan diferensiasi sel dengan efektifitas lebih rendah dari kolagen sapi komersial, tetapi lebih baik dari gelatin ikan komersial.
Saran
Perlu diteliti efektivitas kolagen dari kulit ikan patin sebagai matriks ekstraseluler pada kultur in vitro untuk jenis sel yang lain.
DAFTAR PUSTAKA
Ahmad M, Benjakul S, Nalinanon S. 2010. Compositional and physicochemical characteristics of acid solubilized collagen extracted from the skin of unicorn leatherjacket (Aluterus monoceros). Food Hydrocolloids. 24:588-594.
Binderman I, Duksin D, Harell A, Katzir E, Sachs L. 1974. Formation of bone tissue in culture from isolated bone cells. J Cell Biol. 61:427-439.
Butler M. 2004. Animal Cell Culture and Technology. Cornwall (GB): Bios Scientific Publishers.
Capulli M, Paone R, Rucci N. 2014. Osteoblast and osteocyte: games without frontiers. Archives of Biochem and Biophysics. 561:3-12.
Clarke B. 2008. Normal bone anatomy and physiology. Clin J Am Soc Nephrol. 3:131-139.
Dallas SL, Bonewald LF. 2015. Dynamics of the transition from osteoblast to osteocyte. Ann N Y Acad Sci. 1192:437-443.
Davis JM. 2011. Basic Techniques and Media, The Maintenance of Cell Lines and Safety. Di dalam: John MD, editor. Animal Cell Culture Essential Methods. England (GB): John Wiley and Sons Ltd.
13 Djuwita I, Pratiwi IA, Winarto A, Sabri M. 2012. Proliferasi dan diferensiasi sel tulang tikus dalam medium kultur in vitro yang mengandung ekstrak batang Cissus quadrangula Salisb. (sipatah-patah). J Med Vet. 6(2):75-80.
Ferreira AM, Gentile P, Chiono V, Ciardelli G. 2012. Collagen for bone tissue regeneration. Acta Biomaterialia. 8:3191-3200.
Florencio-Silva R, da Silva Sasso GR, Sasso-Cerri E, SimÕes MJ, Cerri PS. 2015. Biology of bone tissue: structure, function, and factors that influence bone cells. BioMed Research Intern. 1-17.
Franz-Odendaal TA, Hall BK, Witten PE. 2006. Buried alive: how osteoblas become osteocytes. Developmental Dynamics. 235(1):176-190.
Freshney RI. 1986. Animal Cell Culture. Glasgow (UK): IRL Press.
Guo Y, Zeng Q, Yan Y, Shen L, Liu L, Li R, Zhang X, Wu J, Guan J, Huang S. 2013. Proliferative effect and osteoinductive potential of extracellular matrix coated on cell culture plates. SpringerPlus. 2(303):1-10.
Halim D, Murti H, Sandra F, Boediono A, Djuwantono T, Setiawan B.2010. Stem Cell: Dasar Teori dan Aplikasi Klinis. Jakarta (ID): Erlangga.
Hardyanti SK. 2014. Isolasi kolagen dari kulit ikan patin (Pangasius sp.) [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Hintze V, Miron A, Mӧller S, Schnabelrauch M, Heinemann S, Worch H, Scharnweber D. 2012. Artificial extracellular matrices of collagen and sulphated hyaluronan enhance the differentiation of human mesenchymal stem cells in the presense of dexamethasone. J Tissue Eng Regen Med. 1-11.
Hu H, Hilton MJ, Tu X, Yu K, Ornitz DM, Long F. 2005. Sequential roles of Hedgehog and Wnt signaling in osteoblast development. Development. 132(1):49-60.
Iqbal M, Anam C, Achmad RA. 2015. Optimasi rendemen dan kekuatan gel gelatin ekstrak tulang ikan lele dumbo (Clarias gariepinu sp). J Teknosains Pangan. 4(4):3-10.
Jilka RL, Weinstein RS, Bellido T, Parfitt AM, Manolagas SC. 1998. Osteoblast programmed cell death (apoptosis): modulation by growth factors and cytokines. J of Bone and Mineral Research. 13(5):793-802.
Kalajzic I, Matthews BG, Torreggiani E, Harris MA, Pajevic PD, Harris SE. 2013. In vitro and in vivo approaches to study osteocyte biology. Bone. 296-306. Kierszenbaum AL. 2002. Histology and Cell Biology: An Introduction to Pathology.
St. Louis (US): Mosby, Inc. An Affiliate of Elsevier.
Kim SH, Turnbull J, Guimond S. 2011. Extracellular matrix and cell signalling: the dynamic cooperation of integrin, proteoglycan and growth factor receptor. J of Endocrinology. 209:139-151.
Kleinman HK, Klebe RJ, Martin GR. 1981. Role of collagen matrices in the adhesion and growth of cells. The J of Cell Biol. 88:473-485.
Kogianni G, Noble BS. 2007. The biology of osteocytes. J Med Group LLC. 5:81-86.
Liu D, Nikoo M, Boran G, Zhou P, Regenstein JM. 2015. Collagen and gelatin. Annu Rev Food Sci Technol. 6:527-557.
Liu JL, Zhang B, Song SJ, Ma M, Si SY, Wang YH, Xu BX, Feng K, Wu JG, Guo YC. 2014. Bovine collagen peptides compounds promote the proliferation and differentiation of MC3T3-E1 pre-osteoblasts. PLOS ONE. 9(6):1-6.
14
Nakamura H. 2007. Morphology, function, and differentiation of bone cells. J Hard Tissue Biol. 16(1):15-22.
Parenteau-Bareil R, Gauvin R, Berthod F. 2010. Collagen-based biomaterials for tissue engineering application. Materials. 3:1863-1887.
Pati F, Adhikari B, Dhara S. 2010. Isolation and characterization of fish scale collagen of higher thermal stability. Bioresource Tech. 101:3737-3742.
Silvipriya KS, Kumar KK, Bhat AR, Kumar BD, John A, Laksmanan P. 2015. Collagen: animal sources and biomedical application. J of App Pharmaceutical Sci. 5(3):123-127.
Singh P, Benjakul S, Maqsood S, Kishimura H. 2011. Isolation and characterisation of collagen extracted from the skin of striped catfish (Pangasianodon hypophthalmus). Food Chem. 124:97-105.
Suryaningrum TD. 2008. Ikan patin: peluang ekspor, penanganan pascapanen, dan diversifikasi produk olahannya. Squalen. 3(1):16-23.
Susana F. 2014. Pemberian ekstrak jintan hitam (Nigella sativa) pada kultur in vitro sel tulang tikus (Rattus norvegicus) [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Trappmann B, Gautrot JE, Connelly JT, Strange DGT, Li Y, Oyen ML, Stuart MAC, Boehm H, Li B, Vogel V et al. 2012. Extracellular-matrix tehering regulates stem-cell fate. Nature Materials. 11:642-649.
Vater C, Kasten P, Stiehler M. 2011. Culture media for the differentiation of mesenchymal stromal cells. Acta Biomaterial. 7:463-477.
Yamada S, Yamamoto K, Ikeda T, Yanagiguchi K, Hayashi Y. 2014. Potency of fish collagen as a scaffold for regenerative medicine. BioMed Research International. 1-8.
Yang J, Zhang X, Wang W, Liu J. 2010. Insulin stimulates osteoblast proliferation and differentiation through ERK and PI3K in MG-63 cells. Cell Biochem Funct. 28:334-341.
Zhang W, Shen X, Wan C, Zhao Q, Zhang L, Zhou Q, Deng L. 2012. Effects of insulin and insuline-like growth factor 1 on osteoblast proliferation and differentiation: differential signalling via Akt and ERK. Cell Biochem Funct. 30(4):297-302.
15 Lampiran 1 Komposisi asam amino pada kolagen sapi dan kolagen Pangasianodon
hypophthalmus
Sumber: *Singh et al. (2011), **Ahmad et al. (2010) Asam amino Residu/1000
Kolagen Pangasianodon hypophthalmus (*) Kolagen sapi (**)
Asparagina 46 45 Treonina 24 18 Serina 37 33 Glutamina 80 75 Glisina 309 330 Alanina 116 119 Sisteina 0 0 Valina 23 21 Metionina 10 6 Isoleusina 14 11 Leusina 26 23 Tirosina 5 3 Fenilalanina 13 3 Hidroksilisin 5 7 Lisina 27 26 Histidina 4 5 Arginina 54 50 Triptofan 0 3 Hidroksiprolin 86 94 Prolina 120 121 Imino acid 206 215
16
RIWAYAT HIDUP
Penulis dilahirkan di Desa Seminar Salit Kecamatan Brang Rea Kabupaten Sumbawa Barat, Nusa Tenggara Barat pada 10 Oktober 1994. Penulis merupakan anak ketiga dari empat bersaudara dari Bapak Mangandar dan Ibu Khadijah. Jenjang pendidikan formal dari sekolah dasar (SD) sampai sekolah menengah atas (SMA) telah ditempuh di Kabupaten Sumbawa Barat. Penulis lulus tahun 2006 dari SDN Senayan, lulus tahun 2009 dari SMPN 1 Seteluk, dan lulus tahun 2012 dari SMAN 1 Poto Tano. Penulis melanjutkan pendidikan ke perguruan tinggi dan diterima di program studi strata satu (S1) kedokteran hewan Fakultas Kedokteran Hewan (FKH) IPB melalui jalur Beasiswa Utusan Daerah (BUD) pada tahun 2012.
Selama menjadi mahasiswa, penulis aktif dalam kegiatan organisasi Himpunan Profesi Ruminansia divisi kewirausahaan tahun kepengurusan 2014/2015, Pengurus Cabang Ikatan Mahasiswa Kedokteran Hewan Indonesia IPB (PC IMAKAHI IPB) sebagai ketua divisi informasi dan komunikasi tahun kepengurusan 2015/2016, Pengurus Besar Ikatan Mahasiswa Kedokteran Hewan Indonesia (PB IMAKAHI) departemen usaha dan keuangan tahun kepengurusan 2015/2016. Penulis berkesempatan menjadi asisten praktikum pada mata kuliah Embriologi Genetika Perkembangan, Anatomi Veteriner I, dan Anatomi Veteriner II. Tahun 2015 mengikuti program kreativitas mahasiswa (PKM) bidang penelitian dan didanai oleh DIKTI. Penulis berkesempatan mengikuti pemilihan mahasiswa berprestasi tingkat Fakultas Kedokteran Hewan Institut Pertanian Bogor pada tahun 2016 dan meraih peringkat keempat.