OPTIMASI TRANSFORMASI GEN
GUS
KE JARINGAN
TANAMAN KACANG TANAH DENGAN BANTUAN
AGROBACTERIUM
Sholeh Avivi1), Sudarsono2), Satriyas Ilyas2), dan Hajrial Aswidinnoor2)
ABSTRACT
The aims of this research were: (1) to investigate the minimum concentration of kanamycin antibiotic that could stop regeneration of peanut normal cell; (2) to know the effect of the most effective bacteria population, the best time periode of inoculation, the best time time periode of cocultivation, the explant type, and the best time periode of preculture to optimize the Agrobacterium mediated transformation on peanut. We used pKIWI105 (gus and nptII gene inside) to achieve those objectives. To know that the gene have been integrated inside the peanut explant we used transient assay and integrative assay. From this study we concluded that the best result of transformation system could obtain if we used 49 dap (days after planting) embryonic callus as explants, 15 minute inoculation, 24 hours cocultivation, and the bacteria concentration was OD600 = 0.5. The lowest kanamycin concentration that could stop cell regeneration was 100 mg L-1.
Key words: Agrobacterium, gus, nptII, peanut
1) Staf Pengajar Jurusan Budidaya Pertanian, Fakultas Pertanian Universitas Jember, Jl. Kalimantan, Jember 68121, e-mail: avi_vi@yahoo.com
ABSTRAK
Tujuan penelitian ini adalah untuk: (i) menemukan konsentrasi minimal antibiotik kanamycin yang dapat menghentikan pertumbuhan sel kacang tanah normal; (ii) untuk mengetahui pengaruh tingkat populasi bakteri, lama waktu inokulasi, lama waktu kokultivasi, tipe eksplan, dan lama waktu prekultur untuk mengoptimalkan transformasi gen dengan bantuan Agrobacterium pada kacang tanah. Gen gus yang berada dalam plasmid pKIWI105 bersama-sama dengan gen resistensi terhadap antibiotik kanamycin digunakan untuk mencapai tujuan tersebut. Keberhasilan introduksi gen dianalisis pada saat dua hari sesudah inokulasi (transient assay) dan pada beberapa percobaan dilakukan pula integrative assay. Hasil terbaik integrasi gen gus pada kacang tanah dalam penelitian ini diperoleh jika digunakan kalus embriogenik umur 49 HST sebagai eksplan dengan lama waktu inokulasi 15 menit, lama waktu kokultivasi 24 jam, dan konsentrasi bakteri OD600 = 0,5. Konsentrasi kanamycin terendah yang sangat menghambat regenerasi sel nontransgenik tanaman kacang tanah adalah 100 mg L-1.
Kata kunci: Agrobacterium, gus, nptII, kacang tanah
PENDAHULUAN
Setelah sistem regenerasi tanaman yang efektif secara in vitro ditemukan maka tahap berikutnya yang harus dilakukan untuk dapat memperoleh tanaman transgenik adalah introduksi DNA asing ke sel tanaman. Setelah gen dapat terintroduksi ke dalam sel tanaman, sel tersebut perlu ditumbuhkan dalam media seleksi yang mengandung antibiotik. Konsentrasi yang tepat dari antibiotik penyeleksi ini perlu diketahui. Pada umumnya konsentrasi yang digunakan adalah konsentrasi paling rendah yang dapat mematikan sel nontransgenik. Pada tingkat konsentrasi ini, sel tanaman transgenik akan tetap hidup dan beregenerasi dengan normal.
Untuk mengintroduksi DNA asing ke dalam sel tanaman, berbagai teknik dan metode telah dilakukan orang, di antaranya adalah transformasi dengan bantuan
Agrobacterium, particle bombardment, memasukkan DNA secara langsung ke dalam sel tanaman dengan sonikasi atau kejutan listrik, dan dengan cara mikroinjeksi DNA. Walaupun demikian, hingga saat ini terdapat dua metode yang paling banyak digunakan yaitu metode bombardment dan Agrobacterium.
Transformasi gen pada tanaman dengan bantuan Agrobacterium sendiri
transformasi dengan bantuan Agrobacterium telah berkembang cukup baik umumnya pada tanaman dikotil walaupun ada beberapa peneliti telah berhasil melakukan transfer gen dengan bantuan Agrobacterium pada tanaman monokotil seperti padi dan jagung (Hiei, Komari, dan Kubo 1997).
Beberapa faktor yang telah dilaporkan dapat mempengaruhi efisiensi transformasi dengan bantuan Agrobacterium di antaranya adalah: (i) senyawa inducer, seperti acetosyringone, hidroksi acetosyringone, thiamine, beberapa monosakarida, alkysyringamides, dan NaCl (Shetty et al. 1997; Raghothama, et al. 1997; Lee, Marimoto, & William 1997); (ii) konsentrasi relatif bakteri, diukur dengan spektrofotometer pada panjang gelombang λ = 600, yang sering disebut OD600 (optical density yang diukur pada panjang gelombang λ = 600) (Rakousky, et al. 1998); (iii) lamanya waktu inokulasi; (iv) lamanya waktu kokultivasi; (v) kondisi prekultur eksplan yang akan ditransfer dengan Agrobacterium; (vi) perubahan pH dan gula-gula dalam larutan seperti asam galakturonat, pektin dan sebagainya.
Dalam percobaan ini, berbagai faktor yang mempengaruhi keberhasilan introduksi gen ke jaringan kacang tanah dengan bantuan Agrobacterium akan dibakukan. Faktor yang akan diteliti meliputi: metode regenerasi tanaman transgenik yang digunakan, konsentrasi bakteri yang optimum, lama waktu inokulasi, lama waktu kokultivasi, lama waktu prekultur, dan jenis eksplan yang tepat untuk target
inokulasi.
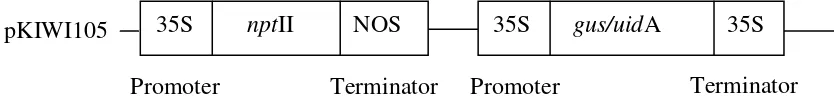
Untuk mempercepat pembakuan metode tersebut, dalam percobaan ini akan digunakan gen marker nptII dengan gen gus (pKIWI105; Gambar 1) dan keberhasilan introduksi gennya akan dianalisis dengan menggunakan teknik
transsient assay. Pada beberapa percobaan juga dilakukan analisis integrative assay. Gen marker tersebut digunakan mengingat ekspresi dari gen marker ini akan dengan mudah dideteksi. Dengan demikian, keberhasilan introduksi gen dengan menggunakan suatu metode baku tertentu akan dapat dengan cepat diketahui.
pKIWI105
Gambar 1. Skema dari Plasmid pKIWI105 yang digunakan dalam percobaan
Promoter Terminator
Terminator Promoter
BAHAN DAN METODE
Penelitian ini dilakukan di Laboratorium Biologi Molekuler Tanaman dan di fasilitas kebun, jurusan Budidaya Pertanian, Fakultas Pertanian IPB. Penelitian mulai dilakukan sejak bulan Januari 1997 sampai dengan bulan Desember 1999.
Metode penelitian yang dilakukan adalah: Preparasi eksplan, sterilisasi bici kacang tanah, dan protokol induksi embrio somatik; Persiapan kultur bakteri; Persiapan eksplan dan inokulasi standar; Percobaan pengaruh antibiotik kanamycin terhadap efisiensi regenerasi tanaman; Percobaan untuk menentukan konsentrasi bakteri yang optimum; Percobaan untuk menentukan lama waktu inokulasi yang optimum; Percobaan untuk menentukan lama waktu kokultivasi yang optimum; Percobaan untuk menentukan lama prekutur yang optimum; Percobaan untuk menentukan jenis eksplan yang terbaik; dan Analisis embrio transgenik dengan PCR.
Preparasi eksplan, sterilisasi, dan protokol induksi embrio somatik. Sebanyak tiga macam eksplan digunakan dalam penelitian ini yaitu leaflet, poros embrio tanpa radikel, dan poros embrio tanpa radikel tanpa leaflet. Ketiga eksplan diambil dari biji kacang tanah kultivar Gajah setelah disterilisasi.
Sebanyak 50-75 biji dalam wadah 1000 ml disterilkan dengan cara mencuci
biji-biji tersebut dengan 1000 ml larutan yang mengandung 1% (w/v) chlorine (NaClO) dan 5-7 tetes Tween-20 selama 5-7 menit dikocok (100 rpm). Kemudian dibilas sebanyak 4 kali dengan 1000 ml air steril. Bagian poros embrio dipisahkan dan disterilisasi selama 5 menit dengan 1 % (w/v) larutan dichloroisocyanuric acid (50 poros embrio/500 ml larutan) kemudian dibilas dengan air steril 3 kali.
Eksplan ditanam pada media MS16 [media dan vitamin MSO (Murashige and
Skoog), 2% (w/v) sukrosa, 0.8% (w/v) agar, dan 16 µM L-1 picloram (sigma)],
selanjutnya eksplan disubkultur pada media yang sama pada suhu 280C tanpa cahaya. Subkultur dilakukan setiap 2 minggu sekali. Media MS16 ini digunakan sebagai media dasar dalam setiap percobaan yang dilakukan.
sebulan. Kemudian dipindah ke media MS10 [media dan vitamin MSO, 2% (w/v) sukrosa, 0.8% (w/v) agar, dan 10 mg/L BAP) hingga terbentuk tanaman kacang tanah (planlet setinggi 2-4 cm). Tahap selanjutnya tanaman dipindah ke media perakaran MSOR [media dan vitamin MSO, 2 % (w/v) sukrosa, 0.8% (w/v) agar, dan NAA 1 mg L-1].
Persiapan kultur bakteri. Agrobacterium dari stok glycerol atau stok LA dicawankan dalam media LA yang mengandung antibiotik 100 mg/l spectinomicin dan 20 mg L-1 rifampicin selama 2 hari pada suhu 280C. Sebanyak 5-7 koloni tunggal yang terbentuk diinokulasikan ke media LB 30 ml (sebagai kultur awal) dan ditumbuhkan selama 24 jam pada suhu 280C dengan dikocok pada kecepatan 100
rpm. Kemudian sebanyak 200 µl dari kultur awal tersebut diinokulasikan pada media
LB sebanyak 100 ml (sebagai kultur yang akan dipanen bakterinya) dan ditumbuhkan selama 15-20 jam pada suhu 280C dengan dikocok pada kecepatan 100 rpm.
Panen bakteri dilakukan dengan cara mensentrifugasi suspensi bakteri yang berasal dari kultur LB 100 ml pada 6000 rpm, selama 15 menit, dan suhu 40C. Supernatan dibuang dan dikeringkan dengan kertas tissue selama 1 menit (harus dijaga agar jangan sampai pelet keluar). Resuspensi pelet dilakukan dengan cara menambahkan media regenerasi dari eksplan yang akan diinokulasi dengan
Agrobacterium. Sentrifugasi dan pengeringan dilakukan lagi seperti tahap sebelumnya, kemudian resuspensi dilakukan kembali dengan media regenerasi sebanyak 10 ml. Kultur diukur absorbannya dan ditera hingga mencapai nilai OD600 = 1 atau disesuaikan dengan perlakuan.
Persiapan eksplan dan inokulasi standar. Eksplan diiris dengan pisau skalpel hingga berukuran 0.5 – 1 mm, kemudian diinokulasi dengan Agrobacterium
selama 10 menit (atau sesuai perlakuan). Periode kokultivasi dilakukan selama satu hari (atau sesuai perlakuan). Eksplan kemudian dipindah ke media yang mengandung antibiotik cefotaxim 300 mg L-1 selama lima hari. Setelah itu eksplan ditanam dalam media seleksi (MS16 + cefotaxim 300 mg L-1 + kanamycin 100 mg L-1). Setiap 3 minggu sekali disubkultur hingga muncul tunas yang diduga transgenik.
terhadap jumlah eksplan yang ditanam, jumlah eksplan yang tertranformasi, dan persentase sel/jaringan yang tertransformasi.
Percobaan pengaruh antibiotik kanamycin terhadap efisiensi regenerasi tanaman. Percobaan ini bertujuan untuk mengetahui pengaruh antibiotik kanamycin terhadap efisiensi regenerasi tanaman kacang tanah dalam media regenerasi. Percobaan ini menggunakan rancangan acak lengkap (RAL) faktorial yang dilakukan dengan cara mengkombinasikan 2 faktor yaitu konsentrasi antibiotik kanamycin dan konsentrasi picloram. Konsentrasi antibiotik yang digunakan terdiri atas taraf yaitu: 0, 50 100, 150, 200, dan 250 mg L-1, sedangkan konsentrasi picloram yang digunakan 3 taraf yaitu 8, 12, dan 16 µM L-1. Eksplan yang digunakan adalah 100 pada masing-masing perlakuan. Pengamatan dilakukan terhadap jumlah eksplan yang mampu membentuk kalus embriogenik dan jumlah embrio pereksplan.
Percobaan untuk menentukan konsentrasi bakteri yang optimum. Percobaan ini bertujuan untuk menentukan konsentrasi bakteri yang optimum untuk menghasilkan introduksi gen yang paling maksimal ke jaringan kacang tanah. Konsentrasi optimum akan ditentukan berdasarkan ekspresi transien yang paling tinggi pada jaringan yang diuji, kerusakan jaringan yang paling ringan, dan keberhasilan dalam membebaskan jaringan dari kontaminasi Agrobacterium setelah introduksi gen berhasil dilakukan.
Percobaan untuk menentukan lama waktu inokulasi yang optimum. Percobaan ini bertujuan untuk menentukan lama waktu inokulasi bakteri maksimal ke jaringan kacang tanah. Eksplan diinokulasi dengan bakteri yang disiapkan dengan cara merendam ke dalam larutan bakteri dengan konsentrasi OD600 = 0,5 selama 5, 15, dan 30 menit. Selanjutnya eksplan ditiriskan di atas kertas tissue steril untuk membersihkan dari larutan bakteri berlebihan. Eksplan yang telah diinfeksi lalu dikokultivasi di dalam media regenerasi embrio kacang tanah (media MS16) tanpa antibiotik selama 24 jam. Inokulasi dan kokultivasi dilakukan untuk memberi kesempatan bagi Agrobacterium untuk mentransfer gen nptII/gus ke jaringan kacang tanah.
Analisis keberhasilan intoduksi gen gus dilakukan dengan melihat terjadinya ekspresi gen ini secara transien. Analisis ekspresi gen gus dilakukan sebagaimana telah dijelaskan sebelumnya. Selanjutnya banyaknya spot warna biru yang terbentuk akan dihitung dan dipakai untuk menentukan waktu inokulasi yang paling optimum.
Percobaan untuk menentukan lama waktu kokultivasi yang optimum. Percobaan ini bertujuan untuk menentukan waktu kokultivasi bakteri yang optimum untuk menghasilkan introduksi gen yang paling maksimal ke jaringan kacang tanah. Kultur Agrobacterium yang akan dipakai disiapkan sebagaimana dalam percobaan sebelumnya. Konsentrasi bakteri yang dipakai OD600 = 0,5. Eksplan kacang tanah
yang digunakan disiapkan pada percobaan sebelumnya.
Eksplan diinokulasi dengan bakteri dengan cara merendam ke dalam larutan bakteri yang konsentrasinya telah ditentukan sebelumnya, selama 15 menit. Selanjutnya eksplan ditiriskan di atas kertas tissue steril untuk membersihkan dari larutan bakteri berlebihan. Eksplan yang telah diinfeksi selanjutnya dikokultivasi di dalam media regenerasi embrio kacang tanah (media MS16) tanpa antibiotik selama 12, 24, dan 48 jam. Eksplan kacang tanah yang digunakan berupa poros embrio atau
leaflet yang diisolasi dari biji kacang tanah tua yang telah disterilkan dan embrio (masih terdapat bagian kalus embriogeniknya).
eksplan tersebut ditanam daam media MS16 dengan antibiotik selama satu minggu sebelum dianalisis dengan menggunakan transient assay untuk ekspresi gen gus.
Percobaan untuk menentukan lama prekutur yang optimum. Percobaan ini bertujuan untuk menentukan waktu prekultur yaitu waktu di antara isolasi eksplan dan perlakuan inokulasi, yang optimum untuk mendapatkan frekuensi produksi gen yang paling maksimum. Perlakuan prekultur akan membuat eksplan menjadi tidak mudah mati akibat infeksi Agrobacterium yang dilakukan dan eksplan dalam kondisi sedang tumbuh ke arah kalus embriogenik yang kemungkinan besar akan lebih bersifat kompeten (lebih mudah diintroduksi). Dengan demikian transfer gen ke jaringan eksplan diharapkan akan lebih baik.
Eksplan ditanam terlebih dahulu dalam media MS16 selama 0, 6, 12, dan 49 hari sebelum perlakuan inokulasi dan kokultivasi bakteri dilakukan. Selanjutnya eksplan yang telah mengalami periode prekultur diinokulasi dan dikokultivasi dengan Agrobacterium dan keberhasilan introduksi gen marker dianalisis seperti pada percobaan sebelumnya.
Percobaan untuk menentukan jenis eksplan yang terbaik. Percobaan ini bertujuan untuk menentukan jenis eksplan yang terbaik untuk mendapatkan frekuensi introduksi gen yang paling maksimum. Eksplan yang berbeda mempunyai tingkat keberhasilan transfer gen yang berbeda pula.
Kultur Agrobacterium yang akan dipakai disiapkan sebagaimana dalam percobaan sebelumnya. Konsentrasi bakteri yang dipakai OD600 = 0,5. Eksplan kacang tanah yang digunakan disiapkan sebagaimana pada percobaan sebelumnya. Eksplan kacang tanah yang digunakan berupa poros embrio atau leaflet yang diisolasi dari biji kacang tanah tua yang telah disterilkan dan embrio (masih terdapat bagian kalus embriogeniknya).
Analisis embrio transgenik dengan PCR. Embrio yang muncul dan mampu hidup dalam media seleksi selama sebelas minggu setelah inokulasi dengan
Agrobacterium kemudian dideteksi gen gusnya dengan PCR seperti yang dilakukan oleh Thomson & Dietzgen (1995). Primer yang digunakan mempunyai sekuen sebagai berikut.
GUS1 : 5’-CGA TAC CTC TCT TTA GGC ATT GG-3’
CH4 : 5’-CAG CTG TCA TTG TTT GCC TCC CTG CTG CGG-3’
Produk yang diberikan oleh primer GUS1 dan CH4 berukuran 600 bp. Kondisi amplifikasi yang digunakan adalah 940C selama 3 menit, 35 siklus dari 940C selama 45 detik, 550C selama 45 detik dan 720C selama 90 detik, kemudian dilanjutkan pada 720C selama 10 menit. Kondisi terakhir reaksi berada pada suhu 40C sampai dirunning pada gel electroforesis.
HASIL DAN PEMBAHASAN
Percobaan pengaruh antibiotik kanamycin terhadap efisiensi regenerasi tanaman.
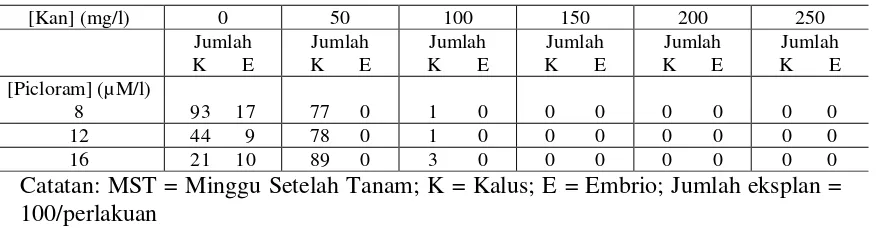
Pengaruh konsentrasi antibiotik kanamycin terhadap kemampuan eksplan membentuk kalus dan pembentukan embrio disajikan pada Tabel 1.
Tabel 1. Pengaruh Konsentrasi Antibiotik Kanamycin terhadap Pembentukan Kalus dan Embrio dari Eksplan Leaflet Kacang Tanah Pada 4 MST
[Kan] (mg/l) 0 50 100 150 200 250
Catatan: MST = Minggu Setelah Tanam; K = Kalus; E = Embrio; Jumlah eksplan = 100/perlakuan
Seperti yang telah dikemukakan di atas bahwa percobaan ini bertujuan untuk
terbentuk sekitar 70-80% tetapi embrio sudah tidak dapat terbentuk pada konsentrasi kanamycin 50 mg L-1 hingga pengamatan pada 4 MST, padahal tanpa antibiotik embrio sudah mulai terbentuk pada 2 MST. Pada konsentrasi 100 mg L-1 Kanamycin, terdapat kalus hanya sekitar 1-3% dan embrio tidak terbentuk sama sekali. Kalus yang terbentuk terlihat berwarna kecoklatan hingga hitam, yang menunjukkan bahwa kalus tersebut menuju proses kematian.
Melihat kondisi demikian, konsentrasi 100 mg L-1 ini dipilih untuk percobaan selanjutnya sebab konsentrasi itu dapat menghambat regenerasi tanaman atau mematikan jaringan ekspan. Antibiotik dengan konsentrasi 100 mg L-1 ini akan digunakan untuk menyeleksi tanaman transgenik (yang tersisipi gen ketahanan terhadap antibiotik). Sel-sel/jaringan tanaman yang mempunyai gen ketahanan terhadap antibiotik kanamycin akan terus tumbuh beregenerasi menjadi tanaman. Namun, sel/jaringan tanaman yang tidak tersisipi gen ketahanan tersebut akan mati atau terhambat pertumbuhannya dan tidak bisa berkembang lebih lanjut.
Percobaan untuk menentukan konsentrasi bakteri yang optimum.
Respon eksplan leaflet, embrio axis tanpa radikel tanpa leaflet dan embrio/kalus embriogenik terhadap berbagai perlakuan populasi bakteri yang dipakai untuk menginokulasi ekspan disajikan pada Tabel 2.
Dari tabel itu terlihat bahwa eksplan positif berwarna biru yang tahan kanamycin hingga 45 HSI diperoleh jika kita menggunakan bakteri dengan konsentrasi OD600=0,5 dan 1. Namun, pada konsentrasi OD600 =1 bakteri sangat sulit dimatikan. Dalam beberapa percobaan bahkan tidak dapat dimatikan. Dengan
demikian OD600=0,5 lebih baik untuk dipilih. Dari tabel tersebut juga dapat diambil kesimpulan bahwa eksplan terbaik yang dapat menghasilkan eksplan positif berwarna biru tahan kanamycin adalah eksplan embrio atau kalus embriogenik. Jadi dari percobaan ini dapat disimpulkan bahwa sebaiknya digunakan konsentrasi bakteri OD600=0,5 dan eksplan embrio/kalus embriogenik.
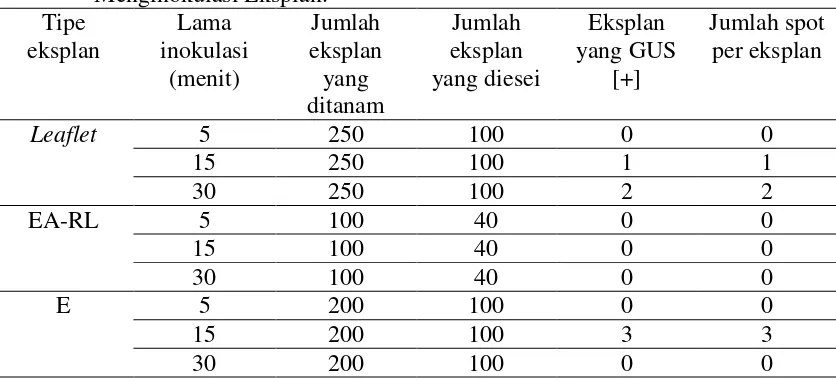
Percobaan untuk menentukan lama inokulasi yang optimum.
Respon eksplan leaflet, embrio axis tanpa radikel tanpa leaflet, dan embrio/kalus embriogenik terhadap lama waktu inokulasi yang digunakan seperti disajikan pada Tabel 3.
menit pada eksplan leaflet dan lama waktu inoulasi 15 menit pada eksplan embrio/kalus embriogenik. Pada lama waktu inokulasi 30 menit bakteri sangat sulit dimatikan, bahkan dalam beberapa percobaan tidak dapat dimatikan. Dengan demikian lama waktu inokulasi 15 menit lebih baik untuk dipilih. Dari tabel tersebut juga dapat diambil kesimpulan bahwa eksplan terbaik yang dapat menghasikan embrio tahan kanamycin adalah eksplan embrio atau kalus embriogenik. Jadi dari percobaan ini dapat kita simpulkan bahwa sebaiknya digunakan lama waktu inokulasi 15 menit dan eksplan embrio/kalus embriogenik.
Percobaan untuk menentukan lama waktu kokultivasi yang optimum. Respon eksplan leaflet, embrio axis tanpa radikel tanpa leaflet, dan embrio/kalus embriogenik terhadap lama waktu kokultivasi yang digunakan seperti disajikan pada Tabel 4.
Tabel 4. Respon eksplan leaflet, embrio axis tanpa radikel tanpa leaflet, dan embrio terhadap berbagai perlakuan lama waktu kokultivasi.
Tipe kanamycin hingga 45 HSI diperoleh jika kita menggunakan lama waktu kokultivasi 1 dan 2 hari pada eksplan embrio/kalus embriogenik. Pada lama waktu kokultivasi 2 hari, bakteri sangat sulit dimatikan, bahkan dalam beberapa percobaan tidak dapat dimatikan. Dengan demikian lama waktu inokulasi 1 hari lebih baik untuk dipilih. Dari tabel tersebut juga dapat diambil kesimpulan bahwa eksplan terbaik yang dapat
embriogenik. Jadi, dari percobaan ini dapat disimpulkan bahwa sebaiknya digunakan lama waktu kokultivasi 1 hari dan eksplan embrio/kalus embriogenik.
Percobaan untuk menentukan lama pre kultur yang optimum.
Respon eksplan leaflet dan embrio axis tanpa radikel tanpa leaflet terhadap lama waktu prekultur yang digunakan seperti disajikan pada Tabel 5.
Tabel 5. Respon eksplan leaflet dan embrio axis tanpa radikel tanpa leaflet terhadap berbagai perlakuan lama prekultur. eksplan embrio axis tanpa radikel tanpa leaflet yang telah diprekultur selama 49 hari. Dengan demikian eksplan leaflet dan eksplan embrio axis tanpa radiel tanpa leaflet
yang telah diprekultur selama 49 HST, keduanya baik untuk dipilih. Sebagai catatan eksplan leaflet maupun eksplan embrio axis tanpa radiel tanpa leaflet yang telah diprekultur selama 49 HST telah menjadi eksplan embrio/kalus embriogenik.
Jadi, percobaan ini memperkuat kesimpulan percobaan sebelumnya bahwa
dibandingkan dengan sel yang belum diprekultur. Di samping itu Agrobacterium
akan lebih mudah mentransfer gen pada sel yang sedang aktif membelah.
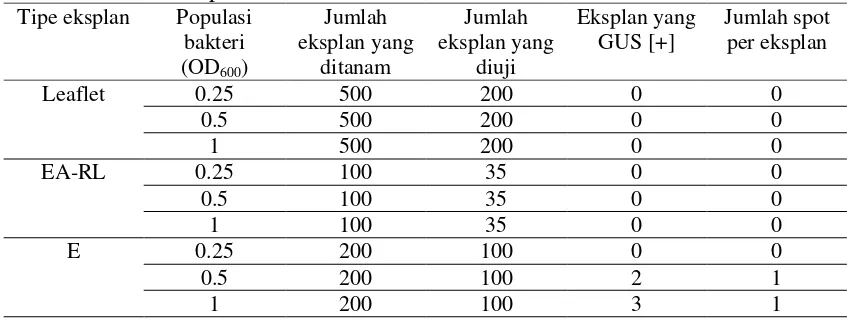
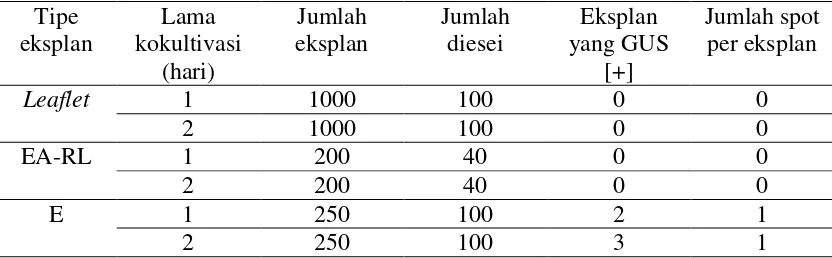
Percobaan untuk menentukan jenis eksplan yang terbaik. Respon eksplan leaflet,embrio axis tanpa radikel tanpa leaflet dan embrio/kalus embriogenik setelah inokulasi Agrobacterium seperti disajikan pada Tabel 6.
Dari tabel itu terlihat bahwa eksplan positif berwarna biru diperoleh jika kita menggunakan eksplan leaflet dan ekspan embrio/kalus embriogenik. Jika pengamatan diteruskan hingga 40 hari setelah inokulasi (Tabel 7) ternyata se-sel positif berwarna biru pada eksplan leaflet tidak dapat berkembang dan akhirnya mati. Dengan demikian eksplan leaflet tidak disarankan untuk dipilih, sedangkan eksplan embrio/kalus embriogenik terbaik untuk dipilih.
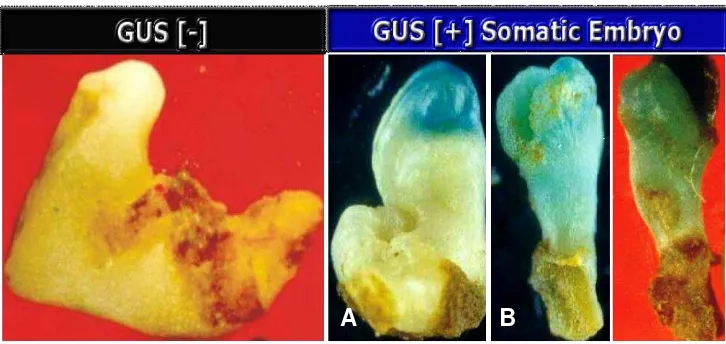
Gambar 2. Embrio Positif GUS. A. Transient Assay B. Integrative Assay
Tabel 6. Respon Eksplan Leaflet, Embrio Axis Tanpa Radikel Tanpa Leaflet, dan Embrio (Transient Assay) Setelah Introduksi Gen Gus.
Tipe eksplan Jumlah eksplan total
Jumlah eksplan yang
diesei
Eksplan yang GUS
[+]
Jumlah spot per eksplan
Leaflet 2000 200 13 20
EA-RL 400 40 0 0
E 400 200 30 35
Catatan: esei dilakukan pada 7 hari setelah inokulasi; EA-RL=embrio tanpa bakal akar dan bakal daun; E =embrio/kalus embriogenik.
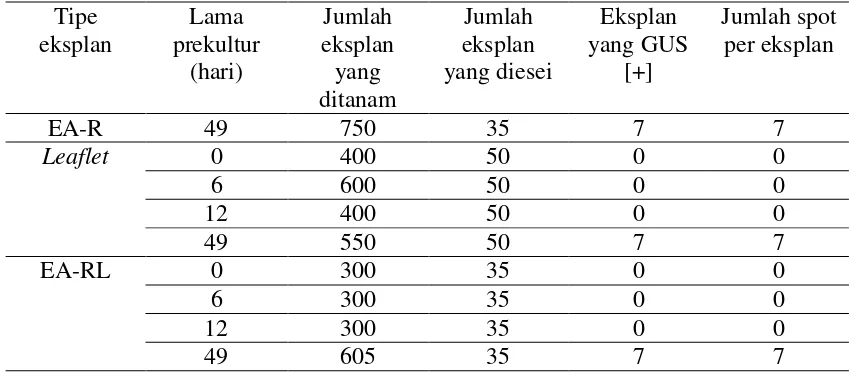
Respon eksplan leaflet, embrio axis tanpa radikel tanpa leaflet, dan embrio/kalus embriogenik setelah inokulasi dengan Agrobacterium disajikan pada Tabel 7. Dari Tabel 7. tersebut terlihat bahwa eksplan positif berwarna biru yang tahan kanamycin hingga 45 HSI diperoleh jika kita menggunakan eksplan embrio/kalus embriogenik (Gambar 2). Dengan demikian eksplan embrio/kalus embriogenik terbaik untuk dipilih.
Tabel 7. Respon eksplan leaflet, embrio axis tanpa radikel tanpa leaflet, dan embrio (Integrative assay) setelah Introdusi gen gus.
Tipe eksplan Jumlah
Pengujian dengan teknik PCR. Untuk membuktikan apakah embrio tersebut benar-benar mengandung gen gus perlu diuji. Uji yang paling ideal dengan menggunakan teknik southern blot, tetapi teknik sothern blot tidak dapat kita
terapkan untuk embrio sebab teknik ini memerlukan ekstrak DNA yang cukup banyak yang tidak dapat kita peroleh dari embrio yang berukuran sangat kecil. Salah satu alternatif pengujian adalah dengan PCR yang tidak memerlukan DNA banyak.
Pengujian DNA embrio yang berasal dari Agrobacterium sangat dikuatirkan terdapat kontaminasi DNA dari Agrobacterium. Untuk menghindari kemungkinan kontaminasi ini, bagian embrio yang di PCR adalah bagian ujung (diusahakan sejauh mungkin dari bagian yang berkalus).
demikian embrio yang diperoleh dapat diyakinkan tidak terkontaminasi
Agrobacterium.
Gambar 3. PCR DNA total dari setengah embrio pada percobaan III dengan menggunakan primer GUS1 & CH4. Lajur 1 kosong, Lajur 25 marker 1 kb ladder; ajur 2, kontrol tanpa template (akuades); Lajur 3-9, 7 DNA total dari setengah embrio yang berasal dari EA-R; Lajur 10-16, 7 DNA total dari setengah embrio yang berasal dari leaflet; Lajur 17-23, 7 DNA total dari setengah embrio yang berasal dari EA-RL; Lajur 4-8, 10-12 17 19, 20 adalah embrio yang positif mengandung gen gus, memberikan produk fragmen sepanjang 600 bp. Lajur 3, 9, 13-16, 18, dan 21-23 adalah embrio yang negatif mengandung gen gus; Lajur 24 adalah pTOK233 DNA murni hasil maxiprep.
Hasil PCR terhadap setengah embrio menggunakan primer GUS1 & CH4
disajikan pada Gambar 3. Lajur 1 dan 25 adalah 1 kb ladder (marker). Kontrol negatif dalam percobaan ini menggunakan air steril (Lajur 2) memang tidak muncul potongan DNA. Hal ini membuktikan bahwa air steril yang kita gunakan tidak terkontaminasi.
Dari Gambar 3. dapat kita ketahui keberhasilan integrasi gen gus setelah analisis dengan PCR sebagai berikut. Sebanyak 7 embrio, yang berasal dari eksplan EA-R berada pada lajur 3-9. Dari sejumlah 7 embrio 2 embrio (28.5%) yang tidak menghasilkan produk DNA sebesar 600 bp/tidak mengandung gen gus (lajur 3 dan 9), sebanyak 7 embrio yang berasal dari eksplan leaflet berada pada lajur 10-16, dari jumlah 7 embrio hanya terdapat 4 embrio (57%) yang tidak menghasilkan produk DNA sebesar 600 bp/tidak mengandung gen gus (lajur 13-16). Sebanyak 7 embrio yang berasal dari eksplan EA-R berada pada lajur 17-23. Dari sejumlah 7 embrio
5 10 15 20
terdapat 4 (57%) embrio yang tidak menghasilkan produk DNA sebesar 600 bp/tidak mengandung gen gus (lajur 18 dan 21-23).
KESIMPULAN
Dari beberapa seri percobaan di atas dapat diambil kesimpuan bahwa hasil terbaik integrasi gen gus pada kacang tanah dalam penelitian ini diperoleh jika kalus embriogenik umur 49 HST digunakan sebagai eksplan dengan lama waktu inokulasi 15 menit, lama waktu kokultivasi 24 jam, dan konsentrasi bakteri OD600 = 0,5. Konsentrasi kanamycin terendah yang sangat menghambat regenerasi tanaman kacang tanah adalah 100 mg L-1.
UCAPAN TERIMAKASIH
Terimakasih kepada pembimbing: Prof Dr Surkati Abidin, Prof Dr Rusmilah Suseno, Dr. Sudarsono, Dr. Hajrial Aswidinnoor, dan Dr. Satriyas Ilyas. Juga terimakasih kepada lembaga pemberi dana untuk penelitian ini: RUT VII: Pengembangan kacang tanah transgenik tahan PStV, DRN, KMNRT (cq. Dr. Sudarsono). Kepada Dra. Erna Rochiyati, MSi. juga diucapkan terimakasih atas perannya sebagai penyelaras bahasa.
DAFTAR PUSTAKA
Cheng, M., Jarret R.L., Li, Z., Xing. A. And Demsi, J.W. 1996. Production of fertile transgenic peanut (Arachis hypogaea L.) plant using Agrobacterium tumefaciens. Plant Cell Rep. 16:653-657.
Hiei, Y., T. Komari, and T. Kubo. 1997. Transformation of rice mediated by Agrobacterium tumefaciens. Plan Mol. Biol. 35:205-218.
Lee, S., H. Marimoto, and P.G. Wiliams. 1997. Synthesis of high specific radioactivity 35-(3H-6) dimethoxy-4-hydroxyacetophenone, an inducing compound of the vir gene in Agrobacterium tumefaciens. Journal of Labelled Compound and Radiopharmaceutica. 39(6):461-470.
Rakousky, S., T. Kocabek, R. Vincenciova, and M. Ondrej. 1998. Transient B-glucuronidase activity after infiltration of Arabidopsis thaliana by Agrobacterium tumefaciens. Biologia Plantarum 40(1):33-41.
Shetty, K., M. Ohshima, T. Murakami, K. Oosawa, and Y. Ohashi. 1997. Transgenic melon (Cucumis meo L.) and potential for expression of novel proteins important to food industry. Food Biotechnoogy. 11(2):111-128.
Thomson, D. and R.G. Dietzgen. 1995. Detection of DNA and RNA plant viruses by PCR and RT-PCR using a rapid virus release protocol without tissue homogenization. J. Virological Methods 54:85-95.