Respon Kekebalan Vaksin Avian Influenza Inaktif pada Ayam
Indukan Pedaging Strain Hubbard (Studi Kasus pada Peternakan
Ayam Indukan Pedaging)
Oleh
YUNI HARTATI
FAKULTAS KEDOKTERAN HEWAN
INSTITUT PERTANIAN BOGOR
BOGOR
2005
vii
ABSTRAK
YUNI HARTATI. Respon Kekebalan Vaksin Avian Influenza Inaktif pada Ayam Indukan Pedaging Strain Hubbard (Studi Kasus pada Peternakan Ayam Indukan Pedaging). Dibawah bimbingan drh. Sri Murtini, MSi dan Ratu Cahyaningrat, SE.
Penelitian ini bertujuan untuk melihat efikasi vaksin AI inaktif pada peternakan ayam indukan pedaging. Penelitian ini merupakan studi kasus di sebuah peternakan ayam indukan pedaging. Sebanyak 20.000 ekor ayam dibagi dalam empat kandang tertutup (close house) yaitu K1, K2, K3, dan K4 yang masing-masing kandang diisi oleh 5000 ekor ayam. Tiap kandang terdiri dari 10 pen dan setiap pen diisi oleh 500 ekor ayam. Vaksinasi AI menggunakan vaksin AI inaktif (Killed Vaccine) konvensional homolog. Vaksinasi dilakukan pada saat ayam berumur 10 minggu, 15 minggu, dan 32 minggu. Vaksinasi dilakukan dengan rute intramuskular, dosis yang berikan sesuai dengan anjuran perusahaan yaitu 0,5 ml / ekor.
Hasil penelitian menunjukkan bahwa vaksin AI inaktif mampu menginduksi pembentukan antibodi dengan titer antibodi protektif 3 minggu setelah vaksinasi pertama. Vaksinasi kedua mampu meningkatkan titer antibodi dan titer tersebut bertahan sampai 15 minggu setelah vaksinasi kedua. Vaksinasi ketiga mampu meningkatkan titer antibodi dan titer protektif tersebut dapat bertahan sampai masa akhir produksi ayam (umur 60 minggu). Dari hasil pemeriksaan pada anak ayam yang divaksinasi (DOC) menunjukkan bahwa titer antibodi tersebut juga diturunkan pada anak ayam dengan titer rataan pada masing-masing kelompok adalah 24,4 (K1), 24,2 (K2), 24,4 (K3), dan 24,0 (K4).
PRAKATA
Bismillahirrahmanirrahim
Puji dan syukur penulis panjatkan kehadirat Allah SWT atas segala karuniaNya sehingga penulis dapat menyelesaikan skripsi yang berjudul “Respon Kekebalan Vaksin Avian Influenza Inaktif pada Ayam Indukan Pedaging Strain
Hubbard (Studi Kasus pada Peternakan Ayam Indukan Pedaging)”. Penulis juga mengucapkan terima kasih yang sebesar-besarnya kepada semua pihak yang telah membantu baik secara langsung maupun tak langsung khususnya kepada :
1. Ibu drh. Sri Murtini, MSi selaku dosen pembimbing I, yang telah memberikan waktu, tenaga, dan arahan selama penelitian dan penulisan.
2. Ibu Ratu Cahyaningrat, SE selaku dosen pembimbing II, yang telah memberikan waktu, tenaga dan izin untuk melakukan penelitian di peternakan ayam P.T. Serpong Unggas Jaya, Tangerang.
3. Ibu drh. Ekowati Handaryani, MS. Ph.D. selaku Dosen Penguji pada saat seminar dan ujian akhir skripsi.
4. Ibu drh. Titiek Sunartatie, MS selaku dosen Pembimbing Akademik. 5. Bapak drh. M.B.M. Malole selaku dosen Pembimbing Akademik.
6. Ayahanda dan ibunda (amak), serta seluruh keluarga tercinta atas do’a, dorongan, bantuan material maupun spiritual dan kasih sayang serta cinta yang tiada hentinya.
7. Kekasihku tersayang Rahadian Muhammad Risma Wangsa Wasita atas cinta, kasih sayang, pengertian, dorongan, kesetiaan, dan bantuan.
8. Mbak Farida, pak Nur, dan Avi yang telah membantu dalam penelitian. 9. Dian Gustrini dan Dwi Endrawati atas persahabatan kita selama ini,
semoga persahabatan kita tetap terjalin dan seluruh teman-teman Gastro 38.
Semoga skripsi ini dapat bermanfaat bagi ilmu pengetahuan, saran dan kritik yang bersifat membangun sangat penulis harapkan.
Bogor, Januari 2006
ii
DAFTAR ISI
HalamanPRAKATA
...……….... iDAFTAR ISI
... iiDAFTAR TABEL
... iiiDAFTAR GAMBAR
... ivPENDAHULUAN
Latar Belakang ... 1Tujuan Penelitian ... 2
TINJAUAN PUSTAKA
Ayam Indukan Pedaging ... 3Sistem Kekebalan pada Unggas ... 5
Avian Influenza (AI) ... 6
Pengendalian Penyakit Viral Avian Influenza ... 10
Vaksin dan Vaksinasi AI pada Unggas ... 11
Profil Peternakan ... 15
MATERI DAN METODA
Tempat dan Waktu Penelitian ... 17Bahan Penelitian ... 17
Metode Penelitian ... 17
Pengambilan Darah dan Evaluasi Titer Antibodi ... 18
HASIL DAN PEMBAHASAN
... 20KESIMPULAN DAN SARAN
... 25DAFTAR PUSTAKA
... 26LAMPIRAN
... 28DAFTAR TABEL
Halaman
Tabel 1 Rancangan penelitian pada masing-masing kelompok ... 18 Tabel 2 Rataan titer antibodi pada masing-masing kelompok ayam ….. 20 Tabel 3 Rataan titer antibodi indukan pada anak ayam dari
masing-masing kelompok ... 23
iv
DAFTAR GAMBAR
Halaman
Gambar 1 Ayam ras strain Hubbard ... 5 Gambar 2 Kenaikkan titer antibodi setelah vaksinasi dengan
Respon Kekebalan Vaksin Avian Influenza Inaktif pada Ayam
Indukan Pedaging Strain Hubbard (Studi Kasus pada Peternakan
Ayam Indukan Pedaging)
Oleh
YUNI HARTATI
B04101063
Skripsi
Sebagai salah satu syarat untuk memperoleh gelar Sarjana Kedokteran Hewan pada
Fakultas Kedokteran Hewan Institut Pertanian Bogor
FAKULTAS KEDOKTERAN HEWAN
INSTITUT PERTANIAN BOGOR
BOGOR
2005
viii Judul Skripsi : Respon Kekebalan Vaksin Avian Influenza Inaktif pada Ayam Indukan Pedaging Strain Hubbard (Studi Kasus pada Peternakan Ayam Indukan Pedaging).
Nama : Yuni Hartati NRP : B04101063
Menyetujui :
drh. Sri Murtini, MSi Ratu Cahyaningrat, SE Pembimbing I Pembimbing II
Diketahui :
Dr. Drh. I Wayan Teguh Wibawan, MS Wakil Dekan
RIWAYAT HIDUP
Penulis dilahirkan pada tanggal 20 Juni 1983 di Muara Bungo sebagai anak tunggal dari ayah Sudirman dan ibu Ermawati. Pendidikan formal penulis dimulai dari SD Negeri No 200/II Simpang Teluk Pandak (1990-1995). Pada tahun 1995 penulis melanjutkan pendidikan ke SMP Negeri I Rimbo Bujang (1995-1998). Kemudian penulis melanjutkan pendidikan ke SMUN I Rimbo Bujang (1998-2001). Pada tahun 2001 penulis diterima di Institut Pertanian Bogor (IPB) Fakultas Kedokteran Hewan melalui jalur Ujian Seleksi Masuk IPB (USMI).
Penulis aktif dalam berbagai organisasi yaitu Himpunan Minat Profesi Ruminansia, dan Himpunan Minat Profesi Ornithologi dan Unggas. Sebagai salah satu syarat untuk memperoleh gelar Sarjana Kedokteran Hewan, penulis melakukan penelitian studi kasus yang berjudul “Respon Kekebalan Vaksin Avian Influenza Inaktif pada Ayam Indukan Pedaging Strain Hubbard (Studi Kasus pada Peternakan Ayam Indukan Pedaging)” dibawah bimbingan drh. Sri Murtini, MSi dan Ratu Cahyaningrat, SE.
PENDAHULUAN
Latar Belakang
Ayam merupakan komoditi ternak yang cukup tinggi populasinya di Indonesia. Hal tersebut karena ayam merupakan ternak yang banyak diusahakan oleh masyarakat. Dipilihnya ayam sebagai ternak yang diusahakan secara komersial karena masa panen ayam cepat dan pemeliharaannya relatif lebih mudah dibandingkan hewan lainnya (Akoso 1998). Daging dan telur ayam merupakan sumber protein hewani utama masyarakat Indonesia, karena harganya yang relatif terjangkau. Usaha peternakan ayam juga dapat menjadi sumber penghasilan bagi peternak untuk memenuhi kebutuhannya. Namun usaha peternakan ayam tidak selalu berjalan lancar. Ada beberapa kendala yang harus dihadapi oleh peternak, salah satunya adalah munculnya berbagai macam penyakit pada ayam yang dapat menurunkan tingkat produksinya bahkan menyebabkan kematian (Anonim 2004a). Penyakit flu burung merupakan salah satu penyakit menular pada unggas yang pertama kali mewabah di Indonesia sejak Agustus 2003. Akibat penyakit tersebut peternak mengalami kerugian yang besar akibat tingginya kematian ayam. Banyak pekerja kandang kehilangan lapangan pekerjaan dan tidak terpenuhinya kebutuhan protein hewani dalam negeri. Dampak ini juga dirasakan oleh pemerintah, dengan adanya peningkatan jumlah pengangguran dan terjadinya penurunan pendapatan daerah (Indartono et al.
2005).
Penyakit flu burung atau Avian Influenza adalah suatu penyakit menular pada unggas yang disebabkan oleh virus influenza tipe A. Menurut Soejoedono dan Handaryani (2005), secara normal, virus AI hanya menginfeksi ternak unggas seperti ayam, kalkun, dan itik. Namun data terakhir menunjukkan bahwa virus AI juga dapat menginfeksi ternak lain, terutama babi. Virus AI menyerang organ pernapasan, pencernaan, dan sistem saraf unggas. Penyebaran yang hebat dari virus Avian Influenza disebabkan oleh migrasi burung-burung liar dan transportasi unggas terinfeksi. Penyakit ini menyebabkan 30-50 juta ekor unggas telah dimusnahkan (Direktoral Jendral Bina Produksi Peternakan 2004). Penyakit
flu burung atau Avian Influenza telah menyebar di 11 negara Asia dan beberapa negara dibelahan dunia lainnya, seperti : Vietnam, Kamboja, Taiwan, Jepang, Cina, Pakistan, Laos, Thailand, Korea Selatan, Malaysia, dan Indonesia. Di Indonesia Avian Influenza telah menyebar di 22 propinsi antara lain : Lampung, Banten, DKI Jakarta, Jawa Barat, Jawa Tengah, Daerah Istimewa Jogyakarta, Jawa Timur, Bali, Kalimantan Tengah, Kalimantan Selatan, Sulawesi Selatan, dan beberapa daerah lainnya (Anonim 2004c). Pemerintah telah menetapkan beberapa langkah untuk membebaskan Indonesia dari flu burung, antara lain biosekuriti yang ketat, vaksinasi untuk ayam di daerah endemis, dan depopulasi selektif untuk ayam yang terbukti telah terinfeksi AI. Vaksinasi dilakukan secara massal pada seluruh populasi unggas yang sehat. Depopulasi dilakukan pada seluruh unggas sehat yang sekandang dengan unggas sakit (Indartono et al. 2005).
Vaksinasi telah dilakukan sejak lama terutama untuk mengatasi penyakit-penyakit infeksius. Vaksinasi dapat dilakukan dengan pemberian vaksin aktif maupan inaktif (Anonim 2004b). Dalam pengendalian virus AI ini digunakan vaksin inaktif. Vaksin inaktif adalah vaksin virus mati tetapi struktur antigenitasnya masih ada dan virus tersebut diinaktifkan dengan menggunakan bahan kimia (Malole 1988).
Tujuan Penelitian
Penelitian ini bertujuan untuk mengetahui tingkat efikasi vaksinasi vaksin
AI inaktif pada ayam indukan pedaging untuk menentukan program vaksinasi yang tepat.
3
TINJAUAN PUSTAKA
Ayam Indukan Pedaging
Ayam pedaging atau lebih dikenal sebagai ayam ras broiler merupakan ayam yang sengaja dikembangkan untuk menghasilkan daging berkualitas. Ayam broiler yang dikenal saat ini merupakan ayam ras yang diseleksi untuk menghasilkan daging dalam waktu yang cepat. Ayam ini baru dikembangkan kurang lebih 50 tahun yang lalu. Di abad 19, ketika parlemen Inggris pada tahun 1849 melarang adu jago, para ahli unggas mengumpulkan ayam kelas bantam yang ukurannya besar yaitu ukuran 10 sampai extra large untuk diseleksi. Dari
hasil seleksi dihasilkan bangsa ayam tipe berat Cornish. Bangsa ayam ini kemudian dipilih yang berbulu putih dan seleksi diteruskan hingga dihasilkan ayam broiler seperti saat sekarang dijumpai (Amrullah 2003).
Beberapa varitas dan ayam galur tertentu telah disilangkan dengan tujuan untuk menghasilkan daging dan telur. Ayam yang diseleksi untuk tujuan menghasilkan daging harus mampu menghasilkan daging dan menguntungkan secara ekonomis. Secara umum, tidak mungkin membibitkan ayam yang menghasilkan daging dan telur dalam jumlah banyak secara bersamaan. Pemuliaan hewan ini harus memilih salah satu jenis yaitu untuk pedaging atau petelur. Jika ditujukan untuk menghasilkan daging, kemampuan produksi telurnya berkurang (Amrullah 2003).
Pada saat ini peternak memilih ayam yang akan dikembang berdasarkan jenis kelamin ayam. Ayam jantan dikembangkan sebagai ayam pedaging sedangkan ayam betina dikembangkan sebagai ayam bibit maupun petelur. Ayam jantan yang dikembangkan harus memiliki perdagingan yang baik yang dicirikan dari badannya yang besar, tumbuh cepat dan mempunyai konversi pakan yang efisien. Sedangkan ayam betina yang dikembangkan sebagai ayam bibit atau petelur harus memiliki produksi tinggi, kualitas kerabang dan telur yang baik sehingga daya tetasnya baik dan dapat menghasilkan anak ayam yang berkualitas (Amrullah 2003).
Ayam ras yang dikembangkan oleh peternak saat ini merupakan hasil persilangan dari berbagai macam ayam ras, sehingga diperoleh jenis ayam dengan nilai ekonomi produksi yang tinggi dan bersifat turun temurun yang disebut strain
(Sudaryani dan Santosa 1994). Berbagai galur ayam indukan pedaging yang dikembangkan di Indonesia yaitu ayam ras strain Hubbard, Cobb, dan lain
sebagainya. Ayam indukan pedaging strain Hubbard berasal dari Belanda,
sedangkan strain Cobb berasal dari Amerika. Ayam indukan pedaging strain Hubbard merupakan hasil persilangan antara ayam ras strain New Hampshire dan Cornish. Ayam ras strain New Hampshire pada awalnya dikembangkan sebagai
ayam petelur (Layer). Ayam ini memiliki ciri-ciri : bulu berwarna coklat muda
keemasan, kaki dan paruh berwarna kuning coklat, ukuran badan sedang (berat badan ayam dewasa jantan 3,5-5 kg, betina 2,5-3), telur berwarna coklat, dan jengger serta pial berwarna merah dengan bentuk jengger sebilah. Keunggulan ayam ini yaitu mampu menghasilkan telur dalam jumlah banyak dan berkualitas, serta daya tetas telur baik. Ayam ras strain Cornish memiliki ciri-ciri : bulu ada
yang berwarna hitam, putih, dan merah bergaris putih, bentuk badan padat, kompak, berdaging penuh, cakar kaki besar, tidak berbulu, dan berwarna kuning, jengger kecil dan berbentuk pea (ercis) telur berwarna coklat dan produksi telur sedikit. Keunggulan ayam ini yaitu daya tetas telur baik dan menghasilkan anak ayam yang berkualitas. Ayam indukan pedaging strain Hubbard memiliki ciri-ciri
: bulu berwarna putih, bentuk badan padat, jengger dan pial berwarna merah, telur berwarna coklat. Keunggulan ayam ini yaitu mampu menghasilkan telur yang dapat ditetaskan sebagai ayam bibit (Siregar 2003).
Ayam indukan pedaging strain Cobb merupakan hasil persilangan antara
ayam ras strain New Hampshire dan White Plymouth Rock.. Ayam ras strain White Plymouth Rock memilik ciri-ciri : bulu ada yang berwarna putih, coklat,
keemasan, ukuran badan sedang dan agak bulat, jengger dan pial berwarna merah, cuping telinga berwarna merah, bentuk jengger sebilah dan berdiri tegak, serta telur berwarna coklat. Keunggulan ayam ini yaitu mampu menghasilkan anak ayam sebagai ayam bibit (Parent Stock). Ayam indukan pedaging strain Cobb
memiliki ciri-ciri : bulu berwarna coklat muda, ukuran badan sedang, jengger berbentuk sebilah, jengger dan pial berwarna merah serta telur berwarna coklat.
5 Keunggulan ayam ini yaitu mampu menghasilkan telur yang banyak dan berkualitas, daya tetas telur baik serta dapat dikembangkan sebagai ayam bibit (Siregar 2003).
Gambar 1 Ayam ras strain Hubbard.
Sistem Kekebalan pada Unggas
Antigen yang masuk ke dalam tubuh pertama kali akan dijerat sehingga dapat diketahui sebagai bahan asing. Bila sudah dikenali sebagai bahan asing, kemudian informasi ini dikirimkan ke sistem pembentuk antibodi atau ke sistem kebal berperantara sel. Sistem ini harus segera menanggapi dengan membentuk antibodi khusus dan / atau sel yang mampu menyingkirkan antigen. Sistem kebal juga harus menyimpan “ingatan” tentang kejadian ini sehingga pada paparan berikutnya dengan antigen yang sama, tanggapannya akan jauh lebih efisien (Tizard 1987).
Secara umum sistem kekebalan pada unggas tidak jauh berbeda dengan sistem kekebalan manusia maupun mamalia lainnya. Unggas mempunyai dua organ limfoid primer yaitu timus dan bursa Fabricius. Bursa Fabricius adalah organ limfoid primer yang berfungsi sebagai tempat pematangan dan diferensiasi bagi sel dari sistem pembentuk antibodi, sehingga sel ini disebut sel B. Disamping itu, bursa juga berfungsi sebagai organ limfoid sekunder (Tizard 1987). Limfosit merupakan unsur kunci sistem kekebalan tubuh. Selama perkembangan janin, prekursor limfosit berasal dari sumsum tulang. Pada unggas, prekursor yang
menempati bursa Fabricius ditransformasi menjadi limfosit yang berperan dalam kekebalan humoral (limfosit B). Sel B berdiferensiasi menjadi sel plasma dan sel B memori. Sel T dibagi menjadi 4 yaitu : sel T pembantu, sel T supresor, sel T
sitotoksik (sel T efektor atau sel pembunuh), dan sel T memori (Ganong 1998). Sebelum terpapar dengan antigen yang spesifik, klon limfosit B tetap dalam keadaan dormant di dalam jaringan limfoid. Bila ada antigen yang masuk,
makrofag yang terdapat dalam jaringan limfoid akan memfagositosis antigen tersebut dan akan membawanya ke limfosit B didekatnya. Disamping itu antigen tersebut juga dibawa ke sel T pembantu pada saat yang bersamaan (Guyton 1995). Limfosit B berproliferasi menghasilkan sel plasma dan sel B memori. Selanjutnya
sel plasma akan menghasilkan antibodi sebagai sistem kekebalan humoral (Wibawan dan Soejoedono 2003). Menurut Malole (1988), antibodi tidak dapat menembus sel, sehingga antibodi hanya akan bekerja selama antigen berada di luar sel. Antibodi bekerja melalui dua cara yang berbeda untuk mempertahankan tubuh terhadap agen penyebab penyakit yaitu : (1) dengan cara langsung menginaktivasi agen penyebab penyakit, atau (2) dengan mengaktifkan sistem komplemen yang kemudian akan menghancurkan agen penyakit tersebut (Guyton 1995).
Anak ayam yang baru menetas memiliki antibodi maternal yang diturunkan dari induknya. Antibodi maternal yang diperoleh secara pasif dapat menghambat pembentukan imunoglobulin, sehingga mempengaruhi keberhasilan vaksinasi. Penghambatan antibodi maternal berlangsung sampai antibodinya habis yaitu sekitar 10 – 20 hari setelah menetas (Tizard 1987). Anak ayam yang antibodi maternal asal induknya telah hilang akan menjadi sangat rentan terhadap infeksi penyakit di alam. Oleh karena itu perlu dilakukan vaksinasi untuk merangsang sistem kekebalan anak ayam.
Avian Influenza (AI)
Avian influenza atau flu burung adalah suatu penyakit menular pada unggas yang disebabkan oleh virus influenza tipe A. Virus ini digolongkan dalam famili Orthomyxoviridae, genus Orthomyxovirus tipe A atau Influenza virus.
7 Virus ini bentuk virionnya membulat tidak beraturan atau menyerupai benang, diameternya 90-120 nanometer. Partikel virus AI mempunyai lapisan luar yang mengandung glikoprotein yang berperan dalam aktivitas aglutinasi, disebut antigen hemaglutinin (HA) dan neuramidase (NA). Glikoprotein HA dan NA merupakan protein permukaan yang sangat berperan dalam penempelan dan pelepasan virus dari sel inang. Perbedaan kedua antigen pada setiap virus AI tersebut digunakan untuk mengidentifikasi serotipe virus influenza dengan inisial huruf H (untuk antigen hemaglutinin), dan N (untuk antigen neuramidase). Terdapat 15 jenis antigen hemaglutinin dan 9 jenis antigen neuramidase. Jika keduanya dikombinasikan maka terdapat 135 kemungkinan subtipe virus yang bisa muncul. Virus influenza tipe A ini menyerang ternak unggas dan merupakan tipe yang dapat menimbulkan wabah pada manusia. Tipe virus influenza lain adalah virus influenza B dan C, virus ini hanya menyerang manusia, tetapi tidak menyerang ternak (Rahardjo 2004). Virus AI dapat mengaglutinasi sel darah merah unggas dan ditemukan pada dinding pembuluh darah inang (Lukman 2005).
Virus influenza tipe A dapat berubah-ubah bentuk atau bermutasi dan dapat menyebabkan epidemi dan pandemi. Mutasi bisa menjadikan virus ini berubah menjadi virulen atau sebaliknya. Variasi antigenik pada virus AI dapat ditemukan dengan frekuensi yang tinggi dan terjadi melalui 2 cara yaitu antigenik
drift dan antigenik shift. Antigenik drift terjadi oleh adanya perubahan struktur
antigenik yang bersifat minor pada antigen permukaan H dan/atau N. Perubahan yang perlahan-lahan ini tidak merubah kedudukan ikatan antibodi dengan antigen. Mutasi asam amino individual semacam itu tidak menimbulkan wabah, hanya kehilangan kekebalan sebagian pada suatu populasi dan beberapa infeksi sehingga menimbulkan gejala ringan. Antigenik shift terjadi oleh adanya perubahan struktur
antigenik yang bersifat dominan pada antigen permukaan H dan/atau N. Perubahan dapat terjadi pada seluruh bagian hemaglutinin sehingga terbentuk hemaglutinin yang baru dari virus tersebut. Perubahan ini dapat menimbulkan wabah yang luas ke seluruh dunia. Hal ini terjadi karena tidak ada lagi perlindungan kekebalan yang tersisa untuk melawan infeksi virus baru tersebut. Virus pada unggas lebih jarang mengalami antigenik drift dibanding virus pada
mamalia. Pengaturan kembali struktur genetik dari virus pada unggas dan mamalia diperkirakan merupakan mekanisme timbulnya strain baru virus (Tabu 2000 dalam Mulia 2005). Pada suatu keadaan tertentu dapat terjadi infeksi dua strain virus. Pertukaran segmen gen antara virus asal manusia dan virus asal unggas dapat terjadi dan akan menghasilkan virus reassortant baru (Rahardjo
2004). Subtipe virus AI yang ganas adalah kelompok subtipe H5 dan H7. Infeksi virus AI dapat mengakibatkan gangguan fungsi respirasi dan juga menimbulkan efek pada sistem kardiovaskular sehingga akan menghambat pertumbuhan ayam (Dunn et al. 2003).
Virus dikeluarkan dari tubuh unggas terinfeksi melalui sekresi hidung dan feses. Virus ini dapat bertahan lama dalam kondisi lingkungan yang lembab dan dingin. Virus ini mampu bertahan bertahan selama 30-35 hari pada suhu 40C dan lebih dari 30 hari pada suhu 00C. Virus AI akan mati pada pemanasan 60 0C selama 30 menit dan pemaparan menggunakan detergent, desinfektan misalnya formalin, serta cairan yang mengandung iodin (Indartono et al. 2005).
Subtipe virus yang ditemukan mewabah dan menyebabkan terjadinya flu burung di beberapa negara Asia adalah H5N1. Subtipe H5N1 ini pertama kali ditemukan di Italia pada tahun 1878 dan sangat cepat menular pada unggas serta cepat menyebabkan kematian. Virus H5N1 termasuk tipe ganas, tetapi peka terhadap panas. Virus ini memiliki masa inkubasi 1 sampai 3 hari. Selain itu, virus AI memiliki daya replikasi tinggi sehingga dapat berkembang sangat cepat di dalam tubuh (Soejoedono dan Handaryani 2005). Patogenitas virus AI dipengaruhi oleh spesies hewan, umur inang, keterpaparan dengan antigen (virus AI), dan faktor lingkungan (Bano et al. 2003).
Terdapat beberapa kelompok hewan selain unggas yang rentan terhadap virus flu burung meliputi kelompok mamalia terdiri dari babi, anjing, kucing, kuda, kambing, dan manusia. Mahkluk yang berhasil bertahan hidup setelah terinfeksi flu burung akan memiliki kekebalan selama 1-2 tahun, tetapi tidak kebal terhadap virus flu burung subtipe lainnya. Pada umumnya zat kebal tubuh yang ditimbulkan karena imunisasi atau infeksi virus alami dapat menangkal serangan infeksi virus yang kedua. Prinsip serangan sistem kekebalan pada penyakit flu burung tertuju pada hemaglutinin virus (Rahardjo 2004).
9 Gejala klinik dari Avian Influenza ini bervariasi diantaranya, hewan susah bernafas, sayap jatuh, jengger, pial, dan kulit perit yang tidak ditumbuhi bulu berwarna biru keunguan, pembengkakan di sekitar kepala dan muka, ada cairan yang keluar dari hidung dan mata, pendarahan di bawah kulit (sub kutan), pendarahan titik (ptechie) pada daerah dada, kaki, dan telapak kaki, batuk, bersin
dan ngorok, diare, tingkat kematian tinggi. Berdasarkan patogenitasnya, virus flu burung diklasifikasikan menjadi dua yaitu Low Pathogenic Avian Influenza (LPAI) yang bersifat kurang ganas dan Highly Pathogenic Avian Influenza (HPAI) yang bersifat ganas. HPAI dapat menyebabkan 100 % kematian pada unggas yang terinfeksi virus ini (Soejoedono dan Handaryani 2005). Sebagian besar subtipe virus AI termasuk dalam kategori LPAI yang apabila berjangkit pada ayam akan menimbulkan gejala ringan. Gejala klinis infeksi LPAI sangat tergantung pada ras ayam, jenis kelamin, kekebalan tubuh dan kondisi lingkungan sekitar. LPAI bersifat kurang ganas dan tidak menimbulkan infeksi sekunder. Ayam yang terjangkit LPAI secara umum tidak menunjukkan gejala klinis pada awal infeksi sehingga sulit untuk diidentifikasi adanya hewan yang terinfeksi. Salah satu gejala klinis yang dapat diamati yaitu terjadinya penurunan produksi telur atau bahkan berhenti sama sekali, kerabang lembek, terjadi gangguan pernapasan, nafsu makan menurun (anoreksia), depresi, dan tingkat kematian rendah. Jika LPAI bermutasi menjadi HPAI, maka akan menimbulkan kematian massal pada populasi unggas (Dunn et al. 2003)
Sumber utama penularan penyakit flu burung yaitu spesies lain dalam kelompok unggas misalnya itik, entog, burung puyuh, burung-burung kesayangan disekitar kandang, burung liar, dan unggas komersial yang telah terinfeksi. Flu burung menular dari unggas ke unggas, dan dari unggas ke manusia, melalui air liur, lendir dari hidung dan feses. Penyebaran utama penularan dari unggas ke unggas tergantung subtipe virus, spesies unggas, dan faktor lingkungan, dapat berasal dari virus yang sudah ada ditempat terjadinya infeksi atau masuknya virus baru yang ditularkan oleh unggas liar. Penyakit ini dapat menular melalui udara yang tercemar virus H5N1 dari kotoran atau sekreta burung/unggas yang menderita flu burung. Penularan dari unggas ke manusia juga dapat terjadi jika bersinggungan langsung dengan unggas yang terinfeksi flu burung dalam jumlah
yang banyak. Contohnya pekerja di peternakan ayam, pemotong ayam dan penjamah produk unggas lainnya (Indartono et al. 2005). Transmisi virus AI dapat
berlangsung melalui aerosol dan droplet serta unggas air (reservoir) (Murphy et al. 1999).
Pengendalian Penyakit Viral Avian Influenza
Di Indonesia, langkah yang ditempuh untuk meredam keganasan AI adalah dengan menerapkan 9 strategi diantaranya : peningkatan biosekuriti, program vaksinasi, depopulasi (pemusnahan terbatas) di daerah tertular, pengendalian lalu-lintas unggas, produk unggas dan limbah peternakan unggas, surveilans dan penelusuran, pengisian kandang kembali (restocking), stamping out
(pemusnahan menyeluruh) di daerah tertular baru, peningkatan kesadaran masyarakat (public awareness) serta monitoring dan evaluasi. Vaksinasi
dilakukan atas dasar pertimbangan tingkat kejadian penyakit atau untuk mengantisipasi mengganasnya agen penyebab penyakit tertentu di satu lokasi peternakan. Selain itu diperlukan biosekuriti yang ketat serta tata laksana peternakan yang tepat untuk mencegah serangan virus AI (Indartono et al. 2005).
Biosekuriti adalah suatu tindakan pencegahan penyebaran penyakit ke dalam suatu peternakan dan harus dilaksanakan secara ketat. Pada prinsipnya biosekuriti mencakup 3 hal utama yaitu meminimalkan keberadaan agen penyebab penyakit, menimimalkan kesempatan agen penyakit berhubungan dengan induk semang, dan membuat lingkungan sedemikian rupa sehingga tidak kondusif untuk kehidupan agen penyakit. Vaksinasi merupakan salah satu cara efektif untuk memutus siklus suatu penyakit. Efektifitas vaksinasi AI dengan kombinasi bersama pelaksanaan biosekuriti ketat terbukti mampu meredam kasus AI di tanah air, yang telah dilakukan sejak November 2003 (Indartono et al. 2005). Vaksinasi
harus dilakukan pada semua jenis unggas yang sehat di daerah yang diketahui telah ada virus flu burung. Vaksin yang digunakan adalah vaksin inaktif yang resmi atau telah teregistrasi dari pemerintah (Seojoedono dan Handaryani 2005).
Depopulasi dilakukan untuk mencegah penyebaran penyakit lebih luas. Depopulasi harus dilaksanakan pada seluruh populasi untuk menghentikan
11 timbulnya gejala penyakit. Depopulasi dilakukan terhadap semua unggas tertular dan sehat yang sekandang dengan dibunuh atau disembelih sesuai prosedur pemotongan unggas. Depopulasi harus selalu diikuti dengan disposal (Rahardjo 2004). Pengaturan lalu lintas ternak bertujuan untuk menghindari terjadinya pemindahan ternak yang sudah terinfeksi dari suatu daerah ke daerah lain yang memungkinkan penyebaran virus lebih cepat. Surveilans dilakukan dengan cara pengambilan sampel dari peternakan di daerah tertular, terancam maupun bebas. Penelusuran bertujuan untuk mengidentifikasi penyebaran penyakit dan harus mengikuti seluruh lalu lintas unggas, produk unggas dan lain sebagainya (Indartono et al. 2005).
Pengisian kembali (restoking) unggas ke dalam kandang dapat dilakukan
paling cepat satu bulan setelah dilakukan pengosongan kandang dan telah selesai dilaksanakan semua tindakan dekontaminasi dan disposal sesuai prosedur (Seojoedono dan Handaryani 2005). Stamping out atau pemusnahan total dapat
dilaksanakan apabila di suatu peternakan baru tertular virus AI dan populasi unggas yang terinfeksi masih terbatas. Peningkatan kesadaran masyarakat sangat diperlukan melalui kerjasama dengan pemerintah dalam menanggulangi penyebaran virus AI. Pada peternakan yang melakukan vaksinasi harus melakukan monitoring. Ada 2 macam monitoring yaitu monitoring efektifitas vaksin dan monitoring situasi epidemiologi untuk semua peternakan. Monitoring efektifitas vaksin pada suatu daerah dilakukan pada minimal 30 peternakan yang melakukan vaksinasi. Monitoring dilakukan dengan pemeriksaan antibodi dengan uji HI pada 20 ekor unggas yang divaksinasi per peternakan per bulan. Monitoring dilakukan setiap 30-45 hari dengan uji serologi (Rahardjo 2004).
Vaksin dan Vaksinasi AI pada Unggas
Tindakan pemusnahan virus AI oleh OIE adalah stamping out pada daerah
yang baru tertular virus AI. Namun setelah diadakan simposium Internasional AI yang pertama pada tahun 1981, tindakan stamping out ini ditentang oleh berbagai
negara dengan alasan tidak memperhatikan kesejahteraan hewan. Sejak saat itu, vaksinasi merupakan pilihan untuk mencegah terjadinya wabah penyakit AI
(Anonim 2004d). Vaksinasi adalah tindakan memasukkan antigen berupa virus atau agen penyakit yang telah dilemahkan ke dalam tubuh sehat dengan maksud untuk merangsang pembentukan kekebalan. Kekebalan tersebut diharapkan dapat melindungi individu yang bersangkutan terhadap infeksi penyakit di alam (Tizard 1987). Vaksin secara umum adalah mikroorganisme atau parasit baik hidup maupun yang telah dimatikan. Mikroorganisme tersebut dapat merangsang pembentukan kekebalan tubuh terhadap penyakit tertentu (Malole 1988). Ada beberapa jenis vaksin yaitu vaksin aktif, inaktif, rekombinan subunit, dan DNA. Vaksin inaktif berisi antigen yang mati, sedangkan yang aktif berisi antigen hidup (Ronohardjo 1995 dalam Syamsi 2003). Vaksin inaktif biasanya dibuat dari virus virulen yang kemudian diinaktifkan secara fisik maupun dengan menggunakan bahan-bahan kimia, tanpa merusak imunogenitas virus tersebut. Untuk meningkatkan imunogenitas vaksin inaktif biasanya vaksin tersebut ditambah dengan adjuvan. Adjuvan merupakan bahan kimia yang memperlambat proses penghancuran antigen dalam tubuh serta merangsang pembentukan kekebalan. Adjuvan yang sering dicampurkan ke dalam vaksin antara lain lemak nabati, minyak mineral dan Al (OH)3 (Malole 1988).
Vaksin inaktif yang baik harus memberikan proteksi terhadap lebih dari 95% hewan dalam suatu percobaan atau tidak lebih dari 5% hewan yang terinfeksi atau sakit (Malole 1988). Salah satu proses inaktifasi virus yaitu dengan menggunakan bahan-bahan penginaktif seperti formalin, beta propiolakton, asetilkimin (AEI) dan etilenimin (EEI) (Edington 1986 dalam Mulia 2005). Sejak tahun 1990, beta propiolakton digunakan untuk menginaktif virus AI dalam bentuk emulsi minyak oleh negara Mexico dan Pakistan. Di negara El savador dan Guatemala, mereka menggunakan vaksin rekombinan fowl poxvirus untuk
mengatasi serangan virus AI. Beta propiolakton banyak digunakan oleh berbagai negara di Asia untuk menginaktif virus AI, karena mampu membunuh virus AI secara keseluruhan sehingga tidak menimbulkan virulensi bagi unggas yang divaksin. Namun beta propiolakton mudah meledak, sehingga harus berhati-hati dalam penggunaannya. Vaksinasi AI harus dapat melindungi hewan sehingga tidak menimbulkan gejala klinis dan kematian, mengurangi jumlah virus yang dikeluarkan oleh unggas, serta mampu mengatasi infeksi virus yang bersifat ganas
13 seperti HPAI. Vaksinasi AI harus disertai dengan monitoring, biosekuriti, serta depopulasi di daerah tertular agar keberhasilan vaksinasi dapat dicapai (Anonim 2004d).
Terdapat beberapa jenis vaksin yang digunakan untuk mengatasi virus AI yaitu vaksin konvensional, vaksin rekombinan. Vaksin konvensional ada 2 yaitu vaksin homolog dan heterolog. Vaksin konvensional diperoleh dengan cara menginfeksikan virus HPAI atau LPAI ke dalam cairan alantois dan diinaktifkan dengan beta propiolakton atau formalin serta minyak mineral dalam bentuk emulsi sebagai adjuvan. Pada Vaksin konvensional homolog merupakan vaksin dengan jenis virus AI yang memiliki subtipe hemaglutinin dan neuraminidase sama dengan jenis virus yang menginfeksi ayam di daerah tersebut. Sedangkan pada vaksin konvensional heterolog, jenis virus AI yang terdapat dalam vaksin tersebut hanya memiliki kesamaan subtipe hemaglutinin dengan virus penginfeksi di daerah tersebut. Vaksin konvensional homolog lebih sering digunakan karena lebih mudah dalam pemeriksaan jenis virus. Dengan demikian, bila terjadi mutasi virus AI dapat segera terdeteksi. Sedangkan vaksin konvensional heterolog, hanya memiliki kesamaan subtipe hemaglutinin sehingga mutasi virus AI pada subtipe neuraminidasenya susah untuk dideteksi. Kombinasi subtipe virus yang banyak dan perbedaan strain virus AI merupakan salah satu kendala dalam penbuatan vaksin AI. Vaksin ini mampu mengatasi serangan virus AI yang memiliki subtipe hemaglutinin yang sama. Namun dalam aplikasinya, konsentrasi vaksin harus ditingkatkan. Vaksin rekombinan untuk virus AI diperoleh dengan cara memasukkan kode genetik untuk hemaglutinin virus AI ke dalam vektor virus hidup. Vaksin rekombinan vektor hidup memiliki beberapa keuntungan, antara lain : Vaksin hidup dapat meningkatkan kekebalan humoral maupun selular, dapat digunakan untuk unggas yang masih muda, serta dapat meningkatkan sistem kekebalan unggas dalam waktu yang singkat. Namun vaksin hidup masih memiliki kemampuan untuk bereplikasi di dalam tubuh unggas, sehingga unggas masih dapat terinfeksi virus AI (Anonim 2004d). Pada saat ini vaksin rekombinan lebih banyak digunakan karena virus yang terdapat dalam vaksin tersebut telah dimatikan terlebih dahulu, sehingga aman digunakan. Sedangkan vaksin konvensional belum bisa menanggulangi virus AI secara
maksimal karena virus yang terdapat di dalam vaksin tersebut hanya dilemahkan. Selain itu pembuatan vaksin konvensional membutuhkan biaya yang besar dan proses pembuatan dengan tingkat keamanan yang tinggi (Siswono 2004).
Aspek positif dari vaksin AI inaktif berdasarkan pengalaman kasus di Hongkong adalah proteksi klinis luas yaitu dapat digunakan untuk semua spesies unggas, aman, standar vaksin mudah dikontrol serta tidak direkomendasikan untuk ayam sebelum berumur 8-10 hari. Aspek negatifnya, konsentrasi virusnya tidak distandarisasi, beresiko bila menggunakan vaksin high pathogenic,
diperlukan booster, dan monitoring lebih kompleks dengan antibodi berbeda-beda
untuk AGPT, HA, dan ELISA (Rahardjo 2004). Vaksinasi terhadap AI dengan vaksin inaktif dapat diberikan melalui penyuntikan. Vaksin inaktif diberikan dengan dosis yang rendah namun membutuhkan vaksinasi ulangan (booster)
sebanyak 2 atau 3 kali (Murphy et al. 1999). Vaksinasi secara penyuntikan
memerlukan pengawasan seorang ahli yaitu dokter hewan dan pemberiannya harus sesuai dengan dosis yang ditentukan. Vaksinasi AI harus dilakukan pada semua jenis unggas yang sehat di daerah yang telah diketahui ada virus AI (Soejoedono dan Handaryani 2005).
Ada beberapa faktor yang mempengaruhi mutu vaksin menurut Tizard (1982) yaitu :
1. Cara penyimpanan
Vaksin dikemas dalam vial tertutup, disimpan pada suhu yang stabil 0-40C dan dihindari dari cahaya matahari.
2. Cara vaksinasi
Cara penanganan vaksin dari tempat penyimpanan sampai ke tempat vaksinasi juga mempengaruhi mutu vaksin. Vaksin harus dibawa dalam kondisi dingin dan terhindar dari sinar matahari. Vaksin hanya diencerkan dengan cairan khusus yang telah disediakan oleh pabrik dengan jumlah pengencer yang telah ditentukan. Sisa vaksin yang telah diencerkan harus dibuang dan tidak dapat digunakan lagi.
Keberhasilan vaksinasi dapat dilihat dari titer antibodi yang dibentuknya. Menurut Akoso (1998), keberhasilan vaksinasi dipengaruhi oleh :
15 1. Status kesehatan unggas, berarti bahwa unggas yang divaksinasi dalam
keadaan sehat 2. Status nutrisi cukup.
3. Sanitasi lingkungan dan sistem perkandangan baik.
4. Vaksinasi dilakukan secara tepat, baik waktu serta umurnya
Keuntungan pemberian vaksin adalah mencegah timbulnya gejala klinis dan kematian, mengurangi keluarnya virus dari tubuh unggas serta mengurangi populasi unggas yang rentan. Kelemahan vaksinasi adalah memerlukan waktu sebelum kekebalan protektif tercapai, flok yang divaksinasi tidak memperlihatkan gejala kinis sesudah terekspos, tetapi tetap dapat terinfeksi virus dan bertindak sebagai reservoir (Rahardjo 2004).
Profil Peternakan
Suatu areal peternakan memerlukan tanah yang cukup luas. Suasana lingkungan disekitar daerah peternakan harus tenang, sehingga banyak peternakan didirikan diluar kota dan jauh dari jalan raya serta lalu lalang manusia. Suasana tenang ini berkaitan erat dengan produksi ayam yang bersangkutan. Peternakan ayam yang digunakan dalam studi kasus ini merupakan peternakan ayam indukan pedaging (breeding farm). Lokasi peternakan ini terletak di daerah Rumpin, Desa
Kerta Jaya, Kabupaten Bogor. Di lokasi peternakan tersebut dibangun 4 buah kandang tertutup (close house), luas setiap kandangnya adalah 100 X 12 m2.
Pertumbuhan dan konversi pakan ayam pedaging sangat dipengaruhi oleh suhu di dalam kandang. Suhu yang terlalu dingin atau terlalu panas akan menurunkan menurunkan konsumsi ransum secara langsung, karena ayam berada dalam cekaman stress akibat perubahan suhu. Dalam pemilihan lokasi kandang hendaknya dipilih lokasi dengan suhu mendekati ideal yaitu 210C. Bila lokasi dengan kondisi ideal tidak dapat diperoleh, maka dapat dilakukan modifikasi kandang dan lain sebagainya (Amrullah 2003). Salah satu bentuk kandang adalah kandang tertutup (Close House). Kandang tertutup adalah kandang dengan desain
seluruh dinding ditutup dan untuk ventilasi serta pengaturan suhu digunakan
mengurangi perbedaan ilklim yang sangat mencolok. Di dalam kandang ini, kelembaban, suhu, serta intensitas cahaya dapat diatur sesuai kebutuhan (Sudaryani dan Santosa 1994). Dinding harus dibuat dari bahan yang kuat dan rapat, tetapi tetap memberikan kondisi yang nyaman bagi lingkungan dalam kandang. Dinding tertutup pada umumnya menggunakan foam (bahan stry foam
untuk membuat dinding kedap temperatur) atau bahan rapat lainnya.
Kandang tertutup dibagi menjadi beberapa ruangan dan setiap ruangan disekat. Kandang tertutup juga harus dilengkapi dengan alat pengatur suhu dan kelembaban dan kandang ini didesain untuk mengurangi stres pada ayam. Populasi ayam dalam setiap kandang juga harus dibatasi sehingga ruang gerak ayam di dalam kandang tidak terbatas atau sempit dan ayam akan merasa nyaman. Selain itu, penggunaan kandang tertutup bagi ayam ras komersial sangat penting, karena ayam ini sangat peka terhadap infeksi penyakit di alam dibandingkan ayam bukan ras.
Pengaturan suhu, kelembaban, dan intensitas cahaya, kandang ayam ini dilengkapi dengan kipas angin besar dan deck serta layar. Layar akan terbuka
secara otomatis saat listrik mati. Kelembaban di dalam kandang berkisar antara 40-60 % dan suhu rata-rata 270C. Alas lantai kandang menggunakan sistem litter. Sistem ini berupa lantai semen atau tanah yang dipadatkan kemudian di atasnya ditaburi kulit padi (sekam), serbuk gergaji, tongkol jagung, atau bahan lainnya yang berfungsi untuk menyerap kotoran ayam yang jatuh. Sistem ini sangat cocok digunakan untuk ayam pedaging, namun sistem litter ini harus dikontrol agar kadar amoniak dalam ruang kandang tidak terlalu tinggi (Priyatno 1996). Pada peternakan ini, ayam dipelihara secara intensif yaitu kehidupan ayam dikendalikan secara penuh oleh si pemelihara sehingga lingkungan hidup dan kebutuhan makan, minum harus diusahakan sebaik-baiknya dan sesempurna mungkin. Sistem ini banyak digunakan pada pemeliharaan ayam secara modern (Sudaryani dan Santoso 1994).
17
MATERI DAN METODA
1. Tempat dan Waktu Penelitian
Penelitian ini dilakukan di peternakan ayam indukan pedaging di Bogor dan Laboratorium Virologi FKH-IPB, Departemen Ilmu Penyakit Hewan dan Kesehatan Masyarakat Veteriner, Fakultas Kedokteran Hewan, Institut Pertanian Bogor dari bulan Januari sampai bulan September 2004.
2. Bahan Penelitian
a. Hewan Percobaan
Hewan coba ayam indukan pedaging strain Hubbard umur 10 minggu.
Jumlah ayam yang diamati sebanyak 20.000 ekor. Ayam tersebut dibagi dalam empat kandang tertutup (close house), masing-masing kandang diisi oleh 5000
ekor ayam. Tiap kandang terdiri dari 10 pen dan setiap pen diisi oleh 500 ekor ayam.
b. Vaksin AI
Vaksin AI yang digunakan dalam penelitian ini berasal dari vaksin AI inaktif (Killed Vaccine) konvensional homolog.
c. Reagensia dan Alat Penelitian
Bahan reagensia yaitu virus AI standar dengan titer 4 HAU/0,05 ml, suspensi RBC 0,5%, serum kebal AI, alkohol 70 %, dan es batu.
Alat penelitian yang digunakan yaitu syring, refrigerator, mikroplate U bottom, mikropipet 200 µl, kapas, botol kecil dan termos es.
3. Metode Penelitian
a. Rancangan percobaan
Percobaan dilakukan dengan rancangan penelitian seperti pada Tabel 1 .
Tabel 1 Rancangan penelitian pada masing-masing kelompok
Kelompok Perlakuan pada ayam umur (minggu)
10 15 32
K1 Vaksinasi ke-1 Vaksinasi ke-2 Vaksinasi ke-3 K2 Vaksinasi ke-1 Vaksinasi ke-2 Vaksinasi ke-3 K3 Vaksinasi ke-1 Vaksinasi ke-2 Vaksinasi ke-3 K4 Vaksinasi ke-1 Vaksinasi ke-2 Vaksinasi ke-3 Pada penelitian ini dilakukan vaksinasi dengan vaksin AI inaktif. Rute vaksinasi intramuskular dan dosis yang diberikan sesuai dengan anjuran perusahaan yaitu 0,5 ml / ekor. Vaksinasi dilakukan sebanyak tiga kali pada saat ayam berumur 10 minggu, 15 minggu, dan 32 minggu. Dari setiap pen diambil 2 ekor ayam sebagai sampel. Sampel darah diambil saat sebelum dan setelah vaksinasi sesuai jadwal. Serum yang diambil dititrasi antibodinya terhadap virus AI dengan uji HI.
b. Pemeliharaan Hewan Coba
Populasi ayam indukan pedaging yang diamati secara keseluruhan yaitu 20.000 ekor. Ayam ini dibagi dalam empat kandang tertutup (close house) yaitu
K1, K2, K3, dan K4. Masing-masing kandang diisi oleh 5000 ekor ayam. Pada tiap-tiap kandang terdiri dari 10 pen dan masing-masing pen diisi oleh 500 ekor ayam. Kandang ayam indukan pedaging ini terletak di daerah Rumpin Desa Kerta Jaya, Kabupaten Bogor. Kelembaban di dalam kandang sekitar 40-60% dan suhu rata-rata 270C. Ayam diberi pakan dengan standar komersial dan diberi minum
ad libitum.
4. Pengambilan Darah dan Evaluasi Titer Antibodi
Ayam diambil darahnya di daerah sayap yaitu pada vena brachialis secara
legeartis dengan menggunakan syring. Darah diambil saat sebelum dan sesudah vaksinasi sesuai jadwal. Darah tersebut selanjutnya dibawa ke Laboratorium Virologi FKH-IPB. Darah dibiarkan tetap berada di dalam syring dan disimpan
19 dalam refrigerator selama satu malam. Selanjutnya serum yang terpisah dari darah diambil dan dilakukan evaluasi titer antibodi dengan uji HI.
Evaluasi titer antibodi menggunakan uji Haemaglutinasi Inhibisi (HI Test) mikrotitrasi metode Beta sebagai berikut :
● Masing-masing lubang di mikroplate dengan dasar U dimasukkan 50 µl suspensi virus AI standar dengan menggunakan mikropipet.
● 50 µl serum AI dimasukkan pada lubang pertama dan dilakukan pencampuran cairan tersebut dengan mengocok dan dipindahkan sebanyak 50 µl ke lubang kedua dan seterusnya sampai lubang 12.
● Kemudian diinkubasikan pada suhu ruangan selama 15 menit.
● Suspensi RBC 0,5 % sebanyak 50 µl dimasukkan ke dalam seluruh sumur, lalu digoyang-goyangkan agar suspensi tercampur.
● Mikroplate didiamkan selama 30 menit dan diamati adanya penghambatan aglutinasi.
● Rataan titer antibodi dihitung dengan cara :
Log2 GMT = (Log2 t1)(S1) + (Log2 t2)(S2) + ... + (Log2 tn)(Sn)
N
Dimana :
N= jumlah contoh serum yang diamati t= titer antibodi pada sampel
S= jumlah contoh serum yang bertiter t n= sample ke-n
HASIL DAN PEMBAHASAN
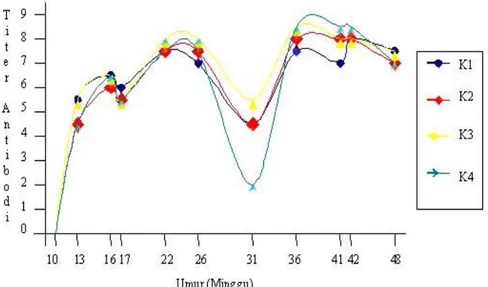
Hasil penelitian menunjukkan bahwa terjadi peningkatan titer antibodi 3 minggu setelah vaksinasi pertama. Ini menunjukkan bahwa vaksin AI inaktif mampu menginduksi pembentukan antibodi dengan titer antibodi protektif 3 minggu setelah vaksinasi. Hal ini sesuai dengan pernyataan Rahardjo (2004) yang menyatakan, bahwa berdasarkan standar OIE, 3 minggu setelah vaksinasi minimal terbentuk antibodi setinggi 24. Setelah vaksin AI inaktif masuk ke dalam tubuh ayam, maka virusnya tidak perlu bermultiplikasi (memperbanyak diri) tetapi langsung memacu jaringan limfoid tubuh untuk membentuk kekebalan. Pembentukan kekebalan yang terjadi memang relatif lebih lambat, namun dapat bertahan dalam waktu lebih lama. Antibodi dengan titer yang tinggi tersebut bersifat protektif terhadap adanya infeksi lapangan (Indartono et al. 2005).
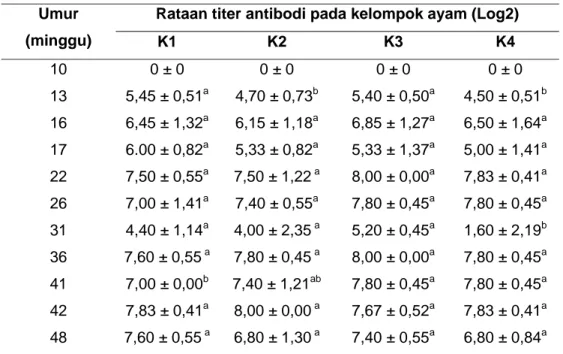
Tabel 2 Rataan titer antibodi pada masing-masing kelompok ayam
Umur (minggu)
Rataan titer antibodi pada kelompok ayam (Log2)
K1 K2 K3 K4 10 0 ± 0 0 ± 0 0 ± 0 0 ± 0 13 5,45 ± 0,51a 4,70 ± 0,73b 5,40 ± 0,50a 4,50 ± 0,51b 16 6,45 ± 1,32a 6,15 ± 1,18a 6,85 ± 1,27a 6,50 ± 1,64a 17 6.00 ± 0,82a 5,33 ± 0,82a 5,33 ± 1,37a 5,00 ± 1,41a 22 7,50 ± 0,55a 7,50 ± 1,22a 8,00 ± 0,00a 7,83 ± 0,41a 26 7,00 ± 1,41a 7,40 ± 0,55a 7,80 ± 0,45a 7,80 ± 0,45a 31 4,40 ± 1,14a 4,00 ± 2,35a 5,20 ± 0,45a 1,60 ± 2,19b 36 7,60 ± 0,55a 7,80 ± 0,45a 8,00 ± 0,00a 7,80 ± 0,45a 41 7,00 ± 0,00b 7,40 ± 1,21ab 7,80 ± 0,45a 7,80 ± 0,45a 42 7,83 ± 0,41a 8,00 ± 0,00a 7,67 ± 0,52a 7,83 ± 0,41a 48 7,60 ± 0,55a 6,80 ± 1,30a 7,40 ± 0,55a 6,80 ± 0,84a
* Keterangan : Tanda huruf (superskrip) yang berbeda pada baris yang sama
menunjukkan nilai yang berbeda nyata pada taraf uji P<0,05. Timbulnya kekebalan protektif baru muncul 3 minggu setelah vaksinasi pertama, hal ini dipengaruhi oleh jenis dan cara vaksinasi yang menggunakan
21 adjuvan. Adjuvan akan membentuk “depo” ditempat penyuntikan dan akan meningkatkan jumlah limfosit di lokasi tersebut. Depo berisi antigen tersebut akan menangkap limfosit tersebut dan selanjutnya merangsang sistem kekebalan melalui stimulasi sel limfosit T dan limfosit B secara umum dan menyeluruh (Indartono et al. 2005). Adjuvan akan memperlambat proses penghancuran
antigen dalam tubuh serta merangsang pembentukan kekebalan (Malole 1988). Adjuvan hanya mempengaruhi tanggap kebal primer dan sedikit pengaruhnya terhadap tanggap kebal sekunder (Tizard 1987).
Saat ayam berumur 15 minggu dilakukan vaksinasi ke-2. Satu minggu setelah vaksinasi kedua dari hasil evaluasi titer antibodi, terjadi peningkatan titer antibodi yang tidak berbeda nyata diantara kelompok ayam dan titer antibodi protektif yang dihasilkan dapat bertahan selama 15 minggu. Tingginya respon vaksinasi kedua ini karena vaksinasi tersebut merupakan vaksinasi ulangan. Hal ini sesuai dengan pernyataan Wibawan dan Soejoedono (2003) yang menyatakan, bahwa pemaparan oleh antigen yang sama pada saat kedua kalinya, maka terjadi pembentukan respon imun sekunder dalam waktu singkat dan peningkatan titer antibodi lebih tinggi dari sebelumnya. Hal ini disebabkan karena adanya sel B dan sel T memori serta antibodi yang masih tersisa akibat pemaparan pertama. Sel T memori akan segera mengenali antigen yang pernah dikenali sebelumnya dan
membantu sel B untuk berproliferasi dan menghasilkan sel plasma, selanjutnya sel plasma akan membentuk antibodi. Sistem pembentukan antibodi memiliki kemampuan untuk “mengingat” keterpaparan dengan suatu antigen sebelumnya (Tizard 1987). Pada saat ayam berumur 31 minggu atau 16 minggu setelah vaksinasi kedua, mulai terjadi penurunan titer antibodi. Hal ini sesuai dengan pernyataan Malole (2005) yang menyatakan bahwa titer antibodi protektif akan mengalami penurunan yang disebabkan oleh adanya waktu paruh antibodi.
Gambar 2 Kenaikkan titer antibodi setelah vaksinasi dengan vaksin AI inaktif. Pada umur 32 minggu dilakukan vaksinasi ke-3. Pemberian booster yang ke-3 ini sesuai dengan pernyataan Tizard (1987) yang menyatakan vaksin inaktif menghasilkan kekebalan yang lemah karena virus inaktif tidak mampu bereplikasi di dalam tubuh, sehingga memerlukan booster yang berulang kali agar dapat
mempertahankan titer antibodi protektif. Empat minggu setelah vaksinasi ke-3 terlihat kembali adanya peningkatan titer antibodi yang tidak berbeda nyata diantara kelompok ayam. Hal ini sesuai dengan pernyataan Wibawan dan Soejoedono (2003) yang menyatakan, pada saat pemaparan kedua dan seterusnya, antigen akan dapat dikenal oleh sel pertahanan dengan lebih efisien. Kondisi tersebut disebabkan oleh jumlah sel B dan T spesifik juga lebih banyak, kemungkinan untuk berinteraksi dengan antigen akan lebih besar, sehingga titer antibodi juga cepat meningkat. Titer antibodi yang terbentuk setelah vaksinasi ke-3 ini lebih tinggi dari sebelumnya dan memerlukan waktu yang semakin singkat. Setelah vaksinasi ke-3, titer antibodi protektif mampu bertahan sampai masa akhir produksi ayam (umur 60 minggu).
23 Tabel 3 Rataan titer antibodi indukan pada anak ayam dari masing-masing Kelompok
Kelompok Titer antibodi Log 2
K1 4,40 ± 1,14a
K2 4,20 ± 1,48 a
K3 4,40 ± 1,14a
K4 4,00 ± 1,58a
* Keterangan : Tanda huruf (superskrip) yang berbeda menunjukkan nilai yang berbeda nyata pada taraf uji P<0,05.
Tingginya titer antibodi pada ayam indukan ini juga diturunkan pada anak ayam melalui telur. Hasil evaluasi titer antibodi, menunjukkan bahwa anak ayam pada masing-masing kelompok memiliki titer antibodi dengan titer cukup protektif yang diturunkan dari induk ayam. Titer antibodi maternal pada anak ayam dari masing-masing kelompok tidak berbeda nyata. Hal ini terjadi karena semua kelompok ayam mendapat perlakuan yang sama, sehingga antibodi maternal pada anak ayam yang dihasilkan tidak berbeda nyata. Hal ini sesuai dengan pernyataan Tizard (1987) yang menyatakan anak ayam memperoleh antibodi IgG dari kuning telur. Imunoglobulin ini dapat diturunkan dari serum induk ayam ke dalam kuning telur ketika telur masih berada dalam ovarium. Dalam fase cair kuning telur, IgG ditemukan memiliki titer yang sama dengan yang ada dalam serum induk. Selama embrio ayam berkembang, IgG dari kuning telur akan diserap. Sedangkan IgM dan IgA maternal ditemukan dalam cairan amnion akan ditelan oleh embrio. Dengan demikian bila anak ayam menetas, telah memiliki IgG di dalam serum dan IgM dan IgA di dalam saluran pencernaan. Titer antibodi induk yang tinggi akan mempengaruhi titer antibodi maternal pada anak ayam. Malole (2005) menyatakan bahwa anak ayam berasal dari induk ayam yang divaksinasi mempunyai titer antibodi maternal lebih lama, dan akan mempengaruhi umur vaksinasi pada anak ayam tersebut. Lamanya antibodi maternal ini dipengaruhi oleh banyaknya antibodi yang dipindahkan kepada anak ayam yang baru menetas dan umur paro imunoglobulin yang bersangkutan (Tizard 1987). Antibodi maternal hanya mampu melindungi anak ayam dalam
kurun waktu yang singkat, namun akan mempengaruhi perkembangan tanggap kebal anak ayam pada umur berikutnya.
25
KESIMPULAN DAN SARAN
KESIMPULAN
Dari hasil penelitian dapat disimpulkan bahwa vaksinasi AI dengan vaksin inaktif mampu menginduksi pembentukan antibodi dengan titer protektif. Vaksinasi AI dengan vaksin inaktif memerlukan 3 kali ulangan untuk mempertahankan titer antibodi protektif. Titer antibodi induk yang tinggi dapat diturunkan pada anak ayam.
SARAN
Perlu dilakukan penelitian lebih lanjut terhadap respon kekebalan vaksin AI inaktif pada ayam bukan ras (ayam kampung).
DAFTAR PUSTAKA
Akoso BT. 1998. Manual Kesehatan Unggas. Kanisius, Yogyakarta.
Amrullah IK. 2003. Nutrisi Ayam Broiler. Lembaga Satu Gunungbudi. Bogor.
Anonimous. 2004a. Kajian Masalah Kesehatan. http://www.litbang.depkes/flu
burung1.htm. [25 Januari 2004].
Anonimous. 2004b. Bagaimana Mengendalikan Influenza Unggas. http://www.
Poultryindonesia.com. [22 Desember 2003].
Anonimous. 2004c. Flu Burung. http://www.infeksi.com/penyakit_flu burung
1.htm [15 Januari 2004].
Anonimous. 2004d. Manual of Diagnostic Tests and Vaccines for Terrestrial Animal. Edisi ke-5. http:www.oie.int/eng/normes/manual/A-37.htm.
[11 September 2005].
Bano S, Naeem K, Malik SA. 2003. The Fifth International Symposium on Avian Influenza. The University of Georgia, Athens, GA.
Direktoral Jendral Bina Produksi Peternakan. 2004. Kebijakan Pemerintah RI Dalam Penanggulangan Wabah Avian Influenza. Makalah Seminar.
FKH, IPB. Bogor.
Dunn PA, Wallner EA, Lu H, Shaw DP, Kradel D. 2003. The Fifth International Symposium on Avian Influenza. The University of Georgia, Athens,
GA.
Ganong WF. 1998. Buku Ajar Fisiologi Kedokteran. Edisi 17. Widjajakusumah,
M, Dkk, penerjemah. Jakarta: EGC. Terjemahan dari: Review of Medical Physiology.
Guyton AC. 1995. Buku Ajar Fisiologi Kedokteran. Edisi 7. Bagian I. Tengadi,
K.A, Dkk, penerjemah; Oswari, editor. Jakarta: EGC. Terjemahan dari:
Text Book of Medical.
Lukman DW. 2005. Diktat Penyakit Zoonosis. Bagian Kesmavet, Departemen
Ilmu Penyakit Hewan dan Kesmavet, FKH, IPB. Bogor. Malole MBM. 2005. Komunikasi pribadi.
Malole MBM. 1988. Virologi. Pusat Antar Universitas. Institut Pertanian Bogor.
Mulia BH. 2005. Inaktivasi Virus Avian Influenza (AI) Untuk Pembuatan Vaksin
AI Inaktif dengan Penambahan Formalin Konsentrasi Bertingkat [skripsi]. FKH, IPB. Bogor.
Murphy FA, E. Paul JG, Marian CH, Michael JS. 1999. Veterinary Virology.
Third Edition. Academic Press. USA.
27 Rahardjo Y. 2004. Avian Influenza, Pencegahan, Pengendalian dan
Pemberantasannya: Hasil Investigasi Kasus Lapangan. Edisi I. PT
Gallus Indonesia Utama. Jakarta.
Russel PH, Edington N. 1986. Veterinary Viruses. Royal Veterinary College.
London.
Siregar R. 2003. Beternak Ayam Broiler Komersial. Penebar Swadaya. Jakarta.
Siswono. 2004. Vaksin Flu Burung Belum Maksimal. http://www.
Mediaindo.co.id. [ 10 Desember 2005].
Soejoedono RD, Handaryani E. 2005. Flu Burung. Penebar Swadaya. Jakarta.
Sudaryani T, Santoso H. 1994. Pembibitan Ayam Ras. Penebar Swadaya. Jakarta.
Syamsi L. 2003. Efektifitas Vaksinasi ND dengan Cara Spray pada Ayam Buras Diukur dari Kenaikan Titer Antibodi dan Berat Badan [skripsi]. FKH, IPB. Bogor.
Tizard. 1987. Pengantar Imunologi Veteriner. Edisi II. Partodiredjo, M,
penerjemah. Surabaya: Airlangga University Press. Terjemahan dari:
Introduction to Veterinary Immunology.
Utami S. 1998. Infeksi Buatan Virus ND pada burung puyuh (Coturnix coturnix Japonica) [skripsi]. FKH, IPB. Bogor.
Wibawan IWT, Soejoedono RD. 2003. Diktat Imunologi. Laboratorium
Imunologi, Departemen Penyakit Hewan dan Kesehatan Masyarakat Veteriner, FKH, IPB. Bogor.
Lampiran
UJI BEDA NILAI TENGAH MINGGU KE‐13 (UMUR)
Analysis of Variance Procedure Class Level Information Class Levels Values PERL 4 K1 K2 K3 K4 Number of observations in data set = 80 Analysis of Variance Procedure Dependent Variable: MG4 Source DF Sum of Squares Mean Square F Value Pr > F Model 3 14.03750000 4.67916667 14.25 0.0001 Error 76 24.95000000 0.32828947 Corrected Total 79 38.98750000 R‐Square C.V. Root MSE MG4 Mean 0.360051 11.43073 0.57296551 5.01250000 Source DF Anova SS Mean Square F Value Pr > F PERL 3 14.03750000 4.67916667 14.25 0.0001
Analysis of Variance Procedure Level of ‐‐‐‐‐‐‐‐‐‐‐‐‐MG13‐‐‐‐‐‐‐‐‐‐‐‐‐ PERL N Mean SD K1 20 5.45000000 0.51041779 K2 20 4.70000000 0.73269510 K3 20 5.40000000 0.50262469 K4 20 4.50000000 0.51298918 Analysis of Variance Procedure
Duncan's Multiple Range Test for variable: MG13
NOTE: This test controls the type I comparisonwise error rate, not the experimentwise error rate Alpha= 0.05 df= 76 MSE= 0.328289 Number of Means 2 3 4 Critical Range .3609 .3797 .3922 Means with the same letter are not significantly different. Duncan Grouping Mean N PERL A 5.4500 20 K1 A 5.4000 20 K3 B 4.7000 20 K2 B 4.5000 20 K4
UJI BEDA NILAI TENGAH MINGGU KE‐16 (UMUR)
Analysis of Variance Procedure Class Level Information Class Levels Values PERL 4 K1 K2 K3 K4 Number of observations in data set = 80 Analysis of Variance Procedure Dependent Variable: MG7 Source DF Sum of Squares Mean Square F Value Pr > F Model 3 4.93750000 1.64583333 0.89 0.4519 Error 76 141.05000000 1.85592105 Corrected Total 79 145.98750000 R‐Square C.V. Root MSE MG7 Mean 0.033821 20.99918 1.36232193 6.48750000 Source DF Anova SS Mean Square F Value Pr > F PERL 3 4.93750000 1.64583333 0.89 0.4519
Analysis of Variance Procedure Level of ‐‐‐‐‐‐‐‐‐‐‐‐‐MG16‐‐‐‐‐‐‐‐‐‐‐‐‐ PERL N Mean SD K1 20 6.45000000 1.31689427 K2 20 6.15000000 1.18210339 K3 20 6.85000000 1.26802789 K4 20 6.50000000 1.63835604 Analysis of Variance Procedure
Duncan's Multiple Range Test for variable: MG16
NOTE: This test controls the type I comparisonwise error rate, not the experimentwise error rate Alpha= 0.05 df= 76 MSE= 1.855921 Number of Means 2 3 4 Critical Range .8580 .9028 .9324 Means with the same letter are not significantly different. Duncan Grouping Mean N PERL A 6.8500 20 K3 A 6.5000 20 K4 A 6.4500 20 K1 A 6.1500 20 K2
29 UJI BEDA NILAI TENGAH MINGGU KE‐17 (UMUR)
General Linear Models Procedure Class Level Information Class Levels Values PERL 4 K1 K2 K3 K4 Number of observations in data set = 22 General Linear Models Procedure Dependent Variable: MG8 Source DF Sum of Squares Mean Square F Value Pr > F Model 3 2.42424242 0.80808081 0.59 0.6297 Error 18 24.66666667 1.37037037 Corrected Total 21 27.09090909 R‐Square C.V. Root MSE MG8 Mean 0.089485 21.82527 1.17062819 5.36363636 Source DF Type I SS Mean Square F Value Pr > F PERL 3 2.42424242 0.80808081 0.59 0.6297 Source DF Type III SS Mean Square F Value Pr > F PERL 3 2.42424242 0.80808081 0.59 0.6297
General Linear Models Procedure Level of ‐‐‐‐‐‐‐‐‐‐‐‐‐MG17‐‐‐‐‐‐‐‐‐‐‐‐ PERL N Mean SD K1 4 6.00000000 0.81649658 K2 6 5.33333333 0.81649658 K3 6 5.33333333 1.36626010 K4 6 5.00000000 1.41421356 General Linear Models Procedure
Duncan's Multiple Range Test for variable: MG17
NOTE: This test controls the type I comparisonwise error rate, not the experimentwise error rate Alpha= 0.05 df= 18 MSE= 1.37037WARNING: Cell sizes are not equal.Harmonic Mean of cell sizes= 5.333333 Number of Means 2 3 4 Critical Range 1.506 1.580 1.627 Means with the same letter are not significantly different. Duncan Grouping Mean N PERL A 6.0000 4 K1 A 5.3333 6 K2 A 5.3333 6 K3 A 5.0000 6 K4
UJI BEDA NILAI TENGAH MINGGU KE‐22 (UMUR)
Analysis of Variance Procedure Class Level Information Class Levels Values PERL 4 K1 K2 K3 K4 Number of observations in data set = 24 Analysis of Variance Procedure Dependent Variable: MG13 Source DF Sum of Squares Mean Square F Value Pr > F Model 3 1.12500000 0.37500000 0.76 0.5282 Error 20 9.83333333 0.49166667 Corrected Total 23 10.95833333 R‐Square C.V. Root MSE MG13 Mean 0.102662 9.096512 0.70118947 7.70833333 Source DF Anova SS Mean Square F Value Pr > F PERL 3 1.12500000 0.37500000 0.76 0.5282
Analysis of Variance Procedure Level of ‐‐‐‐‐‐‐‐‐‐‐‐‐MG22‐‐‐‐‐‐‐‐‐‐‐‐ PERL N Mean SD K1 6 7.50000000 0.54772256 K2 6 7.50000000 1.22474487 K3 6 8.00000000 0.00000000 K4 6 7.83333333 0.40824829 Analysis of Variance Procedure
Duncan's Multiple Range Test for variable: MG22
NOTE: This test controls the type I comparisonwise error rate, not the experimentwise error rate Alpha= 0.05 df= 20 MSE= 0.491667 Number of Means 2 3 4 Critical Range .8445 .8864 .9131 Means with the same letter are not significantly different. Duncan Grouping Mean N PERL A 8.0000 6 K3 A 7.8333 6 K4 A 7.5000 6 K1 A 7.5000 6 K2
UJI BEDA NILAI TENGAH MINGGU KE‐26 (UMUR) Analysis of Variance Procedure Class Level Information Class Levels Values PERL 4 k1 k2 k3 k4 Number of observations in data set = 20 Analysis of Variance Procedure Dependent Variable: MG17 Source DF Sum of Squares Mean Square F Value Pr > F Model 3 2.20000000 0.73333333 1.09 0.3832 Error 16 10.80000000 0.67500000 Corrected Total 19 13.00000000 R‐Square C.V. Root MSE MG17 Mean 0.169231 10.95445 0.8215838 7.50000000 Source DF Anova SS Mean Square F Value Pr > F PERL 3 2.20000000 0.73333333 1.09 0.3832
Analysis of Variance Procedure Level of ‐‐‐‐‐‐‐‐‐‐‐‐‐MG26‐‐‐‐‐‐‐‐‐‐‐‐ PERL N Mean SD k1 5 7.00000000 1.41421356 k2 5 7.40000000 0.54772256 k3 5 7.80000000 0.44721360 k4 5 7.80000000 0.44721360 Analysis of Variance Procedure
Duncan's Multiple Range Test for variable: MG26
NOTE: This test controls the type I comparisonwise error rate, not the experimentwise error rate Alpha= 0.05 df= 16 MSE= 0.675 Number of Means 2 3 4 Critical Range 1.102 1.155 1.189 Means with the same letter are not significantly different. Duncan Grouping Mean N PERL A 7.8000 5 k3 A 7.8000 5 k4 A 7.4000 5 k2 A 7.0000 5 k1
UJI BEDA NILAI TENGAH MINGGU KE‐31 (UMUR)
Analysis of Variance Procedure Class Level Information Class Levels Values PERL 4 K1 K2 K3 K4 Number of observations in data set = 20 Analysis of Variance Procedure Dependent Variable: MG23 Source DF Sum of Squares Mean Square F Value Pr > F Model 3 36.00000000 12.00000000 4.07 0.0252 Error 16 47.20000000 2.95000000 Corrected Total 19 83.20000000 R‐Square C.V. Root MSE MG23 Mean 0.432692 45.19885 1.71755640 3.80000000 Source DF Anova SS Mean Square F Value Pr > F PERL 3 36.00000000 12.00000000 4.07 0.0252
Analysis of Variance Procedure Level of ‐‐‐‐‐‐‐‐‐‐‐‐‐MG31‐‐‐‐‐‐‐‐‐‐‐‐ PERL N Mean SD K1 5 4.40000000 1.14017543 K2 5 4.00000000 2.34520788 K3 5 5.20000000 0.44721360 K4 5 1.60000000 2.19089023 Analysis of Variance Procedure
Duncan's Multiple Range Test for variable: MG31
NOTE: This test controls the type I comparisonwise error rate, not the experimentwise error rate Alpha= 0.05 df= 16 MSE= 2.95 Number of Means 2 3 4 Critical Range 2.303 2.415 2.485 Means with the same letter are not significantly different. Duncan Grouping Mean N PERL A 5.200 5 K3 A 4.400 5 K1 A 4.000 5 K2 B 1.600 5 K4