Bab II
Tinjauan Pustaka
Pengolahan limbah dengan cara fermentasi anaerobik telah lama dikenal. Produk akhir proses ini adalah campuran dari gas metana, karbondioksida, hidrogen dan sedikit hidrogen sulfida yang dikenal sebagai Biogas. Tetapi dalam tesis ini yang diinginkan adalah asam organik volatil yang merupakan produk antara dari proses pengolahan limbah secara anaerobik. Dalam bagian berikut akan dibahas beberapa hal tentang etanol, stillage ubi kayu, reaksi yang terjadi pada proses anaerobik serta faktor-faktor yang mempengaruhi proses anaerobik dalam reaktor partaian (batch).
II.1 Etanol
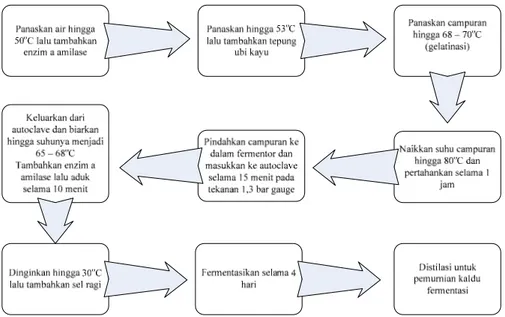
Etanol dapat dihasilkan dengan dua cara, yaitu sintesa kimia dan fermentasi. Proses yang ke dua menghasilkan etanol yang kemudian dikenal sebagai bioetanol. Bioetanol dapat dihasilkan dari berbagai macam bahan baku yang sudah cukup bervariasi. Proses yang umumnya dipakai adalah fermentasi partaian (batch) dengan bahan baku tetes tebu. Tetapi dengan berkembangnya teknologi, sudah mulai dikembangkan penggunaan bahan baku lain yaitu jagung, ubi kayu, sorghum, dan bahan lain yang struktur kimianya tidak sesederhana tetes tebu. Pada gambar II.1 disajikan skema pembuatan bioetanol berbahan baku ubi kayu.
Semua proses itu akan menghasilkan kaldu fermentasi yang membutuhkan pemisahan intensif untuk mendapatkan bioetanol dengan kadar tinggi. Proses tersebut adalah distilasi. Bioetanol yang didapat dengan cara ini berkisar pada konsentrasi 95% karena sifat campuran etanol-air yang azeotrop.
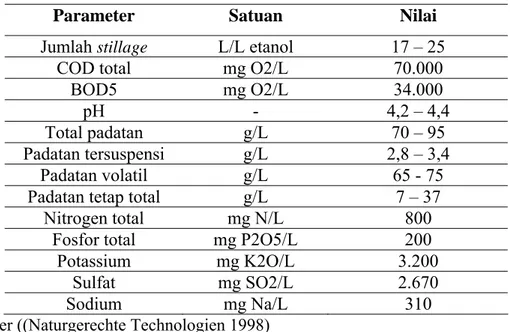
Stillage merupakan produk bawah dari distilasi kaldu fermentasi bioetanol. Komposisi stillage tergantung pada bahan baku produksi bioetanol. Meski berupa cairan tetapi di dalam stillage masih terdapat fasa padat, baik yang terlarut maupun yang berupa emulsi, sejumlah kurang dari 10%. Sebagian besar padatan itu berupa protein yang berasal dari sel-sel yeast yang terikut di kaldu fermentasi maupun dari bahan baku. Selain itu terdapat sisa gula, mineral serta lemak yang tak terkonversi saat fermentasi (Wilkins dkk., 2006). Biasanya pabrik bioetanol memproses stillage dengan cara dipekatkan sebelumnya dan dipakai sebagai pakan ternak atau diolah secara anaerobik. Industri bioetanol yang berbahan baku tetes tebu di Kuba melaporkan komposisi stillagenya pada tabel II.1.
Tabel II.1 Komposisi Stillage tetes tebu
Parameter Satuan Nilai
Jumlah stillage L/L etanol 17 – 25
COD total mg O2/L 70.000
BOD5 mg O2/L 34.000
pH - 4,2 – 4,4
Total padatan g/L 70 – 95
Padatan tersuspensi g/L 2,8 – 3,4
Padatan volatil g/L 65 - 75
Padatan tetap total g/L 7 – 37
Nitrogen total mg N/L 800
Fosfor total mg P2O5/L 200
Potassium mg K2O/L 3.200
Sulfat mg SO2/L 2.670
Sodium mg Na/L 310
Sumber ((Naturgerechte Technologien 1998)
Dari tabel di atas terlihat bahwa bahan organik yang ada sangat tinggi, nampak dari nilai COD yang mencapai 70.000 mg O2/L. Selain itu jumlah stillage yang dihasilkan juga besar, mencapai 17 - 25 L per liter bioetanol yang dihasilkan.
Pengolahan limbah yang kandungan bahan organiknya sangat tinggi agak menyulitkan. Dari dua macam proses pengolahan limbah secara biologis, proses secara anaerobik merupakan proses yang memberikan hasil memuaskan. Tidak saja dari sisi energi yang lebih hemat, tetapi juga dari sisi keberhasilannya (Kim dkk., 2006)
II.2 Asam organik volatil
Asam organik merupakan suatu senyawa hidrokarbon yang memiliki gugus karboksil, COOH sehingga dikenal juga sebagai asam karboksilat. Yang merupakan asam organik volatil adalah asam organik dengan atom karbon C2
hingga C4. Senyawa ini memiliki berat molekul rendah dan dapat menguap pada
tekanan atmosferik. (Gerardi dkk., 1994). Asam organik dengan atom C lebih dari 3 juga dinamakan asam lemak. Asam lemak di alam dijumpai dalam bentuk gliseridanya, yaitu berupa lemak. Bila lemak dihidrolisis maka akan didapatkan asam lemak penyusun lemak. Dalam bagian berikut ini akan diulas sedikit berbagai asam organik volatil yang dihasilkan oleh proses anaerobik.
II.2.1 Asam butirat (C4H8O2)
Asam butirat merupakan asam lemak berberat molekul 88 dengan titik didih 163,5oC dan rumus molekulnya CH3CH2CH2-COOH. Gambar II.2. menunjukkan
rumus bangun dari asam butirat yang termasuk dalam kelompok asam organik volatil karena memiliki 4 atom C.
Gambar II.2 Rumus bangun asam butirat
Dalam lemak hewan dan tanaman dijumpai dalam bentuk esternya, gliserida. Asam butirat dalam bentuk gliseridanya dapat dijumpai sebanyak 3 – 4% dalam mentega. Asam butirat dapat dihasilkan dari fermentasi gula dengan menggunakan mikroba anaerob obligat sesuai jalur metabolisme yang sesuai (Shuler dan Kargi, 2002).
II.2.2 Asam propionat (C3H6O2)
Asam propionat memiliki berat molekul 74 dengan titik didih 141oC, banyak digunakan sebagai penghambat pertumbuhan jamur dan beberapa jenis bakteri. Dapat juga dipakai sebagai senyawa intermediat dalam pembuatan serat selulosa sintetik, pestisida. Sama seperti asam butirat, maka asam propionat juga termasuk dalam kelompok asam organik volatil karena memiliki 3 atom C. Rumus molekulnya CH3CH2-COOH, dan hal ini nampak dalam rumus bangunnya seperti
terlihat dalam gambar II.3.
Gambar II.3 Rumus bangun asam propionat
Mikroba dari genus Propionibacterium dapat menghasilkan asam propionat dari proses metabolisme anaerobiknya. Bakteri dari genus ini dapat ditemukan di lambung hewan memamah biak dan kelenjar keringat manusia.
II.2.3 Asam Asetat (C2H4O2)
Senyawa ini merupakan senyawa karboksilat sederhana setelah asam format, berberat molekul 60. Memiliki suhu didih 118,1oC dan sangat korosif. Banyak dipakai sebagai bahan baku dalam pembuatan polietilen terephtalat, selulosa asetat atau polivinil asetat. Selain itu dikenal di kalangan awam sebagai asam cuka. Rumus molekulnya CH3-COOH, dengan rumus bangun seperti terlihat pada
gambar II.4.
Gambar II.4 Rumus bangun asam asetat
Asam asetat dapat dihasilkan dari fermentasi gula (glukosa) secara anaerob dan dilaksanakan oleh mikroba dari genus Clostridium. Berbeda dengan genus Acetobacter, maka genus Clostridium tidak tahan terhadap kadar asam yang tinggi (≥ 20%).
II.3 Proses Anaerobik
Menurut sejarahnya, proses anaerobik adalah pengertian dari istilah fermentasi. Tetapi di masa kini pengertian itu sudah berkembang menjadi lebih luas, berbagai kegiatan yang melibatkan mikroba akan disebut sebagai fermentasi.
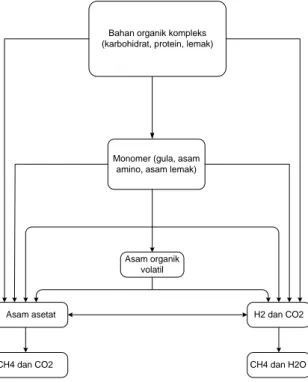
Para ahli mikrobiologi membagi tahapan reaksi dalam proses anaerobik menjadi enam tahap (Speece, 1996). Tetapi bila dicermati lebih lanjut, satu spesies mikroba dapat melaksanakan empat tahap pertama. Sehingga bila pembagian hanya berdasar mikroba yang terlibat, proses anaerobik akan dibagi menjadi dua kelompok reaksi saja. Kebanyakan penelitian menggunakan pembagian reaksi proses anaerobik menjadi empat kelompok. Gambar II.5.merupakan skema reaksi yang umum terjadi dan dipakai pada penelitian proses anaerobik.(Moletta, 2005 )
Bahan organik kompleks (karbohidrat, protein, lemak)
Monomer (gula, asam amino, asam lemak)
Asam asetat H2 dan CO2
Asam organik volatil
CH4 dan CO2 CH4 dan H2O
Gambar II.5 Skema reaksi umum dalam proses anaerobik
Pembagian di gambar II.5 di atas dilakukan dengan tidak hanya mengacu pada mikroba yang terlibat tetapi memperhatikan juga reaksi yang dikelola oleh mikroba yang bersangkutan. Sehingga pembagiannya menjadi empat tahap. Yaitu hidrolisis, asidogenesis, asetogenesis, dan metanogenesis.
Mikroba yang terlibat dalam proses anaerobik merupakan kultur campuran. Terbagi menjadi tiga kelompok besar sesuai reaksi yang dikelola. Yaitu kelompok hidrolitik/asidogenik, asetogenik/anaerobik asidogenik serta metanogenik anaerob. (Gerardi dkk., 1994) Dalam bagian selanjutnya akan dijelaskan lebih rinci tentang ke empat tahap reaksi dalam proses anaerobik.
II.3.1 Hidrolisis dan Asidogenesis
Karena ke dua tahap ini dikendalikan oleh mikroba yang sama, maka penjelasan tentang tahap ini disatukan. Mula-mula bahan organik berberat molekul besar yaitu karbohidrat, protein, lemak, yang tak larut dalam air akan dihidrolisis diubah menjadi monomernya yang lebih mudah larut dalam air. Bakteri hidrolitik dan sekaligus asidogenik yang anaerob fakultatif akan membentuk berbagai produk akhir tergantung dari substratnya yang selanjutnya akan dikonsumsi oleh mikroba tersebut untuk metabolismenya. Enzim yang terlibat dalam reaksi hidrolisis adalah dari jenis selulase, hemiselulase, amilase, lipase, serta protease.
Lipase ekstraseluler akan mengubah lemak menjadi asam lemak rantai panjang dan gliserol. Asam lemak selanjutnya akan didegradasi, melalui mekanisme oksidasi-β, menjadi asetil CoA untuk metabolisme mikroba. Gliserol hasil degradasi asam lemak rantai panjang ini akan masuk ke jalur EMP (Embden-Meyerhof-Parnas) dan dapat menghasilkan asam lemak rantai pendek yang volatil, seperti asam butirat, asam propionat, asam asetat, (Sukandar, 2002). Bakteri yang diketahui mampu mendegradasi lemak (lipolytic) adalah dari genus Clostridium, Sarcia, dan Staphylococcus. (Gerardi dkk., 1994).
Protein akan didegradasi menjadi asam amino oleh protease ekstraseluler yang dihasilkan oleh Bacteroides, Butylvibrio, Clostridium, Fusobacterium, Selenomonas, Streptococcus dan Peptococcus (Gerardi dkk., 1994). Hasil degradasi utama adalah amoniak. Tetapi bila dalam metabolismenya bisa membentuk piruvat, maka akan terbentuk asam organik volatil, (Shuler dan Kargi, 2002).
Selulase akan mendegradasi selulosa menjadi monosakarida, yaitu glukosa. Demikian juga pati, hanya enzim yang terlibat adalah amilase. Pektin didegradasi
oleh pektinase sedang silan akan didegradasi oleh silanase menjadi silosa. Bakteri anaerob dalam kelompok ini adalah dari genus Clostridium, Peptococcus, Fusobacterium, Bacteroides dan Staphylococcus (Gerardi dkk., 1994).. Selanjutnya adalah degradasi monosakarida menjadi asam organik volatil dilakukan oleh mikroba menggunakan bermacam-macam jalur metabolisme yang ada secara anaerobik. Salah satunya adalah jalur EMP (Embden-Meyerhof-Parnas) yang pada kondisi anaerobik dapat menghasilkan asam asetat (Shuler dan Kargi, 2002).
II.3.2 Asetogenesis
Dari tahap sebelumnya sudah dapat terbentuk sedikit asam asetat (20 %) dan H2
(4 %)dari monomer yang terbentuk di tahap hidrolisis. Pada tahap asetogenesis, oleh mikroba asetogenik anaerob obligat, akan dapat dihasilkan asam asetat dan hidrogen dari asam lemak rantai panjang hasil hidrolisis.
Salah satu karakteristik mikroba asetogen anaerob obligat adalah tidak tahan pada pH rendah atau kadar H2 tinggi. Tetapi karena proses menggunakan kultur
campuran, maka hidrogen yang terbentuk akan diubah oleh mikroba metanogen pengkonsumsi hidrogen serta pereduksi sulfat hingga asam organik rantai panjang akan terkonversi juga menjadi metana atau hidrogen sulfida.
Sebagai kelanjutan dari tahap ini adalah metanogenesis, yang dalam penelitian kali ini harus dihambat. Kesempurnaan tahap metanogenesis ditentukan oleh kandungan hidrogen yang dinyatakan dalam tekanan parsialnya. Asam propionat yang dihasilkan di tahap asidogenesis akan terhalang degradasinya menjadi metana bila kandungan hidrogen tinggi. Penyebabnya adalah hidrogen dalam jumlah banyak merupakan inhibitor bagi mikroba asetogen penghasil hidrogen obligat.
II.3.3 Metanogenesis
Bakteri metanogenik termasuk dalam kelompok anaerob obligat, hingga agak sulit untuk mengisolasinya. Hanya beberapa strain bakteri metanogenik ini yang menggunakan asam asetat sebagai substratnya dan dikonversi menjadi metana, Methanosarcina spp dan Methanosaeta spp. Hidrogen yang dihasilkan dapat
menganggu tahap asetogenesis dan metanogenesis. Sehingga mikroba metanogen yang mampu mengkonsumsi hidrogen juga diperlukan untuk menjaga kandungan hidrogen dalam media karena akan menurunkan kandungan CO2 dan diubah menjadi metana. Mikroba pereduksi sulfat juga dapat ditambahkan untuk menggunakan hidrogen dan menghasilkan asam asetat, (Ren dkk., 2007).
II.4 Faktor yang berpengaruh
Reaksi yang melibatkan mikroba harus sangat memperhatikan karakteristik mikroba tersebut. Karena selain mikroba harus bisa tumbuh dan berkembang biak, mikroba juga harus dapat menghasilkan produk yang diinginkan. Dalam rangka menghasilkan suatu produk, terkadang mikroba harus diinduksi untuk menghasilkan suatu enzim yang tidak secara alami dihasilkan, (Sukandar, 2002). Lingkungan dan nutrisi adalah dua faktor utama yang berperan. Beberapa diantaranya adalah pH, suhu, kadar air, kandungan udara atau oksigen, dan inhibitor. Selain itu, untuk keberhasilan produksi asam organik volatil dengan proses anaerobik terhadap stillage ubi kayu maka waktu tinggal serta kandungan COD umpan sangat berpengaruh. Selanjutnya akan dijelaskan faktor-faktor yang berpengaruh terhadap keberhasilan produksi asam organik volatil dari stillage ubi kayu dengan proses anaerobik.
1. pH
pH atau dikenal juga sebagai derajat keasaman merupakan salah satu syarat bagi lingkungan tumbuh yang sesuai bagi suatu mikroba. Selain itu pH memberi pengaruh nyata bagi kerja enzim karena tiap enzim memiliki pH kerja optimum.
Jumlah asam organik volatil akan dipengaruhi oleh pH proses. Pada penelitiannya, Chen dkk (2007) menyatakan bahwa makin tinggi pH maka jumlah asam organik volatil makin banyak. Jenis asam organik volatil yang dihasilkan sangat dipengaruhi oleh pH kultur. Pada pH 5,0 – 7,0 akan didapat asam butirat dan asam asetat dalam jumlah terbanyak. Sedangkan pada pH ≥
7,0 asam organik volatil terbanyak adalah asam propionat dan asam asetat (Fang dan Liu, 2002 ; Horiuchi dkk, 2002). Pada pengolahan air limbah industri pati didapat asam asetat pada pH optimal 5,9 (Ahn dan Hwang, 2004). Penggunaan mikroba dalam bentuk butiran menghasilkan produk yang serupa, pada pH 3,4 – 4,2 mendapatkan asam butirat dan asam asetat dalam jumlah terbanyak (Mu, dkk., 2006).
Karena dalam pembentukan asam organik volatil secara anaerobik ini menggunakan kultur campuran, maka jenis kultur juga turut menentukan jenis asam organik volatil yang dihasilkan. Penelitian yang dilakukan oleh Zoetemeyer, dkk.,(1982) melaporkan bahwa pada pH 8 didapatkan asam laktat, asam format serta etanol yang merupakan produk utamanya. Tetapi Horiuchi dkk., (2002) pada kondisi yang sama dengan mikroba yang berbeda mendapatkan hasil yang berbeda pula, yaitu asam propionat dan asam asetat sebagai produk utama.
Untuk mengatur pH stillage ubi kayu menjadi lebih basa biasa dipakai larutan Natrium Hidroksida. Tetapi jumlah ion Natrium dalam media yang lebih dari 5 g/L dapat menginhibisi mikroba (Feijoo dkk., 1995).
2. Suhu
Reaksi yang berlangsung dan dikelola oleh mikroba sama dengan reaksi kimia biasa. Salah satu karakteristik reaksi kimia adalah laju reaksi akan meningkat dengan naiknya suhu sesuai dengan hukum Arrhenius. Tetapi karena ada dua kelompok mikroba pengelola proses ini, maka pemilihan suhu juga harus memperhatikan dua kelompok mikroba ini.
Untuk kelompok mikroba termofilik, pada bioreaktor asidogenik, dengan lebih tingginya suhu proses tidak didapatkan metana di akhir proses asidogenesis. Berbeda dengan proses yang menggunakan kelompok mikroba mesofilik yang masih menghasilkan metana di akhir proses asidogenesis, (Youn dan Shin, 2005). Sedangkan asam organik volatil dominan yang dihasilkan di bioreaktor termofilik terdiri atas asam butirat dan asam asetat. Berbeda dengan hasil yang
didapat pada bioreaktor mesofilik, asam organik volatil yang dominan adalah asam propionat.
Bila proses anaerobik melalui reaksi asetogenesis dan metanogenesis, maka pada suhu tinggi akan lebih sedikit dihasilkan metana dibanding pada suhu rendah. Akibatnya asam organik volatil total akan makin banyak. (de la Rubia dkk., 2005 ; de la Rubia dkk 2006)
Melihat pengaruh suhu yang begitu besar, maka telah dipelajari cara mengubah suhu lingkungan kerja mikroba dari mesofilik ke termofilik. Bila suhu dinaikkan dengan perlahan, bioreaktor akan stabil dalam waktu yang lebih lama dibanding bila suhu dinaikkan mendadak. (Bouskova dkk., 2005)
Tetapi proses thermofilik membutuhkan reaktor yang lebih canggih karena harus dilengkapi pengatur suhu dan pemanas. Karena kalau suhu turun maka kerja mikroba thermofilik akan terganggu bahkan bisa mematikan. Sedangkan pada proses mesofilik, pada suhu ruang mikroba mesofilik masih bisa beraktivitas meski lebih lambat. Hal ini dapat dilihat pada gambar II.6. yang menunjukkan bahwa suhu optimum untuk pembentukan metana oleh mikroba mesofilik adalah pada suhu 35oC. (Robinson, 2005). Pada suhu itu juga didapat laju pertumbuhan tertinggi mikroba mesofilik, yaitu mendekati satu.
Gambar II.6 Kurva pertumbuhan mikroba mesofilik terhadap suhu Selain itu pada suhu mendekati 20oC, mikroba tidak mati tetapi dalam keadaan dormant. Laju pertumbuhan mikroba mesofilik akan turun bila suhu turun tetapi tidak membuat mikroba mesofilik mati. Sedangkan bila suhu naik, laju pertumbuhan turun bahkan mengakibatkan mikroba mesofilik mati.
3. Kadar air
Air diperlukan oleh mikroba untuk melarutkan nutrisi dan mentransfernya masuk ke dalam sel. Kadar air akan berpengaruh terhadap waktu yang dibutuhkan untuk proses proses. Makin kering maka waktu yang dibutuhkan akan makin lama. Hal ini disebabkan mikroba hidrolitik akan lebih sulit memasuki dan menembus fasa padat selain itu laju hidrolisis juga tidak optimum, akibatnya waktu yang dibutuhkan akan lebih lama. (Delgenes dkk., 2002)
4. Kandungan Oksigen
Proses berlangsung secara anaerob, tetapi mikroba hidrolitik dan asidogenik merupakan mikroba anaerob fakultatif, (Gerardi dkk., 1994). Sehingga meskipun mikroba asetogenik merupakan mikroba anaerob obligat, tetapi
Laju pertumbuhan spe
sifi k 10 20 30 40 50 Suhu (oC) 1.0 0.8 0.6 0.4 0.2
dormant tetapi viable ↔ mati
Digester asam
35 oC produksi CH
karena kerja dua kelompok mikroba sebelumnya maka kondisi anaerob bisa tercapai.
5. Kandungan Hidrogen
Dalam reaksi asidogenesis dan setogenesis akan dihasilkan gas H2. Sedangkan
mikroba penghasil asam asetat (asetogenik) kurang mampu beradaptasi pada kadar hidrogen tinggi. Pada penelitiannya, Mu dkk. (2006) menemukan bahwa pada saat tekanan parsial hidrogen mencapai 4x104 Pa maka kandungan metana nol. Selain itu makin banyak hidrogen dihasilkan maka asam butirat akan terbentuk makin banyak dan asam propionat makin sedikit. (Cheong dkk., 2006 ; Mu dkk., 2006)
6. Inhibitor
Yang dimaksud inhibitor disini adalah senyawa atau unsur kimia yang dapat menghambat proses. Logam berat berbahaya bagi proses anaerobik karena dapat mengendap bila bereaksi dengan ion sulfida atau karbonat hasil degradasi, (Gerardi dkk., 1994). Untuk menghambat raksi metanogenesis bisa ditambahkan inhibitor seperti reduktase mevastatin atau lovastatin yang akan menghambat pertumbuhan dan produksi mikroba penghasil metana, strain Methanobrevibacter. (Miller dkk, 2001)
7. Kandungan COD umpan
Kandungan COD menggambarkan kandungan bahan organik dalam umpan. Proses anaerobik memiliki satu kelebihan dibanding proses aerobik dalam hal kemampuannya mengolah umpan dengan COD tinggi (>5000 ppm).
Limbah etanol, stillage, merupakan limbah yang memiliki kandungan COD tinggi, mencapai 70.000 mg/L. Namun demikian kandungan COD yang tinggi akan menurunkan jumlah gas hidrogen yang terbentuk (Kyazze dkk., 2005) dalam penelitiannya mendapatkan kenaikan perolehan (yield) hidrogen sebesar 35% pada kadar glukosa 40 g/L dan 33% pada kadar glukosa 50 g/L.
Kadar COD yang rendah ini akan meningkatkan jumlah asam organik volatil total yang terbentuk. Hal ini juga dibuktikan dalam penelitian yang dilakukan
oleh Nugroho dan Yustendi (2007) dengan kandungan COD awal stillage ubi kayu 20.000 ppm didapat jumlah asam organik volatil total yang terbaik yaitu 0,233 g C asam organik volatil total/g C COD awal. Hal lain yang juga harus dipertimbangkan dalam pengaturan kandungan COD umpan, yaitu makin besar kandungan COD umpan akan menghasilkan lebih banyak asam asetat. (Nugroho dan Yustendi 2007)
8. Waktu tinggal
Untuk reaktor partaian (batch), waktu tinggal sangat menentukan kinerja reaktor. Desain reaktor partaian (batch) menginginkan waktu tinggal sependek mungkin dan didapat konversi setinggi mungkin.
Untuk mendapatkan asam organik volatil total sebanyak mungkin maka gas hidrogen juga harus sebanyak mungkin tetapi waktu tinggal tidak terlalu lama. Penelitian yang dilakukan dengan pH proses 5,9 dan suhu 35oC membutuhkan waktu 0,88 hari (Hwang dkk., 2001).
Waktu tinggal juga mempengaruhi jenis asam organik volatil yang terbentuk (Yang dkk., 2004). Penelitiannya pada limbah yang kadar nitrogennya dikurangi hingga < 1,2 g/L. Pada saat suhu 34oC dan waktu tinggal 2,4 hari serta suhu 35oC dan waktu tinggal 2,1 hari didapat asam asetat serta asam butirat yang terbanyak. Sedangkan untuk asam propionat, makin lama dan makin tinggi suhu, konsentrasinya juga makin meningkat.
II.5 Produksi asam organik volatil
Ada dua macam cara menghasilkan asam organik volatil secara anaerobik. Yang pertama adalah asidogenesis total dan yang kedua adalah asidogenesis sebagian. Perbedaannya pada jumlah produk yang dihasilkan. Bila asidogenesis total, maka semua komponen umpan akan diubah menjadi asam organik volatil. Proses ini membutuhkan peralatan yang lebih besar dibanding dengan asidogenesis sebagian. Pada asidogenesis sebagian maka asam organik volatil yang dihasilkan hanya precursor utama bagi terbentuknya metana, yaitu asam asetat dan asam
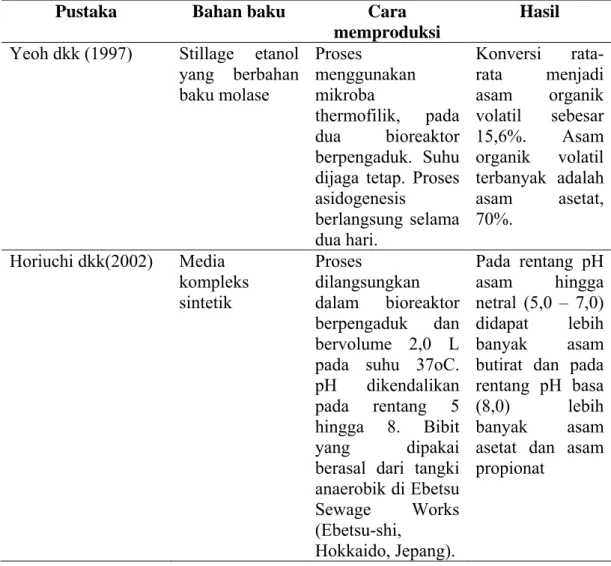
butirat. Karena tidak semua komponen umpan diubah menjadi asam organik volatil, maka peralatan yang dibutuhkan juga lebih kecil. (Hwang dkk., 2001) Untuk memaksimalkan produksi asam organik volatil ini ada beberapa hal yang cukup penting untuk dikaji. Sebagai perbandingan , pada tabel II.2. ditampilkan beberapa penelitian yang telah dilakukan dengan beberapa bahan baku dan kondisi proses yang berbeda.
Tabel II.2 Produksi asam organik volatil
Pustaka Bahan baku Cara
memproduksi
Hasil Yeoh dkk (1997) Stillage etanol
yang berbahan baku molase Proses menggunakan mikroba thermofilik, pada dua bioreaktor berpengaduk. Suhu dijaga tetap. Proses asidogenesis berlangsung selama dua hari. Konversi rata-rata menjadi asam organik volatil sebesar 15,6%. Asam organik volatil terbanyak adalah asam asetat, 70%. Horiuchi dkk(2002) Media kompleks sintetik Proses dilangsungkan dalam bioreaktor berpengaduk dan bervolume 2,0 L pada suhu 37oC. pH dikendalikan pada rentang 5 hingga 8. Bibit yang dipakai berasal dari tangki anaerobik di Ebetsu Sewage Works (Ebetsu-shi, Hokkaido, Jepang). Pada rentang pH asam hingga netral (5,0 – 7,0) didapat lebih banyak asam butirat dan pada rentang pH basa (8,0) lebih banyak asam asetat dan asam propionat
Tabel II.3 Produksi asam organik volatil (lanjutan)
Pustaka Bahan baku Cara
memproduksi
Hasil Lata dkk (2002) Daun teh dan
limbah sayur mayur dari pasar Kedua macam bahan diproses kontinyu pada 37oC selama 24 dan 300 jam dengan cara ekstraksi padat-cair (leaching) menggunakan air. Mikroba yang dipakai adalah mikroba alami yang
ada di daun
Pada ke dua jenis bahan, asam asetat merupakan komponen terbesarnya meski dalam komposisi yang berbeda. Asam organik volatil lain yang dihasilkan oleh limbah sayur mayur adalah terurut berdasar jumlah sebagai asam propionat > asam butirat > asam valerat dan
asam isobutirat. Sedang pada limbah daun teh dihasilkan asam isobutirat > asam isovalerat > asam
propionat Ahn dkk(2004) Limbah industri
pati Bioreaktor CSTR skala laboratorium Pada pH 5,9 suhu 36,1oC dan waktu tinggal hidrolik 0,56 hari didapat produksi optimal asam asetat.
Tabel II.4 Produksi asam organik volatil (lanjutan)
Pustaka Bahan baku Cara
memproduksi
Hasil Panagiotis dan.
Oldham (2004)
Lumpur primer Dipakai dua jenis bioreaktor, CMR (Completely Mixed Reactor) dan UASB (Upflow Anaerobic Solid Blanket). Proses dilangsungkan pada pH yang dikendalikan dan tidak dikendalikan
Pada kedua jenis reaktor didapat bahwa pada rentang pH 4,3-5,2 tidak mempengaruhi laju pembentukan asam organik volatil serta penurunan COD. Tetapi pada rentang pH yang lebih tinggi (5,9 – 6,2) didapat penurunan laju pembentukan asam organik volatil. Asam asetat merupakan produk utama proses ini. Yang dkk(2004) Limbah
peternakan babi (swine waste water)
Kadar amoniak dalam limbah diatur dengan cara aerasi limbah hingga didapat kadar amoniak tertentu. Produksi asam dilangsungkan dalam CSTR. Proses berlangsung selama 1 hingga 3 hari pada 25oC – 35oC, tanpa pengendalian pH karena sudah ada amoniak.
Hasil yang didapat adalah pada waktu tinggal 2,4 hari dan
suhu 34oC didapatkan asam asetat pada konsentrasi maksimalnya. Sedangkan pada waktu tinggal 2,1 hari dan suhu 35oC akan didapat asam butirat dalam jumlah
maksimalnya.
Asam propionat akan makin banyak bila waktu tinggal
dan suhu meningkat. Hasil
ini didapat pada konsentrasi awal amoniak 1,2 g/L.
Tabel II.5 Produksi asam organik volatil (lanjutan)
Pustaka Bahan baku Cara
memproduksi
Hasil Youn, (2005) Limbah pangan
(food waste) Proses dalam bioreaktor asidogenik pada beban organik yang bervariasi dengan kondisi termofilik dan mesofilik
Pada kondisi termofilik didapat asam asetat dan asam butirat sebagai komponen terbanyak sedang pada kondisi mesofilik lebih banyak asam propionat Cheong dan
Hansen (2006) Limbah sintetik yang kaya karbohidrat Produksi asam menggunakan CMBR (Completely Mixed Batch Reactor) dengan pengendalian pH pada 4,6, 5,7, dan 6,8 menggunakan kultur campuran bakteri anaerobik yang sudah dikondisikan pada pH asam
Hasil yang didapat adalah kadar asam butirat berbanding lurus dengan jumlah hidrogen yang terbentuk. Hal ini nampak pada pH media 5,7 yang terkendali didapat hidrogen dalam jumlah terbesar dan asam butirat merupakan asam organik volatil yang dominan. Kalau asam propionat dan etanol dihasilkan dalam jumlah banyak, maka kandungan hidrogen hanya sedikit.
Tabel II.6 Produksi asam organik volatil (lanjutan)
Pustaka Bahan baku Cara
memproduksi
Hasil
Nie dkk (2007) Limbah sintetik yang kandungan glukosanya tinggi Menggunakan dua bioreaktor yang saling terhubung dengan pipa karet silikon. Pada bioreaktor pertama berlangsung
produksi asam asetat oleh mikroba asetogen sintrofik. Pada bioreaktor ke dua mikroba yang bekerja adalah mikroba homoasetogen, mengubah CO2 dan H2 dari bioreaktor pertama menjadi asam asetat.
Yield asam asetat lebih tinggi 87% dibanding bioreaktor kontrol yang tidak
terjadi reaksi homoasetagenesis.
Juga lebih tinggi 52% dibanding bioreaktor kontrol (bioreaktor A
saja) yang mengeluarkan gas
satu kali dalam sehari. Nugroho dan Yustendi (2007) Stillage etanol ubi kayu Proses secara partaian dalam erlenmeyer bervolume 5,0 L pada pH ± 6 dan suhu 35oC. Bibit yang dipakai adalah kotoran sapi dari Lembang-Bandung. Dilakukan penambahan nitrogen untuk mengurangi kandungan H2 dalam reaktor.
Pada masa inkubasi 40 jam dan kandungan COD awal 20 g/L didapat produksi asam organik volatil total
dalam jumlah terbanyak.
Makin besar kandungan COD umpan makin banyak dihasilkan asam asetat. Penurunan COD terbesar pada COD umpan 25 g/L
Tabel II.7 Produksi asam organik volatil (lanjutan)
Pustaka Bahan baku Cara
memproduksi
Hasil
Nie dkk (2008) Limbah sintetik yang kandungan glukosanya tinggi Menggunakan dua bioreaktor yang saling terhubung dengan pipa karet silikon. Pada bioreaktor pertama berlangsung
produksi asam asetat oleh mikroba asetogen sintrofik. Pada bioreaktor ke dua mikroba yang bekerja adalah mikroba homoasetogen, mengubah CO2 dan H2 dari bioreaktor pertama menjadi asam asetat. Gas sisa disirkulasikan dan substrat masuk dengan operasi fed
– batch.
Yield asam asetat lebih tinggi 47% dibanding bioreaktor kontrol yang tidak terjadi sirkulasi gas.