KAJIAN PROSES PRODUKSI XILANASE DARI ISOLAT
BAKTERI ALKALOFILIK MENGGNAKAN MEDIA
XILAN TONGKOL JAGUNG
NUR RICHANA
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Dengan ini saya menyatakan bahwa disertasi Kajian Proses Produksi Xilanase dari Isolat Bakteri Alkalofilik Lokal Menggnakan Media Xilan Tongkol Jagung adalah karya saya sendiri dengan arahan komisis pembimbing dan belum pernah diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir disertasi ini
Bogor, Juli 2006
NUR RICHANA NIM P25600006
NUR RICHANA, Kajian Proses Produksi xilanase dari Isolat Bakteri Alkalofilik Menggnakan Media Xilan Tongkol Jagung dibimbing oleh TUN TEDJA IRAWADI, M. ANWAR NUR, ILLAH SAILAH, KHASWAR SYAMSU, YANDRA ARKEM AN.
Xilanase merupakan enzim ekstraseluler yang dihasilkan oleh mikroba, dapat menghidrolisis xilan (hemiselulosa) menjadi xilo-oligosakarida dan xilosa. Xilanase yang bersifat termostabil dan tahan pada pH tinggi dapat digunakan untuk pemutihan pulp pada proses pembuatan kertas karena dapat mensubstitusi klor.
Kajian proses produksi xilanase dari isolat bakteri alkalofilik menggunakan media xilan tongkol jagung telah dilakukan melalui isolasi dan seleksi bakteri, proses produksi dan karakterisasi xilanase yang dihasilkan oleh isolat bakteri menggunakan xilan tongkol jagung.
Isolat Bacillus pumilus RXAIII-5 adalah isolat yang berasal dari tanah kapur dinyatakan sebagai isolat bakteri potensial d ibanding 24 isolat lainnya. Ekstraksi xilan dari tongkol jagung menggunakan NaOCl 0,5% dan etanol 95% dengan perbandingan 1:3 (v/v) menghasilkan rendemen tertinggi (12,95%). Xilan yang dihasilkan memiliki kemurnian (pola kromatogram) hampir sama dengan oat spelt xylan, dan bersifat sangat larut dalam alkali (NaOH 1%) dan larut dalam air panas.
Kondisi proses optimum pada suhu 35oC, pH = 7 dan agitasi = 140 rpm pada skala 50 ml dengan hasil aktivitas spesifik 655,321 U/mg protein. Optimasi proses pada Bioreaktor-2l pada aerasi 1 vvm dan agitasi 200 rpm dengan hasil efisiensi penggunaan substrat untuk pembentukan produk YP/S sebesar 50,744 U/g substrat. Sifat reologi cairan
kultivasi mengikuti perilaku cairan Non-Newtonian, termasuk pseudoplastik (k =0,179 g cm-1 det -1, n =0,3212), dan aliran bersifat turbulen. Tenaga untuk menggerakkan impeller sebesar 0,228 HP, tenaga untuk sistem beraerasi/unit volume 0,2665 HP/m3. Hasil perhitungan penggandaan skala 10 000 liter dengan volume kerja 6500 diperoleh tinggi bioreaktor 4,83 m, diameter tanki 1,623 m, diameter pengaduk jenis turbin pipih 0,686 m. Laju aerasi yang diperlukan 0,27 vvm dan kecepatan agitasi 37,18 rpm.
Pengendapan xilanase dengan amonium sulfat yang dilanjutkan dengan dialisis menghasilkan aktivitas spesifik tertinggi (267,1 U/mg) dibanding pengendapan dengan aseton (131,1 U/mg) dan etanol (186,65 U/mg). Purifikasi menghasilkan 3 fraksi xilanase.
Xilanase yang dihasilkan memiliki Karakteristik sebagai berikut : pH dan suhu optimum 9 dan 50oC, nilai Km dan Vmaks berturut-turut adalah 6 mg/ml dan 0,2 mol/menit. Ion Fe3+ merupakan aktivator terkuat, dan Mg2+ merupakan inhibitor. Produk hidrolisis xilan oleh xilanase terbanyak adalah xilosa (35,24 mg/100ml), dan glukoxilan (14,65 mg/100 ml), dan tidak terdeteksi selulase. Xilanase ini prospektif untuk proses pemutih kertas.
Harga pokok xilanase pada media xilan dari tongkol jagung Rp32,327 /Unit/mg protein, sedangkan pada media oat spelt xylane Rp 43,104/Unit/mg protein.
NUR RICHANA, Study of Production Process of Xylanase from Alkalophillyc Bacterium Isolate Grown on Corn Cob Xylane. Under the Direction TUN TEDJA IRAWADI, M. ANWAR NUR, ILLAH SAILAH, KHASWAR SYAMSU, YANDRA ARKEMAN.
Xylanase is an extracelulair enzyme which is produced by microorganism. This enzyme is able to hydrolise xylane (hemicelulose) to produce xylooligosaccharide and xylose. Thermo-alkalophillyc xylanase is an agent of pulp whitening process instead of or substitute of chlorine.
Study of Production Process of xylanase from alkalophillyc bacterium isolate in corn cob xylane medium was started with isolation and selection of xylanase producing bacteria, production process technology and characterization of xylanase produced by bacterium isolate in corn cob xylan medium.
Isolate Bacillus pumilus RXAIII-5 originated from lime or alkaline soil is more potential isolate in xylanase production than other 24 isolates. The xylan was extracted from corn cob using 0.5% NaOCl and 95% ethanol : supernatant = 1 : 3 (v/v), yielding 12.95%. The highest solubility of xylane was in alkaline solvent (NaOH 1%) and hot water.
The optimum processing condition was obtained at temperature 35oC, pH 7, and agitation rate 140 rpm in 50 ml scale. The optimum condition for fermentation in Biostat 2l-bioreactor was reached at 1 vvm and 200 rpm aeration and agitation, respectively. In this condition the efficiency of substrate consumption to produce xylanase (Yp/s) was
50.744 U.g-1 substrate. The properties of liquid cultivation medium followed non-Newtonian and was categorized as pseudoplastic (k=0.179 g.cm-1.second-1 and n=0.3212) and showed turbulence flow. Energy consumption to run impeller in aeration system per unit volume was 0.2665 HP.m-3. Demension of scaling up to 10 000 liter of bioreactor with 6 500 liter fermentation vessel was 4.83 m height and 1.623 m diameter tank of bioreactor and 0.686 m of impeller. Aeration rate and agitation speed requirement were 0.27 vvm and 37.18 ppm, respectively.
Precipitation of xylanase using ammonium sulphate followed by dialyzes produced a higher specific activity (267.1 U.mg-1) than using acetone (131.1 U.mg-1) and ethanol (186.65 U.mg-1). Purification produced three fractions of xylanase.
Xylanase characteristics consist of pH and temperature (9 and 50o C), Km and Vmax value 6 mg.ml-1 and 0.2 mol.minute-1, respectively. The Fe2+ is the strongest activator and Mg2+ is the strongest inhibitor. Hydrolysis of xylane by xylanase produced the proportion of xylose (35.24 mg.100ml-1) and glucoxylane (14.65 mg.100ml-1). This enzyme was detected as cellulose- free xylanase. Xylanase is a prospective agent for biobleaching of paper.
The price of xylanase from xylan of corn cob medium (Rp32,327 /Unit/mg protein) is less than the price of xylanase from oat spelt xylan medium (Rp 43,104/Unit/mg protein).
KAJIAN PROSES PRODUKSI XILANASE DARI ISOLAT
BAKTERI ALKALOFILIK MENGGUNAKAN MEDIA
XILAN TONGKOL JAGUNG
NUR RICHANA
Disertasi
sebagai salah satu syarat untuk memperoleh gelar
Doktor pada
Program Studi Teknologi Industri Pertanian
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Alkalofilik Menggnakan Media Xilan Tongkol Jagung
Nama : Nur Richana
No Pokok Mahasiswa : P25600006
Menyetujui Komisis Pembimbing
Prof. Dr. Ir. Tun Tedja Irawadi
Ketua
Prof. Dr. Ir. Anwar Nur, MSc Dr. Ir. Illah Sailah, MS Anggota Anggota
Dr. Ir. Khaswar Syamsu, MSc Dr. Ir. Yandra Arkeman, M. Eng
Anggota Anggota
Ketua Program Studi
Teknologi Industri Pertanian Dekan Sekolah Pascasarjana
Dr. Ir. Irawadi Jamaran Dr. Ir. Khairil A Notodiputro MS
Penulis dilahirkan di Temanggung pada tanggal 25 Juli 1954 sebagai anak bungsu dari sebelas bersaudara pasangan Bapak Achmad Qodli (almarhum) dan Ibu Djuwairiah (almarhumah). Pendidikan sarjana ditempuh di jurusan Teknologi Hasil Pertanian, Fakultas Teknologi Pertanian, Universitas Gajah Mada. Lulus sarjana Teknologi Pertanian pada tahun 1982. Pada tahun 1994 penulis melanjutkan studi program magister pada program studi Teknologi Industri Pertanian Sekolah Pascasarjana IPB Bogor dan lulus pada tahun 1997. Kemudian pada tahun 2000 melanjutkan ke program doktor pada jurusan yang sama.
Penulis bekerja sebagai peneliti di Badan Penelitian dan Pengembangan Pertanian, pada tahun 1983 - 1993 di Balai Penelitian Tanaman Pangan Maros Sulawesi Selatan, kemudian tahun 1993 - 1996 di Balai Penelitian Tanaman Pangan Bogor dan tahun 1997 - 2003 di Balai Penelitian Bioteknologi Pertanian Bogor (Balitbio). Sejak tahun 2003 sampai sekarang di Balai Besar Penelitian dan Pengembangan Pasapanen Pertanian Bogor, dengan jabatan fungsional Ahli Peneliti Muda.
Penulis menikah pada tahun 1978 dengan Singgih Andyantoro, dikaruniai tiga orang putra, Nurendrantoro (1979), Achmad Arie Wibowo (1981), dan Andika Setya Muhamad (1984), menantu Anindita Damayanti dan seorang cucu Muhamad Nikkei Nurenditia Yusuf (2004).
Alhamdulillahi rabbil 'aalamin, segala puji syukur dipanjatkan ke hadirat Allah SWT, karena dengan kehendak Nya dan atas rahmat serta karunia Nya disertas i ini dapat diselesaikan. Penulis menyampaikan rasa hormat dan terima kasih yang tulus kepada Prof.Dr.Ir.Tun Tedja Irawadi selaku Ketua Komisi Pembimbing atas segala curahan waktu, bimbingan, arahan, serta dorongan moral dengan penuh dedikasi kepada penulis sejak awal sampai dengan selesainya disertasi ini.
Penghargaan dan ucapan terima kasih yang tulus penulis sampaikan juga kepada Prof.Dr.M.Anwar Nur M.Sc., Dr.Illah Sailah MS., Dr. Ir.Khaswar Syamsu M.Sc. dan Dr. Ir. Yandra Arkeman M.Eng., masing-masing selaku Anggota Komisi Pembimbing yang telah banyak memberikan bimbingan, arahan, serta dorongan moral dengan penuh dedikasi kepada penulis.
Pada kesempatan ini penulis juga mengucapkan terima kasih kepada Bapak Dr.Ir.Irawadi Jamaran selaku Ketua Program Studi Teknologi Industri Pertanian, Dekan Sekolah Pascasarjana IPB, Dekan Fateta IPB, Rektor IPB dan staf penga jar Program Studi Teknologi Industri Pertanian atas segala bantuannya. Disamping itu, penghargaan penulis sampaikan kepada Prof. Dr. Ir. Djumali Mangunwidjaja DEA atas kesediaan menjadi penguji diluar komisi pembimbing.
Ucapan terima kasih yang tak ternilai kepada Bapak Achmad Qodli dan Ibunda Djuwairiyah yang telah tiada, yang sebelumnya selalu mendorong ananda untuk melanjutkan studi. Terimakasih kepada kakanda Affan Achmad sebagai pengganti orang tua, atas perhatian, dorongan dan semangat yang telah diberikan. Penghargaan dan terimakasih kepada suami kakanda Singgih Andyantoro dan anak-anak terkasih Rendra dan Anin, Arie, Aang juga cucu tersayang Nik kei yang dengan kesabaran dan keikhlasan telah memberikan dorongan moral, material, dan selalu berdoa memohon kepada Allah SWT untuk kesuksesan penulis.
Penghargaan dan terima kasih penulis sampaikan kepada Kepala Balai Besar Bioteknologi dan Sumberdaya Genetika, Kepala Balai Besar Penelitian dan Pengembangan Pascapanen, Kepala Badan Penelitian dan Pengembangan Pertanian yang telah memberikan ijin untuk mengikuti pendidikan program doktor (S3) di IPB.
banyak membantu pelaksanaan penelitian ini.
Ucapan terimakasih penulis sampaikan kepada sahabat-sahabat mahasiswa Pascasarjana Program Studi Teknologi Industri Pertanian, khususnya angkatan 2000 atas segala jalinan kasih sayang, kerjasama dan kebersamaan dalam menempuh pendidikan.
Kepada semua pihak yang telah membantu dengan tulus selama mengikuti pendidikan sampai selesainya disertasi ini, d isampaikan terima kasih.
Seperti pepatah ’tak ada gading yang tak retak’ penulis menyadari bahwa disertasi ini tidak luput dari kekurangan dan kesalahan. Oleh sebab itu penulis harapkan masukan, kritikan atau saran agar hasil penelitian ini dapat dikembangkan lebih lanjut untuk perkembangan kemajuan ilmu pengetahuan.
Bogor, Juli 2006
Halaman
SURAT PERNYATAAN ii
ABSTRAK iii
ABSTRACT v
LEMBAR JUDUL vii LEMBAR PENGESAHAN viii
RIWAYAT HIDUP ix
PRAKATA x DAFTAR ISI xii
DAFTAR TABEL xv
DAFTAR GAMBAR xvii
DAFTAR LAMPIRAN xix PENDAHULUAN ... 1
Latar Belakang …... 1
Tujuan Penelitian ………... 3
Hipotesis ……….... 3
Ruang Lingkup Penelitian ……… ... 4
Kerangka Pemikiran ... 5
TINJAUAN PUSTAKA ... 6
Struktur Xilan ………... 6
Potensi Limbah Jagung Sebagai Sumber Xilan …...………... 8
Xila nase ………...……. 8
Mikroba Penghasil Xilanase ... 10
Media Pertumb uhan Mikroba Penghasil Xilanase…………... 12
Kultivasi Mikroba Penghasil Xilanase …...…...………. 15
Kinetika Produksi Enzim Xilanase ... 19
Sifat Reologi Cairan Kultivasi ... 21
Aplikasi Xilanase ... 23
Tahapan Penelitian ... 27
Metode Penelitian ... 27
- Isolasi, Seleksi dan Identifikasi Bakteri Penghasil Xilanase ……...……... 28
- Formulasi Media Kultivasi Produksi Xilanase Dengan Media Bersubstrat Oat Spelt Xylan... 30
- Ekstraksi Xilan Dari Tongkol Jagung ... 31
- Formulasi Media Kultivasi Produksi Xilanase dengan Media Bersubstrat Xilan Dari Tongkol Jagung ... 33
- Optimasi Kondisi Proses ... 33
- Kinetika Kultivasi Dalam Bioreaktor Biostat-B-2l... 34
- Sifat Reologi Cairan Kultivasi ... 35
- Karakterisasi Enzim Xilanase dari Isolat Bakteri Terpilih ... 35
HASIL DAN PEMBAHASAN ... 39
Isolasi dan Seleksi Bakteri Penghasil Xilanase ………... 39
Identifikasi Isolat Bakteri Unggul Penghasil Xilanase... 45
Formulasi Media Tahap I (Bersubstrat Oat Spelt Xylan) ... 47
Ekstraksi Xilan Dari Tongkol Jagung ... 52
Formulasi Media Tahap II (Bersubstrat Xilan dari Tongkol Jagung)... 57
Optimasi Kondisi Proses Kultivasi Bakteri Bacillus pumilus RXA III-5 ... 61
A. Optimasi Kondisi Proses Skala 50 ml ... 61
B. Optimasi Agitasi, Aerasi Kultivasi Bacillus Pumilus RXA III-5 Pada Bioreaktor ... 66
C. Kinetika Kultivasi Bacillus pumilus RXAIII-5 ... 69
Sifat Reologi Cairan Kultivasi ... 71
Karakterisasi Xilanase ... 74
A. Pengendapan dan Pemurnian ………..……... 74
B. Penentuan pH dan Suhu Optimum... 77
pH Optimum Xilanase ………... 77
pumilus RXAIII-5 ... 81
D. Pengaruh Beberapa Ion Logam Terhadap Aktivitas Xilanase... 83
E. Analisis Produk Hasil Hidro lisis Xilan ... 85
F. Kemampuan Enzim Kasar Mendegradasi Substrat spesifik ... 86
Analisis Finansial ………...….... 87
SIMPULAN DAN SARAN... 91
DAFTAR PUSTAKA... 94
Halaman
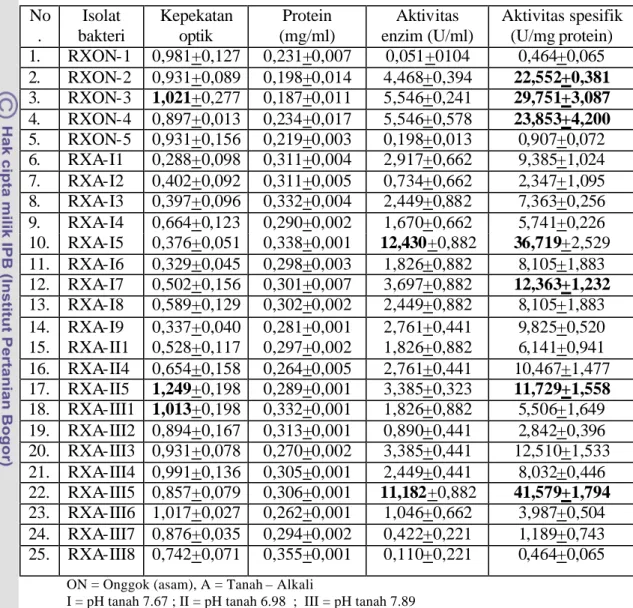
Tabel 1. Kadar (%) xilan dari beberapa limbah hasil pertanian ... 7 Tabel 2. Beberapa mikroba penghasil endoxilanase... 11 Tabel 3. Media pertumbuhan bakteri penghasil xilanase ... 15 Tabel 4. Kepekatan optik, kand ungan protein, aktivitas enzim dan
aktivitas spesifik dari beberapa isolat bakteri penghasil xilanase… 40 Tabel 5. Seleksi isolat bakteri alkalofil ik penghasil xilanase... 42
Tabel 6. Identifikasi isolat bakteri unggul penghasil xilanase ... 45 Tabel 7. Analisis agam protein terlarut, aktivitas xilanase dan
aktivitas spesifik dari formulasi media tahap I... 47 Tabel 8. Formulasi media berdasarkan hasil pengamatan
protein, aktivitas xilanase dan aktivitas spesifik... 51 Tabel 9. Neraca masa ekstraksi xilan dari tongkol jagung ... 54 Tabel 10. Kelarutan xilan dalam beberapa pelarut ... 54 Tabe l 11. Analisis ragam protein terlarut, aktivitas xilanase dan
aktivitas spesifik dari formulasi media tahap II... 57 Tabel 12. Formulasi media berdasarkan hasil pengamatan p rotein,
aktivitas xilanase dan aktivitas spesifik ... 59 Tabel 13. Analisis ragam protein terlarut, aktivitas xilanase, aktivitas
spesifik dari hasil optimasi kondisi proses kultivasi
Bacillus pumilus RXA III-5 pada skala 50 ml ... 61 Tabel 14. Penentuan Yp/s, Yp/x dan Yx/s kultivasi Bacillus pumilus
RXAIII-5 pada beberapa laju aerasi dan agitasi... 71 Tabel 15. Penggandaan skala produksi xilanase menggunakan
bioreaktor 10 000 liter... 75 Tabel 16. Pemurnian xilanase dari Baci llus pumilus RXAIII-5 ... 75 Tabel 17. Aktivitas xilanase dengan perlakuan beberapa senyawa
yang mengandung ion logam... 84 Tabel 18. Aktivitas enzim pada beberapa substrat ... 86
Halaman
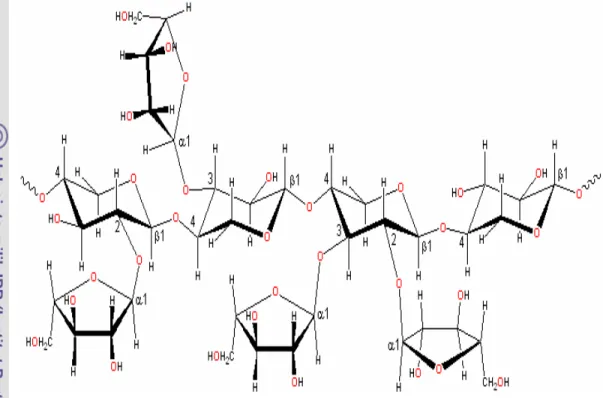
Gambar 1. Struktur xilan (Sunna dan Antranikian, 1997)... 7
Gambar 2. Struktur xilan dan enzim yang terlibat dalam hidrolisisnya (Beg et al. 2001) ... 9
Gambar 3. Diagram alir tahapan kerja isolasi dan seleksi isolat bakteri unggul penghasil xilanase……… 29
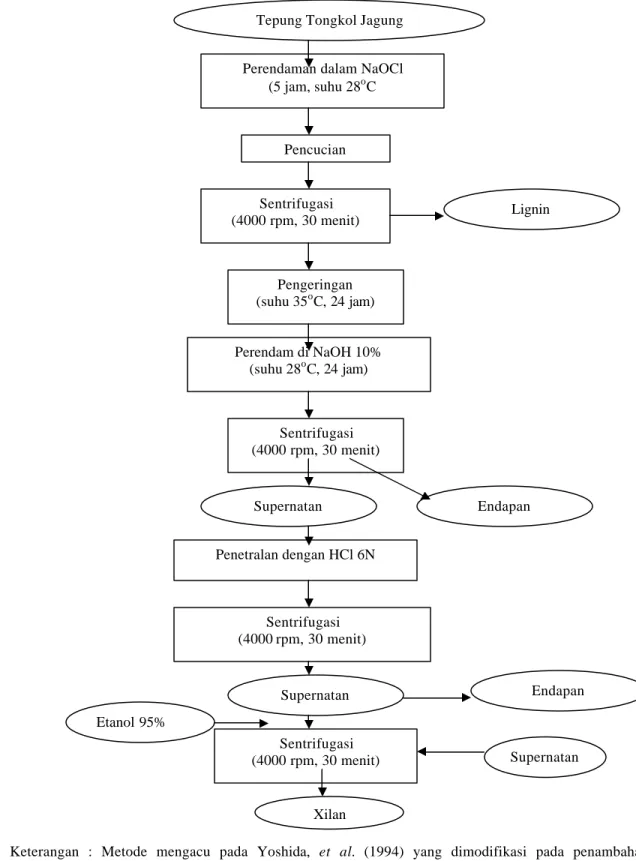
Gambar 4. Diagram alir ekstraksi xilan dari tongkol jagung ... 32
Gambar 5. Diagram alir pengendapan enzim xilanase … ………... 36
Gambar 6. Penampakan koloni bakteri penghasil xilanase ... 39
Gambar 7. Pohon filogenetik isolat RXAIII-5 ... 46
Gambar 8. Protein terlarut pada formulasi media xilan, pepton dan ekstrak khamir... 48
Gambar 9. Aktivitas xilanase pada formulasi media xilan, pepton dan ekstrak khamir... 49
Gambar 10. Aktivitas spesifik xilanase pada formulasi media xilan, pepton dan ekstrak khamir ... 50
Gambar 11. Grafik hubungan antara konsentrasi NaOCl dan perbandingan etanol/supernatan pada ekstraksi xilan dari tongkol jagung ... 53
Gambar 12. Khromatogram hasil ekstrak xilan dari tongkol jagung dan oat spelt xylane sebagai standar ... 55
Gambar 13. Interaksi antar perlakuan terhadap protein terlarut pada optimasi kondisi proses... 62
Gambar 14. Interaksi antar perlakuan terhadap aktivitas xilanase pada optimasi kondisi proses... 64
Gambar 15. Interaksi antar perlakuan terhadap aktivitas spesifik pada optimasi kondisi proses ……… 65
Gambar 16. Kurva bobot sel kering pada laju aerasi 0,5 dan 1 vvm pada berbagai kecepatan agitasi. ... 67
Gambar 17. Kurva protein terlarut pada laju aerasi 0,5 dan 1 vvm pada berbagai kecepatan agitasi... 68
Gambar 19. Kurva linier penentuan nilai Yp/s (A), Yx/s (B), dan Yp/x (C)
kultivasi bakteri Bacillus pumilus RXAIII-5... 70
Gambar 20. Sifat reologi cairan kultivasi Bacillus pumilus RXAIII-5... 72
Gambar 21. Hubungan antara log viskositas dan log laju geser ... 73
Gambar 22. Hasil uji kualitatif pemurnian xilanase ... 76
Gambar 23. Kurva aktivitas xilanase pada beberapa kondisis pH... 78
Gambar 24. Kurva aktivitas xilanase pada beberapa kondisi suhu ... 78
Gambar 25. Stabilitas pH xilanase dari isolat Bacillus pumilus RXA III-5... 79
Gambar 26. Stabilitas suhu xilanase dari isolat Bacillus pumilus RXA III-5... 80
Gambar 27. Kurva Lineweaver-Burk... 81 Gambar 28. Hasil hidrolisis xilan oleh xilanase dari Bacillus pumilus RXAIII-5. 85
Halaman
Lampiran 1. Prosedur pengukuran aktivitas enzim xilanase ……… 101
Lampiran 2. Penetapan protein terlarut menurut Bradford ... 102
Lampiran 3. Penyiapan bahan untuk pemurnian ... 103
Lampiran 4. Data hasil isolasi bakteri penghasil xilanase... 104
Lampiran 5. Hasil pengamatan biomasa, protein dan aktivitas xilanase pada tahap seleksi... 110
Lampiran 6. Data hasil sekuen identifikasi bakteri RXAIII-5... 111
Lampiran 7. Hasil pengamatan dan hasil analisis statistik kegiatan formulasi media tahap I. ………. 114
Lampiran 8. Perhitungan C/N ratio pada formulasi media... 130
Lampiran 9. Hasil dan analisis ragam ekstraksi xilan dari tongkol jagung ... 131
Lampiran 10. Hasil pengamatan dan analisis statistik kegiatan formulasi media tahap II ……….. 134
Lampiran 11. Hasil pengamatan dan analisis statistik kegiatan optimasi Kondisi proses kultivasi Bacillus pumilus RXAIII-5 ... ... 144
Lampiran 12. Hasil pengamatan dan perhitungan optimasi proses dan kinetika kultivasi ... 160
Lampiran 13. Data penentuan reologi cairan kultivasi ... 184
Lampiran 14. Perhitungan kebutuhan tenaga ... 185
Lampiran 15. Perhitungan rancang bangun alat ... 188
PENDAHULUAN Latar Belakang
Xilanase merupakan enzim ekstraseluler yang dapat menghidrolisis xilan (hemiselulosa) menjadi xilo-oligosakarida dan xilosa. Aplikasi xilanase untuk industri diantaranya untuk industri pangan, pakan dan pemutih kertas/pulp. Penggantian penggunaan klor dengan enzim xilanase untuk pemutihan pulp, telah memberikan peluang untuk aplikasi bioteknologi dan sekarang telah digunakan pada beberapa pabrik kertas (Bourbonnais et al. 1997, Ruiz-Arribas et al. 1995). Untuk proses pembuatan kertas diharapkan xilanase yang digunakan adalah yang termostabil dan tahan pada pH alkali (Nakamura et al. 1993). Jumlah pabrik kertas yang sudah beroperasi di Indonesia saat ini lebih dari 14 perusahaan, dan belum ada yang menggunakan proses enzimatis dalam proses pemutihannya. Dengan demikian untuk menghindari pencemaran lingkungan maka perlu segera diaplikasikan proses ramah lingkungan di Indonesia.
Xilanase dapat dihasilkan oleh mikroba melalui proses fermentasi. Xilanase komersial untuk proses pemutihan pulp pertama kali dipasarkan oleh Novo Nordisk A/s dengan nama Pulpzyme HA, yang berasal dari Trichoderma reesei. Setelah itu bermunculan nama - nama lain seperti Cartazyme HS dari Sandoz Chemicals, Irgazyme 40 yang dihasilkan dari T.longibrachiatum dan T. harzianum E 58, Ecopulp (Alko-ICI), Cartazyme-NS-10 (Clariant) dan Pulpzyme HC (Novo Nordisk) yang semuanya telah dicoba dalam proses pemutihan pulp dan hasilnya menunjukkan penurunan yang nyata terhadap penggunaan ClO2 dan H2O2. Namun demikian semua enzim komersial ini masih
belum memenuhi kriteria ideal yang dibutuhkan untuk aktivitas enzimatik yang diperlukan yaitu aktivitas optimum pada pH 10 dan suhu lebih dari 90oC (Kulkarni et al., 1999). Oleh karena itu masih diperlukan upaya untuk mencari galur mikroba unggul yang tahan pada pH dan suhu tinggi (alkalofilik termofilik), atau setidaknya tahan pada pH tinggi. Dilain pihak pakar dari negara maju mengakui bahwa negara yang kaya akan keanekaragaman hayatinya, termasuk Indonesia, merupakan sumber mikroba maupun tanaman yang potensial untuk bioproses (Fox, 1994).
Produksi xilanase oleh mikroba menggunakan substrat xilan. Xilan merupakan polimer kompleks dan xilosa sebagai komponen utama. Pada umumnya substrat yang digunakan untuk media pertumbuhan mikroba penghasil xilanase adalah xilan komersial
dari Sigma yang harganya mahal, yaitu untuk kemasan 100 g harga nya $ 16,6. Oleh karena itu tidak ekonomis bila digunakan dalam skala pabrik. Untuk mengantisipasi masalah tersebut perlu dicari bahan baku terbarukan (renewable raw material) yaitu dari bahan berlignoselulosa. Xilanase komersial kemungkinan juga menggunakan bahan terbarukan. Beberapa peneliti sebelumnya telah mencoba menggunakan bekatul gandum, tepung batang jagung (Yang 1995), dan ampas tebu (Prabhu et al. 1999).
Limbah pertanian sebagian besar merupakan bahan berlignoselulosa. Di Indonesia perkembangan serta kemajuan bidang pertanian dan industri pertanian telah menimbulkan masalah karena peningkatan jumlah limbahnya. Limbah berlignoselulosa yang berpotensi tinggi di Indonesia antara lain jerami, onggok (ampas tapioka, garut), bonggol dan kulit jagung, sabut, tandan kosong kelapa sawit, serta bagase tebu dan lain sebagainya. Seringkali limbah yang tidak tertangani, akan menimbulkan pencemaran lingkungan. Pada dasarnya limbah tidak memiliki nilai ekonomi, bahkan mungkin bernilai negatif karena memerlukan biaya penanganan. Namun demikian bila ditelaah lebih dalam limbah lignoselulosa sebagai bahan organik memiliki potensi besar sebagai bahan baku berbagai industri. Disamping itu fraksinasi limbah ini menjadi komponen-komponen penyusunnya akan meningkatkan pendayagunaan dalam berbagai industri. Melihat potensi bahan limbah berlignoselulosa yang melimpah, serta kekayaan sumber keanekaragaman hayati mikroba di Indonesia, maka perlu dilakukan penelitian mengenai pemanfaatan potensi tersebut, diantaranya untuk substrat pertumbuhan mikroba penghasil enzim xilanase. Berdasarkan penelitian sebelumnya (hasil analisis di Laboratorium biokimia, Balai Penelitian Bioteknologi Pertanian, Badan Litbang Pertanian) dari beberapa bahan berlignoselulosa yang prospektif adalah tongkol jagung, karena mempunyai kandungan xilan tertinggi dan kandungan xilan mendekati oat spelt xylane dari Sigma. Selama ini tongkol jagung belum banyak dimanfaatkan. Dengan mengekstrak xilan dari tongkol jagung sebagai sumber karbon sekaligus sebagai induser pada media pertumbuhan bakteri, akan dapat meningkatkan nilai guna dan ekonominya.
Berdasarkan hal tersebut diatas maka penelitian teknologi produksi xilanase perlu dilakukan yaitu meliputi persiapan bahan (isolasi bakteri alkalofilik dan ekstraksi xilan tongkol jagung), proses produksi, dan karakterisasi xilanase yang dihasilkan.
Tujuan Penelitian
Tujuan penelitian ini untuk mengetahui teknologi proses produksi xilananse dari isolat alkalofilik pada media xilan tongkol jagung. Secara rinci tujuan tersebut dijabarkan sebagai berikut:
1. Mendapatkan isolat bakteri alkalofilik potensial penghasil xilanase yang diisolasi dari tanah berasal dari limbah tapioka dan tanah berkapur.
2. Mendapatkan cara ekstraksi xilan dari tongkol jagung yang efisien
3. Mendapatkan formula media kultivasi (sumber karbon dari xilan standar dan xilan dari tongkol jagung) yang optimum untuk memproduksi xilanase dari isolat bakteri alkalofilik potensial.
4. Mendapatkan kondisi optimum proses produksi xilanase pada bioreaktor 2l, kinetika kultivasi dan sifat reologi cairan kultivasi sebagai dasar untuk penggandaan skala.
5. Mengetahui karakter (stabilitas dan aktivitas enzim pada pH dan suhu optimum, kinetika enzim, serta aktivitas dan inhibisi enzim) xilanase kasar hasil dari pengendapan, dan mengetahui jumlah fraksi xilanase murninya.
6. Mengetahui nilai tambah xilan dari tongkol jagung untuk produksi xilanase sebagai media pertumbuhan bakteri, dengan membandingkan dengan media dari xilan standar (oat spelt xylane).
Hipotesis
Hipotesis yang diajukan dalam penelitian ini adalah:
1. Perolehan isolat bakteri alkalofilik penghasil xilanase berasal dari tanah kapur mempunyai aktivitas spesifik xilanase lebih tinggi karena bersifat lebih tahan alkali dibanding isolat dari tanah limbah tapioka.
2. Xilan dari tongkol jagung dapat menggantikan xilan standar (oat spelt xylan) sebagai sumber karbon dan induser bagi mikroba untuk menghasilkan xilanase, karena sifat xilannya tidak berbeda.
3. Xilanase yang diperoleh dari isolat bakteri yang ditumbuhkan pada media xilan tongkol jagung bersifat alkalofilik dan bebas selulase.
Ruang Lingkup Penelitian
Ruang lingkup penelitian yang dilakukan meliputi: 1. Persiapan bahan untuk produksi xilanase
• Isolasi dan seleksi isolat bakteri penghasil xilanase yang berasal dari tanah tempat pembuangan limbah tapioka dan tanah berkapur, berdasarkan atas aktivitas spesifik.
• Ekstraksi xilan dari tongkoljagung 2. Proses produksi xilanase dari isolat potensial
• Formulasi media menggunakan xilan standar (oat spelt xylan) dan xilan dari tongkol jagung sebagai sumber karbon serta pepton dan ekstrak khamir sebagai sumber nitrogen.
• Kajian kondisi optimum proses (pH dan suhu pada skala erlemeyer serta aerasi dan agitasi pada bioreaktor 2l), kinetika dan sifat reologi cairan kultivasi, sebagai dasar perhitungan penggandaan skala pada proses produksi xilanase dengan ekstrak xilan tongkol jagung sebagai sumber karbon.
3. Karakterisasi xilanase yang dihasilkan meliputi stabilitas dan aktivitas pada beberapa pH dan suhu, kinetika, hasil hidrolisis dan inhibisi enzim.
4. Analisis nilai tambah dari tongkol jagung menjadi xilan, kemudian membandingkan xilanase yang diproduksi dari media xilan tongkol jagung, dan xilan standar (oat spelt xylan).
TINJAUAN PUSTAKA
Struktur Xilan
Xilan adalah hemiselulosa yang merupakan polimer dari pentosa atau xilosa dengan ikatan ß-1,4 yang jumlah monomernya berkisar 150-200 unit (Sunna dan Antranikan. 1997). Hemiselulosa sendiri merupakan polimer dari monomer gula (gula-gula anhidro) yang dapat dikelompokkan menurut penyusunnya yaitu heksosa (glukosa, manosa dan galaktosa), pentosa (xilosa, arabinopiranosa, arabinofuranosa), asam heksuronat (glukoronat, metilglukoronat dan galakturonat) dan deoksi heksosa (rhamnosa dan fruktosa). Rantai utama hemiselulosa dapat hanya terdiri atas satu macam monomer saja (homopolimer), misalnya xilan, atau dapat terdiri dua atau lebih monomer (heteropolimer), misalnya glukomanan (Kulkarni et al. 1999).
Rantai xilan bercabang dan strukturnya tidak berbentuk kristal sehingga lebih mudah dimasuki pelarut dibanding selulosa. Sebagian besar xilan terdiri atas 2-4 heteroglikan. Heteroglikan yang umum dijumpai adalah arabino-D-xilan, L-arabino-D-glukorono-D-xilan, 4-o-metil- D-glukorono -D-xilan, L-arabino-D-xilan, D- gluko-D-mannan, D- galakto -D-gluko-D- gluko-D-mannan, dan L-arabino -D-galaktan.
Xilan mempunyai substituen yang berada di sekitar cincin dari struktur inti xilan. Pada umumnya substituen yang ditemukan dicincin belakang adalah cincin asetil, arabinosil dan glukoronosil. Berdasarkan strukturnya hemiselulosa terutama xilan dapat dilihat dari tanaman yang berbiji terbuka (gymnospermae) dan tanaman berbiji tertutup (angiospermae). Xilan dari angio spermae merupakan O-asetil-4-O-metilglukoronoxilan. Polisakarida ini terdiri atas >70-β-xilopiranosa yang membentuk ikatan dengan β -1,4-glikosida. Setiap 10 xilosa membawa sebuah 4-O-asam metilglukoronat yang berada di dua posisi xilosa (Gambar 1.). Sedangkan komposisi xilan dari gymnospermae memiliki lebih banyak 4-O-metilglukoronoxilan, 4-O-asam metilglukoronat ditempatkan pada dua rantai karbon (Sunna dan Antranikian, 1997). Contoh gymnospermae yang mengandung xilan adalah pinus, sedangkan angiospermae adalah padi, jagung, dan serealia lainnya (Soltes, 1983).
Gambar 1 Struktur xilan (Sunna dan Antranikian, 1997).
Diantara limbah angiospermae tersebut paling tinggi kandungan xilannya adalah jagung (hasil analisis di Laboratorium Biokimia dan Enzimatis Balai Penelitian Bioteknologi, Badan Penelitian dan Pengembangan Pertanian). Demikian juga menurut Paturau (1969) gula xilosa yang dibuat dari beberapa limbah pertanian ternyata paling tinggi adalah jagung (Tabel 1.).
Tabel 1 Kadar (%) xilan dari beberapa limbah hasil pertanian
Bahan Xilan a Xilan b
Bagase tebu 9,6
oat hulls 12,3
Tongkol jagung 12,9 12,4
Sekam 6,3 12,1
Kulit kacang 6,3
kulit biji kapas 10,2
Ampas garut 8,2
Bekatul 6,12
Onggok 5,8
Sumber : a Paturau (1969).
b Hasil analisis di Laboratorium Biokimia dan Enzimatis Balai Penelitian Bioteknologi,
Berdasarkan pertimbangan tersebut maka tongkol jagung berpotensi untuk dimanfaatkan sebagai sumber xilan.
Potensi Limbah Jagung Sebagai Sumber Xilan
Dalam dua dasawarsa terakhir, produksi jagung mengalami peningkatan yang cukup tinggi meskipun agak berfluktuasi. Pada tahun 1989-1993) produksi jagung mencapai 6,7 juta ton/thn dengan produktivitas 2,2 ton/ha (Subandi et al., 1998). Kemudian pada tahun 2003 mencapai 9,66 juta ton/th meningkat sebesar 1,42% diband ing 2002 sebesar 9,53 juta ton/th. Dan di tahun 2004 produksi jagung mencapai 11,75 juta ton/th dengan produktivitas 3,8 ton/ha (Harisno, 2005)
Selain untuk pangan jagung juga banyak digunakan untuk pakan dan bahan industri. Sampai saat ini kebutuhan dan permintaan jagung semakin meningkat. Peningkatan kebutuhan jagung di dalam negeri berkaitan erat dengan pesatnya perkembangan industri pangan dan pakan. Pada tahun 1990, kebutuhan jagung untuk pakan unggas baru sekitar 1,7 juta ton. Tahun 1998 angka itu melonjak lebih dari dua kali lipat yaitu 3,5 juta ton (BP Bimas 1999). Peningkatan produksi dan kebutuhan jagung berarti pula peningkatan limbah baik berupa jerami maupun tongkol jagung. Penggunaan jerami jagung semakin populer untuk makanan ternak. Sedangkan untuk tongkol jagung belum ada pemanfaatan yang lebih bernilai guna dan ekonomis.
Tongkol jagung merupakan bagian terbesar dari limbah jagung yang diperkirakan 50 sampai 60 % (dihitung dari jagung bertongkol) tergantung dari varietasnya. Oleh karena itu dapat diperkirakan untuk produksi jagung 11,75 juta ton/th akan dihasilkan limbah tongkol jagung sekitar 12 juta ton/th. Berdasarkan hal tersebut perlu adanya perhatian dan penanganan untuk pemanfaatannya sehingga lebih bernilai guna dan ekonomis.
Xilanase
Xilanase merupakan kelompok enzim yang memiliki kemampuan menghidrolisis hemiselulosa (xilan) menjadi xilosa dan xilo-oligosakarida dan dapat diklasifikasikan
berdasarkan substrat yang terhidrolisis (Gambar 2.) Enzim xilanase digolongkan atas tiga kelompok yaitu β-xilosidase, eksoxilanase dan endoxilanase.
a. β-xilosidase
Enzim β-xilosidase selain memiliki kemampuan menghidrolisis xilooligosakarida rantai pendek menjadi xilosa, juga dapat menghidrolisis aril-β-D-xilopiranosida, alkil-β -D-xilopiranosida, aril-β-L-arabinoglukosida, aril-β-D-glukopiranosida, xilobitol dan xilotriol. Aktivitas enzim ini akan menurun dengan meningkatnya ranta i xilooligosakarida (Reilly, 1991; Dekker, 1983).
Gambar 2 Struktur xilan dan enzim yang terlibat dalam hidrolisisnya (Beg et al. 2001)
Ikatan oksigen glikosil dari substrat dapat diputus secara heterolisis. Pemutusan terjadi karena bagian elektrofil dan nukleofil dari enzim dapat menyerang atom anomer dan atom C-1 nonreduksi dari rantai oligosakarida. Reaksi pemutusan ini akan menghasilkan gula yang tidak mengalami perubahan konfigurasi.
Reilly (1991) menambahkan bahwa xilosa selain merupakan hasil hidrolisis juga merupakan inhibitor bagi enzim β-xilosidase. Sebagian besar enzim β-xilosidase yang telah berhasil dimurnikan masih menunjukkan adanya aktivitas transferase, yang menyebabkan enzim ini kurang dapat digunakan dalam industri penghasil xilosa.
b. Eksoxilanase
Enzim eksoxilanase memutus rantai polimer pada ujung reduksi seperti pada enzim eksoselulase. Enzim eksoxilanase yang dihasilkan oleh Bacillus pumilus dan
ß-Xylosidase
Arafinosa Arafinosa
Malbranchea pulchella dapat menghidrolisis xilan, menghasilkan xilosa sebagai produk utama dan sejumlah kecil oligosakarida-oligosakarida rantai pendek. Berbeda dengan β -xilosidase, hidrolisis oleh enzim ini dapat merubah konfigurasi gula yang dihasilkan. Enzim ini mempunyai aktivitas transferase yang sangat rendah sehingga menyebabkan enzim ini potensial dalam industri penghasil xilosa.
c. Endoxilanase
Enzim-enzim yang termasuk dalam kelompok endoxilanase adalah enzim yang memutuskan ikatan- ikatan β-1-4 pada bagian dalam dari rantai xilan secara teratur. Ikatan yang diputus ditentukan berdasarkan panjang rantai substrat, derajat percabangan, ada atau tidaknya gugus substitusi dan pola pemutusan dari enzim hidrolase tersebut.
M ikroba Penghasil Xilanase
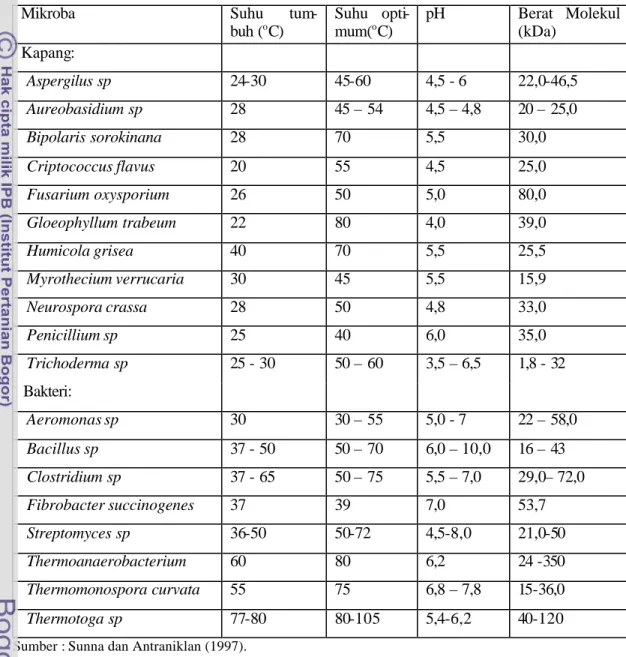
Beberapa mikroba diketahui mampu menghasilkan xilanase secara ekstraseluler. Beberapa penelitian yang telah dilaporkan antara lain xilanase dari bakteri (Gilbert dan Hazlewood 1993, Sunna dan Antranikan 1997), kapang (Sunna dan Antranikan, 1997), Actinomycetes (Ball and Mc Carthy. 1989, Beg et al. 2001), dan khamir (Hrmova et al. 1984, Liu et al. 1998, 1999). Contoh beberapa mikroba penghasil endoxilanase disajikan pada Tabel 2. Xilanase umumnya merupakan protein kecil dengan beral molekul antara 15 000 - 30 000 Dalton, aktif pada suhu 550C dengan pH 9 (Yang, et al., 1988 dan Yu et al., 1991). Pada suhu 600C dengan pH normal xilanase diketahui lebih stabil (Tsujibo, et al., 1992 ; Cho et al., 1996). Untuk pemutih kertas dapat digunakan xilanase jenis xilosidase dan endoxilanase.
Xilanase dari Clostridium acetobutylicum telah diteliti oleh Lee et al. (1985), yaitu dari 20 galur Clostridium sp ternyata C. acetobutylicum NRRL B527 dan ATCC 824 terbanyak menghasilkan xilanase. Galur NRRL B527 menghasilkan xilanase pada pH 5,2 sedangkan galur ATCC 824 menghasilkan xilanase, xilopiranosidase dan arabinofuranosidase pada kultur anaerob.
Isolat Bacillus sp penghasil xilanase yang bersifat alkalofilik telah diteliti oleh Park et al. (1992) yaitu Bacillus sp YC 335 dan oleh Nakamura et al. (1993) yaitu Bacillus sp 41M-1, dan Bacillus sp TAR-1 yang juga bersifat termofilik oleh Nakamura et al. (1994).
Tabel 2 Beberapa mikroba penghasil endoxilanase
Mikroba Suhu tum-
buh (oC) Suhu opti- mum(oC) pH Berat Molekul (kDa) Kapang: Aspergilus sp 24-30 45-60 4,5 - 6 22,0-46,5 Aureobasidium sp 28 45 – 54 4,5 – 4,8 20 – 25,0 Bipolaris sorokinana 28 70 5,5 30,0 Criptococcus flavus 20 55 4,5 25,0 Fusarium oxysporium 26 50 5,0 80,0 Gloeophyllum trabeum 22 80 4,0 39,0 Humicola grisea 40 70 5,5 25,5 Myrothecium verrucaria 30 45 5,5 15,9 Neurospora crassa 28 50 4,8 33,0 Penicillium sp 25 40 6,0 35,0 Trichoderma sp 25 - 30 50 – 60 3,5 – 6,5 1,8 - 32 Bakteri: Aeromonas sp 30 30 – 55 5,0 - 7 22 – 58,0 Bacillus sp 37 - 50 50 – 70 6,0 – 10,0 16 – 43 Clostridium sp 37 - 65 50 – 75 5,5 – 7,0 29,0– 72,0 Fibrobacter succinogenes 37 39 7,0 53,7 Streptomyces sp 36-50 50-72 4,5-8,0 21,0-50 Thermoanaerobacterium 60 80 6,2 24 -350 Thermomonospora curvata 55 75 6,8 – 7,8 15-36,0 Thermotoga sp 77-80 80-105 5,4-6,2 40-120
Sumber : Sunna dan Antraniklan (1997).
Kubata et al. (1992) telah mengisolasi Aeromonas caviae ME-1 penghasil xilanase I dari usus serangga pemakan tumbuhan, sedangkan Dung et al. (1993) melakukan penelitian ß-1,4-xilanase 2 dan 3 dari A. caviae W-61. Irawadi (1992) berhasil memproduksi selulase dan xilanase dari Neurospora sitophila pada substrat
padat limbah kelapa sawit. Kemudian telah dicoba untuk menghidrolisis limbah lignoselulosa lain diantaranya adalah tongkol jagung (Irawadi. 1995).
Demikian juga Winterhalter dan Liebl (1995) dari hasil penelitiannya telah melakukan produksi xilanase thermostabil dari bakteri Thermotoga maritima MSB8, sedangkan Ruiz-Arribas et al. (1995) telah mendapatkan Streptomyces halstedii JM8 penghasil xilanase (xys I) yang diisolasi dari jerami. Lin et al (1999) melakukan pemurnian dan karakterisasi biokimia xilanase dari fungi termofilik Thermomyces lanuginosus-SSBP.
Media Pertumbuhan Mikroba Penghasil Xilanase
Komposisi media kultivasi dapat sederhana atau kompleks tergantung jenis mikroba dan kondisi kultivasinya. Baik media sederhana maupun kompleks dapat merupakan media sintetik atau media kasar (crude). Media sintetik cocok untuk skala laboratorium dan industri kecil karena mempunyai beberapa keuntungan antara lain setiap kompo nen dapat dengan mudah dikurangi, dihilangkan atau ditambahkan. Disamping itu pada media sintetik biasanya media kultivasi tidak membentuk buih selama proses berlangsung, dan kesalahan atau kelainan yang mungkin terjadi selama kultivasi akibat komposisi yang kurang tepat dapat dicegah. Pada industri skala besar media sintetik tidak sesuai digunakan.
Kriteria sumber nutrisi untuk skala besar (Rachman, 1989) adalah:
1. Dapat memproduksi biomassa dengan hasil maksimal untuk tiap gram substrat yang digunakan
2. Memungkinkan pembentukan produk kultivasi dengan laju maksimal.
3. Dapat menekan pembentukan produk yang tidak diinginkan sampai serendah mungkin.
4. Mutu konstan, murah dan tersedia sepanjang tahun.
5. Tidak menimbulkan masalah terhadap aerasi, agitasi, ekstraksi dan pemurnian hasil serta perlakuan limbah.
Substrat yang digunakan dalam proses kultivasi berpengaruh terhadap aktivitas dan produktivitas enzim. Adanya substrat tertentu di dalam medium produksi dapat memacu mikroba untuk mensekresi metabolit selnya (Boing, 1982).
Zat gizi utama bagi pertumbuhan mikroba adalah karbon, nitrogen dan komponen mineral terutama fosfat. Formulasi media dalam pertumbuhan dan produksi hasil kultivasi merupakan suatu tahap penting dalam mendesain percobaan dalam skala kerja (Stanbury dan Whitaker, 1984).
1. Sumber Karbon
Beberapa sumber karbon yang sering digunakan adalah molases, serealia, pati, glukosa, sukrosa, xilan dan laktosa. Produksi xilanase menggunakan xilan sebagai sumber karbon. Pada skala laboratorium xilan yang digunakan adalah spelt oat xylan dari SIGMA, sedangkan untuk skala besar penggunaan xilan tersebut terlalu mahal. Park et al. (1992) telah melakukan penelitian alternatif sumber karbon selain xilan yaitu jerami padi. Jerami kering dipotong sepanjang 10 mm, kemudian dipanaskan 121oC selama 1 jam. Sesudah penyaringan xilan kasar diendapkan dengan etanol 99% dan diinkubasi selama 24 jam. Hasil endapan adalah xilan kasar.
Yoshida et al.(1994) memanfaatkan ampas/limbah ekstrak minyak biji kapas untuk pengganti xilan. Mula- mula ampas biji kapas tersebut direndam dengan klor pada suhu kamar selama 5 jam untuk menghilangkan lignin dan warna bahan. Kemudian dikeringkan, terus direndam kembali dengan larutan 10% NaOH pada suhu kamar selama 24 jam. Filtrat adalah xilan kasar yang diendapkan dengan 2 kali volume etanol 99%.
2. Sumber nitrogen
Sebagai sumber nitrogen biasanya digunakan garam amonium, urea, ekstrak khamir dan pepton. Ekstrak khamir mengandung asam amino, peptida, vitamin dan karbohidrat. Komposisi penggunaan ekstrak khamir yang tepat sangat diperlukan dalam proses kultivasi. Hal tersebut disebabkan penggunaan jumlah ekstrak khamir yang cukup tinggi akan menyebabkan timbulnya buih pada media kultivasi jika diaduk, karena pengadukan akan menyebabkan protein dala m media kontak dengan udara (Suhartono, 1989).
Pepton (hidrolisat protein) sering digunakan untuk pertumbuhan mikroba tetapi relatif mahal untuk diaplikasikan di industri. Sumber pepton diantaranya adalah daging, kasein, gelatin, kreatin, dan biji-bijian. Komposisi pepton bervariasi tergantung dari asalnya. Pepton dan gelatin kaya akan prolin dan hidroprolin, tetapi hampir tidak ada
asam amino mengandung belerang. Sedangkan pepton dari kreatin kaya akan prolin dan sistein tetapi kurang lisin (Crueger dan Crueger. 1984).
3. Koenzim
Mikroba membutuhkan vitamin B untuk pertumbuhannya seperti vitamin B1 (tiamin), B2 (riboflavin), B6 (piridoxin) dan vitamin B12 (kobalamin) yang diantaranya berasal dari sumber kaya vitamin B seperti ekstrak khamir. Vitamin B ini digunakan dalam proses pembentukan koenzim yang akan berikatan dengan enzim dengan ikatan yang tidak begitu kuat. Satu koenzim dapat berikatan dengan beberapa enzim pada kurun waktu yang berlainan selama pertumbuhan sel bakteri. Koenzim dapat dianggap sebagai substrat khusus karena akan diubah oleh daya kerja apoenzim (bagian protein dari enzim) secara kimia, namun kemudian akan diubah kembali pada bentuk semula pada akhir reaksi. Fenomena ini menjadikan koenzim berperan sebagai penghubung berbagai apoenzim yang menggabungkan beberapa reaksi kimia yang berbeda.
Koenzim dapat memindahkan satu molekul dari suatu enzim ke enzim lainnya karena sifatnya tidak khusus dan dapat mengikat diri ke beberapa enzim. Namun demikian setiap koenzim dapat memindahkan hanya satu jenis molekul yang kecil. Berdasarkan proses demikian maka reaksi enzimatis pembentukan produk dari substratnya tidak dapat berlangsung bila tidak ada koenzim walaupun ada apoenzimnya. Menurut Lay dan Hastowo (1992), kekurangan vitamin sebagai koenzim menyebabkan enzim tidak dapat berfungsi semestinya.
4. Garam-garam M ineral
Unsur-unsur mineral seperti magnesium, fosfor, kalium, kalsium, sulfur dan klor, ditambahkan dalam bentuk garam dengan konsentrasi yang tepat (Stanbury dan Whitaker, 1984). Komposisi media untuk produksi xilanase, masing- masing pada media termofilik alkalofilik dan netral disajikan pada Tabel 3.
Seperti halnya sumber karbon, garam-garam nutrien akan menghambat laju pertumbuhan pada konsentrasi tertentu. Bila yang digunakan garam amonium sebagai sumber nitrogen, penghambatan dimulai pada konsentrasi 10 g/l. Penggunaan garam nutrien dari amonium, fosfat dan nitrat masing- masing 9 g/l, 10 g/l, 5 g/l (Wang et al., 1997).
Tabel 3 Media pertumbuhan bakteri penghasil xilanase
No Bahan Komposisi (g/100 l media)
Media alkali a) Media netral b)
1. Polipepton 0,5 -
2. Ekstrak khamir 0,1 0,2
3. K
2PO4 0,1 1,5
4. MgSO4. 7 H2O 0,02 0,025
5. Xilan (sumber karbon) 0,5 0,7
6. NaCl - 0,25
7. NH4Cl - 0,5
8. Na2HPO4 - 5,0
Sumber : a) Nakamura (1993) b) Dung et al (1993)
Kultivasi Mikroba Penghasil Xilanase
Kultivasi isolat mikroba penghasil xilanase dapat dilakukan dengan cara media padat dan cair. Untuk beberapa produk seperti enzim, kultur media cair akan lebih menguntungkan dibanding kultur media padat dan telah secara luas digunakan dalam produksi enzim. Beberapa keuntungan yang dapat diperoleh melalui kultur media cair adalah komposisi dan komponen media dapat diatur dengan mudah, dapat memberikan kondisi yang optimal bagi pertumbuhan, penggunaan substrat lebih efisien, aerasi dapat disesuaikan, laju pertumbuhan mikroba dapat diatur dan resiko kontaminan kecil (Blevin dan Davis, 1979). Sementara menurut Scragg (1994), kultivasi dengan metode kultur media cair membutuhkan penguasaan bioreaktor untuk memperoleh produksi yang tinggi. Melalui mekanisme pengadukan maka suhu, pH, oksigen, nutrien dan faktor lingkungan lainnya dapat tersebar lebih merata di dalam bejana kultivasi.
1. Kondisi Suhu
Enzim dapat mempercepat reaksi kimiawi dengan sempurna bila berada dalam suhu optimumnya, namun bila suhu operasi menyimpang dari suhu optimum maka aktivitas enzim akan menurun. Efek dari suhu yang ekstrim pada pertumbuhan secara umum didasarkan pada inaktivasi enzim atau struktur fungsi sel lainnya. Setiap bakteri
mempunyai suhu optimum dimana pertumbuhannya berlangsung dengan cepat. Di luar kisaran suhu optimum pertumbuhan bakteri menjadi lambat bahkan tidak ada pertumbuhan. Kisaran suhu untuk aktivitas enzim menentukan sifat pertumbuhan mikroba. Suhu tertinggi di mana mikroba masih dapat tumbuh disebut suhu maksimum, sedangkan suhu minimum adalah suhu terendah dimana mikroba masih dapat tumbuh.
Beberapa spesies bakteri indigenous pada tanah, air atau tubuh binatang dapat tumbuh pada kisaran suhu 20–45oC (suhu tubuh manusia adalah 37oC). Spesies yang tumbuh baik pada suhu seperti itu disebut mesofilik (secara harfiah meso artinya medium atau menengah, filik artinya menyenangi). Suhu optimum pertumbuhannya adalah pada kisaran 25-39oC dan sangat beragam tergantung spesiesnya (Frobisher, 1962).
Menurut Frobisher (1962), berdasarkan suhu pertumbuhan optimum dan aktivitas hidrolitik enzim mikroba dapat digolongkan ke dalam empat kelompok, yaitu psikrofilik, psikrofilik fakultatif, mesofilik dan termofilik. Kelompok psikrofilik adalah kelompok mikroba yang maksimum pertumbuhannya pada kondisi lingkungan dingin yaitu pada suhu sekitar 7oC. Spesies yang mempunyai kemampuan tumbuh pada suhu sekitar 20oC disebut psikrofil fakultatif. Mesofilik adalah kelompok mikroba yang pertumbuhan optimumnya terjadi pada suhu sekitar 37OC, namun demikian terdapat pula mikroba kelompok ini yang mempunyai efektivitas kerja diatas 37oC tetapi sangat terbatas. Termofilik adalah kelompok mikroba yang pertumbuhan optimumnya terjadi pada suhu di atas 50oC.
Kisaran suhu tidak saja mempengaruhi aktivitas enzim, namun juga mempengaruhi sifat fisik membran sel. Permeabilitas membran sel tergantung pada kandungan dan jenis lipida. Peningkatan 5-10oC di atas suhu optimum dapat menyebabkan proses lisis dan kematian sel mikroba (Lay, 1994).
2. Kondisi pH
Menurut Lay (1994), mikroba tumbuh dan memiliki enzim yang berfungsi sempurna pada kisaran pH optimum tertentu. Penyimpangan pH medium menimbulkan pertumbuhan dan metabolisme mikroba terhenti yang dikarenakan protein dalam struktur enzim dan sistem transpot yang terdapat pada membran sel berubah. Pada umumnya mikroba tumbuh pada kisaran pH netral, walaupun beberapa spesies mampu bertahan pada pH ekstrim yaitu pada pH 2 dan 10.
Beberapa mikroba melakukan kultivasi menghasilkan asam sehingga pH media turun menjadi 3,5. Namun saat metabolisme protein dan asam amino berlangsung ion amonium akan dilepas sehingga pH media menjadi basa (Lay, 1994).
Upaya mencegah perubahan pH yang berjalan dengan cepat pada sistem tertutup adalah dengan penambahan buffer ke dalam media seperti K2HPO4 atau KH2PO4 untuk
menjaga agar kondisi pH tetap mendekati pH optimum. Kedua macam garam ini dapat mengikat H+ dari asam atau OH- dari basa (Lay dan Hastowo, 1992).
Sumber nitrogen dapat merubah nilai pH, seperti amonia di dalam larutan ber-pH 9 amonia sebagai NH4+ yang oleh mikroba digabungkan ke dalam sel dengan kerangka
karbon R menjadi R-NH3+ sehingga akan menurunkan nilai pH. Apabila nitrat sebagai sumber nitrogen, ion hidrogen akan disingkirkan dari medium untuk mereduksi NO3 -menjadi R-NO3+ dan pH cenderung meningkat. Bila sumber nitrogen adalah bahan organik, maka bahan tersebut akan terdeaminasi sehingga meningkatkan nilai pH (Wang et al, 1979). Menurut Crueger and Crueger (1984) bakteri mempunyai kisaran nilai pH minimum 3-5, kisaran pH optimum 6,5-7,5 dan kisaran pH maksimum 8-10.
Penggunaan enzim yang stabil pada kondisi ekstrem, yang terjadi pada kebanyakan proses industri, akhir-akhir ini meningkat pesat, karena proses pada kondisi ekstrem dapat mengurangi resiko kontaminasi. Oleh karena itu untuk mendapatkan xilanase yang sesuai dengan kebutuhan industri adalah dengan menggunakan enzim yang dihasilkan oleh mikroba ekstremofil (alkalofilik, termofilik).
Mikroba alkalofilik adalah mikroba yang mempunyai pertumbuhan optimal + pH 10. Pada umumnya dalam pertumbuhan mikroba, pH plasma sel internal sama dengan pH optimal enzim intraseluler. Namun ada kalanya internal dan eksternal sel mempunyai pH yang berlainan, pH didalam sel + 8, meski pH luar mencapai 8-11. Seperti halnya protoplas dari galur Bacillus alkalofilik akan kehilangan stabilitasnya pada lingkungan alkalis, sehingga diduga dinding sel berperan melindungi sel dari lingkungan alkalis.
Dind ing sel mengandung polimer asam (asam galakturonat, glukonat, glutamat, asam aspartat, dan asam fosfat), dan peptidoglikan (dalam hidrolisatnya ditemukan glukosamin, asam muronat, D- dan L-alanin, D-asam glutamat, asam miso-diaminpimelat dan asam asetat). Muatan negatif pada komponen tersebut menyebabkan dinding sel
mampu untuk menyerap ion Na+ dan H+ dan menolak ion OH dan membantu dinding sel tumbuh pada lingkungan alkalis.
Menurut teori kimia osmotik kekuatan gerak proton dalam sel dibentuk oleh rantai transfer elektron atau dengan mengeluarkan H+ diturunkan dari metabolisme ATP oleh ATPase. Selanjutnya H+ diganti Na+ oleh sistem antiporter Na+ /H+ menghasilkan kekuatan gerak Na+ untuk berikatan dengan substrat di dalam sel, yang akan berpengaruh terhadap peningkatan pH. Daya ikatan Na+ dan substrat akan meningkat dua kali bila pH bergeser dari 7 ke 9 (Horikoshi dan Atsukawa. 1973).
Xilanase yang berasal dari mikroba alkalofilik menjadi penting karena kegunaannnya untuk pengembangan teknologi yang rama h lingkungan dalam industri kertas dan pulp. Xilanase dapat menghidrolisis xilan dengan lebih mudah karena polimer ini larut dalam kondisi alkalis.
Xilanase yang berasal dari bakteri alkalofilik pertama kali dilaporkan oleh Horikoshi dan Atsukawa pada tahun 1973 yaitu enzim murni dari Bacillus sp. dan Aeromonas sp. yang mempunyai pertumbuhan optimum pada pH 9-10 tetapi tidak aktif pada pH dibawah 8,0. Telah dilaporkan pada satu isolat Bacillus alkalofilik termofilik yang menghasilkan dua jenis xilanase yang mempunyai pH optimum 10,0 dan suhu 50oC. Dey et al. (1992) mengisolasi Bacillus NCIM 59 yang bersifat alkali termofilik yang menghasilkan dua tipe xilanase bebas selulase. Khasin et al. ( 1993 ) melaporkan bahwa alkalofilik B. stearothermophilus T-6 menghasilkan xilanase pH 9 dan suhu 65oC. Blanco et al. (1995) melaporkan bahwa enzim dan Bacillus sp BP-23 dalam proses bleaching mampu mensubstitusi khlorin sampai 38%. Kemudian Garg et al. (1996, 1998) melaporkan penggunaan xilanase dari Streptomyces thermoviolaceus pada proses biobleaching untuk pulp kraft birchwood dengan suhu aktivitas 65oC.
3. Aerasi dan Agitasi
Produksi biomass dapat dicapai dengan mempertahankan kadar O2 yang lebih
besar dari konsentrasi kritis. Jika konsentrasi O2 kurang dari konsentrasi kritis,
metabolisme sel akan terganggu. Kebutuhan O2 untuk memproduksi hasil metabolit
kultivasi secara optimal mungkin berbeda dengan yang kebutuhan untuk memproduksi biomass (Rachman, 1989).
Laju konsumsi O2 oleh mikroba aerobik cukup tinggi. Oksigen yang tidak
mencukupi menyebabkan berkurangnya hasil dari produk mikroba seperti asam organik, enzim, atau antibiotik. Tingkat aerasi dan mixing mempengaruhi kecepatan konsumsi oksigen dan ketersediaannya selama proses kultivasi berlangsung (Sikyta, 1983).
Dalam proses-proses kultivasi aerobik, aerasi dan agitasi merupakan faktor yang sangat penting. Fungsi utamanya adalah untuk mensuplai kebutuhan oksigen bagi aktivitas metabolik mikroba, juga untuk mengaduk mikroba supaya tersuspensi secara homogen dalam bioreaktor (Scragg, 1991).
Menurut Wang et.al. (1979), fungsi aerasi dan agitasi adalah untuk mensuplai kebutuhan oksigen mikroba menurut tingkat aktivitas metabolik yang tepat. Oleh Suhartono (1989) ditambahkan bahwa adanya mekanisme pengadukan (agit asi), maka oksigen, pH, nutrien dan faktor-faktor lain yang terdapat dalam lingkungan dapat tersebar lebih merata di dalam bejana.
Kebutuhan oksigen bagi pertumbuhan mikroba tergantung pada jenis sumber karbon dan efisiensi penggunaannya oleh mikroba tersebut. Peningkatan konsentrasi oksigen terlarut dalam medium dapat dilakukan dengan cara meningkatkan laju aliran udara atau menambah kecepatan pengadukan (Standbury dan Whitaker, 1984).
Lin et al. (1999) telah memproduksi enzim xilanase pada kultivasi media cair dalam bioreaktor kondisi pH 6,0, suhu 50oC, kecepatan agitasi 150 rpm, dan laju aliran udara 1 vvm. Hasil enzim yang diperoleh adalah β-D-xilanase.
Kinetik Produksi Enzim Xilanase
Kinetik kultivasi mikrobia secara umum dikaji berdasarkan laju penggunaan substrat, laju pertumbuhan biomass dan laju pembentukan produk (Judoamidjojo, et.al., 1992). Menurut Monod (1949), untuk menentukan laju pertumbuhan biomass, digunakan persamaan sebagai berikut :
dX = µ X ... (1) dt
Integral dari persamaan (1) akan memberikan hasil sebagaimana diilustrasikan dalam persamaan (2), yaitu :
Ln Xt = µΛt ... (2)
Maka plot linear antara ln X dengan t akan menghasilkan slope yang nilainya sama dengan nilai µ yang dicari. Sedangkan waktu penggandaan (td) dapat ditentukan menggunakan persamaan (3) yaitu :
td= Ln 2 = 0,693 ... (3)
µ µ
Berdasarkan keseimbangan (1) pertumbuhan sel mikroba akan berlangsung dengan mengkonsumsi nutrient sekaligus mengeluarkan (sekresi) produk-produk metabolisme yang terbentuk. Setelah waktu tertentu laju pertumbuhan akan menurun dan akhirnya pertumbuhan berhenti sama sekali. Berhentinya pertumbuhan dapat pula disebabkan karena berkurangnya beberapa nutrient esensial dalam media, atau kombinasi keduanya (Rachman, 1989).
Menurut Monod (1949), laju pertumbuhan spesifik yang maksimal (µ maks) dapat ditentukan dengan persamaan :
S
µ = µmax --- ... (4)
Ks + S
Modifikasi dari persamaan (4) memberikan persamaan : 1 Ks 1 1
--- = --- --- + --- ...(5)
µ µmax S µmax
Sehingga plot linear antara 1/µ dengan 1/S memberikan garis lurus dengan intersep sebagai nilai 1/µmax dan slope garis tersebut merupakan nilai dari Ks/µ max, dengan
operasi aljabar biasa maka nilai- nilai dari Ks (kons tanta yang sebanding pada konsentrasi substrat bila µ = 0,5 µmax) dan µmax dapat ditentukan.
Nilai dari koefisien hasil biomasa persatuan massa nutrien yang dikonsumsi (Yx/s)
dapat ditentukan menggunakan persamaan (6) yaitu
- dS = - µ X - ms X ... (6) dt Y x/s
Modifikasi dari persamaan (6) dengan substitusi bahwa µX = dX/dt, dan semua ruas dibagi dengan X maka akan memberikan hasil :
dS/dt 1 dX/dt
--- = --- --- + ms ... (7)
X Y x/s X
Dari persamaan (7) tersebut maka plot linear antara (dS/dt)/X dengan (dX/dt)/X akan memberikan garis lurus dengan intersep yang akan memberikan nilai ‘m’ (koefisien pemeliharaan) dan slope garis tersebut akan memberikan nilai 1/Yx/s.
Koefisien hasil produk per unit massa nutrien yang dikonsumsi (Yp/s) dapat
ditentukan dengan sederhana yaitu mengikuti persamaan (8) dP/dt = Yp/s dS/dt ... (8)
Sehingga plot linier dari dP/dt dengan dS/dt akan memberikan garis lurus dengan kemiringan merupakan nilai Yp/s .
Pada umumnya produk suatu proses merupakan hasil langsung suatu jalur katabolik atau metabolik primer. Dalam pola ini laju pembentukan produk berbanding secara proposional dengan laju pertumbuhan.
Sifat Reologi Cairan Kultivasi
Secara umum bioreaktor dilengkapi dengan system agitasi (pengadukan) yang merupakan batang agitator (shaft). Beberapa tipe pengaduk yang sering digunakan pada beberapa kondisi proses yaitu turbin, impeller, bilah dan model jangkar (Doran, 1995). Pada bioreaktor sering dilengkapi dengan baffle atau sekat penghambat, untuk menyempurnakan pengadukan.
Reologi atau sifat dan perilaku aliran media kultivasi akan sangat bermanfaat bagi perancangan dasar bioreaktor untuk skala yang lebih besar. Sifat aliran fluida dalam bioreaktor diperlukan untuk mengetahui tingkat homogenitas komponen dalam proses kultivasi. Sifat aliran kekentalan fluida berpengaruh nyata dalam transfer komponen-komponen media ke sel atau sebaliknya. Berbagai informasi yang didapatkan akan sangat berguna terutama dalam penggandaan skala berdasarkan peubah-peubah yang telah ditentukan pada skala yang lebih kecil. Penggandaan skala dilakukan dengan mempertahankan kesamaan geometrik bioreaktor pada berbagai skala, namun demikian kondisi lingkungan yang ideal tetap diperhatikan. Nilai pH, suhu dan kelarutan oksigen optimum diperoleh dari proses optimasi, maka perilaku terpenting cairan dalam
bioreaktor berpengaduk adalah tenaga (P) dan kecepatan pengadukan (N) (Wang et al. 1979).
Tenaga pengadukan sangat dipengaruhi oleh jenis pengaduk yang digunakan dan sifat reologi cairan kultivasi. Sifat aliran seperti turbulensi dapat ditetapkan berdasarkan nilai bilangan Reynolds. Aliran dalam tanki dikatakan laminar apabila bilangan Reynolds lebih kecil dari 10, jenis aliran tangki disebut peralihan atau transisi jika mempunyai bilangan Reynolds 10-10000 dan turbulen bila lebih besar dari 10000. Bilangan Reynolds ini sangat dipengaruhi oleh sifat kekentalan larutan. Kekentalan merupakan ketahanan cairan menahan gaya yang diberikan untuk menjaga agar bidang tetap tidak bergerak pada laju setara gaya tersebut. Gaya kekentalan secara umum dinyatakan per satuan luas yang disebut tegangan geser (shear stress =t ). Tegangan geser suatu cairan kultivasi berbanding dengan perbedaan laju dalam cairan kultivasi yang disebut laju geser (shear rate = ?). Menurut Wang et al. (1979), hubungan antara tegangan geser dan laju geser cairan Newtonian dan bukan-Newtonian ditentukan persamaan:
t = t y + k?n ………. (9)
Keterangan : t : tegangan geser (g /cmdet2) t y : yield stress (g/cmdet2)
k : indeks konsistensi (g/cmdet n+2) ? : laju geser (/det)
n : indeks perilaku cairan µ : viskositas (g/cmdet)
Pada cairan kultivasi non -Newtonian nilai t y : 0, kekentalan (viskositas= µ)
tergantung pada laju geser (?), sehingga persamaan menjadi t = k?n ……….. (10)
dan µ = k?n-1 ... (11)
Nilai k dan n tersebut sangat penting diketahui untuk pengkajian masalah pencampuran. Bila 0<n<1 dan k>0, maka cairan kultivasi adalah pseudoplastik, dan jika n>1 dan k>0, maka cairan kultivasi tersebut adalah dilatan.
Menurut Doran (1995), penentuan bilangan Reynolds pada cairan non-Newtonian dalam memperkirakan kebutuhan tenaga pengadukan jenis impeller adalah sebagai berikut:
Di2 N2-n ?
NRe = --- ... (12) K(ks)n-1
Keterangan : NRe : bilangan Reynolds N: kecepatan putaran agitasi ? : densitas cairan kultivasi Di : garis tengah agitator
ks : konstanta untuk six bladed disc turbine yang besarnya 11,5
Konsumsi tenaga (P) yang dibutuhkan untuk menggerakkan agitator mengikuti persamaan sebagai berikut:
Np Di5 N3 ?
P = --- ... (13) gc
Keterangan : Np = bilangan tenaga
P : tenaga yang terserap oleh agitator gc = faktor konversi (9,81 kg m/kg det2)
Aplikasi Xila nase
Selama dekade terakhir ini, potensi bioteknologi dari aplikasi xilanase telah menjadi perhatian utama para peneliti, karena xilanase berpotensi digunakan bermacam-macam industri antara lain untuk industri pangan, pakan serta pulp dan kertas (Beg et al. 2001).
1. Pemanfaatan Xilanase Untuk Proses Pembuatan Kertas.
Pada pembuatan kertas, xilanase digunakan untuk menghilangkan hemiselulosa dalam proses bleaching. Pengembangan aplikasi xilanase untuk biobleaching pada mulanya ditemukan oleh Viikari et al. (1986). Enzim ini sebagai pengganti cara kimia sehingga pencemaran racun limbah kimia akan dihindari dan lebih murah (Ruiz- Arribas et al. 1995, Viikari et al., 1994). Bahan baku kayu pembuat kertas setelah melalui proses digester dan pencucian, sebenarnya masih dalam keadaan kotor (derajat putihnya rendah). Untuk menghasilkan kertas yang bermutu tinggi perlu dilakukan proses pemutihan. Proses pemutihan bertujuan untuk menghilangkan lignin, hemiselulosa penyebab warna coklat, dan zat ekstraktif yang dikandung dari hasil pencucian dan penyaringan. Proses pemutihan biasanya dilakukan bertahap, karena mempunyai kelebihan diantaranya adalah nilai derajat putihnya tinggi. Proses bertahap ini terdiri atas tahap klorinasi, ekstraksi, dan penambahan klorin dioksida. Klor adalah bahan beracun,
sehingga klor sisa proses yang dibuang ke perairan sungai akan membuat polusi yang tinggi. Polusi terbesar di Indonesia berasal dari pabrik kertas. Jumlah pabrik kertas yang sudah beroperasi di Indonesia saat ini lebih dari 14 perusahaan, dan belum satupun menggunakan proses enzimatis dalam proses pemutihan. Dengan demikian untuk mendukung pelestarian lingkungan maka perlu segera diaplikasikan proses ramah lingkungan (clean processing) tersebut di Indonesia. Penggantian penggunaan klor untuk pemutihan kertas, telah memberikan peluang untuk aplikasi bioteknologi. Untuk proses pembuatan kertas diharapkan xilanase yang digunakan adalah termostabil dan tahan pada pH tinggi (Nakamura et al. 1993), dan jenis enzimnya adalah endoxilanase (Kantelinen et al. 1988, Paice et al. 1988, Viikari et al. 1994), serta diharapkan free celulase (Garg et al. 1996, 1998). Namun demikian kombinasi xilosidase atau xilanolitik lain dan hemiselulolitik dengan endoxilanase telah menunjukkan efektif pada perbaikan mutu kertas (Kantelinen et al. 1993, Clark et al. 1990). Penggunaan xilanase dan enzim-enzim sejenisnya pada proses pemutihan kertas membantu pengurangan jumlah kappa dan meningkatkan derajat putih kertas (Viikari et al 1994, Yang et al. 1995). Sejumlah kajian pengaruh xilanase pada pemutihan kertas yang dilakukan dengan enzim berasal dari Trichoderma sp, ternyata pengurangan penggunaan klor mencapai 20-30% (Viikari et al. 1994).
Xilanase termostabil dari bakteri anaerobik termofilik Dictyoglomus sp. telah diuji kemampuannya dalam proses pemutihan pulp. Perlakuan xilanase pada suhu 80oC dan pH 6-8 menghasilkan peningkatan derajad pemutihan sebanyak 2 satuan ISO dalam satu tahap proses delignifikasi dengan peroksida. Xilanase komersial untuk proses pemutihan pulp pertama kali dipasarkan oleh Novo Nordisk A/s dengan nama Pulpzyme HA, yang berasal dari T. reesei. Setelah itu bermunculan nama-nama lain seperti Cartazyme HS dari Sandoz Chemicals, Irgazyme 40 yang dihasilkan dari T.longibrachiatum dan T. harzianum E 58, Ecopulp (Alko-ICI), Cartazyme-NS-10 (Clariant) dan Pulpzyme HC (Novo Nordisk) yang semuanya telah dicoba dalam proses pemutihan pulp dan hasilnya menunjukkan penurunan yang nyata terhadap penggunaan ClO2 dan H2O2. Namun
demikian semua enzim komersial ini masih belum memenuhi kriteria ideal yang dibutuhkan untuk aktivitas enzimatik yang diperlukan yaitu aktivitas optimum pada pH 10 dan suhu lebih dari 90oC (Kulkarni et al., 1999).
2. Pemanfaatan Xilanase Untuk Gula Xilosa.
Xilanase juga dapat digunakan untuk menghidrolisis xilan (hemiselulosa) menjadi gula xilosa. Gula xilosa dihidrogenasi menjadi xilitol banyak digunakan untuk konsumsi penderita diabetes. Disamping itu di Malaysia saat ini gula xilitol banyak digunakan untuk campuran pasta gigi karena dapat berfungsi memperkuat gusi. Dengan beragamnya kegunaan gula xilitol maka perlu adanya inovasi kearah produksi xilosa tersebut. Inovasi tersebut muncul diantaranya apabila enzim penghidrolisis lignoselulosa tersebut sudah tersedia. Disamping itu perlu pengembangan proses yang efisien untuk hidrolisis enzimatis untuk bahan berhemiselulosa tinggi.
3. Pemanfaatan Xilanase Untuk Makanan Ternak
Van-Paridon et al. (1992) telah melakukan penelitian pemanfaatan xilanase untuk campuran makanan ayam boiler, dengan melihat pengaruhnya terhadap berat yang dicapai dan efisiensi konversi makanan serta hubungannya dengan nilai cernak. Hal yang sama juga dilakukan oleh Bedford dan Classen (1992), yang melaporkan campuran makanan ayam boiler dengan xilanase yang berasal dari T. longibrachiatum ternyata mampu meningkatkan nilai cerna , sehingga meningkatkan efisiensi konversi makanan dan berdampak pada peningkatan berat ayam.
4. Pemanfaatan Xilanase Untuk Meningkatkan Kualitas Roti
Efisiensi xilanase dalam perbaikan kualitas roti yang telah dilakukan yaitu xilanase berasal dari Aspergillus niger var awamori yang ditambahkan ke dalam adonan roti menghasilkan kenaikan volume spesifik roti. Dan untuk lebih meningkatkan kualitas rerotian maka perlu dilakukan kombinasi penambahan amilase dan xilanase (Maat et al. 1992).
5. Pemanfaatan Xilanase Untuk M inuman
Xilanase dapat juga untuk menjernihkan juice, untuk ekstraksi kopi, minyak
nabati dan pati (Wong dan Sadler, 1992). Kombinasi dengan selulase dan pektinase dapat untuk penjernihan juice dan likuifikasi pada buah.
Aspek Finansial Dan Ekonomi
Penilaian kelayakan finansial industri pengolahan enzim xilananse dari tongkol jagung maupun ekstrak xilannya menggunakan kriteria harga pokok dan pengembalian modal dan Break Event Point (BEP) atau titik impas atau pulang modal.
a. Modal investasi, digunakan untuk pembelian tanah, biaya bangunan dan
perlengkapan kantor, alat dan mesin dan biaya pra operasional.
b. Biaya tetap, meliputi biaya penyusustan, bunga modal, pajak dan asuransi.
c. Biaya tidak tetap, meliputi biaya pembelian bahan baku dan bahan penolong, bahan
bakar dan listrik, perbaikan dan pemeliharaan upah karyawan.
d. Pendapatan, dihitung berdasarkan harga jual xilan atau xilanase di tahun 2005
dikalikan dengan jumlah produk yang dihasilkan.
e. Keuntungan, dihitung berdasarkan pendapatan dikurangi biaya total.
f. Waktu pengembalian modal, digunakan untuk mengetahui berapa lama modal awal
tertanam dalam proyek. Waktu pengembalian modal dihitung berdasarkan investasi yang tertanam dibagi dengan keuntungan bersih tahunan dan penyusutan.
g. Titik Pulang Pokok (Break Event Point), digunakan untuk mengetahui jumlah
minimum penjualan produk dengan tujuan perusahaan tidak mengalami kerugian dan juga tidak mendapatkan keuntungan. Rumus titik pulang pokok adalah sebagai berikut:
BEP = (FC) / (H-VC)
Dengan BEP = Jumlah penjualan pada titik pulang pokok FC = Biaya tetap
H = Harga jual /unit
BAHAN DAN METODE
Penelitian berlangsung selama 28 bulan dimulai bulan Januari 2002. Penelitian dilakukan di Laboratorium Biokimia dan Enzimatis Balai Penelitian Bioteknologi Tanaman Pangan dan Industri, Laboratorium Bioproses Balai Besar Penelitian dan Pengembangan Pascapanen, dan Laboratorium Rekayasa Bioproses PP Sumberdaya Hayati dan Bioteknologi, IPB.
Bahan dan Alat
Media mikrobiologi yang digunakan adalah ekstrak khamir, polipepton, K2HPO4, MgSO4.7H2O, NaCl, NH4Cl, Na2HPO4, oat spelt xylan, bakto agar, nutrien
broth. Isolat bakteri Clostridium acetobutylicum ATCC 824 diperoleh dari Balitvet.
Bahan kimia untuk ekstrak xilan yaitu natrium hipokhlorit, HCl, H2SO4, NaOH.
Bahan kimia untuk karakterisasi enzim dan pemurnia n xilanase yaitu sodium didosilsulfat, amonium persulfat,TEMED, tris-HCl, gliserol, albumin bovin serum, akrilamid, asam sitrat, bufer fosfat sitrat, bufer nitrat, maltosa, glukosa, ion- ion logam (dalam persenyawaan garamnya), aseton, etanol dan akuades. Tongkol jagung diperoleh dari petani.
Alat yang digunakan antara lain shaker, laminer, inkubator oven, inkubator
shaker, centrifuge, bioreaktor, spektrofotometer, preparative electrophoresis (Prepcell) 491 Biorad, pipet eppendorf, eppendorf tip, dan tabung eppendorf dalam
berbagai ukuran, dan peralatan gelas.
Tahapan Penelitian
1. Isolasi, seleksi dan identifikasi bakteri penghasil xilanase
2. Formulasi media kultivasi produksi xilanase dengan media bersubstrat oat spelt
xylane.
3. Ekstraksi xilan dari tongkol jagung
4. Formulasi media kultivasi produksi xilanase dengan media bersubstrat xilan dari
tongkol jagung.
5. Optimasi proses untuk kultivasi isolat bakteri alkalofilik lokal penghasil xilanase
unggul pada media bersubstrat xilan dari tongkol jagung.
6. Penentuan reologi cairan kultivasi dan tenaga untuk penggerak impeller 7. Pengendapan, karakterisasi dan pemurnian xilanase