EFEKTIFITAS CELL PENETRATING PEPTIDE VP22 SEBAGAI
ADJUVAN DALAM VAKSIN DNA FLU BURUNG
Novita Damayanti1, Amarila Malik1, Budiman Bela2, Silvia Tri Widyaningtyas2
1Program Studi Farmasi, Fakultas Farmasi, Universitas Indonesia 2Institute of Human Virology and Cancer Biology University of Indonesia
E-mail: novita.damayanti11@gmail.com
Abstrak
Indonesia merupakan negara dengan jumlah infeksi dan angka kematian flu burung tertinggi di dunia sehingga diperlukan adanya pengembangan vaksin flu burung di Indonesia. Vaksin DNA memerlukan dosis yang tinggi untuk respon imun yang baik sehingga diperlukan sistem penghantaran yang baik dan adjuvan untuk meningkatkan respon imun dengan dosis rendah. Salah satu adjuvan yang dapat digunakan adalah cell penetrating peptide yang mampu menghantarkan makromolekul secara intraseluler. Vaksin DNA flu burung menggunakan gen penyandi antigenitas yaitu neuraminidase, hemaglutinin, dan nukleoprotein yang difusikan dengan VP22. Artikel ini membahas mengenai pengembangan vaksin flu burung. Kemampuan VP22 dalam penghantaran interseluler telah dibuktikan pada tahun 2001, bahwadengan adanya fusi NA-VP22 dapat meningkatkan apoptosis. Penelitian tersebut mengalami perkembangan lima sampai tujuh tahun kemudian, hasil dari imunostaining menunjukan ekspresi SFV-VP22-HA lebih tinggi dibandingkan SFV-HA demikian juga VP22-NP lebih tinggi dibandingkan NP sehingga dapat dikatakan bahwa VP22 merupakan adjuvan efektif dalam meningkatkan imunogenesitas vaksin DNA yang menjanjikan untuk pengembangan vaksin DNA flu burung.
Kata kunci: flu burung; VP22; adjuvan; ekspresi; vaksin DNA
Abstract
Indonesia is a country with the highest level of infection and death number caused by avian influenza, so it is necessary to develop a vaccine against avian influenza.DNA vaccine needs high dose to give a good immune response so it is important to have a good delivery system and adjuvant to increase immune response by a low dose.One of adjuvant that can be used is cell penetrating peptide can deliver macromolecule intraseluler. Vaccines DNA against human-avian influenza used gene expressed antigenicity, neuraminidase, hemagglutinin, and nucleoprotein fused with VP22. This article discusses the development of avian influenza vaccine. VP22 in intercellular delivery capability has been demonstrated in
2001 that by fusion of NA-VP22 may increase apoptosis. The research has developed five to seven years later, the results of immunostaining showed expression of SFV-VP22-HA was higher than SFV-VP22-HA as well as higher than NP NP so that it can be said that the VP22 is an effective adjuvant in enhancing DNA vaccines promising immunogenecity development of DNA vaccines for avian influenza.
Keywords: avian influenza; VP22; adjuvant; expression; DNA vaccine
Pendahuluan
Flu burung (avian influenza [AI]) adalah infeksi yang disebabkan oleh virus influenza tipe A yang terdapat pada unggas. Influenza A umumnya tidak menular pada manusia namun beberapa subtipe di antaranya dapat menginfeksi manusia, seperti subtipe H5N1 (Horimoto T, Kawaoka Y. 2001). Virus influenza H5N1 terdiri dari dua jenis, Low Pathogenic H5N1 Avian Influenza (LPAI) hanya menimbulkan infeksi ringan pada unggas sedangkan Highly Pathogenic H5N1 Avian Influenza (HPAI) menyebabkan infeksi ringanbahkan kematian pada unggas dan dapat menular ke manusia (Robbins & Cotran, 2010).
Tahun 1997 dunia dikejutkan dengan merebaknya flu burung H5N1 yang menginfeksi dan menewaskan 6 dari 18 penduduk Hongkong yang terinfeksi (Horimoto T, Kawaoka Y. 2001). Tahun 2004, subtipe H5N1 dan H7N2 telah menginfeksi puluhan penduduk Vietnam, Thailand, dan Kanada. Berdasarkan laporan dari WHO (2012), sejak tahun 2003 HPAI menyebar luas ke beberapa negara, dengan angka kematian yang cukup tinggi, namun pada tahun 2012 telah terjadi kecenderungan penurunan baik angka kesakitan ataupun angka kematian manusia yang terkena infeksi virus H5N1. Hingga 26 April 2013, telah dilaporkan sebanyak 628 kasus infeksi HPAI-H5N1 dan 374 diantaranya telah meninggal dunia. Indonesia merupakan negara dengan jumlah infeksi dan angka kematian tertinggi di dunia (WHO, 2013).
Kasus infeksi clade baru pada unggas yang merebak awal tahun ini, yaitu penyebaran virus flu burung clade 2.3.2 pada unggas hingga mencakup 11 propinsi, menunjukkan perlunya upaya penanggulangan yang lebih nyata, efektif, dan ekonomis sehingga berdampak cukup besar dalam pencegahan infeksi virus HPAI-H5N1. Pengobatan menggunakan osetalmivir dan ribavirin dapat menyebabkan resistensi sehingga diperlukan adanya terapi yang lebih baik atau strategi vaksinasi melawan infeksi virus influenza (Goodman, Alan G, et al., 2011). Salah satunya adalah vaksinasi yang memberikan proteksi dalam jangka waktu lama dan efektif dalam mencegah infeksi (Allegra, 2008).
WHO merekomendasikan vaksin dengan formulasi Trivalent Inactivated Vaccines (TIV) dari dua strain subtipe virus influenza A dan satu strain virus influenza B yang dipilih berdasarkan antigenitas, genetik, dan fenotip oleh WHO Collaborating Center, diinaktifkan dengan formalin (baik berupa keseluruhan virus, subvirion, maupun antigen permukaan) (Compans, 2009). Vaksin dari virus yang diinaktifkan mempunyai kekurangan yaitu kurang ekonomis dalam produksi karena memerlukan penanganan yang lebih khusus dan memerlukan dosis yang tinggi (Rappuoli, Rino dan Fabio Bagnoli, 2011). Sebagai upaya mengatasi berbagai kelemahan yang terjadi pada penggunaan vaksin tersebut mulailah dikembangkan vaksin rekombinan/vaksin DNA. Vaksin DNA mulai dikembangkan namun diperlukan dosis yang tinggi untuk respon imun yang baik sehingga diperlukan sistem penghantaran yang baik dan adjuvan untuk meningkatkan respon imun dengan dosis rendah (Jain, Kewal K., 2008).
Adjuvan dapat berupa bahan kimia, protein ataupun DNA. Bahan kimia yang dapat dijadikan adjuvan contohnya alumunium fosfat. DNA yang memiliki sekuens non-metilasi (purin-purin-sitosin-guanosin-pirimidin-pirimidin) atau CpG dapat menjadi adjuvan karena memiliki efek menstimulasi sistem imun. Selain itu, cell penetrating peptide yang memiliki kemampuan penghantaran intraseluler dapat dijadikan adjuvan (Ellis, Ronald W. & Bernard R. Brodeur, 2003).
Adjuvan yang digunakan adalah cell penetrating peptide VP22 karena terdapat beberapa laporan bahwa protein tegumen HSV-1, VP22 dapat meningkatkan imunogenesitas antigen yang difusikan bersamanya. Mekanisme peningkatan imunogenesitas tersebut dikarenakan kemampuan VP22 dalam penghantaran intraseluler maupun interseluler. VP22 dapat menghantarkan makromolekul menembus membran plasma (intraseluler) (Saha, Sukumar, et al., 2006).
Penyebab utama timbulnya virus penyebab pandemik antara lain adanya rekombinasi dua glikoprotein utama pada permukaan virion yaitu hemaglutinin dan neuraminidase antar subtipe berbeda sehingga agar dapat merangsang sistem kekebalan tubuh, vaksin harus dirancang berdasarkan virus rekombinasi tersebut (Goodman, Alan G, et al., 2011). Hemaglutinin sangat mudah bermutasi sehingga kurang diminati untuk dikembangkan sebagai vaksin yang dapat merangsang proteksi silang antar isolat sedangkan gen nukleoprotein (NP) dan matriks (M) mempunyai laju mutasi yang rendah sehingga lebih
diminati untuk dikembangkan menjadi vaksin yang merangsang proteksi silang antar isolat (Saha, Sukumar, et al., 2006).
Untuk menekan jumlah kasus terinfeksi dan meninggal dunia yang disebabkan flu burung di Indonesia yang cukup tinggi dibandingkan negara lain, diperlukan adanya upaya pengembangan vaksin flu burung yang lebih efektif dengan mencari adjuvan yang efektif dalam meningkatkan imunogenesitas vaksin DNA sehingga didapatkan vaksin DNA yang efektif dan ekonomis (dosis vaksin dan biaya produksi yang rendah).
Virus Influenza
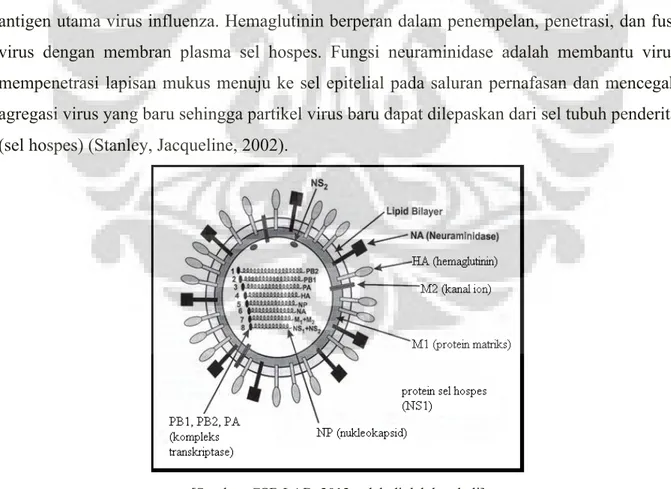
Virus influenza merupakan virus RNA berpolaritas negatif termasuk dalam famili Orthomyxoviridae. Virus influenza mempunyai selubung fosfolipid dari membran sitoplasma sel yang terinfeksi (Horimoto T & Kawaoka Y, 2001). Virus ini mempunyai tonjolan (spikes) pada selubung yang digunakan untuk menempel pada reseptor yang spesifik pada sel-sel hospesnya pada saat menginfeksi sel. Terdapat 2 jenis spikes yaitu glikoprotein hemaglutinin (HA) dan neuraminidase (NA) (Gambar 1). Hemaglutinin dan neuraminidase merupakan antigen utama virus influenza. Hemaglutinin berperan dalam penempelan, penetrasi, dan fusi virus dengan membran plasma sel hospes. Fungsi neuraminidase adalah membantu virus mempenetrasi lapisan mukus menuju ke sel epitelial pada saluran pernafasan dan mencegah agregasi virus yang baru sehingga partikel virus baru dapat dilepaskan dari sel tubuh penderita (sel hospes) (Stanley, Jacqueline, 2002).
[Sumber: CSB LAB, 2012, telah diolah kembali]
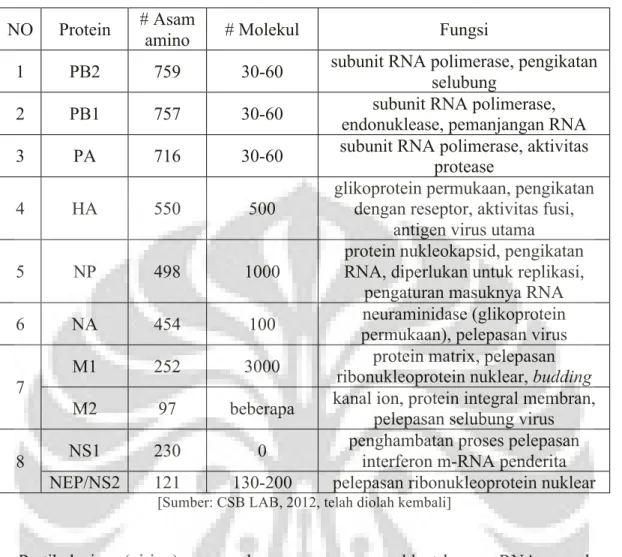
Tabel 2. Protein pada virus influenza
NO Protein # Asam amino # Molekul Fungsi
1 PB2 759 30-60 subunit RNA polimerase, pengikatan
selubung
2 PB1 757 30-60 subunit RNA polimerase,
endonuklease, pemanjangan RNA
3 PA 716 30-60 subunit RNA polimerase, aktivitas
protease
4 HA 550 500
glikoprotein permukaan, pengikatan dengan reseptor, aktivitas fusi,
antigen virus utama
5 NP 498 1000
protein nukleokapsid, pengikatan RNA, diperlukan untuk replikasi,
pengaturan masuknya RNA
6 NA 454 100 neuraminidase (glikoprotein
permukaan), pelepasan virus
7 M1 252 3000
protein matrix, pelepasan ribonukleoprotein nuklear, budding M2 97 beberapa kanal ion, protein integral membran, pelepasan selubung virus
8 NS1 230 0
penghambatan proses pelepasan interferon m-RNA penderita
NEP/NS2 121 130-200 pelepasan ribonukleoprotein nuklear
[Sumber: CSB LAB, 2012, telah diolah kembali]
Partikel virus (virion) mengandung genom asam nukleat berupa RNA yang beruntai tunggal dengan polaritas negatif, terdiri dari 8 molekul RNA (13.5 kb) yang mengkode sekitar 11 jenis protein dalam kompleks ribonukleoprotein (RNP), merupakan kode genetik untuk proses replikasi yang terjadi di dalam nukleus sel hospes. Kompleks ribonukleoprotein terdiri dari RNA yang terikat pada nukleoprotein (NP) dan kompleks RNA-dependent RNA polimerase merupakan suatu heterotrimer yang mengandung tiga subunit yaitu protein polymerase acidic (PA), polymerase basic protein 1 (PB1), dan polymerase basic protein 2 (PB2), yang bertanggung jawab dalam replikasi dan transkripsi RNA. Nukleokapsid (NP) merupakan protein utama komponen RNP dalam membentuk inti yang berbentuk heliks berperan dalam proses replikasi virus (Potter, C. W., 2002).
Kompleks ribonukleoprotein diselubungi oleh suatu cangkang protein matriks 1 (M1) bersifat hidrofobik yang berfungsi memberikan bentuk virus. Protein matriks ada dua jenis yaitu protein matriks 1 (M1) dan protein matriks 2 (M2) yang merupakan kanal ion penghubung antara bagian luar dengan bagian dalam. Satu komponen lainnya yang dimiliki
virus influenza adalah Nuclear Export Protein (NEP) yang lebih dikenal sebagai protein non-struktural 2 (NS2) yang berperan dalam penglepasan ribonukleoprotein (Potter, C. W., 2002). Mekanisme pertahanan tubuh penderita infeksi virus influenza diperantarai sel natural killer (NK) dan sel T CD8+. Sel T CD4+ berperan penting dalam sistem imun penderita karena menghasilkan sitokin. Sel B, antigen presenting cell (APC), dan fagosit juga berperan penting dalam sistem imun melawan infeksi (Stanley, Jacqueline, 2002).
Siklus Replikasi Virus Influenza
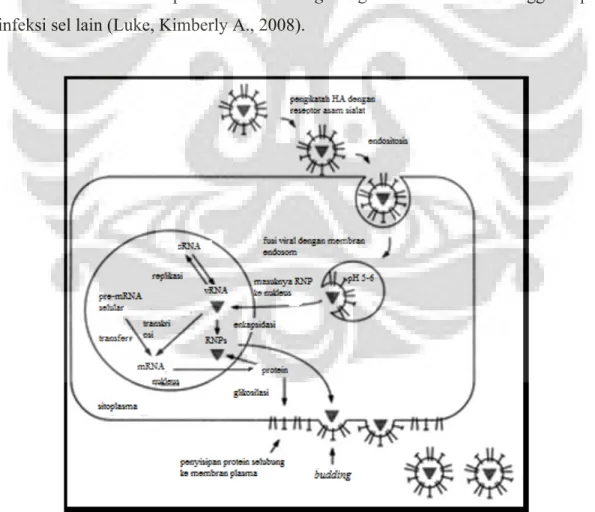
Replikasi virus diawali dengan fase adsorpsi virus. Setelah pembentukan protein subunit HA1 dan HA2, HA1 yang mengandung domain pengikat reseptor akan berikatan dengan molekul reseptor pada permukaan sel hospes [Gambar 2] (Tabel 2) yang mengandung asam N-asetil sialat (Gupte, Suraj, 2011) berupa ikatan galaktosa (GAL) dengan asam sialat (SA) α 2,3 (SAα2,3GAL) pada saluran pencernaan unggas sedangkan α 2,6 (SAα2,6GAL) pada saluran pernafasan manusia (Rappuoli, Rino & Giuseppe Del Giudice, 2011).
Selanjutnya adalah fase penetrasi virus dan pelepasan selubung virus yang terjadi 20-30 menit setelah adsorpsi virus (Gupte, Suraj 2011). Setelah berikatan dengan reseptor, virus masuk ke dalam sel hospes melalui proses endositosis dimediai reseptor klatrin (restriksive endosome). Protein M2 pada membran virus mengkatalisis ion H+ masuk ke dalam virion menyebabkan penurunan pH (pH asam antara 5-6) di dalam endosom, merangsang perubahan konformasi struktural glikoprotein HA0 (membentuk pori dalam endosom) yang mengakibatkan terpaparnya peptida fusi HA2 sambil mempertahankan domain pengikat reseptor HA1. Peptida fusi menyisip ke dalam membran endosom menyebabkan fusi membran virus dengan membran endosom [lepasnya selubung virus] diikuti disosiasi protein M1 dengan ribonukleoprotein menyebabkan pelepasan ribonukleoprotein (RNP’s) ke dalam sitoplasma sel inang (Tabel 2). Ribonukleoprotein ditranspor aktif dari sitoplasma menuju nukleus sel hospes oleh nukleokapsid (bagian dari RNP) untuk mensitesis RNA virus (vRNA) (Rappuoli, Rino & Giuseppe Del Giudice, 2011).
Transkripsi dan replikasi materi genetik virus influenza terjadi di dalam inti sel sehingga ribonukleoprotein virus perlu memiliki kemampuan untuk melakukan translokasi dari sitoplasma ke dalam inti sel. Komponen protein pembentuk RNP virus ialah NP, PA, PB1, dan PB2, memiliki nuclear localization signal (NLS), suatu struktur yang dapat berikatan dengan komponen sel yang berperan dalam transportasi molekul ke dalam inti sel (Boulo et al., 2007).
Untai negatif genom virus digunakan sebagai template dalam transkripsi mRNA positif oleh kompleks RNA-dependent RNA polimerase (PB1, PB2, dan PA) menggunakan promotor RNA influenza dan primer berasal dari pre-mRNA sel hospes (transkripsi pertama). mRNA virus ditranslasikan menjadi protein M1, NS2 (untuk mentransport mRNA dari nukleus menuju sitoplasma), dan NS1 yang diperlukan untuk sintesis RNA virus. Protein yang dihasilkan kemudian ditransport lagi ke dalam nukleus mengikat RNA virus membentuk ribonukleoprotein/RNP. Replikasi terjadi dari RNA virus (-) menjadi cRNA (+) yang kemudian menjadi template untuk pembentukan RNA virus yang baru. RNA virus yang baru berfungsi sebagai template untuk pembentukan mRNA virus yang baru (transkripsi kedua). mRNA virus yang baru ditranslasikan menjadi protein struktural yaitu HA, NA, dan M2, yang disisipkan ke dalam membran retikulum endoplasma dan terglikosilasi kemudian ditransport menuju badan Golgi untuk dihantarkan menuju membran sel dan bergabung dengan ribonukleoprotein yang telah dihasilkan sebelumnya. Interaksi antara komponen struktural virus dengan RNP dibantu M1 membentuk 8 segmen gen dalam virion. Partikel virus baru keluar dari membran sel hospes melalui budding dengan bantuan NA sehingga siap untuk menginfeksi sel lain (Luke, Kimberly A., 2008).
[Sumber: Harper, 1994, telah diolah kembali]
Vaksin DNA
Vaksin DNA merupakan vaksin yang mengandung satu atau lebih plasmid DNA, yang mengkode ekspresi dari protein inti virus atau protein selubung virus. Sel hospes yang diimunisasi akan menggunakan DNA untuk mengekspresikan dan memproduksi protein virus yang bersifat antigenik. Vaksin DNA secara injeksi intramuskular menyebabkan DNA masuk ke dalam jaringan otot yang mengandung beberapa sel dendritik membentuk APC, yang kemudian mengaktifkan respon imun (Wang, Gang, et al, 2011).
Vaksin DNA dapat diproduksi skala besar dengan mudah, pemberian berulang, dan sangat stabil dibandingkan protein atau polimer biologi lainnya. Vaksin DNA efektif dalam merangsang respon imun spesifik terhadap antigen namun dalam dosis yang besar disebabkan beberapa faktor yaitu transfeksi rendah, ekspresi antigen yang kurang memadai, dan penghalang ekstraseluler maupun intraseluler dalam tubuh penjamu sehingga diperlukan adanya design vaksin DNA. Beberapa strategi meliputi optimasi kodon dan gen antigen, pemilihan antigen yang tepat, sistem penghantaran dan rute pemberian vaksin yang memadai, penggunaan sitokin dan molekul kostimulan sebagai adjuvan, penggunaan booster, penghantaran vaksin tertarget. Diantara semua strategi tersebut, sistem penghantaran antigen tertarget terbukti meningkatkan imunogenesitas dan mengurangi dosis vaksinasi (Wang, Gang, et al, 2011).
Cell Penetrating Peptide
Strategi penghantaran makromolekul ke sistolik sebagian besar diformulasikan dengan meniru jalur masuknya virus dan bakteri secara selular. Strategi ini berfokus pada pengeluaran makromolekul dari endosom ke dalam sitosol melalui pengaturan pH dan aktivitas redoks/enzim dengan vesikel endositosis. Metode ini diperantarai oleh cell penetrating peptide yang bertujuan menghantarkan makromolekul menembus membran plasma. “Cell penetrating peptide (CPPs)” atau protein transduction domains (PTDs) merupakan peptida amfifatik dengan panjang sekitar 30 asam amino dengan muatan total positif. Salah satunya CPPs berasal dari glikoprotein yang menempel pada selubung lipid virus seperti virus HIV dan tegumen virion virus Herpes (Gad, 2007).
Protein struktural virus Herpes Simplex (HSV) VP22 adalah komponen utama tegumen virion yang terletak di antara kapsid dan selubung. VP22 adalah protein terfosforilasi dengan berat molekul 38 kDa dan dikodekan oleh gen UL49. VP22 adalah protein
multifungsional untuk sistem penghantaran intraselular dan pengikatan mikrofilamen. VP22 berperan dalam induksi hancurnya sitoskeleton, translokasi nuklear selama mitosis, dan pengikatan kromatin dan membran nuklear (Tihanyi, Karoly & Monika Vastag, 2011). VP22 efektif dalam menghantarkan beberapa protein, seperti GFP dan p53, yang aktif membelah dan berdiferensiasi sehingga meningkatkan efektivitas timidin kinase dan sitosin deamidase dalam sistem terapi gen untuk pengobatan kanker baik secara in vitro maupun in vivo serta berperan membantu penyebaran antigen dari sel yang terinfeksi ke sel dendritik. C-terminal dari VP22 (residu 267-301) diperlukan untuk translokasi membran (Gad, 2007).
VP22 yang terfusi dalam suatu protein memperantarai pemindahan protein fusi tersebut dari sel yang terinfeksi ke dalam sel yang tidak terinfeksi (menyebar antar sel). Pemindahan asam nukleat secara interseluler tersebut menyebabkan terbentuknya antigen presenting cell (APC) yang lebih banyak sehingga respon imun baik respon antibodi maupun seluler yang terbentuk diharapkan meningkat. Vaksin DNA yang mengkodekan fusi VP22 dengan glikoprotein virus hespes, protein papilomavirus atau nukleoprotein virus influenza menunjukan adanya peningkatan respon imun spesifik antigen (Tihanyi, Karoly & Monika Vastag, 2011).
VP22 memperantarai penghantaran protein yang difusikan dengannya menuju ke sitoplasma sel sekitarnya akan mengalami degradasi oleh proteasome menjadi fragmen peptida. Molekul MHC kelas I disintesis dalam retikulum endoplasma. Peptida yang dibentuk proteasome, ditransport ke dalam retikulum endoplasma melalui transporters associated with antigen processing (TAP) 1&2. Kemudian, peptida diproses oleh aminopeptidase ERAAP dan bergabung dengan molekul MHC kelas I. Kompleks peptida dengan molekul MHC kelas I ditransport ke permukaan sel membentuk APC. Pembentukan kompleks antigen dengan molekul MHC-I mengaktifkan sel T dengan marker protein permukaan CD8 (sel T CD8+) yang mengaktifkan sel T sitotoksik untuk melisiskan sel menimbulkan respon imun seluler (Murphy, Kenneth, 2012).
Protein eksogen akan terendositosis masuk ke dalam sitoplasma bentuk endosom yang ketika pHnya menurun, protease aktif mendegradasi protein antigen menjadi fragmen-fragmen peptida. Molekul MHC kelas II terbentuk di dalam retikulum endoplasma yang akan ditransport ke permukaan sel melalui vesikel. Vesikel yang membawa fragmen peptida mengalami fusi dengan vesikel yang membawa molekul MHC kelas II di dalam sitoplasma yang kemudian akan ditransport ke permukaan sel membentuk APC. Sel T CD4 mengenali kompleks MHC kelas II dengan peptida menyebabkan pengaktifan makrofag untuk
menghancurkan antigen, membantu sel B mensekresikan imunoglobulin melawan molekul bebas, dan meregulasi respon imun (Murphy, Kenneth, 2012).
Metodologi
Artikel ini disusun dengan metode tinjauan pustaka dengan membandingkan jurnal yang membahas fusi nukleoprotein dengan VP22, fusi hemaglutinin dengan VP22, fusi neuraminidase dengan VP22 sehingga dapat diketahui keberhasilan kemampuan VP22 sebagai adjuvan dalam meningkatkan imunogenesitas baik respon imun humoral maupun seluler dari nukleoprotein, hemaglutinin, dan neuraminidase. Selain itu, penelusuran berbagai buku dan jurnal lainnya yang dapat menunjang kemampuan penghantaran VP22 secara intraseluler maupun interseluler, dan pembahasan efektifitas VP22 sebagai adjuvan dalam vaksin DNA flu burung.
Pembahasan
Imunologi dan Imunisasi terhadap Virus Flu Burung
Virus Influenza A sangat penting dalam bidang kesehatan karena sangat patogen baik bagi manusia, dan binatang, yang menyebabkan angka kesakitan dan kematian yang tinggi, di seluruh dunia. Virus influenza A ini dapat menyebabkan pandemik karena mudahnya bermutasi, baik berupa antigenic drift ataupun antigenic shift sehingga membentuk varian-varian baru yang lebih patogen (Tamher & Noorkasiani, 2008). Virus flu burung HPAI H5N1 merupakan salah satu jenis virus influenza A yang menjadi perhatian karena dapat menyebar ke manusia terutama mereka yang kontak langsung dengan unggas dan dengan cepat dapat mengalami rekombinasi genetik yang disebabkan antigenic shift menjadi pandemik global (Zimmer, Gert, 2010).
Gejala pada orang yang terinfeksi pada virus influenza antara lain demam selama beberapa hari, sakit kepala, fotofobik, malaise, dan radang tenggorokan. Penderita infeksi influenza yang menggunakan salisilat (aspirin) selama fase permulaan infeksi dapat menyebabkan sindrom Reye (ensefalitis) (Stanley, Jacqueline, 2002).
Berbagai macam pengobatan dan vaksinasi telah dikembangkan untuk mengatasi virus flu burung, di antaranya vaksin mengandung virus yang dilemahkan dan dimatikan dengan
sistem propagasi virus. Pandemik global membutuhkan vaksin dalam jumlah banyak untuk imunisasi sejumlah besar penduduk dunia. Keterbatasan tersedianya telur ayam berembrio bebas patogen spesifik untuk propagasi virus sehingga sulit untuk memenuhi permintaan akan vaksin tersebut. Selain itu, sistem propagasi virus memerlukan BSL tingkat 3 sehingga vaksin yang dihasilkan menjadi kurang ekonomis. Pengembangan vaksin mulai diteliti dengan perlu memperhatikan formulasi dan pengecekan imunogenesitas dan toksisitas (Zimmer, 2010).
Salah satu pengembangannya adalah vaksin DNA yang mudah diproduksi skala besar. Mekanisme vaksin DNA dalam merangsang sistem imun adalah setelah plasmid DNA disuntikkan ke dalam jaringan secara intramuskular maka plasmid DNA akan bereplikasi secara autonom di dalam nukelus, transkripsi, dan memproduksi protein asing atau antigen yang dikode oleh gen vaksin dalam sitoplasma. Antigen ini langsung dapat menstimulasi sel B yang kemudian dapat memproduksi antibodi terhadap antigen atau protein asing yang dikode oleh plasmid DNA. Sel yang mengandung protein asing tersebut kemudian dapat bersifat sebagai sel penyaji antigen (antigen presenting cells/APC), yang kemudian dapat melalui jalur-jalur tertentu, baik melalui jalur major histocompatibility complex (MHC) I pada sel T CD8+ atau MHC II pada sel T CD4+ sehingga mengalami proses yang berbeda dalam merangsang sistem imunitas tubuh (Rappuoli, Rino dan Fabio Bagnoli, 2011).
Ikatan Ag-MHC I menyebabkan antigen dikenali oleh sel Tc, aktivasi sitokin sehingga terjadi lisis pada APC. Ikatan Ag-MHC II dapat mengaktivasi Th (Donelly, Wahren, dan Liu, 2005). Protein asing juga dapat langsung masuk ke dalam suatu sel penyaji lainnya misalnya sel dendritik, sehingga dengan demikian selain dapat merangsang sistem imun humoral juga dapat merangsang sistem imun selular. Karena proses pembentukan antigen oleh sel hospes setelah vaksinasi DNA menyerupai produksi antigen pada saat terinfeksi dengan mikroorganisme secara alamiah, maka respon imun yang dapat terjadi akibat vaksinasi DNA sama dengan respon imun yang diinduksi oleh mikroorganisme patogen (Rappuoli, Rino dan Fabio Bagnoli, 2011).
Vaksin DNA umumnya kurang imunogenik sehingga memerlukan dosis yang cukup tinggi untuk merangsang sistem imun secara efektif. Hal tersebut menyebabkan vaksin DNA menjadi kurang ekonomis. Salah satu upaya dalam mengatasi kelemahan tersebut adalah menggunakan adjuvan yang efektif menghantarkan antigen secara intraseluler. Adjuvan yang kini banyak dikembangkan adalah cell penetrating peptide (Wang, Gang, et al, 2011).
Efektifitas VP22 sebagai Adjuvan
Efektifitas VP22 sebagai adjuvan dalam vaksin DNA flu burung diamati dengan membandingkan tiga penelitian yaitu plasmid penyandi protein fusi nukleoprotein dengan VP22, fusi hemaglutinin dengan VP22. dan fusi neuraminidase dengan VP22. Plasmid tersebut yang akan digunakan untuk vaksin DNA dalam penanganan kasus flu burung.
Plasmid penyandi protein fusi nukleoprotein dengan VP22 hasil konstruksi ditransfeksikan ke dalam sel mamalia kemudian diamati dengan imunostaining untuk mengamati fungsi VP22 menggunakan pembanding plasmid yang mengandung gen nukleoprotein. Setelah didapatkan hasil plasmid tersebut dapat terekspresi di dalam sel mamalia, fungsi VP22 dipastikan kembali dengan imunisasi mencit. Hasil penelitian yang dilakukan oleh Sukumar Saha, et al. menunjukkan saat diinfeksi dengan NP-VP22 lebih banyak sel yang berfluoresensi, dibandingkan NP menandakan bahwa ekspresi protein VP22 lebih tinggi dibandingkan dengan plasmid NP. Mencit yang divaksinasi dengan NP-VP22 menunjukan respon humoral dan produksi interferon γ (IFN- γ) lebih tinggi dbandingkan dengan mencit yang divaksinasi plasmid nukleoprotein (Saha, Sukumar, et al. 2006).
Penelitian yang menggunakan plasmid penyandi protein fusi hemaglutinin dengan VP22 menggunakan metode yang hampir sama yaitu transfeksi ke dalam sel mamalia BHK-21 dengan metode lipofektamin kemudian setelah 48 jam diamati dengan imunostaining menggunakan antibodi poliklonal anti-HA namun tidak dilakukan imunisasi mencit. Hasil imunostaining dengan pengamatan di bawah mikroskop konvokal menunjukkan jumlah sel yang berfluoresensi lebih banyak pada perlakuan yang ditransfeksikan HA-VP22 dibandingkan dengan plasmid HA menandakan bahwa terjadi penyebaran antigen antar sel. Kesimpulan dari penelitian menunjukkan bahwa adanya kemungkinan vaksin DNA menggunakan plasmid HA-VP22 lebih efektif, karena VP22 memperantarai penghantaran antigen antar sel sehingga sebaiknya dilanjutkan dengan imunisasi mencit (Yang, Shi Gui, et al., 2009).
Beberapa protein virus menginduksi respon apoptosis sel yang terinfeksi salah satunya adalah neuraminidase. Neuraminidase mengaktifkan TGF-β laten, penginduksi apoptosis dalam sel epitelial. Apoptosis diinduksi oleh antigen (agen penginfeksi) meliputi aktivasi enzim pengkonversi interleukin (IL)-1β (ICE; caspase 1) yang mengaktifkan pro-IL-1β dan
Kemampuan apoptosis neuraminidase dan pengaruh fusi neuraminidase (NA)-VP22 diteliti oleh S. J. Morris (Morris, S. J., et al., 2002).
Hasil penelitian tersebut menunjukkan bahwa ekspresi protein neuraminidase menginduksi apoptosis dan ekspresi fusi NA-VP22 menginduksi apoptosis dengan lebih baik dikarenakan protein fusi NA-VP22 tersebut mengalami translokasi antar sel melalui medium. Neuraminidase mengaktifkan antibodi TGF-β (transforming growth factor-β) yang menginduksi apoptosis. Dengan demikian, VP22 mempunyai kemampuan menghantarkan protein antigen yang difusikan bersamanya secara interseluler menyebabkan banyak sel yang terinfeksi neuraminidase yang menginduksi reaksi antibodi apoptosis sel yang terinfeksi (Morris, S. J., et al., 2002).
Ketiga penelitian di atas membuktikan bahwa VP22 dapat menjadi adjuvan vaksin DNA yang efektif saat difusikan bersama antigen karena membantu penyebaran antigen secara intraseluler dan interseluler sehingga jumlah sel pengekspresi protein antigen meningkat, hal tersebut dapat mengurangi peningkatan jumlah APC yang merangsang sistem kekebalan tubuh.
Penutup
Cell penetrating peptide VP22 merupakan salah satu adjuvan vaksin DNA flu burung yang efektif dalam meningkatkan respon imun dikarenakan VP22 memiliki kemampuan menyebarkan makromolekul berupa antigenitas utama virus flu burung secara interseluler. Kemampuan VP22 sebagai adjuvan vaksin DNA sebaiknya tidak hanya dikembangkan untuk virus flu burung saja melainkan perlu adanya penelitian untuk virus-virus berbahaya lainnya. VP22 hanya merupakan salah satu adjuvan, diharapkan adanya penelitian-penelitian untuk menemukan adjuvan-adjuvan lainnya yang belum pernah ada. Kemampuan VP22 sebagai adjuvan telah banyak diteliti namun belum banyak penelitian yang memastikan keamanan (toksisitas) vaksin DNA yang difusikan dengan VP22 agar VP22 dapat dijadikan adjuvan untuk vaksin DNA yang dapat diedarkan untuk imunisasi dalam beberapa penyakit, dalam hal ini adalah flu burung. Penelusuran tinjauan pustaka dalam pembuatan artikel ini menemukan bahwa penelitian ini layak dilakukan di Indonesia terutama jika didukung oleh pemerintah dalam hal fasilitas dan pendanaan, mengingat masih adanya ancaman pandemi flu burung.
Kepustakaan
Allegra, Ernesto P. (Ed.). (2008). Avian Influenza Research Progress. New York: Nova Science Publisher, Inc.
Boulo S., Akarsu H., Ruigrok R.W., Baudin F. Nuclear Traffic of Influenza Virus Proteins and Ribonucleoprotein Complexes. Virus Res. 2007; 124:12-21.
Compans, Richard W. dan Walter A. Orenstein (Ed.). (2009). Vaccines for Pandemic Influenza. New York: Springer, 85-88.
CSB LAB. (2011). Avian Influenza. Seoul, Korea. Dikutip pada tanggal 8 Oktober 2012 dari: http://www.csblab.or.kr/avianinfluenza/.
Donelly, Wahren, dan Liu. (2005). DNA Vaccines: Progress and Challenges. J Immunol, 175, 633-639.
Ellis, Ronald W. dan Bernard R. Brodeur. (2003). New Bacterial Vaccines. New York: Kluwer Academic / Plenum Publishers.
Gad, Shayne Cox. (2007). Handbook of Pharmaceutical Biotechnology. Kanada: John Wiley&Sons, Inc., 287-289.
Goodman, Alan G, et al. (2011). A Human Multi-Epitope Recombinant Vaccinia Virus as a Universal T Cell Vaccine Candidate against Influenza Virus. Ploes One, 6, 10, 1-11. Gupte, Suraj. (2011). Influenza “Complete Spectrum”. Philadelphia: Elsevier.
Harper. (1994). Molecular Virology. Oxford UK: BIOS Scientific Publishers Limited, 31-32, 52-56.
Horimoto T & Kawaoka Y. (2001). Pandemic threat posed by avian influenza A viruses. Clin Microbiol Rev, 14, 1, 129-149.
Jain, Kewal K. (2008). The Handbook of Nanomedicine. New Jersey: Humana Press.
Luke, Kimberly A. (2008). Regulation of the Cellular p53 Protein by the Influenza Non-Structural 1 (NS1) Protein. US: ProQuest.
Morris, S. J., H. Smith, dan C. Sweet. (2002). Exploitation of the Herpes Simplex Virus Translocating Protein VP22 to Carry Influenza Virus Proteins into Cells for Studies of Apoptosis: Direct Confirmation that Other Proteins May Have a Role. Archives of Virology (2002), 147, 961-979.
Murphy, Kenneth. (2012). Janeway’s Immunobiology 8th Ed. New York: Garland Science,
Taylor & Francis Group, LLC.
Potter, C.W. (Ed.). (2002). Influenza. Amsterdam: Elsevier Science B.V.
Rappuoli, Rino dan Fabio Bagnoli (Ed.). (2011). Vaccine Design: Innovative Approaches and Novel Strategies. UK: Caister Academic Press.
Rappuoli, Rino & Giuseppe Del Giudice (Ed.). (2011). Influenza Vaccines for the Future 2nd Ed. Berlin: Springer.
Robbins & Cotran. (2010). Pathologic Basis of Disease 8th Edition. Philadelphia: Saunders Elsevier Inc.
Saha, Sukumar, et al. (2006). A Fused Gene of Nucleoprotein (NP) and Herpes Simplex Virus Genes (VP22) Induces Highly Protective Immunity Against Different Subtypes of Influenza Virus. Science Direct Virology, 354, 48-57.
Stanley, Jacqueline. (2002). Essentials of Immunology & Serology. New York: Delmar Thomson Learning.
Tihanyi, Karoly & Monika Vastag. (Ed.). (2011). Solubility, Delivery and ADME Problems of Drugs and Drug-Candidates. USA: Bentham Science Publishers, 190.
Wang, Gang, Li Pan, dan Yongguang Zhang. (2011). Approaches to improved targeting of DNA vaccines. Human Vaccines 7, 12, 1271-1281.
WHO. (2013, 21 Mei). Cumulative Number of Confirmed Human Cases of Avian Influenza
A/(H5N1) dilaporkan ke WHO 23 April, 2013. Dikutip dari:
http://www.who.int/influenza/human_animal_interface/H5N1_cumulative_table_archive s/en/index.html.
Yang, Shi Gui, et al. (2010). Expression of H5N1 influenza virus hemagglutinin protein fused with protein transduction domain in an alphavirus replicon system. Journal of Virological Methods 163, 31–39.
Zimmer, Gert. (2010). RNA Replicons - A New Approach for Influenza Virus Immunoprophylaxis. Viruses 2010, 2, 413-434; doi:10.3390/v2020413