TINJAUAN PUSTAKA
DNA Genom Kedelai
Kedelai Glycine mar (L.) Merry1 termasuk kelas Diotiledon, ordo Polypetales, famili Legurninosae, sub-famili Papilionoidae, genus Glycine, sub-genus Soja dan spesies mar. Menurut Hyrnowitz (l970), Glycine max m e ~ p a k a n hasil domestikasi dari jenis liar Glycine soja atau Glycine ururiensis yang menurut k l a s i f i i n y a termasuk subgenus Soja. Keduanya merupakan tanaman semusim dan memiliki jumlah kromosom yang sama yaitu 2n=40 dengan simbol genom GG.
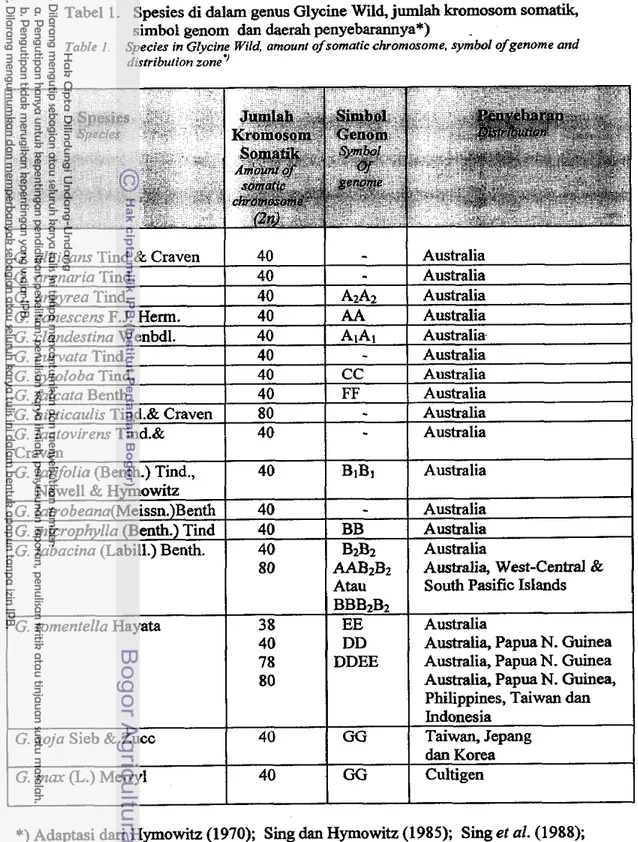
Spesies Glycine mar terdii dari beribu-ribu varietas. Koleksi terbesar dipunyai oleh Amerika Serikat (Bernard clan Hittle, 1976), dimana antara varietas yang satu dengan yang lain dibedakan oleh, antara lain: sifat morfologi, sifat kimia biji, respon terhadap hama dan penyakit, reaksi terhadap lingkungan tumbuh khusus, dan sifat agronomi. Lebii dari sepuluh jenis kerabat liar kedelai telah berhasil diidentifiii dan ditentukan simbol genomnya (Tabel 1) berdasarkan pada analisis sitogenetik
dari
hasil
persilangan interspesifik.
.
Melalui analisis kinetik DNA, diketahui bahwa genom kedelai (Glycine mar) mengandung sekitar 1.55 x106 kpb (Goldberg, 1978; Gurley et al., 1979). Karena genom diploid kedelai m e m i l i kromosom 2n=40 (Hardly clan Hymowitz, 1973), maka setiap DNA kromosomnya memiliki rata-rata panjang sekitar 77.5 x lo3 kpb. Disamping itu, diietahui pula bahwa kedelai ini mempunyai sekitar 60% urutan basanya sebagai basa berulang, baik terdapat secara mengelompok maupun terpisah (Pellegrini clan Goldberg, 1979).Tabel 1. Spesies di dalam genus Glycine Wild, jumlah kromosom somatik, simbol genom dan daerah penyebarannya*) .
Table I . Species in Glycine Wild, amount of somatic chromosome, symbol ofgenome and distribution zone7
*) Adaptasi dari Hymowitz (1970); Sing dan Hymowitz (1985); Sing et al. (1988); Tindale dan Craven (1988) dan Hymowitz (1991).
*)Adaptation from Hymowih (1970); Sing dan Hymowitz (1985); Sing el al. (1988); Tindale dan Craven (1988) don Hymowih (1991)
Kimiawi Aluminium
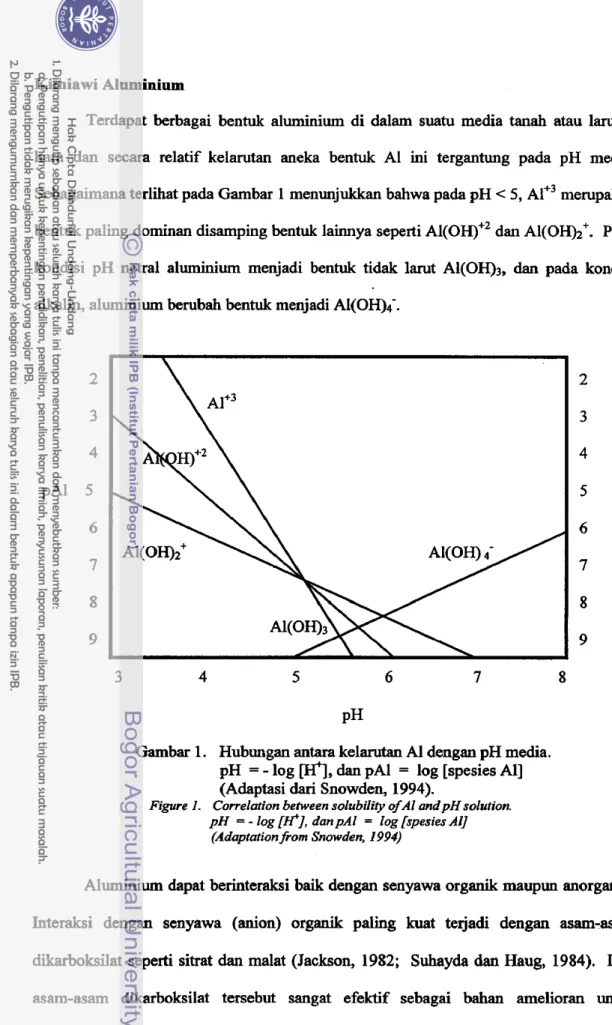
Terdapat berbagai bentuk aluminium di dalam suatu media tanah atau larutan hara dan secara relatif kelarutan aneka bentuk A1 ini tergantung pada pH media. Sebagaimana t e r l i i t pada Garnbar 1 menunjukkan bahwa pada pH < 5, ~ 1 + ~ merupakan bentuk paling dominan disamping bentuk lainnya seperti AI(OH)+~ dan Al(OH)2'. Pada kondisi pH netral aluminium menjadi bentuk tidak larut Al(OH),, dan pada kondisi allcalin, aluminium berubah bentuk menjadi AI(0H);
Garnbar 1. Hubungan antara kelarutan Al dengan pH media.
pH =
-
log[PI,
dan pAl = log [spesies All(Adaptasi dari Snowden, 1994).
Figure I . Correlation between solubility of A1 and pH solution. pH = - log
[a
dan pAI = log [spesies Al](Adaptation from Snowden, 1994)
Aluminium dapat berinteraksi baik dengan senyawa organik maupun anorganik. Interaksi dengan senyawa (anion) organik paling kuat tejadi dengan asam-asam dikarboksiiat seperti sitrat dan malat (Jackson, 1982; Suhayda
dan
Haug, 1984). Dan asam-asam dikarboksilat tersebut sangat efektif sebagai bahan amelioran untukm e n d e t o k s i i i A1 (Neet et al., 1982; Conner dan Meredith, 1985). Sedangkan interaksi A1 dengan senyawa (anion) anorganik seperti sulfat, fosfat, nor dan silikat membentuk suatu kompleks yang mempunyai affinitas tinggi terhadap oksigen atau air (Konishi dan Miyamoto, 1983; Hodson dan Evans, 1995: Haug, 1984). Interaksi A1 dengan anion tersebut berpotensi untuk meningkatkan pH perakaran sekaligus &pat membuat rancu pengaruh toksisitas A1 dengan defisiensi unsw tertentu seperti fosfat, karcna terbentuknya kompleks AI-P yang tidak tersedia bagi tanaman. Oleh karenanya, penggunaan konsentrasi anion yang tidak tinggi sekaligus mencegah interaksinya dengan A1 dapat membantu melihat pengaruh toksisitas A1 yang sebenarnya.
Fisiologi Toksisitas dan Toleransi Aluminium
Toksisitas Al. Gejala pertama yang paling mudah diienali pada tanaman akibat cekaman A1 adalah pada akar, dimana akar menjadi pendek
dan
menebal (stubby, thickenned, coralloid) khususnya akar utama (Sasaki et al., 1992, 1994; Ryan et al., 1993, 1994; dan Prihadi et a[., 1995). Hal ini tejadi karena proses pembelahan dan pemanjangan sel terganggu. Akibatnya, pertumbuhandan
perkembangan akar tanamanterhambat, dan dalam jangka panjang dapat menimbulkan kemampuan tanaman menyerap unsur hara berkurang (tanaman seolah-olah menderita defisiensi unsw hara seperti P, Ca, Mg, Ca, atau Fe) dan tanaman menjadi peka terhadap kekeringan sehingga berakibat pada pertumbuhan dan perkembangan bagian tajuk tanaman (Yamamoto et al.,
1992).
Untuk &pat memahami mekanisme toleransi Al, sangatlah penting untuk mengetahui: (i) bentuk aluminium yang menjadi toksii bagi tanaman (fitotoksik) dan (ii) sasaran utarna dari bagian tanaman yang mengalami kerusakan akibat cekaman aluminium.
Bentuk-bentuk aluminium di dalam tanah dapat berupa ion trivalen (AI'~), bentuk hidroksida seperti AI(OH)+~, AI(OH)2+, AI(OH)3, AI(OH)4', atau berasosiasi dengan berbagai senyawa organik dan inorganik seperti PO>,
sod-*,
F,
asam-asam organik, protein dan lipids sebagaimana diilustrasikan pada Gambar 1 (Haug, 1984; Marschner, 1991 ; DeIhaize dan Ryan, 1995). Diantara bentuk-bentuk A1 tersebut, A I + ~ m e ~ p a k a n bentuk yang paling toksik bagi tanaman dan kelarutannya sangat dipengaruhi oleh pH medialtanah. Dari gambar 1 tersebut nampak bahwa pada pH = 4 kelarutan A I + ~ tertinggi dan menurun seiring dengan peningkatan pH media.Sementara itu, tanah masam dapat te jadi karena banyaknya kation tercuci dari tanah, yang disebabkan antara lain oleh praktek budidaya tanaman yang intensif clan
atau hujan. Oleh karena itu, untuk melihat pengaruh fitotoksik Al, sebaiknya digunakan aluminium dalam bentuk A I + ~ , pH media = 4 dan kekuatan ioniknya rendah (Kinraide,
1991).
Untuk kepentingan pengklonan gen yang dilakukan dengan cara induksi atau memberikan cekarnan pada tanaman, periu dicari pada bagian jaringan tanaman mana cekaman tersebut pertarna kali menampakkan responlgejalanya. Dari bagian jaringan
tanaman itulah nantinya akan diisolasi gen-gen hasil induksi oleh cekaman tersebut. Beberapa hasil penelitian menunjukkan bahwa ekspresi gen-gen yang induksi oleh A1 (pada tanaman Jagung) berada pada ujung akamya (di belakang tudung akar atau daerah
pembelahan dan pemanjangan sel), berjarak
*
3-5 mm (Bennet dan Breen, 1991; Ryanet al., 1993; Jones dan Kochian, 1995). Di samping itu, agar ekspresi gen hasil induksi menampakkan hasil atau ada perbedaan dengan yang tidak diinduksi, maka respon bagian tanaman yang mengalami induksi atau menampakkan gejala cekaman harus mempunyai perbedaan yang cukup jelas, misalnya minimal berbeda setengah dari yang tanpa cekaman (Basu et al., 1994; Hoa
Le Van
et al., 1994; Ryan et al., 1994; danSamuel et al., 1997). Dari fenomena ini, maka ujung akar tanaman sepanjang i= 3-5 mm merupakan sasaran utama toksisitas A1 sekaligus sebagai dasar untuk mempelajari lebii jauh mekanisme toleransi (fisiologi, biokimia, genetika dan molekular) tanaman
terhadap cekaman Al.
Toleransi Al. Sesuatu unsur yang berkebiian pada media tumbuh tanaman, dapat mengganggu metabolisme melalui: (i) kompetisi dengan unsur esensial lain &lam penyerapan, (ii) menonaktifkan suatu enzim, (iii) menggantikan unsur-unsur esensial dari tempat berfungsinya, atau (iv) mengubah struktur air. Oleh karena itu, tanaman yang toleran terhadap kelebihan A1 pada media turnbuhnya, harm rnarnpu mengurangi absorpsi ion A1 oleh a k a atau mempunyai berbagai cara menetralh pengaruh A1 setelah diserap tanaman. Bagian terpenting dari pendekatan ini adalah bagaimana menentukan respon-respon fisiologi, biokimia, genetika, seluler clan molekuler tanaman yang berkaitan dengan toleransi terhadap cekaman Al. Dengan mengetahui sifat-sifat tanaman yang demikian dapat berguna dalam penapisan pada populasi tanaman yang besar, disamping bermanfaat sebagai indikator ada atau tidaknya potensial keracunan A1 pada tanah, sekaligus dapat mempelajari mekanisme dasar tentang adaptasi tanaman terhadap keracunan Al.
Beberapa karakter fisiologi toleransi tanaman terhadap A1 menunjukkan bahwa sifat tanaman yang lebii toleran terhadap cekaman A1 mampu: (I) mengakumulasi A1 lebii sedikit sehingga toksisitas A1 relatif kecil (Sasaki et al., 1994; Delhaize dan Ryan, 1995; Lazof et al., 1994; Sopandie et aL, 1996); ( 2 ) mengakumulasi anion nitrat lebih tinggi dibandingkan kation amonium dan menginduksi pH risosfir lebih tinggi mendekati pH optimal untuk pertumbuhan tanaman (Miyasaka el al., 1989; Anwar et al., 1996; Degenhard, 1998); (3) mensintesis senyawa-senyawa asam dikarboksilat seperti malat, oksalat, sitrat, dan fulvat serta senyawa fenil propanoat seperti kaffeat,
sebagai pengkelat A1 sehingga toksisitasnya menjadi rendah (Ojima et al., 1984; Ryan et
al., 1995 a,b; Sopandie et al., 1996; de la Funte et al., 1997; Ma et al.. 1998 dan Zheng, 1998); (4) meningkatkan aktifitas H + - A T P ~ ~ ~ membran plasma, yang mengatur keseimbangan ion proton antara di dalam dan di luar plasma membran sel, sehingga terjadi depolarisasi di membran plasma dan secara berantai mempengaruhi aktifitas metabolisme turunannya seperti aktifitas K-channel dan Ca-transporter yang masing- masing berperan di dalam proses detoksifikasi Al (Kasai et al., 1993, 1995; Kinraide et
al., 1994; Sasaki et al., 1995; Huang et al., 1996; Kumar, 1996; Larsen et al., 1998; Maathuis et al., 1998); (5) mensintesis protein spesifik pada membran (Picton et al..
1991; Basu et al., 1997) dan protein tertentu dari ujung akar (Marzuki et al., 1997), yang tidak ditemukan pada genotipe peka; serta (6) meningkatkan aktifitas enzim tertentu seperti reduktase nitrat (Anwar et al., 1996).
Respon Molekuler Terhadap Cekaman Aluminium
Salah satu peran penting dari studi mengenai respon molekuler terhadap cekaman A1 adalah untuk dapat lebih memahami mekanisme toieransi A1 baik yang te rjadi pada organisme eukariot maupun prokariot. Pengklonan gen-gen yang responsif terhadap cekaman aluminium merupakan langkah awal yang dapat ditempuh untuk dapat memahami mekanisme tersebut.
Mekanisme toleransi tanaman terhadap cekaman aluminium, terutama pada tingkat molekuler, belum sepenuhnya diietahui dengan jelas. Pada tingkat perkembangan tanaman, mekanisme tersebut sangat kompleks dan melibatkan banyak gen (Jusuf et al., 1997); tetapi pada tingkat biokirnia sel, mekanisme yang terjadi bisa sederhana dan mungkin hanya melibatkan satu gen (de la Funte et al., 1997; Ma et al., 1998 dan Zheng, 1998). Biosintesis suatu senyawa, sebagai respon terhadap kondisi
cekaman, mungkin hanya membutuhkan lintasan biokimia yang sederhana dengan sejumlah kecil enzim yang terlibat, sehingga hanya melibatkan sejumlah kecil gen. Namun dernikian, pengetahuan tentang litasan biokimia clan gen-gen yang terlibat di &lam mekanisme toleransi serta fungsi dari protein spesifik hasil ekspresi dari gen-gen tersebut, sampai saat ini masih amat terbatas.
Strategi pengklonan gen dimulai dari suatu upaya mengisolasi suatu fragmen DNAIgen dari dari suatu pustaka DNA. Terdapat dua jenis pustaka DNA, yaitu: (1) pustaka cDNA, yang merupakan kumpulan potongan DNA sebagai duplikat dari suatu populasi mRNA sehiigga hanya terdiri dari populasi sekuens DNA aktif pengkode protein, dan (2) pustaka genom, sebagai kumpulan dari potongan DNA yang terdiri dari klon-klon gen dari semua genom yang disamping mengandung urutan DNA yang berekspresi, di dalamnya juga tardapat urutan-urutan DNA lain seperti urutan DNA kopi berulang, d i i a pada tanaman tingkat tinggi porsinya sangat besar. Pembuatan pustaka cDNA dalam program pengklonan suatu gen aktif, memberikan keuntungan dibandingkan dengan pembuatan pustaka genom. Sebab, dengan pustaka cDNA yang hanya terdiri dari urutan DNA yang &if berekspresi, proses seleksi untuk mendapatkan gen yang menjadi sasaran menjadi jauh lebii ringan. Jadi, dari asal fragmen DNA yang berbeda akan berbeda pula pendekatan strategi pengklonan yang digunakan (Brown, 1991).
Untuk menyusun kepustakaan DNA yang lengkap atau hampir lengkap, Clark dan Carbon (1976) telah menurunkan suatu rumus yang berkaitan dengan probabilitas
(P) untuk memasukkan suatu urutanlfragmen (F) DNA tunggal terklon dari G ukuran
genom di darn kepustakaan acak dari N r e k o m b i i bebas, yaitu: N = [ ln
(1-P):ln
(I-FIG)1.
Fragmen DNA yang diiiginkan tersebut dapat bempa suatu gen yang aktif
mengendalikan sifat tertentu atau klon-klon DNA lain yang akan digunakan sebagai penanda molekular. Jika DNA yang ingin diklon berupa gen aktif pengkode suatu proteinlenzim, maka ada beberapa altematif pendekatan dalam penentuan strategi pengklonan yang akan dilakukan:
A. Bila DNA atau produk dari gen sasaran (protein atau enzim) telah diketahui, maka yang umum dilakukan adalah : (1) bila berupa suatu urutan DNA yang diketahui, maka dapat memanfaatkan urutan DNA yang telah diketahui itu (baik yang berasal dari satu spesieslhomologous maupun berbeda spesieslheterologous) untuk melacak suatu pustaka DNA; (2) bila berupa suatu proteidenzim yang diketahui, maka dapat menganalisa urutan asam amino dari proteidenzim tersebut kemudian mendeduksi dan mensintesis oligonukleotida kodonnya untuk kemudian dipakai sebagai pelacak dalam menyeleksi pustaka DNA yang dibuat (pendekatan heterologous bila DNA tersebut berasal dari lain spesies, atau pendekatan homologous bila DNA tersebut berasal dari spesies yang sama), atau melalui teknik a d i s a imunokimia, dengan jalan membuat antibodi dari proteinlenzim dimaksud untuk selanjutnya antibodi ini dipakai untuk menyeleksi pustaka DNA yang dibuat. B. Bila DNA atau protein/enzim dari gen sasaran belum diketahui, maka pendekatan
yang dapat dilakukan, yakni: (1) menggunakan teknik induksi terhadap gen sasaran dengan cekaman A1 tertentu, baik dilakukan pada organisme yang toleran maupun yang peka A1 dan dilacak dengan tehnik penapisan diferensial (Mundy dan Chua,
1988 dalam Aswidinnoor, 1991), dengan prinsip bahwa gen yang menjadi sasaran diiiduksi untuk berekspresi, kemudian mRNA diisolasi untuk membuat pustaka cDNA, clan cDNA yang terbentuk diseleksi untuk mendapatkan gen khsusus yang berekspresi oleh induksi tadi (oleh pelacak baik dari tanaman yang diiiduksi
maupun dari yang tidak diinduksi) atau melalui penapisan pita dengan teknik PCR (Polymerase Chaii Reaction); (2) mengisolasi gen A1 yang berasal dari organisme toleran Al; dan (3) mengisolasi gen A1 menggux&an organisme model seperti yeast atau Arabidopsis thaliana bahkan organisme isogenik.
Berdasarkan pendekatan-pendekatan sebagaimana tersebut di atas, maka sampai saat ini telah ditemukan paling tidak dua belas gen-gen hasil induksi A1 pada tanaman seperti yang tercantum pada Tabel 2. Tetapi, keduabelas gen tersebut belum spesifik terhadap cekaman Al, karena dengan cekaman lain seperti logam berat (MT, BCB, PAL, dan BPPI), pelukaan (MT, BCB, PAL, dan BPPI), ozon (SOD) dan oksidasi (SOD, BCB dan BBPI) juga terinduksi.
Tabel 2. Gen-gen yang induksi oleh aluminium pa& tanaman Table 2. Plant's aluminium induced genes
Phenylalanine ammonia lyase (PAL)
I
~andum',Nama GenIGenes SpesieslSpecies
Mebllothionine-like protein (MT)
Bowman-Birk proteinase inhibitors (BBPI) Pathogenesis related protein
(PR2)
P-glucanase
Keterangan :
1) Snowden and gardner (1993) 2) Richards et al. (1998) 3) Richards et al. (1995) 4) Cruz-Ortega & Ownby (1993) 5) Cruz-Ortega et al. (1995) 6) Ezaki et al. (1995)
7) Ezaki et al. (1996) 8) Harris et al., komunikasi personal
9) Ezaki et al. (1997) 10) Solinan dan Ragland (1998)
Notes :
I) Snawden and gardner (1993) 2) Richards et al. (1 998) 3) R i c h a d et al. (1995) 4) Cruz-Ortega & Ownby (1993) 5) Cnu-Ortega et al. (1995) 6) Ezaki el al. (1995) 7) Ezaki et al. (1996) 8) H a h el 01.. komunikaripersonal
9) Ezaki el al. (1997) 10) Soliman dan Ragland (1998)
Gandum', ArabidopsisL ~andum'.', Arabidopsk? Gandumt4
Gandum5 Auxin-induced gene (parA)
Glutathion-S-transferase (GST) Superoxide dismutase (SOD) Blue copper biding protein (BCB) Reticuliie oxygen: oxidoreductase GDP dissociation inhibitors (GDI) Auxin Down Regulated (ADR)
Tembakau" Tembakau7, ArabidopsisZ ~rabidopsis~ Gandum8, Arabidopsis2 Gandumx, ArabidopsisZ ~embakau' ~edelai'"
Pengurutan DNA (DNA Sequencing)
Pengurutan DNA merupakan kemampuan dasar dan prasyarat untuk merancang suatu manipulasi DNA. Pengurutan DNA dapat dilakukan melalui cara kimia (metode Maxam & Gilbert, 1977) atau cara enzimatis (metode Sanger et al., 1977).
Pada metode kimia, suatu DNA yang akan diurutkan harus diberi tanda radioaktif pada salah satu ujungnya dengan gugus fosfat 3 2 ~ , lalu dengan pereaksi
khusus basa (misalnya G = guanin) yang digunakan dalam suatu reaksi terbatas dengan DNA yang ujungnya bertanda, akan dihasilkan suatu set fiagmen tersarang yang ujungnya bertanda dengan panjang yang berbeda-beda. Cara ini saat ini kurang disukai karena kurang praktis dan hasilnya kurang baik.
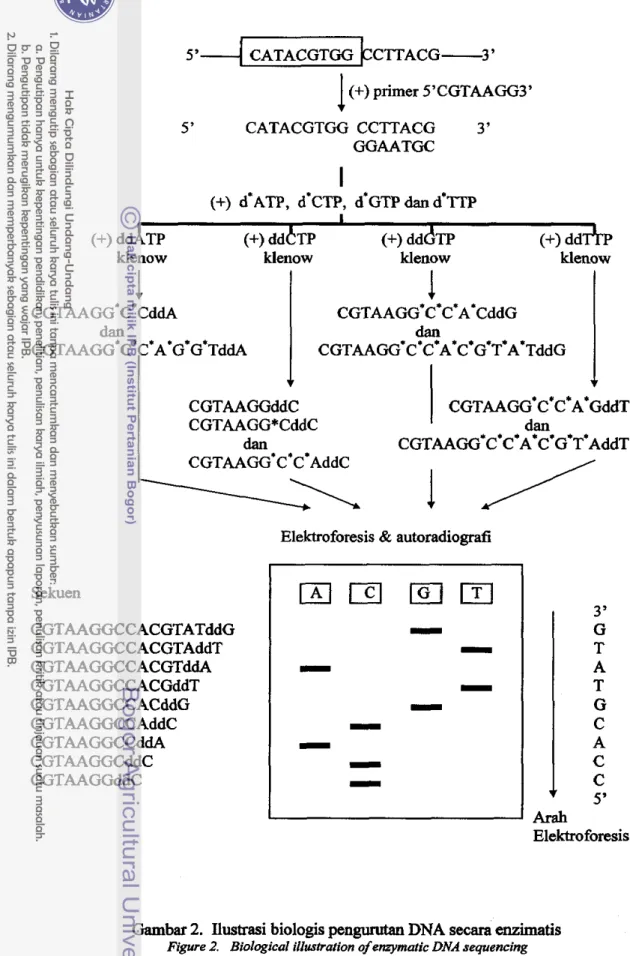
Metode enzimatis merupakan metode pengurutan DNA melalui terminator rantaildideoksiiukleotida yang berpusat pada dua ciri DNA polimerase, yaitu: (i) kemampuannya untuk mensintesis secara tepat salinan komplementer dari suatu cetakan DNA utas tunggal, dan (ii) kemampuannya untuk memanfaatkan 2'3'- dideoksinukleotida trifosfat sebagai substrat. Dalam ha1 ini, bila pada suatu sintesis rantai DNA menjumpai ujung 3'-nya kehilangan gugus hidroksil dan tidak lagi menjadi substrat untuk pemanjangan rantai, maka rantai DNA yang sedang tumbuh itu mengalami terminasi. Dalam praktek, penambahan klenow dari DNA polimerase I (yang telah kehilangan eksonuklease 5'-3' dari enzim utuhnya) digunakan untuk mensintesis kopi komplementer dari DNA cetakan. Ilustrasi biologis dari metode enzimatis ini tercantum pada Gambar 2.
Regulasi Gen
Berdasarkan tipe ekspresi gennya, pada setiap organisme hidup, termasuk tanaman, terdapat dua macam gen, yaitu: (1) gen konstitutif yang diekspresikan secara
5' CATACGTGG CTTACG- 3 '
1
c)
primer S~CGTAAGGY 5' CATACGTGG CClTACG 3' GGAATGCI
(+) ~ ' A T P , ~'CTP, ~ ' G T P dan ~'TTP I (+)~ ~ A T P
(+) d d t ~ ~ (+) d d d n(+I
d d hklenow klenow klenow klenow
I
CGTAAGG'C'C~~A1
1
CGTAAGG*C*C*A*C~~G dandan
CGTAAGG'C*C*A'G'G*T~~AI
CGTAAGG*C*C*A*C*G*T*A*T~~GI
1
C G T A A G G ~ ~ CI
CGTAAGG*C*C*A*G~~T CGTAAGG*CddC danCGTAAGG*C*C*A'C*G*T*A~~T
,
A
Elektroforesis & autoradiograti
Sekuen CGTAAGGcCACGTATddG CGTAAGGCCACGTAddT CGTAAGGCCACGTddA CGTAAGGCCACGddT CGTAAGGCCACddG CGTAAGGCCAddC CGTAAGGCCddA CGTAAGGCddC CGTAAGGddC Arah Elektroforesis
Gambar 2. Ilustrasi biologis pengumtan DNA secara enzimatis Figure 2. Biological ilIutrafion of enzymatic DNA sequencing
,
tern menerus sehingga produknya (proteinfenzim). di dalam sel tidak berubah tanpa memperhatikan kondisi pertumbuhan dan keadaan substrat di dalam sel, misalnya enzim-enzim dalam serangkaian glikolisis. Jadi dibutuhkan setiap saat. Dan (2) gen teregulasi yang ekspresinya tergantung kepada kebutuhan sesuai pertumbuhan dan perkembangan organisme atau situasi lingkungan tumbuhnya, misalnya gen-gen yang terinduksi akibat adanya cekaman biotik atau abiotik. Jadi berekspresi bila dibutuhkan.
Kontrol regulasi gen pada prokariot dan eukariot berbeda (Lewin, 1985). Perbedaan tersebut disebabkan karena berbedanya proses dan perangkat yang terlibat di &lam mengekspresi kan gen-gennya (DNA + RNA --, Protein). Pada prokariot (bakteri dan termasuk fage), kontrol regulasi gen umumnya terjadi pada tinglcat transkripsi dengan empat kunci esensial pengatur yaitu: (1) gen struktural teregulasi, (2) molekul protein regulator (dari gen struturalnya) yang mempunyai potensi mengikat elemen pengontrol secara spesifik, (3) elemen pengontrol (promotor dan operator), dan (4) efektor (inducer atau represor). Sedangkan pada eukariot, kontrol r e g u h i gennya terdiri dari enam tahapan, yaitu: (1) kontrol pa& tahap transkripsi, (2) kontrol pemrosesan mRNA, (3) kontrol transpor mRNA dari inti sel ke sitoplasma, (4) kontrol degradasi mRNA, (5) kontrol translasi oleh scleksi ribosom diantara mRNA, dan (6) kontrol aktivitas protein. Jadi pada eulrariot multiselluler yang telah mengalami diferensiasi, terdapat perbedaan morfologi dan fungsi diantara sel-scl dalam individu yang sama akibat perbedaan ekspresi gennya.