TUGAS AKHIR – TF141581
APLIKASI TiO
2SEBAGAI FOTOKATALIS DALAM
PENJERNIHAN AIR DENGAN MEDIA PEREKAT RESIN
ANING MALIKAH ALFAIZAH
NRP. 2412 100 059 Dosen Pembimbing
Lizda Johar Mawarani, ST, MT Dyah Sawitri, ST, MT
JURUSAN TEKNIK FISIKA Fakultas Teknologi Industri
Institut Teknologi Sepuluh Nopember Surabaya 2017
FINAL PROJECT TF0141581
APPLICATIONOF TiO
2AS PHOTOCATALYST IN
WATER PURIFICATION USING RESIN AS AN
ADHESIVE
ANING MALIKAH ALFAIZAH
NRP. 2412 100 059 Supervisor
Lizda Johar Mawarani, ST, MT Dyah Sawitri, ST, MT
DEPARTMENT OF ENGINEERING PHYSICS Faculty of Industrial Technology InstitutTeknologiSepuluhNopember Surabaya 2017
ix
SELF CLEANING CAT TEMBOK BATU GAMPING
NamaMahasiswa : Aning Malikah Alfaizah
NRP : 2412 100 059
Jurusan : TeknikFisika
DosenPembimbing : LizdaJoharMawarani, S.T, M.T. Dyah Sawitri, S.T, M.T.
Abstrak
Penelitian ini mengenai aplikasi TiO2sebagai
fotokatalis untuk menjernihkan air dengan media perekat resin.Masing-masing TiO2fasa anatase dan TiO2komersil
dicampurkan pada resin dengan perbandingan komposisi TiO2sebesar 0,5 ; 1 ; 1,5 gram dan massa resin tetap 25 gram.
Campuran resin dan TiO2dilapiskan pada stik es krim.
Selanjutnya stik tersebut dimasukkan ke dalam 100 ml air yang telah diberi pewarna merah ponceau (Cl. 16255) dan diberi perlakuan penyinaran. Dilakukan uji absorbansi pada sampel air berwarna setelah penyinaran di bawah sinar matahari setiap 6 jam per harinya selama 48 jam (8 hari). Berdasarkan hasil pengujian yang telah dilakukan pada penelitian ini menunjukkan bahwa semakin luas lapisan TiO2
yang digunakan semakin baik kemampuannya dalam menjernihkan air. Nilai absorbansi terkecil 0,070052 untuk TiO2sintesis yaitu pada sampel dengan konsentrasi TiO2
sintesis 0,5 gram pada luasan 30,255 cm2dengan penurunan sebesar 62,8%.
Kata kunci:TiO2, fotokatalis, absorbansi, resin, penjernihan
x
xi ADHESIVE
Name : Aning Malikah Alfaizah
NRP : 2412 100 059
Department : Engineering Physics
Supervisor : LizdaJoharMawarani, S.T, M.T. Dyah Sawitri, S.T, M.T.
Abstract
This research investigates the use of TiO2 as photocatalist to purify water with resin adhesive as the medium. Each anatase phase of TiO2 and commercil TiO2 was mixed by the resin with the composition of TiO2 namely 0,5 ; 1 ; 1,5 grams and resin mass remains 25 grams. The compound of resin and TiO2 was coated in ice stick. Then the ice stick was soaked in 100 ml of water which has been dyed by using ponceau red stain (Cl. 16255). The absorbance test was performed on the colored water sample which have been receiving sun’s radiation around 6 hours per day during 48 hours (8 days). The result of the test shows that TiO2 coating’s size affects the process of water purification, the more wider TiO2 coating size could make the water purifies well. The minimum absorbance score at 0,070052 for TiO2 syntesis was found on TiO2 syntesis by 0,5 grams concentration at 30,255 cm2 with the reduction of 62,8%.
Keyword:TiO2,photocatalyst, absorbance, resin, water
xii
xiii
KATA PENGANTAR
Segala puji dan syukur Alhamdulillah terpanjatkan kepada Allah SWTyang telah melimpahkan rahmat dan karunia-Nya serta shalawat dan salam kepada junjungan Nabi Muhammad SAW, atas terselesaikannya tugas akhir dengan judul:
” Aplikasi TiO2Sebagai Fotokatalis dalam Penjernihan Air dengan Media Perekat Resin”
Dalam penyelesaian Tugas Akhir ini didapatkan banyak motifasi, bantuan dan juga bimbingan serta arahan dari berbagai pihak. Oleh karena itu disampaikan banyak terima kasih kepada :
1. Bapak Agus Muhamad Hatta, ST, MSi, Ph.D, selaku Ketua Jurusan Teknik Fisika ITS.
2. Ibu Lizda Johar Mawarani, ST, MTdan ibu Dyah Sawitri, ST, MT atas bimbingannya selama pengerjaan tugas akhir ini kepada penulis.
3. Dr. Ing Doty Dewi Risanti, ST, MTselaku Kepala Laboratorium Rekayasa Bahan.
4. Seluruh dosen Rekayasa Bahan yang telah memberikan materi dan bimbingan untuk menunjang tugas akhir.
5. Seluruh dosenTeknik Fisika– ITSyang telah memberikan banyak ilmu dan pengalaman yang sangat bermanfaat pada saat perkuliahan.
6. Seluruh staf pegawai Jurusan Teknik Fisika atas semua bentuk kerjasamanya selama masa kuliah.
7. Seluruh teman-teman Laboratorium Rekaya Bahan, Rekayasa Fotonika atas fasilitas yang telah diberikan. 8. Ibu Hidayah dan Mbak Linda di Laboratorium
Mikrobiologi dan Bioteknologi Jurusan Biologi – ITS yang telah membantu dan memberikan fasilitas yang diperlukan.
xiv
9. Anisa Nurjannah selaku teman seperjuangan TAdan rekan-rekan F47 Teknik Fisika ITS yang senantiasa membantu, memberikan motivasi dan perhatian.
10. Kedua orang tua penulis, Bapak Abu Khoiri dan ibu Khosyi’ah atas do’a dan dukungan baik moriil maupun materiil.
11. Saudara-saudara tersayang (Mas Wahib, Dek Shilvi, Mas Ozy), Ela, Mas Mundzir yang telahmendukung, mendoakan dan memberi semangat kepadapenulis.
12. Rekan-rekan kos GL 105 dan Ma’had Aisyah atas segala bantuan dan perhatiannya.
13. Dan semua pihak yang tidak dapat penulis sebutkan keseluruhan atas segala bantuannya.
Dalam penyusunan laporan Tugas Akhir ini disadari akan banyaknya kekurangan. Oleh karena itu diharapkan saran dan kritik untuk kesempurnaan laporan ini agar menjadi lebih baik dan bermanfaat.
Surabaya, 23 Desember 2016
xv
Halaman HALAMAN JUDUL i LEMBAR PENGESAHAN v ABSTRAK ix ABSTRACT xiKATA PENGANTAR xiii
DAFTAR ISI xv
DAFTAR GAMBAR xvii
DAFTAR TABEL xix
BAB I PENDAHULUAN 1
1.1 Latar Belakang 1
1.2 Rumusan Masalah 2
1.3 Tujuan 2
1.4 Batasan Masalah 2
BAB II TINJAUAN PUSTAKA 3
2.1Titanium Dioksida (TiO2) 3
2.2 Proses Fotokatalis TiO2 6
2.3 Absorbansi 9
2.4 ResinPolyester 10
BAB III METODOLOGI PENELITIAN 13
3.1 Persiapan Bahan 14 3.2 Sintesis TiO2 14 3.3Uji Validitas 15 3.4Pelapisan Stik 17 3.5 Perlakuan Penyinaran 18 3.6 Pengambilan Data 19
3.7 Pengolahan Data dan Analisa 21
BAB IV HASIL DAN PEMBAHASAN 23
4.1 Uji Validitas 23
4.2UjiAbsorbansi 24
4.3 Uji Degradasi Warna Air 31
BAB V KESIMPULAN 37
xvi
LAMPIRAN CLAMPIRAN D
xvii
Hal Gambar 2.1 Struktur kristal TiO2a)anatase ; b) rutile 3
Gambar 2.2 Skema fotoeksitasi yang diikuti oleh deeksitasi pada permukaan
semikonduktor 7
Gambar 2.3 Mekanisme perpindahan elektron karena adanya pengaruh cahaya pada TiO2 7
Gambar 3.1 Skema diagram alir penelitian secara
umum 13
Gambar 3.2 Acuan standar JCPDS 00-021-1272 16 Gambar 3.3 Acuan standar JCPDS 00-004-0551 16 Gambar 3.4 Dimensi permukaan stik 17 Gambar 3.5 Proses penyinaran sampel di bawah sinar
matahari secara langsung 19 Gambar 3.6 Uji absorbansi di laboratorium dengan
menggunakan laser He-Ne dan OPM 20 Gambar 4.1 Hasil uji XRD TiO2 fase anatase 23
Gambar 4.2 Pengaruh waktu penjemuran terhadap nilai absorbansi untuk sampel TiO2
sintesis 0,5 gr 27
Gambar 4.3 Pengaruh waktu penjemuran terhadap nilai absorbansi untuk sampel TiO2
sintesis 1 gr 28
Gambar 4.4 Pengaruh waktu penjemuran terhadap nilai absorbansi untuk sampel TiO2
sintesis 1,5 gr 29
Gambar 4.5 Pengaruh waktu penjemuran terhadap nilai absorbansi untuk sampel TiO2
komersial 0,5 gr 29
Gambar 4.6 Pengaruh waktu penjemuran terhadap nilai absorbansi untuk sampel
xviii
TiO2komersial 1,5 gr 30
Gambar 4.8 Data hasil pengujian degradasi warna air pada sampel TiO2 sintesis 0,5 gr dengan
luasan 3 stik (30,255 cm2) 31 Gambar 4.9 Pengaruh waktu penjemuran terhadap
nilai derajat warna merah untuk sampel
xix
Hal Tabel 2.1 PerbedaanStruktur Kristal AnatasedanRutile 5 Tabel 2.2 Spesifikasi Resin Polyester 11 Tabel3.1 Kode Sampel yang Digunakan untuk
Perlakuan Penyinaran 19
Tabel 4.1 Data Hasil Pengujian Absorbansi Sampel dengan Konsentrasi TiO2 Sintesis 0,5 gr 25
Tabel 4.2 Data Hasil Pengujian Absorbansi Sampel dengan Konsentrasi TiO2 Sintesis 1 gr 25
Tabel 4.3 Data Hasil Pengujian Absorbansi Sampel dengan Konsentrasi TiO2 Sintesis 1,5 gr 25
Tabel 4.4 Data Hasil Pengujian Absorbansi Sampel dengan Konsentrasi TiO2 Komersial 0,5 gr 26
Tabel 4.5 Data Hasil Pengujian Absorbansi Sampel dengan Konsentrasi TiO2 Komersial 1 gr 26
Tabel 4.6 Data Hasil Pengujian Absorbansi Sampel dengan Konsentrasi TiO2 Komersial 1,5 gr 26
Tabel 4.7 Data Nilai Derajat Warna Sampel dengan Konsentrasi TiO2 Sintesis 0,5 gr 32
Tabel 4.8 Data Nilai Derajat Warna Sampel dengan Konsentrasi TiO2 Sintesis 1 gr 32
Tabel 4.9 Data Nilai Derajat Warna Sampel dengan Konsentrasi TiO2 Sintesis 1,5 gr 32
Tabel 4.10 Data Nilai Derajat Warna Sampel dengan Konsentrasi TiO2 Komersial 0,5 gr 33
Tabel 4.11 Data Nilai Derajat Warna Sampel dengan Konsentrasi TiO2 Komersial 1 gr 33
Tabel 4.12 Data Nilai Derajat Warna Sampel dengan Konsentrasi TiO2 Komersial 1,5 gr 33
xix
1 BAB I PENDAHULUAN 1.1 Latar Belakang
Seiring dengan perkembangan disegala aspek kehidupan baik teknologi, industri hingga jumlah penduduk yang semakin meningkat dari tahun ke tahun, semakin besar pula kebutuhan akan air bersih. Akibatnya, ketersediaan air bersih pun semakin berkurang. Pada musim kemarau, kesulitan air bersih juga banyak dialami oleh penduduk yang tinggal di pelosok pedesaan atau pedalaman dimana sumber-sumber air yang ada mengering sehingga air yang tersisa sangat sedikit dan kotor. Air merupakan kebutuhan pokok bagi semua makhluk hidup baik manusia hewan dan tumbuhan. Oleh karena itu ketersediaan air bersih sangatlah penting terutama untuk keperluan manusia baik itu untuk dikonsumsi, untuk sanitasi ataupun untuk keperluan yang lainnya.
Indonesia termasuk dalam negara beriklim tropis yang mana sebagian besar wilayahnya menerima pancaran sinar matahari selama rata-rata 12 jam setiap hari sepanjang tahun. Ketersediaan energi sinar matahari yang cukup melimpah ini dapat dimanfaatkan untuk berbagai kebutuhan. Salah satu pemanfaatan energi matahari ini adalah aplikasi TiO2 sebagai fotokatalisis
dalam penjernihan air.
Material titanium dioksida dikenal dengan titania (TiO2)
mempunyai sifat fotokatalis. Sifat fotokatalis tersebut dapat digunakan untuk pemecah ikatan-ikatan kimia yang terjadi pada air kotor. Peranan material TiO2 apabila dikenai sinar UV akan
merusak polutan sehingga akan keberadaannya di air (Chang W. Dan Lin W.Y, 1994). Penelitian sebelumnya yang telah dilakukan menunjukkan bahwa TiO2dapat meningkatkan kualitas air dengan
semakin menurunnya nilai absorbansi yang didapatkan sehingga air semakin jernih atau warna dari air tersebut semakin memudar (Agus, 2011) (Asthy, 2012). TiO2 yang terbaik dalam
fotokatalisis adalah TiO2 fasa anatase, karena material nano TiO2
fasa anatase memiliki luas permukaan yang lebih besar untuk mengabsorbsi sinar UV(Syukri, 2003). Sehingga semakin besar
energi matahari yang diterima untuk digunakan pada proses fotokatalisis.
Pada penelitian tugas akhir ini dikaji variasi luas lapisan TiO2 yang digunakan untuk mengetahui pengaruhnya dalam
mendegradasi pengotor dalam air atau menjernihkan air yang kotor dengan bantuan cahaya matahari dengan lama waktu penyinaran tertentu. Metode ini memanfaatkan resin sebagai bahan pencampur untuk merekatkan TiO2 pada media tertentu
yaitu stik.
1.2 Rumusan Masalah
Berdasarkan latar belakang di atas, maka permasalahan yang dihadapi dalam tugas akhir ini adalah bagaimana pengaruh luas lapisan TiO2 dalam aplikasinya sebagai fotokatalis dalam
menjernihkan air dengan media perekat resin.
1.3 Tujuan
Tujuan dari penelitian tugas akhir ini adalah untuk mengetahui pengaruh luas lapisan TiO2 pada aplikasi fotokatalisis
dalam penjernihan air dengan menggunakan resinsebagai media perekat.
1.4 Batasan Masalah
Untuk memfokuskan penyelesaian masalah pada penelitian tugas akhir ini dan mencapai tujuan yang diinginkan, maka batasan masalah yang diambil adalah sebagai berikut.
- TiO2 yang digunakan yakni TiO2sintesis dan komersil
- Bahan perekat yang digunakan adalah resin
- Bahan pewarna yang digunakan adalah pewarna merah tua Ponceau 4R (Cl. 16255)
- Kejernihan air diamati dari perubahan warna (kualitatif) dan nilai absorbansi yang diasumsikan mewakili tingkat kejernihan air secara kuantitatif
3
2.1 Titanium Dioksida (TiO2)TiO2 merupakan padatan berwarna putih, mempunyai
berat molekul 79,90, densitas 4,26 gcm3, tidak larut dalam HCl, HNO3 dan aquaregia, tetapi larut dalam HF dan H2SO4
(Cotton dan Wilkinson, 1988). TiO2 merupakan
semikonduktor yang memiliki fotoaktivitas dan stabilitas kimia tinggi serta tahan terhadap fotokorosi dalam semua kondisi larutan kecuali pada larutan yang sangat asam atau mengandung fluoride. Selain murah, TiO2 tersedia secara
komersial dan preparasinya mudah dilakukan di laboratorium (Brown et al., 1992).
Katalis TiO2 memiliki 3 jenis struktur kristal yaitu
anatase, rutiledan brookite. Struktur Rutiledan anatasecukup stabil keberadaannya dibandingkan dengan struktur brookite dan biasa digunakan sebagai fotokatalis (Gates, 1991). Perbedaan kedua struktur ini menyebabkan perbedaan massa jenis (3,9 g/mL untuk anatasedan 4,2 g/mL untuk rutile), energigap, serta kemampuan penyerapan sinar.
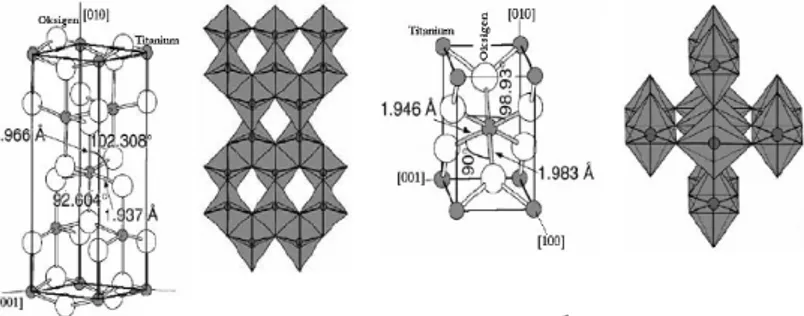
Gambar 2.1 Struktur Kristal TiO2 a) anatase; b) rutile (Diebold,
2003)
Perbedaan bentuk kristal akan mempengaruhi aktivitas fotokatalis TiO2. Bentuk kristal anatase memiliki aktivitas
fotokatalis terbaik dibandingkan dengan bentuk rutilemaupunbrookite. TiO2anataseini memiliki ukuran partikel
yang lebih kecil dan permukaan yang lebih luas sehingga sifat katalitiknya lebih baik (Syukri, 2003). Bentuk kristal anatasediamati terjadi pada pemanasan TiO2 bubuk mulai dari
suhu 120ºC dan mencapai sempurna pada suhu 500ºC. Kristal rutilemulai terbentuk pada suhu 700ºC (Gunlazuardi dan Tjahjanto, 2001) dan terjadi penurunan luas permukaan serta pelemahan aktivitas fotokatalis.
Struktur kristal brookite sulit untuk dipreparasi sehingga biasanya hanya struktur kristal rutiledan anataseyang umum digunakan pada reaksi fotokatalitik. Secara fotokatalitik, struktur anatasemenunjukkan aktivitas yang lebih baik dari segi kereaktifan dibandingkan dengan struktur rutile (Wu, 2004). Struktur anatasemerupakan bentuk yang paling sering digunakan karena memiliki luas permukaan serbuk yang lebih besar serta ukuran partikel yang lebih kecil dibandingkan dengan struktur rutiledan struktur ini muncul pada rentang suhu pemanasan dekomposisi senyawa titanium (400-6500°C).
Perbedaan struktur kristal juga mengakibatkan perbedaan energi struktur pita elektroniknya. Tingkat energi hasil hibridisasi yang berasal dari kulit 3d titanium bertindak sebagai pita konduksi sedangkan tingkat energi hasil hibridisasi dari kulit 2p oksigen bertindak sebagai pita valensi. Konsekuensinya posisi tingkat energi pita valensi, pita konduksi dan besarnya energi gapdi antara keduanya akan berbeda bila lingkungan atau penyusun atom Ti dan O di dalam kristal TiO2 berbeda, seperti
pada struktur anatase(Eg= 3,2 eV) dan rutile(Eg= 3,0 eV) (Gunlazuardi dan Tjahjanto, 2001).
Semakin kecil band gap, semakin mudah pula fotokatalis menyerap foton dengan tingkat energi lebih kecil namun semakin besar pula kemungkinan hole dan elektron untuk berekombinasi. Oleh karena itu, kedua aspek tersebut perlu dipertimbangkan dalam pemilihan fasa semikonduktor TiO2. Akan tetapi energi
gapyang terlalu kecil juga akan berpengaruh padakinerja fotokatalis. Energi gapyang terlalu kecil akan menyebabkan loncatan elektron dari pita valensi ke pita konduksi sehingga elektron kurang bebas (Lestari et al, 2012).
Tabel 2.1 Perbedaan Struktur Kristal Anatase dan Rutile(Palupi,2006)
Sifat Anatase Rutile
Bentuk kristal Tetragonal Tetragonal Tetapan kisi a 3,78 Å 4,58 Å Tetapan kisi c 4,49 Å 2,95 Å Berat jenis 3,9 4,2 Indeks bias 2,52 2,71 Kekerasan 5,5-6,0 6,0-7,0 Permitivitas 31 114 Eg 3,2 eV 3,0 eV Titik didih Berubah menjadi rutile pada suhu
tinggi
1858 °C
Anatasebersifat metastabil dan cenderung bertransformasi menjadi rutilepada suhu tinggi (sekitar 915 °C). Banyak faktor yang mempengaruhi transformasi anatase-rutilediantaranya dimensi rata-rata partikel dan kristal, adanya impurities pada bagian dalam dan permukaan TiO2 dan komposisi gas di sekitar
katalis selama reaksi katalitik (Cristallo et al., 2001). Fasa rutileTiO2menunjukkan fotoaktivitas yang lebih rendah dari fasa
anatase. Seperti yang telah dijelaskan sebelumnya, rutiledipreparasi dengan kalsinasi anatasepada suhu tinggi. Namun beberapa sumber melaporkan bahwa preparasi rutilepada suhu rendah telah berkembang dan menghasilkan fotoaktivitas yang cukup tinggi (Afrozi, 2010).Perbedaan struktur kristal anatasedan rutileditunjukkan pada Tabel 2.1. Kristal rutile
memiliki struktur yang lebih padat dibandingkan anatase, karenanya memiliki densitas dan indeks refraktif yang lebih tinggi.
2.2 Proses FotokatalisisTiO2
Fotokatalis adalah reaksi yang melibatkan cahaya (fotoreaksi) dan mengalamipeningkatan kecepatan reaksi akibat adanya katalis yang mengabsorbsi energicahaya ultraviolet (UV) sehingga menghasilkan senyawa pereduksi danpengoksidasi pada permukaan katalis. Proses di atas didasarkan pada kemampuanganda suatu material semikonduktor (misalnya TiO2,
ZnO, Fe2O3, CdS, ZnS)untuk menyerap foton dan melakukan
reaksi transformasi antar muka materialsecara simultan.
Salah satu tipe kristal dari TiO2 adalah anatase. TiO2 tipe
anatase memiliki aktivitas fotokatalisis terbaik dibandingkan dengan struktur kristal rutile dan brookit. TiO2fasa anatase
memiliki energi band gap (energi celah yang menggambarkan energi cahaya minimum yang dibutuhkan untuk mengeksitasi elektron) sebesar 3,2 eV yang sebanding dengan panjang gelombang < 388 nm dimana panjang gelombang tersebut lebih dekat ke sinar UV (200-400 nm), sedangkan rutile memiliki energi gap sebesar 3,0 eV yang sebanding dengan panjang gelombang < 413 nm dimana panjang gelombang tersebut lebih dekat ke sinar tampak (Linsebigler et al., 1995). Energi foton dipengaruhi oleh frekuensi gelombang dapat dirumuskan :
𝐸𝐸 = ℎ 𝑣𝑣 = ℎ
𝜆𝜆𝑐𝑐 (2.1)E = energi foton (J)
h = konstanta Plank (6,62618 x 10-34 Js)
𝑣𝑣
= frekuensi gelombang (Hz)c = cepat rambat gelombang ( 3 x 108 m/s) λ = panjang gelombang (m)
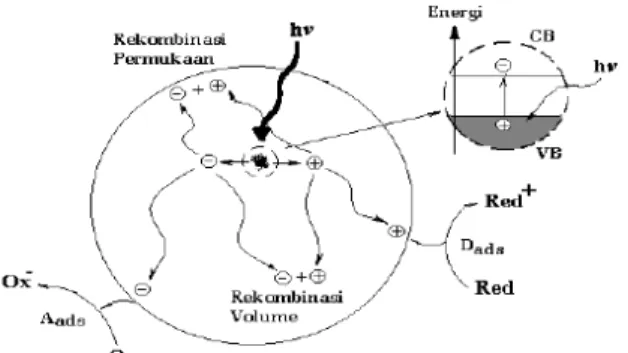
Secara umum, fenomena fotokatalitik pada permukaan semikonduktor dapat dipahami dengan penjelasan seperti
ditunjukkan oleh Gambar 2.2. Jika suatu semikonduktor tipe n dikenai cahaya (hυ) dengan energi yang sesuai, maka elektron (e-) pada pita valensi akan pindah ke pita konduksi, dan meninggalkan lubang positif (hole, disingkat sebagai h+) pada pita valensi. Sebagian besar pasangan e- dan h+ ini akan berekombinasi kembali, baik di permukaan atau di dalam bulk partikel. Sementara itu sebagian pasangan e- dan h+ dapat bertahan sampai pada permukaan semikondutor. Dimana h+ dapat menginisiasi reaksi oksidasi dan dilain pihak e- akan menginisiasi reaksi reduksi zat kimia yang ada disekitar permukaan semikonduktor.
Gambar 2.2Skema fotoeksitasi yang diikuti oleh deeksitasi pada permukaan semikonduktor (Benedix, 2000)
Mekanisme yang menggambarkan efek fotokatalitik dari TiO2 dapat diamati pada Gambar 2.3
Gambar 2.3Mekanisme perpindahan elektron karena adanya pengaruh cahaya pada TiO2 (Hoffman et.al., 1995)
Gambar 2.3 menunjukkan tahapan utama mekanisme fotokatalitik pada semikonduktor TiO2 yang meliputi :
a. Pembentukan muatan oleh foton: jika fotokatalis dikenai radiasi foton (hυ) dengan energi hυ yang besarnya sama atau melebihi energi celahnya (Eg), maka satu elektron akan tereksitasi ke dalam pita konduksi (ecb
-) dengan meninggalkan kekosongan pada pita valensi (hvb+). Reaksi
tersebut dapat dituliskan sebagai berikut.
TiO2 + hυ TiO2 (h +
+ e-) (2.2)
b. Rekombinasi pembawa muatan: kekosongan (lubang pada pita valensi (hvb
+
)). dapat bertindak sebagai oksidator yang cukup kuat dan dapat bergabung dengan elektron pada pita konduksi (ecb
-) sambil melepas panas. Reaksi tersebut dapat dituliskan sebagai berikut.
ecb
-+ {>Ti
IVOH }>Ti
IVOH
(2.3) hvb ++ {>Ti
IVOH }>Ti
IVOH
(2.4)c. Jika dalam sistem terdapat substrat yang dapat teroksidasi maka lubang pada pita valensi (hvb+) akan menginisiasi
reaksi oksidasi terhadap substrat tersebut.
d. Jika di dalam sistem terdapat suatu oksidator (misal oksigen) maka dapat terjadi inisiasi reaksi reduksi oleh elektron pada pita konduksi (ecb
-).
e. Reaksi fotoreduksi terkatalis dan reaksi termal lanjutan (misal reaksi hidrolisis atau reaksi dengan oksigen aktif) akan menghasilkan gas CO2, H
+
, Cl-dan H2O.
f. Penjebakan(trapping) elektron pada pita konduksi (ecb
-) ke permukaan fotokatalis TiIV
OHmembentuk
Ti
IIIOHReaksi tersebut dapat dituliskan sebagai berikut:
ecb
-+ >Ti
IVOH
{>Ti
IVOH}
(2.5) ecb -+ Ti
IVTi
III (2.6)g. Penjebakan (trapping) lubang pada pita valensi (hvb +
) ke dalam permukaan gugus titanol menghasilkan OH•. OH• pada permukaan TiIV
OH dapat bertindak sebagai
oksidator. Reaksi tersebut dapat dituliskan sebagai berikut.hvb +
+ >Ti
IVOH {>Ti
IVOH}
+(2.7)2.3 Absorbansi
Absorbansi cahaya pada suatu molekul merupakan suatu bentuk interaksi yang terjadi antara foton (partikel gelombang cahaya) dengan atom atau molekul. Energi cahaya yang datang diserap oleh atom atau molekul untuk selanjutnya digunakan oleh elektron di dalam molekul tersebut untuk bertransisi ke tingkat energi yang lebih tinggi bersesuaian dengan foton yang datang.
Pengukuran absorbansi dan transmitansi digunakan untuk mendapatkan nilai pengukuran kuantitatif, yaitu besarnya energi yang diserap akan sebanding dengan konsentrasi dan tebal sampel atau medium. Berdasarkan hukum Lambert-Beer, persamaan yang digunakan untuk menghitung banyaknya cahaya yang dihamburkan (T) atau transmitansi adalah sebagai berikut :
𝑇𝑇 = 𝐼𝐼𝑡𝑡
𝐼𝐼0 (2.8)
Sedangkang absorbansi dinyatakan dengan persamaan :
𝐴𝐴 = − log 𝑇𝑇 = log𝐼𝐼0
𝐼𝐼𝑡𝑡 (2.9)
dengan, A = absorbansi I0 = intensitas awal
It = intensitas cahaya setelah melewati sampel atau medium
atau
𝐴𝐴 = log𝑃𝑃0
dengan,
P0 = daya cahayaawal
Pt = daya cahaya setelah melewati sampel atau medium
Berdasarkan rumus I = P/A dimana A adalah luas berkas cahaya dapat diketahui bahwa P (daya) berbanding lurus dengan I (intensitas). Oleh karena itu dapat digunakan persamaan (2.10) untuk menghitung nilai absorbansi.Ketika cahaya dengan panjang berbagai panjang gelombang (cahaya polikromatis) mengenai suatu zat, maka cahaya dengan panjang gelombang tertentu saja yang akan diserap. Di dalam suatu molekul yang memegang peranan terpenting adalah elektron valensi dari setiap atom yang ada hingga terbentuk suatu materi. Elektron-elektron yang dimiliki oleh suatu molekul dapat berpindah (eksitasi), berputar (rotasi), dan bergetar (vibrasi) jika dikenai suatu energi.
Atas dasar inilah spektrofotometri dirancang untuk mengukur konsentrasi suatu zat yang ada dalam sampel. Dimana zat yang ada dalam sampel disinari dengan cahaya yang memiliki panjang gelombang tertentu. Ketika cahaya mengenai sampel sebagian akan diserap, sebagian akan dihamburkan dan sebagian lagi akan diteruskan. Pada spektrofotometri, cahaya datang atau cahaya masuk atau cahaya yang mengenai permukaan zat tidak dapat diukur, yang dapat diukur adalah I0/Itatau
P0/Pt(perbandingan cahaya datang dengan cahaya setelah
melewati materi atau sampel).
2.4 ResinPolyester
Unsaturatedpolyesterresin (UPR) merupakan jenis resin termoset atau lebih populernya sering disebut polyester saja. UPR berupa resin cair dengan viskositas yang cukup rendah, mengeras pada suhu kamar dengan penggunaan katalis tanpa menghasilkan gas sewaktu pengesetan seperti banyak resin termoset lainnya (Nurmaulita, 2010).
Resin polyester digunakan secara luas yaitu mencakup pelapis, perekat, material untuk serat karbon dan fiberglass dan lain sebagainya.Secara umum, resin dikenal karena sangat baik
sebagaiperekat dan tahan panas. Resin polyester dijual di toko-toko perangkat keras, biasanya sebagai paket yang terdiri dari resin dan hardener (katalis) yang terpisah dan harus dicampur segera sebelum digunakan.
Tabel 2.2Spesifikasi Resin Polyester (Surdia, 2005) Sifat Polyester Besaran
Kuat Tarik 40 Mpa
Elongasi 1,8 %
Kuat Tekan 5,5 Mpa
Modulus Elastisitas 300 Gpa
Kuat Impak 0,4 J/m
Densitas 1,1 kg/m3
Rasio Poison 0,33
Catatan untuk sifat-sifat Resin : • Kekentalan (pada 25o
C) : 4,5 – 5,0 Poise • Warna saat mengeras : bening (transparan) • Waktu gel (pada 30o
C) : 20 – 30 menit • Lama dapat disimpan (pada 25o
13 BAB III
METODOLOGI PENELITIAN
Padababinimenjelaskantentangtahapanpengerjaandaripenelitia n yang telahdilakukan. Pada Gambar 3.1 merupakan diagram alirtahapanpengerjaansecaraumum.
Gambar 3.1 Skema diagram alirpenelitiansecaraumum
Tidak Uji Validitas (XRD) Fasa Anatase ? Studi Literatur Persiapan Bahan Sintesis TiO2 Pelapisan Stik Perlakuan Penyinaran Pengamatan Degradasi Warna Uji Absorbansi Pengolahan Data dan Analisa
Penyusunan Laporan Akhir Mulai Ya Tidak Hasil Konsisten ? Selesai Ya
3.1 Persiapan Bahan
Disiapkan alat dan bahan yang diperlukan diantaranya adalah sebagai berikut :
• TiO2 fasa komersial
• TiO2 fasa anatase hasil sintesis
• Stik sebagai media tempat melekatnya TiO2
• Resin sebagai perekat dan hardener
• Pengotor berupa zat warna merah ponceau 4R (Cl. 16255)
• Wadah untuk mencampur • Wadah sampel
• Aquades
• Timbangandigital 3.2 SintesisTiO2
Untuk membuat material nano TiO2fasa anatase dilakukan
proses sintesis. Pada proses sintesis diperlukan beberapa alat dan bahan yang digunakan. Alat dan bahan yang digunakan adalah sebagai berikut :
• TiCl3 (Titanium trichlorid)
• HCl (hydrochlorid acid) 2M 37% • NH4OH (ammonia) 2M 25% • Aquades • Gelas beaker • Gelasukur • Pipet • Spatula • Mortar • Plastik Wrap • Crucible ukuran 50 ml • Magnetic stirrer
• Hotplate Yellow MAG HS • Furnace
Dalam proses sintesis untuk menghasilkan TiO2 fase anatase
digunakan TiCl3sebanyak 10 mldicampurkandengan 4,7 ml
aquades dan 0,3 ml HCl, diadukdengan kecepatan konstan dengan menggunakanmagnetic stirrerpadatemperatur 45oC selama±3 menit. Kemudian ditambahkan lagi HCl sebanyak 20 ml dengan posisi tetap diaduk. Setelah larutan berwarna ungu gelap kemudian ditambahkan NH4OH 25% sebanyak 50 ml dan terus
diaduk hingga larutan berwarna putih jenuh atau putih pekat. Selanjutnya proses dapat dihentikan dan larutan tersebut didiamkan dan ditutup menggunakan plastik wraphingga terbentuk endapan. Hasil endapan TiO2 dipisahkan dari cairan
diatasnya kemudian endapan dicuci dengan aquades hingga larutan NH4OH benar-benar hilang (tidak berbau amonia).Setelah
itu endapan dikalsinasi pada suhu 400 0Cselama 4 jam. Setelah dikalsinasi, TiO2 dihaluskan dengan menggunakan mortar sampai
teksturnya serbuk halus.
Berikutinimerupakanbentukreaksikimiadari proses sintesis yang dilakukanoleh (Hunter, 1998).
TiCl3 + 2NH4OH TiO2 + 2NH4Cl +H2 (3.1)
Setelah didapatkan TiO2fasa anatase kemudian dilakukan
karakterisasi TiO2 dengan menggunakan XRD untuk mengetahui
fasanyaapakah sudah sesuai yaitu fasa anatase.
3.3 Uji Validitas
Pada uji validitas digunakan metode pengujian X-Ray Diffraction (XRD). Pengujian XRDadalahpengujian material yang memanfaatkanprinsipdifraksisinar-X. Sinar-X
ditembakkanpadasampelkemudianakanterjadi proses penghamburansetelahsinar-X bertumbukandengansampel yang
diuji.Hasildaripengujianiniberupagrafikintensitasterhadapsudutdif
raksi (2θ). Semakintinggiintensitas yang dihasilkanmenunjukkanbahwa material yang terkandungdalamsampelsemakinkristalin.
material yang terkandungdalamsampelberbentukamorf. Pengujianinidilakukanuntukmengetahuiukuranpartikeldanfasadari suatubahan. Dalam penelitian ini Pengujian XRD dilakukan untuk mengetahui fasa TiO2 yang terbentuk hasil dari sintesis pada
tahapan sebelumnya. Untuk menganalisa fase anatase digunakan acuan standar JCPDS 00-021-1272 dan 00-004-0551.
Gambar 3.2Acuan standar JCPDS 00-021-1272(International Centre for Diffraction Data)
Gambar 3.3Acuan standar JCPDS 00-004-0551(International Centre for Diffraction Data)
Berdasarkan hasil pengujian XRD TiO2yang diperoleh dapat
dilakukan perhitungan ukuran kristal menggunakan persamaan Scherrer sebagai berikut (Sardela, 2008).
( )
FWHM k D * cosθ λ = (3.2)Dimana D adalah ukuran kristal suatu bahan (nm), k adalah konstanta (k=0,89), λ adalah panjang geombang sinar-X(Cu Kλ) yang bernilai 0,154 nm, FWHM adalah full width half maximum (dalam radian), dan θ adalah sudut difraksinya.
3.4 Pelapisan Stik
Dalam penelitian ini media yang dipilih untuk melapiskan TiO2 pada permukaannya adalah stik es krim. Penggunaan stik es
krim sebagai media tempat melekatnnya TiO2 didasarkan pada
ketersediaannya atau mudah didapat dan juga terjangkaunya harga. Selain itu pada penelitian sebelumnya digunakan media anyaman bambu akan tetapi media ini kurang efektif dikarenakan pada saat direndam dalam air media bambu ini ikut larut atau lapuk sehingga menyebabkan air menjadi keruh.
Gambar 3.4Dimensi permukaan stik Luas stik = luas persegi panjang + luas lingkaran
= (p x l) + (π x r2
) = 10,085 cm2
Dalam pembuatan sampel terdapat beberapa tahapan yaitu pembuatan larutan suspensi campuran resin dan TiO2 dengan
konsentrasi yang berbeda, pelapisan larutan pada permukaan stik es krim, dan pengeringan sampel.Variasi yang diterapkan yaitu
variasi konnsentrasi TiO2 dan variasi luas lapisan TiO2pada stik.
Variasi konsentrasi TiO2 yang digunakan yaitu sebanyak 0,5 gram
: 1 gram : 1,5 gram pada masing-masing material nano baik TiO2
hasil sintesis maupun TiO2 komersial. Sedangkan untuk variasi
luas lapisan TiO2 pada stik digunakan jumlah stik yang berbeda
yaitu 1 stik (10,085 cm2), 2 stik (20,170 cm2) dan 3 stik (30,255 cm2).
Untuk pembuatan larutan suspensi campuran antara resin dan TiO2 yaitu masing-masing sebanyak 25 gram resin kemudian
ditambahkan serbuk TiO2 banyaknya sesuai dengan konsentrasi
yang telah ditentukan sebelumnya. Proses pencampuran TiO2 dan
resin dilakukan dengan diaduk secara bertahap hingga tercampur rata. Media stik es krim yang sudah disiapkan dilapisi dengan larutan suspensi campuran antara resin dan TiO2 yang sudah
diberi hardener sebanyak 2 tetes. Sampel tersebut kemudian didiamkan sampai mengeras atau mengering.
Dalam penelitian ini dibuat sampel stik sebanyak masing-masing minimal 6 buah untuk setiap konsentrasi TiO2 sintesis dan
setiap konsentrasi TiO2 komersial. Sehingga total sampel
stikberlapis TiO2 yang diperlukan sebanyak 36 buah.
3.5 Perlakuan Penyinaran
Permukaanstik berlapis TiO2 yang telah kering kemudian
dimasukkan ke dalam wadah sampel yang berisi 100 ml air berwarna merah (Cl. 16255) untuk direndam. Air berwarna merah tersebut diperoleh dari 2000 ml aquades yang diberi pewarna merah (Cl. 16255) sebanyak 8 tetes kemudian dibagi ke dalam beberapa wadah sampel masing-masing sebanyak 100 ml.wadah sampel yang digunakan adalah yang terdapat penutup beningnya sehingga air tidak habis menguap dan sinar matahari masih bisa mengenai sampel pada saat penyinaran.
Tabel 3.1Kode Sampel yang Digunakan untuk Perlakuan Penyinaran
Jenis TiO2
Var. Luas Lapisan (cm2)
Variasi Konsentrasi TiO2
Air saja a (0,5 gr) b (1 gr) c (1,5 gr) Sintesis 10,085 (1 stik) 1Sa 1Sb 1Sc 0 20,170 (2 stik) 2Sa 2Sb 2Sc 30,255 (3 stik) 3Sa 3Sb 3Sc Komersial 10,085 (1 stik) 1Ka 1Kb 1Kc 20,170 (2 stik) 2Ka 2Kb 2Kc 30,255 (3 stik) 3Ka 3Kb 3Kc
Sampel-sampel tersebut kemudian diberi perlakuan penyinaran dengan dijemur di bawah sinar matahari secara langsung selama 48 jam penyinaran (8 hari).
Gambar 3.5Proses penyinaran sampel di bawah sinar matahari secara langsung.
3.6 Pengambilan Data
Pada penelitian ini data diambil secara kualitatif dan kuantitatif. Dilakukan pengamatan degradasi warna atau
perubahan warna yang terjadi pada sampel air berwarna setelah diberi perlakuan penyinaran.Data kualitatif ini berupa pengamatan dan pengambilan gambar air berwarna dengan menggunakan kamera setiap 6 jam penyinaran. Adapun data kuantitatif berupa nilai absorbansi air. Nilai absorbansi air mewakili tingkat kejernihan airnya. Semakin kecil nilai absorbansi yang didapatkan maka sampel air semakin jernih.
3.6.1 Uji absorbansi
Uji Absorbansi dilakukan setiap 6 jam penyinaran sehingga selama waktu total penyinaran48 jam, setiap sampel diuji absorbansi hingga 8 kali, yaitu setelah sampel disinari selama 6 jam, 12 jam, 18 jam, 24 jam, 30 jam, 36 jam, 42 jam, 48 jam. Untuk mendapatkan nilai absorbansi dari masing-masing sampel air dilakukan pengujian dengan menggunakan prinsip Lambert-Beer. Masing-masing sampel air diambil dan dimasukkan ke dalam kuvet. Kuvet yang berisi sampel air diletakkan di tengah sejajar antara sumber sinar laser He-Ne dan detektor yaitu OPM (optical power meter) seperti tampak pada Gambar 3.6.
Gambar 3.6Uji absorbansi di laboratorium dengan menggunakan laser He-Ne dan OPM
Terdapat dua nilai yang diukur, yaitu nilai daya laser sebelum mengenai kuvet (P0) dan nilai daya laser setelah
melewati kuvet berisi sampel air (P). Nilai absorbansi masing-masing sampel didapatkan dengan membandingkan nilai daya laser sebelum mengenai sampel (P0) dengan nilai daya laser
3.6.2 Uji degradasi warna
Uji degradasi warna dilakukan untuk mengamati perubahan warna yang terjadi pada sampel air berwarna setelah diberi perlakuan penyinaran. Data diperoleh dari pengambilan gambar sampel air setiap 6 jam penyinaran dengan menggunakan kamera. Selain itu dilakukan pengolahan gambar dengan software Image J untuk mengetahui penurunan derajat warna pada sampel air.
3.7 Pengolahan Data dan Analisa
Pada uji absorbansi dengan menggunakan laser He-Ne dan detektor berupa OPM didapatkan nilai daya cahaya laser setelah dilewatkan pada masing-masing sampel air berwarna (Pt).
Sebelumnya diukur nilai daya cahaya laser terlebih dahulu (P0).
Setelah didapatkan nilai P0 dan Pt dari masing-masing sampel air
berwarna kemudian dilakukan pengolahan data untuk mendapatkan nilai absorbansinya. Untuk menghitung nilai absorbansi sampel air berwarna digunakan persamaan (2.10). Data nilai absorbansi yang diperoleh kemudian diplot pada grafik untuk dilihat tren-nya sehingga dapat dianalisa. Pada uji degradasi warna yang dilakukan dengan pengolahan gambar menggunakan software Image J didapatkan nilai derajat warna merah pada masing-masing gambar sampel air. Derajat warna merah tersebut menunjukkan kepekatan warna merah pada gambar. Data nilai derajat warna merah tersebut diplot pada grafik dan dianalisa.
23 BAB IV
HASIL DAN PEMBAHASAN 4.1 Uji Validitas
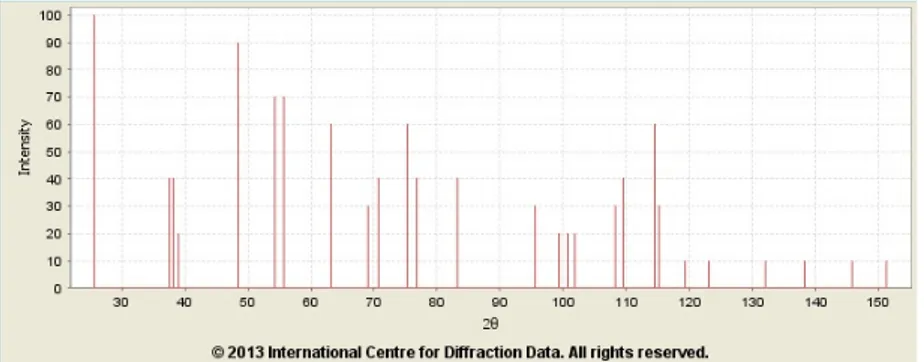
Pada penelitian ini dilakukan uji validitas berupa pengujian XRD. Pengujian XRD serbuk TiO2 bertujuan untuk mengetahui
fase TiO2 yang terbentuk dari hasil sintesis yang telah dilakukan.
Gambar 4.1 dibawah ini merupakan salah satu hasil pengujian XRD TiO2yaitu sintesis ke 3. Untuk menganalisa fase anatase
digunakan acuan standar JCPDS 00-021-1272 dan 00-004-0551 seperti pada Gambar 3.2 dan Gambar 3.3.
Gambar 4.1 Hasil uji XRD TiO2fasaanatase
Pada gambar 4.1 dapat dilihat bahwa ditemukan peaks TiO2 fase anatase pada sudut 2θ yaitu 25
°
, 48°,55°. Dalam penelitian ini dilakukan 6 kali sintesis TiO2 untuk mendapatkan
serbuk TiO2 fasa anatase yang baik. Dari 6 kali sintesis tersebut
didapatkan hasil yang baik yaitu pada sintesis ke 1, 3, 5 dan 6. Dimana pada hasil grafik sintesis ke 1 ditemukan peaksTiO2 fase
anatase pada sudut 2θ yaitu 25°
, 47°, untuk sintesis ke 5 ditemukan peaksTiO2 fase anatase pada sudut 2θ yaitu 25
°
, 37°, 55° dan untuk sintesis ke 6 ditemukan peaksTiO2 fase
anatase pada sudut 2θ yaitu 25°
, 38°, 55°. Peaks tersebut menunjukkan serbuk TiO2 yang dihasilkan dari beberapa sintesis
yang telah dilakukan tersebut mempunyai fasa anatase. Dari hasil tersebut dapat dihitung ukuran kristal TiO2 yang terbentuk.
Berdasarkan hasil pengujian XRD TiO2tersebut dapat
dilakukan perhitungan ukuran kristal menggunakan persamaan 3.2. Setelah dilakukan perhitungan ukuran kristal nano material TiO2 fasa anatase dari beberapa pengujian didapatkan ukuran
kristal antara 10-40 nm yaitu 20 nm untuk sintesis ke 1, 11 nm untuk sintesis ke 3, 12 nm untuk sintesis ke 5 dan 13 nm untuk sintesis ke 6. Serbuk TiO2 hasil dari sintesis-sintesis tersebut
digunakan untuk pembuatan sampel pada tahap selanjutnya.Hasil pengujian XRD selengkapnya dapat dilihat pada Lampiran A.
4.2UjiAbsorbansi
Sebagaimana dibahas dalam sub bab 3.6.1 , uji absorbansi dilakukan setelah sampel air berwana dengan stik berlapis TiO2
di dalamnya disinari selama 6 jam/hari. Pada hari pertama dilakukan penyinaran dengan sinar matahari langsung selama 6 jam, kemudian sampel diambil untuk diuji absorbansi di laboratorium dan dikembalikan lagi untuk diberi perlakuan penyinaran di hari berikutnya. Pengujian dilakukan sampai dengan hari ke delapan sehingga total waktu penyinaran adalah 48 jam.
Pada penelitian ini dilakukan pengambilan data absorbansi sebanyak 3 kali, pertama dengan menggunakan alat spektrofotometer akan tetapi data yang dihasilkan tidak konsisten sebagaimana terlampir pada Lampiran C. Kemudian dilakukan pengukuran kembali dengan menggunakan laser He-Ne dan OPM. Data hasil pengujian absorbansi tertulis pada Tabel 4.1, 4.2, 4.3 untuk sampel dengan stik yang dilapisi TiO2 sintesis.
Adapun data absorbansi untuk sampel degan stik yang dilapisi TiO2 komersial dinyatakan dalam Tabel 4.4, 4.5, 4.6.
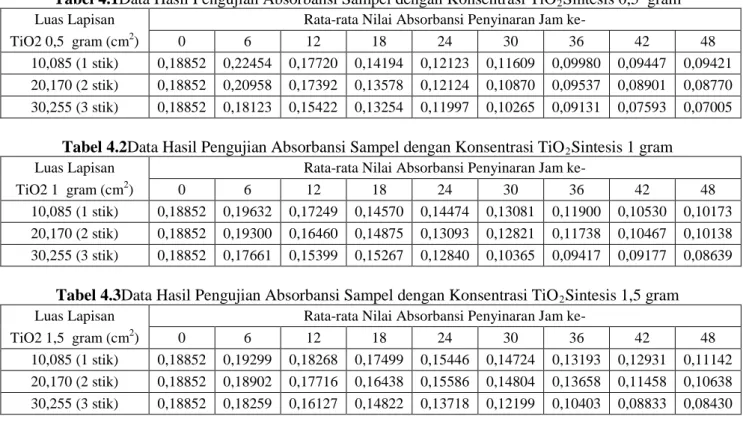
25 Tabel 4.1Data Hasil Pengujian Absorbansi Sampel dengan Konsentrasi TiO2Sintesis 0,5 gram
Luas Lapisan Rata-rata Nilai Absorbansi Penyinaran Jam ke-
TiO2 0,5 gram (cm2) 0 6 12 18 24 30 36 42 48
10,085 (1 stik) 0,18852 0,22454 0,17720 0,14194 0,12123 0,11609 0,09980 0,09447 0,09421
20,170 (2 stik) 0,18852 0,20958 0,17392 0,13578 0,12124 0,10870 0,09537 0,08901 0,08770
30,255 (3 stik) 0,18852 0,18123 0,15422 0,13254 0,11997 0,10265 0,09131 0,07593 0,07005
Tabel 4.2Data Hasil Pengujian Absorbansi Sampel dengan Konsentrasi TiO2Sintesis 1 gram
Luas Lapisan Rata-rata Nilai Absorbansi Penyinaran Jam ke-
TiO2 1 gram (cm2) 0 6 12 18 24 30 36 42 48
10,085 (1 stik) 0,18852 0,19632 0,17249 0,14570 0,14474 0,13081 0,11900 0,10530 0,10173
20,170 (2 stik) 0,18852 0,19300 0,16460 0,14875 0,13093 0,12821 0,11738 0,10467 0,10138
30,255 (3 stik) 0,18852 0,17661 0,15399 0,15267 0,12840 0,10365 0,09417 0,09177 0,08639
Tabel 4.3Data Hasil Pengujian Absorbansi Sampel dengan Konsentrasi TiO2Sintesis 1,5 gram
Luas Lapisan Rata-rata Nilai Absorbansi Penyinaran Jam ke-
TiO2 1,5 gram (cm2) 0 6 12 18 24 30 36 42 48
10,085 (1 stik) 0,18852 0,19299 0,18268 0,17499 0,15446 0,14724 0,13193 0,12931 0,11142
20,170 (2 stik) 0,18852 0,18902 0,17716 0,16438 0,15586 0,14804 0,13658 0,11458 0,10638
Tabel 4.4Data Hasil Pengujian Absorbansi Sampel dengan Konsentrasi TiO2Komersil 0,5 gram
Luas Lapisan Rata-rata Nilai Absorbansi Penjemuran Jam ke-
TiO2 0,5 gram (cm2) 0 6 12 18 24 30 36 42 48
10,085 (1 stik) 0,18852 0,19630 0,18720 0,18130 0,17440 0,14687 0,14631 0,13045 0,12171
20,170 (2 stik) 0,18852 0,19520 0,18260 0,17410 0,16710 0,14493 0,13266 0,12878 0,12090
30,255 (3 stik) 0,18852 0,18790 0,17710 0,15780 0,13920 0,11801 0,10063 0,09487 0,08759
Tabel 4.5Data Hasil Pengujian Absorbansi Sampel dengan Konsentrasi TiO2Komersil 1 gram
Luas Lapisan Rata-rata Nilai Absorbansi Penjemuran Jam ke-
TiO2 1 gram (cm2) 0 6 12 18 24 30 36 42 48
10,085 (1 stik) 0,18852 0,25946 0,23303 0,17554 0,15168 0,12443 0,12175 0,10771 0,10211
20,170 (2 stik) 0,18852 0,24597 0,21272 0,17540 0,14859 0,11058 0,13028 0,10060 0,09856
30,255 (3 stik) 0,18852 0,24140 0,18356 0,15577 0,14084 0,13526 0,11058 0,08880 0,08566
Tabel 4.6Data Hasil Pengujian Absorbansi Sampel dengan Konsentrasi TiO2Komersil 1,5 gram
Luas Lapisan Rata-rata Nilai Absorbansi Penjemuran Jam ke-
TiO2 1,5 gram (cm2) 0 6 12 18 24 30 36 42 48
10,085 (1 stik) 0,18852 0,28795 0,25813 0,23413 0,22192 0,20117 0,17798 0,16043 0,15678
20,170 (2 stik) 0,18852 0,27628 0,23886 0,24282 0,21798 0,18356 0,17237 0,16451 0,15600
Berikut merupakan representasinilai-nilai absorbansi sampel air pada setiap variasi luas lapisan TiO2 baik sintesis
maupun komersil dalam bentuk grafik.
Gambar 4.2Pengaruh waktu penjemuran terhadap nilai absorbansi untuk sampel TiO2sintesis 0,5 gr
Dari hasil pengujian absorbansi dapat diketahui untuk sampel dengan konsentrasi TiO2 sintesis 0,5 gram pada gambar
4.2 dapat dilihat bahwa semakin luas lapisan TiO2 yang
digunakan nilai absorbansinya semakin menurun walaupun penurunannya sangatlah kecil. Dapat dilihat juga semakin lama waktu penjemuran nilai absorbansi dari masing-masing luasan juga mengalami penurunan. Hal ini menunjukkan bahwa luas lapisan dan lama waktu penjemuran berpengaruh pada nilai absorbansi atau kejernihan sampel airnya. Semakin luas lapisan TiO2 yang digunakan dan semakin lama waktu penjemuran maka
nilai absorbansi semakin kecil atau menurun. Sama halnya dengan sampel dengan konsentrasi TiO2 sintesis 1 gram yaitu
pada gambar 4.3 dan sampel dengan konsentrasi TiO2 sintesis 1,5
gram yaitu pada gambar 4.4.
0 0,05 0,1 0,15 0,2 0,25 0 6 12 18 24 30 36 42 48 A bs orb an si
Waktu Penjemuran (jam)
10,085 cm2 20,17 cm2 30,255 cm2 1 stik 2 stik 3 stik
Pada sampel dengan konsentrasi TiO2 komersil 0,5 gram
berdasarkan gambar 4.5 dapat dilihat bahwa semakin luas lapisan TiO2 yang digunakan dan semakin lama waktu penjemuran
semakin menurun nilai absorbansi yang didapatkan. Untuk sampel dengan konsentrasi TiO2 komersil 1 gram pada gambar
4.6 dapat dilihat nilai absorbansi sampel dengan luasan 3 stik pada penjemuran 30 jam mengalami kenaikan, dan sampel dengan luasan 2 stik pada penjemuran 36 jam juga mengalami kenaikan. Akan tetapi pada penjemuran pada jam-jam selanjutnya nilai absorbansi kembali menurun seperti sebelumnya. Untuk sampel dengan konsentrasi TiO2 komersil 1,5 gram pada gambar
4.7 dapat dilihat bahwa semuanya mengalami penurunan nilai absorbansi. Pada umumnya terjadi penurunan nilai absorbansi pada setiap sampel berdasarkan luas lapisan TiO2 dan juga
berdasarkan lama waktu penjemuran walaupun dengan penurunan yang sangat kecil berkisar 0,01 sehingga menyebabkan tidak terjadinya perubahan atau degradasi warna yang signifikan pada sampel air. Hal ini diduga karena media perekat resin menyebabkan halangan yang cukup besar sehingga proses fotokatalisis yang terjadi kurang efektif.
Gambar 4.3Pengaruh waktu penjemuran terhadap nilai absorbansi untuk sampel TiO2 sintesis 1 gr
0 0,05 0,1 0,15 0,2 0,25 0 6 12 18 24 30 36 42 48 A bs orb an si
Waktu Penjemuran (jam)
10,085 cm2 20,17 cm2 30,255 cm2 1 stik 2 stik 3 stik
Gambar 4.4Pengaruh waktu penjemuran terhadap nilai absorbansi untuk sampel TiO2 sintesis 1,5 gr
Gambar 4.5Pengaruh waktu penjemuran terhadap nilai absorbansi untuk sampel TiO2komersil 0,5 gr
0 0,05 0,1 0,15 0,2 0,25 0 6 12 18 24 30 36 42 48 A bs orb an si
Waktu Penjemuran (jam)
10,085 cm2 20,17 cm2 30,255 cm2 0 0,05 0,1 0,15 0,2 0,25 0 6 12 18 24 30 36 42 48 A bs orb an si
Waktu Penjemuran (jam)
10,085 cm2 20,17 cm2 30,255 cm2 1 stik 2 stik 3 stik 1 stik 2 stik 3 stik
Gambar 4.6Pengaruh waktu penjemuran terhadap nilai absorbansi untuk sampel TiO2 komersil 1 gr
Gambar 4.7Pengaruh waktu penjemuran terhadap nilai absorbansi untuk sampel TiO2 komersil 1,5 gr
0 0,05 0,1 0,15 0,2 0,25 0 6 12 18 24 30 36 42 48 A bs orb an si
Waktu Penjemuran (jam)
10,085 cm2 20,17 cm2 30,255 cm2 0 0,05 0,1 0,15 0,2 0,25 0,3 0 6 12 18 24 30 36 42 48 A bs orb an si
Waktu Penjemuran (jam)
10,085 cm2 20,17 cm2 30,255 cm2 1 stik 2 stik 3 stik 1 stik 2 stik 3 stik
4.2 Uji Degradasi Warna Air
Dilakukan pengamatan degradasi warna atau perubahan warna yang terjadi pada sampel air berwarna setelah diberi perlakuan penyinaran. Data kualitatif ini berupa pengamatan dan pengambilan gambar air berwarna dengan menggunakan kamera setiap 6 jam penyinaran. Hasil pengujian degradasi warna air selengkapnya dapat dilihat pada Lampiran B.
Jam ke-6 Jam ke-12 Jam ke-18 Jam ke-24
Jam ke-30 Jam ke-36 Jam ke-42 Jam ke-48
Gambar 4.8Data hasil pengujian degradasi warna air pada sampel TiO2sintesis 0,5 gr dengan luasan 3 stik
(30,255 cm2)
Pada uji degradasi warna yang dilakukan dengan pengolahan gambar menggunakan software Image J didapatkan nilai derajat warna merah pada masing-masing gambar sampel air. Derajat warna merah tersebut menunjukkan kepekatan warna merah pada gambar. Data hasil pengolahan gambar dengan menggunakan
software Image J dinyatakan dalam Tabel 4.7, 4.8, 4.9 untuk sampel dengan stik yang dilapisi TiO2 sintesis. Adapun data dasil
pengolahan gambar dengan software Image J untuk sampel dengan stik yang dilapisi TiO2 komersial dapat dilihat pada Tabel
4.10 , 4.11, 4.12.
Tabel 4.7Data Nilai Derajat Warna Sampel dengan Konsentrasi TiO2Sintesis 0,5 gr
Luas Lapisan TiO2 0,5 gram
(cm2)
Nilai Derajat Warna Merah Sampel Air Penjemuran Jam ke- 0 6 12 18 24 30 36 42 48 10,085 (1 stik) 214 248 231 221 220 213 212 211 211 20,170 (2 stik) 214 230 229 221 219 213 212 206 204 30,255 (3 stik) 214 227 224 220 216 211 210 197 192
Tabel 4.8 Data Nilai Derajat Warna Sampel dengan Konsentrasi TiO2Sintesis 1 gr
Luas Lapisan TiO21 gram (cm 2
)
Nilai Derajat Warna Merah Sampel Air Penjemuran Jam ke- 0 6 12 18 24 30 36 42 48 10,085 (1 stik) 214 237 218 214 213 213 209 208 208 20,170 (2 stik) 214 234 220 213 211 210 209 207 205 30,255 (3 stik) 214 222 215 214 212 209 207 204 203
Tabel 4.9Data Nilai Derajat Warna Sampel dengan Konsentrasi TiO2Sintesis 1,5 gr
Luas Lapisan TiO21,5 gram (cm2)
Nilai Derajat Warna Merah Sampel Air Penjemuran Jam ke- 0 6 12 18 24 30 36 42 48 10,085 (1 stik) 214 228 226 223 223 219 212 212 205 20,170 (2 stik) 214 225 217 217 216 212 210 204 204 30,255 (3 stik) 214 223 216 215 212 210 205 204 203
Tabel 4.10Data Nilai Derajat Warna Sampel dengan Konsentrasi TiO2Komersial 0,5 gr
Luas Lapisan TiO20,5 gram (cm2)
Nilai Derajat Warna Merah Sampel Air Penjemuran Jam ke- 0 6 12 18 24 30 36 42 48 10,085 (1 stik) 214 233 230 229 219 218 216 215 214 20,170 (2 stik) 214 233 227 219 219 217 215 214 212 30,255 (3 stik) 214 226 222 218 217 215 210 206 200
Tabel 4.11Data Nilai Derajat Warna Sampel dengan Konsentrasi TiO2Komersial 1 gr
Luas Lapisan TiO21 gram (cm2)
Nilai Derajat Warna Merah Sampel Air Penjemuran Jam ke- 0 6 12 18 24 30 36 42 48 10,085 (1 stik) 214 229 226 220 219 218 217 216 214 20,170 (2 stik) 214 228 223 219 218 217 217 215 210 30,255 (3 stik) 214 225 220 221 216 214 211 210 208
Tabel 4.12Data Nilai Derajat Warna Sampel dengan Konsentrasi TiO2Komersial 1,5 gr
Luas Lapisan TiO21,5 gram (cm
2 )
Nilai Derajat Warna Merah Sampel Air Penjemuran Jam ke- 0 6 12 18 24 30 36 42 48 10,085 (1 stik) 214 239 239 234 224 220 218 216 213 20,170 (2 stik) 214 239 234 225 225 221 219 216 212 30,255 (3 stik) 214 229 224 222 221 221 218 212 210
Gambar 4.9Pengaruh waktu penjemuran terhadap nilai derajat warna merah untuk sampel TiO2 sintesis 0,5 gr
Dari hasil pengolahan gambar samper air berwarna dengan menggunakan software Image J didapatkan nilai derajat warna merah yang menunjukkan kepekatan warna pada gambar masing-masing sampel air berwarna. Pada gambar 4.8 yaitu sampel air dengan konsentrasi TiO2 sintesis 0,5 gram dapat dilihat bahwa
semakin lama waktu penjemuran nilai derajat warna pada gambar sampel semakin kecil. Hal ini menunjukkan adanya perubahan warna pada sampel air walaupun tidak dapat teramati secara langsung dikarenakan penurunan nilai derajat warna masing-masing gambar sampel air sangat kecil. Sama halnya dengan sampel dengan konsentrasi TiO2 sintesis 1 gram dan sampel
dengan konsentrasi TiO2 sintesis 1,5 gram. Pada sampel dengan
konsentrasi TiO2 komersial padaumumnyajuga menunjukkan
nilai derajat warna merah yang semakin menurun walaupun jika dilihat data pada Tabel 4.10, 4.11, 4.12 terdapat beberapa nilai yang naik atau tetap seperti pada sampel dengan konsentrasi TiO2
komersil 1,5 gram yaitu pada penyinaran jam ke 24, 30, 36 dan 42. Pada umumnya terjadi penurunan nilai derajat warna merah pada setiap gambar sampel air berwarna berdasarkan tren yang
150 170 190 210 230 250 0 6 12 18 24 30 36 42 48 D er aj at W ar na M er ah
Waktu Penyinaran (jam)
10,085 cm2 20,17 cm2 30,255 cm2 1 stik 2 stik 3 stik
terbentuk pada grafik-grafik sebagaimanaterlampirpadaLampiran D.
37 BAB V KESIMPULAN
Berdasarkanhasilpengujiandanpembahasan yang telahdilakukan, denganmedia perekat resin dalam aplikasi TiO2sebagai fotokatalis dalam penjernihan air dapat disimpulkan:
• Semakin luas lapisan TiO2yang digunakan semakin baik
kemampuannya dalam menjernihkan air.
• Penurunan nilai absorbansi pada masing-masing sampel pada setiap luasan dari penjemuran 6-48 jam sangat kecil yaitu berkisar 0,01 atau 6,9 %.
• Penurunan nilai absorbansi terbesar yaitu sampel dengan konsentrasi 0,5 sintesis pada luasan 30 cm2yaitu sebesar 62,8 %.
39
DAFTAR PUSTAKA
Agus Ariyanto. “Pengaruh Konsentrasi TiO2 pada Aplikasi
Fotokatalisis dalam Penjernihan Air”. 2011. Institut Teknologi Sepuluh Nopember.
Asthy Farida. “Aplikasi Fotokatalis TiO2-Serat Kain Untuk
Meningkatkan Kualitas Air”. 2012. Institut Teknologi Sepuluh Nopember.
Gunlazuardi J dan Tjahjanto R.T. “Preparasi Lapisan Tipis TiO2
sebagai Fotokatalisis: Keterkaitan antara ketebalan dan Aktivitas Fotokatalisis. 2001. Jurnal Penelitian Universitas Indonesia, Volume 5, 81-91.
Lestari, D., Sunarto W., Susatyo, Eko B. “Preparasi Nano Komposit ZnO/ TiO2 dengan Sonokimia serta Uji
Aktivitasnya untuk Fotodegradasi Fenol”. 2012. Indonesian Journal of Chemical Science.
Afrozi, A S. “Sintesis dan Karakterisasi Katalis Nano Komposit Berbasis Titania untuk Produksi Hidrogen dari Gliserol dan Air”.2010. Tesis. Jurusan Teknik Kimia Fakultas Teknik, Universitas Indonesia.
Fujishima, A., Rao, T.N., Tryk, D.A. “Titanium Doixide Photocatalysi”. 2000. Journal of Photochemistry and Photobiology C: Photochemistry Review I:1-21.
Arsyad S. F, Agustina E. T, Yulianti. N, Firmansyah, Anggreini. D, Susanti. R, Abdullah. M. (2012). Pengaruh Nanopartikel Titanium Dioksida (TiO2) Yang Disintesis
Menggunakan Metoda Simple Heating Terhadap Kandungan Besi (Fe) Dan Tembaga (Cu) Di Dalam Air Rawa. Prosiding Seminar Nasional Pendidikan 2012, Palembang 26 Juni 2012.
M. M. Hasan, et al. 2008. Effects of Annealing Treatment on Optical Properties of Anatase TiO2 Thin Films.International Journal of Chemical and Biological Engineering 1:2 2008.
Sari L. 2012. Pengaruh Nanopartikel Titanium Dioksida Pada Resin Sebagai Material Transparan Anti UV dan Self
Cleaning Material. Skripsi. Jurusan Fisika. Fakultas Matematika dan Ilmu Pengetahuan Alam. Universitas Andalas Padang.
Slamet, C.H.D. Alwi, J. Viriya. 2010. Rekayasa Plastik Berlapis Nanokristal TiO2Untuk Aplikasi Anti Kabut Dan
A-1
Hasil XRD TIO2 Fasa Anatase
- Sintesis 1
Sintesis 1 Hasil uji XRD fasa anatase dengan ukuran kristal 20 nm
Sintesis 2 Hasil uji XRD fasa anatase dengan ukuran kristal 17,2 nm
Position [°2Theta] (Copper (Cu))
20 30 40 50 60 Counts 0 50 100 150 TiO2
Position [°2Theta] (Copper (Cu))
20 30 40 50 60 Counts 0 20 40 60 80 2
A-2
Sintesis 3 Hasil uji XRD fasa anatase dengan ukuran kristal 10,9 nm
Sintesis 4 Hasil uji XRD fasa anatase dengan ukuran kristal 40 nm
Position [°2Theta] (Copper (Cu))
20 30 40 50 60
0 50 100
Position [°2Theta] (Copper (Cu))
20 30 40 50 60
Counts
0 20 40 4
A-3
Sintesis 5 Hasil uji XRD fasa anatase dengan ukuran kristal 12 nm
Sintesis 6 Hasil uji XRD fasa anatase dengan ukuran kristal 13 nm
Position [°2Theta] (Copper (Cu))
20 30 40 50 60
0 100 200
Position [°2Theta] (Copper (Cu))
20 30 40 50 60 Counts 0 100 200 300 6
B-1
Hasil Uji Degradasi Warna Hari 1 s/d 8 - Hari 1 (jam ke-6)
TiO2 0,5 gr
Luas Lapisan TiO2
Luas 1 Luas 2 Luas 3
Sintesis
Komersil
TiO2 1 gr
Luas Lapisan TiO2
Luas 1 Luas 2 Luas 3
B-2
TiO21,5 gr
Luas Lapisan TiO2
Luas 1 Luas 2 Luas 3
Sintesis
B-3
TiO20,5 gr
Luas Lapisan TiO2
Luas 1 Luas 2 Luas 3
Sintesis
Komersil
TiO2 1 gr
Luas Lapisan TiO2
Luas 1 Luas 2 Luas 3
B-4
TiO21,5 gr
Luas Lapisan TiO2
Luas 1 Luas 2 Luas 3
Sintesis
B-5
TiO20,5 gr
Luas Lapisan TiO2
Luas 1 Luas 2 Luas 3
Sintesis
Komersil
TiO2 1 gr
Luas Lapisan TiO2
Luas 1 Luas 2 Luas 3
B-6
TiO21,5 gr
Luas Lapisan TiO2
Luas 1 Luas 2 Luas 3
Sintesis
B-7
TiO20,5 gr
Luas Lapisan TiO2
Luas 1 Luas 2 Luas 3
Sintesis
Komersil
TiO2 1 gr
Luas Lapisan TiO2
Luas 1 Luas 2 Luas 3
B-8
TiO21,5 gr
Luas Lapisan TiO2
Luas 1 Luas 2 Luas 3
Sintesis
B-9
TiO20,5 gr
Luas Lapisan TiO2
Luas 1 Luas 2 Luas 3
Sintesis
Komersil
TiO2 1 gr
Luas Lapisan TiO2
Luas 1 Luas 2 Luas 3
B-10
TiO21,5 gr
Luas Lapisan TiO2
Luas 1 Luas 2 Luas 3
Sintesis
B-11
TiO20,5 gr
Luas Lapisan TiO2
Luas 1 Luas 2 Luas 3
Sintesis
Komersil
TiO2 1 gr
Luas Lapisan TiO2
Luas 1 Luas 2 Luas 3
B-12
TiO21,5 gr
Luas Lapisan TiO2
Luas 1 Luas 2 Luas 3
Sintesis
B-13
TiO20,5 gr
Luas Lapisan TiO2
Luas 1 Luas 2 Luas 3
Sintesis
Komersil
TiO2 1 gr
Luas Lapisan TiO2
Luas 1 Luas 2 Luas 3
B-14
TiO21,5 gr
Luas Lapisan TiO2
Luas 1 Luas 2 Luas 3
Sintesis
B-15
TiO20,5 gr
Luas Lapisan TiO2
Luas 1 Luas 2 Luas 3
Sintesis
Komersil
TiO2 1 gr
Luas Lapisan TiO2
Luas 1 Luas 2 Luas 3
B-16
TiO21,5 gr
Luas Lapisan TiO2
Luas 1 Luas 2 Luas 3
Sintesis
C-1
Hasil Uji Absorbansi dengan Alat Spektrofotometer - Sampel dengan luasan 1 stik (10,085 cm2)
Sampel Nilai Absorbansi Jam ke-
6 12 18 24 30 36 42 48 TiO2 Sintesis 0,5 gr 0,46 0,494 0,541 0,609 0,732 0,778 0,97 1,21 1 gr 0,438 0,494 0,541 0,609 0,732 0,778 0,97 1,21 1,5 gr 0,438 0,455 0,458 0,496 0,681 0,732 0,923 1,013 TiO2 Komersial 0,5 gr 0,425 0,454 0,458 0,496 0,68 0,732 0,92 1,013 1 gr 0,437 0,455 0,484 0,538 0,619 0,705 0,786 0,951 1,5 gr 0,462 0,455 0,484 0,538 0,619 0,705 0,786 0,95
- Sampel dengan luasan 2 stik (20,170 cm2)
Sampel Nilai Absorbansi Jam ke-
6 12 18 24 30 36 42 48 TiO2 Sintesis 0,5 gr 0,446 0,423 0,417 0,469 0,618 0,653 0,794 0,852 1 gr 0,452 0,423 0,417 0,469 0,618 0,653 0,794 0,852 1,5 gr 0,446 0,457 0,445 0,448 0,651 0,669 0,782 1,002 TiO2 Komersial 0,5 gr 0,41 0,457 0,445 0,448 0,651 0,669 0,782 1,002 1 gr 0,448 0,437 0,469 0,508 0,692 0,824 0,922 1,205 1,5 gr 0,471 0,437 0,469 0,519 0,772 0,824 0,922 1,205
- Sampel dengan luasan 3 stik (30,255 cm2)
Sampel Nilai Absorbansi Jam ke-
6 12 18 24 30 36 42 48 TiO2 Sintesis 0,5 gr 0,448 0,455 0,521 0,618 0,674 0,728 0,805 0,998 1 gr 0,380 0,455 0,492 0,618 0,674 0,728 0,805 0,997 1,5 gr 0,442 0,449 0,445 0,486 0,629 0,673 0,794 0,954 TiO2 Komersial 0,5 gr 0,432 0,449 0,445 0,486 0,629 0,673 0,794 0,954 1 gr 0,430 0,45 0,462 0,513 0,669 0,739 0,97 1,127 1,5 gr 0,459 0,451 0,462 0,513 0,669 0,779 0,969 1,126
D-1
Software Image J
GrafikHasil Uji Degradasi Warna denganMengunakan Software Image J
Gambar 1 Pengaruh waktu penjemuran terhadap nilai derajat warna merah untuk sampel TiO2 sintesis 0,5 gr
150 170 190 210 230 250 0 6 12 18 24 30 36 42 48 D er aj at W ar na M er ah
Waktu Penyinaran (jam)
10,085 cm2 20,17 cm2 30,255 cm2 1 stik 2 stik 3 stik
D-2
Gambar 2 Pengaruh waktu penjemuran terhadap nilai derajat warna merah untuk sampel TiO2 sintesis 1 gr
Gambar 3 Pengaruh waktu penjemuran terhadap nilai derajat warna merah untuk sampel TiO2 sintesis 1,5 gr
150 170 190 210 230 0 6 12 18 24 30 36 42 48 D er aj at W ar na M er ah
Waktu Penyinaran (jam)
20,17 cm2 30,255 cm2 150 170 190 210 230 250 0 6 12 18 24 30 36 42 48 D er aj at W ar na M er ah
Waktu Penyinaran (jam)
10,085 cm2 20,17 cm2 30,255 cm2 2 stik 3 stik 1 stik 2 stik 3 stik
D-3
Gambar 4 Pengaruh waktu penjemuran terhadap nilai derajat warna merah untuk sampel TiO2 komersial 0,5 gr
Gambar 5 Pengaruh waktu penjemuran terhadap nilai derajat warna merah untuk sampel TiO2 komersial 1 gr
150 170 190 210 230 0 6 12 18 24 30 36 42 48 D er aj at W ar na M er ah
Waktu Penyinaran (jam)
20,17 cm2 30,255 cm2 150 170 190 210 230 250 0 6 12 18 24 30 36 42 48 D er aj at W ar na M er ah
Waktu Penyinaran (jam)
10,085 cm2 20,17 cm2 30,255 cm2 2 stik 3 stik 1 stik 2 stik 3 stik
D-4
Gambar 6 Pengaruh waktu penjemuran terhadap nilai derajat warna merah untuk sampel TiO2 komersial 1,5 gr
150 170 190 210 230 0 6 12 18 24 30 36 42 48 D er aj at W ar na M er ah
Waktu Penjemuran (jam)
cm2 20,17 cm2 2 stik 3 stik
Penulis mempunyai nama lengkap Aning Malikah Alfaizah, lahir di Kabupaten Nganjuk pada tanggal 26 Mei 1994 dan merupakan anak sulung dari 2 bersaudara. Penulis berasal dari Ngetos kabupaten Nganjuk dengan menempuh pendidikan di SDN Kuncir I, MTsN Berbek, kemudian MAN 3 Kediri. Penulis melanjutkan studi sebagai mahasiswa Jurusan Teknik Fisika FTI – ITS di Surabaya. Penulis menyusun laporan tugas akhir penelitian yang telah dilakukan sebagai syarat kelulusan studi S-1 di Jurusan Teknik Fisika FTI – ITS dengan judul “APLIKASI TiO2 SEBAGAI FOTOKATALIS DALAM PENJERNIHAN AIR DENGAN MEDIA PEREKAT RESIN”.Bagi pembaca yang ingin memberikan kritik maupun saran mengenai penelitian yang telah penulis lakukan dapat disampaikan kepada penulis melalui email penulis faza.alfaizah@gmail.com.