1 BAB I PENDAHULUAN
A. Latar belakang masalah
Indonesia sebagai negara tropis memiliki beraneka ragam tumbuhan yang dapat dimanfaatkan sebanyak-banyaknya untuk kepentingan manusia. Masyarakat Indonesia sejak zaman dahulu telah mengenal tanaman yang mempunyai khasiat obat atau menyembuhkan berbagai macam penyakit. Tanaman yang berkhasiat obat tersebut dikenal dengan sebutan tanaman obat tradisional.
Sarang semut (Myrmecodia tuberosa (Jack) Bl.), yang salah satu penyebarannya terdapat di Papua, telah banyak digunakan oleh masyarakat untuk mengobati berbagai macam penyakit. Sarang semut adalah tanaman epifit berbentuk bulat. Tanaman ini berupa umbi yang tumbuh menempel pada pohon lain. Subroto dan Saputro (2006) menyatakan bahwa kandungan zat berkhasiat dari tumbuhan sarang semut sebagai bahan obat tergantung pada tempat tumbuh dan usia tumbuhan. Tumbuhan sarang semut yang tumbuh liar di hutan mengandung lebih banyak zat aktif daripada yang ditanam di pot sebagai tanaman hias.
Telah dilakukan penelitian terhadap sarang semut (Myrmecodia pendens) dan hasilnya menyatakan bahwa sarang semut mengandung senyawa aktif penting, yakni flavonoid, tanin, dan polifenol. Tumbuhan sarang semut mengandung flavonoid yang berguna sebagai antioksidan sehingga baik untuk mencegah dan membantu mengobati kanker, melindungi struktur sel, meningkatkan efektivitas vitamin C, antiinflamasi, dan antibiotik. Selain itu juga
ditemukan kandungan bermanfaat yang lain seperti tokoferol, magnesium, kalsium, besi, fosfor, natrium, dan seng. Kandungan berbagai macam mineral pada tumbuhan sarang semut memiliki kegunaan antara lain membantu mengatasi gangguan jantung, melancarkan haid dan mengobati keputihan, melancarkan peredaran darah, mengobati migrain, gangguan fungsi ginjal dan prostat, memulihkan kesegaran dan stamina tubuh, serta memulihkan gairah seksual (Subroto dan Saputro, 2006).
Tumbuhan sarang semut jenis M. tuberosa dilaporkan mengandung senyawa terpenoid dan fenolik (Hertiani dkk., 2010). Komponen senyawa fenol biasanya bersifat polar dan berfungsi sebagai penangkap radikal bebas (Kumalaningsih, 2006). Ekstrak etanolik terpurifikasi umbi sarang semut (M. tuberosa) juga memiliki efek imunostimulator yang poten, baik secara in vitro maupun in vivo (Sumardi, 2011) sehingga dapat dikembangkan sebagai sediaan fitofarmaka.
Luasnya penggunaan umbi sarang semut dalam pengobatan penyakit kronis seperti kanker (Subroto dan Saputro, 2006) mendorong perlu dilakukannya uji untuk mengetahui batas keamanannya. Sebagian besar tanaman memproduksi senyawa toksik dengan tujuan perlindungan diri. Senyawa toksik yang secara alami diproduksi oleh tanaman dapat menyebabkan pengguna tanaman tersebut keracunan. Konsep ‘natural is safe’ yang selama ini terdapat dalam masyarakat dalam banyak kasus sangat jauh dari kebenaran dan beberapa zat yang paling beracun bagi manusia berasal dari alam (Timbrell, 2002). Pemberian secara berulang mungkin saja dapat menimbulkan efek toksik pada organ tubuh.
Soeksmanto, dkk (2010) telah melakukan penelitian mengenai uji toksisitas akut ekstrak air tanaman sarang semut (M. pendans), tumbuhan sarang semut yang memiliki genus sama tetapi spesies berbeda dengan tumbuhan sarang semut yang akan diteliti dalam penelitian ini. Tinjauan dilakukan terhadap histologi organ hati mencit. Hasil penelitian menunjukkan bahwa pada dosis 3750 mg/kg BB menyebabkan terjadinya nekrosis pada jaringan hati dan ginjal. Meskipun demikian, tidak terjadi kematian yang disebabkan oleh pemberian dosis selama penelitian berlangsung.
Uji yang dilakukan dalam penelitian ini adalah uji toksisitas pemberian berulang fraksi tidak larut n-heksan ekstrak etanolik umbi sarang semut (M. tuberosa) terhadap tikus betina Wistar yang bertujuan untuk mengetahui pengaruh pemberian fraksi tidak larut n-heksan ekstrak etanolik umbi sarang semut ini selama 28 hari secara terus menerus. Uji ini merupakan modifikasi dari uji toksisitas subkronik selama 28 hari (OECD 407).
Uji toksisitas dilakukan pada fraksi tidak larut n-heksan karena sesuai dengan hasil penelitian Sumardi (2011), fraksi tidak larut n-heksan adalah fraksi aktif yang pada dosis 20 µg/ml memiliki kemampuan yang paling tinggi dalam meningkatkan fagositosis sel makrofag dibanding dengan ekstrak atau fraksi lainnya. Aktivitas yang tinggi fraksi tidak larut n-heksan terhadap fagositosis tersebut dapat dikaitkan dengan tingginya kandungan fenolik total dan tidak mengandung senyawa non polar yang diduga berperan dalam menghambat aktivitas fagositosis sel makrofag.
Efek toksik diamati melalui pengamatan terhadap profil mikroskopis jaringan hepar dari hewan uji yang telah dipejani fraksi tidak larut n-heksan ekstrak etanolik umbi sarang semut selama 28 hari. Selain itu juga dilakukan pengukuran aktivitas ALT (alanine transaminase) atau SGPT (serum glutamic-pyruvic transaminase) dan AST (aspartate transaminase) atau SGOT (serum glutamic-oxaloacetic transaminase), dimana serum aminotransferase ini adalah penanda yang sensitif terhadap adanya kerusakan hati (Gines dkk., 2011).
Diharapkan dengan dilakukannya penelitian mengenai efek toksik fraksi tidak larut n-heksan ekstrak etanolik umbi sarang semut terhadap aktivitas SGPT, SGOT, dan gambaran histopatologi hepar, selain dapat menambah pengetahuan tentang gambaran toksisitas obat tradisional, masyarakat juga mempunyai dasar ilmiah yang jelas tentang penggunaan umbi sarang semut.
B.Rumusan masalah
1. Bagaimanakah pengaruh pemberian berulang fraksi tidak larut n-heksan ekstrak etanolik umbi sarang semut (M. tuberosa) selama 28 hari terhadap wujud efek toksik dan histopatologis hepar tikus betina galur Wistar?
2. Bagaimanakah pengaruh pemberian fraksi tidak larut n-heksan ekstrak etanolik umbi sarang semut (M. tuberosa) terhadap perubahan aktivitas SGPT dan SGOT?
3. Bagaimanakah pengaruh dosis terhadap wujud efek toksis yang ditimbulkan dari pemberian berulang fraksi tidak larut n-heksan ekstrak etanolik umbi sarang semut (M. tuberosa) ditinjau dari parameter histopatologis hati serta aktivitas SGPT dan SGOT?
C.Tujuan Penelitian A. Tujuan Umum
Penelitian ini bertujuan untuk mengevaluasi ketoksikan berulang selama 28 hari fraksi tidak larut n-heksan ekstrak etanolik umbi sarang semut (M. tuberosa) pada tikus betina galur Wistar.
B. Tujuan Khusus
a. Mengetahui pengaruh pemberian fraksi tidak larut n-heksan ekstrak etanolik umbi sarang semut (M. tuberosa) selama 28 hari terhadap aktivitas SGPT dan SGOT pada tikus betina galur Wistar.
b. Mengetahui pengaruh pemberian fraksi tidak larut n-heksan umbi sarang semut (M. tuberosa) selama 28 hari terhadap histopatologis hepar tikus betina galur Wistar.
D.Tinjauan Pustaka 1. Tumbuhan Sarang Semut
a. Uraian Tumbuhan Kingdom : Plantae Divisi : Magnoliophyta Kelas : Magnoliatae Ordo : Rubiales Famili : Rubiaceae Genus : Myrmecodia
Spesies : Myrmecodia tuberosa (Jack) Bl. (Anonim, 2013a)
Gambar 1. Sarang Semut (Myrmecodia tuberosa (Jack) Bl.) (Lok dan Tan, 2009). Sarang Semut (M. tuberosa) (Gambar.1) dapat ditemukan di Malaysia, kepulauan Indonesia, Filipina, Papua, Pulau Slomon, dan di Cape York Peninsula Australia (Huxley dan Jebb, 1993). Di Pulau Papua, tanaman ini dapat ditemukan di puncak gunung Jayawijaya, Tolikara, Puncak Jaya, Gunung Bintang, dan Paniai (Subroto dan Saputro, 2006).
Secara turun-temurun tumbuhan sarang semut telah digunakan secara tradisional sebagai obat oleh masyarakat pedalaman bagian barat Wamena, Papua, Sumatera, Ambon, Sumatera Barat, Sulawesi Utara, dan Kalimantan (Whitten, 1981).
Sarang semut merupakan salah satu tumbuhan epifit dari Hydnophytinae (Rubiaceae) yang dapat berasosiasi dengan semut. Tumbuhan ini bersifat epifit, artinya tumbuhan yang menempel pada tumbuhan lain, tetapi tidak hidup secara parasit pada inangnya, hanya sebagai tempat menempel. Contoh tanaman epifit lain yang lazim dijumpai hidup di pohon adalah lumut kerak, lumut, alga, tumbuhan perambat, dan anggrek (Subroto dan Saputro, 2006).
Tanaman sarang semut biasanya hidup epifit pada pohon kayu putih (Melaleuca), cemara gunung (Casuarina), kaha (Castanopsis), dan Nothofagus. Di habitat liarnya, tumbuhan sarang semut dihuni oleh beragam jenis semut.
Namun, dapat ditemukan pula satu tumbuhan sarang semut yang hanya dihuni oleh satu jenis semut (Subroto dan Saputro, 2006).
b. Morfologi dan Habitat
Menurut Huxley & Jebb (1993), M. tuberosa merupakan semak yang bersifat epifit, umbinya terdapat duri yang tersebar sepanjang 10-20 cm pada daerah linear. Umbinya memiliki semacam terowongan dan penuh dengan lubang-lubang yang berfungsi sebagai jalan masuknya semut ke dalam umbi dan sebagai saluran ventilasi udara dalam rongga-rongga tersebut. Tanaman ini biasanya tidak bercabang, tetapi terkadang ditemukan tanaman yang mengandung dua atau lebih cabang. Lembar daun keras dengan panjang 7-25 cm dan lebar 4-11 cm tergantung pada intensitas cahaya yang diterima dan memiliki 10-15 tulang daun lateral. Peneliti menemukan fakta bahwa tanaman yang tumbuh dengan intensitas cahaya sedikit tumbuh lebih baik dengan lembar daun yang lebih tipis dan lebar dibandingkan dengan tanaman yang tumbuh dengan intensitas cahaya penuh yang memiliki lembar daun lebih kecil dan keras. Bunga tumbuh menyendiri atau beberapa kelompok dan menempel pada batang. Buahnya berwarna oranye cerah, berdaging, dan berbiji 3-8 buah.
c. Sinonim
Sarang semut di Wamena, Papua disebut lokon, di lembah Baliem disebut nongon, di Vietnam disebut by kin am atau nam gi, sedangkan suku Yali menyebutnya sahendap (Mangan, 2009).
d. Kandungan Kimia
e. Efek Biologis
Meningkatkan daya tahan tubuh, memberikan energi, menghentikan nyeri, mengatasi rematik, melancarkan pembuluh darah, menghambat enzim oksidase sehingga mencegah radikal bebas dan menghambat kerja enzim dismutase, glutation, dan reduktase. Sarang semut juga mampu mengobati penyakit kanker otak, kanker hidung, kanker payudara, kanker paru-paru, kanker usus, kanker rahim, kanker kulit, kanker prostat, serta kanker darah (leukemia) (Mangan, 2009).
2. Ekstraksi
Ekstraksi adalah kegiatan penarikan kandungan kimia yang dapat larut terpisah dari bahan yang tidak dapat larut dengan pelarut cair. Simplisia yang diekstrak mengandung senyawa aktif yang dapat larut dan senyawa yang tidak dapat larut seperti serat, karbohidrat, protein dan lain-lain (Anonim, 2000). Beberapa metode ekstraksi bahan alam menggunakan solven antara lain adalah maserasi, perkolasi, Soxhletasi, dan destilasi uap (Sarker dkk., 2006).
Maserasi adalah proses pengekstraksian simplisia dengan menggunakan pelarut dengan beberapa kali pengadukan pada temperatur kamar (Anonim, 2000). Metode ini simpel tetapi tetap digunakan secara luas, prosedur dilakukan dengan merendam serbuk simplisia tanaman di dalam solven yang sesuai di dalam bejana tertutup pada suhu ruangan. Pengadukan sesekali atau konstan (menggunakan pengaduk mekanik atau mikser untuk menjamin pencampuran homogen) dapat menaikkan kecepatan ekstraksi. Ekstraksi akan berhenti saat mencapai
kesetimbangan konsentrasi antara zat aktif di dalam ekstrak dan yang terdapat di dalam simplisia. Setelah ekstraksi, ampas dipisahkan dari solven. Sentrifugasi mungkin diperlukan jika serbuk terlalu halus untuk difiltrasi. Solven dapat ditambahkan kembali ke dalam ampas untuk mengekstraksi zat aktif yang mungkin masih terdapat di dalam ampas.
Kelemahan metode maserasi adalah prosesnya lama, memerlukan waktu beberapa jam sampai beberapa minggu (Takahashi dkk., 2001). Maserasi juga membutuhkan solven dalam jumlah yang besar. Selain itu, beberapa komponen kemungkinan tidak dapat terekstraksi secara efisien jika komponen tersebut sukar larut pada suhu kamar. Sedangkan di sisi lain, jika ekstraksi dilakukan pada suhu kamar, akan semakin kecil kemungkinan terdegradasinya zat aktif yang bersifat termolabil (Sarker dkk., 2006).
3. Toksikologi
Toksikologi adalah ilmu mengenai racun (Duffus & Worth, 2006). Menurut Paracelsus (1493-1541), semua senyawa dapat bertindak sebagai racun. Takaran (dosis) yang tepatlah yang membedakan antara racun dan obat (Doull & Bruce, 1986; Gallo, 1996). Karena itu definisi toksikologi kemudian berkembang menjadi ilmu yang mempelajari pengaruh kuantitatif zat kimia atas sistem biologi, yang pusat perhatiannya terletak pada aksi berbahaya zat kimia tersebut (Donatus, 2001).
Pada dasarnya, ruang lingkup toksikologi dapat dipisahkan menjadi tiga kajian pokok, yakni toksikologi lingkungan, toksikologi ekonomi, dan toksikologi
kehakiman (forensik) (Donatus, 2001). Toksikologi lingkungan merupakan cabang toksikologi yang menguraikan pemejanan (exposure) yang tak disengaja jaringan biologi (lebih khusus hidup manusia) dengan zat kimia yang pada dasarnya merupakan pencemar lingkungan, makanan, atau air. Toksikologi ekonomi merupakan cabang toksikologi yang menguraikan pengaruh berbahaya zat kimia, yang dengan sengaja dipejankan pada jaringan biologi, dengan maksud untuk mencapai pengaruh atau efek khas (misal obat, zat tambahan makanan, pestisida). Dan toksikologi kehakiman merupakan cabang toksikologi yang mengkaji aspek medis dan aspek hukum atas pengaruh berbahaya zat kimia pada manusia (Loomis, 1978; Gallo, 1996; Polkis, 1996).
Berdasarkan prinsip dasar toksikologi, efek toksik terhadap manusia dapat dibagi menjadi dua macam. Yang pertama yaitu efek toksik yang secara umum bersifat irreversible, meliputi mutagenisitas, karsinogenisitas, teratogenisitas, dan kematian. Yang kedua yaitu efek toksik yang secara umum bersifat reversible, dimana kerusakan awal yang diakibatkan tidak terlalu besar. Efek-efek yang timbul adalah kerusakan organ, seperti kerusakan hati, ginjal, atau kulit, dan kerusakan fungsional, seperti depresi pernafasan, kehilangan kesadaran, atau gemetar (Loomis, 1996).
4. Uji Toksisitas
Secara umum metode uji toksisitas dapat dibagi menjadi dua macam. Pertama, uji yang didesain untuk mengevaluasi efek dari suatu senyawa uji terhadap hewan uji, seperti uji toksisitas akut, subkronis, dan kronis. Uji toksisitas
akut dirancang untuk mengetahui efek yang timbul setelah pemejanan dalam waktu singkat. Uji toksisitas subkronik dirancang untuk mengetahui efek yang timbul setelah pemejanan dalam waktu yang panjang, biasanya selama 28 atau 90 hari. Uji toksisitas kronik dirancang untuk mengetahui efek yang timbul setelah pemejanan dalam waktu sedikitnya 12 bulan sampai 2 tahun pada hewan rodent dan 6-12 bulan pada hewan non-rodent. Kedua, uji yang didesain untuk mengevaluasi jenis toksisitas spesifik secara terperinci, seperti uji teratogenik, uji karsinogenik, uji mutagenik, dan lain-lain. Uji toksisitas subkronik dan kronik tidak mendeteksi keseluruhan bentuk toksisitas yang terjadi tetapi dapat memperlihatkan beberapa toksisitas spesifik dan masih memerlukan penelitian lebih lanjut (Loomis, 1996).
Menurut Timbrell (2002), toksisitas dari suatu senyawa dapat diketahui melalui 3 cara, yaitu :
a. Dengan meneliti populasi manusia atau hewan atau tumbuhan yang terekspos senyawa kimia (epidemiologi)
b. Dengan memberikan senyawa kimia ke hewan atau tumbuhan dengan mengontrol kondisi dan meneliti efek yang terjadi (in vivo)
c. Dengan memberikan senyawa kimia ke sel, fraksi subseluler atau organisme bersel satu (in vitro).
5. Uji Toksisitas Subkronik
Uji toksisitas subkronik dirancang untuk mengetahui efek toksik senyawa yang timbul setelah pemejanan berulang secara oral dalam waktu yang panjang,
biasanya selama 28 atau 90 hari (Timbrell, 2002). Uji ini memberikan informasi mengenai bahaya kesehatan yang mungkin timbul akibat pemejanan secara berulang selama waktu tertentu.
Prinsip uji ini adalah hewan uji dipejani dengan senyawa uji secara oral setiap hari selama 28 hari dengan dosis yang bertingkat untuk setiap kelompok hewan uji. Selama masa pemejanan, hewan uji diamati untuk melihat ada atau tidaknya efek toksik yang timbul. Hewan uji yang mati selama masa pemejanan senyawa uji harus segera diautopsi. Dan pada akhir masa pemejanan senyawa uji, semua hewan yang masih hidup juga dikorbankan, diautopsi, dilakukan pengamatan makropatologi, penimbangan organ-organ tertentu, dan pemeriksaan histopatologis pada setiap organ dan jaringan.
Jumlah hewan uji yang digunakan dalam uji ini sedikitnya berjumlah 10 ekor (lima betina dan lima jantan) untuk setiap kelompok dosis. Umumnya, digunakan sedikitnya tiga kelompok uji dan kelompok kontrol. Hewan uji dipejani dengan senyawa uji setiap hari selama 28 hari. Volume maksimal larutan senyawa uji yang dapat dipejani tergantung pada berat badan hewan uji. Volume tidak boleh melebihi 1 ml/100 g BB. Seluruh hewan uji harus ditimbang sedikitnya sekali dalam seminggu. Asupan makanan dan minuman juga harus diukur sedikitnya per minggu (Anonim, 2013b).
Setelah 28 hari, sebelum hewan uji dikorbankan, sampel darah hewan uji dikumpulkan. Pemeriksaan parameter hematologi dan biokimia klinis harus dilakukan pada darah yang dikumpulkan pada saat pengorbanan hewan;
pemeriksaan dilakukan terhadap sebanyak mungkin parameter (Harmita dan Maksum, 2008).
6. OECD 407
Organisation for Economic Co-Operation and Development (OECD) adalah sebuah lembaga multinasional yang bekerjasama di bidang ekonomi dan pembangunan. Misi dari OECD adalah untuk mempromosikan kebijakan yang dapat meningkatkan ekonomi dan kesejahteraan sosial seluruh manusia di dunia. OECD seccara bertahap dan melalui proses revisi secara periodik telah menghasilkan metode (guidelines) OECD untuk prosedur penelitian (Anonim, 2013c).
OECD guidelines berisi mengenai prosedur uji laboratorium tentang efek kesehatan (studi tentang keamanan bahan kimia), di samping sifat fisika-kimia, efek sistem biotik, dan degradasi atau akumulasi. Sejak OECD guidelines mencakup seluruh bahan kimia industri, sebagian besar studi tentang keamanan bahan kimia secara umum menggunakan OECD guidelines. Sebagian besar guidelines tersebut efektif digunakan pada 1981 dan digunakan penambahan atau modifikasi saat diperlukan (Krinke, 2001).
Metode OECD 407 adalah metode konvensional uji toksisitas pemberian berulang selama 28 hari. Metode ini telah digunakan secara luas untuk identifikasi keberbahayaan dan karakterisasi bahan kimia komersial. Metode ini telah direvisi berulang kali dan metode yang paling terbaru untuk OECD 407 ini adalah yang direvisi pada 3 Oktober 2008 (Anonim, 2013c)
7. Histopatologis Organ Hati
Hati merupakan kelenjar tubuh yang paling besar dan khas karena memiliki multi fungsi kompleks, misalnya ekskresi (metabolit), sekresi (empedu), penyimpanan (glikogen, vitamin A dan D), sintesis protein, detoksifikasi dan mengatur penyimpanan serta distribusi asam lemak dan trigliserida (Widmann, 1989).
Tikus memiliki organ hati dengan bobot sekitar 4-5% dari berat badan dan terdiri dari empat lobus yaitu : lobus kiri, lobus tengah, lobus kanan, dan lobus kaudal. Lobus tengah, kanan dan kaudal (bagian belakang) terdiri dari tiga sublobus (Haschek dan Rousseaux, 1991).
Secara umum, hati adalah organ target untuk senyawa-senyawa toksik (khususnya efek toksik secara langsung). Alasan mengapa hati bertindak sebagai target dari senyawa-senyawa toksik, antara lain :
a. Posisinya di dalam tubuh. Hubungannya dengan aliran darah. b. Strukturnya
c. Perannya sebagai perantara dan metabolisme senyawa xenobiotik d. Fungsinya
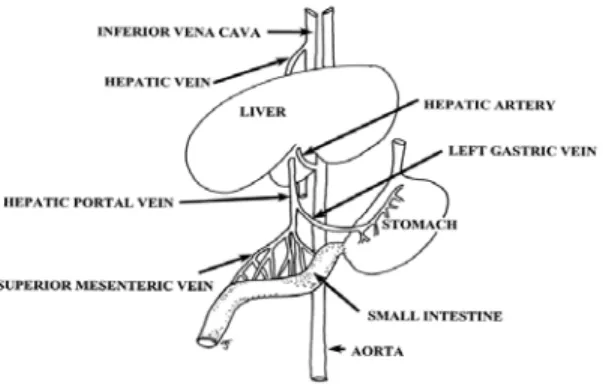
Sebagian besar senyawa toksik dicerna di dalam mulut kemudian diabsorbsi dari saluran gastrointestinal ke aliran darah dan diatur sedemikian rupa sehingga senyawa tersebut dibawa langsung ke hati melalui vena portal (Gambar 2). Oleh karena itu, hati merupakan organ yang pertama terekspos oleh senyawa toksik (setelah saluran gastrointestinal itu sendiri). Hati menerima 25% darah dari jantung. Dari hati, senyawa toksik tersebut akan dibawa ke sel-sel hati (hepatosit)
melalui difusi aktif ataupun difusi pasif tergantung pada struktur senyawa toksik tersebut (Timbrell, 2002).
Gambar 2. Aliran pembuluh darah hati dan hubungannya dengan sirkulasi sistemik (Timbrell, 2002)
Hepatosit menyusun 60% bagian dari hati (Weibel dkk., 1969). Sel-sel hati (hepatosit) akan melaksanakan berbagai reaksi biokimia penting bagi seluruh organisme, seperti sintesis protein, penghilangan kelebihan nitrogen (detoksifikasi ammonia menjadi urea), dan metabolisme lipid. Hepatosit juga sangat aktif dalam memetabolisme senyawa xenobiotik, yang menyebabkan hati menjadi organ target.
Alasan terakhir mengapa hati bertindak sebagai organ target untuk toksisitas adalah karena hati memiliki fungsi ekskretori, yaitu memproduksi empedu yang mengumpulkan dan mengangkut produk akhir. Karenanya senyawa xenobiotik dan metabolitnya dapat diekskresikan melalui mekanisme ini.
Toksisitas dapat menyebabkan berbagai jenis efek toksik pada berbagai organel dalam sel hati sehingga mengakibatkan berbagai jenis kerusakan hati, antara lain :
1. Perlemakan hati (Steatosis)
Perlemakan hati adalah keadaan dimana hati mengandung berat lipid lebih dari 5%. Terjadinya penimbunan lipid dalam hati karena adanya berbagai toksikan. Mekanisme yang mendasari sangatlah beragam, akan tetapi yang paling umum yaitu rusaknya pelepasan trigliserid hati ke plasma. Karena trigliserid hati hanya disekresi bila dalam keadaan tergabung dengan lipoprotein (Lu, 1995). Secara patologis hal yang dapat menyebabkan perlemakan adalah hipoksemi karena hati tidak membakar lemak atau karena adanya toksin yang menyebabkan penurunan fungsi lipolitik hati (Ressang, 1984).
2. Nekrosis
Nekrosis merupakan suatu proses degenerasi sehingga pada akhirnya terjadi kematian hepatosit. Kematian sel terjadi bersama dengan pecahnya membran plasma. Nekrosis hati merupakan suatu manifestasi toksik yang berbahaya tetapi tidak selalu kritis karena hati memiliki kapasitas pertumbuhan kembali yang luar biasa (Himawan, 1973; Lu, 1995).
3. Kolestasis
Kolestasis merupakan berkurangnya aktivitas ekskresi empedu pada membran kanalikulis. Selain itu disebabkan oleh perubahan permeabilitas sel duktulus. Jenis kerusakan hati yang bersifat akut ini lebih jarang ditemukan dibandingkan dengan perlemakan hati dan nekrosis (Lu, 1995).
4. Sirosis
Sirosis merupakan kerusakan yang ditandai oleh adanya septa kolagen yang terbesar di sebagian besar hati. Kumpulan hepatosit muncul sebagai nodul yang
dipisahkan oleh lapisan berserat ini. Dalam sebagian besar kasus, sirosis berasal dari nekrosis sel tunggal karena kurangnya perbaikan. Keadaan tersebut dapat menyebabkan aktivitas fibroblastik dan pembentukan jaringan parut. Selain itu juga disebabkan tidak cukupnya aliran darah dalam hati (Lu, 1995). 5. Hepatitis
Hepatitis merupakan radang hati yang umumnya disebabkan oleh virus. Meskipun demikian, berbagai macam senyawa kimia dapat mengakibatkan sindrom klinis yang tidak dapat dibedakan dari hepatitis virus (Lu, 1995) 6. Karsinogenesis
Karsinoma hepatoseluler dan kolangiokarsinoma adalah jenis neoplasma ganas yang paling umum pada hati (Lu, 1995).
8. Kimia Darah
Menurut Widmann (1989), jenis-jenis zat yang diangkut oleh darah, berperan dalam darah, serta mencerminkan proses-proses metabolik tak terhingga banyaknya tetapi relatif sedikit diantaranya yang diukur pada pemeriksaan rutin. Ada yang ditetapkan guna mendapat informasi mengenai organ atau proses tertentu dan ada juga yang menggambarkan akibat menyeluruh dari banyak peristiwa metabolik.
Hati yang merupakan pusat sintesis protein dan penyaluran asam amino ke dalam jalur-jalur biokimia lain adalah salah satu organ yang sangat banyak mengandung aminotransferase yang merupakan enzim yang mengkatalisis perpindahan reversible satu gugusan amino dari molekul donor ke molekul
resipien. Kehadiran transaminase dalam plasma pada kadar di atas nilai normal memberi dugaan suatu peningkatan kecepatan kerusakan jaringan (Meyes dkk., 1991).
Kedua macam aminotransferase yang paling sering diukur adalah glutamat-piruvat transaminase (SGPT) dan glutamat-oksaloasetat transaminase (SGOT) (Widmann, 1989). Aspartat aminotransferase membantu konversi aspartat dan α-ketoglutarat menjadi oksaloasetat dan glutamat, sedangkan alanin aminotransferase membantu konversi alanin dan α-ketoglutarat menjadi piruvat dan glutamat (Gines dkk., 2011).
Serum Aspartate Transaminase (AST) atau Serum Glutamate Oxaloacetate Transaminase (SGOT) dan Alanine Transaminase (ALT) atau Serum Glutamate Pyruvic Transaminase (SGPT) merupakan parameter adanya kerusakan hati. Keduanya terdapat di dalam sitosol pada sel hati. SGOT juga terdapat pada mitokondria. Di dalam hati, konsentrasi SGOT per unit lebih tinggi daripada konsentrasi SGPT. Enzim-enzim ini adalah yang paling penting dalam memperkirakan dan memonitoring tingkat inflamasi sel hati dan nekrosis, dikarenakan pelepasan enzim-enzim ini ke dalam sirkulasi akibat dari peningkatan permeabilitas membran sel atau rusaknya sel. SGPT spesifik untuk hati, sedangkan SGOT dapat meningkat dikarenakan kerusakan jaringan lainnya, contohnya infraksi miokardial,nekrosis otot, gangguan renal, gangguan otak, dan hemolisis intravaskular. Pada kerusakan tersebut, jumlah serum SGOT lebih besar daripada jumlah SGPT. Walaupun demikian, pada penyakit hati, umumnya
kenaikan konsentrasi SGPT jauh lebih tinggi daripada SGOT (Talwar dan Srivastava, 2006).
Rentangan nilai normal aktivitas SGPT dan SGOT tikus menurut Tucker (1997) ialah :
SGPT : 20-72 U/L SGOT : 63-131 U/L
E. Keterangan Empiris
Penelitian ini bersifat eksploratif untuk mendapatkan gambaran efek toksik fraksi tidak larut n-heksan ekstrak etanolik umbi sarang semut (M. tuberosa) secara per oral selama 28 hari terhadap aktivitas SGPT, SGOT, dan histopatologis organ hati tikus Wistar betina.